Aula 8 DINÂMICA DAS REAÇÕES MOLECULARES: TEORIA DA COLISÃO. META Apresentar ao aluno os conceitos da Teoria da Colisão.
|
|
|
- Simone Madureira Barata
- 6 Há anos
- Visualizações:
Transcrição
1 DINÂMICA DAS REAÇÕES MOLECULARES: TEORIA DA COLISÃO Glauber Silva Godoi META Apresentar ao aluno os conceitos da Teoria da Colisão. OBJETIVOS Ao fi nal desta aula, o aluno deverá: Conhecer os fatores que determinam a velocidade das reações químicas em termos da Teoria da Colisão. PRÉ-REQUISITOS Lei Empírica de Arrhenius; Teoria Cinética dos Gases;
2 Cinética Química INTRODUÇÃO Caro aluno, agora vamos abordar uma questão muito importante sobre teorias que tentam explicar o que ocorre em termos moleculares durante uma reação química, e quais os fatores que influenciam os seus diferentes parâmetros cinéticos. Primeiro iremos falar sobre a primeira teoria desenvolvida com este propósito, conhecida como Teoria de Colisão. Originalmente proposta por dois químicos, sendo um alemão, Max Trautz ( ), e o outro britânico, William Lewis ( ), a principal característica desta teoria, baseada na Teoria Cinética dos Gases, é que as moléculas reagentes são tratadas como esferas rígidas colidindo entre si. Este modelo bastante simplificado se mostrou bastante conveniente para explicar dados experimentais de reações no estado gasoso, porém apresentou falhas para reações mais complexas, principalmente aquelas que ocorriam em soluções (reação no estado líquido). 90
3 Dinâmica das reações moleculares: Teoria da Colisão TEORIA DA COLISÃO Trautz publicou o seu trabalho sobre Teoria da Colisão em 1916, enquanto que Lewis em 191. Curiosamente, nenhum dos dois estava ciente do trabalho do outro, principalmente em virtude de que neste período a Europa se encontrava durante a Primeira Guerra Mundial ( ). Uma característica marcante desta teoria é que ela deve ser aplicada basicamente a reações elementares bimoleculares em fase gasosa, como no exemplo mostrado na reação (1): A + B P (1) De onde podemos escrever: v = k 2 [A][B] (2) Onde P representa o produto da reação, v é a velocidade da reação e k2 a constante de velocidade de ordem 2. Uma análise física do problema (reação química) nos permite dizer que a constante k2 depende dos seguintes fatores: freqüência de colisões das moléculas (fator de freqüência), energia mínima necessária para que uma colisão tenha energia suficiente para resultar no produto da reação (fator energético), e por último, da probabilidade de que a colisão entre as moléculas ocorra em uma orientação favorável à transformação dos reagentes em produtos (fator estérico). Isto nos permite escrever a velocidade de reação como sendo dependente dos fatores mencionados conforme a relação: v fator de freqüência x fator energético x fator estérico (3) Agora você pode estar se perguntando o que vem a ser realmente cada termo descrito acima. É isso que iremos ver nas secções seguintes. Freqüência de colisão Como foi dito, a constante de velocidade de uma reação química depende da freqüência de colisão z entre as moléculas reagentes. Para podermos quantificar esta freqüência de colisão vamos considerar a seguinte situação apresentada na figura 1. 91
4 Cinética Química Figura 1: Representação esquemática para determinação da freqüência de colisão. Adaptado de: ATKINS, P. W.; Físico-Química, vol. 1 e 2, ed., Editora LTC, São Paulo, 200. Nesta figura todas as moléculas de um determinado gás estão com suas respectivas posições congeladas no intervalo de tempo t. Apenas a molécula na posição 1, a esquerda do tubo, se encontra em movimento com velocidade média. Deste modo, após o intervalo de tempo t a molécula irá percorrer a distância t. Durante o seu percurso, ela irá se chocar com todas as moléculas que estejam dentro do tubo de comprimento t e de raio d, onde d representa o diâmetro da própria molécula. A partir destas informações, podemos definir o volume V do tubo de colisão como sendo: V = t (4) onde representa a área da secção transversal de colisão dada pela equação (5): = d2 (5) Considerando que o número N de moléculas estacionárias dentro do tubo de colisão é dado pelo produto entre o número de densidade de moléculas por unidade de volume e o volume do tubo, dado pela relação: N= V (6) Portanto, da equação (4) e (6): N = t (7) Para saber finalmente o número de moléculas que colidem em certo intervalo de tempo, ou seja, a freqüência de colisão z, basta dividir o número obtido na equação (7) por t: z = () 92
5 Dinâmica das reações moleculares: Teoria da Colisão Neste exemplo mais simples, determinamos a freqüência de colisão envolvendo o mesmo tipo de moléculas. Porém, quando queremos determinar esta freqüência envolvendo moléculas distintas, por exemplo, A e B, a secção transversal do tubo de colisão deve levar em conta d como sendo a semi-soma dos diâmetros moleculares, ou seja, a soma dos seus respectivos raios, como está ilustrado na figura 2. Ou matematicamente falando: = d 2, d = Onde da e db são respectivamente os diâmetros moleculares da molécula A e B, respectivamente. Afigura 2 nos permite visualizar mais facilmente o motivo da área de secção transversal apresentado na equação (5) ser definido em função de d. Naquele caso, nós tínhamos apenas moléculas de um mesmo tipo, e, portanto com o mesmo diâmetro d, o que seria equivalente a escrever a equação (9), da seguinte forma: (9) = d 2, d = = = d (10) Figura 2: Representação esquemática para determinação da área de secção transversal de colisão. Adaptado de: ATKINS, P. W.; Físico-Química, vol. 1 e 2, ed., Editora LTC, São Paulo,
6 Cinética Química Agora que o conceito de freqüência de colisão já foi apresentado podemos definir um conceito mais genérico denominado densidade de colisão, que é nada mais do que o número de colisões que ocorrem entre as moléculas de A e de B em certo intervalo de tempo t, e em um volume V. Para um sistema envolvendo apenas moléculas A e B, a densidade de colisão ZAB é definida simplesmente pela equação: ZAB = z B (11) Onde z = rel A, de modo que a equação final obtida é: ZAB = rel A B (12) Nesta equação vale lembrar que tem o mesmo significado apresentado na equação (9), e que a velocidade média relativa rel representa a velocidade média das moléculas de A em relação à das moléculas de B. É importante frisar que neste caso introduzimos a velocidade média relativa no cálculo de ZAB, equação (12), devido ao fato de ser mais fácil realizar este cálculo em termos de velocidade relativa, semelhante ao que descrevemos na figura 1 quando foi dito que todas as moléculas dentro do tubo de colisão estavam estacionárias, e apenas a molécula na posição 1, à esquerda do tubo, estava em movimento. De maneira semelhante podemos também introduzir um novo conceito denominado massa reduzida. Este conceito é importante quando queremos descrever o movimento relativo de duas partículas, neste caso moléculas, em rota de colisão, como se fosse o movimento de uma única partícula, formada a partir daquelas, e de massa reduzida. A equação (13) nos mostra como pode ser determinada a massa reduzida para um evento envolvendo a colisão de uma molécula A de massa m A com uma molécula B, de massa m B. (13) Uma relação importante que nos permite definir o valor da velocidade relativa em termos da temperatura absoluta e da massa reduzida obtida é mostrada na equação (14): rel = (14) 94
7 Dinâmica das reações moleculares: Teoria da Colisão Caso estivéssemos falando de colisões envolvendo apenas moléculas de A, ao definir o valor de = (basta usar a equação 13 e lembrar que neste caso m A = m B = m) obteríamos a seguinte relação entre a velocidade média e a velocidade média relativa rel: rel =, = (15) Onde k é a constante de Boltzmann, T a temperatura absoluta em Kelvin e m a massa da molécula. Após definir todas estas relações podemos finalmente definir a densidade de colisão ZAB como sendo: A B (16) Lembrando que: A =N A [A], e B =N A [B] (17) Onde NA é o número de Avogadro, [X] é a concentração molar (mol m-3), do componente X, ou seja, A ou B. Obtemos: N A 2 [A][B] (1) Se considerarmos que em toda colisão a reação ocorre, o número de colisões após um intervalo de tempo e por unidade de volume, Z AB, seria a própria velocidade de desaparecimento de A ou B, por unidade de volume: N A 2 [A][B] (19) Na realidade nem toda colisão resulta efetivamente em produto de reação, mas apenas aquelas que apresentam energia suficiente. 95
8 Cinética Química Agora que você já tem conhecimento sobre o termo relacionado à freqüência de colisão em uma reação química, ou mais especificamente, à densidade de colisão, vamos ver agora como podemos interpretar a existência de uma energia mínima necessária para ocorrência da reação. Energia mínima para ocorrência da reação Uma maneira relativamente simples para incorporar este aspecto da energia mínima necessária para ocorrência da reação no cálculo da velocidade de reação é considerar que a área de secção transversal de colisão depende da energia cinética relativa das moléculas envolvidas, ou seja, ( ). Neste caso, a secção transversal será nula caso esta energia esteja abaixo de um valor mínimo necessário para que a reação ocorra. Este tipo de consideração nos permite realizar algumas operações matemáticas de modo que o resultado final que iremos obter para a velocidade de reação pode ser escrito conforme a equação (20): NA 2 [A][B] (20) Nesta equação o termo é o fator de Boltzmann responsável pela distribuição de velocidades apresentada pelas moléculas em colisão, e por conseqüência, da dependência da secção transversal de colisão com a energia cinética relativa das moléculas, como mencionado anteriormente (fator energético). Nós podemos ainda realizar a divisão da equação (20) pelo produto das densidades de moléculas de A e B, A B, com o objetivo de obter o valor da constante de velocidade em unidades moleculares (SI: m3 s -1 ). Se multiplicarmos este resultado pela constante de Avogadro, NA, obtemos k 2 em unidades molares (SI: m3 mol -1 s -1 ): (21) A análise da equação (21) nos permite identificar facilmente, a partir da comparação com a equação de Arrhenius,, a seguinte relação: (22) 96
9 Dinâmica das reações moleculares: Teoria da Colisão Um aspecto importante de ser observado é que a dependência exponencial do fator energético com a temperatura justifica o fato de que pequenas variações de temperatura podem produzir grandes variações no valor da constante de velocidade, mesmo que o resultado no fator de freqüência seja relativamente pequeno. Para que possamos obter finalmente uma equação semelhante a apresentada na equação (3), falta apenas discutir o último aspecto importante chamado fator estérico P. Antes que você, caro aluno, se questione sobre o motivo da letra P para designar o fator estérico, é importante que você saiba que este fator leva em conta um aspecto estatístico, e por isso está relacionado com a probabilidade de que a colisão ocorra de maneira adequada, permitindo que a reação aconteça. Fator estérico Se compararmos os valores obtidos, a partir de considerações teóricas (tal como discutido na secção anterior), para o fator de freqüência de algumas reações químicas com aqueles obtidos experimentalmente a partir da equação de Arrhenius veremos que em alguns casos existe uma considerável discordância, como mostra a tabela 1. Isto sugere que a energia de colisão não é o único critério que deve ser levado em conta no cálculo da constante de velocidade, e que algum outro fator relacionado com a orientação das moléculas durante a colisão deve ser considerado. Observe que na maioria dos casos o fator de freqüência experimental é inferior ao teórico obtido, porém em apenas um caso a relação se inverte, isto é, o valor experimental é superior. Tabela 1: Parâmetros de Arrhenius para reações em fase gasosa. A/(dm 3 mol -1 s -1 ) Experimental Teórico Ea/(kJ mol -1 ) P 2NOCl 2NO +Cl 9,4 x ,9 x ,16 2ClO Cl 2 + O 2 6,3 x ,5 x ,5 x 10-3 H 2 + C 2 H 4 C 2 H 6 1,24 x ,4 x ,7 x 10-6 K + Br 2 KBr + Br 1,0 x ,1 x , Para resolver este problema nós podemos introduzir um novo conceito denominado secção transversal reativa *, que pode ser determinada a partir da seguinte equação: * = P (23) 97
10 Cinética Química Onde P é o fator estérico e a secção transversal de colisão, já definida anteriormente. Deste modo, a depender do valor de P, que pode ser maior ou menor do que 1, nós podemos ter o valor de * como sendo um múltiplo ou submúltiplo de. Mas em termos práticos o que significa, por exemplo, dizer que a secção transversal reativa é menor do que a secção transversal de colisão, ou seja, que o fator estérico P é menor do que 1? A resposta para esta pergunta é que nem toda colisão envolvendo as moléculas reagentes resulta em produtos. A figura 3 ilustra este caso onde a secção transversal reativa é menor do que a secção transversal de colisão. Figura 3: Comparativo entre área de secção transversal de colisão e área de secção transversal reativa. Adaptado de: ATKINS, P. W.; Físico-Química, vol. 1 e 2, ed., Editora LTC, São Paulo, 200. Deste modo, a constante de velocidade pode então ser finalmente escrita sob a forma: 9
11 Dinâmica das reações moleculares: Teoria da Colisão (24) Você pode estar se perguntando agora qual seria o motivo para que algumas reações apresentem o valor de P superior à unidade (P>1). Como exemplo, vamos analisar a seguinte reação gasosa, K + Br2 KBr + Br, cujo valor de P = 4,. Para que esta reação ocorra, a distância entre as espécies reagentes parece ser bem superior do que aquela necessária para provocar apenas uma colisão não-reativa. Isto pode ser explicado conforme o que é conhecido como Mecanismo do Arpão. Para poder entender melhor este mecanismo vamos observar passo a passo o que ocorre durante a reação, conforme esquematizado na figura 4. Figura 4: Representação esquemática para o mecanismo do arpão envolvendo K e Br2. Adaptado de: ATKINS, P. W.; JONES, L. L.; Chemistry Principles, 4ed., Freeman,
12 Cinética Química Quando as espécies reagentes se aproximam (a), a maior eletronegatividade do bromo faz com que seja arrancado um elétron (arpão) do potássio (b). Neste momento, tanto o potássio como a molécula de bromo se tornam íons (c), fazendo com que a atração entre eles se torne mais pronunciada devido à atração de Coulomb. A linha de atuação da força de Coulomb atua como se fosse a linha de um arpão fazendo com que as espécies reagentes colidam entre si (d) permitindo que ocorra finalmente a reação (e). A linha de atuação do arpão é, portanto a responsável pelo aumento considerável da secção transversal reativa, e por conseqüência do valor de P > 1. Com relação a reações que ocorrem em meio líquido, outros processos mais complexos devem ser levados em consideração. Normalmente estas reações são controladas por processos difusivos e por isso a freqüência de colisão envolvendo as espécies reagentes é consideravelmente menor do que nos gases. Por outro lado, esta menor mobilidade das espécies reagentes, em presença das moléculas circunvizinhas de solvente, faz com que o tempo da colisão também seja superior, o que é conhecido como Efeito Gaiola (Cage Effect). Além disso, embora no momento da colisão as moléculas reagentes não tenham energia suficiente para provocar a formação dos produtos, elas podem acumular a energia necessária durante o período em que estão sob efeito do Efeito Gaiola. Esta breve explanação sobre as reações em meio líquido foi feita apenas para que você tenha uma noção sobre reações que ocorrem no estado líquido. No entanto, todos estes fenômenos estão fora do escopo do nosso curso, e por isso não serão discutidos. CONCLUSÃO Agora que você já foi apresentado a todos os fatores que influenciam a velocidade das reações, certamente a partir de agora você terá outra visão sobre os fenômenos envolvidos em uma reação, e como diferentes aspectos influenciam o seu comportamento. Lembre-se que a teoria apresentada nesta aula é útil basicamente para o estudo de reações elementares bimoleculares em fase gasosa, e que por isso apresenta certa limitação a medida que a reação vai se tornando mais complexa. RESUMO A Teoria da Colisão foi um importante marco para o entendimento dos processos reacionais, buscando uma interpretação no âmbito molecular. Anteriormente, Arrhenius havia proposto uma lei empírica para a avaliação da velocidade de uma reação. No entanto, foi somente com a Teoria da colisão que os fatores: energético, estérico e de frequência de colisão vieram à tona com o objetivo de explicar e também de estimar a velocidade das reações químicas. 100
13 Dinâmica das reações moleculares: Teoria da Colisão PRÓXIMA AULA Na próxima aula, você aprenderá sobre a Teoria do Estado Estacionário, e sua grande contribuição para obtenção de dados termodinâmicos, bem como terá uma valiosa noção sobre dois importantes métodos de Simulação Computacional. REFERÊNCIAS ATKINS, P. W.; Físico-Química, vol. 1 e 2, ed., Editora LTC, São Paulo, 200. CASTELLAN, G.; Fundamentos de físico-química, Editora LTC, São Paulo, MOORE, W. J.; Físico-química, vol 1, Editora Edgar Blucher, São Paulo,
TEORIA DO ESTADO ESTACIONÁRIO E SIMULAÇÃO COMPUTACIONAL.
 EXERCÍCIOS SOBRE: TEORIA DA COLISÃO, TEORIA DO ESTADO ESTACIONÁRIO E SIMULAÇÃO COMPUTACIONAL. Glauber Silva Godoi META Desenvolver no aluno a capacidade de extrair os parâmetros cinéticos de uma reação
EXERCÍCIOS SOBRE: TEORIA DA COLISÃO, TEORIA DO ESTADO ESTACIONÁRIO E SIMULAÇÃO COMPUTACIONAL. Glauber Silva Godoi META Desenvolver no aluno a capacidade de extrair os parâmetros cinéticos de uma reação
AVALIAÇÃO DOS FATORES QUE INFLUENCIAM A VELOCIDADE DAS REAÇÕES QUÍMICAS: CONCENTRAÇÃO DE REAGENTES E TEMPERATURA DE REAÇÃO.
 AVALIAÇÃO DOS FATORES QUE INFLUENCIAM A VELOCIDADE DAS REAÇÕES QUÍMICAS: CONCENTRAÇÃO DE REAGENTES E TEMPERATURA DE REAÇÃO. Aula 11 Glauber Silva Godoi META Desenvolver no aluno a capacidade de avaliar
AVALIAÇÃO DOS FATORES QUE INFLUENCIAM A VELOCIDADE DAS REAÇÕES QUÍMICAS: CONCENTRAÇÃO DE REAGENTES E TEMPERATURA DE REAÇÃO. Aula 11 Glauber Silva Godoi META Desenvolver no aluno a capacidade de avaliar
META Transmitir para o aluno os conceitos relativos à Teoria do Estado de Transição, bem como noções sobre Simulação Computacional.
 DINÂMICA DAS REAÇÕES MOLECULARES: TEORIA DO ESTADO DE TRANSIÇÃO E SIMULAÇÃO COMPUTACIONAL Glauber Silva Godoi META Transmitir para o aluno os conceitos relativos à Teoria do Estado de Transição, bem como
DINÂMICA DAS REAÇÕES MOLECULARES: TEORIA DO ESTADO DE TRANSIÇÃO E SIMULAÇÃO COMPUTACIONAL Glauber Silva Godoi META Transmitir para o aluno os conceitos relativos à Teoria do Estado de Transição, bem como
ESTUDO DA CINÉTICA DA HIDRÓLISE ÁCIDA DO ACETATO DE ETILA.
 ESTUDO DA CINÉTICA DA HIDRÓLISE ÁCIDA DO ACETATO DE ETILA. Glauber Silva Godoi Aula 14 META Desenvolver no aluno a capacidade de extrair informações quanto aos parâmetros cinéticos de uma reação a partir
ESTUDO DA CINÉTICA DA HIDRÓLISE ÁCIDA DO ACETATO DE ETILA. Glauber Silva Godoi Aula 14 META Desenvolver no aluno a capacidade de extrair informações quanto aos parâmetros cinéticos de uma reação a partir
CQ110 : Princípios de FQ. Imagens de Rorschach
 Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
DETERMINAÇÃO DE ALGUNS PARÂMETROS CINÉTICOS DA REAÇÃO DE DECOMPOSIÇÃO DO PERÓXIDO DE HIDROGÊNIO.
 DETERMINAÇÃO DE ALGUNS PARÂMETROS CINÉTICOS DA REAÇÃO DE DECOMPOSIÇÃO DO PERÓXIDO DE HIDROGÊNIO. Glauber Silva Godoi Aula 13 META Desenvolver no aluno a capacidade de extrair informações quanto aos parâmetros
DETERMINAÇÃO DE ALGUNS PARÂMETROS CINÉTICOS DA REAÇÃO DE DECOMPOSIÇÃO DO PERÓXIDO DE HIDROGÊNIO. Glauber Silva Godoi Aula 13 META Desenvolver no aluno a capacidade de extrair informações quanto aos parâmetros
Neste caso, diz-se que a reação é de primeira ordem, e a equação pode ser resolvida conforme segue abaixo:
 1. Introdução Cinética Química A termodinâmica indica a direção e a extensão de uma transformação química, porém não indica como, nem a que velocidade, uma reação acontece. A velocidade de uma reação deve
1. Introdução Cinética Química A termodinâmica indica a direção e a extensão de uma transformação química, porém não indica como, nem a que velocidade, uma reação acontece. A velocidade de uma reação deve
Cinética Química. Prof. Alex Fabiano C. Campos. Rapidez Média das Reações
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
2. Aborda a rapidez com que os reagentes são consumidos e os produtos são formados;
 CINÉTICA QUÍMICA 1. Trata das velocidades das reações; 2. Aborda a rapidez com que os reagentes são consumidos e os produtos são formados; 3. A dependência da velocidade; 4. Estudo do mecanismo de reação.
CINÉTICA QUÍMICA 1. Trata das velocidades das reações; 2. Aborda a rapidez com que os reagentes são consumidos e os produtos são formados; 3. A dependência da velocidade; 4. Estudo do mecanismo de reação.
Cinética Química. Prof. Alex Fabiano C. Campos
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
CINÉTICA QUÍMICA. Profa. Loraine Jacobs DAQBI.
 CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Cinética Química Lei de Velocidade Integrada Mostra a variação das concentrações
CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Cinética Química Lei de Velocidade Integrada Mostra a variação das concentrações
Concentração dos reagentes Quanto maior a concentração dos reagentes, maior a velocidade da reação.
 Setor 3306 Aula 20 Lei da velocidade das reações Complemento. As reações químicas podem ocorrer nas mais diferentes velocidades. Existem reações tão lentas que levam milhares de anos para ocorrer, como
Setor 3306 Aula 20 Lei da velocidade das reações Complemento. As reações químicas podem ocorrer nas mais diferentes velocidades. Existem reações tão lentas que levam milhares de anos para ocorrer, como
Cinética. Módulo I - Físico Química Avançada. Profa. Kisla P. F. Siqueira
 Cinética Módulo I - Físico Química vançada Profa. Introdução Estudo das velocidades das reações químicas; Velocidade em função das concentrações das espécies presentes; Leis de velocidade: equações diferenciais;
Cinética Módulo I - Físico Química vançada Profa. Introdução Estudo das velocidades das reações químicas; Velocidade em função das concentrações das espécies presentes; Leis de velocidade: equações diferenciais;
ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA
 ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA Camilo Andrea Angelucci META Compreender os conceitos relacionados as leis de velocidade e seus modelos matematicos. compreender as aplicações conjuntas dessas
ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA Camilo Andrea Angelucci META Compreender os conceitos relacionados as leis de velocidade e seus modelos matematicos. compreender as aplicações conjuntas dessas
AVALIAÇÃO DOS FATORES QUE INFLUENCIAM A VELOCIDADE DAS REAÇÕES QUÍMICAS: PRESENÇA
 AVALIAÇÃO DOS FATORES QUE INFLUENCIAM A VELOCIDADE DAS REAÇÕES QUÍMICAS: PRESENÇA DE CATALISADOR E SUPERFÍCIE DE CONTATO. Aula 12 Glauber Silva Godoi META Desenvolver no aluno a capacidade de avaliar os
AVALIAÇÃO DOS FATORES QUE INFLUENCIAM A VELOCIDADE DAS REAÇÕES QUÍMICAS: PRESENÇA DE CATALISADOR E SUPERFÍCIE DE CONTATO. Aula 12 Glauber Silva Godoi META Desenvolver no aluno a capacidade de avaliar os
UNIVERSIDADE PRESBITERIANA MACKENZIE CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE
 UNIVERSIDADE PRESBITERIANA MACKENZIE CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PLANO DE ENSINO Código Unidade 040 CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE Curso Etapa Sem. / Ano 4045-1 Farmácia 2ª 2º /
UNIVERSIDADE PRESBITERIANA MACKENZIE CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PLANO DE ENSINO Código Unidade 040 CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE Curso Etapa Sem. / Ano 4045-1 Farmácia 2ª 2º /
PAG Química Cinética 1.
 1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
1. 2. 3. errata: a reação é em mais de uma etapa, os gráficos devem apresentar pelo menos duas!! 4. 5. Explique se cada uma das alternativas abaixo é correta ou não, para reações químicas que ocorrem
Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio.
 EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
META Estudar o comportamento de reações químicas que envolvem mais de uma etapa.
 EQUÇÕES CINÉTICS COMPOSTS Camilo ndrea ngelucci ula MET Estudar o comportamento de reações químicas que envolvem mais de uma etapa. OBJETIVOS o fi nal desta aula, o aluno deverá: compreender e determinar
EQUÇÕES CINÉTICS COMPOSTS Camilo ndrea ngelucci ula MET Estudar o comportamento de reações químicas que envolvem mais de uma etapa. OBJETIVOS o fi nal desta aula, o aluno deverá: compreender e determinar
CINÉTICA QUÍMICA TUTOR: LUIZ EDUARDO NOCHI DISCIPLINA: QUÍMICA (FÍSICO QUÍMICA) CURSO ALCANCE (TURMA A E B ) DATA: 17/09/2016
 CINÉTICA QUÍMICA TUTOR: LUIZ EDUARDO NOCHI DISCIPLINA: QUÍMICA (FÍSICO QUÍMICA) CURSO ALCANCE (TURMA A E B ) DATA: 17/09/2016 O QUE É CINÉTICA QUÍMICA? É a área da química que estuda a velocidade das reações
CINÉTICA QUÍMICA TUTOR: LUIZ EDUARDO NOCHI DISCIPLINA: QUÍMICA (FÍSICO QUÍMICA) CURSO ALCANCE (TURMA A E B ) DATA: 17/09/2016 O QUE É CINÉTICA QUÍMICA? É a área da química que estuda a velocidade das reações
CINÉTICA QUÍMICA. Obs.: a variação da quantidade deverá ser sempre um valor positivo, então ela deverá ser em módulo. 1.
 CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
Cinética Química. Cinética Química: Velocidade média, instantânea e inicial. Lei cinética. Fatores que influenciam a velocidade.
 Cinética Química IV Cinética Química: Velocidade média, instantânea e inicial. Lei cinética. Fatores que influenciam a velocidade. Mecanismos reacionais. Catálise. Cinética Química Cinética Química é a
Cinética Química IV Cinética Química: Velocidade média, instantânea e inicial. Lei cinética. Fatores que influenciam a velocidade. Mecanismos reacionais. Catálise. Cinética Química Cinética Química é a
Aula 3 REAÇÕES ELEMENTARES. META Estudar as reações elementares e suas peculiaridades
 REAÇÕES ELEMENTARES Camilo Andrea Angelucci Aula META Estudar as reações elementares e suas peculiaridades OBJETIVOS Ao fi nal desta aula, o aluno deverá: reações Elementares molecularidade de uma reação
REAÇÕES ELEMENTARES Camilo Andrea Angelucci Aula META Estudar as reações elementares e suas peculiaridades OBJETIVOS Ao fi nal desta aula, o aluno deverá: reações Elementares molecularidade de uma reação
Objetivo : obter por cálculo teórico a constante de velocidade k 1
 Aplicações da Teoria de Reações Unimoleculares Mecanismo unimolecular: - dado uma reação elementar de primeira ordem k 1 CD Produtos Objetivo : obter por cálculo teórico a constante de velocidade k 1 ocorrem,
Aplicações da Teoria de Reações Unimoleculares Mecanismo unimolecular: - dado uma reação elementar de primeira ordem k 1 CD Produtos Objetivo : obter por cálculo teórico a constante de velocidade k 1 ocorrem,
Aula 3 DESCRIÇÃO TERMODINÂMICA DE MISTURAS. Glauber Silva Godoi
 Aula 3 DESCRIÇÃO TERMODINÂMICA DE MISTURAS META Capacitar o aluno sobre a descrição termodinâmica de misturas e conceitos relacionados. OBJETIVOS Ao final desta aula, o aluno deverá: aprender os principais
Aula 3 DESCRIÇÃO TERMODINÂMICA DE MISTURAS META Capacitar o aluno sobre a descrição termodinâmica de misturas e conceitos relacionados. OBJETIVOS Ao final desta aula, o aluno deverá: aprender os principais
FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos
 FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos 1. Conceitue colisão efetiva, colisão não-efetiva, energia de ativação e complexo
FUP - Faculdade UnB Planaltina Disciplina: Energia e Dinâmica das Transformações Químicas Professor: Alex Fabiano C. Campos 1. Conceitue colisão efetiva, colisão não-efetiva, energia de ativação e complexo
Conceitos Básicos sobre gases
 Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Transporte Iônico e o Potencial de Membrana
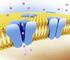 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Apresentar os conceitos fundamentais da termodinâmica estatística e como aplicá-los as propriedades termodinâmicas vista até então.
 Introdução À Termodinâmica Estatística Aula 15 Meta Apresentar os conceitos fundamentais da termodinâmica estatística e como aplicá-los as propriedades termodinâmicas vista até então. Objetivos Ao final
Introdução À Termodinâmica Estatística Aula 15 Meta Apresentar os conceitos fundamentais da termodinâmica estatística e como aplicá-los as propriedades termodinâmicas vista até então. Objetivos Ao final
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
META Compreender os conceitos relacionado a lei de arrhenius e seus modelos matematicos. Compreender as aplicações catálise e seus fundamentos.
 ATIVIDADS SOBR LI D ARHHNIUS CATÁLIS Aula 7 MTA Compreender os conceitos relacionado a lei de arrhenius e seus modelos matematicos. Compreender as aplicações catálise e seus fundamentos. OBJTIVOS Ao fi
ATIVIDADS SOBR LI D ARHHNIUS CATÁLIS Aula 7 MTA Compreender os conceitos relacionado a lei de arrhenius e seus modelos matematicos. Compreender as aplicações catálise e seus fundamentos. OBJTIVOS Ao fi
Cinética Química. c) A opção (C) está correta. B 3+ e B 4+ não aparecem na reação global, portanto, são intermediários da reação.
 Capítulo 6 Cinética Química 1. (ITA) Considere o seguinte mecanismo de reação genérica: A 4+ + B 2+ A 3+ + B 3+ (etapa lenta) A 4+ + B 3+ A 3+ + B 4+ (etapa rápida) C + + B 4+ C 3+ + B 2+ (etapa rápida)
Capítulo 6 Cinética Química 1. (ITA) Considere o seguinte mecanismo de reação genérica: A 4+ + B 2+ A 3+ + B 3+ (etapa lenta) A 4+ + B 3+ A 3+ + B 4+ (etapa rápida) C + + B 4+ C 3+ + B 2+ (etapa rápida)
Cinética Química. Prof. Alexandre D. Marquioreto
 Prof. Alexandre D. Marquioreto Estuda as velocidades, mecanismos e os fatores que podem interferir nas reações químicas. Lentas Reações Químicas Rápidas Reação Rápida Cinética Química Faísca 2 H 2(g) +
Prof. Alexandre D. Marquioreto Estuda as velocidades, mecanismos e os fatores que podem interferir nas reações químicas. Lentas Reações Químicas Rápidas Reação Rápida Cinética Química Faísca 2 H 2(g) +
CAPÍTULO 1 Quantidades e Unidades 1. CAPÍTULO 2 Massa Atômica e Molecular; Massa Molar 16. CAPÍTULO 3 O Cálculo de Fórmulas e de Composições 26
 Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
Plano de Curso: 2009 Área: Curso Técnico: Química C. Horária: 60 Módulo/Disciplina: QUÍMICA GERAL Professor: Período: 1º Nº Aulas: 04
 Plano de Curso: 2009 Área: Curso Técnico: Química C. Horária: 0 Módulo/Disciplina: QUÍMICA GERAL Professor: Período: 1º Nº Aulas: 0 COMPETÊNCIAS HABILIDADES BASES TECNOLÓGICAS Nº aulas Introduzir uma visão
Plano de Curso: 2009 Área: Curso Técnico: Química C. Horária: 0 Módulo/Disciplina: QUÍMICA GERAL Professor: Período: 1º Nº Aulas: 0 COMPETÊNCIAS HABILIDADES BASES TECNOLÓGICAS Nº aulas Introduzir uma visão
CINÉTICA QUÍMICA. Profa. Loraine Jacobs DAQBI.
 CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Estudo da velocidade das reações químicas. REAGENTES PRODUTOS Cinética Tempo necessário
CINÉTICA QUÍMICA Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Estudo da velocidade das reações químicas. REAGENTES PRODUTOS Cinética Tempo necessário
ocorridas na concentração dos participantes das reações em função do tempo:
 CINÉTICA QUÍMICA Fala Gás Nobre! Preparado para reagir? Então vamos para mais um resumo de química! Você já parou pra pensar, que a velocidade com que as reações químicas acontecem, podem estar relacionadas
CINÉTICA QUÍMICA Fala Gás Nobre! Preparado para reagir? Então vamos para mais um resumo de química! Você já parou pra pensar, que a velocidade com que as reações químicas acontecem, podem estar relacionadas
Físico-Química Experimental Exp. 10. Cinética Química
 Cinética Química 1. Introdução Cinética química é o estudo da progressão das reações químicas, o que determina suas velocidades e como controlá-las. Ao estudar a termodinâmica de uma reação, leva-se em
Cinética Química 1. Introdução Cinética química é o estudo da progressão das reações químicas, o que determina suas velocidades e como controlá-las. Ao estudar a termodinâmica de uma reação, leva-se em
Físico-Química III CONTEÚDO. Teoria da Colisão. A + B k 2. v = k 2 [ A][B] Dinâmica Molecular das Reações.
![Físico-Química III CONTEÚDO. Teoria da Colisão. A + B k 2. v = k 2 [ A][B] Dinâmica Molecular das Reações. Físico-Química III CONTEÚDO. Teoria da Colisão. A + B k 2. v = k 2 [ A][B] Dinâmica Molecular das Reações.](/thumbs/48/24395453.jpg) Físico-Química III Este material está disponível no endereço: http://otaviosantana.cjb.net/ Programa da Disciplina: Conteúdo CONTEÚDO. : : Teoria da Colisão; Reações Controladas pela Difusão; Equação do
Físico-Química III Este material está disponível no endereço: http://otaviosantana.cjb.net/ Programa da Disciplina: Conteúdo CONTEÚDO. : : Teoria da Colisão; Reações Controladas pela Difusão; Equação do
Equações-chave FUNDAMENTOS. Seção A. Seção E. Seção F. Seção G. mv 2. E c E P. mgh. Energia total energia cinética energia potencial, ou E E c.
 Equações-chave FUNDAMENTOS Seção A 3 A energia cinética de uma partícula de massa m relaciona-se com sua velocidade v, por: E c mv 2 4 Um corpo de massa m que está a uma altura h da Terra tem energia potencial
Equações-chave FUNDAMENTOS Seção A 3 A energia cinética de uma partícula de massa m relaciona-se com sua velocidade v, por: E c mv 2 4 Um corpo de massa m que está a uma altura h da Terra tem energia potencial
3.2.2 Métodos de relaxação Métodos de competição Métodos de elevada resolução temporal ORDENS E CONSTANTES DE
 ÍNDICE Prefácio... 3 1. INTRODUÇÃO... 7 1.1. Dificuldades iniciais no desenvolvimento da Cinética Química no séc. XX... 8 1.2. A Cinética Química actual... 12 2. LEIS DE VELOCIDADE DE REACÇÃO... 27 2.1.
ÍNDICE Prefácio... 3 1. INTRODUÇÃO... 7 1.1. Dificuldades iniciais no desenvolvimento da Cinética Química no séc. XX... 8 1.2. A Cinética Química actual... 12 2. LEIS DE VELOCIDADE DE REACÇÃO... 27 2.1.
as concentrações dos reagentes, a temperatura na qual a reação ocorre e a presença de um catalisador.
 CINÉTICA QUÍMICA A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores importantes que afetam as velocidades das reações: o estado físico do reagente, as concentrações
CINÉTICA QUÍMICA A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores importantes que afetam as velocidades das reações: o estado físico do reagente, as concentrações
Química Geral e Inorgânica. QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin. Cinética Química
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Cinética Química Cinética Química É a área da química que está preocupada com a velocidade das reações químicas.
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Cinética Química Cinética Química É a área da química que está preocupada com a velocidade das reações químicas.
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
CATÁLISE ENZIMÁTICA. CINÉTICA Controle da velocidade de reações. CINÉTICA Equilíbrio e Estado Estacionário
 CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
cas AULA 5 es Quími rmaçõ o sfo Tr C0307
 BC0307 Transfo ormaçõe es Químicas AULA 5 - Combustíveis (Termodinâmica x Cinética); - Por que uma reação ocorre? - Qual a velocidade d da reação? - Cinética: leis de velocidade, ordem de reação e sua
BC0307 Transfo ormaçõe es Químicas AULA 5 - Combustíveis (Termodinâmica x Cinética); - Por que uma reação ocorre? - Qual a velocidade d da reação? - Cinética: leis de velocidade, ordem de reação e sua
As bases da Dinâmica Molecular - 8
 As bases da Dinâmica Molecular - 8 Alexandre Diehl Departamento de Física - UFPel Hipóteses fundamentais da teoria cinética Qualquer porção pequena do gás contém um número N enorme de moléculas. Número
As bases da Dinâmica Molecular - 8 Alexandre Diehl Departamento de Física - UFPel Hipóteses fundamentais da teoria cinética Qualquer porção pequena do gás contém um número N enorme de moléculas. Número
Cinética Química. Cinética Química...? É o estudo da velocidade das reações químicas e dos fatores que as influenciam.
 Cinética Química...? Universidade Federal de Campina Grande Centro de Ciência e Tecnologia groalimentar Profª Roberlucia Candeia Disciplina: Química geral É o estudo da velocidade das reações químicas
Cinética Química...? Universidade Federal de Campina Grande Centro de Ciência e Tecnologia groalimentar Profª Roberlucia Candeia Disciplina: Química geral É o estudo da velocidade das reações químicas
Aula 14 Cinética Química
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 14 Cinética Química Dr. Tiago P. Camargo Velocidades de reação... 85 % das espécies dependem da luz solar Apenas
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 14 Cinética Química Dr. Tiago P. Camargo Velocidades de reação... 85 % das espécies dependem da luz solar Apenas
Copyright McGraw-Interamericana de España. Autorização necessária para reprodução ou utilização. Cinética Química
 Capítulo 3 Cinética Química Velocidade de Uma Reacção Lei de Velocidades Relação Entre a Concentração de Reagente e o Tempo Energia de Activação e Dependência das Constantes de Velocidade com a Temperatura
Capítulo 3 Cinética Química Velocidade de Uma Reacção Lei de Velocidades Relação Entre a Concentração de Reagente e o Tempo Energia de Activação e Dependência das Constantes de Velocidade com a Temperatura
A Ligação Iônica ou Eletrovalente
 A Ligação Iônica ou Eletrovalente Formação de pares iônicos As substâncias sólidas podem ser formadas por átomos, moléculas, macromoléculas, ou seja, por partículas eletricamente neutras ou por íons dispostos
A Ligação Iônica ou Eletrovalente Formação de pares iônicos As substâncias sólidas podem ser formadas por átomos, moléculas, macromoléculas, ou seja, por partículas eletricamente neutras ou por íons dispostos
Fundamentos de Química Profa. Janete Yariwake
 2. Introdução: Conceitos e cálculos fundamentais (Estequiometria; Concentrações) 1 Lei das proporções definidas (Lei de Proust) Em uma substância química, os elementos estão sempre presentes em proporções
2. Introdução: Conceitos e cálculos fundamentais (Estequiometria; Concentrações) 1 Lei das proporções definidas (Lei de Proust) Em uma substância química, os elementos estão sempre presentes em proporções
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Apresentar os principais conceitos envolvidos no equilíbrio químico de reações múltiplas e de soluções
 EQUILÍBRIO QUÍMICO E DE SOLUÇÕES Meta Apresentar os principais conceitos envolvidos no equilíbrio químico de reações múltiplas e de soluções Objetivos Ao final desta aula, o aluno deverá: compreender os
EQUILÍBRIO QUÍMICO E DE SOLUÇÕES Meta Apresentar os principais conceitos envolvidos no equilíbrio químico de reações múltiplas e de soluções Objetivos Ao final desta aula, o aluno deverá: compreender os
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Pesquisa em Engenharia
 Pesquisa em Engenharia CIÊNCIA E TECNOLOGIA A ciência procura descobrir leis e explicações que possam desvendar os fenômenos da natureza. A tecnologia, através dos conhecimentos científicos, procura obter
Pesquisa em Engenharia CIÊNCIA E TECNOLOGIA A ciência procura descobrir leis e explicações que possam desvendar os fenômenos da natureza. A tecnologia, através dos conhecimentos científicos, procura obter
Escola Estadual Antunes de Andrade CINÉTICA QUÍMICA
 Escola Estadual Antunes de Andrade CINÉTICA QUÍMICA Sidrolândia, MS, 2013 Escola Estadual Sidrônio Antunes de Andrade Estudantes: Thaís Silva e Giovani N : 45 e 15 1 - CINÉTICA QUÍMICA Existe um ramo na
Escola Estadual Antunes de Andrade CINÉTICA QUÍMICA Sidrolândia, MS, 2013 Escola Estadual Sidrônio Antunes de Andrade Estudantes: Thaís Silva e Giovani N : 45 e 15 1 - CINÉTICA QUÍMICA Existe um ramo na
Cinética Química. Mestrado integrado em Engenharia Biológica. Disciplina Química II, 2º semestre 2009/10. Professsora Ana Margarida Martins
 Cinética Química Mestrado integrado em Engenharia Biológica Disciplina Química II, 2º semestre 2009/10 Professsora Ana Margarida Martins Usamos atermodinâmica para saber se uma reacção é favorecida no
Cinética Química Mestrado integrado em Engenharia Biológica Disciplina Química II, 2º semestre 2009/10 Professsora Ana Margarida Martins Usamos atermodinâmica para saber se uma reacção é favorecida no
Físico-química Farmácia 2014/02
 Físico-química Farmácia 2014/02 1 Decomposição Química Cinética de decomposição Lei de velocidade Ordem de reação Tempo de meia vida e prazo de validade Fatores que influenciam a estabilidade Equação de
Físico-química Farmácia 2014/02 1 Decomposição Química Cinética de decomposição Lei de velocidade Ordem de reação Tempo de meia vida e prazo de validade Fatores que influenciam a estabilidade Equação de
Revisão 1 H 99,985 2 H 0, C 98,89 13 C 1,11 14 N 99,63 15 N 0,37 16 O 99, O 0, O 0,204
 Revisão Número de massa A característica fundamental que define um elemento químico é o número de prótons (Z) no núcleo. Se chamarmos de N o número de nêutrons no núcleo, o número de massa A é dado por:
Revisão Número de massa A característica fundamental que define um elemento químico é o número de prótons (Z) no núcleo. Se chamarmos de N o número de nêutrons no núcleo, o número de massa A é dado por:
Fundamentos de Química
 FCiências Fundamentos de Química Apontamentos Equilíbrio químico, Ácido e Bases, Cinética Química Produzido por Filipa França Divulgado e Partilhado por FCiências Equilíbrio Químico FCiências Reações em
FCiências Fundamentos de Química Apontamentos Equilíbrio químico, Ácido e Bases, Cinética Química Produzido por Filipa França Divulgado e Partilhado por FCiências Equilíbrio Químico FCiências Reações em
Determinar a constante de velocidade, k, a energia de. Se a reação de saponificação for de segunda ordem a
 LABORATÓRIO DE FÍSICO-QUÍMICA SAPONIFICAÇÃO DO ACETATO DE ETILA: MÉTODO CONDUTIMÉTRICO OBJETIVO Determinar a constante de velocidade, k, a energia de ativação,e a, para a reação de saponificação do acetato
LABORATÓRIO DE FÍSICO-QUÍMICA SAPONIFICAÇÃO DO ACETATO DE ETILA: MÉTODO CONDUTIMÉTRICO OBJETIVO Determinar a constante de velocidade, k, a energia de ativação,e a, para a reação de saponificação do acetato
6/Mar/2013 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
24/Abr/2014 Aula /Abr/2014 Aula 15
 /Abr/014 Aula 15 Ondas de matéria; comprimento de onda de de Broglie. Quantização do momento angular no modelo de Bohr. Difracção e interferência. Função de onda; representação matemática do pacote de
/Abr/014 Aula 15 Ondas de matéria; comprimento de onda de de Broglie. Quantização do momento angular no modelo de Bohr. Difracção e interferência. Função de onda; representação matemática do pacote de
ESCOLA SECUNDÁRIA DR. SOLANO DE ABREU ABRANTES TURMA: G ANO: 12º ANO LETIVO 2011/2012 ATIVIDADES ESTRATÉGIAS. Diagnose da turma. -Trabalho individual
 ESCOLA SECUNDÁRIA DR. SOLANO DE ABREU ABRANTES CURSO PROFISSIONAL Técnico de Instalações Elétricas DISCIPLINA: FÌSICA e QUÌMICA TURMA: G ANO: 12º ANO LETIVO 2011/2012 COMPETÊNCIAS CONTEÚDOS PROGRAMÁTICOS
ESCOLA SECUNDÁRIA DR. SOLANO DE ABREU ABRANTES CURSO PROFISSIONAL Técnico de Instalações Elétricas DISCIPLINA: FÌSICA e QUÌMICA TURMA: G ANO: 12º ANO LETIVO 2011/2012 COMPETÊNCIAS CONTEÚDOS PROGRAMÁTICOS
E-books PCNA. Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 4 ESTEQUIOMETRIA
 E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 4 ESTEQUIOMETRIA 1 QUÍMICA ELEMENTAR CAPÍTULO 4 SUMÁRIO Apresentação -------------------------------------------- 2 Capítulo 4 ------------------------------------------------
E-books PCNA Vol. 1 QUÍMICA ELEMENTAR CAPÍTULO 4 ESTEQUIOMETRIA 1 QUÍMICA ELEMENTAR CAPÍTULO 4 SUMÁRIO Apresentação -------------------------------------------- 2 Capítulo 4 ------------------------------------------------
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS FÍSICAS E MATEMÁTICAS DEPARTAMENTO DE QUÍMICA
 UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS FÍSICAS E MATEMÁTICAS DEPARTAMENTO DE QUÍMICA Campus Universitário -Trindade - 88040-900 - Florianópolis - SC - Brasil Fone: (048) 3721-6852 Disciplina:
UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS FÍSICAS E MATEMÁTICAS DEPARTAMENTO DE QUÍMICA Campus Universitário -Trindade - 88040-900 - Florianópolis - SC - Brasil Fone: (048) 3721-6852 Disciplina:
ESTUDO COMPARATIVO DE MODELOS DE COEFICIENTES DE ATIVIDADE DA FASE LÍQUIDA PARA SEPARAÇÃO DA MISTURA ETANOL-ÁGUA
 ESTUDO COMPARATIVO DE MODELOS DE COEFICIENTES DE ATIVIDADE DA FASE LÍQUIDA PARA SEPARAÇÃO DA MISTURA ETANOL-ÁGUA A. APIO 1 e N. P. G. SALAU Universidade Federal de Santa Maria, Departamento de Engenharia
ESTUDO COMPARATIVO DE MODELOS DE COEFICIENTES DE ATIVIDADE DA FASE LÍQUIDA PARA SEPARAÇÃO DA MISTURA ETANOL-ÁGUA A. APIO 1 e N. P. G. SALAU Universidade Federal de Santa Maria, Departamento de Engenharia
PROGRAMAÇÃO DA 3ª ETAPA
 PROGRAMAÇÃO DA 3ª ETAPA - 2012 FÍSICA CARLOS 3ª MÉDIO Srs. pais ou responsáveis, caros alunos, Encaminhamos a Programação de Etapa, material de apoio para o acompanhamento dos conteúdos e habilidades que
PROGRAMAÇÃO DA 3ª ETAPA - 2012 FÍSICA CARLOS 3ª MÉDIO Srs. pais ou responsáveis, caros alunos, Encaminhamos a Programação de Etapa, material de apoio para o acompanhamento dos conteúdos e habilidades que
Química Geral e Experimental II Equilíbrio químico Resolução comentada de exercícios selecionados versão equilíbrio_v1_2005 Prof. Fabricio R.
 Química Geral e Experimental II Equilíbrio químico comentada de exercícios selecionados versão equilíbrio_v1_2005 Prof. Fabricio R. Sensato 1) A constante de equilíbrio K c da reação: H 2 (g) + Cl 2 (g)
Química Geral e Experimental II Equilíbrio químico comentada de exercícios selecionados versão equilíbrio_v1_2005 Prof. Fabricio R. Sensato 1) A constante de equilíbrio K c da reação: H 2 (g) + Cl 2 (g)
2 Considerações teóricas
 2 Considerações teóricas Uma breve abordagem termodinâmica e cinética do sistema reacional Cu- Ni/Al 2 O 3, será apresentada neste capitulo. As previsões teóricas do comportamento reacional do sistema
2 Considerações teóricas Uma breve abordagem termodinâmica e cinética do sistema reacional Cu- Ni/Al 2 O 3, será apresentada neste capitulo. As previsões teóricas do comportamento reacional do sistema
Cinética Química 17/04/17. V m h. Prof. Xuxu. Velocidade das reações químicas. Velocidade das reações químicas. Velocidade Média. Hora da saída: 11:45
 Seja Bem-indo a Goiânia elocidade Média Cinética Química Hora da saída: 11:45 Δd 40km m 40 km Δt 1h h Distância Hidrolândia: 40 km Seja Bem-indo a Hidrolândia Prof. Xuxu Hora da chegada: 12:45 elocidade
Seja Bem-indo a Goiânia elocidade Média Cinética Química Hora da saída: 11:45 Δd 40km m 40 km Δt 1h h Distância Hidrolândia: 40 km Seja Bem-indo a Hidrolândia Prof. Xuxu Hora da chegada: 12:45 elocidade
Introdução à Modelagem Molecular
 Introdução à Modelagem Molecular Prof. Alex Fabiano C. Campos, Dr Introdução Métodos teóricos e técnicas computacionais para modelar ou imitar o comportamento de moléculas e sistemas atômicos. Empregados
Introdução à Modelagem Molecular Prof. Alex Fabiano C. Campos, Dr Introdução Métodos teóricos e técnicas computacionais para modelar ou imitar o comportamento de moléculas e sistemas atômicos. Empregados
Aula 2 DIAGRAMAS DE FASE DE SUBSTÂNCIAS PURAS. Glauber Silva Godoi
 Aula 2 DIAGRAMAS DE FASE DE SUBSTÂNCIAS PURAS META Capacitar o aluno sobre a importância dos diagramas de fase, a interpretação das informações contidas nele, e os meios pelos quais pode ser obtido. OBJETIVOS
Aula 2 DIAGRAMAS DE FASE DE SUBSTÂNCIAS PURAS META Capacitar o aluno sobre a importância dos diagramas de fase, a interpretação das informações contidas nele, e os meios pelos quais pode ser obtido. OBJETIVOS
Combustíveis Energia e Ambiente. Combustíveis gasosos, líquidos e sólidos: compreender as diferenças
 Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Cinética química David P. White Fatores que afetam a velocidade de reações A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores
QUÍMICA A Ciência Central 9ª Edição Cinética química David P. White Fatores que afetam a velocidade de reações A cinética é o estudo da velocidade na qual as reações químicas ocorrem. Existem quatro fatores
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
MARATONA PISM III 2016 PROFESSOR: ALEXANDRE FIDELIS BLACK LICENCIADO E BACHAREL EM QUÍMICA -UFJF
 MARATONA PISM III 2016 PROFESSOR: ALEXANDRE FIDELIS BLACK LICENCIADO E BACHAREL EM QUÍMICA -UFJF Parte da química que estuda a rapidez das reações Este estudo é importante para o nosso dia-a-dia, pois
MARATONA PISM III 2016 PROFESSOR: ALEXANDRE FIDELIS BLACK LICENCIADO E BACHAREL EM QUÍMICA -UFJF Parte da química que estuda a rapidez das reações Este estudo é importante para o nosso dia-a-dia, pois
4. Propriedades dos gases experimentos e modelo microscópico simples para a temperatura
 PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
EQUILÍBRIO QUÍMICO. Profa. Loraine Jacobs DAQBI.
 EQUILÍBRIO QUÍMICO Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs É a parte da físico-química que estuda as reações reversíveis e as condições para
EQUILÍBRIO QUÍMICO Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs É a parte da físico-química que estuda as reações reversíveis e as condições para
BC Transformações Químicas
 Transformações Químicas BC0307 Prof. Anderson O. Ribeiro http://www.andersonorzari.com BC 0307 Transformações Químicas ANDERSON ORZARI RIBEIRO Bloco B, 10º andar - Sala 1043 www.andersonorzari.com Transformações
Transformações Químicas BC0307 Prof. Anderson O. Ribeiro http://www.andersonorzari.com BC 0307 Transformações Químicas ANDERSON ORZARI RIBEIRO Bloco B, 10º andar - Sala 1043 www.andersonorzari.com Transformações
Aula FUNÇÕES DE ESTADO: ENERGIA INTERNA E ENTALPIA
 FUNÇÕES DE ESTADO: ENERGIA INTERNA E ENTALPIA Metas Apresentar as aplicações da energia interna e da entalpia; apresentar as equações que expressam a capacidade calorífica. Objetivos Ao final desta aula,
FUNÇÕES DE ESTADO: ENERGIA INTERNA E ENTALPIA Metas Apresentar as aplicações da energia interna e da entalpia; apresentar as equações que expressam a capacidade calorífica. Objetivos Ao final desta aula,
TEM701 Termodinâmica dos Materiais
 Universidade Federal do Paraná Setor de Tecnologia Departamento de Engenharia Mecânica TEM701 Termodinâmica dos Materiais Conceitos, definições e motivação Prof. Rodrigo Perito Cardoso Onde estamos Introdução
Universidade Federal do Paraná Setor de Tecnologia Departamento de Engenharia Mecânica TEM701 Termodinâmica dos Materiais Conceitos, definições e motivação Prof. Rodrigo Perito Cardoso Onde estamos Introdução
LICENCIATURA EM QUÍMICA QUÍMICA
 Programa de Disciplina Nome: Química Geral II IQ Código: IQG 120 Categoria: Carga Horária Semanal: CARACTERÍSTICAS Número de Semanas Previstas para a Disciplina: 15 Número de Créditos da Disciplina: 4
Programa de Disciplina Nome: Química Geral II IQ Código: IQG 120 Categoria: Carga Horária Semanal: CARACTERÍSTICAS Número de Semanas Previstas para a Disciplina: 15 Número de Créditos da Disciplina: 4
Forças Intermoleculares
 Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
DISCIPLINA DE QUÍMICA
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
é o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições
 Cinética Química Cinética química é o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições Fatores que afetam a velocidade da reação: Concentração dos reagentes.
Cinética Química Cinética química é o estudo da velocidade das reações, de como a velocidade varia em função das diferentes condições Fatores que afetam a velocidade da reação: Concentração dos reagentes.
AULA 05: Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa do carbono-12.
 SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
Propriedades de uma substância pura
 Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Atividade a Distância 4 CINÉTICA
 Atividade a Distância 4 CINÉTICA Na parte 1 da Aula 3 vimos a definição de velocidade inicial e como deve ser medida. Agora, vamos ver como ela varia se mudarmos a concentração dos reagentes. Estamos acostumados
Atividade a Distância 4 CINÉTICA Na parte 1 da Aula 3 vimos a definição de velocidade inicial e como deve ser medida. Agora, vamos ver como ela varia se mudarmos a concentração dos reagentes. Estamos acostumados
ENSINO MÉDIO QUÍMICA
 ENSINO MÉDIO QUÍMICA TERMOQUÍMICA TERMOQUÍMICA Termoquímica é a parte da química que estuda o calor associado a uma reação química. A unidade usada para medir a energia liberada ou absorvida por um sistema
ENSINO MÉDIO QUÍMICA TERMOQUÍMICA TERMOQUÍMICA Termoquímica é a parte da química que estuda o calor associado a uma reação química. A unidade usada para medir a energia liberada ou absorvida por um sistema
Física Geral II. Aula 1 - Teoria cinética dos gases. D. Valin 1. Universidade do Estado de Mato Grosso. Sinop-MT, April 25, 2017
 Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Estequiometria. Índice. Por Victor Costa
 Estequiometria Por Victor Costa Índice 1. Massa atômica 2. Mol 3. Massa molar 4. Massa molecular 5. Composição percentual 6. Reação química 7. Balanceamento 8. Reagente limitante 9. Rendimento Essa aula
Estequiometria Por Victor Costa Índice 1. Massa atômica 2. Mol 3. Massa molar 4. Massa molecular 5. Composição percentual 6. Reação química 7. Balanceamento 8. Reagente limitante 9. Rendimento Essa aula
Aula 4 PREPARO DE SOLUÇÕES. META Introduzir técnicas básicas de preparo de soluções.
 PREPARO DE SOLUÇÕES META Introduzir técnicas básicas de preparo de soluções. OBJETIVOS Ao final desta aula o aluno deverá: Fornecer conhecimento necessário para o preparo de soluções. Calcular a concentração
PREPARO DE SOLUÇÕES META Introduzir técnicas básicas de preparo de soluções. OBJETIVOS Ao final desta aula o aluno deverá: Fornecer conhecimento necessário para o preparo de soluções. Calcular a concentração
Prática 05 Determinação Da Massa Molar Do Magnésio
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 05 Determinação Da Massa Molar Do Magnésio
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 05 Determinação Da Massa Molar Do Magnésio
Gabarito das Questões
 II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
UNIDADE 15 OSCILAÇÕES
 UNIDADE 15 OSCILAÇÕES 557 AULA 40 OSCILAÇÕES OBJETIVOS: - DEFINIR O CONCEITO DE OSCILAÇÃO; - CONHECER AS GRANDEZAS QUE DESCREVEM O MOVIMENTO. 40.1 Introdução: Há, na Natureza, um tipo de movimento muito
UNIDADE 15 OSCILAÇÕES 557 AULA 40 OSCILAÇÕES OBJETIVOS: - DEFINIR O CONCEITO DE OSCILAÇÃO; - CONHECER AS GRANDEZAS QUE DESCREVEM O MOVIMENTO. 40.1 Introdução: Há, na Natureza, um tipo de movimento muito
Química Geral e Experimental II: Cinética Química. Prof. Fabrício Ronil Sensato
 Química Geral e Experimental II: Cinética Química Prof. Fabrício Ronil Sensato Resolução comentada de exercícios selecionados. Versão v2_2005 2 1) Para a reação em fase gasosa N 2 + 3H 2 2NH 3, 2) A decomposição,
Química Geral e Experimental II: Cinética Química Prof. Fabrício Ronil Sensato Resolução comentada de exercícios selecionados. Versão v2_2005 2 1) Para a reação em fase gasosa N 2 + 3H 2 2NH 3, 2) A decomposição,
