Clarice Kirszberg MECANISMOS DE AÇÃO PRÓ-COAGULANTE EM LINHAGENS TUMORAIS
|
|
|
- Melissa Alvarenga Silva
- 6 Há anos
- Visualizações:
Transcrição
1 Universidade Federal do Rio de Janeiro Centro de Ciências da Saúde Instituto de Bioquímica Médica Clarice Kirszberg MECANISMOS DE AÇÃO PRÓ-COAGULANTE EM LINHAGENS TUMORAIS Rio de Janeiro Fevereiro de 2007
2 Livros Grátis Milhares de livros grátis para download.
3 ii Clarice Kirszberg MECANISMOS DE AÇÃO PRÓ-COAGULANTE EM LINHAGENS TUMORAIS Tese de doutorado submetida ao Instituto de Bioquímica Médica da Universidade Federal do Rio de Janeiro, visando ao grau de doutor em Química Biológica Orientador: Robson Q. Monteiro Prof. Adjunto do Instituto de Bioquímica Médica/CCS/UFRJ Co-orientadora: Vivian M. Rumjanek Profa. Titular do Instituto de Bioquímica Médica/CCS/UFRJ Rio de Janeiro Fevereiro de 2007
4 iii Ficha Catalográfica Kirszberg, Clarice Mecanismos de ação pró-coagulante em linhagens tumorais / Clarice Kirszberg. Rio de Janeiro, xvii, 118f. Tese (Doutorado em Química Biológica) Universidade Federal do Rio de Janeiro, Instituto de Bioquímica Médica CCS, Orientador: Robson Queiroz Monteiro Co-orientador: Vivian Mary Rumjanek 1. Palavras chaves: câncer, células tumorais, complexos enzimáticos da coagulação, fator tecidual, fosfatidilserina, trombina I. Monteiro, Robson Q. (Orient.). II. Universidade Federal do Rio de Janeiro. Instituto de Bioquímica Médica. III. Título.
5 iv Folha de Aprovação Clarice Kirszberg MECANISMOS PRÓ-COAGULANTES EM LINHAGENS TUMORAIS Rio de Janeiro, 12 de Fevereiro de 2007 (Robson Queiroz Monteiro, Prof Adjunto do IBqM, UFRJ) (Mario Alberto C. da Silva Neto, Prof Adjunto do IBqM, UFRJ) (Marcello Andre Barcinski, Prof. Titular da USP e Pesquisador do INCa) (Raquel Ciuvalschi Maia, Profa. Adjunta da UNIGRANRIO e Medica do INCa) (Russolina Benedeta Zingali, Profa. Adjunta do IBqM, UFRJ)
6 v Dedico esta tese à minha querida filha, minha maior alegria e inspiração e ao meu querido pai, in memorian, o meu maior incentivador.
7 vi Agradecimentos Primeiramente devo agradecer a existência da minha bonequinha, meu mundo não seria mais o mesmo sem ela, sem a sua simpatia e sua alegria que move todos que a rodeiam. Agradeço enormemente à minha mãe e ao meu pai (In Memorian), por sempre me incentivarem e estarem sempre por perto quando precisei de apoio. Se eu cheguei até aqui, certamente devo essa conquista a vocês. Vocês sempre foram presentes e me possibilitaram ganhar asas para voar e encontrar o meu caminho. Eu os amo muito, muito mais do que vocês podem imaginar e palavras faltam para dizer a importância que vocês têm na minha vida. Ao meu pai, em especial, agradeço por me ajudar enormemente com o meu português. As coisas não serão mais as mesmas sem você. Agradeço ao meu marido, por ter trazido amor para a minha vida, ter me carregado para a Inglaterra e ter me dado de presente a coisa mais preciosa de nossas vidas, a Debbie. À minha querida irmã, in memorian, os anos se passam mas a saudade e a memória ficam dentro de mim. Você é parte da minha vida e vive nos meus pensamentos. Amo-te muito! Sinto muitas saudades de nossa convivência! À meu querido irmão, carinhoso e prestativo, sinto estar indo embora e deixando a responsabilidade para você. Amo-te muito! Obrigada pelas horas que você dá uma de super tio e cuida da De pra mim. Aos meus queridos avós (in memorian) e minha querida avó, carinhosa e mais forte do que se acredita. Obrigada pela simples existência e por sempre querer agradar. Amo-te muito! Aos meus queridos tios e primos, aqueles de verdade e os postiços, que são da onde eu tiro forças para seguir em frente, sempre do meu lado me apoiando em todos os momentos. Isso é que é família, o resto é conversa. Vocês são os melhores! Amo vocês! Ao meu orientador, Robson, o que eu faria sem você, certamente que está tese não teria existido. Obrigada por me orientar de perto e de longe pelo computador, sempre presente quando precisei, quebrando todos os meus galhos. Obrigada por acreditar em mim, sempre me dizendo que eu iria conseguir, mesmo quando as coisas davam errado. À minha querida orientadora e mãe, Vivian, depois de quase 10 anos de convívio, eu agradeço por um belo dia você ter me dado a oportunidade de entrar no seu laboratório e poder ter contato com a grande mestra que você é. Obrigada por tudo, você me deu mais que formação acadêmica, você me deu chances de caminhar e trilhar o meu caminho no pessoal também. À Dra. Ottilia, a eterna Mary Poppins, por ser essa pessoa meiga, simpática, especial, que alegra os nossos dias e sempre consegue nos salvar tirando substâncias mágicas de sua bolsa misteriosa. Aos meus orientadores no NIBSC, Dra. Elaine Gray e Dr. Trevor Barrowcliffe, por me permitirem trabalhar em seus laboratórios e me receberem muito bem.
8 À Profa. Lina, que além de revisora desse trabalho, me ajudou e me ensinou muito quando eu precisei dar aulas. À minha querida amiga Juju, agora Profa. Juliana, por tudo, por me permitir ser sua amiga, por estar sempre presente em todos os momentos da minha vida, trocar inúmeras e eficientes idéias comigo, por eu saber que posso contar sempre com você. Por você ser essa pessoa carinhosa e especial e minha amiga acima de tudo. À minha querida amiga Cla, minha quase xará, que eu tenho o grande prazer de poder chamar de amiga, fashion e especial, amiga pra toda hora. Sempre presente e sempre me socorrendo quando eu preciso de algo. Amiga, você entrou na minha vida e espero que mesmo com a distância você nunca mais saia. À minha amiga Fe, que veio a se juntar ao grupo mais tarde mas que rapidamente conquistou o meu coração e hoje é uma grande amiga. À minha amiga Dani Leite, que esteve junto comigo em momentos importantes da minha vida pessoal e laboratorial e que foi morar na melhor cidade, Floripa, deixando a gente com saudades mas sempre aparecendo pra relembrar e criar mais momentos especiais que eu vou levar comigo no fundo do coração. Ao Flavinho, um fofo, sempre com uma palavra especial um carinho e um abraço, que fazem a vida no laboratório mais alegre e agradável. Gosto muito de você. Ao Rapha que forma com o Flavio a dupla dinâmica. Obrigada por todos os momentos que convivemos fora e dentro do laboratório. À Claudia Jurberg, a nossa jornalista que rapidamente virou amiga, sua presença e alto astral são de extrema importância. Adoro nossos papos. Ao Tião que me ensinou muito quando eu entrei no laboratório e que sempre me ajudou quando precisei encomendar alguma coisa. É um prazer poder conviver com você! Ao André e à Jacque porque sem eles este trabalho simplesmente não existiria. Vocês são de fundamental importância! Ao pessoal de todos os laboratórios por onde passei, aqui e na Inglaterra, pela boa convivência e por fazer o meu dia mais prazeroso, e por terem ajudado na conclusão deste trabalho. Em especial a minha amiga Louisa, lá do NIBSC, que passou de colega de trabalho a amiga em poucos meses de convivência. À todos os meus amigos que sempre estiveram presentes na minha vida me apoiando e estando por perto nos momentos felizes e nos momentos ruins, sem vocês a vida não tem graça. Em especial, ao Kandy, o q eu faria sem você, e às Danis, sempre presentes em minha vida mesmo que à distância. vii
9 viii Resumo A correlação entre câncer e estados hipercoagulantes tem sido descrita por mais de um século. Pacientes com câncer têm um risco aumentado para complicações trombóticas e hemorrágicas. A proteína pró-coagulante, Fator Tecidual (TF), funciona como receptor para o fator VIIa (FVIIa) plasmático iniciando reações de proteólise que culminam com a coagulação do plasma. De fato a expressão aumentada de TF em células neoplásicas tem sido implicada na patogênese das desordens de coagulação em pacientes com câncer. Alguns estudos demonstraram que a atividade pró-coagulante não é dependente exclusivamente de TF, mas também da exposição de fosfolipídios carregados negativamente, particularmente a fosfatidilserina (PS). A presença de PS na superfície das células permite a geração de FXa e trombina através da montagem dos complexos tenase intrínseco (FIXa/FVIIIa) e protrombinase (FXa/FVa). Nosso objetivo foi caracterizar a atividade pró-coagulante em diferentes linhagens celulares, incluindo linhagens de melanoma murino (B16F10) e humano (WM-266-4), além das linhagens de leucemia humana Molt-4, THP-1 e NB4. A expressão de TF foi verificada por meio de ensaios de citometria de fluxo e de coagulação do plasma. A exposição de PS também foi avaliada por ensaios de citometria de fluxo além de análise da geração de FXa e trombina, utilizando enzimas da coagulação purificadas. Nossos resultados mostraram que todas as células expressam TF na sua superfície. Os ensaios de coagulação plasmática demonstraram, para todas as linhagens celulares, uma diminuição progressiva no tempo de coagulação com o aumento da concentração de células. Nas linhagens humanas, este fenômeno foi fortemente inibido por anticorpos anti-tf, mas não por Aprotinina, um inibidor não específico de serino-proteases, indicando que a presença de TF na superfície dessas células foi determinante para a atividade pró-coagulante. As linhagens aqui estudadas apresentaram PS em sua superfície, permitindo a ativação de FX a FXa e de protrombina em trombina pelos complexos tenase intrínseco e protrombinase, respectivamente. Para a linhagem WM-266-4, a formação dos complexos foi inibida por Anexina V, confirmando que a ligação dos complexos era dependente da exposição de PS. Em conclusão, todas as linhagens celulares tiveram uma atividade pró-coagulante que não foi dependente somente da expressão de TF, mas também de uma membrana carregada negativamente. Em conjunto, estes eventos podem contribuir para as anormalidades de coagulação e para o padrão agressivo visto nos diferentes tipos de câncer. Além disso, estas linhagens podem ser utilizadas como modelos para o estudo do papel das proteínas da coagulação sanguínea na biologia tumoral.
10 ix Abstract The correlation between cancer and hypercoagulant states has been described for more than a century. Patients with cancer are at increased risk for thrombotic and hemorrhagic complications. The procoagulant protein, tissue factor (TF), functions as a receptor for the plasmatic factor VIIa (FVIIa), initiating proteolysis reactions that culminate with the plasma coagulation. In fact, the TF expression in neoplastic cells has been implied in the pathogenesis of the coagulation disorders in patients with cancer. Some studies showed that the procoagulant activity is not just dependent on TF but also on the exposure of negatively charged phospholipids, particularly phosphatidylserine (PS). The presence of PS on the cell surface allows the generation of FXa and thrombin through the assembly of the intrinsic tenase (FIXa/FVIIIa) and prothrombinase (FXa/FVa) complexes. Our aim was to characterize the procoagulant activity of different cell lines, including the murine (B16F10) and human (WM ) melanoma cell lines and the human leukemic cell lines Molt-4, THP-1 and NB4. The levels of TF expression were assessed by flow cytometry and using plasma clotting assays. PS exposure was evaluated by flow cytometry and FXa and thrombin generation assays employing purified coagulation enzymes. Our results showed that all the cell lines expressed TF antigen on the surface. The plasma clotting assays had demonstrated, for all the cell lines, a progressive reduction in clotting time with the increase of the cell concentrations. To the human cell lines, this phenomenon was inhibited by anti-tf antibody but not by Aprotinin, a non-specific serine-protease inhibitor, indicating that the presence of TF in the surface of these cells was determinative for the procoagulant activity. The cell lines studied here expressed PS on their cell surfaces, allowing the activation of FX to FXa and prothrombin to thrombin when assembled in intrinsic tenase and prothrombinase complexes respectively. For the cell line WM-266-4, the formation of the complexes were inhibited by Anexin V, confirming that the binding of the complexes were dependent on the PS exposure. In conclusion, all the cell lines showed a procoagulant activity that is not due just to TF but also to a negatively charged membrane. Together these events may contribute to the clotting abnormalities and to the aggressive pattern seen in the different types of cancer. Therefore, this cell lines may be used as models for studying the role of blood coagulation proteins in tumour biology.
11 x Lista de Figuras Figura 1 Teoria da coagulação proposta por Morawitz Figura 2 Modelo da cascata de coagulação...6 Figura 3 Modelo celular da coagulação sanguínea...8 Figura 4 Complexos da coagulação sanguínea Figura 5 Inativação dos complexos da coagulação pelo TFPI...13 Figura 6 Estrutura do fibrinogênio Figura 7 Formação do polímero de fibrina Figura 8 Inibição dos complexos da coagulação Figura 9 Formação dos D-dímeros pela plasmina Figura 10 Anormalidades da coagulação de pacientes com câncer verificados em testes de laboratório Figura 11 O papel central da célula tumoral na patogênese do estado pró-trombótico em pacientes com câncer Figura 12 TF e angiogênese mecanismos independentes da coagulação Figura 13 Trombina e angiogênese: mecanismos dependentes da coagulação Figura 14 Trombina e angiogênese: mecanismos independentes da coagulação Figura 15 Estrutura dos receptores PAR Figura 16 Ativação dos receptores PAR Figura 17 Moléculas envolvidas na invasão celular e angiogênese na progressão do tumor via PAR Figura 18 Análise da expressão de TF na membrana da linhagem B16F Figura 19 Atividade de TF na linhagem B16F Figura 20 Análise da exposição de PS na membrana de células da linhagem B16F Figura 21 As células de melanoma B16F10 promovem a ativação de FXa através do complexo tenase intrínseco...60
12 Figura 22 As células de melanoma B16F10 aumentam a ativação de protrombina pelo fator Xa Figura 23 Atividade do complexo protrombinase em células B16F Figura 24 Citometria de fluxo para expressão de TF na membrana da linhagem WM Figura 25 Atividade de TF nas linhagens WM Figura 26 Análise da presença de PS na membrana da linhagem WM Figura 27 As células de melanoma WM promovem a ativação de FXa através do complexo tenase intrínseco...68 Figura 28 Atividade do complexo protrombinase nas células WM Figura 29 Efeito de WM na formação de trombina em plasma desfibrinado Figura 30 Citometria de fluxo para a análise de TF na membrana das linhagens leucêmicas Figura 31 Atividade de TF nas linhagens leucêmicas...74 Figura 32 Análise da exposição de PS na membrana das linhagens leucêmicas Figura 33 Linhagens leucêmicas promovem a ativação de FX através do complexo tenase intrínseco...77 Figura 34 Atividade do complexo protrombinase nas células Molt-4 e THP Figura 35 Efeito de THP-1 e NB4 na formação de trombina em plasma desfibrinado xi
13 xii Lista de Tabelas Tabela 1 Resumo da expressão, ativação e funcionalidade dos receptores PAR em células normais...37 Tabela 2 Atividade de TF nas linhagens WM Tabela 3 Atividade de TF nas linhagens THP-1, Molt-4 e NB
14 xiii Abreviaturas APC proteína C ativada (activated C protein) aptt tempo de tromboplastina parcial ativada (activated parcial thromboplastin time) AT antitrombina bfgf fator de crescimento básico de fibroblastos (basic fibroblast growth factor) CID coagulação intravascular disseminada CP pró-coagulante neoplásico (cancer procoagulant) DAG diacilglicerol DNA ácido desoxirribonucléico (deoxyribonucleic acid) Gla ácido γ-carboxiglutâmico HK cininogênio de alto peso molecular (high molecular weight kininogen) IL-1 interleucina-1 IL-8 interleucina-8 IP3 inositol-3-fosfato MAPK proteína quinase ativada por mitógeno (mitogen activated protein kinase) MMP-2 matriz metaloproteínase-2 PAI-1 inibidor do ativador de plasminogênio 1 (plasminogen activator inhibitor 1) PAR receptores ativados por proteases (protease activated receptors) PDGF fator de crescimento derivado de plaquetas (platelet derived growth factor) PI3-K fosfoinositidio 3-quinase PK pré-calicreína PKC proteína quinase C PS fosfatidilserina (phosphatidilserine) PT tempo de protrombina (prothrombin time) RNA ácido ribonucleico (ribonucleic acid)
15 xiv TAT complexo trombina-antitrombina TF fator tecidual (tissue factor) TFPI inibidor da via do fator tecidual (tissue factor pathway inhibitor) TGF-β1 fator de crescimento transformador-β1 (transforming growth factor-β1) TM trombomodulina TNF fator de necrose tumoral (tumor necrosis factor) t-pa ativador de plasminogênio tecidual (tissue plasminogen activator) TVP trombose venosa profunda u-pa ativador de plasminogênio do tipo uroquinase (urokinase type plasminogen activator) VEGF fator de crescimento do endotélio vascular (vascular endothelial growth factor) VTE tromboembolismo venoso (venous tromboembolism) vwf fator de von Willebrand (von Willebrand factor)
16 xv Sumário Agradecimentos... vi Resumo... viii Abstract... ix Lista de Figuras...x Lista de Tabelas... xii Abreviaturas... xiii 1 Introdução Fisiologia da Coagulação As fases da Coagulação Sanguínea Fase de Iniciação e o Fator Tecidual Fase de Amplificação Fase de Propagação e a Trombina Terminação Eliminação Patologia da Coagulação no Câncer Manifestações da coagulopatia no câncer Atividades pró-coagulantes associadas ao câncer O papel do Fator Tecidual no Câncer Trombina e Câncer Sinalização por receptores PAR no Câncer Objetivos Objetivo Geral Objetivos Específicos Materiais e Métodos...45
17 xvi 3.1 Reagentes Linhagens Celulares Cultura de Células Citometria de Fluxo Identificação de Fator Tecidual Identificação de Fosfatidilserina (PS) Ensaio de atividade do Fator Tecidual tempo de coagulação do plasma Ensaio de geração de fator Xa Ensaio de formação do complexo Protrombinase Ativação de protrombina estimada por SDS-PAGE Inibição dos complexos da coagulação por Anexina V Desfibrinação de plasma humano com ancrod Ensaio cromogênico para geração de trombina no plasma Análise Estatística Resultados Ação pró-coagulante de Linhagens de Melanoma Linhagem de melanoma murino B16F Expressão e atividade do Fator Tecidual Papel da expressão de fosfatidilserina na atividade pró-coagulante Linhagem de melanoma humano WM Expressão e atividade do Fator Tecidual Papel da expressão de fosfatidilserina na atividade pró-coagulante Ação pró-coagulante das linhagens de leucemia Molt-4, THP-1 e NB Expressão e atividade do Fator Tecidual Papel da expressão de fosfatidilserina na atividade pró-coagulante...75
18 5 Discussão Conclusão...90 Bibliografia...92 Anexos Anexo 1 Assembly and regulation of prothrombinase complex on B16F10 melanoma cells Anexo 2 On the molecular mechanisms for the highly procoagulant pattern of C6 glioma cells xvii
19 1 1 Introdução
20 2 1.1 Fisiologia da Coagulação A hemostasia é o mecanismo que mantém a fluidez do sangue pelos vasos, incluindo o controle da hemorragia e a dissolução do coágulo, por meio de eventos mecânicos e bioquímicos. Didaticamente pode-se dividir a hemostasia em primária, secundária e terciária, embora os três processos estejam inter-relacionados. Na hemostasia primária, tem-se vasoconstrição local, adesão e agregação plaquetária com conseqüente formação de um tampão plaquetário inicial. A hemostasia secundária compreende uma série de reações em cascata cujo resultado final é a formação de fibrina a partir do fibrinogênio que confere estabilidade ao coágulo. Por fim, a hemostasia terciária ou fibrinólise é ativada na mesma ocasião da coagulação, existindo um equilíbrio fisiológico entre as mesmas, onde a plasmina atua degradando a fibrina e desfazendo o coágulo formado. A hemostasia requer a formação de uma rolha impermeável de plaquetas e fibrina no sítio da lesão ao vaso, mas também requer que poderosas substâncias pró-coagulantes, ativadas nesse processo, permaneçam localizadas no sítio da injúria. Este controle da coagulação sanguínea é conseguido localizando as reações pró-coagulantes somente na superfície de células específicas. A localização celular é um importante mecanismo de controle para não permitir que a coagulação se espalhe pelo sistema vascular. A coagulação sangüínea faz parte da resposta do sistema hemostático à uma injúria e auxilia na manutenção da integridade do sistema vascular, onde a formação do coágulo de fibrina no sítio de lesão endotelial representa o processo crítico para a manutenção dessa integridade. Os mecanismos envolvidos nesse processo são uma série de interações complexas entre zimogênios, enzimas e cofatores que levam à geração de trombina e ao
21 3 coágulo de fibrina. Estes mecanismos devem ser regulados de forma a balancear a perda excessiva de sangue e a formação de trombos intravasculares decorrentes da formação excessiva de fibrina (BROZE, 1995; FRANCO, 2001), que podem bloquear o fluxo sanguíneo. Uma variedade de tipos celulares contribui para o processo de coagulação. Monócitos, plaquetas, células vasculares endoteliais e os arredores das células musculares do vaso são os principais envolvidos, cada qual atuando em funções específicas. Várias células extravasculares expressam Fator Tecidual (Tissue Factor TF), mas nem todas possuem propriedades coagulantes equivalentes. Sob circunstâncias normais, na circulação, um nível baixo de coagulação ocorre, mas sem uma significante formação de coágulo como evidenciado pela detecção na circulação de fragmentos de proteína associados com o processo de coagulação/fibrinólise. No entanto, se a integridade da barreira endotelial é quebrada, as reações que levam a uma substancial geração de trombina local são iniciadas. Um dano intravascular pode ocorrer devido a uma ruptura de uma placa aterosclerótica ou uma injúria penetrante. Em qualquer um dos casos, plaquetas aderem e agregam para cercar e cobrir o sítio do dano vascular. Com a massa perivascular de células teciduais resultantes, células endoteliais danificadas e membranas de plaquetas aderentes fornecem a plataforma para a coagulação e geração de trombina e fibrina (HOFFMAN, 2003). De fato, o processo de coagulação sanguínea tem fascinado o homem desde os tempos de Platão e Aristóteles, que discutiam a origem das fibras no processo de coagulação. Segue abaixo um breve histórico do processo de coagulação: Cerca de 360 AC, Platão descreveu no seu tratado teórico, Timeu, que as fibras no sangue ajudavam na coagulação.
22 Por volta de 340 AC, Aristóteles achava que as fibras eram feitas de terra, eram sólidas e que o sangue na ausência das fibras não coagulava. 4 Em 1686, Malpighi lavou um coágulo e mostrou as fibras brancas que remanesciam. Nos anos 70 do século XVIII, Hewson localizou as fibras na linfa coagulável, a parte líquida do sangue que hoje chamamos de plasma. Ele achava que a coagulação ocorria quando o sangue entrava em contato com o ar, mas esta teoria foi desacreditada por John Hunter, na mesma época, que demonstrou que a coagulação poderia ocorrer no vácuo. Em 1797, Chaptal foi o primeiro a utilizar o nome fibrina e acreditava que o sangue permanecia fluido porque a fibrina era continuamente removida. No século XIX, Babington, Virchow e Richardson, nos anos 30, 56 e 58, respectivamente, sugeriram que a fibrina se originava de um precursor que denominaram fibrinogênio, que foi isolado do plasma por de Commercy. No final do século XIX, Buchanan e Schmidt identificaram um agente que convertia o fibrinogênio em fibrina e o chamaram de fermento de fibrina, o que foi mais tarde denominado trombina. Schmidt ainda postulou que a trombina não poderia existir na circulação normal do sangue ou tudo coagularia, e portanto, também deveria haver a existência de um precursor, que mais tarde foi chamado de protrombina por Pekelharing (revisado por BÄCHLI, 2000; DOYLE, 2006).
23 As fases da Coagulação Sanguínea Em 1905, Morawitz propôs uma teoria para a coagulação sanguínea que influenciaria as pesquisas nessa área pelos próximos 50 anos. Ele foi o primeiro a introduzir o termo trombokinase para descrever a substância presente nos tecidos que promoveria o coágulo. Sua teoria propôs a existência de quatro elementos: trombokinase (fator tecidual), cálcio, protrombina e fibrinogênio, onde a trombokinase na presença de cálcio converteria a protrombina em trombina, que por sua vez converteria o fibrinogênio em fibrina (Figura 1) (BÄCHLI, 2000; DOYLE 2006; ØSTERUD e BJØRKLID, 2006). Figura 1 Teoria da coagulação proposta por Morawitz. Figura adaptada de Bächli, Em 1964, dois grupos de bioquímicos propuseram a teoria da cascata para explicar a fisiologia da coagulação no sangue. Nesse modelo (Figura 2), a coagulação consistia de uma serie de passos que ativariam proteoliticamente e sequencialmente zimogênios que seriam convertidos a enzimas e que iriam resultar na geração exacerbada de trombina (MACFARLANE, 1964; DAVIE e RATNOFF, 1964). Os modelos originais das cascatas foram modificados subsequentemente para incluir a observação de que alguns pró-coagulantes eram co-fatores e não possuíam atividade enzimática. O esquema dividia a coagulação em uma via extrínseca que consistia do fator VIIa e do fator tecidual, onde este último era visto como ocorrendo somente fora da circulação sangüínea, e uma via intrínseca, iniciada por
24 6 componentes que se acreditava estarem presentes somente no compartimento intravascular. Ambas as vias convergiriam no ponto de ativação do fator X ( via final comum ), que em conjunto com o seu cofator Va converteriam protrombina em trombina. Os componentes da via extrínseca e da via comum se refletem clinicamente no tempo de protrombina (prothrombin time PT), e componentes da via intrínseca e comum se refletem no tempo de tromboplastina parcial ativada (activated partial thromboplastin time aptt) (HOFFMAN, 2003). Na via extrínseca, o fator VII plasmático, na presença do seu cofator, o fator tecidual, ativaria diretamente o fator X em fator Xa. Na via intrínseca, a ativação do fator XII ocorreria quando o sangue entrasse em contato com uma superfície, contendo cargas elétricas negativas. Tal processo foi denominado ativação por contato e requeria ainda a presença de outros componentes do plasma: pré-calicreína (zimogênio da serino-protease calicreína) e cininogênio de alto peso molecular (um cofator não enzimático). O fator XIIa ativaria o fator XI, que, por sua vez, ativaria o fator IX. O fator IXa, na presença de fator VIII, ativaria o fator X da coagulação, desencadeando a geração de trombina e subseqüente formação de fibrina (BROZE, 1995; HOFFMAN, 2003). Figura 2 Modelo da cascata de coagulação. HK = cininogênio de alto peso molecular. PK = pré-calicreína. PL = fosfolipídio. Figura adaptada de King MW.
25 7 No entanto, o modelo de cascata não explicava como, in vivo, a ativação do fator X pelo complexo TF-FVIIa não conseguia compensar a falta do complexo FIXa-FVIIIa. Além disso, pacientes deficientes nos componentes iniciais da via intrínseca (cininogênio de alto peso molecular, calicreína e FXII) não têm tendência a sangramentos, enquanto que os deficientes nos fatores IX e VIII possuem sangramentos severos, mesmo possuindo uma via extrínseca normal. De forma similar, pacientes deficientes no fator VII também possuem sangramentos severos apresentando uma via intrínseca normal. Portanto, a via intrínseca e a via extrínseca não operam de forma independente. In vivo estas vias são interligadas e complementares (HOFFMAN, 2003). Em 2001, Hoffman e Monroe propuseram que o processo de coagulação ocorreria em uma série de 3 fases que se sobreporiam e ocorreriam em diferentes superfícies celulares. Os dois tipos celulares principais são Células que expressam TF e plaquetas. Estes dois tipos celulares são mantidos afastados, prevenindo a coagulação, até que haja uma injúria que torne favorável a ativação do sistema de coagulação. Nesse momento e na região limitada da injúria, haveria a possibilidade destas células intra e extra-vasculares entrarem em contato e promoverem as reações que irão levar à coagulação (Figura 3). A primeira fase da coagulação, aqui denominada fase de iniciação, ocorreria em células que expressam TF. Nesta fase, concentrações picomolares de trombina (10-12 M) são produzidas. Na fase de amplificação, plaquetas e cofatores seriam ativados a fim de se preparem para a geração em larga escala de trombina. Finalmente, a propagação ocorreria na superfície das plaquetas, e resultaria em uma produção de trombina que seria produzida em concentrações micromolares (10-6 M), um milhão de vezes mais concentrada que a sua produção durante a fase de iniciação (Figura 3) (BUTENAS e MANN, 2001; MONROE e col., 2002; HOFFMAN, 2003).
26 8 Figura 3 Modelo celular da coagulação sanguínea. Neste esquema mostramos que a coagulação ocorre em diferentes células (células que expressam TF e plaquetas). O processo é dividido em 3 fases: iniciação, amplificação e propagação. Figura adaptada de Monroe e col, As diversas fases da coagulação são reguladas diferentemente por sistemas inibitórios presentes no plasma, nas células sangüíneas e no tecido vascular. Inibidores de alta afinidade, que estão em pequena quantidade, são os mais importantes para bloquear a iniciação, enquanto que, os inibidores que possuem baixa afinidade, mas estão em abundância, são os mais importantes para regular negativamente a fase de propagação. Os sistemas inibidores da coagulação consistem em componentes com um potencial anticoagulante mais alto que aqueles expressos pelos pró-coagulantes normalmente presentes no sangue. Portanto, um estímulo deve chegar a um certo nível, suficiente para disparar a cascata de coagulação. O balanço entre os sistemas pró e anti-coagulante é que irá determinar os limiares da resposta do sistema de coagulação que vai ser iniciada. Esta interação é vital para a manutenção do balanço entre a fluidez do sangue e a proteção de um sangramento (MANN, 2003). Os elementos inibidores que atenuam a Fase de Propagação da coagulação contribuem para as atividades das proteínas plasmáticas responsáveis pela geração de trombina. Isto ocorre durante a Fase de Atenuação, que bloqueia a progressão do processo de coagulação sangüínea, com respeito à geração de trombina e formação do coágulo.
27 9 A barreira do fluxo sangüíneo, o coágulo, é uma complexa rede na qual os principais componentes são as plaquetas ativadas agregadas e um polímero de fibrina, sendo o último o produto de clivagem do fibrinogênio pela trombina. Estes produtos reativos, que promovem a barreira física temporária à perda sangüínea em caso de hemorragia ou bloqueio do fluxo sangüíneo na trombose, são removidos pela ação da via fibrinolítica durante a fase de eliminação da coagulação na qual a enzima plasmina dissolve o coágulo. Os elementos vasculares danificados são substituídos por novos que são sintetizados por tecido conectivo e componentes celulares durante a Fase de Reparo. Apesar da coagulação sangüínea e os reparos vasculares ocorrerem sequencialmente, esses processos estão integrados e se sobrepõem Fase de Iniciação e o Fator Tecidual A fase de iniciação começa com a exposição do fator tecidual no sangue, que levará à geração de trombina. O termo Fator Tecidual (TF) e o seu conceito foram introduzidos pela primeira vez em A noção de que uma única proteína seria responsável pela promoção da coagulação nos tecidos levou a tentativas de purificação do TF. Finalmente, em 1981, o TF foi purificado pela primeira vez e com isso o seu significado biológico como iniciador da coagulação ganhou espaço (SPEK, 2004). Hoje, sabe-se que o fator tecidual é um receptor transmembrana do Fator VIIa, de 47-kDa, com 219 aminoácidos no domínio extracelular, 21 aminoácidos no domínio transmembrana hidrofóbico e 21 aminoácidos no domínio da cauda intracelular, que contém 3 sítios possíveis de fosforilação de serina (FERNANDEZ e col, 2004). Também chamado de CD142, a seqüência do TF tem um grau de similaridade com os receptores classe II das citocinas como o Interferon (MORRISSEY, 2001; RAK e col., 2006).
28 10 O TF não é normalmente expresso em células em contato direto com o sangue (tais como células endoteliais e leucócitos), mas apresenta expressão constitutiva em fibroblastos subjacentes ao endotélio vascular. O TF é também encontrado em queratinócitos, células epiteliais do trato respiratório e trato gastrointestinal, cérebro, células musculares cardíacas e glomérulos renais. Células endoteliais e monócitos, que, normalmente, não expressam o TF podem expressá-lo na vigência de lesão endotelial e na presença de estímulos específicos, tais como endotoxinas e citocinas (TNF-α e interleucina-1) (FRANCO, 2001, FERNANDEZ e col, 2004). Recentemente, controvérsias emergiram com relação à presença e funcionalidade de espécies de TF circulantes no sangue (ORFEO e col., 2005; MACKMAN, 2006). Os artigos se dividem naqueles que mostram TF localizado na superfície de células do sangue e micropartículas e aqueles que descrevem espécies de TF que circulam como proteína solúvel. Os autores destes trabalhos acreditam que estas espécies de TF circulante geram uma nova hipótese onde a geração de trombina dependente de TF necessitaria de infusões constantes desse cofator. O grupo do Bogdanov em 2003 lançou a hipótese de que uma forma solúvel de TF circulante, contendo uma grande parte do domínio extracelular poderia se ligar à borda do trombo, criando uma superfície capaz de iniciar e propagar a coagulação e com isso contribuindo para o crescimento do trombo. No entanto, Orfeo e colaboradores em 2005 demonstraram que em indivíduos sadios, essa reserva de TF circulante não era necessária para a geração de trombina e portanto para a manutenção da coagulação, visto que, no sangue de indivíduos sadios ou de camundongos há pouca ou nenhuma atividade relacionada à TF. A exposição do TF ao plasma, na luz do vaso, induz a uma cadeia de reações onde os processos chave são a ativação de proenzimas e procofatores derivados do plasma, que dão
29 origem à enzimas e cofatores capazes de interagir com membranas carregadas negativamente. 11 As proenzimas são proteínas sintetizadas no fígado e são dependentes de vitamina K. A vitamina K media a adição pós-translacional de grupos carboxil à resíduos de ácido glutâmico específicos, localizados na região amino-terminal dessas proenzimas, formando os domínios Gla, compostos de ácido γ-carboxi-glutâmico (Gla) (MARTINEZ e BARSIGIAN, 2003). Após a ativação proteolítica, as enzimas possuem vida curta na circulação; a exceção a regra é o fator VIIa. A forma clivada do fator VII (fator VIIa) é uma protease inativa que requer a ligação ao TF para revelar seu sítio ativo. Como conseqüência, o fator VIIa escapa dos inibidores plasmáticos que reconhecem a função do sítio ativo, e uma pequena fração (1-2%) do total de fator VII circula no sangue como fator VIIa. Após uma injúria vascular, o TF, agora exposto, se liga ao fator VIIa presente no plasma formando a reação catalítica inicial que irá disparar a cascata de coagulação. O resultante sistema pró-coagulante pode ser representado por uma série de 3 complexos enzimáticos similares, cada um composto por uma serino-protease e um cofator montados como um complexo na superfície da membrana. Cada complexo atua em um substrato também ligado à membrana (Figura 4) (MANN, 2003; MANN e col., 2003).
30 12 Figura 4 Complexos da coagulação sanguínea. Cada complexo é composto por uma serino-protease (fator VIIa, fator IXa ou fator Xa) ligado a um cofator (fator tecidual, fator VIIIa ou fator Va, respectivamente) ligados a superfície da membrana. Cada complexo catalisa a ativação de um zimogênio dependente de vitamina K (fator IX, fator X ou protrombina (II), respectivamente) ( Coagulation Explosion, Vermont Business Graphics, Kenneth G Mann, 1997). Durante a Fase de Iniciação, o participante principal é o complexo Tenase Extrínseco, um complexo composto por membrana celular, TF exposto devido a uma injúria vascular ou estimulação de citocinas, e o fator VIIa presente no plasma. O complexo é formado pelo fator VIIa e o TF na superfície de Células que expressam TF e ativa as proenzimas fator X e fator IX em seus respectivos produtos, fator Xa e fator IXa. Inicialmente, a ativação do fator X é maior que a ativação do fator IX; então o produto inicial predominante é o fator Xa. No entanto, uma vez gerado o fator Xa, há uma retro-alimentação para aumentar a formação de fator IXa. O Fator Xa ligado à membrana irá converter o fator IX em uma forma capaz de se ligar ao complexo TF-fator VIIa atuando como substrato e sendo convertido em fator IXa. O fator Xa ligado à membrana também é capaz de ativar mais fator VII. Qualquer fator Xa que se dissocia da célula que expressa TF é logo inibido por Antitrombina (AT) e pelo inibidor da via do fator tecidual (tissue factor pathway inhibitor TFPI) (MONROE e HOFFMAN, 2006).
31 13 O TFPI está presente em pequenas quantidades no sangue, mas possui uma alta afinidade pelo complexo TF-fator VIIa-fator Xa. Assim, enquanto a coagulação procede com o complexo TF-fator VIIa formando fator Xa e fator IXa, esta reação é terminada pela formação do complexo fator Xa-fator VIIa-TF-TFPI (Figura 5) (MANN, 1999). Figura 5 Inativação dos complexos da coagulação pelo TFPI. O complexo fator tecidual-fator VIIa é inativado pela ligação do TFPI ao complexo fator tecidual-fator VIIa-fator Xa, eliminando a geração de fator IXa e fator Xa por essa reação catalítica. O efeito resultante é que a geração de fator Xa passa a ser catalisada pelo complexo fator VIIIa-fator IXa. Adaptado de Coagulation Explosion, Vermont Business Graphics, Mann KG, A reação inicial leva à geração de pequenas quantidades de fator Xa, fator IXa e Trombina. O fator Xa se dissocia do complexo tenase extrínseco e se associa ao cofator proteico fator Va, íons cálcio e membranas carregadas negativamente para formar o complexo protrombinase, que ativa o zimogênio protrombina na serino-protease trombina com eficiência catalítica cerca de 10 5 vezes superior ao fator Xa isolado (Figura 3 e Figura 4) (KALAFATIS e col., 1994). O fator V plasmático se liga, reversivelmente, a sítios na membrana e pode ser ativado diretamente por FXa nas plaquetas mas a maior parte do FV é ativado pelas primeiras moléculas de trombina geradas durante o processo de coagulação (DAHLBÄCK, 2005). De
32 14 fato, a pequena quantidade de trombina formada também tem um papel importante na subseqüente ativação de plaquetas e FVIII na fase de Amplificação (HOFFMAN e MONROE, 2001) Fase de Amplificação A fase de amplificação prepara a cena para a subseqüente geração em larga escala de trombina durante a fase de propagação (Figura 3). O dano na vasculatura permite às plaquetas, aderir a matriz extravascular, localizandoas perto do sítio de exposição de TF. A pequena quantidade de trombina gerada pelas células que expressam TF amplifica o sinal inicial de pró-coagulação aumentando a adesão e ativando completamente as plaquetas e ativando os fatores V, VIII e XI. A ativação das plaquetas pela trombina expõe receptores e sítios de ligação para os fatores ativados da coagulação (HOFFMAN e MONROE, 2001; HOFFMAN, 2003). Durante o processo de ativação do FVIII pela trombina, o complexo FVIII/vWF (fator von Willebrand) é dissociado permitindo que o vwf medie a adesão e agregação adicional de plaquetas no sítio da injúria, enquanto que o FVIII é mantido ligado à superfície das plaquetas podendo fazer parte da montagem do complexo tenase intrínseco durante a fase de propagação (HOFFMAN e MONROE, 2001; HOFFMAN, 2003) Fase de Propagação e a Trombina Durante a fase de propagação da coagulação, o complexo tenase extrínseco é neutralizado pelo TFPI (Figura 5) e a reação de geração de trombina é continuada pelos
33 15 complexos tenase intrínseco e protrombinase. A trombina controla a fase de propagação da coagulação, e amplifica sua própria produção ao ativar os fatores XI, V e VIII. Além disso, a trombina promove a coagulação do fibrinogênio, a ativação do fator XIII e a ativação plaquetária (KALAFATIS e col., 1994; ESMON, 2000). A trombina é a protease central da cascata de coagulação dos vertebrados. Ela foi identificada como a substância capaz de promover a formação de um coágulo fibroso (fibrina), e seu nome deriva de thrombos, que em grego significa coágulo. Ela atua em uma variedade de substratos para promover a hemostase, na qual o mais bem estudado é o fibrinogênio (DAVIE e KULMAN, 2006). O precursor da α-trombina humana, que circula no sangue é a protrombina humana. Esta é uma glicoproteína com 579 resíduos de aminoácidos, um domínio N-terminal rico em ácido γ-carboxiglutâmico (Gla), dois domínios kringle, um pequeno peptídeo de ativação (short activation peptide), e o domínio trombina/catalítico/serina proteinase (BODE, 2006). A fase de propagação ocorre na superfície das plaquetas ativadas. O complexo composto por fator IXa-fator VIIIa ativa o fator X a fator Xa muito mais eficientemente que o complexo TF-fator VIIa; portanto, a maior quantidade de fator Xa gerada é provida pelo complexo tenase intrínseco. Este complexo gera uma produção explosiva de fator Xa. O fator Xa formado rapidamente se associa ao fator Va ligado às plaquetas em condições fisiológicas, a superfície de plaquetas ativadas na área de lesão vascular constitui o principal componente lipídico do complexo protrombinase e a montagem do complexo protrombinase nas plaquetas gera uma massiva produção de trombina, gerando um efeito crescente na coagulação, onde complexos adicionais são montados e geram trombina (SOLUM, 1999; HOFFMAN e MONROE, 2001; HOFFMAN, 2003).
34 16 A carga negativa do fosfolipídio de membrana das plaquetas ativadas na qual os complexos protrombinase e tenase intrínseco são montados é conferida pela fosfatidilserina (PS). Sob condições normais a PS se localiza na camada interna da membrana das plaquetas, mas é translocada para fora durante a ativação das mesmas (ZWAAL e col., 1998). Todas as proteínas que participam dos complexos protrombinase e tenase possuem afinidade por fosfolipídio carregados negativamente e tanto as enzimas como os substratos se ligam na membrana através do seu domínio amino-terminal que contém resíduos Gla. Os domínios Gla estão unicamente presentes nas proteínas dependentes de vitamina K e se ligam à cálcio, que é importante para o enovelamento correto deste domínio (DAHLBÄCK, 2005). A trombina, uma vez gerada, ativa plaquetas adicionais e cliva os fibrinopeptídeos transformando fibrinogênio em fibrina que formará com as plaquetas já ativadas no sítio da injúria, um coágulo insolúvel para selar o sítio da injúria (RAK e col., 2006). O fibrinogênio é o precursor plasmático da fibrina, o principal constituinte do coágulo no plasma. Entretanto, o fibrinogênio atua em mais de um ponto do sistema hemostático, incluindo a coagulação, o processo fibrinolítico e o reparo. Ele é um componente importante do processo de agregação plaquetária e o principal contribuidor para a ativação do sistema fibrinolítico. A sua molécula é composta por seis cadeias arranjadas como três pares simétricos de cadeias (Figura 6a e 6b). Figura 6 Estrutura do fibrinogênio. (A) Diagrama da estrutura do fibrinogênio. (B) Estrutura proposta do fibrinogênio (VOET e VOET, 2004).
35 17 A clivagem do fibrinogênio pela trombina libera pequenos peptídeos das cadeias Aα e Ββ (os fibrinopeptídeos), expondo regiões de cargas opostas que tendem a se polimerizar e formar um gel insolúvel. Este gel de fibrina, inicialmente gerado por interações nãocovalentes, é posteriormente estabilizado pela introdução de ligações covalentes entre resíduos específicos de glutamina e lisina, presentes na molécula de fibrina. Esta reação é catalisada pelo Fator XIIIa, uma transglutaminase que circula no plasma em uma forma
36 18 nela, ele irá converter FX em FXa na superfície das plaquetas. O FXIa serve para impulsionar a geração de FIXa na plaqueta ativada, aumentando a geração de FXa e a subseqüente geração de trombina. Obviamente que na ausência de FXI, os complexos tenase intrínseco e protrombinase irão se formar na superfície das plaquetas, portanto a geração de trombina sempre é possível. Isto explica o porquê de humanos com deficiência no FXI tem uma tendência suave de sangramento quando comparados a pacientes com deficiência no FVIII e FIX Terminação O término da coagulação é atingido por um conjunto de processos estequiométricos e enzimáticos que inativam as proteínas dos complexos pró-coagulantes e inibem as enzimas residuais. Isto ocorre através de inibidores específicos, como a antitrombina e o TFPI e através do sistema da proteína C. A trombina liberada do complexo protrombinase se liga à trombomodulina (TM), uma proteína constitutiva da membrana de células endoteliais, e converte a proenzima dependente de vitamina K, proteína C, em proteína C ativada (activated protein C APC) (Figura 8) (ESMON, 2000). Uma vez que a trombina é ligada à TM, sua especificidade proteolítica se altera para reconhecer o zimogênio da proteína C, além de reduzir o reconhecimento de fibrinogênio, plaquetas e fator V. Os alvos da proteína C ativada são as moléculas de fator VIIIa e fator Va ligados à membrana. A concentração dessa enzima anticoagulante natural determina o tempo de vida desses elementos essenciais dos complexos pró-coagulantes. Como os complexos pró-coagulantes (Figura 4) que convertem o fator X e a protrombina nos seus respectivos produtos são ligados reversivelmente, a proteína C ativada pode intercambiar com o fator Xa e fator IXa nos seus respectivos sítios de ligação com o fator Va e fator VIIIa. Clivagens
37 19 subseqüentes nas regiões de cadeia pesada de ambas as moléculas levam a sua inativação para que estas não possam mais se ligar nas suas respectivas enzimas ou substratos. A AT forma complexos com o fator IXa, trombina e fator Xa remanescentes, neutralizando todas as enzimas pró-coagulantes do sistema (Figura 8) (MANN e col., 2003). Figura 8 Inibição dos complexos da coagulação. A trombina se liga a trombomodulina (TM) e ativa o zimogênio da proteína C em proteína C ativada (APC) que regula negativamente a coagulação por se ligar competitivamente com o fator Xa e IXa e clivar os fatores Va e VIIIa, inativando-os. A antitrombina (AT) inibe a trombina e os fatores Xa e IXa. Adaptado de Coagulation Explosion, Vermont Business Graphics, Mann KG, Eliminação O coágulo sanguíneo é um material complexo no qual os principais componentes estruturais são as plaquetas agregadas e a fibrina. Os outros constituintes estão emaranhados dentro da matriz, incluindo outras proteínas plasmáticas e células do sangue. Este selo temporário é eliminado enquanto a reconstrução de uma estrutura vascular estável está ocorrendo. A principal enzima que atua para destruir o coágulo é a plasmina, que é gerada a partir de seu precursor plasmático, o plasminogênio, pela ação de duas enzimas, a uroquinase e o ativador de plasminogênio tecidual (tissue plasminogen activator t-pa), ambos secretados pelas células endoteliais vasculares. A secreção dessas duas enzimas é regulada
38 20 por citocinas e produtos produzidos durante a coagulação, incluindo a trombina. O inibidor das enzimas fibrinolíticas, o inibidor do ativador de plasminogênio I (plasminogen activator inhibitor I PAI-1), também é secretado pelas células endoteliais vasculares. O antagonismo entre o PAI-1 e o t-pa determina o limiar da resposta para seguir com a fibrinólise da mesma forma que os pró- e anti-coagulantes determinam o limiar do processo de coagulação. Com estímulo suficiente os ativadores de plasminogênio tecidual convertem o plasminogênio plasmático solúvel na enzima plasmina, que se liga ao coágulo de fibrina e cliva ligações específicas desta molécula, levando à dissolução do coágulo ou "fibrinólise. O processo de digestão do coágulo de fibrina pela plasmina é regulado por seu inibidor plasmático α2-antiplasmina, um processo também catalisado pela fibrina. Os produtos finais da digestão do coágulo de fibrina são os fibrinopeptídios, entre os quais, os chamados D-dímeros, que são produzidos através da digestão dos domínios D terminais pela plasmina, de moléculas de fibrina adjacentes (figura 9). Estes marcadores são úteis clinicamente para descobrir a extensão da fibrinólise que está ocorrendo em um evento trombótico e durante a terapia com infusão de agentes trombolíticos. Figura 9 Formação dos D-dímeros pela plasmina. A plasmina, gerada pela clivagem do palsminogênio plasmático pelos ativadores de plasminogênio dos tipos tecidual ou uroquinase, cliva o polímero de fibrina entre os domínios D e E, gerando os produtos de degradação de fibrina. Adaptado de Coagulation Explosion, Vermont Business Graphics, Mann KG, 1997.
39 Patologia da Coagulação no Câncer Em pacientes humanos, desordens tromboembólicas envolvendo hiperativação do sistema de coagulação e formação intravascular de coágulos de fibrina (trombose) podem ser os primeiros sinais da manifestação de um tumor (RICKLES e EDWARDS, 1983; MAIOLO e col, 2002; BOCCACCIO e MEDICO, 2006). A associação entre tromboembolismo venoso (venous thromboembolism VTE) e câncer é conhecida desde os tempos do Professor Armand Trousseau, o clínico Francês que é considerado o primeiro cientista a descrevê-la em Desta forma esta associação recebeu seu nome, síndrome de Trousseau. (RICKLES e FALANGA, 2001; PRINS e OTTEN, 2004; BOCCACCIO e MEDICO, 2006). No entanto, até 1951, a associação entre um câncer oculto e o tromboembolismo venoso primário ou idiopático era baseada apenas em descrições de casos e necropsias, não sendo esta evidência suficientemente forte quanto os médicos normalmente requereriam para guiar sua prática clínica. Em 1951, o primeiro estudo em larga escala foi publicado, mas os autores não possuíam testes objetivos a sua disposição para confirmar o diagnóstico de VTE. Outros estudos se seguiram, mas foram necessários cerca de 30 anos para que o primeiro estudo em larga escala, reconhecidamente apropriado, fosse publicado (revisado por PRINS e OTTEN, 2004; FALANGA, 2005). É quase intuitivo e óbvio que o equilíbrio cuidadoso do sistema hemostático possa colapsar em um estado avançado de câncer como resposta a um espalhamento sistêmico de células neoplásicas, um extenso dano tecidual e uma severa decadência geral do organismo. Em contraste, é mais difícil conectar a trombose sem causa definida com o início do câncer. Os clínicos podem perder esta conexão, já que os estágios iniciais do câncer podem escapar à sensibilidade das ferramentas sofisticadas de diagnóstico. Os biólogos também podem perder esta conexão visto que, é difícil visualizar uma célula transformada afetando o sistema
40 22 hemostático enquanto permanece confinada dentro do tecido de origem. No entanto, estudos clínicos confiáveis de pacientes com síndrome de Trousseau conduziram a uma conclusão impressionante de que ou mudanças pré-malignas promovem a trombose, ou o câncer e a trombose compartilham os mesmos fatores de risco (BOCCACCIO e MEDICO, 2006). No final do século XIX, o patologista Theodor Billroth, encontrou células tumorais envolvidas em microtrombos circulantes, e sugeriu que esses coágulos poderiam esconder seguramente células tumorais enquanto estas navegariam através da corrente sanguínea, favorecendo a metástase. Se o tumor tira vantagens da coagulação sanguínea, a procura por moléculas associadas ao câncer, responsáveis pela trombose, poderia revelar alvos para se lutar tanto contra o efeito colateral (trombose, que também pode ser letal) quanto contra a doença primária (câncer) (BOCCACCIO e MEDICO, 2006). Embora as células tumorais sejam frequentemente descritas como atuando autonomamente, na verdade elas se encontram em uma complexa, recíproca e indispensável relação com os seus arredores (RAK e col., 2006). Os eventos que ocorrem nas fronteiras entre os nichos de células tumorais e o sistema vascular (isto é, a interface tumor-vasculatura) têm um importante papel na progressão do câncer, morbidade e mortalidade. Esta interface se desenvolve e muda através dos estágios seqüenciais da progressão da doença e envolve vários processos como: (1) recrutamento ativo e remodelamento dos vasos sanguíneos para o redor e dentro das massas tumorais crescentes, para formar o que efetivamente será a rede microvascular privada do tumor, um processo referido como angiogênese tumoral; (2) a resultante proximidade e o contato direto entre as células tumorais, adjacentes aos vasos sanguíneos, e a circulação sanguínea leva a uma situação onde a ativação local e sistêmica da coagulação e fibrinólise podem ocorrer de maneira crônica; (3) a entrada de células cancerosas no espaço vascular e linfático durante o processo de metástase, um processo que
41 23 também dispara a segunda onda de angiogênese em sítios distantes do crescimento tumoral, exacerbando as anormalidades hemostáticas observadas na síndrome de Trousseau (RAK e col, 2006) Manifestações da coagulopatia no câncer No câncer, eventos hemostáticos são disparados de maneira aberrante, crônica e contínua, gerando sinais de coagulopatia, que são consequentemente considerados como um marcador para casos de malignidade avançada (RAK e col, 2006). Assim, anormalidades ocultas ou não, nos parâmetros da coagulação foram descritas em aproximadamente 50% de todos os pacientes com câncer e em 90% dos pacientes com metástase (LORETO e col, 2000; MAIOLO e col, 2002; DE CICCO, 2004). O tromboembolismo, sendo reconhecido como a principal complicação no câncer, é a segunda causa mais comum de morte em pacientes com câncer (HOFFMAN e col, 2001; FURIE e FURIE, 2006). As formas mais comuns de complicações tromboembólicas nesses pacientes são trombose venosa profunda (TVP) das extremidades inferiores e embolismo pulmonar. Estas condições requerem a mesma abordagem de diagnóstico como realizado em pacientes sem câncer. Entretanto, outras complicações mais raras também foram observadas em certos tipos de neoplasias, incluindo a tromboflebite superficial migratória, conhecida como síndrome de Trousseau (LORETO e col, 2000). Embora nem todos os pacientes sejam sintomáticos, severidades variadas de coagulação intravascular disseminada (CID) podem acompanhar leucemias agudas, como as leucemias promielocíticas agudas, onde o consumo de plaquetas e fatores de coagulação pode levar a um sangramento (FALANGA, 2005). Da mesma forma, certos tipos de tumores
42 24 sólidos, como câncer de pâncreas, cérebro e ovário, podem estar associados a um aumento de 10 vezes na incidência de tromboembolismo venoso. Este estado hipercoagulante é normalmente exacerbado pela progressão do tumor, e por terapias anti-tumorais como terapias hormonais, quimioterapia e cirurgia, onde o impacto combinado de cada terapia, como por exemplo, em câncer de mama, pode levar a um aumento estimado de VTE de 0.1% para 18% (RICKLES e col, 2003). Efeitos colaterais associados à coagulação também foram observados em pacientes tratados com certos tipos de agentes anti-angiogênicos (SU5416, talidomida, bevacizumab), especialmente se em combinação com quimioterapia padrão (cisplatina e gemcitabine), provavelmente devido a efeitos pró-coagulantes em células vasculares lesadas, efeitos em plaquetas, ou desregulação das vias dependentes ou independentes do fator de crescimento do endotélio vascular VEGF (vascular endothelial growth factor), que controlam a expressão de TF, TFPI e t-pa por células endoteliais (RAK e col., 2006) Por outro lado, a trombose pode representar uma das primeiras manifestações clínicas de um câncer oculto. Prandoni e colaboradores, em 1992, demonstraram que pacientes com VTE idiopático tiveram de 4 a 7 vezes mais risco de serem diagnosticados com câncer no primeiro ano após a trombose, quando comparados com pacientes com VTE secundário a causas conhecidas (cirurgia, trombofilia congênita, gravidez e etc.). Este risco aumentou 10 vezes em pacientes com VTE idiopático recorrente. Mesmo em casos assintomáticos, a coagulopatia pode interferir em testes de laboratório (Figura 10) que incluem um aumento nos níveis plasmáticos de produtos de degradação do fibrinogênio e/ou fibrina solúvel e D-dímeros de fibrina e também pode ser acompanhados de aspectos de ativação crônica da coagulação como: um aumento nos níveis circulantes de FVIIa, TAT, fragmentos 1+2 da protrombina, e fibrinopeptídeos A e B, assim
43 25 como alterações (aumento ou diminuição) na contagem das plaquetas. A fibrinólise em curso também pode ser deduzida por uma redução no t-pa, PAI-1, plasmina e complexos plasmina α2-antiplasmina (LORETO e col, 2000; DE CICCO, 2004; FALANGA, 2005). Figura 10 Anormalidades da coagulação de pacientes com câncer verificados em testes de laboratório. PT=tempo de protrombina; aptt = tempo de tromboplastina parcial ativada; PF4 = fator plaquetário 4; t- PA=ativador de plasminogênio tecidual; u-pa = ativador de plasminogênio do tipo uroquinase; PAI-1 = inibidor do ativador de plasminogênio 1, FPA = fibrinopeptídeo A, F 1+2 = fragmento 1+2 da protrombina, TAT = complexo trombina-antitrombina; FDP = produtos de degradação do fibrinogênio; DD=fragmentos D-dímeros. Adaptado de De Cicco, As manifestações da coagulação sistêmica ligada ao câncer geralmente são relacionadas a evidências de coagulação dentro das próprias massas tumorais. Isto é compreensível em vista das características da relação vascular-tumoral, incluindo vasos tortuosos, estase, descontinuidades da parede do vaso, invasão vascular por células tumorais, micro-hemorragias, hipermeabilidade vascular e, extravasamento esparso de células e proteínas plasmáticas. Estes eventos levam à ativação da coagulação extravascular, evidenciado por estudos que verificam deposição de fibrina no parênquima de câncer de mama, pulmão, cérebro e próstata. A geração de trombina nos tumores também é evidenciada pela marcação positiva de fragmentos de protrombina ou quando hirudina é utilizada como sonda específica para trombina em secções de tecido tumoral (RAK e col, 2006). Várias outras proteínas hemostáticas também já foram localizadas no espaço extravascular dos tumores como os fatores as FVII, FVIIIc, FIX, FX, FXII, FXIII, fibrina, PAI-1, - 2, e -3 (WOJTUKIEWICZ e col, 2001).
44 Atividades pró-coagulantes associadas ao câncer A patogênese do VTE no câncer é complexa, mas se relaciona principalmente às propriedades pró-coagulantes das próprias células tumorais, das células endoteliais associadas às células tumorais e das células inflamatórias do hospedeiro. Em adição, uma concatenação infeliz de anormalidades dos mecanismos normais de defesa como: estase, defeitos vasculares, redução dos inibidores da coagulação e, ativadores fibrinolíticos e anticoagulantes associados à célula, predispõem pacientes com câncer à hipercoagulabilidade (RICKLES e col, 2003). Esse estado de hipercoagulabilidade perturba o balanço hemostático entre as forças pró-coagulantes e anticoagulantes e envolve uma série de complexos mecanismos tumor-específicos, capazes de promover a coagulação (PICCIOLI e PRANDONI, 2004). Os fatores que levam a um potencial pró-trombótico no câncer são complexos e refletem a interação de diferentes mecanismos baseados na tríade de Virchow: hipercoagulabilidade, injúria na parede do vaso e estase venosa. As células malignas podem perturbar o sistema de coagulação, tanto diretamente, sintetizando e liberando moléculas promotoras da coagulação como indiretamente, por interações celulares. As interações entre as células tumorais e do hospedeiro envolvem interações diretas célula-célula ou mecanismos indiretos de liberação de citocinas (PICCIOLI e PRANDONI, 2004). O papel central da célula tumoral na patogênese do estado prótrombótico em pacientes com câncer esta resumido na Figura 11, mostrando que a expressão aberrante de TF, adicionada a desregulação dos mecanismos que controlam a atividade prócoagulante de TF, contribui para a hipercoagulabilidade do sistema, que é finalmente mediado pela geração de trombina (RICKLES e col., 2003; DE CICCO, 2004).
45 27
46 O papel do Fator Tecidual no Câncer Uma das causas do estado de hipercoagulabilidade em pacientes com câncer é a expressão aumentada (up-regulation) do TF, tanto na célula tumoral quanto em células normais, onde a indução da expressão desta proteína pode ser devido à liberação de citocinas e fatores de crescimento das células tumorais assim como de uma ativação do sistema imune do hospedeiro (TILLEY e MACKMAN, 2006). Esta indução se deve ao fato do TF possuir homologia com membros da superfamília dos receptores de citocinas (RICKLES e col., 2003). O papel chave do TF no sistema de coagulação é refletido nas provas crescentes do papel central deste receptor na coagulopatia do câncer. Assim, diversos artigos apontam para as profundas mudanças na expressão de TF nos pacientes com câncer. A expressão aumentada de TF foi identificada por imuno-histoquímica e/ou técnicas de binding por ligação do FVIIa em vários tipos de tumores como glioma, câncer de mama, câncer de pulmão, câncer de cólon, câncer de próstata, câncer pancreático, carcinoma ovariano, carcinoma hepatocelular e leucemias, tanto em células tumorais e/ou células estromais do tumor (RICKLES e col, 2003; FÖRSTER e col, 2006; RAK e col, 2006). Essa expressão elevada de TF foi relacionada a indicadores de prognósticos desfavoráveis como aumento da angiogênese, estágios avançados da doença e fenótipo de resistência a múltiplas drogas que, em conjunto, contribuiriam para uma diminuição da sobrevida dos pacientes com câncer (LWALEED e COOPER, 2000; RICKLES e col., 2003). Em geral, a transformação em células malignas resulta em uma alteração na expressão de TF, isto é, células normais que normalmente não expressariam esta proteína passam a fazê-lo quando se tornam malignas. Essa expressão varia de acordo com a espécie e, às vezes, há diferenças dentro do próprio espécime de tumor (FÖRSTER e col, 2006).
47 29 A progressão do câncer eventualmente culmina na sua disseminação metastática a principal causa de mortalidade relacionada ao câncer (RAK e col, 2006). Em células metastáticas, os níveis de expressão de TF podem ser até mil vezes maior do que em células não-metastáticas, sugerindo um papel direto do TF na metástase tumoral, visto que esse potencial metastático poderia ser diminuído utilizando-se um anticorpo monoclonal inibitório anti-tf (MUELLER e col, 1992). A metástase é um processo multifatorial no qual as células tumorais adquirem a capacidade de migrar, ganhando acesso à corrente sanguínea ou vasos linfáticos e, finalmente, se fixar a sítios distantes. Ela é criticamente dependente da formação de novos vasos, já que sem o desenvolvimento de uma vasculatura local capaz de suportar o tumor, o tumor secundário iria parar de crescer (DONATI e LORENZET, 2004; VERSTEEG e col., 2004; BELTING e col, 2005). Devido ao fato de células metastáticas entrarem na circulação sanguínea e linfática diretamente e entrar em contato com as proteases plasmáticas, incluindo o FVIIa, é razoável se perguntar qual seria o processo relacionado ao TF que levaria a disseminação do tumor e como isto ocorreria. Controvérsias ainda existem sobre a contribuição do domínio citoplasmático e extracelular do TF e o seu papel na ativação de FVIIa, FXa, trombina ou na própria coagulação (RAK e col., 2006). Evidências para o papel de TF no processo metastático têm sido demonstradas em diversos estudos. Em gliomas humanos a expressão de TF está correlacionada com o grau de malignidade, células de carcinoma de mama metastático possuem maior nível de expressão de TF que os não metastáticos. Em pacientes com câncer coloretal, a expressão de TF foi demonstrada ser um fator de risco para a metástase hepática. O TF foi detectado em 57% dos
48 pacientes de câncer coloretal não metastáticos. Esta expressão aumenta para 88% em pacientes metastáticos (revisado por VERSTEEG e col, 2004). 30 Bromberg e colaboradores em 1999 descreveram que em células de melanoma é necessária a fosforilação do domínio citoplasmático do TF e a formação do complexo TF- FVIIa na parte extracelular da proteína para se obter um completo efeito metastático. Em um experimento similar, mas em células de ovário de hamster chinês, Mueller e Ruf em 1998 também verificaram que o domínio citoplasmático de TF era importante para o processo metastático, mas que um complexo TF-FVIIa proteoliticamente ativo era necessário para obtenção do alto índice de metástases. Esses experimentos demonstram a importância do TF para a metástase das células tumorais de uma forma independente da coagulação. Outros pesquisadores, utilizando-se de antagonistas da via do TF como TFPI ou neutralizando TF com anticorpos em camundongos injetados com células tumorais também encontraram uma redução do número de metástases nesses camundongos. Estes efeitos também tinham um impacto direto na sinalização dependente de TF e com isso, na expressão de genes envolvidos na migração celular, invasão e sobrevida (MUELLER e col., 1992; AMIRKHOSRAVI e col, 2002). Em 2004, Wang e colaboradores, utilizando-se da técnica de RNA interferencial (short hairpin RNA (shrna)-mediated RNA interference) para abolir (knock down) a expressão de TF em células de melanoma humano LOX-L, demonstraram que a redução na expressão de TF diminuía a proliferação destas células in vitro e diminuía a incidência de metástase pulmonar quando comparado com o controle. Além disso, o animal injetado com as células sem TF vivia mais. Utilizando-se de análise de cdna microarray, as células sem TF tinham uma alteração no padrão genético comparado ao controle. As diferenças incluíam a expressão
49 de genes que codificavam proteínas necessárias na transcrição, tradução, comunicação da célula e crescimento e morte da célula. 31 A metástase é criticamente dependente da formação de novos vasos a angiogênese. Sem o desenvolvimento de uma vasculatura local que daria suporte ao tumor, os tumores secundários iriam parar de crescer (VERSTEEG e col, 2004). A angiogênese também é um processo multifatorial requerido para o crescimento tumoral invasivo e a metástase (DONATI e LORENZET, 2004). O TF parece ter um papel fundamental no processo fisiológico e patológico da angiogênese. No câncer, a expressão aberrante de TF contribui para o fenótipo angiogênico em parte por uma regulação positiva da expressão da proteína pró-angiogênica, VEGF e por regular negativamente a expressão da proteína anti-angiogênica, trombospondina (RICKLES e col., 2003). O papel de TF na formação e remodelamento da microcirculação do tumor pode ser vista por pelo menos duas perspectivas. A primeira, originalmente proposta por Dvorak e colaboradores em 1979, propõe que perturbações na interface tumoral-vascular e a coagulação extravascular associada, poderiam exercer uma influência ampla e indireta na angiogênese, que poderia ser vista como dependente de TF, mas não necessariamente TF específica. A segunda, por outro lado, propõe que a expressão de TF esteja fortemente associada à progressão do tumor, e este seria normalmente localizado tanto nas células tumorais quanto no endotélio associado a essas células, que seriam o disparador e o efetor do processo angiogênico, respectivamente. Essas duas fontes principais de atividade do TF no câncer seriam os recipientes dos sinais regulatórios dependentes diretamente desta proteína (RAK e col, 2006).
50 32 Em 1994, Zhang e colaboradores demonstraram que o aumento da expressão de TF, em células de sarcoma Meth-A, estava relacionado a um aumento na angiogênese e que este efeito era independente da coagulação. Rickles e colaboradores em 2001 também demonstraram em diferentes células uma correlação entre VEGF e TF. Controversamente, Bromberg e colaboradores verificaram, em 1999, que o aumento da expressão de TF, em células de melanoma, não aumentava a expressão de VEGF ou promoveriam o crescimento e a vascularização dos tumores derivados dessas células de melanoma. Estes dados sugeriram que o TF atuaria, nessas linhagens, em um mecanismo diferente da angiogênese para promover a metástase. Apesar dos resultados experimentais serem controversos, acredita-se que a contribuição do TF para a angiogênese poderia ocorrer dependente ou independente da coagulação. A via dependente da coagulação envolveria a ligação do TF ao fator VIIa com conseqüente desenvolvimento das reações da coagulação, com geração de trombina seguida da formação do coágulo. A via independente envolveria a fosforilação do domínio citoplasmático do TF com subseqüentes eventos de sinalização que ocorreriam independentemente da produção de trombina ou formação do coágulo (Figura 12). Estes eventos regulariam uma série de fenômenos intracelulares incluindo a reorganização do citoesqueleto e ativação de vias de sinalização. Ambas as vias podem diretamente e/ou indiretamente contribuir para a angiogênese e a progressão do tumor (RICKLES e col, 2003).
51 33 Figura 12 TF e angiogênese mecanismos independentes da coagulação. O TF pode induzir a angiogênese via mecanismos independentes da geração de trombina e deposição de fibrina. Figura adaptada de Rickles e col, 2003; Fernandez e col, Trombina e Câncer A geração de trombina é um passo central na coagulação sanguínea. Esta enzima foi detectada in situ em vários tipos de tumores como câncer de pequenas células do pulmão, câncer renal, melanoma, câncer de ovário, câncer da laringe, câncer pancreático e câncer gástrico, onde contribuiria para a progressão do câncer de diferentes formas. Os efeitos da trombina incluiriam o aumento da adesividade da célula tumoral e a sua metástase, indução da agregação de plaquetas induzida pela célula tumoral, efeitos pró-migratórios, mitogênese da célula tumoral assim como, amplificação dos efeitos exercidos por outros mitógenos. A trombina também estimula o crescimento e as respostas quimiotáticas de células inflamatórias, indiretamente facilitando a angiogênese tumoral (revisado por WOJTUKIEWICZ e col, 2004).
52 34 Assim como o TF, os mecanismos de ação da trombina podem ser dependentes ou independentes da coagulação. Os mecanismos dependentes da coagulação envolvem plaquetas e a deposição de fibrina (Figura 13). O fibrinogênio é capaz de entrar no tecido extravascular e é clivado pela trombina que é gerada no microambiente do tumor. A fibrina gerada é encontrada dentro do endotélio vascular ligada a células inflamatórias e/ou tumorais, ou depositada ao redor do tumor facilitando a angiogênese (RICKLES e col., 2003; FERNANDEZ e col., 2004). Além disso, a fibrina poderia ter dois efeitos opostos no desenvolvimento de metástases: retardar a liberação do tumor primário e aumentar o aprisionamento de células tumorais circulantes (FRANCIS e col., 1998). Figura 13 Trombina e angiogênese: mecanismos dependentes da coagulação. A geração de trombina pelo complexo protrombinase leva a formação de fibrina e ativação de plaquetas. A deposição de fibrina sobre as plaquetas forma o coágulo que é capaz de contribuir para o crescimento tumoral e a angiogênese. Adaptada de Rickles e col, 2003; Fernandez e col, 2004.
53 35 Os efeitos da trombina independentes da coagulação, no câncer, podem ser através da promoção da angiogênese in vivo, induzindo infiltração dos microvasos e in vitro promovendo diferenciações morfológicas dependentes de PKC. No microambiente do tumor, a trombina poderia estar envolvida no recrutamento de novos vasos, já que ativa a proliferação e migração de células endoteliais. A trombina também atuaria indiretamente liberando VEGF dos grânulos das plaquetas e promoveria o aumento da permeabilidade vascular pelas células endoteliais. Esses efeitos pró-angiogênicos poderiam contribuir para os efeitos da trombina no aumento do crescimento tumoral e potencial metastático das células tumorais (RICKLES e col., 2003). Através da mobilização de moléculas de adesão como as integrinas α2bβ3, P- selectina e ligante do CD-40 para a superfície da célula, a trombina aumentaria a adesão entre a célula tumoral, célula endotelial e matriz extracelular, promovendo a progressão do tumor. Ela também libera fatores de crescimento, quimiocinas e proteínas extracelulares que promoveriam a proliferação e migração do tumor (RICKLES e col., 2003). A atividade prómetastática da trombina também foi demonstrada in vivo por modelos experimentais de metástase pulmonar onde os autores mostraram uma indução aumentada de metástases pulmonares quando as células eram tratadas com trombina quando comparado ao controle sem o tratamento (NIERODZIK e col., 1991; WOJTUKIEWICZ e col., 1993). A maioria dos efeitos celulares da trombina são mediados pela ativação, com subseqüente geração de cascatas de sinalização, dos membros da família PAR que falaremos a seguir (Figura 14), sugerindo que a ativação proteolítica da trombina é essencial para a mediação desses eventos (RICKLES e col., 2003).
54 36 Figura 14 Trombina e angiogênese: mecanismos independentes da coagulação. A trombina pode induzir a angiogênese independentemente da formação do coágulo via ativação dos receptores do tipo PAR ligados à membrana da célula. As cascatas de sinalização que se seguirão, irão ativar genes envolvidos na angiogênese. Figura adaptada de Rickles e col, 2003; Fernandez e col, Sinalização por receptores PAR no Câncer As respostas celulares do TF e da trombina são mediadas por uma família de receptores acoplados a proteína G, conhecidos como PAR receptores ativados por proteases. Os receptores PAR possuem 7 domínios transmembrana que carregam seu próprio ligante ativador. Já foram identificados 4 membros da família PAR: PAR-1, PAR-2, PAR-3 e PAR-4. Experimentos com camundongos knockout (-/-) para PAR-1, PAR-2 e PAR-3 demonstraram que os camundongos PAR-1 -/- são os que possuem a maior influência no desenvolvimento vascular, com uma mortalidade de 50% dos seus embriões, enquanto que
55 37 PAR-2 -/-, PAR-3 -/- e PAR-4 -/- se desenvolveram relativamente normais, sugerindo uma redundância na função desses receptores. A expressão dos receptores PAR varia de acordo com a tipo de célula e espécie. Plaquetas humanas expressam PAR-1 e PAR-4 e plaquetas murinas expressam PAR-3 e PAR-4 e células endoteliais humanas PAR-1, PAR-2 e possivelmente PAR-3, mas não PAR-4 (SAMBRANO e col., 2001; FERNANDEZ e col., 2004; OSSOVSKAYA e BUNNETT, 2004; COUGHLIN e col., 2005). A tabela abaixo (Tabela 1) resume a expressão e funcionalidade dos receptores PAR em células normais. Tabela 1 Resumo da expressão, ativação e funcionalidade dos receptores PAR em células normais. AP = peptídeo de ativação. Ossovskaya e Bunnett, O mecanismo de ativação desses receptores é bastante original e bem distinto dos outros tipos de receptores. O receptor é ativado por serino-proteases capazes de clivar o domínio extracelular, produzindo uma seqüência N-terminal, constituída de um peptídeo ligante de 5 a 6 aminoácidos que é capaz de se ligar ao sítio de ligação do receptor e ativá-lo (BROMBERG e col., 2001; NISHIBORI e col., 2005; RAO e PENDURTHI, 2005).
56 38 Figura 15 Estrutura dos receptores PAR. Na figura, estrutura do receptor PAR-1. Clivagem de PAR-1 pela trombina expõe o novo domínio N-terminal que serve de ligante. A ativação de PAR-1 é seguida de uma rápida sinalização antes do receptor ser desensibilizado e, em alguns casos, retirado da superfície celular. Figura adaptada de Brass, No câncer, esses receptores são expressos em diferentes tipos celulares e têm sido implicados no crescimento tumoral, invasão e metástase de vários tipos de câncer malignos humanos. A expressão de PAR-1 e PAR-2 foi observada em células tumorais, células endoteliais, células vasculares de músculo liso, fibroblastos de estroma de músculo liso positivos para actina, mastócitos e macrófagos dentro do microambiente do tumor metastático. Apesar de PAR ter sido encontrado em células normais do microambiente tumoral, esse receptores não são encontrados em células normais em tecidos benignos. Estes resultados sugerem que o microambiente tumoral seja receptivo a induções genéticas mediadas por PAR oferecendo mecanismos potenciais de metástase promovida por trombina (RICKLES e col., 2003; RAK e col., 2006).
57 39 Even-Ram e colaboradores em 1998, usando tanto linhagens quanto espécimes de câncer de mama, encontraram uma correlação direta entre níveis elevados de expressão de PAR e potencial invasivo. Enquanto que os espécimes normais ou pré-malignos não tinham expressão de PAR detectáveis, carcinomas infiltrantes dos ductos mamários expressavam altos níveis. Fazendo uma transfecção de DNA complementar antisense PAR-1 em células da linhagem de câncer de mama metastático, MDA-435, reduzia-se significativamente seu potencial metastático. Enquanto a trombina ativa os receptores PAR-1, PAR-3 e PAR-4, o complexo TF-FVIIa ativa o receptor PAR-2, e o produto do início da coagulação, FXa, enquanto montado como o complexo ternário TF-FVIIa-FXa, sinaliza via receptores PAR-1 e PAR-2 (Figura 16). O FXa é capaz de ativar o receptor PAR-1 mas a sua cinética é bem mais lenta quando comparado a clivagem por trombina (FERNANDEZ e col., 2004; BELTING e col., 2005; MORRIS e col., 2006). Figura 16 Ativação dos receptores PAR. Trombina ativa os receptores PAR-1, PAR-2 e PAR-4, TF:FVIIa ativa o receptor PAR-2 e o complexo TF:FVIIa:FXa ativa os receptores PAR-1 e PAR-2. Figura adaptada de Rickles e col., 2003 e Fernandez e col., 2004.
58 40 A ativação do receptor PAR-1 pela trombina resulta em uma série de sinalizações celulares que evocam uma variedade de respostas celulares. A via de ativação celular envolve aumento de Ca 2+ e ativação da proteína quinase C (PKC) via segundos mensageiros como inositol-trifosfato (IP3) e diacilglicerol (DAG) (VOURET-CRAVIARI e col., 1992). Além disso, induz a ativação de moléculas de sinalização intracelular como Ras, PI3-K (fosfoinositide 3- quinase), e MAPK (proteína quinase ativada por mitógeno), que estão envolvidos no crescimento celular, promoção do tumor e carcinogênese (Figura 17) (GRAND e col., 1996; MACFARLANE e col., 2001). Apesar de estar correlacionado com a progressão do tumor, a superexpressão do PAR-1 em células tumorais contribui para a invasão celular e angiogênese. Ativação desse receptor em uma variedade de tipos celulares pode levar a uma série de respostas celulares e expressão de genes responsivos a trombina, muitos deles envolvidos na angiogênese e invasão do tumor, incluindo IL-8 (interleucina-8), VEGF, bfgf (fator de crescimento básico de fibroblastos), PDGF (fator de crescimento derivado de plaquetas), MMP-2 (matriz metaloproteínase-2), upa (ativador de plasminogênio do tipo uroquinase), integrinas α2bβ3, αvβ3, αvβ5 (Figura 17). Isto sugere que a ativação do receptor de trombina pode facilitar a invasão e metástase tumoral através da indução de moléculas de adesão, proteases que degradam matriz e, estimulação da secreção de fatores angiogênicos, que contribuiriam para o fenótipo metastático de vários tipos de câncer (TELLEZ e BAR-ELI, 2003; YIN e col., 2003). Liu e colaboradores em 2006 demonstraram em células de câncer de próstata que o sistema trombina/par-1 estimula a expressão de VEGF e IL-8 através das vias de sinalização ERK e PI3-K.
59 Figura 17 Moléculas envolvidas na invasão celular e angiogênese na progressão do tumor via PAR-1. Os sinais promovidos pelo tumor traduzidos por PAR-1 através de proteínas G regulam positivamente moléculas 41
60 42 Com base nas informações anteriores, torna-se claro que a geração de enzimas da coagulação sanguínea em áreas próximas ao tumor pode gerar uma série de respostas celulares via receptores específicos. Assim, torna-se fundamental o perfeito entendimento dos mecanismos de coagulação sanguínea pelas células tumorais.
61 43 2 Objetivos
62 Objetivo Geral Caracterizar os mecanismos moleculares responsáveis pelas propriedades prócoagulantes de linhagens tumorais. 2.2 Objetivos Específicos Caracterizar o potencial pró-coagulante das linhagens de melanoma murino B16F10 e melanoma humano WM-266-4, incluindo a identificação de fator tecidual e fosfatidilserina na membrana das células. Caracterizar e comparar o potencial pró-coagulante das linhagens de leucemia humana, Molt-4, THP-1 e NB4, incluindo a identificação de fator tecidual e fosfatidilserina na membrana das células.
63 45 3 Materiais e Métodos
64 Reagentes Meio RPMI 1640 (Sigma Chemical Co, EUA) suplementado com Penicilina/Estreptomicina, 2 mm de L-glutamina e 20 mm de tampão Hepes. Meio MEM (Sigma Chemical Co, EUA) suplementado com Penicilina/Estreptomicina e 2 mm de L-glutamina. Soro Fetal Bovino (SFB) (Gibco, EUA) distribuído em alíquotas e mantido a -20 C até a sua utilização. Tripsina (Gibco, EUA) distribuído em alíquotas de 25 µg/ml e mantido a -20 C até a sua utilização. Anticorpo anti-tf humano (mouse IgG1) conjugado com ficoeritrina (PE), (BD, EUA) utilizado nos ensaios de citometria de fluxo. Anticorpo anti-tf humano (mouse IgG1) cod (American Diagnostica Inc, EUA) utilizado nos ensaios de inibição. Anticorpo anti-ps (IgG1) (Upstate, EUA) utilizado nos ensaios de citometria de fluxo. Anticorpo secundário goat anti-mouse IgG conjugado com isotiocianato de fluoresceína (FITC) (Upstate, EUA) utilizado nos ensaios de citometria de fluxo. Tampão de Reação (RB): Tampão Tris (TBS 50 mm Tris; 150 mm NaCl; 0,02% NaN 2 ajustado para ph p/7.4) + 1% Albumina humana Tampão STOP (SB): Tampão Tris/EDTA 175 mm NaCl; 50 mm Tris; 75 mm Na 2 EDTA.2H 2 O Ajustado para ph p/8.4.
65 47 Fator tecidual recombinante humano X/95 (NIBSC) reconstituído com 1 ml de água (potência arbitrária de 1000 TFU/mL). Diluído em TBS para fazer a curva de 100 TFU/mL a 1 TFU/mL. Padrão de Fosfolipídios de cérebro de boi (PL) (NIBSC - 91/542) reconstituído com 1mL de água (potência arbitrária de PLU/mL) e diluído em RB para fazer as curvas de PL. FIXa humano recombinante (NIBSC - 97/562) potência de 11 U/mL. FVIII humano recombinante (NIBSC - 96/598 e 95/608) potência de 7.4 U/mL. FX humano (NIBSC - 98/754) potência de 0.7 U/mL FXa bovino (NIBSC - 75/595) reconstituído com 0.5 ml de água para fazer a curva padrão 2 IU/mL depois de reconstituído. Protrombina humana (Haematologic Technologies, EUA) diluído em água na concentração de 125 µm e armazenado a -80 ºC. PM = Da. FXa humano (Haematologic Technologies, EUA) diluído em água na concentração de 200nM e armazenado a -80ºC. PM = Da FXa Gla-domainless humano (Haematologic Technologies, EUA) diluído em água na concentração de 200 nm e armazenado a -80ºC. FVa humano (Haematologic Technologies, EUA) diluído em água na concentração de 1 µm e armazenado a -80ºC. PM = Da.
66 DAPA (Dansilarginina N 3 etil 1,5 pentanedil-amida) (Haematologic Technologies, EUA). 48 FPRCK (D-Phe-Pro-Arg-chloromethylketone) (Calbiochem, EUA) SDS (duodecil sulfato de sódio) (Sigma Chemical Co, EUA) PEG (polietilenoglicol) 6000 (Sigma Chemical Co, EUA) EGTA (ácido Etilenoglicol-bis-(2-aminoetil)-N,N,N',N'-tetraacético) (Sigma Chemical Co, EUA) EDTA (ácido Etileno-dioxi-dietileno-dinitrilo-tetraacético) (Sigma Chemical Co, EUA) S-2238 (H-D-phenylalanyl-L-pipecolyl-L-arginine-p-nitroaniline dihydro-chloride) (Chromogenix, Mölndal, Suécia). S-2765 (N-α α benziloxicarbonil-d-arg-gli-arg-p-nitroanilida) (Chromogenix, Mölndal, Suécia). Anexina V de placenta humana (Sigma Chemical Co, Poole, UK) diluído em TBS e utilizado em diversas concentrações. Aprotinina KIU/mL diluído em TBS na concentração de 2000 KIU/mL. Ancrod (NBSC 74/581) diluído em 1 ml de água potência de 55 IU/mL. α trombina (NIBSC 89/588) diluído em 1 ml de água potência de 100 IU/mL.
67 Linhagens Celulares Linhagens de melanoma: B16F10 (linhagem de melanoma murino) e WM (linhagem de melanoma humano), ambas obtidas na ATCC (American Type Culture Collection). Linhagens de leucemia: Molt-4 (linhagem humana de leucemia T-linfocítica), THP-1 (linhagem humana de leucemia monocítica) e NB4 (linhagem humana de leucemia promielocítica), todas obtidas no NIBSC (National Institute for Biological Standards and Control) Cultura de Células Molt-4, THP-1 e NB4 - as linhagens foram mantidas com duas passagens semanais em meio RPMI 1640 suplementado com Penicilina/Streptomicina, 2 mm de L-glutamina, 20 mm de HEPES e 10% de SFB e incubadas em estufa com atmosfera de 5% de CO 2, a 37ºC, na concentração de 2x10 4 células/ml. Utilizadas nos experimentos com 3 dias de cultura. B16F10 a linhagem foi mantida com duas passagens semanais. As células eram lavadas 2x com PBS, à temperatura de 37ºC, para retirada do SFB, depois tripsinizadas com 100 µl de tripsina na concentração de 25 µg/ml, para soltar as células da garrafa, e ressuspensas em meio RPMI 1640 com 10% de SFB e incubadas em estufa com atmosfera de 5% de CO 2 a 37ºC. Utilizada nos experimentos com 3 dias de cultura. WM a linhagem era mantida com duas passagens semanais. As células eram lavadas 1x com meio MEM, descoladas com um rodinho e ressuspensas em meio MEM suplementado com Penicilina/Streptomicina, 2 mm de L-glutamina e 10% de SFB e incubadas em estufa com atmosfera de 5% de CO 2 a 37ºC. Utilizada nos experimentos após 3 dias.
68 Citometria de Fluxo As análises feitas no citômetro de fluxo FACSCalibur (Becton-Dickinson, EUA), foram analisadas com os seguintes parâmetros: desvio frontal (ou forward scatter), desvio lateral (ou side scatter) e sinais de fluorescência na cor verde (FL1), cujo comprimento de onda é de 525 nm ou, na cor laranja (FL2), cujo comprimento de onda é de 575 nm. A excitação das amostras foi realizada por laser de argônio ajustado para emitir 15 mw a 488 nm, resfriado por ar-refrigerado. Um total de eventos foi adquirido e os dados obtidos foram analisados utilizando o programa WinMDI Identificação de Fator Tecidual As células (5x10 5 células/ml) foram incubadas com anticorpo monoclonal anti-tf conjugado com ficoeritrina (PE) por 30 min à 4ºC no escuro. As células foram resuspendidas em 300 µl de PBS e levadas para análise. A média da intensidade de fluorescência (MIF) de eventos foi determinada para cada amostra Identificação de Fosfatidilserina (PS) As células (5x10 5 células/ml) foram incubadas com anticorpo monoclonal anti-ps por 30 min à 4ºC, lavadas e incubadas com anticorpo secundário conjugado com fluoresceína (FITC) por 30 min à 4ºC no escuro. As células foram resuspendidas em 300µL de PBS e levadas para análise. A média da intensidade de fluorescência (MIF) de eventos foi determinada para cada amostra.
69 3.5. Ensaio de atividade do Fator Tecidual tempo de coagulação do plasma 51 A habilidade das células tumorais em potencializar a coagulação do plasma foi verificada pela medida do tempo de recalcificação em um coagulômetro KC-4 micro (Amelung Ltd, Diagnostic Grifols, Barcelona, Spain) de acordo com o seguinte protocolo: 100 µl de pool de plasma humano pobre em plaquetas (PPP) foi misturado com 100 µl de células, em diferentes concentrações, resuspendidas em tampão Tris (TBS) ou um padrão de TF (X/95). Após 2 minutos, foi adicionado 100 µl de 25 mm CaCl 2 e o tempo necessário para ocorrer a coagulação foi medido. Para as linhagens humanas, os tempos obtidos no coagulômetro foram convertidos em unidades de TF (TFU) por comparação com uma curva de diluição de um padrão de TF, X/95). Para checar a especificidade do TF as células foram incubadas previamente por 5 minutos com anti-tf ou aprotinina nas concentrações finais de 10 µg/ml e 1000 KIU/mL, respectivamente Ensaio de geração de fator Xa A geração de fator Xa foi verificada de acordo com o seguinte protocolo: as células a 1x10 5 células/ml ou diferentes concentrações de PL foram incubados a 37 C com 1.0 IU/mL FIXa, 1.0 IU/mL FVIII e 0.5 IU/mL FX (concentrações finais) por 2 minutos. A geração de FXa foi iniciada pela adição de 25mM CaCl 2. Foram removidas da mistura alíquotas de 25 µl a cada 2 minutos e adicionados a 50 µl de tampão STOP (SB). A quantidade de FXa formada foi estimada adicionando-se o substrato cromogênico, 0.5 mm S-2765 por exatos 3 minutos. A reação foi interrompida por meio da adição de 50 µl de ácido acético a 50% e a densidade ótica medida em um leitor de Elisa (Thermomax Microplate Reader, Molecular Devices, Menlo
70 Park, EUA) a 405 nm e convertidas em concentrações de FXa a partir de uma curva de diluição de uma preparação de FXa. Foram realizados controles na ausência de células Ensaio de formação do complexo Protrombinase A ativação de protrombina foi verificada através do seguinte protocolo: as células a 1x10 5 células/ml ou diferentes concentrações de PL foram incubados a 37 C com 0.1 nm e ou 1 nm FXa/1 nm FVa (concentrações finais) por 5 minutos. A reação foi iniciada pela adição de 1 µm protrombina (concentração final) e alíquotas de 10 µl foram removidas a cada 2 minutos e adicionadas a 25 µl de SB. A quantidade de trombina formada foi estimada através da adição de 50 µl de 1 mm do substrato cromogênico, S-2238, e a absorbância lida a 405 nm, a 37ºC por 6 min com intervalo de 6 segundos em um leitor de Elisa. As velocidades (mod/min) obtidas nos primeiros minutos da reação foram usados para calcular a quantidade de trombina formada. Foram realizados controles na ausência de células Ativação de protrombina estimada por SDS-PAGE A ativação de protrombina na presença de células tumorais também foi avaliada por SDS-PAGE por meio do seguinte protocolo: FXa e FVa na concentração final de 1nM foram incubados na presença ou ausência de 1x10 5 células/ml por 10 minutos a temperatura ambiente. A reação foi iniciada com a adição de 1 µm (concentração final) de protrombina, num total de 500 µl. Para reduzir a formação de produtos clivados pela trombina, as reações foram feitas na presença de 6 µm de DAPA, um inibidor específico desta enzima. Alíquotas de 50 µl foram retiradas em diferentes tempos, a reação interrompida com 15 mm EDTA e 5 µm
71 53 FPRCK (20 µl), e as alíquotas foram aplicadas em gel de acrilamida (SDS-PAGE 10% acrilamida) sob condições não redutoras Inibição dos complexos da coagulação por Anexina V O efeito de Anexina V na formação de trombina e FXa foi verificada de acordo com o seguinte protocolo: as células (1x10 5 cels/ml) foram incubadas com diferentes concentrações de Anexina V (0-25 nm) por 5 min a 37ºC em TBS. Após esse período seguia-se ativação dos complexos tenase intrínseco (formação de FXa) e protrombinase (formação de trombina) como descrito acima, nesta seção, no entanto as alíquotas foram removidas em tempo fixo de 14 minutos para a formação de FXa e 10 minutos para a formação de trombina Desfibrinação de plasma humano com ancrod Pool de plasma humano pobre em plaquetas foi incubado com 9 µl de ancrod por ml de plasma por 30 min a 37 C. Após este período o coágulo formado era retirado com um palito de madeira. O plasma era então centrifugado a 2700 g por 10 min para retirada de qualquer resíduo de fibrina, o sobrenadante era removido e guardada em um tubo de plástico no gelo até o momento de sua utilização Ensaio cromogênico para geração de trombina no plasma Pool de plasma humano pobre em plaquetas, desfibrinado com ancrod foi incubado por 90 segundos com FIXa a 37ºC. Após esse período eram adicionados às células ou ao
72 54 padrão de PL e incubados a 37ºC por 120 segundos. A reação foi iniciada pela adição de 100 mm CaCl 2. Alíquotas de 10 µl da mistura foram retiradas em diferentes tempos e adicionadas a 140 µl de SB. A formação de trombina foi estimada através da adição de 1 mm do substrato cromogênico, S-2238 por exatos 3 minutos. A reação era interrompida por meio da adição de 50 µl de ácido acético a 50% e a densidade ótica medida em um leitor de Elisa a 405 nm e convertida a concentração de trombina por meio de uma curva de diluição de uma preparação de α-trombina. Foram realizados controles na ausência de FIXa, na ausência de células e na ausência de ambos Análise Estatística prisma 4. Os experimentos foram analisados por One-way ANOVA ou Two-way ANOVA no
73 55 4 Resultados
74 Ação pró-coagulante de Linhagens de Melanoma Linhagem de melanoma murino B16F Expressão e atividade do Fator Tecidual Diversos trabalhos demonstram uma expressão aumentada de fator tecidual (TF) em linhagens tumorais e a importância desta proteína na atividade pró-coagulante dessas células, visto que o TF é a proteína que inicia a cascata de coagulação (MUELLER e col., 1992; BROMBERG e col., 1995; FISCHER e col., 1995; HAIR e col., 1995; HAMADA e col., 1996; FÖRSTER e col., 2003). O melanoma é um câncer altamente metastático e há evidências de que o TF contribua para esse padrão. A linhagem de melanoma murino, B16F10, é uma linhagem extremamente metastática. Dessa forma, verificamos a expressão de TF na membrana das células de B16F10, por meio da citometria de fluxo. Verificamos que a linhagem B16F10 expressa TF em sua membrana com uma média de intensidade de fluorescência (MIF) de 15,0 ± 3.2 (Figura 18). Figura 18 Análise da expressão de TF na membrana da linhagem B16F10. Realizada por citometria de fluxo. A linha preta representa a fluorescência basal das células B16F10 e a linha vermelha representa as células incubadas com anticorpo anti-tf. Histograma representativo de 4 ensaios.
75 57 Posteriormente, verificamos a atividade pró-coagulante do TF por intermédio de um ensaio baseado no tempo de coagulação do plasma após a adição de CaCl 2. Verificamos que o TF expresso na membrana das células desta linhagem é funcional, visto que as células foram capazes de diminuir o tempo de coagulação de forma concentração de céluladependente, quando comparadas com o controle realizado na ausência de células (Figura 19A). A presença de aprotinina, um inibidor não-específico de serino-proteases, mostrou ineficaz no bloqueio da ação pró-coagulante das células tumorais (Figura 19B), indicando que este efeito seria exclusivamente via TF. Surpreendentemente, nestas condições experimentais, a presença de anticorpo anti-tf não foi capaz de bloquear a ação prócoagulante das células tumorais de forma significativa (Figura 19B). Uma possível explicação para este resultado é a de que os anticorpos anti-tf humano utilizados neste ensaio devem reconhecer uma região do TF murino não relacionada com sua atividade.
76 58 Tempo de coagulação do plasma A 0 controle 1x10 4 1x10 5 1x10 6 número de células 400 B Tempo de coagulação do plasma Anti-TF + Aprotinina 1x10 6 cels/ml Figura 19 Atividade de TF na linhagem B16F10. (A) Redução do tempo de recalcificação de plasma humano de forma concentração de células dependente quando comparadas ao controle somente com TBS. (B) Atividade de TF não foi inibida por anticorpo anti-tf e nem por aprotinina (concentração de células de 1x10 6 cells/ml). Os dados representam a média ± EP de três experimentos independentes.
77 Papel da expressão de fosfatidilserina na atividade pró-coagulante Estudos anteriores demonstraram a importância de fosfolipídios carregados negativamente na membrana de células tumorais para a ligação das enzimas da cascata de coagulação (BARROWCLIFFE e col., 2002; PICKERING e col., 2004). Assim, a exposição de fosfatidilserina (PS) na membrana de células B16F10 foi medida por intermédio de citometria de fluxo. O de MIF obtido foi de 0,85 ± 0,42, em relação ao controle, analisado nas células viáveis, mostrando que as células viáveis da linhagem B16F10 expressam PS em sua membrana (Figura 20). Figura 20 Análise da exposição de PS na membrana de células da linhagem B16F10. Realizada através de ensaios de citometria de fluxo. A linha preta representa a fluorescência basal das células e a linha vermelha a fluorescência na presença do anticorpo anti-ps. Histograma representativo de cinco ensaios.
78 60 Para verificar o papel da fosfatidilserina, exposta na membrana das células B16F10, na atividade pró-coagulante, realizamos ensaios de formação dos complexos tenase intrínseco e protrombinase, ambos dependentes da presença de fosfolipídio carregados negativamente. Para analisar a formação do complexo tenase intrínseco, incubamos as células de B16F10 na presença de FIXa, FVIIIa, FX e íons Ca 2+. A figura 21 mostra que as células de B16F10 foram capazes de aumentar a conversão de FX em FXa (quadrados), quando comparadas ao ensaio controle, realizado na ausência de células (triângulos). Esta ativação pode ser comparada com a ativação de 0.4 unidades de PL/mL de uma curvapadrão de fosfolipídio (Figura 21, inset) PLU/mL 0.1 PLU/mL FXa (IU/mL) FXa (IU/mL) Tempo (min) Tempo (min) Figura 21 As células de melanoma B16F10 promovem a ativação de FXa através do complexo tenase intrínseco. A ativação de FX (0,5 IU/mL) por FIXa (1 IU/mL) e FVIIIa (1 IU/mL) foi realizada na ausência ( ) ou na presença ( ) de células de B16F10 (concentração de célula 1 x 10 5 cels/ml). A formação de FXa foi determinada como indicado nos materiais e métodos. Os dados são médias ± EP de três experimentos independentes. Inset: Ativação do complexo tenase intrínseco em diferentes concentrações de um padrão PL. Os dados são médias ± EP de três experimentos independentes.
79 61 Estudos anteriores demonstraram que algumas linhagens tumorais aumentam a ativação de protrombina pelo FXa de forma membrana-dependente (SAKAI e col., 1990; DONELLY e col., 1998; BARROWCLIFFE e col., 2002). Para investigar se as células B16F10 também possuíam essa habilidade, as células foram incubadas com FXa e protrombina na presença de íons Ca 2+. A figura 22 mostra que as células de B16F10 aumentaram significativamente a atividade de FXa (círculos), quando comparado com os controles realizados na ausência de células (quadrados). Não foi observada a formação de trombina quando a protrombina foi incubada na presença das células de melanoma e na ausência de FXa (triângulos). Além disso, o aumento da atividade de FXa foi completamente dependente
80 62 A habilidade das células B16F10 de suportarem a montagem do complexo protrombinase foi determinada incubando-se as células com FXa (1 nm), FVa (1 nm) e protrombina (1 µm) na presença de íons Ca 2+. Como mostrado na figura 23A, a formação de trombina por FXa foi bastante aumentada pela presença de FVa (círculos) quando comparado ao controle realizado na ausência de células (quadrados). Portanto, a formação de trombina por FXa/FVa/B16F10 foi bastante similar ao observado quando as células eram previamente incubadas com FXa (10 nm) na ausência de FVa (Figura 22), sugerindo um aumento de ~10 vezes na atividade enzimática pelo cofator protéico. A habilidade do complexo protrombinase montado na B16F10 em converter protrombina em trombina foi confirmada posteriormente por SDS-PAGE. A figura 23B mostra o curso temporal de incubação das células B16F10 com protrombina na presença de FXa, FVa e íons Ca 2+. Uma banda correspondente à trombina é formada progressivamente enquanto a banda correspondente de protrombina é gradativamente consumida, Em contraste, não foi possível detectar bandas correspondentes à trombina quando a incubação era feita na ausência de FXa ou na ausência de células (Figura 23B). Os dados acima fazem parte do Anexo 1.
81 Figura 23 Atividade do complexo protrombinase em células B16F10. (A) A ativação de protrombina humana (1 µm) por FXa (1 nm) e FVa (1 nm) foi realizada na ausência ( ) ou na presença ( ) das células de B16F10. A formação de trombina foi determinada nos tempos indicados como descrito na seção 2 Materiais e Métodos. Os dados são médias ± DP de quatro experimentos independentes. (B) Ativação de protrombina analisada por SDS-PAGE A ativação da protrombina humana (1 µm) pela linhagem de B16F10 previamente incubada com FXa (1 nm) e FVa (1 nm), foi monitorada por SDS-PAGE como descrito na seção 2 Materiais e Métodos. Os controles foram realizados incubando o zimogênio somente com tampão ou células de B16F10 na ausência das proteínas da coagulação. Alíquotas foram retiradas nos tempos indicados e a formação de trombina foi determinada comparando o padrão de migração com aquele observado pela enzima purificada (Th, indicado pela seta). 63
82 Linhagem de melanoma humano WM Expressão e atividade do Fator Tecidual Assim como para a linhagem de melanoma murino, B16F10, a expressão de TF na linhagem de melanoma humano, WM foi medida por citometria de fluxo. A figura 24 mostra um histograma representativo onde verificamos que a linhagem WM expressa TF em sua membrana. Esta expressão possui uma média de intensidade de fluorescência (MIF) de 11,4 ± 1,4. Figura 24 Citometria de fluxo para expressão de TF na membrana da linhagem WM A linha preta representa a fluorescência basal das células WM (5x10 5 cels/ml) e a linha verde representa as células incubadas com anticorpo anti-tf. Histograma representativo de 6 ensaios independentes. Assim como para a linhagem B16F10, verificamos a atividade pró-coagulante do TF por meio de ensaios de coagulação do plasma. De forma similar, verificamos que o TF expresso na membrana da linhagem de melanoma humano, WM-266-4, é funcional visto que as células foram capazes de diminuir o tempo de coagulação de forma concentração de célula-dependente, quando comparadas com o controle na ausência de células (Figura 25A). Diferentemente da linhagem de melanoma murino, o anticorpo anti-tf humano foi capaz de inibir essa atividade, demonstrando que o epítopo reconhecido no TF humano é importante
83 65 para a sua função pró-coagulante. A atividade pró-coagulante da linhagem WM não foi inibida por Aprotinina, assim como visto para os ensaios realizados com a linhagem B16F10. Em conjunto, estes resultados mostraram que a atividade pró-coagulante da linhagem humana de melanoma WM é devido ao TF presente na sua superfície e não a uma atividade serino-proteásica não específica (Figura 25B). 600 A Tempo de coagulação do plasma controle 1x10 4 1x10 5 1x10 6 número de celulas/ml aprotinina + anti-tf
84 O tempo de recalcificação obtido na figura 25A foi convertido a unidades de TF através da comparação com uma curva de diluição de um padrão de TF, X/95 (Tabela 2). 66 Tabela 2 Atividade de TF nas linhagens WM Tempos de recalcificação convertidos em unidades de TF por comparação com uma curva de diluição de padrão de TF, X/95). Número de Células Atividade de TF (TFU/mL) 1 x 10 4 células/ml 0,61 ± 0,09 1 x 10 5 células/ml 3,15 ± 0,31 1 x 10 6 células/ml 11,44 ± 0, Papel da expressão de fosfatidilserina na atividade pró-coagulante Assim como para a linhagem de melanoma murino, verificamos a exposição de fosfatidilserina (PS) na membrana das células de WM O de MIF obtido foi de 0,76 ± 0,16 relativo ao controle, analisado nas células viáveis, mostrando que a células viáveis da linhagem WM apresentam PS exposto em suas membranas (Figura 26). Figura 26 Análise da presença de PS na membrana da linhagem WM Realizada através de ensaios de citometria de fluxo. A linha preta representa a fluorescência basal das células e a linha verde a fluorescência na presença do anticorpo anti-ps. Histograma representativo de cinco ensaios.
85 67 A próxima etapa foi analisar a contribuição da exposição de PS para a atividade prócoagulante da linhagem WM-266-4, verificando a formação dos complexos tenase intrínseco e protrombinase na superfície destas células. Para analisar a formação do complexo tenase intrínseco, incubamos as células de WM na presença de FIXa, FVIIIa, FX e íons Ca 2+. A figura 27A mostra que as células de WM foram capazes de aumentar a conversão de FX em FXa (quadrados), quando comparadas ao controle realizado sem células (triângulos). A ativação do complexo tenase intrínseco nas células WM pode ser comparada com a ativação de ~1 unidades de PL/mL de uma curva-padrão de fosfolipídio (Figura 27A, inset). A atividade do complexo tenase intrínseco foi inibida progressivamente por concentrações crescentes de Anexina V, proteína reconhecidamente capaz de se ligar à PS, confirmando a importância deste lipídeo para a ligação e montagem do complexo tenase intrínseco na membrana das células de melanoma (Figura 27B).
86 PLU/mL 0.4 PLU/mL 0.1 PLU/mL A FXa (IU/mL) FXa (IU/mL) Tempo (min) Tempo (min) B % de Inibição de formação de FXa Anexina Figura 27 As células de melanoma WM promovem a ativação de FXa através do complexo tenase intrínseco. (A) Ativação de FX (0,5 IU/mL) por FIXa (1 IU/mL) e FVIIIa (1 IU/mL) realizada na ausência ( ) ou na presença ( ) de células de WM (1 x 10 4 céls/poço). A formação de FXa foi determinada como indicado na seção 2 de Materiais e Métodos. Os dados são médias ± EP de 5 experimentos independentes. Inset: Ativação do complexo tenase intrínseco em diferentes concentrações de um padrão de PL. Os dados são médias ± EP de 3 experimentos independentes (B) Inibição da formação de FXa por concentrações crescentes de Anexina V. Os dados são médias de 3 experimentos.
87 69 A habilidade das células WM de suportarem a montagem do complexo protrombinase foi determinada incubando as células com FXa (0.1 nm), FVa (1 nm) e protrombina (1 µm) na presença de íons Ca 2+. Como mostrado na figura 28A, a formação de trombina é aumentada significativamente pelo complexo protrombinase (quadrado) quando comparada à formação de trombina por FXa/WM-266-4, na ausência de FVa (losango) ou quando comparado ao controle na ausência de células (triângulo). Também não foi observada a formação de trombina quando a protrombina foi incubada na presença das células de melanoma e na ausência de FXa (círculo). Assim como a atividade do complexo tenase intrínseco foi inibida progressivamente por concentrações crescentes de Anexina V, a atividade do complexo protrombinase também foi inibida por concentrações crescentes desta proteína, evidenciando a importância de PS para a ligação e montagem do complexo protrombinase na membrana das células WM (Figura 28B).
88 A Trombina formada (mod/min) Tempo (min) 100 B % de Inibição da Formação de Trombina Anexina (nm) Figura 28 Atividade do complexo protrombinase nas células WM (A) Ativação de protrombina humana (1 µm) por FXa (0,1 nm) e FVa (1 nm) realizada na ausência ( ) ou na presença ( ) das células de WM (1 x 10 4 cels/poço). Foram realizados controles incubando as células somente com 1 µm protrombina ( ) e na presença de 1 µm protrombina e 0,1 nm FXa ( ). A formação de trombina foi determinada nos tempos indicados como descrito na seção 2 - Materiais e Métodos. Os dados são médias ± EP de 3 experimentos independentes.
89 71 O efeito das células WM na geração de trombina pela via intrínseca em plasma desfibrinado foi posteriormente analisado incubando-se as células com FIXa e plasma previamente desfibrinado com ancrod na presença de íons Ca 2+. Como visto na figura 29A, a presença das células WM (triângulo) antecipou a formação de trombina de forma substancial quando comparado com os controles sem FIXa (quadrado), na ausência de células (triângulo) na ausência de células e de FIXa (círculo). Este efeito mostrou-se concentração de célula-dependente, como demonstrado na figura 29B s/cell e s/ FIXa WM s/fixa s/cell WM A x10 5 1x10 4 1x10 3 B α-trombina (IU/mL) α-trombina (IU/mL) Tempo (seg) tempo (seg) Figura 29 Efeito de WM na formação de trombina em plasma desfibrinado. (A) Formação de trombina na presença de plasma desfibrinado e FIXa realizada na presença ( ) ou na ausência ( ) de células de WM (1x10 4 cels/poço). Foram realizados controles incubando as células somente com plasma sem FIXa ( ) ou ausência de células e de FIXa ( ). A formação de trombina foi determinada nos tempos indicados como descrito na seção 2 Materiais e Métodos. (B) Curva de células. Os dados são médias ± EP de 3 experimentos independentes.
90 4.2 Ação pró-coagulante das linhagens de leucemia Molt-4, THP-1 e NB Expressão e atividade do Fator Tecidual 72 Pacientes com leucemia aguda apresentam um grande risco de complicações trombóticas e hemorrágicas, particularmente aqueles com leucemia promielocítica aguda. Estas sérias complicações têm sido atribuídas à atividade pró-coagulante do TF, particularmente durante quimioterapia (HAIR e col., 1996). Visto que os dados com melanoma evidenciam mais de um mecanismo de ação pró-coagulante, decidimos estudar três linhagens leucêmicas quanto à expressão de TF e quanto à exposição de PS. Molt-4 é uma linhagem humana de leucemia T-linfocítica; THP-1 é uma linhagem humana de leucemia monocítica e NB4 é uma linhagem humana de leucemia promielocítica. Por citometria de fluxo verificamos a presença de TF nessas linhagens. As linhagens Molt-4, THP-1 e NB4 expressam TF em sua membrana com uma MIF de 34,9 ± 2,7, 34,5 ± 2,3 e 29,2 ± 0,7, respectivamente, relativo ao controle (Figura 30). Não houve diferença significativa (p=0.1) entre as linhagens. Figura 30 Citometria de fluxo para a análise de TF na membrana das linhagens leucêmicas. As linhas pretas representam a fluorescência basal das linhagens e as linhas verde, vermelha e azul representam as células Molt-4, THP-1 e NB4 respectivamente, incubadas com anticorpo anti-tf. Histogramas representativos de 5 ensaios.
91 73 Para analisar a funcionalidade do TF expresso nas linhagens leucêmicas, medimos a atividade pró-coagulante utilizando plasma humano. Verificamos que o TF expresso na membrana das linhagens leucêmicas, é funcional visto que as células foram capazes de diminuir o tempo de coagulação de forma concentração de célula-dependente, quando comparadas com o controle na ausência de células (Figura 31A). Como visto nos ensaios realizados com a linhagem de melanoma humano, a atividade pró-coagulante das células foi inibida na presença de anticorpos anti-tf, mas não por aprotinina, indicando que a atividade é principalmente devido à presença de TF na superfície dessas células e não por uma atividade serino-proteásica não específica (Figura 31B). Os tempos de coagulação obtidos na figura 31A foram convertidos em unidades de TF por meio da comparação com uma curva-padrão de TF, X/95 (Tabela 3). Verificamos que não
92 74 Tempo de Coagulação do Plasma A 0 1x10 4 cells/ml 1x10 5 cells/ml 1x10 6 cells/ml Tempo de Coagulação do Plasma (seg) Controle Molt-4 THP-1 NB4 Molt THP NB4 Controle Anti-TF Aprotinina B Figura 31 Atividade de TF nas linhagens leucêmicas. (A) Redução do tempo de coagulação do plasma humano de forma concentração de células-dependente, quando comparadas ao controle somente com TBS. (B) Atividade de TF foi inibida por anticorpo anti-tf, mas não por aprotinina, onde a concentração de células foi de 1 x 10 6 cells/ml. Os dados representam a média ± EP de 3 experimentos independentes. Tabela 3 Atividade de TF nas linhagens THP-1, Molt-4 e NB-4. Tempos de coagulação convertidos em unidade de TF por comparação com uma curva-padrão de TF (X/95). Células (1 x 10 6 céls/ml) Atividade de TF (TFU/mL) Molt ±0.55 THP ±0.51 NB ±0.33
93 Papel da expressão de fosfatidilserina na atividade pró-coagulante Como o grupo do Dr. Barrowcliffe demonstrava a importância de fosfolipídios carregados negativamente na membrana das células das linhagens leucêmicas (PICKERING e col., 2004), decidimos verificar a expressão de fosfatidilserina na membrana das três linhagens leucêmicas. Utilizando ensaios de citometria de fluxo observou-se que Molt-4, THP- 1 e NB4 apresentam PS exposto em suas membranas, analisado nas células viáveis, com um de MIF (Gmean-Gmean 2ario ) de 1,6 ± 0,2, 0,9 ± 0,3 e 0,8 ± 0,1, respectivamente. Estes dados indicam que a linhagem Molt-4 expressa mais PS na sua superfície que as outras linhagens (Figura 32). Figura 32 Análise da exposição de PS na membrana das linhagens leucêmicas. Foi realizada por ensaios de citometria de fluxo. As linhas pretas representam as células incubadas somente com o anticorpo secundário (upstate) e as linhas vermelhas representam as células incubadas com anti-ps e anticorpo secundário. Experimentos representativos de cinco ensaios.
94 76 Visto que todas as linhagens leucêmicas aqui estudadas expõem PS em suas membranas, analisamos a capacidade destas células de suportar a formação dos complexos tenase intrínseco e protrombinase. Para analisar a formação do complexo tenase intrínseco, incubamos as células (1 x 10 5 cels/ml) de Molt-4, THP-1 e NB4 na presença de FIXa, FVIIIa, FX e íons Ca 2+. A figura 33A mostra que as células de todas as linhagens foram capazes de aumentar a conversão de FX em FXa, quando comparadas ao controle sem células (losango). No entanto verificamos que a linhagem Molt-4 (quadrado) possui uma maior atividade que as linhagens THP-1 (triângulos) e NB4 (círculos), provavelmente devido à presença de maiores quantidades de PS em sua membrana, como demonstrado na figura 32. Estes dados corroboram os resultados publicados previamente pelo grupo do Dr. Barrowcliffe, em 2002, que mostram que a linhagem Molt-4 realmente possui maior atividade de PS que as linhagens NB4 e THP-1. A figura 33B mostra a atividade do complexo tenase intrínseco em um padrão de PL e esta curva pode ser utilizada para avaliar a quantidade de PL presente nas células aqui estudadas. Observamos que os nossos resultados evidenciam uma menor quantidade de PL que aqueles publicados previamente (BARROWCLIFFE e col., 2002), o que provavelmente deve-se ao fato de utilizarmos uma concentração de células 40 vezes menor.
95 Molt-4 THP-1 NB4 sem celula A FXa (IU/mL) Tempo (min) PLU/mL 0.4 PLU/mL 0.1 PLU/mL B FXa (IU/mL) Tempo (min) Figura 33 Linhagens leucêmicas promovem a ativação de FX através do complexo tenase intrínseco. (A) A ativação de FX (0,5 IU/mL) por FIXa (1 IU/mL) e FVIIIa (1 IU/mL) foi realizada na ausência ( ) ou na presença das células (1 x 10 5 céls/ml) Molt-4 ( ), THP-1 ( ) e NB4 ( ). A formação de FXa foi determinada como indicado na seção materiais e métodos. Os dados são médias ± EP de 3 experimentos independentes. (B) A ativação de FX (0.5 IU/mL) por FIXa (1 IU/mL) e FVIIIa (1 IU/mL) foi realizada na presença de diferentes concentrações de PL (fosfolipídio) padrão. Os dados são médias± EP de 7 experimentos.
96 78 A habilidade das linhagens leucêmicas de suportarem a montagem do complexo protrombinase foi determinada incubando-se as células com FXa (0,1 nm), FVa (1 nm) e protrombina (1 µm) na presença de íons Ca 2+. Como mostrado na figura 34A, a formação de trombina foi significativamente aumentada pelo complexo protrombinase tanto nas células Molt-4 (triângulos) quanto nas células THP-1 (círculo) quando comparada ao controle na ausência de células (quadrado). Apesar das diferenças encontradas na expressão de PS entre as duas linhagens, não foi verificada uma diferença quanto à ativação do complexo protrombinase. A figura 34B mostra a atividade do complexo protrombinase em uma curva de diluição do padrão de PL.
97 s/celula Molt-4 THP-1 A Trombina formada (Vmax/min) Tempo (min) PLU/mL 0.8 PLU/mL 0.2 PLU/mL B Trombina formada (Vmax/min) Tempo (min) Figura 34 Atividade do complexo protrombinase nas células Molt-4 e THP-1. (A) A ativação de protrombina humana (1 µm) por FXa (0,1 nm) e FVa (1 nm) foi realizada na ausência ( ) ou na presença das células de Molt-4 ( ) ou THP-1 ( ) (1x10 5 cels/ml). A formação de trombina foi determinada nos tempos indicados como descrito na seção de materiais e métodos. Os dados são médias± EP de 5 experimentos independentes. (B) A ativação de protrombina humana (1 µm) por FXa (0,1 nm) e FVa (1 nm) foi realizada na presença de diferentes concentrações de PL (fosfolipídio) padrão. Os dados são médias± EP de 7 experimentos.
98 80 Finalmente analisamos o efeito das células THP-1 e NB4 na geração de trombina, pela via intrínseca, em plasma desfibrinado. Este ensaio foi realizado incubando-se as células com FIXa e plasma desfibrinado na presença de íons Ca 2+. A figura 35 mostra que a presença das células THP-1 e NB4 (triângulo) antecipou de forma substancial a formação de trombina, quando comparado com os controles na ausência de FIXa (losango), na ausência de células (quadrado) ou na ausência de células e de FIXa (círculo). Entretanto, é possível perceber uma interessante diferença entre as duas linhagens analisadas: as células THP-1 na ausência de FIXa (losango) apresentaram um perfil de formação de trombina similar ao do ensaio controle sem células (quadrado), enquanto que as células NB4, na ausência de FIXa, mantiveram uma geração de trombina relativamente alta em relação ao controle. Uma possível explicação é que apesar de ambas as células expressarem níveis similares de TF, a diferença encontrada poderia significar que na linhagem NB4 a via do TF seria mais atuante, sendo a formação de trombina menos dependente de FIXa, isto é, da via intrínseca, que a linhagem THP-1. Uma outra explicação seria o fato das células NB4, ao contrário da THP-1, expressarem a proteína CP, permitindo a ativação direta do FX a FXa, sem a necessidade do complexo tenase intrínseco, o que contribuiria para uma maior formação de trombina na presença de NB4. No entanto é interessante notar que as linhagens NB4 e THP-1 permitiram a montagem do complexo tenase intrínseco de forma muito similar (Figura 33).
99 81
100 82 5 Discussão
101 83 A elevada ocorrência de estados de hipercoagulação em pacientes com neoplasias malignas foi descrita há mais de um século por Armand Trousseau, sendo a principal complicação clínica nestes pacientes, e a segunda causa de morte na maioria dos tipos de câncer (DONATI, 1995; MANDALA e col., 2003). A incidência de trombose em pacientes com diagnóstico de neoplasia varia de 60% a 100%, dependendo do tipo de tumor. Determinadas neoplasias como a leucemia pró-mielocítica, a leucemia monocítica aguda, tumores de pâncreas, pulmão e gliomas têm relação com maior freqüência de fenômenos trombóticos (HOFFMAN e col., 2001; RICKLES e LEVINE, 2001). Adicionalmente, alguns estudos epidemiológicos têm demonstrado uma correlação entre a ocorrência de trombose e um pior prognóstico da doença (SØRENSEN e col., 2000). Diversos mecanismos têm sido propostos para explicar o estado trombofílico do paciente com câncer (RICKLES e FALANGA, 2001): 1. A síntese de moléculas prócoagulantes pelas células tumorais, entre os quais podemos destacar o Fator Tecidual (TF) e o pró-coagulante neoplásico (CP), um ativador direto do fator X (FX); 2. A síntese de citocinas pró-inflamatórias, como a interleucina 1β (IL-1β) e o fator de necrose tumoral (TNF), pelas células tumorais, ativando as células endoteliais e os monócitos a expressarem o TF na sua membrana externa; 3. A interação direta entre as células tumorais e as células vasculares, resultando na ativação de células endoteliais, plaquetas ou monócitos. Este processo gera tanto a expressão de fatores pró-coagulantes quanto geração de superfícies lipídicas que suportam os complexos da coagulação sanguínea; e 4. A própria exposição do lipídio fosfatidilserina na membrana externa das células tumorais (SUGIMURA e col., 1994). A expressão de TF por células tumorais é amplamente descrita na literatura e já foi demonstrada em linhagens celulares de melanoma M24met e C8161 (MUELLER e col., 1992) e TAC7 (BROMBERG e col., 1995), linhagens celulares de glioma U87-MG (CARSON e
102 84 PIRRUCCELLO, 1998), U251 (GUAN e col., 2002) e C6 (FERNANDES e col., 2006), linhagens leucemicas HL-60 (HAIR e col., 1995) e NB4 (FALANGA e col., 1998), linhagens de câncer de pulmão (KELLER e col., 2001), linhagem de câncer de mama MDA-MB-231 (ZHOU e col., 1998) e linhagens de carcinoma coloretal (YU e col., 2005). Adicionalmente, a superexpressão de TF foi observada por imunohistoquímica em diferentes tipos de tumores obtidos de pacientes, como pulmão, mama, pancreático, colon e carcinoma gástrico (BAUER e col., 1989; CALLENDER e col., 1992; KAKKAR e col., 1995) sendo que os seus níveis de expressão parecem estar relacionados com o grau histológico de malignidade e invasividade tumoral, sugerindo uma íntima correlação com os processos de metástase e angiogênese (GUAN e col., 2002; ISHIMARU e col., 2003). No presente trabalho, tanto as linhagens de melanoma, B16F10 e WM-266-4, quanto as linhagens leucêmicas, Molt-4, THP-1 e NB4, evidenciaram a presença do TF em sua superfície, demonstrado por ensaios de citometria de fluxo. Nas linhagens humanas foi possível demonstrar claramente que a presença desta proteína foi responsável, pelo menos em parte, pela habilidade exibida pelas linhagens testadas em acelerar a coagulação do plasma. Desta forma, a presença de anticorpos anti-tf reverteu parcialmente o efeito prócoagulante das linhagens WM-266-4, Molt-4, THP-1 e NB4. Nossos resultados com linhagens leucêmicas corroboram com os dados publicados por Pickering e colaboradores em 2004, que também demonstraram o efeito inibitório do anticorpo anti-tf na atividade pró-coagulante das células CEM-CCRF, Jurkat Molt-4, A3.01 e THP-1. No entanto, a comparação entre as linhagens leucêmicas com relação a sua atividade pró-coagulante apresentou uma forte discrepância em relação aos resultados obtidos por citometria de fluxo. A linhagem NB4 mostrou um efeito pró-coagulante significativamente superior às linhagens THP-1 e Molt-4, embora todas tenham apresentado uma marcação similar para TF nos ensaios de citometria de fluxo. Neste contexto é possível que a ação pró-coagulante das células NB4 seja em parte
103 85 devido a outros mecanismos como, por exemplo, pela ação da proteína CP. Neste caso, a quantificação da atividade de TF utilizando-se uma curva-padrão desta proteína seria questionável e poderia gerar uma estimativa incorreta dos seus níveis de expressão. Interessantemente, alguns trabalhos têm reportado um efeito pró-coagulante de TF em micropartículas liberadas pelas células tumorais (BASTIDA e col., 1984; SILBERBERG e col., 1989; YU e RAK, 2004). Essas micropartículas contendo TF seriam capazes de induzir o estado pró-trombótico visto em pacientes com câncer. Furie e Furie, em 2006, publicaram que em seus estudos preliminares encontraram micropartículas contendo TF em 1/3 dos pacientes com estado avançado de câncer, incluindo pacientes com carcinoma pancreático, carcinoma ovariano, carcinoma de cólon e câncer de mama. Em nossos experimentos de coagulação plasmática não podemos descartar a presença dessas micropartículas contendo TF e a sua importância para a atividade pró-coagulante relacionada ao TF, apesar de provavelmente essas micropartículas serem eliminadas nas centrifugações de lavagem utilizadas em nosso protocolo. No entanto, como o conteúdo das micropartículas é o mesmo da membrana, podemos assumir que a atividade pró-coagulante vista para a membrana poderia ser relacionada com aquela que seria vista com as micropartículas. Notoriamente a presença do TF em células tumorais presentes no sangue, como no caso das linhagens de leucemia, poderia representar um importante mecanismo para a geração de eventos trombóticos ou coagulação intravascular disseminada. De fato é muito bem reconhecido que a expressão de TF por células sanguíneas, em especial monócitos, consiste no principal mecanismo de ativação sistêmica do processo de coagulação sanguínea e estaria fortemente envolvido no processo de inflamação. Em situações de inflamação como placas ateroscleróticas ou sepse, as células mononucleares seriam capazes de expressar TF
104 via indução por citocinas pró-inflamatórias. Isto levaria a uma ativação sistêmica da coagulação (LEVI e col., 2004). 86 Vários autores já demonstraram a presença de infiltrados inflamatórios em diferentes tumores como o câncer ovariano epitelial (WANG e col., 2005) e também que esses tumores são capazes de liberar citocinas pró-inflamatórias que poderiam estar ativando essas células leucocitárias a expressar TF, em particular as citocinas pró-inflamatórias TNF e IL-1 (De Cicco, 2004). Além do papel pró-coagulante, o TF está envolvido com fenômenos de transdução de sinal, onde sua porção citoplasmática pode gerar sinais intracelulares ou sua porção extracelular pode facilitar a ativação de receptores de membrana sensíveis a proteases da coagulação, como o Fator VIIa, Fator Xa e trombina. Estes receptores, denominados PAR (Receptores Ativados por Protease), com 4 isoformas (PAR 1-4), são expressos em diversos tecidos inclusive tecidos tumorais (RICKLES e col., 2003; OSSOVSKAYA e BUNNETT, 2004; RAK e col., 2006), onde os mais freqüentemente encontrados nas linhagens e tecidos tumorais são os receptores do tipo PAR-1 e PAR-2. Visto que as linhagens de melanoma B16F10 e WM reconhecidamente expressam somente o PAR-1 (NIERODZIK e col., 1998; HAZARIKA e col., 2004, ZAIN e col., 2000), podemos postular que a presença de TF poderia atuar de forma independente da coagulação nessas linhagens, via sinalização direta da parte citoplasmática do TF ou via formação do complexo ternário com o FXa e formação de trombina. Quanto às linhagens leucêmicas, a única descrição de PAR foi feita para a linhagem THP-1 por Mari e colaboradores em 1996 onde estas células não foram responsivas à trombina ou à tripsina sugerindo ausência de PAR-1 e PAR-2. O inicio do processo de coagulação depende da presença do TF, mas a propagação deste fenômeno é extremamente dependente da presença de superfícies lipidicas aniônicas,
105 87 especialmente fornecidas pela fosfatidilserina (PS). A PS é extremamente importante para a composição da membrana celular e normalmente ela é expressa no interior da membrana e facilita a ligação de proteínas de membrana na parte endofacial e funciona como co-fator para diversas enzimas ligadas a membrana. Mudanças na distribuição lipídica da membrana celular, que levam à exposição de PS na sua superfície, podem acompanhar uma variedade de doenças. O fato de PS ser expressa na membrana externa pode gerar uma membrana prócoagulante ou ser um marco para ser fagocitada por macrófagos e isto pode levar a complicações substanciais em diversas doenças como a síndrome de Scott, síndrome antifosfolipídica, talassemia, estomatocitose, uremia, cálculo renal, diabetes e hiperglicemia, infecções bacterianas e virais, malária, pré-eclampsia, hiperbilirrubinemia e as próprias neoplasias (ZWAAL e col., 2005). Nas neoplasias, a expressão de PS na superfície da membrana pode ser até 5 vezes superior as suas counterparts não tumorigênicas (UTSUGI e col., 1991). Além disso, sabe-se que as micropartículas tumorais também expõe PS. Estes fenômenos poderiam aumentar a coagulação sanguínea e contribuir para a deposição de fibrina encontrada em tumores sólidos (ZWAAL e col., 2005). As linhagens celulares analisadas neste trabalho evidenciaram a presença de PS em sua membrana externa, como demonstrado por ensaios de citometria de fluxo. A presença deste lipídio é crucial para a montagem de dois complexos da coagulação sanguínea: o complexo tenase intrínseco (FIXa e FVIIIa) e o complexo protrombinase (FXa e FVa). Consistente com esta informação, todas as linhagens analisadas foram eficientes em suportar a formação dos complexos tenase intrínseco e protrombinase, possibilitando a ativação do fator X e protrombina, respectivamente, em suas formas ativadas. A importância de PS nessa atividade pró-coagulante das linhagens tumorais pôde ser verificada através da
106 88 inibição desses fenômenos por Anexina V, uma proteína com grande afinidade por superfícies lipídicas contendo PS. Em nossos experimentos com a linhagem de melanoma humano WM , nos experimentos com as linhagens leucêmicas Molt-4, THP-1, A3-01, Jurkat e CEM- CCRF (BARROWCLIFFE e col., 2002; PICKERING e col., 2004) e nos experimentos com a linhagem de glioma C6 (FERNANDES e col, 2006), utilizando Anexina V, comprovou-se que a presença desse lipídio na superfície das células tumorais é crucial para a sua atividade prócoagulante. É importante ressaltar, a possibilidade de que a PS detectada em nossos ensaios de citometria de fluxo, assim como nos ensaios funcionais de formação dos complexos tenase intrínseco e protormbinase, seja devido à presença de células apoptóticas. No entanto, Hamatake e colaboradores em 2000 demonstraram a expressão de PS em células da linhagem Molt-4 por mecanismos independentes da via da apoptose. Adicionalmente, experimentos realizados pelo grupo de Barrowcliffe (BARROWCLIFFE e col., 2002 e PICKERING e col., 2004) com as linhagens leucêmicas aqui estudadas também demonstraram que a exposição de PS é independente da apoptose. Além disso, os nossos ensaios de inibição por Anexina V, que normalmente é utilizada na marcação de células apoptóticas, foram realizados com células aderidas, favorecendo a ausência de restos celulares e células em apoptose. Recentemente, Timar e colaboradores. (2005) sugeriram que células tumorais, em particular o melanoma, adquirem um fenótipo denominado mimetismo plaquetário. Esta hipótese baseia-se em estudos deste grupo que demostraram que células neoplásicas podem expressar proteínas típicas de plaquetas como determinadas integrinas e 12-lipoxigenase tipo plaquetária (platelet-type 12-LOX). Neste contexto, a presença de PS na membrana de células tumorais também se encaixa nesta hipótese, visto no modelo de hemostase proposto por
107 89 Hoffman e Monroe em 2001 (Introdução, figura 3), estas células são a principal fonte de superfícies lipidicas aniônicas envolvidas nas fases de amplificação e propagação da coagulação sanguínea. Mais do que isso, concluímos que as células tumorais aqui estudadas são capazes de suportar em sua membrana todas as reações envolvidas nas três fases da coagulação: iniciação, amplificação e propagação.
108 90 6 Conclusão
109 Com base nos resultados encontrados nesta tese, utilizando as diferentes linhagens tumorais, concluímos que: 91 Todas as linhagens tumorais estudadas foram capazes de acelerar a coagulação do plasma, evidenciando mecanismos pró-coagulantes. Parte da ação pró-coagulante se deve à expressão de Fator Tecidual, proteína responsável pela fase de iniciação da coagulação sanguínea, e que foi detectada em todas as linhagens avaliadas. As linhagens tumorais utilizadas neste estudo evidenciaram a presença do lipídio prócoagulante fosfatidilserina (PS), envolvido na fase de propagação da coagulação sanguínea. A concomitante presença de Fator Tecidual e PS nas células tumorais permite a formação dos complexos tenase extrínseco (FVIIa/Fator tecidual), tenase intrínseco (FIXa/FVIIIa) e protrombinase (FXa/FVa). Portanto, nossos resultados indicam que tanto a presença de Fator Tecidual quanto a presença de uma membrana carregada negativamente, são importantes para a atividade prócoagulante das células tumorais e que, diferentemente do fisiológico, as células tumorais são capazes de gerar na sua membrana as 3 fases da coagulação: iniciação, amplificação e propagação. Assim, estas linhagens podem ser utilizadas como modelo para estudo das proteínas da coagulação sanguínea na biologia tumoral.
110 92 Bibliografia
111 AMIRKHOSRAVI A, MEYER T, CHANG JY, AMAYA M, SIDDIQUI F, DESAI H, FRANCIS JL. Tissue factor pathway inhibitor reduces experimental lung metastasis of B16 melanoma. Thromb Haemost. 2002;87(6): BÄCHLI E. History of tissue factor. Br J Haematol. 2000;110(2): BASTIDA E, ORDINAS A, ESCOLAR G, JAMIESON GA. Tissue factor in microvesicles shed from U87MG human glioblastoma cells induces coagulation, platelet aggregation, and thrombogenesis. Blood. 1984; 64(1): BARROWCLIFFE TW, FABREGAS P, JARDI M, CANCELAS J, RABANEDA M, FEIEZ J. Procoagulant activity of T lymphoblastoid cells due to exposure of negatively charged phospholipid. Thromb Haemost. 2002; 87: BAUER KA, CONWAY EM, BACH R, KONIGSBERG WH, GRIFFIN JD, DEMETRI G. Tissue factor gene expression in acute myeloblastic leukemia. Thromb Res. 1989; 56(3): BELTING M, AHAMED J, RUF W. Signaling of the tissue factor coagulation pathway in angiogenesis and cancer. Arterioscler Thromb Vasc Biol. 2005; 25(8): BOCCACCIO C, MEDICO E. Cancer and blood coagulation. Cell Mol Life Sci. 2006; 63(9): BODE W. The structure of thrombin: a janus-headed proteinase. Semin Thromb Hemost. 2006; 32 Suppl 1: BOGDANOV VY, BALASUBRAMANIAM V, HATHCOCK J, VELE O, LIEB M, NEMERSON Y. Alternatively spliced human tissue factor: a circulating soluble, thrombogenic protein. Nat Med. 2003; 9(4): BRASS LF. Thrombin and platelet activation. Chest. 2003; 124(3 Suppl):18S-25S BROMBERG ME, BAILLY MA, KONIGSBERG WH. Role of protease-activated receptor 1 in tumor metastasis promoted by tissue factor. Thromb Haemost. 2001; 86(5): BROMBERG ME, KONIGSBERG WH, MADISON JF, PAWASHE A, GAREN A. Tissue factor promotes melanoma metastasis by a pathway independent of blood coagulation. Proc Natl Acad Sci U S A. 1995; 92(18): BROMBERG ME, SUNDARAM R, HOMER RJ, GAREN A, KONIGSBERG WH. Role of tissue factor in metastasis: functions of the cytoplasmic and extracellular domains of the molecule. Thromb Haemost. 1999; 82(1): BROZE GJ JR. Tissue factor pathway inhibitor and the revised theory of coagulation. Annu Rev Med. 1995; 46: BUTENAS S, MANN KG. Blood coagulation. Biochemistry (Mosc). 2002; 67(1):3-12. CALLANDER NS, VARKI N, RAO LV. Immunohistochemical identification of tissue factor in solid tumors. Cancer. 1992; 70(5):
112 CARSON SD, PIRRUCCELLO SJ. Tissue factor and cell morphology variations in cell lines subcloned from U87-MG. Blood Coagul Fibrinolysis. 1998; 9(6): COUGHLIN SR. Protease-activated receptors in hemostasis, thrombosis and vascular biology. J Thromb Haemost. 2005; 3(8): DAHLBÄCK B. Blood coagulation and its regulation by anticoagulant pathways: genetic pathogenesis of bleeding and thrombotic diseases. J Intern Med. 2005; 257(3): DAVIE EW, KULMAN JD. An overview of the structure and function of thrombin. Semin Thromb Hemost. 2006; 32 Suppl 1:3-15. DAVIE EW, RATNOFF OD. Waterfall sequence for intrinsic blood clotting. Science. 1964; 145: DE CICCO M. The prothrombotic state in cancer: pathogenic mechanisms. Crit Rev Oncol Hematol. 2004; 50(3): DONATI MB. Cancer and thrombosis: from Phlegmasia alba dolens to transgenic mice. Thromb Haemost. 1995; 74(1): DONATI MB, LORENZET R. The role of blood clotting in tumor metastasis: A case for tissue factor. In: LUGASSY G, FALANGA A, KAKKAR AK, RICKLES FR. Thrombosis and Cancer. London, United Kingdom, Taylor and Francis Group. 2004; DONNELLY KM, BROMBERG ME, MILSTONE A, MADISON MCNIFF JM, TERWILLIGER G, KONIGSBERG WH, ET AL. Ancylostoma caninum anticoagulant peptide blocks metastasis in vivo and inhibits factor Xa binding to melanoma cells in vitro. Thromb Haemost 1998;79: DOYLE D. Thomas Addis of Edinburgh ( ) and the coagulation cascade: 'for the greatest benefit done to practical medicine'. Br J Haematol. 2006; 132(3): DVORAK HF, ORENSTEIN NS, CARVALHO AC, CHURCHILL WH, DVORAK AM, GALLI SJ, FEDER J, BITZER AM, RYPYSC J, GIOVINCO P. Induction of a fibrin-gel investment: an early event in line 10 hepatocarcinoma growth mediated by tumor-secreted products. J Immunol. 1979; 122(1): ESMON CT. Regulation of blood coagulation. Biochim Biophys Acta. 2000; 1477(1-2): EVEN-RAM S, UZIELY B, COHEN P, GRISARU-GRANOVSKY S, MAOZ M, GINZBURG Y, REICH R, VLODAVSKY I, BAR-SHAVIT R. Thrombin receptor overexpression in malignant and physiological invasion processes. Nat Med. 1998; 4(8): FALANGA A. Thrombophilia in cancer. Semin Thromb Hemost. 2005; 31(1): FALANGA A, CONSONNI R, MARCHETTI M, LOCATELLI G, GARATTINI E, PASSERINI CG, GORDON SG, BARBUI T. Cancer procoagulant and tissue factor are differently modulated by all-trans-retinoic acid in acute promyelocytic leukemia cells. Blood. 1998; 92(1):
113 FALANGA A, CONSONNI R, MARCHETTI M, MIELICKI WP, RAMBALDI A, LANOTTE M, GORDON SG, BARBUI T. Cancer procoagulant in the human promyelocytic cell line NB4 and its modulation by all-trans-retinoic acid. Leukemia. 1994; 8(1): FERNANDES RS, KIRSZBERG C, RUMJANEK VM, MONTEIRO RQ. On the molecular mechanisms for the highly procoagulant pattern of C6 glioma cells. J Thromb Haemost. 2006; 4(7): FERNANDEZ PM, PATIERNO SR, RICKLES FR. Tumor Angiogenesis and blood coagulation. In: LUGASSY G, FALANGA A, KAKKAR AK, RICKLES FR. Thrombosis and Cancer. London, United Kingdom, Taylor and Francis Group. 2004; FISCHER EG, RUF W, MUELLER BM. Tissue factor-initiated thrombin generation activates the signaling thrombin receptor on malignant melanoma cells. Cancer Res. 1995; 55(8): FÖRSTER Y, MEYE A, ALBRECHT S, KOTZSCH M, FUSSEL S, WIRTH MP, SCHWENZER B. Tissue specific expression and serum levels of human tissue factor in patients with urological cancer. Cancer Lett. 2003; 193(1): FÖRSTER Y, MEYE A, ALBRECHT S, SCHWENZER B. Tissue factor and tumor: clinical and laboratory aspects. Clin Chim Acta. 2006; 364(1-2): FRANCIS JL, BIGGERSTAFF J, AMIRKHOSRAVI A. Hemostasis and malignancy. Semin Thromb Hemost. 1998; 24(2): FRANCO RF. Fisiologia da coagulação, anticoagulação e fibrinólise. Medicina, Ribeirão Preto, 2001; 34: FURIE B, FURIE BC. Cancer-associated thrombosis. Blood Cells Mol Dis. 2006; 36(2): GRAND RJ, TURNELL AS, GRABHAM PW. Cellular consequences of thrombin-receptor activation. Biochem J. 1996; 313 ( Pt 2): GUAN M, JIN J, SU B, LIU WW, LU Y. Tissue factor expression and angiogenesis in human glioma. Clin Biochem. 2002; 35(4): HAIR GA, PADULA S, ZEFF R, SCHMEIZL M, CONTRINO J, KREUTZER DL, DE MOERLOOSE P, BOYD AW, STANLEY I, BURGESS AW, RICKLES FR. Tissue factor expression in human leukemic cells. Leuk Res. 1996; 20(1):1-11. HAMADA K, KURATSU J, SAITOH Y, TAKESHIMA H, NISHI T, USHIO Y. Expression of tissue factor correlates with grade of malignancy in human glioma. Cancer. 1996; 77(9): HAMATAKE M, IGUCHI K, HIRANO K, ISHIDA R. Zinc induces mixed types of cell death, necrosis, and apoptosis, in Molt-4 Cells. J Biochem (Tokyo). 2000; 128(6):
114 HAZARIKA P, MCCARTY MF, PRIETO VG, GEORGE S, BABU D, KOUL D, BAR-ELI M, DUVIC M. Up-regulation of Flotillin-2 is associated with melanoma progression and modulates expression of the thrombin receptor protease activated receptor 1. Cancer Res. 2004; 4(20): HOFFMAN M, MONROE DM 3rd. A cell-based model of hemostasis. Thromb Haemost. 2001; 85(6): HOFFMAN M. Remodeling the blood coagulation cascade. J Thromb Thrombolysis. 2003; 16(1-2): HOFFMAN R, HAIM N, BRENNER B. Cancer and thrombosis revisited. Blood Rev. 2001; 15(2):61-7. ISHIMARU K, HIRANO H, YAMAHATA H, TAKESHIMA H, NIIRO M, KURATSU J. The expression of tissue factor correlates with proliferative ability in meningioma. Oncol Rep. 2003; 10(5): KALAFATIS M, SWORDS NA, RAND MD, MANN KG. Membrane-dependent reactions in blood coagulation: role of the vitamin K-dependent enzyme complexes. Biochim Biophys Acta. 1994; 1227(3): KAKKAR AK, LEMOINE NR, SCULLY MF, TEBBUTT S, WILLIAMSON RC. Tissue factor expression correlates with histological grade in human pancreatic cancer. Br J Surg. 1995; 82(8): KELLER T, SALGE U, KONIG H, DODT J, HEIDEN M, SEITZ R. Tissue factor is the only activator of coagulation in cultured human lung cancer cells. Lung Cancer. 2001; 31(2-3):171-9 LEVI M, VAN DER POLL T, BULLER HR. Bidirectional relation between inflammation and coagulation. Circulation. 2004; 109(22): LIU J, SCHUFF-WERNER P, STEINER M. Thrombin/thrombin receptor (PAR-1)-mediated induction of IL-8 and VEGF expression in prostate cancer cells. Biochem Biophys Res Commun. 2006; 343(1): LIU Y, MUELLER BM. Protease-activated receptor-2 regulates vascular endothelial growth factor expression in MDA-MB-231 cells via MAPK pathways. Biochem Biophys Res Commun. 2006; 344(4): LORETO MF, DE MARTINIS M, CORSI MP, MODESTI M, GINALDI L. Coagulation and cancer: implications for diagnosis and management. Pathol Oncol Res. 2000;6(4): LWALEED BA, COOPER AJ. Tissue factor expression and multidrug resistance in cancer: two aspects of a common cellular response to a hostile milieu. Med Hypotheses. 2000; 55(6): MACFARLANE RG. An enzyme cascade in the blood clothing mechanism, and its function as a biochemicak amplifier. Nature. 1964; 202:
115 MACFARLANE SR, SEATTER MJ, KANKE T, HUNTER GD, PLEVIN R. Proteinase-activated receptors. Pharmacol Rev. 2001; 53(2): MACKMAN N. Role of tissue factor in hemostasis and thrombosis. Blood Cells Mol Dis. 2006; 36(2): MAIOLO A, TUA A, GRIGNANI G. Hemostasis and cancer: tumor cells induce the expression of tissue factor-like procoagulant activity on endothelial cells. Haematologica. 2002; 87(6): MANDALA M, FERRETTI G, CREMONESI M, CAZZANIGA M, CURIGLIANO G, BARNI S. Venous thromboembolism and cancer: new issues for an old topic. Crit Rev Oncol Hematol 2003; 48(1): MANN KG, BUTENAS S, BRUMMEL K. The dynamics of thrombin formation. Arterioscler Thromb Vasc Biol. 2003; 23(1): MANN KG. Biochemistry and physiology of blood coagulation. Thromb Haemost. 1999; 82(2): MANN KG.. Thrombin formation. Chest. 2003; 124(3 Suppl):4S-10S. MARI B, GUERIN S, FAR DF, BREITMAYER JP, BELHACENE N, PEYRON JF, ROSSI B, AUBERGER P. Thrombin and trypsin-induced Ca(2+) mobilization in human T cell lines through interaction with different protease-activated receptors. FASEB J. 1996; 10(2): MARTINEZ J, BARSIGIAN C. Coagulophaty of liver failure and vitamin K deficiency. In: LOSCALZO J, SCHAFER AI. Thrombosis and Hemorrhage. 3ª edição. Philadelphia, PA, USA, Lippincott Williams & Wilkins. 2003; 40: 808. MONROE DM, HOFFMAN M E ROBERTS HR. Platelets and thrombin generation. Arterioscler Thromb Vasc Biol. 2002; 22(9): MONROE DM, HOFFMAN M. What does it take to make the perfect clot? Arterioscler Thromb Vasc Biol. 2006; 26(1):41-8. MORRIS DR, DING Y, RICKS TK, GULLAPALLI A, WOLFE BL, TREJO J. Protease-activated receptor-2 is essential for factor VIIa and Xa-induced signaling, migration, and invasion of breast cancer cells. Cancer Res. 2006; 66(1): MORRISSEY JH. Tissue factor: an enzyme cofactor and a true receptor. Thromb Haemost. 2001; 86(1): MUELLER BM, REISFELD RA, EDGINGTON TS, RUF W. Expression of tissue factor by melanoma cells promotes efficient hematogenous metastasis. Proc Natl Acad Sci U S A. 1992; 89(24): MUELLER BM, RUF W. Requirement for binding of catalytically active factor VIIa in tissue factor-dependent experimental metastasis. J Clin Invest. 1998; 101(7):
116 NIERODZIK ML, CHEN K, TAKESHITA K, LI JJ, HUANG YQ, FENG XS, D'ANDREA MR, ANDRADE-GORDON P, KARPATKIN S. Protease-activated receptor 1 (PAR-1) is required and rate-limiting for thrombin-enhanced experimental pulmonary metastasis. Blood. 1998; 92(10): NIERODZIK ML, PLOTKIN A, KAJUMO F, KARPATKIN S. Thrombin stimulates tumor-platelet adhesion in vitro and metastasis in vivo. J Clin Invest. 1991; 87(1): NISHIBORI M, MORI S, TAKAHASHI HK. Physiology and pathophysiology of proteinaseactivated receptors (PARs): PAR-2-mediated proliferation of colon cancer cell. J Pharmacol Sci. 2005; 97(1): ORFEO T, BUTENAS S, BRUMMEL-ZIEDINS KE E MANN KG. The tissue factor requirement in blood coagulation. J Biol Chem. 2005; 280(52): OSSOVSKAYA VS, BUNNETT NW. Protease-activated receptors: contribution to physiology and disease. Physiol Rev. 2004; 84(2): ØSTERUD B, BJØRKLID E. Sources of tissue factor. Semin Thromb Hemost. 2006; 32(1): PICCIOLI A, PRANDONI P. Risk of cancer in patients presenting with venous thromboembolism. In: LUGASSY G, FALANGA A, KAKKAR AK, RICKLES FR. Thrombosis and Cancer. London, United Kingdom, Taylor and Francis Group. 2004; PICKERING W, GRAY E, GOODALL AH, RAN S, THORPE PE, BARROWCLIFFE TW. Characterization of the cell-surface procoagulant activity of T-lymphoblastoid cell lines. J Thromb Haemost. 2004; 2(3): PRANDONI P, LENSING AW, BULLER HR, COGO A, PRINS MH, CATTELAN AM, CUPPINI S, NOVENTA F, TEN CATE JW. Deep-vein thrombosis and the incidence of subsequent symptomatic cancer. N Engl J Med. 1992; 327(16): PRINS M, OTTEN HM. Thrombosis and Cancer: a short history of Trousseau s syndrome. In: LUGASSY G, FALANGA A, KAKKAR AK, RICKLES FR. Thrombosis and Cancer. London, United Kingdom, Taylor and Francis Group. 2004; RAK J, MILSOM C, MAY L, KLEMENT P, YU J. Tissue factor in cancer and angiogenesis: the molecular link between genetic tumor progression, tumor neovascularization, and cancer coagulopathy. Semin Thromb Hemost. 2006; 32(1): RAO LV, PENDURTHI UR. Tissue factor-factor VIIa signaling. Arterioscler Thromb Vasc Biol. 2005; 25(1): RICKLES FR, EDWARDS RL. Activation of blood coagulation in cancer: Trousseau's syndrome revisited. Blood. 1983; 62(1): RICKLES FR, FALANGA A. Molecular basis for the relationship between thrombosis and cancer. Thromb Res. 2001; 102(6):V
117 99 RICKLES FR, LEVINE MN. Epidemiology of thrombosis in cancer. Acta Haematol. 2001; 106(1-2):6-12. RICKLES FR, PATIERNO S, FERNANDEZ PM. Tissue factor, thrombin, and cancer. Chest. 2003; 124(3 Suppl):58S-68S. ROBERTS HR, HOFFMAN M, MONROE DM. A cell-based model of thrombin generation. Semin Thromb Hemost Apr;32 Suppl 1:32-8. SAKAI T, NOGUCHI M, KISIEL W. Tumor cells augment the factor Xa-catalyzed conversion of prothrombin to thrombin. Haemostasis 1990; 20: SAMBRANO GR, WEISS EJ, ZHENG YW, HUANG W, COUGHLIN SR. Role of thrombin signalling in platelets in haemostasis and thrombosis. Nature. 2001; 413(6851):74-8. SILBERBERG JM, GORDON S, ZUCKER S. Identification of tissue factor in two human pancreatic cancer cell lines. Cancer Res. 1989; 49(19): SOLUM NO. Procoagulant expression in platelets and defects leading to clinical disorders. Arterioscler Thromb Vasc Biol. 1999; 19(12): SØRENSEN HT, MELLEMKJAER L, OLSEN JH, BARON JA. Prognoses of cancer associated with venous thromboembolism. N Engl J Med. 2000; 343(25): SPEK CA. Tissue factor: from 'just one of the coagulation factors' to a major player in physiology. s7(o)1.1((i)(5( d)14.c.4(oagu)6o)1.1((i.8( )11F(s714.6(i)5(b7(er)84.6(i)5(.7()-8.2gu)6o)1.1((i(phy24.6(i)5( Res)]TJ/TT2 1 (o)176800
118 VOET D, VOET JG. Molecular physiology. In: Voet D, Voet JG. Biochemistry. 3ª edição. United States of America, Willey International Edition, Seção VOURET-CRAVIARI V, VAN OBBERGHEN-SCHILLING E, RASMUSSEN UB, PAVIRANI A, LECOCQ JP, POUYSSEGUR J. Synthetic alpha-thrombin receptor peptides activate G protein-coupled signaling pathways but are unable to induce mitogenesis. Mol Biol Cell. 1992; 3(1): WANG X, WANG M, AMARZGUIOUI M, LIU F, FODSTAD O, PRYDZ H. Downregulation of tissue factor by RNA interference in human melanoma LOX-L cells reduces pulmonary metastasis in nude mice. Int J Cancer. 2004; 112(6): WANG X, WANG E, KAVANAGH JJ, FREEDMAN RS. Ovarian cancer, the coagulation pathway, and inflammation. J Transl Med. 2005; 3:25. WOJTUKIEWICZ MZ, RUCINSKA M, ZACHARSKI LR, KOZLOWSKI L, ZIMNOCH L, PIOTROWSKI Z, KUDRYK BJ, KISIEL W. Localization of blood coagulation factors in situ in pancreatic carcinoma. Thromb Haemost. 2001; 86(6): WOJTUKIEWICZ MZ, TANG DG, CIARELLI JJ, NELSON KK, WALZ DA, DIGLIO CA, MAMMEN EF, HONN KV. Thrombin increases the metastatic potential of tumor cells. Int J Cancer. 1993; 54(5): YIN YJ, SALAH Z, GRISARU-GRANOVSKY S, COHEN I, EVEN-RAM SC, MAOZ M, UZIELY B, PERETZ T, BAR-SHAVIT R. Human protease-activated receptor 1 expression in malignant epithelia: a role in invasiveness. Arterioscler Thromb Vasc Biol. 2003; 23(6): YU JL, MAY L, LHOTAK V, SHAHRZAD S, SHIRASAWA S, WEITZ JI, COOMBER BL, MACKMAN N, RAK JW. Oncogenic events regulate tissue factor expression in colorectal cancer cells: implications for tumor progression and angiogenesis. Blood. 2005; 105(4): YU JL, RAK JW. Shedding of tissue factor (TF)-containing microparticles rather than alternatively spliced TF is the main source of TF activity released from human cancer cells. J Thromb Haemost. 2004; 2(11): ZAIN J, HUANG YQ, FENG X, NIERODZIK ML, LI JJ, KARPATKIN S. Concentrationdependent dual effect of thrombin on impaired growth/apoptosis or mitogenesis in tumor cells. Blood. 2000; 95(10): ZHANG Y, DENG Y, LUTHER T, MULLER M, ZIEGLER R, WALDHERR R, STERN DM, NAWROTH PP. Tissue factor controls the balance of angiogenic and antiangiogenic properties of tumor cells in mice. J Clin Invest. 1994; 94(3): ZHOU JN, LJUNGDAHL S, SHOSHAN MC, SWEDENBORG J, LINDER S. Activation of tissue-factor gene expression in breast carcinoma cells by stimulation of the RAF-ERK signaling pathway. Mol Carcinog. 1998; 21(4):
119 ZWAAL RF, COMFURIUS P, BEVERS EM. Lipid-protein interactions in blood coagulation. Biochim Biophys Acta. 1998; 1376(3): ZWAAL RF, COMFURIUS P, BEVERS EM. Surface exposure of phosphatidylserine in pathological cells. Cell Mol Life Sci. 2005; 62(9):
120 102 Anexos
121 Anexo 1 Assembly and regulation of prothrombinase complex on B16F10 melanoma cells Artigo publicado na Thrombosis Research (2005) 115: Autores: Kirszberg, C.; Rumjanek, V.M.; Monteiro, R.Q. 103
122 104
123 105
124 106
125 107
126 108
127 109
128 110
129 111 Anexo 2 On the molecular mechanisms for the highly procoagulant pattern of C6 glioma cells. Artigo publicado no Journal of Thrombosis and Haemostasis, 4: Autores: Fernandes, R.S.; Kirszberg, C.; Rumjanek, V.M.; Monteiro, R.Q.
130 112
131 113
132 114
133 115
134 116
135 117
136 118
Profa. Dra. Larissa Gorayb F Mota
 HEMOSTASIA & COAGULAÇÃO Profa. Dra. Larissa Gorayb F Mota HEMOSTASIA Fenômeno fisiológico, dinâmico: mantém o sangue fluido no interior dos vasos e impede sua saída para os tecidos(trombose e hemorragia)
HEMOSTASIA & COAGULAÇÃO Profa. Dra. Larissa Gorayb F Mota HEMOSTASIA Fenômeno fisiológico, dinâmico: mantém o sangue fluido no interior dos vasos e impede sua saída para os tecidos(trombose e hemorragia)
HEMOSTASIA E COAGULAÇÃO. Instituto de Hematologia e Oncologia Curitiba
 HEMOSTASIA E COAGULAÇÃO Instituto de Hematologia e Oncologia Curitiba 1.Petéquias: DISTÚRBIOS DA COAGULAÇÃO O PACIENTE QUE SANGRA alteração dos vasos ou plaquetas 2.Equimoses, melena, hematúria, hematêmese,
HEMOSTASIA E COAGULAÇÃO Instituto de Hematologia e Oncologia Curitiba 1.Petéquias: DISTÚRBIOS DA COAGULAÇÃO O PACIENTE QUE SANGRA alteração dos vasos ou plaquetas 2.Equimoses, melena, hematúria, hematêmese,
HEMOSTASIA. Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria
 HEMOSTASIA Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria HEMOSTASIA PRIMÁRIA Divisões da hemostasia primária alteração no calibre
HEMOSTASIA Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria HEMOSTASIA PRIMÁRIA Divisões da hemostasia primária alteração no calibre
Trombocitopenia induzida pela heparina
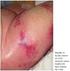 Trombocitopenia induzida pela heparina Novembro 2012 ULSM Hospital Pedro Hispano, Matosinhos Distinguir Terapêutica curta duração: Profilática Emergência Heparina via parentérica Heparinas baixo peso molecular
Trombocitopenia induzida pela heparina Novembro 2012 ULSM Hospital Pedro Hispano, Matosinhos Distinguir Terapêutica curta duração: Profilática Emergência Heparina via parentérica Heparinas baixo peso molecular
SANGUE PLAQUETAS HEMOSTASIA
 SANGUE PLAQUETAS HEMOSTASIA Fisiologia Molecular BCT 2S/2011 Universidade Federal de São Paulo EPM/UNIFESP DISTÚRBIOS RELACIONADOS ÀS HEMÁCEAS CASO 1: Paciente portador de úlcera péptica Diagnóstico: Anemia
SANGUE PLAQUETAS HEMOSTASIA Fisiologia Molecular BCT 2S/2011 Universidade Federal de São Paulo EPM/UNIFESP DISTÚRBIOS RELACIONADOS ÀS HEMÁCEAS CASO 1: Paciente portador de úlcera péptica Diagnóstico: Anemia
Distúrbios da Coagulação
 Distúrbios da Coagulação Hemofilias HEMOFILIAS Doenças hemorrágicas resultantes da deficiência quantitativa e/ou qualitativa do fator VIII ou fator IX da coagulação Genética (cromossomo X) / adquirida
Distúrbios da Coagulação Hemofilias HEMOFILIAS Doenças hemorrágicas resultantes da deficiência quantitativa e/ou qualitativa do fator VIII ou fator IX da coagulação Genética (cromossomo X) / adquirida
AS VANTAGENS DO NOVO MODELO DA CASCATA DE COAGULAÇÃO BASEADO NAS SUPERFÍCIES CELULARES
 AS VANTAGENS DO NOVO MODELO DA CASCATA DE COAGULAÇÃO BASEADO NAS SUPERFÍCIES CELULARES Rassan Dyego Romão Silva, Antonio Jose Dias Martins e Bruna Rezende Faculdade Alfredo Nasser Aparecida de Goiânia
AS VANTAGENS DO NOVO MODELO DA CASCATA DE COAGULAÇÃO BASEADO NAS SUPERFÍCIES CELULARES Rassan Dyego Romão Silva, Antonio Jose Dias Martins e Bruna Rezende Faculdade Alfredo Nasser Aparecida de Goiânia
Fármacos Anticoagulantes, Trombolíticos e Antiplaquetários
 Fármacos Anticoagulantes, Trombolíticos e Antiplaquetários COAGULAÇÃO SANGUÍNEA A coagulação sanguínea trata-se de uma serie de castas enzimáticas que vão se ativando gradativamente e aumentando os fatores
Fármacos Anticoagulantes, Trombolíticos e Antiplaquetários COAGULAÇÃO SANGUÍNEA A coagulação sanguínea trata-se de uma serie de castas enzimáticas que vão se ativando gradativamente e aumentando os fatores
AULA-7 PROCESSO DE HEMOSTASIA
 AULA-7 PROCESSO DE HEMOSTASIA Profª Tatiani UNISALESIANO PROCESSO DE HEMOSTASIA- COAGULAÇÃO DO SANGUE Toda vez que ocorre ferimento e extravasamento de sangue dos vasos, imediatamente são desencadeados
AULA-7 PROCESSO DE HEMOSTASIA Profª Tatiani UNISALESIANO PROCESSO DE HEMOSTASIA- COAGULAÇÃO DO SANGUE Toda vez que ocorre ferimento e extravasamento de sangue dos vasos, imediatamente são desencadeados
INTRODUÇÃO À HEMOSTASIA. Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria
 INTRODUÇÃO À HEMOSTASIA Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Hemostasia A hemostasia compreende as interações que ocorrem
INTRODUÇÃO À HEMOSTASIA Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Hemostasia A hemostasia compreende as interações que ocorrem
AVALIAÇÃO LABORATORIAL DOS DISTÚRBIOS DE COAGULAÇÃO HEMOSTASIA
 AVALIAÇÃO LABORATORIAL DOS DISTÚRBIOS DE COAGULAÇÃO HEMOSTASIA 1- Componente Vascular Endotélio íntegro: impede a adesão das plaquetas Lesão Vascular: Vasoconstrição mediada por via reflexa (reduz o fluxo
AVALIAÇÃO LABORATORIAL DOS DISTÚRBIOS DE COAGULAÇÃO HEMOSTASIA 1- Componente Vascular Endotélio íntegro: impede a adesão das plaquetas Lesão Vascular: Vasoconstrição mediada por via reflexa (reduz o fluxo
Hemostasia: Princípios Gerais Liga de Hematologia da Bahia Aula Inaugural Thaizza Correia
 Hemostasia: Princípios Gerais Liga de Hematologia da Bahia Aula Inaugural 2012.2 Thaizza Correia Princípios Gerais Limita a perda de sangue interações da parede vascular, plaquetas e proteínas plasmáticas
Hemostasia: Princípios Gerais Liga de Hematologia da Bahia Aula Inaugural 2012.2 Thaizza Correia Princípios Gerais Limita a perda de sangue interações da parede vascular, plaquetas e proteínas plasmáticas
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Sysmex Educational Enhancement & Development
 Sysmex Educational Enhancement & Development SEED-África Boletim Informativo No 4 Abril de 2010 Introdução à coagulação O objectivo deste boletim informativo é o de proporcionar à equipa laboratorial uma
Sysmex Educational Enhancement & Development SEED-África Boletim Informativo No 4 Abril de 2010 Introdução à coagulação O objectivo deste boletim informativo é o de proporcionar à equipa laboratorial uma
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS. Enzimas. Prof. Me. Cássio Resende de Morais
 FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
FISIOLOGIA DA COAGULAÇÃO, ANTICOAGULAÇÃO E FIBRINÓLISE
 Medicina, Ribeirão Preto, Simpósio: HEMOSTASIA E TROMBOSE 34: 229-237, jul./dez. 2001 Capítulo I FISIOLOGIA DA COAGULAÇÃO, ANTICOAGULAÇÃO E FIBRINÓLISE OVERVIEW OF COAGULATION, ANTICOAGULATION AND FIBRINOLYSIS
Medicina, Ribeirão Preto, Simpósio: HEMOSTASIA E TROMBOSE 34: 229-237, jul./dez. 2001 Capítulo I FISIOLOGIA DA COAGULAÇÃO, ANTICOAGULAÇÃO E FIBRINÓLISE OVERVIEW OF COAGULATION, ANTICOAGULATION AND FIBRINOLYSIS
-Separar fisicamente as substâncias trombogênicas subendoteliais do sangue.
 Hemostasia A hemostasia é a manutenção da homeostasia do sistema sanguíneo. Isso consiste na interrupção fisiológica de hemorragias, evitando perdas de sangue e lesões vasculares, e também na manutenção
Hemostasia A hemostasia é a manutenção da homeostasia do sistema sanguíneo. Isso consiste na interrupção fisiológica de hemorragias, evitando perdas de sangue e lesões vasculares, e também na manutenção
DIVISÃO DE LABORATÓRIO CENTRAL HC FMUSP PARAMETRIZAÇÃO DE COLETA. Data criação: 22/02/2010 Data aprovação: 31/05/2012. Numero da versão: 03
 Tempo de Sangramento IVY (NÃO ESTÁ SENDO REALIZADO) Vide observação. Contagem de Plaquetas (manual) 1 tubo de EDTA Temperatura ambiente, até 5 horas da coleta. Para 24 horas, armazenar a 4 C Tempo de Protrombina
Tempo de Sangramento IVY (NÃO ESTÁ SENDO REALIZADO) Vide observação. Contagem de Plaquetas (manual) 1 tubo de EDTA Temperatura ambiente, até 5 horas da coleta. Para 24 horas, armazenar a 4 C Tempo de Protrombina
DIVISÃO DE LABORATÓRIO CENTRAL HC FMUSP PARAMETRIZAÇÃO DE COLETA
 Contagem de Plaquetas (manual) Temperatura, até 5 horas da coleta. Para 24 horas, armazenar a 4 C De 2ª à 6ª feira das 07hs às 15hs. Tempo de Protrombina (TP) Tempo de Tromboplastina Parcial Ativado (TTPA)
Contagem de Plaquetas (manual) Temperatura, até 5 horas da coleta. Para 24 horas, armazenar a 4 C De 2ª à 6ª feira das 07hs às 15hs. Tempo de Protrombina (TP) Tempo de Tromboplastina Parcial Ativado (TTPA)
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios
 Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
Resposta inicial que, em muitos casos, impede a infecção do hospedeiro podendo eliminar os micróbios Células da imunidade inata (macrófagos e neutrófilos) chegam rapidamente e em grande número no foco
Fisiologia celular I. Fisiologia Prof. Msc Brunno Macedo
 celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
celular I celular I Objetivo Conhecer os aspectos relacionados a manutenção da homeostasia e sinalização celular Conteúdo Ambiente interno da célula Os meios de comunicação e sinalização As bases moleculares
DIVISÃO DE LABORATÓRIO CENTRAL HC FMUSP PARAMETRIZAÇÃO DE COLETA
 LABORATÓRIO DE HEMOSTASIA - 1º andar Sala 57 - Fone 3061 5544 PABX. 6099 - Ramal 332-287 - 202 Tempo de Sangramento IVY (NÃO ESTÁ SENDO REALIZADO) Vide observação. Contagem de Plaquetas (manual) 1 tubo
LABORATÓRIO DE HEMOSTASIA - 1º andar Sala 57 - Fone 3061 5544 PABX. 6099 - Ramal 332-287 - 202 Tempo de Sangramento IVY (NÃO ESTÁ SENDO REALIZADO) Vide observação. Contagem de Plaquetas (manual) 1 tubo
São moléculas catalíticas protéicas (exceto algumas que são RNA) - Prefixo que designa a reação: lactato desidrogenase, catalase
 1 5 Enzimas a) Conceito - O que são enzimas? São moléculas catalíticas protéicas (exceto algumas que são RNA) - Moléculas que aumentam a velocidade de reações sem se alterarem neste processo. - Catalisam
1 5 Enzimas a) Conceito - O que são enzimas? São moléculas catalíticas protéicas (exceto algumas que são RNA) - Moléculas que aumentam a velocidade de reações sem se alterarem neste processo. - Catalisam
I Curso de Choque Faculdade de Medicina da UFMG INSUFICIÊNCIA DE MÚLTIPLOS ÓRGÃOS MODS
 I Curso de Choque Faculdade de Medicina da UFMG INSUFICIÊNCIA DE MÚLTIPLOS ÓRGÃOS MODS Alterações Hematológicas Anatomia. Circulação. Distribuição. Função. Adaptação x Disfunção. Alterações Hematológicas
I Curso de Choque Faculdade de Medicina da UFMG INSUFICIÊNCIA DE MÚLTIPLOS ÓRGÃOS MODS Alterações Hematológicas Anatomia. Circulação. Distribuição. Função. Adaptação x Disfunção. Alterações Hematológicas
Aspectos gerais da estrutura celular
 Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
Ciclo celular Aspectos gerais da estrutura celular A célula é a unidade básica da vida Altamente organizada, dividida em compartimentos As células surgem de outras células préexistentes As células são
FARMACODINÂMICA. da droga. Componente da célula c. (ou organismo) que interage com a droga e
 FARMACODINÂMICA Prof. Carlos Cezar I. S. Ovalle Princípio básicob A droga deve se ligar a um constituinte celular (proteína - alvo) para produzir uma resposta farmacológica. Proteínas alvos para ligação
FARMACODINÂMICA Prof. Carlos Cezar I. S. Ovalle Princípio básicob A droga deve se ligar a um constituinte celular (proteína - alvo) para produzir uma resposta farmacológica. Proteínas alvos para ligação
Terapia Ocupacional. Fisilogia
 Curso: Terapia Ocupacional Disciplina: Fisilogia Aula: Membrana Plasmática Profº. Ms. Rafael Palhano Fedato rafapalha@gmail.com Membrana Plasmática ou Membrana celular É uma dupla camada de lipídios com
Curso: Terapia Ocupacional Disciplina: Fisilogia Aula: Membrana Plasmática Profº. Ms. Rafael Palhano Fedato rafapalha@gmail.com Membrana Plasmática ou Membrana celular É uma dupla camada de lipídios com
Embriologia (BMH120) - Biologia Noturno. Aula 1
 Embriologia (BMH120) - Biologia Noturno Aula 1 Introdução das Bases Moleculares e Celulares: Sinalização Intracelular Prof. Rodrigo A. P. Martins ICB - LaNCE - HUCFF - UFRJ Objetivos Ao final desta aula
Embriologia (BMH120) - Biologia Noturno Aula 1 Introdução das Bases Moleculares e Celulares: Sinalização Intracelular Prof. Rodrigo A. P. Martins ICB - LaNCE - HUCFF - UFRJ Objetivos Ao final desta aula
Importância dos processos de sinalização. Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases)
 Sinalização celular Importância dos processos de sinalização Seres unicelulares Seres multicelulares Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases) Receptores Proteínas -
Sinalização celular Importância dos processos de sinalização Seres unicelulares Seres multicelulares Moléculas sinalizadoras (proteínas, peptídeos, aminoácidos, hormônios, gases) Receptores Proteínas -
Fisiologia das Plaquetas
 Fisiologia das Plaquetas Definição Funções Origem/Formação = Trombocitopoese Estrutura: 4 regiões Não Activadas e Activadas Participação na Hemostase Caso: Plasma Rico em Plaquetas Componentes do Sangue
Fisiologia das Plaquetas Definição Funções Origem/Formação = Trombocitopoese Estrutura: 4 regiões Não Activadas e Activadas Participação na Hemostase Caso: Plasma Rico em Plaquetas Componentes do Sangue
Resposta imune adquirida do tipo celular
 Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune adquirida do tipo celular Profa. Dra. Silvana Boeira Imunidade adquirida Imunidade adaptativa = específica = adquirida
Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune adquirida do tipo celular Profa. Dra. Silvana Boeira Imunidade adquirida Imunidade adaptativa = específica = adquirida
Aspectos Moleculares da Inflamação:
 Patologia Molecular Lucas Brandão Aspectos Moleculares da Inflamação: os mediadores químicos inflamatórios Inflamação São uma série de eventos programados que permitem com que Leucócitos e outras proteínas
Patologia Molecular Lucas Brandão Aspectos Moleculares da Inflamação: os mediadores químicos inflamatórios Inflamação São uma série de eventos programados que permitem com que Leucócitos e outras proteínas
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros
 Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
PROTEÍNAS Professores: Manoela e Marco Aurélio 2017
 PROTEÍNAS Professores: Manoela e Marco Aurélio 2017 Bioquímica Celular Elementos químicos da matéria viva Principais substâncias presentes na matéria viva Proteínas - Nutriente construtor (função plástica)
PROTEÍNAS Professores: Manoela e Marco Aurélio 2017 Bioquímica Celular Elementos químicos da matéria viva Principais substâncias presentes na matéria viva Proteínas - Nutriente construtor (função plástica)
Plaquetas e hemostasia. Cláudia Minazaki
 Plaquetas e hemostasia Cláudia Minazaki Plaquetas Corpúsculos anucleados em forma de disco Derivados dos MEGACARIÓCITOS (fragmentos citoplasmáticos) Plaquetas Funções: Manutenção da integridade vascular
Plaquetas e hemostasia Cláudia Minazaki Plaquetas Corpúsculos anucleados em forma de disco Derivados dos MEGACARIÓCITOS (fragmentos citoplasmáticos) Plaquetas Funções: Manutenção da integridade vascular
O SANGUE HUMANO. Professora Catarina
 O SANGUE HUMANO Professora Catarina SANGUE Principais funções: Transportar O 2 e nutrientes a todas as células do corpo; Recolher CO 2 e excreções; Transportar hormônios; Proteger o corpo contra a invasão
O SANGUE HUMANO Professora Catarina SANGUE Principais funções: Transportar O 2 e nutrientes a todas as células do corpo; Recolher CO 2 e excreções; Transportar hormônios; Proteger o corpo contra a invasão
ANTICOAGULANTES, TROMBOLÍTICOS E ANTIPLAQUETÁRIOS
 ANTICOAGULANTES, TROMBOLÍTICOS E ANTIPLAQUETÁRIOS Alguns pacientes são propensos a ter hipercoagulabilidade, ou seja, formar trombos de forma patológica. São pacientes que normalmente apresentam doenças
ANTICOAGULANTES, TROMBOLÍTICOS E ANTIPLAQUETÁRIOS Alguns pacientes são propensos a ter hipercoagulabilidade, ou seja, formar trombos de forma patológica. São pacientes que normalmente apresentam doenças
Profº Lásaro Henrique
 Profº Lásaro Henrique Proteínas são macromoléculas complexas, compostas de aminoácidos. São os constituintes básicos da vida e necessárias para os processos químicos que ocorrem nos organismos vivos. Nos
Profº Lásaro Henrique Proteínas são macromoléculas complexas, compostas de aminoácidos. São os constituintes básicos da vida e necessárias para os processos químicos que ocorrem nos organismos vivos. Nos
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR
 FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
FISIOLOGIA E TRANSPORTE ATRAVÉS DA MEMBRANA CELULAR AULA 2 DISCIPLINA: FISIOLOGIA I PROFESSOR RESPONSÁVEL: FLÁVIA SANTOS Membrana Celular ou Membrana Plasmática Função 2 Membrana Celular ou Membrana Plasmática
INFLAMAÇÃO. Prof a Adriana Azevedo Prof. Archangelo P. Fernandes Processos Patológicos Gerais
 INFLAMAÇÃO Prof a Adriana Azevedo Prof. Archangelo P. Fernandes Processos Patológicos Gerais Para quê serve? A INFLAMAÇÃO é uma resposta do tecido à lesão, ela procura conter e isolar a lesão e preparar
INFLAMAÇÃO Prof a Adriana Azevedo Prof. Archangelo P. Fernandes Processos Patológicos Gerais Para quê serve? A INFLAMAÇÃO é uma resposta do tecido à lesão, ela procura conter e isolar a lesão e preparar
Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula.
 Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
Aula 01 Composição química de uma célula O que é uma célula? Vamos iniciar o estudo da unidade fundamental que constitui todos os organismos vivos: a célula. Toda célula possui a capacidade de crescer,
MACRONUTRIENTES III PROTEÍNAS
 MACRONUTRIENTES III PROTEÍNAS 1 PROTEÍNAS As proteínas são compostos orgânicos de estrutura complexa e massa molecular elevada, elas são sintetizadas pelos organismos vivos através da condensação de um
MACRONUTRIENTES III PROTEÍNAS 1 PROTEÍNAS As proteínas são compostos orgânicos de estrutura complexa e massa molecular elevada, elas são sintetizadas pelos organismos vivos através da condensação de um
Profº André Montillo
 Profº André Montillo www.montillo.com.br Sistema Imunológico Simples: Não Antecipatório / Inespecífico Sistema Imune Antígeno Específico: Antecipatório Sistema Imunológico Simples: Não Antecipatório /
Profº André Montillo www.montillo.com.br Sistema Imunológico Simples: Não Antecipatório / Inespecífico Sistema Imune Antígeno Específico: Antecipatório Sistema Imunológico Simples: Não Antecipatório /
Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos
 UNIVERSIDADE DE SÃO PAULO USP FARMÁCIA BIOQUÍMICA 015N Reatividade de Compostos Orgânicos II Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos Beatriz In Soon Chang (9328183) João Gabriel
UNIVERSIDADE DE SÃO PAULO USP FARMÁCIA BIOQUÍMICA 015N Reatividade de Compostos Orgânicos II Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos Beatriz In Soon Chang (9328183) João Gabriel
Princípios. Gerais da Fisiologia Endócrina. Diego Veras Wilke
 Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
Princípios Gerais da Fisiologia Endócrina Diego Veras Wilke Claude Bernard: pai da endocrinologia Endocrinologia estudo das secreções internas do organismos. Sistema Endócrino e Homeostasia: Os hormônios
Enzimas. Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini
 Enzimas Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Enzimas Proteínas especializadas em catalisar reações biológicas, ou seja aumentam a velocidade
Enzimas Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Enzimas Proteínas especializadas em catalisar reações biológicas, ou seja aumentam a velocidade
COAGULOPATIAS NO PACIENTE ONCOLÓGICO. Dra Carmen Helena Vasconcellos Hospital Veterinário Botafogo - RJ
 COAGULOPATIAS NO PACIENTE ONCOLÓGICO Dra Carmen Helena Vasconcellos Hospital Veterinário Botafogo - RJ HEMOSTASIA Conjunto de mecanismos que visa manter a fluidez do sangue no interior dos vasos no sistema
COAGULOPATIAS NO PACIENTE ONCOLÓGICO Dra Carmen Helena Vasconcellos Hospital Veterinário Botafogo - RJ HEMOSTASIA Conjunto de mecanismos que visa manter a fluidez do sangue no interior dos vasos no sistema
Proteínas II. (Enzimas) Bioquímica Prof. Dr. Marcelo Soares
 Proteínas II (Enzimas) Conceitos Gerais e Funções As enzimas são proteínas especializadas na catálise de reações biológicas Consideradas as biomoléculas mais notáveis devido a sua extraordinária especificidade
Proteínas II (Enzimas) Conceitos Gerais e Funções As enzimas são proteínas especializadas na catálise de reações biológicas Consideradas as biomoléculas mais notáveis devido a sua extraordinária especificidade
HEMOSTASIA E COAGULAÇÃO SANGUÍNEA NEA
 Universidade Federal do Ceará Faculdade de Medicina Departamento de Fisiologia e Farmacologia HEMOSTASIA E COAGULAÇÃO SANGUÍNEA NEA Davi Matthews Jucá Hemostasia Hemostasia: (Do gr. Haimostasis) Ação ou
Universidade Federal do Ceará Faculdade de Medicina Departamento de Fisiologia e Farmacologia HEMOSTASIA E COAGULAÇÃO SANGUÍNEA NEA Davi Matthews Jucá Hemostasia Hemostasia: (Do gr. Haimostasis) Ação ou
Membranas Biológicas
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Membranas Biológicas Prof Karine P. Naidek Outubro/2016 Membranas Biológicas Membranas
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular
 Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
Mecanismos bio-moleculares responsáveis pela captação e interpretação dos sinais do meio externo e interno comunicação celular Transferência citoplasmática direta de sinais elétricos e químicos Como as
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR. Sinalização Celular SALVADOR - BA 2016
 UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
UNIVERSIDADE ESTADUAL DA BAHIA - UNEB DEPARTAMENTO DE CIÊNCIAS DA VIDA DCV CCS006 - BIOLOGIA CELULAR Sinalização Celular PROFª POLYANNA CARÔZO DE OLIVEIRA SALVADOR - BA 2016 Introdução Evolução da multicelularidade
ENGENHARIA TECIDUAL. Prof. Flávio F. Demarco
 ENGENHARIA TECIDUAL Prof. Flávio F. Demarco Nor, 2006 ENGENHARIA TECIDUAL Fatores morfogênicos (fatores de crescimento) Definição Fatores de crescimento são proteínas solúveis que atuam como agentes de
ENGENHARIA TECIDUAL Prof. Flávio F. Demarco Nor, 2006 ENGENHARIA TECIDUAL Fatores morfogênicos (fatores de crescimento) Definição Fatores de crescimento são proteínas solúveis que atuam como agentes de
Introdução às Práticas Laboratoriais em Imunologia. Prof. Helio José Montassier
 Introdução às Práticas Laboratoriais em Imunologia Prof. Helio José Montassier Principais preparações antigênicas usadas em atividades experimentais em imunologia: Antígenos particulados: apresentam dimensão
Introdução às Práticas Laboratoriais em Imunologia Prof. Helio José Montassier Principais preparações antigênicas usadas em atividades experimentais em imunologia: Antígenos particulados: apresentam dimensão
Função proteica envolve a ligação reversível com outras moléculas O ligante se liga na proteína e um sítio específico, chamado SÍTIO DE LIGAÇÃO.
 Estrutura Função 1. Função proteica envolve a ligação reversível com outras moléculas. A molécula que se liga reversivelmente à proteina LIGANTE 2. O ligante se liga na proteína e um sítio específico,
Estrutura Função 1. Função proteica envolve a ligação reversível com outras moléculas. A molécula que se liga reversivelmente à proteina LIGANTE 2. O ligante se liga na proteína e um sítio específico,
Complexo Principal de Histocompatibilidade. Alessandra Barone
 Complexo Principal de Histocompatibilidade Alessandra Barone MHC Complexo principal de histocompatibilidade (MHC) ou antígeno leucocitário humano (HLA) Conjunto de proteínas associadas a membrana celular
Complexo Principal de Histocompatibilidade Alessandra Barone MHC Complexo principal de histocompatibilidade (MHC) ou antígeno leucocitário humano (HLA) Conjunto de proteínas associadas a membrana celular
Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras
 Sinalização celular Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras Etapas da Sinalização 1) Síntese e liberação da molécula sinalizadora pela célula sinalizadora
Sinalização celular Cada célula é programada para responder a combinações específicas de moléculas sinalizadoras Etapas da Sinalização 1) Síntese e liberação da molécula sinalizadora pela célula sinalizadora
Imunidade Humoral. Células efectoras: Linfócitos B. (Imunoglobulinas)
 Imunidade Humoral Células efectoras: Linfócitos B (Imunoglobulinas) Determinantes antigénicos Também conhecidos como epítopos, são porções do antigénio que reúnem aspectos físicos e químicos que favorecem
Imunidade Humoral Células efectoras: Linfócitos B (Imunoglobulinas) Determinantes antigénicos Também conhecidos como epítopos, são porções do antigénio que reúnem aspectos físicos e químicos que favorecem
O sangue e seus constituintes. Juliana Aquino. O sangue executa tantas funções que, sem ele, de nada valeria a complexa organização do corpo humano
 O sangue e seus constituintes Juliana Aquino O sangue executa tantas funções que, sem ele, de nada valeria a complexa organização do corpo humano O sangue e seus constituintes É através da circulação sanguínea
O sangue e seus constituintes Juliana Aquino O sangue executa tantas funções que, sem ele, de nada valeria a complexa organização do corpo humano O sangue e seus constituintes É através da circulação sanguínea
Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III
 Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III A maioria das cadeias polipeptídicas naturais contém entre 50 e 2.000 aminoácidos e são comumente referidas como proteínas. Peptídeos
Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III A maioria das cadeias polipeptídicas naturais contém entre 50 e 2.000 aminoácidos e são comumente referidas como proteínas. Peptídeos
Resposta imune inata (natural ou nativa)
 Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune inata (natural ou nativa) Profa. Dra. Silvana Boeira Acreditou-se por muitos anos que a imunidade inata fosse inespecífica
Universidade Federal do Pampa Campus Itaqui Curso de Nutrição Imunologia Resposta imune inata (natural ou nativa) Profa. Dra. Silvana Boeira Acreditou-se por muitos anos que a imunidade inata fosse inespecífica
Estrutura e função dos anticorpos. Alessandra Barone
 Estrutura e função dos anticorpos Alessandra Barone Estrutura e função dos anticorpos Anticorpos Glicoproteínas produzidas e excretadas por plasmócitos derivadas dos linfócitos B após exposição a antígenos
Estrutura e função dos anticorpos Alessandra Barone Estrutura e função dos anticorpos Anticorpos Glicoproteínas produzidas e excretadas por plasmócitos derivadas dos linfócitos B após exposição a antígenos
Sinalização Celular e Alvos Farmacológicos
 Final do século XVII Mecanismo de ação dos fármacos ainda era impedido pela ausência de métodos para a purificação dos princípios ativos e pela falta de método para a o teste de hipótese a respeito da
Final do século XVII Mecanismo de ação dos fármacos ainda era impedido pela ausência de métodos para a purificação dos princípios ativos e pela falta de método para a o teste de hipótese a respeito da
Plaquetas 1) CARACTERÍSTICAS DAS PLAQUETAS 10/4/2017. Thais Schwarz Gaggini. 1) Características das plaquetas; 2) Função; 3) Trombocitopoiese;
 Plaquetas Thais Schwarz Gaggini Médica Veterinária, Msc., Dra. CONTEÚDOS DE AULA 1) Características das plaquetas; 2) Função; 3) Trombocitopoiese; 4) Hemostasia; 5) Alterações da hemostasia; 1) CARACTERÍSTICAS
Plaquetas Thais Schwarz Gaggini Médica Veterinária, Msc., Dra. CONTEÚDOS DE AULA 1) Características das plaquetas; 2) Função; 3) Trombocitopoiese; 4) Hemostasia; 5) Alterações da hemostasia; 1) CARACTERÍSTICAS
Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula!
 Aula: 20 Temática: Funções bioquímicas das proteínas parte II Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula! 1) Mediadores e reguladores metabólicos (continuação):
Aula: 20 Temática: Funções bioquímicas das proteínas parte II Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula! 1) Mediadores e reguladores metabólicos (continuação):
São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas.
 São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas. Proteínas possuem muitas funções dentro do organismo. Aminoácidos
São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas. Proteínas possuem muitas funções dentro do organismo. Aminoácidos
SAÚDE & CIÊNCIA EM AÇÃO Revista Acadêmica do Instituto de Ciências da Saúde A ATUAL TEORIADACOAGULAÇÃO BASEADA EM SUPERFÍCIES CELULARES
 79 A ATUAL TEORIADACOAGULAÇÃO BASEADA EM SUPERFÍCIES CELULARES Rassan Dyego Romão Silva 1 Érico Meirelles de Melo 2 RESUMO: Embora o conceito da cascata da coagulação tenha representado um modelo bemsucedido
79 A ATUAL TEORIADACOAGULAÇÃO BASEADA EM SUPERFÍCIES CELULARES Rassan Dyego Romão Silva 1 Érico Meirelles de Melo 2 RESUMO: Embora o conceito da cascata da coagulação tenha representado um modelo bemsucedido
OBJETIVOS BIBLIOGRAFIA ENZIMAS E INIBIDORES ENZIMÁTICOS
 OBJETIVOS Enzimas: Funções, Nomenclatura e Propriedades Fundamentos da Cinética Enzimática Cinética Enzimática: Michaelis-Menten Ensaios Cinéticos: Padronização e Validação Parâmetros Cinéticos: vo, KM,
OBJETIVOS Enzimas: Funções, Nomenclatura e Propriedades Fundamentos da Cinética Enzimática Cinética Enzimática: Michaelis-Menten Ensaios Cinéticos: Padronização e Validação Parâmetros Cinéticos: vo, KM,
Predição de modificações em proteínas
 Predição de modificações em proteínas Modificações de proteína Ao representarmos uma proteína como uma seqüência de caracteres representando os seus aminoácidos (estrutura primaria) estamos representando
Predição de modificações em proteínas Modificações de proteína Ao representarmos uma proteína como uma seqüência de caracteres representando os seus aminoácidos (estrutura primaria) estamos representando
19 de Agosto de Professor Fernando Pretti. Hemostasia. Definição É a interrupção da hemorragia no local da lesão vascular.
 19 de Agosto de 2008. Professor Fernando Pretti. Hemostasia Definição É a interrupção da hemorragia no local da lesão vascular. Deve-se inibir a trombose fora do local da lesão vascular. Hemostasia é o
19 de Agosto de 2008. Professor Fernando Pretti. Hemostasia Definição É a interrupção da hemorragia no local da lesão vascular. Deve-se inibir a trombose fora do local da lesão vascular. Hemostasia é o
Introdução. Estrutura dos Aminoácidos e Proteínas. Aminoácidos componentes de proteínas. Aminoácidos componentes de proteínas 10/02/2012.
 Introdução Estrutura dos Aminoácidos e Prof. Dr. Bruno Lazzari de Lima : Componentes celulares mais importantes. Diversidade de forma e função. Estruturais. Enzimáticas. Transportadoras. Ex.: Insulina,
Introdução Estrutura dos Aminoácidos e Prof. Dr. Bruno Lazzari de Lima : Componentes celulares mais importantes. Diversidade de forma e função. Estruturais. Enzimáticas. Transportadoras. Ex.: Insulina,
BIOLOGIA - 1 o ANO MÓDULO 50 TECIDO SANGUÍNEO
 BIOLOGIA - 1 o ANO MÓDULO 50 TECIDO SANGUÍNEO Adenoide Tonsila Nódulos linfáticos Timo Células dos tecidos Capilar sanguíneo Baço Nódulos de Peyer Apêndice Capilar linfático Fluído intertical intercelular
BIOLOGIA - 1 o ANO MÓDULO 50 TECIDO SANGUÍNEO Adenoide Tonsila Nódulos linfáticos Timo Células dos tecidos Capilar sanguíneo Baço Nódulos de Peyer Apêndice Capilar linfático Fluído intertical intercelular
Metabolismo de aminoácidos de proteínas
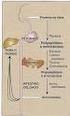 Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 12.09.2012 1 Introdução As proteínas são a segunda maior fonte de estocagem de energia no corpo; O maior estoque de proteínas
Metabolismo de aminoácidos de proteínas Profa Dra Mônica Santos de Freitas 12.09.2012 1 Introdução As proteínas são a segunda maior fonte de estocagem de energia no corpo; O maior estoque de proteínas
Enzimas - Sítio catalítico
 Enzimas - Sítio catalítico Significado de cofator, grupo prostético e coenzima Enzima holozima Grupo prostético metal cofator coenzima Distinção entre cofator e coenzima depende da força de ligação com
Enzimas - Sítio catalítico Significado de cofator, grupo prostético e coenzima Enzima holozima Grupo prostético metal cofator coenzima Distinção entre cofator e coenzima depende da força de ligação com
TECIDO HEMATOPOIÉTICO E SANGUÍNEO
 TECIDO HEMATOPOIÉTICO E SANGUÍNEO CARACTERÍSTICAS Denomina-se hematopoiese o processo de formação dos elementos figurados do sangue; A hematopoiese antes do nascimento ocorre no saco vitelínico do embrião
TECIDO HEMATOPOIÉTICO E SANGUÍNEO CARACTERÍSTICAS Denomina-se hematopoiese o processo de formação dos elementos figurados do sangue; A hematopoiese antes do nascimento ocorre no saco vitelínico do embrião
Proteínas São macromoléculas complexas, compostas de aminoácidos, e necessárias para os processos químicos que ocorrem nos organismos vivos
 Proteínas São macromoléculas complexas, compostas de aminoácidos, e necessárias para os processos químicos que ocorrem nos organismos vivos São os constituintes básicos da vida: tanto que seu nome deriva
Proteínas São macromoléculas complexas, compostas de aminoácidos, e necessárias para os processos químicos que ocorrem nos organismos vivos São os constituintes básicos da vida: tanto que seu nome deriva
Universidade Federal Fluminense Resposta do hospedeiro às infecções virais
 Universidade Federal Fluminense Resposta do hospedeiro às infecções virais Disciplina de Virologia Departamento de Microbiologia e Parasitologia (MIP) Mecanismos de resposta inespecífica Barreiras anatômicas
Universidade Federal Fluminense Resposta do hospedeiro às infecções virais Disciplina de Virologia Departamento de Microbiologia e Parasitologia (MIP) Mecanismos de resposta inespecífica Barreiras anatômicas
Cinética enzimática. Cinética enzimática. Cinética enzimática 20/03/2012. Classificação sistemática das enzimas
 Processo enzimático mais antigo conhecido é o da fermentação da glicose até etanol leveduras. (Pasteur, 1850). Enzima grego na levedura (Pasteur, 1877). Isolamento de todas as enzimas associadas a fermentação
Processo enzimático mais antigo conhecido é o da fermentação da glicose até etanol leveduras. (Pasteur, 1850). Enzima grego na levedura (Pasteur, 1877). Isolamento de todas as enzimas associadas a fermentação
Olfato e visão. Dependem de GPCRs!!
 Sinalização celular Olfato e visão Dependem de GPCRs!! Olfato e Visão Dependem de GPCRs que regulam canais iônicos controlados por AMPc/GMPc Humanos: distinguem ~350 grupos odorantes (sinais) Detecção
Sinalização celular Olfato e visão Dependem de GPCRs!! Olfato e Visão Dependem de GPCRs que regulam canais iônicos controlados por AMPc/GMPc Humanos: distinguem ~350 grupos odorantes (sinais) Detecção
INTRODUÇÃO Á BIOQUÍMICA
 INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
Constituintes químicos dos seres vivos
 REVISÃO Bioquímica Constituintes químicos dos seres vivos S A I S I N O R G Â N I C O S CARBOIDRATOS São denominados: açúcares, hidratos de carbono, glicídios ou glicosídeos Energia para o trabalho celular
REVISÃO Bioquímica Constituintes químicos dos seres vivos S A I S I N O R G Â N I C O S CARBOIDRATOS São denominados: açúcares, hidratos de carbono, glicídios ou glicosídeos Energia para o trabalho celular
Disciplina Biologia Celular. Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA
 Disciplina Biologia Celular Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA Aula 4: Bases Macromoleculares da Constituição Celular Bio Cel Profª Cristina Introdução Células
Disciplina Biologia Celular Profª Cristina Lacerda Soares Petrarolha Silva Curso de Agronomia FISMA / FEA Aula 4: Bases Macromoleculares da Constituição Celular Bio Cel Profª Cristina Introdução Células
Proteínas. Professora: Luciana Ramalho 2017
 Proteínas Professora: Luciana Ramalho 2017 Introdução Também chamados de Peptídeo As proteínas são macromoléculas orgânicas formadas pela sequência de vários aminoácidos, unidos por ligações peptídicas
Proteínas Professora: Luciana Ramalho 2017 Introdução Também chamados de Peptídeo As proteínas são macromoléculas orgânicas formadas pela sequência de vários aminoácidos, unidos por ligações peptídicas
Resposta Imunológica celular. Alessandra Barone
 Resposta Imunológica celular Alessandra Barone Resposta mediada pelos linfócitos T: TCD4 e TCD8 Resposta contra microrganismos que estão localizados no interior de fagócitos e de células não fagocíticas
Resposta Imunológica celular Alessandra Barone Resposta mediada pelos linfócitos T: TCD4 e TCD8 Resposta contra microrganismos que estão localizados no interior de fagócitos e de células não fagocíticas
Membrana Plasmática. Dra. Maria Izabel Gallão
 Membrana Plasmática Composição química A composição química das membranas oscila em torno dos valores médios de 60% de proteínas e 40% de lipídios. Associados às proteínas e os lipídios encontram-se açúcares,
Membrana Plasmática Composição química A composição química das membranas oscila em torno dos valores médios de 60% de proteínas e 40% de lipídios. Associados às proteínas e os lipídios encontram-se açúcares,
INTRODUÇÃO À BIOQUÍMICA DA CÉLULA. Bioquímica Celular Prof. Júnior
 INTRODUÇÃO À BIOQUÍMICA DA CÉLULA Histórico INTRODUÇÃO 1665: Robert Hooke Compartimentos (Células) 1840: Theodor Schwann Teoria Celular 1. Todos os organismos são constituídos de uma ou mais células 2.
INTRODUÇÃO À BIOQUÍMICA DA CÉLULA Histórico INTRODUÇÃO 1665: Robert Hooke Compartimentos (Células) 1840: Theodor Schwann Teoria Celular 1. Todos os organismos são constituídos de uma ou mais células 2.
ESTUDO DA CASCATA DE COAGULAÇÃO SANGÜÍNEA E SEUS VALORES DE REFERÊNCIA
 ESTUDO DA CASCATA DE COAGULAÇÃO SANGÜÍNEA E SEUS VALORES DE REFERÊNCIA [Study of blood coagulation cascade and the reference values] Maria Marília Leite Carlos 1,*, Polyanna Dantas Fernandes de Sousa Freitas
ESTUDO DA CASCATA DE COAGULAÇÃO SANGÜÍNEA E SEUS VALORES DE REFERÊNCIA [Study of blood coagulation cascade and the reference values] Maria Marília Leite Carlos 1,*, Polyanna Dantas Fernandes de Sousa Freitas
Farmacoterapia do Sistema Hematopoiético. Prof. Dr. Marcelo Polacow Bisson
 Farmacoterapia do Sistema Hematopoiético Prof. Dr. Marcelo Polacow Bisson Aspectos Importantes da Coagulação São três os fatores importantes para coagulação: Parede do vaso Atividade plaquetária Fatores
Farmacoterapia do Sistema Hematopoiético Prof. Dr. Marcelo Polacow Bisson Aspectos Importantes da Coagulação São três os fatores importantes para coagulação: Parede do vaso Atividade plaquetária Fatores
DISFUNÇÕES HEMODINÂMICAS
 Cursos de Graduação em Farmácia e Enfermagem DISFUNÇÕES HEMODINÂMICAS PARTE 2 Disciplina: Patologia Geral http://lucinei.wikispaces.com Prof.Dr. Lucinei Roberto de Oliveira 2012 DISFUNÇÕES HEMODINÂMICAS
Cursos de Graduação em Farmácia e Enfermagem DISFUNÇÕES HEMODINÂMICAS PARTE 2 Disciplina: Patologia Geral http://lucinei.wikispaces.com Prof.Dr. Lucinei Roberto de Oliveira 2012 DISFUNÇÕES HEMODINÂMICAS
Resposta Imune Humoral Dr. Carlos R Prudencio
 Resposta Imune Humoral Dr. Carlos R Prudencio O Sistema Imune e os agentes infecciosos Técnicas sorológicas e de biologia molecular no diagnóstico de agentes infecciosos Órgãos do sistema linfóide Introdução:
Resposta Imune Humoral Dr. Carlos R Prudencio O Sistema Imune e os agentes infecciosos Técnicas sorológicas e de biologia molecular no diagnóstico de agentes infecciosos Órgãos do sistema linfóide Introdução:
Aula: Histologia II. Sangue e linfa. Funções de hemácias, plaquetas e leucócitos.
 Sangue e linfa. Funções de hemácias, plaquetas e leucócitos. PROFESSORA: Brenda Braga DATA: 10/04/2014 7. Tecidos Conjuntivos de Transporte 7.1. Sangue Centrifugação 55 % Plasma 45 % Elementos figurados
Sangue e linfa. Funções de hemácias, plaquetas e leucócitos. PROFESSORA: Brenda Braga DATA: 10/04/2014 7. Tecidos Conjuntivos de Transporte 7.1. Sangue Centrifugação 55 % Plasma 45 % Elementos figurados
Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 ANTÍGENOS
 Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 ANTÍGENOS Monitor: Alessandro Almeida Sumário 1 Definições...1
Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 ANTÍGENOS Monitor: Alessandro Almeida Sumário 1 Definições...1
Fisiologia Endócrina
 Fisiologia Endócrina Profa. Letícia Lotufo Claude Bernard: pai da endocrinologia Definiu o termo milieu intérieur Endocrinologia estudo das secreções internas do organismos. 1 Sistema Endócrino e Homeostasia
Fisiologia Endócrina Profa. Letícia Lotufo Claude Bernard: pai da endocrinologia Definiu o termo milieu intérieur Endocrinologia estudo das secreções internas do organismos. 1 Sistema Endócrino e Homeostasia
ENZIMAS. Dra. Flávia Cristina Goulart. Bioquímica
 ENZIMAS Dra. Flávia Cristina Goulart Bioquímica ENZIMAS CONCEITO: São proteínas que catalisam reações químicas diferentes no organismo. Como proteínas, elas são moléculas grandes, constituídas de 20 AA.
ENZIMAS Dra. Flávia Cristina Goulart Bioquímica ENZIMAS CONCEITO: São proteínas que catalisam reações químicas diferentes no organismo. Como proteínas, elas são moléculas grandes, constituídas de 20 AA.
AVALIAÇÃO LABORATORIAL DA HEMOSTASIA
 AVALIAÇÃO LABORATORIAL DA HEMOSTASIA Disciplina LCV UESP Araçatuba Prof.Adjunto Paulo César Ciarlini MEGACARIOPOESE IL-3; IL-6; G-CSF; GM-CSF HEMOSTASIA Vaso + Plaquetas + Fatores de Coagulação Fibrinogênio
AVALIAÇÃO LABORATORIAL DA HEMOSTASIA Disciplina LCV UESP Araçatuba Prof.Adjunto Paulo César Ciarlini MEGACARIOPOESE IL-3; IL-6; G-CSF; GM-CSF HEMOSTASIA Vaso + Plaquetas + Fatores de Coagulação Fibrinogênio
Proteínas catalisadoras que AUMENTAM a VELOCIDADE das reações, sem sofrerem alterações no processo global.
 ENZIMAS Proteínas catalisadoras que AUMENTAM a VELOCIDADE das reações, sem sofrerem alterações no processo global. Toda enzima é uma proteína, mas nem toda proteína é uma enzima! CARACTERÍSTICAS GERAIS:
ENZIMAS Proteínas catalisadoras que AUMENTAM a VELOCIDADE das reações, sem sofrerem alterações no processo global. Toda enzima é uma proteína, mas nem toda proteína é uma enzima! CARACTERÍSTICAS GERAIS:
Introdução à Bioquímica Celular
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Introdução à Bioquímica Celular Prof. Msc. Macks Wendhell Gonçalves mackswendhell@gmail.com O que é Biologia Celular? É o ramo da ciência
Pontifícia Universidade Católica de Goiás Departamento de Biologia Introdução à Bioquímica Celular Prof. Msc. Macks Wendhell Gonçalves mackswendhell@gmail.com O que é Biologia Celular? É o ramo da ciência
Prof. Me. Anny C. G. Granzoto
 Prof. Me. Anny C. G. Granzoto 1 Ocupa-se do estudo dos efeitos bioquímicos e fisiológicos dos fármacos e seus mecanismos de ação É utilizada para descrever os efeitos de um fármaco no corpo. Tipicamente
Prof. Me. Anny C. G. Granzoto 1 Ocupa-se do estudo dos efeitos bioquímicos e fisiológicos dos fármacos e seus mecanismos de ação É utilizada para descrever os efeitos de um fármaco no corpo. Tipicamente
TÍTULO: USO DO PLASMA SANGUÍNEO EM GEL NA CICATRIZAÇÃO DE FERIDAS CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE
 Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: USO DO PLASMA SANGUÍNEO EM GEL NA CICATRIZAÇÃO DE FERIDAS CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS
Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: USO DO PLASMA SANGUÍNEO EM GEL NA CICATRIZAÇÃO DE FERIDAS CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS
Controle por retroalimentação. Controle negativo
 Controle por retroalimentação Controle negativo Controle por retroalimentação Controle positivo Parto Controle positivo Ejeção do leite Controle por retroalimentação Controle positivo Ovulação Transporte
Controle por retroalimentação Controle negativo Controle por retroalimentação Controle positivo Parto Controle positivo Ejeção do leite Controle por retroalimentação Controle positivo Ovulação Transporte
