DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO (Interpretação da gasometria) Paulo R. Margotto
|
|
|
- Lucas Custódio
- 5 Há anos
- Visualizações:
Transcrição
1 DISTÚRBIOS DO EQUILÍBRIO ÁCIDOBÁSICO (Interpretação da gasometria) Paulo R. Margotto Capítulo do livro Assistência ao RecémNascido de Risco, editado por Paulo R. Margotto, 2 a Edição, 2004 O perfeito equilíbrio entre ácidos e bases depende de uma série de reações que procuram corrigir os desvios da homeostase. A manutenção da concentração de hidrogênio nos líquidos do organismo dentro da estreita faixa de normalidade é essencial para o pleno desenvolvimento das funções biológicas, uma vez que o rendimento das reações bioquímicas depende do ph; esse objetivo é alcançado graças à contribuição de sistemas e órgãos diferentes atuando de maneira conjunta. A concentração normal de hidrogênio (H+) no fluido extracelular é continuamente ameaçada pela carga de íons H+ liberada pelo metabolismo normal. Diariamente o metabolismo acrescenta ao organismo ácidos de duas espécies: voláteis (ácido carbônico) e fixos. Essa carga ácida deverá ser neutralizada com o objetivo de manter o ph e esse trabalho pode ser, didaticamente, dividido em três etapas básicas: ação dos tampões do organismo, regulação respiratória do ph e regulação renal. 1 Sistemas de Tampões: Um par conjugado (ácidobase) capaz de absorver ou doar prótons conforme a necessidade para manter o ph do organismo é um sistema tampão. São quatro os principais tampões: Sistematampão ácido carbônicobicarbonato (45% da capacidade tampão total do sangue) Sistematampão de fosfato (glóbulos vermelhos, células dos túbulos renais) Sistematampão de proteínas (células dos tecidos) Sistematampão de hemoglobina dos glóbulos vermelhos (5% do CO 2 é transportado pelo plasma; 20% pela hemácia como compostos carbamínicos e os 75% restantes circulam no sangue como bicarbonato). O tampão ácido carbônicobicarbonato age da seguinte maneira: os ácidos orgânicos e inorgânicos que se formam durante as atividades metabólicas normais causam a seguinte reação. HCl + NaHCO 3 H 2 CO 3 + NaCl CO 2 + H 2 O Assim, os ácidos não voláteis são tamponados evitando grandes desvios no ph até que haja a excreção renal de ácidos e regeneração dos tampões (vide à frente sobre o mecanismo renal na regulação do ph). Devido à importância do bicarbonato e do CO 2 na regulação do ph, o ph sanguíneo depende da relação bicarbonato/ácido carbônico no plasma e no líquido extracelular. Em condições normais, a relação bicarbonato/ácido carbônico é 20/1 e o ph é 7.4
2 A determinação do ph do sangue é assim feita: EQUAÇÃO DE HENDERSONHASSELBALCH ph = pk + log [ HCO 3 ] [H 2 CO 3 ] Taxa de H 2 CO 3 = 1.20 meq/l. O ÁCIDO CARBÔNICO (H 2 CO 3 ) encontrase no plasma quase todo como gás carbônico (CO 2 ). A proporção é: CO 2 /H 2 CO 3 : 500/1 Ou seja: CO 2 + H 2 O H 2 CO 3 (500) (1) Esta proporção é mantida pela LEI DA AÇÃO DAS MASSAS (a velocidade de uma reação é proporcional à concentração dos reagentes), ou seja, caindo teor de H 2 CO 3, mais CO 2 combinase com a água para restabelecer esta relação e viceversa. Por sua vez a quantidade de CO 2 dissolvida no plasma é função do CO 2 alveolar (paco2: veremos a frente) com o qual se mantém em equilíbrio tensional; a paco 2 (lêse pressão parcial de CO 2 no ar alveolar) é de 40 mmhg, assim como é a paco 2 (lêse: pressão parcial de CO 2 no sangue arterial). A concentração do CO 2 no sangue em meq/l pode ser obtida multiplicando a paco 2 pelo deu índice de solubilidade na água, que é 0.03 e assim temos: [ CO 2 ] ( lêse : concentração do CO 2 ) = paco 2 X 0.03 Assim: [CO 2 ] = 40 X 0.03 = 1.20 meq/l Ora sendo a quantidade de H 2 CO 3 insignificante (a relação CO 2 /H 2 CO 3 é 500) podemos escrever a equação de HENDERSONHASSELBALCH da seguinte maneira: ph = pk + log [ HCO 3 ] paco 2 x 0.03 componente METABÓLICO componente RESPIRATÓRIO NOTA: pk = 6.1 taxa de HCO 3 no plasma (bicarbonato) : 24mEq/l Portanto, temos: ph = log 24 = log 20 = = LOGO: AUMENTANDO O TEOR DE BICARBONATO SANGÜÍNEO OU DIMINUINDO A paco 2, A RELAÇÃO BICARBONATO/H 2 CO 3 AUMENTA E O ph TORNASE MAIOR QUE O NORMAL ( ) : ALCALOSE DIMINUINDO A CONCENTRAÇÃO DE BICARBONATO DO SANGUE OU AUMENTANDO A paco 2, A RELAÇÃO BICARBONATO/H 2 CO 3 DIMINUI E O ph TORNASE MENOR QUE O VALOR NORMAL : ACIDOSE
3 2 Regulação Respiratória do ph Inicialmente, vejamos o que vem a ser pco 2 (lêse: pressão parcial do CO 2 ) : é a pressão que este gás exerceria se ocupasse sozinho todo o recipiente em que se encontra: as ações químicas e fisiológicas de um gás dependem da pressão que este gás exerce. paco 2 : pressão parcial do CO 2 no sangue arterial paco 2 : pressão parcial do CO 2 no ar Alveolar IMPORTÂNCIA da paco 2 : A paco 2 ESPELHA OS ACONTECIMENTOS A NÍVEL ALVEOLAR ; REFLEXO DA FUNÇÃO RESPIRATÓRIA. O CENTRO RESPIRATÓRIO DO BULBO é sensível à: paco 2 pao 2 ph sangüíneo A falta ou excesso de co 2 estimula o centro respiratório (uma paco 2 maior que 65 mmhg: há depressão do SNC (narcose pelo CO 2 ). A freqüência e profundidade dos movimentos respiratórios: são influenciados pelos receptores químicos do arco aórtico e do seio carotídeo. paco 2 (baixa) paco 2 ph INFLUENCIAM Menor que Em torno de 7.0 desaparece hiperventilação GRAU Máximo (fome de ar) A fome de ar NEM SEMPRE ESTÁ PRESENTE EM PACIENTES COM ACIDOSE
4 A paco 2 está em equilíbrio com a paco 2 e esta, em equilíbrio com o teor de ácido carbônico (H 2 CO 3 ). Qualquer elevação da paco 2 causará alteração da paco 2 e no teor de H 2 CO 3. Em condições normais: paco 2 = 40 mmhg COMO AS ALTERAÇÕES PRIMÁRIAS DA CONCENTRAÇÃO DO BICARBONATO DO SANGUE PODEM SER REGULADAS PELOS MECANISMOS RESPIRATÓRIOS? ph = pk + log [ HCO 3 ] paco 2 X 0.03 HCO 3 CENTRO RESPIRATÓRIO Movimentos respiratórios Freqüência ou profundidade RESULTADO PACO 2 (e paco 2 e H 2 CO 3 ) A relação HCO 3 /H 2 CO 3 se mantém ph SE MANTÉM HCO 3 CENRO HCO 3 RESPIRATÓRIO Movimentos respiratórios Freqüência ou profundidade RESULTADO PACO 2 (e paco 2 e H 2 CO 3 ) A relação HCO 3 /H 2 CO 3 se mantém
5 NOTAS: Como a paco 2 O ph SE MANTÉM e teor de H 2 CO 3 no sangue diminuem a despeito de se manter inalterada a freqüência respiratória? A pressão parcial de um gás é inversamente proporcional ao volume em que esteja contido; o volume do pulmão pode aumentar por meio de respirações profundas e, portanto, teremos diminuição da paco 2 a despeito de inalterada a freqüência respiratória. O declínio da paco 2 é predicto pela fórmula : 1.5X HCO 3 plasmático + 8.( para cada 1 meq/l na diminuição do HCO 3 plasmático, a paco 2 diminui 1 a 1.3 mmhg). Para cada aumento de 1 meq/l no HCO 3 plasmático, a paco 2 aumenta mmhg. Para cada 10 mmhg de aumento na paco 2, o HCO 3 diminui de 1(caso agudo) a 3.5 meq/l (caso crônico). Para cada 10 mmhg de diminuição da paco 2, o HCO 3 aumenta de 2 (caso agudo) a 4 meq/l (caso crônico). Voltando à EQUAÇÃO DE HENDERSONHASSELBALCH a nossa linha básica de raciocínio diagnóstico, ninguém estranharia se assim escrevêssemola: ph = 6.1 RIM responsável pela concentração do HCO 3 PULMÃO responsável pela concentração do CO 2 ENQUANTO O PULMÃO manter O RIM manter a concentração do CO 2 a concentração do HCO 3 O ph SERÁ MANTIDO 3 Regulação Renal do ph: O rim compensa o excesso de ácidos produzidos durante o metabolismo normal promovendo a excreção de ácidos e o retorno do bicarbonato ao plasma. O ph urinário é habitualmente ácido (ph: 5.5 a 6.5). Como ocorre esta compensação:
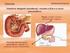
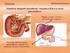
6 1 REABSORÇÃO DO BICARBONATO INTERSTÍCIO CÉLULA TUBULAR LUZ TUBULAR CO 2 AC + H 2 O NaHCO 3 H 2 CO 3 H + HCO 3 ΝaHCO 3 Na+ HCO 3 H 2 CO 3 H 2 O CO 2 Diagrama da permuta de H + pelo Na + do bicarbonato do filtrado urinário. AC: anidrase carbônica. 2 ACIDIFICAÇÃO DOS SAIS TAMPÕES DE FOSFATO: INTERSTÍCIO CÉLULA TUBULAR LUZ TUBULAR Na 2 HPO 4 CO 2 AC + H 2 O H + H 2 CO 3 NaHCO 3 HCO 3 NaHPO 4 Na+ NaH 2 PO 4 DIAGRAMA DA TROCA DE H+ PELO SÓDIO FOSFATO BÁSICO (Na2PO4) do filtrado que desce pelos túbulos do néfron. 3 SECREÇÃO DE AMÔNIA: INTERSTÍCIO CÉLULA TUBULAR LUZ TUBULAR CO 2 AC + H 2 O H 2 CO 3 H + NaCl HCO 3 glutamina NH 3 NaCO 3 NH 4 Na + CL NH 4 Cl DIAGRAMA DO INTERCÂMBIO DE H+ pelo Na+ do cloreto de sódio (NaCl) urinário com a ajuda da amônia (NH 3 ).
7 Em presença de ACIDOSE, estes mecanismos reguladores estão exacerbados: URINA: ph vem a 4.5 excreção de HCO 3 diminui ou desaparece excreção de sais de amônio (NH 4 Cl) aumenta Em presença de ALCALOSE, estes mecanismos reguladores diminuem ou cessam: URINA: ph: 7.8 excreção de HCO 3 aumenta excreção de sais de amônio diminui excreção de Na + e K + aumenta Após termos visto de que meios o organismo lança mão para acalmar H + que não podem vagar livres pelo organismo, é importante que se frise que há um trabalho em CONJUNTO para se conseguir tal objetivo. Acompanhe a seqüência do seguinte raciocínio: INFUSÃO EXPERIMENTAL EV DE SOLUÇÃO DE HCl (ácido clorídrico) 1 ª linha de defesa: sistemas tampões químicos (ação imediata célula: difusão do H + para as células (2 a 4 horas). 2 ª linha de defesa: pulmões, ajuda em 50% (10 a 30 minutos) 3 ª linha de defesa: rins: depende da modificação do intracelular (1 a 2 dias) MEDIDA CLÍNICA DO EQUILÍBRIO ÁCIDO BÁSICO: 1. ph: é o logaritmo do inverso da concentração hidrogeniônica. : portanto, o quanto mais alta for a concentração ph = log 1 hidrogeniônica, mais baixo é o ph (ACIDOSE). H + A determinação do ph deve ser feita o mais rápido possível, devido haver formação de ácido láctico pelo desdobramento da glicose. O valor normal do ph do sangue é 7.35 a IDEAL: 7.4. O ph isoladamente apenas quantifica o fenômeno, não o qualificando. 2. paco2: A pressão parcial do gás carbônico mede a fração dissolvida não combinada do CO 2 total, dependendo basicamente da ventilação pulmonar. VALOR NORMAL: 35 a 45 mmhg. IDEAL: 40 mmhg. No RN < 1500g, sob ventilação mecânica, devese tolerar paco 2 até 55 mmhg (hipercapnia permissiva neonatal). Níveis associados de paco 2 abaixo de 40 mmhg estiveram associados com aumento da doença pulmonar crônica. NÃO ESQUEÇAMOS: A paco 2 espelha a ventilação pulmonar: uma elevação da paco 2 indica hipoventilação e acidose respiratória; uma diminuição da paco 2 indica hiperventilação e alcalose respiratória.
8 BICARBONATO STANDARD E REAL: BICARBONATO REAL: representa a determinação do bicarbonato plasmático quaisquer que sejam os valores de paco 2 do indivíduo. BICARBONATO STANDARD: representação da determinação do bicarbonato plasmático após o sangue ter sido equilibrado a uma paco 2 de 40 mmhg. Havendo acúmulo de CO 2 (acidose respiratória) por comprometimento respiratório, haverá: CO 2 sangue (Hb) + a. c H 2 O H 2 CO 3 H + + HCO 3 + Hb alveolar (na hemácia) HHb+HCO 3 a.c : anidrase carbônica Plasma Qual é a explicação da interdependência entre paco 2 e Bicarbonato? Isto se deve ao efeito tamponante da Hb ( reveja a reação acima), havendo formação de HCO 3 que se difunde para o plasma. Portanto, em indivíduos normais, os valores do bicarbonato standard e bicarbonato real são iguais (ambos medidos a uma paco 2 de 40 mmhg). VALOR NORMAL: 24 meq/l (22 a 26). Nos RN < 1500g, devido ao menor limiar renal de HCO 3 considerar anormal valores abaixo de 14 meq/l. HAVENDO ACÚMULO DE CO 2 O BICARBONATO REAL É MAIOR QUE O STANDARD (fácil de entender; reveja a reação apresentada acima) HAVENDO DIMINUIÇÃO DO CO 2 O BICARBONATO REAL É MENOR QUE O STANDARD (não memorize: correse o risco fatal de tudo cair no labirinto do esquecimento) 3. Excesso de Base (BE): Expressa o que teria de acrescentar (BE NEGATIVO) ou subtrair (BE POSITIVO) de bases para que o organismo mantenha o seu ph, corrigindo a anormalidade. Tem um valor de 0(ZERO) em um ph de 7.4. VALOR NORMAL: 2.5 a (nos RN, se aceita níveis até 8 meq/l) O que significa, por exemplo, um BE = 8? O excesso de ácido mobilizou certa parte do HCO 3 do sistematampão. OU Depleção de líquidos orgânicos ricos em bicarbonato LOGO: Significa queda do bicarbonato com queda do ph (vejam: significa que há 8 meq de base a menos em relação a uma paco 2 de 40 mmhg). 4. pao 2 : a pressão parcial do oxigênio no RN devese manter entre 5070 mmhg. Ao interpretarmos a pao 2, devemos sempre fazêlo com o conhecimento da FiO2. Vejamos a definição de FiO2: é mensurável ou calculável concentração de O 2 distribuída ao paciente. Vimos anteriormente que a HIPOXEMIA é definida como uma pao 2 abaixo do limite aceitável QUANDO O PACIENTE ESTIVER RESPIRANDO AR AMBIENTAL, na qual a FiO2 é 21%. Devemos retirar o O 2 do paciente de modo que possa respirar ar ambiental para realização
9 da gasometria? É lógico que NÃO. Portanto, para interpretar a pao 2, é necessário que conheçamos a interrelação entre pao 2 e FiO2: O AUMENTO DA CONCENTRAÇÃO DE O 2 em 10% SIGNIFICA UM AUMENTO NA pao 2 de 50 mmhg (BASTA MULTIPLICAR A FiO2 por 5). Por exemplo: uma criança com FiO2 de 30%, a pao 2 mínima pressuposta é 150 mmhg (isto é: 30 X 5 = 150 mmhg). Outros utilizam a relação pao 2 = FiO2 X 3. A única informação que a pao 2 nos fornece é a indicação da existência ou não da HIPOXEMIA ARTERIAL; a hipoxemia arterial não assegura a presença de hipoxia tecidual, embora haja esta possibilidade. Lembremos que a hipoxia pode ser a causa de distúrbios ventilatórios e metabólicos. A avaliação do estado hipoxêmico deve seguirse à avaliação das condições ventilatórias e metabólicas. Embora o diagnóstico real de hipoxemia deva ser feito quando o paciente respirar ar ambiente (FiO2 de 21%), A HIPOXEMIA PODE SER AVALIADA QUANDO O PACIENTE ESTIVER RESPIRANDO AR ENRIQUECIDO DE O 2 (daí a importância do conhecimento da FiO2). Assim temos, de acordo com a resposta a administração de oxigênio: HIPOXEMIA NÃO CORRIGIDA: pao 2 MENOR que o limite satisfatório no ar ambiente, apesar do aumento da FiO2. HIPOXEMIA CORRIGIDA: pao 2 MAIOR que o limite mínimo satisfatório no ar ambiente; a oxigenoterapia restituiu a pao 2 a um limite satisfatório; neste caso, a hipoxemia deve existir ao ar ambiente, porque pao 2 está abaixo do nível normal pressuposto para oxigenoterapia HIPOXEMIA EXCESSIVAMENTE CORRIGIDA: pao 2 maior que 100 mmhg com a administração de O 2 ; a hipoxemia deve existir ao ar ambiente, pois a pao 2 não está tão alta quanto se poderia esperar com FiO2 administrada. Nunca interprete o valor da pao 2 sem conhecer a FiO2. Consulte o capítulo Avaliação da Severidade Clínica no RN sob Assistência Respiratória para o cálculo do gradiente alvéoloarterial P(Aa)O 2 e da proporção artérioalveolar pao 2 /pao 2. Uma vez vistos estes parâmetros que a gasometria nos fornece, temos condições de entender os distúrbios do equilíbrio ácidobásico. A faixa normal do ph sanguíneo vai de 7.35 a A faixa extrema compatível com a vida situase entre 6.7 a 7.9 DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BÁSICO ACIDOSE: este termo, embora insatisfatório, é usado para definir o aumento da concentração do íon H + no sangue. O aumento da concentração de H + pode ocorrer em conseqüência de uma alteração respiratória primária (excesso de ácido carbônico): ACIDOSE RESPIRATÓRIA ou de uma alteração metabólica primária (esta pode ser
10 devida a um excesso de ácidos orgânicos ou inorgânicos ou a diminuição de bases do organismo) : ACIDOSE METABÓLICA. ENTÃO TEMOS: ACIDOSE METABÓLICA: presença de excesso de ácido ou perda de base paco 2 NORMAL a relação HCO 3 / H 2 CO 3 o ph RESPIRATÓRIA: acúmulo do CO 2 (acúmulo de H 2 CO 3 ) Devido a hipoventilação a paco 2 a relação HCO 3 / H 2 CO 3 o ph ALCALOSE: termo usado para definir uma concentração de íons H + no sangue inferior ao normal. A diminuição da concentração do H + pode ocorrer em conseqüência de uma alteração respiratória primária (perda de ácido carbônico): ALCALOSE RESPIRATÓRIA ou de uma alteração metabólica primária (aumento do teor de bases ou a perda de ácidos no organismo): ALCALOSE METABÓLICA. ENTÃO TEMOS: ALCALOSE : METABÓLICA: excesso de base ou perda de ácido. paco 2 l da relação HCO 3 / H 2 CO 3 do ph RESPIRATÓRIA: perda de CO 2 (e do H 2 CO 3 ) devido a hiperventilação da paco 2 dar relação CO 3 /H 2 CO 3 ph O que vimos acima (ACIDOSE E ALCALOSE RESPIRATÓRIAS E METABÓLICAS) foram distúrbios descompensados. Como estes distúrbios são compensados ou pelo menos parcialmente compensados pelo organismo? Para isto, basta aplicar a equação de HendersonHasselbalch. Citaremos o que ocorre na acidose metabólica descompensada, como exemplo. Vejamos: acidose metabólica descompensada: queda do ph. (excesso de ácido ou, mais queda da relação HCO 3 /H 2 CO 3 comum na prática pediátrica, ATENÇÃO: paco 2 NORMAL perda de bases)
11 ACIDOSE METABÓLICA COMPENSADA : Equação de HendersonHasselbalch: ph= log HCO 3 H 2 CO 3 queda da paco2 (o pulmão entrou em ação hiperventilando) e assim, queda de H 2 CO 3 e assim. aumento da relação HCO 3 / H 2 CO 3 e o ph se normaliza. Para ficar mais claro: Relação HCO 3 / H 2 CO 3 : 24 = 20 normal 1.2 Acidose metabólica descompensada, temos: 12 = 10 (exemplo: diarréia) 1.2 Acidose metabólica compensada, temos: 12 = Nota: neste exemplo, só comentamos o efeito pulmonar, para fins didáticos; nós sabemos que o pulmão ajuda até 50% e é o que ocorre na grande maioria das vezes na prática, levando então a uma acidose metabólica parcialmente compensada, (o ph, neste caso, não voltaria ao normal). Com este mesmo raciocínio, sempre pensando na Equação de Henderson Hasselbalch, podemos imaginar o que ocorre com os demais outros distúrbios. Portanto, fundamentalmente temos dois tipos de distúrbios do equilíbrio ácidobásico: DISTÚRBIO METABÓLICO ganho ou perda de ácidos ou bases DISTÚRBIO RESPIRATÓRIO diminuição ou aumento da ventilação pulmonar às custas da elevação ou baixa, respectivamente da paco ACIDOSE METABÓLICA As principais causas no RN são: Excesso de produção ou de aporte de H + (anóxia tissular; jejum, erro inato do metabolismo dos glicídeos, proteínas e lipídeos) Deficiente contratilidade do miocárdio (a hipotensão arterial e a acidose metabólica ocorrem em aproximadamente 40% dos RN ventilados, particularmente nas primeiras 24 h de vida e estão associados em quase 50% com deficiente contratilidade do miocárdio, sendo que 90% respondem à dopamina). Alteração na excreção de H + : como na insuficiência renal aguda, acidose tubular renal distal Perda de bicarbonato: diarréia, oclusão intestinal, peritonite, acidose tubular renal proximal
12 Correção: usando a fórmula: meq de HCO 3 = peso x déficit BE x 0.3 ( para 5 ) Diluir em água destilada 1:5 (correr em 2h) 2. ACIDOSE RESPIRATÓRIA: As principais causas no RN estão relacionadas ao pulmão, como síndrome de aspiração meconeal, doença de membrana hialina, broncoespasmo, pneumotórax, edema pulmonar, derrame pleural, depressão do SNC Correção: tratar a causa básica NaHCO 3 : nos casos de acidose metabólica concomitante e com controle das condições ventilatórias. 3.ALCALOSE METABÓLICA No RN, as causas mais comuns são: perda de líquido gástrico pelo vômito (estenose hipertrófica de piloro), condições que expoliam potássio (furosemide) e excesso de NaHCO 3. Correção: tratar a causa básica; dar ao rim condições de excretar o excesso e NaHCO 3 (aporte adequado de cloreto, Na + e K + ). 4.ALCALOSE RESPIRATÓRIA: No RN as principais causas são: encefalite, meningite, febre, doenças pulmonares, localizadas, alterações no SNC, ventilação mecânica. Correção: nos casos de ph > 7.60, está indicado ventilação mecânica com o objetivo de aumentar o espaço morto para reter CO 2 tratar a causa básica. Quanto à relação entre ph e pco 2: para todo aumento de 20 mmhg na paco 2, o ph diminui 0.1 unidade; para toda diminuição de 10 mmhg na paco 2, o ph aumenta 0.1 unidade CORRELAÇÃO ENTRE K + E CÁLCIO E O EQUILÍBRIO ÁCIDOBÁSICO: Na prática, não podemos separar o distúrbio do equilíbrio ácidobásico e o distúrbio hídroeletrolítico. Vejamos a correlação com K + : Se o K + (íon potássio) abandona a célula, outros íons com igual carga elétrica terão de nela penetrar; para cada 3 partes de K + que saem da célula, entrarão 2 partes de Na + (íon sódio) e 1 de H + (íon hidrogênio). A concentração de K + no meio extracelular podese alterar devido às modificações primárias do H + : Relação entre phk + sérico: O aumento ou diminuição de 0.1 unidade do ph causaria alteração de 0.6 meq/l da calemia no sentido oposto. Veja o exemplo: Uma criança com ph de 7.1 e com K + de 4.8 meq/l: qual é o seu K + real? Vejamos: o ph abaixou de 7.4 para 7.1, isto é abaixou 3 vezes 0.1 (ou seja 0.3) e portanto a
13 calemia aumentou de 3 x 0.6 = 1.8. LOGO, o nível sérico real de K + desta nossa criança é: = 3.0 (vejam que ela está em níveis hipocalêmicos: eis a importância do conhecimento deste fato). Como a hipocalemia leva a alcalose metabólica? O paciente pode apresentar hipocalemia secundária a uma terapia diurética, diarréia, hidratação venosa com recolocação inadequada de K +. A hipocalemia pode levar a alcalose metabólica pelo seguinte mecanismo: a célula socorre o extracelular cedendolhe K + e com isso entra na célula Na + e H +. a célula SENTINDOSE ÁCIDA, envia ordens para que o rim ECONOMIZE BASES E ELIMINE o H + e assim o BICARBONATO SANGUÍNEO AUMENTA NO EXTRACELULAR e a urina sai ÁCIDA (ALCALOSE METABÓLICA HIPOCALÊMICA COM URINA PARADOXALMENTE ÁCIDA); chamase paradoxal porque, na vigência da alcalose, era de se esperar que o organismo eliminasse bases e a urina fosse, consequentemente alcalina, isto é, básica. Quanto ao cálcio: A acidose aumenta o fluxo de cálcio do osso para o espaço extracelular, enquanto a alcalose diminui ou reverte este fluxo. Com base na relação homeostática existente entre o equilíbrio ácidobásico e o cálcio, esperase que a correção de acidose através do uso de álcali resulte numa diminuição do cálcio total e do cálcio ionizado. Cada aumento no ph de 0.1 unidade, eqüivale a uma queda na calcemia iônica de 0.46 mg%. III DIFERENÇA DE ANIONTES: ANION GAP A diferença de aniontes é a maneira mais simples de mostrar o acúmulo de aniontes anormais (aniontes residuais ou não medidos: fosfatos, sulfatos, aniontes proteínas de ácidos orgânicos, como o lactato). Fórmula: (Na + + K + ) (HCO 3 + Cl ) VALOR NORMAL: Na presença de acidose metabólica, ânion gap maior que 16 meq/l é altamente predictivo de acidose láctica; ânion gap menor que 8 meq/l é altamente predictivo de ausência de acidose lática; valor entre 816 meq/l não é útil no diagnóstico diferencial de acidose metabólica no RN criticamente doente. Quando há ACIDOSE com uma diferença de aniontes anormal, o valor desta diferença é habitualmente maior que 22 meq/l, como por exemplo, na acidose láctica, em que há acúmulo de lactato não medido na cetoacidose (acúmulo de ácido cetoacético) e etc. COMO INTERPRETAR OS GASES SANGÜÍNEOS DE UM MODO SENSATO E DE FÁCIL RACIOCÍNIO: TRATAMENTO E ÍNDICE DE 95% DE CONFIANÇA Em primeiro lugar o PACIENTE. É imprescindível a história clínica que nos permitirá a formulação de uma explicação dos fatos que desencadearam o quadro em análise. O médico deve usar os valores da gasometria com a descrição do doente. Quando assim ele o faz, será capaz de tratar o seu paciente satisfatoriamente, pois assim, ele não está usando apenas uma medida de alteração ácidobásica. A habilidade do médico está justamente na capacidade de reunir todos os fatos (clínicos e laboratoriais) num conjunto harmônico e lógico. ph : ACIDOSE (o mais comum na clínica) ou ALCALOSE
14 Em seguida, verifiquemos os parâmetros metabólicos (bicarbonato real e o BE) para caracterizarmos, juntamente com os dados clínicos em mente, um distúrbio metabólico. Se todos os dados nos orientam para um distúrbio metabólico, verificamos em seguida a paco 2. paco 2 : nos fornecerá uma idéia de como está sendo a resposta pulmonar. Quando a clínica nos sugere um distúrbio respiratório, analisemos inicialmente a paco 2 (esta mede a magnitude deste distúrbio) e em seguida, os parâmetros metabólicos que refletirão ou não a resposta dos mecanismos compensatórios (raciocinemos em ternos de RINS). Muitas vezes o distúrbio é misto. Veja o exemplo: um doente com uma broncopneumopatia crônica que apresenta, devido uma diarréia, um quadro de acidose metabólica primária; é lógico que o seu aparelho respiratório lesado será incapaz de hiperventilar e assim, eliminar o CO 2 o suficiente para elevar o ph a níveis normais. Assim temos uma acidose metabólica descompensada ou uma acidose metabólica e respiratória. CASOS CLÍNICOS 1.Criança (lactente) com DIARRÉIA e DESIDRATAÇÃO DO II GRAU: ph : 7.20 pco 2 : 25.0 (acidose metabólica parcialmente compensada: HCO 3 : 9.0 é parcial porque o ph não está normal) BE : 17.0 Usando o índice de 95% de confiança para a acidose metabólica (consulte a figura n º.1 no final), veremos que o encontro entre duas linhas traçadas, uma partindo da ordenada (paco 2 ) no nível da paco 2 que marca 25 e a outra da abscissa (Base excess) no nível de 17, darseá dentro das faixas de confiança demonstrando a função pulmonar normal do paciente. 2. Lactente com diarréia + desidratação II grau ph : 7.35 pco 2 :25.0 Acidose metabólica compensada (o ph normalizou HCO 3 : 14.0 às custas da hiperventilação pulmonar) BE : RN em um Respirador: ph : 7.52 O ph é alcalótico; o bicarbonato está normal; esta PCO 2 : 28.0 alcalose só pode ser explicada pela HIPERVEN HCO 3 : 22.0 TILAÇÃO ALVEOLAR e portanto, temos uma BE : +1 ALCALOSE RESPIRATÓRIA DESCOMPENSADA ; observem que nos exemplos 1 e 2, a hiperventilação alveolar é secundária à acidose metabólica. Este paciente apresenta uma alcalose respiratória aguda, por quê aguda? Não houve tempo de entrar em ação os mecanismos renais e como agiriam? Pense na equação de HendersonHasselbalch e veremos que agiriam através da diminuição do bicarbonato de sódio e é exatamente o que vemos no exemplo seguinte, caso o fator causal desta alcalose respiratória persistisse:
15 4. ph : 7.44 pco 2 : 24.0 Agora estamos diante de uma ALCALOSE RES HCO : PIRATÓRIA COMPENSADA. esta compensa BE :6.0 ção foi graças aos mecanismos renais que agiram perdendo bicarbonato. NOTA: se compararmos o exemplo n o 4 e o exemplo n o 2, parece, à primeira vista que são iguais. Realmente, MAS lembremos do doente; são dois pacientes diferentes; um paciente, o n º 2 tem um fator desencadeante primário da acidose metabólica que é a diarréia e a resposta pulmonar é secundária, a esta acidose, ou seja, temos, no paciente n º 2, uma alcalose respiratória SECUNDÁRIA. Já o paciente n º 4: há um fator desencadeante para a hiperventilação (como exemplo escolhemos o fator respiratório) e a queda do bicarbonato foi secundária e então temos uma acidose metabólica SECUNDÁRIA. 5. ph :7.24 Lactente com diarréia + broncopneumonia pco 2 :44.0 ACIDOSE METABÓLICA DESCOMPENSADA HCO 3 : 18.0 ou ACIDOSE RESPIRATÓRIA (veja no índice BE : 7 de 95% de confiança para a acidose metabólica e verá que as linhas encontrarseão bem acima da faixa de confiança).tratase de uma acidose metabólica (história de diarréiaperda de bicarbonato pelas fezes) descompensada (os mecanismos, respiratórios não foram eficientes pelo fato do pulmão estar comprometido. VEJA BEM: há uma acidose respiratória, APESAR do paco 2 estar em nível normal, MAS lembremos que este nível normal corresponderia a um bicarbonato de 22 meq/l e um BE de 2.5 a ph : 7.56 RN em uso de furosemide e com K+ de 2.0 pco 2 : 40.0 ALCALOSE (veja o ph) METABÓLICA (veja HCO 3 : 34.0 o bicarbonato e o BE) DESCOMPENSADA (ve BE : +11 já o ph). A causa é a hipocalemia. Observe que é descompensada porque o ph não está normal; o mecanismo respiratório de compensação ainda não se efetuou e como seria? Pense na Equação de HendersonHasselbalch e verá que a compensação (isto é, a correção do ph) darseá por uma HIPOVENTILAÇÃO. É o que veremos no exemplo seguinte, se o fator desencadeante persistir: 7. ph : 7.44 pco 2 : 65.0 Agora temos uma ALCALOSE METABÓLICA HCO 3 : 34.0 COMPENSADA. BE : Este caso não poderia ser uma ACIDOSE RESPIRATÓRIA COMPENSADA? Poderia, SE NÃO CONHECÊSSEMOS A HISTÓRIA DO NOSSO PACIENTE. Este paciente não tem nenhum fator pulmonar que responsabilize pela hipoventilação e, portanto, esta HIPOVENTILAÇÃO é SECUNDÁRIA à ALCALOSE METABÓLICA DESENCADEADA PELA HIPOPOTASSEMIA. LOGO, NUNCA
16 ESQUEÇA DOS DADOS CLÍNICOS AO ANALISAR UMA GASOMETRIA. AS CONCLUSÕES SERÃO ERRÔNEAS e a TERAPÊUTICA, evidentemente, um FRACASSO. 8. Analisemos agora a seguinte gasometria de um RN prematuro com Doença de Membrana Hialina: ph : 7.11 FIO 2 100% pco 2 : 45.0 Acidose mista (Respiratória em função do po 2 : 48.0 do comprometimento pulmonar e metabólica HCO 3 :10.0 devido a formação de ácido lático pelo meta BE : 13.0 bolismo anaeróbio da glicose consequente à hipoxia) Este bebê apresenta uma hipoxemia não corrigida (pao2 menor que 50 mmhg ) 9. Paciente com história de que ingeriu uma superdosagem de opiáceos gases: PH : 7.16 (indicado respirador) : insuficiência ventilatória pco2 : 85.0 aguda ou ACIDOSE RESPIRATÓRIA DESCOMpO2 : 30.0 PENSADA COM HIPOXEMIA SEVERA NÃO HCO CORRIGIDA ( observe a paco 2 ). Para haver a BE : 3.0 compensação, como agiria o mecanismo renal? Raciocine com a Equação de HendersonHasselbalch: retendo bicarbonato.' 10. Agora vejamos a seguinte gasometria de uma criança que apresenta fibrose pulmonar, por exemplo: ph : 7.36 pco 2 : 85.0 Acidose respiratória compensada (ou insuficiên HCO 3 : 47.0 cia ventilatória crônica ). Observe o bicarbonato, BE : +15 o BE. Observem que a alcalose metabólica é se cundária à acidose respiratória (raciocine com a Equação de Handerson Hasselbalch). Esta gasometria é muito semelhante a de n º 7, mas naquela, a acidose respiratória é secundária à alcalose respiratória. Mais uma vez frisamos a importância de se conhecer a história clínica na inter relação dos gases sangüíneos. 11. Neste último exemplo, comentário sobre um dos mais freqüentes distúrbios do equilíbrio ácidobásico na prática pediátrica: Lactente com diarréia e desidratação do III grau : Inicialmente prescrevemos uma fase rápida (40 ml/kg) em 2 horas; persistindo sinais de acidose metabólica (freqüência respiratória elevada ou freqüência respiratória normal, mas com incursões respiratórias profundas), colhemos sangue (de preferencia radial) para gasometria: ph : 7.14 Peso: 6 Kg pco 2 :15.1 K+: 6.0 meq/l po 2 : HCO 3 real: 5.0 HCO 3 : 6.5 BE :22.5 FIO 2 :21%
17 ANÁLISE COMPLETA: 1) ACIDOSE: ph menor que 7.3 2) METABÓLICA : história clínica: diarréia (perda de HCO 3 )parâmetros metabólicoshco 3 e BE. 3) PARCIALMENTE COMPENSADA: vejam a resposta pulmonar:paco 2. Se o pulmão não desse esta ajuda, veja como ficaria a situação: ph= pka + log HCO 3 ph= log 5 e ph=6.7 paco 2 x Então o pulmão deu uma valiosa ajuda, auxílio este já perceptível dentro de 10 minutos e máximo com 30 minutos. Observem que a ajuda do pulmão tornou irrisória a queda de quase 80% do bicarbonato sanguíneo. Consultando a fig. n º 1,veremos que a relação BEpaCO2 está dentro da faixa de segurança, ou seja, o pulmão exerceu seu papel. Como prova da eficiência pulmonar, o cálculo da P(Aa)O 2 revela: 11.8 mmhg (valor normal: ausência do shunt patológico). Portanto : ACIDOSE METABÓLICA PARCIALMENTE COMPENSADA Conduta: Com a fase rápida. Iniciamos a terapêutica da acidose metabólica: com a fase rápida há melhora da perfusão renal, oferecendo aos rins melhores condições para que ajam com eficiência retendo bicarbonato. DOSE DE BICARBONATO: fórmula: peso x BE x 0.3 Diferencial (absoluta) entre o BE real (da gasometria do paciente) e o BE normal (2.5) Para o caso temos: 6 x ( ) x 0.3 = 36 meq/l de NaHCO 3 QUANTO PRESCREVER? Para isto, antes gostaríamos de frisar que as fórmulas são secas, não tomando em consideração a totalidade dos fatores envolvidos no equilíbrio ácidobásico. Não devemos tratar a doença diferenças de bases e sim o fator causal. Ensinanos a prática (dotados de bastante prudência) que se deve apenas melhorar; nunca corrigir completamente a concentração do bicarbonato, pois concomitantemente está sendo feito o tratamento da causa básica (isto é, hidratando), o que irá diminuir o grau de acidose. A correção total da acidose poderá ser feita nas 1236 h posteriores a dose inicial do bicarbonato. para o caso prescreveríamos a metade, uma vez que a resposta pulmonar é bastante eficiente (como comprovamos na fig. 1). O restante, o organismo se encarregaria (muitas vezes, basta hidratar para que a maioria dos casos de acidose se resolva, mas quando o bicarbonato estiver abaixo de 10, principalmente 3 primeiros meses de vida, o rim agradecerá o que se fizer por ele. O auxílio é feito com bicarbonato de sódio. No nosso meio, temos o Bicarbonato de Sódio a 8.4%; usamos numa proporção de 1:5,tornandose isotônico com o plasma e infundilo em 60 minutos. E OS ELETRÓLITOS? : Comentaremos apenas sobre o K + e cálcio. O potássio real de nosso paciente é 4.2mEq/l, não devendo retirar totalmente o potássio da hidratação venosa, pois com a persistência do quadro diarréico, correção da acidose, a criança poderá desenvolver HIPOCALEMIA. Com relação ao cálcio, após a infusão do bicarbonato, o lactente poderá desencadear um quadro convulsivo (o cálcio estava baixo e a acidose protegia. Na prática, após o uso de
18 bicarbonato, introduzimos na hidratação venosa o gluconato de cálcio (1.5 a 2 meq/kg) ou (3 a 4 ml/kg a 10%). NOTA: nesta gasometria o bicarbonato padrão é maior que o bicarbonato real um sinal de alcalose respiratória (evidentemente secundária). Na prática, não tem muito valor, na interpretação da gasometria. BIBLIOGRAFIA 1. Mahmensmith RL. Electrolyte and acidbase disorders. IN: Bone: Pulmonary & Critical Care Medicine, pg 34, Freire E. Equilíbrio ácidobásico. Urgências, n º 1, Ano 10, Mariani GL, Carlo WA. Ventilatory management in neonates science or art. Clin Perinatol 25 : 33, Gallaci CB, Sanches AJ. Sódio, Potassio e equilíbrio ácidobásico. IN: Diniz MAD. Manual de Neonatologia, Revinter, Rio de Janeiro, pg 185, Nogueira PK. Acidose metabólica. IN: Hirschheimer MR, Matsumoto T, Carvalho WB. Terapia Intensiva Pediátrica. Atheneu, Rio de Janeiro, pg 393, 1989
19 6. Lima GML. Distúrbios do sódio, potássio e equilíbrio ácidobásico. IN: Marba ST, Filho Mezzacappa F. Manual de Neonatologia. UNICAMP. Revinter, Rio de Janeiro, pg 228, Ceccon MEJR, Vaz FA. Distúrbios do Equilíbrio ÁcidoBásico. IN: Vaz FAC, Manissadjean A, Zugaib M. Assistência à gestante de Alto Risco e ao Recémnascido nas primeiras horas. Atheneu, São Paulo, pg 257, Mendes A. Distúrbios hidreletrolíticos e desequilíbrio ácidobásico. I Congresso Brasileiro de Nutrição e Metabolismo Infantil, Rio de Janeiro, 22 a 27 de novembro de Engel K, Dell RB, Rahill WJ. Quantitative displacement of acidbase equilibrium in chronic respiratory acidosis. J Appl Physiol 24: 288, Albert MS, Dell RB, Winters RW. Quantitative displacement of acidbase equilibrium in metabolic acidosis. Ann Internal Med 66:312, Snider G L. Interpretation of the arterial oxygen and carbon dioxide partial pressures: a simplified approach for bedside use. Chest 63: 804, Shapiro BA, Harrison RA, Walton JR. Aplicações clínicas dos gases sangüíneos, 2 ª Edição, Editora Cultura Médica Ltda, Rio de Janeiro, Goldberger E. Alterações do Equilíbrio Hídrico, Eletrolítico e ÁcidoBase, 5 ª Edição, Guanabara, Koogan, Rio de Janeiro, Carvalho JM. Distúrbios Hidreletrolíticos extra e intracelulares em Pediatria. Guanabara Koogan, Rio de Janeiro, Hollerman CE. Pediatric Nephrology. Guanabara Koogan, Rio de Janeiro, Marques E, Birolini. Equilíbrio ÁcidoBásico. Sarvier, São Paulo, 2 ª Edição, Lorenz.JM, Kleinman LI, ET AL. Serum anion gap in the differential diagnosis of metabolic acidosis in critically ill newborn. J Pediatr 135:751,1999
Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent
![Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent](/thumbs/50/27125458.jpg) Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS
 SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
21/07/14. Processos metabólicos. Conceitos Básicos. Respiração. Catabolismo de proteínas e ácidos nucleicos. Catabolismo de glicídios
 Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE
 Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Equilíbrio ácido-básico. Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF
 Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG
 Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Lembrando. Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico
 GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
Profa Maria Clorinda EV/UFG
 Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
BIOQUÍMICA II SISTEMAS TAMPÃO NOS ORGANISMOS ANIMAIS 3/1/2012
 BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
ALCALOSES 1. Introdução HA H + +A -.
 ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
ph do sangue arterial = 7.4
 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO. interpretação
 TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
EXAMES COMPLEMENTARES GASOMETRIA GASOMETRIA ARTERIAL EQUILÍBRIO ÁCIDO - BÁSICO EQUILÍBRIO ÁCIDO - BÁSICO
 GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
Distúrbios Ácido Básicos
 Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Alterações do equilíbrio hídrico Alterações do equilíbrio hídrico Desidratação Regulação do volume hídrico
 Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
Regulação renal do equilíbrio ácido base
 Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Distúrbios do equilíbrio ácido básico. Fisiologia do equilíbrio ácido básico (6,80) 7,35 7,45 (7,80)
 Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO. Profa. Dra. Celene Fernandes Bernardes
 TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
GASOMETRIA ph E GASES SANGUÍNEOS
 GASOMETRIA ph E GASES SANGUÍNEOS CBHPM 4.03.0.01-6 AMB 8.01.096-5 CBHPM 4.14.01.16-6 Sinonímia: Gasometria de Siggaard-Andersen. Teste de exercício em ergômetro com realização de gasometria arterial. Gasometria
GASOMETRIA ph E GASES SANGUÍNEOS CBHPM 4.03.0.01-6 AMB 8.01.096-5 CBHPM 4.14.01.16-6 Sinonímia: Gasometria de Siggaard-Andersen. Teste de exercício em ergômetro com realização de gasometria arterial. Gasometria
Manutenção do ph do sangue
 Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Tampão. O que é? MISTURA DE UM ÁCIDO FRACO COM SUA BASE CONJUGADA, QUE ESTABILIZA O P H DE UMA SOLUÇÃO
 Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO. Prof. Fernando Ramos Gonçalves -Msc
 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
Sistema Respiratório. Superior. Língua. Inferior
 Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
Fisiologia do Sistema Urinário
 Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Universidade Federal Rural de Pernambuco
 Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Homeostase do potássio, cálcio e fosfato
 Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Fisioterapia em Terapia Intensiva
 Ácidos e Bases Fisioterapia em Terapia Intensiva ÁCIDO moléculas que contem átomos de hidrogênio capazes de liberar íons de hidrogênio. HCl H + + Cl BASE molécula que pode aceitar um íon de hidrogênio
Ácidos e Bases Fisioterapia em Terapia Intensiva ÁCIDO moléculas que contem átomos de hidrogênio capazes de liberar íons de hidrogênio. HCl H + + Cl BASE molécula que pode aceitar um íon de hidrogênio
Fisiologia Renal. Mecanismos tubulares I ESQUEMAS SOBRE FISIOLOGIA RENAL. Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás
 ESQUEMAS SOBRE FISIOLOGIA RENAL. Mecanismos tubulares I Fisiologia Renal Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás Mecanismos de manipulação do filtrado pelos túbulos renais:
ESQUEMAS SOBRE FISIOLOGIA RENAL. Mecanismos tubulares I Fisiologia Renal Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás Mecanismos de manipulação do filtrado pelos túbulos renais:
INSUFICIÊNCIA RESPIRATÓRIA
 Clínica Médica e Cirúrgica I INSUFICIÊNCIA RESPIRATÓRIA João Adriano de Barros Disciplina de Pneumologia Universidade Federal do Paraná Objetivos da Aula... Importância da IRA devido a sua alta mortalidade
Clínica Médica e Cirúrgica I INSUFICIÊNCIA RESPIRATÓRIA João Adriano de Barros Disciplina de Pneumologia Universidade Federal do Paraná Objetivos da Aula... Importância da IRA devido a sua alta mortalidade
Homeostase do ph. Ácidos e Bases. HA H + + A - HCl H + + Cl - H 2 CO 3 H + + HCO H + + NH 3. Escala de ph
 Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Natal/RN SOLUÇÃO TAMPÃO
 QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL. Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal.
 1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes
 ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
D) Como seria a correção desse distúrbio? A correção seria atuar na causa e proporcionar eliminação de CO2 por aumento da ventilação alveolar.
 Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
98% intracelular extracelular
 DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
MECANISMOS DE ACIDIFICAÇÃO URINÁRIA. Carlos Balda UNIFESP
 MECANISMOS DE ACIDIFICAÇÃO URINÁRIA Carlos Balda UNIFESP - 2012 Steady State Equilíbrio Dinâmico VALORES NORMAIS ph H+ (nanoeq/l) pco 2 (mmhg) HCO 3 (meq/l) ARTERIAL 7,37-7,43 37-43 36-44 22-26 VENOSO
MECANISMOS DE ACIDIFICAÇÃO URINÁRIA Carlos Balda UNIFESP - 2012 Steady State Equilíbrio Dinâmico VALORES NORMAIS ph H+ (nanoeq/l) pco 2 (mmhg) HCO 3 (meq/l) ARTERIAL 7,37-7,43 37-43 36-44 22-26 VENOSO
Ciclo Respiratório Normal. Como Respiramos? Prova de Função Pulmonar. Que diz a espirometria? Espirômetro. Sensível ao volume.
 Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016
 Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016 Tamponamento Substâncias que se dissociam em solução e liberam H + são denominadas ácidos Compostos que
Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016 Tamponamento Substâncias que se dissociam em solução e liberam H + são denominadas ácidos Compostos que
Biofísica renal. Estrutura e função dos rins
 Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
FISIOLOGIA DO EXERCÍCIO
 FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
Hidroclorotiazida. Diurético - tiazídico.
 Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
Considerações Gerais sobre Hemogasometria
 Considerações Gerais sobre Hemogasometria Exame hemogasométrico Grande importância na avaliação do equilíbrio ácido-básico Diagnóstico e prognóstico de inúmeras enfermidades Cuidados importantes para obtenção
Considerações Gerais sobre Hemogasometria Exame hemogasométrico Grande importância na avaliação do equilíbrio ácido-básico Diagnóstico e prognóstico de inúmeras enfermidades Cuidados importantes para obtenção
tampão Prof a Alessandra Smaniotto QMC Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B
 Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Aula-8Gasometria Arterial. Profª Tatiani
 Aula-8Gasometria Arterial Profª Tatiani Gasometria Arterial A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Tipicamente, os valores
Aula-8Gasometria Arterial Profª Tatiani Gasometria Arterial A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Tipicamente, os valores
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS
 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
BIOQUÍMICA PARA ODONTO
 BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
PROTOCOLO MÉDICO MANEJO DO RECÉM-NASCIDO NOS PRIMEIROS DIAS DE VIDA
 Página: 1 de 8 1.Introdução: Sabendo-se que: * A grande proporção de água extracelular nos RN pré-termo dificulta ainda mais a manutenção de seu equilíbrio hídrico. * A reabsorção tubular do sódio está
Página: 1 de 8 1.Introdução: Sabendo-se que: * A grande proporção de água extracelular nos RN pré-termo dificulta ainda mais a manutenção de seu equilíbrio hídrico. * A reabsorção tubular do sódio está
Reconhecendo os agravos clínicos em urgência e emergência. Prof.º Enfº. Diógenes Trevizan
 Reconhecendo os agravos clínicos em urgência e emergência Prof.º Enfº. Diógenes Trevizan Cuidando do cliente com agravos respiratórios em urgência e emergência Introdução Em atenção às urgências, a insuficiência
Reconhecendo os agravos clínicos em urgência e emergência Prof.º Enfº. Diógenes Trevizan Cuidando do cliente com agravos respiratórios em urgência e emergência Introdução Em atenção às urgências, a insuficiência
São exemplos de órgãos que realizam excreção em nosso corpo: Rins (exemplo de substância excretada = uréia);
 O sistema excretor é formado pelo conjunto de órgãos que permitem a eliminação de substâncias encontradas em excesso no corpo ou algumas são nocivas à saúde humana; Muitos metabólitos (Ex: uréia, H +,
O sistema excretor é formado pelo conjunto de órgãos que permitem a eliminação de substâncias encontradas em excesso no corpo ou algumas são nocivas à saúde humana; Muitos metabólitos (Ex: uréia, H +,
FISIOLOGIA RESPIRATÓRIA REVISÃO
 FISIOLOGIA RESPIRATÓRIA REVISÃO Fisioterapia FMRPUSP Paulo Evora Revisão Anatômica O sistema respiratório consiste no nariz, faringe, laringe, traquéia, brônquios e pulmões. A pleura visceral cobre a superfície
FISIOLOGIA RESPIRATÓRIA REVISÃO Fisioterapia FMRPUSP Paulo Evora Revisão Anatômica O sistema respiratório consiste no nariz, faringe, laringe, traquéia, brônquios e pulmões. A pleura visceral cobre a superfície
PROCESSO-CONSULTA CFM Nº 25/2017 PARECER CFM Nº 25/2018 INTERESSADOS: I.M.S. R.S.R.
 PROCESSO-CONSULTA CFM Nº 25/2017 PARECER CFM Nº 25/2018 INTERESSADOS: I.M.S. R.S.R. ASSUNTO: RELATOR: Diagnóstico de morte encefálica. Teste de apneia. Cons. Hideraldo Luis Souza Cabeça EMENTA: No diagnóstico
PROCESSO-CONSULTA CFM Nº 25/2017 PARECER CFM Nº 25/2018 INTERESSADOS: I.M.S. R.S.R. ASSUNTO: RELATOR: Diagnóstico de morte encefálica. Teste de apneia. Cons. Hideraldo Luis Souza Cabeça EMENTA: No diagnóstico
Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM
 Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM Fisiologia Renal Função Tubular Formação da Urina Clearance (Depuração) Prof. Wagner de Fátima Pereira Departamento de Ciências Básicas
Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM Fisiologia Renal Função Tubular Formação da Urina Clearance (Depuração) Prof. Wagner de Fátima Pereira Departamento de Ciências Básicas
FISIOLOGIA GERAL INTRODUÇÃO
 FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
Ácidos, bases e sistemas tampão
 Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
GASOMETRIA ARTERIAL GASOMETRIA. Indicações 11/09/2015. Gasometria Arterial
 GASOMETRIA ARTERIAL Processo pelo qual é feita a medição das pressões parciais dos gases sangüíneos, a partir do qual é possível o cálculo do PH sangüíneo, o que reflete o equilíbrio Ácido-Básico 2 GASOMETRIA
GASOMETRIA ARTERIAL Processo pelo qual é feita a medição das pressões parciais dos gases sangüíneos, a partir do qual é possível o cálculo do PH sangüíneo, o que reflete o equilíbrio Ácido-Básico 2 GASOMETRIA
ALCALOSES 1. Introdução
 ALCALOSES 1 Introdução O organismo é responsável por manter em equilíbrio o ph dos fluidos corpóreos presentes nos espaços extracelulares e intracelular através de diversos sistemas e mecanismos compensatórios
ALCALOSES 1 Introdução O organismo é responsável por manter em equilíbrio o ph dos fluidos corpóreos presentes nos espaços extracelulares e intracelular através de diversos sistemas e mecanismos compensatórios
Balanço Eletrolítico e Equilíbrio Ácido-Base
 Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Equilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira
 UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Equilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Equilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO REVISÃO DE LITERATURA
 DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO REVISÃO DE LITERATURA SOUZA, Camila Carolina Discente do Curso de Medicina Veterinária da FAMED Garça SACCO, Soraya Regina ZAPPA, Vanessa Docente do Curso de Medicina
DISTÚRBIOS DO EQUILÍBRIO ÁCIDO-BÁSICO REVISÃO DE LITERATURA SOUZA, Camila Carolina Discente do Curso de Medicina Veterinária da FAMED Garça SACCO, Soraya Regina ZAPPA, Vanessa Docente do Curso de Medicina
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro:
 TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO. Prof. Fernando Ramos Gonçalves -Msc
 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
Anatomia funcional do rim Função renal
 Anatomia funcional do rim Função renal Ganho Balanço diário Perda Ingestão Equilíbrio osmótico Bebidas e comidas Suor Pulmões Ingestão Metabolismo Metabolismo Urina Fezes Perdas Fluido extracelular Fluido
Anatomia funcional do rim Função renal Ganho Balanço diário Perda Ingestão Equilíbrio osmótico Bebidas e comidas Suor Pulmões Ingestão Metabolismo Metabolismo Urina Fezes Perdas Fluido extracelular Fluido
BIOLOGIA - 2 o ANO MÓDULO 10 EXCREÇÃO HUMANA
 BIOLOGIA - 2 o ANO MÓDULO 10 EXCREÇÃO HUMANA Fixação 1) A ingestão de álcool inibe a liberação de ADH (hormônio antidiurético) pela hipófise. Assim sendo, espera-se que um homem alcoolizado: a)
BIOLOGIA - 2 o ANO MÓDULO 10 EXCREÇÃO HUMANA Fixação 1) A ingestão de álcool inibe a liberação de ADH (hormônio antidiurético) pela hipófise. Assim sendo, espera-se que um homem alcoolizado: a)
Eletrólitos na Nutrição Parenteral
 Unesp Eletrólitos na Nutrição Parenteral Sergio A R Paiva Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da
Unesp Eletrólitos na Nutrição Parenteral Sergio A R Paiva Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da
Desequilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira
 UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Desequilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
UNIVERSIDADE DE SÃO PAULO Escola de Enfermagem Departamento de Enfermagem Médico-Cirúrgica Desequilíbrio Ácido básico Enfa. Profa. Dra. Paula C Nogueira Objetivos Conhecer e identificar os distúrbios ácido-básico
EQUILIBRIO HIDRICO. Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop
 EQUILIBRIO HIDRICO Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop Porque os organismos de mamíferos possuem grande quantidade de água? Alto ponto de ebulição (controle da temperatura);
EQUILIBRIO HIDRICO Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop Porque os organismos de mamíferos possuem grande quantidade de água? Alto ponto de ebulição (controle da temperatura);
CAPÍTULO 3 SISTEMA TAMPÃO
 17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
CONHECIMENTO ESPERADO
 REPOSIÇÃO VOLÊMICA GABRIEL MAGALHÃES NUNES GUIMARÃES, GABRIEL@GABRIEL.MED.BR DISPONÍVEL EM WWW.ANESTESIOLOGIAUNB.COM.BR AULA DA DISCIPLINA BASES DA ANESTESIOLOGIA UNIVERSIDADE DE BRASÍLIA, 2017 CONHECIMENTO
REPOSIÇÃO VOLÊMICA GABRIEL MAGALHÃES NUNES GUIMARÃES, GABRIEL@GABRIEL.MED.BR DISPONÍVEL EM WWW.ANESTESIOLOGIAUNB.COM.BR AULA DA DISCIPLINA BASES DA ANESTESIOLOGIA UNIVERSIDADE DE BRASÍLIA, 2017 CONHECIMENTO
A FUNÇÃO RENAL DURANTE OS PROCEDIMENTOS DE ECMO / ECLS.
 AULA 9 A FUNÇÃO RENAL DURANTE OS PROCEDIMENTOS DE ECMO / ECLS. Os rins desempenham duas funções primordiais no organismo: 1. a eliminação dos produtos finais do metabolismo, como a uréia, a creatinina
AULA 9 A FUNÇÃO RENAL DURANTE OS PROCEDIMENTOS DE ECMO / ECLS. Os rins desempenham duas funções primordiais no organismo: 1. a eliminação dos produtos finais do metabolismo, como a uréia, a creatinina
TRANSTORNOS ÁCIDOS-BÁSICOS
 TRANSTORNOS ÁCIDOS-BÁSICOS Marcos Mendes Disciplina de Fisiologia FMABC Conceitos ph = 7,40 0,04 (compatível com a vida 6,8 a 7,8) ph < 7,36 ACIDEMIA ph > 7,44 ALCALEMIA pco2 (a) = (40 4) mmhg TRANST.
TRANSTORNOS ÁCIDOS-BÁSICOS Marcos Mendes Disciplina de Fisiologia FMABC Conceitos ph = 7,40 0,04 (compatível com a vida 6,8 a 7,8) ph < 7,36 ACIDEMIA ph > 7,44 ALCALEMIA pco2 (a) = (40 4) mmhg TRANST.
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL
 AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária. Pelotas, 11 de novembro de 2015
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
VI SEMINÁRIO. Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDO-BASE. Subtemas: Bioquímica do equilíbrio ácido-base Acidoses e alcaloses.
 EQUILÍBRIO ÁCIDOBASE Actas Bioq. 2007, 8: 185192 VI SEMINÁRIO Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDOBASE Subtemas: Bioquímica do equilíbrio ácidobase Acidoses e alcaloses Intervenientes: Docentes convidados:
EQUILÍBRIO ÁCIDOBASE Actas Bioq. 2007, 8: 185192 VI SEMINÁRIO Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDOBASE Subtemas: Bioquímica do equilíbrio ácidobase Acidoses e alcaloses Intervenientes: Docentes convidados:
Reabsorção tubular. substâncias. reabsorção tubular.
 Reabsorção tubular Tanto a filtração glomerular quanto a reabsorção tubular ocorrem em muito maior escala do que a excreção da maioria das substâncias. Reabsorção tubular é altamente seletiva. Como a filtração
Reabsorção tubular Tanto a filtração glomerular quanto a reabsorção tubular ocorrem em muito maior escala do que a excreção da maioria das substâncias. Reabsorção tubular é altamente seletiva. Como a filtração
UNIVERSIDADE FEDERAL DO CEARÁ PROGRAMA DE ENSINO TUTORIAL (PET) FACULDADE DE MEDICINA DISTÚRBIO HIDROELETROLÍTICO E ÁCIDO-BÁSICO
 UNIVERSIDADE FEDERAL DO CEARÁ PROGRAMA DE ENSINO TUTORIAL (PET) FACULDADE DE MEDICINA DISTÚRBIO HIDROELETROLÍTICO E ÁCIDO-BÁSICO Petiano(a): Flora Cruz de Almeida ÁGUA CORPORAL Sexo - Homem: 60% - Mulher:
UNIVERSIDADE FEDERAL DO CEARÁ PROGRAMA DE ENSINO TUTORIAL (PET) FACULDADE DE MEDICINA DISTÚRBIO HIDROELETROLÍTICO E ÁCIDO-BÁSICO Petiano(a): Flora Cruz de Almeida ÁGUA CORPORAL Sexo - Homem: 60% - Mulher:
Biologia. Identidade dos Seres Vivos. Sistema Respiratório Humano. Prof.ª Daniele Duó
 Biologia Identidade dos Seres Vivos Prof.ª Daniele Duó Fisiologia do Sistema Respiratório Pode ser interpretada como um processo de trocas gasosas entre o organismo e o meio, ou conjunto de reações químicas
Biologia Identidade dos Seres Vivos Prof.ª Daniele Duó Fisiologia do Sistema Respiratório Pode ser interpretada como um processo de trocas gasosas entre o organismo e o meio, ou conjunto de reações químicas
Colheita e manuseamento de fluidos biológicos
 Colheita e manuseamento de fluidos biológicos Na aula de hoje, vamos falar de: 1. Importância da análise de amostras biológicas como ferramentas de diagnóstico 2. Composição dos dois fluidos mais analisados:
Colheita e manuseamento de fluidos biológicos Na aula de hoje, vamos falar de: 1. Importância da análise de amostras biológicas como ferramentas de diagnóstico 2. Composição dos dois fluidos mais analisados:
Livro Eletrônico Aula 00 Questões Comentadas de Fisioterapia - Terapia Intensiva
 Livro Eletrônico Questões Comentadas de Fisioterapia - Terapia Intensiva Professor: Fábio Cardoso 1 APRESENTAÇÃO.... 2 2 -QUESTÕES COMENTADAS...5 RESUMO....7 LISTA DE QUESTÕES SEM COMENTÁRIOS... 7 GABARITO...8
Livro Eletrônico Questões Comentadas de Fisioterapia - Terapia Intensiva Professor: Fábio Cardoso 1 APRESENTAÇÃO.... 2 2 -QUESTÕES COMENTADAS...5 RESUMO....7 LISTA DE QUESTÕES SEM COMENTÁRIOS... 7 GABARITO...8
Sistema tampão. Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H +
 Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
26/10/2018. A osmolaridade pode ser entendida como a proporção entre solutos e água de uma solução.
 COMPOSIÇÃO IÔNICA DOS LÍQUIDOS CORPORAIS HUMANOS Soluto Líquido extracelular Líquido intracelular Na + (meq/l) 145 12 K + (meq/l) 4 150 Ca 2+ (meq/l) 5 0,001 Cl - (meq/l) 105 5 HCO 3- (meq/l) 25 12 Pi
COMPOSIÇÃO IÔNICA DOS LÍQUIDOS CORPORAIS HUMANOS Soluto Líquido extracelular Líquido intracelular Na + (meq/l) 145 12 K + (meq/l) 4 150 Ca 2+ (meq/l) 5 0,001 Cl - (meq/l) 105 5 HCO 3- (meq/l) 25 12 Pi
Como interpretar a Gasometria de Sangue Arterial
 Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Hemolenta. Bula para paciente. Solução para hemodiálise 6,14 MG/ML + 0,18596 MG/ML
 Hemolenta Bula para paciente Solução para hemodiálise 6,14 MG/ML + 0,18596 MG/ML HEMOLENTA (cloreto de sódio + sulfato de magnésio heptaidratado) Solução para Hemodiálise SOLUÇÃO - SISTEMA FECHADO MEDFLEX
Hemolenta Bula para paciente Solução para hemodiálise 6,14 MG/ML + 0,18596 MG/ML HEMOLENTA (cloreto de sódio + sulfato de magnésio heptaidratado) Solução para Hemodiálise SOLUÇÃO - SISTEMA FECHADO MEDFLEX
Exercícios de Aprofundamento Biologia Trocas Gasosas
 1. (Unesp 2014) Os gráficos representam a concentração de três gases no sangue assim que passam pelos alvéolos pulmonares. É correto afirmar que os gráficos que representam as concentrações dos gases O
1. (Unesp 2014) Os gráficos representam a concentração de três gases no sangue assim que passam pelos alvéolos pulmonares. É correto afirmar que os gráficos que representam as concentrações dos gases O
Desequilíbrio Hidroeletrolítico. Prof.º Enfº. Esp. Diógenes Trevizan
 Desequilíbrio Hidroeletrolítico Prof.º Enfº. Esp. Diógenes Trevizan Muitos pacientes que dão entrada na unidade de atendimento de urgência podem ter o equilíbrio hidroeletrolítico comprometido em função
Desequilíbrio Hidroeletrolítico Prof.º Enfº. Esp. Diógenes Trevizan Muitos pacientes que dão entrada na unidade de atendimento de urgência podem ter o equilíbrio hidroeletrolítico comprometido em função
3) Complicações agudas do diabetes
 73 3) Complicações agudas do diabetes Hiperglicemias As emergências hiperglicêmicas do diabetes melitus são classificadas em: cetoacidose diabética (CAD) e estado hiperglicêmico hiperosmolar (EHH), que
73 3) Complicações agudas do diabetes Hiperglicemias As emergências hiperglicêmicas do diabetes melitus são classificadas em: cetoacidose diabética (CAD) e estado hiperglicêmico hiperosmolar (EHH), que
FCAV/ UNESP Jaboticabal. Disciplina: Química Geral Assunto: Solução Tampão. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
CINÉTICA QUÍMICA Folha 15 Prof.: João Roberto Mazzei
 01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
CASO CLÍNICO. O fim do mundo está próximo José Costa Leite Juazeiro do Norte Ceará
 CASO CLÍNICO Leitor nosso mundo velho Já está vai ou não vai Uma banda pendurada E a outra cai não cai Daqui pro fim da era Nada de bom se espera Vem castigos de Deus Pai O fim do mundo está próximo José
CASO CLÍNICO Leitor nosso mundo velho Já está vai ou não vai Uma banda pendurada E a outra cai não cai Daqui pro fim da era Nada de bom se espera Vem castigos de Deus Pai O fim do mundo está próximo José
Mensuração da concentração de gases e de íons dissolvidos no sangue
 UNIVERSIDADE ESTADUAL DE CAMPINAS FACULDADE DE ENGENHARIA ELÉTRICA E DE COMPUTAÇÃO DEPARTAMENTO DE ENGENHARIA BIOMÉDICA Curso de especialização em Engenharia Clínica Medição e Transdução Grandezas Biomédicas
UNIVERSIDADE ESTADUAL DE CAMPINAS FACULDADE DE ENGENHARIA ELÉTRICA E DE COMPUTAÇÃO DEPARTAMENTO DE ENGENHARIA BIOMÉDICA Curso de especialização em Engenharia Clínica Medição e Transdução Grandezas Biomédicas
DISTÚRBIOS DO SÓDIO E DO POTÁSSIO
 DISTÚRBIOS DO SÓDIO E DO POTÁSSIO HIPONATREMIA Dosagem de sódio ( Na ) sérico < 130mEq/L Oferta hídrica aumentada; Baixa oferta de sódio; Redistribuição osmótica de água ( p.ex. hiperglicemia); Excreção
DISTÚRBIOS DO SÓDIO E DO POTÁSSIO HIPONATREMIA Dosagem de sódio ( Na ) sérico < 130mEq/L Oferta hídrica aumentada; Baixa oferta de sódio; Redistribuição osmótica de água ( p.ex. hiperglicemia); Excreção
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
MODELO DE BULA (Profissionais de Saúde)
 MODELO DE BULA (Profissionais de Saúde) CPHD SMP 35 FRAÇÃO ÁCIDA cloreto de sódio + cloreto de potássio + associações APRESENTAÇÃO E FORMA FARMACÊUTICA Solução para hemodiálise bombona plástica de 5 ou
MODELO DE BULA (Profissionais de Saúde) CPHD SMP 35 FRAÇÃO ÁCIDA cloreto de sódio + cloreto de potássio + associações APRESENTAÇÃO E FORMA FARMACÊUTICA Solução para hemodiálise bombona plástica de 5 ou
