Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
|
|
|
- Renata Bárbara Guterres Angelim
- 7 Há anos
- Visualizações:
Transcrição
1 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO DE PROBLEMAS DE EQUILÍBRIO ÁCIDOBASE APLICAÇÂO A CASOS CLÍNICOS 1
2 IMPORTÂNCIA CLÍNICA DA REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA Num organismo multicelular, em particular no organismo humano, os mecanismos responsáveis pela manutenção duma concentração constante de H + são, além da combinação química do H + com outras substâncias que actuam como tampões de ph, os sistemas respiratório e renal (Tabela I). Tabela I Regulação da concentração do H + nos sistemas biológicos Tipo de regulação Função Tempo necessário para a regulação 1. Tampões químicos Combinamse com o H + milisegundos (Proteínas, HCO 3, HPO 2 4 ) (Pr (proteína) + H + PrH) 2. Respiração Eliminação de CO 2 nos pulmões minutos (H + + HCO 3 H 2 CO 3 CO 2 + H 2 O) 3. Regulação renal Secreção de H + horas Reabsorção de HCO 2 3 e HPO 4 De acordo com o que foi referido anteriormente, o controlo preciso do ph dentro dos limites estreitos (fisiológicos) de 7,357,45 é conseguido pela regulação da concentração do ião H +. Esta é determinada pela relação da concentração do HCO 3 (regulada pelos rins) e a pco 2 (controlada pelo sistema respiratório), através da Reacção 1. CO 2 +H 2 O H 2 CO 3 HCO 3 +H + (Reacção 1) A Reacção 1 traduz a lei de acção da massa do sistema CO 2 / HCO 3, que é o principal tampão de ph do meio extracelular. É de notar que a [H + ] aumenta ou diminui quer pelo aumento ou diminuição da pco 2 (acidose/alcalose respiratória), quer pela diminuição ou aumento da [HCO 3 ] (acidose/alcalose metabólica). Normalmente os pulmões mantêm a pco 2 na ordem dos 40 mmhg e os rins controlam a concentração de HCO 3, mantendoa em 2426 meq/l. Quando se perde um HCO 3, fica retido um H +, o que corresponde à adição de um H + ao organismo. Inversamente, o ganho de um HCO 3 é o mesmo que a perda de um H +. 2
3 Em condições normais há duas fontes de H + que o organismo tem de eliminar: a) Cerca de 20 moles de CO 2 são produzidos pelo catabolismo por dia e são eliminados pelos pulmões. Embora não seja um ácido, o CO 2 combinase com a H 2 O para formar H 2 CO 3. Assim, acumularseá ácido muito rapidamente se o CO 2 não é adequadamente eliminado pelos pulmões (acidose respiratória). b) Cerca de 1 meq /Kg de ácido não volátil é produzido diariamente pelo metabolismo. Este ácido é tamponado pelo HCO 3 no fluido extracelular. Isto levaria a uma depleção de HCO 3 e acidose metabólica se o rim não regenerasse o HCO 3 (reabsorção). Os sistemas tampão de ph do organismo constituem as primeiras linhas de defesa contra variações agudas de [H + ]. O H + é tamponado tanto por tampões intracelulares (que incluem os fosfatos e as proteínas citosólicas), como extracelulares, dos quais o mais importante é o tampão bicarbonato (CO 2 HCO 3 ). Quando se faz uma gasimetria arterial medese a po 2, a pco 2 (pressão parcial de O 2 e de CO 2, respectivamente, em mmhg), e o ph. A [HCO 3 ] é então calculada ( automaticamente pelo aparelho) com base na equação de HendersonHasselbach, a partir do ph e da pco 2 medidos. O hiato aniónico (HA) anion gap O cálculo do HA é fundamental para interpretar correctamente as alterações ácidobase em caso de acidose metabólica, ie aquela que é causada por uma alteração primária da [HCO 3 ]. O fluido extracelular é electroneutro, i.e., a soma da concentração dos iões positivos é igual à dos negativos. [Na + ] + [CNM*] = [Cl ] + [HCO 3 ] + [ANM**] * CNM: catiões não medidos (K +, Ca 2+, Mg 2+ e algumas γglobulinas) ** ANM: aniões não medidos (albumina, sulfato, fosfato e vários aniões orgânicos, p.e. lactato) Da equação anterior, [ANM] [CNM] = [Na + ] ([Cl ] + [HCO 3 ]) = HA 3
4 O HA normal é de 916 meq/l (ou 1014), consoante se considere ±2 ou ± 1 dp 1. O valor normal depende do laboratório. Se se incluir a [K + ] nos cálculos, i.e. HA = ([Na + ] + [K + ]) ([Cl ] + [HCO 3 ]). O valor normal é mais elevado, uma vez que a [K + ] é ~3,54,5 meq/l Na prática clínica classificamse as acidoses metabólicas em duas categorias: a) com HA normal. Também se designam hiperclorémicas, embora a [Cl ]. plasmática não esteja sempre elevada (ie em todos os casos). O mecanismo causador da acidose é a perda de HCO 3 pelo rim (tubulopatia proximal) ou pelo intestino (diarreia prolongada). Para manter a electroneutralidade do meio interno, a saída de HCO 3 é compensada pela retenção de Cl, donde o HA ser normal. b) com HA aumentado. Normoclorémicas. O mecanismo causador da acidose é a produção de anormal (em quantidade e/ ou em qualidade) de um ácido endógeno (ex. cetoacidose, acidose láctica, acidose urémica) ou a adição de um ácido exógeno (ex: intoxicação pelo metanol, que é metabolizado a ácido fórmico). O hiato aniónico aumenta porque estes ácidos circulam sob a forma de aniões, aumentando assim a concentrações de aniões não medidos. Não há uma relação directa entre a elevação do HA e a correspondente baixa na [HCO 3 ], porque este tampão é ajudado (está em equilíbrio) pelos outros sistemas tampão de ph e pela regulação pulmonar e renal. Assim, a diminuição da [HCO 3 ] é menor do que seria esperado, decorrente da elevação do HA. 1 dp: desvio padrão (em inglês: standard deviation, sd). 4
5 II. RESOLUÇÃO DE CASOS CLÍNICOS E PROBLEMAS DE EQUILÍBRIO ÁCIDOBASE CASOS CLÍNICOS CASO I Um rapaz de 18 anos foi internado por diarreia severa e os seguintes dados laboratoriais: Na meq/l (N= ); K + 3,6 meq/l (N=3,5 5,1); Cl 115 meq/l (N=98 107); HCO 3 12 meq/l; creatinina 1,1 g/dl (N<1); cetonúria negativa; Gasimetria arterial: ph 7.12 (N=7,35 7,45); pco 2 26 mmhg (N=35 40); HCO 3 12 meq/l (N=24 25). 1. Como interpreta as alterações presentes? 2. Como trataria este doente? 3. Calcule o hiato aniónico. CASO II Uma senhora de 49 anos, ansiosa, queixase de que parece que lhe falta o ar nos últimos 4 dias. A avaliação laboratorial mostrou: ph 7,4; pco 2 30 mmhg; HCO 3 19 meq/l. Como interpreta as alterações encontradas? CASO III Um doente com insuficiência respiratória com 2 semanas de duração apresenta os seguintes parâmetros na gasimetria arterial: pco 2 70 mmhg (N 35 40); HCO 3 35 mm; (N= 24 25); po 2 60mmHg (N ). A concentração de um gás em mm é = 0,0301 x Pressão parcial do gás (mmhg). O valor normal do ph do sangue arterial varia entre 7,35 e 7,45. HCO 3 : pk 1 = 6,1; pk 2 = 10,2 1. Qual o valor do ph sanguíneo do doente? Apresente os cálculos 2. Como interpreta as alterações observadas? Seria de esperar a ocorrência de alteração do ph urinário deste doente? Justifique. 5
6 PROBLEMAS 1. Considere a curva de titulação do ácido glutâmico representada na figura seguinte: 9,67 C ph 4,25 B 2,19 A [OH ] a) A que corresponde cada um dos pontos assinalados pelas letras A, B e C. Qual o seu significado? b) Determine o PI do aminoácido representado na figura e diga qual o seu significado. 2. Descreva a preparação de 1 L de solução tampão de histidina 0,2 M com ph 6,5, partindo da sua forma isoeléctrica sólida e de uma solução de HCl 1 M (pk 1 = 1,82; pk 2 = 6,0; pk 3 = 9,17; PM = 150 g/ mol). 3. Calcule a concentração de H + e o ph de uma solução preparada pela mistura de 125 ml de H 3 PO 4 0,1 M com 175 ml de NaOH 0,1 M. (pk 1 = 2,1; pk 2 = 7,21; pk 3 = 12,32). 4. O suco gástrico tem uma concentração de H + de 0,16 M. a) Calcule o ph e o poh. b) Calcule o número de iões H + existentes em 250 ml de suco gástrico. 5.a) Quais são as concentrações de NH 3 e NH 4 Cl num tampão de amónia 0,15 M e ph 9,6? (K b = 1,8 x 10 5 ). b) Explique em termos de equilíbrio químico o que acontece, se à solução anterior, for adicionado 1 ml de HCl 0,01 M. Justifique apresentando os cálculos (considere que não há variação de volume). c) Calcule o ph da solução referida na alínea b) na ausência do tampão. 6
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Ácidos, bases e sistemas tampão
 Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
ph do sangue arterial = 7.4
 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Regulação renal do equilíbrio ácido base
 Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS
 SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE
 Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
21/07/14. Processos metabólicos. Conceitos Básicos. Respiração. Catabolismo de proteínas e ácidos nucleicos. Catabolismo de glicídios
 Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent
![Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent](/thumbs/50/27125458.jpg) Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Equilíbrio ácido-básico. Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF
 Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Manutenção do ph do sangue
 Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Tampão. O que é? MISTURA DE UM ÁCIDO FRACO COM SUA BASE CONJUGADA, QUE ESTABILIZA O P H DE UMA SOLUÇÃO
 Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Homeostase do ph. Ácidos e Bases. HA H + + A - HCl H + + Cl - H 2 CO 3 H + + HCO H + + NH 3. Escala de ph
 Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Fisiologia do Sistema Urinário
 Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Natal/RN SOLUÇÃO TAMPÃO
 QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
Distúrbios Ácido Básicos
 Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Lembrando. Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico
 GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG
 Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Distúrbios do equilíbrio ácido básico. Fisiologia do equilíbrio ácido básico (6,80) 7,35 7,45 (7,80)
 Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
FISIOLOGIA GERAL INTRODUÇÃO
 FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
Fundamentos de Química Profa. Janete Yariwake. Equilíbrio químico em solução aquosa. Soluções-tampão. Soluções tampão
 Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes
 ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
BIOQUÍMICA II SISTEMAS TAMPÃO NOS ORGANISMOS ANIMAIS 3/1/2012
 BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
Colheita e manuseamento de fluidos biológicos
 Colheita e manuseamento de fluidos biológicos Na aula de hoje, vamos falar de: 1. Importância da análise de amostras biológicas como ferramentas de diagnóstico 2. Composição dos dois fluidos mais analisados:
Colheita e manuseamento de fluidos biológicos Na aula de hoje, vamos falar de: 1. Importância da análise de amostras biológicas como ferramentas de diagnóstico 2. Composição dos dois fluidos mais analisados:
tampão Prof a Alessandra Smaniotto QMC Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B
 Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
FCAV/ UNESP Jaboticabal. Disciplina: Química Geral Assunto: Solução Tampão. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO. Profa. Dra. Celene Fernandes Bernardes
 TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
Sistema Respiratório. Superior. Língua. Inferior
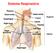 Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
GASOMETRIA ph E GASES SANGUÍNEOS
 GASOMETRIA ph E GASES SANGUÍNEOS CBHPM 4.03.0.01-6 AMB 8.01.096-5 CBHPM 4.14.01.16-6 Sinonímia: Gasometria de Siggaard-Andersen. Teste de exercício em ergômetro com realização de gasometria arterial. Gasometria
GASOMETRIA ph E GASES SANGUÍNEOS CBHPM 4.03.0.01-6 AMB 8.01.096-5 CBHPM 4.14.01.16-6 Sinonímia: Gasometria de Siggaard-Andersen. Teste de exercício em ergômetro com realização de gasometria arterial. Gasometria
BIOQUÍMICA PARA ODONTO
 BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
Alterações do equilíbrio hídrico Alterações do equilíbrio hídrico Desidratação Regulação do volume hídrico
 Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO. interpretação
 TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
ALCALOSES 1. Introdução HA H + +A -.
 ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
Química II - 1º Exame A 7 de Julho de ª Parte
 Nome Química II - 1º Exame A 7 de Julho de 2017 MEQ MEBiol Sala nº 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 5 na folha do enunciado Responda
Nome Química II - 1º Exame A 7 de Julho de 2017 MEQ MEBiol Sala nº 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 5 na folha do enunciado Responda
CURVAS DE TITULAÇÃO PARA SISTEMAS ÁCIDO/BASE COMPLEXOS (complicados)
 CURVAS DE TITULAÇÃO PARA SISTEMAS ÁCIDO/BASE COMPLEXOS (complicados)! MISTURA DE 2 ÁCIDOS (ou bases) DE DIFERENTES FORÇAS (pk a )! ÁCIDOS (ou bases) POLIFUNCIONAIS! SUBSTÂNCIAS ANFIPRÓTICAS (podem atuar
CURVAS DE TITULAÇÃO PARA SISTEMAS ÁCIDO/BASE COMPLEXOS (complicados)! MISTURA DE 2 ÁCIDOS (ou bases) DE DIFERENTES FORÇAS (pk a )! ÁCIDOS (ou bases) POLIFUNCIONAIS! SUBSTÂNCIAS ANFIPRÓTICAS (podem atuar
VI SEMINÁRIO. Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDO-BASE. Subtemas: Bioquímica do equilíbrio ácido-base Acidoses e alcaloses.
 EQUILÍBRIO ÁCIDOBASE Actas Bioq. 2007, 8: 185192 VI SEMINÁRIO Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDOBASE Subtemas: Bioquímica do equilíbrio ácidobase Acidoses e alcaloses Intervenientes: Docentes convidados:
EQUILÍBRIO ÁCIDOBASE Actas Bioq. 2007, 8: 185192 VI SEMINÁRIO Tema: BIOQUÍMICA DO EQUILÍBRIO ÁCIDOBASE Subtemas: Bioquímica do equilíbrio ácidobase Acidoses e alcaloses Intervenientes: Docentes convidados:
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS
 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
Biofísica renal. Estrutura e função dos rins
 Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Universidade Federal Rural de Pernambuco
 Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Homeostase do potássio, cálcio e fosfato
 Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Anatomia funcional do rim Função renal
 Anatomia funcional do rim Função renal Ganho Balanço diário Perda Ingestão Equilíbrio osmótico Bebidas e comidas Suor Pulmões Ingestão Metabolismo Metabolismo Urina Fezes Perdas Fluido extracelular Fluido
Anatomia funcional do rim Função renal Ganho Balanço diário Perda Ingestão Equilíbrio osmótico Bebidas e comidas Suor Pulmões Ingestão Metabolismo Metabolismo Urina Fezes Perdas Fluido extracelular Fluido
Fisiologia Renal. Mecanismos tubulares I ESQUEMAS SOBRE FISIOLOGIA RENAL. Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás
 ESQUEMAS SOBRE FISIOLOGIA RENAL. Mecanismos tubulares I Fisiologia Renal Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás Mecanismos de manipulação do filtrado pelos túbulos renais:
ESQUEMAS SOBRE FISIOLOGIA RENAL. Mecanismos tubulares I Fisiologia Renal Profa. Ms Ana Maria da Silva Curado Lins Universidade Católica de Goiás Mecanismos de manipulação do filtrado pelos túbulos renais:
EXAMES COMPLEMENTARES GASOMETRIA GASOMETRIA ARTERIAL EQUILÍBRIO ÁCIDO - BÁSICO EQUILÍBRIO ÁCIDO - BÁSICO
 GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
P4 PROVA DE QUÍMICA GERAL 02/12/08
 P4 PROVA DE QUÍMICA GERAL 0/1/08 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,314
P4 PROVA DE QUÍMICA GERAL 0/1/08 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Constantes e equações: R = 0,08 atm L mol -1 K -1 = 8,314
Interpretação de Exames Laboratoriais para Doença Renal
 Interpretação de Exames Laboratoriais Aplicados à Nutrição Clínica Interpretação de Exames Laboratoriais para Doença Renal Prof. Marina Prigol Investigação da função renal Funções do rim: Regulação do
Interpretação de Exames Laboratoriais Aplicados à Nutrição Clínica Interpretação de Exames Laboratoriais para Doença Renal Prof. Marina Prigol Investigação da função renal Funções do rim: Regulação do
São exemplos de órgãos que realizam excreção em nosso corpo: Rins (exemplo de substância excretada = uréia);
 O sistema excretor é formado pelo conjunto de órgãos que permitem a eliminação de substâncias encontradas em excesso no corpo ou algumas são nocivas à saúde humana; Muitos metabólitos (Ex: uréia, H +,
O sistema excretor é formado pelo conjunto de órgãos que permitem a eliminação de substâncias encontradas em excesso no corpo ou algumas são nocivas à saúde humana; Muitos metabólitos (Ex: uréia, H +,
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO. Prof. Fernando Ramos Gonçalves -Msc
 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
Considerações Gerais sobre Hemogasometria
 Considerações Gerais sobre Hemogasometria Exame hemogasométrico Grande importância na avaliação do equilíbrio ácido-básico Diagnóstico e prognóstico de inúmeras enfermidades Cuidados importantes para obtenção
Considerações Gerais sobre Hemogasometria Exame hemogasométrico Grande importância na avaliação do equilíbrio ácido-básico Diagnóstico e prognóstico de inúmeras enfermidades Cuidados importantes para obtenção
MECANISMOS DE ACIDIFICAÇÃO URINÁRIA. Carlos Balda UNIFESP
 MECANISMOS DE ACIDIFICAÇÃO URINÁRIA Carlos Balda UNIFESP - 2012 Steady State Equilíbrio Dinâmico VALORES NORMAIS ph H+ (nanoeq/l) pco 2 (mmhg) HCO 3 (meq/l) ARTERIAL 7,37-7,43 37-43 36-44 22-26 VENOSO
MECANISMOS DE ACIDIFICAÇÃO URINÁRIA Carlos Balda UNIFESP - 2012 Steady State Equilíbrio Dinâmico VALORES NORMAIS ph H+ (nanoeq/l) pco 2 (mmhg) HCO 3 (meq/l) ARTERIAL 7,37-7,43 37-43 36-44 22-26 VENOSO
TRANSTORNOS ÁCIDOS-BÁSICOS
 TRANSTORNOS ÁCIDOS-BÁSICOS Marcos Mendes Disciplina de Fisiologia FMABC Conceitos ph = 7,40 0,04 (compatível com a vida 6,8 a 7,8) ph < 7,36 ACIDEMIA ph > 7,44 ALCALEMIA pco2 (a) = (40 4) mmhg TRANST.
TRANSTORNOS ÁCIDOS-BÁSICOS Marcos Mendes Disciplina de Fisiologia FMABC Conceitos ph = 7,40 0,04 (compatível com a vida 6,8 a 7,8) ph < 7,36 ACIDEMIA ph > 7,44 ALCALEMIA pco2 (a) = (40 4) mmhg TRANST.
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária. Pelotas, 11 de novembro de 2015
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária Pelotas, 11 de novembro de 2015 Carlos Loures Pires Josiane de Oliveira Feijó Escolha do artigo Cálcio Homeostase Hormônios
Fundamentos de Química Q101 Aulas Téorico-Práticas Ano letivo 2011/12 Licenciaturas em Química e Bioquímica
 DEPARTAMENTO DE QUÍMICA E BIOQUÍMICA Fundamentos de Química Q101 Aulas Téorico-Práticas Ano letivo 2011/12 Licenciaturas em Química e Bioquímica Equilíbrio ácido-base (10.32) Calcule o ph e o poh de cada
DEPARTAMENTO DE QUÍMICA E BIOQUÍMICA Fundamentos de Química Q101 Aulas Téorico-Práticas Ano letivo 2011/12 Licenciaturas em Química e Bioquímica Equilíbrio ácido-base (10.32) Calcule o ph e o poh de cada
ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL. Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal.
 1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE
 TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA. Profa. Dra. Monica Akemi Sato
 EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA Profa. Dra. Monica Akemi Sato Introdução Homeostasia: constância do meio interno Claude Bernard Parâmetros fisiológicos constantes: temperatura, volume, pressão,
EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA Profa. Dra. Monica Akemi Sato Introdução Homeostasia: constância do meio interno Claude Bernard Parâmetros fisiológicos constantes: temperatura, volume, pressão,
Introdução à Análise Química QUI 094 VOLUMETRIA DE NEUTRALIZAÇÃO
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos VOLUMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos VOLUMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE
Os sais são neutros, ácidos ou básicos? Íons como Ácidos e Bases
 Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Química Analítica IV TITULOMETRIA DE NEUTRALIZAÇÃO
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE FRACA COM ÁCIDO
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE FRACA COM ÁCIDO
artéria renal arteríola aferente capilares glomerulares artéria renal capilares glomerulares veia renal
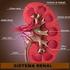 FUNÇÕES DOS RINS Controle da osmolaridade dos fluidos corporais Regulação do volume dos fluidos corporais (controle a longo prazo da pressão arterial) Regulação da concentração de eletrólitos: Na +, K
FUNÇÕES DOS RINS Controle da osmolaridade dos fluidos corporais Regulação do volume dos fluidos corporais (controle a longo prazo da pressão arterial) Regulação da concentração de eletrólitos: Na +, K
D) Como seria a correção desse distúrbio? A correção seria atuar na causa e proporcionar eliminação de CO2 por aumento da ventilação alveolar.
 Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
c) Escreva a equação da reação de combustão completa, devidamente equilibrada, para o composto de fórmula molecular C 5 H 10 O.
 Questão 1 O esquema abaixo mostra compostos que podem ser obtidos a partir de um alceno de fórmula molecular C 5 H 10. A seguir, responda às questões relacionadas a esse esquema, considerando sempre o
Questão 1 O esquema abaixo mostra compostos que podem ser obtidos a partir de um alceno de fórmula molecular C 5 H 10. A seguir, responda às questões relacionadas a esse esquema, considerando sempre o
QUÍMICA 3 - APOSTILA 4. Prof. Msc João Neto
 QUÍMICA - APOSTILA Prof. Msc João Neto A (g) B (g) C (g) D (g) Em um sistema fechado, o equilíbrio é atingido quando: as propriedades macroscópicas ficam inalteradas; no estado final, coexistem reagentes
QUÍMICA - APOSTILA Prof. Msc João Neto A (g) B (g) C (g) D (g) Em um sistema fechado, o equilíbrio é atingido quando: as propriedades macroscópicas ficam inalteradas; no estado final, coexistem reagentes
TITULAÇÃO ÁCIDO-BASE
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química I semestre 2018 TITULAÇÃO ÁCIDO-BASE Ácidos Polipróticos Profa.
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química I semestre 2018 TITULAÇÃO ÁCIDO-BASE Ácidos Polipróticos Profa.
APARELHO URINÁRIO (III)
 APARELHO URINÁRIO (III) (Reabsorção e secreção tubulares) Mário Gomes Marques Instituto de Fisiologia da FML (Director: Prof. Luis Silva-Carvalho) 1 RIM (reabsorção e secreção tubulares) Qualquer substância
APARELHO URINÁRIO (III) (Reabsorção e secreção tubulares) Mário Gomes Marques Instituto de Fisiologia da FML (Director: Prof. Luis Silva-Carvalho) 1 RIM (reabsorção e secreção tubulares) Qualquer substância
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell
 LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) DISSOCIAÇÃO ÁCIDO/BASE Constante de dissociação de ácido: K a O ácido nitroso (HNO 2 ) é um ácido fraco, então Enquanto
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) DISSOCIAÇÃO ÁCIDO/BASE Constante de dissociação de ácido: K a O ácido nitroso (HNO 2 ) é um ácido fraco, então Enquanto
EQUILÍBRIO QUÍMICO. Profa. Loraine Jacobs DAQBI.
 EQUILÍBRIO QUÍMICO Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs EQUILÍBRIO IÔNICO DA ÁGUA Equilíbrio Iônico da Água Ácido e Base de Arrhenius H
EQUILÍBRIO QUÍMICO Profa. Loraine Jacobs DAQBI lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs EQUILÍBRIO IÔNICO DA ÁGUA Equilíbrio Iônico da Água Ácido e Base de Arrhenius H
Equilíbrio Ácido-base. Controle de ph por meio de soluções tampão
 Equilíbrio Ácido-base Controle de ph por meio de soluções tampão Conceitos Soluções tampão = são sistemas aquosos que tendem a resistir a mudanças no seu ph quando pequenas quantidades de ácido ( H + )
Equilíbrio Ácido-base Controle de ph por meio de soluções tampão Conceitos Soluções tampão = são sistemas aquosos que tendem a resistir a mudanças no seu ph quando pequenas quantidades de ácido ( H + )
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2009/2010. Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2009/2010 Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 7ª AULA PRÁTICA Determinação
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2009/2010 Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 7ª AULA PRÁTICA Determinação
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL
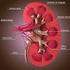 AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
Profa Maria Clorinda EV/UFG
 Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
Responder às questões da Parte III nas folhas do enunciado
 Exame de Química II 2º teste A 29 de Maio de 2015 Mestrado Integrado em Engenharia Química Mestrado Integrado em Engenharia Biológica RM-A: IV-1A: IV-2A: IV-3A: Total: Nome:... nº. Sala... Responder às
Exame de Química II 2º teste A 29 de Maio de 2015 Mestrado Integrado em Engenharia Química Mestrado Integrado em Engenharia Biológica RM-A: IV-1A: IV-2A: IV-3A: Total: Nome:... nº. Sala... Responder às
CAPÍTULO 3 SISTEMA TAMPÃO
 17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
CINÉTICA QUÍMICA Folha 15 Prof.: João Roberto Mazzei
 01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
Experimento 1: Efeito do íon comum equilíbrio de ionização da amônia
 Experimento Deslocamento de equilíbrios químicos (Princípio de Le Chatelier) Objetivo: Estudar e compreender alguns fatores que deslocam equilíbrios químicos. Experimento 1: Efeito do íon comum equilíbrio
Experimento Deslocamento de equilíbrios químicos (Princípio de Le Chatelier) Objetivo: Estudar e compreender alguns fatores que deslocam equilíbrios químicos. Experimento 1: Efeito do íon comum equilíbrio
Nome: Nº BI: Data - Local Emissão: / / -
 PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
PROVA DE QUÍMICA Nome: Nº BI: Data - Local Emissão: / / - Pergunta / Opção 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 a) b) c) d) PROVA DE QUÍMICA Duração da prova: 60 minutos +
EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS
 EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS Eletrólitos Fortes Fracos Ionizam/Dissociam completamente Ionizam/Dissociam parcialmente Ex: HCl, NaNO 3 Ex: HF, BaSO 4 EQUILÍBRIOS ÁCIDO-BASE
EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS Eletrólitos Fortes Fracos Ionizam/Dissociam completamente Ionizam/Dissociam parcialmente Ex: HCl, NaNO 3 Ex: HF, BaSO 4 EQUILÍBRIOS ÁCIDO-BASE
Curva de titulação efeito da concentração
 Exercício 1) Considere a titulação de 100 ml de solução HCl 0,0100 mol L -1 com solução padrão de NaOH 0,0500 mol L -1. Calcule o ph da solução do titulado após a adição das seguintes quantidades de titulante:
Exercício 1) Considere a titulação de 100 ml de solução HCl 0,0100 mol L -1 com solução padrão de NaOH 0,0500 mol L -1. Calcule o ph da solução do titulado após a adição das seguintes quantidades de titulante:
s e õ ç lu o S a ic ím u Q G A. P 1
 1. 2. Uma solução comercial de soro fisiológico tem concentração de NaCl de 0,9% (massa/volume). Soluções com essa concentração podem ser consideradas como tendo densidade unitária. a) expresse essa concentração
1. 2. Uma solução comercial de soro fisiológico tem concentração de NaCl de 0,9% (massa/volume). Soluções com essa concentração podem ser consideradas como tendo densidade unitária. a) expresse essa concentração
Avaliação da Função Renal. Dr. Alexandre S. Fortini Divisão de Laboratório Central HC-FMUSP
 Avaliação da Função Renal Dr. Alexandre S. Fortini Divisão de Laboratório Central HC-FMUSP Funções do Rim Balanço hídrico e salino Excreção de compostos nitrogenados Regulação ácido-base Metabolismo ósseo
Avaliação da Função Renal Dr. Alexandre S. Fortini Divisão de Laboratório Central HC-FMUSP Funções do Rim Balanço hídrico e salino Excreção de compostos nitrogenados Regulação ácido-base Metabolismo ósseo
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
CPV seu pé direito também na medicina
 CPV seu pé direito também na medicina unifesp 18/dezembro/2009 QUÍMICA 06. Na queima do cigarro, há a liberação dos gases C, C 2 e de outras substâncias tóxicas como alcatrão, nicotina, fenóis e amônia
CPV seu pé direito também na medicina unifesp 18/dezembro/2009 QUÍMICA 06. Na queima do cigarro, há a liberação dos gases C, C 2 e de outras substâncias tóxicas como alcatrão, nicotina, fenóis e amônia
Balanço Eletrolítico e Equilíbrio Ácido-Base
 Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Gabaritos Resolvidos Energia Química Semiextensivo V4 Frente C
 01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
Química. APL 1.6 Funcionamento de um sistema-tampão: titulação ácido forte-base fraca (HCl e Na 2 CO 3 )
 Química APL 1.6 Funcionamento de um sistema-tampão: titulação ácido forte-base fraca (HCl e Na 2 CO 3 ) Luísa Neves, 12ºCT 09 de março de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4
Química APL 1.6 Funcionamento de um sistema-tampão: titulação ácido forte-base fraca (HCl e Na 2 CO 3 ) Luísa Neves, 12ºCT 09 de março de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4
2ª SÉRIE roteiro 1 SOLUÇÕES
 2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM
 Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM Fisiologia Renal Função Tubular Formação da Urina Clearance (Depuração) Prof. Wagner de Fátima Pereira Departamento de Ciências Básicas
Universidade Federal dos Vales do Jequitinhonha e Mucuri - UFVJM Fisiologia Renal Função Tubular Formação da Urina Clearance (Depuração) Prof. Wagner de Fátima Pereira Departamento de Ciências Básicas
98% intracelular extracelular
 DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
Química II - 1º Exame A 5 de Junho de ª Parte
 Química II - 1º Exame A 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
Química II - 1º Exame A 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
Revisão da aula anterior
 Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Química II - 1º Exame B 5 de Junho de ª Parte
 Química II - 1º Exame B 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
Química II - 1º Exame B 5 de Junho de 2017 Nome nº MEQ MEBiol Sala 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. Duração do exame: 3h TOTAL. Responda às perguntas 1 a 6 na folha do enunciado
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em , Prof. Mauricio
 Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
ph DAS ÁGUAS NATURAIS.
 TRABALHO Nº 3 ph DAS ÁGUAS NATURAIS. ACIDEZ (PH) POR MEDIDA ELECTROMÉTRICA. OBJECTIVOS 1) Familiarizar os alunos com o ph e o método corrente de determinação. 2) Constituição das águas naturais (CO 2,
TRABALHO Nº 3 ph DAS ÁGUAS NATURAIS. ACIDEZ (PH) POR MEDIDA ELECTROMÉTRICA. OBJECTIVOS 1) Familiarizar os alunos com o ph e o método corrente de determinação. 2) Constituição das águas naturais (CO 2,
CRONOGRAMA DE RECUPERAÇÃO ATIVIDADE DE RECUPERAÇÃO
 CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
