Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
|
|
|
- Rayssa Azambuja Sousa
- 7 Há anos
- Visualizações:
Transcrição
1 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais tampões fisiológicos 3. Efeito tampão e sua eficiência
2 Importância da concentração de H + nos sistemas biológicos O ião de hidrogénio (H + ) é, de entre todos os iões inorgânicos, talvez aquele que exerce maior influência na célula, por unidade de concentração. Muitas das moléculas das estruturas celulares e dos vários sistemas de enzimas, ionizam-se e existem em equilíbrio com os protões livres da célula. Se representarmos os grupos ionizados destas estruturas e enzimas por R -, poderemos representar o equilíbrio com H + pela seguinte equação: RH R - + H + (1) em que K A representa a constante de dissociação do ácido. K A A concentração de H + determina, portanto, as concentrações de R - e RH, que representam, respectivamente, as moléculas dissociadas e em combinação com H +. Deve notar-se que a associação de H + com R - para formar RH determina também a concentração de H + livre e que, quanto maior for a afinidade de R - por H +, menor será a concentração de H + livre. Muitas reacções que ocorrem na célula dependem da carga eléctrica das moléculas dos sistemas envolvidos. Por exemplo, a actividade das enzimas, a permeabilidade da membrana plasmática, o transporte activo de substâncias concentradas selectivamente na célula, são dependentes da concentração de H +, provavelmente porque este ião determina a carga eléctrica das moléculas e estruturas celulares. Geralmente, existe uma concentração óptima de H + para cada mecanismo celular. Concentrações inferiores ou superiores a essa concentração são, em geral, inibidoras, como se indica no caso específico das actividades enzimáticas (Fig. 1). Actividade enzimática ph óptimo 1
3 (% do máximo) ph Fig. 1. Relação entre o ph do meio e a actividade enzimática O ph óptimo da enzima representada na figura é de aproximadamente 7,0. Apesar do ph óptimo de actuação de uma variedade de enzimas ser de aproximadamente 7, existem excepções significativas; por exemplo, a enzima pepsina, uma protease do estômago, tem um ph óptimo de 1,5. O ph do estômago é bastante ácido (ph = 1), podendo a enzima funcionar neste meio. Um aumento do ph (redução de [H + ]) aumenta a dissociação das substâncias, nomeadamente das proteínas, e aquelas com um pk relativamente baixo, dissociam-se primeiro. Normalmente, ao ph das células (± 6,5-7,0), as proteínas possuem uma carga predominantemente negativa e podem, portanto, absorver iões H + produzidos pelo metabolismo da célula. Esta reacção entre as proteínas ou outras substâncias capazes de absorverem H + (por ex., HPO 4 2- e HCO 3 - ) é rápida e é, portanto, responsável por evitar flutuações na concentração de H + na célula durante a sua actividade. Porém, torna-se, eventualmente, necessário dispor de iões H +, temporariamente absorvidos pelas várias substâncias que entram em combinação com este ião. Ácidos e Bases Um ácido, segundo a definição de Bronsted, é uma substância dadora de H +, enquanto que uma base absorve H +. Na descrição que se segue, faremos referência somente aos ácidos, especialmente ácidos fracos, que se dissociam parcialmente e existem em equilíbrio, em solução com o H + e A - produzidos pela dissociação: K A HA H + + A - (2) 2
4 onde HA representa o ácido, A - a quantidade do ácido que se dissociou e K D representa a constante de dissociação, a qual se pode expressar pela equação (3): [ H + ] [A - ] K a = (3) [HA] ácidos. Em relação às bases, as considerações são idênticas às que foram descritas para os Os ácidos fortes, tais como o HCl, dissociam-se completamente e, portanto, em água, a concentração de H + ou Cl - é igual à concentração original do ácido. Assim, 0,1 M de HCl produz 0,1 M de H + e 0,1 M de Cl -. No caso dos ácidos fracos, tais como o ácido acético, a concentração de H + produzida pelo ácido em solução aquosa é inferior à concentração original do ácido, porque só parte do H + do ácido se dissocia. A concentração de H + dissociado pode calcular-se pela equação (3), que pode ser representada como se segue: [HA] [H + ] = K a (4) [A - ] ou [HA] - log [H + ] = - log K D - log (5) [A - ] A [H + ] é geralmente indicada pelo valor do ph que é definido como o negativo do logaritmo da concentração de [H + ]. Portanto: [HA] ph = - log K A - log (6) [A - ] 3
5 Verifica-se na equação (6) que, quando as concentrações de HA e A - são iguais, o ph é igual a - log K D. O valor de - log K a é uma constante característica de cada ácido e é definida como o ph a que as concentrações de HA e A - são iguais. Esta constante (-log K a ) representa-se pelo símbolo pka. Portanto: [A - ] ph = pk a + log (7) [HA] Esta equação é a equação de Henderson-Hasselbalch, a qual é muito útil para calcular o ph de soluções de ácidos fracos. Dissociação da água A água actua como um ácido e como uma base, uma vez que produz H + e OH - : K e H 2 O H + + OH - (8) onde Ke é a constante do equilíbrio da reacção. A concentração de H + concentração de OH -. O valor de Ke é: produzido pela água é relativamente baixa e é igual à [H + ] [OH - ] K e = (9) [H 2 O] Como a concentração da água [H 2 O] é relativamente alta e constante (é igual ao número de gramas de H 2 O num litro, dividido pelo peso molecular da água, ou seja 1000/ 18 = 55,55 M), o produto Ke [H 2 O] pode expressar-se pela constante Kw (produto iónico da água). Portanto: 4
6 Kw = [H + ] [OH] = (10) Se expressarmos esta equação em termos dos logaritmos dos valores representados: pkw = ph + poh = 14 (11) onde poh tem o valor do - log [OH] por analogia com o valor de ph definido acima. Uma vez que consideraremos somente ácidos e bases fracos em água, o produto das concentrações de [H + ] e [OH - ] será igual a (ou a soma ph + poh = 14). Portanto, se a concentração de H + dum ácido fraco em água for de 10-5 M, a concentração de OH - nessa mesma solução será de 10-9 M. Esta relação é válida para valores de ph entre 0 e 14. Apesar da concentração de H + poder ser expressa em termos de normalidade (N) ou molaridade (M), é um pouco inconveniente, uma vez que se tem de recorrer ou a potências (ex.: 10-6 M) ou a decimais (ex.: 0, M). Assim, para evitar esta dificuldade Sorensen escolheu arbitrariamente expressar a concentração de H + como o negativo do seu logaritmo e designou esta função de ph: ph = - log 10 [H + ] (12) Na tabela I indica-se a relação entre concentração de H +, de OH - e o ph. 5
7 TABELA I. Relação entre concentração de H + expressa em normalidade e o ph [H + ] [ OH - ] log [H + ] - log [H + ] = ph 1N 10 0 N N ,1 N 10-1 N N ,001 N 10-3 N N , N 10-5 N 10-9 N , N 10-7 N 10-7 N , N 10-9 N 10-5 N , N N 10-3 N , N N 10-0 N Tampões Um tampão é, geralmente, uma mistura dum ácido fraco e do seu sal, capaz de absorver ou libertar H +, de modo a evitar alterações na concentração deste ião. Um termo mais descritivo para este sistema seria amortecedor, pois o seu efeito é manter um meio constante, no que diz respeito à concentração de H +, em face de produção ou gasto deste ião por qualquer reacção a nível celular. Eficiência do Tampão A eficiência dum sistema tampão, refere-se à eficácia do sistema para manter a concentração de H +, constante. Quantos moles de H + (ou OH - ) podem ser adicionados a um meio contendo um sistema tampão para alterar significativamente a concentração de H +? Claro que o número de moles necessário é tanto maior quanto mais eficiente for o sistema tampão. Pela equação de Henderson-Hasselbalch, pode verificar-se que a alteração do valor de ph (e portanto da concentração de H + ) depende da razão [A - ]/ [HA], isto é, depende das concentrações do ácido, [HA], e do sal do ácido, [A-]. Uma análise cuidadosa da equação revela também que o sistema tampão (isto é, mistura do ácido e do seu sal) é mais eficiente na manutenção do ph constante, quando [HA] = [A - ] e, portanto, quando ph = pka. Na 6
8 prática, utiliza-se um tampão para manter o ph constante. Este é mais eficiente na gama de valores de ph situados entre uma unidade inferior e uma unidade superior ao valor do pka do ácido fraco (ou base fraca) que serve de tampão. Fora desta gama, a eficiência do tampão é muito reduzida, como se pode verificar na fig. 2, que representa a titulação do ácido acético e do amónio com NaOH. CH 3 COOH CH 3 COO - + H + Fig. 2. Curva de titulação de um ácido fraco, o ácido acético, com um pka = 4,7 Analisando a curva de titulação do ácido acético representada na figura 2 pode verificar-se no início da curva que, a adição de 0,1 do equivalente de NaOH, causa uma alteração no ph de aproximadamente uma unidade. Porém, para valores de ph entre 3,76 e 5,75 (ou seja, uma unidade de ph inferior e uma unidade de ph superior ao pka do ácido) a adição de mais NaOH, aumenta mais lentamente o ph. Fora destes valores de ph, uma 7
9 pequena adição de NaOH causa um aumento relativamente grande no valor do ph. O ácido acético pode, portanto, ser usado como tampão na gama de ph entre 3,76 e 5,76. Para se tamponizar uma solução noutra gama de ph, é necessário usar-se um ácido fraco (ou base fraca) cujo valor do pka corresponda ao ph desejado. Para se preparar o tampão, titula-se o ácido até se obter o ph desejado. Os tampões mais comuns, porque são eficientes a ph fisiológico, são os de fosfato (preparados de ácido fosfórico ou de sais de fosfato), histidina e imidazol. Todas estas substâncias possuem pka entre 6 e 8. Para o caso do ácido fosfórico, com três equivalentes de H + por mole (H 3 PO 4 ), existem três valores de pka. Este ácido pode portanto, servir de tampão em três regiões de ph, correspondentes aos valores de pka do ácido (pka 1 = 2,1; pka 2 = 7,2; pka 3 = 12,3). Fig. 3. Curva de titulação do ácido fosfórico. No caso dos aminoácidos, os grupos carboxílicos dissociam-se a um ph mais baixo do que o ph a que se dissociam os grupos amínicos (Tabela II): 8
10 Tabela II. Os grupos químicos dos aminoácidos e os seus valores de pka. Grupo das proteínas Reacção de dissociação pk Carboxílico COOH COO - + H + 3-4,7 + Imidazol HC NH HC N + H + 6,1 HC CH HC CH N H N H Amínico NH 3 + NH 2 + H + 6,5-10,5 Um aminoácido como a glicina tem dois grupos ionizáveis, logo aprsentará as seguintes formas de ionização, com duas regiões com poder tampão: PK 1 = 2,3 pk 2 = 9,6 H 2 C - COOH H 2 C - COO - + H + H 2 C - COO - + H + NH + 3 NH + 3 NH 2 No caso de aminoácidos com mais de um grupo carboxílico, a curva que representa a titulação do aminoácido com uma base, apresenta uma região tampão para cada grupo carboxílico, além da região tampão correspondente ao grupo amínico. Como exemplo, apresenta-se a dissociação do ácido aspártico: 9
11 COOH COO - COO - COO - pk 1 = 2,1 pk 2 = 3,9 pk 3 = 9,8 HC - NH + 3 HC - NH H + HC - NH H + HC - NH 2 +H + CH 2 -COOH CH 2 -COOH - CH 2 -COO - CH 2 -COO - Carga eléctrica (+1) (0) (-1) (-2) As proteínas possuem vários aminoácidos e, portanto, grupos carboxílicos e amínicos, que se ionizam a diferentes valores de ph. Isto explica o facto de as proteínas serem bons tampões contribuindo para a manutenção do ph nas células. Regulação do ph nos sistemas biológicos No organismo humano existem diversos tipos de regulação do ph (Tabela III). Tabela III. Regulação da concentração de ph nos sistemas biológicos. Tipo de regulação Função Tempo necessário 1. Tampões químicos Combinam-se com o H + milisegundos (Proteínas, HCO 3 -, HPO 4 2- ) (Pr (proteína) + H + PrH) 2. Respiração Eliminação de CO 2 nos pulmões minutos (H + + HCO 3- H 2 CO 3 CO 2 + H 2 O) 3. Regulação renal Secreção de H + horas Reabsorção de HCO e HPO 4 Para além dos tampões químicos, a respiração e a regulação renal têm um papel de relevo os sistemas respiratório e renal. 10
Homeostase do ph. Ácidos e Bases. HA H + + A - HCl H + + Cl - H 2 CO 3 H + + HCO H + + NH 3. Escala de ph
 Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Ácidos, bases e sistemas tampão
 Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Os sais são neutros, ácidos ou básicos? Íons como Ácidos e Bases
 Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 11 Por favor, deixem as calculadoras a postos! http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 11 Por favor, deixem as calculadoras a postos! http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Natal/RN SOLUÇÃO TAMPÃO
 QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
TEORIA DE ÁCIDOS E BASES
 TEORIA DE ÁCIDOS E BASES Proposição de S. Arrhenius (1887) Substâncias produtoras de íons hidrogênio em água fossem chamadas de ácidos Substâncias produtoras de íons hidroxila em água fossem chamadas de
TEORIA DE ÁCIDOS E BASES Proposição de S. Arrhenius (1887) Substâncias produtoras de íons hidrogênio em água fossem chamadas de ácidos Substâncias produtoras de íons hidroxila em água fossem chamadas de
Aula Teórica 3 Cálculo de ph de Ácidos Fracos e Bases Fracas
 Aula Teórica 3 Cálculo de ph de Ácidos Fracos e Bases Fracas JRM Como calcular o ph de soluções de ácidos e bases fracas? Considere um ácido fraco (monoácido), HA H 2 O H OH - ------ Keq ~ 10-14 HA H A
Aula Teórica 3 Cálculo de ph de Ácidos Fracos e Bases Fracas JRM Como calcular o ph de soluções de ácidos e bases fracas? Considere um ácido fraco (monoácido), HA H 2 O H OH - ------ Keq ~ 10-14 HA H A
FCAV/ UNESP Jaboticabal. Disciplina: Química Geral Assunto: Solução Tampão. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
Experimentalmente, definimos a FAIXA DE TAMPONAMENTO de um tampão, sendo o intervalo de 1 unidade acima e 1 unidade abaixo do pka:
 3a LISTA DE EXERCÍCIOS DE TRANSFORMAÇÕES BIOQUÍMICAS PROF. Ana Paula de Mattos Arêas Dau 22/02/2010 03. Defina faixa de tamponamento e poder tamponante. Do que depende cada um? Estes tampões diferem entre
3a LISTA DE EXERCÍCIOS DE TRANSFORMAÇÕES BIOQUÍMICAS PROF. Ana Paula de Mattos Arêas Dau 22/02/2010 03. Defina faixa de tamponamento e poder tamponante. Do que depende cada um? Estes tampões diferem entre
ph do sangue arterial = 7.4
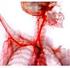
 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
10/22/2013. Segunda Avaliação (20/11): Precipitações Fracionadas. - Precipitações Fracionadas. - Auto-Ionização da Água
 Segunda Avaliação (20/11): - Precipitações Fracionadas - Auto-Ionização da Água - Equílíbrio Químico Tratamento Sistemático - Equilíbrio Ácido-Base e cálculos de ph - Sistemas Tamponantes - Hidrólise 1
Segunda Avaliação (20/11): - Precipitações Fracionadas - Auto-Ionização da Água - Equílíbrio Químico Tratamento Sistemático - Equilíbrio Ácido-Base e cálculos de ph - Sistemas Tamponantes - Hidrólise 1
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes
 ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
Volumetria de Neutralização
 Volumetria de Neutralização H 3 O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva Princípio Envolve titulações de espécies ácidas com soluções padrão alcalinas e titulações de espécies
Volumetria de Neutralização H 3 O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva Princípio Envolve titulações de espécies ácidas com soluções padrão alcalinas e titulações de espécies
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Revisão da aula anterior
 Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
CURVAS DE TITULAÇÃO PARA SISTEMAS ÁCIDO/BASE COMPLEXOS (complicados)
 CURVAS DE TITULAÇÃO PARA SISTEMAS ÁCIDO/BASE COMPLEXOS (complicados)! MISTURA DE 2 ÁCIDOS (ou bases) DE DIFERENTES FORÇAS (pk a )! ÁCIDOS (ou bases) POLIFUNCIONAIS! SUBSTÂNCIAS ANFIPRÓTICAS (podem atuar
CURVAS DE TITULAÇÃO PARA SISTEMAS ÁCIDO/BASE COMPLEXOS (complicados)! MISTURA DE 2 ÁCIDOS (ou bases) DE DIFERENTES FORÇAS (pk a )! ÁCIDOS (ou bases) POLIFUNCIONAIS! SUBSTÂNCIAS ANFIPRÓTICAS (podem atuar
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Produto Iônico da Água. - Equilíbrio Químico -Auto ionização da água -Balanços de carga e massa -Tratamento Sistemático 5/7/2012.
 Próximas Aulas -Ácidos e Bases -Forçados Ácidos -Soluções Tamponantes e Hidrólise - Volumetria Ácido-Base 1 Ácidos e Bases - Equilíbrio Químico -Auto ionização da água -Balanços de carga e massa -Tratamento
Próximas Aulas -Ácidos e Bases -Forçados Ácidos -Soluções Tamponantes e Hidrólise - Volumetria Ácido-Base 1 Ácidos e Bases - Equilíbrio Químico -Auto ionização da água -Balanços de carga e massa -Tratamento
Equilíbrio Ácido Base. Definição de Brønsted-Lowry. O íon H + (aq) é simplesmente um próton sem elétrons. Em água, o H + (aq) forma aglomerados.
 Equilíbrio Ácido Base Definição de Brønsted-Lowry Ácidos têm gosto azedo e bases têm gosto amargo. Definição de Arrhenius: os ácidos aumentam a [H + ] e as bases aumentam a [OH ] em solução. Arrhenius:
Equilíbrio Ácido Base Definição de Brønsted-Lowry Ácidos têm gosto azedo e bases têm gosto amargo. Definição de Arrhenius: os ácidos aumentam a [H + ] e as bases aumentam a [OH ] em solução. Arrhenius:
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE
 TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
TITULAÇÃO BASE FRACA COM ÁCIDO FORTE TITULAÇÃO BASE FRACA COM ÁCIDO FORTE 1 ETAPA Antes de iniciar a titulação A solução contém apenas base fraca e água - solução aquosa de uma base fraca. O ph da solução
Tampão. O que é? MISTURA DE UM ÁCIDO FRACO COM SUA BASE CONJUGADA, QUE ESTABILIZA O P H DE UMA SOLUÇÃO
 Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Ácidos e Bases. Capítulo 15
 Capítulo 15 Ácidos e Bases Ácidos e Bases de Brønsted Propriedades Ácido-Base da Água ph Uma Medida de Acidez Força de Ácidos e de Bases Ácidos Fracos e Constantes de Ionização Ácida Bases Fracas e Constantes
Capítulo 15 Ácidos e Bases Ácidos e Bases de Brønsted Propriedades Ácido-Base da Água ph Uma Medida de Acidez Força de Ácidos e de Bases Ácidos Fracos e Constantes de Ionização Ácida Bases Fracas e Constantes
Água, ph e tampão. Profa. Alana Cecília
 Água, ph e tampão Profa. Alana Cecília Água: Estrutura e Propriedades Físico-químicas A água é o principal componente da maioria das células; Permeia todas as porções de todas as células; Importância em
Água, ph e tampão Profa. Alana Cecília Água: Estrutura e Propriedades Físico-químicas A água é o principal componente da maioria das células; Permeia todas as porções de todas as células; Importância em
FCAV/ UNESP EQUILÍBRIO ÁCIDO-BASE
 FCAV/ UNESP EQUILÍBRIO ÁCIDO-BASE Prof a. Dr a. Luciana M. Saran 1 Tópicos da Aula: Substâncias que interferem no equilíbrio químico da água; Equilíbrio ácido-base; Soluções ácidas, neutras e alcalinas;
FCAV/ UNESP EQUILÍBRIO ÁCIDO-BASE Prof a. Dr a. Luciana M. Saran 1 Tópicos da Aula: Substâncias que interferem no equilíbrio químico da água; Equilíbrio ácido-base; Soluções ácidas, neutras e alcalinas;
Regulação renal do equilíbrio ácido base
 Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
AULA 3. Tratamento Sistemático do Equilíbrio Químico
 AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
O plasma sanguíneo contém uma reserva ("pool") total de carbonato (essencialmente HCO 3-
 Exercícios 1. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é 1,6 x 10-6. Calcular: a) O grau de ionização do ácido para uma solução 10-3 M. b) O ph 2. Segel, Biochemical
Exercícios 1. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é 1,6 x 10-6. Calcular: a) O grau de ionização do ácido para uma solução 10-3 M. b) O ph 2. Segel, Biochemical
Reações ácido base 1
 1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
1 Reações ácido base Evolução Histórica A palavra ácido (acidus, em latim) significa azedo (sabor azedo) A palavra alcalino (do termo árabe al Kali) significa cinza de plantas (sabor amargo e escorregadias
EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS
 EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS Eletrólitos Fortes Fracos Ionizam/Dissociam completamente Ionizam/Dissociam parcialmente Ex: HCl, NaNO 3 Ex: HF, BaSO 4 EQUILÍBRIOS ÁCIDO-BASE
EQUILÍBRIOS IÔNICOS ÁCIDO-BASE SAIS POUCO SOLÚVEIS ÍONS COMPLEXOS Eletrólitos Fortes Fracos Ionizam/Dissociam completamente Ionizam/Dissociam parcialmente Ex: HCl, NaNO 3 Ex: HF, BaSO 4 EQUILÍBRIOS ÁCIDO-BASE
tampão Prof a Alessandra Smaniotto QMC Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B
 Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Cerca de 99% dos átomos no corpo humano são de H, O, C e N. Oxigenio 63% Hidrogenio 25.2% Carbono 9.5% Azoto 1.4%
 Cerca de 99% dos átomos no corpo humano são de H, O, C e N Oxigenio 63% Hidrogenio 25.2% Carbono 9.5% Azoto 1.4% Tipos de ligação covalente mais comuns em biomoleculas As reacções bioquímicas utilizam
Cerca de 99% dos átomos no corpo humano são de H, O, C e N Oxigenio 63% Hidrogenio 25.2% Carbono 9.5% Azoto 1.4% Tipos de ligação covalente mais comuns em biomoleculas As reacções bioquímicas utilizam
A molécula de água A ÁGUA 2
 A água A maior parte da superfície do planeta terra está coberto com água. A água é também a substância mais abundante dos sistemas vivos, perfazendo cerca de 70% ou mais do peso dos mesmos. A água influência
A água A maior parte da superfície do planeta terra está coberto com água. A água é também a substância mais abundante dos sistemas vivos, perfazendo cerca de 70% ou mais do peso dos mesmos. A água influência
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 01 Equilíbrio Ácido-base Profa. Maria Auxiliadora Costa
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 01 Equilíbrio Ácido-base Profa. Maria Auxiliadora Costa
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 II semestre 2016 AULA 01 Equilíbrio Ácido-base Profa. Maria Auxiliadora
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 II semestre 2016 AULA 01 Equilíbrio Ácido-base Profa. Maria Auxiliadora
Ácidos e Bases. a) Produto iônico da água
 1 Ácidos e Bases a) Produto iônico da água A água é anfiprótica. Ou seja, ela tanto doa, com aceita prótons Reação direta: 2H 2O(l) H 3O + (aq) + OH (aq) autoprotólise: uma molécula transfere um próton
1 Ácidos e Bases a) Produto iônico da água A água é anfiprótica. Ou seja, ela tanto doa, com aceita prótons Reação direta: 2H 2O(l) H 3O + (aq) + OH (aq) autoprotólise: uma molécula transfere um próton
LIPOFILIA LIPOFILIA COEFICIENTE DE PARTIÇÃO.
 LIPOFILIA A lipofilia de um composto é comumente estimada usando Log P a partir da partição de um sistema octanol/água aandrico@ifsc.usp.br A lipofilia é uma das propriedades mais importantes relacionadas
LIPOFILIA A lipofilia de um composto é comumente estimada usando Log P a partir da partição de um sistema octanol/água aandrico@ifsc.usp.br A lipofilia é uma das propriedades mais importantes relacionadas
QUI109 QUÍMICA GERAL (Ciências Biológicas) 10ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 10ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) EQUILÍBRIO QUÍMICO T 1 T 2 T 2 > T 1 N 2 O 4 (g) 2NO 2 (g) EQUILÍBRIO
QUI109 QUÍMICA GERAL (Ciências Biológicas) 10ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) EQUILÍBRIO QUÍMICO T 1 T 2 T 2 > T 1 N 2 O 4 (g) 2NO 2 (g) EQUILÍBRIO
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
INTRODUÇÃO. As reacções bioquímicas requerem, muitas vezes, energia. A fonte mais vulgar de energia química é a adenosina trifosfato (ATP).
 INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
INTRODUÇÃO. As reacções bioquímicas requerem, muitas vezes, energia. A fonte mais vulgar de energia química é a adenosina trifosfato (ATP).
 INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
INTRODUÇÃO Célula é a unidade básica dos organismos - tem a área limitada por uma membrana Todas as células são compostas por moléculas pequenas, macromoléculas e organelos. 70% da célula é Água Há quatro
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÕES AQUOSAS Equilíbrios químicos A água e os eletrólitos (solutos que forma íons quando dissolvidos em água):
Disciplina de Química Geral Profa. Marcia Margarete Meier
 Soluções 1 Propriedades gerais das soluções Os materiais são feitos geralmente de misturas de substâncias mais simples. Ex.: ar, sangue, água do mar, ligas metálicas, perfumes, etc As composições precisam
Soluções 1 Propriedades gerais das soluções Os materiais são feitos geralmente de misturas de substâncias mais simples. Ex.: ar, sangue, água do mar, ligas metálicas, perfumes, etc As composições precisam
Equilíbrio Ácido-Base. Ácidos e Bases Fracos
 Equilíbrio Ácido-Base Ácidos e Bases Fracos ph de soluções CH 3 COOH (aq) 0,10 mol/dm 3 HCl (aq) 0,10 mol/dm 3 ph? ph= 2,9 ph= 1 [H 3 O + ] < [H 3 O + ] PORQUÊ? 2 ph de soluções Segundo Arrhenius o ácido
Equilíbrio Ácido-Base Ácidos e Bases Fracos ph de soluções CH 3 COOH (aq) 0,10 mol/dm 3 HCl (aq) 0,10 mol/dm 3 ph? ph= 2,9 ph= 1 [H 3 O + ] < [H 3 O + ] PORQUÊ? 2 ph de soluções Segundo Arrhenius o ácido
Universidade Federal Rural de Pernambuco
 Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Lista de Exercícios 8 Resolução pelo Monitor: Rodrigo Papai de Souza
 Lista de Exercícios 8 Resolução pelo Monitor: Rodrigo Papai de Souza 1) What is the ph of the buffer solution that contains 2,2 g of NH 4 Cl in 250 ml of 0,12M NH 3? Is the final ph lower or higher than
Lista de Exercícios 8 Resolução pelo Monitor: Rodrigo Papai de Souza 1) What is the ph of the buffer solution that contains 2,2 g of NH 4 Cl in 250 ml of 0,12M NH 3? Is the final ph lower or higher than
CAPÍTULO 3 SISTEMA TAMPÃO
 17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
4. Ácidos e Bases em Química Orgânica
 4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
EQUILÍBRIO ÁCIDO-BASE 1
 EQUILÍBRIO ÁCIDO-BASE 1 1- Definição de ph Os possíveis valores da concentração de H + e OH -, em uma solução aquosa, podem ser de várias ordens de magnitude, variando de cerca de 10 1,3 a 10-15,3. Assim
EQUILÍBRIO ÁCIDO-BASE 1 1- Definição de ph Os possíveis valores da concentração de H + e OH -, em uma solução aquosa, podem ser de várias ordens de magnitude, variando de cerca de 10 1,3 a 10-15,3. Assim
1- Reação de auto-ionização da água
 Equilíbrio Iônico 1- Reação de auto-ionização da água A auto- ionização da água pura produz concentração muito baixa de íons H 3 O + ou H + e OH -. H 2 O H + (aq) + OH - (aq) (I) ou H 2 O + H 2 O H 3 O
Equilíbrio Iônico 1- Reação de auto-ionização da água A auto- ionização da água pura produz concentração muito baixa de íons H 3 O + ou H + e OH -. H 2 O H + (aq) + OH - (aq) (I) ou H 2 O + H 2 O H 3 O
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS
 SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
TITULAÇÃO ÁCIDO-BASE
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química I semestre 2018 TITULAÇÃO ÁCIDO-BASE Ácidos Polipróticos Profa.
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química I semestre 2018 TITULAÇÃO ÁCIDO-BASE Ácidos Polipróticos Profa.
Concentração de soluções
 Concentração de soluções Química Geral Prof. Edson Nossol Uberlândia, 02/09/2016 Solução: mistura homogênea, em nível molecular, de duas ou mais substâncias O solvente é o meio em que uma outra substância,
Concentração de soluções Química Geral Prof. Edson Nossol Uberlândia, 02/09/2016 Solução: mistura homogênea, em nível molecular, de duas ou mais substâncias O solvente é o meio em que uma outra substância,
Introdução à Análise Química QUI 094 VOLUMETRIA DE NEUTRALIZAÇÃO
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos VOLUMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos VOLUMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE
CINÉTICA QUÍMICA Folha 15 Prof.: João Roberto Mazzei
 01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
Fundamentos de Química Profa. Janete Yariwake. Equilíbrio químico em solução aquosa. Soluções-tampão. Soluções tampão
 Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
BIOQUÍMICA PARA ODONTO
 BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
Química Analítica IV TITULOMETRIA DE NEUTRALIZAÇÃO
 Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE FRACA COM ÁCIDO
Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE NEUTRALIZAÇÃO 1 TITULAÇÃO BASE FRACA COM ÁCIDO
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS
 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
TITULAÇÃO ÁCIDO-BASE
 Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química II sem/2015 Profa Ma Auxiliadora Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Gabaritos Resolvidos Energia Química Semiextensivo V4 Frente C
 01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 01 Equilíbrio Ácido-base Profa. Maria Auxiliadora Costa
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 01 Equilíbrio Ácido-base Profa. Maria Auxiliadora Costa
Constantes de acidez e basicidade
 Constantes de acidez e basicidade Quando se dissolve ácido nítrico, HNO 3, em água, o ácido ioniza-se de acordo com a equação: HNO 3 (aq) + H 2 O (l) NO 3 (aq) + H 3 O + (aq) A extensão desta reação relaciona-se
Constantes de acidez e basicidade Quando se dissolve ácido nítrico, HNO 3, em água, o ácido ioniza-se de acordo com a equação: HNO 3 (aq) + H 2 O (l) NO 3 (aq) + H 3 O + (aq) A extensão desta reação relaciona-se
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei
 EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
AMPLIAÇÃO DOS CONCEITOS DE EQUÍLÍBRIO ÁCIDO BASE
 AMPLIAÇÃO DOS CONCEITOS DE EQUÍLÍBRIO ÁCIDO BASE Gás carbônico atmosférico CO 2 ph < 7 mais ácido OH H + menos ácido CO 2 H 2 O H 2 H + H ph > 7 1 Cálculo de ph para soluções de ácidos e bases fortes e
AMPLIAÇÃO DOS CONCEITOS DE EQUÍLÍBRIO ÁCIDO BASE Gás carbônico atmosférico CO 2 ph < 7 mais ácido OH H + menos ácido CO 2 H 2 O H 2 H + H ph > 7 1 Cálculo de ph para soluções de ácidos e bases fortes e
PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA CADERNO DE PROVAS
 PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA 20/10/2013 INSTRUÇÕES CADERNO DE PROVAS 1. Confira, abaixo, seu nome e número de inscrição. Confira, também, o curso e a série correspondentes à sua inscrição.
PROCESSO SELETIVO DE TRANSFERÊNCIA EXTERNA 20/10/2013 INSTRUÇÕES CADERNO DE PROVAS 1. Confira, abaixo, seu nome e número de inscrição. Confira, também, o curso e a série correspondentes à sua inscrição.
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) DISSOCIAÇÃO ÁCIDO/BASE Constante de dissociação de ácido: K a O ácido nitroso (HNO 2 ) é um ácido fraco, então Enquanto
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) DISSOCIAÇÃO ÁCIDO/BASE Constante de dissociação de ácido: K a O ácido nitroso (HNO 2 ) é um ácido fraco, então Enquanto
Química das soluções. Profa. Denise Lowinshon
 Química das soluções Profa. Denise Lowinshon denise.lowinsohn@ufjf.edu.br http://www.ufjf.br/nupis 1º semestre 2018 Equilíbrio ácido base Bibliografia Brown, LeMay e Bursten, Química - A ciência central,
Química das soluções Profa. Denise Lowinshon denise.lowinsohn@ufjf.edu.br http://www.ufjf.br/nupis 1º semestre 2018 Equilíbrio ácido base Bibliografia Brown, LeMay e Bursten, Química - A ciência central,
Volumetria Ácido-base
 Volumetria Ácido-base H O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
Volumetria Ácido-base H O + + OH - H + +OH - ou 2H 2 O H 2 O Profa. Lilian Lúcia Rocha e Silva INDICADOR ÁCIDO-BASE São ácidos ou bases orgânicas fracas que sofrem dissociação ou associação dependendo
Reações ácido-base. Ácidos. Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre).
 Ácidos Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre). H + é conhecido como próton Ácidos com um próton ácido são chamados monopróticos (por
Ácidos Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre). H + é conhecido como próton Ácidos com um próton ácido são chamados monopróticos (por
Fundamentos de Química Profa. Janete Yariwake
 Soluções. Equilíbrio químico em solução aquosa Equilíbrio químico: ácidos e bases 1 ácidos e bases cf. Arrhenius Exemplo: Preparo de uma solução de HCl em água HCl (aq) + H 2 O H 3 O + (aq) + Cl (aq) íon
Soluções. Equilíbrio químico em solução aquosa Equilíbrio químico: ácidos e bases 1 ácidos e bases cf. Arrhenius Exemplo: Preparo de uma solução de HCl em água HCl (aq) + H 2 O H 3 O + (aq) + Cl (aq) íon
II - ELECTROFORESE DE AMINOÁCIDOS
 II - ELECTROFORESE DE AMINOÁCIDOS Introdução Muitas moléculas biológicas apresentam carga eléctrica cujo valor e sinal depende das suas características e também do ph e da composição do meio em que se
II - ELECTROFORESE DE AMINOÁCIDOS Introdução Muitas moléculas biológicas apresentam carga eléctrica cujo valor e sinal depende das suas características e também do ph e da composição do meio em que se
Exercícios de Equilíbrio Iônico I
 Exercícios de Equilíbrio Iônico I 1. Uma substância química é considerada ácida devido a sua tendência em doar íons H + em solução aquosa. A constante de ionização Ka é a grandeza utilizada para avaliar
Exercícios de Equilíbrio Iônico I 1. Uma substância química é considerada ácida devido a sua tendência em doar íons H + em solução aquosa. A constante de ionização Ka é a grandeza utilizada para avaliar
QUÍMICA - 2 o ANO MÓDULO 19 EQUILÍBRIO IÔNICO - PARTE 1
 QUÍMICA - 2 o ANO MÓDULO 19 EQUILÍBRIO IÔNICO - PARTE 1 H O 2 + H + 2 - H - 2 O + 2 - H + - H O 2 2 + H + - Como pode cair no enem (PUC) A tabela abaixo se refere a dados de forças relativas de ácidos
QUÍMICA - 2 o ANO MÓDULO 19 EQUILÍBRIO IÔNICO - PARTE 1 H O 2 + H + 2 - H - 2 O + 2 - H + - H O 2 2 + H + - Como pode cair no enem (PUC) A tabela abaixo se refere a dados de forças relativas de ácidos
Estrutura e propriedade de aminoácidos Definição de ácidos fracos, fortes Ligação peptídica Peptídeos. Referência: Stryer ou Lehninger
 Estrutura e propriedade de aminoácidos Definição de ácidos fracos, fortes Ligação peptídica Peptídeos Referência: Stryer ou Lehninger Deoxi-hemoglobina Slide - Lehninger 5a edição Estrutura de proteínas
Estrutura e propriedade de aminoácidos Definição de ácidos fracos, fortes Ligação peptídica Peptídeos Referência: Stryer ou Lehninger Deoxi-hemoglobina Slide - Lehninger 5a edição Estrutura de proteínas
13/08/2018. Escala de ph. Escala de ph. Crescimento básico. Crescimento ácido. Neutro. básico
 Escala de ph Crescimento básico Neutro Crescimento ácido Escala de ph básico 1 Sistema tampão Um par conjugado ácido-base tende a resistir a alteração de ph, quando pequenas quantidades de ácido ou base
Escala de ph Crescimento básico Neutro Crescimento ácido Escala de ph básico 1 Sistema tampão Um par conjugado ácido-base tende a resistir a alteração de ph, quando pequenas quantidades de ácido ou base
O CONCEITO DE ARRHENIUS PARA ÁCIDOS E BASES
 ÁCIDOS E BASES O CONCEITO DE ARRHENIUS PARA ÁCIDOS E BASES Apresentado pelo químico, físico e matemático sueco Svante August Arrhenius (18591927) em 1887. Ácidos são substâncias que, quando dissolvidas
ÁCIDOS E BASES O CONCEITO DE ARRHENIUS PARA ÁCIDOS E BASES Apresentado pelo químico, físico e matemático sueco Svante August Arrhenius (18591927) em 1887. Ácidos são substâncias que, quando dissolvidas
QUÍMICA GERAL Ácidos e Bases
 QUÍMICA GERAL Ácidos e Bases Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia 1 Produto iônico da água A água
QUÍMICA GERAL Ácidos e Bases Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia 1 Produto iônico da água A água
QBQ 0204 Bioquímica. Carlos Hotta e Glaucia Souza. Introdução à disciplina 11/03/17
 QBQ 0204 Bioquímica Introdução à disciplina Carlos Hotta e Glaucia Souza 11/03/17 Organização do curso Os tópicos serão tratados em aulas expositivas e resolução de exercícios. Material disponível em http://carloshotta.com.br/qbq0304
QBQ 0204 Bioquímica Introdução à disciplina Carlos Hotta e Glaucia Souza 11/03/17 Organização do curso Os tópicos serão tratados em aulas expositivas e resolução de exercícios. Material disponível em http://carloshotta.com.br/qbq0304
Curva de titulação efeito da concentração
 Exercício 1) Considere a titulação de 100 ml de solução HCl 0,0100 mol L -1 com solução padrão de NaOH 0,0500 mol L -1. Calcule o ph da solução do titulado após a adição das seguintes quantidades de titulante:
Exercício 1) Considere a titulação de 100 ml de solução HCl 0,0100 mol L -1 com solução padrão de NaOH 0,0500 mol L -1. Calcule o ph da solução do titulado após a adição das seguintes quantidades de titulante:
Prof.ª Loraine Jacobs
 Funções Inorgânicas Prof.ª Loraine Jacobs lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Ácidos e Bases Fracos Soluções de ácidos diferentes com a mesma concentração podem não
Funções Inorgânicas Prof.ª Loraine Jacobs lorainejacobs@utfpr.edu.br http://paginapessoal.utfpr.edu.br/lorainejacobs Ácidos e Bases Fracos Soluções de ácidos diferentes com a mesma concentração podem não
02/03/2012. Rodrigo Borges, M.Sc. Absorção Distribuição Metabolização ou biotransformação Excreção
 Rodrigo Borges, M.Sc 2012 Movimento dos fármacos no organismo O que o organismo faz sobre a droga É o estudo da velocidade com que os fármacos atingem o sítio de ação e são eliminados do organismo, bem
Rodrigo Borges, M.Sc 2012 Movimento dos fármacos no organismo O que o organismo faz sobre a droga É o estudo da velocidade com que os fármacos atingem o sítio de ação e são eliminados do organismo, bem
QUÍMICA. Equilíbrio Químico. Sistemas Homogêneos: Solubilidade dos Sais, Hidrólise dos Sais e Curvas de Titulação - Parte 2. Prof ª.
 QUÍMICA Equilíbrio Químico - Parte 2 Prof ª. Giselle Blois HIDRÓLISE SALINA É a reação entre o sal e a água produzindo o ácido e a base correspondentes. * O processo é reversível, logo deve ser estudado
QUÍMICA Equilíbrio Químico - Parte 2 Prof ª. Giselle Blois HIDRÓLISE SALINA É a reação entre o sal e a água produzindo o ácido e a base correspondentes. * O processo é reversível, logo deve ser estudado
BC0307 Transformações Químicas. Equilíbrio Químico
 Equilíbrio Químico - Avaliação do equilíbrio heterogêneo: K= [Ca2+ ]. [CO 3 2- ] [CaCO 3 ] H 2 O CaCO 3 (s) Ca 2+ 2- + CO 3 K. [CaCO 3 ] = [Ca 2+ ]. [CO 3 2- ] Kps = [Ca 2+ ]. [CO 3 2- ] Concentração necessária
Equilíbrio Químico - Avaliação do equilíbrio heterogêneo: K= [Ca2+ ]. [CO 3 2- ] [CaCO 3 ] H 2 O CaCO 3 (s) Ca 2+ 2- + CO 3 K. [CaCO 3 ] = [Ca 2+ ]. [CO 3 2- ] Kps = [Ca 2+ ]. [CO 3 2- ] Concentração necessária
FUNÇÕES INORGÂNICAS. As substâncias são agrupadas de acordo com as suas propriedades. ÁCIDO BASE SAL ÓXIDO
 FUNÇÕES INORGÂNICAS As substâncias são agrupadas de acordo com as suas propriedades. ÁCIDO BASE SAL ÓXIDO ÁCIDOS e BASES de ARRHENIUS Acidos são substâncias que em solução aquosa liberam H +. Ex. HCl +
FUNÇÕES INORGÂNICAS As substâncias são agrupadas de acordo com as suas propriedades. ÁCIDO BASE SAL ÓXIDO ÁCIDOS e BASES de ARRHENIUS Acidos são substâncias que em solução aquosa liberam H +. Ex. HCl +
Introdução à Bioquímica
 Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
2005 by Pearson Education. Capítulo 04
 QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
Soluções, concentrações e diluições
 Soluções, concentrações e diluições Mistura homogênea constituída: soluto (presente em menor quantidade) solvente (presente em maior quantidade). MASSA MOLECULAR: soma das massas atômicas de cada átomo
Soluções, concentrações e diluições Mistura homogênea constituída: soluto (presente em menor quantidade) solvente (presente em maior quantidade). MASSA MOLECULAR: soma das massas atômicas de cada átomo
Química das soluções. Profa. Denise Lowinshon
 Química das soluções Profa. Denise Lowinshon denise.lowinsohn@ufjf.edu.br http://www.ufjf.br/nupis 2º semestre 2017 Equilíbrio ácido base Bibliografia Brown, LeMay e Bursten, Química - A ciência central,
Química das soluções Profa. Denise Lowinshon denise.lowinsohn@ufjf.edu.br http://www.ufjf.br/nupis 2º semestre 2017 Equilíbrio ácido base Bibliografia Brown, LeMay e Bursten, Química - A ciência central,
CURSO ABSOLUTO VESTIBULARES - ISOLADO DE QUÍMICA EQUILÍBRIO IÔNICO Prof.: Mazzei
 01. O ácido cianídrico tem ampla aplicação industrial, sendo matéria-prima para a fabricação de vários bens de consumo. Entretanto, ao trabalhar-se com essa substância deve-se tomar o devido cuidado. Esse
01. O ácido cianídrico tem ampla aplicação industrial, sendo matéria-prima para a fabricação de vários bens de consumo. Entretanto, ao trabalhar-se com essa substância deve-se tomar o devido cuidado. Esse
EQUILÍBRIO ÁCIDO BASE. Profa. Marcia M. Meier QUÍMICA GERAL II
 EQUILÍBRIO ÁCIDO BASE Profa. Marcia M. Meier QUÍMICA GERAL II 1 EQUILÍBRIO ÁCIDO BASE Ácidos e bases são dois tipos muito comuns de substâncias encontradas no laboratório e no mundo cotidiano. Inclusive
EQUILÍBRIO ÁCIDO BASE Profa. Marcia M. Meier QUÍMICA GERAL II 1 EQUILÍBRIO ÁCIDO BASE Ácidos e bases são dois tipos muito comuns de substâncias encontradas no laboratório e no mundo cotidiano. Inclusive
Solução Comentada Prova de Química
 34. Considere duas soluções de ácido clorídrico (HCl), um ácido forte, (solução I), e ácido acético (CH 3 COOH), um ácido fraco, k a =1,8 x 10-5, (solução II). Ambas as soluções com concentração 0,02 mol.
34. Considere duas soluções de ácido clorídrico (HCl), um ácido forte, (solução I), e ácido acético (CH 3 COOH), um ácido fraco, k a =1,8 x 10-5, (solução II). Ambas as soluções com concentração 0,02 mol.
Química C Semiextensivo V. 4
 Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
MÓDULO 1 ESTRUTURA DE BIOMOLÉCULAS. Bianca Zingales IQ-USP
 MÓDULO 1 ESTRUTURA DE BIOMOLÉCULAS Bianca Zingales IQ-USP Biomoléculas As biomoléculas são compostos químicos presentes nas células de todos os seres vivos. São em geral moléculas orgânicas, compostas
MÓDULO 1 ESTRUTURA DE BIOMOLÉCULAS Bianca Zingales IQ-USP Biomoléculas As biomoléculas são compostos químicos presentes nas células de todos os seres vivos. São em geral moléculas orgânicas, compostas
