UNIVERSIDADE FEDERAL DE OURO PRETO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS BEATRIZ CARVALHO CUNHA
|
|
|
- Danilo Neves Sampaio
- 6 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DE OURO PRETO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS BEATRIZ CARVALHO CUNHA AVALIAÇÃO DA ATIVIDADE LEISHMANICIDA DO EXTRATO HIDROALCOÓLICO DA PRÓPOLIS VERDE OURO PRETO - MINAS GERAIS - BRASIL 2017
2 BEATRIZ CARVALHO CUNHA AVALIAÇÃO DA ATIVIDADE LEISHMANICIDA DO EXTRATO HIDROALCOÓLICO DA PRÓPOLIS VERDE Linha de Pesquisa: Terapêutica, Vacina, Diagnóstico e Prognóstico das Doenças Área de Concentração: Fármacos e Medicamentos Subárea: Protozoologia de Parasitos Dissertação apresentada ao Programa de Pós- Graduação em Ciências Farmacêuticas, da Universidade Federal de Ouro Preto, como requisito parcial para obtenção do título de Mestre em Ciências Farmacêuticas. Orientadora: Prof a. Dr a Sandra Aparecida Lima de Moura. Co-orientadora: Dr a Míriam Conceição de Souza Testasicca. OURO PRETO - MINAS GERAIS - BRASIL 2017
3 C972a Cunha, Beatriz Carvalho. Avaliação da atividade Leishmanicida do extrato hidroalcoólico da própolis verde [manuscrito] / Beatriz Carvalho Cunha f.: il.: color; grafs. Orientador: Prof. Dr. Sandra Aparecida Lima de Moura. Coorientador: Prof. Dr. Míriam Conceição de Souza Testasicca. Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Escola de Farmácia. Departamento de Farmácia. Programa de Pós-Graduação em Ciências Farmacêuticas. Área de Concentração: Fármacos e Medicamentos. 1. Própolis verde. 2. Extrato hidroalcoólico. 3. Leishmania amazonensis. I. Moura, Sandra Aparecida Lima de. II. Testasicca, Míriam Conceição de Souza. III. Universidade Federal de Ouro Preto. IV. Titulo. CDU: 615.1/.2 Catalogação:
4
5 AGRADECIMENTOS AGRADECIMENTOS À Deus, fonte de minha força e perseverança, pelo dom da vida e por ter permitido que eu trilhasse essa trajetória. Aos meus pais, Inês e José, pelo apoio incondicional, pelas palavras de conforto e incentivo. Por todo amor, carinho e cuidado a mim dedicados. À toda a minha família, pelo apoio e confiança. À Henrique, que tornou esta jornada mais leve e feliz, agradeço pelo companheirismo e cuidado em todos os momentos. À Lorena, que embarcou comigo nesta jornada e sempre esteve disposta a ouvir e ajudar. Aos meus amigos que, mesmo distantes fisicamente em sua maioria, se mantiveram sempre presentes, me incentivando e acreditando no meu potencial. Aos amigos que fiz em Ouro Preto, em especial Ana Lia, que além de tudo foi de grande importância para a realização de parte dos experimentos, e Carol. E à República Castelo dos Nobres, por todos os momentos de entretenimento proporcionados. Às minhas orientadora e co-orientadora, Sandra Aparecida Lima de Moura e Míriam Conceição de Souza Testasicca, por todos os ensinamentos e amizade. À Marina, por todo o suporte nos experimentos, pela amizade e pelas conversas estimuladoras e de apoio. À Carol e Pryscila, por toda a colaboração nos experimentos in vivo. Ao professor Luís Carlos Crocco Afonso e à professora Maria Terezinha Bahia, por disponibilizarem reagentes e equipamentos dos seus laboratórios, que foram fundamentais para a realização deste trabalho. À PharmaNectar, por ceder o extrato da própolis verde utilizado neste trabalho. II
6 RESUMO RESUMO As leishmanioses, que tem protozoários parasitos do gênero Leishmania como agentes etiológicos, são doenças de grande importância em saúde pública no Brasil. Há uma gama muito restrita de fármacos para o tratamento da leishmaniose e, além disso, estes apresentam alta toxicidade, comprometendo a eficácia da terapia. Assim, a busca por outras alternativas terapêuticas se faz necessária. Neste contexto, a própolis representa uma potencial alternativa para auxiliar no tratamento da leishmaniose, uma vez que a sua atividade leishmanicida vem sendo avaliada e relatada na literatura. Este estudo tem como finalidade avaliar a atividade leishmanicida do extrato hidroalcoólico da própolis verde sobre Leishmania amazonensis, tanto in vitro, quanto in vivo. Para tanto, a atividade leishmanicida do extrato hidroalcoólico da própolis verde foi avaliada em cultura de formas promastigotas, de formas amastigotas axênicas e de macrófagos peritoneais murinos infectados, e em camundongos C57BL/6 infectados por L. amazonensis. Nos testes in vitro, observou-se que o extrato hidroalcoólico da própolis verde não foi tóxico para macrófagos peritoneais murinos nas concentrações testadas e foi capaz de inibir a proliferação de L. amazonensis a partir da concentração 62,5 µg/ml para formas promastigotas, 31,25 µg/ml para formas amastigotas axênicas e 250 µg/ml para formas amastigotas intracelulares. Para os ensaios in vivo, foram utilizados camundongos C57BL/6 divididos em quatro grupos: grupos tratados com o extrato hidroalcoólico da própolis verde na dose de 250 mg/kg/dia, por 2 e 8 semanas e os respectivos grupos controle. No tempo de 2 semanas, houve uma redução da carga parasitária no linfonodo poplíteo drenante, mas não houve redução da carga na pata infectada. No tempo de 8 semanas, houve aumento da carga parasitária no linfonodo poplíteo drenante, mas não houve alteração na pata infectada. Para ambos os tempos de tratamento, não houve influência significativa no tamanho da lesão na pata infectada. Conclui-se que o extrato hidroalcoólico da própolis verde possui efeitos inibitórios sobre L. amazonensis in vitro, de maneira concentração-dependente e, na infecção in vivo, este extrato possui efeito leishmanicida apenas nos estágios iniciais da infecção. Palavras-chave: Própolis verde, extrato hidroalcoólico, Leishmania amazonensis. III
7 ABSTRACT ABSTRACT Leishmaniasis has protozoan parasites of the genus Leishmania as etiological agentes and are diseases of great importance in public health in Brazil. There is a very narrow range of drugs for the treatment of leishmaniasis and, in addition, they present high toxicity, compromising the efficacy of the therapy. Thus, the search for other therapeutic alternatives becomes necessary. In this context, propolis represents a potential alternative to assist in the treatment of leishmaniasis, since its leishmanicidal activity has been evaluated and reported in the literature. This study aims to evaluate the leishmanicidal activity of the hydroalcoholic extract of the green propolis on Leishmania amazonensis, both in vitro and in vivo. For this, the leishmanicidal activity of the green propolis hydroalcoholic extract was evaluated in culture of promastigotes, axenic amastigotes and murine peritoneal macrophages, and in C57BL/6 mice infected with L. amazonensis. In the in vitro tests, it was observed that the hydroalcoholic extract of the green propolis was not toxic to murine peritoneal macrophages in the tested concentrations and was able to inhibit the proliferation of L. amazonensis from 62,50 μg/ml for promastigotes, 31,25 μg/ml for axenic amastigote forms and 250 μg/ml for intracellular amastigote forms. For the in vivo assays, C57BL/6 mice were divided into four groups: groups treated with the hydroalcoholic extract of green propolis at a dose of 250 mg/kg/day for 2 and 8 weeks and the respective control groups. At 2 weeks, there was a reduction of the parasitic load on the draining popliteal lymph node, but there was no reduction of the load on the infected paw. At 8 weeks, there was an increase in the parasitic load on the draining popliteal lymph node, but there was no change in the infected paw. For both treatment times, there was no significant influence on the lesion size in the infected paw. It is concluded that the hydroalcoholic extract of green propolis has inhibitory effects on L. amazonensis in vitro in a dose-dependent manner and, in in vivo infection, this extract has leishmanicidal effect only in the initial stages of infection. Keywords: Green propolis, hydroalcoholic extract, Leishmania amazonensis. IV
8 LISTA DE FIGURAS LISTA DE FIGURAS Figura 1: Ciclo de vida de Leishmania...13 Figura 2: Delineamento experimental Figura 3: Avaliação da viabilidade de macrófagos peritoneais murinos expostos ao extrato hidroalcoólico da própolis verde em diferentes concentrações...33 Figura 4: Curva de crescimento da cepa PH8 de L. amazonensis...34 Figura 5: Curva de crescimento de formas promastigotas de L. amazonensis exposta ao extrato hidroalcoólico da própolis verde...35 Figura 6: Avaliação da viabilidade de formas promastigotas de L. amazonensis expostas ao extrato hidroalcoólico da própolis verde...37 Figura 7: Curva de crescimento de formas amastigotas axênicas L. amazonensis expostas ao extrato hidroalcoólico da própolis verde...40 Figura 8: Avaliação da viabilidade de formas amastigotas axênicas de L. amazonensis expostas ao extrato hidroalcoólico da própolis verde...41 Figura 9: Avaliação da atividade leishmanicida do extrato hidroalcoólico da própolis verde contra formas amastigotas intracelulares...43 Figura 10: Macrófagos peritoneais murinos infectados por L. amazonensis...44 Figura 11: Curva de desenvolvimento de lesão na pata de camundongos C57BL/6 infectados por L. amazonensis e submetidos ao tratamento com extrato hidroalcoólico de própolis verde na dose de 250 mg/kg...46 Figura 12: Carga parasitária da pata e linfonodo poplíteo drenante de camundongos C57BL/6 infectados por L. amazonensis e submetidos ao tratamento com extrato hidroalcoólico de própolis verde...47 Figura 13: Fotomicrografia de cortes histológicos (4 μm, HE) de coxim plantar de camundongos C57BL/6 infectados por L. amazonensis...51 V
9 SUMÁRIO SUMÁRIO 1 INTRODUÇÃO REVISÃO BIBLIOGRÁFICA Leishmaniose Ciclo de vida do parasito Leishmania amazonensis Própolis OBJETIVOS Objetivo geral Objetivos específicos JUSTIFICATIVA MATERIAL E MÉTODOS Manutenção da cepa de Leishmania amazonensis Extrato hidroalcoólico da própolis verde Animais Avaliação do efeito do extrato hidroalcoólico da própolis verde na viabilidade celular Isolamento de macrófagos peritoneais Determinação da viabilidade celular Avaliação in vitro da atividade leishmanicida do extrato hidroalcoólico da própolis verde contra formas promastigotas de L. amazonensis Determinação das curvas de crescimento Determinação da viabilidade dos parasitos Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas axênicas de L. amazonensis Cultivo de formas amastigotas axênicas Determinação das curvas de crescimento Determinação da viabilidade dos parasitos VII
10 SUMÁRIO 5.7 Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas intracelulares Estudo da atividade leishmanicida in vivo Enriquecimento de formas promastigotas metacíclicas a partir de culturas de L. amazonensis Infecção e tratamento dos camundongos Determinação da carga parasitária Avaliação histopatológica da pata dos camundongos C57BL/6 infectados por L. amazonensis Análise estatística RESULTADOS E DISCUSSÃO Identificação e quantificação de componentes ativos no extrato hidroalcoólico da própolis verde Avaliação do efeito do extrato hidroalcoólico da própolis verde na viabilidade celular Curva de crescimento de L. amazonensis Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde em cultura de formas promastigotas de L. amazonensis Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas axênicas de L. amazonensis Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas intracelulares Determinação do tamanho da lesão decorrente da infecção por L. amazonensis Avaliação in vivo da atividade leishmanicida do extrato hidroalcoólico da própolis verde em camundongos C57BL/6 infectados por L. amazonensis Avaliação histopatológica das lesões desenvolvidas em camundongos C57BL/6 infectados por L. amazonensis e tratados com extrato hidroalcoólico de própolis verde RESUMO DOS RESULTADOS CONCLUSÃO REFERÊNCIAS VII
11 SUMÁRIO ANEXO I...62 ANEXO II...75 VII
12 INTRODUÇÃO 1 INTRODUÇÃO As leishmanioses são doenças negligenciadas causadas por protozoários parasitos do gênero Leishmania, que são transmitidos para os humanos por meio da picada da fêmea de insetos flebotomíneos (WHO, 2016). Existem quatro formas principais da doença: visceral, cutânea, mucocutânea e difusa (KEVRIC et al., 2015). A leishmaniose cutânea causa lesões na pele e é a forma mais comum da doença. Cerca de 95% dos casos de leishmaniose cutânea ocorrem nas Américas, na bacia do Mediterrâneo e na Ásia. Estima-se que 0,7 a 1,3 milhões de novos casos ocorram anualmente em todo o mundo (WHO, 2016). No Brasil, são reconhecidas pelo menos sete espécies de parasitos causadores de leishmaniose cutânea, sendo os mais comuns L. (V.) braziliensis, L. (V.) guyanensis e L. (L.) amazonensis. Mais raramente, L. (V.) lainsoni, L. (V.) naiffi e L. (V.) shawi também são observados (VALE & FURTADO, 2005). Os fármacos de primeira escolha para o tratamento das leishmanioses são os antimoniais pentavalentes (Sb(V)), encontrados em duas formas: antimoniato de N- metilglucamina e estibogluconato de sódio, que não é comercializado no Brasil (MINISTÉRIO DA SAÚDE, 2010). O antimoniato de N-metilglucamina é indicado para o tratamento de todas as formas clínicas da leishmaniose tegumentar americana, embora as formas mucosas exijam maior cuidado, podendo apresentar respostas mais lentas e maior possibilidade de recidivas (MINISTÉRIO DA SAÚDE, 2010). Não havendo resposta satisfatória frente ao tratamento com o antimonial pentavalente, os fármacos de segunda escolha são a anfotericina B e as pentamidinas, que incluem o sulfato de pentamidina e o mesilato de pentamidina (MINISTÉRIO DA SAÚDE, 2010). Há uma gama muito restrita de fármacos disponíveis para o tratamento da leishmaniose e estes medicamentos apresentam alta toxicidade, acarretando em diversos efeitos adversos indesejáveis, que comprometem a eficácia da terapia. Além disso, já foram observadas cepas do parasito resistentes aos antimoniais (KANSAL et al., 2012). Outro problema frequentemente observado na terapia anti-leishmania é a taxa de recaídas, em que parasitos podem se tornar novamente detectáveis após um tempo e, neste caso, podem não ser responsivos ao fármaco utilizado no primeiro tratamento (CARVALHO & FERREIRA, 2001). Assim, a busca por outras alternativas terapêuticas para a leishmaniose se faz necessária. 9
13 INTRODUÇÃO Neste contexto, a própolis vem sendo estudada quanto à sua propriedade leishmanicida e representa uma potencial alternativa para auxiliar no tratamento da leishmaniose. A própolis é um produto natural de fácil aquisição e é utilizada pela humanidade há séculos. É produzida por abelhas (Appis mellifera) a partir de flores e exsudatos das plantas, juntamente com secreções salivares, cera e pólen, sendo sua composição química dependente da especificidade da flora local. Este fato resulta na grande diversidade da composição química da própolis, especialmente aquela oriunda de regiões tropicais (BANKOVA et al, 2005a). A resina que constitui a própolis possui frações solúveis em água e frações solúveis em álcool. O extrato hidroalcoólico é a combinação das duas frações da própolis verde, a aquosa e a alcoólica, proporcionando a mais alta concentração de compostos fitoquímicos. O extrato utilizado neste trabalho consiste em um extrato hidroalcoólico da própolis verde, que é produzido sob rigorosos padrões de controle de qualidade e é comercializado com a marca Cytopropolis. Dentre as indicações de uso do Cytopropolis, estão: antibiótico, anti-inflamatório, antimicótico, antioxidante e nutracêutico antitumoral. Sendo que a atividade leishmanicida deste composto ainda não havia sido testada anteriormente. Já foi demonstrada atividade biológica da própolis contra diversos microrganismos, tais como Staphylococcus aureus, Salmonella thyphimuruim, Candida albicans, Trypanosoma cruzi e Giardia duonenalis (HIGASHI & DE CASTRO, 1994; MARCUCCI et al., 2001; MIORIN et al., 2003; UZEL et al., 2005; DANTAS et al., 2006; FREITAS et al., 2006; TRUSHEVA et al., 2006). Além destes, também foi evidenciada atividade da própolis contra L. amazonenis, L. brasiliensis e L. infantum (AYRES et al., 2007; PONTIN et al., 2008; FERREIRA et al., 2014). Diante dessas considerações, este trabalho tem como finalidade avaliar os efeitos do extrato hidroalcoólico da própolis verde (Cytopropolis ) sobre a infecção por L. amazonensis, tanto in vitro, em formas promastigotas, amastigotas axênicas e amastigotas intracelulares, quanto in vivo, em camundongos C57BL/6 infectados. 10
14 REVISÃO BIBLIOGRÁFICA 2 REVISÃO BIBLIOGRÁFICA 2.1 Leishmaniose As leishmanioses são doenças causadas por diferentes espécies de protozoários do gênero Leishmania, que são parasitos intracelulares obrigatórios pertencentes à família Trypanossomatidae, transmitidos pelo inseto flebotomíneo durante o repasto sanguíneo (MARTINEZ & PETERSEN, 2014). Trata-se de uma doença negligenciada e que afeta, principalmente, a população pobre da África, Ásia e América Latina, estando associada com mal nutrição, moradias precárias, migração populacional e deficiências imunológicas. Segundo dados da Organização Mundial da Saúde (2016), 98 países e territórios são endêmicos para leishmaniose e estima-se que cerca de 0,2 a 0,4 milhões de novos casos de leishmaniose visceral e 0,7 a 1,2 milhões de novos casos de leishmaniose cutânea ocorrem a cada ano em todo o mundo. O Brasil está na lista dos seis países que concentram mais de 90% de todos os casos de leishmaniose visceral registrados. A leishmaniose cutânea é a forma mais amplamente distribuída, compreendendo cerca de um terço dos casos registrados nas Américas, no Mediterrâneo e na Ásia, sendo que o Brasil está entre os dez países com maior número de casos (WHO, 2016). Assim, a leishmaniose é uma doença de grande importância em saúde pública no Brasil, devido à sua ampla distribuição pelo território nacional, à ocorrência de formas clínicas graves e às dificuldades de diagnóstico e de tratamento das mesmas (KANSAL et al., 2012). Em seres humanos, a leishmaniose pode se manifestar em diferentes formas clínicas, com vários graus de severidade: a tegumentar ou cutânea, a mucocutânea, a difusa e a visceral, também conhecida como calazar. Além disso, esta doença pode ser assintomática nos humanos e nos animais que servem de reservatório para o parasito (KEVRIC et al., 2015; LOEUILLET et al., 2016). O que determina o tipo da doença é a espécie do parasito e o estado imunológico do hospedeiro. Em geral, pacientes imunossuprimidos, crianças e idosos tendem a ser afetados de forma mais intensa e são mais susceptíveis ao desenvolvimento da forma visceral da doença (STEBUT, 2014). L. amazonensis é agente etiológico da leishmaniose tegumentar ou cutânea, sendo capaz de causar a leishmaniose visceral em alguns casos (KANSAL et al., 2012). A leishmaniose tegumentar ou cutânea é a forma mais comum da doença, ocorrendo em 90% dos pacientes (STEBUT, 2014). Esta forma da doença pode se manifestar em três 11
15 REVISÃO BIBLIOGRÁFICA formas clínicas: leishmaniose cutânea, mucocutânea e cutânea difusa. Apesar dessas possibilidades de variações nas manifestações clínicas da leishmaniose tegumentar, 75% dos pacientes apresentam um quadro típico, caracterizado por úlceras arredondadas com bordas elevadas e um centro necrótico. Além disso, o indivíduo pode apresentar linfadenopatia no início da infecção (OLIVEIRA et al., 2011). A extensão das lesões depende em grande parte da resposta imunológica desenvolvida pelo hospedeiro (MARTINEZ & PETERSEN, 2014). O diagnóstico da leishmaniose inclui biópsia, observação de sinais clínicos, análise histológica, cultura do parasito, PCR e testes parasitológicos e sorológicos (STEBUT, 2014). Na leishmaniose cutânea e mucocutânea, as manifestações clínicas, juntamente com testes parasitológicos, confirmam o diagnóstico, sendo que, para estes casos, os testes sorológicos tem valor limitado, devido aos resultados falso negativos na fase inicial da infecção (WHO, 2016). 2.2 Ciclo de vida do parasito O agente etiológico da leishmaniose é transmitido pelo inseto flebotomíneo durante o repasto sanguíneo. Os principais flebotomínios capazes de transmitir este parasito pertencem ao gênero Lutzomyia, no Novo Mundo, e ao gênero Phlebotomus, no Velho Mundo (MARTINEZ & PETERSEN, 2014). Os parasitos possuem diferentes formas evolutivas, que apresentam em sua superfície diversas moléculas que são de fundamental importância para a relação entre parasito e hospedeiro, influenciando na virulência, infecciosidade, sobrevivência e patogênese. Exemplos de moléculas determinantes no processo de infecção são o lipofosfoglicano (LPG) e a metaloproteinase gp63 (JOSHI et al., 2002). A Leishmania sp. é infecciosa durante todos os seus estágios de vida, porém o inseto flebotomíneo transmite a forma promastigota metacíclica, que é a forma mais infecciosa (KANSAL et al., 2012). Durante o repasto sanguíneo, o inseto inocula o parasito juntamente com sua saliva, que tem propriedades anticoagulante e vasodilatadora. Além disso, a saliva do flebotomínio é quimiotática para monócitos e imunorreguladora, com capacidade de interagir com macrófagos, impedindo suas ações efetoras contra o parasito e aumentando a sua proliferação. As formas promastigotas metacíclicas são resistentes à lise pelo complemento devido à presença do lipofosfoglicano em sua superfície e à metaloproteinase gp63, que cliva as proteínas do complemento (KAYE & SCOTT, 2011). 12
16 REVISÃO BIBLIOGRÁFICA A internalização da Leishmania sp. se dá por meio de endocitose mediada por receptores presentes na superfície dos macrófagos. Após a internalização, a promastigota metacíclica é encontrada dentro do vacúolo parasitóforo e se transforma na forma amastigota, que é capaz de resistir ao meio ácido do vacúolo digestivo. As amastigotas se multiplicam até o momento em que são liberadas da célula e passam a ser internalizadas por outros macrófagos (KAYE & SCOTT, 2011). A infecção do hospedeiro invertebrado ocorre no momento do repasto sanguíneo em um hospedeiro infectado, em que há ingestão de formas amastigotas. Ao chegarem ao intestino do inseto, essas formas são envolvidas pela matriz peritrófica, onde se transformam em formas promastigotas (figura 1) (KAYE & SCOTT, 2011). Figura 1: Ciclo de vida da Leishmania. Adaptado de KAYE & SCOTT, O período de incubação, que corresponde ao período entre a picada do inseto e o aparecimento das primeiras lesões, varia de duas semanas a três meses. A lesão inicial pode regredir espontaneamente após um período, pode permanecer estacionária ou evoluir para um nódulo dérmico denominado histiocitoma (HANDLER et al., 2015; SCOTT & NOVAIS, 2016.). 2.3 Leishmania amazonensis 13
17 REVISÃO BIBLIOGRÁFICA Existem pelo menos vinte espécies de Leishmania descritas e que estão associadas com a leishmaniose humana. No Brasil, a L. amazonensis está entre as espécies mais amplamente distribuídas, principalmente pelas florestas tropicais da região amazônica, estendendo-se à região Nordeste, Centro-oeste e Sudeste (LAINSON, 1983; GRIMALDI et al., 1987). L. amazonensis é, na maioria dos casos, agente etiológico da leishmaniose cutânea. Geralmente, a infecção por L. amazonensis gera pequenas lesões localizadas, porém em alguns casos causa a forma difusa da doença, que é uma forma mais agressiva caracterizada por nódulos espalhados pelo corpo, anergia aos antígenos parasitários e falta de responsividade à terapia (VELASQUEZ, et al., 2016). Quanto à virulência, L. amazonensis apresenta algumas características que a diferenciam das outras espécies do parasito. No interior dos macrófagos, L. amazonensis se desenvolve em um vacúolo parasitóforo extremamente grande em relação às outras espécies, sendo que as amastigotas podem coabitar em um grande vacúolo comum. Possivelmente, o processo de fusão/fissão que ocorre a nível dessas organelas é diferente na infecção por L. amazonensis quando comparado à infecção por outras espécies de Leishmania sp. Além disso, L. amazonensis permanece inerte no interior dos macrófagos por um tempo maior, o que pode ser um fator favorável para a ação de fármacos leishmanicidas (ANTOINE et al., 1998; OSORIO Y FORTEA et al., 2007). 2.4 Tratamento da leishmaniose A terapia convencional da leishmaniose consiste basicamente em quatro fármacos: antimoniais pentavalentes, pentamidinas, anfotericina B desoxicolato e anfotericina B lipossomal. As primeiras alternativas terapêuticas são os antimoniais pentavalentes (Sb(V)), encontrados em duas formas: antimoniato de N-metilglucamina e estibogluconato de sódio, que não é comercializado no Brasil (MINISTÉRIO DA SAÚDE, 2010). O antimoniato de N- metilglucamina é indicado para o tratamento de todas as formas clínicas da leishmaniose tegumentar americana, no entanto, as formas mucosas exigem maior cuidado, podendo apresentar respostas mais lentas e maior possibilidade de recidivas (MINISTÉRIO DA SAÚDE, 2010). As exceções para esta conduta terapêutica são Índia, onde os antimoniais já foram completamente substituídos por anfotericina B devido à resistência, e Guiana Francesa, onde mais de 90% dos casos de leishmaniose cutânea são causados por L. guyanensis, que 14
18 REVISÃO BIBLIOGRÁFICA tem por tratamento de escolha a pentamidina (MALTEZOU et al., 2008; NACHER et al., 2001). Apesar de os antimoniais pentavalentes serem utilizados para o tratamento da leishmaniose desde 1940, o seu mecanismo de ação ainda não é totalmente elucidado, existindo dois modelos que buscam esclarecer tal mecanismo (FRÉZARD et al., 2009). Segundo o primeiro modelo, o antimonial pentavalente, Sb(V), é uma pró-droga que, quando absorvida, é reduzida a um ativo mais tóxico, o antimonial trivalente, Sb(III), que seria a forma ativa final (MISHAN, et al., 2001). Estudos apontam que os tióis podem agir como agentes redutores nesta conversão. Três tióis presentes nas células dos mamíferos (glutationa, cisteína e cisteinil-glicina) e um tiol presente no parasito (conjugado glutationa-espermina, tripanotiona) tem sido reportados como importantes na redução de Sb(V) a Sb(III) (FERREIRA et al, 2003; YAN et al.,2003). Além destes tióis, enzimas específicas da Leishmania parecem atuar no processo de redução do Sb(V), a redutase dependente de tiol e a antimoniato redutase (DENTON et al., 2004; ZHOU et al., 2004). Há evidências de que o Sb(III) entra no parasito por meio de uma aquaglicerilporina (AQP1) e o nível de expressão deste transportador determina a resistência do parasito ao Sb(III) (GOURBAL et al., 2004). No interior do parasito, o Sb(III) forma complexos estáveis com tióis, enzimas, proteínas e peptídeos, levando à inibição da expressão de genes essenciais e ao aumento da susceptibilidade da célula ao estresse oxidativo, ocasionando em morte celular por apoptose (FRÉZARD et al., 2001). De acordo com o segundo modelo, Sb(V) apresenta uma atividade anti-leishmania intrínseca, com capacidade de inibir a DNA topoisomerase tipo I (CHAKRABORTY et al., 1988). Quando não há uma resposta satisfatória com o tratamento com o antimonial pentavalente, os fármacos de segunda escolha são a anfotericina B e as pentamidinas, que incluem o sulfato de pentamidina e o mesilato de pentamidina (MINISTÉRIO DA SAÚDE, 2010). A anfotericina B age inibindo a síntese do ergosterol, que é o principal esterol constituinte da membrana celular do parasito. Este fármaco é altamente eficaz para o tratamento da leishmaniose visceral, com uma taxa de cura de 90% (SUNDAR et al., 2007). A anfotericina B desoxicolato é o único fármaco que até então não selecionou parasitos resistentes (LUPI et al., 2009). Entretanto, é um tratamento de baixa tolerabilidade e com efeitos adversos que incluem nefrotoxicidade, hipocalemia, miocardite e anemia, que implicam em necessidade de monitoramento e internação hospitalar, aumentando os custos da terapia (KEVRIC et al., 2015; SUNDAR & SINGH, 2016). 15
19 REVISÃO BIBLIOGRÁFICA Com o intuito de diminuir os efeitos tóxicos da anfotericina B desoxicolato, foram desenvolvidas as formulações lipídicas deste fármaco. A anfotericina B lipossomal possui um regime de tratamento mais curto, com menor toxicidade e taxa de cura acima de 95% para leishmaniose visceral (OLLIARO et al., 2005). Porém, é um medicamento de alto custo, sendo pouco acessível na grande maioria das regiões endêmicas para leishmaniose (MURRAY, HW., 2012). Por causa da pouca acessibilidade a este fármaco, existe um acordo de preços com a Organização Mundial de Saúde, em que há diminuição dos custos da anfotericina B lipossomal para os países em desenvolvimento que são áreas endêmicas (SUNDAR & SINGH, 2016). Os dados de uso da anfotericina B lipossomal no tratamento da leishmaniose cutânea são limitados; no entanto, é utilizada como primeira linha de tratamento para leishmaniose cutânea e mucocutânea nos países não endêmicos (HARMS, G. et al., 2003). As pentamidinas são outra alternativa terapêutica em casos de intolerância ou resistência aos antimoniais, sendo altamente eficaz nas infecções por L. guyanensis e L. braziliensis. O mecanismo de ação das pentamidinas não está bem esclarecido, podendo estar associado a interações com o DNA ou com nucleotídeos e seus derivados, ou por interferir na captação de poliaminas. Também apresenta efeitos adversos, tais como hipotensão, nefrotoxicidade e hepatotoxicidade, sendo recomendado o acompanhamento laboratorial durante o tratamento (KEVRIC et al., 2015). Assim, as terapias disponíveis para a leishmaniose apresentam alta toxicidade, baixa eficácia e altos custos. Além disso, já foram observadas cepas de Leishmania sp. que apresentam resistência aos antimoniais (KANSAL et al., 2012). Outro problema frequentemente observado na terapia é a taxa de recaída, em que o paciente volta a apresentar parasitismo tecidual e, neste caso, pode se tornar não responsivo ao fármaco utilizado no primeiro tratamento (CARVALHO & FERREIRA, 2001). Justifica-se, assim, a busca de outras alternativas terapêuticas. 2.5 Própolis A própolis é um material resinoso produzido por abelhas da espécie Apis mellifera a partir de brotos e exsudatos de plantas, que são coletados e misturados à secreções salivares ou orgânicas das abelhas, além de pólen e cera (SFORCIN, 2016; NASCIMENTO et al., 2016). A própolis é um produto natural utilizado pela humanidade há séculos por apresentar atividades biológicas e farmacológicas, como atividade imunomoduladora, antitumoral, anti- 16
20 REVISÃO BIBLIOGRÁFICA inflamatória, antioxidante, antibacteriana, antiviral, antifúngica, antiparasitária, dentre outras (SFORCIN & BANKOVA, 2011). Alguns autores demonstraram a atividade da própolis contra diversos microrganismos. Higashi & de Castro (1994) demonstraram atividade da própolis extraída em etanol e em dimetilsulfóxido contra formas amastigotas e tripomastigotas de Trypanosoma cruzi. Dantas et al. (2006) também demonstraram atividade da própolis contra T. cruzi ao testaram a própolis búlgara extraída em etanol e em acetona. Marcucci et al. (2001) isolaram quatro compostos da própolis verde brasileira (ácido 3-prenil-4-hidroxicinâmico, 2,2-dimetil-6- carboxietenil-2h-1-benzopirano, ácido 3,5-diprenil-4-hidroxicinâmico e 2,2-dimetil-6- carboxietenil-8-prenil-2h-1-benzopirano) e os testaram contra T. cruzi, Escherichia coli, Pseudomonas aeruginosa, Staphylococcus aureus e Streptococcus faecalis. Todos os compostos apresentaram atividade contra o protozoário e, com exceção do primeiro, todos foram eficazes contra as bactérias analisadas. Miorin et al. (2003) testaram a atividade do extrato etanólico da própolis verde contra S. aureus e demonstraram que este extrato exibe atividade antibacteriana contra este microrganismo. Uzel et al. (2005) também observaram atividade antimicrobiana do extrato etanólico da própolis ao testarem seu efeito contra Streptococcus mutans, Streptococcus sobrinus e Candida albicans. Trusheva et al. (2006) demonstraram atividade da própolis vermelha extraída em etanol e éter de petróleo contra C. albicans e S. aureus. Freitas et al. (2006) observaram inibição do crescimento de trofozoítos de Giardia duodenalis pelo extrato etanólico da própolis. Além destes, também foi demonstrada atividade da própolis contra algumas espécies de Leishmania. Ayres et. al. (2007) demonstraram atividade do extrato etanólico da própolis verde contra L. amazonenis in vitro. Pontin et al. (2008) observaram atividade do extrato hidroalcoólico da própolis verde contra L. brasiliensis in vitro e in vivo e Ferreira et al. (2014) evidenciaram atividade do extrato aquoso da própolis verde brasileira conta L. infantum in vivo. A atividade leishmanicida da própolis vem sendo elucidada tanto in vitro quanto in vivo. Foi demonstrado efeito protetor da própolis contra várias espécies de Leishmania, incluindo L. amazonensis. A própolis atua diretamente sobre as formas promastigotas e amastigotas, além de ser capaz de ativar macrófagos e estimular a produção de substâncias microbicidas por estas células, e, em experimentos in vivo, diminuir as lesões causadas pelo parasito (ODA et al., 2011). Em geral, a própolis in natura é composta por 30% de cera, 50% de resina e bálsamo vegetal, 10% de óleos essenciais e aromáticos e 10% de pólen e outras substâncias 17
21 REVISÃO BIBLIOGRÁFICA (BURDOCK, 1998). Cerca de 300 compostos já foram identificados e caracterizados em diferentes amostras de própolis. Os principais constituintes são os compostos fenólicos, sendo representados pelas agliconas de flavonoides, ácidos fenólicos e seus ésteres, os quais são responsáveis pelos diversos efeitos terapêuticos (BANKOVA et al., 2005a; SOUSA et al., 2007; LUSTOSA et al., 2007). Além destes, também são encontrados ácidos aromáticos, aldeídos, terpenos, aminoácidos, polissacarídeos, hidrocarbonetos, álcoois, hidroxibenzenos, dentre outros (MARCUCCI, 1995). A composição química da própolis depende das condições fitogeográficas do local de coleta e do método de extração utilizado, o que dificulta a padronização do seu uso, uma vez que diferentes amostras podem apresentar diferentes atividades biológicas. Por isso, essas atividades biológicas da própolis devem ser sempre associadas à informações acerca da composição química e da sua fonte botânica (BANKOVA, 2005b). Para este trabalho, foi utilizado o extrato hidroalcoólico da própolis verde produzido em Belo Horizonte, Minas Gerais, pela empresa PharmaNectar. Este extrato, após ser caracterizado e ter seus compostos ativos identificados e quantificados, foi classificado como pertencente ao grupo 12 da própolis brasileira. Além disso, sua origem botânica foi identificada como Baccharis dracunculifolia (Anexo I). O método de extração utilizado concentra as duas frações da própolis verde, a aquosa e a alcoólica, conferindo uma alta concentração de componentes ativos, proporcionando, assim, uma maior amplitude de efeitos biológicos quando comparado com as frações isoladas. Após o processo de extração, a preparação concentrada foi submetida à liofilização, possibilitando, assim, a obtenção de um extrato seco. Este foi, então, encapsulado a 50% p/p em cápsulas de 700 miligramas. Salientase que este extrato é um produto registrado e comercializado com a marca Cytopropolis, sendo assim, cada lote produzido é submetido às mesmas análises descritas no anexo I, o que garante a qualidade e reprodutibilidade dos efeitos biológicos proporcionados por este extrato. Dentre estes efeitos biológicos apresentados pelo Cytopropolis, estão: antibiótico, antiinflamatório, antimicótico, antioxidante e nutracêutico antitumoral. Sendo que a atividade leishmanicida deste composto ainda não havia sido testada anteriormente. 18
22 OBJETIVOS 3 OBJETIVOS 3.1 Objetivo geral Avaliar a atividade leishmanicida do extrato hidroalcoólico da própolis verde sobre L. amazonensis in vitro e in vivo. 3.2 Objetivos específicos Avaliar in vitro a citotoxicidade do extrato hidroalcoólico da própolis verde em macrófagos peritoneais murinos Determinar in vitro a atividade leishmanicida do extrato hidroalcoólico da própolis verde em cultura de formas promastigotas de L. amazonensis Determinar in vitro a atividade leishmanicida do extrato hidroalcoólico da própolis verde em cultura axênica de formas amastigotas de L. amazonensis Analisar in vitro a atividade leishmanicida do extrato hidroalcoólico da própolis verde em macrófagos peritoneais murinos experimentalmente infectados por L. amazonensis Avaliar in vivo a atividade leishmanicida do extrato hidroalcoólico da própolis verde em camundongos C57BL/6 experimentalmente infectados por L. amazonensis, através do acompanhamento do tamanho da lesão em função do tempo, da determinação da carga parasitária e da avaliação das características histopatológicas no sítio da infecção. 19
23 JUSTIFICATIVA 4 JUSTIFICATIVA A leishmaniose consiste em um grave problema de saúde pública, principalmente nos países tropicais e subtropicais. No entanto, os fármacos disponíveis para o tratamento desta doença apresentam alta toxicidade, acarretando em diversos efeitos adversos indesejáveis, que comprometem a eficácia da terapia. Dentre os efeitos adversos, destacam-se: artralgia, mialgia, náuseas, vômito, cefaléia, anorexia, leucopenia, comprometimento cardíaco, além de aumento das enzimas transaminases, da fosfatase alcalina, da lipase e da amilase. Dessa forma, o tratamento da leishmaniose tegumentar americana, em algumas situações, torna-se complexo, principalmente em indivíduos idosos e portadores de co-morbidades, como cardiomiopatias, nefropatias e diabetes mellitus. Assim, alternativas terapêuticas efetivas na redução da carga parasitária e com menos efeitos tóxicos representam um grande avanço no tratamento para a leishmaniose. Dentro deste contexto, com base nos dados já existentes na literatura, a própolis pode representar um potencial agente leishmanicida, que, além de possuir potencial atividade contra o parasito, também é capaz de modular a resposta inflamatória do hospedeiro. Além disso, trata-se de uma substância natural e de fácil aquisição. Assim, a melhor elucidação dos efeitos da própolis verde sobre a infecção por L. amazonensis poderá subsidiar a busca por uma nova alternativa terapêutica para auxiliar no tratamento da leishmaniose. 20
24 MATERIAL E MÉTODOS 5 MATERIAL E MÉTODOS 5.1 Manutenção da cepa de Leishmania amazonensis Para a realização deste trabalho, foi utilizada a cepa IFLA/BR/67/PH8 de Leishmania amazonensis. Os parasitos foram cultivados em estufa BOD a 25 C em Grace s Insect Medium (Sigma-Aldrich, St. Louis, MO, EUA) suplementado com 10% de soro fetal bovino (SFB - LGC, Cotia, SP, Brasil) previamente inativado a 56 C por 30 minutos, 1 mm de L glutamina (Gibco BRL, Grand Island, NY, EUA) e 100 unidades/ml de penicilina G potássica (USB Corporation, Cleveland, OH, EUA), ph 6,5 (Grace s 10% SFB). As passagens da cultura foram mantidas por três dias de incubação. 5.2 Extrato hidroalcoólico da própolis verde A própolis foi produzida em Caeté, Minas Gerais, região rica em Baccharis dracunculifolia nativa. O extrato hidroalcoólico foi padronizado, caracterizado e gentilmente cedido pela empresa PharmaNectar, Belo Horizonte, MG, Brasil. Salienta-se que se trata de um produto registrado e comercializado com a marca Cytopropolis. Para todos os ensaios in vitro, o extrato seco foi solubilizado em dimetilsulfóxido (DMSO) a uma concentração de 75 mg/ml e filtrado em membrana de 0,22 µm. Esta solução foi dissolvida em meio de cultura para obter uma solução a 500 µg/ml, na qual a concentração de DMSO é de 0,67%, não apresentando toxicidade. Realizou-se diluição seriada a partir da solução estoque, obtendo-se as oito concentrações utilizadas nos testes. Para o experimento in vivo, o extrato foi dissolvido em água autoclavada a uma concentração de 37,5 mg/ml. Os animais receberam diariamente 200 µl desta solução por meio de gavagem, correspondendo à 7,5 mg de extrato, que, para um animal de 30 gramas, consiste em uma dose de 250 mg/kg. 5.3 Animais Para a obtenção dos macrófagos utilizados nos experimentos in vitro foram utilizados camundongos fêmeas da linhagem BALB/c, com idade média entre seis e oito semanas. Para os experimentos in vivo foram utilizados camundongos fêmeas da linhagem C57BL/6, com idade média entre seis e oito semanas. Os animais foram provenientes do Centro de Ciência 21
25 MATERIAL E MÉTODOS Animal (CCA) da Universidade Federal de Ouro Preto (UFOP). Foram mantidos em grupos com quatro animais, em gaiolas de plástico, em temperatura entre 21ºC e 25ºC, em ciclo de claro e escuro, e receberam ração padrão e água ad libitum. O Comitê de Ética em Pesquisa da UFOP aprovou este estudo, sob os protocolos 2015/58 e 2017/01 (Anexo II). 5.4 Avaliação do efeito do extrato hidroalcoólico da própolis verde na viabilidade celular Isolamento de macrófagos peritoneais Os testes in vitro foram realizados com macrófagos peritoneais de camundongos BALB/c. Estimulou-se o recrutamento dos macrófagos para o peritônio dos animais por meio de injeção de solução de amido de milho, na concentração de 20 mg/ml, em água, na cavidade peritoneal, um dia antes da eutanásia (PHILIPPEAUX, MM. et al., 2009; BAHIA, MT. et al., 2014). Os camundongos foram eutanasiados em câmara de CO 2 e foi obtido o lavado peritoneal por meio de injeção de 10 ml de solução salina tamponada (PBS) estéril e posterior recuperação do fluido. O lavado foi centrifugado a 1500 rpm, à 4ºC, por 10 minutos, o sobrenadante foi descartado e o pellet ressuspendido em meio RPMI 1640 suplementado com 10% de SFB, 1000 U/mL de penicilina, 1 mm de L-glutamina (GIBCO BRL), 2,5% de HEPES 1M, 0,1% de β-mercaptoetanol e 4,9% de bicarbonato de sódio (RPMI 1640 completo). As células foram quantificadas em câmara de Neubauer e o número de células por mililitro da amostra foi estimado como a média do número de células contadas nos quatro quadrantes da câmara multiplicada pelo fator de diluição da amostra e por 10 4, que é o fator de correção da câmara Determinação da viabilidade celular Para avaliar o efeito do extrato hidroalcoólico da própolis verde sobre a viabilidade de macrófagos peritoneais, foi utilizada a técnica do MTT (brometo de 3-(4,5-dimetiltiazol-2-il)- 2,5-difenil-tetrazólio) (MOSMANN, 1983; SIEUWERTS et al, 1995). Os macrófagos isolados de acordo com a metodologia descrita no item foram adicionados à microplacas estéreis de 96 poços, consistindo em 5x10 5 macrófagos por poço em um volume final de 50 µl de meio RPMI 1640 completo. As placas foram mantidas por 24 horas em estufa umidificada a 37 C, 5% de CO 2, para adesão das células aos poços. Após este período, todos os poços foram lavados com 200 L de meio RPMI 1640 para retirar as células que não aderiram e, em seguida, a formulação testada foi adicionada aos poços, 22
26 MATERIAL E MÉTODOS seguindo diluição seriada de 500 a 3,9 µg/ml, obtendo-se um volume final de 200 L em cada poço. Como controle, células foram incubadas na presença de meio de cultura, correspondendo a 100% de viabilidade. As placas foram incubadas por 24, 48 e 72 horas em estufa umidificada a 37 C, 5% de CO 2. Decorrido o tempo de incubação, retirou-se as formulações testadas e lavou-se os poços 2 vezes com meio RPMI 1640 e adicionou-se a cada poço 150 L de meio de cultura e 20 L de solução de MTT a 2,5 mg/ml em meio RPMI As placas foram incubadas por 4 horas em estufa umidificada a 37 C, 5% de CO 2. Os cristais de azul de formazan, resultado da redução do MTT pelas células viáveis, foram dissolvidos pela adição de 100 L de SDS a 10% em HCl 10 mm, seguido por um período de incubação de 16 horas, nas mesmas condições anteriores. A leitura da absorbância foi realizada em leitor de microplaca (Molecular Devices) utilizando comprimento de onda de 570 nm. 5.5 Avaliação in vitro da atividade leishmanicida do extrato hidroalcoólico da própolis verde contra formas promastigotas de L. amazonensis Para avaliar o efeito do extrato hidroalcoólico da própolis verde sobre formas promastigotas de L. amazonensis foram utilizados dois métodos: a determinação das curvas de crescimento e a determinação da viabilidade dos parasitos por meio do ensaio de MTT, cujos procedimentos estão descritos abaixo Determinação das curvas de crescimento Os parasitos foram cultivados em placas de 24 poços, iniciando-se a cultura na concentração de 1x10 5 parasitos/ml em meio Grace s acrescido de diferentes concentrações do extrato (500 a 3,9 µg/ml). Como controle, manteve-se uma cultura em condições padrão. As placas foram, então, incubadas em estufa BOD a 25 C. A cultura foi, então, quantificada diariamente, por meio de contagem em câmara de Neubauer após diluição em formalina 4%, por 10 dias. O número de parasitos por mililitro da amostra foi estimado como a média do número de parasitos contados nos quatro quadrantes da câmara multiplicada pelo fator de diluição da amostra e por 10 4, que é o fator de correção da câmara Determinação da viabilidade dos parasitos 23
27 MATERIAL E MÉTODOS As formas promastigotas foram cultivadas na presença de diferentes concentrações do extrato da própolis (500 a 3,9 µg/ml), em placas de 96 poços, sendo 5x10 5 parasitos por poço, em um volume de 50 µl de meio Grace s. As placas foram, então, incubadas por 24, 48 e 72 horas a 25ºC. A atividade leishmanicida das diferentes concentrações do extrato foi avaliada por meio da técnica do MTT (SIEUWERTS et al.,1995). Após os períodos de incubação, cada placa foi centrifugada a 1700 xg, à 4ºC, por 10 minutos, o sobrenadante foi removido e adicionou-se a cada poço 150 µl de meio Grace s e 20 µl da solução de MTT a 2,5 mg/ml em meio Grace s. A placa foi, então, incubada a 25ºC, por 4 horas. Os cristais de azul de formazan, resultado da redução do MTT pelos parasitos viáveis, foram dissolvidos pela adição de 100 L de SDS a 10% em HCl 10 mm, seguida por um período de incubação de 16 horas, nas mesmas condições anteriores. A leitura da absorbância foi realizada em leitor de microplaca (Molecular Devices) utilizando comprimento de onda de 570 nm. 5.6 Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas axênicas de L. amazonensis Para avaliar o efeito do extrato hidroalcoólico da própolis verde sobre formas amastigotas axênicas de L. amazonensis foram utilizados dois métodos: a determinação das curvas de crescimento e a determinação da viabilidade dos parasitos por meio do ensaio de MTT, cujos procedimentos estão descritos abaixo Cultivo de formas amastigotas axênicas Formas promastigotas de L. amazonensis foram cultivadas por 7 dias, até atingirem a fase estacionária de crescimento e foram, então, lavadas uma vez em PBS ph 7,4 a xg, por 10 minutos. Em seguida, os parasitos foram cultivados em meio Grace s suplementado com 5% de soro fetal bovino previamente inativado a 56 C por 30 minutos, 1 mm de L glutamina e 100 unidades/ml de penicilina G potássica, ph 5,4 e incubados a 32ºC por 7 dias até a completa transformação em formas amastigotas-like (TEIXEIRA et al., 2002) Determinação das curvas de crescimento Os parasitos foram cultivados em placas de 24 poços na concentração de 1x10 5 parasitos/ml em meio Grace s suplementado com 5% SFB, 1 mm de L glutamina e
28 MATERIAL E MÉTODOS unidades/ml de penicilina G potássica, ph 5,4, acrescido de diferentes concentrações do extrato (500 a 3,9 µg/ml). As placas foram, então, incubadas a 32ºC. Como controle, manteve-se uma cultura em condições padrão. A cultura foi, então, quantificada diariamente, por meio de contagem em câmara de Neubauer após diluição em formalina 4%, por 10 dias. O número de parasitos por mililitro da amostra foi estimado como a média do número de parasitos contados nos quatro quadrantes da câmara multiplicada pelo fator de diluição da amostra e por 10 4, que é o fator de correção da câmara Determinação da viabilidade dos parasitos As formas amastigotas axênicas foram cultivadas na presença de diferentes concentrações do extrato hidroalcoólico da própolis (500 a 3,9 µg/ml), em placas de 96 poços, sendo 5x10 5 parasitos por poço, em um volume de 50 µl de meio Grace s suplementado com 5% de soro fetal bovino, 1 mm de L glutamina e 100 unidades/ml de penicilina G potássica, ph 5,4. As placas foram, então, incubadas por 24, 48 e 72 horas, a 32ºC. A atividade leishmanicida das diferentes concentrações do extrato foi avaliada por meio da técnica do MTT (SIEUWERTS et al.,1995). Após os períodos de incubação, cada placa foi centrifugada a 1700 xg por 10 minutos, o sobrenadante foi removido e adicionou-se a cada poço 150 µl de meio Grace s (5% SFB, ph 5,4) e 20 µl da solução de MTT a 2,5 mg/ml em meio. A placa foi, então, incubada a 32ºC, por 18 horas. Os cristais de azul de formazan, resultado da redução do MTT pelas células viáveis, foram dissolvidos pela adição de 100 L de SDS a 10% em HCl 10 mm, seguida por um período de incubação de 16 horas, nas mesmas condições anteriores. A leitura da absorbância foi realizada em leitor de microplaca (Molecular Devices) utilizando comprimento de onda de 570 nm. 5.7 Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas intracelulares Os macrófagos peritoneais obtidos conforme descrito no item foram cultivados na proporção de 6x10 5 células por poço, em um volume de 500 µl de meio RPMI 1640 completo, em placas de 24 poços contendo lamínulas de cultura de tecidos de 13 mm estéreis. As placas foram incubadas por 24 horas em estufa de CO 2 a 5%, a 37ºC para adesão das células aos poços. Decorrido o tempo de incubação, os poços foram lavados duas vezes com meio e os macrófagos aderidos foram infectados com formas promastigotas de L. 25
29 MATERIAL E MÉTODOS amazonensis na fase estacionária de crescimento, na proporção de 10 parasitos para cada macrófago em um volume final de 200 µl de meio RPMI 1640 completo. As placas foram, então, incubadas por 4 horas em estufa de CO 2 a 5%, a 33ºC. Posteriormente, as placas foram lavadas três vezes com meio a fim de retirar as formas promastigotas livres e os macrófagos infectados foram incubados com meio contendo o extrato hidroalcoólico da própolis verde em diferentes concentrações (500 a 3,9 µg/ml) por 24, 48 e 72 horas a 37ºC, 5% de CO 2. Como controle, foram mantidos macrófagos infectados não tratados. Após os tempos de incubação, o sobrenadante foi retirado e os poços foram fixados com metanol por 10 minutos e corados com Giemsa. Foi realizada a contagem de 200 macrófagos por poço para calcular a porcentagem de macrófagos infectados e o número de amastigotas por macrófago. 5.8 Estudo da atividade leishmanicida in vivo Enriquecimento de formas promastigotas metacíclicas a partir de culturas de L. amazonensis Iniciou-se uma cultura de L. amazonensis com 1x10 5 parasitos/ml. No quinto dia de cultura, início de fase estacionária, onde se pode obter a maior quantidade de formas metacíclicas, a cultura foi centrifugada a 1540 xg, a 4 C, por 10 minutos, sendo a seguir lavada três vezes com PBS estéril, ph 7,2. Após a lavagem, os parasitos foram ressupendidos em DMEM (Sigma Aldrich Inc), ph 7,2 e distribuídos em alíquotas de 2 ml. Sob essa suspensão, foram adicionados 2 ml de Ficoll 10% (Sigma Aldrich Inc) e o gradiente assim formado foi centrifugado a 1070 xg, a 25 C, por 15 minutos. Após a centrifugação, coletou-se o sobrenadante rico em formas promastigotas metacíclicas. Os parasitos foram lavados duas vezes com PBS estéril. O pellet final foi ressuspendido em PBS estéril. A quantificação de parasitos na amostra foi feita em câmara de Neubauer Infecção e tratamento dos camundongos Os camundongos C57BL/6 foram inoculados com 1x10 5 formas promastigotas metacíclicas em PBS estéril, no coxim plantar da pata traseira direita. O volume total do inóculo foi de 40 µl/pata. Os animais foram, então, divididos em 4 grupos experimentais, consistindo em 2 grupos infectados por L. amazonensis submetidos ao tratamento com o extrato hidroalcoólico de própolis verde, na dose de 250 mg/kg/dia por via oral, por meio de 26
30 MATERIAL E MÉTODOS gavagem, sendo um grupo tratado por 2 semanas e o outro por 8 semanas; e os respectivos grupos controle, compreendidos por camundongos infectados por L. amazonensis que receberam apenas o diluente utilizado, ou seja, água. O tratamento foi iniciado duas semanas após a infecção dos animais (Figura 2). 27
31 MATERIAL E MÉTODOS Quatro grupos experimentais (n=24), C57BL/6, fêmeas, de 6 a 8 semanas. Inóculo de 1x10 5 /40 µl formas promastigotas metacíclicas no coxim plantar da pata. Início do tratamento com extrato hidroalcoólico da própolis verde (250 mg/kg/dia) 2 semanas após o inóculo. Grupo tratado com própolis por 2 semanas (n=24) Grupo tratado com água por 2 semanas (n=24) Grupo tratado com própolis por 8 semanas (n=24) Grupo tratado com água por 8 semanas (n=24) Eutanásia 2 e 8 semanas após o início do tratamento Parasitismo na pata e linfonodo poplíteo drenante. Histopatologia da pata. Figura 2: Delineamento experimental. 28
32 MATERIAL E MÉTODOS Determinação do tamanho da lesão desencadeada por L. amazonensis O desenvolvimento das lesões foi acompanhado, periodicamente, por meio da medição das patas direita e esquerda na posição horizontal, utilizando-se um paquímetro como instrumento de medida. A lesão foi definida como a diferença entre a espessura da pata infectada e da pata controle (AFONSO & SCOTT, 1993) Determinação da carga parasitária Para avaliar a atividade leishmanicida do extrato hidroalcoólico da própolis verde após duas e oito semanas de tratamento, os animais foram eutanasiados por deslocamento cervical e a carga parasitária na pata infectada e no linfonodo poplíteo drenante foi avaliada pelo método de diluição limitante (TITUS et al., 1985) com modificações (MARQUES-DA- SILVA et al., 2005). Após a eutanásia, os animais foram submergidos em álcool etílico 70% (V/V) por 5 minutos. As patas infectadas e o linfonodo poplíteo drenante foram retirados sob condições assépticas. As amostras coletadas permaneceram em banho de gelo imersos em meio Grace s não suplementado. As amostras foram então maceradas em meio Grace s não suplementado, individualmente, com o auxílio de um macerador de órgãos (Pyrex 2 ml) e o sobrenadante de maceração foi coletado em tubo cônico. O volume total de maceração foi submetido à centrifugação a 42 xg, a 4ºC, por 1 minuto para a retirada de possíveis resíduos de tecido. O sobrenadante resultante da centrifugação inicial foi centrifugado a 1540 xg, a 4ºC, por 10 minutos para a sedimentação dos parasitos e o precipitado formado foi ressuspendido em 500 μl de meio Grace s completo. O material assim obtido foi plaqueado, em duplicata, em placas de 96 poços estéreis, seguindo diluição seriada na proporção de 1:10. As placas foram avaliadas quanto à presença de parasitos em 7 e 14 dias. Os resultados foram expressos como logaritmo negativo do título de parasitos, correspondendo à última diluição na qual estes foram observados Avaliação histopatológica da pata dos camundongos C57BL/6 infectados por L. amazonensis Para a avaliação histopatológica, as patas infectadas foram coletadas nos tempos de duas e oito semanas após o início do tratamento e foram fixadas em solução de metanol/dmso (80:20) por, no mínimo, 7 dias. Posteriormente, estes órgãos foram processados manualmente e incluídos em parafina a 60ºC. Após estes procedimentos, os 29
33 MATERIAL E MÉTODOS blocos foram cortados na espessura de 4 μm e corados com o corante hematoxilina-eosina (HE). Os cortes histológicos foram analisados e, então, digitalizados por uma microcâmera JVC-TK 1270/JGB. 5.9 Análise estatística Foram realizadas as análises estatísticas com o auxílio do programa GraphPad Prism 5. Todas as amostras foram inicialmente submetidas aos testes de normalidade de Kolmogorov-Smirnov. As amostras que apresentaram distribuição normal foram analisadas por one way ANOVA seguidas por teste de Turkey. Quando as amostras não seguiram distribuição normal, foram analisadas pelo teste de Kruskal-Wallis com pós-teste de Dunn. Foi adotado como diferença estatística valores de p inferiores a 0,05. 30
34 RESULTADOS E DISCUSSÃO 6 RESULTADOS E DISCUSSÃO 6.1 Identificação e quantificação de componentes ativos no extrato hidroalcoólico da própolis verde A própolis utilizada neste trabalho foi produzida em Caeté, Minas Gerais, região rica em Baccharis dracunculifolia nativa. O extrato hidroalcoólico padronizado e caracterizado foi fornecido pela Pharma Nectar, Belo Horizonte, MG, Brasil. Trata-se de um produto registrado e comercializado com a marca Cytopropolis. A empresa fornecedora disponibilizou um Certificado de Análises (Anexo I) contendo todos os testes realizados com a amostra, que incluem a identificação e quantificação de componentes ativos, que foi realizada por meio de Cromatografia Líquida de Alta Eficiência (HPLC). Todos os lotes produzidos são submetidos à estas análises, garantindo, assim, a reprodutibilidade dos efeitos biológicos conferidos por este extrato. Dentre os compostos ativos presentes neste extrato hidroalcoólico da própolis verde, os mais abundantes são a artepilina C, a bacarina, o ácido cumárico e o pinobanksin-3-acetato. A artepilina C (ácido 3,5-diprenil-4-hidroxicinâmico) é um composto fenólico de baixo peso molecular encontrado apenas na própolis verde brasileira, sendo um dos seus principais componentes (CHAN et al., 2013). Esta substância possui atividade anti-câncer, antimicrobiana, pró-apoptótica e anti-oxidante. A artepilina C também apresenta atividade imunomoduladora, sendo capaz de aumentar a produção de células T e inibir a atividade do NF-κB em macrófagos. Além disso, inibe a exarcebação do edema de pata induzido pela carragenina em modelo murino e inibe a mobilização de neutrófilos para o sítio da inflamação (PAULINO et al., 2008). A bacarina (ácido 3-prenil-4-diidrocinamoiloxi-cinâmico) é um derivado do ácido cinâmico, que apresenta atividade antitumoral demonstrada in vitro, possivelmente devido à sua atividade pró-apoptótica (AKAO, 2003). O ácido cumárico é um composto fenólico que possui diversas atividades biológicas, que incluem a atividade antioxidante, anti-inflamatória, antimutagênica, anti-ulcerativa, antiagregante plaquetário e anti-câncer. Além disso, tem efeitos benéficos na aterosclerose, ansiedade, gota e diabetes e atenua o dano oxidativo no coração, o dano induzido por radiação ultravioleta em tecido ocular e danos neuronais (PEI et al., 2015). O pinobanksin-3-acetato é um ácido polifenólico e já foi relatado como substância cardioprotetora e pró-apoptótica (SUN et al., 2017; ALDAY et al., 2015). 31
35 RESULTADOS E DISCUSSÃO 6.2 Avaliação do efeito do extrato hidroalcoólico da própolis verde na viabilidade celular Realizou-se o teste de redução do MTT com o objetivo de avaliar o efeito do extrato hidroalcoólico da própolis verde sobre a viabilidade de macrófagos peritoneais murinos. Este ensaio é baseado na clivagem do sal tetrazólio MTT à azul de formazan pelas células viáveis. O anel tetrazólio é clivado na mitocôndria ativa, sendo assim, a reação ocorre apenas em células vivas (MOSMANN, 1983). De acordo com a ISO Biological evaluation of medical devices (2009), concentrações de um composto são consideradas citotóxicas quando matam mais de 30% das células. Como demonstrado na figura 3, a viabilidade das células apresentou-se sempre igual ou acima de 80%. Assim, a adição de diferentes concentrações (500 a 3,9 µg/ml) do extrato hidroalcoólico da própolis verde à cultura de macrófagos não ocasionou em redução da viabilidade celular a ponto de serem consideradas citotóxicas, independente do tempo de incubação. 32
36 Viabilidade celular (%) Viabilidade celular (%) Viabilidade celular (%) RESULTADOS E DISCUSSÃO (A) 24 horas (B) Extrato hidroalcoólico da própolis verde ( g/ml) horas Extrato hidroalcoólico da própolis verde ( g/ml) (C) 72 horas Extrato hidroalcoólico da própolis verde ( g/ml) Figura 3: Avaliação da viabilidade de macrófagos peritoneais murinos expostos ao extrato hidroalcoólico da própolis verde em diferentes concentrações. Avaliou-se a viabilidade de macrófagos peritoneais ao serem expostos ao extrato hidroalcoólico da própolis verde nas concentrações 500 a 3,9 µg/ml, nos tempos de exposição de 24 (A), 48 (B) e 72 horas (C). Como controle, manteve-se células em meio de cultura livre do extrato de própolis, correspondendo à 100% de viabilidade. 33
37 Parasitos / ml RESULTADOS E DISCUSSÃO Resultados semelhantes podem ser encontrados em estudos prévios. Szliszka et al. (2013), ao avaliarem o efeito das concentrações 5-50 µg/ml do extrato etanólico da própolis verde sobre a viabilidade de células J774-A1, expostas ao extrato por 24 horas, observaram que não houve influência do extrato na viabilidade celular. Da mesma forma, Ferreira et al. (2014) observaram que a exposição de células J774-A1 à diferentes concentrações (até 1000 µg/ml) do extrato aquoso de própolis verde, por 24, 48 e 72 horas, não ocasionou redução da viabilidade celular, independente do tempo de incubação. Assim, ficou demonstrado que a própolis verde não afetou a viabilidade celular, evidenciando, portanto, ausência de toxicidade nas doses testadas. Tal fato pode ser reafirmado com outros dados da literatura, de estudos in vivo. Arvouet-Grand, A. et al. (1993) avaliaram a toxicidade subaguda da própolis administrada por via oral em modelo murino e observaram que a LD 50 é maior que 7340 mg/kg. 6.3 Curva de crescimento de L. amazonensis As formas promastigotas foram cultivadas conforme descrito no item 5.1. Para determinar a curva de crescimento da cepa utilizada neste trabalho, iniciou-se uma cultura com 1x10 5 parasitos/ml e contou-se o número de parasitos, diariamente, em câmara de Neubauer. Como pode ser observado na figura 4, houve um aumento expressivo do número de parasitos na fase logarítmica, que vai até o quarto dia. A partir do quinto dia, a cultura se estabiliza, iniciando a fase estacionária. Destaca-se que no quinto dia observou-se um grande número de formas metacíclicas Tempo (dias) Figura 4: Curva de crescimento da cepa PH8 de L. amazonensis. O número de parasitos em cultura, nas condições padrão, foi determinado diariamente por meio de contagem em câmara de Neubauer. 34
38 Parasitos / ml RESULTADOS E DISCUSSÃO 6.4 Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde em cultura de formas promastigotas de L. amazonensis Avaliou-se o efeito de diferentes concentrações (500 a 3,9 µg/ml) do extrato hidroalcoólico da própolis verde em cultura de formas promastigotas de L. amazonensis, por meio da determinação das curvas de crescimento e da determinação da viabilidade dos parasitos através do ensaio de MTT. Como observado na figura 5, que demonstra as curvas de crescimento do parasito exposto às concentrações testadas do extrato, as concentrações 500, 250 e 125 µg/ml foram capazes de inibir o crescimento do protozoário desde o primeiro dia de exposição. O crescimento dos parasitos expostos à concentração 62,5 µg/ml foi menor até o quarto dia, quando comparado ao grupo controle, sendo que, a partir do quinto dia, os parasitos não foram mais observados na cultura. Em relação às culturas expostas às demais concentrações, não houve diferença nas curvas de crescimento em relação ao controle. Estes resultados evidenciam que o extrato hidroalcoólico da própolis verde foi capaz de inibir a proliferação de L. amazonensis in vitro a partir da concentração 62,5 µg/ml, exercendo uma atividade leishmanicida concentração-dependente. Controle 3,9 g/ml 7,8 g/ml ,6 g/ml 31,25 g/ml 62,5 g/ml 125 g/ml 250 g/ml 500 g/ml Tempo (dias) Figura 5: Curva de crescimento de formas promastigotas de L. amazonensis exposta ao extrato hidroalcoólico da própolis verde. Determinou-se o efeito do extrato hidroalcoólico da própolis verde em cultura de formas promastigotas de L. amazonensis por meio do cultivo em meio acrescido das concentrações 500 a 3,9 g/ml do extrato. Como controle, manteve-se uma cultura em condições padrão. Estão apresentados a média e o desvio padrão de três experimentos independentes. 35
39 RESULTADOS E DISCUSSÃO Em relação ao ensaio de MTT, demonstrado na figura 6, observou-se que as concentrações 500, 250, 125 e 62,5 µg/ml foram capazes de reduzir significativamente a viabilidade dos parasitos nos três tempos de tratamento avaliados (p<0,05). No tempo de 24 horas de tratamento, estas concentrações foram capazes de reduzir a viabilidade dos parasitos em cultura para 19, 17, 17 e 24%, em relação ao controle, respectivamente (Figura 6A). Nos tempos de 48 (Figura 6B) e 72 horas de tratamento (Figura 6C), a viabilidade dos parasitos expostos a estas concentrações caiu para 30, 20, 22 e 22% e 26, 20, 15, 18%, respectivamente. Por outro lado, as demais concentrações não diminuíram de forma significativa a viabilidade dos parasitos em cultura, levando, curiosamente, ao aumento do metabolismo dos parasitos, em alguns casos. No tempo de 48 horas, as concentrações 31,25, 15,63, 7,81 e 3,9 µg/ml induziram viabilidades de 61, 121, 120 e 118%, respectivamente. De forma semelhante, no tempo de 72 horas, as concentrações 31,25, 15,63, 7,81 e 3,9 µg/ml induziram viabilidades de 114, 136, 127 e 131%, respectivamente. Com base nas curvas de crescimento do parasito exposto às diferentes concentrações do extrato hidroalcoólico da própolis, nenhuma das concentrações induziu uma maior proliferação dos parasitos em relação ao controle. Logo, a maior metabolização apresentada não se justifica por um maior número de parasitos em cultura. Aparentemente, a própolis, nas concentrações citadas, induziu uma maior capacidade metabolizadora do parasito. Esta hipótese pode ser sustentada pelos dados descritos por Mosmann (1983), segundo os quais a quantidade de formazan gerada por célula depende do nível de metabolismo energético da célula. Este autor demonstrou, em experimento com linfócitos, que células ativadas produzem 10 vezes mais formazan por célula quando comparadas às células normais. 36
40 Viabilidade celular (%) Viabilidade celular (%) Viabilidade celular (%) RESULTADOS E DISCUSSÃO A horas Extrato hidroalcoólico da própolis verde ( g/ml) B horas C Extrato hidroalcoólico da própolis verde ( g/ml) 72 horas Extrato hidroalcoólico da própolis verde ( g/ml) Figura 6: Avaliação da viabilidade de formas promastigotas de L. amazonensis expostas ao extrato hidroalcoólico da própolis verde. Determinou-se o efeito do extrato hidroalcoólico da própolis verde em cultura de formas promastigotas de L. amazonensis por meio do cultivo em meio acrescido das concentrações 500 a 3,9 g/ml do extrato, nos tempos de 24 (A), 48 (B) e 72 horas (C). Como controle, manteve-se uma cultura em condições padrão. Estão apresentados a média e o desvio padrão de três experimentos independentes. 37
41 RESULTADOS E DISCUSSÃO Outros estudos já demonstraram a atividade leishmanicida da própolis in vitro. Pontin et al. (2008) avaliaram o efeito do extrato hidroalcoólico da própolis verde nas concentrações de 1 a 750 µg/ml em cultura de formas promastigotas de L. (Vianna) braziliensis. Neste estudo, observou-se que o extrato exerceu uma atividade leishmanicida sobre as formas promastigotas, com uma IC 50 de 18,13 µg/ml. Igualmente, Silva et al. (2013) avaliaram o efeito da própolis (5, 10, 25, 50 e 100 µg/ml) sobre formas promastigotas de L. braziliensis. Estes autores observaram que houve uma redução na proliferação do parasito quando exposto por 24 horas à concentração de 100 µg/ml, sendo que, após 96 e 168 horas, todas as concentrações avaliadas foram capazes de reduzir a proliferação parasitária. Em outro estudo, Silva et al. (2015) avaliaram o efeito do extrato hidroalcoólico da própolis verde (5, 10, 25, 50 e 100 μg/ml) sobre formas promastigotas de L. amazonensis nos tempos de 24, 96 e 168 horas de tratamento e todas as concentrações mostraram um efeito inibitório no crescimento do parasito em todos os tempos avaliados. Apesar destes dados serem semelhantes aos resultados obtidos neste trabalho, nota-se que foram relatadas concentrações menores para que o mesmo resultado fosse atingido. Isso pode ser explicado pelas diferenças na composição dos extratos de própolis, que são decorrentes das diferentes origens de cada amostra e dos métodos utilizados na extração. Dados da literatura apontam que a Leishmania sp. apresenta alterações morfológicas ao ser exposta à própolis. Silva et al. (2013) observaram, por meio de microscopia eletrônica, que L. braziliensis, ao ser tratada com própolis, apresenta sinais de encolhimento celular e mudanças no tamanho do flagelo. Tal fato dá indícios do possível mecanismo de ação da própolis como substância leishmanicida, que provavelmente está relacionado à indução de mudanças estruturais do protozoário. Dentre os compostos ativos presentes na própolis, os ácidos cafeico, p-cumárico, 3- prenil-p-cumárico (drupanina) e 3,5-diprenil-p-cumárico (artepilina C), além da aromadendrina-4-metil éster são reportadas como substâncias que exercem um efeito direto sobre formas promastigotas do parasito. Salienta-se, no entanto, que amostras de própolis distintas possuem diferenças significativas em seus componentes ativos e suas respectivas quantidades, devido à influência do local de origem e da forma de extração. Logo, amostras de própolis oriundas de locais distintos estão associadas à diferentes resultados experimentais (SILVA et al., 2013). 38
42 RESULTADOS E DISCUSSÃO 6.5 Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas axênicas de L. amazonensis Um dos parâmetros mais importantes a ser avaliado na busca de novos fármacos para a leishmaniose é a determinação da atividade direta do composto sobre a forma do parasito que está presente no hospedeiro mamífero, ou seja, a forma amastigota. Neste contexto, amastigotas geradas em cultura axênica podem representar uma importante estratégia para os testes com novos compostos, uma vez que se assemelham bastante às amastigotas intracelulares no que diz respeito às propriedades estruturais, biológicas, imunológicas e bioquímicas (GUPTA et al., 2001). Avaliou-se o efeito de diferentes concentrações (500 a 3,9 µg/ml) do extrato hidroalcoólico da própolis verde em cultura de formas amastigotas axênicas de L. amazonensis, por meio da determinação das curvas de crescimento e da determinação da viabilidade dos parasitos por meio do ensaio de MTT. A figura 7 demonstra as curvas de crescimento das formas amastigotas axênicas quando expostas às diferentes concentrações do extrato. Observa-se que todas as concentrações avaliadas foram capazes de diminuir o número de parasitos em cultura, quando comparado ao controle. As concentrações 500 e 250 µg/ml foram capazes de inibir totalmente a proliferação dos parasitos a partir do quarto dia de cultura, enquanto as concentrações 125 e 62,50 µg/ml inibiram a proliferação parasitária por completo a partir do oitavo dia. 39
43 Parasitos / ml RESULTADOS E DISCUSSÃO Controle 3,9 g/ml 7,81 g/ml 15,6 g/ml 31,25 g/ml 62,5 g/ml 125 g/ml 250 g/ml 500 g/ml Tempo (dias) Figura 7: Curva de crescimento de formas amastigotas axênicas L. amazonensis expostas ao extrato hidroalcoólico da própolis verde. Determinou-se o efeito do extrato hidroalcoólico da própolis verde em cultura de formas amastigotas axênicas de L. amazonensis por meio do cultivo em meio de cultura acrescido das concentrações 500 a 3,9 g/ml do extrato. Como controle, manteve-se uma cultura em condições padrão. Estão apresentados a média e o desvio padrão de três experimentos independentes. Em relação ao MTT, demonstrado na figura 8, as concentrações 500, 250, 125, 62,50, 31,25 e 15,63 µg/ml foram capazes de diminuir de forma significativa (p<0,05) a viabilidade dos parasitos em cultura desde o primeiro dia de exposição, enquanto que as concentrações 7, 81 e 3,9 µg/ml não interferiram na viabilidade dos parasitos. Já para os tempos de 48 e 72 horas de exposição, todas as concentrações testadas foram capazes de diminuir a viabilidade dos parasitos em cultura de forma significativa (p<0,05). Tais resultados evidenciam que o extrato hidroalcoólico da própolis verde é capaz de exercer uma atividade leishmanicida também contra as amastigotas axênicas de L. amazonensis. 40
44 Viabilidade celular (%) Viabilidade celular (%) Viabilidade celular (%) RESULTADOS E DISCUSSÃO (A) horas Extrato hidroalcoólico da própolis verde ( g/ml) (B) horas Extrato hidroalcoólico da própolis verde ( g/ml) (C) 72 horas Extrato hidroalcoólico da própolis verde ( g/ml) Figura 8: Avaliação da viabilidade de formas amastigotas axênicas de L. amazonensis expostas ao extrato hidroalcoólico da própolis verde. Determinou-se o efeito do extrato hidroalcoólico da própolis verde em cultura de formas amastigotas axênicas de L. amazonensis por meio do cultivo em meio acrescido das concentrações 500 a 3,9 g/ml do extrato, nos tempos de 24 (A), 48 (B) e 72 horas (C). Como controle, manteve-se uma cultura em condições padrão. Estão apresentados a média e o desvio padrão de três experimentos independentes. 41
45 RESULTADOS E DISCUSSÃO Ao compararmos tais resultados com os obtidos nos testes realizados com formas promastigotas, nota-se que as amastigotas axênicas são mais susceptíveis ao extrato, tendo em vista que até mesmo as menores concentrações do extrato reduziram a viabilidade dos parasitos. Na literatura, não existem dados acerca da atividade da própolis sobre formas amastigotas axênicas de Leishmania ssp.. No entanto, outros compostos já foram testados contra esta forma do parasito e, de uma forma geral, as amastigotas axênicas são mais resistentes que as formas promastigotas. Sereno e Lemesre (1997) avaliaram a susceptibilidade de amastigotas axênicas e promastigotas de L. amazonensis, L. infantum e L. mexicana frente à fármacos leishmanicidas que são utilizados no tratamento das leishmanioses. Ao avaliar a atividade do Pentostan, da Pentamidina e da Anfotericina B, a IC 50 variou de 248 a 470 µg/ml (410 µg/ml para L. amazonensis), 0,45 a 1,03 µm (0,48 µm para L. amazonensis) e 0,14 a 0,24 µm (0,16 µm para L. amazonensis) para formas promastigotas, respectivamente. E para formas amastigotas axênicas, a IC 50 destes fármacos foi de 134 a 270 µg/ml (270 µg/ml para L. amazonensis), 4,55 e 7,95 µm (4,52 µm para L. amazonensis) e 0,21 a 0,79 µm (0,26 µm para L. amazonensis), respectivamente. Nota-se que, para L. amazonensis, as formas amastigotas axênicas são mais resistentes que as formas promastigotas à Pentamidina e à Anfotericina B, enquanto que para o Pentostan, as formas amastigotas axênicas são mais susceptíveis. A diferença observada na atividade dos compostos contra formas promastigotas e amastigotas axênicas ocorre devido às diferenças bioquímicas entre as duas formas do parasito, incluindo as atividades desidrogenase, peroxidase, adenina desaminase, ribonuclease e proteinase, além do catabolismo da glicose, síntese de ácido nucleico e atividade de óxido nítrico (SERENO E LEMESRE, 1997). 6.6 Avaliação in vitro do efeito do extrato hidroalcoólico da própolis verde contra formas amastigotas intracelulares Para avaliar o efeito do extrato hidroalcoólico da própolis verde sobre formas amastigotas intracelulares de L. amazonensis, infectou-se macrófagos murinos com formas promastigotas de L. amazonensis no quinto dia de cultura, ou seja, na fase estacionária de crescimento, onde é possível observar a maior quantidade de formas metacíclicas. As culturas foram, então, tratadas com diferentes concentrações do extrato hidroalcoólico da própolis verde (500 a 3,9 µg/ml) por 24, 48 e 72 horas. Como pode ser observado nas figuras 9 e 10, o tratamento com as concentrações 500 e 250 µg/ml foi capaz de reduzir a taxa de infecção dos 42
46 Controle 3,9 7,81 15,62 31,25 62, Controle 3,9 7,81 15,62 31,25 62, % de macrófagos infectados Parasitos/macrófago infectado Controle 3,9 7,81 15,62 31,25 62, Controle 3,9 7, ,625 31,25 62, % de macrófagos infectados Parasitos/macrófago infectado Controle 3,9 7,81 15,62 31,25 62, Controle 3,9 7,81 15,62 31,25 62, % de macrófagos infectados Parasitos/macrófago infectado RESULTADOS E DISCUSSÃO macrófagos nos três tempos analisados (p<0,05). Enquanto as demais concentrações não tiveram impacto sobre a infecção. 24 horas (A) 100 * (B) * horas (C) * (D) 15 * horas (E) 100 * (F) 15 * Figura 9: Avaliação da atividade leishmanicida do extrato hidroalcoólico da própolis verde contra formas amastigotas intracelulares. Determinou-se o efeito do extrato hidroalcoólico da própolis verde em diferentes 43
47 RESULTADOS E DISCUSSÃO concentrações (500 a 3,9 µg/ml) em cultura de macrófagos peritoneais murinos infectados por L. amazonensis, nos tempos de tratamento de 24, 48 e 72 horas. Como controle, manteve-se uma cultura infectada em condições padrão. Os dados são mostrados como a porcentagem média de células parasitadas nos tempos de 24 (A), 48 (C) e 72 horas (E) e o número de parasitos por macrófago infectado (B, D e F). Estão apresentados a média e o desvio padrão de dois experimentos independentes. Figura 10: Macrófagos peritoneais murinos infectados por L. amazonensis. Os macrófagos foram infectados por L. amazonensis na proporção de 10 parasitos para cada célula. Tratou-se as culturas com diferentes concentrações do extrato hidroalcoólico da própolis verde, por 24, 48 e 72 horas. Obteve-se, em média, 85% de infecção nos grupos controle. Em (A), (B) e (C) estão representados as culturas controle de 24, 48 e 72 horas, respectivamente. Em (D), (E) e (F) tem-se as culturas tratadas com 250 µg/ml do extrato por 24, 48 e 72 horas, respectivamente. Em (G), (H) e (I) tem-se as culturas tratadas com 500 µg/ml do extrato por 24, 48 e 72 horas, respectivamente. Para as demais concentrações testadas, não houve diferença na porcentagem de células infectadas em relação ao controle. Setas vermelhas indicam o citoplasma celular contendo formas amastigotas de L. amazonensis. Setas azuis indicam o citoplasma sem parasitos. Aumento 1000x. A figura 9 também demonstra o número médio de amastigotas por macrófago infectado. O tratamento com as concentrações 500 e 250 µg/ml reduziu o número de amastigotas por célula infectada, enquanto as demais concentrações não exerceram efeito neste número. 44
48 RESULTADOS E DISCUSSÃO Resultados semelhantes podem ser observados na literatura. Pontin et al. (2008) avaliaram o efeito do extrato hidroalcoólico da própolis verde em cultura de macrófagos peritoneais murinos infectados por L. (Vianna) braziliensis. Para tanto, foi avaliado o efeito das concentrações 10, 100 e 250 µg/ml em formas amastigotas intracelulares. Neste estudo, observou-se que o extrato foi ineficaz contra as formas amastigotas nas concentrações testadas. Porém, os dados relatados na literatura variam. Ayres et al. (2007), ao avaliarem o efeito do extrato etanólico da própolis verde em cultura de macrófagos peritoneais murinos infectados por L. amazonensis, observaram que a concentração de 25 µg/ml, após 72 horas de tratamento, levou à redução da porcentagem de macrófagos infectados e do número de parasitos intracelulares. Da mesma forma, tais variações nos dados podem ser explicadas pelas diferenças entre os extratos da própolis utilizados em cada experimento, bem como entre as cepas de parasitos. Diante destes resultados, fica evidenciada a atividade leishmanicida concentraçãodependente do extrato hidroalcoólico da própolis verde. Nota-se, no entanto, que para as formas amastigotas intracelulares, a concentração necessária para matar o parasito foi maior do que para as formas promastigotas e amastigotas axênicas. Apesar das semelhanças entre as formas amastigotas axênicas e as amastigotas intracelulares, a diferença nos resultados pode ser explicada levando-se em consideração o fato de a membrana plasmática celular representar uma barreira para a permeação de substâncias, resultando na necessidade de uma maior dose para atingir a mesma concentração que irá atuar diretamente sobre o parasito. Além disso, a cultura de macrófagos representa um ambiente muito mais favorável para o parasito que apenas um meio de cultura, facilitando, assim, a sua proliferação. 6.7 Determinação do tamanho da lesão decorrente da infecção por L. amazonensis O desenvolvimento das lesões na pata de camundongos C57BL/6 infectados por L. amazonensis e submetidos ao tratamento oral com extrato hidroalcoólico de própolis verde na dose de 250 mg/kg/dia foi acompanhado periodicamente, utilizando-se paquímetro. Definiuse a lesão como a diferença entre a espessura da pata infectada e a pata controle (AFONSO & SCOTT, 1993). A figura 11 representa a curva da lesão desenvolvida na pata infectada dos camundongos a partir da segunda semana de infecção, na qual iniciou-se o tratamento. Podese observar que, a partir da quinta semana de infecção, a lesão de ambos os grupos começou a crescer progressivamente, o que é característico da infecção por L. amazonensis, sendo que no grupo tratado observou-se uma leve tendência à redução no tamanho da lesão sem, contudo, 45
49 Lesão (mm) RESULTADOS E DISCUSSÃO haver diferença estatística. Assim, o tratamento com extrato hidroalcoólico de própolis verde na dose de 250 mg/kg/dia não foi capaz de alterar a lesão gerada em resposta à infecção por L. amazonensis Controle Própolis 500 mg/kg Semanas de infecção Figura 11: Curva de desenvolvimento de lesão na pata de camundongos C57BL/6 infectados por L. amazonensis e submetidos ao tratamento com extrato hidroalcoólico de própolis verde na dose de 250 mg/kg. Fêmeas de camundongos C57BL/6 foram inoculadas, na pata direita traseira, com 1x10 5 formas promastigotas metacíclicas de L. amazonensis. Determinou-se o tamanho da lesão periodicamente, a partir da segunda semana de infecção, na qual iniciou-se o tratamento oral com extrato hidroalcoólico de própolis verde. São apresentados a média e o desvio-padrão de 24 animais por grupo. Apesar dos resultados obtidos neste trabalho mostrarem que o tratamento com própolis não teve impacto nas lesões geradas pela infecção por L. amazonenis, este tipo de tratamento já foi reportado como capaz de reduzir as lesões causadas por este parasito. Pontim et al. (2008), ao realizarem tratamento com extrato hidroalcoólico de própolis verde (1,5 mg/kg/dia) em camundongos BALB/c infectados por L. braziliensis, observaram que o tratamento oral por 90 dias reduziu o tamanho das lesões em 78,6%. Esta discordância dos resultados pode ser explicada com base nas diferenças entre os modelos experimentais e entre as amostras de própolis utilizadas em cada experimento, além de se tratar de parasitos distintos, que apresentam diferentes níveis de virulência (SOONG et al., 2012). 46
50 - log do título de parasitos - log do título de parasitos RESULTADOS E DISCUSSÃO 6.8 Avaliação in vivo da atividade leishmanicida do extrato hidroalcoólico da própolis verde em camundongos C57BL/6 infectados por L. amazonensis Avaliou-se a atividade leishmanicida do extrato hidroalcoólico da própolis verde por meio da quantificação de parasitos na pata infectada e no linfonodo drenante do sítio da infecção. Mediante o tratamento realizado por 2 semanas, a carga parasitária na pata infectada dos camundongos mostrou redução (p-valor = 0,0567; figura 12A) e o parasitismo no linfonodo drenante foi menor no grupo tratado (figura 12B). Quando os animais foram tratados por 8 semanas, não foram observadas diferenças entre o parasitismo nas patas dos animais tratados e do grupo controle (figura 12A); de modo surpreendente, o parasitismo do linfonodo drenante do grupo tratado foi maior que o do grupo controle (figura 12B). A Controle Própolis 500 mg/kg 8 6 a b sem 8 sem B 5 4 b * 3 * sem 8 sem Tempo de tratamento Figura 12: Carga parasitária da pata (A) e linfonodo poplíteo drenante (B) de camundongos C57BL/6 infectados por L. amazonensis e submetidos ao tratamento com extrato hidroalcoólico de própolis verde. 47
51 RESULTADOS E DISCUSSÃO Após 2 e 8 semanas de tratamento com extrato hidroalcoólico da própolis verde na dose de 250 mg/kg/dia, determinou-se a carga parasitária no sítio da infecção e no linfonodo drenante por meio do método de diluição limitante. Os dados representam a média e desvio padrão de 8 animais por grupo. (*) indica p-valor < 0,05, (a) indica diferença estatística entre os grupos controles e (b) diferença estatística entre os tratados. Observa-se, então, que no estágio inicial da infecção, o tratamento com própolis foi capaz de controlar a proliferação parasitária, enquanto em um estágio mais tardio (10 semanas de infecção), o tratamento não auxiliou no controle da infecção, resultando, inclusive, em um aumento do parasitismo tecidual no linfonodo drenante. Diante destes resultados, alguns fatores devem ser considerados: os perfis de resposta imunológica que levam à resistência ou susceptibilidade à leishmaniose e a imunomodulação gerada pela própolis. A resistência ou a susceptibilidade à infecção por parasitos do gênero Leishmania está relacionada à fatores intrínsecos do hospedeiro, como o perfil de resposta imunológica desenvolvido frente à infecção, e aos fatores de virulência do parasito. Em relação à resposta imunológica do hospedeiro, os parasitos estimulam o aumento de linfócitos T CD4 +, desencadeando um perfil de resposta Th1 ou Th2 (REIS et al., 2006; ALEXANDER & BRYSON, 2005; ALEXANDER & BROMBACHER, 2012). O desenvolvimento de uma resposta do tipo Th1 está relacionado com a resistência à infecção. Esta resposta é caracterizada pela maior produção das citocinas TNF-α e IFN-γ, que levam à ativação de macrófagos. Os macrófagos ativados produzem espécies reativas de oxigênio, que estão diretamente relacionadas à eliminação do parasito (CUNNINGHAM, 2002). Já a resposta Th2 se relaciona com a susceptibilidade à infecção, sendo caracterizada pela produção de citocinas anti-inflamatórias, como IL-10 e IL-4 (AWASTHI; MATHUR; SAHA, 2004). Camundongos C57BL/6 apresentam um perfil de resistência à leishmaniose devido ao desenvolvimento de uma resposta Th1, o que é característico deste modelo animal (PEARSON & STEIGBIGEL, 1981; SOONG et al., 2012). Entretanto, apesar de o perfil de resposta Th1 estar relacionado à resistência à infecção, estudos apontam que a exacerbação desse tipo de resposta leva ao aparecimento de lesões típicas que culminam em dano tecidual importante (PETERS et al., 2008). Por outro lado, Afonso & Scott (1993) associaram o desenvolvimento de lesões em camundongos C57BL/10 infectados por L. amazonensis à uma fraca resposta Th1, não estando associado ao desenvolvimento de uma resposta Th2. A própolis possui diversas atividades biológicas, dentre as quais está a atividade imunomoduladora (SFORCIN & BANKOVA, 2011). Em trabalho realizado por Missima et al. (2010), a administração de própolis por 14 dias à camundongos C57BL/6 inibiu a 48
52 RESULTADOS E DISCUSSÃO produção de IL-2 e IFN-γ por células do baço. Além disso, a própolis foi reportada como inibidora da produção dos mediadores óxido nítrico e prostaglandinas (HU et al., 2005). Ansorge et al. (2003) demonstraram que a própolis inibe a proliferação de células mononucleares do sangue periférico e de células T humanas, além de diminuir a síntese das citocinas pró-inflamatórias IL-1β, IL-12 e IL-2 e induzir a síntese de TGF-β. O éster fenetílico do ácido cafeico, um componente fenólico presente na própolis, inibe a ativação de células T por inibir os fatores de transcrição NFAT e NF-κB, além de inibir os genes de transcrição e a síntese de IL-2 em células T estimuladas (MARQUEZ et al., 2004). Diante destas considerações, pode-se explicar os resultados obtidos neste trabalho pela modulação da resposta imunológica induzida pela própolis. É provável que o tratamento tenha exercido uma atividade anti-inflamatória com inibição da produção de IFN-γ, induzindo o estabelecimento de um perfil de resposta Th1 fraca, tornando o organismo mais susceptível à infecção. Além disso, é possível que o nível de resposta Th1 tenha sido insuficiente para a erradicação do parasito, mas tenha permitido o recrutamento de macrófagos e células T. Estudos anteriores estabeleceram que linfócitos T CD4 + reativos à L. amazonensis contribuem para o desenvolvimento da lesão, e não para sua cura (SOONG et al., 1997). Assim, o tratamento com a própolis pode ter criado um ambiente favorável à proliferação do parasito e progressão da lesão, justificando o aumento da carga parasitária no linfonodo drenante dos camundongos tratados por 8 semanas. Cabe ressaltar que o tratamento por 2 semanas levou a uma redução da carga parasitária no linfonodo drenante; isto pode ser explicado pelo fato de o IFN-γ não ser crucial para o controle do parasito nos estágios iniciais da infecção em camundongos C57BL/6, sendo essencial para o desenvolvimento de uma resposta Th1 protetora apenas nos estágios mais avançados da infecção (PINHEIRO & ROSSI- BERGMAN, 2007). Salienta-se, no entanto, que a própolis já foi reportada como agente pró-inflamatório. Lima et al. (2014) avaliaram o efeito do tratamento com extrato aquoso de própolis verde (500 mg/kg/dia, por 4 dias) em modelo de inflamação induzida por implantes de esponja de poliéster-poliuretano. Neste estudo, foi observado que o tratamento com própolis induziu o aumento da atividade das enzimas inflamatórias NAG e MPO, dos níveis de TNF-α e da expressão dos genes para NOS2 e IFN-γ. Estes resultados aparentemente discrepantes podem ser atribuídos à vários fatores, como diferenças no modelo animal utilizado, no tipo de lesão induzida, na dose de própolis administrada, na duração do tratamento, na origem da própolis e no tipo de extrato utilizado. 49
53 RESULTADOS E DISCUSSÃO 6.9 Avaliação histopatológica das lesões desenvolvidas em camundongos C57BL/6 infectados por L. amazonensis e tratados com extrato hidroalcoólico de própolis verde Para a realização das análises histopatológicas, as patas infectadas dos camundongos foram coletadas após 2 e 8 semanas de tratamento com extrato hidroalcoólico de própolis verde, correspondentes à 4 e 10 semanas de infecção, respectivamente. Os resultados das análises revelaram que, após 4 semanas de infecção (2 semanas de tratamento), os animais tratados com o extrato hidroalcoólico da própolis verde exibiram intenso infiltrado inflamatório, de distribuição difusa, composto de forma majoritária por macrófagos. Ao passo que no grupo controle a inflamação foi discreta a ausente. Em ambos os grupos a epiderme apresentava-se íntegra em todas as camadas, bem como a derme, com seus respectivos anexos cutâneos de aspecto e distribuição convencional. Na décima semana de infecção (8 semanas de tratamento), observou-se um intenso infiltrado inflamatório na derme, em ambos os grupos, controle e tratado, caracterizado por um perfil inflamatório crônico, distribuído em toda a camada reticular da derme, de forma difusa, caracterizado de forma predominante pela presença de macrófagos, linfócitos e esparsos eosinófilos. Foram observados ainda, alguns macrófagos com citoplasma amplo, de aspecto vacuolizado (Figura 13). Desta forma, as análises histopatológicas demonstraram que o extrato hidroalcoólico da própolis foi capaz de recrutar de forma precoce os macrófagos para o sítio da lesão causada por L. amazonensis. 50
54 RESULTADOS E DISCUSSÃO Figura 13: Fotomicrografia de cortes histológicos (4 μm, HE) de coxim plantar de camundongos C57BL/6 infectados por L. amazonensis. Figuras A e C indicam os grupos controle infectados e não tratados, por 2 e 8 semanas, respectivamente. Figuras B e D indicam os grupos infectados e tratados por 2 e 8 semanas, respectivamente. Aumento 40x. As setas indicam infiltrado inflamatório difuso na derme. Estes resultados são condizentes com dados da literatura, que apontam que a própolis modula a imunidade não específica por meio do recrutamento de macrófagos. Tatefuji et al. (1996) demonstraram que seis compostos isolados da própolis, identificados como ácidos cafeoilquínicos, são capazes de aumentar a motilidade e distribuição dos macrófagos. Da mesma forma, Miranda et al. (2015) observaram que camundongos BALB/c infectados por L. amazonensis e tratados com própolis na dose de 5 mg/kg/dia apresentaram um significativo aumento no infiltrado de macrófagos no sítio da lesão quando comparados com o grupo controle infectado. O fato de o extrato hidroalcoólico da própolis verde ter aumentado o recrutamento de macrófagos para o sítio da infecção aliado à possível inibição da produção de IFN-γ por estas células tornou o ambiente favorável ao desenvolvimento do parasito, deixando o organismo susceptível à infecção. 51
55 RESUMO DOS RESULTADOS 7 RESUMO DOS RESULTADOS Neste estudo, os efeitos leishmanicidas do extrato hidroalcoólico da própolis verde foram investigados in vitro, em formas promastigotas, amastigotas axênicas e amastigotas intracelulares de L. amazonensis e in vivo, em camundongos C57BL/6 infectados por L. amazonensis. Observou-se que este extrato não possui efeitos citotóxicos sobre macrófagos peritoneais murinos e apresenta atividade inibitória sobre todas as formas de L. amazonensis testadas in vitro, de maneira concentração-dependente. Enquanto que in vivo, para a dose testada, foram observados efeitos leishmanicidas apenas nos estágios iniciais da infecção, havendo até mesmo aumento da carga parasitária no linfonodo poplíteo drenante no estágio mais tardio. Além disso, o tratamento não teve influência significativa no tamanho da lesão apresentada pelos animais, havendo apenas uma tendência a ser menor quando comparada com o grupo controle. A partir destes resultados, conclui-se que a própolis pode representar uma potencial alternativa terapêutica para utilização em associação no tratamento da leishmaniose. No entanto, são necessárias mais investigações a respeito da sua atividade leishmanicida in vivo, principalmente. Destaca-se a necessidade de testar outros regimes terapêuticos, com diferentes doses e vias de administração. Além disso, é preciso avaliar quais são os efeitos leishmanicida e imunomodulador dos diferentes extratos da própolis (alcoólico, aquoso e hidroalcoólico), a fim de elucidar melhor tais efeitos de cada tipo de extrato e esclarecer até que ponto a imunomodulação exercida pela própolis influencia na atividade leishmanicida dos diferentes tipos de extrato de própolis. 52
56 CONCLUSÃO 8 CONCLUSÃO Conclui-se que o extrato hidroalcoólico da própolis verde (Cytopropolis ) possui efeitos inibitórios sobre L. amazonensis in vitro, de maneira concentração-dependente. E, para a infecção in vivo, este extrato possui efeito leishmanicida apenas nos estágios iniciais da infecção. Além disso, por se tratar de um extrato que é submetido à um rigoroso controle de qualidade, há uma garantia da confiabilidade e reprodutibilidade dos resultados obtidos neste trabalho. 53
57 REFERÊNCIAS REFERÊNCIAS AFONSO, L.C. & SCOTT, P. Immune responses associated with susceptibility of C57BL/10 mice to Leishmania amazonensis. Infect. Immun. v. 61, p , AKAO, Y. et al. Cell growth inhibitory effect of cinnamic acid derivatives from propolis on human tumor cell lines. Biol Pharm Bull. v.26(7), p , ALDAY, E.; VALENCIA, D.; CARREÑO, AN.; PICERNO, P.; PICCINELLI, AL.; RASTRELLI, L.; ROBLES-ZEPEDA, R.; HERNANDEZ, J.; VELAZQUEZ, C. Apoptotic induction by pinobanksin and some of its ester derivatives from Sonoran propolis in a B-cell lymphoma cell line. Chemico-Biological Interactions. v. 242, p , ALEXANDER, J. & BROMBACHER, F. T helper1/t helper2 cells and resistance/susceptibility to Leishmania infection: is this paradigm still relevant? Frontiers in immunology. v. 3, ALEXANDER, J. & BRYSON, K. T helper (h)1/th2 and Leishmania: paradox rather than paradigm. Immunology Letters. v. 99, p , ANSORGE, S.; REINHOLD, D.; LENDECKEL, U. Propolis and some of its constituents down-regulate DNA synthesis and inflammatory cytokine production but induce TGF-beta 1 production of human immune cells. Zeitschrift fur Naturforschung. v. 58c, p , ANTOINE, J.C.; PRINA, E.; LANG, T.; COURRET, N. The biogenesis and properties of the parasitophorous vacuoles that harbour Leishmania in murine macrophages. Trends microbiol. v. 07, n. 20, ARVOUET-GRAND, A.; LEJEUNE, B.; BASTIDE, P.; POURRAT, A.; PRIVAT, AM.; LEGRET, P. Propolis extract. I. Acute toxicity and determination of acute primary cutaneous irritation index. J Pharm Belg. v. 48 (3), p , AWASTHI, A.; MATHUR, R. K.; SAHA, B. Immune response to Leishmania infection. Indian J. Med. Res. v. 119 (6), p , AYRES, D.C.; MARCUCCI, M.C.; GIORGIO, S. Effects of Brazilian propolis on Leishmania amazonensis. Mem Inst Oswaldo Cruz. v. 102, n. 2, p , BAHIA, MT.; NASCIMENTO, AF.; MAZZETI, AL.; MARQUES, LF.; GONÇALVES, KR.; MOTA, LW.; DINIZ, LF.; CALDAS, IS.; TALVANI, A.; SHACKLEFORD, DM.; KOLTUN, M.; SAUNDERS, J.; WHITE, KL.; SCANDALE, I.; CHARMAN, SA.; CHATELAIN, E. Antitrypanosomal activity of fexinidazole metabolites, potential new drug candidates for Chagas disease. Antimicrob Agents Chemother. v. 58(8), p , BANKOVA, V. Chemical diversity of propolis and the problem of standardization. Journal of Ethnopharmacology. v. 100, p , 2005a. BANKOVA,V. Recent trends and important developments in propolis research. Evid Based Complement Alternat Med. v. 2, n. 1, p , 2005b. 54
58 REFERÊNCIAS BURDOCK, GA. Review of the biological properties and toxicity of bee propolis (propolis). Food Chem Toxicol. v. 36, p , CARVALHO, P.B. & FERREIRA, E.I. Leishmaniais phytotherapy. Nature s leadership against na ancient disease. Fitoterapia. v. 72, p , CHAKRABORTY, A.K.; MAJUMDER, H.K. Mode of action of pentavalent antimonials: specific inhibition of type I DNA topoisomerase of Leishmania donovani. Biochem. Biophys. Res. Commun. v. 152, p , CHAN, G.C.F.; CHEUNG, K.W.; SZE, D.M.Y. The Immunomodulatory and Anticancer Properties of Propolis. Clinic Rev Allerg Immunol. v. 44, p , CROSS, A. S.; SAKARYA, S. et al. Recruitment of murine neutrophils in vivo through endogenous sialidase activity. J. Biol. Chem, v.278, n.6, Feb 7, p , CUNNINGHAM, A. C. Parasitic adaptive mechanisms in infection by Leishmania. Exp Mol Pathol. v. 72, p , DANTAS, AP.; SALOMÃO, K.; BARBOSA, HS.; DE CASTRO, SL. The effect of Bulgarian propolis against Trypanosoma cruzi and during its interaction with host cells. Men Inst Oswaldo Cruz. v. 101, p , DENTON, H.; MCGREGOR, J.C.; COOMBS, G.H. Reduction of anti-leishmanial pentavalent antimonial drugs by a parasite-specific thiol-dependent reductase, TDR1. Biochem. J. v. 381, p , FERREIRA, C.S.; MARTINS, P.S.; DEMICHELI, C.; BROCHU, C.; OUELLETTE,M.; FRÉZARD, F. Thiol-induced reduction of antimony(v) into antimony(iii): a comparative study with trypanothione, cysteinylglycine, cysteine and glutathione. BioMetals. v. 16, p , FERREIRA, F.M.; CASTRO, R.A.O.; BATISTA, M.A.; ROSSI, F.M.D.; SILVEIRA- LEMOS, D.; FRÉZARD, F.; MOURA, S.A.L.; REZENDE, S.A. Association of water extract of green propolis and liposomal meglumine antimoniate in the treatment of experimental visceral leishmaniasis. Parasitol Res. v. 113, p , FREITAS, SF.; SHINOHARA, L.; SFORCIN, JM., GUIMARÃES, S. In vitro effects of propolis on Giardia duodenalis trophozoites. Phytomedicine. v. 13, p , FRÉZARD, F.; DEMICHELI, C.; FERREIRA, C.S.; COSTA, M.A.P. Glutathione-induced conversion of pentavalent antimony to trivalent antimony in meglumine antimoniate. Antimicrob. Agents Chemother. v. 45, p , FRÉZARD, F.; DEMICHELI, C.; RIBEIRO, R.R. Pentavalent antimonials: new perspectives for old drugs. Molecules. v. 14 (7), p , GOURBAL, B.; SONUC, N.; BHATTACHARJEE, H.; LEGARE, D.; SUNDAR, S.; OUELLETTE, M.; ROSEN, B.P.; MUKHOPADHYAY, R. Drug uptake and modulation of drug resistance in Leishmania by an aquaglyceroporin. J. Biol. Chem. v. 279, p ,
59 REFERÊNCIAS GRIMALDI, J.R.G.; DAVID, J.R.; MCMAHON-PRATT, D. Identification and distribution of New World Leishmania species caracterized by serademe analysis using monoclonal antibodies. The American Journal of Tropical Medicine and Hygiene, v. 36, p , GUPTA, N.; GOYAL, N.; RASTOGI, AK. In vitro cultivation and characterization of axenic amastigotes of Leishmania. Trends in Parasitology. v.17, n. 3, HANDLER, M.Z.; PATEL, P.A.; KAPILA, R.; AL-QUBATI, Y.; SCHWARTZ, R.A. Cutaneous and mucocutaneous leishmaniasis: Clinical perspectives. J Am Acad Dermatol. v. 73(6), p , HARMS, G.; SCHONIAN, G.; FELDMEIER, H. Leishmaniasis in Germany. Emerg infect dis. v. 9, n. 7, p , HIGASHI, KO.; DE CASTRO, SL. Propolis extracts are effective against Trypanosoma cruzi and have an impact on its interaction with host cells. J Ethnopharmacol. v. 43, p , HU, F.; HEPBURN, H.R.; LI, Y.; CHEN, M.; RADLOFF, S.E.; DAYA, S. Effects of ethanol and water extracts of propolis (bee glue) on acute inflammatory animal models. Journal of Ethnopharmacology. v. 100, p , INTERNATIONAL ORGANIZATION FOR STANDARDIZATION (ISO). Biological evaluation of medical devices Part 5: Tests for in vitro cytotoxicity. ISO 2009, p. 9-28, ISO JOSHI, P. B.; KELLY, B. L.; KAMHAWI, S.; SACKS, D. L. & MCMASTER, W. R. Targeted gene deletion in Leishmania major identifies leishmanolysin (GP63) as a virulence factor. Mol. Biochem. Parasitol. v. 120, p , KANSAL, S.; TANDON, R.; DWIVEDI, P.; MISRA, P.; VERMA, P. R. P.; DUBE, A.; MISHRA, P.R. Development of nanocapsules bearing doxorubicin for macrophage targeting through the phosphatidylserine ligand: a system for intervention in visceral leishmaniasis. J Antimicrob Chemother. v. 67, p , KAYE, P. e SCOTT, P. Leishmaniasis: complexity at the host pathogen interface. Nat Rev Microbiol.v.9(8), p , KEVRIC, I.; CAPPEL, M.A.; KEELING, J.H. New World and Old World Leishmania Infections: A Practical Review. Dermatol Clin. v.33, n. 3, p , LAINSON, R. The American leishmaniases: some observations on their ecology and epidemiology. Trans.R.Soc.Trop.Med.Hyg., v. 77, n. 5, p , LIMA, LD.; ANDRADE, SP.; CAMPOS, PP.; BARCELOS, LS.; SORIANI, FM.; MOURA. SA.; FERREIRA, MA. Brazilian green propolis modulates inflammation, angiogenesis and fibrogenesis in intraperitoneal implant in mice. BMC Complement Altern Med. v. 14, p. 177,
60 REFERÊNCIAS LOEUILLET, C.; BAÑULS, AL.; HIDE, M. Study of Leishmania pathogenesis in mice: experimental considerations. Parasites & Vectors. v. 9, p.144, LUPI, O.; BARTLETT, B.L.; HAUGEN, R.N. et al. Tropical dermatology: Tropical diseases caused by protozoa. J am Acad dermatol. v. 60, n. 6, p , MALTEZOU HC. Visceral leishmaniasis: advances in Treatment. Recent Pat Antiinfect Drug Discov. v. 3, n. 3, p.192-8, MARCUCCI, M. C. Propolis: chemical composition, biological properties and therapeutic activity. Apidologie. v. 26, n. 2, p , MARCUCCI, M.C.; FERRERES, F.; GARCIA-VIGUEIRA, C.; BANKOVA, V.S.; DE CASTRO, S.L.; DANTAS, A.P.; VALENTE, P.H.M.; PAULINO, N. Phenolic compounds from Brazilian propolis with pharmacological activities. J Ethnopharmacol. v. 74, p , MARQUES-DA-SILVA, E.A.; COELHO, E.A.; GOMES, D.C.; VILELA, M.C.; MASIOLI, C.Z.; TAVARES, C.A.; FERNANDES, A.P.; AFONSO, L.C.; REZENDE, S.A. Intramuscular immunization with p36(lack) DNA vaccine induces IFN-gamma production but does not protect BALB/c mice against Leishmania chagasi intravenous challenge. Parasitol Res. v.98, p.67-74, MARQUEZ, N.; SANCHO, R.; MACHO, A.; CALZADO, M.A.; FIEBICH, B.L.; MUNOZ, E. Caffeic acid phenethyl ester inhibits T-cell activation by targeting both nuclear factor of activated T-cells and NF-kappaB transcription factors. Journal of Pharmacology and Experimental Therapeutics. v. 308, p , MARTINEZ, P.A.; PETERSEN, C.A. Chronic infection by Leishmania amazonensis mediated through MAPK ERK mechanisms. Immunol Res. v. 59, p , MINISTÉRIO DA SAÚDE. Manual de controle da Leishmaniose Tegumentar Americana. 2ºed. Brasília/DF, MIORIN, P.L.; LEVY JUNIOR, N.C.; CUSTODIO, A.R.; BRETZ, W.A.; MARCUCCI, M.C. Antibacterial activity of honey and propolis from Apis mellifera and Tetragonisca angustula against Staphylococcus aureus. J Appl Microbiol. v. 95, p , MIRANDA, MM.; PANIS, C.; CATANEO, AHD.; DA SILVA, SS.; KAWAKAMI, NY.; LOPES, LGDF, et al. Nitric Oxide and Brazilian Propolis Combined Accelerates Tissue Repair by Modulating Cell Migration, Cytokine Production and Collagen Deposition in Experimental Leishmaniasis. Plos One. v. 10, p. 5, MISHAN, PS.; ULRICH, N.; EPHROS, M.; ZILBERSTEIN, D. Novel intracellular SbV reducing activity correlates with antimony susceptibility in Leishmania donovani. The Journal of Biological Chemistry. v. 276, p , n. 6, MISSIMA, F.; PAGLIARONE, A. C.; ORSATTI, C. L.; ARAÚJO JR, J. P.; SFORCIN, J. M. The Effect of Propolis on Th1/Th2 Cytokine Expression and Production by Melanomabearing Mice Submitted to Stress. Phytother Res. v. 24, p ,
61 REFERÊNCIAS MOSMANN, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Meth. v. 65, p , MULLANE, K.M.; R. KRAEMER et al. Myeloperoxidase activity as a quantitative assessment of neutrophil infiltration into ischemic myocardium. J. Pharmacol. Methods. v.14, n.3, p , MURRAY, HW. Leishmaniasis in the united states: treatment in Am j trop med hyg. v. 86, n. 3, p , NACHER, M.; CARME, B.; SAINTE MARIE, D.; et al. Influence of clinical presentation on the efficacy of a short course of pentamidine in the treatment of cutaneous leishmaniasis in French Guiana. Ann trop med parasitol. v. 95, n. 4, p , NASCIMENTO, T.G. et al. Polymeric Nanoparticles of Brazilian Red Propolis Extract: Preparation, Characterization, Antioxidant and Leishmanicidal Activity. Nanoscale Research Letters. v. 11, n. 1, p. 301, ODA, J. M. M.; FUJITA, T.C.; PITZ, A.F., et al. Ação do extrato de própolis na Leishmaniose. Semina: Ciências Biológicas e da Saúde. v. 32, n. 1, p , OLIVEIRA, F.; BAFICA, A.; ROSATO, A.B.; FAVALI, C.B.F.; COSTA, J.M.; CAFÉ, V.; BARRAL-NETTO, M.; BARRAL, A. Short Report : Lesion Size Correlates with Leishmania Antigen-Stimulated TNF-Levels in Human Cutaneous Leishmaniasis. Am J Trop Med Hyg. v. 85, n. 1, p , OLLIARO, P.L.; GUERIN, P.J.; GERSTL, S., et al. Treatment options for visceral leishmaniasis: a systematic review of clinical studies done in India, Lancet infect dis. v. 5, n. 12, p , OSORIO Y FORTEA, J.; PRINA, E.; DE LA LLAVE, E.; LECOEUR, H.; LANG, T.; MILON, G. Unveiling pathways used by Leishmania amazonensis amastigotes to subvert macrophage function. Immunol. v. 219, p , PAULINO, N.; ABREU, S.R.L.; UTO, Y. et al. Anti-inflammatory effects of a bioavailable compound, Artepillin C, in Brazilian propolis. European Journal of Pharmacology. v. 587 p , PEARSON, R. D.; STEIGBIGEL, R. T. Phagocytosis and killing of the protozoan Leishmania donovani by human polymorphonuclear leukocytes. J Immunol. v. 127(4), p , PEI, K.; OU, J.; HUANGA, J.; OUA, S. p-coumaric acid and its conjugates: dietary sources, pharmacokinetic properties and biological activities. J Sci Food Agric. v. 96, p , PETERS, N. C.; EGEN, J. G.; SECUNDINO, N.; DEBRABANT, A.; KIMBLIN, N.; KAMHAWI, S.; LAWYER, P.; FAY, M. P.; GERMAIN, R. N.; SACKS, D. In vivo imaging reveals an essential role for neutrophils in leishmaniasis transmitted by sand flies. Science. v. 321, p ,
62 REFERÊNCIAS PHILIPPEAUX, MM.; BARGETZI, JP.; PACHE, JC.; ROBERT, J.; SPILIOPOULOS, A.; MAUE, J. Culture and functional studies of mouse macrophages on native-like fibrillar type I collagen. European Journal of Cell Biology. v. 88. p , PINHEIRO, R. O.; ROSSI-BERGMANN, B. Interferon-gamma is required for the late but not early control of Leishmania amazonensis infection in C57Bl/6 mice. Memorias do Instituto Oswaldo Cruz. v. 102, p , PONTIN, K.; DA SILVA FILHO, AA.; SANTOS, FF.; SILVA, MLA., et al. In vitro and in vivo antileishmanial activities of a Brazilian green propolis extract. Parasitol Res. v p , REIS, L. C.; BRITO, M. E. F.; SOUZA, M. A.; PEREIRA, V. R. A. Mecanismo imunológico da resposta celular e humoral na Leishmaniose Tegumentar Americana. Rev Pat Trop. v. 35(2), p , ROBERTS, M.T.M. Current understandings on the immunology of leishmaniasis and recent developments in prevention and treatment. Br Med Bull. v , n. 1, p , SAVOIA, D. Recent updates and perspectives on leishmaniasis. J Infect Dev Ctries. v. 9, n. 6, p , SCOTT, P. & NOVAIS, F. O. Cutaneous leishmaniasis: immune responses in protection and pathogenesis. Nat Rev Immunol. v. 16(9), p , SERENO, D.; LEMESRE, J.L. Axenically cultured amastigote forms as an in vitro model for investigation of antileishmanial agents. Antimicrob. Agents Chemother., v. 41, n. 5, p , SFORCIN, J.M. & BANKOVA, V. Propolis: Is there a potential for the development of new drugs? Journal of Ethnopharmacology. v. 133, p , SFORCIN, J.M. Biological Properties and Therapeutic Applications of Propolis. Phytother. Res. v. 30, n. 6, p , SIEUWERTS, A.M.; KLIJIN, J.G.M.; PETERS, H.A.; FOEKENS, J.A. The MTT tetrazolium salt assay scrutinized: How to use this assay reliably to measure metabolic activity to cell culture in vitro for the assessment of growth characteristics, IC50- values nd cell survival. Eur Journ Clin Chem Clin Biochem, v. 33, p , SILVA, S. S.; THOMÉ, G. S.; CATANEO, A. H. D.; MIRANDA, M. M et al. Brazilian Propolis Antileishmanial and Immunomodulatory Effects. Evidence-Based Complementary and Alternative Medicine. v. 2013, SILVA, SS.; MIRANDA, MM.; COSTA, IN.; WATANABE, MAE.; PAVANELLI, WR.; FELIPE,I.; SFORCIN, JF.; COSTA, IC. Leishmanicidal activity of brazilian propolis hydroalcoholic extract in Leishmania amazonensis. Semina: Ciências Biológicas e da Saúde. v. 36, n. 2, p , SOONG, L.; CHANG, C. H.; SUN, J.; LONGLEY, B. J., Jr.; RUDDLE, N. H.; FLAVELL, R. A.; MCMAHON-PRATT, D. Role of CD4+ T cells in pathogenesis associated with 59
63 REFERÊNCIAS Leishmania amazonensis infection. The Journal of Immunology. v. 158, n. 11, p , SOONG, L.; HENARD, C. A.; MELBY, P.C. Immunopathogenesis of non-healing American cutaneous leishmaniasis and progressive visceral leishmaniasis. Semin Immunopathol. v. 34, p , STEBUT, EV. Leishmaniasis. Journal of the German Society of Dermatology. v. 13, p , SUN, L.; WANG, K.; XU, X.; GE, M.; CHEN, Y.; HU, F. Potential protective effects of bioactive constituents from chinese propolis against acute oxidative stress induced by hydrogen peroxide in cardiac H9c2 cells. Evidence-Based Complementary and Alternative Medicine.V. 2017, SUNDAR, S.; CHAKRAVARTY, J.; RAI, V.K., et al. Amphotericin B treatment for indian visceral leishmaniasis: Response to 15 daily versus alternate-day infusions. Clin infect dis. v. 45, n. 5, p , SUNDAR, S.; SINGH, A. Recent developments and future prospects in the treatment of visceral leishmaniasis. Ther Adv Infectious Dis. v. 3 (3-4), p , SZLISZKA, E.; KUCHARSKA, A. Z.; SOKÓB-AWTOWSKA, A.; MERTAS, A.; CZUBA, Z. P.; KRÓL, W. Chemical Composition and Anti-Inflammatory Effect of Ethanolic Extract of Brazilian Green Propolis on Activated J774A.1 Macrophages. Evidence-Based Complementary and Alternative Medicine TATEFUJI, T.; IZUMI, N.; OHTA, T.; ARAI, S.; IKEDA, M.; KURIMOTO, M. Isolation and identification of compounds from Brazilian propolis which enhance macrophage spreading and mobility. Biological & Pharmaceutical Bulletin. v. 19, n. 7, p , TEIXEIRA, M.C.A.; SANTOS, RJ.; SAMPAIO, RB.; CARVALHO, LP.; SANTOS, WLC. A simple and reproducible method to obtain large numbers of axenic amastigotes of different Leishmania species. Parasitol Res. v. 88, p , TITUS, R.G.; MARCHAND, M.; BOON, T.; LOUIS, J.A. A limiting dilution assay for quantifying Leishmania major in tissues of infected mice. Parasite Immunol, v.7, p , TRUSHEVA, B.; POPOVA, M.; BANKOVA, V.; SIMOVA, S.; MARCUCCI, MC.; MIORIN, PL.; PASIN, FR.; TSVETKOVA, I. Bioactive constituents of brazilian red propolis. Evid Based Complement Alternat Med. v. 3, p , UZEL, A., SORKUN, K.; ONCAG, O.; COGULU, D.; GENCAY, O.; SALIH, B. Chemical compositions and antimicrobial activities of four different Anatolian propolis samples. Microbiol Res. v. 160, p , VALE, E.C.S. & FURTADO, T. Leishmaniose tegumentar no Brasil: revisão histórica da origem, expansão e etiologia. An Bras Dermatol. v. 80, n. 4, p ,
64 REFERÊNCIAS VELASQUEZ, L.G.; GALUPPO, M.K.; REZENDE, E.; BRANDÃO, W.N.; PERON, J.P.; ULIANA,S.R.B.; DUARTE, M.I.; STOLF, B.S. Distinct courses of infection with Leishmania (L.) amazonensis are observed in BALB/c, BALB/c nude and C57BL/6 mice. Parasitology. v. 143, p , WORLD HEALTH ORGANIZATION. Leishmaniasis. Disponível em: < Acesso em 05/09/2016. YAN, S.C.; LI, F.; DING, K.Y.; SUN, H. Reduction of pentavalent antimony by trypanothione and formation of a binary and ternary complex of antimony(iii) and trypanothione. J. Biol. Inorg. Chem. v. 8, p , ZHOU, Y.; MESSIER, N.; OUELLETTE, M.; ROSEN, B.P.; MUKHOPADHYAY, R. Leishmania major LmACR2 is a pentavalent antimony reductase that confers sensitivity to the drug Pentostam. J. Biol. Chem. v. 279, p ,
65 Certified ISO GMP - Ref. Lot: CT0216.V COA Certificate of Analyzes Product: CYTOPROPOLIS 62
66 Certified ISO GMP - Green Propolis Dried Extract at 50% w/w concentration in Vegetal Hard Capsules of 700 mg Botanical Origin Baccharis dracunculifolia Lot code: CT0216.V 63
67 Certified ISO GMP - Ref. Lot: CT0216.V Quality Policy Product Description 3. Sensorial Characteristics 4. Physic Chemical Control 5. DPPH Free Radical Scavenging Activity 6. Identification and Quantification of Active Compounds 7. Identification of the Botanical Origin 8. Undesirable Contaminants 8.1 Antibiotics Tests 64
68 8.2 Certified ISO GMP - Microbiological Control 8.3 Pesticides Test 65
69 Certified ISO GMP - Ref. Lot: CT0216.V 1. Y Thank you very much for choosing our propolis! We believe we have been producing the finest and safest ftropolis on the market today. In support of that, we have been working under the strictest quality management system of ISO 9001, GMft & HACCft that are issued by international accreditation institutions. We offer a 100% satisfaction guarantee. Despite our efforts, should you have an unsatisfactory experience with a particular product, simply let us know as soon as possible, we will gladly refund your money, or replace the merchandise.* * You may return items for a refund of the purchase price, or replacement for another product, within 30 days of the delivery date of your order. 66
70 Certified ISO GMP - Ref. Lot: CT0216.V 67
71 Certified ISO GMP - Ref. Lot: CT0216.V 68
72 Certified ISO GMP - Ref. Lot: CT0216.V 69
73 Certified ISO GMP - Ref. Lot: CT0216.V DESCRIPTION Product: Propolis Dried Extract at 50% concentration in hard vegetal Capsules Standardized Extract: Min. 50% w/w Concentration of extracted Propolis Origin: State of Minas Gerais / Brazil Lot code: CT0216.V Manufactured on: February 2016 Use before: February 2019 Storage conditions: Keep the container tightly closed in a cool dry place Propolis Dried Extract (from Baccharis dracunculifolia), Starch, Ingredients: Vegetal Capsules (V CAPS From Hypromellose) CHARACTERISTICS Color: Appearance of the Capsules: Aroma: Flavor: Amorphous greenish powder Transparent capsules Characteristic of Baccharis dracunculifolia Strong and Bitter 70
74 Certified ISO GMP - Ref. Lot: CT0216.V 4. CONTROL PHYSIC-CHEMICAL CONTROL Specifications Results 1 Physical Aspects Uniform, Symmetrical, Characteristic Brightness Accordingly 2 Aspect of the Content Greenish Color, No Impurities, Characteristic Odor Accordingly 3 Quercetin (Flavonoid) Min. 1450mg / 100g 2021 mg / 100g 4 Capsule moisture Max. 8% 5,90 % 5 Powder moisture Max. 8% 5,76 % 6 Phenolic Compounds Min mg /100g 7211 mg/100g Methodology: 3.Japan Health Food & Nutrition Food Association (validated to October 31st, 2001). 4. ARAUJO, J.M.A. Food Chemistry, 3rd edition Instituto Adolfo Lutz; Book: Rules of the Instituto Adolfo Lutz, v.1: Physical and Chemical Methods for Analysis of Food. 1ed. Digital. São Paulo: 2005.p ARAUJO, J.M.A. Food Chemistry, 3rd edition Instituto Adolfo Lutz; Book: Rules of the Instituto Adolfo Lutz, v.1: Physical and Chemical Methods for Analysis of Food. 1ed. Digital. São Paulo: 2005.p FOLIN, O., CIOCAUTEAU, V. On tyrosine and triptofane determination in proteins. J. of Biol. Chem., v.27, P , Brazilian Pharmacopoeia, 4th edition, Part DPPH FREE RADICAL SACAVENGING E D 5 0 * Sample Specifications Result CT0216.V Max 8.0 μg / ml 6,88 Analyses performed by: spectrophotometer at 520nm. Methodology described by Hatano et al (1989). 1) 500μL of the ethanolic extract of Propolis sample was mixed with equal volume of DPPH solution(60μm). 2) The absorbance of resulting solution was measured at 520nm after 30minutes. The chemical structure of DPPH (1,1-diphenyl-picrylhydrazyl radical) 3) The Scavenging activity was determinated by comparing the absorbance with that of the blank(100% DPPH solution). * ED50: Effective Dose that scavenges 50% of radical. Methodology: Hatano, T., Edamatsu,R., Mori, A., Fulita,Y., Yasuhara, T., Yoshida,T., Okuda, T. (1998) Chemical and Pharmaceutical Bulletin 37,
75 Certified ISO GMP - Ref. Lot: CT0216.V 6. IDENTIFICATION & QUANTIFICATION OF ACTIVE COMPOUNDS Analyzes method by HPLC After blending the sample to be analyzed, two grams of propolis were extracted with 25mL of 80% ethanol, under ultrasound for 5 minutes, bain-marie at 70ºC for 30 minutes and finally ultrasound for 5 minutes. The solution was centrifuged for 30 minutes to obtain the supernatant. After that, take 2 ml of supernatant + 8 ml of 80% ethanol and filter by membrane. The filtered will be used directly for HPLC/DAD analysis with a Merck Hitachi chromatograph equipped with an YMC-Pack ODS-A of 250 x 4.6; 5µm column. Results: Identified Flavonoids and other chemical constituents in Propolis Extract of lot CT0216.V 70
76 Certified ISO GMP - Ref. Lot: CT0216.V Phytochemicals Wave-length Retention Resultado Resultado compounds (nm) time (min) (mg/g) (%) 1 Coumaric 2 Rutin ,847 5,800 0, ,86 0,543 0,054 3 Pinobanksin ,287 0,704 0,070 4 Quercetin ,527 1,805 0,181 5 Kaempferol ,067 1,330 0,133 6 Apigenina ,48 0,104 0,010 7 Pinocembrim ,747 1,670 0,167 8 Pinobanksin-3-acetato ,413 5,342 0,534 9 Crysin ,533 1,014 0, Galangin ,113 0,577 0, Tectocrysin ,78 0,453 0, Artepillin C ,533 63,504 6, Baccharin ,08 17,873 1,787 Total 10,07% 7. IDENTIFICATION OF BOTANICALORIGIN 71
77 Certified ISO GMP - Ref. Lot: CT0216.V No. Compounds Retention Time (Min) Wave-length (nm) 1 Coumaric 13, Rutin 22, Pinobanksin 33, Quercetin 40, Kaempferol 50, Apigenin 51, Pinocembrin 55, Pinobanksin-3-acetate 57, Galangin 60, Chrysin 62, Kaempferide 64, Tectochrysin 74, Artepillin C 79, Baccharin 87, Conclusion: The Pharmanectar s Propolis sample, Lot# CT0216.V, belongs to Group 12 of Brazilian Propolis. Its botanical origin is identified as Baccharis dracunculifolia. 8. UNDESIRABLE CONTAMINANTS 8.1: ANTIBIOTICS TESTS ANTIBIOTICS TESTS Test Specification Result Chlortetracycline Max 0,05 < 0.05 Oxytetracycline Max 0,05 mg/kg < 0.05 Tetracycline Max 0,05 < 0.05 Methodology: J5015 Tetracyclines LC/MS/MS (Ref.: Internal Method) Detection Limit: Tetracycline 0.05 mg/kg / Chlortetracycline 0.05 mg/kg / Oxytetracycline 0.05 mg/kg 72
78 Certified ISO GMP - Ref. Lot: CT0216.V 8.2: MICRO-BIOLOGICAL CONTROL MICRO-BIOLOGICAL Specification Result 1 Total bacteria Count Max 3000 CFU/g Absent/g 2 Total Coliforms Absent/g Absent/g 2 Escherichia Coli Absent/g Absent/g 3 Staphylococcus aureus Absent/g Absent/g 4 Mould and Yeast Max 3000 CFU/g Absent/g 5 Samonella ssp (Research) Absent/25g Absent/25g 1- Methodology: Total count of bacteria Bibliography: -ISO Microbiology of food and animal feed products - samples test preparation, initial suspension and decimal dilutions for microbiological analyzes. -ISO 7218, Microbiology of food and animal feed products - General guidelines for microbiological analyzes. -Norma ISO 6222: Ministry of Agriculture, Livestock and Supply. IN number 62, August 26, Guide Interpretation 3M Petrifilm. 2- Methodology: Identification and count Total coliforms and Escherichia coli Bibliography: -Method Official AOAC ISO Microbiology of food and animal feed products - samples test preparation, initial suspension and decimal dilutions for microbiological analyzes. -ISO 7218, Microbiology of food and animal feed products - General guidelines for microbiological analyzes. -Ministry of Agriculture, Livestock and Abastecimento.IN number 62, August 26, Guide Interpretation 3M Petrifilm. 3- Methodology: Identification and count of Staphylococcus aureus Bibliography: -Ministry of Agriculture, Livestock and Abastecimento- Secretary of agricultural defense, General Coordination of Laboratory Support. (Circular Letter number 06 -GAB / CGAL- BSB, 14/02/2012) LANAGRO of Pernambuco approved the Petrifilm Plate STX Staphylococcus aureus- AOAC ISO Microbiology of food and animal feed products - samples test preparation, initial suspension and decimal dilutions for microbiological analyzes. -ISO 7218, Microbiology of food and animal feed products - General guidelines for microbiological analyzes. ISO Norma: Ministry of Agriculture, Livestock and Supply. IN number 62, August 26, Guide Interpretation 3M Petrifilm. 4- Methodology: Count Total Yeast and molds Bibliography: -ISO Microbiology of food and animal feed products - samples test preparation, initial suspension and decimal dilutions for microbiological analyzes. -ISO 7218, Microbiology of food and animal feed products - General guidelines for microbiological analyzes. -Norma ISO : Ministry of Agriculture, Livestock and Supply. IN number 62, August 26, Guide Interpretation 3M Petrifilm. 5- Methodology: Salmonella ssp (Research) Bibliography: -FDA / BAM Chapter 5 Salmonella Method -ISO 6579: Microbiology of food and animal feed - Horizontal method for the detection of Salmonella spp. -AOAC Research Institute Performance Tested MethodSM # ; Validated on June 3, ISO Microbiology of food and animal feed products - samples test preparation, initial suspension and decimal dilutions for microbiological analyzes. -ISO 7218, Microbiology of food and animal feed products - General guidelines for microbiological analyzes. -Norma ISO 6579: Ministry of Agriculture, Livestock and Supply. IN number 62, August 26, Guide Interpretation 3M Petrifilm. 73
79 Certified ISO GMP - Ref. Lot: CT0216.V 8.3: PESTICIDES TESTS ORGANOCHLORINE COMPOUNDS Test Specification Result Test Specification Result Heptachlor Max 0,004 ppm Not Detected Mirex Max 0,02 ppm Not Detected Heptachlor epoxide Max 0,004 ppm Not Detected Chlordane Max 0,0001 ppm Not Detected OP DDE & PP DDE Max 0,02 ppm Not Detected Aldrin Max 0,004 ppm Not Detected OP DDD & PP DDD Max 0,02 ppm Not Detected Dieldrin Max 0,008 ppm Not Detected OP DDT & PP - DDT Max 0,02 ppm Not Detected Endrin Max 0,008 ppm Not Detected BHC - Alpha Max 0,004 ppm Not Detected Methoxychlor Max 0,06 ppm Not Detected BHC - Beta Max 0,02 ppm Not Detected Endosulfan I Max 0,02 ppm Not Detected BHC Gamma (Lindane) Max 0,004 ppm Not Detected Endosulfan II Max 0,02 ppm Not Detected BHC Delta Max 0,02 ppm Not Detected Endosulfan (Sulfate) ORGANOPHOSPHORUS COMPOUNDS Max 0,02 ppm Not Detected Test Specification Result Test Specification Result Diazinon Max 0,05 ppm Not Detected Ethyl Parathion Max 0,05 ppm Not Detected Ethion Max 0,05 ppm Not Detected Methyl Parathion Max 0,05 ppm Not Detected Malathion Max 0,05 ppm Not Detected Phorate Max 0,05 ppm Not Detected CHLORINEPHOSPHORUS COMPOUNDS Test Specification Result Chlorpyrifos Max 1,0 ppm Not Detected Methodology: Gaseous Chromatography - Bibliography: AOAC 14 Ed Adapted Detection Limit Organochlorine (Heptachlor 0,004ppm/ Heptachlor epoxide - 0,004ppm / OP DDE e PP DDE 0,02ppm/ OP DDD e PP DDD 0,02ppm/ OP DDT e PP DDT 0,02ppm/ Mirex - 0,02ppm/ Chlordane 0,0001ppm/ BHC Alfa 0,004ppm/ BHC Beta 0,02ppm/ BHC Gama (Lindane) 0,004ppm / BHC Delta - 0,02ppm/ Aldrin -0,004ppm/ Dieldrin - 0,008ppm/ Endrin 0,008ppm/ Methoxychlor 0,06ppm/ Endossulfan I - Endossulfan II - Endossulfan (Sulfato) 0,02ppm) Organophosphorus - Diazinon - 0,05ppm / Ethion -0,05ppm / Malathion -0,05ppm / Ethyl Parathion -0,05ppm /Methyl Parathion- 0,05ppm / Phorate- 0,05ppm Chlorpyrifos ppm. Sheila Rago Lemos Abreu - Director Pharmacist - CRF 8439 Nectar Farmaceutica Ltda Certified Company ISO 9001 GMP HACCP 74
Leishmaniose. Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi, causador de Chagas).
 Leishmaniose Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Kinetoplastida (porque tem cinetoplasto) Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi,
Leishmaniose Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Kinetoplastida (porque tem cinetoplasto) Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi,
Gênero Leishmania. século XIX a febre negra ou Kala-azar era temida na Índia. doença semelhante matava crianças no Mediterrâneo
 Leishmaniose Leishmaniose é um espectro de doenças produzidas por Leishmania sp. cuja manifestação clínica varia de infecção assintomática tica à morte Gênero Leishmania Histórico século XIX a febre negra
Leishmaniose Leishmaniose é um espectro de doenças produzidas por Leishmania sp. cuja manifestação clínica varia de infecção assintomática tica à morte Gênero Leishmania Histórico século XIX a febre negra
FAMÍLIA TRYPANOSOMATIDAE
 FAMÍLIA TRYPANOSOMATIDAE CLASSIFICAÇÃO: FILO SARCOMASTIGOPHORA(flagelos, pseudópodes ou ambos) SUBFILO MASTIGOPHORA (protozoários com 1 ou + flagelos) FAMÍLIA TRYPANOSOMATIDAE: São nove gêneros que parasitam
FAMÍLIA TRYPANOSOMATIDAE CLASSIFICAÇÃO: FILO SARCOMASTIGOPHORA(flagelos, pseudópodes ou ambos) SUBFILO MASTIGOPHORA (protozoários com 1 ou + flagelos) FAMÍLIA TRYPANOSOMATIDAE: São nove gêneros que parasitam
Trypanosoma cruzi Doença de Chagas
 Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
REVIEW. DNA Topoisomerase I from parasitic protozoa: A potencial target for chemotherapy
 REVIEW DNA Topoisomerase I from parasitic protozoa: A potencial target for chemotherapy R.M. Reguera, C.M. Redondo, R. Gutierrez de Prado, Y. Pérez-Pertejo, R. Balaña-Fouce Dpto. Farmacologia y Toxicologia
REVIEW DNA Topoisomerase I from parasitic protozoa: A potencial target for chemotherapy R.M. Reguera, C.M. Redondo, R. Gutierrez de Prado, Y. Pérez-Pertejo, R. Balaña-Fouce Dpto. Farmacologia y Toxicologia
EXTRATOS VEGETAIS DE PLANTAS MEDICINAIS DO CERRADO NO ALTO PARANAÍBA - MG
 LEVANTAMENTO ETNOFARMACOLÓGICO DA ATIVIDADE TRIPANOCIDA DE EXTRATOS VEGETAIS DE PLANTAS MEDICINAIS DO CERRADO NO ALTO PARANAÍBA - MG Maicon Hitoshi Maeda* Karla Borges Nogueira** Paulo César Ferreira**
LEVANTAMENTO ETNOFARMACOLÓGICO DA ATIVIDADE TRIPANOCIDA DE EXTRATOS VEGETAIS DE PLANTAS MEDICINAIS DO CERRADO NO ALTO PARANAÍBA - MG Maicon Hitoshi Maeda* Karla Borges Nogueira** Paulo César Ferreira**
Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011
 1 Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011 1. Introdução As parasitoses intestinais representam sério problema de saúde pública, em
1 Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011 1. Introdução As parasitoses intestinais representam sério problema de saúde pública, em
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 1º Semestre de Prova de Conhecimentos Gerais em Química
 Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 1º Semestre de 2014 Prova de Conhecimentos Gerais em Química Nome do candidato: Instruções: Escreva seu nome de forma legível no espaço acima.
Programa de Pós-Graduação em Química IQ USP Exame de Capacidade 1º Semestre de 2014 Prova de Conhecimentos Gerais em Química Nome do candidato: Instruções: Escreva seu nome de forma legível no espaço acima.
ESTUDO DA EFICIÊNCIA DE ANTIBIOTICOS CONTRA BACTÉRIAS PATOGÊNICAS
 ESTUDO DA EFICIÊNCIA DE ANTIBIOTICOS CONTRA BACTÉRIAS PATOGÊNICAS Alessandra Maria Stefani NOGUEIRA Franceline Gravielle Bento PEREIRA Lisliana Garcia BELCHIOR Leizer Cordeiro da Silva FREITAS Discentes
ESTUDO DA EFICIÊNCIA DE ANTIBIOTICOS CONTRA BACTÉRIAS PATOGÊNICAS Alessandra Maria Stefani NOGUEIRA Franceline Gravielle Bento PEREIRA Lisliana Garcia BELCHIOR Leizer Cordeiro da Silva FREITAS Discentes
Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública
 Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública LEISHMANIOSE CANINA Leishmanose Tegumentar America LTA Leishmania Visceral - LV Adivaldo
Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública LEISHMANIOSE CANINA Leishmanose Tegumentar America LTA Leishmania Visceral - LV Adivaldo
Isolamento, Seleção e Cultivo de Bactérias Produtoras de Enzimas para Aplicação na Produção mais Limpa de Couros
 Universidade Federal do Rio Grande do Sul Programa de Pós-Graduação em Engenharia Química Departamento de Engenharia Química Laboratório de Estudos em Couro e Meio Ambiente Isolamento, Seleção e Cultivo
Universidade Federal do Rio Grande do Sul Programa de Pós-Graduação em Engenharia Química Departamento de Engenharia Química Laboratório de Estudos em Couro e Meio Ambiente Isolamento, Seleção e Cultivo
número 10 - outubro/2015 RELATÓRIO PARA A SOCIEDADE informações sobre recomendações de incorporação de medicamentos e outras tecnologias no SUS
 número 10 - outubro/2015 RELATÓRIO PARA A SOCIEDADE informações sobre recomendações de incorporação de medicamentos e outras tecnologias no SUS RELATÓRIO PARA A SOCIEDADE Este relatório é uma versão resumida
número 10 - outubro/2015 RELATÓRIO PARA A SOCIEDADE informações sobre recomendações de incorporação de medicamentos e outras tecnologias no SUS RELATÓRIO PARA A SOCIEDADE Este relatório é uma versão resumida
Terramicina com sulfato de polimixina B. cloridrato de oxitetraciclina, sulfato de polimixina B. Pomada Tópica
 Terramicina com sulfato de polimixina B cloridrato de oxitetraciclina, sulfato de polimixina B Pomada Tópica PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Terramicina com sulfato de polimixina B - pomada tópica.
Terramicina com sulfato de polimixina B cloridrato de oxitetraciclina, sulfato de polimixina B Pomada Tópica PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Terramicina com sulfato de polimixina B - pomada tópica.
Complexo Leishmania donovani Forte tendência a visceralização (baço, fígado, medula óssea e órgãos linfóides).
 ORDEM: KINETOPLASTIDA FAMÍLIA: TRYPANOSOMATIDAE GÊNERO: Leishmania Classificações: A) SUBGÊNEROS: Leishmania Viannia B) COMPLEXOS: Parasitologia (Nutrição) Aula 4 (26/03) Leishmania Profa. Adriana Pittella
ORDEM: KINETOPLASTIDA FAMÍLIA: TRYPANOSOMATIDAE GÊNERO: Leishmania Classificações: A) SUBGÊNEROS: Leishmania Viannia B) COMPLEXOS: Parasitologia (Nutrição) Aula 4 (26/03) Leishmania Profa. Adriana Pittella
Universidade de São Paulo -USP. Leishmanioses. Luciana Benevides. Ribeirão Preto- 2013
 Universidade de São Paulo -USP Leishmanioses Luciana Benevides Ribeirão Preto- 2013 Tópicos abordados Definição Leishmaniose Vetores Parasita Manifestações clínicas Epidemiologia Classificação das doenças
Universidade de São Paulo -USP Leishmanioses Luciana Benevides Ribeirão Preto- 2013 Tópicos abordados Definição Leishmaniose Vetores Parasita Manifestações clínicas Epidemiologia Classificação das doenças
14/06/12. Esta palestra não poderá ser reproduzida sem a referência do autor
 14/06/12 Esta palestra não poderá ser reproduzida sem a referência do autor ESTA PALESTRA NÃO PODERÁ SER REPRODUZIDA SEM A REFÊNCIA DO AUTOR. LEISHMANIOSE VISCERAL TRANSMISSÃO EM BANCO DE SANGUE Dra. Margarida
14/06/12 Esta palestra não poderá ser reproduzida sem a referência do autor ESTA PALESTRA NÃO PODERÁ SER REPRODUZIDA SEM A REFÊNCIA DO AUTOR. LEISHMANIOSE VISCERAL TRANSMISSÃO EM BANCO DE SANGUE Dra. Margarida
Pesquisador em Saúde Pública Prova Discursiva INSTRUÇÕES
 Fisiopatologia de Doenças Negligenciadas Pesquisador em Saúde Pública Prova Discursiva 1. Você recebeu do fiscal o seguinte material: INSTRUÇÕES a) Este Caderno de Questões contendo o enunciado das 2 (duas)
Fisiopatologia de Doenças Negligenciadas Pesquisador em Saúde Pública Prova Discursiva 1. Você recebeu do fiscal o seguinte material: INSTRUÇÕES a) Este Caderno de Questões contendo o enunciado das 2 (duas)
Leishmaniose Tegumentar Americana
 Leishmaniose Tegumentar Americana (Leishmania) Prfª. M.Sc. Yara Bandeira Azevedo UNIFAN Leishmania Filo: Sarcomastigophora Subfilo: Mastigophora Ordem: Kinetoplastida Família: Trypanosomatidae Gênero:
Leishmaniose Tegumentar Americana (Leishmania) Prfª. M.Sc. Yara Bandeira Azevedo UNIFAN Leishmania Filo: Sarcomastigophora Subfilo: Mastigophora Ordem: Kinetoplastida Família: Trypanosomatidae Gênero:
Cultivo de Células Animais
 Técnico em Biotecnologia Módulo IV Cultivo de Células Animais Aula 3 Esterilização de materiais para a Cultura de Células Prof. Leandro Parussolo Trabalhar com cultura de células Ambiente Estéril Cells
Técnico em Biotecnologia Módulo IV Cultivo de Células Animais Aula 3 Esterilização de materiais para a Cultura de Células Prof. Leandro Parussolo Trabalhar com cultura de células Ambiente Estéril Cells
Infecções causadas por microrganismos multi-resistentes: medidas de prevenção e controle.
 INFORME TÉCNICO XXXVII Outubro 2010 Infecções causadas por microrganismos multi-resistentes: medidas de prevenção e controle. Definição de microorganismos multi-resistentes: São microrganismos resistentes
INFORME TÉCNICO XXXVII Outubro 2010 Infecções causadas por microrganismos multi-resistentes: medidas de prevenção e controle. Definição de microorganismos multi-resistentes: São microrganismos resistentes
UFF Instituto de Biologia Departamento de Imunobiologia GIM
 UFF Instituto de Biologia Departamento de Imunobiologia GIM 1- PROJETOS EXTENSÃO COORDENADOR RESUMO PERFIL DO ALUNO Produção, aplicação e divulgação de material educativo. Claudia Marcia Borges Barreto
UFF Instituto de Biologia Departamento de Imunobiologia GIM 1- PROJETOS EXTENSÃO COORDENADOR RESUMO PERFIL DO ALUNO Produção, aplicação e divulgação de material educativo. Claudia Marcia Borges Barreto
1.4 Metodologias analíticas para isolamento e identificação de micro-organismos em alimentos
 Áreas para Submissão de Resumos (1) Microbiologia de Alimentos Trabalhos relacionados com micro-organismos associados aos alimentos: crescimento, identificação, biossíntese, controle, interação com o hospedeiro,
Áreas para Submissão de Resumos (1) Microbiologia de Alimentos Trabalhos relacionados com micro-organismos associados aos alimentos: crescimento, identificação, biossíntese, controle, interação com o hospedeiro,
EFEITO DA TEMPERATURA E DO FOTOPERÍODO NA GERMINAÇÃO in vitro DE CONÍDIOS DE Aspergillus niger, AGENTE ETIOLÓGICO DO MOFO PRETO DA CEBOLA
 EFEITO DA TEMPERATURA E DO FOTOPERÍODO NA GERMINAÇÃO in vitro DE CONÍDIOS DE Aspergillus niger, AGENTE ETIOLÓGICO DO MOFO PRETO DA CEBOLA Autores: Jéssica Tainara IGNACZUK 1, Leandro Luiz MARCUZZO 2 Identificação
EFEITO DA TEMPERATURA E DO FOTOPERÍODO NA GERMINAÇÃO in vitro DE CONÍDIOS DE Aspergillus niger, AGENTE ETIOLÓGICO DO MOFO PRETO DA CEBOLA Autores: Jéssica Tainara IGNACZUK 1, Leandro Luiz MARCUZZO 2 Identificação
Curso Técnico em Análises Químicas Microbiologia. Meios de cultura
 Curso Técnico em Análises Químicas Microbiologia Meios de cultura DEFINIÇÃO: Formulações químicas (associação qualitativa e quantitativa) Nutrientes necessários Multiplicação (desenvolvimento, cultivo)
Curso Técnico em Análises Químicas Microbiologia Meios de cultura DEFINIÇÃO: Formulações químicas (associação qualitativa e quantitativa) Nutrientes necessários Multiplicação (desenvolvimento, cultivo)
PREVALÊNCIA DE GIARDIA LAMBLIA NA CIDADE DE BURITAMA ESTADO DE SÃO PAULO
 PREVALÊNCIA DE GIARDIA LAMBLIA NA CIDADE DE BURITAMA ESTADO DE SÃO PAULO Catierine Hirsch Werle RESUMO A Giardia está distribuída mundialmente. No Brasil sua prevalência varia de 4 a 30%, dependendo das
PREVALÊNCIA DE GIARDIA LAMBLIA NA CIDADE DE BURITAMA ESTADO DE SÃO PAULO Catierine Hirsch Werle RESUMO A Giardia está distribuída mundialmente. No Brasil sua prevalência varia de 4 a 30%, dependendo das
UNIVERSIDADE FEDERAL DO PARANÁ
 UNIVERSIDADE FEDERAL DO PARANÁ CARLOS RENATO PFAU EFICÁCIA DO SULFETO DE SELÊNIO EM DIFERENTES CONCENTRAÇÕES SOBRE Malassezia pachydermatis EM CÃES: ESTUDO IN VITRO E IN VIVO. Dissertação apresentada ao
UNIVERSIDADE FEDERAL DO PARANÁ CARLOS RENATO PFAU EFICÁCIA DO SULFETO DE SELÊNIO EM DIFERENTES CONCENTRAÇÕES SOBRE Malassezia pachydermatis EM CÃES: ESTUDO IN VITRO E IN VIVO. Dissertação apresentada ao
DANIELLE LETÍCIA DA SILVA. ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL
 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL BELO HORIZONTE 2009 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA
DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA DE EXTRATOS DE PLANTAS MEDICINAIS EM AMOSTRAS DE Candida albicans ISOLADAS DE MUCOSA BUCAL BELO HORIZONTE 2009 DANIELLE LETÍCIA DA SILVA ATIVIDADE ANTIFÚNGICA
Patogêneses virais II. Profa Dra Mônica Santos de Freitas
 Patogêneses virais II Profa Dra Mônica Santos de Freitas 09.11.2011 1 Determinante da patogênese Interação com o tecido alvo; Acesso ao tecido alvo; Presença de receptores; Estabilidade das partículas
Patogêneses virais II Profa Dra Mônica Santos de Freitas 09.11.2011 1 Determinante da patogênese Interação com o tecido alvo; Acesso ao tecido alvo; Presença de receptores; Estabilidade das partículas
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg)
 HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M CALAZAR GERMANO DA SILVA DE SOUZA R 2
 SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M EM PEDIATRIA CALAZAR GERMANO DA SILVA DE SOUZA R 2 www.paulomargotto.com.br CALAZAR DEFINIÇÃO ÃO: Zoonose
SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M EM PEDIATRIA CALAZAR GERMANO DA SILVA DE SOUZA R 2 www.paulomargotto.com.br CALAZAR DEFINIÇÃO ÃO: Zoonose
Determinação de sensibilidade bacteriana aos antimicrobianos
 Determinação de sensibilidade bacteriana aos antimicrobianos Prof. Adj. Ary Fernandes Junior Departamento de Microbiologia e Imunologia Instituto de Biociências UNESP Tel. 14 3880.0412/0413 ary@ibb.unesp.br
Determinação de sensibilidade bacteriana aos antimicrobianos Prof. Adj. Ary Fernandes Junior Departamento de Microbiologia e Imunologia Instituto de Biociências UNESP Tel. 14 3880.0412/0413 ary@ibb.unesp.br
biologia caderno de prova instruções informações gerais 13/12/2009 boa prova! 2ª fase exame discursivo
 2ª fase exame discursivo 13/12/2009 biologia caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Biologia. Não abra o caderno antes de receber autorização.
2ª fase exame discursivo 13/12/2009 biologia caderno de prova Este caderno, com dezesseis páginas numeradas sequencialmente, contém dez questões de Biologia. Não abra o caderno antes de receber autorização.
Cultura de Células Animais. Aula 4 - Fases do Crescimento Celular. Prof. Me. Leandro Parussolo
 Cultura de Células Animais Aula 4 - Fases do Crescimento Celular Prof. Me. Leandro Parussolo NOVA CÉLULA Introdução A dinâmica de uma cell é + bem compreendida examinandose o curso de sua vida; divisão
Cultura de Células Animais Aula 4 - Fases do Crescimento Celular Prof. Me. Leandro Parussolo NOVA CÉLULA Introdução A dinâmica de uma cell é + bem compreendida examinandose o curso de sua vida; divisão
Departamento de Bioquímica Instituto de Química USP EXERCÍCIOS BIOQUÍMICA EXPERIMENTAL QBQ 0316N Professores. Carlos T. Hotta Ronaldo B.
 Departamento de Bioquímica Instituto de Química USP EXERCÍCIOS BIOQUÍMICA EXPERIMENTAL QBQ 0316N 2016 Professores Carlos T. Hotta Ronaldo B. Quaggio 1 1. Um extrato de proteínas foi obtido a partir da
Departamento de Bioquímica Instituto de Química USP EXERCÍCIOS BIOQUÍMICA EXPERIMENTAL QBQ 0316N 2016 Professores Carlos T. Hotta Ronaldo B. Quaggio 1 1. Um extrato de proteínas foi obtido a partir da
(22) Data do Depósito: 25/02/2015. (43) Data da Publicação: 20/09/2016
 INPI (21) BR 102015003982-4 A2 (22) Data do Depósito: 25/02/2015 *BR102015003982A República Federativa do Brasil Ministério da Indústria, Comércio Exterior e Serviços Instituto Nacional da Propriedade
INPI (21) BR 102015003982-4 A2 (22) Data do Depósito: 25/02/2015 *BR102015003982A República Federativa do Brasil Ministério da Indústria, Comércio Exterior e Serviços Instituto Nacional da Propriedade
Bases ecológicas da resistência bacteriana às drogas
 Bases ecológicas da resistência bacteriana às drogas Drogas antimicrobianas: mecanismo de ação Um aspecto do controle do crescimento dos microrganismos envolve a utilização de fármacos no tratamento de
Bases ecológicas da resistência bacteriana às drogas Drogas antimicrobianas: mecanismo de ação Um aspecto do controle do crescimento dos microrganismos envolve a utilização de fármacos no tratamento de
PAULO EDUARDO BRANDÃO, PhD DEPARTAMENTO DE MEDICINA VETERINÁRIA PREVENTIVA E SAÚDE ANIMAL FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA UNIVERSIDADE
 PAULO EDUARDO BRANDÃO, PhD DEPARTAMENTO DE MEDICINA VETERINÁRIA PREVENTIVA E SAÚDE ANIMAL FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA UNIVERSIDADE DE SÃO PAULO 1. DEFINIÇÃO 2. PRINCÍPIO 3. APLICAÇÕES
PAULO EDUARDO BRANDÃO, PhD DEPARTAMENTO DE MEDICINA VETERINÁRIA PREVENTIVA E SAÚDE ANIMAL FACULDADE DE MEDICINA VETERINÁRIA E ZOOTECNIA UNIVERSIDADE DE SÃO PAULO 1. DEFINIÇÃO 2. PRINCÍPIO 3. APLICAÇÕES
Profa. Carolina G. P. Beyrodt
 Profa. Carolina G. P. Beyrodt Agente etiológico: Toxoplasma gondii (Protozoário coccídeo do Filo Apicomplexa) Histórico Isolado em 1908 de um roedor do deserto: Ctenodactylus gondii 1923 descrição do primeiro
Profa. Carolina G. P. Beyrodt Agente etiológico: Toxoplasma gondii (Protozoário coccídeo do Filo Apicomplexa) Histórico Isolado em 1908 de um roedor do deserto: Ctenodactylus gondii 1923 descrição do primeiro
Nutrigenômica x Nutrigenética - doenças relacionadas
 Nutrigenômica x Nutrigenética - doenças relacionadas Início Projeto Genoma Humano 20.000 genes (120.000 inicialmente estimados) Diversidade nucleotídica: 0,1 a 0,4% pares de base correspondente a aproximadamente
Nutrigenômica x Nutrigenética - doenças relacionadas Início Projeto Genoma Humano 20.000 genes (120.000 inicialmente estimados) Diversidade nucleotídica: 0,1 a 0,4% pares de base correspondente a aproximadamente
Tela 1. Imagem. Esboço da tela. texto
 Título da animação: No tempo certo Autoras: Maria Aparecida da Silva Prado e Silvana Texto: A descoberta casual da penicilina por Alexander Fleming no final da década de 20 marca o início da era moderna
Título da animação: No tempo certo Autoras: Maria Aparecida da Silva Prado e Silvana Texto: A descoberta casual da penicilina por Alexander Fleming no final da década de 20 marca o início da era moderna
IDENTIFICAÇÃO DOS RISCOS BIOLÓGICOS DE ACORDO COM A NR 32
 IDENTIFICAÇÃO DOS RISCOS BIOLÓGICOS DE ACORDO COM A NR 32 1 PROCEDIMENTOS PARA AVALIAÇÃO E CONTROLE DE AGENTES BIOLÓGICOS Objetivo: Determinar a natureza, grau e o tempo de exposição dos trabalhadores
IDENTIFICAÇÃO DOS RISCOS BIOLÓGICOS DE ACORDO COM A NR 32 1 PROCEDIMENTOS PARA AVALIAÇÃO E CONTROLE DE AGENTES BIOLÓGICOS Objetivo: Determinar a natureza, grau e o tempo de exposição dos trabalhadores
CULTIVO, NUTRIÇÃO E MEIOS DE CULTURA UTILIZADOS NO CRESCIMENTO DE MICRORGANISMOS
 CULTIVO, NUTRIÇÃO E MEIOS DE CULTURA UTILIZADOS NO CRESCIMENTO DE MICRORGANISMOS CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO:
CULTIVO, NUTRIÇÃO E MEIOS DE CULTURA UTILIZADOS NO CRESCIMENTO DE MICRORGANISMOS CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO: CONDIÇÕES FÍSICAS PARA O CRESCIMENTO MICROBIANO CULTIVO:
PATOGENICIDADE BACTERIANA
 PATOGENICIDADE BACTERIANA Fatores de de Virulência Instituto Federal de Educação, Ciência e Tecnologia do Pará Instituto Federal de Educação, Ciência e Tecnologia do Pará Curso de Licenciatura Plena em
PATOGENICIDADE BACTERIANA Fatores de de Virulência Instituto Federal de Educação, Ciência e Tecnologia do Pará Instituto Federal de Educação, Ciência e Tecnologia do Pará Curso de Licenciatura Plena em
não podem ser aplicados em experimentos que envolvem
 1 - INTRODUÇÃO A adição de produtos químicos aos alimentos, para a sua conservação, não é um processo novo. O homem préhistórico, com a descoberta do fogo, criou o processo de defumação. Depois, aprendeu
1 - INTRODUÇÃO A adição de produtos químicos aos alimentos, para a sua conservação, não é um processo novo. O homem préhistórico, com a descoberta do fogo, criou o processo de defumação. Depois, aprendeu
QUANTIFICAÇÃO DE FLAVONÓIDES E FENÓIS DO EXTRATO DO FEIJÃO BRAVO
 QUANTIFICAÇÃO DE FLAVONÓIDES E FENÓIS DO EXTRATO DO FEIJÃO BRAVO Aldenir Feitosa dos Santos (1); Amanda Lima Cunha (2); Anderson Soares de Almeida (3); Marília Layse Alves da Costa (4). (1) Universidade
QUANTIFICAÇÃO DE FLAVONÓIDES E FENÓIS DO EXTRATO DO FEIJÃO BRAVO Aldenir Feitosa dos Santos (1); Amanda Lima Cunha (2); Anderson Soares de Almeida (3); Marília Layse Alves da Costa (4). (1) Universidade
Protistas. Thiago Lins do Nascimento
 Protistas 1 Thiago Lins do Nascimento tiagolinsnasc@gmail.com Protistas: Características Gerais São seres eucariontes. Os protistas são compostos pelas algas e protozoários. Apresentam muita diversidade
Protistas 1 Thiago Lins do Nascimento tiagolinsnasc@gmail.com Protistas: Características Gerais São seres eucariontes. Os protistas são compostos pelas algas e protozoários. Apresentam muita diversidade
CAPÍTULO 6: COMPOSTOS ORGÂNICOS PROTEÍNAS CAP. 7: COMPOSTOS ORGÂNICOS ÁCIDOS NUCLEICOS E VITAMINAS
 CAPÍTULO 6: COMPOSTOS ORGÂNICOS PROTEÍNAS CAP. 7: COMPOSTOS ORGÂNICOS ÁCIDOS NUCLEICOS E VITAMINAS 1. Dentre os diferentes compostos orgânicos das células temos as proteínas. Sobre estas responda: a) Cite
CAPÍTULO 6: COMPOSTOS ORGÂNICOS PROTEÍNAS CAP. 7: COMPOSTOS ORGÂNICOS ÁCIDOS NUCLEICOS E VITAMINAS 1. Dentre os diferentes compostos orgânicos das células temos as proteínas. Sobre estas responda: a) Cite
Módulo: Nível Superior Dezembro/2014 GVDATA
 Módulo: Nível Superior Dezembro/2014 GVDATA Classificada no grupo de doenças extremamente negligenciadas Leishmanioses Volta Redonda Barra Mansa Rio de Janeiro Niterói Definição de Caso suspeito Todo individuo
Módulo: Nível Superior Dezembro/2014 GVDATA Classificada no grupo de doenças extremamente negligenciadas Leishmanioses Volta Redonda Barra Mansa Rio de Janeiro Niterói Definição de Caso suspeito Todo individuo
Estabilidade do produto
 Estabilidade do produto A estabilidade e a segurança de embutidos cárneos são relacionadas com atividade de água, ph e temperatura de armazenagem Grupos de produtos Aw ph Temperatura de armazenagem Facilmente
Estabilidade do produto A estabilidade e a segurança de embutidos cárneos são relacionadas com atividade de água, ph e temperatura de armazenagem Grupos de produtos Aw ph Temperatura de armazenagem Facilmente
Turma Fisioterapia - 2º Termo. Profa. Dra. Milena Araújo Tonon Corrêa
 Turma Fisioterapia - 2º Termo Profa. Dra. Milena Araújo Tonon Corrêa Administração Absorção Fármaco na circulação sistêmica A absorção, a distribuição, o metabolismo e a excreção de um fármaco envolvem
Turma Fisioterapia - 2º Termo Profa. Dra. Milena Araújo Tonon Corrêa Administração Absorção Fármaco na circulação sistêmica A absorção, a distribuição, o metabolismo e a excreção de um fármaco envolvem
Vestibular1 A melhor ajuda ao vestibulando na Internet Acesse Agora! Leishmaniose
 Leishmaniose Sob a denominação genérica de leishmaniose, a ciência médica descreve um grupo de doenças infecciosas causadas por protozoários do gênero Leishmania, transmitidos ao homem por mosquitos do
Leishmaniose Sob a denominação genérica de leishmaniose, a ciência médica descreve um grupo de doenças infecciosas causadas por protozoários do gênero Leishmania, transmitidos ao homem por mosquitos do
Biologia. Alexandre Bandeira (Julio Junior) Membrana e Organelas
 Membrana e Organelas Membrana e Organelas 1. As funções das células estão relacionadas com sua estrutura e com sua atividade metabólica. Apresenta-se abaixo uma tabela em que estão discriminadas, em porcentagens,
Membrana e Organelas Membrana e Organelas 1. As funções das células estão relacionadas com sua estrutura e com sua atividade metabólica. Apresenta-se abaixo uma tabela em que estão discriminadas, em porcentagens,
USO RACIONAL DE ANTIBIÓTICOS EM GERMES MULTIRRESISTENTES
 USO RACIONAL DE ANTIBIÓTICOS EM GERMES MULTIRRESISTENTES Francisco Eugênio Deusdará de Alexandria Infectologista e Mestre em Genética e Toxicologia Aplicada 14/04/2015 13:19 1 O QUE É USO RACIONAL DE ANTIBIÓTICOS?
USO RACIONAL DE ANTIBIÓTICOS EM GERMES MULTIRRESISTENTES Francisco Eugênio Deusdará de Alexandria Infectologista e Mestre em Genética e Toxicologia Aplicada 14/04/2015 13:19 1 O QUE É USO RACIONAL DE ANTIBIÓTICOS?
Detecção de IL-1 por ELISA sanduíche. Andréa Calado
 Detecção de IL-1 por ELISA sanduíche Andréa Calado andreabelfort@hotmail.com ELISA O teste identifica e quantifica Ag ou Ac, utilizando um dos dois conjugados com enzimas; PRINCIPAIS TIPOS: INDIRETO:
Detecção de IL-1 por ELISA sanduíche Andréa Calado andreabelfort@hotmail.com ELISA O teste identifica e quantifica Ag ou Ac, utilizando um dos dois conjugados com enzimas; PRINCIPAIS TIPOS: INDIRETO:
AVALIAÇÃO DA ATIVIDADE ANTIMICROBIANA DOS ÓLEOS ESSENCIAIS DE Eugenia caryophyllata E Croton rhamnifolioides pax e hoffm
 AVALIAÇÃO DA ATIVIDADE ANTIMICROBIANA DOS ÓLEOS ESSENCIAIS DE Eugenia caryophyllata E Croton rhamnifolioides pax e hoffm Nathália Ventura de Almeida ITAPARICA 1, Sofia Suely Ferreira Brandão RODRIGUES
AVALIAÇÃO DA ATIVIDADE ANTIMICROBIANA DOS ÓLEOS ESSENCIAIS DE Eugenia caryophyllata E Croton rhamnifolioides pax e hoffm Nathália Ventura de Almeida ITAPARICA 1, Sofia Suely Ferreira Brandão RODRIGUES
RootBioTec HO: Previne a perda capilar - garante um cabelo mais cheio
 RootBioTec HO: Previne a perda capilar - garante um cabelo mais cheio A perda de cabelo tem várias causas Volume normal do cabelo: 100,000-150,000 cabelos Para manter um volume normal, o cabelo deve ser
RootBioTec HO: Previne a perda capilar - garante um cabelo mais cheio A perda de cabelo tem várias causas Volume normal do cabelo: 100,000-150,000 cabelos Para manter um volume normal, o cabelo deve ser
de laboratório em pesquisas Segurança dos animais Segurança do experimentador
 Segurança no uso de animais de laboratório em pesquisas Segurança dos animais Ética no uso dos animais Segurança do experimentador Como em qualquer laboratório, pratique Boas Praticas Laboratoriais no
Segurança no uso de animais de laboratório em pesquisas Segurança dos animais Ética no uso dos animais Segurança do experimentador Como em qualquer laboratório, pratique Boas Praticas Laboratoriais no
RELATÓRIO FOSFOETANOLAMINA. Centro de Inovação e Ensaios Pré-Clínicos CIEnP RELATÓRIO FINAL
 Centro de Inovação e Ensaios Pré-Clínicos CIEnP RELATÓRIO FINAL FOSFOBISETANOLAMINA (UNICAMP) EM LINHAGENS DE CÉLULAS HUMANAS DE CARCINOMA DE PULMÃO, CARCINOMA DE PÂNCREAS E MELANOMA. Estudo nº: 024-VIP-008-16
Centro de Inovação e Ensaios Pré-Clínicos CIEnP RELATÓRIO FINAL FOSFOBISETANOLAMINA (UNICAMP) EM LINHAGENS DE CÉLULAS HUMANAS DE CARCINOMA DE PULMÃO, CARCINOMA DE PÂNCREAS E MELANOMA. Estudo nº: 024-VIP-008-16
Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194
 Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 Imunologia das Viroses Monitor: Daniel Valente 1.Introdução...
Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 Imunologia das Viroses Monitor: Daniel Valente 1.Introdução...
Curso Técnico em Análises Químicas Disciplina: Microbiologia. Aula 3.1 Bactérias
 Curso Técnico em Análises Químicas Disciplina: Microbiologia Aula 3.1 Bactérias CLASSIFICAÇÃO: Bactérias Quanto a respiração: Aeróbicas: crescem apenas na presença de O 2. Anaeróbicas: crescem em ausência
Curso Técnico em Análises Químicas Disciplina: Microbiologia Aula 3.1 Bactérias CLASSIFICAÇÃO: Bactérias Quanto a respiração: Aeróbicas: crescem apenas na presença de O 2. Anaeróbicas: crescem em ausência
Instituto de Pesquisas em Patologias Tropicais IPEPATRO/FIOCRUZ. Ferida Brava (Leishmaniose): Conheça e Aprenda a se proteger
 Instituto de Pesquisas em Patologias Tropicais IPEPATRO/FIOCRUZ Ferida Brava (Leishmaniose): Conheça e Aprenda a se proteger Janeiro de 2013 O que é? É uma doença infecciosa, não contagiosa, que afeta
Instituto de Pesquisas em Patologias Tropicais IPEPATRO/FIOCRUZ Ferida Brava (Leishmaniose): Conheça e Aprenda a se proteger Janeiro de 2013 O que é? É uma doença infecciosa, não contagiosa, que afeta
Audiência Pública 17/08/2015. Projeto de Lei 1.738/2011
 Audiência Pública 17/08/2015 Projeto de Lei 1.738/2011 Prof. Vitor Márcio Ribeiro PUC Minas A LEISHMANIOSE VISCERAL NO BRASIL O primeiro caso no Brasil foi descrito por Migone L.E.,em 1913 O paciente era
Audiência Pública 17/08/2015 Projeto de Lei 1.738/2011 Prof. Vitor Márcio Ribeiro PUC Minas A LEISHMANIOSE VISCERAL NO BRASIL O primeiro caso no Brasil foi descrito por Migone L.E.,em 1913 O paciente era
Universidade Federal Fluminense Resposta do hospedeiro às infecções virais
 Universidade Federal Fluminense Resposta do hospedeiro às infecções virais Disciplina de Virologia Departamento de Microbiologia e Parasitologia (MIP) Mecanismos de resposta inespecífica Barreiras anatômicas
Universidade Federal Fluminense Resposta do hospedeiro às infecções virais Disciplina de Virologia Departamento de Microbiologia e Parasitologia (MIP) Mecanismos de resposta inespecífica Barreiras anatômicas
Capítulo 30. Produtos farmacêuticos. b) os gessos especialmente calcinados ou finamente triturados para dentistas (posição 25.20);
 Capítulo 30 Produtos farmacêuticos Notas. 1. O presente Capítulo não compreende: a) os alimentos dietéticos, alimentos enriquecidos, alimentos para diabéticos, complementos alimentares, bebidas tônicas
Capítulo 30 Produtos farmacêuticos Notas. 1. O presente Capítulo não compreende: a) os alimentos dietéticos, alimentos enriquecidos, alimentos para diabéticos, complementos alimentares, bebidas tônicas
MÉTODOS DE ESTUDO DE BACTÉRIAS BUCAIS
 LABORATÓRIO DE ANAERÓBIOS http://www.icb.usp.br/bmm/mariojac MÉTODOS DE ESTUDO DE BACTÉRIAS BUCAIS Prof. Dr. Mario J. Avila-Campos Para que isolar microrganismos? - Conhecer os diferentes tipos microbianos
LABORATÓRIO DE ANAERÓBIOS http://www.icb.usp.br/bmm/mariojac MÉTODOS DE ESTUDO DE BACTÉRIAS BUCAIS Prof. Dr. Mario J. Avila-Campos Para que isolar microrganismos? - Conhecer os diferentes tipos microbianos
Procedimento Complementar para Validação de Métodos Analíticos e Bioanalíticos usando Análise de Regressão Linear
 Procedimento Complementar para Validação de Métodos Analíticos e Bioanalíticos usando Análise de Regressão Linear Rogério Antonio de Oliveira 1 Chang Chiann 2 1 Introdução Atualmente, para obter o registro
Procedimento Complementar para Validação de Métodos Analíticos e Bioanalíticos usando Análise de Regressão Linear Rogério Antonio de Oliveira 1 Chang Chiann 2 1 Introdução Atualmente, para obter o registro
Faculdade de São Lourenço - UNISEPE Cursos de extensão nas áreas de Estética e Cosmética
 Faculdade de São Lourenço - UNISEPE Cursos de extensão nas áreas de Estética e Cosmética Orientações gerais: Público-alvo: Estudantes e profissionais da área de estética e cosmetologia, farmacêuticos e
Faculdade de São Lourenço - UNISEPE Cursos de extensão nas áreas de Estética e Cosmética Orientações gerais: Público-alvo: Estudantes e profissionais da área de estética e cosmetologia, farmacêuticos e
Bases do diagnóstico bacteriológico
 Bases do diagnóstico bacteriológico Prof. Cláudio Galuppo Diniz Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação agentes
Bases do diagnóstico bacteriológico Prof. Cláudio Galuppo Diniz Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação agentes
24/11/2015. Biologia de Microrganismos - 2º Semestre de Prof. Cláudio 1. O mundo microbiano. Profa. Alessandra B. F. Machado
 UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Relação bactéria-hospedeiro Profa. Alessandra B. F. Machado O mundo microbiano Os microrganismos são ubíquos.
UNIVERSIDADE FEDERAL DE JUIZ DE FORA DEPARTAMENTO DE PARASITOLOGIA, MICROBIOLOGIA E IMUNOLOGIA Relação bactéria-hospedeiro Profa. Alessandra B. F. Machado O mundo microbiano Os microrganismos são ubíquos.
Giardíase. - É a principal parasitose intestinal (com maior incidência do que a ascaridíase e a amebíase).
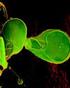 Giardíase Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Diplomonadida Família: Hexamitidae Gênero: Giardia Espécie: Giardia lamblia - É a principal parasitose intestinal
Giardíase Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Diplomonadida Família: Hexamitidae Gênero: Giardia Espécie: Giardia lamblia - É a principal parasitose intestinal
NANOFACTOR C Sodium Ascorbyl Phosphate Decapeptide 4
 NANOFACTOR C Sodium Ascorbyl Phosphate Decapeptide 4 A forma mais ESTÁVEL da VITAMINA C potencializada com FATOR DE CRESCIMENTO (PEPTÍDEO BIOIDÊNTICO ) NANOLIPOSSOMADO elevada ESTABILIDADE e BIODISPONIBILIDADE
NANOFACTOR C Sodium Ascorbyl Phosphate Decapeptide 4 A forma mais ESTÁVEL da VITAMINA C potencializada com FATOR DE CRESCIMENTO (PEPTÍDEO BIOIDÊNTICO ) NANOLIPOSSOMADO elevada ESTABILIDADE e BIODISPONIBILIDADE
02/07/2010. Importância. Pesquisas. Agente Antimicrobiano. Biofilmes. Agentes Quimioterápicos (Antimicróbicos) Antibióticos. Saúde.
 Importância Saúde Economia Pesquisas Novos compostos Resustência Biofilmes Importância na terapêutica antimicrobiana Agente Antimicrobiano Composto químico que mata ou inibe o crescimento de microrganismos,
Importância Saúde Economia Pesquisas Novos compostos Resustência Biofilmes Importância na terapêutica antimicrobiana Agente Antimicrobiano Composto químico que mata ou inibe o crescimento de microrganismos,
Toxoplasmose. Filo: Apicomplexa (porque possui complexo apical)
 Toxoplasmose Parasito Reino: Protozoa Filo: Apicomplexa (porque possui complexo apical) Ordem: Eucoccidiida Família: Sarcocystidae Gênero: Toxoplasma Espécie: Toxoplasma gondii - É uma doença cosmopolita.
Toxoplasmose Parasito Reino: Protozoa Filo: Apicomplexa (porque possui complexo apical) Ordem: Eucoccidiida Família: Sarcocystidae Gênero: Toxoplasma Espécie: Toxoplasma gondii - É uma doença cosmopolita.
AVALIAÇÃO DA ATIVIDADE TRIPANOCIDA E LEISHMANICIDA DE PRODUTOS NATURAIS DA FLORA MATO-GROSSENSE
 UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS BIOLÓGICAS - CCB DEPARTAMENTO DE MICROBIOLOGIA E PARASITOLOGIA MIP LABORATÓRIO DE PROTOZOOLOGIA TRABALHO DE CONCLUSÃO DE CURSO AVALIAÇÃO DA ATIVIDADE
UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS BIOLÓGICAS - CCB DEPARTAMENTO DE MICROBIOLOGIA E PARASITOLOGIA MIP LABORATÓRIO DE PROTOZOOLOGIA TRABALHO DE CONCLUSÃO DE CURSO AVALIAÇÃO DA ATIVIDADE
TÍTULO: DESENVOLVIMENTO DA POPULAÇÃO DE STAPHYLOCOCCUS EM PATÊ DE PEITO DE PERU SABOR DEFUMADO DURANTE 45 DIAS DE ARMAZENAMENTO
 TÍTULO: DESENVOLVIMENTO DA POPULAÇÃO DE STAPHYLOCOCCUS EM PATÊ DE PEITO DE PERU SABOR DEFUMADO DURANTE 45 DIAS DE ARMAZENAMENTO CATEGORIA: CONCLUÍDO ÁREA: ENGENHARIAS E ARQUITETURA SUBÁREA: ENGENHARIAS
TÍTULO: DESENVOLVIMENTO DA POPULAÇÃO DE STAPHYLOCOCCUS EM PATÊ DE PEITO DE PERU SABOR DEFUMADO DURANTE 45 DIAS DE ARMAZENAMENTO CATEGORIA: CONCLUÍDO ÁREA: ENGENHARIAS E ARQUITETURA SUBÁREA: ENGENHARIAS
Taninos. Profa. Wânia Vianna 1S/2014
 Taninos Profa. Wânia Vianna 1S/2014 Estudo Metabólitos Secundário Aspectos Importantes Identificar aspectos característicos da estrutura química; Caracterizar a polaridade da molécula: escolha do solvente
Taninos Profa. Wânia Vianna 1S/2014 Estudo Metabólitos Secundário Aspectos Importantes Identificar aspectos característicos da estrutura química; Caracterizar a polaridade da molécula: escolha do solvente
Avaliação Quantitativa das Preparações Enzimáticas
 Avaliação Quantitativa das Preparações Enzimáticas Como diferenciar enzimas? Quando não podemos determinar a concentração de uma enzima devemos diferenciar as enzimas por sua atividade (moléculas não podem
Avaliação Quantitativa das Preparações Enzimáticas Como diferenciar enzimas? Quando não podemos determinar a concentração de uma enzima devemos diferenciar as enzimas por sua atividade (moléculas não podem
MSc. Wagner Fernando Fuck Letícia Pavoni Grasselli Drª Mariliz Gutterres
 Universidade Federal do Rio Grande do Sul Programa de Pós-Graduação em Engenharia Química Departamento de Engenharia Química Laboratório de Estudos em Couro e Meio Ambiente ESTADO DA ARTE E DESENVOLVIMENTO
Universidade Federal do Rio Grande do Sul Programa de Pós-Graduação em Engenharia Química Departamento de Engenharia Química Laboratório de Estudos em Couro e Meio Ambiente ESTADO DA ARTE E DESENVOLVIMENTO
Tópicos de Imunologia Celular e Molecular (Parte 2)
 IMUNOLOGIA BÁSICA Tópicos de Imunologia Celular e Molecular (Parte 2) Prof. M. Sc. Paulo Galdino Os três outros tipos de hipersensibilidade ( II, III e IV) têm em comum uma reação exagerada do sistema
IMUNOLOGIA BÁSICA Tópicos de Imunologia Celular e Molecular (Parte 2) Prof. M. Sc. Paulo Galdino Os três outros tipos de hipersensibilidade ( II, III e IV) têm em comum uma reação exagerada do sistema
2.Introdução A Doença Descrição...11
 Índice 1.Apresentação... 05 2.Introdução...07 3.A Doença... 11 3.1. Descrição...11 3.2. Epidemiologia... 11 3.2.1. Agente Etiológico e Ciclo Evolutivo...11 3.2.2. Reservatórios / Hospedeiros Intermediários...
Índice 1.Apresentação... 05 2.Introdução...07 3.A Doença... 11 3.1. Descrição...11 3.2. Epidemiologia... 11 3.2.1. Agente Etiológico e Ciclo Evolutivo...11 3.2.2. Reservatórios / Hospedeiros Intermediários...
1- TURMA A. Biologia. a) proteínas. b) glicídios. c) lipídios. d) lipídios e glicídios. e) lipídios e proteínas.
 Biologia Atividade de classe Gabarito 2 os anos Tatiana mar/12 1- TURMA A 1- (PUCCamp modificada) Os fenilcetonúricos têm falta de uma enzima responsável pelo metabolismo do aminoácido fenilalanina. Para
Biologia Atividade de classe Gabarito 2 os anos Tatiana mar/12 1- TURMA A 1- (PUCCamp modificada) Os fenilcetonúricos têm falta de uma enzima responsável pelo metabolismo do aminoácido fenilalanina. Para
Enzimas e Actividade enzimática
 Enzimas e Actividade enzimática Energia de activação de uma reacção Em todas as células de um organismo vivo ocorre um número infindável de reacções químicas. Estas reacções implicam a quebra, e posteriormente,
Enzimas e Actividade enzimática Energia de activação de uma reacção Em todas as células de um organismo vivo ocorre um número infindável de reacções químicas. Estas reacções implicam a quebra, e posteriormente,
Palavras-chave: Índigo Carmim. Teste de Estabilidade. Degradação forçada.
 ESTUDO DE ESTABILIDADE DO CORANTE ÍNDIGO CARMIM EM CONDIÇÕES DE DEGRADAÇÃO FORÇADA Élisson Nogueira LOPES 1 Fabrício Vieira de ANDRADE 2 RESUMO O Índigo Carmim é um corante sintético de cor azul muito
ESTUDO DE ESTABILIDADE DO CORANTE ÍNDIGO CARMIM EM CONDIÇÕES DE DEGRADAÇÃO FORÇADA Élisson Nogueira LOPES 1 Fabrício Vieira de ANDRADE 2 RESUMO O Índigo Carmim é um corante sintético de cor azul muito
Características Gerais dos Vírus
 Características Gerais dos Vírus Vírus Agentes causadores de infecções no homem, outros animais, vegetais e bactérias. São desprovidos de organelas e sem metabolismo próprio. Parasitas intracelulares obrigatórios.
Características Gerais dos Vírus Vírus Agentes causadores de infecções no homem, outros animais, vegetais e bactérias. São desprovidos de organelas e sem metabolismo próprio. Parasitas intracelulares obrigatórios.
PROJETO DE INICIAÇÃO CIENTÍFICA MEDICINA VETERINÁRIA
 PROJETO DE INICIAÇÃO CIENTÍFICA MEDICINA VETERINÁRIA Contaminação por ovos e larvas de helmintos em areia de praças públicas na cidade de Taguatinga-DF BRASÍLIA 2012 PROJETO DE INICIAÇÃO CIENTÍFICA MEDICINA
PROJETO DE INICIAÇÃO CIENTÍFICA MEDICINA VETERINÁRIA Contaminação por ovos e larvas de helmintos em areia de praças públicas na cidade de Taguatinga-DF BRASÍLIA 2012 PROJETO DE INICIAÇÃO CIENTÍFICA MEDICINA
Antígenos e Imunoglobulinas
 Curso: farmácia Componente curricular: Imunologia Antígenos e Imunoglobulinas DEYSIANE OLIVEIRA BRANDÃO Antígenos (Ag) São estruturas solúveis ou particuladas reconhecidas pelo organismo como estranha
Curso: farmácia Componente curricular: Imunologia Antígenos e Imunoglobulinas DEYSIANE OLIVEIRA BRANDÃO Antígenos (Ag) São estruturas solúveis ou particuladas reconhecidas pelo organismo como estranha
ESPECÍFICO DE ENFERMAGEM PROF. CARLOS ALBERTO
 ESPECÍFICO DE ENFERMAGEM PROF. CARLOS ALBERTO CONCURSO HOSPITAL UNIVERSITÁRIO ESPECÍFICO DE ENFERMAGEM TEMA 11 PROGRAMA NACIONAL DE IMUNIZAÇÃO DESENVOLVIMENTO DE VACINAS O que faz uma vacina? Estimula
ESPECÍFICO DE ENFERMAGEM PROF. CARLOS ALBERTO CONCURSO HOSPITAL UNIVERSITÁRIO ESPECÍFICO DE ENFERMAGEM TEMA 11 PROGRAMA NACIONAL DE IMUNIZAÇÃO DESENVOLVIMENTO DE VACINAS O que faz uma vacina? Estimula
Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain
 67 4.2 Estudo II Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain Enquanto anticorpos anti-t. gondii são
67 4.2 Estudo II Heterologous antibodies to evaluate the kinetics of the humoral immune response in dogs experimentally infected with Toxoplasma gondii RH strain Enquanto anticorpos anti-t. gondii são
LITERATURA MERATRIM REDUTOR DE MEDIDAS DIMINUÇÃO DAS MEDIDAS DE CINTURA E QUADRIL EM 2 SEMANAS!
 MERATRIM REDUTOR DE MEDIDAS DIMINUÇÃO DAS MEDIDAS DE CINTURA E QUADRIL EM 2 SEMANAS! A Organização Mundial de Saúde aponta a obesidade como um dos maiores problemas de saúde pública no mundo. Segundo dados
MERATRIM REDUTOR DE MEDIDAS DIMINUÇÃO DAS MEDIDAS DE CINTURA E QUADRIL EM 2 SEMANAS! A Organização Mundial de Saúde aponta a obesidade como um dos maiores problemas de saúde pública no mundo. Segundo dados
BIOLOGIA 2ª ETAPA do VESTIBULAR 2005
 IOLOGIA 2ª ETAPA do VESTIULAR 2005 QUESTÃO 01 Os hormônios sexuais são substâncias que, no sistema reprodutor feminino, promovem interações que regulam o ciclo menstrual. Analise a possibilidade de ocorrência
IOLOGIA 2ª ETAPA do VESTIULAR 2005 QUESTÃO 01 Os hormônios sexuais são substâncias que, no sistema reprodutor feminino, promovem interações que regulam o ciclo menstrual. Analise a possibilidade de ocorrência
MATÉRIA ORGÂNICA DO SOLO (MOS) Fertilidade do Solo Prof. Josinaldo
 MATÉRIA ORGÂNICA DO SOLO (MOS) Fertilidade do Solo Prof. Josinaldo 1 ASPECTOS GERAIS - MOS todos os compostos orgânicos do solo - Influência os atributos do solo - Teor no solo amplamente variável (0,5
MATÉRIA ORGÂNICA DO SOLO (MOS) Fertilidade do Solo Prof. Josinaldo 1 ASPECTOS GERAIS - MOS todos os compostos orgânicos do solo - Influência os atributos do solo - Teor no solo amplamente variável (0,5
Exercício de Fixação: Características Gerais dos Vírus
 Exercício de Fixação: Características Gerais dos Vírus 01-2017 1- Quais foram as observações feitas por Adolf Mayer que permitiram concluir que o agente etiológico da Doença do Mosaico do tabaco era um
Exercício de Fixação: Características Gerais dos Vírus 01-2017 1- Quais foram as observações feitas por Adolf Mayer que permitiram concluir que o agente etiológico da Doença do Mosaico do tabaco era um
Aula: 26 Temática: Estrutura dos lipídeos parte I
 Aula: 26 Temática: Estrutura dos lipídeos parte I Os lipídeos são abundantes em animais e vegetais. Compreendem os óleos, as gorduras, as ceras, os lipídios compostos como os fosfolipídios e os esteróides
Aula: 26 Temática: Estrutura dos lipídeos parte I Os lipídeos são abundantes em animais e vegetais. Compreendem os óleos, as gorduras, as ceras, os lipídios compostos como os fosfolipídios e os esteróides
PROGRAD / COSEAC Padrão de Respostas Biologia
 1 a QUESTÃO: Cada vez mais a técnica da reação em cadeia da polimerase (PCR - polimerase chain reaction) tem sido utilizada no diagnóstico de doenças parasitárias. Por essa técnica, regiões específicas
1 a QUESTÃO: Cada vez mais a técnica da reação em cadeia da polimerase (PCR - polimerase chain reaction) tem sido utilizada no diagnóstico de doenças parasitárias. Por essa técnica, regiões específicas
ANÁLISE DAS CONDIÇÕES CLIMÁTICAS PARA O CULTIVO DO MILHO, NA CIDADE DE PASSO FUNDO-RS.
 ANÁLISE DAS CONDIÇÕES CLIMÁTICAS PARA O CULTIVO DO MILHO, NA CIDADE DE PASSO FUNDO-RS. Claudia Guimarães CAMARGO Bolsista do grupo PET do curso de Meteorologia/ FacMet/UFPel e-mail: camargo@ufpel.tche.br
ANÁLISE DAS CONDIÇÕES CLIMÁTICAS PARA O CULTIVO DO MILHO, NA CIDADE DE PASSO FUNDO-RS. Claudia Guimarães CAMARGO Bolsista do grupo PET do curso de Meteorologia/ FacMet/UFPel e-mail: camargo@ufpel.tche.br
1/12/2008. HIV como modelo de estudo de retrovírus e patogênese. Retrovírus e oncogênese. Retrovírus e oncogênese.
 HIV como modelo de estudo de retrovírus e patogênese Retrovírus e oncogênese. Um pouco de história: 1904: Ellerman and Bang, procurando por bactérias como agentes infecciosos para leucemia em galinhas,
HIV como modelo de estudo de retrovírus e patogênese Retrovírus e oncogênese. Um pouco de história: 1904: Ellerman and Bang, procurando por bactérias como agentes infecciosos para leucemia em galinhas,
MICROBIOLOGIA E PARASITOLOGIA II
 MICROBIOLOGIA E PARASITOLOGIA II MICROBIOLOGIA: Mikros (= pequeno) + Bio (= vida) + logos (= ciência) A Microbiologia é definida, como a área da ciência que dedica - se ao estudo de microrganismos. Os
MICROBIOLOGIA E PARASITOLOGIA II MICROBIOLOGIA: Mikros (= pequeno) + Bio (= vida) + logos (= ciência) A Microbiologia é definida, como a área da ciência que dedica - se ao estudo de microrganismos. Os
METABÓLITOS SECUNDÁRIOS. Taninos
 METABÓLITOS SECUNDÁRIOS Taninos Corresponde a um grupo diverso de substâncias fenólicas, hidrossolúveis e com peso molecular superior a 500 D De acordo com sua estrutura química, pode se dividir nos seguintes
METABÓLITOS SECUNDÁRIOS Taninos Corresponde a um grupo diverso de substâncias fenólicas, hidrossolúveis e com peso molecular superior a 500 D De acordo com sua estrutura química, pode se dividir nos seguintes
TÍTULO: SEXAGEM FETAL:DIAGNÓTICO DO SEXO DO FETO POR REAÇÃO EM CADEIA DE POLIMERASE (PCR)
 TÍTULO: SEXAGEM FETAL:DIAGNÓTICO DO SEXO DO FETO POR REAÇÃO EM CADEIA DE POLIMERASE (PCR) CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: BIOMEDICINA INSTITUIÇÃO: CENTRO UNIVERSITÁRIO
TÍTULO: SEXAGEM FETAL:DIAGNÓTICO DO SEXO DO FETO POR REAÇÃO EM CADEIA DE POLIMERASE (PCR) CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: BIOMEDICINA INSTITUIÇÃO: CENTRO UNIVERSITÁRIO
TÍTULO: EFEITO DA TERAPIA PERIODONTAL NÃO CIRÚRGICA SOBRE O CONTROLE GLICÊMICO EM INDIVÍDUOS COM DIABETES TIPO2 E PERIODONTITE CRÔNICA: ENSAIO CLÍNICO
 16 TÍTULO: EFEITO DA TERAPIA PERIODONTAL NÃO CIRÚRGICA SOBRE O CONTROLE GLICÊMICO EM INDIVÍDUOS COM DIABETES TIPO2 E PERIODONTITE CRÔNICA: ENSAIO CLÍNICO CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS
16 TÍTULO: EFEITO DA TERAPIA PERIODONTAL NÃO CIRÚRGICA SOBRE O CONTROLE GLICÊMICO EM INDIVÍDUOS COM DIABETES TIPO2 E PERIODONTITE CRÔNICA: ENSAIO CLÍNICO CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS
