Estrutura tridimensional das proteinas
|
|
|
- Raul Bayer da Costa
- 7 Há anos
- Visualizações:
Transcrição
1 Estrutura tridimensional das proteinas
2 Talvez as características mais notáveis (mioglobina) sejam a sua complexidade e ausência de simetria, Nature,1958 John Kendrew
3 Kendrew & Perutz PN 1962 pelos estudos de estruturas de proteínas globulares
4 1920 s várias proteínas cristalizadas urease (MM ) hemoglobina (MM )
5 Como é que uma sequência de aminoácidos se traduz numa estrutura tridimensional? A estrutura tridimensional de uma proteína é determinada pela sequência de aminoácidos. A função de uma proteína depende da sua estrutura. Uma proteína isolada existe em várias formas estáveis. As forças mais relevantes na estabilização das estruturas específicas são não covalentes. Apesar do grande nº de estruturas únicas, é possível reconhecer padrões estruturais.
6 Conformação arranjo espacial dos átomos numa proteína. Muitas conformações são teoricamente possíveis, mas só algumas predominam em condições biológicas as que são termodinamicamente mais estáveis. Quais os princípios que determinam a conformação mais estável de uma proteína?
7 Estabilidade de uma proteína tendência para manter uma conformação nativa (funcional). Interacções químicas que estabilizam a conformação nativa: Ligações dissulfureto Interacções fracas : Ligações de H, Ligações iónicas Interacções hidrofóbicas
8 A conformação mais estável é que tem um maior nº de interacções fracas As interacções hidrofóbicas predominam Aumento de entropia das moléculas da H 2 O Formação de ligações de hidrogénio Cada grupo polar ou carregado deve ter o seu contraponto. As ligações iónicas limitam a flexibilidade estrutural.
9 Os resíduos hidrofóbicos estão no interior da proteína. O número de pontes de hidrogénio e de interacções iónicas no interior da proteína é maximizado.
10 Níveis de estrutura de uma proteína
11 A ligação peptídica Nível primário de estrutura As ligações covalentes impõem constrangimentos à conformação de um polipéptido
12 Estrutura primária das proteínas Pauling PN 1954 (Q) PN 1962 (Paz) Stop the war! Pauling propôs em 1950 o primeiro modelo aceitável para a molécula de proteína!
13 A unidade peptídica é planar e rígida. Tem em parte carácter de ligação dupla Lig simples-1.47 Å Lig dupla-1,20 Å O oxigénio do grupo carbonilo tem uma carga parcial negativa e o azoto da amida uma carga parcial positiva criando um dipolo.
14 O grupo peptídico planar As ligações peptídicas limitam a gama de conformações possíveis para a cadeia polipeptídica.
15 ψ (graus) Gráfico de Ramachandran para L-Ala Φ (graus) Valores permitidos para Φ e ψ
16 Todas as proteínas têm uma estrutura que reflecte a sua função. A estrutura de uma proteína é estabilizada por múltiplas interacções fracas. A natureza das ligações covalentes no esqueleto da proteína impõe constrangimentos. A dupla ligação tem em parte carácter de ligação dupla colocando os átomos do grupo peptídico numa configuração planar rígida. As ligações N-Cα e Cα-C podem rodar definindo os ângulos diedro Ψ e Φ respectivamente.
17 Nível secundário de estrutura
18 Estrutura secundária de uma proteína (geometria local) Refere-se a um segmento de uma cadeia polipeptídica Descreve os arranjos espaciais locais dos átomos da cadeia principal, sem considerar a conformação das cadeias laterais ou relações com outros segmentos da cadeia. Hélice α e conformação β (previstas por Pauling e Corey, 1951). hélice α é a mais comum
19 Modelo da hélice α Extremo amina Extremo carboxilo
20 Modelo da hélice α
21 Hélice α É estabilizada por ligações de H entre o átomo de H ligado ao N electronegativo da ligação peptídica e o átomo de oxigénio electronegativo do grupo carbonilo do 4º aminoácido seguinte. Todas as ligações peptídicas participam nestas ligações de H
22 A sequência de aa afecta a estabilidade da hélice α Os resíduos Pro e Gly têm a menor tendência para formar hélices α por motivos diferentes. A alanina tem a maior tendência para formar hélices α em modelos experimentais. Um conjunto de resíduos Glu não forma uma hélice α. Muitos resíduos Lys e/ou Arg também não formam hélices α. O volume e a forma de Asn, Ser, Thr e Cys, desestabilizam a hélice se estiverem perto
23 N O dipolo da hélice C
24 A estabilidade da hélice α é afectada por: 1.Propensão intrínseca de cada resíduo de aa para formar hélice α. 2.Interacções entre grupos R (sobretudos os separados por 3 ou 4 resíduos). 3.Tamanho dos grupos R adjacentes. 4.Ocorrência de resíduos Pro e Gly. 5. Interacções entre resíduos de aa nos extremos e o dipolo inerente à hélice.
25 Mioglobina (153 resíduos) 79% hélice α Insulina (51 resíduos) 52% hélice α Citocromo c (104 resíduos) 39% hélice α
26 A conformação β (folhas pregueadas β) Também previstas por Pauling e Corey Confirmadas por difracção de Raios X Antiparalelas Vista de topo Vista de lado
27 Paralelas Vista de topo Vista de lado
28 Na conformação β, as ligações de hidrogénio formamse entre segmentos adjacentes de uma cadeia polipeptídica. Os segmentos podem estar próximos na cadeia polipeptídica mas também podem estar distantes na sequência linear do polipéptido. Em algumas estruturas os aa empacotados nas conformações β têm que ter grupos R pequenos. A alanina e glicina são frequentes nestas estruturas.
29 Estrutura de β turns (elementos de ligação) A glicina e a prolina são comuns nestas estruturas
30 folhas pregueadas β antiparalelas ψ (graus) folhas pregueadas β paralelas tripla hélice de colagéneo folhas pregueadas β enroladas à direira α-hélice esquerda α-hélice direita Gráfico de Ramachandran Φ (graus)
31 ψ (graus) Φ (graus) Ramachandran para piruvatocinase de músculo coelho
32 Estrutura terciária conformação tridimensional biologicamente activa Aminoácidos que estão afastados na sequência linear e estão em diferentes tipos de estrutura secundária podem interactuar. Estrutura quaternária arranjo espacial das subunidades em complexos tridimensionais
33 A forma das proteínas Proteínas fibrosas : constituídas em geral por um único tipo de estrutura secundária e uma estrutura terciária relativamente simples. Alongadas, insolúveis Proteínas globulares : Em geral contêm vários tipos de estrutura secundárias. Compactas, esféricas solúveis
34 Estruturas secundárias e propriedades de algumas proteínas fibrosas Estrutura Características Exemplos Hélice α (entrecruzada por ligações S-S) Rija, estruturas protectoras com dureza e flexibilidade variadas) α- queratina do cabelo, penas e unhas Conformação β Filamentos flexíveis Fibroína da seda Hélice tripla Enrolamento ao acaso (ligações covalentes entre cadeias laterais) Elevada força de tensão sem flexibilidade Elevada flexibilidade e elasticidade Colagéneo dos tendões ossos, etc Elastina dos vasos sanguíneos
35 Estrutura da α queratina (cabelo) α-hélice 2 cadeias enroladas para a esquerda protofilamentos protofibrila As α queratinas pertencem à família dos filamentos intermediários
36 células filamento intermediário protofibrila protofilamento 2 cadeias α-hélice Secção de um cabelo Secção de um cabelo
37 As superfícies das duas cadeias são constituídas por resíduos de aa hidrofóbicos empacotamento forte. Ala, Val, leu, Ile, Met e Phe Estrutura terciária simples dominada por estrutura secundária em hélice α. Estrutura quaternária - interligação dos dois polipéptidos em hélice α Ligações S-S entre cadeias estabilizam a estrutura quaternária (18% das cisteínas estão envolvidas em ligações S-S no corno do rinoceronte)
38 As permanentes são Engenharia Bioquímica
39 Estrutura do colagéneo hélice tripla Gly X Pro Gly X 4-Hyp Gly 3 Hélice esquerda de prolinas(3res/volta)
40 Estrutura das fibrilas de colagéneo cabeças da molécula de colagéneo zonas cruzadas(64nm) Tendão-100% colag. Cartilagem-colag. embebido em matriz poliosídica Osso-matriz colag. cimentada por depósitos de Ca 10 (PO 4 ) 6 (OH) 2 secção da molécula de colagéneo Nos vertebrados há muitos tipos de colagéneo
41 Estrutura das fibrilas de colagéneo cabeças da molécula de colagéneo zonas cruzadas(64nm) Tendão-100% colag. Cartilagem-colag. embebido em matriz poliosídica Osso-matriz colag. cimentada por depósitos de Ca 10 (PO 4 ) 6 (OH) 2 Colagéneo típico: 35% Gly secção da molécula de colagéneo 11% Ala 21% Pro(Hyp)
42 Estrutura das fibrilas de colagéneo cabeças da molécula de colagéneo zonas cruzadas(64nm) Tendão-100% colag. Cartilagem-colag. embebido em matriz poliosídica Osso-matriz colag. cimentada por depósitos de Ca 10 (PO 4 ) 6 (OH) 2 secção da molécula de colagéneo Cross-links invulgares entre Lys, 5-HyL ou His (X)
43 Vitaminas grupo de pequenas moléculas nutrientes essenciais para muitos organismos multicelulares (humanos em particular). vitamin = vital amine
44 Vitaminas grupo de pequenas moléculas nutrientes essenciais para muitos organismos multicelulares (humanos em particular). vitamin = vital amine Walter Norman Haworth PN 1937(Q) for his work in determining the structure of ascorbic acid Paul Karrer PN 1937(Q) for his work on Vitamins Albert Szent-Györgyi PN 1937(M) for his studies of the biological functions of L-ascorbic acid
45 20% dos mamíferos não sintetizam Vit C A China fornece 80% da Vit C mundial Dose discutível: <2g/dia? Obrigatório fumadores, grávidas, stress Panaceia universal Apenas 20% dos marinheiros de Fernão de Magalhães sobreviveram (1820) Na viagem à India de Vasco da Gama morreu 2/3 da tripulação Entre milhão de mortos com escorbuto
46
47 Vitamina C e Escorbuto Formação da hidroxiprolina A prolina é hidroxilada em C-4 por acção da prolil hidroxilase, um enzima que activa o oxigénio molecular
48 prolil 4-hidroxilase resíduo Pro α-oxoglutarato resíduo 4-Hyp succinato prolil 4-hidroxilase α-oxoglutarato ascorbato succinato ascorbato oxidado
49 A reacção é assistida por um ião Fe 2 + ligado ao enzima e que é necessário para activar o O 2. O enzima também converte α-cetoglutarato em succinato sem hidroxilar a prolina. Nesta reacção forma-se um complexo Fe 3+ - O, que inactiva o enzima. O enzima é regenerado por acção do ascorbato (vit C) que reduz o Fe 3+ a Fe 2 + sendo ele próprio oxidado a ácido desidroascórbico.
50 Consequências da não hidroxilação da prolina poli (Pro-Pro-Gly) Tm = 24ºC poli(pro-hypro-gly) Tm = 58ºC A hidroxiprolina estabiliza a hélice tripla promovendo ligações de H entre cadeias.
51 Estrutura da seda: as fibras da seda e da teia da aranha são constituídas pela proteína fibroína A fibroína consiste em camadas de folhas β antiparalelas ricas em resíduos Ala e Gly Cadeia lateral da alanina Cadeia lateral da glicina
52 Cadeias de fibroína (azul) em microscopia electrónica
53 folhas β antiparalelas Ala Gly Não extensível Flexível
54 As proteínas globulares são compactas. Incluem enzimas, proteínas de transporte, proteínas motoras, proteínas reguladoras, imunoglobulinas, etc. Conformação β Hélice α Forma globular nativa
55 Representações da estrutura terciária da mioglobina de cachalote
56 Mioglobina MM (cachalote) Cadeia única com 156 resíduos+heme Músculo Funções: Transporte e armazenamento de O2 Difusão facilitada de O 2 (contracção muscular)
57 resíduos hidrófobos Leu, Ile, Val, Phe A maior parte dos resíduos hidrófobos no interior Compacta Interior hidrófobo 4 H 2 O no interior 70% hélice α
58 4 S-S 40% hélice α algumas folhas β Lisozima PDB ID 3LYM
59 4 S-S 40% hélice α algumas folhas β MM ;129 res.; clara de ovo; lágrima humana; catalisa a hidrólise de poliósidos de algumas paredes bacterianas(agente bactericida) Lisozima PDB ID 3LYM
60 hélice α muitas folhas β 4 S-S MM ; 124 res.; produzido no pâncreas e activo no intestino delgado Ribonuclease PDB ID 3RN3
61 % aproximada de hélices α e estruturas β nalgumas proteínas globulares de cadeia única resíduos Proteína (nº resíduos) hélice α conformação β quimotripsina ribonuclease carboxipeptidase citocromo c lisozima mioglobina Comum Interacções hidrófobas no interior grupos hidrófilos no exterior muitas ligações de H algumas interacções Iónicas
62 Proteínas globulares grandes Estruturas supersecundárias (motivos)- arranjos estáveis de elementos de estruturas secundárias
63 Motivos β com ligações típicas Motivos β com ligações crossover (não observado)
64 Domínio- parte da cadeia polipeptídica que é estável independentemente da proteína total(clivagem hidrolítica). Às vezes é um segmento contínuo da sequência. Pode sofrer movimentos relativamente à totalidade da proteína. As proteínas pequenas têm um só domínio. O domínio é a proteína!
65 Troponina C (PDB ID 4TCN) Alguns domínios são suficiente/ estáveis para existirem autónomos em meio aquoso (experiências de clonagem e expressão do domínio)
66 Repressor Lac de E. coli (tetrâmero com dois domínios)
67 Domínio de α hemolisina de Staphilococcus aureus (toxina que mata células criando poros na membrana)
68 Nível quaternário
69 Hemoglobina (MM ; 2 cadeias α - 2x141 res.+ 2 cadeias β - 2x146 res.) Tetrâmero α 2 β 2 ou dímero (αβ) 2
70 Homodímero a 2 Heterodímero ab Multímeros(subunidades= protómeros) Regulação Funções mas relacionadas (catálise e regulação) Heterotetrâmero a 2 b 2 Heteropentâmero a 2 bcd
71 As proteínas multiméricas com subunidades idênticas podem ter uma simetria rotacional ou helicoidal Simetria icosaédrica (rotacional) Poliovirus:diâmetro 300 Å
72 Simetria helicoidal Subunidade proteica Virus do mosaico do tabaco: diam. 180 Å; comp Å
73 Há limite à dimensão da proteína? Maior dimensão Maior complexidade funcional Factores limitantes: 1. Capacidade codificadora do DNA É mais fácil fazer muitas cópias de um pequeno polipéptido do que uma cópia de uma grande estrutura! Ex: capside do vírus, citoesqueleto, enzimas (MM múltiplas subunidades)
74 Há limite à dimensão da proteína? Maior dimensão Maior complexidade funcional Factores limitantes: 2. Precisão do processo de tradução Frequência do erro: 1 / resíduos
75
76 Desnaturação e folding de proteínas A desnaturação de uma proteína resulta da perda da estrutura tridimensional que dá origem à perda da sua função. Agentes desnaturantes: calor, phs extremos, solventes orgânicos, detergentes.
77 A sequência de aminoácidos determina a estrutura terciária A desnaturação de algumas proteínas é reversível. (a maioria necessita de ajuda). Adição de ureia e mercaptoetanol Estado nativo, cataliticamente activo Estado desenrolado. Inactivo. Ligações S-S- reduzidas Remoção da ureia e mercaptoetanol Desnaturação e renaturação da ribonuclease Nativa, cataliticamente activa. Ligações S-Sreformuladas
78 O folding das proteínas - os polipéptidos dobram-se num processo sequencial. Via simulada de folding
79 O folding correcto das proteínas é facilitado por proteínas - chaperones moleculares Proteínas Hsp70 Chaperoninas
80 As vias de folding de algumas proteínas requerem 2 enzimas que catalisam reacções de isomerização: Isomerase dissulfito de proteínas (PDI) catalisa a troca de ligações dissulfureto até que as ligações da conformação nativa estejam formadas. Elimina intermediários com ligações S S incorrectas. Isomerase prolil cis-trans peptídico catalisa a interconversão dos isómeros cis e trans do resíduo prolina que é um passo limitante no folding de proteinas que contêm Pro. Defeitos no folding podem ser a base molecular de doenças humanas Doenças associadas a folding incorrecto de proteínas: doença de Alzheimer, Parkinson, BSE, etc
ESTRUTURA DAS PROTEÍNAS
 ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
ESTRUTURA DAS PROTEÍNAS
 ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
BIOQUÍMICA I 1º ano de Medicina Ensino teórico 2010/2011
 BIOQUÍMICA I 1º ano de Medicina Ensino teórico 2010/2011 7ª aula teórica 11 Outubro 2010 Proteínas estruturais e funcionais Organização estrutural das proteínas Estrutura e diferentes funções de proteínas
BIOQUÍMICA I 1º ano de Medicina Ensino teórico 2010/2011 7ª aula teórica 11 Outubro 2010 Proteínas estruturais e funcionais Organização estrutural das proteínas Estrutura e diferentes funções de proteínas
ESTRUTURA DAS PROTEÍNAS
 ESTRUTURA DAS PROTEÍNAS Todas essas forças são usadas para a manutenção da estrutura tridimensional das proteínas - conformação A conformação de uma proteína é fundamental para a função que ela exerce
ESTRUTURA DAS PROTEÍNAS Todas essas forças são usadas para a manutenção da estrutura tridimensional das proteínas - conformação A conformação de uma proteína é fundamental para a função que ela exerce
Estrutura tridimensional das proteínas
 Estrutura tridimensional das proteínas Uma proteína contém centenas de ligações, as quais permitem rotação livre entre os seus átomos. Proteína poderá em princípio assumir um número elevado de conformações.
Estrutura tridimensional das proteínas Uma proteína contém centenas de ligações, as quais permitem rotação livre entre os seus átomos. Proteína poderá em princípio assumir um número elevado de conformações.
BIOQUÍMICA PARA ODONTO
 BIOQUÍMICA PARA ODONTO Aula 3: Autoria: Ligação peptídica Proteínas globulares: estrutura primária, secundária e terciária Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade
BIOQUÍMICA PARA ODONTO Aula 3: Autoria: Ligação peptídica Proteínas globulares: estrutura primária, secundária e terciária Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade
Proteínas. Profa. Alana Cecília
 Proteínas Profa. Alana Cecília Proteínas Aminoácidos ligados formam uma cadeia proteica (polipeptídica). As unidades de repetição são planos de amida que contêm ligações peptídicas. Esses planos de amida
Proteínas Profa. Alana Cecília Proteínas Aminoácidos ligados formam uma cadeia proteica (polipeptídica). As unidades de repetição são planos de amida que contêm ligações peptídicas. Esses planos de amida
Rafael Mesquita. Proteínas. Estrutura
 Proteínas Estrutura Ligação peptídica Ligação peptídica - Rígida e plana - Ligação simples com caráter de dupla ligação Ângulos Φ e Ψ Ligação peptídica limitações estruturais Limitações estruturais impostas
Proteínas Estrutura Ligação peptídica Ligação peptídica - Rígida e plana - Ligação simples com caráter de dupla ligação Ângulos Φ e Ψ Ligação peptídica limitações estruturais Limitações estruturais impostas
Proteínas. Proteínas são polímeros de aminoácidos
 Proteínas Estrutura & Propriedades Proteínas são polímeros de aminoácidos Existem 20 tipos diferentes de aminoácidos Aminoácidos são ácidos fracos A carga elétrica do aminoácido varia de acordo com o ph
Proteínas Estrutura & Propriedades Proteínas são polímeros de aminoácidos Existem 20 tipos diferentes de aminoácidos Aminoácidos são ácidos fracos A carga elétrica do aminoácido varia de acordo com o ph
Proteínas. Prof.: Matheus de Souza Gomes Disciplina: Bioquímica I
 Prof.: Matheus de Souza Gomes Disciplina: Bioquímica I Patos de Minas 2017 Conteúdo Proteínas Estrutura Tridimensional de proteína Conformação Estabilidade de proteínas Ligação peptídica Estrutura Secundária
Prof.: Matheus de Souza Gomes Disciplina: Bioquímica I Patos de Minas 2017 Conteúdo Proteínas Estrutura Tridimensional de proteína Conformação Estabilidade de proteínas Ligação peptídica Estrutura Secundária
Peptídeos e Proteínas: Estrutura de Proteínas
 Peptídeos e Proteínas: Estrutura de Proteínas QFL0343 - REATIVIDADE DE COMPOSTOS ORGÂNICOS II E BIOMOLÉCULAS Adriana Uehara 9820384 Janaína Novais 9819722 Aminoácidos Estruturas carbônicas que possuem
Peptídeos e Proteínas: Estrutura de Proteínas QFL0343 - REATIVIDADE DE COMPOSTOS ORGÂNICOS II E BIOMOLÉCULAS Adriana Uehara 9820384 Janaína Novais 9819722 Aminoácidos Estruturas carbônicas que possuem
LIGAÇÕES QUÍMICAS REVISÃO
 LIGAÇÕES QUÍMICAS REVISÃO Ligações químicas e forças atrativas 1- Ligações covalentes Ligação química entre dois átomos na qual elétrons são compartilhados Ligação Forte Energia de ligação é a energia
LIGAÇÕES QUÍMICAS REVISÃO Ligações químicas e forças atrativas 1- Ligações covalentes Ligação química entre dois átomos na qual elétrons são compartilhados Ligação Forte Energia de ligação é a energia
29/08/2015 QUÍMICA DE PROTEÍNAS. Medicina Veterinária IBGM - IBS. Medicina Veterinária IBGM - IBS
 QUÍMICA DE PROTEÍNAS D i s c i p l i n a : b i o q u í m i c a, p r o f. D r. Va g n e O l i v e i ra E-mail: vagne_melo_oliveira@outlook.com Medicina Veterinária IBGM - IBS Medicina Veterinária IBGM -
QUÍMICA DE PROTEÍNAS D i s c i p l i n a : b i o q u í m i c a, p r o f. D r. Va g n e O l i v e i ra E-mail: vagne_melo_oliveira@outlook.com Medicina Veterinária IBGM - IBS Medicina Veterinária IBGM -
Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III
 Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III A maioria das cadeias polipeptídicas naturais contém entre 50 e 2.000 aminoácidos e são comumente referidas como proteínas. Peptídeos
Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III A maioria das cadeias polipeptídicas naturais contém entre 50 e 2.000 aminoácidos e são comumente referidas como proteínas. Peptídeos
Estrutura Secundária
 Bioinformática I Estrutura Secundária Profa. Dra. Ignez Caracelli bit.603@gmail.com Julio Zukerman Schpector 1 Ignez Caracelli aminoácido em sua forma ionizada forma zwitteriônica cadeia lateral amino-terminal
Bioinformática I Estrutura Secundária Profa. Dra. Ignez Caracelli bit.603@gmail.com Julio Zukerman Schpector 1 Ignez Caracelli aminoácido em sua forma ionizada forma zwitteriônica cadeia lateral amino-terminal
Universidade de São Paulo QFL0343: Reações de Compostos Orgânicos II e Biomoléculas Grupo 2: Peptídeos e Proteínas - Estrutura de Proteínas
 Universidade de São Paulo QFL0343: Reações de Compostos Orgânicos II e Biomoléculas - 2016 Grupo 2: Peptídeos e Proteínas - Estrutura de Proteínas Alex Monteiro Magalhães (8020779) Karina Brandt (8566483)
Universidade de São Paulo QFL0343: Reações de Compostos Orgânicos II e Biomoléculas - 2016 Grupo 2: Peptídeos e Proteínas - Estrutura de Proteínas Alex Monteiro Magalhães (8020779) Karina Brandt (8566483)
8ª aula teórica Proteínas estruturais: colagénio, queratina e elastina. Bibliografia
 BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina 8ª aula teórica Proteínas estruturais: colagénio, queratina e elastina 12-10-2010 Bibliografia Biochemistry with clinical correlations,
BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina 8ª aula teórica Proteínas estruturais: colagénio, queratina e elastina 12-10-2010 Bibliografia Biochemistry with clinical correlations,
O QUE É UMA PROTEÍNA?
 PROTEÍNAS O QUE É UMA PROTEÍNA? Macromoléculas que agem em processos biológicos como: Mediação por catálise proteica, transporte de outras moléculas, controle de condições intra/extra celulares e transporte
PROTEÍNAS O QUE É UMA PROTEÍNA? Macromoléculas que agem em processos biológicos como: Mediação por catálise proteica, transporte de outras moléculas, controle de condições intra/extra celulares e transporte
LIGAÇÃO PEPTÍDICA. ligação peptídica DIPEPTÍDEO AMINOÁCIDOS
 PROTEÍNAS PROTEÍNAS LIGAÇÃO PEPTÍDICA DIPEPTÍDEO AMINOÁCIDOS ligação peptídica PEPTÍDEO Resíduo N-terminal Resíduo C-terminal OLIGOPEPTÍDEOS: 2 a 10 resíduos de aminoácidos. Exemplos: dipeptídio (2 aminoácidos),
PROTEÍNAS PROTEÍNAS LIGAÇÃO PEPTÍDICA DIPEPTÍDEO AMINOÁCIDOS ligação peptídica PEPTÍDEO Resíduo N-terminal Resíduo C-terminal OLIGOPEPTÍDEOS: 2 a 10 resíduos de aminoácidos. Exemplos: dipeptídio (2 aminoácidos),
Proteínas são organizadas em níveis. Na aula passada... Cadeia polipetídica na conformação estendida
 Na aula passada... Proteínas são organizadas em níveis Proteínas adotam forma tridimensional característica sua forma nativa Uma cadeia polipetídica com uma certa sequência de aminoácidos sempre se dobra
Na aula passada... Proteínas são organizadas em níveis Proteínas adotam forma tridimensional característica sua forma nativa Uma cadeia polipetídica com uma certa sequência de aminoácidos sempre se dobra
PROTEÍNAS. Um polipeptídeo de dimensão macromolecular ou um conjunto de polipeptídeos associados entre si constituem proteínas.
 PROTEÍNAS PROTEÍNAS DEFINIÇÃO Compostos nitrogenados orgânicos complexos, presentes em todas as células vivas, formados fundamentalmente por C, H, O e N. Contêm ainda S, P, Cu, etc.. Os compostos nitrogenados
PROTEÍNAS PROTEÍNAS DEFINIÇÃO Compostos nitrogenados orgânicos complexos, presentes em todas as células vivas, formados fundamentalmente por C, H, O e N. Contêm ainda S, P, Cu, etc.. Os compostos nitrogenados
PROTEÍNAS PROTEÍNAS PROTEÍNAS FUNÇÃO BIOLÓGICA DAS PROTEÍNAS FUNÇÃO BIOLÓGICA DAS PROTEÍNAS 06/04/15
 Macromoléculas mais abundantes do organismo - 50% do peso seco celular Constituídas de L-aa, de número, composição e seqüência variada Citocromo C humano -104 resíduos de aa Apolipoproteína B - 4536 resíduos
Macromoléculas mais abundantes do organismo - 50% do peso seco celular Constituídas de L-aa, de número, composição e seqüência variada Citocromo C humano -104 resíduos de aa Apolipoproteína B - 4536 resíduos
Aminoácidos peptídeos e proteínas
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Aminoácidos peptídeos e proteínas Prof. Macks Wendhell Gonçalves, Msc mackswendhell@gmail.com Algumas funções de proteínas A luz produzida
Pontifícia Universidade Católica de Goiás Departamento de Biologia Aminoácidos peptídeos e proteínas Prof. Macks Wendhell Gonçalves, Msc mackswendhell@gmail.com Algumas funções de proteínas A luz produzida
ESTRUTURA DAS PROTEÍNAS
 ESTRUTURA DAS PROTEÍNAS Aminoácidos ligam-se por ligações peptídicas = reação de condensação entre: OH do grupo carboxila de um aminoácido H do grupo amina do outro aminoácido ( liberação de uma molécula
ESTRUTURA DAS PROTEÍNAS Aminoácidos ligam-se por ligações peptídicas = reação de condensação entre: OH do grupo carboxila de um aminoácido H do grupo amina do outro aminoácido ( liberação de uma molécula
Aula 5 30/09/13 Sumário
 Aula 5 30/09/13 Sumário Proteínas Níveis de organização estrutural Estrutura primária Estrutura secundária Hélice, folha, voltas ou loops, random coil Estrutura terciária Motivos, Domínios Estrutura quaternária
Aula 5 30/09/13 Sumário Proteínas Níveis de organização estrutural Estrutura primária Estrutura secundária Hélice, folha, voltas ou loops, random coil Estrutura terciária Motivos, Domínios Estrutura quaternária
Profº Lásaro Henrique
 Profº Lásaro Henrique Proteínas são macromoléculas complexas, compostas de aminoácidos. São os constituintes básicos da vida e necessárias para os processos químicos que ocorrem nos organismos vivos. Nos
Profº Lásaro Henrique Proteínas são macromoléculas complexas, compostas de aminoácidos. São os constituintes básicos da vida e necessárias para os processos químicos que ocorrem nos organismos vivos. Nos
AMINOÁCIDOS E PROTEÍNAS: ESTRUTURA E FUNÇÕES
 Universidade Estadual Paulista Júlio de Mesquita Filho Faculdade de Odontologia de Araçatuba Departamento de Ciências Básicas AMINOÁCIDOS E PROTEÍNAS: ESTRUTURA E FUNÇÕES Professora Marcelle Danelon Tópicos
Universidade Estadual Paulista Júlio de Mesquita Filho Faculdade de Odontologia de Araçatuba Departamento de Ciências Básicas AMINOÁCIDOS E PROTEÍNAS: ESTRUTURA E FUNÇÕES Professora Marcelle Danelon Tópicos
Estruturas β. Cadeias β anti-paralelas φ = -139, ψ= Cadeias β paralelas φ = -119, ψ= +113
 Estruturas β A estrutura em folhaβconstitui 20-28% da estrutura secundária das protéinas globulares conhecidas. A conformação extendida da cadeia polipeptídica foi proposta nos anos 30, mas só observada
Estruturas β A estrutura em folhaβconstitui 20-28% da estrutura secundária das protéinas globulares conhecidas. A conformação extendida da cadeia polipeptídica foi proposta nos anos 30, mas só observada
Profª Eleonora Slide de aula
 Proteínas Profª Eleonora Slide de aula Estruturas conformacionais Proteínas São resultantes das forças de ligação entre os diferentes segmentos da cadeia polipeptídica e freqüentemente envolvem grupamentos
Proteínas Profª Eleonora Slide de aula Estruturas conformacionais Proteínas São resultantes das forças de ligação entre os diferentes segmentos da cadeia polipeptídica e freqüentemente envolvem grupamentos
Proteínas FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS
 FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Proteínas Disciplina: Bioquímica I Prof. Me. Cássio Resende de Morais Peptídeos São cadeias de aminoácidos; São percursores
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Proteínas Disciplina: Bioquímica I Prof. Me. Cássio Resende de Morais Peptídeos São cadeias de aminoácidos; São percursores
Lista de Exercícios Aminoácidos e Proteínas
 Universidade do Estado de Santa Catarina Centro de Ciências Tecnológicas CCT Departamento de Química BIO0001 - Bioquímica Lista de Exercícios Aminoácidos e Proteínas 1) Uma solução de 100 ml de glicina
Universidade do Estado de Santa Catarina Centro de Ciências Tecnológicas CCT Departamento de Química BIO0001 - Bioquímica Lista de Exercícios Aminoácidos e Proteínas 1) Uma solução de 100 ml de glicina
UNIFESO Engenharia Ambiental Prof.: Edson R. Fernandes dos Santos Aminoácidos
 UNIFESO Engenharia Ambiental Prof.: Edson R. Fernandes dos Santos Aminoácidos Clique para editar o estilo do subtítulo mestre α-aminoácidos Variações possíveis Estrutura básica Amina Ácido Carboxílico
UNIFESO Engenharia Ambiental Prof.: Edson R. Fernandes dos Santos Aminoácidos Clique para editar o estilo do subtítulo mestre α-aminoácidos Variações possíveis Estrutura básica Amina Ácido Carboxílico
Aula 2: Estrutura e Função de Proteínas
 Disciplina de Mét. Purif. e Anál. Proteínas Curso de Ciências Biológicas Aula 2: Estrutura e Função de Proteínas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e
Disciplina de Mét. Purif. e Anál. Proteínas Curso de Ciências Biológicas Aula 2: Estrutura e Função de Proteínas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e
Proteínas São macromoléculas complexas, compostas de aminoácidos, e necessárias para os processos químicos que ocorrem nos organismos vivos
 Proteínas São macromoléculas complexas, compostas de aminoácidos, e necessárias para os processos químicos que ocorrem nos organismos vivos São os constituintes básicos da vida: tanto que seu nome deriva
Proteínas São macromoléculas complexas, compostas de aminoácidos, e necessárias para os processos químicos que ocorrem nos organismos vivos São os constituintes básicos da vida: tanto que seu nome deriva
Biologia Molecular (Parte I)
 Biologia Molecular (Parte I) Introdução 1. Substâncias Inorgânicas 1.1. Água A água faz pontes de hidrogênio Polaridade Propriedades da água Solvente Universal Participa de reações químicas vitais Adesão
Biologia Molecular (Parte I) Introdução 1. Substâncias Inorgânicas 1.1. Água A água faz pontes de hidrogênio Polaridade Propriedades da água Solvente Universal Participa de reações químicas vitais Adesão
FFI0750 Biologia Molecular Estrutural
 Objetivos FFI0750 Biologia Molecular Estrutural Prof. Rafael V. C. Guido rvcguido@ifsc.usp.br Estrutura de proteínas Estrutura primária Estrutura secundária Estrutura terciária Estrutura quaternária Aula
Objetivos FFI0750 Biologia Molecular Estrutural Prof. Rafael V. C. Guido rvcguido@ifsc.usp.br Estrutura de proteínas Estrutura primária Estrutura secundária Estrutura terciária Estrutura quaternária Aula
Graduação em Biotecnologia Disciplina de Proteômica. Caroline Rizzi Doutoranda em Biotecnologia -UFPel
 Graduação em Biotecnologia Disciplina de Proteômica Caroline Rizzi Doutoranda em Biotecnologia -UFPel Ligação peptídica Aminoácido 1 Aminoácido 2 um dipeptídeo A ligação peptídica é uma amida. O -C NH
Graduação em Biotecnologia Disciplina de Proteômica Caroline Rizzi Doutoranda em Biotecnologia -UFPel Ligação peptídica Aminoácido 1 Aminoácido 2 um dipeptídeo A ligação peptídica é uma amida. O -C NH
Você deve desenhar o aminoácido com o grupo amino protonado (pka > 7) e o grupo carboxílico desprotonado (pka <7).
 QBQ4010 Introdução à Bioquímica Exercícios sobre sistema tampão, aminoácidos e estrutura de proteínas 1. Você estagiário de um laboratório bioquímica, recebeu a função de preparar uma solução tamponada
QBQ4010 Introdução à Bioquímica Exercícios sobre sistema tampão, aminoácidos e estrutura de proteínas 1. Você estagiário de um laboratório bioquímica, recebeu a função de preparar uma solução tamponada
Aula 5 Estrutura e função de proteínas
 Aula 5 Estrutura e função de proteínas parte 1: aminoácidos Parte 2: estrutura Proteínas As proteínas são os principais constituinte da célula Importantes na manutenção da vida Desempenham diversas funções
Aula 5 Estrutura e função de proteínas parte 1: aminoácidos Parte 2: estrutura Proteínas As proteínas são os principais constituinte da célula Importantes na manutenção da vida Desempenham diversas funções
Bioinformática Estrutural Aula 1
 Bioinformática Estrutural Aula 1 03 de Junho de 2013 Paula Kuser-Falcão Laboratório de Bioinformática Aplicada Embrapa Informática Agropecuária Paula.kuser-falcao@embrapa.br Pratique Atividade Física Paula
Bioinformática Estrutural Aula 1 03 de Junho de 2013 Paula Kuser-Falcão Laboratório de Bioinformática Aplicada Embrapa Informática Agropecuária Paula.kuser-falcao@embrapa.br Pratique Atividade Física Paula
Componentes Químicos das Células
 Componentes Químicos das Células Os seres vivos são um sistema Fundamentam-se em: químico! compostos de carbono, ou seja, na química orgânica. Dependem de reações químicas que ocorrem em soluções aquosas,
Componentes Químicos das Células Os seres vivos são um sistema Fundamentam-se em: químico! compostos de carbono, ou seja, na química orgânica. Dependem de reações químicas que ocorrem em soluções aquosas,
NÓS SOMOS AS NOSSAS PROTEÍNAS
 PROTEÍNAS As proteínas são biomoléculas formadas essencialmente por carbono, hidrogénio, oxigénio e azoto. Podem também ter enxofre, fósforo, ferro ou cobre. 1 Constituintes principais da maioria das células
PROTEÍNAS As proteínas são biomoléculas formadas essencialmente por carbono, hidrogénio, oxigénio e azoto. Podem também ter enxofre, fósforo, ferro ou cobre. 1 Constituintes principais da maioria das células
Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP. Prof. Marcos Túlio Oliveira Depto. Tecnologia
 Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Prof. Marcos Túlio Oliveira Depto. Tecnologia Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Green Fluorescent Protein (GFP) Engenharia
Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Prof. Marcos Túlio Oliveira Depto. Tecnologia Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Green Fluorescent Protein (GFP) Engenharia
Aula 1. Referência. Bancos de Dados. Linguagem x Informação. Introdução a Bioquímica: Biomoléculas. Introdução ao Curso: Aminoácidos.
 Introdução a Bioquímica: Biomoléculas Aula 1 Introdução ao urso: Aminoácidos eferência Autores: Ignez aracelli e Julio Zukerman-Schpector Editora: EdUFSar Ignez aracelli BioMat DF UNESP/Bauru Julio Zukerman
Introdução a Bioquímica: Biomoléculas Aula 1 Introdução ao urso: Aminoácidos eferência Autores: Ignez aracelli e Julio Zukerman-Schpector Editora: EdUFSar Ignez aracelli BioMat DF UNESP/Bauru Julio Zukerman
Composição e Estrutura Molecular dos Sistemas Biológicos
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Prof. Hugo Henrique Pádua M.Sc. Fundamentos de Biofísica Composição e Estrutura Molecular dos Sistemas Biológicos Átomos e Moléculas Hierarquia
Pontifícia Universidade Católica de Goiás Departamento de Biologia Prof. Hugo Henrique Pádua M.Sc. Fundamentos de Biofísica Composição e Estrutura Molecular dos Sistemas Biológicos Átomos e Moléculas Hierarquia
Aminoácidos, Péptidos e Proteínas
 Aminoácidos, Péptidos e Proteínas Proteínas: -São as macromoléculas biológicas mais abundantes, presentes em todas as células. - Ocorrem numa variedade enorme numa mesma célula. - Exibem uma enorme diversidade
Aminoácidos, Péptidos e Proteínas Proteínas: -São as macromoléculas biológicas mais abundantes, presentes em todas as células. - Ocorrem numa variedade enorme numa mesma célula. - Exibem uma enorme diversidade
Faculdade Anhanguera Curso de Graduação em Educação Física
 Faculdade Anhanguera Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Mês de agosto Conteúdo 9 Unidade 1 16 Unidade 1 23 Unidade 1 30
Faculdade Anhanguera Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Mês de agosto Conteúdo 9 Unidade 1 16 Unidade 1 23 Unidade 1 30
BIOENGENHARIA I UFPB CT DEQ Prof. Sharline Florentino de Melo Santos
 BIOENGENHARIA I UFPB CT DEQ Prof. Sharline Florentino de Melo Santos As proteínas são compostos orgânicos de alto peso molecular formadas pelo encadeamento de aminoácidos. Representam cerca do 50 a 80%
BIOENGENHARIA I UFPB CT DEQ Prof. Sharline Florentino de Melo Santos As proteínas são compostos orgânicos de alto peso molecular formadas pelo encadeamento de aminoácidos. Representam cerca do 50 a 80%
PROTEÍNA Deriva do grego proteios (da primeira classe) Berzellius (1838).
 PROTEÍNAS PROTEÍNA Deriva do grego proteios (da primeira classe) Berzellius (1838). As proteínas desempenham um papel fundamental em todos os processos biológicos. São as macromoléculas mais comuns do
PROTEÍNAS PROTEÍNA Deriva do grego proteios (da primeira classe) Berzellius (1838). As proteínas desempenham um papel fundamental em todos os processos biológicos. São as macromoléculas mais comuns do
Origem grego (protos) primeira, mais importante
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
Proteínas: propriedades conformacionais
 Proteínas: propriedades conformacionais Energia Estado nativo Conformações O elevado número de graus de liberdade da cadeia polipeptídica resulta num igualmente grande número de conformações possíveis.
Proteínas: propriedades conformacionais Energia Estado nativo Conformações O elevado número de graus de liberdade da cadeia polipeptídica resulta num igualmente grande número de conformações possíveis.
PROTEÍNAS AMINOÁCIDOS AMINOÁCIDOS ESTRUTURA DE AMINOÁCIDOS E PROTEÍNAS 31/03/2018
 As proteínas são macromoléculas orgânicas de alto peso molecular constituídas por unidades ou monômeros denominados aminoácidos. A A A A A A Polipeptídeo Aminoácido Ligação Peptídica ESTRUTURA DE E LIVRO
As proteínas são macromoléculas orgânicas de alto peso molecular constituídas por unidades ou monômeros denominados aminoácidos. A A A A A A Polipeptídeo Aminoácido Ligação Peptídica ESTRUTURA DE E LIVRO
Introdução. Estrutura dos Aminoácidos e Proteínas. Aminoácidos componentes de proteínas. Aminoácidos componentes de proteínas 10/02/2012.
 Introdução Estrutura dos Aminoácidos e Prof. Dr. Bruno Lazzari de Lima : Componentes celulares mais importantes. Diversidade de forma e função. Estruturais. Enzimáticas. Transportadoras. Ex.: Insulina,
Introdução Estrutura dos Aminoácidos e Prof. Dr. Bruno Lazzari de Lima : Componentes celulares mais importantes. Diversidade de forma e função. Estruturais. Enzimáticas. Transportadoras. Ex.: Insulina,
BÁSICA EM IMAGENS. Aminoácidos, peptídeos e proteínas
 Universidade Federal de Pelotas Instituto de Química e Geociências Departamento de Bioquímica 04 BÁSICA EM IMAGENS - um guia para a sala de aula Aminoácidos, peptídeos e proteínas Hierarquia estrutural
Universidade Federal de Pelotas Instituto de Química e Geociências Departamento de Bioquímica 04 BÁSICA EM IMAGENS - um guia para a sala de aula Aminoácidos, peptídeos e proteínas Hierarquia estrutural
Disciplina de Proteômica. Caroline Rizzi Doutoranda em Biotecnologia -UFPel
 Disciplina de Proteômica Caroline Rizzi Doutoranda em Biotecnologia -UFPel Ligação peptídica Aminoácido 1 Aminoácido 2 um dipeptídeo A ligação peptídica é uma amida. O -C NH 2 Não são reações espontâneas
Disciplina de Proteômica Caroline Rizzi Doutoranda em Biotecnologia -UFPel Ligação peptídica Aminoácido 1 Aminoácido 2 um dipeptídeo A ligação peptídica é uma amida. O -C NH 2 Não são reações espontâneas
Proteínas - I. (Estrutura) Bioquímica Prof. Dr. Marcelo Soares
 Proteínas - I (Estrutura) Proteínas São polímeros compostos por combinações entre os 20 aminoácidos-padrão Apresentam tamanho que vai desde 50 até 4000 aminoácidos, variando também nas proporções entre
Proteínas - I (Estrutura) Proteínas São polímeros compostos por combinações entre os 20 aminoácidos-padrão Apresentam tamanho que vai desde 50 até 4000 aminoácidos, variando também nas proporções entre
CURSO: ENFERMAGEM DISCIPLINA: BIOQUÍMICA HUMANA PROF. WILLAME BEZERRA. Aminoácidos. Prof. Willame Bezerra
 CURSO: ENFERMAGEM DISCIPLINA: BIOQUÍMICA HUMANA PROF. WILLAME BEZERRA Aminoácidos Prof. Willame Bezerra As proteínas são as biomoléculas mais abundantes nos seres vivos e exercem funções fundamentais em
CURSO: ENFERMAGEM DISCIPLINA: BIOQUÍMICA HUMANA PROF. WILLAME BEZERRA Aminoácidos Prof. Willame Bezerra As proteínas são as biomoléculas mais abundantes nos seres vivos e exercem funções fundamentais em
Proteínas fibrosas e globulares ESTRUTURAS FUNÇÕES
 Proteínas fibrosas e globulares ESTRUTURAS FUNÇÕES 2 OBJETIVOS DA AULA PROTEÍNAS FIBROSAS Conhecer a classificação das proteínas quanto à forma Estudar a estrutura das queratinas, bem como suas funções
Proteínas fibrosas e globulares ESTRUTURAS FUNÇÕES 2 OBJETIVOS DA AULA PROTEÍNAS FIBROSAS Conhecer a classificação das proteínas quanto à forma Estudar a estrutura das queratinas, bem como suas funções
Aminoácidos e proteínas
 Aminoácidos e proteínas Visão geral 2 https://www.youtube.com/watch?v=qbrfimcxznm Importância dessa aula Serina Fosfoserina Treonina Fosfotreonina Fosforilação de resíduos de aa modifica a atividade enzimática
Aminoácidos e proteínas Visão geral 2 https://www.youtube.com/watch?v=qbrfimcxznm Importância dessa aula Serina Fosfoserina Treonina Fosfotreonina Fosforilação de resíduos de aa modifica a atividade enzimática
Proteínas. - Revisão - Prof a. Dr a. Elisa d Avila Costa Cavalcanti. Bromatologia EN/UNIRIO
 Proteínas - Revisão - Prof a. Dr a. Elisa d Avila Costa Cavalcanti Bromatologia EN/UNIRIO 2018.2 O que são proteínas? Aminoácidos α 21 tipos Grupos R Tendência de interagir com a água em ph intracelular
Proteínas - Revisão - Prof a. Dr a. Elisa d Avila Costa Cavalcanti Bromatologia EN/UNIRIO 2018.2 O que são proteínas? Aminoácidos α 21 tipos Grupos R Tendência de interagir com a água em ph intracelular
13/08/2018. Escala de ph. Escala de ph. Crescimento básico. Crescimento ácido. Neutro. básico
 Escala de ph Crescimento básico Neutro Crescimento ácido Escala de ph básico 1 Sistema tampão Um par conjugado ácido-base tende a resistir a alteração de ph, quando pequenas quantidades de ácido ou base
Escala de ph Crescimento básico Neutro Crescimento ácido Escala de ph básico 1 Sistema tampão Um par conjugado ácido-base tende a resistir a alteração de ph, quando pequenas quantidades de ácido ou base
Macromolécula mais abundante nas células
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
Estrutura. Estrutura 29/10/2010. Visão Geral Existem 4 níveis de estrutura de proteínas:
 Definições importantes: - Por serem conceitos didáticos, frequentemente é difícil distinguir em uma proteína os níveis secundário e terciário de organização estrutural. - Para evitar tais ambiguidades
Definições importantes: - Por serem conceitos didáticos, frequentemente é difícil distinguir em uma proteína os níveis secundário e terciário de organização estrutural. - Para evitar tais ambiguidades
Estrutura tridimensional de proteínas. Prof. Dr. Fernando Berton Zanchi
 Estrutura tridimensional de proteínas Prof. Dr. Fernando Berton Zanchi Níveis de Estruturas Protéicas A conformação espacial das proteínas As proteínas não são traços rígidos porque suas ligações químicas
Estrutura tridimensional de proteínas Prof. Dr. Fernando Berton Zanchi Níveis de Estruturas Protéicas A conformação espacial das proteínas As proteínas não são traços rígidos porque suas ligações químicas
Aminoácidos e Proteínas
 Aminoácidos e Proteínas PROTEÍNAS As proteínas são as macromoléculas mais abundantes nas células vivas. Ocorrem em todas as células e em todas as partes das mesmas. FUNÇÕES DAS PROTEÍNAS Formam estruturas
Aminoácidos e Proteínas PROTEÍNAS As proteínas são as macromoléculas mais abundantes nas células vivas. Ocorrem em todas as células e em todas as partes das mesmas. FUNÇÕES DAS PROTEÍNAS Formam estruturas
As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos
 Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
REVISÃO: ENADE BIOQUÍMICA - 1
 FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS REVISÃO: ENADE BIOQUÍMICA - 1 Prof. Me. Cássio Resende de Morais Propriedades da Água Introdução Substância líquida,
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS REVISÃO: ENADE BIOQUÍMICA - 1 Prof. Me. Cássio Resende de Morais Propriedades da Água Introdução Substância líquida,
Interacções em moléculas biológicas
 Interacções em moléculas biológicas Interacções intramoleculares Ligações covalentes (manutenção da estrutura covalente das moléculas Interacções não-covalentes (conformções, folding, estrutura secundária)
Interacções em moléculas biológicas Interacções intramoleculares Ligações covalentes (manutenção da estrutura covalente das moléculas Interacções não-covalentes (conformções, folding, estrutura secundária)
Constituintes básicos de uma célula - Biomoléculas. Biomoléculas
 Biomoléculas Todas as moléculas que fazem parte da constituição dos seres vivos são designadas biomoléculas. Formam-se a partir da união de bioelementos. Biomoléculas Os bioelementos combinam-se entre
Biomoléculas Todas as moléculas que fazem parte da constituição dos seres vivos são designadas biomoléculas. Formam-se a partir da união de bioelementos. Biomoléculas Os bioelementos combinam-se entre
São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas.
 São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas. Proteínas possuem muitas funções dentro do organismo. Aminoácidos
São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas. Proteínas possuem muitas funções dentro do organismo. Aminoácidos
Aminoácidos (aas) Prof.ª: Suziane Antes Jacobs
 Aminoácidos (aas) Prof.ª: Suziane Antes Jacobs Introdução Pequenas moléculas propriedades únicas Unidades estruturais (UB) das proteínas N- essencial para a manutenção da vida; 20 aminoácidos-padrão -
Aminoácidos (aas) Prof.ª: Suziane Antes Jacobs Introdução Pequenas moléculas propriedades únicas Unidades estruturais (UB) das proteínas N- essencial para a manutenção da vida; 20 aminoácidos-padrão -
Estrutura Geral dos α-aminoácidos.
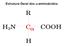 Estrutura Geral dos α-aminoácidos. Os aminoácidos podem ser classificados pelos seus grupos R POLARES APOLARES Peptídios Os peptídios são polímeros de aminoácidos. Duas moléculas de aminoácidos podem
Estrutura Geral dos α-aminoácidos. Os aminoácidos podem ser classificados pelos seus grupos R POLARES APOLARES Peptídios Os peptídios são polímeros de aminoácidos. Duas moléculas de aminoácidos podem
Dos genes às proteínas
 Dos genes às proteínas - Estrutura e função Bioinformática aula 1 INTRODUÇÃO O Dogma Central O fluxo de informação nos organismos segue uma direção única: do DNA para o RNA, e do RNA para a proteína DNA
Dos genes às proteínas - Estrutura e função Bioinformática aula 1 INTRODUÇÃO O Dogma Central O fluxo de informação nos organismos segue uma direção única: do DNA para o RNA, e do RNA para a proteína DNA
ESTRUTURAS TRIDIMENSIONAIS E FUNÇÕES BIOLÓGICAS DAS PROTEÍNAS GLOBULARES
 ESTRUTURAS TRIDIMENSIONAIS E FUNÇÕES BIOLÓGICAS DAS PROTEÍNAS GLOBULARES Aula 6 META Identificar as estruturas tridimensionais das proteínas globulares, relacionando-as com as funções biológicas que essas
ESTRUTURAS TRIDIMENSIONAIS E FUNÇÕES BIOLÓGICAS DAS PROTEÍNAS GLOBULARES Aula 6 META Identificar as estruturas tridimensionais das proteínas globulares, relacionando-as com as funções biológicas que essas
Universidade Salgado de Oliveira Disciplina de Bioquímica Básica Proteínas
 Universidade Salgado de Oliveira Disciplina de Bioquímica Básica Proteínas Profª Larissa dos Santos Introdução As proteínas (ou também conhecidas como polipeptídeos) são as macromoléculas mais abundantes
Universidade Salgado de Oliveira Disciplina de Bioquímica Básica Proteínas Profª Larissa dos Santos Introdução As proteínas (ou também conhecidas como polipeptídeos) são as macromoléculas mais abundantes
Todos os seres vivos são constituídos por células unidade estrutural.
 Prof. Ana Rita Rainho Biomoléculas Todos os seres vivos são constituídos por células unidade estrutural. Para além da unidade estrutural também existe uma unidade bioquímica todos os seres vivos são constituídos
Prof. Ana Rita Rainho Biomoléculas Todos os seres vivos são constituídos por células unidade estrutural. Para além da unidade estrutural também existe uma unidade bioquímica todos os seres vivos são constituídos
A estrutura tridimensional das proteínas
 A estrutura tridimensional das proteínas O esqueleto covalente das proteínas possui um elevado número de ligações em torno das quais é possível rotação, resultando num enorme número de conformações moleculares.
A estrutura tridimensional das proteínas O esqueleto covalente das proteínas possui um elevado número de ligações em torno das quais é possível rotação, resultando num enorme número de conformações moleculares.
Aula de Bioquímica I. Tema: Proteínas. Prof. Dr. Júlio César Borges
 Aula de Bioquímica I Tema: Proteínas Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica I Tema: Proteínas Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
AMINOÁCIDOS. - Os aminoácidos são os elementos constituintes de peptídeos, proteínas; - Precursores de hormônios, neurotransmissores, nucleotídeos;
 1 AMINOÁCIDOS - Os aminoácidos são os elementos constituintes de peptídeos, proteínas; - Precursores de hormônios, neurotransmissores, nucleotídeos; - Ocorrem em grande variedade, sendo descritos cerca
1 AMINOÁCIDOS - Os aminoácidos são os elementos constituintes de peptídeos, proteínas; - Precursores de hormônios, neurotransmissores, nucleotídeos; - Ocorrem em grande variedade, sendo descritos cerca
Aminoácidos AMINOÁCIDOS, PEPTÍDEOS E PROTEÍNAS. Universidade Federal de Mato Grosso Disciplina de Bioquímica H2N C COOH
 1 2 Universidade Federal de Mato Grosso Disciplina de Bioquímica AMINOÁCIDOS, PEPTÍDEOS E PROTEÍNAS Vagalume (fireflies) Prof. Ms. Reginaldo Vicente Ribeiro Eritrócitos Luciferina Rinoceronte Queratina
1 2 Universidade Federal de Mato Grosso Disciplina de Bioquímica AMINOÁCIDOS, PEPTÍDEOS E PROTEÍNAS Vagalume (fireflies) Prof. Ms. Reginaldo Vicente Ribeiro Eritrócitos Luciferina Rinoceronte Queratina
Soluções para Conjunto de Problemas 1
 Soluções para 7.012 Conjunto de Problemas 1 Pergunta 1 a) Quais são os quatro principais tipos de moléculas biológicas discutidas na palestra? Cite uma função importante para cada tipo de molécula biológica
Soluções para 7.012 Conjunto de Problemas 1 Pergunta 1 a) Quais são os quatro principais tipos de moléculas biológicas discutidas na palestra? Cite uma função importante para cada tipo de molécula biológica
BIOQUÍMICA. Profº André Montillo
 BIOQUÍMICA Profº André Montillo www.montillo.com.br Definição: É uma Molécula Orgânica que contém simultaneamente grupo funcionais amina (NH2) e carboxílico (COOH) É formado pelos seguintes Átomos: o Carbono
BIOQUÍMICA Profº André Montillo www.montillo.com.br Definição: É uma Molécula Orgânica que contém simultaneamente grupo funcionais amina (NH2) e carboxílico (COOH) É formado pelos seguintes Átomos: o Carbono
PROTEÍNAS. A palavra proteína derivada de proteos, (grego = primeira ou a mais importante)
 PROTEÍNAS A palavra proteína derivada de proteos, (grego = primeira ou a mais importante) Macromolécula mais abundante nas células Produto final da informação genética (DNA-RNA-Proteína) Diversidade funcional
PROTEÍNAS A palavra proteína derivada de proteos, (grego = primeira ou a mais importante) Macromolécula mais abundante nas células Produto final da informação genética (DNA-RNA-Proteína) Diversidade funcional
Lista de Exercícios de Bioquímica
 Universidade Federal de Santa Catarina - UFSC Departamento de Bioquímica - CCB Disciplina: BQA5125 - Bioquímica para Engenharia Sanitária e Ambiental Bolsistas REUNI: Priscila G. A. Martins e Tiago Bortolotto
Universidade Federal de Santa Catarina - UFSC Departamento de Bioquímica - CCB Disciplina: BQA5125 - Bioquímica para Engenharia Sanitária e Ambiental Bolsistas REUNI: Priscila G. A. Martins e Tiago Bortolotto
ESCOLA TÉCNICA ESTADUAL FREDERICO GUILHERME SCHMIDT Escola Técnica Industrial. Disciplina de Biologia Primeiro Ano Curso Técnico de Eletromecânica
 ESCOLA TÉCNICA ESTADUAL FREDERICO GUILHERME SCHMIDT Escola Técnica Industrial Disciplina de Biologia Primeiro Ano Curso Técnico de Eletromecânica Prof. Diogo Schott diogo.schott@yahoo.com Substâncias orgânicas
ESCOLA TÉCNICA ESTADUAL FREDERICO GUILHERME SCHMIDT Escola Técnica Industrial Disciplina de Biologia Primeiro Ano Curso Técnico de Eletromecânica Prof. Diogo Schott diogo.schott@yahoo.com Substâncias orgânicas
Aminas. Dependendo do número de grupos orgânicos ligados ao nitrogênio
 Aminas São derivados orgânicos da amônia, NH 3, no qual um ou mais hidrogênios foram substituidos por grupos alquilas ou aromáticos, dando RNH 2, R 2 NH e R 3 N. Amina primária: R-NH 2 Amina secundária:
Aminas São derivados orgânicos da amônia, NH 3, no qual um ou mais hidrogênios foram substituidos por grupos alquilas ou aromáticos, dando RNH 2, R 2 NH e R 3 N. Amina primária: R-NH 2 Amina secundária:
Rafael Mesquita. Proteínas. Enovelamento, Desnaturação e Função
 Proteínas Enovelamento, Desnaturação e Função Ligação peptídica limitações estruturais Limitações estruturais impostas pelas ligações peptídicas Impedimento estérico Radical limitações estruturais Limitações
Proteínas Enovelamento, Desnaturação e Função Ligação peptídica limitações estruturais Limitações estruturais impostas pelas ligações peptídicas Impedimento estérico Radical limitações estruturais Limitações
- Apresentam uma fórmula básica: um átomo central de carbono onde se ligam:
 1 4 Aminoácidos e proteínas a) Aminoácidos - São encontrados polimerizados formando proteínas ou livres - São degradados, originando moléculas intermediárias da síntese de glicose e lipídeos - Alguns são
1 4 Aminoácidos e proteínas a) Aminoácidos - São encontrados polimerizados formando proteínas ou livres - São degradados, originando moléculas intermediárias da síntese de glicose e lipídeos - Alguns são
Aminoácidos FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS
 FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Aminoácidos Disciplina: Bioquímica I Prof. Me. Cássio Resende de Morais Introdução Proteínas são as macromoléculas
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Aminoácidos Disciplina: Bioquímica I Prof. Me. Cássio Resende de Morais Introdução Proteínas são as macromoléculas
resumo da aula anterior: Estrutura e função de proteinas
 QBQ 2451 Introdução à Bioquímica 2013 Maria Teresa Machini Laboratório de Química de Peptídeos Bloco 8 Superior sala 0854 mtmachini@iq.usp.br resumo da aula anterior: Estrutura e função de proteinas IDENTIFICAÇÃO
QBQ 2451 Introdução à Bioquímica 2013 Maria Teresa Machini Laboratório de Química de Peptídeos Bloco 8 Superior sala 0854 mtmachini@iq.usp.br resumo da aula anterior: Estrutura e função de proteinas IDENTIFICAÇÃO
RMN em proteínas pequenas
 COSY COrrelated SpectroscopY Experimento 2D homonuclear ( 1 H- 1 H) mais simples Primeiro experimento 2D proposto (Jeener, 1971) Período de mistura: 1 único pulso de 90 Transferência da coerência entre
COSY COrrelated SpectroscopY Experimento 2D homonuclear ( 1 H- 1 H) mais simples Primeiro experimento 2D proposto (Jeener, 1971) Período de mistura: 1 único pulso de 90 Transferência da coerência entre
Aminoácidos. Prof. Dr. Walter F. de Azevedo Jr. Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP.
 Aminoácidos Prof. Dr. Walter F. de Azevedo Jr. Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. Resumo Introdução Quiralidade Ligação peptídica Cadeia peptídica
Aminoácidos Prof. Dr. Walter F. de Azevedo Jr. Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. Resumo Introdução Quiralidade Ligação peptídica Cadeia peptídica
Prof. Marcelo Langer. Curso de Biologia. Aula Genética
 Prof. Marcelo Langer Curso de Biologia Aula Genética CÓDIGO GENÉTICO Uma linguagem de códons e anticódons, sempre constituídos por 3 NUCLEOTÍDEOS. 64 CODONS = 4 tipos diferentes de nucleotídeos, combinação
Prof. Marcelo Langer Curso de Biologia Aula Genética CÓDIGO GENÉTICO Uma linguagem de códons e anticódons, sempre constituídos por 3 NUCLEOTÍDEOS. 64 CODONS = 4 tipos diferentes de nucleotídeos, combinação
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande diversidade
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande diversidade
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
Biomoléculas. * Este esquema não está a incluir as Vitaminas que são classificadas no grupo de moléculas orgânicas. Biomoléculas
 Biomoléculas Biomoléculas Inorgânicas Orgânicas Água Sais Minerais Glícidos Lípidos Prótidos Ácidos Nucléicos * Este esquema não está a incluir as Vitaminas que são classificadas no grupo de moléculas
Biomoléculas Biomoléculas Inorgânicas Orgânicas Água Sais Minerais Glícidos Lípidos Prótidos Ácidos Nucléicos * Este esquema não está a incluir as Vitaminas que são classificadas no grupo de moléculas
INTRODUÇÃO Á BIOQUÍMICA
 INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
INTRODUÇÃO Á BIOQUÍMICA BIOQUÍMICA ENFERMAGEM FIO Faculdades Integradas de Ourinhos. Prof. Esp. Roberto Venerando Fundação Educacional Miguel Mofarrej. FIO robertovenerando@fio.edu.br 1 - Introdução à
Proteínas funcionais: hemoglobina e mioglobina
 BIOQUÍMICA 1º ano de Medicina Ensino teórico 2007/2008 9ª aula teórica Proteínas funcionais: hemoglobina e mioglobina - Biochemistry (J. M. Berg, J. L. Tymozko, L. Stryer) 6ª Ed., W. H. Freeman & Company,
BIOQUÍMICA 1º ano de Medicina Ensino teórico 2007/2008 9ª aula teórica Proteínas funcionais: hemoglobina e mioglobina - Biochemistry (J. M. Berg, J. L. Tymozko, L. Stryer) 6ª Ed., W. H. Freeman & Company,
03/01/2016. Proteína INTRODUÇÃO INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE CADEIA PROTÉICA FUNÇÕES FUNÇÕES BIOLÓGICAS
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Química e Bioquímica de Alimentos Componentes principais Proteína INTRODUÇÃO Proteínas Macromoléculas compostas de vários
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA RIO GRANDE DO NORTE Disciplina: Química e Bioquímica de Alimentos Componentes principais Proteína INTRODUÇÃO Proteínas Macromoléculas compostas de vários
a. RE: b. RE: c. RE:
 1. O veneno de diversas serpentes contém a enzima fosfolipase A2, que catalisa a hidrólise de ácidos graxos na posição C-2 dos glicerolfosfolipídeos. O produto fosfolipídico resultante dessa hidrólise
1. O veneno de diversas serpentes contém a enzima fosfolipase A2, que catalisa a hidrólise de ácidos graxos na posição C-2 dos glicerolfosfolipídeos. O produto fosfolipídico resultante dessa hidrólise
