DISTÚRBIOS DO EQUILÍBRIO HIDROELETROLÍTICO E DO EQUILÍBRIO ACIDOBÁSICO UMA REVISÃO PRÁTICA
|
|
|
- Bárbara Desconhecida Palmeira
- 7 Há anos
- Visualizações:
Transcrição
1 Medicina, Ribeirão Preto, 32: , out./dez REVISÃO DISTÚRBIOS DO EQUILÍBRIO HIDROELETROLÍTICO E DO EQUILÍBRIO ACIDOBÁSICO UMA REVISÃO PRÁTICA FLUID, ELECTROLYTE AND ACID-BASE DISORDERS. A PRACTICAL REVIEW Paulo Roberto B. Évora 1 ; Celso Luís dos Reis 2 ; Marcus A. Ferez 2 ; Denise A. Conte 2 & Luís Vicente Garcia 3 1 Livre Docente em Cirurgia Torácica e Cardiovascular e Coordenador do Laboratório de Função Endotelial da Divisão de Técnica Cirúrgica e Cirurgia Experimental; 2 Médicos Assistentes do Centro de Tratamento Intensivo (Campus) do Hospital das Clínicas de Ribeirão Preto; 3 Docente da Disciplina de Dor e Anestesiologia, Diretor do Serviço de Anestesiologia. Departamento de Cirurgia, Ortopedia e Traumatologia da Faculdade de Medicina de Ribeirão Preto da USP. CORRESPONDÊNCIA: Paulo Roberto B. Evora Rua Rui Barbosa, 367, 7º Andar CEP: Ribeirão Preto, SP EVORA PRB; REIS CL; FEREZ MA; CONTE DA & GARCIA LV. Distúrbios do equilíbrio hidroeletrolítico e do equilíbrio acidobásico Uma revisão prática. Medicina, Ribeirão Preto, 32: , out./dez RESUMO: O equilíbrio hidroeletrolítico e o equilíbrio acidobásico são assuntos de importância para todas as especialidades. Porém, seu entendimento prático é, por vezes, revestido de variados graus de dificuldades. No presente texto apresenta-se o assunto apenas como uma visão prática, adquirida em mais de vinte (20) anos de ensino para estudantes, médicos residentes e médicos pósgraduandos. O texto tem apenas a pretensão didática, sem nenhuma preocupação acadêmica. UNITERMOS: Água. Eletrólitos. Acidose. Alcalose. Equilíbrio acidobásico. Equilibrio hidroeletrolítico. Este é um texto de revisão que representa um estilo adotado para o ensino dos equilíbrios hidroeletrolítico (EHE) e acidobásico (EAB) por mais de duas décadas (1975 a 1998). Do ponto de vista acadêmico, a maneira como o assunto é apresentado pode estar sujeita a muitas críticas, mas esta foi a melhor maneira encontrada para ensinar médicos residentes e estudantes. Incluir os dois assuntos em um texto de revisão, sem estendê-lo excessivamente, foi outro desafio. Assim, temos consciência de que a manutenção de uma fluência de estilo pode ter deixado a desejar, uma vez que, em determinados momentos, sempre com a preocupação da extensão do texto, ele se torna mais próximo do estilo que se lê em manuais. Os principais objetivos relativos ao EHE, a serem atingidos pelo leitor, podem ser enumerados como a seguir: 1. Reconhecer os compartimentos hídricos e a água total do organismo. 2. Reconhecer os efeitos da permeabilidade e tonicidade nas diferenças de composição entre os líquidos intracelular e extracelular. 3. Ter noções de equilíbrio hídrico. 4. Reconhecer a importância das chamadas perdas para o terceiro espaço. 5. Reconhecer e tratar os principais distúrbios do equilíbrio hídrico (desidratação, edema e intoxicação hídrica). 6. Reconhecer e tratar os principais distúrbios do equilíbrio eletrolítico (hipo e hipernatremia, hipo e hiperpotassemia, hipo e hipercalcemia, hipo e hipermagnesemia). Os principais objetivos relativos ao EAB, a serem atingidos pelo leitor, podem ser enumerados como a seguir: 1. Reconhecer os dois mecanismos básicos que os sistemas orgânicos utilizam para a manutenção do 451
2 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia EAB: cota fixa de ácidos da dieta e destino do CO2 gerado como produto final do metabolismo. 2. Deduzir a Equação de Henderson-Hasselbalch (Tampão bicarbonato, componente metabólico ou não respiratório/função renal; componente respiratório/função pulmonar). 3. Conhecer os mecanismos de excreção do H Reconhecer as evidências de que o organismo animal possui mecanismos naturais de defesa contra a acidose mais eficientes do que os mecanismos de defesa contra a alcalose. 5. Conhecer os principais sistemas tampões além do tampão bicarbonato. 6. Conceituar Base-Excess e Reserva Alcalina. 7. Entender as interrelações entre o EAB e EHE através do conceito do Anion Gap. 8. Saber interpretar uma gasometria, diagnosticando os desvios do EAB. 9. Reconhecer os fatores que podem influenciar os resultados de uma gasometria. 10. Conhecer as causas mais comuns dos desvios do EAB: alcalose respiratória, acidose respiratória, Síndrome da Angústia Respiratória do Adulto (SARA), acidose metabólica e alcalose metabólica. 11. Saber tratar os distúrbios do EAB. 12. Conhecer os efeitos deletérios da acidose aguda. 13. Conhecer os efeitos deletérios da alcalose aguda. 1. EQUILÍBRIO HIDROELETROLÍTICO E SEUS DESVIOS 1.1 COMPARTIMENTOS HÍDRICOS E TONICIDADE Água total do organismo Embora a concentração dos íons de uma solução seja rapidamente determinada laboratorialmente, é bom ressaltar que os volumes dos vários compartimentos hídricos têm uma importância ainda maior no tratamento cirúrgico. Embora a extensão e as distorções presentes nestes volumes hídricos não sejam prontamente determinadas por medida direta, é essencial um conhecimento das várias subdivisões da água total do organismo para compreender e tratar os problemas hidroeletrolíticos mais complexos. A água tritiada foi utilizada como isótopo para determinar a água do organismo. A água representa 50 a 60% do peso corporal, estando presente, em maior quantidade, nas pessoas magras, e, em menor quantidade, nas obesas. As mulheres têm uma percentagem menor de água total no organismo devido à maior quantidade de tecido adiposo subcutâneo. A água do organismo pode ser dividida em compartimentos: a) Intracelular - 40% do peso corpóreo, b) Extracelular - 20% do peso corpóreo (Intersticial 5% e Intravascular 15%). O líquido intersticial não pode ser medido diretamente por isótopos usados nas dosagens de diluição do indicador, porém consiste na diferença entre o líquido extracelular total e o volume localizado no espaço intravascular. Os três compartimentos que compõem a água total do organismo também diferem em composição. O potássio (K + ), o cálcio (Ca 2+ ) e o magnésio (Mg 2+ ) representam os principais cátions na água intracelular, e os fosfatos e as proteínas, os principais ânions. Grande parte do sódio (Na + ) é eliminada desse compartimento por processos que requerem energia (Bomba Na + -K + ou Na + -K + ATPase). Por outro lado, o sódio é o principal cátion do líquido extracelular (LEC), enquanto o Cl - e o HCO3 - representam os principais ânions. A importância do Na + está relacionada com o controle que ele exerce na distribuição da água em todo o organismo. O número de moléculas de Na + por unidade de água determina a osmolalidade do LEC. Se o Na + é perdido, a água é excretada na tentativa de manter a osmolalidade normal, e se o Na + é retido, a água também deve ser retida para diluí-lo. A quantidade total de Na + existente no organismo é de aproximadamente 4000 meq, porém, a maior parte dessa quantidade encontra-se no esqueleto. Para fins didáticos, as composições iônicas do plasma e do líquido intersticial podem ser consideradas idênticas, embora possa haver pequenas diferenças, resultantes da concentração desigual de proteína. O plasma tem um conteúdo muito maior de proteína, e esses ânions orgânicos exigem um aumento na concentração total de cátions. A concentração dos ânions inorgânicos é algo menor no plasma do que no interstício. Essas relações são estabelecidas pelo equilíbrio de Gibbs-Donnan Permeabilidade e tonicidade As diferenças na composição entre o líquido intracelular (LIC) e o LEC são mantidas ativamente pela membrana celular. Essa é uma membrana semipermeável, uma vez que é totalmente permeável à água, porém é seletivamente permeável a outras substâncias. Embora o número total de osmoles seja igual em ambos os lados da membrana celular, a pressão osmótica efetiva é determinada por substâncias 452
3 EAB e EHE que não podem passar através da membrana semipermeável. Isso é bem estabelecido no limite da célula capilar, entre o plasma e o líquido intersticial. A passagem limitada das proteínas plasmáticas é responsável pela pressão osmótica eficaz, geralmente, conhecida como pressão coloidosmótica desse compartimento. Analogamente, as substâncias cuja passagem é limitada pela membrana celular, tais como o sódio, contribuem para a pressão osmótica eficaz do LEC. É importante ter em mente que a água atravessa livremente todas as membranas celulares. Isso significa que o movimento da água através da membrana celular equalizará sempre a pressão osmótica eficaz no interior e no exterior da célula. Se houver alteração da pressão osmótica eficaz no LEC, haverá uma redistribuição de água entre os compartimentos. Esses desvios da água orgânica resultam de alterações na composição, e não alterações no volume, de maneira que a água intracelular é muito menos afetada pelos aumentos ou diminuições do LEC do que pela pressão osmótica. A pressão osmótica de uma solução é referida em termos de osmoles ou miliosmoles, e está relacionada com o número de partículas osmoticamente ativas, presentes na solução. Portanto, 1 mmol de NaCl, que se dissocia em Na + e Cl -, contribui com dois miliosmoles. Assim, 1 mmol de uma substância não ionizada, tal como a glicose ou a uréia, contribuirá com um mosm. Quando se consideram os problemas hidroeletrolíticos, os termos tais como osmol ou miliosmol não são tão freqüentemente empregados como o são o equivalente e o milequivalente. O equivalente de um íon é o seu peso atômico, expresso em gramas, dividido pela sua valência. Quando se trata de íons univalentes, 1 meq é igual a 1 mmol. No caso dos íons divalentes, (um) mmol é igual a dois meq. Esses conceitos são importantes para o entendimento do equilíbrio eletrolítico corpóreo, uma vez que, em qualquer solução, o número total de cátions expressos em meq deve ser igual ao número de ânions, também expressos em meq Balanço hídrico O peso corporal tornou-se uma medida bastante importante, porque as alterações agudas refletem aumentos ou diminuições na água total do organismo. Como foi observado anteriormente, a água total do organismo representa 50 a 60% do peso corporal. Em um adulto de 70 quilos essa fração seria de 35 a 42 litros de água, uma ampla faixa que está relacionada com a idade, o sexo e as diferenças na composição do organismo existentes entre adultos normais. Assim, uma única medida do peso corporal, geralmente, tem pouco valor no cálculo da água total. No entanto, no contexto da unidade de tratamento intensivo, as mudanças do peso a curto prazo devem-se, em grande parte, mais às alterações na água total do organismo, mesmo se o valor absoluto da água total permanecer incerto; o conhecimento da direção e da intensidade da alteração desse parâmetro pode revestir-se de grande importância no diagnóstico e tratamento de distúrbios complexos do EHE. Quando não se dispõe de camas-balanças, ou quando não se podem fazer pesagens fiéis devido à condição do paciente, tornase necessário fazer determinações do balanço hídrico (BH). O BH diário, incluindo uma estimativa das perdas por evaporação, pode ser acrescentado ou subtraído, sendo que o BH cumulativo resultante, reflete as alterações da água total do organismo. O BH teve aplicação clínica limitada devido às dificuldades em se medir o conteúdo hídrico dos alimentos sólidos e das fezes, a água e as perdas pela evaporação. Na verdade, alguns desses problemas são simplificados no pós-operatório (PO), uma vez que quase todo o aporte de água é intravenoso, sendo facilmente medido. Devido à ausência de ingestão por via oral, as fezes não são freqüentes e o débito urinário pode ser medido com facilidade. As perdas por evaporação são inferiores a 1000 ml/dia nos pacientes afebris e ainda menores, quando se umidificam as vias aéreas com vapor aquecido, e nos pacientes febris existem cálculos que possibilitam avaliar as perdas aproximadas. No ambiente com ar condicionado, muitos pacientes febris ainda perderão menos que dois litros por dia através da pele e da respiração. A hiperventilação dos pacientes com febre elevada pode eliminar até três litros de água por dia, porém isso é incomum. As queimaduras graves são uma exceção óbvia, porém, à exceção desse grupo de pacientes, podem ser feitas aproximações razoáveis da perda evaporativa de água que, por sua vez, possibilita o cálculo do BH diário e cumulativo, a partir da ingesta de líquidos e de registros de débito. Uma vez que as pesagens seriadas ou o BH geram informações principalmente sobre as alterações na água total do organismo, outros meios são importantes para diagnosticar um decréscimo ou um excesso no volume absoluto. O volume plasmático é a única medida de volume clinicamente disponível, porém pode ter um valor limitado, uma vez que os valores normais previstos variam consideravelmente. O 453
4 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia exame clínico do paciente é essencial, e certos sinais e sintomas indicam a existência de anormalidade no volume hídrico do organismo. O sistema cardiovascular é o indicador mais sensível, e uma Pressão Venosa Central (PVC) abaixo de 3 cmh 2 0, taquicardia e até mesmo hipotensão indicam um déficit de volume. Na Unidade de Terapia Intensiva (UTI) o excesso de volume é mais comum, uma vez que os pacientes recebem, durante a ressuscitação, grandes volumes de líquido por via endovenosa. São sinais bem reconhecidos de sobrecarga hídrica: a PVC aumentada, o Débito Cardíaco (DC) elevado, ritmo de galope cardíaco, uma segunda bulha pulmonar hiperfonética, a congestão pulmonar e algumas vezes o edema. O Sistema Nervoso Central (SNC) pode fornecer evidências de déficit na água total do organismo, tais como apatia, reflexos tendinosos, profundos e diminuídos, estupor ou coma. Porém, os excessos isotônicos exercem pouco ou nenhum efeito na função do SNC. Os sinais teciduais são tradicionalmente usados para avaliar a hidratação, porém podem aparecer lentamente. O turgor cutâneo diminuído, os olhos encovados e a língua seca são sinais tardios de déficit de líquido, assim como o edema subcutâneo é um sinal tardio de sobrecarga. Finalmente, deve-se salientar que o conhecimento da composição das várias secreções orgânicas pode ser de grande valia para um raciocínio mais dirigido diante de alterações do EHE. Essas composições podem ser obtidas em tabelas próprias, ou pela análise bioquímica de alíquotas dessas secreções A importância das perdas para o terceiro espaço É possível ocorrer uma desidratação por seqüestro interno de líquido. Como já se descreveu, os compartimentos normais são o LEC (IV + INT) e o LIC. Quando ocorrem lesões, como as queimaduras, trauma acidental e cirurgia, o LEC é seqüestrado na área de lesão, formando um terceiro espaço líquido anormal. Esta perda se faz a expensas do LEC normal e reduz o seu volume efetivo, produzindo hemoconcentração e hipovolemia. A terapêutica imediata com soluções salinas ou balanceadas em sais e plasma, restaura os volumes plasmático e do interstício. As perdas para o terceiro espaço devem ser repostas como uma perda externa, uma vez que o líquido seqüestrado não tem nenhum valor do ponto de vista volêmico do paciente. À medida que este espaço diminui ( resolução do terceiro espaço ), após a estabilização do paciente, ocorre uma auto-infusão de líquido que, se não for eliminada por uma função renal adequada, pode transformar-se em edema intersticial com conseqüente quadro de SARA. Este problema tem grande importância na mortalidade de pacientes traumatizados após 48 a 72 horas de estabilizado o quadro inicial de choque hipovolêmico. Se o paciente não apresentar boa diurese, deve-se restringir líquidos, usar diuréticos e até processos dialíticos. 1.2 DISTÚRBIOS DO EQUILÍBRIO HÍDRICO Desidratação a) Definição A desidratação é uma diminuição na quantidade total de água corpórea com hiper, iso ou hipotonicidade dos fluidos orgânicos.os testes de laboratório mostram Hb e Ht, uréia, creatinina, proteínas e densidade específica da urina elevados, e sódio urinário baixo (a não ser que haja doença renal primária). b) Etiologia Perdas gastrintestinais (diarréia, vômitos, aspiração gástrica); perdas geniturinárias (poliúria de qualquer etiologia, doença de Addison, diabetes, terapêutica com diuréticos, etc.); perdas pela pele (sudorese abundante, queimaduras, etc.); ingestão insuficiente (numerosas etiologias). c) Sinais e Sintomas Sede (com perda de 2% do peso corpóreo); precoces (mucosas secas, pele intertriginosa seca, perda da elasticidade da pele, oligúria); tardios (taquicardia, hipotensão postural, pulso fraco, obnubilação, febre, coma); morte (com perda de 15% do peso corpóreo) d) Conduta 1) corrigir o problema primário; 2) a diferença entre o peso prévio ao processo mórbido e o peso atual (na possibilidade de obtenção), corresponde ao grau de desidratação e o volume a ser reposto; 3) se não for possível a utilização do peso como parâmetro, estimar o grau de desidratação, combinando a história com os sinais e sintomas e exames de laboratório; classifica-se, deste modo, a desidratação em: Leve (perda de 3% do peso corpóreo); Moderada (perda de 5 a 8%) e; Grave (perda de 10%); 4) reponha o volume perdido, representado pela perda do peso corpóreo, dando 1/2 do volume total a repor nas primeiras doze horas, dependendo do estado clínico; 5) determine o estado iônico do paciente e reponha sal de acordo com 454
5 EAB e EHE as necessidades, utilizando soluções eletrolíticas adequadas; 6) quando houver desidratação grave, use soluções eletrolíticas em grandes quantidades, não espere pelos resultados das determinações eletrolíticas Edema O edema não é, por si só, uma emergência. A sua presença, no entanto, é indicativa de doença de base, cuja natureza deve ser elucidada. As causas cardíacas, hepáticas ou renal são as mais comuns. Não se deve dar diuréticos até que se tenham analisados os múltiplos fatores que podem levar ao edema. Os diuréticos empregados sem critério podem induzir distúrbios eletrolíticos, coma hepático, azotemia e arritmias Intoxicação hídrica a) Definição É o oposto direto da hipertonicidade (por sobrecarga de solutos), causada pela excessiva ingestão de água na presença de baixa diurese. A fonte de água pode ser a ingestão oral, mas, mais freqüentemente, é uma má orientação e excessiva terapêutica parenteral com glicose e água. As irrigações dos colos, particularmente as destinadas a reduzir a distensão pós-operatória, podem resultar em retenção substâncial de volumes de água. Os pacientes com enfermidades crônicas, debilitantes, com câncer, insuficiência cardíaca congestiva ou enfermidade hepática ou renal, são propensos a ter um LEC expandido e algum grau de hipotonicidade antes de vir à cirurgia ou de sofrer um trauma acidental. Esses pacientes estão particularmente sujeitos a reter excesso de água no pós-operatório e a expandir, e, posteriormente, diluir o LEC. b) Quadro clínico As náuseas, a astenia e uma queda do volume urinário são os sintomas mais precoces, seguidos por convulsão e coma. Sempre ocorrerá rápido aumento de peso, podendo observar-se edema periférico e pulmonar. Os achados laboratoriais incluirão rápida queda na concentração do Na + sérico e na osmolalidade plasmática. A urina pode conter substanciais quantidades de sódio que, em presença de uma baixa concentração plasmática, indicam uma inapropriada excreção de sódio, devido ao excesso de volume do LEC, se estiverem afastadas doença renal e insuficiência adrenal. A velocidade de queda do sódio plasmático parece ser de maior importância do que seu valor absoluto. O edema cerebral é a causa do coma e das convulsões, sendo encontrados, comumente, valores de Na + inferiores a 120 meq/l. c) Conduta Restrição hídrica, reposição de sódio (administração de sal hipertônico em pequenas quantidades ml de NaCL a 3%), uso cuidadoso de diurético osmótico (manitol) e administração lenta de glicose hipertônica. Nenhuma tentativa deverá ser feita para uma reposição calculada do déficit de sódio, baseada no volume do LEC e na unidade de déficit de sódio, porque resultará numa grave sobrecarga. O tempo com a perda insensível de água pelos pulmões, juntamente com o fluxo de urina, pode, por si só, levar o paciente gradualmente ao normal. 1.3 DISTÚRBIOS DO EQUILÍBRIO ELETROLÍTICO Alterações do sódio O sódio é o cátion que existe em maior quantidade nos líquidos extracelulares. Os íons de sódio participam da manutenção do EH, da transmissão dos impulsos nervosos e da contração muscular. A sua concentração normal no LEC varia entre 136 e 144mEq/l. O EHE é regido por um princípio fisiológico importante: a água vai para onde for o sódio. Quando os rins retêm sódio, a água também é retida. Por outro lado, e a sua excreção é acompanhada pela excreção de água. Este é o princípio da maioria dos diuréticos. Quando a ingestão de sódio diminui, ou quando o paciente perde líquidos, o organismo procura reter sódio por ação da aldosterona nos túbulos renais, onde promove a reabsorção do sódio Hiponatremia Pode ser resultado da deficiência corpórea do sódio, uma diluição por excesso de água, ou uma combinação dos dois fatores. A causa mais comum é a excreção ineficiente de água frente ao excesso de administração (freqüentemente induzida iatrogênicamente) Etiologia - é importante tentar diferenciar o tipo de hiponatremia presente, isto é, super-hidratação ou deficiência de sódio, já que a causa básica e o tratamento são muito diferentes. A depleção de sódio (hiponatremia) é encontrada quando as perdas de fluidos que contêm Na + com continuada ingestão de água: perdas gastrintestinais (diarréia, vômito); perdas pela pele (lesões exsudativas da pele, queimaduras, sudorese); seqüestros no corpo (obstrução intestinal); perda renal (primária ou secundária a estados de depleção, incluindo as perdas por diuréticos e na doença de Addison). 455
6 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia A hiponatremia dilucional pode ocorrer na: Insuficiência Cardíaca Congestiva (ICC), cirrose, doença renal com oligúria, síndrome de secreção inadequada do Hormônio Anti-Diurético (HAD), doença de Addison. Outras causas incluem: síndrome de hiponatremia familiar (assintomática, vista em muitos tipos de doenças de depleção); sódio sérico artificial baixo, como nas hiperlipidemias, hiperglicemias e hiperproteinemia do mieloma múltiplo. Sinais e sintomas - dificuldade na concentração mental, alterações da personalidade, confusão, delírio, coma, oligúria. ca). As mucosas e a boca estão secas. A sede está presente, mas pode ser ocultada pela náusea e vômitos. A fraqueza muscular e as cãibras são comuns. Pode ocorrer febre (maior que 40ºC graus em alguns casos). Sinais e sintomas neurológicos, incluindo tremor, hiperreflexia profunda, memória alterada, confusão e alucinações podem estar presentes. Conduta - pesar o paciente e tratar a doença primária. Estimar a porcentagem de perdas em termos de peso corpóreo, planejar a reposição de aproximadamente metade do volume nas primeiras oito a doze horas. O edema cerebral pode complicar a reposição muito rápida. Conduta - tratar a doença de base, pesar o paciente, determinar se a hiponatremia é secundária à Nota: uma estimativa grosseira da osmolalidade sérica pode ser obtida pela seguinte fórmula: perda de sal ou à sobrecarga de água. Nos casos de hiponatremia por depleção salina, repor o sódio, calculando o seu déficit com base Osmolalidade = 2(Na + + K + ) + Uréia + Glicemia no volume da água total (60% do peso para os homens e 50% do peso para as mulheres). A prática Alterações do potássio revela que a reposição à base apenas do LEC (20% O potássio é o principal cátion intracelular que do peso corpóreo) retarda a resolução do problema. regula a excitabilidade neuromuscular e a contratilidade muscular. O potássio é necessário para a for- A hiponatremia por excesso de água é tratada como intoxicação hídrica: repor sódio só em caso com mação do glicogênio, para a síntese protéica e para a menos de 110 meq/l, manitol (observar cuidadosamente sinais de ICC). correção do desequilíbrio acidobásico. A sua importância no EAB é importante, porque os íons K + competem com os íons H +. Por conseguinte, na acidose, A síndrome de hiponatremia familiar e sódio baixo artificial não necessita, em geral, de tratamento. ocorre eliminação de um H + para cada K + retido. Na Hipernatremia Está, geralmente, associada à desidratação com Na + superior a 150 meq/l. Etiologia - perda de água superior à de sódio: diarreia e vômitos, insuficiência renal, diabetes insipidus, diabetes mellitus, febre, insolação, hiperventilação; reposição insuficiente das perdas hídricas: alcalose, dá-se o contrário. A regulagem do potássio está a cargo, principalmente, dos rins. Quando a aldosterona aumenta, a urina elimina maior quantidade de potássio e o nível de potássio no sangue pode diminuir. Outro mecanismo regulador baseia-se na permuta com o Na + nos túbulos renais. A retenção de sódio é acompanhada pela eliminação de potássio. diminuição da ingestão hídrica por náuseas, vômitos ou incapacidade Tabela I - Diagnóstico diferencial de hiponatremia física; administração de sobre- carga de soluto: suplementação de proteínas e sal, na alimentação, por Depleção de sódio (Hiponatremia real) Excesso de água (Hiponatremia dilucional) sonda, envenenamento acidental por Uréia elevada normal sal de cozinha, diuréticos osmóticos, Hematócrito elevado normal ou baixo diálise; excesso de esteróides. Pressão Arterial geralmente baixa normal Sinais e Sintomas - a detecção clínica precoce pode ser difícil, Pulso rápido normal porque o plasma hipertônico atrai Pele fria, pastosa normal, úmida água das células, escondendo os sinais de colapso circulatório, vistos na desidratação hiponatrêmica. O turgor cutâneo pode ser normal (em oposição à desidratação hiponatrêmi- Mucosas Turgor cutâneo Edema Urina secas diminuído ausente pouca, concentrada úmidas normal às vezes, presente normal ou poliúrica, diluída 456
7 EAB e EHE Os níveis séricos normais de potássio oscilam entre 3,5 a 5 meq/l. Ressalte-se que os valores plasmáticos representam os valores extracelulares. Sua normalidade ou o seu aumento não significam alterações globais dos seus valores, isto porque ele predomina no LIC. Já o seu valor plasmático é importante no caso de hiperpotassemia, porque é o aumento dos seus níveis extracelulares que pode levar à parada cardíaca diastólica Hiperpotassemia Etiologia - insuficiência renal aguda, doença de Addison, acidose, transfusões e hemólise, lesões por esmagamento de membros e outras causas de degradação de proteínas, grande ingestão de K + frente à insuficiência renal, entre outras. Sinais e Sintomas - fraqueza muscular, paralisia flácida, diminuição de ruídos hidroaéreos, parestesias (face, língua, pés, mãos), irritabilidade muscular, arritmias cardíacas e outras alterações do Eletrocardiograma (ECG) (onda T em campânula, complexos QRS alargados), parada cardíaca em diástole. Conduta - gluconato ou cloreto de cálcio, bicarbonato de sódio, solução polarizante sem K (glicose-insulina), resinas de troca iônica (Kayexalate, Sorcal), diálise Hipopotassemia Etiologia - perdas gastrintestinais (diarréia, fístula Gastrintestinal (GI), vômitos); perdas geniturinárias (acidose tubular renal e outras doenças renais, doença de Cushing, síndrome de Cohn, uso de diuréticos); ingestão insuficiente (notar que há perda obrigatória nas fezes); desvio iônico (alcalose). Sinais e Sintomas - neuromusculares (fraqueza muscular, parestesias); renais (concentração prejudicada, poliúria); gastrintestinais (náuseas, íleo adinâmico); SNC (irritabilidade, letargia, coma); cardíacos (arritmias tipo bigeminismo e/ou trigeminismo, onda U ao ECG) Conduta - via oral (KCl xarope, K efervescente ou em comprimidos); via endovenosa (aumentando-se a concentração de K + nas soluções eletrolíticas usuais, solução polarizante: G-I-K). Nota: a reposição do K + se faz de maneira empírica, sendo um esquema usual a reposição de 40 a 60 meq/l por via EV (Endovenosa) a velocidades não maiores do que meq/hora. Casos especiais - os cirróticos são especialmente suscetíveis às complicações da hipopotassemia e devem ser tratados agressivamente com relação a tal problema. Os pacientes digitalizados são especialmente suscetíveis às arritmias, se hipopotassêmicos, e também necessitam de tratamento intensivo para esta alteração eletrolítica. Deve-se prevenir a hipopotassemia após tratamento para acidose em geral, e da acidose diabética, em especial Alterações do cálcio O cálcio ocupa o quinto lugar entre os elementos mais abundantes no corpo humano. O organismo precisa do cálcio para a integridade e estrutura das membranas celulares, condução adequada dos estímulos cardíacos, coagulação sangüínea e formação e crescimento ósseos. O cálcio se encontra nos líquidos orgânicos sob três formas diferentes: 10 cálcio ionizado (4,5 mg/100ml); 20 cálcio não difusível, formando complexos com ânions protéicos (5mg/100ml) e; 3) sais de cálcio, tais como citrato e fosfato de cálcio (q mg/100ml). Alguns laboratórios clínicos indicam os níveis de cálcio em meq/l. O cálcio contido nos líquidos orgânicos representa uma pequena porcentagem do cálcio total, sendo que a maior parte dele se encontra nos ossos e dentes. O cálcio contido no LEC é regulado pela ação dos hormônios das paratireóides e tireóides. O hormônio da paratireóide regula o equilíbrio entre o cálcio contido nos ossos, a absorção de cálcio pelo trato gastrintestinal e a eliminação do cálcio pelos rins. A tireocalcitonina, produzida pela tireóide, também desempenha um certo papel na determinação dos níveis séricos do cálcio, porque inibe a reabsorção do cálcio dos ossos Hipocalcemia Etiologia - perda de tecido da paratireóide após tireoidectomia, hipoparatireoidismo idiopático, insuficiência renal (raramente sintomática). Sinais e Sintomas - parestesias (especialmente perorais e nas mãos e pés); labilidade emocional; miastenia e cãibras; diarréia e poliúria; disfagia; estridor laríngeo e broncoespasmo, convulsões; arritmias cardíacas e intervalo Q-T aumentado; espasmo carpopedal (espontâneo ou com uso de manguito de pressão durante três minutos, inflado acima da pressão sistólica - Sinal de Trousseau); contração do músculo facial após leve golpe na frente da orelha - Sinal de Chvostek; opistótono. Conduta - a reposição é empírica, usando-se tantas ampolas de gluconato de cálcio quantas forem necessárias, até o desaparecimento dos sinais clínicos. A infusão venosa deve ser lenta. Nos casos de 457
8 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia hipoparatireoidismo, pode-se utilizar extrato de paratireóide (100 a 200 unidades USP) por via EV. No tratamento pós-controle da fase aguda, deve-se acrescentar cálcio oral e Vitamina D. Nota importante: se não houver resposta ao tratamento com cálcio, considerar a possibilidade de hipomagnesemia Hipercalcemia Etiologia - hiperparatireoidismo, neoplasias (carcinoma, leucemia, linfoma, mieloma múltiplo), sarcoidose, intoxicação por Vitamina D, hipo e hipertireoidismo, síndrome do milk-alkali, insuficiência adrenal. Sinais e Sintomas - fraqueza, anorexia e vômitos, constipação, sonolência, estupor, coma, cefaléia occipital, intervalo Q-T e segmento ST supranivelados no ECG, arritmias. Conduta - o objetivo final do tratamento deve ser dirigido para eliminar a causa, se possível. O tratamento de urgência das crises hipercalcêmicas inclui: hidratação com Soro Fisiológico (SF) e diurese forçada com diuréticos (pode ser suficiente nos casos leves). O sulfato de sódio (0,12 M) um (1) litro em 4-6 horas, seguido de uma infusão adicional de três litros em vinte e quatro (24) horas. O sulfato de sódio é mais eficiente que o SF, porém podem ocorrer hipernatremia, hipopotassemia e hipomagnesemia, apesar de sua ação ser de curta duração. Outra opção para o tratamento da hipercalcemia grave são os fosfatos (K 2 HPO 4-1,5 g em infusão EV, correndo durante 7 horas). Os fosfatos podem causar efeitos cardíacos letais, sendo a sua administração Via Oral (VO) mais segura. Além disso os fosfatos podem causar insuficiência renal por depósito de cálcio no rim. São especialmente perigosos nos pacientes com uremia. Os glicocorticóides podem ser úteis nos casos de metástases ósseas, porém não são efetivos nos casos de hipercalcemia causada pelo excesso do hormônio da paratireóide Alterações do magnésio O magnésio ocupa o segundo lugar, por ordem de importâncias, entre os cátions do LIC. Ele é indispensável para as atividades enzimáticas e neuroquímicas, assim como para a excitabilidade dos músculos. Seus níveis plasmáticos variam entre 1,5 e 2,5 meq/l. A regulagem dos níveis de magnésio é indireta, estando a cargo da eliminação renal, além de depender do hormônio das paratireóides. As alterações dos níveis de magnésio são, freqüentemente, associadas a doenças graves e manifestam-se por sinais sugestivos de alterações das funções neuromusculares Hipermagnesemia Etiologia - o excesso de magnésio é quase sempre o resultado de uma insuficiência renal e inabilidade em excretar o que foi absorvido do alimento ou infundido. Ocasionalmente, o uso do sulfato de magnésio, como catártico, pode ser absorvido o bastante para produzir uma intoxicação, particularmente da função renal comprometida. Sinais e Sintomas - fraqueza muscular, queda da pressão sangüínea, sedação e estado de confusão mental. O ECG mostra aumento do intervalo P-R, alargamento dos complexos QRS e elevação das ondas T. A morte, geralmente, resulta da paralisia dos músculos respiratórios. Conduta - o tratamento é dirigido no sentido de melhorar a insuficiência renal. O cálcio age como antagonista do magnésio e pode ser empregado por via parenteral para benefício temporário. Pode estar indicado na diálise peritoneal ou extracorpórea Hipomagnesemia Etiologia - pode ser encontrado no alcoolismo crônico em associação com delirium tremens, cirrose, pancreatite, acidose diabética, jejum prolongado, diarréia, má absorção, aspiração gastrintestinal prolongada, diurese exagerada, hiperaldosteronismo primário e hiperparatireoidismo, particularmente depois de paratireoidectomia e quando largas doses de Vitamina D e cálcio são consumidas. Sinais e Sintomas - hiperirritabilidade neuromuscular e do SNC com movimentos atetóticos, balismos, tremores amplos ( flapping ), sinal de Babinski, nistagmo, taquicardia e arritmias ventriculares, hipertensão e distúrbios vasomotores. Confusão, desorientação e inquietação podem estar em destaque. Conduta - infusão parenteral de soluções eletrolíticas, contendo magnésio (10 a 40 meq/l/dia, durante o período de maior gravidade, seguindo-se manutenção com 10 meq/dia). O sulfato de magnésio pode também ser dado por via IM (4 a 8 g / 66 a 133mEq, diariamente, divididos em quatro doses; os níveis séricos devem ser monitorizados para prevenir a concentração superior a 5-5,5 meq/l). 458
9 EAB e EHE 2. EQUILÍBRIO ACIDOBÁSICO (EAB) E SEUS DESVIOS 2.1 Introdução - Alguns conceitos fisiológicos, fundamentais A avaliação acidobásica do sangue é feita na grande maioria dos doentes que são atendidos em UTI, qualquer que seja a patologia de base. A sua avaliação é fundamental, pois, além dos desvios do equilíbrio acidobásico, propriamente dito, pode fornecer dados sobre a função respiratória do doente e sobre as condições de perfusão tecidual. Os sistemas orgânicos enfrentam dois desafios básicos para a manutenção do EAB. O primeiro é a disposição da cota fixa de ácidos, ingerida na dieta diária. O segundo é o destino dado ao CO 2 gerado como produto final do metabolismo. Para manter o ph em limites compatíveis com os processos vitais, o organismo lança mão de uma série de mecanismos bioquímicos, com destaque para o papel desempenhado pelo chamado sistema tampão. O sistema tampão do organismo pode ser dividido em três grandes componentes: bicarbonato/ácido carbônico, proteína e fosfatos. As substâncias tampões são responsáveis pelo fato de que ph uma solução se modifica menos do que deveria pela adição ou subtração de íons H +. Com a queda do ph da solução, estas substâncias aceitam os íons H + para entregá-los novamente, quando aumenta o ph, desta maneira, agem contra as modificações abruptas da reação. Entre os tampões do espaço extracelular, o bicarbonato e as proteínas plasmáticas desempenham um papel relevante, enquanto a hemoglobina e os fosfatos estão em primeiro plano no compartimento intracelular. Graças a estes sistemas de tamponamento, pequenas alterações do EAB manifestam-se por um deslocamento do equilíbrio da reação dos tampões com atenuação de modificações significativas da concentração dos íons H + livres ou do ph. O tampão bicarbonato é o mais importante: CO 2 + H 2 0 H 2 CO 3 H HCO 3 A partir desta reação química, é possível deduzir a Equação de Henderson - Hasselbach, fundamental para o entendimento do equilíbrio acidobásico: HCO 3 - ph = pk + log H2 CO 3 - O ácido carbônico pode ser representado pela constante 0.03 pela pressão parcial de C0 2 do sangue arterial, surgindo, no denominador da equação, um gás que expressa a ventilação. HCO - 3 ph = pk + log 0.03 X PaCO 2 Assim, é possível concluir que a manutenção do ph depende, fundamentalmente da função renal (numerador da equação) e da função respiratória (denominador da equação). ph = Função Renal (componente não respiratório ou metabólico) Função Respiratória (componente respiratório) O termo metabólico é um erro consagrado pelo uso, uma vez que que ambos os componentes da Equação de Henderson - Hasselbach envolvem um processo metabólico. Este erro histórico será preservado, falando-se em distúrbios metabólicos e distúrbios respiratórios do EAB. Considerando-se estes conceitos, os mecanismos de excreção do H + podem assim ser resumidos: a) a excreção pulmonar do íon H + é indireta; o pulmão só excreta substâncias voláteis, isto é, substâncias que podem ser convertidas em gases; b) a excreção renal não apresenta esta limitação, sendo coadjuvada pelas bases tampões; c) a média de excreção de CO 2 pelos pulmões pode ser mudada rapidamente, em qualquer direção, por alterações apropriadas da ventilação alveolar, porém a hipoventilação, no sentido de poupar H + não é um mecanismo tão eficiente quanto a hiperventilação que elimina este mesmo íon de maneira eficiente, no início de um quadro acidótico; d) a função renal pela excreção de H + e eletrólitos influencia o estado acidobásico do LEC, porém um período de horas é necessário para que esta influência seja significante. Um outro detalhe interessante da fisiologia do EAB são as evidências de que o organismo animal, na sua evolução, adquiriu mecanismos naturais de defesa contra a acidose mais eficientes do que os mecanismos contra a alcalose: a) características próprias da função renal que elimina o H + e reabsorve o HCO - 3 ; b) curva da dissociação da Hb: na acidose, a curva se desvia para a direita, diminuindo a afinidade da Hb pelo oxigênio e, na alcalose, ela se desvia para a esquerda, aumentando a afinidade; 459
10 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia c) a hiperventilação com alcalose respiratória, desviando a reação do CO 2 com a água para a esquerda, é um mecanismo natural de compensação da acidose metabólica, que pode ocorrer normalmente, por exemplo, no exercício físico. A ocorrência do fenômeno inverso é possível na teoria, mas a depressão respiratória, produzindo uma acidose respiratória para compensar uma alcalose metabólica, só ocorreria com um BE>+40, uma situação praticamente impossível; d) isto reflete em uma maior dificuldade do tratamento da alcalose metabólica, como se observa na prática diária da terapia intensiva. Os conceitos de reserva alcalina e Base Excess (BE) merecem um pequeno comentário. A reserva alcalina (capacidade de ligação de CO 2 ) é a quantidade total de CO 2 de uma amostra de plasma, separada anaerobicamente, após equilibrá-la com 40 mmhg de pco 2 à temperatura ambiente (usa-se de preferência o bicarbonato padrão em mmol/l) (Escola americana, liderada por Davenport). O excesso de bases (BE = Base Excess) é igual à concentração de bases do sangue em meq/l, tituladas por um ácido forte a um ph de 7,40, com uma pco2 de 40 mmhg e a uma temperatura de 37 0 C (Escola dinamarquesa, liderada por Sigaard- Andersen). Com a crescente simplificação da análise do EAB por aparelhos de alto rendimento, a determinação de parâmetros isolados, como a reserva alcalina, em comparação com um levantamento completo do EAB, passou para um segundo plano. Existem importantes interrelações entre o EAB e o EHE. a) Lei da eletroneutralidade - Estabelece que a soma das cargas negativas dos ânions deve ser igual à soma das cargas positivas dos cátions. No plasma, há 154 meq/l de cátions e, conseqüentemente, 154 meq de ânions. Em todas as circunstâncias, o sódio responsabiliza-se pela maior parte dos equivalentes catiônicos. Portanto, o bicarbonato constitui-se no elo entre o EAB e o EHE, já que ele faz parte destas duas entidades. Para que se mantenha a eletroneutralidade, quando ocorre uma queda do bicarbonato, ocorre um aumento do cloreto e vice-versa. Assim, a interação entre prótons e ânions, de um modo cumulativo com os componentes normais do soro, resulta em padrões de eletrólitos que possibilitam a classificação de todas as acidoses metabólicas. Os prótons consomem as reservas de álcali, manifestando sua presença sob a forma de hipobicarbonatemia. Como o álcali perdido é substituído por ânions ácidos (fosfato, acetoacetato, cloreto, etc.), segue-se que qualquer ácido, exceto o HCl, substitui o ânion HCO 3-, facilmente medido, por ânions que não são medidos rotineiramente. Por este motivo criou-se o conceito de diferença de ânions ( ânion gap, DA), que reflete o balanço entre o cátion rotineiramente medido (Na+) e os ânions rotineiramente medidos (Cl - + HCO 3- ). DA = ( anion gap ) = (Na + ) - (Cl - + HCO - 3 ) Como as acidoses por HCl efetuam uma troca igual de HCO 3 - perdido por Cl- retido, sem alterar necessariamente o Na + sérico, a DA permanece dentro da faixa normal (12 ± 2 meq/l), dessa maneira, definindo uma acidose hiperclorêmica ou com DA normal. Todas as outras formas de acidose aumentam o anion gap, ao substituir o HCO - 3 por ânions diversos do Cl -. Uma análise crítica do conceito de anion gap demonstra sua pouca utilização na prática diária. Qual seria a sua real utilidade? Diagnóstico diferencial entre tipos de acidoses, permitindo pensar em diagnósticos menos comuns? Como índice prognóstico? Uma utilidade real seria como controle de qualidade de dosagens laboratoriais, já que não existe a situação de anion gap aumentado, que ocorre só na condição de erros de dosagem. Como, alguns aparelhos de origem americana mostram a grande vantagem de fornecer diretamente o valor do anion gap, pressente-se até um possível lance comercial. Finalmente, merecem menções os Nomogramas de Gamble para a ilustração e integração entre o EAB e o EHE. b) Lei da isosmolaridade - Determina que a osmolaridade é a mesma, nos sistemas de líquidos dos organismos, entre os quais a água passa livremente. Seu valor normal é em torno de 285 mosm/l, e, se o número de partículas dissolvidas aumenta em um compartimento a água mobilizar-se-á em direção a ele até que um novo equilíbrio da osmolaridade seja estabelecido. c) Lei fisiológica do equilíbrio acidobásico - Afirma que o organismo tende a manter o ph do sangue em torno de um valor normal. Em relação a esta lei, um fato importante é a interação entre o potássio e o H + em relação ao intra e extracelular. No caso de uma acidose, na tentativa de manter o ph do sangue, o potássio sai da célula com a entrada do H +, ocorrendo o contrário na alcalose, ou seja, saída do H + e entrada do potássio para o compartimento intracelular. 460
11 EAB e EHE 2.2 Diagnóstico dos distúrbios do equilíbrio acidobásico pela análise gasométrica Por tratar-se de um texto apenas com pretensões didáticas, antes da apresentação das causas dos distúrbios do EAB, que seria a seqüência lógica, serão apresentados os princípios diagnósticos. Esta inversão tem se mostrado útil, pois torna fácil a dedução posterior das variadas causas de desequilíbrio acidobásico. O diagnóstico das alterações do EAB é feito pela análise dos valores obtidos através da gasometria sangüínea. Como em todo exame laboratorial, existem fatores que podem influenciar seus resultados, como veremos a seguir a) em pacientes conscientes, a punção arterial pode resultar em hiperventilação, pelo temor induzido pelo procedimento; b) a heparina é ácida e, ao menos teoricamente, pode influenciar os valores do ph, pco 2 e po 2, em amostras pequenas; c) a presença de leucocitose e grande número de plaquetas reduzirá o valor do po 2, dando a falsa impressão de hipoxemia. A queda na po 2 é negligenciável, se a amostra é armazenada em gelo e analisada dentro de uma hora. Presumivelmente, o metabolismo, em andamento, dos elementos celulares do sangue pode consumir O 2 e reduzir a po 2 ; d) o resfriamento aumenta o ph e a saturação de oxigênio, e diminui a po 2 ; e) o halotano aumenta falsamente os valores do po 2, porque o eletrodo para o po 2, no aparelho de gasometria, também responde ao halotano. Ainda sob o ponto de vista da análise gasométrica, alguns detalhes merecem destaque: a) a adoção da escola dinamarquesa (Sigaard- Andersen) é praticamente uma unanimidade internacional; b) quando se solicita uma gasometria sangüínea, o ph, a po 2 e a pco 2 são obtidos por medida eletrônica direta; os valores do CO 2 total, HCO 3, BE, SatO 2 são obtidos por medida indireta, através de leitura no nomograma de Sigaard-Andersen; c) como os distúrbios envolvem mecanismos renais e respiratórios, o diagnóstico deve ser com base na gasometria do sangue arterial; d) a amostra venosa não permite a análise da função respiratória e sua colheita está sujeita a erros; para fins científicos, deve, inclusive, ser colhida na artéria pulmonar, onde o sangue venoso é misto; porém, duas informações práticas podem ser obtidas pela análise da gasometria venosa: 1) a po 2 venosa, quando comparada com a po 2 arterial, dá uma idéia do débito cardíaco (diferença arteriovenosa grande com po 2 venoso baixo significa baixo débito, com os tecidos extraindo muito o oxigênio da hemoglobina pelo fluxo lento, sendo esta uma situação ainda favorável para se tentar a reversão de um estado de choque) e; 2) a diferença arteriovenosa pequena, com progressivo aumento da po 2 venosa, indica um shunt sistêmico, ou seja, um agravamento das trocas teciduais); portanto, o principal dado fornecido pela gasometria venosa é a po 2. Pelo acima exposto, fica claro que o diagnóstico dos distúrbios do EAB deve embasar-se nos valores da gasometria arterial. Antes da análise das possibilidades diagnósticas da gasometria arterial, é importante que se definam os valores normais de seus parâmetros. Para Ribeirão Preto, Manço & Terra Filho definiram, por amostragem, os seguintes valores normais (Tabela II): Tabela II - Valores normais da gasometria arterial * ph = 7,35 a 7,45 po2 = 70 a 90 mmhg pco2 = 35 a 45 mmhg Sat O2 = 95 a 97% *Informação pessoal: Manço & Terra-Filho CO2 = 23 a 27 mmol/l HCO3 = 22 a 26 meq/l BE = -3.5 a +4,5 meq/l Pela gasometria arterial, é possível o diagnóstico dos desvios do componente respiratório (O 2 /oxigenação e pco 2 /ventilação) e do componente metabólico (BE e HCO 3 - ). (Figura 1) Um nomograma clássico bastante útil é o apresentado por West em seu livro, Fisiopatologia Pulmonar Moderna (Figura 2). Este nomograma permite o diagnóstico diferencial de praticamente todos os tipos de insuficiência respiratória, sendo complementar aos dados da Figura 1. Trata-se de um nomograma Ventilação (pco 2 ) / Oxigenação (po 2 ). Como todas as insuficiências respiratórias caracterizam-se pela hipóxia, o diagnóstico diferencial é dado pelo padrão ventilatório, ou seja, pela variação da pco 2. a) Na hipoventilação pura, o aumento da pco 2 arterial é extremamente rápido, atingindo valores superiores a 80 mmhg com vasodilatação cerebral e falência cardiorrespiratória. 461
12 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia Hiperventilação 1. po 2 e pco 2 Alcalose respiratória COMPONENTE 2. po 2 e pco 2 Hipoventilação RESPIRATÓRIO (Pulmões) Acidose Respiratória Alterações da V/Q + PEEP) 3. po2 e pco2 Alterações da difusão Aumento do Qs/Qt (SARA) COMPONENTE - 1. HCO 3 e BE < - 3,5 Acidose Metabólica NÃO RESPIRA- TÓRIO ( Rins ) 2. HCO 3 e BE > + 3,5 Alcalose metabólica Figura 1 - Interpretação da gasometria arterial. PCO2 (mmhg) A F A = Hipoventilação pura B = DPOC C = Pneumopatia restritiva D = SARA E = SARA + O 2 F = DPOC + O 2 60 B 40 C 20 D E PCO2 P (mmhg) Figura 2 - Nomograma pco 2 / po 2 (West) - Diagnóstico diferencial de todas as modalidades de insuficiência respiratória. 462
13 EAB e EHE b) Nos casos de descompensação da doença pulmonar obstrutiva crônica (DPOC), o aumento da pco 2 arterial é mais lento, dificilmente atingindo valores superiores a mmhg. c) Nas pneumopatias restritivas, a pco 2 permanece normal, porque existe uma compensação pela característica hiperventilação destas doenças. d) Na Síndrome da Angústia Respiratória do Adulto (SARA), ocorre uma queda da pco 2 arterial como uma conseqüência do efeito shunt (áreas bem perfundidas e mal ventiladas com alta difusibilidade do CO 2 ). E) Com o tratamento adequado da SARA, a oxigenação pode melhorar, porém uma não observância da normalização da pco 2 pode significar que ainda persistem áreas bem perfundidas e mal ventiladas, levando, ainda, ao efeito shunt. F) O excesso de oxigênio oferecido a pacientes portadores de DPOC pode levar a uma elevação da pco 2, inclusive atingindo valores superiores a 80 mmhg. Isto se deve ao fato de a ventilação destes pacientes ser controlada por quimiorreceptores aórticos e carotídeos, que respondem à hipóxia e à acidose Causas mais comuns dos distúrbios do EAB De um modo bastante simplificado, as causas mais comuns dos distúrbio do EAB podem ser agrupadas conforme relato abaixo Acidose respiratória Aguda: por comprometimento do SNC (poliomielite anterior e aguda, intoxicações exógenas, comas, traumas); por comprometimento anatômico ou funcional da caixa torácica (ossos e músculos). Crônica: por lesões pulmonares (insuficiência respiratória crônica) Alcalose respiratória Aguda: estimulação do Centro Respiratório Bulbar (CRB) (encefalites, emoção, febre e infecções sistêmicas, intoxicação por salicilato, hipoxemia); reflexos (choque); por estimulação de receptores torácicos (atelectasia, pneumopatias agudas). Crônica: vários mecanismos (assistência ventilatória, insuficiência hepática/amônia, lesões do SNC, infecções, hipoxemia, hipertireoidismo) Acidose metabólica Por adição de ácido forte: Aguda exógena (infusão de NH 4 Cl); Aguda endógena (acidose láctica/ácido láctico, acidose diabética/corpos cetônicos, cetose de jejum, azotemia por IRA/ácido sulfúrico, ácido fosfórico), Crônica: azotemia/irc. Por perda de bicarbonato: Aguda (diarréia); Crônica (fístula pancreática, acidose tubular renal) Alcalose metabólica Por perda de ácido forte: Aguda (vômitos), Crônica/perda de potássio (diarréia crônica, corticóides, diuréticos). Por ganho de bicarbonato: Aguda exógena (infusão de bicarbonato); Aguda endógena ( stress ); Crônica (ingestão de antiácidos). Existem situações clínicas importantes que apresentam padrões de alterações do EAB que merecem um breve comentário. a) Estado de choque - A regra é a ocorrência de acidose metabólica devida à má perfusão tecidual com conseqüente metabolismo celular anaeróbio. Em uma fase inicial, existe a tentativa de compensação respiratória, e, em fase final a regra é uma acidose mista. b) Parada cardíaca - Ocorre acidose metabólica e respiratória, respectivamente, pela parada brusca de oxigenação tecidual e da ventilação pulmonar. Nestes casos, os pacientes devem ser hiperventilados, pois o tratamento da acidose é feito com o bicarbonato de sódio que é doador de CO 2. c) Circulação extracorpórea (CEC) - Por melhor que seja sua técnica, vários são os mecanismos que elevam a uma inadequada perfusão tecidual (hipofluxo, hipotermia, hiperatividade simpática e ausência de fluxo pulsátil) com conseqüente acidose metabólica. Por outro lado, o uso de oxigênio puro no oxigenador leva, muitas vezes, a uma acentuada diminuição do CO 2. A alcalose metabólica pode ocorrer pelo excesso de bicarbonato administrado durante a CEC ou, no pós-operatório, pela perda excessiva de potássio muito comum durante a derivação cardiopulmonar. Um outro problema digno de menção é a ocorrência de alcalose metabólica tardia (48-72 horas no pós-operatório). Pode ocorrer pelo metabolismo do citrato ou do lactato da solução de Ringer-Lactato no perfusato. Existem evidências de que esta alcalose seja mais devida ao citrato do anticoagulante do sangue politransfundido, do que ao uso do Ringer-Lactato. d) Politransfusão sangüínea - O sangue estocado possui uma considerável carga de radicais ácidos, 463
14 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia devida, em grande parte, a um acúmulo de ácidos orgânicos (ácido cítrico do anticoagulante e o ácido láctico gerado pela hipotermia da estocagem e pela hipóxia). Se ocorrer acidose metabólica, deve-se proceder à alcalinização, antes feita rotineiramente e, hoje, conforme as necessidades mostradas por gasometrias seriadas. Além disso, o sangue estocado tem os seus níveis de 2,3 difosfoglicerato (2,3 DPG) diminuídos, o que leva a um deslocamento da curva de dissociação da hemoglobina para a esquerda com aumento da sua afinidade pelo oxigênio, piorando a oxigenação periférica e, conseqüentemente, agravando a acidose metabólica. Pode ocorrer, mais tardiamente, uma alcalose metabólica devida à metabolização do citrato pelo fígado. e) Alimentação parenteral - No início desta técnica de suporte nutricional a acidose metabólica era uma grave e freqüente complicação, que ocorria porque alguns aminoácidos essenciais hisitidina, lisina, ornitina e arginina encontravam-se nas soluções sob a forma de cloridrato. Esta complicação tornou-se mais rara com as soluções de aminoácidos mais recentes que substituem o cloridrato por aspartato. f) Insuficiência renal crônica - A regra é a existência de acidose metabólica por adição de ácidos fortes (sulfúrico e fosfórico) devido à azotemia. Pode ocorrer ainda acidose metabólica pela subtração do bicarbonato, devida à chamada acidose tubular renal. Este distúrbio é raro, freqüentemente associada a síndromes genéticas, e são de dois tipos: distal devido a uma incapacidade do túbulo distal de manter gradiente máximo de H + entre a luz tubular e o sangue, e proximal devido a uma deficiência de reabsorção do bicarbonato no início do néfron. Os pacientes portadores de insuficiência renal crônica, em geral, adaptam-se à acidose metabólica. g) Diabetes mellitus - Ocorre acidose metabólica por adição de ácidos devidos aos corpos cetônicos (ácidos acetoacético e betaidroxibutírico). Muitas vezes só o emprego da insulina é o suficiente para o seu tratamento pela diminuição da produção dos corpos cetônicos, sem a necessidade do emprego de bicarbonato. h) Afecções gastrintestinais - Nelas, as principais alterações podem ser divididas em três grupos: acidose metabólica, alcalose metabólica e perda de potássio. A acidose metabólica pode ocorrer por perda de bicarbonato nas diarréias graves e nas fístulas pancreáticas. A acidose pode ainda ocorrer devido a um estado de choque secundário, por exemplo, a uma trombose mesentérica, pancreatite aguda ou fístula pancreática. A alcalose metabólica pode ocorrer por perda de suco gástrico ou perda de potássio (diarréia, tumores vilosos do reto, tumores do pâncreas, fístulas biliares, uso excessivo de laxativos). 2.4 Tratamento dos distúrbios do EAB Princípios gerais Alguns preceitos devem ser seguidos para um adequado tratamento dos desvios do EAB, lembrando-se sempre que a gasometria é um exame subsidiário que deve ser analisado em conjunto com os dados clínicos do paciente. a) O tratamento deve fundamentar-se em dosagens freqüentes e seriadas dos gases e do ph sangüíneo. b) Não confiar de forma absoluta em qualquer resultado de laboratório. c) Não corrigir as alterações muito rapidamente; d) normalizar, inicialmente, o volume sanguíneo e a perfusão tecidual. e) Não corrigir o ph, o cálcio e o potássio isoladamente Tratamento da acidose respiratória Oxigenação e ventilação adequadas: manutenção das vias aéreas livres, correção da hipóxia e/ou hipercapnia, remoção de secreções e tratamento das infecções respiratórias, quando presentes. Um erro freqüente é a administração de bicarbonato de sódio com base apenas no valor do ph Tratamento da alcalose respiratória O objetivo é combater a hiperventilação com sedação de pacientes ansiosos e histéricos. É um distúrbio freqüente em pacientes submetidos a assistência respiratória, principalmente se curarizados. A diminuição da hipoventilação pode ser tentada pelo aumento do espaço morto, diminuição do volume corrente e pela utilização da Ventilação Mandatória Intermitente (IMV), que tem por característica a normalização da pco 2, uma vez que permite a respiração espontânea, intercalada pelo auxílio do respirador Tratamento da Síndrome da Angústia Respiratória Aguda (SARA) Não é objetivo deste texto discutir esta entidade em detalhes. A SARA é um problema de barreira alveolocapilar, causada pela presença de edema pulmonar intersticial. Caracteriza-se por diminuição da capacidade residual funcional, alteração da relação ventilação/perfusão (V/Q) e aumento do shunt pulmonar (Qs/Qt). 464
15 EAB e EHE Basicamente, seu tratamento consiste em instalar-se assistência respiratória com a associação de Ventilação Mandatória Intermitente (IMV) Intermitent Mandatory Ventilation com Pressão Expiratória Positiva Final (PEEP) Positive End Expiratory Pressure, restrição hídrica, diuréticos, processos dialíticos, metilprednisolona, albumina humana (apenas nas fases iniciais, para aumentar a pressão coloidosmótica e ajudar a diminuir o edema pulmonar intersticial, pois, em fases avançadas, pode extravasar para o alvéolo, contribuindo para a formação de membrana hialina), antibióticos. A utilização do nutroprussiato de sódio, na tentativa de reduzir a hipertensão pulmonar, pode piorar a shuntagem, se diminuir muito a pressão arterial sistêmica. A recente utilização de óxido nítrico inalado para reduzir a hipertensão pulmonar de modo seletivo é promissora, mas ainda controversa, havendo mais evidências de que não muda a evolução da SARA. Os valores da po 2 e da pco 2 só voltarão à normalidade com a regressão da situação do shunt pulmonar aumentado Tratamento da acidose metabólica Utiliza-se o bicarbonato de sódio, cuja quantidade necessária para a correção da acidose, em meq, é fornecido pela Fórmula de Mellengard-Astrup: 0,03 x peso (Kg) x BE (2 a 3) O tratamento da acidose metabólica pode ser feito por estimativa, caso não se disponha dos dados gasométricos, utilizando-se, em média, 2 meq/kg de bicarbonato de sódio como dosagem inicial, seguidos de dosagens criteriosas. Erro comum é o emprego desta solução alcalina em excesso, que pode aumentar muito a osmolaridade do sangue, dificultando as trocas celulares, ou, ainda, induzir arritmias cardíacas pela alcalose metabólica. O bicarbonato de sódio é, universalmente, o elemento utilizado para tratar a acidose metabólica na parada cardíaca. Tem sido estudada a utilização do tampão TRIS (THAM), que teria a vantagem de não ser doador de gás carbônico e não necessitar de hiperventilações, além de sua provável ação superior nas correções das acidoses intracelulares. Como não se observa a utilização rotineira do tampão TRIS, pode-se inferir que, em termos de custo-benefício, não deva haver grandes vantagens sobre o uso do bicarbonato de sódio, Tratamento da alcalose metabólica Reposição de cloretos, acetazolamida, cloridrato de arginina, HCl (0,1N), NH 4 Cl (?). Desde os anos setenta, a utilização do cloridrato de arginina foi utilizado no Centro de Terapia Intensiva do Hospital das Clínicas de Ribeirão Preto. A sua administração era empírica (7,5 g/12 horas), uma vez que só a sua fração catabolizada seria acidificante. Conseguiam-se reversões parciais da alcalose metabólica, que se recuperava algumas horas depois. Com o tempo, passou-se a utilizar mais a reposição de cloreto de potássio em associação com a acetazolamida, a qual, inibindo a anidrase carbônica, aumenta a excreção urinária de bicarbonato. A experiência com HCl foi pequena e nunca se utilizou o NH 4 Cl por ser neurotóxico. 2.5 Efeitos deletérios dos distúrbios do EAB Tanto a acidose como a alcalose apresentam uma série de efeitos indesejáveis, que devem ser de pleno conhecimento, e estão representados nas Tabelas III e IV. Tabela III - Efeitos deletérios da acidose aguda - Sobrecarga respiratória. - Anorexia, náuseas, vômitos e alterações neurológicas. - Hiperpotassemia. - Diminuição da responsividade às catecolaminas e depressão da contratilidade miocárdica. - Vasoconstrição renal e oligúria. - Resistência à ação da insulina. Tabela IV - Efeitos deletérios de alcalose aguda - Hipocalcemia por diminuição do cálcio ionizável. - Hipopotassemia com aumento da perda urinária de K +. - Alteração da relação K + intracelular/ K + extracelular no miocárdio, com susceptibilidade a arritmias - Aumento da afinidade da Hb pelo O 2 (desvio da curva de dissociação para a esquerda), com hipóxia tecidual. - Acidose paradoxal do líquor, com piora das condições neurológicas. A alcalose metabólica, cuja importância clínica costuma ser relegada a um plano secundário, merece um lugar de destaque entre os possíveis distúrbios da homeostase do paciente gravemente enfermo e daqueles submetidos a grandes cirurgias. Além de aumentar a afinidade da Hb pelo 0 2, tem-se dado importância à alcalose metabólica como causa de arritmia cardíaca, principalmente à supraventricular, que não apresenta boa resposta aos antiarrítmicos convencio- 465
16 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia nais, admitindo-se, inclusive, a ocorrência de morte súbita e sua correlação com aumento da mortalidade em pacientes graves. A Figura 3 apresenta um resumo das possibilidades diagnósticas e terapêuticas dos distúrbios do EAB. Este quadro, associado ao Nomograma de West (pco 2 / po 2 ), resume grande parte dos conhecimentos utilizados na prática clínica diária Exercícios gasométricos Apresentam-se, a seguir, exemplos comentados de gasometrias arteriais que mais ocorrem na prática médica. É evidente que a gasometria é um exame complementar que deve ser analisado dentro do quadro clínico apresentado pelo paciente. Esta parte do texto tem apenas a finalidade de ajudar na interpretação prática da gasometria arterial. Os diagnósticos e as condutas serão baseados nas Figuras 1 e 3. Caso 1 ph = 7,30; p0 2 = 86; pco 2 = 39; HCO 3 - = 18,12; BE= -7,5. Diagnóstico: ausência de alterações respiratórias e acidose metabólica leve. DIAGNÓSTICO Conduta: acidoses com BE até 7-8 sem sobrecarga respiratória não necessitam de tratamento, ocorrendo compensação pelo próprio organismo. Observar que o valor do ph está abaixo do normal. No exemplo, não se observam os mecanismos de compensação respiratória, e ele é bastante observado nas acidoses do jejum pré-operatório. Caso 2 ph = 7,42; p0 2 = 99; pco 2 = 21,39; HCO - 3 = 18,12; BE= -8,0 Diagnóstico: acidose metabólica compensada por alcalose respiratória. Conduta: esta é uma resposta natural do organismo, ou seja, a hiperventilação para eliminação indireta H +. Apesar do BE ser semelhante ao do caso 1, neste caso, deve-se tratar a acidose, pois esta deve ser importante a ponto de desencadear os mecanismos respiratórios de compensação, que, no exemplo apresentado foi, inclusive, capaz de normalizar o ph. Caso 3 ph = 7,61; p0 2 = 91; pco 2 = 4 1; HCO - 3 = 39,81; BE= + 18 Diagnóstico: ausência de alterações respiratórias e alcalose metabólica. TRATAMENTO 1. PO2 e PCO2, Hiperventilação Alcalose respiratória Hipoventilação, sedação Aumento do espaço morto IMV COMPONENTE RESPIRATÓRIO (Pulmões) Hipoventilação 2. PO2 e PCO2 Ventilação adequada Acidose respiratória 3. PO2 e PCO2 Alterações da V/Q Alteração da difusão shunts A-V Respirador volumétrico, IMV + PEEP Restrição de líquidos, Diuréticos, diálise Antibióticos, Corticóide COMPONENTE NÃO RESPIRA- TÓRIO (Rins) 1. HCO3 - e BE < - 3,5 Acidose metabólica 2. HCO3 - e BE > + 3,5 Alcalose metabólica (Fórmula de Meleengard-Astrup) NaHCO 3 (0,3 x peso (Kg) x BE 2 a 3 Cloretos (KCl), Acetazolamida cloridrato de arginina, HCl 0,1 N Figura 3 - Resumo das possibilidades diagnósticas e terapêuticas dos distúrbios do equilíbrio acidobásico. 466
17 EAB e EHE Conduta: uma boa parte das alcaloses metabólicas estão associadas a hipopotassemia e/ou hipocloremia, portanto, estes íons devem ser dosados no plasma.caso estejam normais, optar por outro agente acidificante: HCI 0,1 a 0,2 N, cloridrato de arginina. Lembrar que a acetazolamida é de grande utilidade no tratamento das alcaloses de adição e que o cloreto de amônio tem seu uso limitado pela neurotoxidade. Caso 4 ph = 7,29; p0 2 = 60; pco 2 = 57; HCO - 3 = 26,5; BE= -1 Diagnóstico: acidose respiratória sem alterações metabólicas. Conduta: esta gasometria pode ser perfeitamente aceitável para um paciente portador de doença pulmonar obstrutiva crônica. Caso não se trate de um paciente enfisematoso, deve-se buscar a causa da hipoventilação e tratá-la por meio de uma ventilação adequada. Caso 5: - ph= 7,45; po 2 = 55; pco 2 = 61; HCO 3 = 26,5; BE = +1 9 Diagnóstico: acidose respiratória e alcalose metabólica. Conduta: devem-se tratar ambos os desvios do equilíbrio acidobásico. Comumente interpreta-se o presente quadro gasométrico como acidose respiratória compensada por alcalose metabólica, o que leva a uma conduta inadequada. Costuma-se tratar os dois distúrbios, pois sabe-se que os mecanismos naturais de defesa contra a acidose são muito mais eficientes do que os mecanismos de defesa contra a alcalose. Por outro lado, se o paciente for um enfisematoso, pode-se interpretar a alcalose metabólica como uma conseqüência da hipercapnia crônica, devendo-se tratá-la com o emprego de acetazolamida. Caso 6 ph= 7,63; po 2 = 100; pco 2 = 22; HCO - 3 = 22,36; BE = + 4,5 Diagnóstico: alcalose respiratória e alcalose metabólica leve. Conduta: tratar a alcalose respiratória. Este é um distúrbio comum que ocorre com o uso de respiradores mecânicos e, no caso, poder-se-ia diminuir a freqüência respiratória ou aumentar o espaço morto. Uma vez que a p0 2 se apresenta em níveis normais, talvez não seja conveniente diminuir o volume corrente. Caso se trate de uma hiperventilação psicogênica, deve-se promover à sedação do paciente ou, se possível, fazê-lo respirar em saco fechado. Caso 7 ph = 7,30; p0 2-55; PCO2 = 18; HCO 3 - = 20,2; BE= - 4,0 Diagnóstico: sempre que houver hipóxia com hipocapnia deve-se pensar em alterações pulmonares funcionais (alteração da relação ventilação-perfusão, da difusão alveolocapilar, shunts arteriovenosos intrapulmonares). Na prática médica, até prova em contrário, trata-se de Insuficiência Respiratória Aguda do Adulto ( pulmão de choque, SARA) devido a edema pulmonar intersticial. Conduta: procurar tratar a moléstia de base, assistência respiratória com respirador volumétrico e IMV + PEEP, metilprednisolona, furosemide, diálise albumina humana, quando houver hipoproteinemia nas primeiras fase da SARA. 3. QUESTÕES DIRIGIDAS 3.1 Questões dirigidas sobre o equilíbrio hidroeletrolítico 1. Descreva sucintamente os compartimentos hídricos orgânicos. 2. Conceitos de permeabilidade, tonicidade, pressão coloidosmótica e pressão osmótica. 3. Indicadores clínicos para a realização do balanço hídrico diário no paciente cirúrgico. 4. Qual a importância das chamadas perdas para o terceiro espaço? 5. Defina desidratação. 6. Quais as causas mais comuns de desidratação? 7. Sinais e sintomas da desidratação. 8. Conduta geral na desidratação. 9. Princípios terapêuticos do edema. 10. Definição, diagnóstico e conduta da intoxicação hídrica. 11. Diagnóstico e conduta na hipernatremia. 12. Diagnóstico e conduta na hiponatremia. 13. Diagnóstico e conduta na hiperpotassemia. 14. Diagnóstico e conduta na hipopotassemia. 15. Diagnóstico e conduta na hipercalcemia. 16. Diagnóstico e conduta na hipocalcemia. 17. Diagnóstico e conduta na hipermagnesemia. 18. Diagnóstico e conduta na hipomagnesemia. 3.2 Questões dirigidas sobre o equilíbrio acidobásico 1. Quais os dois desafios básicos que os sistemas orgânicos enfrentam para a manutenção do EAB? 2. Deduza a Equação de Henderson-Hasselbalch e discuta a sua importância. 467
18 PRB Évora; CL Reis; MA Ferez; DA Conte & LV Garcia 3. Quais as características das respostas pulmonares e renais na eliminação do H +? 4. Quais as principais evidências de que o organismo animal possui mecanismos naturais de defesa contra a acidose mais eficientes do que os mecanismos contra a alcalose? 5. Como pode ser dividido o sistema-tampão do organismo. 6. Qual o conceito de reserva alcalina? 7. Qual o conceito de Base Excess? 8. Qual o conceito de Anion gap e qual a sua importância? 9. Quais os principais diagnósticos dos distúrbios do EAB com base na gasometria arterial? 10. Represente e descreva o nomograma po 2 /pco 2 (West). Qual a sua importância prática? 11. Qual a importância da amostra venosa? 12. Cite os principais fatores que podem, potencial- mente, alterarem os valores da gasometria? 13. Cite quais as principais causas da acidose respiratória. 14. Cite as principais causas da alcalose respiratória. 15. Cite as principais causas da acidose metabólica. 16. Cite as principais causas da alcalose metabólica. 17. Quais as possibilidades terapêuticas para o tratamento da acidose respiratória? 18. Quais as possibilidades terapêuticas para o tratamento da alcalose respiratória? 19. Quais as possibilidades terapêuticas para o tratamento da SARA? 20. Quais as possibilidades terapêuticas para o tratamento da acidose metabólica? 21. Quais as possibilidades terapêuticas para o tratamento da alcalose metabólica? 22. Quais os principais efeitos deletérios da acidose? 23. Quais os principais efeitos deletérios da alcalose? EVORA PRB; REIS CL; FEREZ MA; CONTE DA & GARCIA LV. Fluid, electrolyte and acid-base disorders. A practical review. Medicina, Ribeirão Preto, 32: , oct./dec ABSTRACT: Fluid, electrolyte and acid-base disorders are very important subjects for all medical specialties. But their practical learning is, sometimes, very difficult. This text intends to discuss this subject based on more than 20 years of didatic experience teaching medical students, medical residents and post-doctoral students. The text has only didatic pretensions without any academic purpose. UNITERMS: Fluid. Water. Electrolytes. Acidosis. Alkalosis. Acid-base Equilibrium. Water- Eletrolyte Balance. BIBLIOGRAFIA CONSULTADA 1 - AMERICAN COLLEGE OF SURGEONS. Assistência cirúrgica intensiva: Comitê de cuidados pré e pós-operatórios. Interamericana, Rio de Janeiro, EVORA PRB. Tópicos em terapia intensiva. Associação dos Médicos Residentes de Ribeirão Preto e Centro Acadêmico Rocha Lima da Faculdade de Medicina de Ribeirão Preto USP, Ribeirão Preto, EVORA PRB; REIS CL; RIBEIRO PJF; BRASIL JCF; OTAVIANO AG & SILVA JRP. Alcalose metabólica. tratamento com solução da aminoácidos contendo cloridrato de arginina. Rev Paul Med 97: 25-28, EVORA PRB; RIBEIRO PJF; BRASIL JCF; SILVA JRP; OTAVIANO AG & REIS CL. Alcalose metabólica hipoclorêmica. Tratamento pela reposição do cloro por via retal. J Pediatr 50: , EVORA PRB. Aspectos práticos sobre o equilíbrio ácidobásico do sangue. Rev Bras Anestesiol 32: , EVORA PRB. Treatment of the hypocloremic metabolic alkalosis by rectal infusion of chloride. (Letter). Crit Care Med 13: 874, EVORA PRB; BONGIOVANI HL; RIBEIRO PJF; BRASIL JCF; OTAVIANO AG & BOMBONATO R. Alcalose metabólica no posoperatório de cirurgia cardíaca com circulação extracorpórea: Importância do emprego de solução de Ringer-Lactato e do sangue citratado. Rev Paul Med 103: 88-91, EVORA PRB. Equilíbrio acidobásico. Klinikos 2: 26-40, FAINTUCH J; BIROLINI D & MACHADO AC. Equilíbrio ácido-básico na prática clínica. Manole, São Paulo, MAXWELL MH & KLEEMAN CR. Clínica das alterações eletrolíticas. 3 a ed. Guanabara-Koogan, Rio de Janeiro,
19 EAB e EHE 11 - MOORE ME. Manual de emergências médicas. Manole, São Paulo, NAKAO RM; FREITAS JNA; PORTO ALEGRE EM; SILVA JF & EVORA PRB. Aspectos práticos sobre os eletrólitos e coração. Rev Soc Cardiol, Ribeirão Preto, 5 (1/4): 9-16, PARSONS PE & WIENER-KRONISH JP. Critical care secrets. Hanley & Belfus, Philadelphia ROOTH G. Introdução ao equilíbrio ácido-básico e eletrolítico, Atheneu, Rio de Janeiro, SCHUMER W & NIHUS LM. Tratamento do choque. Manole, São Paulo, TIERNEY LM; MC PHEE SJ; PAPADAKIS MA & SCHROEDER AS. Current diagnosis & therapeutics. Appleton & Lange, New York, TRUNIGER B. Equilíbrio hidro-eletrolítico. Diagnóstico e Terapêutica. E.P.U, São Paulo, TULLER MA. Acid-base homeostasis and its disorders. Medical Examination Publishing Company, Flushing, NY, WEST JB. Fisiopatologia pulmonar moderna. Manole, São Paulo, POTTER PA & PERRY AG. Grande tratado de enfermagem prática. Clínica e prática hospitalar. São Paulo, Livraria Santos Editora, Recebido para publicação em 07/04/99 Aprovado para publicação em 05/11/99 469
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE
 Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO. Prof. Fernando Ramos Gonçalves -Msc
 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG
 Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
21/07/14. Processos metabólicos. Conceitos Básicos. Respiração. Catabolismo de proteínas e ácidos nucleicos. Catabolismo de glicídios
 Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Desequilíbrio Hidroeletrolítico. Prof.º Enfº. Esp. Diógenes Trevizan
 Desequilíbrio Hidroeletrolítico Prof.º Enfº. Esp. Diógenes Trevizan Muitos pacientes que dão entrada na unidade de atendimento de urgência podem ter o equilíbrio hidroeletrolítico comprometido em função
Desequilíbrio Hidroeletrolítico Prof.º Enfº. Esp. Diógenes Trevizan Muitos pacientes que dão entrada na unidade de atendimento de urgência podem ter o equilíbrio hidroeletrolítico comprometido em função
Alterações do equilíbrio hídrico Alterações do equilíbrio hídrico Desidratação Regulação do volume hídrico
 Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
Regulação do volume hídrico Alteração do equilíbrio hídrico em que a perda de líquidos do organismo é maior que o líquido ingerido Diminuição do volume sanguíneo Alterações do equilíbrio Hídrico 1. Consumo
Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent
![Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent](/thumbs/50/27125458.jpg) Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
BIOQUÍMICA II SISTEMAS TAMPÃO NOS ORGANISMOS ANIMAIS 3/1/2012
 BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS
 SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
EXAMES COMPLEMENTARES GASOMETRIA GASOMETRIA ARTERIAL EQUILÍBRIO ÁCIDO - BÁSICO EQUILÍBRIO ÁCIDO - BÁSICO
 GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
Sistema Urinário. Patrícia Dupim
 Sistema Urinário Patrícia Dupim Insuficiência Renal Ocorre quando os rins não conseguem remover os resíduos metabólicos do corpo. As substância normalmente eliminadas na urina acumulam-se nos líquidos
Sistema Urinário Patrícia Dupim Insuficiência Renal Ocorre quando os rins não conseguem remover os resíduos metabólicos do corpo. As substância normalmente eliminadas na urina acumulam-se nos líquidos
Hidroclorotiazida. Diurético - tiazídico.
 Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
Hidroclorotiazida Diurético - tiazídico Índice 1. Definição 2. Indicação 3. Posologia 4. Contraindicação 5. Interação medicamentosa 1. Definição A Hidroclorotiazida age diretamente sobre os rins atuando
ph do sangue arterial = 7.4
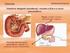 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Lembrando. Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico
 GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
Eletrólitos na Nutrição Parenteral
 Unesp Eletrólitos na Nutrição Parenteral Sergio A R Paiva Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da
Unesp Eletrólitos na Nutrição Parenteral Sergio A R Paiva Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da NP Mecânicas Infecciosas Distúrbios metabólicos Complicações da
Equilíbrio ácido-básico. Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF
 Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Drogas que atuam no sistema cardiovascular, respiratório e urinário
 Drogas que atuam no sistema cardiovascular, respiratório e urinário Drogas que atuam no sistema cardiovascular As principais classes terapêuticas: 1. Antihipertensivos 2. Antiarrítmicos 3. Antianginosos
Drogas que atuam no sistema cardiovascular, respiratório e urinário Drogas que atuam no sistema cardiovascular As principais classes terapêuticas: 1. Antihipertensivos 2. Antiarrítmicos 3. Antianginosos
Homeostase do potássio, cálcio e fosfato
 Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Homeostase do potássio, cálcio e fosfato Regulação dos eletrólitos Homeostase do potássio Intracellular ADP ATP P Extracellular Hipocalemia: baixo Repolarização mais lenta do potencial de membrana. - Fraqueza
Reconhecendo os agravos clínicos em urgência e emergência. Prof.º Enfº. Diógenes Trevizan
 Reconhecendo os agravos clínicos em urgência e emergência Prof.º Enfº. Diógenes Trevizan Cuidando do cliente com agravos respiratórios em urgência e emergência Introdução Em atenção às urgências, a insuficiência
Reconhecendo os agravos clínicos em urgência e emergência Prof.º Enfº. Diógenes Trevizan Cuidando do cliente com agravos respiratórios em urgência e emergência Introdução Em atenção às urgências, a insuficiência
FISIOLOGIA GERAL INTRODUÇÃO
 FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
FISIOLOGIA GERAL INTRODUÇÃO FISIOLOGIA Fisiologia (do grego physis = natureza, função ou funcionamento; e logos =estudo) A fisiologia: - estuda as funções mecânicas, físicas e bioquímicas nos seres vivos.
Distúrbios do equilíbrio ácido básico. Fisiologia do equilíbrio ácido básico (6,80) 7,35 7,45 (7,80)
 Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
21/07/14' ! Dinâmica da água e eletrólitos no organismo! Água x Peso
 Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br! Dinâmica da água e eletrólitos no organismo! Água x Peso Neonato 75% Adulto 66% Idoso 60% 40% Intracelular 20% Extracelular
Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br! Dinâmica da água e eletrólitos no organismo! Água x Peso Neonato 75% Adulto 66% Idoso 60% 40% Intracelular 20% Extracelular
Distúrbios Ácido Básicos
 Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
CASO CLÍNICO. O fim do mundo está próximo José Costa Leite Juazeiro do Norte Ceará
 CASO CLÍNICO Leitor nosso mundo velho Já está vai ou não vai Uma banda pendurada E a outra cai não cai Daqui pro fim da era Nada de bom se espera Vem castigos de Deus Pai O fim do mundo está próximo José
CASO CLÍNICO Leitor nosso mundo velho Já está vai ou não vai Uma banda pendurada E a outra cai não cai Daqui pro fim da era Nada de bom se espera Vem castigos de Deus Pai O fim do mundo está próximo José
CONHECIMENTO ESPERADO
 REPOSIÇÃO VOLÊMICA GABRIEL MAGALHÃES NUNES GUIMARÃES, GABRIEL@GABRIEL.MED.BR DISPONÍVEL EM WWW.ANESTESIOLOGIAUNB.COM.BR AULA DA DISCIPLINA BASES DA ANESTESIOLOGIA UNIVERSIDADE DE BRASÍLIA, 2017 CONHECIMENTO
REPOSIÇÃO VOLÊMICA GABRIEL MAGALHÃES NUNES GUIMARÃES, GABRIEL@GABRIEL.MED.BR DISPONÍVEL EM WWW.ANESTESIOLOGIAUNB.COM.BR AULA DA DISCIPLINA BASES DA ANESTESIOLOGIA UNIVERSIDADE DE BRASÍLIA, 2017 CONHECIMENTO
DISTÚRBIOS DO SÓDIO E DO POTÁSSIO
 DISTÚRBIOS DO SÓDIO E DO POTÁSSIO HIPONATREMIA Dosagem de sódio ( Na ) sérico < 130mEq/L Oferta hídrica aumentada; Baixa oferta de sódio; Redistribuição osmótica de água ( p.ex. hiperglicemia); Excreção
DISTÚRBIOS DO SÓDIO E DO POTÁSSIO HIPONATREMIA Dosagem de sódio ( Na ) sérico < 130mEq/L Oferta hídrica aumentada; Baixa oferta de sódio; Redistribuição osmótica de água ( p.ex. hiperglicemia); Excreção
Controle da Osmolalidade dos Líquidos Corporais. Prof. Ricardo Luzardo
 Controle da Osmolalidade dos Líquidos Corporais Prof. Ricardo Luzardo Osmolalidade é uma função do número total de partículas em solução, independente de massa, carga ou composição química. As partículas
Controle da Osmolalidade dos Líquidos Corporais Prof. Ricardo Luzardo Osmolalidade é uma função do número total de partículas em solução, independente de massa, carga ou composição química. As partículas
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Fisioterapia em Terapia Intensiva
 Ácidos e Bases Fisioterapia em Terapia Intensiva ÁCIDO moléculas que contem átomos de hidrogênio capazes de liberar íons de hidrogênio. HCl H + + Cl BASE molécula que pode aceitar um íon de hidrogênio
Ácidos e Bases Fisioterapia em Terapia Intensiva ÁCIDO moléculas que contem átomos de hidrogênio capazes de liberar íons de hidrogênio. HCl H + + Cl BASE molécula que pode aceitar um íon de hidrogênio
Fisiologia do Sistema Urinário
 Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Aula 05 DIABETES MELLITUS (DM) Definição CLASSIFICAÇÃO DA DIABETES. Diabetes Mellitus Tipo I
 Aula 05 DIABETES MELLITUS (DM) Definição O diabetes surge de um distúrbio na produção ou na utilização da insulina por isso é considerado um distúrbio endócrino provocado pela falta de produção ou de ação
Aula 05 DIABETES MELLITUS (DM) Definição O diabetes surge de um distúrbio na produção ou na utilização da insulina por isso é considerado um distúrbio endócrino provocado pela falta de produção ou de ação
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Distúrbios Hidroeletrolíticos. Hiponatremia - I
 Distúrbios Hidroeletrolíticos Hiponatremia - I Déficit de H 2 O corporal total e déficit maior de Na + corporal total Excesso de H 2 O corporal total Excesso de Na + corporal total. Excesso mais acentuado
Distúrbios Hidroeletrolíticos Hiponatremia - I Déficit de H 2 O corporal total e déficit maior de Na + corporal total Excesso de H 2 O corporal total Excesso de Na + corporal total. Excesso mais acentuado
Profa Maria Clorinda EV/UFG
 Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
Escola de Veterinária e Zootecnia da UFG Departamento de Medicina Veterinária Maria Clorinda Soares Fioravanti (clorinda@vet.ufg.br) Disciplina: Clínica Médica de Pequenos Animais Profa Maria Clorinda
ALCALOSES 1. Introdução HA H + +A -.
 ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
HIPERÊMESE GRAVÍDICA. Msc. Roberpaulo Anacleto
 HIPERÊMESE GRAVÍDICA Msc. Roberpaulo Anacleto Introdução A ocorrência ocasional de náuseas e vômitos até 14 semanas de gestação, mais comum no período da manhã, é rotulada como êmese gravídica e pode ser
HIPERÊMESE GRAVÍDICA Msc. Roberpaulo Anacleto Introdução A ocorrência ocasional de náuseas e vômitos até 14 semanas de gestação, mais comum no período da manhã, é rotulada como êmese gravídica e pode ser
BIOQUÍMICA E METABOLISMO DOS MICRONUTRIENTES NA TERAPIA NUTRICIONAL ENTERAL E PARENTERAL
 BIOQUÍMICA E METABOLISMO DOS MICRONUTRIENTES NA TERAPIA NUTRICIONAL ENTERAL E PARENTERAL Profa. Dra. Maria Rosimar Teixeira Matos Docente do Curso de Nutrição da UECE TERAPIA NUTRICIONAL Suprir as necessidades
BIOQUÍMICA E METABOLISMO DOS MICRONUTRIENTES NA TERAPIA NUTRICIONAL ENTERAL E PARENTERAL Profa. Dra. Maria Rosimar Teixeira Matos Docente do Curso de Nutrição da UECE TERAPIA NUTRICIONAL Suprir as necessidades
Tetania da. Lactação e das. Pastagens
 Tetania da Lactação e das Pastagens Tetania da Lactação e das Pastagens Hipomagnesemia Conjunto de fatores: Desequilíbrio da ingestão e excreção de Mg Estresse - esteróides endógenos Cátions com ação neuromuscular
Tetania da Lactação e das Pastagens Tetania da Lactação e das Pastagens Hipomagnesemia Conjunto de fatores: Desequilíbrio da ingestão e excreção de Mg Estresse - esteróides endógenos Cátions com ação neuromuscular
Reposição Volêmica. Paulo do Nascimento Junior. Departamento de Anestesiologia da Faculdade de Medicina de Botucatu
 Paulo do Nascimento Junior Departamento de Anestesiologia da Faculdade de Medicina de Botucatu Tipo e Quantidade de Fluido condições clínicas do paciente tipo e duração da cirurgia objetivos da reposição
Paulo do Nascimento Junior Departamento de Anestesiologia da Faculdade de Medicina de Botucatu Tipo e Quantidade de Fluido condições clínicas do paciente tipo e duração da cirurgia objetivos da reposição
CONCEITO FALHA CIRCULATÓRIA HIPOPERFUSÃO HIPÓXIA
 Urgência e Emergência Prof.ª André Rodrigues CONCEITO FALHA CIRCULATÓRIA HIPOPERFUSÃO HIPÓXIA 1 FISIOPATOLOGIA MORTE CELULAR 2 MECANISMOS COMPENSATÓRIOS AUMENTO DA ATIVIDADE SIMPÁTICA 3 COMPENSAÇÃO RESPIRATÓRIA
Urgência e Emergência Prof.ª André Rodrigues CONCEITO FALHA CIRCULATÓRIA HIPOPERFUSÃO HIPÓXIA 1 FISIOPATOLOGIA MORTE CELULAR 2 MECANISMOS COMPENSATÓRIOS AUMENTO DA ATIVIDADE SIMPÁTICA 3 COMPENSAÇÃO RESPIRATÓRIA
26/10/2018. A osmolaridade pode ser entendida como a proporção entre solutos e água de uma solução.
 COMPOSIÇÃO IÔNICA DOS LÍQUIDOS CORPORAIS HUMANOS Soluto Líquido extracelular Líquido intracelular Na + (meq/l) 145 12 K + (meq/l) 4 150 Ca 2+ (meq/l) 5 0,001 Cl - (meq/l) 105 5 HCO 3- (meq/l) 25 12 Pi
COMPOSIÇÃO IÔNICA DOS LÍQUIDOS CORPORAIS HUMANOS Soluto Líquido extracelular Líquido intracelular Na + (meq/l) 145 12 K + (meq/l) 4 150 Ca 2+ (meq/l) 5 0,001 Cl - (meq/l) 105 5 HCO 3- (meq/l) 25 12 Pi
Urgência e Emergência
 Urgência e Emergência CHOQUE Choque Um estado de extrema gravidade que coloca em risco a vida do paciente. Dica: Em TODOS os tipos de choques ocorre a queda da pressão arterial e, consequentemente, um
Urgência e Emergência CHOQUE Choque Um estado de extrema gravidade que coloca em risco a vida do paciente. Dica: Em TODOS os tipos de choques ocorre a queda da pressão arterial e, consequentemente, um
Regulação renal do equilíbrio ácido base
 Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA
 METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA Prof. José Aroldo Filho goncalvesfilho@nutmed.com.br ÁGUA CORPORAL A água e eletrólitos são componentes essenciais do meio interno do organismo. São
METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA Prof. José Aroldo Filho goncalvesfilho@nutmed.com.br ÁGUA CORPORAL A água e eletrólitos são componentes essenciais do meio interno do organismo. São
GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO. interpretação
 TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
TRABALHO DE CONCLUSÃO DE CURSO GASOMETRIA ARTERIAL- ARTIGO DE REVISÃO interpretação Dra Leticia Godoy Dias Sanderson Porto Ferreira, fevereiro 2012 Resumo O objetivo do estudo é identificar na literatura
Tampão. O que é? MISTURA DE UM ÁCIDO FRACO COM SUA BASE CONJUGADA, QUE ESTABILIZA O P H DE UMA SOLUÇÃO
 Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Problemas Endócrinos
 Problemas Endócrinos Diabetes O que é Diabetes? É uma deficiência do organismo no aproveitamento do açucar. Isto ocorre devido a falha total ou parcial de um hormônio chamado insulina. DIABETES MELLITUS
Problemas Endócrinos Diabetes O que é Diabetes? É uma deficiência do organismo no aproveitamento do açucar. Isto ocorre devido a falha total ou parcial de um hormônio chamado insulina. DIABETES MELLITUS
DISTÚRBIOS HIDROELETROLÍTICOS HIPONATREMIA - I
 DISTÚRBIOS HIDROELETROLÍTICOS HIPONATREMIA - I Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Excesso de Na
DISTÚRBIOS HIDROELETROLÍTICOS HIPONATREMIA - I Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Déficit de H 2 O Corporal total e déficit maior de Na + corporal total Excesso de Na
Cerca de 60% do peso de um homem adulto e de 50% do de uma mulher adulta são constituídos de água (42 L em um homem de 70 kg). Desse total, 2/3 (28
 Cerca de 60% do peso de um homem adulto e de 50% do de uma mulher adulta são constituídos de água (42 L em um homem de 70 kg). Desse total, 2/3 (28 L) situam-se no compartimento intracelular e 1/3 (14
Cerca de 60% do peso de um homem adulto e de 50% do de uma mulher adulta são constituídos de água (42 L em um homem de 70 kg). Desse total, 2/3 (28 L) situam-se no compartimento intracelular e 1/3 (14
METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA
 METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA Prof. José Aroldo Filho goncalvesfilho@nutmed.com.br ÁGUA CORPORAL A água e eletrólitos são componentes essenciais do meio interno do organismo. São
METABOLISMO DE ÁGUA E ELETRÓLITOS NA SAÚDE E NA DOENÇA Prof. José Aroldo Filho goncalvesfilho@nutmed.com.br ÁGUA CORPORAL A água e eletrólitos são componentes essenciais do meio interno do organismo. São
Água o componente fundamental!
 Ms. Sandro de Souza Água o componente fundamental! Claude Bernard, no século XIX, foi o primeiro fisiologista a elucidar a quantidade de líquidos no corpo humano. Posteriormente os líquidos foram compartimentalizados
Ms. Sandro de Souza Água o componente fundamental! Claude Bernard, no século XIX, foi o primeiro fisiologista a elucidar a quantidade de líquidos no corpo humano. Posteriormente os líquidos foram compartimentalizados
Problemas Endócrinos. Prof.º Enf.º Esp. Diógenes Trevizan
 Problemas Endócrinos Prof.º Enf.º Esp. Diógenes Trevizan Pâncreas Produz um hormônio chamado insulina que é fundamental para a manutenção da vida. As células alfa são células endócrinas nas ilhotas de
Problemas Endócrinos Prof.º Enf.º Esp. Diógenes Trevizan Pâncreas Produz um hormônio chamado insulina que é fundamental para a manutenção da vida. As células alfa são células endócrinas nas ilhotas de
Cetoacidose Diabética
 Cetoacidose Diabética Introdução A Cetoacidose diabética (CAD) é a complicação aguda do Diabetes Mellitus mais clássica e, embora não seja a mais comum (perde para hipoglicemia), é de longe a mais cobrada
Cetoacidose Diabética Introdução A Cetoacidose diabética (CAD) é a complicação aguda do Diabetes Mellitus mais clássica e, embora não seja a mais comum (perde para hipoglicemia), é de longe a mais cobrada
FISIOTERAPIA PREVENTIVA
 FISIOTERAPIA PREVENTIVA DIABETES MELLITUS APOSTILA 5 DEFINIÇÃO É um distúrbio crônico, caracterizado pelo comprometimento do metabolismo da glicose e de outras substâncias produtoras de energia, bem como
FISIOTERAPIA PREVENTIVA DIABETES MELLITUS APOSTILA 5 DEFINIÇÃO É um distúrbio crônico, caracterizado pelo comprometimento do metabolismo da glicose e de outras substâncias produtoras de energia, bem como
Disciplina Fisiologia veterinária I (VET 302)
 Disciplina Fisiologia veterinária I (VET 302) Prof. Bruna Waddington de Freitas Médica Veterinária bruna.freitas@ufv.br 1 Bibliografia Básica REECE, W. O. Dukes Fisiologia dos Animais Domésticos. 12 a
Disciplina Fisiologia veterinária I (VET 302) Prof. Bruna Waddington de Freitas Médica Veterinária bruna.freitas@ufv.br 1 Bibliografia Básica REECE, W. O. Dukes Fisiologia dos Animais Domésticos. 12 a
Manutenção do ph do sangue
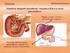 Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
3) Complicações agudas do diabetes
 73 3) Complicações agudas do diabetes Hiperglicemias As emergências hiperglicêmicas do diabetes melitus são classificadas em: cetoacidose diabética (CAD) e estado hiperglicêmico hiperosmolar (EHH), que
73 3) Complicações agudas do diabetes Hiperglicemias As emergências hiperglicêmicas do diabetes melitus são classificadas em: cetoacidose diabética (CAD) e estado hiperglicêmico hiperosmolar (EHH), que
EQUILÍBRIO ÁCIDO-BASE
 Medicina, Ribeirão Preto, Simpósio: FUNDAMENTOS EM CLÍNICA CIRÚRGICA - 1ª Parte 2008; 41 (3): 301-11 Capítulo VI EQUILÍBRIO ÁCIDO-BASE ACID-BASE BALANCE Paulo Roberto Barbosa Évora 1, Luis Vicente Garcia
Medicina, Ribeirão Preto, Simpósio: FUNDAMENTOS EM CLÍNICA CIRÚRGICA - 1ª Parte 2008; 41 (3): 301-11 Capítulo VI EQUILÍBRIO ÁCIDO-BASE ACID-BASE BALANCE Paulo Roberto Barbosa Évora 1, Luis Vicente Garcia
Biofísica renal. Estrutura e função dos rins
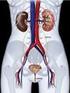 Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Sepse Professor Neto Paixão
 ARTIGO Sepse Olá guerreiros concurseiros. Neste artigo vamos relembrar pontos importantes sobre sepse. Irá encontrar de forma rápida e sucinta os aspectos que você irá precisar para gabaritar qualquer
ARTIGO Sepse Olá guerreiros concurseiros. Neste artigo vamos relembrar pontos importantes sobre sepse. Irá encontrar de forma rápida e sucinta os aspectos que você irá precisar para gabaritar qualquer
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO. Profa. Dra. Celene Fernandes Bernardes
 TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Lesão Renal Aguda. Revista Qualidade HC. Autores e Afiliação: Área: Objetivos: Definição / Quadro Clínico:
 Lesão Renal Aguda Autores e Afiliação: Caio Pereira Miarelli. Ex-Médico Residente Cínica Médica do HCFMRP USP; Dr. Gustavo Frezza. Médico Assistente da Divisão de Nefrologia; Dra. Valéria Takeuchi Okino.
Lesão Renal Aguda Autores e Afiliação: Caio Pereira Miarelli. Ex-Médico Residente Cínica Médica do HCFMRP USP; Dr. Gustavo Frezza. Médico Assistente da Divisão de Nefrologia; Dra. Valéria Takeuchi Okino.
Impact Factor: 1,75. Gabriela Bueno Luz Maria Amélia A. Weiller Vinicius Copes
 Impact Factor: 1,75 Gabriela Bueno Luz Maria Amélia A. Weiller Vinicius Copes Fósforo Função estrutural em tecidos Metabolismo de células Rigidez óssea Equilíbrio ácido-base DNA e RNA Algumas definições
Impact Factor: 1,75 Gabriela Bueno Luz Maria Amélia A. Weiller Vinicius Copes Fósforo Função estrutural em tecidos Metabolismo de células Rigidez óssea Equilíbrio ácido-base DNA e RNA Algumas definições
REPOSIÇÃO VOLÊMICA. Dr. Adriano Carvalho Médico do CTI HC UFMG Especialista em Medicina de Cuidados Intensivos
 REPOSIÇÃO VOLÊMICA Dr. Adriano Carvalho Médico do CTI HC UFMG Especialista em Medicina de Cuidados Intensivos Objetivo: Manter Débito Cardíaco adequado, mantendo pressões de enchimento dos ventrículos
REPOSIÇÃO VOLÊMICA Dr. Adriano Carvalho Médico do CTI HC UFMG Especialista em Medicina de Cuidados Intensivos Objetivo: Manter Débito Cardíaco adequado, mantendo pressões de enchimento dos ventrículos
10anos. Jose Roberto Fioretto
 198 10 1988 1988 1998 10anos Jose Roberto Fioretto jrf@fmb.unesp.br Professor Adjunto-Livre Docente Disciplina de Medicina Intensiva Pediátrica Faculdade de Medicina de Botucatu-UNESP Metabolismo do K
198 10 1988 1988 1998 10anos Jose Roberto Fioretto jrf@fmb.unesp.br Professor Adjunto-Livre Docente Disciplina de Medicina Intensiva Pediátrica Faculdade de Medicina de Botucatu-UNESP Metabolismo do K
FLUIDOTERAPIA E HEMODINÂMICA EM CÃES E GATOS
 FLUIDOTERAPIA E HEMODINÂMICA EM CÃES E GATOS Professora: Dra. Juliana Peloi Vides 08/02/2018 OBJETIVOS Compreender desidratação x hipovolemia Repor déficits por desidratação Escolha da solução cristaloide
FLUIDOTERAPIA E HEMODINÂMICA EM CÃES E GATOS Professora: Dra. Juliana Peloi Vides 08/02/2018 OBJETIVOS Compreender desidratação x hipovolemia Repor déficits por desidratação Escolha da solução cristaloide
D) Como seria a correção desse distúrbio? A correção seria atuar na causa e proporcionar eliminação de CO2 por aumento da ventilação alveolar.
 Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
Exercícios de Gasometria Arterial - Gabarito Docente responsável: Profª Paula C Nogueira Para as situações abaixo, responda às seguintes questões: Considere os seguintes valores de referência: ph: 7,35-7,45
Diuréticos. Classificação da diurese. FUNÇÕES RENAIS A manutenção do meio interno através s da: Secreção de hormônios. Excreção de drogas
 Diuréticos Os diuréticos são fármacos f que tem a propriedade de causar Diuréticos aumento do volume urinário rio e cujo mecanismo é a inibição da reabsorção tubular de sódio s e água. Prof. Carlos Cezar
Diuréticos Os diuréticos são fármacos f que tem a propriedade de causar Diuréticos aumento do volume urinário rio e cujo mecanismo é a inibição da reabsorção tubular de sódio s e água. Prof. Carlos Cezar
ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL. Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal.
 1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
FISIOLOGIA DO EXERCÍCIO
 FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
BULA PACIENTE MixIstar HALEX ISTAR
 BULA PACIENTE MixIstar HALEX ISTAR SOLUÇÃO INJETÁVEL MixIstar cloreto de potássio + glicose + cloreto de sódio IDENTIFICAÇÃO DO MEDICAMENTO MixIstar 0,4%; 0,6% e 0,8% FORMA FARMACÊUTICA E APRESENTAÇÕES
BULA PACIENTE MixIstar HALEX ISTAR SOLUÇÃO INJETÁVEL MixIstar cloreto de potássio + glicose + cloreto de sódio IDENTIFICAÇÃO DO MEDICAMENTO MixIstar 0,4%; 0,6% e 0,8% FORMA FARMACÊUTICA E APRESENTAÇÕES
PROTOCOLO MÉDICO SEPSE E CHOQUE SÉPTICO
 Página: 1 de 6 1. INTRODUÇÃO: Considerar SEPSE e CHOQUE SÉPTICO quando: - Temperatura >38 C ou < 36 C - FR >20 ou paco2 12.000 ou leucopenia 10% de bastões - Hipotensão induzida
Página: 1 de 6 1. INTRODUÇÃO: Considerar SEPSE e CHOQUE SÉPTICO quando: - Temperatura >38 C ou < 36 C - FR >20 ou paco2 12.000 ou leucopenia 10% de bastões - Hipotensão induzida
PROTOCOLO MÉDICO MANEJO DO RECÉM-NASCIDO NOS PRIMEIROS DIAS DE VIDA
 Página: 1 de 8 1.Introdução: Sabendo-se que: * A grande proporção de água extracelular nos RN pré-termo dificulta ainda mais a manutenção de seu equilíbrio hídrico. * A reabsorção tubular do sódio está
Página: 1 de 8 1.Introdução: Sabendo-se que: * A grande proporção de água extracelular nos RN pré-termo dificulta ainda mais a manutenção de seu equilíbrio hídrico. * A reabsorção tubular do sódio está
Riscos da Exposição à Luz do Sol
 Riscos da Exposição à Luz do Sol Riscos à saúde fazem com que a proteção solar seja essencial no trabalho desenvolvido a céu aberto. A radiação ultravioleta (UV) está nos atingindo constantemente, proveniente
Riscos da Exposição à Luz do Sol Riscos à saúde fazem com que a proteção solar seja essencial no trabalho desenvolvido a céu aberto. A radiação ultravioleta (UV) está nos atingindo constantemente, proveniente
EQUILIBRIO HIDRICO. Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop
 EQUILIBRIO HIDRICO Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop Porque os organismos de mamíferos possuem grande quantidade de água? Alto ponto de ebulição (controle da temperatura);
EQUILIBRIO HIDRICO Prof. Dr. Rodolfo C. Araujo Berber Médico Veterinário, MSc. PhD. UFMT-Sinop Porque os organismos de mamíferos possuem grande quantidade de água? Alto ponto de ebulição (controle da temperatura);
12/03/2018 GRANDES ANIMAIS
 1 2 3 GRANDES ANIMAIS Manutenção da Vida Volume : 45% células sangüíneas 55% plasma Células : hemácias, leucócitos, plaquetas Plasma : 90% água 1% (potássio, sódio, ferro, cálcio) 7% (albumina, imunoglobulinas,
1 2 3 GRANDES ANIMAIS Manutenção da Vida Volume : 45% células sangüíneas 55% plasma Células : hemácias, leucócitos, plaquetas Plasma : 90% água 1% (potássio, sódio, ferro, cálcio) 7% (albumina, imunoglobulinas,
FLUÍDOS, ELECTROLITOS E ÁCIDO-BASE FLUÍDOS E SÓDIO. Maria do Rosário Barroso - Pós graduação em medicina de emergência
 FLUÍDOS, ELECTROLITOS E ÁCIDO-BASE FLUÍDOS E SÓDIO 1 FLUÍDOS, ELECTROLITOS E ÁCIDO-BASE I. AVALIAÇAO CLINICA Informação clínica; Avaliação da volémia e hidratação; Antecipação dos desvios esperados. II.
FLUÍDOS, ELECTROLITOS E ÁCIDO-BASE FLUÍDOS E SÓDIO 1 FLUÍDOS, ELECTROLITOS E ÁCIDO-BASE I. AVALIAÇAO CLINICA Informação clínica; Avaliação da volémia e hidratação; Antecipação dos desvios esperados. II.
MANIPULAÇÃO DE NUTRIÇÃO PARENTERAL VETERINÁRIA CLAUDETE JACYCZEN. Dezembro de 2018
 MANIPULAÇÃO DE NUTRIÇÃO PARENTERAL VETERINÁRIA CLAUDETE JACYCZEN claudetejacyczen@gmail.com Dezembro de 2018 DEGLUTIÇÃO NUTRIÇÃO DIGESTÃO METABOLISMO ABSORÇÃO NUTRIÇÃO METABOLISMO NUTRIENTES NO SANGUE
MANIPULAÇÃO DE NUTRIÇÃO PARENTERAL VETERINÁRIA CLAUDETE JACYCZEN claudetejacyczen@gmail.com Dezembro de 2018 DEGLUTIÇÃO NUTRIÇÃO DIGESTÃO METABOLISMO ABSORÇÃO NUTRIÇÃO METABOLISMO NUTRIENTES NO SANGUE
EXAMES BIOQUÍMICOS. Profa Dra Sandra Zeitoun Aula 3
 EXAMES BIOQUÍMICOS Profa Dra Sandra Zeitoun Aula 3 Íons/Eletrólitos do plasma No plasma existem diversos eletrólitos positivos: Na+, K+, Ca², Mg² E eletrólitos negativos: Cl-, HCO3-, fosfatos e proteínas.
EXAMES BIOQUÍMICOS Profa Dra Sandra Zeitoun Aula 3 Íons/Eletrólitos do plasma No plasma existem diversos eletrólitos positivos: Na+, K+, Ca², Mg² E eletrólitos negativos: Cl-, HCO3-, fosfatos e proteínas.
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO. Prof. Fernando Ramos Gonçalves -Msc
 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias; Alterações do potássio; Acidoses
Objetivos da Respiração. Prover oxigênio aos tecidos Remover o dióxido de carbono
 Anatomia e Fisiologia pulmonar Objetivos da Respiração Prover oxigênio aos tecidos Remover o dióxido de carbono PatologiasRespiratórias Mais Comuns Patologias Respiratórias Mais Comuns Insuficiência Respiratória
Anatomia e Fisiologia pulmonar Objetivos da Respiração Prover oxigênio aos tecidos Remover o dióxido de carbono PatologiasRespiratórias Mais Comuns Patologias Respiratórias Mais Comuns Insuficiência Respiratória
INSUFICIÊNCIA RESPIRATÓRIA
 Clínica Médica e Cirúrgica I INSUFICIÊNCIA RESPIRATÓRIA João Adriano de Barros Disciplina de Pneumologia Universidade Federal do Paraná Objetivos da Aula... Importância da IRA devido a sua alta mortalidade
Clínica Médica e Cirúrgica I INSUFICIÊNCIA RESPIRATÓRIA João Adriano de Barros Disciplina de Pneumologia Universidade Federal do Paraná Objetivos da Aula... Importância da IRA devido a sua alta mortalidade
SISTEMA EDUCACIONAL INTEGRADO CENTRO DE ESTUDOS UNIVERSITÁRIOS DE COLIDER Av. Senador Julio Campos, Lote 13, Loteamento Trevo Colider/MT Site:
 SISTEMA EDUCACIONAL INTEGRADO CENTRO DE ESTUDOS UNIVERSITÁRIOS DE COLIDER Av. Senador Julio Campos, Lote 13, Loteamento Trevo Colider/MT Site: www.sei-cesucol.edu.br e-mail: sei-cesu@vsp.com.br FACULDADE
SISTEMA EDUCACIONAL INTEGRADO CENTRO DE ESTUDOS UNIVERSITÁRIOS DE COLIDER Av. Senador Julio Campos, Lote 13, Loteamento Trevo Colider/MT Site: www.sei-cesucol.edu.br e-mail: sei-cesu@vsp.com.br FACULDADE
OBJETIVOS Ao final da aula os participantes terão de. Definir:
 Estado de Choque OBJETIVOS Ao final da aula os participantes terão de Definir: Estado de Choque; Classificação do Estado de Choque; Sinais e sintomas; Choque compensado / descompensado; Conduta no tratamento
Estado de Choque OBJETIVOS Ao final da aula os participantes terão de Definir: Estado de Choque; Classificação do Estado de Choque; Sinais e sintomas; Choque compensado / descompensado; Conduta no tratamento
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL
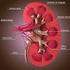 AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
CONTROLE HIDROELETROLÍTICO
 CONTROLE HIDROELETROLÍTICO Profa. Dra. Monica Akemi Sato CONCEITO DE MEIO INTERNO E SUA HOMEOSTASE MEIO INTERNO: MEIO INTERSTICIAL- VASCULAR CONCEITO DESENVOLVIDO POR CLAUDE BERNARD (1813-1878) HOMEOSTASE:
CONTROLE HIDROELETROLÍTICO Profa. Dra. Monica Akemi Sato CONCEITO DE MEIO INTERNO E SUA HOMEOSTASE MEIO INTERNO: MEIO INTERSTICIAL- VASCULAR CONCEITO DESENVOLVIDO POR CLAUDE BERNARD (1813-1878) HOMEOSTASE:
98% intracelular extracelular
 DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
DISTRIBUIÇÃO CORPORAL DE 98% intracelular extracelular 2% HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO BALANÇO INTERNO BALANÇO EXTERNO HOMEOSTASE DE POTÁSSIO BALANÇO EXTERNO vs BALANÇO INTERNO
BULA PACIENTE MixIstar HALEX ISTAR SOLUÇÃO PARA INFUSÃO
 BULA PACIENTE MixIstar HALEX ISTAR SOLUÇÃO PARA INFUSÃO (1,91 + 4 5,5 + 4) mg/ml) (1,91 + 4 5,5 + 6) mg/ml) (1,91 + 4 5,5 + 8) mg/ml) MixIstar cloreto de potássio + glicose + cloreto de sódio APRESENTAÇÕES
BULA PACIENTE MixIstar HALEX ISTAR SOLUÇÃO PARA INFUSÃO (1,91 + 4 5,5 + 4) mg/ml) (1,91 + 4 5,5 + 6) mg/ml) (1,91 + 4 5,5 + 8) mg/ml) MixIstar cloreto de potássio + glicose + cloreto de sódio APRESENTAÇÕES
Fluidoterapia. Vias de Administração. Fluidoterapia. Fluidoterapia. Fluidoterapia. Fluidoterapia. Enteral Via oral Via intra retal
 Vias de Administração Enteral Via oral Via intra retal Parenteral Via Subcutânea Via Intramuscular Via endovenosa Via Intra Óssea Via Intra Cardíaca Via Intra Traqueal Via Epidural Via Subaracnóidea Via
Vias de Administração Enteral Via oral Via intra retal Parenteral Via Subcutânea Via Intramuscular Via endovenosa Via Intra Óssea Via Intra Cardíaca Via Intra Traqueal Via Epidural Via Subaracnóidea Via
Fisiologia do Sistema Endócrino. Metabolismo do Cálcio e a Paratireóide
 Fisiologia do Sistema Endócrino Metabolismo do Cálcio e a Paratireóide Prof. Dr. Leonardo Rigoldi Bonjardim Profa. Adjunto do Depto. De Fisiologia-CCBS-UFS Material disponível em: http://www.fisiologiaufs.xpg.com.br
Fisiologia do Sistema Endócrino Metabolismo do Cálcio e a Paratireóide Prof. Dr. Leonardo Rigoldi Bonjardim Profa. Adjunto do Depto. De Fisiologia-CCBS-UFS Material disponível em: http://www.fisiologiaufs.xpg.com.br
A Bioquímica Da Célula. Alternar entre páginas 0/1 Página Anterior Próxima página
 A Bioquímica Da Célula Alternar entre páginas 0/1 Página Anterior Próxima página A importância da água em nossa vida A água é indispensável para o nosso planeta. Foi através dela que surgiram as primeiras
A Bioquímica Da Célula Alternar entre páginas 0/1 Página Anterior Próxima página A importância da água em nossa vida A água é indispensável para o nosso planeta. Foi através dela que surgiram as primeiras
Magnésio. Magnésio Funções. Magnésio Sódio Potássio. HNT 130 Nutrição normal. Organismo humano adulto
 HNT 130 Nutrição normal Funções, metabolismo, necessidades e recomendações dietéticas Organismo humano adulto 20 a 28g 60% 26% 14% Vísceras e fluidos corpóreos Funções Cofator em diversas reações enzimáticas
HNT 130 Nutrição normal Funções, metabolismo, necessidades e recomendações dietéticas Organismo humano adulto 20 a 28g 60% 26% 14% Vísceras e fluidos corpóreos Funções Cofator em diversas reações enzimáticas
Nefropatia Diabética. Caso clínico com estudo dirigido. Coordenadores: Márcio Dantas e Gustavo Frezza
 Nefropatia Diabética Caso clínico com estudo dirigido Coordenadores: Márcio Dantas e Gustavo Frezza Neste texto está descrita a apresentação clínica e a evolução ao longo de 3 décadas de caso clínico de
Nefropatia Diabética Caso clínico com estudo dirigido Coordenadores: Márcio Dantas e Gustavo Frezza Neste texto está descrita a apresentação clínica e a evolução ao longo de 3 décadas de caso clínico de
Regulação Endócrina do metabolismo do cálcio e do fosfato
 Regulação Endócrina do metabolismo do cálcio e do fosfato Profa. Letícia Lotufo Distribuição de cálcio Intracelular: 10-7 M Livre: 0,2 mg Pode aumentar de 10 a 100x Potencial de ação Contração Motilidade
Regulação Endócrina do metabolismo do cálcio e do fosfato Profa. Letícia Lotufo Distribuição de cálcio Intracelular: 10-7 M Livre: 0,2 mg Pode aumentar de 10 a 100x Potencial de ação Contração Motilidade
Universidade Federal de Pelotas Programa de Pós-Graduação em Veterinária Disciplina de Doenças metabólicas DOENÇAS METABÓLICAS
 Universidade Federal de Pelotas Programa de Pós-Graduação em Veterinária Disciplina de Doenças metabólicas DOENÇAS METABÓLICAS Lourdes Caruccio Hirschmann Julho, 2016 Transtornos relacionados ao metabolismo
Universidade Federal de Pelotas Programa de Pós-Graduação em Veterinária Disciplina de Doenças metabólicas DOENÇAS METABÓLICAS Lourdes Caruccio Hirschmann Julho, 2016 Transtornos relacionados ao metabolismo
Classificação. Diuréticos Tiazídicos Hidroclorotiazida Diuréticos de Alça Furosemida Diuréticos Poupadores de Potássio Espironolactona e Amilorida
 Diuréticos Classificação Diuréticos Tiazídicos Hidroclorotiazida Diuréticos de Alça Furosemida Diuréticos Poupadores de Potássio Espironolactona e Amilorida Diuréticos Tiazídicos Hidroclorotiazida Hidroclorotiazida:
Diuréticos Classificação Diuréticos Tiazídicos Hidroclorotiazida Diuréticos de Alça Furosemida Diuréticos Poupadores de Potássio Espironolactona e Amilorida Diuréticos Tiazídicos Hidroclorotiazida Hidroclorotiazida:
DISTÚRBIOS DO EQUILÍBRIO HIDROELETROLÍTICO. Funções Renais. Equilíbrio do Na e K EQUILÍBRIO HIDROELETROLÍTICO. Regulação da Pressão Arterial;
 Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
Renato Ribeiro Nogueira Ferraz Mestre e Doutor em Nefrologia pela Universidade Federal de São Paulo UNIFESP, com Pós Doutorado também em Nefrologia pela mesma Universidade. Organizador do livro Nefrologia:
1. O QUE É CLORETO DE SÓDIO PROAMP 20% concentrado para solução para perfusão, E PARA QUE É UTILIZADO?
 FOLHETO INFORMATIVO Leia atentamente este folheto antes de utilizar o medicamento Conserve este folheto. Pode ter necessidade de o reler. Caso tenha dúvidas, consulte o seu médico. Este medicamento foi
FOLHETO INFORMATIVO Leia atentamente este folheto antes de utilizar o medicamento Conserve este folheto. Pode ter necessidade de o reler. Caso tenha dúvidas, consulte o seu médico. Este medicamento foi
