Introdução à Bioquímica. Função das Proteínas
|
|
|
- Therezinha Casqueira Caetano
- 7 Há anos
- Visualizações:
Transcrição
1 Introdução à Bioquímica Função das Proteínas Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física.. UNESP São José do Rio Preto.. SP.
2 Tópicos! Mioglobina! Hemoglobina! Miosina e actina! Anticorpos
3 Mioglobina - Estrutura! Primeira proteína a ter sua estrutura determinada por cristalografia de raios X (1959).! Pequena proteína intracelular do músculo dos vertebrados com função de ligar oxigênio (O 2 ).! Possui 153 resíduos de aminoácidos, sendo que a maioria faz parte de oito hélices α.! Possui um único grupamento heme.
4 Mioglobina O grupo heme
5 Estrutura da mioglobina! O heme está encaixado em uma concavidade hidrofóbica! Duas cadeias laterais hidrofóbicas auxiliam na manutenção da posição do heme.! O sistema de anel heterocíclico do heme é um derivado porfirínico, contendo 4 grupos pirrólicos
6
7 Estrutura da mioglobina! O átomo de Fe(II) do grupo heme, quando exposto ao O 2 é oxidado de maneira irreversível a Fe(III), forma que não liga O 2.! A porção protéica da mioglobina impede essa oxidação e torna possível a ligação reversível do O 2 ao heme.! A oxigenação leva a mudança de coloração da molécula de mioglobina.
8 Outras moléculas se ligam ao heme! Além do O 2, outras moléculas podem se ligar ao grupo heme: CO, NO e H 2 S! A afinidade destes compostos é muito maior do que o O 2.
9 Função da mioglobina Somente uma proteína armazenadora de O 2? Sua principal função fisiológica consiste em facilitar o transporte de oxigênio nos músculos. A mioglobina aumenta a solubilidade efetiva do O 2 no músculo, atuando como um carregador / descarregador molecular para aumentar a velocidade de difusão do O 2.
10 Função da mioglobina! Função de armazenar O 2 : Importante nos mamíferos aquáticos. Nesses animais, a concentração de mioglobina nos músculos é aprox. 10x maior do que nos mamíferos terrestres.
11 Função da mioglobina A ligação reversível do O 2 à mioglobina (Mb) é descrita por uma equação de equilíbrio Mb + O 2 MbO 2 A constante de dissociação (K) para essa equação é: K = [Mb][O 2 ] / [MbO 2 ]
12 A dissociação do O 2 da mioglobina é caracterizada por sua saturação fracional Y O2, que é definida como a fração dos sítios de ligação ocupados pelo O 2. Y O2 = [MbO 2 ] / [Mb] + [MbO 2 ] = [O 2 ] / K +[O 2 ] Desde que o O 2 é um gás, sua concentração é expressa por sua pressão parcial (po 2 ) Y O2 = po 2 / K + po 2 Essa equação descreve uma hipérbole
13
14 Função da mioglobina! Numa po 2 baixa, pouco O 2 se liga à mioglobina (Y O2 é muito baixa).! A medida que a po 2 aumenta, mais O 2 ligase a Mb.! Numa po 2 muito alta, quase todos os sítios estão ocupados - diz-se que a Mb está saturada de O 2.
15 Função da mioglobina! A inclinação da hipérbole aumenta à medida que diminui o valor de K.! Quando po 2 é igual a K, metade da Mb estará saturada com O 2! Isso pode ser mostrado substituindo-se K por po 2 na equação anterior: se po 2 = K, Y O2 = po 2 /K + po 2 " Y O2 = 0,5 Então, K pode ser definido como o valor de po 2, no qual Y=0,5
16 Função da mioglobina! É conveniente definir K como p 50, ou seja, a pressão de O 2 na qual Mb está 50% saturada! A p 50 para a Mb é de 2,6 torr (760 torr=1atm) " no intervalo fisiológico da po 2 no sangue, a Mb está quase totalmente saturada com O 2. Y O2 =0,97 a po 2 =100 torr e 0,91 a po 2 =30 torr A Mb é um modelo útil para o estudo de outras proteínas de ligação.
17 Hemoglobina! Tem função fisiologicamente específica o transporte de O 2.! Constitui um sistema sofisticado de transporte que fornece a quantidade adequada de O 2 aos tecidos.
18 Estrutura da hemoglobina! É uma proteína tetramérica, com a estrutura quaternária α 2 β 2 (um dímero αβ).! As subunidades α e β são relacionadas estrutural e evolutivamente entre si e com a mioglobina.! Sua estrutura foi elucidada por Max Perutz em 1968, o pai da cristalografia de proteínas por difração de raios X.
19 Cada monômero da estrutura tetramérica da hemoglobina possui um grupo heme
20 Estrutura da hemoglobina Apenas cerca de 18% dos resíduos de aminoácidos são identicos na mioglobina e nas subunidades da hemoglobina, mas os três polipeptídeos possuem estruturas terciárias similares.
21 A estrutura da hemoglobina! A ligação do O 2 altera toda a estrutura do tetrâmero, de forma que a estrutura da desoxiemoglobina e a da oxiemoglobina são perceptivelmente diferentes.! Em ambas as formas, as subunidades α e β fazem contato extenso: os contatos na interface α 1 -β 1 e seu equivalente, envolvem 35 resíduos, e os da interface α 1 -β 2 envolvem 19 resíduos.! Essas associações são predominantemente hidrofóbicas, embora envolvam ligações de H e pares iônicos.
22 Oxihemoglobina e desoxihemoglobina
23 A estrutura da hemoglobina! Os pares das subunidades α 1 α 2 e β 1 β 2 estão separados por um canal de ~20Å de diâmetro preenchido com solvente.! Quando o O 2 se liga, os contatos α 1 β 2 e α 2 β 1 sofrem um deslocamento, produzindo uma alteração na estrutura quaternária.! Esse rearranjo estrutural é um elemento crucial no comportamento da ligação do O 2 à hemoglobina.
24
25 Ligação do O 2 à hemoglobina! A hemoglobina tem uma p 50 total de 26 torr (em uma pressão de O 2 de 26 torr, metade da hemoglobina está saturada com O 2 )! Valor cerca de 10x maior do que a p 50 da mioglobina (2,8 torr)! A hemoglobina não apresenta uma curva hiperbólica de ligação ao O 2, como na mioglobina.
26 A ligação de O 2 à hemoglobina segue o traçado de uma curva sigmóide
27 Ligação do O 2 à hemoglobina! A hemoglobina pode transferir mais O 2 para os tecidos do que transferiria se apresentasse uma curva hiperbólica com a mesma p 50! Nas pressões arteriais de O 2, está quase totalmente saturada com O 2, mas nas pressões venosas de O 2 está somente metade saturada.
28 Ligação do O 2 à hemoglobina! Em qualquer sistema de ligação, uma curva sigmóide é característica de uma interação cooperativa entre os sítios: A ocupação de um sítio pelo ligante afeta a ocupação dos demais sítios por ligantes adicionais
29 Equação de Hill! Tentativa inicial de analisar a curva sigmóide de dissociação do O 2 da hemoglobina foi realizada por Archibald Hill (1910)! Hill presumiu que a hemoglobina (Hb) liga n moléculas de O 2 em uma única etapa Hb + n O 2 " Hb(O 2 ) n ou seja, com cooperatividade infinita.
30 Equação de Hill Em analogia a equação Y O2 = po 2 /K + po 2 para a Mb, Y O2 = (po 2 ) n / (p 50 ) n + (po 2 ) n é conhecida como equação de Hill. Ela descreve o grau de saturação da hemoglobina como uma função da po 2.
31 " A cooperatividade infinita da ligação de O 2 como descrita por Hill é uma impossibilidade física! A quantidade n, a constante de Hill, aumenta com o grau de cooperatividade de uma reação, proporcionando uma caracterização conveniente de uma reação de ligação de ligante n=1, a equação descreve uma hipérbole (reação não cooperativa) n>1, a equação descre uma sigmóide (reação positivamente cooperativa) n<1, reação negativamente cooperativa
32 A constante de Hill, n, e o valor de p 50 que melhor descrevem uma curva de saturação da Hb podem ser determinados graficamente pela equação Y O2 / 1 - Y O2 = (po 2 ) n / (p 50 ) n Tomando o log em ambos os lados, tem-se uma equação linear log (Y O2 / 1 - Y O2 ) = n log po 2 n log p 50
33 Gráfico de Hill A curva linear do log (Y O2 / [1 - Y O2 ]) pelo log de po 2, chamada curva de Hill, tem uma inclinação de n e um intercepto de log p 50 no eixo do log po 2.
34 Modelos mais realistas para analisar a ligação cooperativa do O 2 à Hb foram desenvolvidos Proteínas alostéricas A cooperatividade da ligação do O 2 à Hb é um modelo clássico A ligação de um ligante pode aumentar ou diminuir a afinidade de ligação de ligantes a outros sítios da proteína são interações alostéricas
35 Existem dois modelos propostos para explicar a ligação cooperativa do ligante 1. Modelo de simetria do alosterismo (proposto por Monod, Wyman e Changeux em 1965): a. Uma proteína alostérica é um oligômero de subunidades simetricamente relacionadas; b. Cada subunidade existe em dois estados conformacionais em equilíbrio; c. O ligante pode ligar-se à subunidade em ambas as conformações. Somente a mudança conformacional altera a afinidade pelo ligante; d. As subunidades devem alterar a conformação de modo combinado.
36 Modelo de simetria de MWC! A principal objeção ao modelo de simetria consiste na dificuldade de acreditar que a simetria oligomérica seja perfeitamente conservada em todas as proteínas! E, embora algumas proteínas exibam cooperatividade negativa, o modelo explica somente a cooperatividade positiva.
37 2. Modelo sequencial - proposto por Daniel Koshland! É uma alternativa ao modelo de simetria.! A ligação do ligante induz uma alteração conformacional na subunidade à qual se liga e, pela influência dessa sobre as subunidades vizinhas, surgem interações cooperativas! As mudanças conformacionais ocorrem sequencialmente à medida que mais sítios de ligação estão sendo ocupados! A afinidade varia com a conformação.
38 As proteínas que seguem o modelo sequencial do alosterismo podem apresentar cooperatividade positiva ou negativa! Se o acoplamento mecânico entre as subunidades for particularmente forte, as mudanças conformacionais ocorrerão simultaneamente, mantendo sua simetria! Neste caso, o modelo de simetria pode ser considerado um caso extremo do modelo sequencial! A ligação do O 2 à Hb exibe características de ambos os modelos é combinada e causa mudanças estruturais pequenas
39 Mecanismo de cooperatividade da ligação de O 2 Como a ligação de um O 2 num grupo heme afeta a afinidade de ligação de outro grupo heme? A informação é transmitida de modo mecânico para os demais grupos heme por movimentos da proteína. Esses movimentos são responsáveis pelas diferentes estruturas quaternárias da oxi- e desoxi- Hb.
40 A hemoglobina possui dois estados conformacionais! Baseadas nas estruturas cristalográficas das formas oxi e desoxi, Perutz formulou um mecanismo para a oxigenação da Hb: Há dois estados conformacionais estáveis: o estado R, oxigenado, e o estado T, desoxigenado. As conformações das 4 subunidades diferem do estado T para o R. A ligação do O 2 inicia uma série de movimentos coordenados.
41
42 Formas R e T! A característica da transição T " R da Hb é que suas subunidades estão tão firmemente acopladas que não podem acontecer grandes mudanças estruturais terciárias dentro de uma subunidade, sem que ocorram mudanças estruturais quaternárias em toda a proteína só há duas formas R e T.! Nenhuma subunidade ou dímero muda sua conformação de modo independente.
43 Formas R e T! O estado T tem baixa afinidade pelo O 2, devido ao comprimento da ligação Fe-O 2 (0,1 Å maior).! Quando 1 O 2 liga-se a um dímero, a tensão gerada no estado T é suficiente para levar a proteína ao estado R! Então todas as subunidades são convertidas simultaneamente ao estado R, tenham ou não O 2 ligado.! Nesta conformação, as subunidades não-ocupadas apresentam maior afinidade pelo O 2.
44 O efeito Bohr! As mudanças conformacionais que ocorrem na Hb pela ligação do O 2 reduzem os pks de vários grupos (N-terminal das α e C-terminal das β).! No estado T esses grupos ácidos com carga positiva participam de ligações iônicas o que eleva seus pks, ao passo que no estado R tais interações não existem.! O aumento do ph (remoção de prótons), estimula a hemoglobina a ligar mais O 2 em pressões de O 2 mais baixas é o efeito Bohr Christian Bohr (1904)
45 O efeito Bohr
46 O efeito Bohr desempenha funções importantes O 2 " pulmões para os tecidos CO 2 " difunde-se dos tecidos para os capilares e pulmões O CO 2 dissolvido transforma-se lentamente em bicarbonato (HCO 3- ) CO 2 + H 2 O " H + + CO 3 - No eritrócito, a enzima anidrase carbônica acelera essa reação. Então, a maior parte do CO 2 é transportado no sangue na forma de bicarbonato.
47 Nos pulmões, onde a pressão de O 2 é alta, a ligação do O 2 à Hb rompe as ligações iônicas do estado T e forma o estado R, liberando assim, os prótons de Bohr, que se recombinam com o bicarbonato para eliminar o CO 2.
48 A hemoglobina altamente purificada (Stripped Hb) tem uma afinidade muito maior pelo oxigênio do que a hemoglobina no sangue total. Porque? Joseph Barcroft (1921) especulou que o sangue conteria, além do CO 2, alguma outra substância, afetando a ligação do O 2 à Hb.
49 D-2,3-bisfosfoglicerato o BPG
50 D-2,3-bisfosfoglicerato o BPG Liga-se fortemente a desoxi-hb e fracamente a oxi- Hb. Assim, a presença do BPG nos eritrócitos reduz a afinidade da Hb pelo O 2 por mantê-la na sua forma desoxi Onde se liga na molécula da Hb?
51 O BPG liga-se à concavidade central! Na transição T " R, as duas subunidades β se aproximam,estreitando a concavidade central, e expulsando o BPG! Portanto, estabiliza a conformação T da Hb pela ligação cruzada de suas subunidades β! Desloca o equilíbrio R " T, reduzindo a afinidade da Hb pelo O 2.
52 BPG função fisiológica indispensável! No sangue arterial (po 2 = 100 torr) a Hb está 95% saturada com O 2! No sangue venoso (po 2 = 30 torr) a Hb está 55% saturada Então, ao passar pelos capilares, a Hb descarrega cerca de 40% de O 2 Na ausência de BPG, somente pequena parte do O 2 seria liberado, devido ao aumento da afinidade. O BPG exerce um papel importante na adaptação às grandes altitudes
53 A Hb fetal (α 2 γ 2 ) tem baixa afinidade pelo BPG
54 Hemoglobinas anormais O estudo de indivíduos com deficiências fisiológicas levou a descoberta de aproximadamente 500 hemoglobinas variantes Cerca de 95% delas são resultado de substituições de um único aminoácido na cadeia polipeptídica da globina.
55 Hemoglobinas anormais! As mutações que desestabilizam as estruturas terciárias e quaternárias alteram a afinidade da Hb pelo O 2 e reduzem a sua cooperatividade.! As Hbs instáveis são degradadas pelos eritrócitos e seus produtos de degradação causam lise celular é a anemia hemolítica
56 Hemoglobinas anormais! Outras mutações favorecem a oxidação do Fe(II) para Fe(III) cianose São indivíduos portadores de metahemoglobina Essa Hb apresentam cooperatividade reduzida! Há também mutações que aumentam a afinidade da Hb pelo O 2, levando ao aumento do número de eritrócitos para compensar a quantidade reduzida de O 2 que chega aos tecidos - policitemia
57 A anemia falciforme! Os indivíduos que apresentam os dois alelos (homozigotos) do gene da hemoglobina S sofrem de anemia falciforme, na qual a desoxi-hb S forma filamentos insolúveis que deformam os eritrócitos
58 Micrografia eletrônica de eritrócitos humanos
59 A anemia falciforme! As células rígidas e em forma de foice não conseguem passar com facilidade pelos capilares.! Em 1956, V. Ingram mostrou que a Hb S continha uma Val na posição 6 das cadeias β, ao invés de Glu. Doença congênita originada pela troca de um aminoácido específico de uma proteína
60 Hemoglobina S! A estrutura cristalográfica da desoxi-hb S mostrou que a cadeia lateral da Val de cada molécula mutante encaixase em uma concavidade hidrofóbica na superfície da subunidade β de outra molécula de hemoglobina! Esse contato intermolecular permite a formação de polímeros lineares entre as moléculas da Hb S formam agregados de 14 cadeias que enrolam-se e formam fibras de cerca de 220Å de diâmetro
61 Anemia falciforme Nem a Hb normal, e nem a oxi-hb S podem polimerizar A concavidade hidrofóbica não acomoda a cadeia lateral do Glu de uma cadeia normal, e essa concavidade não existe na oxi-hb Muitos homozigotos para Hb S apresentam somente uma forma leve de anemia falciforme, pois apresentam níveis relativamente altos de Hb fetal (α 2 γ 2 )
FUNÇÃO PROTÉICA. Bioquímica da Respiração. Transporte de O 2
 FUNÇÃO PROTÉICA Bioquímica da Respiração Transporte de O 2 1 DEFININDO CONCEITOS Ligante Ligação reversível de uma molécula à proteína. (Ex: enzima-substrato). Sítio de ligação Ligante se liga ao sítio
FUNÇÃO PROTÉICA Bioquímica da Respiração Transporte de O 2 1 DEFININDO CONCEITOS Ligante Ligação reversível de uma molécula à proteína. (Ex: enzima-substrato). Sítio de ligação Ligante se liga ao sítio
História antiga da química de proteínas é a da Hb Hb cristalina atlas fotográfico com cristais de 109 espécies. Urease 1926.
 História antiga da química de proteínas é a da Hb. 1849 Hb cristalina. 1909 atlas fotográfico com cristais de 109 espécies. Urease 1926. Uma das primeiras proteínas a ter a massa molecular determinada,
História antiga da química de proteínas é a da Hb. 1849 Hb cristalina. 1909 atlas fotográfico com cristais de 109 espécies. Urease 1926. Uma das primeiras proteínas a ter a massa molecular determinada,
As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos
 Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
PROTEÍNAS GLOBULARES E
 Universidade Federal do Rio de Janeiro Centro de Ciências da Saúde Instituto de Bioquímica Médica Curso: Enfermagem e Obstetrícia PROTEÍNAS GLOBULARES E TRANSPORTE DE O 2 TRANSPORTE DE O 2 O 2 é pouco
Universidade Federal do Rio de Janeiro Centro de Ciências da Saúde Instituto de Bioquímica Médica Curso: Enfermagem e Obstetrícia PROTEÍNAS GLOBULARES E TRANSPORTE DE O 2 TRANSPORTE DE O 2 O 2 é pouco
Proteínas funcionais: hemoglobina e mioglobina
 BIOQUÍMICA 1º ano de Medicina Ensino teórico 2010/2011 9ª aula teórica 18 Outubro 2010 Proteínas funcionais: hemoglobina e mioglobina - Biochemistry (J. M. Berg, J. L. Tymozko, L. Stryer) 6ª Ed., W. H.
BIOQUÍMICA 1º ano de Medicina Ensino teórico 2010/2011 9ª aula teórica 18 Outubro 2010 Proteínas funcionais: hemoglobina e mioglobina - Biochemistry (J. M. Berg, J. L. Tymozko, L. Stryer) 6ª Ed., W. H.
Proteínas funcionais: hemoglobina e mioglobina
 BIOQUÍMICA 1º ano de Medicina Ensino teórico 2007/2008 9ª aula teórica Proteínas funcionais: hemoglobina e mioglobina - Biochemistry (J. M. Berg, J. L. Tymozko, L. Stryer) 6ª Ed., W. H. Freeman & Company,
BIOQUÍMICA 1º ano de Medicina Ensino teórico 2007/2008 9ª aula teórica Proteínas funcionais: hemoglobina e mioglobina - Biochemistry (J. M. Berg, J. L. Tymozko, L. Stryer) 6ª Ed., W. H. Freeman & Company,
Função de Proteínas: Mioglobina e Hemoglobina
 Aula de Bioquímica Avançada Tema: Função de Proteínas: Mioglobina e Hemoglobina Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade
Aula de Bioquímica Avançada Tema: Função de Proteínas: Mioglobina e Hemoglobina Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade
accad.osu.edu/~vberezin/ibp/progress.htm Interações - e - mantém tetrâmero Hemoglobina é formada por cadeias e A G B D
 accad.osu.edu/~vberezin/ibp/progress.htm Hemoglobina é formada por cadeias e Interações - e - mantém tetrâmero 2 2 A G H B E D F C 1 Mioglobina e Hemoglobina O grupo heme Heme é um grupo prostético. Proteína
accad.osu.edu/~vberezin/ibp/progress.htm Hemoglobina é formada por cadeias e Interações - e - mantém tetrâmero 2 2 A G H B E D F C 1 Mioglobina e Hemoglobina O grupo heme Heme é um grupo prostético. Proteína
Proteínas. Prof.: Matheus de Souza Gomes Disciplina: Bioquímica I
 Prof.: Matheus de Souza Gomes Disciplina: Bioquímica I Patos de Minas 2017 Conteúdo Proteínas Estrutura Tridimensional de proteína Conformação Estabilidade de proteínas Ligação peptídica Estrutura Secundária
Prof.: Matheus de Souza Gomes Disciplina: Bioquímica I Patos de Minas 2017 Conteúdo Proteínas Estrutura Tridimensional de proteína Conformação Estabilidade de proteínas Ligação peptídica Estrutura Secundária
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO. Profa. Dra. Celene Fernandes Bernardes
 TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
Aula 2: Estrutura e Função de Proteínas
 Disciplina de Mét. Purif. e Anál. Proteínas Curso de Ciências Biológicas Aula 2: Estrutura e Função de Proteínas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e
Disciplina de Mét. Purif. e Anál. Proteínas Curso de Ciências Biológicas Aula 2: Estrutura e Função de Proteínas Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e
Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro:
 TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
Enzimologia Aula 2. Leitura sugerida. Biochemistry Voet & Voet 3ª edição Capítulo 10 parte 1Bb (página 323), parte 4A, 4B e 4C (páginas )
 Enzimologia Aula 2 Leitura sugerida Biochemistry Voet & Voet 3ª edição Capítulo 10 parte 1Bb (página 323), parte 4A, 4B e 4C (páginas 346-350) Structure and Mechanism in Protein Science Alan Fersht 1999
Enzimologia Aula 2 Leitura sugerida Biochemistry Voet & Voet 3ª edição Capítulo 10 parte 1Bb (página 323), parte 4A, 4B e 4C (páginas 346-350) Structure and Mechanism in Protein Science Alan Fersht 1999
FISIOLOGIA DO EXERCÍCIO
 FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
Os gases respiratórios não exercem pressão parcial quando estão combinados com os pigmentos respiratórios, nem quando estão quimicamente modificados.
 A circulação de um fluido (sangue ou hemolinfa) acelera a distribuição dos gases respiratórios (movimento por fluxo). Entretanto, os gases, especialmente oxigênio, são pouco solúveis em soluções aquosas.
A circulação de um fluido (sangue ou hemolinfa) acelera a distribuição dos gases respiratórios (movimento por fluxo). Entretanto, os gases, especialmente oxigênio, são pouco solúveis em soluções aquosas.
A função das proteínas fibrosas como elementos estruturais de células e tecidos depende de interações entre cadeias polipeptídicas idênticas.
 A função das proteínas quase sempre depende da interação com outras moléculas A função das proteínas fibrosas como elementos estruturais de células e tecidos depende de interações entre cadeias polipeptídicas
A função das proteínas quase sempre depende da interação com outras moléculas A função das proteínas fibrosas como elementos estruturais de células e tecidos depende de interações entre cadeias polipeptídicas
Proteínas. Proteínas são polímeros de aminoácidos
 Proteínas Estrutura & Propriedades Proteínas são polímeros de aminoácidos Existem 20 tipos diferentes de aminoácidos Aminoácidos são ácidos fracos A carga elétrica do aminoácido varia de acordo com o ph
Proteínas Estrutura & Propriedades Proteínas são polímeros de aminoácidos Existem 20 tipos diferentes de aminoácidos Aminoácidos são ácidos fracos A carga elétrica do aminoácido varia de acordo com o ph
resumo da aula anterior: Estrutura e função de proteinas
 QBQ 2451 Introdução à Bioquímica 2013 Maria Teresa Machini Laboratório de Química de Peptídeos Bloco 8 Superior sala 0854 mtmachini@iq.usp.br resumo da aula anterior: Estrutura e função de proteinas IDENTIFICAÇÃO
QBQ 2451 Introdução à Bioquímica 2013 Maria Teresa Machini Laboratório de Química de Peptídeos Bloco 8 Superior sala 0854 mtmachini@iq.usp.br resumo da aula anterior: Estrutura e função de proteinas IDENTIFICAÇÃO
Proteínas. Profa. Alana Cecília
 Proteínas Profa. Alana Cecília Proteínas Aminoácidos ligados formam uma cadeia proteica (polipeptídica). As unidades de repetição são planos de amida que contêm ligações peptídicas. Esses planos de amida
Proteínas Profa. Alana Cecília Proteínas Aminoácidos ligados formam uma cadeia proteica (polipeptídica). As unidades de repetição são planos de amida que contêm ligações peptídicas. Esses planos de amida
Ciclo Respiratório Normal. Como Respiramos? Prova de Função Pulmonar. Que diz a espirometria? Espirômetro. Sensível ao volume.
 Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP. Prof. Marcos Túlio Oliveira Depto. Tecnologia
 Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Prof. Marcos Túlio Oliveira Depto. Tecnologia Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Green Fluorescent Protein (GFP) Engenharia
Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Prof. Marcos Túlio Oliveira Depto. Tecnologia Engenharia de Proteínas 2017 Ciências Biológicas FCAV/UNESP Green Fluorescent Protein (GFP) Engenharia
Os gases respiratórios não exercem pressão parcial quando estão combinados com os pigmentos respiratórios, nem quando estão quimicamente modificados.
 A circulação de um fluido (sangue ou hemolinfa) acelera a distribuição dos gases respiratórios (movimento por fluxo). Entretanto, os gases, especialmente oxigênio, são pouco solúveis em soluções aquosas.
A circulação de um fluido (sangue ou hemolinfa) acelera a distribuição dos gases respiratórios (movimento por fluxo). Entretanto, os gases, especialmente oxigênio, são pouco solúveis em soluções aquosas.
Sistema Respiratório. Superior. Língua. Inferior
 Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
ESTRUTURA DAS PROTEÍNAS
 ESTRUTURA DAS PROTEÍNAS Todas essas forças são usadas para a manutenção da estrutura tridimensional das proteínas - conformação A conformação de uma proteína é fundamental para a função que ela exerce
ESTRUTURA DAS PROTEÍNAS Todas essas forças são usadas para a manutenção da estrutura tridimensional das proteínas - conformação A conformação de uma proteína é fundamental para a função que ela exerce
ESTRUTURA DAS PROTEÍNAS
 ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
Casos clínicos. Seção II
 Casos clínicos Seção II CASO 1 Menina afro-americana de 15 anos vai à emergência com queixa de dor bilateral na coxa e no quadril. A dor está presente há um dia e é cada vez mais intensa em termos de
Casos clínicos Seção II CASO 1 Menina afro-americana de 15 anos vai à emergência com queixa de dor bilateral na coxa e no quadril. A dor está presente há um dia e é cada vez mais intensa em termos de
Sangue!!! TRANSPORTE DE GASES NOS FLUÍDOS CORPORAIS. O que é sangue? Qual(is) a(s) sua(s) função(ões)? 03/04/2017 PERGUNTAS INICIAIS FUNÇÕES DO SANGUE
 TRANSPORTE DE GASES NOS FLUÍDOS CORPORAIS Sangue!!! PERGUNTAS INICIAIS O que é sangue? Qual(is) a(s) sua(s) função(ões)? FUNÇÕES DO SANGUE Transporte: Nutrientes Metabólitos Gases Hormônios Calor (regulação
TRANSPORTE DE GASES NOS FLUÍDOS CORPORAIS Sangue!!! PERGUNTAS INICIAIS O que é sangue? Qual(is) a(s) sua(s) função(ões)? FUNÇÕES DO SANGUE Transporte: Nutrientes Metabólitos Gases Hormônios Calor (regulação
BIOQUÍMICA I 1º ano de Medicina Ensino teórico 2010/2011
 BIOQUÍMICA I 1º ano de Medicina Ensino teórico 2010/2011 7ª aula teórica 11 Outubro 2010 Proteínas estruturais e funcionais Organização estrutural das proteínas Estrutura e diferentes funções de proteínas
BIOQUÍMICA I 1º ano de Medicina Ensino teórico 2010/2011 7ª aula teórica 11 Outubro 2010 Proteínas estruturais e funcionais Organização estrutural das proteínas Estrutura e diferentes funções de proteínas
Hemoglobina. Prof. Archangelo Fernandes Profa Alessandra Barone
 Hemoglobina Prof. Archangelo Fernandes Profa Alessandra Barone www.profbio.com.br Hemoglobina (Hb) Molécula formada por quadro cadeias polipeptídicas globínicas associadas a 4 anéis porfirínicos heme.
Hemoglobina Prof. Archangelo Fernandes Profa Alessandra Barone www.profbio.com.br Hemoglobina (Hb) Molécula formada por quadro cadeias polipeptídicas globínicas associadas a 4 anéis porfirínicos heme.
UFABC Bacharelado em Ciência & Tecnologia
 UFABC Bacharelado em Ciência & Tecnologia Transformações Bioquímicas (BC0308) Prof Luciano Puzer http://professor.ufabc.edu.br/~luciano.puzer/ Propriedades e funções de proteínas: Mioglobina / Hemoglobina
UFABC Bacharelado em Ciência & Tecnologia Transformações Bioquímicas (BC0308) Prof Luciano Puzer http://professor.ufabc.edu.br/~luciano.puzer/ Propriedades e funções de proteínas: Mioglobina / Hemoglobina
ESTRUTURA DAS PROTEÍNAS
 ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
ESTRUTURA DAS PROTEÍNAS Como é a estrutura tridimensional das proteínas??? 4 níveis estruturais Estrutura primária, secundária, terciária e quaternária Mantidas por: ligações covalentes (ligação peptídica
Função de Proteínas: Mioglobina e Hemoglobina
 Aula de Bioquímica I Tema: Função de Proteínas: Mioglobina e Hemoglobina Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São
Aula de Bioquímica I Tema: Função de Proteínas: Mioglobina e Hemoglobina Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São
São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas.
 São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas. Proteínas possuem muitas funções dentro do organismo. Aminoácidos
São macromoléculas formadas pela união de muitos aminoácidos. Esses aminoácidos estão ligados um ao outro por meio de ligações peptídicas. Proteínas possuem muitas funções dentro do organismo. Aminoácidos
Faculdade Anhanguera Curso de Graduação em Educação Física
 Faculdade Anhanguera Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Mês de agosto Conteúdo 9 Unidade 1 16 Unidade 1 23 Unidade 1 30
Faculdade Anhanguera Curso de Graduação em Educação Física Profa. Dra. Amabile Vessoni Arias E-mail: Amabile.arias@anhanguera.com 2016-2 Mês de agosto Conteúdo 9 Unidade 1 16 Unidade 1 23 Unidade 1 30
Metais no Organismo Humano
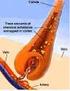 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Cinética Enzimática. Prof Karine P. Naidek Novembro/2016
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Cinética Enzimática Prof Karine P. Naidek Novembro/2016 Cinética das Reações Bioquímicas
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Cinética Enzimática Prof Karine P. Naidek Novembro/2016 Cinética das Reações Bioquímicas
O grupo responsável pelo transporte de O 2 é uma porfirina lidada à cadeia proteica com um átomo de Fe 2+ quelado
 Transporte de Oxigênio Shriver & Atikins, cap. 26 Mioglobina é uma proteína de baixa massa molar (17 kda) presente nos tecidos musculares de mamíferos que apresenta a função de transportar O 2 O grupo
Transporte de Oxigênio Shriver & Atikins, cap. 26 Mioglobina é uma proteína de baixa massa molar (17 kda) presente nos tecidos musculares de mamíferos que apresenta a função de transportar O 2 O grupo
Enzimas Alostéricas e com Múltiplos Sítios Ativos
 Enzimas Alostéricas e com Múltiplos ítios Ativos A presença do substrato em um dos sítios influencia: - a ligação do substrato aos demais sítios vazios - a taxa de formação de produto nos sítios ocupados
Enzimas Alostéricas e com Múltiplos ítios Ativos A presença do substrato em um dos sítios influencia: - a ligação do substrato aos demais sítios vazios - a taxa de formação de produto nos sítios ocupados
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros
 Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III
 Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III A maioria das cadeias polipeptídicas naturais contém entre 50 e 2.000 aminoácidos e são comumente referidas como proteínas. Peptídeos
Aula: 18 Temática: Estrutura dos aminoácidos e proteínas parte III A maioria das cadeias polipeptídicas naturais contém entre 50 e 2.000 aminoácidos e são comumente referidas como proteínas. Peptídeos
Origem grego (protos) primeira, mais importante
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS. Um polipeptídeo de dimensão macromolecular ou um conjunto de polipeptídeos associados entre si constituem proteínas.
 PROTEÍNAS PROTEÍNAS DEFINIÇÃO Compostos nitrogenados orgânicos complexos, presentes em todas as células vivas, formados fundamentalmente por C, H, O e N. Contêm ainda S, P, Cu, etc.. Os compostos nitrogenados
PROTEÍNAS PROTEÍNAS DEFINIÇÃO Compostos nitrogenados orgânicos complexos, presentes em todas as células vivas, formados fundamentalmente por C, H, O e N. Contêm ainda S, P, Cu, etc.. Os compostos nitrogenados
( ) Prova de Conhecimentos Específicos. 1 a QUESTÃO: (2,0 pontos) PROAC / COSEAC - Gabarito. P ρ. Biomedicina 1
 Prova de Conhecimentos Específicos 1 a QUESTÃO: (2,0 pontos) Uma transfusão de sangue é feita ligando-se, à veia do paciente, com um tubo, uma bolsa contendo plasma a uma altura h do paciente. A pressão
Prova de Conhecimentos Específicos 1 a QUESTÃO: (2,0 pontos) Uma transfusão de sangue é feita ligando-se, à veia do paciente, com um tubo, uma bolsa contendo plasma a uma altura h do paciente. A pressão
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 7ª AULA PRÁTICA
 Disciplina de BOQUÍMCA do Ciclo Básico de MEDCNA Universidade dos Açores 1º Ano ENSNO PRÁTCO 7ª AULA PRÁTCA 1. PRNCÍPOS GERAS DE ESPECTROFOTOMETRA DE ABSORÇÃO - Lei de Beer-Lambert - Espectro de absorção
Disciplina de BOQUÍMCA do Ciclo Básico de MEDCNA Universidade dos Açores 1º Ano ENSNO PRÁTCO 7ª AULA PRÁTCA 1. PRNCÍPOS GERAS DE ESPECTROFOTOMETRA DE ABSORÇÃO - Lei de Beer-Lambert - Espectro de absorção
Aula 4: Enzimas Cinética e Regulação
 Disciplina de Engenharia de Proteínas Curso de Ciências Biológicas Aula 4: Enzimas Cinética e Regulação Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias
Disciplina de Engenharia de Proteínas Curso de Ciências Biológicas Aula 4: Enzimas Cinética e Regulação Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias
Macromolécula mais abundante nas células
 PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
PROTEÍNAS Origem grego (protos) primeira, mais importante A palavra proteína que eu proponho vem derivada de proteos, porque ela parece ser a substância primitiva ou principal da nutrição animal, as plantas
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros
 Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
TRANSPORTE DE GASES NO SANGUE. Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas
 TRANSPORTE DE GASES NO SANGUE Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas ANATOMIA DO SISTEMA RESPIRATÓRIO ESTRUTURA DAS VIAS AÉREAS ESQUERDO WEST 2002 VASOS ALVEOLARES
TRANSPORTE DE GASES NO SANGUE Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas ANATOMIA DO SISTEMA RESPIRATÓRIO ESTRUTURA DAS VIAS AÉREAS ESQUERDO WEST 2002 VASOS ALVEOLARES
LIGAÇÃO PEPTÍDICA. ligação peptídica DIPEPTÍDEO AMINOÁCIDOS
 PROTEÍNAS PROTEÍNAS LIGAÇÃO PEPTÍDICA DIPEPTÍDEO AMINOÁCIDOS ligação peptídica PEPTÍDEO Resíduo N-terminal Resíduo C-terminal OLIGOPEPTÍDEOS: 2 a 10 resíduos de aminoácidos. Exemplos: dipeptídio (2 aminoácidos),
PROTEÍNAS PROTEÍNAS LIGAÇÃO PEPTÍDICA DIPEPTÍDEO AMINOÁCIDOS ligação peptídica PEPTÍDEO Resíduo N-terminal Resíduo C-terminal OLIGOPEPTÍDEOS: 2 a 10 resíduos de aminoácidos. Exemplos: dipeptídio (2 aminoácidos),
Introdução. Estrutura dos Aminoácidos e Proteínas. Aminoácidos componentes de proteínas. Aminoácidos componentes de proteínas 10/02/2012.
 Introdução Estrutura dos Aminoácidos e Prof. Dr. Bruno Lazzari de Lima : Componentes celulares mais importantes. Diversidade de forma e função. Estruturais. Enzimáticas. Transportadoras. Ex.: Insulina,
Introdução Estrutura dos Aminoácidos e Prof. Dr. Bruno Lazzari de Lima : Componentes celulares mais importantes. Diversidade de forma e função. Estruturais. Enzimáticas. Transportadoras. Ex.: Insulina,
Prof. Leonardo F. Stahnke
 Prof. Leonardo F. Stahnke Moléculas orgânicas mais abundantes nos seres vivos, sendo importantes tanto na estrutura como funcionamento das células. São encontrados na carne vermelha, de frango ou peixe,
Prof. Leonardo F. Stahnke Moléculas orgânicas mais abundantes nos seres vivos, sendo importantes tanto na estrutura como funcionamento das células. São encontrados na carne vermelha, de frango ou peixe,
Aula 12: Enzimas Introdução e Cinética
 Disciplina de Bioquímica Estrutural Curso de Biologia Aula 12: Enzimas Introdução e Cinética Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias de Jaboticabal
Disciplina de Bioquímica Estrutural Curso de Biologia Aula 12: Enzimas Introdução e Cinética Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias de Jaboticabal
Aula 4: Enzimas Cinética e Regulação
 Disciplina de Engenharia de Proteínas Curso de Ciências Biológicas Aula 4: Enzimas Cinética e Regulação Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias
Disciplina de Engenharia de Proteínas Curso de Ciências Biológicas Aula 4: Enzimas Cinética e Regulação Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias
CATÁLISE ENZIMÁTICA. CINÉTICA Controle da velocidade de reações. CINÉTICA Equilíbrio e Estado Estacionário
 CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
Profº Lásaro Henrique
 Profº Lásaro Henrique Proteínas são macromoléculas complexas, compostas de aminoácidos. São os constituintes básicos da vida e necessárias para os processos químicos que ocorrem nos organismos vivos. Nos
Profº Lásaro Henrique Proteínas são macromoléculas complexas, compostas de aminoácidos. São os constituintes básicos da vida e necessárias para os processos químicos que ocorrem nos organismos vivos. Nos
Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos
 UNIVERSIDADE DE SÃO PAULO USP FARMÁCIA BIOQUÍMICA 015N Reatividade de Compostos Orgânicos II Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos Beatriz In Soon Chang (9328183) João Gabriel
UNIVERSIDADE DE SÃO PAULO USP FARMÁCIA BIOQUÍMICA 015N Reatividade de Compostos Orgânicos II Estrutura Primária de Proteínas: Sequenciamento de Aminoácidos Beatriz In Soon Chang (9328183) João Gabriel
Enzimas. Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini
 Enzimas Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Enzimas Proteínas especializadas em catalisar reações biológicas, ou seja aumentam a velocidade
Enzimas Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Enzimas Proteínas especializadas em catalisar reações biológicas, ou seja aumentam a velocidade
ENZIMAS ENZIMAS ENZIMAS ENZIMAS ENZIMAS 31/03/2018. PROFº STUART - 1 TEORIA DA CATÁLISE A + B DEFINIÇÃO
 DFNÇÃO nzimas são proteínas que atuam como catalisadores biológicos o Aceleram a velocidade das reações químicas o Não alteram os produtos finais das reações o Zimogênio (inativas) / nzima (ativas) Composto
DFNÇÃO nzimas são proteínas que atuam como catalisadores biológicos o Aceleram a velocidade das reações químicas o Não alteram os produtos finais das reações o Zimogênio (inativas) / nzima (ativas) Composto
SO9 TOXICIDADE DO MONÓXIDO DE CARBONO
 9 de Novembro de 2011 Turma 2 Grupo 6 SO9 TOXICIDADE DO MONÓXIDO DE CARBONO Beatriz Teixeira Pinto Daniel Melo Pinto Verena Almeida Pires Dina Rodriguez Pita Ana Cristina Vitorino Diana Murteira Maria
9 de Novembro de 2011 Turma 2 Grupo 6 SO9 TOXICIDADE DO MONÓXIDO DE CARBONO Beatriz Teixeira Pinto Daniel Melo Pinto Verena Almeida Pires Dina Rodriguez Pita Ana Cristina Vitorino Diana Murteira Maria
Peptídeos e Proteínas: Estrutura de Proteínas
 Peptídeos e Proteínas: Estrutura de Proteínas QFL0343 - REATIVIDADE DE COMPOSTOS ORGÂNICOS II E BIOMOLÉCULAS Adriana Uehara 9820384 Janaína Novais 9819722 Aminoácidos Estruturas carbônicas que possuem
Peptídeos e Proteínas: Estrutura de Proteínas QFL0343 - REATIVIDADE DE COMPOSTOS ORGÂNICOS II E BIOMOLÉCULAS Adriana Uehara 9820384 Janaína Novais 9819722 Aminoácidos Estruturas carbônicas que possuem
MACRONUTRIENTES III PROTEÍNAS
 MACRONUTRIENTES III PROTEÍNAS 1 PROTEÍNAS As proteínas são compostos orgânicos de estrutura complexa e massa molecular elevada, elas são sintetizadas pelos organismos vivos através da condensação de um
MACRONUTRIENTES III PROTEÍNAS 1 PROTEÍNAS As proteínas são compostos orgânicos de estrutura complexa e massa molecular elevada, elas são sintetizadas pelos organismos vivos através da condensação de um
Função proteica envolve a ligação reversível com outras moléculas O ligante se liga na proteína e um sítio específico, chamado SÍTIO DE LIGAÇÃO.
 Estrutura Função 1. Função proteica envolve a ligação reversível com outras moléculas. A molécula que se liga reversivelmente à proteina LIGANTE 2. O ligante se liga na proteína e um sítio específico,
Estrutura Função 1. Função proteica envolve a ligação reversível com outras moléculas. A molécula que se liga reversivelmente à proteina LIGANTE 2. O ligante se liga na proteína e um sítio específico,
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS. Enzimas. Prof. Me. Cássio Resende de Morais
 FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
LIGAÇÕES QUÍMICAS REVISÃO
 LIGAÇÕES QUÍMICAS REVISÃO Ligações químicas e forças atrativas 1- Ligações covalentes Ligação química entre dois átomos na qual elétrons são compartilhados Ligação Forte Energia de ligação é a energia
LIGAÇÕES QUÍMICAS REVISÃO Ligações químicas e forças atrativas 1- Ligações covalentes Ligação química entre dois átomos na qual elétrons são compartilhados Ligação Forte Energia de ligação é a energia
III SEMINÁRIO. Tema: PATOLOGIA MOLECULAR DA HEMOGLOBINA. Subtemas:
 III SEMINÁRIO Tema: PATOLOGIA MOLECULAR DA HEMOGLOBINA Subtemas: Estrutura da hemoglobina e transporte de oxigénio Síntese de hemoglobina durante o desenvolvimento fetal Generalidades sobre as hemoglobinas
III SEMINÁRIO Tema: PATOLOGIA MOLECULAR DA HEMOGLOBINA Subtemas: Estrutura da hemoglobina e transporte de oxigénio Síntese de hemoglobina durante o desenvolvimento fetal Generalidades sobre as hemoglobinas
ENZIMAS ENZIMAS ENZIMAS 19/02/17 DEFINIÇÃO CLASSIFICAÇÃO ESTRUTURAL. ativa. inativa
 DFNÇÃO nzimas são proteínas que atuam como catalisadores biológicos o Aceleram a velocidade das reações químicas o Não alteram os produtos finais das reações o Zimogênio (inativas) / nzima (ativas) Composto
DFNÇÃO nzimas são proteínas que atuam como catalisadores biológicos o Aceleram a velocidade das reações químicas o Não alteram os produtos finais das reações o Zimogênio (inativas) / nzima (ativas) Composto
Exercícios de Aprofundamento Biologia Trocas Gasosas
 1. (Unesp 2014) Os gráficos representam a concentração de três gases no sangue assim que passam pelos alvéolos pulmonares. É correto afirmar que os gráficos que representam as concentrações dos gases O
1. (Unesp 2014) Os gráficos representam a concentração de três gases no sangue assim que passam pelos alvéolos pulmonares. É correto afirmar que os gráficos que representam as concentrações dos gases O
Universidade de São Paulo QFL0343: Reações de Compostos Orgânicos II e Biomoléculas Grupo 2: Peptídeos e Proteínas - Estrutura de Proteínas
 Universidade de São Paulo QFL0343: Reações de Compostos Orgânicos II e Biomoléculas - 2016 Grupo 2: Peptídeos e Proteínas - Estrutura de Proteínas Alex Monteiro Magalhães (8020779) Karina Brandt (8566483)
Universidade de São Paulo QFL0343: Reações de Compostos Orgânicos II e Biomoléculas - 2016 Grupo 2: Peptídeos e Proteínas - Estrutura de Proteínas Alex Monteiro Magalhães (8020779) Karina Brandt (8566483)
AMINOÁCIDOS E PROTEÍNAS: ESTRUTURA E FUNÇÕES
 Universidade Estadual Paulista Júlio de Mesquita Filho Faculdade de Odontologia de Araçatuba Departamento de Ciências Básicas AMINOÁCIDOS E PROTEÍNAS: ESTRUTURA E FUNÇÕES Professora Marcelle Danelon Tópicos
Universidade Estadual Paulista Júlio de Mesquita Filho Faculdade de Odontologia de Araçatuba Departamento de Ciências Básicas AMINOÁCIDOS E PROTEÍNAS: ESTRUTURA E FUNÇÕES Professora Marcelle Danelon Tópicos
Bioquímica: Componentes orgânicos e inorgânicos necessários à vida. Leandro Pereira Canuto
 Bioquímica: orgânicos e inorgânicos necessários à vida Leandro Pereira Canuto Toda matéria viva: C H O N P S inorgânicos orgânicos Água Sais Minerais inorgânicos orgânicos Carboidratos Proteínas Lipídios
Bioquímica: orgânicos e inorgânicos necessários à vida Leandro Pereira Canuto Toda matéria viva: C H O N P S inorgânicos orgânicos Água Sais Minerais inorgânicos orgânicos Carboidratos Proteínas Lipídios
Introdução à Bioquímica
 Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
São moléculas catalíticas protéicas (exceto algumas que são RNA) - Prefixo que designa a reação: lactato desidrogenase, catalase
 1 5 Enzimas a) Conceito - O que são enzimas? São moléculas catalíticas protéicas (exceto algumas que são RNA) - Moléculas que aumentam a velocidade de reações sem se alterarem neste processo. - Catalisam
1 5 Enzimas a) Conceito - O que são enzimas? São moléculas catalíticas protéicas (exceto algumas que são RNA) - Moléculas que aumentam a velocidade de reações sem se alterarem neste processo. - Catalisam
Farmacodinâmica. Alvos para a ação dos fármacos 02/03/2012. Farmacodinâmica
 Farmacodinâmica Rodrigo Borges, M.Sc. 2012 Farmacodinâmica Estudo dos efeitos bioquímicos e fisiológicos do fármaco com seu receptor ou outros sítios de primários de ação (mecanismo de ação) É o que o
Farmacodinâmica Rodrigo Borges, M.Sc. 2012 Farmacodinâmica Estudo dos efeitos bioquímicos e fisiológicos do fármaco com seu receptor ou outros sítios de primários de ação (mecanismo de ação) É o que o
ESTABILIDADE DE ENZIMAS
 ESTABILIDADE DE ENZIMAS Estabilidade Enzimática X Atividade Enzimática Atividade Enzimática: É dada pela medição da velocidade inicial da reação sob uma faixa de condições determinadas. Establidade Enzimática:
ESTABILIDADE DE ENZIMAS Estabilidade Enzimática X Atividade Enzimática Atividade Enzimática: É dada pela medição da velocidade inicial da reação sob uma faixa de condições determinadas. Establidade Enzimática:
Constituintes químicos dos seres vivos
 REVISÃO Bioquímica Constituintes químicos dos seres vivos S A I S I N O R G Â N I C O S CARBOIDRATOS São denominados: açúcares, hidratos de carbono, glicídios ou glicosídeos Energia para o trabalho celular
REVISÃO Bioquímica Constituintes químicos dos seres vivos S A I S I N O R G Â N I C O S CARBOIDRATOS São denominados: açúcares, hidratos de carbono, glicídios ou glicosídeos Energia para o trabalho celular
Complexo Principal de Histocompatibilidade. Alessandra Barone
 Complexo Principal de Histocompatibilidade Alessandra Barone MHC Complexo principal de histocompatibilidade (MHC) ou antígeno leucocitário humano (HLA) Conjunto de proteínas associadas a membrana celular
Complexo Principal de Histocompatibilidade Alessandra Barone MHC Complexo principal de histocompatibilidade (MHC) ou antígeno leucocitário humano (HLA) Conjunto de proteínas associadas a membrana celular
1. Respiração Orgânica x Respiração Celular
 Respiração 1. Respiração Orgânica x Respiração Celular 2. Respiração Direta x Respiração Indireta O 2 CO 2 O 2 CO 2 superfície respiratória tecidos Problema Limita o tamanho Ex: poríferos, cnidários, platelmintos,
Respiração 1. Respiração Orgânica x Respiração Celular 2. Respiração Direta x Respiração Indireta O 2 CO 2 O 2 CO 2 superfície respiratória tecidos Problema Limita o tamanho Ex: poríferos, cnidários, platelmintos,
UNIFESO Engenharia Ambiental Prof.: Edson R. Fernandes dos Santos Aminoácidos
 UNIFESO Engenharia Ambiental Prof.: Edson R. Fernandes dos Santos Aminoácidos Clique para editar o estilo do subtítulo mestre α-aminoácidos Variações possíveis Estrutura básica Amina Ácido Carboxílico
UNIFESO Engenharia Ambiental Prof.: Edson R. Fernandes dos Santos Aminoácidos Clique para editar o estilo do subtítulo mestre α-aminoácidos Variações possíveis Estrutura básica Amina Ácido Carboxílico
Função de Proteínas: Mioglobina e Hemoglobina
 Aula de Bioquímica I Tema: Função de Proteínas: Mioglobina e Hemoglobina Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São
Aula de Bioquímica I Tema: Função de Proteínas: Mioglobina e Hemoglobina Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São
UFSC. Química (Amarela) Resposta: = 05
 Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
BIOLOGIA. Moléculas, células e tecidos. A química da vida Parte 4. Professor: Alex Santos
 BIOLOGIA Moléculas, células e tecidos A química da vida Parte 4 Professor: Alex Santos Tópicos em abordagem: Proteínas: I Conceitos fundamentais II Composição química das proteínas III Funções das proteínas
BIOLOGIA Moléculas, células e tecidos A química da vida Parte 4 Professor: Alex Santos Tópicos em abordagem: Proteínas: I Conceitos fundamentais II Composição química das proteínas III Funções das proteínas
Enzimas e Actividade enzimática
 Enzimas e Actividade enzimática Energia de activação de uma reacção Em todas as células de um organismo vivo ocorre um número infindável de reacções químicas. Estas reacções implicam a quebra, e posteriormente,
Enzimas e Actividade enzimática Energia de activação de uma reacção Em todas as células de um organismo vivo ocorre um número infindável de reacções químicas. Estas reacções implicam a quebra, e posteriormente,
Proteínas e enzimas. Profs. Lourdes, Guilherme e Lauren
 Proteínas e enzimas Profs. Lourdes, Guilherme e Lauren Definição As proteínas são polipeptídios que resultam na condensação de milhares de moléculas de aminoácidos, ligadas em sequencia como elos em uma
Proteínas e enzimas Profs. Lourdes, Guilherme e Lauren Definição As proteínas são polipeptídios que resultam na condensação de milhares de moléculas de aminoácidos, ligadas em sequencia como elos em uma
Aula de Bioquímica II SQM Fosforilação Oxidativa
 Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Tema: Fosforilação Oxidativa Síntese de ATP Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM
Aula de Bioquímica II SQM04242015201 Bacharelado em Ciências Físicas e Biomoleculares Tema: Fosforilação Oxidativa Síntese de ATP Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM
29/08/2015 QUÍMICA DE PROTEÍNAS. Medicina Veterinária IBGM - IBS. Medicina Veterinária IBGM - IBS
 QUÍMICA DE PROTEÍNAS D i s c i p l i n a : b i o q u í m i c a, p r o f. D r. Va g n e O l i v e i ra E-mail: vagne_melo_oliveira@outlook.com Medicina Veterinária IBGM - IBS Medicina Veterinária IBGM -
QUÍMICA DE PROTEÍNAS D i s c i p l i n a : b i o q u í m i c a, p r o f. D r. Va g n e O l i v e i ra E-mail: vagne_melo_oliveira@outlook.com Medicina Veterinária IBGM - IBS Medicina Veterinária IBGM -
Cinética enzimática. Cinética enzimática. Cinética enzimática 20/03/2012. Classificação sistemática das enzimas
 Processo enzimático mais antigo conhecido é o da fermentação da glicose até etanol leveduras. (Pasteur, 1850). Enzima grego na levedura (Pasteur, 1877). Isolamento de todas as enzimas associadas a fermentação
Processo enzimático mais antigo conhecido é o da fermentação da glicose até etanol leveduras. (Pasteur, 1850). Enzima grego na levedura (Pasteur, 1877). Isolamento de todas as enzimas associadas a fermentação
DISCIPLINA DE QUÍMICA
 DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
DISCIPLINA DE QUÍMICA OBJETIVOS: 1ª série Traduzir linguagens químicas em linguagens discursivas e linguagem discursiva em outras linguagens usadas em Química tais como gráficos, tabelas e relações matemáticas,
Sequência 2 = 5...AGG CAT TTC AAG TGC GCT TTC CAT Hae III
 Questão 5 As moléculas de DNA mitocondrial de muitos protozoários conservam diversas características evolutivas, além de sequências intra e interespecíficas que são estudadas nas mais diversas áreas biológicas.
Questão 5 As moléculas de DNA mitocondrial de muitos protozoários conservam diversas características evolutivas, além de sequências intra e interespecíficas que são estudadas nas mais diversas áreas biológicas.
FISIOLOGIA RESPIRATÓRIA REVISÃO
 FISIOLOGIA RESPIRATÓRIA REVISÃO Fisioterapia FMRPUSP Paulo Evora Revisão Anatômica O sistema respiratório consiste no nariz, faringe, laringe, traquéia, brônquios e pulmões. A pleura visceral cobre a superfície
FISIOLOGIA RESPIRATÓRIA REVISÃO Fisioterapia FMRPUSP Paulo Evora Revisão Anatômica O sistema respiratório consiste no nariz, faringe, laringe, traquéia, brônquios e pulmões. A pleura visceral cobre a superfície
Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 ANTÍGENOS
 Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 ANTÍGENOS Monitor: Alessandro Almeida Sumário 1 Definições...1
Universidade Federal da Bahia Faculdade de Medicina Departamento de Anatomia Patológica e Medicina Legal Disciplina de Imunologia MED 194 ANTÍGENOS Monitor: Alessandro Almeida Sumário 1 Definições...1
Licenciatura em Ciências Exatas - IFSC
 Biologia IV Licenciatura em Ciências Exatas - IFSC Proteínas e enzimas Monitora: Natália Karla Bellini Professora: Dra. Ilana Camargo Moléculas orgânicas grupos funcionais Glicose (carboidrato) DNA (fosfodiéster)
Biologia IV Licenciatura em Ciências Exatas - IFSC Proteínas e enzimas Monitora: Natália Karla Bellini Professora: Dra. Ilana Camargo Moléculas orgânicas grupos funcionais Glicose (carboidrato) DNA (fosfodiéster)
Inibidores Enzimáticos
 Inibidores Enzimáticos BIOQUÍMICA - INIBIÇÃO ENZIMÁTICA NOÇÕES BÁSICAS SOBRE ENZIMAS CONCEITO As enzimas são proteínas especializadas na catálise de reações biológicas MECANISMO DE AÇÃO As enzimas aceleram
Inibidores Enzimáticos BIOQUÍMICA - INIBIÇÃO ENZIMÁTICA NOÇÕES BÁSICAS SOBRE ENZIMAS CONCEITO As enzimas são proteínas especializadas na catálise de reações biológicas MECANISMO DE AÇÃO As enzimas aceleram
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa
 OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
OXIDAÇÕES BIOLÓGICAS: Cadeia respiratória e fosforilação oxidativa Metabolismo: integração entre catabolismo e anabolismo Assimilação ou processamento da mat. Orgânica Síntese de Substâncias Estágio 1
AULA ESPECÍFICA. Prof. Rodrigo Becker Cordeiro
 AULA ESPECÍFICA Prof. Rodrigo Becker Cordeiro Química 2ª fase UFPR Apogeu Aula 03 Assuntos abordados Propriedades coligativas Teorias ácido-base Propriedades dos compostos orgânicos Pilhas (ACAFE-SC) O
AULA ESPECÍFICA Prof. Rodrigo Becker Cordeiro Química 2ª fase UFPR Apogeu Aula 03 Assuntos abordados Propriedades coligativas Teorias ácido-base Propriedades dos compostos orgânicos Pilhas (ACAFE-SC) O
FUVEST Segunda Fase. Prova de Biologia
 FUVEST 2004 Segunda Fase Prova de Biologia 06/01/2004 Q.01 Uma enzima, extraída da secreção de um órgão abdominal de um cão, foi purificada, dissolvida em uma solução fisiológica com ph 8 e distribuída
FUVEST 2004 Segunda Fase Prova de Biologia 06/01/2004 Q.01 Uma enzima, extraída da secreção de um órgão abdominal de um cão, foi purificada, dissolvida em uma solução fisiológica com ph 8 e distribuída
PROTEÍNAS. A palavra proteína derivada de proteos, (grego = primeira ou a mais importante)
 PROTEÍNAS A palavra proteína derivada de proteos, (grego = primeira ou a mais importante) Macromolécula mais abundante nas células Produto final da informação genética (DNA-RNA-Proteína) Diversidade funcional
PROTEÍNAS A palavra proteína derivada de proteos, (grego = primeira ou a mais importante) Macromolécula mais abundante nas células Produto final da informação genética (DNA-RNA-Proteína) Diversidade funcional
A massa de uma proteína é expressa em daltons
 Proteínas Globulares Apesar de proteínas fibrosas terem só um tipo de estrutura secundária, as proteínas globulares podem ter diversos tipos de estrutura secundária em uma mesma molécula. As proteínas
Proteínas Globulares Apesar de proteínas fibrosas terem só um tipo de estrutura secundária, as proteínas globulares podem ter diversos tipos de estrutura secundária em uma mesma molécula. As proteínas
