Cinética e regulação enzímicas (a velocidade das reacções enzímicas in vivo e in vitro)
|
|
|
- Giovanni Gonçalves Palmeira
- 6 Há anos
- Visualizações:
Transcrição
1 Cinética e regulação enzímicas (a velocidade das reacções enzímicas in vivo e in vitro) rui.fontes@mail.telepac.pt Laboratório de Bioquímica da Faculdade de Medicina do Porto 1 As concentrações dos intermediários do metabolismo variam de indivíduo para indivíduo e com o estado metabólico mas mantêm-se em torno de determinados valores. As concentrações dos intermediários do metabolismo dizem-se estacionárias. Exemplo: A concentração de ATP (e a maioria dos outros compostos existentes nos seres vivos) considerando as várias reacções em que intervém como reagente ou produto não está em equilíbrio químico....mas a velocidade do conjunto de reacções que formam ATP é (quase) sempre igual à velocidade do conjunto de reacções em que este se gasta... existe nas células uma concentração estacionária de ATP. s mecanismos que permitem manter o ATP, os intermediários do metabolismo, a glicose do plasma, etc em concentrações estacionárias são muito complexos e denominam-se 2de mecanismos homeostáticos. A regulação do metabolismo de modo a adaptar-se a diferentes condições (actividade ou descanso, jejum ou estado absortivo, diferentes tipos de dieta, etc.) é uma condição de sobrevivência. nutrientes C 2 + H 2 ureia 2 ADP + Pi ATP trabalho mecânico contracção muscular transporte activo Ca + Na + Estado absortivo= Glicemia glicose Estado de jejum = Glicemia A adaptação a diferentes condições só é possível porque a actividade das 3 enzimas se modifica quando se alteram essas condições. As enzimas são sensores do ambiente onde se encontram variando a sua actividade em função de variações nesse ambiente. 11 A As enzimas que catalisam reacções fisiologicamente reversíveis catalisam a conversão líquida no sentido directo ou inverso de acordo com a lei da acção das massas mas não são determinantes no sentido nem na velocidade de fluxo (J) da via metabólica... S 1,1 P 1 B,1 As enzimas marca passo de uma via metabólica catalisam reacções fisiologicamente irreversíveis e a sua actividade determina a velocidade de fluxo nessa via metabólica. Estas enzimas (1) têm baixa actividade, (2) tem um papel determinante na regulação do metabolismo e (3) são controladas por efectores que só às vezes coincidem com os substratos e produtos... Glicólise 4
2 Aumentar a actividade de uma enzima que catalisa uma reacção de desequilíbrio (M2 M3) pode significar um aumento transitório na concentração do intermediário M3 mas, a enzima a jusante que catalisa a conversão reversível M3 M4 rapidamente repõe a concentração de M3 num valor próximo do original. J 1 = (1) = (11 1) = 1 É na barragem que se controla o caudal (fluxo) de um rio mudanças no valor do fluxo (J) na barragem provocam mudanças de fluxo idênticas a montante e a jusante da barragem. J 2 = (2) = (12 1) = 2 5 Diferentes tipos de mecanismos podem participar na regulação das enzimas marca-passo das vias metabólicas: 1- De instalação lenta (horas ou dias): a quantidade de enzima como a resultante das velocidades da sua síntese e da sua degradação Modificação alostérica (AMP, Ca 2+ ) 2- De instalação rápida (segundos ou milisegundos): 3- De instalação rápida mas, geralmente, com papel menos importante (pelo menos no metabolismo normal) 2.2- Modificação covalente (fosforilação e defosforilação, clivagem hidrolítica ) 2.3- Ciclos de substratos ( fúteis ) H 2 M M-P 2.4- Acesso ao substrato por regulação do transporte transmembranar (GLUT4, CPT ) M e concentração de substratos Pi ATP ADP 3.1- Inibição isostérica (competitiva) e inibição pelo produto 3.2- ph Temperatura M 1- Mesmo quando o que varia é apenas a concentração da enzima E sem que tenha variado a actividade de cada uma das suas moléculas se a velocidade da reacção que E catalisa aumentou dizemos que a actividade enzímica da enzima E aumentou (e vice-versa). É um mecanismo de instalação lenta. RNAm v1 Síntese proteica H 2 v2 RNAm 2.1- Quando uma fibra muscular se contrai aumenta a velocidade de hidrólise do ATP e aumenta a concentração de ADP (e AMP; 2 ADP AMP + ATP). AMP liga-se à fosforílase muscular induzindo uma conformação mais activa o AMP é um activador alostérico da fosforílase muscular. Fosforílase muscular na conformação tensa (inactiva) AMP sítio alostérico Fosforílase muscular na conformação relaxada (activa) Glicose-1-P v1 > v2 v2 > v1 AMP Se a velocidade de síntese de uma determinada enzima (v1) é maior que a velocidade com que se degrada (hidrolisa) na célula (v2) a concentração e a actividade dessa 7 enzima aumenta. Na condição inversa a concentração e a actividade diminuem. centro activo 8 C 2 + H 2
3 A complexidade dos processos de regulação de enzimas induzida por hormonas e neurotransmissores tem levado a que a palavra alostérico não se use neste contexto mesmo quando o termo seria adequado. Insulina ligada ao seu receptor A ligação entre os modificadores (activadores ou inibidores) alostéricos e os sítios alostéricos das enzimas é reversível e é de tipo não covalente. Activador alostérico receptor da insulina pode ser visto como uma enzima alostérica com o seu centro alostérico activador virado para o lado extra-celular (onde se liga a insulina) e o centro activo no lado citoplasmático. Inibidor alostérico Efeitos da insulina A ligação da insulina induz uma alteração conformacional no receptor que se torna capaz de catalisar a fosforilação de resíduos tirosina de proteínas designadas de Substratos do Receptor da Insulina (IRS). 9 e o mesmo acontece nas ligações dos substratos e dos inibidores isostéricos competitivos ao sítio activo das enzimas. Inibidor isostérico competitivo A modificação da actividade de uma enzima pode envolver a sua modificação covalente (hidrólise irreversível ou fosforilação reversível) por acção catalítica de enzimas (normalmente outras enzimas). Certas enzimas são activadas por hidrólise irreversível. São exemplos a activação dos zimogénios na digestão dos nutrientes. Exemplo 1: tripsinogénio é segregado pelo pâncreas. Convertese em tripsina (protéase digestiva) por acção da enteropeptídase (uma ectopeptídase presente no pólo apical dos enterócitos). Tripsinogénio H 2 Tripsina (activa) Enteropeptídase + polipeptídeo inactivo Exemplo 2: pepsinogénio é segregado pelas células principais do estômago. Converte-se em pepsina (protéase digestiva) por acção hidrolítica do ph ácido do estômago e da próprio pepsina que já se formou. 11 Muitas enzimas são reguladas por mecanismos de fosforilação/desfosforilação catalisadas por enzimas (cínases e fosfátases). Forma desfosforilada (activa) A fosfátase da desidrogénase do piruvato catalisa a desfosforilação da desidrogénase do piruvato que no estado desfosforilado fica activa. Forma fosforilada (inactiva) A cínase da desidrogénase do piruvato catalisa a fosforilação da desidrogénase do piruvato que no estado fosforilado fica inactiva. A actividade da desidrogénase do piruvato depende da percentagem da enzima total que está na forma activa (desfosforilada). valor desta percentagem depende das actividades relativas da (1) cínase 12 da desidrogénase do piruvato e da (2) fosfátase da desidrogénase do piruvato.
4 2.3- A existência de ciclos de substrato (antigamente chamados de fúteis ) permite amplificar o efeito de um sinal. glicose glicose J=1 J=91 Frutose-6-P Pi H 2 Frutose-1,6-bisP J=1 C 2 + H 2 ATP v = 9 v = 1 ADP Frutose-6-P Frutose-1,6-bisP C 2 + H 2 ATP ADP AMP activa a glicólise muscular porque estimula a cínase da frutose-6-p. Se este aumento for de 1 vezes, o facto de esta enzima fazer parte de um ciclo de substrato 13 permite compreender que o aumento no fluxo possa ser de 91 vezes. Pi v = 9 v = 1 AMP H 2 J= Também há ciclos de substrato no fígado (principal órgão da gliconeogénese). Aqui, o sentido do fluxo pode inverter-se. Após uma refeição que contenha glicídeos, a concentração intracelular de frutose-2,6-bisfosfato é alta e fica estimulada a cínase 1 da frutose-6-p (e a glicólise). No jejum, a concentração intracelular de frutose-2,6-bisfosfato é baixa e fica estimulada a frutose-1,6-bisfosfátase (e a gliconeogénese). Glicose-6-P glicose Glicose-6-P J=1 J= - 1 Pi Frutose-6-P Frutose-1,6-bisP Fosfoenol-piruvato ATP J=1 glicose Pi v = 2 H 2 Frutose-6-P Frutose-2,6- v = 1 v = 2 H 2 bisfosfato ADP Frutose- 2,6- bisfosfato Frutose-1,6-bisP Fosfoenol-piruvato J= - 1 ATP ADP 14 v = A acessibilidade aos substratos. Nas fibras musculares a entrada de glicose (e a sua subsequente metabolização) é limitada pelo número de transportadores (GLUT4) presentes na membrana sarcoplasmática. Contracção muscular ou insulina Quer o exercício físico quer a insulina estimulam a entrada de glicose para as fibras musculares porque nestas condições, de forma rápida, vesículas intracelulares contendo GLUT4 fundem-se com a membrana sarcoplasmática. Nos adipócitos o mesmo efeito é induzido pela insulina. A insulina e o exercício físico estimulam a remoção da glicose Nas enzimas marca-passo, geralmente, o efeito directo da variação da concentração do substrato é pequeno (que mais não seja porque, in vivo, as concentrações dos metabolitos são estacionárias). Mas, em alguns casos foi possível estudar in vivo a variação da actividade de enzimas com a concentração do substrato. Num estudo de Brindle et al. (1989) estimulou-se electricamente o nervo ciático de ratos e mediu-se, na musculatura da perna, por NMR (1) a concentração de ADP e (2) a incorporação de Pi no ATP (síntase do ATP). Baixa actividade contráctil Alta actividade contráctil do plasma para as células Brindle et al. (1989) Biochemistry 28:
5 Estudamos até agora os mecanismos 1, 2.1, 2.2, 2.3 e 2.4. Falta referir os 3.1, 3.2 e De instalação lenta: a quantidade de enzima como a resultante das velocidades da sua síntese e da sua degradação. 2- De instalação rápida: 3- De instalação rápida mas, geralmente, com papel menos importante (pelo menos no metabolismo normal) 2.1- Controlo alostérico (AMP, Ca 2+ ) 2.2- Modificação covalente (fosforilação e defosforilação, clivagem hidrolítica ) 2.3- Ciclos de substratos ( fúteis ) 2.4- Acesso ao substrato por regulação do transporte transmembranar (GLUT4, CPT ) e concentração de substrato 3.1- Inibição isostérica (competitiva) e inibição pelo produto 3.2- ph 3.3- Temperatura produto como inibidor das enzimas marca-passo. Na reacção catalisada pela desidrogénase da glicose-6-p (via das pentoses- P) a reacção inversa não existe mas o NADPH compete com o NADP + pelo local de ligação deste no centro activo (inibição isostérica e competitiva). NADP + NADPH NADP + NADPH G 18 kj; Keq/QR 1 6-fosfogliconolactona NADPH é induzida pela insulina) a descida da concentração intracelular de NADPH 18 + A desidrogénase da glicose-6- fosfato é activada sempre que a concentração intracelular de NADPH desce. Para além de regulada ao nível da transcrição (a desidrogénase da glicose-6-p (um dos produtos) também estimula a actividade da enzima Pensa-se que a variação do ph não tem, em geral, um papel importante na regulação das enzimas intracelulares mas a) No estômago o ph do suco gástrico é ácido e as enzimas deste suco têm ph óptimo ácido No homem, a alteração de actividade das enzimas das células em situações de abaixamento da temperatura corporal ou de febre poderá ser importante mas não desempenha um papel relevante na regulação do metabolismo normal. As enzimas e transportadores humanos (ao contrário do que acontece com outros seres vivos) foram seleccionados de forma a manterem velocidades de fluxo adequadas à vida (nas vias anabólicas e catabólicas) numa estreita gama de temperaturas. b) suco pancreático neutraliza o quimo gástrico (H + + HC 3- C 2 + H 2 ) e as enzimas do suco pancreático e as enzimas digestivas Francisco Lázaro ( ) s órgãos para transplante são transportados a baixas temperaturas de forma a lentificar os processos catabólicos nomeadamente a hidrólise de proteínas (enzimas, transportadores, actina-miosina, etc) intestinais têm ph óptimo neutro. 19 2
6 Estudar as enzimas in vitro (no tubo de ensaio) para quê? A) estudo das enzimas é muito útil em análises clínicas A) estudo das enzimas é muito útil em investigação A1 - Doseamentos de enzimas plasmáticas (algumas enzimas só aparecem no plasma sanguíneo em determinadas patologias) A2 - Doseamentos de enzimas celulares (a deficiência de uma enzima pode ser diagnosticada ) A3 Uso de enzimas purificadas de bactérias ou fungos como instrumento no doseamento de substâncias (como a glicose sanguínea e múltiplas outras substâncias ) B1- estudo das enzimas é uma importante área da investigação bioquímica. B2-As enzimas purificadas são instrumentos imprescindíveis em múltiplas outras áreas de 21 investigação. Quando se quer quantificar a actividade de uma enzima adicionamos num tubo de ensaio a enzima ao(s) substrato(s) e vamos observando ao longo do tempo como evolui a reacção. Produto (micromoles) Acumulação de produto versus tempo 1/min,5/min tempo (min),1/min normal é que (por motivos vários) a reacção se vá lentificando. Quando se atingir o equilíbrio químico ou se esgotar o substrato a velocidade será zero mas actividade enzímica = velocidade da reacção enzímica Produto (micromoles) Acumulação de produto versus tempo Actividade azul (v ou ) = 1 mole / min Tempo (min) Admitamos que fizemos dois ensaios idênticos mas com duas amostras diferentes da mesma enzima E: amostra azul amostra vermelha Em qual das amostras a enzima E tinha maior actividade? Como podemos exprimir quantitativamente a actividade da enzima E na amostra azul? Se respondessemos: actividade = 3 moles/5 min =,6 moles/min... estariamos a falar da velocidade média nos 5 min de ensaio e a dizer que nas duas amostras a actividade era igual. Para a concentração de substrato em que o ensaio se iniciou a velocidade será o declive da curva produto formado versus tempo no tempo zero (v ou ) mas poderemos considerar que, pelo menos no caso do ensaio azul, uma boa estimativa 23 de v pode ser a velocidade média no primeiro minuto de ensaio (1 mole/min). Em teoria a actividade de uma enzima (num sistema de ensaio especificado e adequado) define-se como o aumento de velocidade de conversão (S P) induzido pela enzima: Actividade = = vel. na presença de enzima vel. na sua ausência ph=1 incubar substrato na presença de Fosf Alc. durante um tempo t ph=1 incubar substrato na ausência de Fosf Alc. durante um tempo t NaH NaH ph=12; ph onde a Fosfátase Alcalina pára de funcionar ph=12 ler Absorvância no ensaio enzímico ler Absorvância no ensaio a branco A realização de ensaios a branco (sem enzima) permite prevenir a eventualidade de ocorrer reacção não enzímica. Ao subtrair o branco... também se subtrai o produto que eventualmente 24 se tenha formado na ausência de enzima (ou que esteja presente como contaminante do substrato).
7 Como variará se duplicarmos (ou triplicarmos...) a concentração de enzima num ensaio enzímico? Qual a quantidade de enzima E no ensaio vermelho? Acumulação de produto versus tempo 3 A actividade enzímica ( ou uma boa estimativa de ) num meio especificado e adequado é proporcional à quantidade de enzima ( desde que a concentração molar de enzima seja muito inferior à do substrato). v inicial kcat Km S S E total v const. inicial E total se fizermos ensaios nas mesmas condições (temperatura, ph, etc.) k cat e Km são constantes; se também usarmos a mesma concentração de substrato [S] 25 este factor éconstante Produto (micromoles) Tempo (min) UI (unidade internacional) = quantidade de enzima que catalisa a conversão de 1 mol de substrato em produto / min Embora, pelo menos teoricamente, a quantidade de uma enzima possa ser medida em moles ou em gramas, é mais frequente medir a quantidade de enzima como uma velocidade de reacção; a velocidade da reacção catalisada pela enzima 26 em análise (idealmente no tempo zero; ). Admitindo que 1) a enzima E catalisa a reacção XY 2) o tubo de ensaio A continha 1 ml de solução 3) no tempo zero se adicionou 1 l de soro 4)... e se foi medindo a quantidade X ao longo do tempo Qual a actividade da enzima E no soro em análise? 1) No tubo A nos primeiros 1 min a concentração de X passou de 1 para 9 mm = diminuiu 1 mm (ou 1 M) 2) 1 M *,1 L = 1 moles de X convertido em Y 3) 1 mol de X/ 1 min = 1 mol / min 4) 1 UI / l soro Notar que no tubo B se adicionou um volume diferente do mesmo soro. Porque a velocidade de reacção observada em B era metade da observada em A quer dizer que em B havia metade do número de moles da enzima E. u seja, em B o volume de soro era,5 l. 27 Quando se doseiam enzimas numa preparação que a contém (usando a actividade como medida da quantidade de enzima) pressupõe-se que a actividade ( ) é proporcional à quantidade de enzima. Pâncreas inflamado liberta amílase para o sangue Em química clínica doseiam-se com frequência enzimas no soro (por exemplo a amílase do soro em situações em que se suspeita de pancreatite aguda) exprimindo o resultado do ensaio enzimático em velocidade de reacção / volume de soro sanguíneo Porque as condições de ensaio (concentração e natureza dos substratos, ph, natureza do tampão, temperatura, etc.) podem não ser iguais em dois laboratórios distintos os valores normais de um laboratório podem não ser iguais aos de outro laboratório. 1 mol de glicose é 1 mol de glicose em qualquer sítio do mundo mas 1 UI de amílase (ou outra enzima qualquer) em dois laboratórios 28 distintos pode significar diferentes quantidades de enzima.
8 A actividade enzímica aumenta se o número de moléculas de enzima aumentar (e vice-versa). doseamento de uma enzima em tecidos pode servir para estudar o efeito de hormonas na síntese dessa enzima. A insulina inibe a expressão de genes que codificam enzimas envolvidas na produção de glicose como, por exemplo, o gene da glicose-6-fosfátase. Glicose-6-P Porquê expressar actividade em UI / massa de tecido (ou UI / mg de proteína)? Permite comparar dois ensaios enzímicos em que se usam concentrações de enzima distintas... 2 mg de fígado Homogeneizado de fígado 1 mg de fígado 2 mol/min = 2UI 2 mol / 2min = 1UI o número de moléculas de glicose-6-29 fosfátase aumenta pela razão oposta. Glicose-6- fosfátase no fígado Voice et al. (1992) BST 2:272S Quando há muita insulina o número de moléculas de glicose-6-fosfátase diminui porque diminui a transcrição do seu gene. Quando há pouca insulina 2 UI 2 mg de fígado Actividade específica = 1 UI / mg de fígado 1 UI 1 mg de fígado Actividade específica = 1 UI / mg de fígado 3 Quando se doseia uma enzima necessitamos de um meio de ensaio que contém obrigatoriamente o substrato (ou substratos) da enzima...mas em diferentes laboratórios podem usar-se diferentes temperaturas de ensaio. 2ºC 7ºC Aumentar a temperatura aumenta a velocidade das reacções incluindo a velocidade de desnaturação das enzimas. Para dosear uma enzima, para além da temperatura, também se escolhem outras condições de ensaio como, por exemplo, o ph do meio de ensaio. Quando doseamos uma enzima costuma escolher-se para ph de ensaio um valor próximo do ph óptimo dessa enzima. Se numa amostra de tecido existirem duas enzimas que catalisem a mesma reacção mas essas enzimas tiverem phs óptimos distintos posso, escolhendo o ph de ensaio, estudar uma ou outra dessas enzimas. exemplo da figura indica que se se pretendesse dosear a enzima em questão poderia ser 31mais cómodo escolher para temperatura de ensaio 3ºC... ph 7 favorece isoenzima vermelha ph 1 favorece isoenzima azul 32
9 Para dosear uma enzima, para além da temperatura e do ph, também se escolhe a concentração do substrato. Eventualmente podemos fazer vários ensaios usando diferentes concentrações do substrato. A actividade de uma enzima aumenta com a concentração de substrato......mas para concentrações altas (saturantes) aumentar a concentração de substrato praticamente não afecta a actividade. Considerar apenas um substrato é uma simplificação (estritamente só as isomérases têm um substrato)...mas podem fixar-se as concentrações dos outros substratos e estudar-se como varia a actividade ( )... em função da variação da concentração de um deles. 33 = k cat A actividade é proporcional à quantidade de complexo ES no meio de ensaio (k cat é a constante de proporcionalidade) Para diferentes enzimas o aspecto do gráfico actividade versus S... pode ser hiperbólico ou sigmoide... mas a característica saturabilidade está sempre presente. 34 Num grande número de enzimas o gráfico versus [S] tem o aspecto de uma hipérbole que se ajusta à equação de Michaelis-Menten V S max Km S As enzimas com cinéticas de tipo hiperbólico são aquelas em que o gráfico versus [S] pode ser ajustado a uma equação do tipo V max Km S S... sendo que Vmax e Km são constantes (...se a única condição de ensaio que varia é [S]) 35 Numa reacção enzímica existe um ciclo catalítico em que da ligação entre a enzima livre e o substrato resulta a formação do complexo ES; o complexo ES pode dissociar-se mas também vai formando produto e regenerando enzima livre. Num ensaio enzímico enquanto a concentração de substrato não baixar de forma significativa a concentração do complexo ES vai-se mantendo numa concentração estacionária. valor da concentração estacionária de ES depende (1) da concentração de enzima, (2) da concentração de substrato e (3) da afinidade entre a enzima e o seu substrato. k cat A velocidade de formação do produto é proporcional à concentração do complexo ES (M/min) = k cat [ES] (mol/min) = 36 k cat [ES] x vol. meio de ensaio
10 Actividade ou v ou =k cat [ES] = k cat [Etotal]/2 = Vmax/2 Se não há substrato [ES] = V inicial = Existe uma concentração de substrato (= Km) em que metade das moléculas de enzima estão ligadas ao substrato (enzima hemisaturada) [ES] = [E] [ES] = [Etotal]/2 concentração de substrato = Km Se a concentração de substrato é elevada quase todas as moléculas de enzima estão ligadas ao substrato [ES] [Etotal] k cat [Etotal] Vmax concentração de substrato é saturante 37 Se [S] < K m é quase proporcional a [S]...e menos de metade das moléculas de enzima estão ligadas ao substrato A actividade enzímica para concentração saturante de substrato = V max... se a concentração de substrato é elevada variações moderadas na concentração do substrato não afectam a actividade para dosear enzimas é frequente usarem-se concentrações elevadas de substrato porque o gráfico produto formado versus tempo se mantém linear durante mais tempo. Se [S] = K m = V max / 2...e a enzima está hemisaturada 38 A partir da equação v Vmax Km S S Km é uma medida da afinidade da enzima para o seu substrato...quando maior o valor do Km menor a afinidade (e vive-versa)....pode deduzir-se o valor de v para determinadas concentrações de substrato. v Km >> v V max Km [S] S S... se Km>>[S] denominador Km [S] = Km Km << [S] V S v Vmax v max S S Km S S... se Km<<[S] denominador [S] Vmax S v S v VmaxS v Vmax S 2 S Km v é directamente proporcional a [S] para baixas concentrações de S... se Km=[S] denominador =2 [S] V v 2 max V max v não é afectado por 39[S] para altas concentrações de S Km A enzima azul precisa de uma concentração de substrato menor para ficar hemisaturada......porque tem maior afinidade para o substrato que a enzima cinzenta. Em ambos os casos a enzima está hemisaturada mas Km (no caso da enzima azul) < Km (no caso da enzima cinzenta) Brincando: o Km mede o desamor entre a enzima e o seu substrato Km 4
11 Km mede a afinidade da enzima para o seu substrato...quando maior o valor do Km menor a afinidade. A enzima azul já está hemisaturada ([ES]=[Et]/2) quando [S]= 3 mm (Km = 3 mm) tem alta afinidade para o substrato Vmax1=Vmax2 (mm) A enzima cinzenta está hemisaturada ([ES]=[Et]/2) quando [S]= 1 mm (Km = 1 mm) tem baixa afinidade para o substrato 41 Quando se estuda o efeito da concentração de substrato na actividade de algumas enzimas e se representa versus [S] o gráfico pode ser não uma hipérbole mas um sigmóide. As teorias actualmente mais aceites para interpretar este tipo de comportamento cinético surgiram na década de 6 e visavam interpretar um fenómeno semelhante: a forma sigmoide do gráfico de saturação da hemoglobina. Essas teorias revelaram-se adequadas para interpretar as cinéticas de tipo sigmoide em enzimas com mais de um local de ligação ao substrato por molécula de enzima (enzimas poliméricas). v V S max h 5 h S S h ; h = coeficiente de Hill 42 Quando o gráfico velocidade de reacção (ou velocidade de transporte transmembranar) versus concentração de reagente (ou substância transportada) é uma recta indica-nos que o processo reactivo (ou de transporte) é não enzímico (ou não mediado). Velocidade de reacção ou transporte transmembranar Processo não catalisado; saturabilidade ausente Processos reactivos (ou de transporte) catalisados por enzimas (ou transportadores); saturabilidade presente Concentrações de glicose possíveis no hepatócito A actividade das enzimas pode ser diminuída ou aumentada pela adição ao sistema de ensaio de modificadores da actividade enzímica (inibidores e activadores). Adicionando a um meio de ensaio uma substância M (inibidor ou activador) e mantendo constantes todas as outras condições de ensaio podemos obter diminuição (inibição) ou aumento (activação) da actividade enzímica. na ausência de inibidor = 1 UI = 3 UI Grau de inibição = 3% Actividade enzímica } v o +inibidor v o{ +activador A comparação entre o valor do Km (ou S 5 ) e a concentração estacionária (in vivo) do substrato numa enzima (ou num transportador) diz-nos se a enzima (ou o transportador) 43 é ou não sensível a variações fisiológicas na concentração de substrato. Grau de inibição ou grau de activação = v inicial vinicial na ausência de M 44
12 Um estudo mais aprofundado do efeito de um inibidor na actividade duma enzima pode revelar que ele aumenta o K m do substrato sem modificar V max. Quando se estuda a actividade enzímica para vários valores de S podemos, multiplicando o número de tubos de ensaios, fazer esse estudo: na ausência e na presença de um inibidor I. Algumas vezes observa-se que: 1- Na presença do inibidor o valor de V max não se modifica; para concentrações de substrato elevadas o inibidor I não tem efeito. 2- valor do K m observado é maior na presença de I que na sua ausência; o grau de inibição é mais marcado para concentrações de substrato baixas. Nestes casos falamos de inibição competitiva Para [S] = 4 grau inibição = 14 % Para [S] = saturante grau inibição = % Para [S] = 4 grau inibição =5% 45 Para explicar o comportamento deste sistema (I aumento do K m mas I não afecta V max ) poderemos admitir que o inibidor I e o substrato S se ligam no centro activo da enzima competindo entre si. As possibilidades do modelo apresentado corresponderem à realidade são reforçadas se as estruturas moleculares do substrato e do inibidor forem semelhantes. Nestes casos há inibição isostérica competitiva H 2 A fosfátase alcalina catalisa a hidrólise do para-nitrofenilfosfato: para-nitrofenilfosfato + H 2 para-nitrofenol + Pi vanadato é um inibidor competitivo 46 da fosfátase alcalina. Quando um inibidor isostérico competitivo está presente, para obter hemisaturação da enzima com substrato, preciso de ter maior concentração do substrato; a presença do inibidor aumenta o Km. vanadato é um inibidor competitivo da fosfátase alcalina = eleva o Km do para-nitrofenilfosfato mas não tem efeito no Vmax. Se a concentração de substrato for suficientemente alta compete eficazmente como o inibidor. Vmax sem vanadato Vmax/2 vanadato 2,5 M Na ausência de inibidor esta concentração de substrato permitia hemisaturação. Km era 9. Mas na presença do inibidor para esta concentração de substrato só 1/6 das moléculas de enzima estão ligadas ao substrato. Na presença do inibidor competitivo preciso de aumentar a concentração de substrato para 32 para obter hemisaturação com o substrato. Na presença do inibidor 47 o Km (que era 9) aumentou para 32. Km (sem vanadato) =1,1 mm Km (com vanadato) =7,6 mm Seargeant & Stinson (1979) Biochem J. 181: 247. Quando adicionado a meios de ensaio que contenham para-nitrofenilfosfato e fosfátase alcalina, o vanadato (HV 2-4 ), inibe a actividade da enzima quando a concentração de para-nitrofenilfosfato não é saturante 48 = a inibição é de tipo competitivo.
13 Quando se estuda de efeito de um inibidor para diferentes concentrações de substrato podemos, eventualmente, observar que a inibição não é de tipo competitivo. Algumas vezes observa-se que: 1- V max é menor na presença de I que na sua ausência. 2- Na presença de I o K m não se modifica; a concentração de substrato para a qual se observa um valor de actividade que é metade de V max (ou de V max ) é igual na presença e na ausência de I. Um modelo possível para explicar a inibição de tipo não competitivo é admitir a existência na enzima de um local de ligação diferente do centro activo (um sítio alostérico) cuja ligação ao inibidor impedisse a formação do produto. km1 Km1= Km2 km2 kcat1 Kcat2 = 3- grau de inibição é independente da concentração de substrato. No exemplo o grau de inibição = 4% para todas as concentrações de substrato Nestes casos diz-se que a inibição é não competitiva. 49 De acordo com o modelo (garantindo Km invariante) a afinidade entre a enzima e o substrato é igual nos casos da forma ligada e desligada do inibidor. De acordo com este modelo tudo se passaria como se as moléculas de enzima ligadas ao inibidor estivessem excluídas do processo catalítico, isto é, como se houvesse menos moléculas de enzima no meio de ensaio. 5 Um ligando diferente do substrato que se liga ao centro activo é um inibidor isostérico (se se liga no centro activo só pode inibir). Se a ligação entre um inibidor isostérico e o centro activo for reversível (se poder se deslocado pelo substrato) esse inibidor comporta-se funcionalmente como inibidor competitivo... mas se a ligação do inibidor ao sítio activo for irreversível (não podendo ser deslocado por altas concentrações de substrato) as moléculas de enzima ligadas ao inibidor ficam excluídas do processo catalítico. A lípase pancreática catalisa a hidrólise de triacilgliceróis no intestino. No tratamento da obesidade pode usar-se um fármaco (orlistat; xenical) que é um inactivador (= inibidor irreversível) da lípase pancreática. Neste caso o inibidor comporta-se funcionalmente como não competitivo e é, frequentemente, orlistat reage com uma serina (formando uma ligação covalente e irreversível) situada no centro activo da enzima usado o termo inactivador bloqueando a sua actividade.
14 No estudo in vitro de enzimas reguladas por fosforilação/desfosforilação podem usar-se inibidores das cínases e das fosfátases envolvidas. doseamento da actividade da desidrogénase do piruvato pode ser feito em homogeneizados. Se o homogeneizado é preparado na presença de inibidores quer da cínase (dicloroacetato) quer da fosfátase (fluoreto)...quando se faz o ensaio mede-se a actividade actual. Se o homogeneizado é preparado na presença do inibidor da cínase (dicloroacetato) mas na ausência de fluoreto...quando se faz o ensaio mede-se a actividade total. Na ausência de inibidor (fluoreto), a fosfátase do tecido transforma toda a desidrogénase do piruvato na sua forma activa. Pi H 2 fluoreto P ADP Dicloroacetato ATP 53 Bibliografia utilizada: 1. Rakus, D., Maciaszczyk, E., Wawrzycka, D., Ulaszewski, S., Eschrich, K. & Dzugaj, A. (25) The origin of the high sensitivity of muscle fructose 1,6- bisphosphatase towards AMP, FEBS Lett. 579, Sugden, M. C. & Holness, M. J. (26) Mechanisms underlying regulation of the expression and activities of the mammalian pyruvate dehydrogenase kinases, Arch Physiol Biochem. 112, Veiga-da-Cunha, M., Courtois, S., Michel, A., Gosselain, E. & Van Schaftingen, E. (1996) Amino acid conservation in animal glucokinases. Identification of residues implicated in the interaction with the regulatory protein, J Biol Chem. 271, Jeukendrup, A. E. (22) Regulation of fat metabolism in skeletal muscle, Ann N Y Acad Sci. 967, Sterk, J. P., Stanley, W. C., Hoppel, C. L. & Kerner, J. (23) A radiochemical pyruvate dehydrogenase assay: activity in heart, Anal Biochem. 313, Voet, D. & Voet, J. G. (24) Biochemistry, 3rd edn, John Wiley and Sons, Inc., USA. 7. Nelson, D. L. & Cox, M. M. (25) Lenhinger principles of biochemistry, 4ª edn, New York. 8. Thorens, B. (1996) Glucose transporters in the regulation of intestinal, renal, and 54 liver glucose fluxes, Am J Physiol. 27, G
Estudar as enzimas in vitro (no tubo de ensaio) para quê?
 Estudar as enzimas in itro (no tubo de ensaio) para quê? A) O estudo das enzimas é muito útil em análises clínicas A) O estudo das enzimas é muito útil em inestigação A - Doseamentos de enzimas plasmáticas
Estudar as enzimas in itro (no tubo de ensaio) para quê? A) O estudo das enzimas é muito útil em análises clínicas A) O estudo das enzimas é muito útil em inestigação A - Doseamentos de enzimas plasmáticas
Cinética e regulação enzímicas (a velocidade das reações enzímicas in vivo e in vitro)
 Conceitos de substrato de via metabólica, coenzima, grupo prostético e cofator. Cinética e regulação enzímicas (a velocidade das reações enzímicas in vivo e in vitro) ruifonte@med.up.pt Departamento de
Conceitos de substrato de via metabólica, coenzima, grupo prostético e cofator. Cinética e regulação enzímicas (a velocidade das reações enzímicas in vivo e in vitro) ruifonte@med.up.pt Departamento de
Cinética e regulação enzímicas (a velocidade das reacções enzímicas in vivo e in vitro)
 Conceitos de substrato de via metabólica, coenzima, grupo prostético e cofactor. Cinética e regulação enzímicas (a velocidade das reacções enzímicas in vivo e in vitro) rui.fontes@mail.telepac.pt Laboratório
Conceitos de substrato de via metabólica, coenzima, grupo prostético e cofactor. Cinética e regulação enzímicas (a velocidade das reacções enzímicas in vivo e in vitro) rui.fontes@mail.telepac.pt Laboratório
[ S] [ S] se fizermos ensaios nas mesmas condições (temperatura, ph,
![[ S] [ S] se fizermos ensaios nas mesmas condições (temperatura, ph, [ S] [ S] se fizermos ensaios nas mesmas condições (temperatura, ph,](/thumbs/62/47257897.jpg) Quando se quer quantificar a atiidade de uma enzima adicionamos num tubo de ensaio a enzima ao(s) (s) e amos obserando ao longo do tempo como eolui a reação. Produto (micromoles) 1.5 1.5 Acumulação de
Quando se quer quantificar a atiidade de uma enzima adicionamos num tubo de ensaio a enzima ao(s) (s) e amos obserando ao longo do tempo como eolui a reação. Produto (micromoles) 1.5 1.5 Acumulação de
Estudar as enzimas in vitro (no tubo de ensaio) para quê?
 Estudar as enzimas in itro (no tubo de ensaio) para quê? A) O estudo das enzimas é muito útil em análises clínicas A) O enzimas na inestigação A1 - Doseamentos de enzimas plasmáticas (algumas enzimas só
Estudar as enzimas in itro (no tubo de ensaio) para quê? A) O estudo das enzimas é muito útil em análises clínicas A) O enzimas na inestigação A1 - Doseamentos de enzimas plasmáticas (algumas enzimas só
Problemas sobre o doseamento da actividade de enzimas
 Problemas sobre o doseamento da actividade de enzimas Perg. 1: Uma enzima E catalisa a transformação A P. Num tubo de ensaio colocou-se A, tampão e ao minuto zero adicionou-se uma determinada quantidade
Problemas sobre o doseamento da actividade de enzimas Perg. 1: Uma enzima E catalisa a transformação A P. Num tubo de ensaio colocou-se A, tampão e ao minuto zero adicionou-se uma determinada quantidade
Enzimas e Actividade enzimática
 Enzimas e Actividade enzimática Energia de activação de uma reacção Em todas as células de um organismo vivo ocorre um número infindável de reacções químicas. Estas reacções implicam a quebra, e posteriormente,
Enzimas e Actividade enzimática Energia de activação de uma reacção Em todas as células de um organismo vivo ocorre um número infindável de reacções químicas. Estas reacções implicam a quebra, e posteriormente,
A velocidade das reacções enzímicas in vivo e in vitro
 A elocidade das reacções enzímicas in io e in itro Conceitos de de ia metabólica, coenzima, grupo prostético e cofactor. Os conceitos de da ia metabólica e coenzima só têm sentido se analisamos uma ia
A elocidade das reacções enzímicas in io e in itro Conceitos de de ia metabólica, coenzima, grupo prostético e cofactor. Os conceitos de da ia metabólica e coenzima só têm sentido se analisamos uma ia
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
Pontifícia Universidade Católica de Goiás Departamento de Biologia Bioquímica Metabólica ENZIMAS Origem das proteínas e de suas estruturas Níveis de Estrutura Protéica Estrutura das proteínas Conformação
São moléculas catalíticas protéicas (exceto algumas que são RNA) - Prefixo que designa a reação: lactato desidrogenase, catalase
 1 5 Enzimas a) Conceito - O que são enzimas? São moléculas catalíticas protéicas (exceto algumas que são RNA) - Moléculas que aumentam a velocidade de reações sem se alterarem neste processo. - Catalisam
1 5 Enzimas a) Conceito - O que são enzimas? São moléculas catalíticas protéicas (exceto algumas que são RNA) - Moléculas que aumentam a velocidade de reações sem se alterarem neste processo. - Catalisam
O 2 CO 2 + H 2 O. Absorção da glicose, glicólise e desidrogénase do piruvato. ADP + Pi. nutrientes ATP
 Absorção da glicose, glicólise e desidrogénase do piruvato Em todas as células ocorre continuamente a hidrólise do ATP (formando ADP + a uma velocidade tal que, mesmo em repouso, todo o stock de ATP se
Absorção da glicose, glicólise e desidrogénase do piruvato Em todas as células ocorre continuamente a hidrólise do ATP (formando ADP + a uma velocidade tal que, mesmo em repouso, todo o stock de ATP se
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2007/2008. Disciplina de BIOQUÍMICA I Curso de MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2007/2008 Disciplina de BIOQUÍMICA I Curso de MEDICINA º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 8ª AULA PRÁTICA Determinação da actividade enzimática
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2007/2008 Disciplina de BIOQUÍMICA I Curso de MEDICINA º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 8ª AULA PRÁTICA Determinação da actividade enzimática
Gliconeogénese e Metabolismo do Glicogénio
 Página 1 de 5 Aulas de grupo 2001-02; Rui Fontes Gliconeogénese e Metabolismo do Glicogénio 1- Gliconeogénese 1- A gliconeogénese é um termo usado para incluir o conjunto de processos pelos quais o organismo
Página 1 de 5 Aulas de grupo 2001-02; Rui Fontes Gliconeogénese e Metabolismo do Glicogénio 1- Gliconeogénese 1- A gliconeogénese é um termo usado para incluir o conjunto de processos pelos quais o organismo
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros
 Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
Cinética Enzimática. Prof Karine P. Naidek Novembro/2016
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Cinética Enzimática Prof Karine P. Naidek Novembro/2016 Cinética das Reações Bioquímicas
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA DQMC BIOQUÍMICA BIO0001 Cinética Enzimática Prof Karine P. Naidek Novembro/2016 Cinética das Reações Bioquímicas
Enzimas revisões. v o = V max [S] K m + [S]
![Enzimas revisões. v o = V max [S] K m + [S] Enzimas revisões. v o = V max [S] K m + [S]](/thumbs/67/57975399.jpg) nzimas revisões k 1 k + 3 + S k 2 S P v o = V max [S] K m + [S] quação de Michaelis-Menten V max é o valor para o qual tende a velocidade à medida que se aumenta a concentração de substrato; corresponde
nzimas revisões k 1 k + 3 + S k 2 S P v o = V max [S] K m + [S] quação de Michaelis-Menten V max é o valor para o qual tende a velocidade à medida que se aumenta a concentração de substrato; corresponde
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros
 Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
Estudo da velocidade da reação enzimática e como ela se altera em função de diferentes parâmetros Importante abordagem para o entendimento do mecanismo de ação de uma enzima. Vários fatores afetam a atividade
UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO Campus de Jaboticabal Faculdade de Ciências Agrárias e Veterinárias.
 UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO Campus de Jaboticabal Faculdade de Ciências Agrárias e Veterinárias Enzimas Prof. Luciano Hauschild Plano de aula 1) Atuação das enzimas na cinética
UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO Campus de Jaboticabal Faculdade de Ciências Agrárias e Veterinárias Enzimas Prof. Luciano Hauschild Plano de aula 1) Atuação das enzimas na cinética
Resumo esquemático da glicólise
 Resumo esquemático da glicólise Destino do piruvato em condições aeróbicas e anaeróbicas Glicólise Fermentação Oxidação completa Em condições aeróbicas o piruvato é oxidado a acetato que entra no ciclo
Resumo esquemático da glicólise Destino do piruvato em condições aeróbicas e anaeróbicas Glicólise Fermentação Oxidação completa Em condições aeróbicas o piruvato é oxidado a acetato que entra no ciclo
Cinética enzimática. Cinética enzimática. Cinética enzimática 20/03/2012. Classificação sistemática das enzimas
 Processo enzimático mais antigo conhecido é o da fermentação da glicose até etanol leveduras. (Pasteur, 1850). Enzima grego na levedura (Pasteur, 1877). Isolamento de todas as enzimas associadas a fermentação
Processo enzimático mais antigo conhecido é o da fermentação da glicose até etanol leveduras. (Pasteur, 1850). Enzima grego na levedura (Pasteur, 1877). Isolamento de todas as enzimas associadas a fermentação
Proteínas II. (Enzimas) Bioquímica Prof. Dr. Marcelo Soares
 Proteínas II (Enzimas) Conceitos Gerais e Funções As enzimas são proteínas especializadas na catálise de reações biológicas Consideradas as biomoléculas mais notáveis devido a sua extraordinária especificidade
Proteínas II (Enzimas) Conceitos Gerais e Funções As enzimas são proteínas especializadas na catálise de reações biológicas Consideradas as biomoléculas mais notáveis devido a sua extraordinária especificidade
Que relação existe entre a atividade enzimática e a velocidade das reações? Catalisadores
 Que relação existe entre a atividade enzimática e a velocidade das reações? Catalisadores Que relação existe entre a atividade enzimática e a velocidade das reações? As enzimas diminuem a energia de ativação
Que relação existe entre a atividade enzimática e a velocidade das reações? Catalisadores Que relação existe entre a atividade enzimática e a velocidade das reações? As enzimas diminuem a energia de ativação
Biossíntese e degradação de glicogênio. Integração entre o controle da glicólise e da glicogenólise em diferentes tipos celulares
 Biossíntese e degradação de glicogênio Regulação da via glicolítica Integração entre o controle da glicólise e da glicogenólise em diferentes tipos celulares O glicogênio é o polissacarídio de reserva
Biossíntese e degradação de glicogênio Regulação da via glicolítica Integração entre o controle da glicólise e da glicogenólise em diferentes tipos celulares O glicogênio é o polissacarídio de reserva
Metabolismo e Regulação
 Metabolismo e Regulação PRBLEMAS - Série 1 Soluções 2009/2010 idratos de Carbono (Revisão) e Metabolismo Central 1 R: (α 1 4) (lineares) Ο (α1 6) (pontos de ramificação) 2. R: Locais de glicosilação são
Metabolismo e Regulação PRBLEMAS - Série 1 Soluções 2009/2010 idratos de Carbono (Revisão) e Metabolismo Central 1 R: (α 1 4) (lineares) Ο (α1 6) (pontos de ramificação) 2. R: Locais de glicosilação são
A atividade das enzimas e o seu controlo na regulação do fluxo das vias metabólicas
 A atividade das enzimas e o seu controlo na regulação do fluxo das vias metabólicas Índice 1. A atividade das enzimas cujas reações são fisiologicamente reversíveis é controlada pelas concentrações dos
A atividade das enzimas e o seu controlo na regulação do fluxo das vias metabólicas Índice 1. A atividade das enzimas cujas reações são fisiologicamente reversíveis é controlada pelas concentrações dos
O passo limitante de uma via metabólica (que determina a velocidade de toda a via) pode ser determinado por:
 O passo limitante de uma via metabólica (que determina a velocidade de toda a via) pode ser determinado por: Limite por quantidade/velocidade de enzima Limite por quantidade de substrato Bioquímica 15
O passo limitante de uma via metabólica (que determina a velocidade de toda a via) pode ser determinado por: Limite por quantidade/velocidade de enzima Limite por quantidade de substrato Bioquímica 15
Introdução e apresentação geral do metabolismo da glicose
 Introdução e apresentação geral do metabolismo da glicose Índice 1- O transporte transmembranar e a fosforilação da glicose...1 2- A glicólise e a oxidação da glicose a CO 2...1 3- A oxidação da glicose-6-fosfato
Introdução e apresentação geral do metabolismo da glicose Índice 1- O transporte transmembranar e a fosforilação da glicose...1 2- A glicólise e a oxidação da glicose a CO 2...1 3- A oxidação da glicose-6-fosfato
1- Microrganismos e indústria alimentar 1.1 Fermentação e actividade enzimática
 Unidade 4 Produção de alimentos e sustentabilidade 1- Microrganismos e indústria alimentar 1.1 1 Qual é a importância dos microrganismos na indústria alimentar? Queijo Os microrganismos são essenciais
Unidade 4 Produção de alimentos e sustentabilidade 1- Microrganismos e indústria alimentar 1.1 1 Qual é a importância dos microrganismos na indústria alimentar? Queijo Os microrganismos são essenciais
Teste de frequência módulo de Bioquímica 21 Jan 98
 Licenciatura em Enfermagem Biofísica e Bioquímica 1º Ano - 1º Semestre 2007/2008 Teste de frequência módulo de Bioquímica 21 Jan 98 Cotação máxima 13,5 valores (A cotação de cada pergunta está indicada
Licenciatura em Enfermagem Biofísica e Bioquímica 1º Ano - 1º Semestre 2007/2008 Teste de frequência módulo de Bioquímica 21 Jan 98 Cotação máxima 13,5 valores (A cotação de cada pergunta está indicada
Revisão do Metabolismo da Glicose
 Gliconeogênese Revisão do Metabolismo da Glicose Esquema Geral da Glicólise lise 1 açúcar de 6 C 2 açúcares de 3 C A partir deste ponto as reações são duplicadas 2 moléculas de Piruvato (3C) Saldo 2 moléculas
Gliconeogênese Revisão do Metabolismo da Glicose Esquema Geral da Glicólise lise 1 açúcar de 6 C 2 açúcares de 3 C A partir deste ponto as reações são duplicadas 2 moléculas de Piruvato (3C) Saldo 2 moléculas
DETERMINAÇÃO DA ACTIVIDADE DE ENZIMAS DA GLICÓLISE EM EXTRACTOS DE CÉLULAS DE LEVEDURA. Glucose + 2Pi + 2ADP + 2NAD! 2CH COCOO " 2ATP " 2NADH " 2 H
 DETERMINAÇÃ DA ACTIVIDADE DE ENZIMAS DA GLICÓLISE EM EXTRACTS DE CÉLULAS DE LEVEDURA 1. Introdução A glicólise é um caminho metabólico quase universal no qual a glucose é convertida em piruvato com síntese
DETERMINAÇÃ DA ACTIVIDADE DE ENZIMAS DA GLICÓLISE EM EXTRACTS DE CÉLULAS DE LEVEDURA 1. Introdução A glicólise é um caminho metabólico quase universal no qual a glucose é convertida em piruvato com síntese
Avaliação Quantitativa das Preparações Enzimáticas
 Avaliação Quantitativa das Preparações Enzimáticas Como diferenciar enzimas? Quando não podemos determinar a concentração de uma enzima devemos diferenciar as enzimas por sua atividade (moléculas não podem
Avaliação Quantitativa das Preparações Enzimáticas Como diferenciar enzimas? Quando não podemos determinar a concentração de uma enzima devemos diferenciar as enzimas por sua atividade (moléculas não podem
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE. Profa. Dra. Marina Prigol
 Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE Profa. Dra. Marina Prigol GLICONEOGÊNESE PROCESSO DE SÍNTESE DE GLICOSE A PARTIR DE COMPOSTOS NÃO GLICÍDICOS OCORRÊNCIA: Citosol do
Universidade Federal do Pampa Campus Itaqui Bioquímica GLICONEOGÊNESE Profa. Dra. Marina Prigol GLICONEOGÊNESE PROCESSO DE SÍNTESE DE GLICOSE A PARTIR DE COMPOSTOS NÃO GLICÍDICOS OCORRÊNCIA: Citosol do
REGULAÇÃO HORMONAL DO METABOLISMO DO GLICOGÊNIO E DE LIPÍDIOS
 REGULAÇÃO HORMONAL DO METABOLISMO DO GLICOGÊNIO E DE LIPÍDIOS Tiroxina Epinefrina (adrenalina) Glucagon Insulina Hormônios esteroides: Cortisol (Suprarenal) Progesterona Testosterona Estradiol Aldosterona
REGULAÇÃO HORMONAL DO METABOLISMO DO GLICOGÊNIO E DE LIPÍDIOS Tiroxina Epinefrina (adrenalina) Glucagon Insulina Hormônios esteroides: Cortisol (Suprarenal) Progesterona Testosterona Estradiol Aldosterona
Metabolismo e Endocrinologia
 Metabolismo e Endocrinologia Teórica-Pratica: 1 Tema: 1.Enzimologia 1.1 Noções de termodinâmica 1.2 Cinética 1.3 Inibição 2. Tópicos de resposta para a primeira teórico-prática Data: 30.03.2011 1 ENZIMOLOGIA
Metabolismo e Endocrinologia Teórica-Pratica: 1 Tema: 1.Enzimologia 1.1 Noções de termodinâmica 1.2 Cinética 1.3 Inibição 2. Tópicos de resposta para a primeira teórico-prática Data: 30.03.2011 1 ENZIMOLOGIA
Glória Braz GLICÓLISE
 Glória Braz GLICÓLISE Utilização de glicose pelas células A glicólise é a via metabólica mais conservada nos sistemas biológicos A glicose é o combustível preferencial e mais versátil disponível nas células
Glória Braz GLICÓLISE Utilização de glicose pelas células A glicólise é a via metabólica mais conservada nos sistemas biológicos A glicose é o combustível preferencial e mais versátil disponível nas células
METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários. Bioquímica. Profa. Dra. Celene Fernandes Bernardes
 METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários Bioquímica Profa. Dra. Celene Fernandes Bernardes REFERÊNCIA: Bioquímica Ilustrada - Champe ESTÁGIOS DO CATABOLISMO
METABOLISMO ENERGÉTICO integração e regulação alimentado jejum catabólitos urinários Bioquímica Profa. Dra. Celene Fernandes Bernardes REFERÊNCIA: Bioquímica Ilustrada - Champe ESTÁGIOS DO CATABOLISMO
Biologia 12 Fermentação e actividade enzimática
 Biologia 12 Fermentação e actividade enzimática Uma elevada percentagem de produtos que consumimos é produzida, mantida ou degradada por microorganismos. O conhecimento do metabolismo microbiano permitirá
Biologia 12 Fermentação e actividade enzimática Uma elevada percentagem de produtos que consumimos é produzida, mantida ou degradada por microorganismos. O conhecimento do metabolismo microbiano permitirá
5/4/2011. Metabolismo. Vias Metabólicas. Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos).
 Metabolismo Vias Metabólicas Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos). 1 Endergônico Exergônico Catabolismo Durante o catabolismo de carboidratos,
Metabolismo Vias Metabólicas Séries de reações consecutivas catalisadas enzimaticamente, que produzem produtos específicos (metabólitos). 1 Endergônico Exergônico Catabolismo Durante o catabolismo de carboidratos,
Mecanismo de reação de uma enzima com substrato único. A enzima (E) liga o substrato (S) e liberta o produto (P).
 CINÉTICA ENZIMÁTICA Cinética Enzimática Estudo da velocidade de uma reação química que ocorre na presença de uma enzima a) Medir as velocidades das transformações que se processam; b) Estudar a influências
CINÉTICA ENZIMÁTICA Cinética Enzimática Estudo da velocidade de uma reação química que ocorre na presença de uma enzima a) Medir as velocidades das transformações que se processam; b) Estudar a influências
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS. Enzimas. Prof. Me. Cássio Resende de Morais
 FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
FUNDAÇÃO CARMELITANA MÁRIO PALMÉRIO FACIHUS - FACULDADE DE CIÊNCIAS HUMANAS E SOCIAIS Enzimas Prof. Me. Cássio Resende de Morais Enzimas Catalisadores biológicos: substâncias de origem biológica que aceleram
Enzimas. Bianca Zingales IQ - USP
 Enzimas Bianca Zingales IQ - USP Enzimas As enzimas são catalisadores biológicos extremamente eficientes que aceleram 10 9 a 10 12 vezes (em média) a velocidade da reação. As enzimas chegam a transformar
Enzimas Bianca Zingales IQ - USP Enzimas As enzimas são catalisadores biológicos extremamente eficientes que aceleram 10 9 a 10 12 vezes (em média) a velocidade da reação. As enzimas chegam a transformar
Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula!
 Aula: 20 Temática: Funções bioquímicas das proteínas parte II Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula! 1) Mediadores e reguladores metabólicos (continuação):
Aula: 20 Temática: Funções bioquímicas das proteínas parte II Na aula de hoje continuaremos a estudar as funções bioquímicas das proteínas. Boa aula! 1) Mediadores e reguladores metabólicos (continuação):
Aula INIBIÇÃO E REGULAÇÃO ENZIMÁTICA
 INIBIÇÃO E REGULAÇÃO ENZIMÁTICA META Entender como os inibidores enzimáticos e a regulação enzimática interferem na velocidade das reações enzimáticas. OBJETIVOS Ao final desta aula, o aluno deverá: definir
INIBIÇÃO E REGULAÇÃO ENZIMÁTICA META Entender como os inibidores enzimáticos e a regulação enzimática interferem na velocidade das reações enzimáticas. OBJETIVOS Ao final desta aula, o aluno deverá: definir
Proteínas catalisadoras que AUMENTAM a VELOCIDADE das reações, sem sofrerem alterações no processo global.
 ENZIMAS Proteínas catalisadoras que AUMENTAM a VELOCIDADE das reações, sem sofrerem alterações no processo global. Toda enzima é uma proteína, mas nem toda proteína é uma enzima! CARACTERÍSTICAS GERAIS:
ENZIMAS Proteínas catalisadoras que AUMENTAM a VELOCIDADE das reações, sem sofrerem alterações no processo global. Toda enzima é uma proteína, mas nem toda proteína é uma enzima! CARACTERÍSTICAS GERAIS:
Introdução ao bloco II Enfermagem. Monica Montero Lomeli Sylvia Alquéres
 Introdução ao bloco II Enfermagem Monica Montero Lomeli Sylvia Alquéres Programação de aulas 16/set 21/set 23/set 28/set 30/set 05/out 07/out 12/out 14/out Apresentação do bloco + Enzimas I (cinéeca) Enzimas
Introdução ao bloco II Enfermagem Monica Montero Lomeli Sylvia Alquéres Programação de aulas 16/set 21/set 23/set 28/set 30/set 05/out 07/out 12/out 14/out Apresentação do bloco + Enzimas I (cinéeca) Enzimas
Hormônios do pâncreas. Insulina. Glucagon. Somatostatina. Peptídeos pancreáticos
 Endocrinologia do Pâncreas! O pâncreas como um órgão endócrino Importante papel na absorção, distribuição e armazenamento de vários substratos energéticos Hormônios do pâncreas Insulina Glucagon Somatostatina
Endocrinologia do Pâncreas! O pâncreas como um órgão endócrino Importante papel na absorção, distribuição e armazenamento de vários substratos energéticos Hormônios do pâncreas Insulina Glucagon Somatostatina
Prática 8: Inibição por maltose (Ki) Execução e recolhimento dos exercícios 11 a 13
 Prática 7: Caracterização da -glicosidase (Km e Vmax) Prática 8: Inibição por maltose (Ki) Execução e recolhimento dos exercícios 11 a 13 Prática 7: Caracterização da -glicosidase (Km e Vmax) Prática 8:
Prática 7: Caracterização da -glicosidase (Km e Vmax) Prática 8: Inibição por maltose (Ki) Execução e recolhimento dos exercícios 11 a 13 Prática 7: Caracterização da -glicosidase (Km e Vmax) Prática 8:
Hidrólise da ureia pela urease
 Hidrólise da ureia pela urease DQB Velocidade de uma reacção enzimática DQB Para cada case do utilização de um enzima para catálise de uma dada reacção é necessário conhecer a estequiometria da reacção
Hidrólise da ureia pela urease DQB Velocidade de uma reacção enzimática DQB Para cada case do utilização de um enzima para catálise de uma dada reacção é necessário conhecer a estequiometria da reacção
Gliconeogénese. glicose-6-p + H 2 O glicose + Pi (1)
 Gliconeogénese 1- A palavra gliconeogénese é, num sentido mais estrito, usada para designar colectivamente o conjunto de processos pelos quais o organismo pode converter substâncias não glicídicas (como
Gliconeogénese 1- A palavra gliconeogénese é, num sentido mais estrito, usada para designar colectivamente o conjunto de processos pelos quais o organismo pode converter substâncias não glicídicas (como
2- No dia estavam classificadas 4046 enzimas que podem ser consultadas em
 A maioria das enzimas são de natureza proteica e, relativamente aos outros catalisadores, têm uma grande especificidade em relação aos substratos e produtos da reacção. 1- A palavra enzima (do Grego: en,
A maioria das enzimas são de natureza proteica e, relativamente aos outros catalisadores, têm uma grande especificidade em relação aos substratos e produtos da reacção. 1- A palavra enzima (do Grego: en,
Enzimas - Sítio catalítico
 Enzimas - Sítio catalítico Significado de cofator, grupo prostético e coenzima Enzima holozima Grupo prostético metal cofator coenzima Distinção entre cofator e coenzima depende da força de ligação com
Enzimas - Sítio catalítico Significado de cofator, grupo prostético e coenzima Enzima holozima Grupo prostético metal cofator coenzima Distinção entre cofator e coenzima depende da força de ligação com
Enzimas. Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini
 Enzimas Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Enzimas Proteínas especializadas em catalisar reações biológicas, ou seja aumentam a velocidade
Enzimas Disciplina: Bioquímica Curso: Análises Clínicas 3º. Módulo Docente: Profa. Dra. Marilanda Ferreira Bellini Enzimas Proteínas especializadas em catalisar reações biológicas, ou seja aumentam a velocidade
Inibidores Enzimáticos
 Inibidores Enzimáticos BIOQUÍMICA - INIBIÇÃO ENZIMÁTICA NOÇÕES BÁSICAS SOBRE ENZIMAS CONCEITO As enzimas são proteínas especializadas na catálise de reações biológicas MECANISMO DE AÇÃO As enzimas aceleram
Inibidores Enzimáticos BIOQUÍMICA - INIBIÇÃO ENZIMÁTICA NOÇÕES BÁSICAS SOBRE ENZIMAS CONCEITO As enzimas são proteínas especializadas na catálise de reações biológicas MECANISMO DE AÇÃO As enzimas aceleram
PRINCIPAIS VIAS METABÓLICAS
 PRINCIPAIS VIAS METABÓLICAS DEGRADAÇÃO DO GLIGOGÊNIO GLICÓLISE VIA DAS PENTOSES FOSFATO GLICONEOGÊNESE SÍNTESE DE CORPOS CETÔNICOS DEGRADAÇÃO DE AMINOÁCIDOS E CICLO DA URÉIA CICLO DE KREBS Β-OXIDAÇÃO DE
PRINCIPAIS VIAS METABÓLICAS DEGRADAÇÃO DO GLIGOGÊNIO GLICÓLISE VIA DAS PENTOSES FOSFATO GLICONEOGÊNESE SÍNTESE DE CORPOS CETÔNICOS DEGRADAÇÃO DE AMINOÁCIDOS E CICLO DA URÉIA CICLO DE KREBS Β-OXIDAÇÃO DE
Aula 4: Enzimas Cinética e Regulação
 Disciplina de Engenharia de Proteínas Curso de Ciências Biológicas Aula 4: Enzimas Cinética e Regulação Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias
Disciplina de Engenharia de Proteínas Curso de Ciências Biológicas Aula 4: Enzimas Cinética e Regulação Prof. Marcos Túlio de Oliveira mtoliveira@fcav.unesp.br Faculdade de Ciências Agrárias e Veterinárias
Conceitos de cinética enzimática e modelos clássicos de inibição enzimática
 Conceitos de cinética enzimática e modelos clássicos de inibição enzimática Índice 1 Conceitos básicos de cinética química.... 1 2 Natureza química das enzimas e modelos de interação com os seus substratos....
Conceitos de cinética enzimática e modelos clássicos de inibição enzimática Índice 1 Conceitos básicos de cinética química.... 1 2 Natureza química das enzimas e modelos de interação com os seus substratos....
SINAIS EXTRACELULARES. sinais e receptores químicos
 SINAIS EXTRACELULARES sinais e receptores químicos SINAIS EXTRACELULARES principais tipos SINAIS EXTRACELULARES exemplos MOLÉCULAS Metabolitos Citocinas Interleucinas Factores de crescimento Hormonas Nutrientes
SINAIS EXTRACELULARES sinais e receptores químicos SINAIS EXTRACELULARES principais tipos SINAIS EXTRACELULARES exemplos MOLÉCULAS Metabolitos Citocinas Interleucinas Factores de crescimento Hormonas Nutrientes
CATÁLISE ENZIMÁTICA. CINÉTICA Controle da velocidade de reações. CINÉTICA Equilíbrio e Estado Estacionário
 CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
CATÁLISE ENZIMÁTICA Equilíbrio e Estado Estacionário P U T F M A Velocidade: período inicial Tempo As medidas de velocidade inicial (v 0 ) são obtidas com a variação da concentração de S btenção de várias
Metabolismo e Regulação
 Metabolismo e Regulação PROBLEMAS - Série 1 Licenciatura em Bioquímica Licenciatura em Biologia Celular e Molecular Licenciatura em Química Aplicada Hidratos de Carbono e Metabolismo Central (Revisão)
Metabolismo e Regulação PROBLEMAS - Série 1 Licenciatura em Bioquímica Licenciatura em Biologia Celular e Molecular Licenciatura em Química Aplicada Hidratos de Carbono e Metabolismo Central (Revisão)
Catalizadores biológicos - Aceleram reações químicas específicas sem a formação de produtos colaterais
 O que são enzimas? Catalizadores biológicos - Aceleram reações químicas específicas sem a formação de produtos colaterais Reagentes = substratos Local onde a reação ocorre = sitio ou centro ativo S + E
O que são enzimas? Catalizadores biológicos - Aceleram reações químicas específicas sem a formação de produtos colaterais Reagentes = substratos Local onde a reação ocorre = sitio ou centro ativo S + E
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2010/2011. Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2010/2011 Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 7ª AULA TEÓRICO-PRÁTICA
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2010/2011 Unidade Curricular de BIOQUÍMICA II Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 7ª AULA TEÓRICO-PRÁTICA
Gliconeogênese. Gliconeogênese. Órgãos e gliconeogênese. Fontes de Glicose. Gliconeogênese. Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia
 Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia Gliconeogênese Alexandre Havt Gliconeogênese Fontes de Energia para as Células Definição Via anabólica que ocorre no fígado e, excepcionalmente
Gliconeogênese Metabolismo dos aminoácidos Ciclo da Uréia Gliconeogênese Alexandre Havt Gliconeogênese Fontes de Energia para as Células Definição Via anabólica que ocorre no fígado e, excepcionalmente
Metabolismo CO 2 + H 2 O O 2 + CH 2 O
 Metabolismo CO 2 + H 2 O O 2 + CH 2 O Glicólise Glicólise A via de Embden-Meyerhof (Warburg) Essencialmente todas as células executam a glicólise Consiste em dez reacções iguais em todas as células
Metabolismo CO 2 + H 2 O O 2 + CH 2 O Glicólise Glicólise A via de Embden-Meyerhof (Warburg) Essencialmente todas as células executam a glicólise Consiste em dez reacções iguais em todas as células
Exame normal módulo de Bioquímica 11 Fev 08
 Licenciatura em Enfermagem Biofísica e Bioquímica 1º Ano - 1º Semestre 2007/2008 Exame normal módulo de Bioquímica 11 Fev 08 Duração = 2 horas Cotação máxima = 13,5 valores (A cotação de cada pergunta
Licenciatura em Enfermagem Biofísica e Bioquímica 1º Ano - 1º Semestre 2007/2008 Exame normal módulo de Bioquímica 11 Fev 08 Duração = 2 horas Cotação máxima = 13,5 valores (A cotação de cada pergunta
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
BIOQUÍMICA 1º ano de Medicina Ensino teórico 2010/2011
 BIOQUÍMICA 1º ano de Medicina Ensino teórico 2010/2011 10ª aula teórica 19 Outubro 2010 Príncipios gerais de enzimologia. Modo de acção das enzimas. Cinética enzimática (Eq. Michaelis-Menten; K M e V max
BIOQUÍMICA 1º ano de Medicina Ensino teórico 2010/2011 10ª aula teórica 19 Outubro 2010 Príncipios gerais de enzimologia. Modo de acção das enzimas. Cinética enzimática (Eq. Michaelis-Menten; K M e V max
QBQ 0102 Educação Física. Carlos Hotta. Enzimas 17/03/15
 QBQ 0102 Educação Física Carlos Hotta Enzimas 17/03/15 Previously... Proteínas são polímeros de aminoácidos A estrutura primária de uma proteína determina sua estrutura terciária e, portanto, sua função
QBQ 0102 Educação Física Carlos Hotta Enzimas 17/03/15 Previously... Proteínas são polímeros de aminoácidos A estrutura primária de uma proteína determina sua estrutura terciária e, portanto, sua função
CQ110 : Princípios de FQ. Imagens de Rorschach
 Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
Cinética em fase homogênea
 Cinética em fase homogênea Hipótese chave-fechadura Centro ativo complementar em tamanho, forma e natureza química à molécula do substrato, ou seja, uma cavidade geometricamente rígida. Emil Fischer (1894)
Cinética em fase homogênea Hipótese chave-fechadura Centro ativo complementar em tamanho, forma e natureza química à molécula do substrato, ou seja, uma cavidade geometricamente rígida. Emil Fischer (1894)
Epinefrina, glucagon e insulina. Hormônios com papéis fundamentais na regulação do metabolismo
 Epinefrina, glucagon e insulina Hormônios com papéis fundamentais na regulação do metabolismo Epinefrina ou adrenalina Estímulos para a secreção de epinefrina: Perigos reais ou imaginários Exercício físico
Epinefrina, glucagon e insulina Hormônios com papéis fundamentais na regulação do metabolismo Epinefrina ou adrenalina Estímulos para a secreção de epinefrina: Perigos reais ou imaginários Exercício físico
Metabolismo do Glicogénio
 Metabolismo do Glicogénio Metabolismo do glicogénio; Rui Fontes 1- O glicogénio é um polímero que contém resíduos de glicose ligados por ligações glicosídicas (1 4) e, nos locais de ramificação, glicosídicas
Metabolismo do Glicogénio Metabolismo do glicogénio; Rui Fontes 1- O glicogénio é um polímero que contém resíduos de glicose ligados por ligações glicosídicas (1 4) e, nos locais de ramificação, glicosídicas
OBJETIVOS BIBLIOGRAFIA ENZIMAS E INIBIDORES ENZIMÁTICOS
 OBJETIVOS Enzimas: Funções, Nomenclatura e Propriedades Fundamentos da Cinética Enzimática Cinética Enzimática: Michaelis-Menten Ensaios Cinéticos: Padronização e Validação Parâmetros Cinéticos: vo, KM,
OBJETIVOS Enzimas: Funções, Nomenclatura e Propriedades Fundamentos da Cinética Enzimática Cinética Enzimática: Michaelis-Menten Ensaios Cinéticos: Padronização e Validação Parâmetros Cinéticos: vo, KM,
2 APLICAÇÕES INDUSTRIAIS Tabela 1: Enzimas aplicadas na indústria APLICAÇÃO ENZIMA
 CINÉTICA ENZIMÁTICA INTRODUÇÃO O conhecimento das propriedades cinéticas das enzimas é importante para compreender as transformações que ocorrem no interior das células que participam dos processos fermentativos
CINÉTICA ENZIMÁTICA INTRODUÇÃO O conhecimento das propriedades cinéticas das enzimas é importante para compreender as transformações que ocorrem no interior das células que participam dos processos fermentativos
Enzimas versus outros catalisadores
 Enzimas versus outros catalisadores Catalisadores proteicos Elevados factores de aceleração das reacções Grande especificidade para os substratos Estereo-especificidade (também absoluta) Reduzido número
Enzimas versus outros catalisadores Catalisadores proteicos Elevados factores de aceleração das reacções Grande especificidade para os substratos Estereo-especificidade (também absoluta) Reduzido número
Bibliografia. BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina. Stryer, Biochemistry, 5ª Ed, 2006, Capítulo 17
 BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina 14ª aula teórica Complexo da piruvato desidrogenase (PDH) e ciclo de Krebs. 15/11/2010 Bibliografia Stryer, Biochemistry, 5ª
BIOQUÍMICA I 2010/2011 Ensino teórico - 1º ano Mestrado Integrado em Medicina 14ª aula teórica Complexo da piruvato desidrogenase (PDH) e ciclo de Krebs. 15/11/2010 Bibliografia Stryer, Biochemistry, 5ª
Enzimas regulatórias no controle do metabolismo 1
 Enzimas regulatórias no controle do metabolismo 1 1. Introdução A regulação do metabolismo é fundamental para que um organismo possa responder de modo rápido e eficiente a variações das condições ambientais,
Enzimas regulatórias no controle do metabolismo 1 1. Introdução A regulação do metabolismo é fundamental para que um organismo possa responder de modo rápido e eficiente a variações das condições ambientais,
Glicólise e desidrogénase do piruvato
 Glicólise e desidrogénase do piruvato Glicólise e desidrogénase do piruvato; Rui Fontes 1- O metabolismo energético dos seres vivos pode ser interpretado como um processo no qual os nutrientes são oxidados
Glicólise e desidrogénase do piruvato Glicólise e desidrogénase do piruvato; Rui Fontes 1- O metabolismo energético dos seres vivos pode ser interpretado como um processo no qual os nutrientes são oxidados
ENZIMAS. Faculdade Maurício de Nassau Cursos de Biomedicina, Enfermagem, Farmácia e Fisioterapia Disciplina de Bioquímica. Prof.: Me.
 Faculdade Maurício de Nassau Cursos de Biomedicina, Enfermagem, Farmácia e Fisioterapia Disciplina de Bioquímica ENZIMAS Prof.: Me. Allysson Haide 1 O que será abordado sobre as enzimas? Introdução às
Faculdade Maurício de Nassau Cursos de Biomedicina, Enfermagem, Farmácia e Fisioterapia Disciplina de Bioquímica ENZIMAS Prof.: Me. Allysson Haide 1 O que será abordado sobre as enzimas? Introdução às
Utilização de glicose pelas células. A glicólise é a via metabólica mais conservada nos sistemas biológicos
 Utilização de glicose pelas células A glicólise é a via metabólica mais conservada nos sistemas biológicos A glicose é o combustível preferencial e mais versátil disponível nas células vivas. Principais
Utilização de glicose pelas células A glicólise é a via metabólica mais conservada nos sistemas biológicos A glicose é o combustível preferencial e mais versátil disponível nas células vivas. Principais
Universidade de São Paulo Instituto de Física Energia em Sistemas Biológicos Edi Carlos Sousa
 Universidade de São Paulo Instituto de Física Energia em Sistemas Biológicos Edi Carlos Sousa edisousa@if.usp.br Metabolismo Celular Cada reação que ocorre em um organismo vivo requer o uso de energia
Universidade de São Paulo Instituto de Física Energia em Sistemas Biológicos Edi Carlos Sousa edisousa@if.usp.br Metabolismo Celular Cada reação que ocorre em um organismo vivo requer o uso de energia
ENZIMAS ENZIMAS ENZIMAS 19/02/17 DEFINIÇÃO CLASSIFICAÇÃO ESTRUTURAL. ativa. inativa
 DFNÇÃO nzimas são proteínas que atuam como catalisadores biológicos o Aceleram a velocidade das reações químicas o Não alteram os produtos finais das reações o Zimogênio (inativas) / nzima (ativas) Composto
DFNÇÃO nzimas são proteínas que atuam como catalisadores biológicos o Aceleram a velocidade das reações químicas o Não alteram os produtos finais das reações o Zimogênio (inativas) / nzima (ativas) Composto
Metabolismo de Carboidratos
 Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Gliconeogênese - Ocorre principalmente no fígado; - Algumas das enzimas utilizadas na síntese
Metabolismo de Carboidratos Curso de Bioqímica para Saúde Coletiva- UFRJ Profa. Dra. Mônica Santos de Freitas 1 Gliconeogênese - Ocorre principalmente no fígado; - Algumas das enzimas utilizadas na síntese
Cinética das reacções enzimáticas
 Cinética das reacções enzimáticas Pioneiros da cinética enzimática: 1913 - L. Michaelis e M.L. Menten 1925 - Briggs e Haldane Leonor Michaelis Maud L. Menten v o = V max [S] K m + [S] Equação de Michaelis-Menten
Cinética das reacções enzimáticas Pioneiros da cinética enzimática: 1913 - L. Michaelis e M.L. Menten 1925 - Briggs e Haldane Leonor Michaelis Maud L. Menten v o = V max [S] K m + [S] Equação de Michaelis-Menten
Equipe de Biologia. Biologia
 Aluno (a): Série: 3ª Turma: TUTORIAL 4B Ensino Médio Equipe de Biologia Data: Biologia ENZIMAS CONCEITOS GERAIS E FUNÇÕES As enzimas são proteínas especializadas na catálise de reações biológicas. Elas
Aluno (a): Série: 3ª Turma: TUTORIAL 4B Ensino Médio Equipe de Biologia Data: Biologia ENZIMAS CONCEITOS GERAIS E FUNÇÕES As enzimas são proteínas especializadas na catálise de reações biológicas. Elas
-Caracterizar os componentes moleculares das células e dos compostos químicos biologicamente importantes para a área de nutrição.
 UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA PLANO DE ENSINO SEMESTRE 2010-2 I. IDENTIFICAÇÃO DA DISCIPLINA CÓDIGO NOME DA DISCIPLINA NO DE HORAS-AULA
UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS BIOLÓGICAS DEPARTAMENTO DE BIOQUÍMICA PLANO DE ENSINO SEMESTRE 2010-2 I. IDENTIFICAÇÃO DA DISCIPLINA CÓDIGO NOME DA DISCIPLINA NO DE HORAS-AULA
Pâncreas Endócrino Controle da glicemia
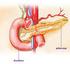 Pâncreas Endócrino Controle da glicemia Curso de Odontologia da UEM Prof. Kellen Brunaldi Silverthorn (Cap. 22) Guyton (Cap. 78) O SNC é responsável por cerca de 50% da glicose diariamente consumida para
Pâncreas Endócrino Controle da glicemia Curso de Odontologia da UEM Prof. Kellen Brunaldi Silverthorn (Cap. 22) Guyton (Cap. 78) O SNC é responsável por cerca de 50% da glicose diariamente consumida para
Trabalhos de Bioquímica
 Trabalhos de Bioquímica Professora Liza Felicori Bioquímica do Exercício Bioquímica do Câncer Bioquímica do Envelhecimento Bioquímica do Diabetes Bioquímica da Obesidade 5 pontos : material Fórum Moodle
Trabalhos de Bioquímica Professora Liza Felicori Bioquímica do Exercício Bioquímica do Câncer Bioquímica do Envelhecimento Bioquímica do Diabetes Bioquímica da Obesidade 5 pontos : material Fórum Moodle
PERÍODO ABSORTIVO E PÓS-ABSORTIVO
 PERÍODO ABSORTIVO E PÓS-ABSORTIVO HORMONAS QUE REGULAM O METABOLISMO PRINCIPAIS FONTES DE ENERGIA CELULAR VIAS METABÓLICAS DO PERIODO ABSORTIVO ALTERAÇÕES METABÓLICAS DO PERIODO PÓS-ABSORTIVO PRODUÇÃO
PERÍODO ABSORTIVO E PÓS-ABSORTIVO HORMONAS QUE REGULAM O METABOLISMO PRINCIPAIS FONTES DE ENERGIA CELULAR VIAS METABÓLICAS DO PERIODO ABSORTIVO ALTERAÇÕES METABÓLICAS DO PERIODO PÓS-ABSORTIVO PRODUÇÃO
Metabolismo do azoto dos aminoácidos e ciclo da ureia
 Metabolismo do azoto dos aminoácidos e ciclo da ureia 1- Os aminoácidos existentes no sangue e nas células resultam da hidrólise das proteínas endógenas ou das proteínas da dieta. A maior parte dos aminoácidos
Metabolismo do azoto dos aminoácidos e ciclo da ureia 1- Os aminoácidos existentes no sangue e nas células resultam da hidrólise das proteínas endógenas ou das proteínas da dieta. A maior parte dos aminoácidos
PROTEÍNAS Professores: Manoela e Marco Aurélio 2017
 PROTEÍNAS Professores: Manoela e Marco Aurélio 2017 Bioquímica Celular Elementos químicos da matéria viva Principais substâncias presentes na matéria viva Proteínas - Nutriente construtor (função plástica)
PROTEÍNAS Professores: Manoela e Marco Aurélio 2017 Bioquímica Celular Elementos químicos da matéria viva Principais substâncias presentes na matéria viva Proteínas - Nutriente construtor (função plástica)
MONITORIZAÇÃO DA DEGRADAÇÃO DO GLICOGÉNIO
 MONITORIZAÇÃO DA DEGRADAÇÃO DO GLICOGÉNIO 1. Objectivo Neste trabalho, ir-se-á observar a degradação do glicogénio ao longo tempo: i) em meio ácido e à temperatura de 100ºC (degradação química); ii) em
MONITORIZAÇÃO DA DEGRADAÇÃO DO GLICOGÉNIO 1. Objectivo Neste trabalho, ir-se-á observar a degradação do glicogénio ao longo tempo: i) em meio ácido e à temperatura de 100ºC (degradação química); ii) em
Farmacodinamia. Estudo dos mecanismos de acção e efeitos dos fármacos
 Sumário Farmacodinamia. Conceito de receptor. Afinidade e eficácia; constantes de afinidade. Tipos e subtipos de receptores. Mecanismos transductores / efectores; família da proteína G, receptores ligados
Sumário Farmacodinamia. Conceito de receptor. Afinidade e eficácia; constantes de afinidade. Tipos e subtipos de receptores. Mecanismos transductores / efectores; família da proteína G, receptores ligados
Termodinâmica. Estudo das formas de energia que afetam a matéria. Sistemas (moléculas + solutos) X ambiente (sistema - universo)
 Termodinâmica Estudo das formas de energia que afetam a matéria Sistemas (moléculas + solutos) X ambiente (sistema - universo) Possibilita prever se processos bioquímicos são possíveis Aplicações: conformação
Termodinâmica Estudo das formas de energia que afetam a matéria Sistemas (moléculas + solutos) X ambiente (sistema - universo) Possibilita prever se processos bioquímicos são possíveis Aplicações: conformação
Via das pentoses-fosfato
 Via das pentoses-fosfato A U L A 24 objetivos Nesta aula, você vai conhecer a via das pentoses-fosfato, um desvio da via glicolítica necessário às células que realizam reações de biossíntese redutoras.
Via das pentoses-fosfato A U L A 24 objetivos Nesta aula, você vai conhecer a via das pentoses-fosfato, um desvio da via glicolítica necessário às células que realizam reações de biossíntese redutoras.
Aula: 29 Temática: Metabolismo dos lipídeos parte I
 Aula: 29 Temática: Metabolismo dos lipídeos parte I Os lipídeos são armazenados em grandes quantidades como triglicerídeos neutros altamente insolúveis, tanto nos vegetais como nos animais. Eles podem
Aula: 29 Temática: Metabolismo dos lipídeos parte I Os lipídeos são armazenados em grandes quantidades como triglicerídeos neutros altamente insolúveis, tanto nos vegetais como nos animais. Eles podem
Estabilidade Enzimática
 Estabilidade Enzimática Biocatálise e Biorremediação 17 de Março de 2016 David Cruz Nº 47030 Matteo Melosini Nº 48286 Vânia Silva Nº 48242 Índice Objectivos... 2 Resumo... 2 Resultados... 3 Meio não aquoso
Estabilidade Enzimática Biocatálise e Biorremediação 17 de Março de 2016 David Cruz Nº 47030 Matteo Melosini Nº 48286 Vânia Silva Nº 48242 Índice Objectivos... 2 Resumo... 2 Resultados... 3 Meio não aquoso
Oxidação parcial o que acontece com o piruvato?
 A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
A glicólise ocorre no citosol das células transforma a glicose em duas moléculas de piruvato e é constituída por uma sequência de 10 reações (10 enzimas) divididas em duas fases. Fase preparatória (cinco
Rui Fontes. O sentido das reacções de oxi-redução e a fosforilação oxidativa
 Rui Fontes O sentido das reacções de oxi-redução e a fosforilação oxidativa Porto 2005 Índice 1. As tabelas de potencial redox dos bioquímicos não são iguais às dos químicos porque são diferentes as condições
Rui Fontes O sentido das reacções de oxi-redução e a fosforilação oxidativa Porto 2005 Índice 1. As tabelas de potencial redox dos bioquímicos não são iguais às dos químicos porque são diferentes as condições
Glicólise. Monica Montero Lomeli Sylvia Alquéres
 Glicólise Monica Montero Lomeli Sylvia Alquéres Fontes de energia Como esses alimentos viram energia? Fontes de energia HOJE O Que é um carboidrato? Carbono Hidrato Poli hidroxi cetonas ou Poli hidroxi
Glicólise Monica Montero Lomeli Sylvia Alquéres Fontes de energia Como esses alimentos viram energia? Fontes de energia HOJE O Que é um carboidrato? Carbono Hidrato Poli hidroxi cetonas ou Poli hidroxi
