RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA. Adilson A. Cardoso Cleber R. Malagoli
|
|
|
- Geovane de Santarém Castelo
- 6 Há anos
- Visualizações:
Transcrição
1 RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA Adilson A. Cardoso Cleber R. Malagoli
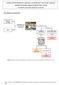
2 RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA Fluxograma genérico para escolha do Solvente ( testar água, etanol e clorofórmio ) 0,1 g de Acetanilida em um tubo de ensaio Solúvel 1 - Adicionar 3,0 ml do solvente a ser testado, agitar vigorosamente ( usar técnica adequada evitando derramar a solução). Insolúvel Solução de Acetanilida ( inadequado ) Desprezar em lugar adequado, dependendo do solvente testado Solúvel Duas fases:- Acetanilida + Solvente 2 - Aquecer lentamente ( utilizar banho maria ) Insolúvel Solução de Acetanilida (Adequado) Escolher o melhor solvente e proceder a Recristalização e Purificação da Acetanilida Duas fases:- Acetanilida + Solvente ( Inadequado ) Desprezar em lugar adequado, dependendo do solvente testado Solução de Acetanilida com impurezas Deixar esfriar lentamente
3 RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA Água em ebulição ( ± 200 ml ) + 10 g de Acetanilida impurezas: Quinona ( traços), Anilina, Ac. Acético, acetato de sódio 3. Adicionar carvão ativo para adsorver impurezas coloridas ( 1 a 2% em peso de amostra ) ou seja 0,2 g ATENÇÃO não colocar em excesso, nem adicionar com a solução em ebulição! 4. Agitar a mistura e deixar aquecer por alguns minutos em ebulição. 5. Aquecer o funil do sistema de filtração por gravidade 6. Filtrar por gravidade a quente rapidamente 7. Recolher o filtrado em um bequer Solução filtrada com a Acetanilida + impurezas solúveis ( Ác. Acético, Acetato de Sódio, Anilina ) Impurezas insolúveis + carvão ativo retido no filtro com a Quinona adsorvida 8. Deixar recristalizar por resfriamento lento. (o repouso máximo favorece a formação de cristais grandes, deve-se manter a calma, e não perturbar a Recristalização ) 9. Separar os cristais por filtração a vácuo Cristais de Acetanilida purificados + água mãe ( traços Ác. Acético, Anilina e Acetato de Sódio ) Solução filtrada contendo Acetanilida ( traços 1 ) e impurezas solúveis
4 10. Lavar g com água gelada várias vezes (quanto melhor esse procedimento mais puros serão os cristais obtidos. 11. Deixar secar no próprio funil deixando a sucção ligada. 1 Justifica-se pelo fato que não há soluto nem totalmente solúvel nem insolúvel Cristais de Acetanilida purificados traços ( Ác. Acético, Anilina e Acetato de Sódio 2 ) Solução filtrada contendo traços da Acetanilida e traços de impurezas solúveis que estavam impregnadas junto com a água mãe 2 presença de traços depende do operador 12. Secar a amostra em dessecador por uma semana. 13. Pesar a amostra e calcular o rendimento. 14. Determinar o ponto de fusão i da Acetanilida utilizando o aparelho do laboratório. Cristais de Acetanilida devidamente embalado e rotulado
5 Solvente Um bom solvente deve dissolver uma grande quantidade de soluto em temperatura elevada ou mesmo no ponto de ebulição, e dissolver pouco do mesmo soluto quando estiver a temperatura ambiente ou temperatura mais baixas, (quanto mais insolúvel a temperatura ambiente melhor). Características do solvente: Ser facilmente removido quando o composto purificado for secado. Permitir uma boa formação dos cristais (Recristalização) Não reagir quimicamente com a substância a ser purificada
6 A escolha do melhor solvente não é um procedimento fácil de realizar. A melhor maneira de se escolher o solvente adequado é realizar testes preliminares em tubos de ensaios com 0,1 g de material a ser recristalizado e dissolve-lo no solvente que está sendo testado, repetindo este procedimento para vários tipos de solventes. Um solvente muito pouco solúvel deve ser descartado porque por exemplo se for gasto 0,8 g/100ml para dissolve-lo, amostras maiores precisaria de uma quantidade enorme de solvente, o que tornaria inviável à prática.
7 O solvente então que diluir o soluto no ponto de ebulição e permitir uma boa Recristalização poderá ser escolhido. Deve-se tomar cuidado para não escolher um solvente que tenha ponto de ebulição mais alto que o composto a ser cristalizado, pois o composto pode se fundir formando uma espécie de óleo que não se recristaliza quando o solvente esfriar, formando um líquido super resfriado, se isso ocorrer, deve-se então tentar dissolver novamente o óleo e deixar resfriar novamente para tentar a Recristalização.
8 Soluções supersaturadas ou certos tipos de impurezas também provocam a formação desse óleo, por exemplo a acetanilida em água numa concentração maior que 5,5 % pode formar o óleo. Um solvente com baixo ponto de ebulição permite ser removido com mais facilidade do soluto purificado depois de filtrado e lavado. Se for muito volátil deve se tomar os devidos cuidados. Deve-se levar em conta também a toxidade do solvente.
9 Procedimento experimental Testar os solventes: Água, etanol, éter, clorofôrmio, acetona e benzeno. Pode ser feito o teste em grupos ou individual. Separar 0,1 g de amostra por tubo para realizar o teste. Adicionar o solvente gota a gota e verificar sua solubilidade a frio, adicionar até aproximadamente 1mL. Se não diluir, aquecer até a ebulição, (tomar cuidado com os solventes voláteis, pois estes não podem ser trabalhados diretamente com o bico de gás, e sim usar uma manta aquecedora ou banho maria).
10 Se com pequeno aquecimento já se dissolver, pode-se descartar o solvente, mas se não dissolver, quando chegar no ponto de ebulição adicionar solvente até a dissolução, se completar aproximadamente 3 ml, caso ainda não dilua o composto, também descarta-se o solvente pois é pouco solúvel naquele solvente. Se dissolver deixar esfriar para verificar se ocorre Recristalização, pode-se atritar com um bastão de vidro não polido para auxiliar a Recristalização.
11 Água pe pf Solubilidade Observações em água A ser usada destilada sempre que for apropriada Metanol 65 * + Inflamável Etanol 78 * + Inflamável absoluto Etanol 95% 78 * + Inflamável Benzeno Inflamável e tóxico Cloroformio 61 * - Não inflamável, vapores tóxicos Ac. Acético Não muito flamável, (glacial) vapores irritantes Dioxano Inflamável Acetona 56 * + Inflamável pe e pf estão expressos em ºC
12 Dissolução da amostra Escolhido o melhor solvente, devese então pesar uma porção da amostra e dissolver no solvente a quente. Deve-se minimizar as perdas de soluto saturando ao máximo a solução, mas tomando cuidado para não formar o óleo. Coloca-se o soluto num erlenmeyer com uma quantidade de solvente ligeiramente menor do que a quantidade necessária para dissolução. Quando estiver em ebulição, adiciona-se pequenas quantidades de solvente até a dissolução se complete.
13 Deve-se porem tomar cuidado para não confundir impurezas sólidas insolúveis e fibra de papel com a substância, pois isso levaria a adição de mais solvente e diminuindo o rendimento da Recristalização, o teste preliminar de escolha do solvente ajudará a reconhecer como são as impurezas insolúveis. Quando o solvente for muito volátil, inflamável, toxico ou caro aconselha-se usar um condensador de refluxo. Usar também pedras de porcelana para evitar ebulição intensa com arraste de líquido que comprometeria todo o procedimento.
14 Carvão ativo (descoramento) Quando a substância se dissolveu por completo, usa-se o carvão ativo para eliminar impurezas coloridas e materiais resinosos. Usa-se uma pequena quantidade de carvão ativo, pois o excesso pode adsorver também a substância a ser cristalizada. A quantidade ideal é em torno de 1 a 2 % do total pesado da amostra, se não for suficiente vai- se adicionando mais 0,5 % até que limpe todas as impurezas.
15 Deve-se ter o CUIDADO para não colocar carvão ativo sobe a solução em ebulição, pois provocaria uma ebulição tumultuosa da solução levando ao derramamento e perda de material. Tomar cuidado também com o pó muito fino do carvão ativo pois faz mal aos pulmões quando inalado. Tipos de carvão ativo: Animal: mais baratos, porém não tão eficaz. Carvão obtido da madeira vendidos com as marcas, Norit* (obtido de madeira de vidoeiro), Darco*, Nuchar*.
16 Filtração por gravidade Filtração efetuada para separar a solução com amostras dissolvidas das impurezas insolúveis de do carvão ativo. Deve ser feita de maneira rápida e eficiente para não ocorrer cristalização no papel de filtro que além de perder material pode obstruir o funil. Para a filtração por gravidade precisa se de um funil de colo longo, papel de filtro pregueado e o recipiente para receber o filtrado. A solução pode esfriar enquanto está sendo filtrada, para evitar uma cristalização precoce pode se tomar algumas precauções:
17 Colocar uma quantidade extra de solvente, lembrando que depois da filtração o excesso de solvente deve ser removido por evaporação Aquecer o funil com solvente quente (que será descartado logo após a operação), antes de realizar a filtração e depois filtrar rapidamente mantendo o funil aquecido com um banho-maria especial para funil. Usa- se um funil sem colo, e quando aquece-lo ao invés de recolher o filtrado no erlenmeyer, faz-se num becker (vide fig. 01).
18 Se mesmo assim começar a ocorrer cristalização, pequenas quantidades de solvente devem ser adicionadas sobre o funil, para dissolver os cristais, lembrando sempre de remover as quantidade extras de solventes depois de filtrar. O uso da manta ou banho maria é recomendado principalmente no caso de solvente voláteis e inflamáveis.
19 Recristalização A Recristalização é um processo lento e delicado. Depois de filtrar, ajusta-se a quantidade de solvente e deixa-se esfriar para recristalizar. Melhor se for feito em um erlenmeyer para evitar contaminação por pó. A taxa de resfriamento é que determina o tamanho dos cristais, se quiser obter cristais grandes, deixa-se resfriar lentamente, não esquecendo que cristais muito grandes facilitam a oclusão e se quiser obter cristais pequenos,
20 lembrando também do risco de obstruir o funil e dificuldade de lavagem além de que um resfriamento rápido provoca o arraste de impurezas junto com a precipitação dos cristais. O ideal seria obter cristais entre 2 a10 mm. Eventuais problemas durante a recristalização.
21 Eventuais problemas com a Recristalização Substância com baixo ponto de fusão, se forem recristalizados rapidamente podem também formar o líquido oleoso. Se isso acontecer dissolva novamente adicionando um pouco de solvente e aquecendo novamente a solução agitando bastante até a dissolução da substância. Deixar resfriar novamente lentamente sob agitação até formar os primeiros cristais. Se formar o óleo devido a impurezas e a Recristalização falhar, usa-se novamente carvão ativo e tenta-se novamente a Recristalização.
22 Também pode acontecer dos cristais resistirem a cristalização, isso ocorre quando a solução está muito saturada ou está sendo impedida por impurezas como alcatrão ou outra substância viscosa que age como um colóide protetor. Deve-se então induzir a cristalização Arranha-se a parede do frasco com um bastão de vidro não polido ou adiciona-se um pequeno cristal de acetanilida pura (semente) para iniciar a nucleação.
23 Para obter os cristais retira-se algumas gotas da solução colocase numa lâmina e força-se a cristalização por resfriamento rápido, ou utiliza-se de pequenos pedaços da amostra original ou de compostos já purificados e guardados.
24 Resfria-se a solução em banho de gelo. Lembrando que se o solvente for volátil, usa se o condensador de refluxo para evitar evaporação. O tempo ideal para Recristalização pode variar de 10 min a horas ou de um dia para o outro
25 Filtração a vácuo Tem-se um aumento no fluxo de filtrado devido a sucção provocado pelo vácuo. O papel de filtro deve ser cortado no tamanho exato do diâmetro do funil, para evitar perda de vácuo e par que não passe material sem filtrar. Molha-se o papel de filtro com solvente gelado antes de filtrar, para que o papel aderir ao funil. O vácuo é feito com o auxilio de uma bomba d água, mantendo um frasco no meio como armadilha para evitar que puxe água para a solução caso a pressão da água caia.
26 Esquema de Aquecimento do Funil Esquema de Filtração por Gravidade
27 Esquema de Filtração a Vácuo
28 Quando a solução é vertida totalmente no funil pode-se aumentar o vácuo e aguardar a filtração. Com respeito ao material recristalizado Deve-se atentar para que a solução e os cristais não encha mais que meio funil. Despeja-se primeiramente o sobrenadante, depois o restante da solução e os cristais devem se agitados e vertido de uma vez, o restante é retirado com o auxilio de uma bagueta com ponta de borracha e depois lavado com um pouco da água mãe filtrada ou solvente gelado para retirar todos os cristais do frasco.
29 Procedimento experimental Recorte o papel de filtro exatamente do tamanho da boca do funil de buchner Acione a bomba de vácuo Importante colocar entre o kitassato e a bomba de vácuo um frasco como armadilha, para evitar que seja aspirado água caso caia a pressão de água. Recolher o restante dos cristais com uma bagueta de ponta de borracha Lave o restante com um pouco de água mãe ou solvente gelado
30 Lavagem dos Cristais Depois de filtrado a substância, antes da secagem é preciso lavar a substância para evitar que impurezas dissolvidas na solução que encharca os cristais fiquem aderidas nos cristais quando o solvente evaporar. Faz-se a lavagem com um solvente limpo e gelado, podendo ser lavado por 2 vezes se a substância não for muito solúvel no solvente gelado. Se os cristais não estiverem amontoados num bolo sólido,.
31 pode-se fazer vácuo normalmente para auxiliar a lavagem, Uma boa alternativa para uma segunda lavagem é usar um solvente mais volátil e miscível com o primeiro e que não dissolva os cristais a frio, pois sua melhor evaporação facilitará a secagem dos cristais. Deixa-se então os cristais secando com passagem de ar, é aconselhável cobrir o funil com um papel de filtro para evitar contaminação com pó
32 Procedimento Experimental Fazer a lavagem com solvente gelado para eliminar impurezas no solvente. Lavar 2 vezes, verificar condições dos cristais para decidir a intensidade de vácuo a ser usado. Deixa-se ficar passando ar para secagem do solvente Prepara-se para a secagem
33 Secagem Um método comum é colocar em um vidro relógio e secar ao ar livre. Este método tem a vantagem de não se correr o risco de decompor o produto, mas é demorado alem de substância higroscópicas certamente se hidrolizarem no contato com o ar atmosférico. Outra maneira, talvez a melhor é utilizar um dessecador a vácuo na presença de um agente secante.
34 Precauções no uso do dessecador Cuidado com amostras que sublimam facilmente Cuidado para não implodir o dessecador, então por medida de segurança deve-se usar uma gaiola protetora Para tornar o dessecador livre de ar, untar a superfície esmerilhada da tampa e do corpo com vaselina. Usar um kitassato de segurança entre o dessecador e a bomba de vácuo.
35 Maneira universal de encher um dessecador Coloca-se o secante na reentrância no fundo do dessecador, cobrindo-o com uma chapa porcelana perfurada. Quando o solvente for éter, clorofórmio, tetracloreto de carbono, benzeno, tolueno e vapores similares, deve-se colocar aparas de parafina recentemente cortadas sobre o secante sólido. Hidróxido de sódio, cloreto de cálcio, sílica gel, pentóxido de fósforo ou ácido sulfúrico podem ser utilizados como secantes.
36 Ao usar o dessecador sob vácuo, coloca-se a substância com um vidro relógio invertido para impedir que cristais pequenos sejam varridos do dessecador. Procedimento experimental Depois que a substância já secou bem no funil de Buchner, retira-se os cristais e leva-se a um dessecador a vácuo para secar. Pode se colocar dentro de uma placa de Petri ou dentro de dois vidros relógios sendo um invertido. Para finalizar pesar a amostra e determinar o ponto de fusão.
37 Teoria do ponto de fusão O ponto de fusão de um sólido cristalino é a temperatura na qual o sólido começa a se tornar um líquido sob a pressão de uma atmosfera. Um composto orgânico cristalino puro tem um ponto de fusão bem definido com um intervalo menor de 0,5 ºC, presença de impurezas miscíveis ou parcialmente miscíveis faz com que essa diferença entre a primeira formação do líquido e a fusão total aumenta bastante, também causa o início do ponto de fusão a uma temperatura mais baixa.
38 Um composto com alto grau de pureza tem um ponto de fusão bem definido, com exceção de ser um mistura eutética onde dois sólidos passam para do estado sólido paro o estado líquido ao mesmo tempo apenas em duas fases. O ponto de fusão é usado como critério para avaliar o grau de pureza de um composto, ou ajudar na sua identificação através de comparações com tabelas de pontos de fusão
39 Métodos de determinar o ponto de Fusão Há vários métodos de determinar o ponto de fusão, entre eles temos via experimentos e aquecimentos da solução em banho com substância com ponto de ebulição maior, ou aparelhos de resistência elétrica equipados com termômetros. Um método comum é o de aquecer uma pequena quantidade de substância que está num tubo capilar, próximo a um termômetro dentro de um banho num líquido que tenha um ponto de ebulição maior que o ponto de fusão da substância.
40 Outro método é utilizando um aparelho aquecido eletricamente. Determina até 2 capilares simultaneamente, um bloco de cobre com buracos para capilares e o termômetro enrolado por um fio de resistência elétrica coberto por um vidro. Pode-se manter vários velocidade de aquecimentos. Há um aparato para se observar o momento em que ocorre o ponto de fusão, onde os capilares são iluminados por um luz de 6V
41 Procedimento experimental Pesa-se a amostra e calcula-se o rendimento Aquece-se um ou dois capilares num bico de bunsen para fechar uma das pontas Coloca-se acetanilida pressionando a ponta da acetanilida contra o cristal desde que esteja finamente dividido. Soca-se deixando o capilar correr por um tubo de vidro com aproximadamente 50 cm Coloca-se o capilar e determinase o ponto de fusão, ou se ainda estiver impuro o intervalo de fusão.
42 Bibliografia ADAMS, R., JOHNSON, J. R., WILCOX, C. F. T. Laboratory Experiments in Organic Chemistry. 7th ed. New York : McMillan Publishing, l979. AGOSTA,W.C.,J.Chem.Ed.(1997),74, 875. BREWSTER, R. O., VANDERWERF, C. A., McEVEN, W. E. Unitized Experiments in Organic Chemistry. 4th ed. New York : D. Van Nostrand, l977. COLLINS, C. H., BRAGA, G. L., BONATO, P.S., (Coord.). Introdução a Métodos Cromatográficos. 6.ed. Campinas : UNICAMP, DOYLE, M. P., MUNGALL, W. S. Experimental Organic Chemistry. New York : John Wiley, l980. FESSENDEN, R. J., FESSENDEN, J. S. Organic Laboratory Techniques. 2nd ed. Califórnia : Brooks ; Cole Publishing, 1993 GONÇALVES, D., WAL, E., ALMEIDA, R. R. Química Orgânica Experimental. São Paulo : McGraw Hill, l988. HELMKAMP, G. K., JOHNSON, H. W. Seleted Experiments in Organic Chemistry. San Francisco : W. H. Freemean, 1964.
43 JONES, E. E. Introduction Organic Chemistry. Boston : Northeastern University, l974. MANO, E. B., SEABRA, A. F. Práticas de Química Orgânica. 2.ed. São Paulo : Edart, l977. PAVIA, D. L., LAMPMAN, G. M., KRIZ, G. S. Introduction to LaboratoryTechniques : a microscale approach. 2nd ed. Philadelphia : Saunders College, SOARES, B. G., SOUZA, N. A., PIRES, D. X. Química Orgânica : teoria e técnicas de preparação, purificação e identificação de compostos orgânicos. Rio de Janeiro : Guanabara, l988. VOGEL'S Text Book of Practical Organic Chemistry, Rev. FURNISS, B. S. et al. 5th ed. London : Longman, l989. WILCOX, C. F. Experimental Organic Chemistry, (A Small-Scalle Approach). New York : McMillan, Orgânica Experimental / Bibliografia / Introdução / Instrumentos / Experimentos / Links / Segurança / Técnicas
Seminário de Química Orgânica Experimental I. Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002
 Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
PURIFICAÇÃO DE UM COMPOSTO ORGÂNICO SÓLIDO
 PURIFICAÇÃO DE UM COMPOSTO ORGÂNICO SÓLIDO INTRODUÇÃO Substâncias sólidas raramente são puras quando obtidas a partir de uma reação. Conseqüentemente, desde a época dos primeiros alquimistas, substâncias
PURIFICAÇÃO DE UM COMPOSTO ORGÂNICO SÓLIDO INTRODUÇÃO Substâncias sólidas raramente são puras quando obtidas a partir de uma reação. Conseqüentemente, desde a época dos primeiros alquimistas, substâncias
RECRISTALIZAÇÃO. Princípio: Dissolver a substância em um solvente a quente e deixar a solução esfriar lentamente. Cristalização versus Precipitação
 RECRISTALIZAÇÃO Método de purificação de substâncias sólidas Princípio: Dissolver a substância em um solvente a quente e deixar a solução esfriar lentamente. Cristalização versus Precipitação lento / seletivo
RECRISTALIZAÇÃO Método de purificação de substâncias sólidas Princípio: Dissolver a substância em um solvente a quente e deixar a solução esfriar lentamente. Cristalização versus Precipitação lento / seletivo
pf ºC pe ºC Densidade Solubilidade Toxidade Propriedades Físicas Nomenclatura Fórmula Mol (g/mol)
 Nomenclatura Fórmula Mol (g/mol) pf ºC pe ºC Densidade Solubilidade Toxidade Propriedades Físicas Acetanilida C 8 H 9 NO 135,17 113-115 304-305 1,219 Água H 2 O 18,02 0 100 ( 3,98 º) 1,0000 1 ml se dissolve
Nomenclatura Fórmula Mol (g/mol) pf ºC pe ºC Densidade Solubilidade Toxidade Propriedades Físicas Acetanilida C 8 H 9 NO 135,17 113-115 304-305 1,219 Água H 2 O 18,02 0 100 ( 3,98 º) 1,0000 1 ml se dissolve
Experiência N º11. Recristalização e determinação da pureza de sólidos
 1 QMC 5119 II Semestre de 2014 Experiência N º11 Recristalização e determinação da pureza de sólidos 1. Introdução O método mais utilizado para a purificação de sólidos é a recristalização. Nesse método,
1 QMC 5119 II Semestre de 2014 Experiência N º11 Recristalização e determinação da pureza de sólidos 1. Introdução O método mais utilizado para a purificação de sólidos é a recristalização. Nesse método,
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini
 Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
QUÍMICA FARMACÊUTICA
 INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
Introduzir o aluno à técnica de purifi cação de sólidos orgânicos por recristalização.
 RECRISTALIZAÇÃO Aula 3 META Introduzir o aluno à técnica de purifi cação de sólidos orgânicos por recristalização. OBJETIVOS Ao fi nal desta aula, o aluno deverá: executar a purifi cação de materiais orgânicos
RECRISTALIZAÇÃO Aula 3 META Introduzir o aluno à técnica de purifi cação de sólidos orgânicos por recristalização. OBJETIVOS Ao fi nal desta aula, o aluno deverá: executar a purifi cação de materiais orgânicos
Álvaro Guimarães Braz Danilo Lauriano Cenerini Gustavo Pereira Teodoro Raul da Costa Casaut
 Álvaro Guimarães Braz Danilo Lauriano Cenerini Gustavo Pereira Teodoro Raul da Costa Casaut É um produto orgânico, uma amida, sólida à temperatura ambiente, de cor branca, praticamente inodora; solúvel
Álvaro Guimarães Braz Danilo Lauriano Cenerini Gustavo Pereira Teodoro Raul da Costa Casaut É um produto orgânico, uma amida, sólida à temperatura ambiente, de cor branca, praticamente inodora; solúvel
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Experiência 02 - SOLUBILIDADE SOLUBILIDADE
 1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
3002 Adição de bromo ao ácido fumárico para formação de ácido meso-dibromo-succínico
 32 Adição de bromo ao ácido fumárico para formação de ácido meso-dibromo-succínico H HOOC COOH H Br 2 HOOC H Br Br H COOH C 4 H 4 O 4 (116.1) (159.8) C 4 H 4 Br 2 O 4 (275.9) Referência Bibliográfica A.
32 Adição de bromo ao ácido fumárico para formação de ácido meso-dibromo-succínico H HOOC COOH H Br 2 HOOC H Br Br H COOH C 4 H 4 O 4 (116.1) (159.8) C 4 H 4 Br 2 O 4 (275.9) Referência Bibliográfica A.
Grupo 6 Carolina lourencetti Jean Vicente Ferrari Marco Aurélio Cebim Marília Longo Biasioli Vanessa Yumi Nagayassu Uisley
 Grupo 6 Carolina lourencetti Jean Vicente Ferrari Marco Aurélio Cebim Marília Longo Biasioli Vanessa Yumi Nagayassu Uisley Sumário SUMÁRIO...1 PURIFICAÇÃO DE SÓLIDOS POR RECRISTALIZAÇÃO...2 1) INTRODUÇÃO...2
Grupo 6 Carolina lourencetti Jean Vicente Ferrari Marco Aurélio Cebim Marília Longo Biasioli Vanessa Yumi Nagayassu Uisley Sumário SUMÁRIO...1 PURIFICAÇÃO DE SÓLIDOS POR RECRISTALIZAÇÃO...2 1) INTRODUÇÃO...2
Exercícios Métodos de Separação. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017
 Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
5007 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína
 57 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Classificação Tipos de reações e classes das substâncias
57 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Classificação Tipos de reações e classes das substâncias
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
1011 Síntese do 1,4-di-terc-butil benzeno a partir do terc-butil benzeno e cloreto de terc-butila.
 1011 Síntese do 1,4-di-terc-butil benzeno a partir do terc-butil benzeno e cloreto de terc-butila. + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Classificação Tipos de Reações e
1011 Síntese do 1,4-di-terc-butil benzeno a partir do terc-butil benzeno e cloreto de terc-butila. + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Classificação Tipos de Reações e
2017 Obtenção da amida do ácido cinâmico através da reação do cloreto do ácido cinâmico com amônia
 217 Obtenção da amida do ácido cinâmico através da reação do cloreto do ácido cinâmico com amônia O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Classificação Tipos de reação e classes de
217 Obtenção da amida do ácido cinâmico através da reação do cloreto do ácido cinâmico com amônia O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Classificação Tipos de reação e classes de
3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno
![3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno 3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno](/thumbs/61/45682965.jpg) 00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
APÊNDICE A - Calibração do Forno de Redução
 APÊNDICE A - Calibração do Forno de Redução A calibração do forno de redução Combustol para o conhecimento da temperatura real em seu centro, foi realizada com base num indicador digital de temperatura,
APÊNDICE A - Calibração do Forno de Redução A calibração do forno de redução Combustol para o conhecimento da temperatura real em seu centro, foi realizada com base num indicador digital de temperatura,
PÓ DE CARVÃO MINERAL PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE ENXOFRE TOTAL PELO PROCESSO DE ESCHKA (GRAVIMETRIA)
 SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Princípio do método 4_ Definição 5_ Aparelhagem/reagentes 6_ Preparação das soluções 7_ Execução do ensaio 8_ Segurança
4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico
 NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
Preparação da Acetanilida. Ana Carolina Gavioli Guerra Flávio Pereira Cardoso
 Preparação da Acetanilida Ana Carolina Gavioli Guerra Flávio Pereira Cardoso Acetanilida A acetanilida (C8H9NO) é uma amida que foi introduzida no grupo dos primeiros analgésicos em 1884, com o nome de
Preparação da Acetanilida Ana Carolina Gavioli Guerra Flávio Pereira Cardoso Acetanilida A acetanilida (C8H9NO) é uma amida que foi introduzida no grupo dos primeiros analgésicos em 1884, com o nome de
BC-1302 QUÍMICA DOS ELEMENTOS
 PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
EXPERIÊNCIA 4 SÍNTESE E PURIFICAÇÃO DO ÁCIDO ACETILSALICÍLICO (AAS)
 EXPERIÊNCIA 4 SÍNTESE E PURIFICAÇÃ D ÁCID ACETILSALICÍLIC (AAS) 1 - INTRDUÇÃ Ácido Acetilsalicílico (AAS), também conhecido como Aspirina, é um dos remédios mais populares mundialmente produzidas e consumidas
EXPERIÊNCIA 4 SÍNTESE E PURIFICAÇÃ D ÁCID ACETILSALICÍLIC (AAS) 1 - INTRDUÇÃ Ácido Acetilsalicílico (AAS), também conhecido como Aspirina, é um dos remédios mais populares mundialmente produzidas e consumidas
Isolamento de compostos orgânicos voláteis de fontes naturais
 Isolamento de compostos orgânicos voláteis de fontes naturais Os componentes voláteis de plantas constituem uma enorme riqueza da Química Orgânica. Eles são utilizados na farmacologia, ingredientes de
Isolamento de compostos orgânicos voláteis de fontes naturais Os componentes voláteis de plantas constituem uma enorme riqueza da Química Orgânica. Eles são utilizados na farmacologia, ingredientes de
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 )
 Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Parte II. Meneah Renata Talita
 Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
4009 Síntese de ácido adípico a partir do ciclohexeno
 4009 Síntese de ácido adípico a partir do ciclohexeno C 6 H 10 (82,2) + tungstato de sódio dihidratado 4 H 2 H + 2 H + 4 H 2 + Aliquat 336. Na 2 W 4 2 H 2 (329,9) C 6 H 10 4 (34,0) C 25 H 54 ClN (404,2)
4009 Síntese de ácido adípico a partir do ciclohexeno C 6 H 10 (82,2) + tungstato de sódio dihidratado 4 H 2 H + 2 H + 4 H 2 + Aliquat 336. Na 2 W 4 2 H 2 (329,9) C 6 H 10 4 (34,0) C 25 H 54 ClN (404,2)
2004 Redução diastereosseletiva de benzoina com boro-hidreto de sódio a 1,2-difenil-1,2-etanodiol
 24 Redução diastereosseletiva de benzoina com boro-hidreto de sódio a 1,2-difenil-1,2-etanodiol OH O NaBH 4 H HO OH meso H + H OH H OH racemic C 14 H 12 O 2 (212.3) (37.8) C 14 H 14 O 2 (214.3) Referência
24 Redução diastereosseletiva de benzoina com boro-hidreto de sódio a 1,2-difenil-1,2-etanodiol OH O NaBH 4 H HO OH meso H + H OH H OH racemic C 14 H 12 O 2 (212.3) (37.8) C 14 H 14 O 2 (214.3) Referência
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA
 MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
Preparação da Acetanilida. Carla Cristina Perez Profº José Eduardo
 Preparação da Acetanilida Carla Cristina Perez Profº José Eduardo p-aminofenol Acetanilida NH 2 Fármaco com ação analgésica e antipirética; OH Pertence ao grupo dos derivados do p-aminofenol, juntamente
Preparação da Acetanilida Carla Cristina Perez Profº José Eduardo p-aminofenol Acetanilida NH 2 Fármaco com ação analgésica e antipirética; OH Pertence ao grupo dos derivados do p-aminofenol, juntamente
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS
 EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXPERIÊNCIA 2 TEMPERATURA DE FUSÃO DE UMA SUBSTÂNCIA
 EXPERIÊNCIA 2 TEMPERATURA DE FUSÃO DE UMA SUBSTÂNCIA 1. OBJETIVOS No final desta experiência espera-se que o aluno seja capaz de: Determinar pontos de fusões usando o método gráfico da curva de resfriamento.
EXPERIÊNCIA 2 TEMPERATURA DE FUSÃO DE UMA SUBSTÂNCIA 1. OBJETIVOS No final desta experiência espera-se que o aluno seja capaz de: Determinar pontos de fusões usando o método gráfico da curva de resfriamento.
Aula prática 1: Materiais de laboratório, exatidão e precisão. 1. Material de laboratório
 Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
FATEC- Mecanização em agricultura de Precisão. Professora Mirian Maya Sakuno
 FATEC Mecanização em agricultura de Precisão Professora Mirian Maya Sakuno Análise Gravimétrica Na análise gravimétrica, a massa de um produto é usada para calcular a quantidade do constituinte original
FATEC Mecanização em agricultura de Precisão Professora Mirian Maya Sakuno Análise Gravimétrica Na análise gravimétrica, a massa de um produto é usada para calcular a quantidade do constituinte original
Cargo: D-43 - Tecnólogo Laboratório Meio ambiente
 da Prova Prática QUESTÃO 1: Cargo: D-43 - Tecnólogo Laboratório Meio ambiente A titulometria volumétrica envolve a medida de volume de uma solução de concentração conhecida, necessária para reagir essencial
da Prova Prática QUESTÃO 1: Cargo: D-43 - Tecnólogo Laboratório Meio ambiente A titulometria volumétrica envolve a medida de volume de uma solução de concentração conhecida, necessária para reagir essencial
IDENTIFICAÇÃO DE SUBSTÂNCIAS E AVALIAÇÃO DA SUA PUREZA
 IDENTIFICAÇÃO DE SUBSTÂNCIAS E AVALIAÇÃO DA SUA PUREZA O que se pretende Utilizar técnicas experimentais de determinação de propriedades físicas características das substâncias como métodos de identificação
IDENTIFICAÇÃO DE SUBSTÂNCIAS E AVALIAÇÃO DA SUA PUREZA O que se pretende Utilizar técnicas experimentais de determinação de propriedades físicas características das substâncias como métodos de identificação
SÍNTESE DO SULFATO DE TETRAAMINA COBRE (II) MONO HIDRATADO
 SÍNTESE DO SULFATO DE TETRAAMINA COBRE (II) MONO HIDRATADO O que se pretende Realizar laboratorialmente a síntese do sal sulfato de tetraaminacobre (II) monohidratado, uma substância usado como fungicida
SÍNTESE DO SULFATO DE TETRAAMINA COBRE (II) MONO HIDRATADO O que se pretende Realizar laboratorialmente a síntese do sal sulfato de tetraaminacobre (II) monohidratado, uma substância usado como fungicida
Experimentos de Química Orgânica
 Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
AULA PRÁTICA 4 Série de sólidos
 SANEAMENTO AMBIENTAL EXPERIMENTAL TH 758 DHS PPGERHA - UFPR AULA PRÁTICA 4 Série de sólidos 1. Série de sólidos Resíduos ou sólidos são todas as matérias suspensas ou dissolvidas na água, provenientes
SANEAMENTO AMBIENTAL EXPERIMENTAL TH 758 DHS PPGERHA - UFPR AULA PRÁTICA 4 Série de sólidos 1. Série de sólidos Resíduos ou sólidos são todas as matérias suspensas ou dissolvidas na água, provenientes
Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE
 Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE densidade Nomenclatur a 2,152 cloreto de cálcio 0,789 álcool etílico fórmula Mol (g/ml) P.F.( 0 C) P.E.( 0 C) toxidade solubilidade
Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE densidade Nomenclatur a 2,152 cloreto de cálcio 0,789 álcool etílico fórmula Mol (g/ml) P.F.( 0 C) P.E.( 0 C) toxidade solubilidade
Ministério da Educação Universidade Federal do Paraná Setor Palotina. Soluções e cálculos de soluções
 Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
QUESTÕES DISSERTATIVAS - GABARITO RESOLVIDO
 Química Avaliação Bimestral 1 o ano Vivian março/ 2011 Nome: Turma: QUESTÕES DISSERTATIVAS - GABARITO RESOLVIDO Substância T. F. (ºC) T.E. (ºC) Densidade a 20ºC (g/cm 3 ) Solubilidade (g/100 g de água)
Química Avaliação Bimestral 1 o ano Vivian março/ 2011 Nome: Turma: QUESTÕES DISSERTATIVAS - GABARITO RESOLVIDO Substância T. F. (ºC) T.E. (ºC) Densidade a 20ºC (g/cm 3 ) Solubilidade (g/100 g de água)
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
Experiência 04 - Solubilidade
 Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
EQUIPAMENTO BÁSICO DE LABORATÓRIO
 1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira
 DISCIPLINA QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira DATA 1 Instruções gerais para as aulas práticas
DISCIPLINA QUÍMICA GERAL EXPERIMENTAL CURSO Engenharia de Produção e Engenharia Ambiental PERÍODO: BIMESTRE Primeiro PROFESSOR Priscila de Freitas Siqueira DATA 1 Instruções gerais para as aulas práticas
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
Química Orgânica Experimental
 Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
SISTEMAS MATERIAIS. Conceitos Fundamentais, Classificação, Purificação. Reis, Oswaldo Henrique Barolli.
 SISTEMAS MATERIAIS Conceitos Fundamentais, Classificação, Purificação Reis, Oswaldo Henrique Barolli. R375s Sistemas materiais : conceitos fundamentais, classificação, purificação / Oswaldo Henrique Barolli.
SISTEMAS MATERIAIS Conceitos Fundamentais, Classificação, Purificação Reis, Oswaldo Henrique Barolli. R375s Sistemas materiais : conceitos fundamentais, classificação, purificação / Oswaldo Henrique Barolli.
Cromatografia em Coluna: Dicas
 Cromatografia em Coluna: Dicas A cromatografia em coluna é comumente utilizada para purificação de substâncias orgânica ou, para remover o material de partida ou isolar o produto desejado de uma reação.
Cromatografia em Coluna: Dicas A cromatografia em coluna é comumente utilizada para purificação de substâncias orgânica ou, para remover o material de partida ou isolar o produto desejado de uma reação.
Síntese e Recristalização da Acetanilida
 Síntese e Recristalização da Acetanilida Química Orgânica Experimental BAC 2013 Docentes: Profº. Dr. José Eduardo de Oliveira Profº. Dr. Humberto Márcio dos Santos Milagre Profª. Dra. Isabele Rodrigues
Síntese e Recristalização da Acetanilida Química Orgânica Experimental BAC 2013 Docentes: Profº. Dr. José Eduardo de Oliveira Profº. Dr. Humberto Márcio dos Santos Milagre Profª. Dra. Isabele Rodrigues
POQ 6 Determinação do teor de Lípidos
 POQ 6 Determinação do teor de Lípidos Elaboração: RQ Verificação: DT e RDQ Aprovação: DT e RQ Entidade Emissora: RQ POQ 6 E0 (18-10-2013) 1/7 Historial de Versões Edição Data Motivo da Emissão/Alterações
POQ 6 Determinação do teor de Lípidos Elaboração: RQ Verificação: DT e RDQ Aprovação: DT e RQ Entidade Emissora: RQ POQ 6 E0 (18-10-2013) 1/7 Historial de Versões Edição Data Motivo da Emissão/Alterações
3 - Reciclagem de poli(tereftalato de etileno), PET, e reutilização do ácido tereftálico (3 aulas)
 3 - Reciclagem de poli(tereftalato de etileno), PET, e reutilização do ácido tereftálico (3 aulas) Pretende-se reciclar PET, recuperar o ácido tereftálico correspondente, e usá-lo para sintetizar tereftalato
3 - Reciclagem de poli(tereftalato de etileno), PET, e reutilização do ácido tereftálico (3 aulas) Pretende-se reciclar PET, recuperar o ácido tereftálico correspondente, e usá-lo para sintetizar tereftalato
I) Comparação da precisão em medidas volumétricas
 EXPERIMENTO 1 PROCEDIMENTOS DE LABORATÓRIO MEDIDAS DE MASSA, VOLUME E TEMPERATURA I) Comparação da precisão em medidas volumétricas Procedimento Experimental Materiais necessários: bureta de 50 ml (1);
EXPERIMENTO 1 PROCEDIMENTOS DE LABORATÓRIO MEDIDAS DE MASSA, VOLUME E TEMPERATURA I) Comparação da precisão em medidas volumétricas Procedimento Experimental Materiais necessários: bureta de 50 ml (1);
Prática 08 Determinação da Massa Molar da Ureia via Ebuliometria
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
Título do vídeo: Síntese de sulfato de tetraminocobre (II) mono-hidratado
 Título do vídeo: Síntese de sulfato de tetraminocobre (II) mono-hidratado Nome dos participantes: Luís Amores; Melanie Matos; Miguel Sousa; Paulo Caldeira Professor responsável: Dina Albino E-mail: f188@esjd.pt
Título do vídeo: Síntese de sulfato de tetraminocobre (II) mono-hidratado Nome dos participantes: Luís Amores; Melanie Matos; Miguel Sousa; Paulo Caldeira Professor responsável: Dina Albino E-mail: f188@esjd.pt
Determinação de amido em farinha de mandioca, produtos amiláceos e outros
 Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
Página 1 de 5 1 Escopo Este método determina o teor de amido em farinha de mandioca, produtos amiláceos e outros, cujo parâmetro está relacionado à qualidade do produto segundo a Instrução Normativa nº
Título do Vídeo: Nome dos participantes: Professor responsável: Escola: Cristalização - "On the Rocks".
 Título do Vídeo: Cristalização - "On the Rocks". Nome dos participantes: Ana Rita Carvalho; Cristiano Correia; João Pereira; Wendy Moreira. Professor responsável: Paulo Jesus. Escola: Agrup. Esc. Camarate
Título do Vídeo: Cristalização - "On the Rocks". Nome dos participantes: Ana Rita Carvalho; Cristiano Correia; João Pereira; Wendy Moreira. Professor responsável: Paulo Jesus. Escola: Agrup. Esc. Camarate
a) 20 d) 100 b) 40 e) 160 c) 80
 01) (Unifesp-SP) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 ml de água foi deixada em um frasco aberto, a 30 C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo
01) (Unifesp-SP) Uma solução contendo 14 g de cloreto de sódio dissolvidos em 200 ml de água foi deixada em um frasco aberto, a 30 C. Após algum tempo, começou a cristalizar o soluto. Qual volume mínimo
AREIA BASE PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE ARGILA AFS PELO MÉTODO DO LAVADOR CONTÍNUO DE ARGILA
 SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Definição 4_ Aparelhagem 5_ Execução do ensaio 6_ Resultados 7_ Anexos 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método
SUMÁRIO Método de Ensaio Folha : 1 de 6 1_ Objetivo 2_ Documentos a consultar 3_ Definição 4_ Aparelhagem 5_ Execução do ensaio 6_ Resultados 7_ Anexos 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método
Alguns materiais utilizados no Laboratório de Química
 Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
Concentração de soluções e diluição
 Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Unidade V - Determinação de umidade e sólidos totais
 Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Processos físicos de separação de misturas
 Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
PROCESSOS DE SEPARAÇÃO. Prof. Ms. George Verçoza
 PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
Prof. José Valter SEPARAÇÃO DE MISTURAS
 1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
Prática de Laboratório 1
 Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
EXTRAÇÃO COM SOLVENTES
 EXTRAÇÃO COM SOLVENTES Discentes: Alessandra Maciel do Nascimento Mariana Alessandra Corrêa Docente: Prof.Dr. José Eduardo de Oliveira INTRODUÇÃO MISTURAS HOMOGÊNEAS HETEROGÊNEAS SOLUÇÃO EXTRAÇÃO! Exemplos:
EXTRAÇÃO COM SOLVENTES Discentes: Alessandra Maciel do Nascimento Mariana Alessandra Corrêa Docente: Prof.Dr. José Eduardo de Oliveira INTRODUÇÃO MISTURAS HOMOGÊNEAS HETEROGÊNEAS SOLUÇÃO EXTRAÇÃO! Exemplos:
IQ-UFG. Curso Experimental de Química Geral e Inorgânica. Prof. Dr. Anselmo
 IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
Química. APL 2.5 Síntese de biodiesel a partir de óleo alimentar
 Química APL 2.5 Síntese de biodiesel a partir de óleo alimentar Luísa Neves, 12ºCT de abril de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4 Perigos específicos e conselhos de segurança
Química APL 2.5 Síntese de biodiesel a partir de óleo alimentar Luísa Neves, 12ºCT de abril de 2015 Índice Introdução...2 Material e Reagentes...3 Procedimento..4 Perigos específicos e conselhos de segurança
2008 Esterificação do ácido propiônico com 1-butanol via catálise ácida para a obtenção do éster propanoato de butila
 28 Esterificação do ácido propiônico com 1-butanol via catálise ácida para a obtenção do éster propanoato de butila Classificação Tipos de reações e classes de substâncias Reação de carbonila de ácidos
28 Esterificação do ácido propiônico com 1-butanol via catálise ácida para a obtenção do éster propanoato de butila Classificação Tipos de reações e classes de substâncias Reação de carbonila de ácidos
Professor Daniel Rossi Janeiro de 2012
 Equipamentos de Laboratório Professor Daniel Rossi Janeiro de 2012 [Escolha a data] O LABORATORIO A palavra laboratório provém da união de duas palavras latinas: labor = trabalho + oratorium = lugar de
Equipamentos de Laboratório Professor Daniel Rossi Janeiro de 2012 [Escolha a data] O LABORATORIO A palavra laboratório provém da união de duas palavras latinas: labor = trabalho + oratorium = lugar de
OFICINA DE FORMAÇÃO. Utilização e Organização dos Laboratórios Escolares. Formador: Professor Vitor Duarte Teodoro
 OFICINA DE FORMAÇÃO Utilização e Organização dos Laboratórios Escolares Actividade Laboratorial: Formação de cristais/minerais (Biologia e Geologia Ano 2) Formador: Professor Vitor Duarte Teodoro Formanda:
OFICINA DE FORMAÇÃO Utilização e Organização dos Laboratórios Escolares Actividade Laboratorial: Formação de cristais/minerais (Biologia e Geologia Ano 2) Formador: Professor Vitor Duarte Teodoro Formanda:
EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS
 1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015.1 EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS 1. Densidade Densidade (d) é uma grandeza expressa pela
1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015.1 EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS 1. Densidade Densidade (d) é uma grandeza expressa pela
AVALIAÇÃO DE PUREZA DE MATERIAIS. Principais fontes de impurezas em fármacos e excipientes: São decorrentes do processamento da matéria-prima ou
 AVALIAÇÃO DE PUREZA DE MATERIAIS Principais fontes de impurezas em fármacos e excipientes: Impurezas inorgânicas Impurezas orgânicas 1) Impurezas inorgânicas São decorrentes do processamento da matéria-prima
AVALIAÇÃO DE PUREZA DE MATERIAIS Principais fontes de impurezas em fármacos e excipientes: Impurezas inorgânicas Impurezas orgânicas 1) Impurezas inorgânicas São decorrentes do processamento da matéria-prima
EXTRAÇÃO COM SOLVENTES
 UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE QUÍMICA EXTRAÇÃO COM SOLVENTES Extração simples, múltipla e quimicamente ativa Química Orgânica Experimental Prof. José Eduardo de Oliveira Profa. Dra. Angela
UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE QUÍMICA EXTRAÇÃO COM SOLVENTES Extração simples, múltipla e quimicamente ativa Química Orgânica Experimental Prof. José Eduardo de Oliveira Profa. Dra. Angela
Tarefa 22 Professor Gustavo
 6º ano Química Tarefa 22 Professor Gustavo 01. Uma amostra de água do mar contaminada com óleo foi coletada em alto mar. Sobre os procedimentos aplicados para a separação eficiente dos componentes dessa
6º ano Química Tarefa 22 Professor Gustavo 01. Uma amostra de água do mar contaminada com óleo foi coletada em alto mar. Sobre os procedimentos aplicados para a separação eficiente dos componentes dessa
Experiência 2. DETERMINAÇÃO DO PONTO DE FUSÃO DE SUBSTÂNCIAS
 Experiência 2. DETERMINAÇÃO DO PONTO DE FUSÃO DE SUBSTÂNCIAS 1. Objetivos Ao final desta atividade experimental espera-se que o aluno seja capaz de: - Identificar compostos e determinar suas purezas usando
Experiência 2. DETERMINAÇÃO DO PONTO DE FUSÃO DE SUBSTÂNCIAS 1. Objetivos Ao final desta atividade experimental espera-se que o aluno seja capaz de: - Identificar compostos e determinar suas purezas usando
Química Orgânica Experimental I
 Química Orgânica Experimental I Preparação e Purificação do Acetato de Isopentila Ronan Geraldo Ferreira Introdução Neste experimento, será preparado um éster, o Acetato de Isopentila que freqüentemente
Química Orgânica Experimental I Preparação e Purificação do Acetato de Isopentila Ronan Geraldo Ferreira Introdução Neste experimento, será preparado um éster, o Acetato de Isopentila que freqüentemente
Preparação do Cloreto de terc-butila
 Preparação do Cloreto de terc-butila Substituição Nucleofílica Alifática João Fernando Villarrubia Lopes Munhoz Mariana Rosa Pereira Milena Fontes Luizete Yussra Abdul Ghani Substituição Nucleofílica -
Preparação do Cloreto de terc-butila Substituição Nucleofílica Alifática João Fernando Villarrubia Lopes Munhoz Mariana Rosa Pereira Milena Fontes Luizete Yussra Abdul Ghani Substituição Nucleofílica -
Extração com Solventes
 Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
AULA PRÁTICA Nº / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS
 LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
O que se pode fazer com amoníaco?
 Nome :.. 11º Ano Turma: Classificação: Professora:... Disciplina de Física e Química A Ano 2 (Susana Vieira) AL 1.2 Síntese do sulfato de tetraminocobre(ii) mono-hidratado Questão - problema O que se pode
Nome :.. 11º Ano Turma: Classificação: Professora:... Disciplina de Física e Química A Ano 2 (Susana Vieira) AL 1.2 Síntese do sulfato de tetraminocobre(ii) mono-hidratado Questão - problema O que se pode
MT DEPARTAMENTO NACIONAL DE ESTRADAS DE RODAGEM
 Método de Ensaio Página 1 de 7 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser adotado na determinação da densidade de materiais líquidos e semi-sólidos, a 25/25ºC ou 15,6/15,6ºC,
Método de Ensaio Página 1 de 7 RESUMO Este documento, que é uma norma técnica, fixa o procedimento a ser adotado na determinação da densidade de materiais líquidos e semi-sólidos, a 25/25ºC ou 15,6/15,6ºC,
Preparação e padronização de soluções
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
ANÁLISE DOS GASES DE COMBUSTÃO ATRAVÉS DO APARELHO ORSAT. Procedimento
 CETESB ANÁLISE DOS GASES DE COMBUSTÃO ATRAVÉS DO APARELHO ORSAT Procedimento L9.210 OUT/90 SUMÁRIO Pág. 1 Objetivo...1 2 Normas Complementar...1 3 Definições...1 4 Aparelhagem e reagentes...1 5 Execução
CETESB ANÁLISE DOS GASES DE COMBUSTÃO ATRAVÉS DO APARELHO ORSAT Procedimento L9.210 OUT/90 SUMÁRIO Pág. 1 Objetivo...1 2 Normas Complementar...1 3 Definições...1 4 Aparelhagem e reagentes...1 5 Execução
MF-0427.R-2 - MÉTODO DE DETERMINAÇÃO DE FÓSFORO TOTAL (DIGESTÃO COM HNO 3 + HClO 4 E REAÇÃO COM MOLIBDATO DE AMÔNIO E ÁCIDO ASCÓRBICO)
 MF-0427.R-2 - MÉTODO DE DETERMINAÇÃO DE FÓSFORO TOTAL (DIGESTÃO COM HNO 3 + HClO 4 E REAÇÃO COM MOLIBDATO DE AMÔNIO E ÁCIDO ASCÓRBICO) Notas: Aprovado pela Deliberação CECA nº 0424, de 24 de fevereiro
MF-0427.R-2 - MÉTODO DE DETERMINAÇÃO DE FÓSFORO TOTAL (DIGESTÃO COM HNO 3 + HClO 4 E REAÇÃO COM MOLIBDATO DE AMÔNIO E ÁCIDO ASCÓRBICO) Notas: Aprovado pela Deliberação CECA nº 0424, de 24 de fevereiro
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
html Química 10º Ano - Módulo Inicial
 http://adorofisicaequimica.blogs.sapo.pt/ 15572.html Química 10º Ano - Módulo Inicial http:// phet.colorado.edu/ pt/simulation/statesof-matter MISTURA Heterogénea Homogénea Ex: Mel; café,
http://adorofisicaequimica.blogs.sapo.pt/ 15572.html Química 10º Ano - Módulo Inicial http:// phet.colorado.edu/ pt/simulation/statesof-matter MISTURA Heterogénea Homogénea Ex: Mel; café,
Experimento 2: SÍNTESE DE COMPOSTOS DE COORDENAÇÃO
 Universidade Federal do Paraná Departamento de Química Disciplina: Química Inorgânica e Experimental CQ071 Curso: Licenciatura e Bacharelado em Química Professor: Shirley Nakagaki Experimento 2: SÍNTESE
Universidade Federal do Paraná Departamento de Química Disciplina: Química Inorgânica e Experimental CQ071 Curso: Licenciatura e Bacharelado em Química Professor: Shirley Nakagaki Experimento 2: SÍNTESE
Alexandra Silva Fernandes
 Alexandra Silva Fernandes APL 2.1. 1ª parte Soluções como se preparam? Problema: Como preparar 50,0 cm 3 de um solução aquosa de tiossulfato de sódio 0,030 mol.dm 3? Como preparar uma solução, a partir
Alexandra Silva Fernandes APL 2.1. 1ª parte Soluções como se preparam? Problema: Como preparar 50,0 cm 3 de um solução aquosa de tiossulfato de sódio 0,030 mol.dm 3? Como preparar uma solução, a partir
4024 Síntese enantioseletiva do éster etílico do ácido (1R,2S)-cishidroxiciclopentano-carboxílico
 4024 Síntese enantioseletiva do éster etílico do ácido (1R,2S)-cishidroxiciclopentano-carboxílico H levedura C 8 H 12 3 C 8 H 14 3 (156,2) (158,2) Classificação Tipos de reação e classes de substâncias
4024 Síntese enantioseletiva do éster etílico do ácido (1R,2S)-cishidroxiciclopentano-carboxílico H levedura C 8 H 12 3 C 8 H 14 3 (156,2) (158,2) Classificação Tipos de reação e classes de substâncias
32 nd IChO Laboratory Task 1 Student Code. 32nd International Chemistry Olympiad Copenhagen, Terça-feira, 4 Julho 2000 Exame Prático
 32 nd IChO Laboratory Task 1 Student Code 32nd International Chemistry Olympiad Copenhagen, Terça-feira, 4 Julho 2000 Exame Prático Problema 1 30 Pontos Este experimento inclui uma preparação de um sal
32 nd IChO Laboratory Task 1 Student Code 32nd International Chemistry Olympiad Copenhagen, Terça-feira, 4 Julho 2000 Exame Prático Problema 1 30 Pontos Este experimento inclui uma preparação de um sal
SEMINÁRIO DA EXTRAÇÃO DA CAFEÍNA DO CHÁ PRETO
 SEMINÁRIO DA EXTRAÇÃO DA CAFEÍNA DO CHÁ PRETO 1. INTRODUÇÃO: A cafeína (3,7-diidro-1,3,7-trimetil-1H-purina-2,6-diona) pura é uma substância branca, sem gosto, que constitui aproximadamente 5% do peso
SEMINÁRIO DA EXTRAÇÃO DA CAFEÍNA DO CHÁ PRETO 1. INTRODUÇÃO: A cafeína (3,7-diidro-1,3,7-trimetil-1H-purina-2,6-diona) pura é uma substância branca, sem gosto, que constitui aproximadamente 5% do peso
EXPERIÊNCIA 6 TINGIMENTO DE DIFERENTES TIPOS DE FIBRAS/TECIDOS COM CORANTES DE NATUREZAS DIVERSAS 1- INTRODUÇÃO
 EXPERIÊNCIA 6 TINGIMENTO DE DIFERENTES TIPOS DE FIBRAS/TECIDOS COM CORANTES DE NATUREZAS DIVERSAS 1- INTRODUÇÃO Com foco na realidade da comunidade blumenauense e partindo desta para a compreensão da realidade
EXPERIÊNCIA 6 TINGIMENTO DE DIFERENTES TIPOS DE FIBRAS/TECIDOS COM CORANTES DE NATUREZAS DIVERSAS 1- INTRODUÇÃO Com foco na realidade da comunidade blumenauense e partindo desta para a compreensão da realidade
Qui. Allan Rodrigues Xandão (Victor Pontes)
 Semana 16 Allan Rodrigues Xandão (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. Solubilidade
Semana 16 Allan Rodrigues Xandão (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. Solubilidade
1) O que aconteceu com o cubo de gelo no béquer 1? Que conclusão você tira desse resultado?...
 Nº da Prática: 01 Data: / / Título da Prática: Qual o líquido é mais denso: a água líquida ou o álcool? S Comparar as densidades da água líquida, do gelo e do álcool. 2 cubos de gelo; álcool; água. Coloque
Nº da Prática: 01 Data: / / Título da Prática: Qual o líquido é mais denso: a água líquida ou o álcool? S Comparar as densidades da água líquida, do gelo e do álcool. 2 cubos de gelo; álcool; água. Coloque
