AULA 01 - GASES QUÍMICA GERAL II QGE2001 Profa. Marcia Margarete Meier
|
|
|
- Mauro Osório Rocha
- 7 Há anos
- Visualizações:
Transcrição
1 1 AULA 01 - GASES QUÍMICA GERAL II QGE2001 Profa. Marcia Margarete Meier
2 2 CONCEITOS QUE VOCÊ DEVE DOMINAR PARA ACOMPANHAR AS AULAS -Matemática básica -Noções de gráficos -Forças intermoleculares HABILIDADES QUE VOCÊ IRÁ ADQUIRIR COM ESTE CONTEÚDO - Compreender a Lei dos Gases ideais - Compreender os experimentos realizados por Boyle, Charles, Avogadro e Dalton - Elaborar e Interpretar gráficos - Correlacionar gráficos lineares com a equação dos gases ideais - Aplicar a equação dos gases ideias em situações do cotidiano
3 3 As Propriedades dos Gases O que estas imagens dizem sobre os gases?
4 4 As Propriedades dos Gases Um gás é um conjunto de moléculas (ou átomos) em movimento permanente e aleatório, com velocidades que aumentam quando a temperatura se eleva. Um gás pode se transformar em um líquido (liquefação)? Como? O que ocorre a nível molecular? Diferentes estados de agregação da matéria.
5 5 Estados de agregação da matéria O que causa os diferentes estados de agregação da matéria? Distância entre as moléculas/átomos Repulsão e atração entre as moléculas/átomos Equilíbrio de forças Interação (forças intermoleculares) ou conhecido como Energia potencial de interação
6 6 Energia potencial de interação q E atração carga-carga = 1 q 2 Lei de Couloumb 4 ε o r 12 repulsão repulsão atração
7 7 Revisão: Forças Intermoleculares
8 8 Revisão: Forças Intermoleculares A capacidade de atração/repulsão entre as moléculas (não iônicas) depende do dipolo (permanente ou induzido) gerado por moléculas. A intensidade do momento de dipolo (µ) depende de dois fatores: Diferença de eletronegatividade entre átomos; Geometria das moléculas
9 9 Revisão: Forças Intermoleculares Por que O 2 dissolve-se em água? Polarizabilidade
10 10 Revisão: Forças Intermoleculares 1)Justifique o aumento da temperatura de ebulição das substâncias químicas abaixo:
11 11 Revisão: Forças Intermoleculares 2) Por que Butano (gás de cozinha) pode ser liquefeito?
12 12 Revisão: Forças Intermoleculares 3) Coloque as seguintes substâncias em ordem crescente de força intermolecular, justificando.
13 13 Revisão: Forças Intermoleculares 4) Considere as bases nitrogenadas citosina, timina, guanina, adenina responsáveis pela interação entre as cadeias do DNA. Diga quais bases nitrogenadas podem e não podem interagir, mostrando como e por que.
14 14 Revisão: Forças Intermoleculares 5) Quais informações relevantes você pode extrair do gráfico abaixo?
15 15 Revisão: Forças Intermoleculares 6) Por que gelo flutua sobre a água? Uma garrafa de refrigerando congelada pode estourar na geladeira?
16 16 Revisão: Forças Intermoleculares 7) Explique a imagem abaixo, qual a correlação com as forças intermoleculares:
17 17 Revisão: Forças Intermoleculares 8)A Tabela abaixo traz os valores de solubilidade de alguns gases em água. Considerando os valores tabelados, percebe-se que oxigênio apresenta a maior solubilidade em água. Essa característica é de fundamental importância para a sobrevivência de organismos vivos nos rios e lagos. Responda: a) como justificar a solubilidade de uma molécula apolar, como o oxigênio, em água? b) como justificar a diferença de solubilidade em água entre H 2, N 2 e O 2?
18 18 Estados Físicos Como transformar a mesma matéria nos diferentes estados físicos? Variação de pressão Variação de volume Variação de temperatura
19 19 Propriedade dos Gases Comportam-se de forma caótica; Não ocupa lugar definido no espaço, por si só não tem fronteira; Não tem forma definida, adquirindo a forma do recipiente; O choque de suas moléculas ou átomos contra a parede do recipiente que os contém se traduz em uma propriedade denominada PRESSÃO. P = Força (N) Área (m 2 ) N/m 2 = Pascal (Pa) pelo SI. J= 1 N.m = 1 kg.m².s -2 1 atm = Pa = 760 mmhg = 760 Tor
20 20 Propriedade dos Gases Outra propriedade dos gases é seu volume (V) que eles ocupam quando confinados em um espaço limitado fisicamente. V é medido em m 3 pelo SI 1 m 3 = 1000 L Tanto a Pressão como o Volume estão relacionados com a Temperatura de um gás (T). T é expresso em Kelvin (K) pelo SI 1K = o C + 273,15 A quantidade do gás também é uma variável que define o comportamento de um gás e é medida em número de mols (n).
21 21 Propriedade dos Gases O comportamento de um gás é definido por quatro variáveis: P V T n Descreve o Estado do Gás Equação de Estado! Mas, as forças intermoleculares não afetam o comportamento dos gases?
22 22 Lei dos Gases Ideais Os estudos iniciais dos gases desconsideravam as forças intermoleculares. Então um gás não pode ser liquefeito!??? Diz-se que nesta situação o comportamento do gás é IDEAL ou PERFEITO. Na verdade o gás ideal é apenas um modelo (uma idealização) que parte do pressuposto que as interações entre as moléculas são nulas! Por definição, o modelo de gás ideal parte dos seguintes princípios: 1) O gás ideal é composto por partículas tão minúsculas comparadas ao volume do gás, que podem ser consideradas como pontos no espaço com volume zero; 2) Não há interações, atrativas ou repulsivas, entre as partículas do gás. Em qual situação se espera ausência de interação entre as moléculas/átomos de um gás?
23 23 Lei dos Gases Ideais Alguns dos primeiros experimentos de Físico-Química envolveram o estudo de gases num abordagem empírica na compressão dos sistemas químicas. Abordagem empírica: são realizadas e correlacionadas várias observações experimentais de modo a se obter leis que descrevem e explicam o comportamento da matéria. Por outro lado, sistemas químicos podem ser abordados teoricamente. Abordagem teórica: é construído um modelo para descrever o comportamento das moléculas do sistema, e esse modelo é usado para descrever uma teoria.
24 24 Lei dos Gases Ideais Lei de Boyle, 1661 Realizou experimentos com gases mantendo a massa e temperatura constantes. Lei de Charles e Gay-Lussac, 1787 Realizaram experimentos com gases mantendo a massa e a pressão constantes. Lei de Avogadro, 1811 Realizou experimentos com diferentes gases, mas mantendo o número de mols dos gases constantes.
25 25 Lei dos Gases Ideais Lei de Boyle
26 26 Lei dos Gases Ideais Lei de Boyle 1) Vamos elaborar um gráfico de P vs V: 2) Agora, faça outro gráfico mas de V vs. 1/P. 3) Agora, calcule o coeficiente angular da reta e coeficiente linear. Veja que o gráfico torna-se linear!
27 27 Lei dos Gases Ideais Lei de Boyle P 1 x V 1 = k P 2 x V 2 = k P 1 x V 1 = P 2 x V 2 V 2 = k P 2
28 28 Lei dos Gases Ideais Lei de Boyle Temperatura constante = Isoterma A curva acima é chamada de hipérbole. Ao multiplicar xy = constante
29 29 Lei dos Gases Ideais Lei de Boyle Teoria cinética dos gases quando: A pressão do gás aumenta quando o volume do recipiente diminui? Lembre-se que a pressão do gás nas paredes do recipiente devem-se às colisões das moléculas nas paredes. Se o volume do recipiente é reduzido, as moléculas do gás tem uma distância mais curta para deslocar-se antes de colidir com as paredes do recipiente. Isto significa que elas colidirão com as paredes mais frequentemente. O aumento da frequência de colisões com as paredes causa o aumento da pressão.
30 30 Lei dos Gases Ideais Lei de Charles ou Gay-Lussac 1) Elabore um gráfico T vs. V (a pressão e massa constante), lembrando de deixar espaço para escala negativa do eixo x. 2) Extrapole a linha do gráfico para V = 0. Qual será o valor da temperatura?
31 31 Lei dos Gases Ideais Lei de Charles ou Gay-Lussac Pressão constante = Isobárico Volume constante= Isométrica Qual explicação molecular para P = 0, quando T = 0?
32 32 Lei dos Gases Ideais Lei de Charles ou Gay-Lussac Teoria cinética dos gases quando: O volume do gás aumenta quando a temperatura se eleva à pressão constante? O aumento da T causa um aumento na velocidade das moléculas; Isso resulta numa maior força exercida pelas moléculas nas paredes do recipiente; Para manter a força (consequentemente a pressão) constantes, o número de colisões de moléculas/área deve diminuir. A única maneira de fazer isso é aumentando a distância percorrida pelas moléculas, ou seja, aumentando o volume do recipiente que contém as moléculas.
33 33 Lei dos Gases Ideais Lei de Avogadro: permite calcular o volume molar T 2 T 1 T 2 > T 1 Sistema Isotérmico e Isóbaro
34 34 Lei dos Gases Ideais Lei de Clayperon: Uniu os resultados experimentais de Boyle, Charles, Gay-Lussac e Avogadro. atm L
35 35 Lei dos Gases Ideais Lei de Clayperon: Uniu os resultados experimentais de Boyle, Charles, Gay-Lussac e Avogadro. Esta equação é uma equação de estado dos gases ideais (descreve as propriedades de um gás) quando a pressão tende a zero. Pois nesta condição as forças intermoleculares podem ser desconsideradas. R = constante dos gases ideais, P tendendo a zero 8,314 JK-1mol-1 0,08205 L atm K-1mol-1
36 36 Lei dos Gases Ideais Como converter unidades... Suponha que você necessite converter a constante universal dos gases, R de 8,314 J K -1 mol -1 para a unidade em?? cal K -1 mol -1 1 cal = 4,184 J Então, 1cal/4,184 = J 8,314 J K -1 mol -1 8,314 cal/4,184 K -1 mol -1 8,314/4,184 cal K -1 mol -1 1,987 cal K -1 mol -1
37 37 Lei dos Gases Ideais Como converter unidades... Suponha que você necessite converter a constante universal dos gases, R de 0, atm L K -1 mol -1 para a unidade em?? J K -1 mol -1 atm = Pa 0,08205 atm L K -1 mol -1 0,08205x Pa L K -1 mol -1 J = Pa. m 2.m = Pa. m 3 = Pa. 1000L J = N.m Pa = N/m 2 ou N = Pa.m 2 Se, J = Pa. 1000L Então, J/1000 = Pa. L 0,08205x J K -1 mol ,314 J K -1 mol -1
38 38 1) Qual será o volume molar de um gás ideal nas Condições Ambientes de Temperatura e Pressão (CNATP), quando T = 25 o C. 2)Uma das aplicações da teoria dos gases ideais na prática farmacêutica é do doseamento gasométrico de substâncias que, quando decompostas em meio ácido, liberam gás. Qual é o grau de pureza de uma amostra de 2,0 g de bicarbonato de sódio (NaHCO 3 ) sabendo-se que a mesma, quando em contato com HCl, libera 0,480 L de CO 2, medido a 273 K e 1 atm? Considere que CO 2 tenha comportamento de gás ideal nestas condições. V teórico = 0,533 L Pureza = 0,480 L/0,533x100 = 90,06% 3)Uma amostra de 1 mol de gás ideal, inicialmente a 25 o C e 1 atm de pressão é aquecida isobaricamente até que seu volume duplique. Após esta expansão, a amostra é resfriada isometricamente até a sua temperatura inicial. Depois dessa etapa, a amostra sofre compressão isotérmica até 1 atm. Calcule a pressão, o volume e a temperatura de cada estado intermediário pelo qual passa o gás e esboce as transformações em um diagrama P vs. V.
39 , 39 Lei Combinada dos gases Ao combinar a Lei de Boyle e Lei de Charles, obtem-se a Lei combinada dos Gases: Para uma quantidade constante de gás, n
40 40 Exercício: Suponha que um balão preenchido com gás hélio seja lançado para a atmosfera quando a temperatura for 22,5 o C e a pressão for 754 mmhg. Se o volume do balão for 4,19 x 10 3 L ( e não há escape de hélio do balão), qual será o volume do balão a uma altitude de 20 milhas, onde a pressão é 76,0 mmhg e a temperatura é de -33 o C? Condição Inicial Condições Finais V 1 = 4,19 x 10 3 L V 1 =?? P 1 = 754 mmhg P 1 = 76,0 mmhg T 1 = 22,5 o C (295,7 K) T 1 = -33,0 o C (240,2 K) Resposta: 3,38 x 10 4 L
41 , 41 Outras possibilidades... Para uma quantidade constante de gás, n Quando V e n são constantes Quando T e n são constantes Quando P e n são constantes
42 42 Lei de Dalton Mistura de Gases Suponha três gases diferentes confinados em cilindros: P T = P 1 + P 2 + P 3 O que ocorrerá ao misturarmos os três gases? Parte-se do princípio dos gases ideais, não há interação entre os gases. Portanto, cada gás irá se comportar de forma independente ao outro. Desta maneira, cada gás se comporta como se estivesse ocupando todo o recipiente sozinho, mas as paredes do recipiente sentirão o choque de todas as moléculas misturadas, portanto a pressão será modificada ao misturar os gases.
43 43 Lei de Dalton Mistura de Gases P T = P 1 + P 2 + P Σ P i Pressão parcial do gás 1 P = x P 1 1 T Fração molar do gás 1 Pressão total de todos os gases misturados Qual a diferença entre fração mássica e fração molar?? Porcentagem podenral!
44 44 4) A percentagem poderal (isto é, em massa) do ar seco, ao nível do mar, é aproximadamente 75,5% de N 2, 23,2 % de O 2 e 1,3% de outros gases, cuja massa molar média é 39,95 g/mol. Qual é a pressão parcial de cada componente quando a pressão total é igual a 1,00 atm?
45 45 RESUMINDO... GASES IDEAIS
46 46 Colunas de mercúrio para medir pressão Historicamente, as pressões eram medidas pela determinação da altura de uma coluna de mercúrio em equilíbrio com a pressão atmosférica. Quanto mais alta a pressão atmosférica, mais longa a coluna de mercúrio que pode ser sustentada no tubo. P = hρg ρ=densidade
47 47 Colunas de mercúrio para medir pressão Exemplo: Próximo da temperatura ambiente, a densidade (massa específica) do mercúrio é 13,6 g.cm -3 e a da água é 1,0 g.cm -3. Calcule a altura de uma coluna de cada líquido que suportaria uma pressão de 1 atm e sugira por que o mercúrio é utilizado em barômetros em lugar da água.
48 48 Lei dos Gases e Densidade d = P.M w RT Exercício: Calcule a densidade do CO 2 nas CNTP. O CO 2 é mais ou menos denso do que o ar (1,2 g/l)?
49 49 Lei dos Gases e Densidade Como o dióxido de carbono do extintor de incêndio é mais denso que o ar ele se acumula sobre o fogo abafando-o. Quando o gás CO 2 é liberado do tanque, ele se expande e se resfria consideravelmente. A nuvem consiste de CO 2 sólido e umidade do ar condensada.
50 50 Lei dos Gases e Densidade O ar seco, que tem massa molar média de 29 g/mol, tem densidade de aproximadamente 1,2 g/l a 1 atm e 25 o C. Os gases ou vapores com massas molares maiores que 29 g/mol apresentam densidades maiores do que 1,2 g/l nas mesmas condições de T e P. Gases como CO 2, SO 2 e vapor da gasolina descem ao nível do solo se liberados na atmosfera. Lago Nyos, Camarões. Liberação de CO 2 causou a morte de 1700 pessoas em Gases como H 2, He, CO, CH 4 sobem se liberados na atmosfera.
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Físico-Química I. Profa. Dra. Carla Dalmolin. Gases. Gás perfeito (equações de estado e lei dos gases) Gases reais
 Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA
 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Gases UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG120. Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI
 UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
GASES. QUIMICA II a Unidade
 GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Características dos gases
 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Luis Eduardo C. Aleotti. Química. Aula 38 - Transformações Gasosas
 Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
11/08/2014. Lei de Avogadro. Equação de Clayperon. CNTP 1 atm 0 C 273K
 Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Física II FEP 112 ( ) 1º Semestre de Instituto de Física - Universidade de São Paulo. Professor: Valdir Guimarães
 Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
QUÍMICA I Gases
 QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
GASES. Maira Gazzi Manfro e Giseli Menegat
 GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
Estudo dos gases. Prof. Leandro Zatta - Química Geral 1
 Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Gases. Compostos orgânicos de baixa massa molar são gases a temperatura ambiente. CH 4 (metano gás natural), C 3 H 8
 Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
2º ano FÍSICA Prof. Márcio Marinho DIAGRAMA DE FASES E GASES PERFEITOS
 DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
EXPERIÊNCIA 2 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO
 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que:
 01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
s e s a G a ic ím u Q G. A 1 P
 1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
Química Prof. Giacometto
 Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
O ESTADO GASOSO - CARACTERÍSTICAS GERAIS
 Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Conceitos Básicos sobre gases
 Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Estado Gasoso. Características. Expansibilidade compressibilidade. Situação de um gás. Variáveis de estado
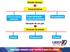 Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO
 AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
Vejamos agora alguns casos particulares dessas transformações com quantidade de gás constante.
 Setor 2306 Aula 06 Transformações Gasosas em sistemas fechados Complemento. Como vimos em aula, as transformações realizadas em sistemas fechados tem sua quantidade de gás constante. Nessa situação, a
Setor 2306 Aula 06 Transformações Gasosas em sistemas fechados Complemento. Como vimos em aula, as transformações realizadas em sistemas fechados tem sua quantidade de gás constante. Nessa situação, a
6/Mar/2013 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
QUÍMICA. Transformações Químicas. Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Princípio de Avogadro Parte 4
 QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
Professora : Elisângela Moraes
 UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
ATMOSFERA. Volume molar; constante de Avogadro
 ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
Disciplina: Sistemas Térmicos
 Disciplina: Sistemas Térmicos Definição de Substância Pura Equilíbrio de Fases Líquido-Vapor de uma Substância Pura Diagrama de Temperatura versus Volume Específico Título de uma Substância com Fases Líquida
Disciplina: Sistemas Térmicos Definição de Substância Pura Equilíbrio de Fases Líquido-Vapor de uma Substância Pura Diagrama de Temperatura versus Volume Específico Título de uma Substância com Fases Líquida
QUÍMICA - 1 o ANO MÓDULO 10 LIGAÇÕES QUÍMICAS - PARTE 3
 QUÍMICA - 1 o ANO MÓDULO 10 LIGAÇÕES QUÍMICAS - PARTE 3 Como pode cair no enem (CESGRANRIO) Observe a tabela de pontos de ebulição: Substância P.E. ( C) H 2 O +100,0 H 2 S -60,3 H 2 Se -41,3 H 2 Te -2,2
QUÍMICA - 1 o ANO MÓDULO 10 LIGAÇÕES QUÍMICAS - PARTE 3 Como pode cair no enem (CESGRANRIO) Observe a tabela de pontos de ebulição: Substância P.E. ( C) H 2 O +100,0 H 2 S -60,3 H 2 Se -41,3 H 2 Te -2,2
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
Estequiometria. Mestranda: Daniele Potulski Disciplina: Química da madeira I
 Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Combustíveis Energia e Ambiente. Combustíveis gasosos, líquidos e sólidos: compreender as diferenças
 Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
= 6, mol de moléculas de um gás possui aproximadamente 6, moléculas deste gás, ou seja, seiscentos e dois sextilhões de moléculas;
 TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
Prof. Vanderlei I Paula -
 Centro Universitário Anchieta Engenharia Química Físico Química I Prof. Vanderlei I Paula Gabarito 3 a lista de exercícios 01 Alimentos desidratados apresentam maior durabilidade e mantêm a maioria das
Centro Universitário Anchieta Engenharia Química Físico Química I Prof. Vanderlei I Paula Gabarito 3 a lista de exercícios 01 Alimentos desidratados apresentam maior durabilidade e mantêm a maioria das
Química B Extensivo V. 7
 Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
FUNDAMENTOS FÍSICOS DO AR COMPRIMIDO
 DEFINIÇÃO: O ar é incolor, insípido e é uma mistura de diversos gases. Composição percentual do ar seco padrão: (ISO 2533). Elementos Percentual em volume Percentual em massa Nitrogênio 78,08 75,52 Oxigênio
DEFINIÇÃO: O ar é incolor, insípido e é uma mistura de diversos gases. Composição percentual do ar seco padrão: (ISO 2533). Elementos Percentual em volume Percentual em massa Nitrogênio 78,08 75,52 Oxigênio
Aula 6. Forças Intermoleculares
 ACH5521 - Química Geral Aula 6. Forças Intermoleculares Profa Káthia M. Honório (kmhonorio@usp.br) Quais são as forças envolvidas em cada caso? Questões Por que a água é encontrada na forma líquida e não
ACH5521 - Química Geral Aula 6. Forças Intermoleculares Profa Káthia M. Honório (kmhonorio@usp.br) Quais são as forças envolvidas em cada caso? Questões Por que a água é encontrada na forma líquida e não
Equilíbrio Físico. Disciplina Química Geral II Curso de Química habilitação em licenciatura Prof a. Marcia Margarete Meier
 1 Equilíbrio Físico Disciplina Química Geral II Curso de Química habilitação em licenciatura Prof a. Marcia Margarete Meier 2 Equilíbrio Físico Estamos rodeados por substâncias que mudam de uma forma a
1 Equilíbrio Físico Disciplina Química Geral II Curso de Química habilitação em licenciatura Prof a. Marcia Margarete Meier 2 Equilíbrio Físico Estamos rodeados por substâncias que mudam de uma forma a
Física Geral II. Aula 1 - Teoria cinética dos gases. D. Valin 1. Universidade do Estado de Mato Grosso. Sinop-MT, April 25, 2017
 Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Atividades de Recuperação Paralela de Química 2º. Trimestre. Conteúdo para estudos:
 Atividades de Recuperação Paralela de Química 2º. Trimestre 1ª série Ensino Médio Setor A: Livro-texto: Conteúdo para estudos:. Capítulo 5: O mol e as massas de átomos e moléculas Compreender os conceitos
Atividades de Recuperação Paralela de Química 2º. Trimestre 1ª série Ensino Médio Setor A: Livro-texto: Conteúdo para estudos:. Capítulo 5: O mol e as massas de átomos e moléculas Compreender os conceitos
11/Mar/2016 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
Primeira Lei da Termodinâmica
 Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trabalho de expansão Trocas térmicas Entalpia Termodinâmica Estudo das transformações de
Físico-Química I Profa. Dra. Carla Dalmolin Primeira Lei da Termodinâmica Definição de energia, calor e trabalho Trabalho de expansão Trocas térmicas Entalpia Termodinâmica Estudo das transformações de
COMPORTAMENTO DOS GASES
 BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
Qui. Semana. Allan Rodrigues Gabriel Pereira (Victor Pontes)
 Semana 8 Allan Rodrigues Gabriel Pereira (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Semana 8 Allan Rodrigues Gabriel Pereira (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Termodinâmica Lista de Problemas 1.1
 Termodinâmica - 2018.2 - Lista de Problemas 1.1 1 Termodinâmica Lista de Problemas 1.1 Departamento de Física de Ji-Paraná Universidade Federal de Rondônia Prof. Marco Polo Questão 01 A pressão necessária
Termodinâmica - 2018.2 - Lista de Problemas 1.1 1 Termodinâmica Lista de Problemas 1.1 Departamento de Física de Ji-Paraná Universidade Federal de Rondônia Prof. Marco Polo Questão 01 A pressão necessária
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS
 ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
Soluções e Gases III. Gases
 Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Metal, Não Metal e Metaloide
 Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2
 QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
1ª Parte: Questões resolvidas
 ANÁLISE ELEMENTAR QUANTITATIVA DISCIPLINA: QUÍMICA GERAL / TURMA: 1º ano Ensino Médio 1ª Parte: Questões resolvidas Nota: A massa molecular de um composto, pode ser calculada em função da densidade de
ANÁLISE ELEMENTAR QUANTITATIVA DISCIPLINA: QUÍMICA GERAL / TURMA: 1º ano Ensino Médio 1ª Parte: Questões resolvidas Nota: A massa molecular de um composto, pode ser calculada em função da densidade de
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor dessa pressão em atm e kpa?
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
Lista de Exercícios 9 Teoria cinética dos gases, Primeira e Segunda leis da Termodinâmica
 Lista de Exercícios 9 Teoria cinética dos gases, Primeira e Segunda leis da Termodinâmica Exercícios Sugeridos (14 de novembro de 2008) A numeração corresponde ao Livro Texto. 16.19 Um balão de ar quente
Lista de Exercícios 9 Teoria cinética dos gases, Primeira e Segunda leis da Termodinâmica Exercícios Sugeridos (14 de novembro de 2008) A numeração corresponde ao Livro Texto. 16.19 Um balão de ar quente
Gases. 1) Assinale a alternativa CORRETA.
 Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011
 André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
QUÍMICA Profº JAISON
 QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
PROVA DE QUÍMICA. Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: PROVA DE QUÍMICA - Caderno 1
 PROVA DE QUÍMICA Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: http://wwwiupacorg/reports/periodic_table/ 18 PROVA DE QUÍMICA - Caderno 1 QUESTÃO 25 1 Na extração do ouro, os garimpeiros costumam
PROVA DE QUÍMICA Adaptada da Tabela Periódica da IUPAC/versão 2007 Acesso: http://wwwiupacorg/reports/periodic_table/ 18 PROVA DE QUÍMICA - Caderno 1 QUESTÃO 25 1 Na extração do ouro, os garimpeiros costumam
Termodinâmica 7. Alexandre Diehl. Departamento de Física - UFPel
 Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
Questão 4. Questão 5
 Questão 1 Um mol de gás ideal sofre transformação AëBëC indicada no diafragma pressão x volume da figura a seguir. a) qual é a temperatura do gás no estado A? b) Qual é o trabalho realizado pelo gás na
Questão 1 Um mol de gás ideal sofre transformação AëBëC indicada no diafragma pressão x volume da figura a seguir. a) qual é a temperatura do gás no estado A? b) Qual é o trabalho realizado pelo gás na
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE
 Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
PROPRIEDADE DOS GASES
 RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
Física Geral e Experimental III. Exercícios Temperatura e Dilatação
 Física Geral e Experimental III Exercícios Temperatura e Dilatação 1. Em um dia quando a temperatura alcança 50ºF, qual é a temperatura em graus Celsius e Kelvins? R: 10ºC; 283 K. 2. O ouro tem um ponto
Física Geral e Experimental III Exercícios Temperatura e Dilatação 1. Em um dia quando a temperatura alcança 50ºF, qual é a temperatura em graus Celsius e Kelvins? R: 10ºC; 283 K. 2. O ouro tem um ponto
Experimento N 3 DETERMINAÇÃO EXPERIMENTAL DA MASSA MOLAR DO GÁS BUTANO E DO MAGNÉSIO
 Experimento N 3 DETERMINAÇÃO EXPERIMENTAL DA MASSA MOLAR DO GÁS BUTANO E DO MAGNÉSIO 1) INTRODUÇÃO A maioria dos gases reais mostra um comportamento aproximado ao de um gás ideal, especialmente se a pressão
Experimento N 3 DETERMINAÇÃO EXPERIMENTAL DA MASSA MOLAR DO GÁS BUTANO E DO MAGNÉSIO 1) INTRODUÇÃO A maioria dos gases reais mostra um comportamento aproximado ao de um gás ideal, especialmente se a pressão
Forças intermoleculares. Formação de fases condensadas Forças íon-dipolo Forças dipolo-dipolo Forças de London Ligação de hidrogênio
 Forças intermoleculares Formação de fases condensadas Forças íon-dipolo Forças dipolo-dipolo Forças de London Ligação de hidrogênio Estado gasoso O estado da matéria mais simples é o gás. Descrevemos esse
Forças intermoleculares Formação de fases condensadas Forças íon-dipolo Forças dipolo-dipolo Forças de London Ligação de hidrogênio Estado gasoso O estado da matéria mais simples é o gás. Descrevemos esse
b) Tendo em conta a conclusão de Avogadro, selecione a opção que completa corretamente a frase seguinte. Em condições PTN,...
 QUESTÕES DE EXAME 4 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 4 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
Hipótese de Avogadro e Volume Molar
 Hipótese de Avogadro e Volume Molar EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H, N e O, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
Hipótese de Avogadro e Volume Molar EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H, N e O, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
Unimonte, Engenharia Física Aplicada, prof. Marco Simões Comportamento Térmico dos Gases. Exercícios selecionados do Sears & Zemanzki, vol.
 Unimonte, Engenharia Física Aplicada, prof. Marco Simões Comportamento Térmico dos Gases. Exercícios selecionados do Sears & Zemanzki, vol. 2 Nos exercícios abaixo adotar! = 8,315!!"#! = 0,08206!!"#!"#!
Unimonte, Engenharia Física Aplicada, prof. Marco Simões Comportamento Térmico dos Gases. Exercícios selecionados do Sears & Zemanzki, vol. 2 Nos exercícios abaixo adotar! = 8,315!!"#! = 0,08206!!"#!"#!
Equilíbrio Físico. Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança.
 Equilíbrio Físico Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança. FASES E TRANSIÇÕES DE FASES SOLUBILIDADE PROPRIEDADES COLIGATIVAS MISTURAS
Equilíbrio Físico Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança. FASES E TRANSIÇÕES DE FASES SOLUBILIDADE PROPRIEDADES COLIGATIVAS MISTURAS
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES
 MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
Termo- estatística REVISÃO DE TERMODINÂMICA. Alguns conceitos importante que aparecem nesta lei:
 Lei Zero da Termodinâmica 4300259 Termo- estatística REVISÃO DE TERMODINÂMICA Se dois sistema estão em equilíbrio térmico com um terceiro sistema, então eles também estão em equilíbrio entre si. Alguns
Lei Zero da Termodinâmica 4300259 Termo- estatística REVISÃO DE TERMODINÂMICA Se dois sistema estão em equilíbrio térmico com um terceiro sistema, então eles também estão em equilíbrio entre si. Alguns
HIPÓTESE DE AVOGADRO E VOLUME MOLAR
 HIPÓTESE DE AVOGADRO E VOLUME MOLAR EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H2, N2 e O2, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
HIPÓTESE DE AVOGADRO E VOLUME MOLAR EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H2, N2 e O2, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
2. Considere um bloco de gelo de massa 300g á temperatura de 20 C, sob pressão normal. Sendo L F
 1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2. prof. Daniela Szilard 23 de maio de 2016
 Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2 prof. Daniela Szilard 23 de maio de 2016 1. Julgue os itens: verdadeiro ou falso. ( ) A lei de Stevin é válida para qualquer
Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2 prof. Daniela Szilard 23 de maio de 2016 1. Julgue os itens: verdadeiro ou falso. ( ) A lei de Stevin é válida para qualquer
Físico-Química Farmácia 2014/02
 Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
Propriedades de uma substância pura
 Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
QUÍMICA 2 Prof Emanuele
 QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
Física. Leo Gomes (Vitor Logullo) Termodinâmica
 Termodinâmica Termodinâmica 1. No Rio de Janeiro (ao nível do mar), uma certa quantidade de feijão demora 40 minutos em água fervente para ficar pronta. A tabela abaixo fornece o valor da temperatura de
Termodinâmica Termodinâmica 1. No Rio de Janeiro (ao nível do mar), uma certa quantidade de feijão demora 40 minutos em água fervente para ficar pronta. A tabela abaixo fornece o valor da temperatura de
Estudo dos gases. Profa. Kátia Aquino
 Estudo dos gases Profa. Kátia Aquino Vapor ou Gás? O CO2 um gás Vapor de água Industrias em Yokohama-Japão: O homem injeta somente 3% de todo CO2. (foto:paul Davdson) O calor liberado na condensação do
Estudo dos gases Profa. Kátia Aquino Vapor ou Gás? O CO2 um gás Vapor de água Industrias em Yokohama-Japão: O homem injeta somente 3% de todo CO2. (foto:paul Davdson) O calor liberado na condensação do
Química da atmosfera...
 Atmosfera é a camada de ar que envolve a Terra do grego atmos = vapor do latim sphaera = invólucro. Assim, a palavra atmosfera pode significar: invólucro de vapor. Química - O estudo das propriedades e
Atmosfera é a camada de ar que envolve a Terra do grego atmos = vapor do latim sphaera = invólucro. Assim, a palavra atmosfera pode significar: invólucro de vapor. Química - O estudo das propriedades e
EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I
 Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
