Características dos gases
|
|
|
- João Gusmão Leão
- 6 Há anos
- Visualizações:
Transcrição
1 Gases
2 Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas homogêneas com outros gases. Os gases ocupam somente cerca de 0,1 % do volume de seus recipientes.
3 Características dos gases
4 Pressão A pressão é a força atuando em um objeto por unidade de área: P = F A A gravidade exerce uma força sobre a atmosfera terrestre Uma coluna de ar de 1 m 2 de seção transversal exerce uma força de 10 5 N. A pressão de uma coluna de ar de 1 m 2 é de 100 kpa.
5 Pressão
6 Pressão A pressão atmosférica e o barômetro Unidades SI: 1 N = 1 kg m/s 2 ; 1 Pa = 1 N/m 2. A pressão atmosférica é medida com um barômetro. Se um tubo é inserido em um recipiente de mercúrio aberto à atmosfera, o mercúrio subirá 760 mm no tubo. A pressão atmosférica padrão é a pressão necessária para suportar 760 mm de Hg em uma coluna. Unidades: 1 atm = 760 mmhg = 760 torr = 1, Pa = 101,325 kpa.
7 Pressão A pressão atmosférica e o barômetro
8 Pressão A pressão atmosférica e o barômetro As pressões de gases não abertos para a atmosfera são medidas em manômetros. Um manômetro consiste de um bulbo de gás preso a um tubo em forma de U contendo Hg: Se P gas < P atm então P gas + P h = P atm Se P gas > P atm então P gas = P atm + P h
9 As leis dos gases Relação pressão-volume: lei de Boyle Os balões de previsão de tempo são usados como uma consequência prática para a relação entre a pressão e o volume de um gás. Quando o balão de previsão de tempo se distancia da superfície terrestre, a pressão atmosférica diminui e seu volume aumenta A Lei de Boyle: o volume de uma quantidade fixa de gás é inversamente proporcional à sua pressão. Boyle usou um manômetro para executar o experimento.
10
11 As leis dos gases Matematicamente: Relação pressão-volume: lei de Boyle Um gráfico de V versus P é um hiperbolóide. Da mesma forma, um gráfico de V versus 1/P deve ser uma linha reta passando pela origem.
12 As leis dos gases Relação pressão-volume: lei de Boyle
13 As leis dos gases Relação temperatura-volume: lei de Charles Sabemos que balões de ar quente expandem quando são aquecidos. A lei de Charles: o volume de uma quantidade fixa de gás à pressão constante aumenta com o aumento da temperatura. Matematicamente:
14 As leis dos gases Relação temperaturavolume: lei de Charles Um gráfico de V versus T é uma linha reta. Quando T é medida em C, a intercessão no eixo da temperatura é -273,15 C. Definimos o zero absoluto, 0 K = -273,15 C.
15
16 As leis dos gases Relação quantidade-volume: lei de Avogadro A lei de Gay-Lussac de volumes combinados: a uma determinada temperatura e pressão, os volumes dos gases que reagem são proporções de números inteiros pequenos.
17 As leis dos gases Relação quantidade-volume: lei de Avogadro A hipótese de Avogadro: volumes iguais de gases à mesma temperatura e pressão conterão o mesmo número de moléculas. A lei de Avogadro: o volume de gás a uma dada temperatura e pressão é diretamente proporcional à quantidade de matéria do gás.
18 As leis dos gases Relação quantidade-volume: lei de Avogadro Matematicamente: Podemos mostrar que 22,4 L de qualquer gás a 0 C contém 6, moléculas de gás.
19 As leis dos gases Relação quantidade-volume: lei de Avogadro
20 A equação do gás ideal Considere as três leis dos gases. Lei de Boyle: Lei de Charles: Lei de Avogadro: Podemos combiná-las em uma lei geral dos gases:
21 A equação do gás ideal Se R é a constante de proporcionalidade (chamada de constante dos gases), então A equação do gás ideal é: R = 0,08206 L atm mol -1 K -1 = 8,314 J mol -1 K -1
22
23 A equação do gás ideal Definimos TPP (temperatura e pressão padrão) = 0 C, 273,15 K, 1 atm. Também se conhece a TPP por CNTP, mas O volume de 1 mol de gás na TPP é:
24 A equação do gás ideal Relacionando a equação do gás ideal e as leis dos gases Se PV = nrt e n e T são constantes, então PV = constante e temos a lei de Boyle. Outras leis podem ser criadas de modo similar. Em geral, se temos um gás sob dois grupos de condições, então: PV 1 n T = P2 V n T 2 2 2
25 Aplicações adicionais da equação do gás ideal Densidades de gases e massa molar A densidade tem unidades de massa por unidades de volume. Reajustando a equação ideal dos gases com M como massa molar, teremos: PV n = V nm V = P RT = nrt d = PM RT
26 A equação do gás ideal Densidades de gases e massa molar A massa molar de um gás pode ser determinada como se segue: M = drt P Volumes de gases em reações químicas A equação ideal dos gases relaciona P, V e T ao número de mols do gás. O n pode então ser usado em cálculos estequiométricos.
27 Mistura de gases e pressões parciais Uma vez que as moléculas de gás estão tão separadas, podemos supor que elas comportam-se independentemente. A Lei de Dalton: em uma mistura gasosa, a pressão total é dada pela soma das pressões parciais de cada componente: P total = P1 + P2 + P3 +L Cada gás obedece à equação ideal dos gases: P i = n i RT V
28 Mistura de gases e pressões parciais Combinando as equações: P total = ( n + n + n + L) 1 Pressões parciais e frações em quantidade de matéria Considere n i a quantidade de matéria de gás i exercendo uma pressão parcial P i, então i onde Χ i é a fração em quantidade de matéria (n i /n t ). 2 3 P = Χi P total RT V
29 Mistura de gases e pressões parciais Coletando gases sobre a água É comum sintetizar gases e coletá-los através do deslocamento de um volume de água. Para calcular a quantidade de gás produzido, precisamos fazer a correção para a pressão parcial da água. P = P + P total gás água
30 Mistura de gases e pressões parciais Coletando gases sobre a água
31 Mistura de gases e pressões parciais Coletando gases sobre a água P = P + P total gás água
32 Gases reais: desvios do Comportamento ideal Da equação do gás ideal, temos PV = RT n Para 1 mol de gás, PV/RT = 1 para todas as pressões. Emum gásreal, PV/RT varia significativamente de 1. Quanto maior for a pressão, maior será o desvio do comportamento ideal.
33 Gases reais: desvios do Comportamento ideal Da equação do gás ideal, temos PV = RT n Para 1 mol de gás, PV/RT = 1 a todas as temperaturas.
34
35
36 Gases reais: desvios do Comportamento ideal A equação de van der Waals Adicionamos dois termos à equação do gás ideal: um para corrigir o volume das moléculas e o outro para corrigir as atrações intermoleculares. Os termos de correção geram a equação de van der Waals: onde a e b são constantes empíricas. P nrt = V nb n V 2 a 2
37
38 Gases reais: desvios do Comportamento ideal A equação de van der Waals nrt P = V nb n V 2 a 2 Correção para o volume das moléculas Correção para a atração molecular Forma geral da equação de van der Waals: 2 n a P + = V 2 ( V nb) nrt
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO
 AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
QUÍMICA I Gases
 QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
Gases UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG120. Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI
 UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
Capítulo 10. 2005 by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Gases David P. White Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
QUÍMICA A Ciência Central 9ª Edição Gases David P. White Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
Gases. Compostos orgânicos de baixa massa molar são gases a temperatura ambiente. CH 4 (metano gás natural), C 3 H 8
 Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Professora : Elisângela Moraes
 UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
Estrutura da Matéria Prof. Fanny Nascimento Costa
 Estrutura da Matéria Prof. Fanny Nascimento Costa (fanny.costa@ufabc.edu.br) Aula 03 Gases e suas propriedades; Conservação de massa e volume (teoria cinética). Gases Os gases são o estado mais simples
Estrutura da Matéria Prof. Fanny Nascimento Costa (fanny.costa@ufabc.edu.br) Aula 03 Gases e suas propriedades; Conservação de massa e volume (teoria cinética). Gases Os gases são o estado mais simples
COMPORTAMENTO DOS GASES
 BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
Físico-Química I. Profa. Dra. Carla Dalmolin. Gases. Gás perfeito (equações de estado e lei dos gases) Gases reais
 Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Luis Eduardo C. Aleotti. Química. Aula 38 - Transformações Gasosas
 Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
ATMOSFERA. Volume molar; constante de Avogadro
 ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS
 ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
QUÍMICA. Transformações Químicas. Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Princípio de Avogadro Parte 4
 QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Estequiometria. Mestranda: Daniele Potulski Disciplina: Química da madeira I
 Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal.
 Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
Química da atmosfera...
 Atmosfera é a camada de ar que envolve a Terra do grego atmos = vapor do latim sphaera = invólucro. Assim, a palavra atmosfera pode significar: invólucro de vapor. Química - O estudo das propriedades e
Atmosfera é a camada de ar que envolve a Terra do grego atmos = vapor do latim sphaera = invólucro. Assim, a palavra atmosfera pode significar: invólucro de vapor. Química - O estudo das propriedades e
GASES. QUIMICA II a Unidade
 GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Capítulo 1. Propriedades dos Gases
 Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Características dos gases
 Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas homogêneas
Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas homogêneas
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
PRÁTICA: DETERMINAÇÃO DA CONSTANTE R DOS GASES. pv= nrt (01) Gás Ideal : obedece pv=n RT em qualquer condição de T e p.
 PRÁTICA: DETERMINAÇÃO DA CONSTANTE R DOS GASES 1. Introdução A matéria pode se apresentar nos estados sólido, líquido e gasoso. A temperatura e a pressão são as variáveis responsáveis pelo seu estado físico.
PRÁTICA: DETERMINAÇÃO DA CONSTANTE R DOS GASES 1. Introdução A matéria pode se apresentar nos estados sólido, líquido e gasoso. A temperatura e a pressão são as variáveis responsáveis pelo seu estado físico.
Estudo dos gases. Prof. Leandro Zatta - Química Geral 1
 Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Termodinâmica 7. Alexandre Diehl. Departamento de Física - UFPel
 Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
11/08/2014. Lei de Avogadro. Equação de Clayperon. CNTP 1 atm 0 C 273K
 Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
DURAÇÃO DA PROVA Manual da disciplina, livros de Química, computador, Trabalho Escrito. Conteúdos Objetivos e/ou Competências Estrutura Cotações
 ÉPOCA ESPECIAL DE EXAMES ANO LETIVO 2011/2012 MATRIZ DO EXAME DO MÓDULO QM6 Estado Físico das Substâncias e Interações Moleculares. Estado Gasoso. Química MATERIAL A UTILIZAR TIPO DE PROVA DURAÇÃO DA PROVA
ÉPOCA ESPECIAL DE EXAMES ANO LETIVO 2011/2012 MATRIZ DO EXAME DO MÓDULO QM6 Estado Físico das Substâncias e Interações Moleculares. Estado Gasoso. Química MATERIAL A UTILIZAR TIPO DE PROVA DURAÇÃO DA PROVA
P1 - PROVA DE QUÍMICA GERAL 09/04/11
 P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
P1 - PROVA DE QUÍMICA GERAL 09/04/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Dados R = 0,0821 atm L mol -1 K -1 T (K) =
GASES. Maira Gazzi Manfro e Giseli Menegat
 GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
Experimento N 3 DETERMINAÇÃO EXPERIMENTAL DA MASSA MOLAR DO GÁS BUTANO E DO MAGNÉSIO
 Experimento N 3 DETERMINAÇÃO EXPERIMENTAL DA MASSA MOLAR DO GÁS BUTANO E DO MAGNÉSIO 1) INTRODUÇÃO A maioria dos gases reais mostra um comportamento aproximado ao de um gás ideal, especialmente se a pressão
Experimento N 3 DETERMINAÇÃO EXPERIMENTAL DA MASSA MOLAR DO GÁS BUTANO E DO MAGNÉSIO 1) INTRODUÇÃO A maioria dos gases reais mostra um comportamento aproximado ao de um gás ideal, especialmente se a pressão
O ESTADO GASOSO - CARACTERÍSTICAS GERAIS
 Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA
 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Metal, Não Metal e Metaloide
 Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011
 André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
Combustíveis Energia e Ambiente. Combustíveis gasosos, líquidos e sólidos: compreender as diferenças
 Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
GASES PERFEITOS AULA INTRODUÇÃO
 AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
Física II FEP 112 ( ) 1º Semestre de Instituto de Física - Universidade de São Paulo. Professor: Valdir Guimarães
 Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana.
 Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Aula 8 OS GASES E SUAS PROPRIEDADES. Eliana Midori Sussuchi Samísia Maria Fernandes Machado Valéria Regina de Souza Moraes
 Aula 8 OS GASES E SUAS PROPRIEDADES META Apresentar as leis fundamentais dos gases. OBJETIVOS Ao final desta aula, o aluno deverá: reconhecer as Leis que levaram à compreensão do comportamento dos gases:
Aula 8 OS GASES E SUAS PROPRIEDADES META Apresentar as leis fundamentais dos gases. OBJETIVOS Ao final desta aula, o aluno deverá: reconhecer as Leis que levaram à compreensão do comportamento dos gases:
Estado Gasoso. Características. Expansibilidade compressibilidade. Situação de um gás. Variáveis de estado
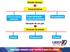 Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Lei de Charles e Gay-Lussac V T. Pressão baixa. Pressão alta
 GASES Lei de Boyle V 1/P Lei de Charles e Gay-Lussac V T Pressão baixa Pressão alta Lei de Avogadro V n Equação dos gases perfeitos Lei de Boyle V 1/P Lei de Charles e Gay-Lussac Lei de Avogadro V T V
GASES Lei de Boyle V 1/P Lei de Charles e Gay-Lussac V T Pressão baixa Pressão alta Lei de Avogadro V n Equação dos gases perfeitos Lei de Boyle V 1/P Lei de Charles e Gay-Lussac Lei de Avogadro V T V
CAPITULO 1 Propriedades dos gases. PGCEM Termodinâmica dos Materiais UDESC
 CAPITULO 1 Propriedades dos gases PGCEM Termodinâmica dos Materiais UDESC Referência Bibliográfica ATKINS, P.; Paula, J. de. Fisico-Química, Vol 1. 8ª ed., Editora LTC, Rio de Janeiro, 2006, cap 1. Ball,
CAPITULO 1 Propriedades dos gases PGCEM Termodinâmica dos Materiais UDESC Referência Bibliográfica ATKINS, P.; Paula, J. de. Fisico-Química, Vol 1. 8ª ed., Editora LTC, Rio de Janeiro, 2006, cap 1. Ball,
EXPERIÊNCIA 2 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO
 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
CQ 028 FÍSICO QUÍMICA GERAL
 UNIVERSIDADE FEDERAL DO ARANÁ SETOR DE CIÊNCIAS EXATAS DEARTAMENTO DE QUÍMICA CQ 028 FÍSICO QUÍMICA GERAL Aula 1.1 Apresentação do curso. Características do estado gasoso. Lei de Boyle. Lei de Gay-Lussac.
UNIVERSIDADE FEDERAL DO ARANÁ SETOR DE CIÊNCIAS EXATAS DEARTAMENTO DE QUÍMICA CQ 028 FÍSICO QUÍMICA GERAL Aula 1.1 Apresentação do curso. Características do estado gasoso. Lei de Boyle. Lei de Gay-Lussac.
Professora : Elisângela Moraes
 UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 09/03/2012 LEI DE GAY-LUSSAC E AVOGADRO Os volumes de gases se combinavam em razão expressa por pequenos números
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 09/03/2012 LEI DE GAY-LUSSAC E AVOGADRO Os volumes de gases se combinavam em razão expressa por pequenos números
FUNDAMENTOS FÍSICOS DO AR COMPRIMIDO
 DEFINIÇÃO: O ar é incolor, insípido e é uma mistura de diversos gases. Composição percentual do ar seco padrão: (ISO 2533). Elementos Percentual em volume Percentual em massa Nitrogênio 78,08 75,52 Oxigênio
DEFINIÇÃO: O ar é incolor, insípido e é uma mistura de diversos gases. Composição percentual do ar seco padrão: (ISO 2533). Elementos Percentual em volume Percentual em massa Nitrogênio 78,08 75,52 Oxigênio
Propriedades de uma substância pura
 Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
P1 - PROVA DE QUÍMICA GERAL 04/04/08
 P1 - PROVA DE QUÍMICA GERAL 04/04/08 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 T (K) = T ( C) + 73,15
P1 - PROVA DE QUÍMICA GERAL 04/04/08 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 T (K) = T ( C) + 73,15
CQ110 : Princípios de FQ
 CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
Soluções e Gases III. Gases
 Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS
 GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2
 QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
Prática 05 Determinação Da Massa Molar Do Magnésio
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 05 Determinação Da Massa Molar Do Magnésio
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 05 Determinação Da Massa Molar Do Magnésio
baixa pressão e alta temperatura
 É um dos estados da matéria, não tem forma e volume definidos, e consiste em uma coleção de partículas cujos os movimentos são aproximadamente aleatórios. As forças de coesão entre as partículas que formam
É um dos estados da matéria, não tem forma e volume definidos, e consiste em uma coleção de partículas cujos os movimentos são aproximadamente aleatórios. As forças de coesão entre as partículas que formam
EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I
 Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Química Prof. Giacometto
 Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Gases. Teoria cinética
 Gases Teoria cinética Para os gases, muitas propriedades podem ser explicadas com o auxílio de um modelo microscópico muito rudimentar, criado quase um século antes da teoria atômica. Em 1738, o suíço
Gases Teoria cinética Para os gases, muitas propriedades podem ser explicadas com o auxílio de um modelo microscópico muito rudimentar, criado quase um século antes da teoria atômica. Em 1738, o suíço
PROPRIEDADE DOS GASES
 RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
Prática 03 Determinação do Zero Absoluto
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 03 Determinação do Zero Absoluto 1. Introdução
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 03 Determinação do Zero Absoluto 1. Introdução
Química Geral e Experimental II Gases Resolução comentada de exercícios selecionados versão gases_v2_2005 Prof. Fabricio R.
 Química Geral e Experimental II Gases Resolução comentada de exercícios selecionados Prof. Fabricio R. Sensato 1) Imagine que o pneu de uma bicicleta, contendo 0,406 mol de ar arrebente se a pressão interna
Química Geral e Experimental II Gases Resolução comentada de exercícios selecionados Prof. Fabricio R. Sensato 1) Imagine que o pneu de uma bicicleta, contendo 0,406 mol de ar arrebente se a pressão interna
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
AS PROPRIEDADES DOS GASES. Apresentar as propriedades dos gases; explicitar as diferentes propriedades dos gases reais e dos gases perfeitos;
 AS PROPRIEDADES DOS GASES Metas Apresentar as propriedades dos gases; explicitar as diferentes propriedades dos gases reais e dos gases perfeitos; Objetivos Ao final desta aula, o aluno deverá: compreender
AS PROPRIEDADES DOS GASES Metas Apresentar as propriedades dos gases; explicitar as diferentes propriedades dos gases reais e dos gases perfeitos; Objetivos Ao final desta aula, o aluno deverá: compreender
TRABALHO PRÁTICO 2 GASES: DETERMINAÇÃO DA RELAÇÃO DO VOLUME COM A PRESSÃO DE UMA AMOSTRA DE AR EM TEMPERATURA CONSTANTE VERIFICAÇÃO DA LEI DE BOYLE
 TRABALHO PRÁTICO 2 GASES: DETERMINAÇÃO DA RELAÇÃO DO VOLUME COM A PRESSÃO DE UMA AMOSTRA DE AR EM TEMPERATURA CONSTANTE VERIFICAÇÃO DA LEI DE BOYLE 1. Introdução A Lei de Boyle, verificada experimentalmente,
TRABALHO PRÁTICO 2 GASES: DETERMINAÇÃO DA RELAÇÃO DO VOLUME COM A PRESSÃO DE UMA AMOSTRA DE AR EM TEMPERATURA CONSTANTE VERIFICAÇÃO DA LEI DE BOYLE 1. Introdução A Lei de Boyle, verificada experimentalmente,
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA PARAÍBA Campus Princesa Isabel. Fluidos. Disciplina: Física Professor: Carlos Alberto
 INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA PARAÍBA Campus Princesa Isabel Fluidos Disciplina: Física Professor: Carlos Alberto Objetivos de aprendizagem Ao estudar este capítulo você aprenderá:
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA PARAÍBA Campus Princesa Isabel Fluidos Disciplina: Física Professor: Carlos Alberto Objetivos de aprendizagem Ao estudar este capítulo você aprenderá:
Química B Extensivo V. 7
 Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Moléculas em Movimento
 Físico-Química II Profa. Dra. Carla Dalmolin Moléculas em Movimento Modelo Cinético dos Gases Modelo Cinético dos Gases A única contribuição para a energia do gás vem das energias cinéticas das moléculas
Físico-Química II Profa. Dra. Carla Dalmolin Moléculas em Movimento Modelo Cinético dos Gases Modelo Cinético dos Gases A única contribuição para a energia do gás vem das energias cinéticas das moléculas
LOQ-4007 Físico-Química
 LOQ-4007 Físico-Química Profa. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia LOT E-mail: rita@debiq.eel.usp.br ritaclb_rodrigues@hotmail.com Fone: 3159-5027 Informações da Disciplina USP
LOQ-4007 Físico-Química Profa. Rita de Cássia L.B. Rodrigues Departamento de Biotecnologia LOT E-mail: rita@debiq.eel.usp.br ritaclb_rodrigues@hotmail.com Fone: 3159-5027 Informações da Disciplina USP
Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: ESTUDO DOS GASES
 1º EM E.M. FÍSICA Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: Resumão com exercícios: ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que
1º EM E.M. FÍSICA Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: Resumão com exercícios: ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que
P1 - PROVA DE QUÍMICA GERAL 31/03/07
 1 - ROVA DE QUÍMICA GERAL 31/03/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15 1
1 - ROVA DE QUÍMICA GERAL 31/03/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L mol -1 K -1 T (K) T ( C) + 73,15 1
P1 - PROVA DE QUÍMICA GERAL - 20/09/03
 P1 - PROVA DE QUÍMICA GERAL - 0/09/03 Nome: Nº de Matrícula: Gabarito Turma: Assinatura: Questão Valor Grau Revisão 1 a,0 a,0 3 a,0 4 a,0 5 a,0 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 K = C + 73,15
P1 - PROVA DE QUÍMICA GERAL - 0/09/03 Nome: Nº de Matrícula: Gabarito Turma: Assinatura: Questão Valor Grau Revisão 1 a,0 a,0 3 a,0 4 a,0 5 a,0 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 K = C + 73,15
Gases. 1) Assinale a alternativa CORRETA.
 Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS
 TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS Profa. Danielle Cardoso www.profadanielle.com.br danielle@profadanielle.com.br Substância Pura É um a substância que possui a mesma composição química em
TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS Profa. Danielle Cardoso www.profadanielle.com.br danielle@profadanielle.com.br Substância Pura É um a substância que possui a mesma composição química em
Gás Ideal (1) PMT2305 Físico-Química para Metalurgia e Materiais I César Yuji Narita e Neusa Alonso-Falleiros 2012
 Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
P1 - PROVA DE QUÍMICA GERAL - 18/09/04
 P1 - PROVA DE QUÍMICA GERAL - 18/09/0 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 a,5 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 K = C + 73,15 1 atm
P1 - PROVA DE QUÍMICA GERAL - 18/09/0 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 a,5 Total 10,0 Dados R = 0,081 atm L mol -1 K -1 K = C + 73,15 1 atm
Hidrostática Prof: Edson Rizzo. Pressões: Mecânica, Hidrostática, Atmosférica e Absoluta. Empuxo
 Hidrostática Prof: Edson Rizzo Pressões: Mecânica, Hidrostática, Atmosférica e Absoluta. Empuxo DENSIDADE Consideremos um corpo de massa m e volume V. A densidade (d) do corpo é definida por: d = m V No
Hidrostática Prof: Edson Rizzo Pressões: Mecânica, Hidrostática, Atmosférica e Absoluta. Empuxo DENSIDADE Consideremos um corpo de massa m e volume V. A densidade (d) do corpo é definida por: d = m V No
Teoria Cinética dos gases
 Estrutura da Matéria Unidade II: A matéria fragmentada Aula 5: Origem estatística e corpuscular da termodinâmica http://professor.ufabc.edu.br/~pieter.westera/estrutura.html Teoria Cinética dos gases Bernoulli
Estrutura da Matéria Unidade II: A matéria fragmentada Aula 5: Origem estatística e corpuscular da termodinâmica http://professor.ufabc.edu.br/~pieter.westera/estrutura.html Teoria Cinética dos gases Bernoulli
1,0 atm; 3,0 atm; 3,3 atm; 3,9 atm; 4,0 atm.
 1. Um tubo cilíndrico de oxigênio de um mergulhador contém 3,2 kg de O 2. Antes de mergulhar, verificou-se que a temperatura e a pressão no interior do cilindro valiam, respectivamente, 27 C e 1,5 atm.
1. Um tubo cilíndrico de oxigênio de um mergulhador contém 3,2 kg de O 2. Antes de mergulhar, verificou-se que a temperatura e a pressão no interior do cilindro valiam, respectivamente, 27 C e 1,5 atm.
P1 - PROVA DE QUÍMICA GERAL 09/09/11
 P1 - PROVA DE QUÍMICA GERAL 09/09/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R = 0,081 atm L -1 K -1 T (K) = T ( C) + 73,15
P1 - PROVA DE QUÍMICA GERAL 09/09/11 Nome: Nº de Matrícula: GABARITO Turma: Assinatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R = 0,081 atm L -1 K -1 T (K) = T ( C) + 73,15
QUÍMICA Profº JAISON
 QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC 2º TRI PRIMEIRO ANO FSC II
 1º EM E.M. FÍSICA Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC º TRI PRIMEIRO ANO FSC II Estudar FÍSICA II LIVRO PV = nrt Dilatação dos Sólidos e dos Líquidos
1º EM E.M. FÍSICA Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC º TRI PRIMEIRO ANO FSC II Estudar FÍSICA II LIVRO PV = nrt Dilatação dos Sólidos e dos Líquidos
Disciplina: Sistemas Térmicos
 Disciplina: Sistemas Térmicos Apresentação da Termodinâmica Sistemas Termodinâmicos e Volume de Controle Estado e Propriedades de uma Substância Processos Termodinâmicos e Ciclos Conceitos e Unidades Lei
Disciplina: Sistemas Térmicos Apresentação da Termodinâmica Sistemas Termodinâmicos e Volume de Controle Estado e Propriedades de uma Substância Processos Termodinâmicos e Ciclos Conceitos e Unidades Lei
Equilíbrio Químico. início x 2x 0 0
 Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
Estrutura da Matéria Hipótese Atômica 1. Hipótese na antiquidade 2.Conceito de elementos e lei da proporções 3.Hipótese de Avogadro 4.
 Estrutura da Matéria Hipótese Atômica 1. Hipótese na antiquidade 2.Conceito de elementos e lei da proporções 3.Hipótese de Avogadro 4.Massa Atômica e molecular 5.Lei dos gases ideais 6.Lei de Van der Waals
Estrutura da Matéria Hipótese Atômica 1. Hipótese na antiquidade 2.Conceito de elementos e lei da proporções 3.Hipótese de Avogadro 4.Massa Atômica e molecular 5.Lei dos gases ideais 6.Lei de Van der Waals
Termodinâmica. Lucy V. C. Assali
 Termodinâmica Gases Ideais Física II 2016 - IO Propriedades dos Gases: Equação de Estado dos Gases Ideais Fluido homogêneo: caracterizado por qualquer par das três variáveis (P, V, T) uma relação funcional
Termodinâmica Gases Ideais Física II 2016 - IO Propriedades dos Gases: Equação de Estado dos Gases Ideais Fluido homogêneo: caracterizado por qualquer par das três variáveis (P, V, T) uma relação funcional
Curso: ENGENHARIA BÁSICA Disciplina: ESTÁTICA DOS FLUIDOS LISTA DE EXERCÍCIOS UNIDADES DE PRESSÃO:
 Curso: ENGENHARIA BÁSICA Disciplina: ESTÁTICA DOS FLUIDOS LISTA DE EXERCÍCIOS UNIDADES DE PRESSÃO: 1. Determinar o valor da pressão de 340 mmhg em psi e kgf/cm² na escala efetiva e em Pa e atm na escala
Curso: ENGENHARIA BÁSICA Disciplina: ESTÁTICA DOS FLUIDOS LISTA DE EXERCÍCIOS UNIDADES DE PRESSÃO: 1. Determinar o valor da pressão de 340 mmhg em psi e kgf/cm² na escala efetiva e em Pa e atm na escala
