TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS
|
|
|
- Maria de Lourdes Wagner Marinho
- 6 Há anos
- Visualizações:
Transcrição
1 TERMODINÂMICA PROPRIEDADES DAS SUBSTÂNCIAS PURAS Profa. Danielle Cardoso Substância Pura É um a substância que possui a mesma composição química em toda a sua extensão. Uma substância pura não pr ecisa ser constituída por um único elemento ou composto químico. A combinação de vários elementos ou compostos químicos também se qualifica como substância pura, desde que seja homogênea. Exemplos: 1
2 Substância Pura Uma mistura de gelo e água líquida é uma mistura pura? Sim, porque ambas as fases têm a mesma composição química. Uma mistura de de ar liquído e ar gasoso é uma mistura pura? Não, já que a composição do arlíquido é diferente da composição do ar gasoso, portanto, a mistura não é mais químicamente homogênea. Estado da matéria As ligações intermoleculares são mais fortes nos sólidos e mais fracas nos gases. Um motivo para isso é que as moléculas dos sólidos estão mais compactadas, enquanto nos gases elas estão separadas por distâncias relativamente grandes. 2
3 09/02/17 Processos de mudança de fases de substâncias puras Há várias situações práticas em que duas fases de uma substâncias pura coexistem em equilibrio. Por exemplo, a água existe como uma mistura de líquido e vapor na caldeira e no condensador de uma usina. O refrigerante passa de líquido para vapor no congelador de um refrigerados. Processos de mudança de fases de substâncias puras 3
4 Processos de mudança de fases de substâncias puras ü Líquido comprimido (sub-resfriado) é uma subtância que não irá se vaporizar. ü Líquido saturado é uma substância líquida que está proximo à se tornar vapor. ü Mistura saturada de líquido-vapor estado em que o líquido e vapor coexistem em equilibrio. A água na fase líquida a 20 C e à pressão de 1 atm. (líquido comprimido) A água a 100 C e à pressão de 1 atm ainda está na fase líquida, mas qualquer calor adicional ao fl u i do fará com que uma parte do líquido comece a se vaporizar. Quanto mais calor é transferido ao sistema, parte do líquido saturado se vaporiza (mistura líquidovapor). Processos de mudança de fases de substâncias puras ü Vapor Saturado: O vapor que está na fronteira para se condensar. ü Vapor Superaquecido: Vapor que não está propício a condensar-se (ou seja, não é um vapor saturado) Qualquer perda de calor do vapor fará com que parte do vapor condense (mudança de fase a partir do vapor para líquido). A água a 300 C e à pressão de 1 atm. (vapor superaqueido) 4
5 Processos de mudança de fases de substâncias puras Diagrama T-v do processo de aquecimento a pressão constante Temperatura e pressão de saturação A temperatura que a água comec a a ferver depende da pressão; portanto, se a pressão é fixa a temperatura de ebulição também é fixa. ü Temperatura de saturação (T sat ) é a temperatura que a substa ncia pura muda de fase a uma dada pressão. ü Pressão de saturação (P sat ) é a pressão que a substa ncia pura muda de fase a uma dada temperatura. 5
6 Temperatura e pressão de saturação Calor Latente A quantidade de energia absorvida ou liberada durante um processo de mudança de fase é chamada de calor latente. A quantidade de energia absorvida durante a fusão é chamada de calor latente de fusão e é equivalente à quantidade de energia liberada durante a solidificação. A quantidade de energia absorvida durante a vaporização é chamada de calor latente de vaporização e é equivalente à quantidade de energia liberada durante a condensação. 6
7 Temperatura e pressão de saturação Durante um processo de mudança de fase, pressão e temperatura são propriedade dependentes, diretamente. Na Figura abaixo tem-se o exemplo para a água da curva de saturação líquido-vapor, sendo esta curva característica de todas substâncias puras. Assim, uma substância a pressão mais alta entra em ebulição a temperaturas mais altas. Propriedades dos diagramas de mudança de fase Ponto crítico O pont o crítico ponto é definido como o ponto em que os estados de líquido saturado e vapor saturado são idênticos. A temperatura, pressão e volume específico de uma substância no ponto crítico são chamados, respectivamente, a temperatura crítica, T cr, pressão crítica, P cr e volume específico crítico, v cr. Diagrama T-v dos processos de mudança de fase a pressão constante para substância pura a diferentes valores de pressão de saturação 7
8 Propriedades dos diagramas de mudança de fase diagrama T-v diagrama P-v Identificanco o Estados ü A Partir dos valores de Pressão (P): ü A Partir dos valores de Temperatura (T): 8
9 Identificanco o Estados ü A Partir dos valores de Temperatura (T) ou Pressão e volume Específico (v esp ) Tabelas de Propriedade Termodinâmica ü Tabel a de satur ação- referenciada pela temperatura ü Tabela de vapor superaquecido 9
10 Energia Interna e Entalpia A energia interna (U), é a energia térmica contida em uma substância A entalpia (H), que é útil para os cálculos de fluxo de fluido, é definida por Então, a entalpia específica é: h = u + Pv kj kg H = U+ PV kj O postulado de estado defende que somente duas propriedades independentes de uma substância são necessárias para determinar todas as outras ü Título (x) Mistura líquido-vapor saturado Para analisar esta mistura corretamente, precisamos saber as proporções das fases líquida e vapor na mistura. Isto é feito através da definição de uma nova propriedade chamada de título, designada pela letra x. Definida como a razão entre a massa de vapor e a massa total da mistura bifásica: onde Título, x, tem significado apenas para misturas saturadas. Não tem nenhum significado em regiões de vapor superaquecidos ou líquido comprimido. O seu valor situa-se entre 0 (liq. Saturado) e 1(vapor saturado). 10
11 Mistura líquido-vapor saturado Considere-se um tanque que contém uma mistura saturada de líquido-vapor. O volume ocupado pelo líquido saturado é V l, e o volume ocupado pelo vapor saturado é V v. O volume total específico (V T ) ou V méd volume médio específico é a soma dos dois: m 3 V T = (1 x)v liq + xv vap kg onde : x = Título v líq = v esp. liq.saturado v vap = v esp. vap.saturado m 3 V T = v liq + xv lv kg v lv = v vap vliq x = V T v liq v lv Mistura líquido-vapor saturado A análise pode ser repetida para a energia interna e para entalpia. u /é1 = u 2 + xu 24 kj kg h /é1 = h 2 + x h 24 kj kg onde: u 2 : Energia interna líq. Saturado x: Título; u 24 : energia interna de vaporização. onde: h 2 : Entapia líq. Saturado x: Título; h 24 : Entalpiade vaporização. 11
12 Refigerantes Os refrigerantes são frequentemente utilizados como fluidos de trabalho em aparelhos de ar-condicionado e sistemas semelhantes A amônia era o refrigerante utilizado no primeiro sistema de refrigeração R134a (Tetrafluoretano) é um refrigerante comum utilizado que substituiu o R12 (Freon)porrazões ambientais HFO-1234yf (Tetrafluoropropeno) eventualmente substituirá o R134a EQUAÇÃO DE ESTADO DO GÁS IDEAL Qualquer equação que relaciona a pressão, temperatura, e o volume específico de uma substância é chamada uma equação de estado. Equação abaixo é chamada de equação de estado dos gases ideais, e um gás que obedece a esta relação é chamada um gás ideal Na equação acima, R é a constante de proporcionalidade chamada de constante dos gases. Nesta equação, P é a pressão, T é a temperatura, e v é o volume específico do gás. 12
13 EQUAÇÃO DE ESTADO DO GÁS IDEAL A constante de gás R é diferente para cada gás e é determinada a partir de R = R u MM (kj / kg.k)ou(kpa.m3 / kg.k) onde R u é a constante universal dos gases e MM é a massa molar (também chamado de peso molecular) do gás. A constante R u é a mesma para todas as substâncias, e o seu valor é : EQUAÇÃO DE ESTADO DO GÁS IDEAL A massa de um sistema é igual ao produto da sua massa molar MM e o seu respectivo número de mols N: [ ] m = MM.N kg A equação de estado dos gases ideais pode ser escrito de várias formas diferentes: PV = mrt PV = NR u T Pv = R u T P = ρrt onde é v o volume molar específico, isto é, o volume por unidade de moles (em m3 / kmol). v = v N m< kmol 13
14 EQUAÇÃO DE ESTADO DO GÁS IDEAL Ao escrever a dos gases ideais duas vezes para uma mesma massa fixa e simplificando, as propriedades de um gás ideal em dois estados diferentes estão relacionados entre si pela equação: EQUAÇÃO DE ESTADO DO GÁS REAL A lei do gás ideal pode ser modificada para se ajustar melhor aos gases reais introduzindo o fator de compressibilidade: Z = Pv RT Z = v ABC2 v D1BC2 Z = 1 para um gás ideal Z pode ser encontrado em tabelas de compressibilidade 14
15 EQUAÇÃO DE ESTADO DO GÁS REAL Os gases se comportam de modo diferente a uma determinada temperatura e pressão. Entretanto, eles se comportam de modo muito parecido quando as temperaturas e pressão são normalizadas em relação às temperaturas e pressão crítica. A normalização é feita da seguinte forma: P AB1 = P P EA T AB1 = T T EA Pred= Pressão reduzida Pcr= Pressão Critica Tred= Temperatura reduzida Tcr= Temperatura Critica EQUAÇÃO DE VAN DER WAALS Outra equação de gás real é a equação de van der Waals: P = RT ν b a ν 2 As constantes adicionais a e b estão relacionadas aos valores do ponto crítico para o gás a = 27R2 T cr 2 64P cr b = R2 T cr 8P cr 15
16 EQUAÇÃO BEATTIE-BRIDGEMAN Uma equação Beattie-Bridge é uma equação de gás real mais sofisticada P = R T u 1 c ν + B ν 2 νt b A 0 1 a ν ν 2 ν Em que é o volume molar específico As cinco constantes A 0, B 0,, e são diferentes paracada gás 16
Disciplina : Máquinas Térmicas e de Fluxo. Aula 2 Propriedades Termodinâmicas
 Disciplina : Máquinas Térmicas e de Fluxo Aula 2 Propriedades Termodinâmicas Prof. Evandro Rodrigo Dário, Dr. Eng. Líquido comprimido Considere-se um dispositivo de cilindropistão contendo água na fase
Disciplina : Máquinas Térmicas e de Fluxo Aula 2 Propriedades Termodinâmicas Prof. Evandro Rodrigo Dário, Dr. Eng. Líquido comprimido Considere-se um dispositivo de cilindropistão contendo água na fase
ESZO Fenômenos de Transporte
 Universidade Federal do ABC ESZO 001-15 Fenômenos de Transporte Profa. Dra. Ana Maria Pereira Neto ana.neto@ufabc.edu.br Bloco A, torre 1, sala 637 Propriedades Termodinâmicas Propriedades Termodinâmicas
Universidade Federal do ABC ESZO 001-15 Fenômenos de Transporte Profa. Dra. Ana Maria Pereira Neto ana.neto@ufabc.edu.br Bloco A, torre 1, sala 637 Propriedades Termodinâmicas Propriedades Termodinâmicas
Disciplina : Termodinâmica. Aula 4
 Disciplina : Termodinâmica Aula 4 Prof. Evandro Rodrigo Dário, Dr. Eng. SUBSTÂNCIA PURA Uma substância que tem a mesma composição química em toda a sua extensão é chamada de substância pura. A água, o
Disciplina : Termodinâmica Aula 4 Prof. Evandro Rodrigo Dário, Dr. Eng. SUBSTÂNCIA PURA Uma substância que tem a mesma composição química em toda a sua extensão é chamada de substância pura. A água, o
Capítulo 2 Propriedades de uma Substância Pura
 Capítulo 2 Propriedades de uma Substância Pura 2.1 - Definição Uma substância pura é aquela que tem composição química invariável e homogênea. Pode existir em mais de uma fase Composição química é igual
Capítulo 2 Propriedades de uma Substância Pura 2.1 - Definição Uma substância pura é aquela que tem composição química invariável e homogênea. Pode existir em mais de uma fase Composição química é igual
TERMODINÂMICA APLICADA CAPÍTULO 2
 TERMODINÂMICA APLICADA CAPÍTULO 2 PROPRIEDADES DAS SUBSTÂNCIAS PURAS SUMÁRIO Neste capítulo o conceito de substância pura é introduzido e as várias fases, bem como as propriedades físicas dos processos
TERMODINÂMICA APLICADA CAPÍTULO 2 PROPRIEDADES DAS SUBSTÂNCIAS PURAS SUMÁRIO Neste capítulo o conceito de substância pura é introduzido e as várias fases, bem como as propriedades físicas dos processos
Disciplina: Sistemas Térmicos
 Disciplina: Sistemas Térmicos Definição de Substância Pura Equilíbrio de Fases Líquido-Vapor de uma Substância Pura Diagrama de Temperatura versus Volume Específico Título de uma Substância com Fases Líquida
Disciplina: Sistemas Térmicos Definição de Substância Pura Equilíbrio de Fases Líquido-Vapor de uma Substância Pura Diagrama de Temperatura versus Volume Específico Título de uma Substância com Fases Líquida
TERMODINÂMICA APLICADA
 TERMODINÂMICA APLICADA LEONARDO DE QUEIROZ MOREIRA Propriedades de uma substância pura GOIÂNIA, 29 DE AGOSTO DE 2016. Objetivo Apresentar como algumas propriedades termodinâmicas se correlacionam: Temperatura;
TERMODINÂMICA APLICADA LEONARDO DE QUEIROZ MOREIRA Propriedades de uma substância pura GOIÂNIA, 29 DE AGOSTO DE 2016. Objetivo Apresentar como algumas propriedades termodinâmicas se correlacionam: Temperatura;
Diagramas termodinâmicos e Propriedades das substâncias. Prof. Bogdan
 Diagramas termodinâmicos e Propriedades das substâncias Prof. Bogdan Objetivos Apresentar relações de propriedades relevantes à Termodinâmica voltada para a engenharia; Utilizar as propriedades e relações
Diagramas termodinâmicos e Propriedades das substâncias Prof. Bogdan Objetivos Apresentar relações de propriedades relevantes à Termodinâmica voltada para a engenharia; Utilizar as propriedades e relações
Aula 2 Termodinâmica de substâncias puras: diagramas de fase
 Uniersidade Federal do ABC P O S M E C Aula 2 Termodinâmica de substâncias puras: diagramas de fase MEC202 Susbtância Pura Uma substancia que tem uma única composição. Exemplo: N 2, álcool, CO 2. Pode
Uniersidade Federal do ABC P O S M E C Aula 2 Termodinâmica de substâncias puras: diagramas de fase MEC202 Susbtância Pura Uma substancia que tem uma única composição. Exemplo: N 2, álcool, CO 2. Pode
UTFPR Termodinâmica 1 Avaliando Propriedades Termodinâmicas
 UTFPR Termodinâmica 1 Avaliando Propriedades Termodinâmicas Princípios de Termodinâmica para Engenharia Capítulo 3 Parte 2 Tabelas de Saturação As Tabelas A-2 e A-3 listam os valores de propriedades para
UTFPR Termodinâmica 1 Avaliando Propriedades Termodinâmicas Princípios de Termodinâmica para Engenharia Capítulo 3 Parte 2 Tabelas de Saturação As Tabelas A-2 e A-3 listam os valores de propriedades para
Essa relação se aplica a todo tipo de sistema em qualquer processo
 Módulo III Primeira Lei da Termodinâmica e em Ciclos de Potência e Refrigeração. Propriedades de Substâncias Puras: Relações P-V-T e Diagramas P-V, P-T e T-V, Título, Propriedades Termodinâmicas, Tabelas
Módulo III Primeira Lei da Termodinâmica e em Ciclos de Potência e Refrigeração. Propriedades de Substâncias Puras: Relações P-V-T e Diagramas P-V, P-T e T-V, Título, Propriedades Termodinâmicas, Tabelas
Propriedades de uma substância pura
 Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Propriedades das substâncias puras simples compressíveis
 Propriedades das substâncias puras simples compressíveis Substâncias puras: possuem composição química uniforme e invariável, independentemente da fase. Sistemas simples: pode se desprezar efeitos de superfície,
Propriedades das substâncias puras simples compressíveis Substâncias puras: possuem composição química uniforme e invariável, independentemente da fase. Sistemas simples: pode se desprezar efeitos de superfície,
UTFPR Termodinâmica 1 Avaliando Propriedades
 UTFPR Termodinâmica 1 Avaliando Propriedades Moran e Shapiro - Cap. 3 Çengel e Boles - Cap. 3 Van Wylen e Sonntag - Cap. 3 Fase Refere-se a uma quantidade de matéria que é homegênea como um todo, tanto
UTFPR Termodinâmica 1 Avaliando Propriedades Moran e Shapiro - Cap. 3 Çengel e Boles - Cap. 3 Van Wylen e Sonntag - Cap. 3 Fase Refere-se a uma quantidade de matéria que é homegênea como um todo, tanto
Capítulo 3: Propriedades de uma Substância Pura
 Capítulo 3: Propriedades de uma Substância Pura Substância pura Princípio de estado Equilíbrio de fases Diagramas de fases Substância Pura Substância pura é a aquela que tem composição química invariável
Capítulo 3: Propriedades de uma Substância Pura Substância pura Princípio de estado Equilíbrio de fases Diagramas de fases Substância Pura Substância pura é a aquela que tem composição química invariável
DISCIPLINA AMB30093 TERMODINÂMICA - Aula 4 Capítulo 3 Propriedades de uma Substância Pura 24/10/2013
 DISCIPLINA AMB30093 TERMODINÂMICA - Aula 4 Capítulo 3 Propriedades de uma Substância Pura 24/10/2013 Prof. Robson Alves de Oliveira robson.aoliveira@gmail.com.br robson.oliveira@unir.br Ji-Paraná - 2013
DISCIPLINA AMB30093 TERMODINÂMICA - Aula 4 Capítulo 3 Propriedades de uma Substância Pura 24/10/2013 Prof. Robson Alves de Oliveira robson.aoliveira@gmail.com.br robson.oliveira@unir.br Ji-Paraná - 2013
PME 3344 Termodinâmica Aplicada
 PME 3344 Termodinâmica Aplicada 3) Substâncias Puras 1 v. 2.0 Diagramas de propriedades Vamos elaborar um experimento para relacionar temperatura e volume específico a pressão constante. Pressão no fluido
PME 3344 Termodinâmica Aplicada 3) Substâncias Puras 1 v. 2.0 Diagramas de propriedades Vamos elaborar um experimento para relacionar temperatura e volume específico a pressão constante. Pressão no fluido
Sistemas de Refrigeração Parte I
 Sistemas de Refrigeração Parte I 1 Tópicos da Aula de Hoje Introdução / definições sobre sistemas de refrigeração Ciclo de refrigeração por compressão Fatores que influenciam o desempenho do sistema de
Sistemas de Refrigeração Parte I 1 Tópicos da Aula de Hoje Introdução / definições sobre sistemas de refrigeração Ciclo de refrigeração por compressão Fatores que influenciam o desempenho do sistema de
TERMODINÂMICA. Propriedades Independentes de uma Substância Pura
 UNIVERSIDADE FEDERAL RURAL DO SEMI - ÁRIDO DEPARTAMENTO DE CIÊNCIAS AMBIENTAIS TERMODINÂMICA Um motivo importante para a introdução do conceito de substância pura é que o estado de uma substância pura
UNIVERSIDADE FEDERAL RURAL DO SEMI - ÁRIDO DEPARTAMENTO DE CIÊNCIAS AMBIENTAIS TERMODINÂMICA Um motivo importante para a introdução do conceito de substância pura é que o estado de uma substância pura
EM34F Termodinâmica A
 EM34F Termodinâmica A Prof. Dr. André Damiani Rocha arocha@utfpr.edu.br Propriedades: Parte II 2 Avaliando Propriedades Calores Específicos As propriedades intensivas c v e c p são definidas para substâncias
EM34F Termodinâmica A Prof. Dr. André Damiani Rocha arocha@utfpr.edu.br Propriedades: Parte II 2 Avaliando Propriedades Calores Específicos As propriedades intensivas c v e c p são definidas para substâncias
Capítulo 3: Propriedades de uma Substância Pura
 Capítulo 3: Propriedades de uma Substância Pura Substância pura Princípio de estado Equilíbrio de fases Diagramas de fases Equação de estado do gás ideal Outras equações de estado Outras propriedades termodinâmicas
Capítulo 3: Propriedades de uma Substância Pura Substância pura Princípio de estado Equilíbrio de fases Diagramas de fases Equação de estado do gás ideal Outras equações de estado Outras propriedades termodinâmicas
17/08/ /08/2011 Prof. Dr. Ricardo A. Mazza 3
 Propriedades de Uma Substância Pura Prof. Dr. Ricardo A. Mazza DE/FEM/UNICAMP 17/08/2011 Prof. Dr. Ricardo A. Mazza 1 Substância Pura Substância pura é a aquela que tem composição química invariável e
Propriedades de Uma Substância Pura Prof. Dr. Ricardo A. Mazza DE/FEM/UNICAMP 17/08/2011 Prof. Dr. Ricardo A. Mazza 1 Substância Pura Substância pura é a aquela que tem composição química invariável e
EM 524 : aula 3. Capítulo 3 : Propriedades das. Substâncias Puras
 EM 524 : aula 3 Capítulo 3 : Propriedades das 1. Definições; Substâncias Puras 2. Equilíbrio de fase; Diagrama temperatura volume; Título de uma mistura líquido-vapor; Diagrama pressão temperatura; Diagrama
EM 524 : aula 3 Capítulo 3 : Propriedades das 1. Definições; Substâncias Puras 2. Equilíbrio de fase; Diagrama temperatura volume; Título de uma mistura líquido-vapor; Diagrama pressão temperatura; Diagrama
Termodinâmica - 2. Alexandre Diehl. Departamento de Física - UFPel
 Termodinâmica - 2 Alexandre Diehl Departamento de Física - UFPel Caracterizado por estados de equilíbrio termodinâmico. Num estado de equilíbrio todas as propriedades macroscópicas físicas do sistema (definem
Termodinâmica - 2 Alexandre Diehl Departamento de Física - UFPel Caracterizado por estados de equilíbrio termodinâmico. Num estado de equilíbrio todas as propriedades macroscópicas físicas do sistema (definem
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal.
 Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
Aquecimento de um sistema
 Aquecimento de um sistema Aquecimento de diferentes quantidades de água Quando se fornece, num dado intervalo de tempo, a mesma quantidade de energia a dois sistemas, A e B, que diferem apenas na sua massa.
Aquecimento de um sistema Aquecimento de diferentes quantidades de água Quando se fornece, num dado intervalo de tempo, a mesma quantidade de energia a dois sistemas, A e B, que diferem apenas na sua massa.
SISTEMAS TÉRMICOS PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS - Alberto Hernandez Neto Direitos ais reservados Proibida a reprodução desse material sem a
 PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS INTRODUÇÃO E CONCEITOS INICIAIS ALBERTO HERNANDEZ NETO PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS - Alberto Hernandez Neto Direitos ais reservados Proibida a reprodução
PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS INTRODUÇÃO E CONCEITOS INICIAIS ALBERTO HERNANDEZ NETO PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS - Alberto Hernandez Neto Direitos ais reservados Proibida a reprodução
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Propriedades de uma Substância Pura
 Propriedades de uma Substância Pura Nesta aula, nossa atenção estará voltada para substâncias puras, consideraremos algumas das fases em que uma substância pura pode existir, o número de propriedades independentes
Propriedades de uma Substância Pura Nesta aula, nossa atenção estará voltada para substâncias puras, consideraremos algumas das fases em que uma substância pura pode existir, o número de propriedades independentes
DEGGE, 2012 Pedro M A Miranda Termodinâmica Aplicada Exame 2
 DEGGE, 2012 Pedro M A Miranda Termodinâmica Aplicada Exame 2 Justifique, sucintamente, todos os cálculos e aproximações. Parte 1 1. O comporta-se como um gás de van der Waals com. Considere um dispositivo
DEGGE, 2012 Pedro M A Miranda Termodinâmica Aplicada Exame 2 Justifique, sucintamente, todos os cálculos e aproximações. Parte 1 1. O comporta-se como um gás de van der Waals com. Considere um dispositivo
Trabalho em uma transformação
 Trabalho em uma transformação Trabalho (W) é uma medida da energia transferida pela aplicação de uma força ao longo de um deslocamento W = a b F dx A unidade de trabalho, no SI, é o Joule (J); 1 J = 1
Trabalho em uma transformação Trabalho (W) é uma medida da energia transferida pela aplicação de uma força ao longo de um deslocamento W = a b F dx A unidade de trabalho, no SI, é o Joule (J); 1 J = 1
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
Utilizando Gráficos de Entropia
 Módulo IV Variação da Entropia em Substâncias Puras, Relações Termodinâmicas (Tds), Diagramas T-s e h-s, Entropia em Substâncias Incompressíveis, Entropia em Gás Ideal. Utilizando Gráficos de Entropia
Módulo IV Variação da Entropia em Substâncias Puras, Relações Termodinâmicas (Tds), Diagramas T-s e h-s, Entropia em Substâncias Incompressíveis, Entropia em Gás Ideal. Utilizando Gráficos de Entropia
m = P 1V 1 R T 1 = 0,697 kg
 TEA007 - Termodinâmica Ambiental - Engenharia Ambiental - UFPR Data: 20/03/2017 Professor: Emílio G. F. Mercuri Gabarito P1 (1) (40,0 pontos) Ar dentro de um cilindro-pistão é submetido a dois processos.
TEA007 - Termodinâmica Ambiental - Engenharia Ambiental - UFPR Data: 20/03/2017 Professor: Emílio G. F. Mercuri Gabarito P1 (1) (40,0 pontos) Ar dentro de um cilindro-pistão é submetido a dois processos.
Físico-Química Farmácia 2014/02
 Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Diagramas de Energia
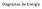 Diagramas de Energia 1.1- Análise Gráfica Reação exotérmica Reação endotérmica (a) Energia de ativação (Ea) para a reação inversa (b) Energia de ativação (Ea) para a reação direta (c) ΔH 1.2- Entropia
Diagramas de Energia 1.1- Análise Gráfica Reação exotérmica Reação endotérmica (a) Energia de ativação (Ea) para a reação inversa (b) Energia de ativação (Ea) para a reação direta (c) ΔH 1.2- Entropia
TERMODINÂMICA I 1º SEMESTRE DE 2015 Docente: Anderson H.R. Ferreira 2º LISTA DE EXERCÍCIOS UNIDADE II PROPRIEDADES TERMODINÂMICAS
 1 TERMODINÂMICA I 1º SEMESTRE DE 2015 Docente: Anderson H.R. Ferreira 2º LISTA DE EXERCÍCIOS Instruções: Tenha sempre em mãos uma Calculadora Científica, pois a mesma será utilizada exaustivamente no curso
1 TERMODINÂMICA I 1º SEMESTRE DE 2015 Docente: Anderson H.R. Ferreira 2º LISTA DE EXERCÍCIOS Instruções: Tenha sempre em mãos uma Calculadora Científica, pois a mesma será utilizada exaustivamente no curso
Lei de Charles e Gay-Lussac V T. Pressão baixa. Pressão alta
 GASES Lei de Boyle V 1/P Lei de Charles e Gay-Lussac V T Pressão baixa Pressão alta Lei de Avogadro V n Equação dos gases perfeitos Lei de Boyle V 1/P Lei de Charles e Gay-Lussac Lei de Avogadro V T V
GASES Lei de Boyle V 1/P Lei de Charles e Gay-Lussac V T Pressão baixa Pressão alta Lei de Avogadro V n Equação dos gases perfeitos Lei de Boyle V 1/P Lei de Charles e Gay-Lussac Lei de Avogadro V T V
Curvas de aquecimento e diagrama de fases
 Curvas de aquecimento e diagrama de fases PROF : JOSÉ LUCAS FÍSICA B Curvas de aquecimento Curva de aquecimento e resfriamento é o gráfico que mostra a variação de temperatura de uma amostra quando aquecida
Curvas de aquecimento e diagrama de fases PROF : JOSÉ LUCAS FÍSICA B Curvas de aquecimento Curva de aquecimento e resfriamento é o gráfico que mostra a variação de temperatura de uma amostra quando aquecida
Equilíbrio Físico. Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança.
 Equilíbrio Físico Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança. FASES E TRANSIÇÕES DE FASES SOLUBILIDADE PROPRIEDADES COLIGATIVAS MISTURAS
Equilíbrio Físico Equilíbrio físico estado no qual duas ou mais fases de uma substância coexistem sem uma tendência a mudança. FASES E TRANSIÇÕES DE FASES SOLUBILIDADE PROPRIEDADES COLIGATIVAS MISTURAS
Refrigeração e Ar Condicionado
 Refrigeração e Ar Condicionado Psicrometria Filipe Fernandes de Paula filipe.paula@engenharia.ufjf.br Departamento de Engenharia de Produção e Mecânica Faculdade de Engenharia Universidade Federal de Juiz
Refrigeração e Ar Condicionado Psicrometria Filipe Fernandes de Paula filipe.paula@engenharia.ufjf.br Departamento de Engenharia de Produção e Mecânica Faculdade de Engenharia Universidade Federal de Juiz
Calcule o valor mínimo de M para permitir o degelo (e recongelação) do bloco à medida que é atravessado pela barra.
 Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 7. Uma barra metálica rectangular fina, com 0 cm de comprimento e mm de largura, está assente num bloco de gelo
Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 7. Uma barra metálica rectangular fina, com 0 cm de comprimento e mm de largura, está assente num bloco de gelo
Resoluções dos exercícios propostos
 1 P.109 p a) AB corresponde a uma fusão (passagem da Sólido F fase sólida para a fase líquida). A B Líquido G b) B corresponde a uma vaporização E (passagem da fase líquida para a fase de D Vapor vapor).
1 P.109 p a) AB corresponde a uma fusão (passagem da Sólido F fase sólida para a fase líquida). A B Líquido G b) B corresponde a uma vaporização E (passagem da fase líquida para a fase de D Vapor vapor).
P01. 1 [10] Se a pressão de uma substância sofre aumento durante um processo de vaporização, a temperatura irá aumentar,
![P01. 1 [10] Se a pressão de uma substância sofre aumento durante um processo de vaporização, a temperatura irá aumentar, P01. 1 [10] Se a pressão de uma substância sofre aumento durante um processo de vaporização, a temperatura irá aumentar,](/thumbs/81/83807069.jpg) TEA007 - TERMODINÂMICA AMBIENTAL Curso de Graduação em Engenharia Ambiental Departamento de Engenharia Ambiental, UFPR P01, 18 Agosto 2017 Prof. Michael Mannich NOME: GABARITO Assinatura: P01 1 [10] Se
TEA007 - TERMODINÂMICA AMBIENTAL Curso de Graduação em Engenharia Ambiental Departamento de Engenharia Ambiental, UFPR P01, 18 Agosto 2017 Prof. Michael Mannich NOME: GABARITO Assinatura: P01 1 [10] Se
PME 3344 Exercícios - Ciclos
 PME 3344 Exercícios - Ciclos 13) Exercícios sobre ciclos 1 v. 2.0 Exercício 01 Água é utilizada como fluido de trabalho em um ciclo Rankine no qual vapor superaquecido entra na turbina a 8 MPa e 480 C.
PME 3344 Exercícios - Ciclos 13) Exercícios sobre ciclos 1 v. 2.0 Exercício 01 Água é utilizada como fluido de trabalho em um ciclo Rankine no qual vapor superaquecido entra na turbina a 8 MPa e 480 C.
Propriedades de uma Substância Pura
 Propriedades de uma Substância Pura A substância pura Composição química invariável e homogênea. Pode existir em mais de uma fase, porém sua composição química é a mesma em todas as fases. Equilíbrio Vapor-líquido-sólido
Propriedades de uma Substância Pura A substância pura Composição química invariável e homogênea. Pode existir em mais de uma fase, porém sua composição química é a mesma em todas as fases. Equilíbrio Vapor-líquido-sólido
Uma fase é definida como uma quantidade de matéria homogênea.
 Aula 02 Estado e fase. Propriedades, processos e Ciclo Se considerarmos uma dada massa de água, reconhecemos que ela pode existir sob várias formas (fases). Se ela é inicialmente líquida pode-se tornar
Aula 02 Estado e fase. Propriedades, processos e Ciclo Se considerarmos uma dada massa de água, reconhecemos que ela pode existir sob várias formas (fases). Se ela é inicialmente líquida pode-se tornar
Entalpia. O trabalho realizado por esta reação é denominado trabalho de pressão-volume (trabalho PV)
 Entalpia As reações químicas podem absorver ou liberar calor e também podem provocar a realização de trabalho. Quando um gás é produzido, ele pode ser utilizado para empurrar um pistão: Zn(s) + 2H + (aq)
Entalpia As reações químicas podem absorver ou liberar calor e também podem provocar a realização de trabalho. Quando um gás é produzido, ele pode ser utilizado para empurrar um pistão: Zn(s) + 2H + (aq)
Fisica do Corpo Humano ( ) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01. Temperatura Aula 5 e 1/2 da 6
 Fisica do Corpo Humano (4300325) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01 Temperatura Aula 5 e 1/2 da 6 1. Existem em torno de uma centena de átomos 2. Cada átomo
Fisica do Corpo Humano (4300325) Prof. Adriano Mesquita Alencar Dep. Física Geral Instituto de Física da USP B01 Temperatura Aula 5 e 1/2 da 6 1. Existem em torno de uma centena de átomos 2. Cada átomo
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Aula 14 Equilíbrio de Fases: Substâncias Puras
 Aula 14 Equilíbrio de Fases: Substâncias Puras 1. A condição de estabilidade Inicialmente precisamos estabelecer a importância da energia de Gibbs molar na discussão das transições de fase. A energia de
Aula 14 Equilíbrio de Fases: Substâncias Puras 1. A condição de estabilidade Inicialmente precisamos estabelecer a importância da energia de Gibbs molar na discussão das transições de fase. A energia de
Características dos gases
 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Capítulo 1. Propriedades dos Gases
 Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Profª. Drª. Marivone Nunho Sousa Laboratório de Catálise 1 Departamento de Engenharia Química Escola de Engenharia de Lorena EEL/USP
 TERMODINÂMICA QUÍMICA APLICADA 2 CAPÍTULO 1 TERMODINÂMICA DE SOLUÇÕES Parte 1 Profª. Drª. Marivone Nunho Sousa Laboratório de Catálise 1 Departamento de Engenharia Química Escola de Engenharia de Lorena
TERMODINÂMICA QUÍMICA APLICADA 2 CAPÍTULO 1 TERMODINÂMICA DE SOLUÇÕES Parte 1 Profª. Drª. Marivone Nunho Sousa Laboratório de Catálise 1 Departamento de Engenharia Química Escola de Engenharia de Lorena
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
PME 3344 Exercícios - Ciclos
 PME 3344 Exercícios - Ciclos 13) Exercícios sobre ciclos 1 v. 2.0 Exercício 01 Água é utilizada como fluido de trabalho em um ciclo Rankine no qual vapor superaquecido entra na turbina a 8 MPa e 480 C.
PME 3344 Exercícios - Ciclos 13) Exercícios sobre ciclos 1 v. 2.0 Exercício 01 Água é utilizada como fluido de trabalho em um ciclo Rankine no qual vapor superaquecido entra na turbina a 8 MPa e 480 C.
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
Equações do estado Termodinâmica Aula [22/ ]
![Equações do estado Termodinâmica Aula [22/ ] Equações do estado Termodinâmica Aula [22/ ]](/thumbs/65/52652858.jpg) Equações do estado Termodinâmica Aula [22/03-2017] Tuong-Van Nguyen tungu@mek.dtu.dk Escola Politécnica Universidade de São Paulo 1 / 27 Plano Modelos termodinâmicos Equações do estado cúbicas 2 / 27 Plano
Equações do estado Termodinâmica Aula [22/03-2017] Tuong-Van Nguyen tungu@mek.dtu.dk Escola Politécnica Universidade de São Paulo 1 / 27 Plano Modelos termodinâmicos Equações do estado cúbicas 2 / 27 Plano
Calor e Temperatura, Trocas de Calor Bibliografia e figuras desta aula: Fundamentos da Física, Halliday, Resnick e Walker, 8a Ed., vol 2 pág
 Calor e Temperatura, Trocas de Calor Bibliografia e figuras desta aula: Fundamentos da Física, Halliday, Resnick e Walker, 8a Ed., vol 2 pág2 188-190 Até agora aprendemos: O conceito de temperatura A lei
Calor e Temperatura, Trocas de Calor Bibliografia e figuras desta aula: Fundamentos da Física, Halliday, Resnick e Walker, 8a Ed., vol 2 pág2 188-190 Até agora aprendemos: O conceito de temperatura A lei
PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS
 PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS CALOR E TRABALHO ALBERTO HERNANDEZ NETO 1/60 Calor (Q) : energia em trânsito devido a diferença de temperatura não associada a transferência de massa 1 B C A 2
PME 2378 INTRODUÇÃO ÀS CIÊNCIAS TÉRMICAS CALOR E TRABALHO ALBERTO HERNANDEZ NETO 1/60 Calor (Q) : energia em trânsito devido a diferença de temperatura não associada a transferência de massa 1 B C A 2
Disciplina: Sistemas Térmicos
 Disciplina: Sistemas Térmicos Apresentação da Primeira Lei da Termodinâmica Primeira Lei para um Sistema que Percorre um Ciclo Primeira Lei para Mudança de Estado do Sistema Descrição da Propriedade Termodinâmica
Disciplina: Sistemas Térmicos Apresentação da Primeira Lei da Termodinâmica Primeira Lei para um Sistema que Percorre um Ciclo Primeira Lei para Mudança de Estado do Sistema Descrição da Propriedade Termodinâmica
A 1 a lei da termodinâmica para um sistema transiente é:
 TT011 - Termidinâmica - Engenharia Ambiental - UFPR Gabarito - Avaliação Final Data: 15/07/2016 Professor: Emílio G. F. Mercuri Antes de iniciar a resolução leia atentamente a prova e verifique se a mesma
TT011 - Termidinâmica - Engenharia Ambiental - UFPR Gabarito - Avaliação Final Data: 15/07/2016 Professor: Emílio G. F. Mercuri Antes de iniciar a resolução leia atentamente a prova e verifique se a mesma
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO
 AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
UNIVERSIDADE ZAMBEZE. Fundamentos de Combustão Aula 2-Prática Prof. Jorge Nhambiu
 UNIVERSIDADE ZAMBEZE Fundamentos de Combustão Aula 2-Prática Aula 2. Tópicos Termodinâmica da combustão: Revisão dos conceitos da primeira lei; Propriedades das misturas; Estequiometria da combustão; Energia
UNIVERSIDADE ZAMBEZE Fundamentos de Combustão Aula 2-Prática Aula 2. Tópicos Termodinâmica da combustão: Revisão dos conceitos da primeira lei; Propriedades das misturas; Estequiometria da combustão; Energia
Capítulo 1: Conceitos Fundamentais. ÍNDICE
 Capítulo : Conceitos Fundamentais. ÍNDICE CONCEITOS FUNDAMENTAIS.... Sistema Termodinâmico.... Estado e Propriedades de uma Substância....3 Mudança de Estado de um Sistema Termodinâmico... 4.4 Escalas
Capítulo : Conceitos Fundamentais. ÍNDICE CONCEITOS FUNDAMENTAIS.... Sistema Termodinâmico.... Estado e Propriedades de uma Substância....3 Mudança de Estado de um Sistema Termodinâmico... 4.4 Escalas
Transformações Físicas
 Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
Forças intermoleculares
 Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio As ligações de hidrogênio são responsáveis pela: Flutuação do gelo
Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio As ligações de hidrogênio são responsáveis pela: Flutuação do gelo
Aula 15 Diagramas de Fase
 Aula 15 Diagramas de Fase 1. Introdução O diagrama de fases de uma substância é um mapeamento que mostra as condições de temperatura e pressão em que as diferentes fases são termodinamicamente mais estáveis.
Aula 15 Diagramas de Fase 1. Introdução O diagrama de fases de uma substância é um mapeamento que mostra as condições de temperatura e pressão em que as diferentes fases são termodinamicamente mais estáveis.
ZEA0466 TERMODINÂMICA
 ZEA0466 TERMODINÂMICA SUBSTÂNCIAS PURAS Substâncias Puras Coposição quíica: Hoogênea e invariável Pode existir e ais de ua fase as a coposição quíica é a esa para todas as fases; Mistura de gases (exeplo:
ZEA0466 TERMODINÂMICA SUBSTÂNCIAS PURAS Substâncias Puras Coposição quíica: Hoogênea e invariável Pode existir e ais de ua fase as a coposição quíica é a esa para todas as fases; Mistura de gases (exeplo:
Lista de Exercícios Solução em Sala
 Lista de Exercícios Solução em Sala 1) Um conjunto pistão-cilindro área de seção transversal igual a 0,01 m². A massa do pistão é 101 kg e ele está apoiado nos batentes mostrado na figura. Se a pressão
Lista de Exercícios Solução em Sala 1) Um conjunto pistão-cilindro área de seção transversal igual a 0,01 m². A massa do pistão é 101 kg e ele está apoiado nos batentes mostrado na figura. Se a pressão
Capítulo 1. Introdução à Termodinâmica Aplicada
 Capítulo Introdução à Termodinâmica Aplicada Objetivos Na disciplina de Fundamentos da Termodinâmica, você aprendeu inúmeros conceitos físicos importantes. O objetivo da disciplina de Termodinâmica Aplicada
Capítulo Introdução à Termodinâmica Aplicada Objetivos Na disciplina de Fundamentos da Termodinâmica, você aprendeu inúmeros conceitos físicos importantes. O objetivo da disciplina de Termodinâmica Aplicada
2 bt2 20 o C. O calor trocado pelo sistema é, fazendo a = 5,4 cal/g.k, b = 0,0024 cal/g.k 2, c = 0, cal.k/g, dt, T 2. = 230,2kcal.
 FÍSICA - LISTA 4 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância se a temperatura
FÍSICA - LISTA 4 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância se a temperatura
Termodinâmica. Lucy V. C. Assali
 Termodinâmica Calor Física II 2016 - IO Calor Final do século XVIII: duas hipóteses alternativas 1) Fluido indestrutível (calórico) que preencheria os poros dos corpos, escoando-se de um corpo mais quente
Termodinâmica Calor Física II 2016 - IO Calor Final do século XVIII: duas hipóteses alternativas 1) Fluido indestrutível (calórico) que preencheria os poros dos corpos, escoando-se de um corpo mais quente
Capítulo 3: Propriedades de uma Substância Pura
 Capítulo 3: Propriedades de uma Substância Pura Equação de estado do gás ideal Outras equações de estado Outras propriedades termodinâmicas Princípio de estado O número de propriedades independentes requerido
Capítulo 3: Propriedades de uma Substância Pura Equação de estado do gás ideal Outras equações de estado Outras propriedades termodinâmicas Princípio de estado O número de propriedades independentes requerido
C m Q C T T 1 > T 2 T 1 T 2. 1 cal = 4,184 J (14,5 o C p/ 15,5 o C) 1 Btu = 252 cal = 1,054 kj
 A teoria do calórico (~1779) Para atingir o estado de equilíbrio térmico, T 1 T 2 T 1 > T 2 -Substância fluida - invisível - peso desprezível T a quantidade de calórico Esta teoria explicava um grande
A teoria do calórico (~1779) Para atingir o estado de equilíbrio térmico, T 1 T 2 T 1 > T 2 -Substância fluida - invisível - peso desprezível T a quantidade de calórico Esta teoria explicava um grande
2/Mar/2016 Aula 4. 26/Fev/2016 Aula 3
 6/Fev/016 Aula 3 Calor e Primeira Lei da Termodinâmica Calor e energia térmica Capacidade calorífica e calor específico Calor latente Diagrama de fases para a água Primeira Lei da Termodinâmica Trabalho
6/Fev/016 Aula 3 Calor e Primeira Lei da Termodinâmica Calor e energia térmica Capacidade calorífica e calor específico Calor latente Diagrama de fases para a água Primeira Lei da Termodinâmica Trabalho
PME 3344 Termodinâmica Aplicada
 PME 3344 Termodinâmica Aplicada 4) Trabalho e calor 1 v. 1.1 Trabalho e calor Energia pode atravessar a fronteira de um sistema fechado apenas através de duas formas distintas: trabalho ou calor. Ambas
PME 3344 Termodinâmica Aplicada 4) Trabalho e calor 1 v. 1.1 Trabalho e calor Energia pode atravessar a fronteira de um sistema fechado apenas através de duas formas distintas: trabalho ou calor. Ambas
Profa.. Dra. Ana Maria Pereira Neto
 5/09/0 Universidade Federal do ABC BC309 Termodinâmica Aplicada Profa.. Dra. Ana Maria Pereira Neto ana.neto@ufabc.edu.br Bloco A, torre, sala 637 Calor, Trabalho e Primeira Lei da Termodinâmica 5/09/0
5/09/0 Universidade Federal do ABC BC309 Termodinâmica Aplicada Profa.. Dra. Ana Maria Pereira Neto ana.neto@ufabc.edu.br Bloco A, torre, sala 637 Calor, Trabalho e Primeira Lei da Termodinâmica 5/09/0
Mistura de Diversas Fases de uma Substância Pura Não é pura, diferentes temperaturas de condensação para diferentes componentes
 H 2 O W PdV, W m w P d V m Pdv y 0 yy 1,y 2 Pv RT PV mrt R R u M > > > > > < < x m vapor m total m vapor m liquid m vapor m g m l m g v V m V liq V vap m v f m liq v g m vap
H 2 O W PdV, W m w P d V m Pdv y 0 yy 1,y 2 Pv RT PV mrt R R u M > > > > > < < x m vapor m total m vapor m liquid m vapor m g m l m g v V m V liq V vap m v f m liq v g m vap
FÍSICA TÉRMICA TEMPERATURA, DILATAÇÃO TÉRMICA, CALORIMETRIA E TRANSMISSÃO DE CALOR
 FÍSICA TÉRMICA TEMPERATURA, DILATAÇÃO TÉRMICA, CALORIMETRIA E TRANSMISSÃO DE CALOR TEMPERATURA Grandeza Fundamental do S.I. Medida aproximada de agitação média de moléculas Unidade Principal: (Kelvin)
FÍSICA TÉRMICA TEMPERATURA, DILATAÇÃO TÉRMICA, CALORIMETRIA E TRANSMISSÃO DE CALOR TEMPERATURA Grandeza Fundamental do S.I. Medida aproximada de agitação média de moléculas Unidade Principal: (Kelvin)
Refrigeração e Ar Condicionado
 Refrigeração e Ar Condicionado Revisão Filipe Fernandes de Paula filipe.paula@engenharia.ufjf.br Departamento de Engenharia de Produção e Mecânica Faculdade de Engenharia Universidade Federal de Juiz de
Refrigeração e Ar Condicionado Revisão Filipe Fernandes de Paula filipe.paula@engenharia.ufjf.br Departamento de Engenharia de Produção e Mecânica Faculdade de Engenharia Universidade Federal de Juiz de
QUÍMICA GERAL Termodinâmica
 QUÍMICA GERAL Termodinâmica Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 18 de Setembro de 2018 Agronomia Sistemas, Estados e Energia
QUÍMICA GERAL Termodinâmica Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 18 de Setembro de 2018 Agronomia Sistemas, Estados e Energia
Aula 7 Refrigeração e bombeamento de calor
 Universidade Federal do ABC P O S M E C Aula 7 Refrigeração e bombeamento de calor MEC202 Refrigeração Transferência de calor a partir de uma região de temperatura mais baixa para uma região com temperatura
Universidade Federal do ABC P O S M E C Aula 7 Refrigeração e bombeamento de calor MEC202 Refrigeração Transferência de calor a partir de uma região de temperatura mais baixa para uma região com temperatura
Exercícios e exemplos de sala de aula Parte 1
 PME2398 Termodinâmica e suas Aplicações 1 o semestre / 2013 Prof. Bruno Carmo Exercícios e exemplos de sala de aula Parte 1 Propriedade das substâncias puras: 1- Um tanque rígido com volume de 1m 3 contém
PME2398 Termodinâmica e suas Aplicações 1 o semestre / 2013 Prof. Bruno Carmo Exercícios e exemplos de sala de aula Parte 1 Propriedade das substâncias puras: 1- Um tanque rígido com volume de 1m 3 contém
Transformações Físicas
 Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
Físico-Química I Profa. Dra. Carla Dalmolin Transformações Físicas Transições de Fase de Substâncias Puras Diagrama de Fases Transformações Físicas Transformações onde não ocorrem mudança na composição
Capítulo 6 Processos Envolvendo Vapores
 Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física - Calorimetria Mudanças de fase. Pré Universitário Uni-Anhanguera
 Lista de Exercícios Pré Universitário Uni-Anhanguera Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física - Calorimetria Mudanças de fase 01 - (FPS PE) Uma barra de gelo com massa
Lista de Exercícios Pré Universitário Uni-Anhanguera Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física - Calorimetria Mudanças de fase 01 - (FPS PE) Uma barra de gelo com massa
Energética Industrial
 Universidade do Minho Departamento de Engenharia Mecânica Energética Industrial Problemas propostos José Carlos Fernandes Teixeira 1) 1.5 kg de gelo à temperatura de 260 K, funde-se, à pressão de 1 bar,
Universidade do Minho Departamento de Engenharia Mecânica Energética Industrial Problemas propostos José Carlos Fernandes Teixeira 1) 1.5 kg de gelo à temperatura de 260 K, funde-se, à pressão de 1 bar,
CALORIMETRIA (CONTINUAÇÃO)
 CALORIMETRIA (CONTINUAÇÃO) Calor latente Nem toda a troca de calor existente na natureza se detém a modificar a temperatura dos corpos. Em alguns casos há mudança de estado físico destes corpos. Neste
CALORIMETRIA (CONTINUAÇÃO) Calor latente Nem toda a troca de calor existente na natureza se detém a modificar a temperatura dos corpos. Em alguns casos há mudança de estado físico destes corpos. Neste
Descrição Macroscópica de um Gás ideal
 Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
c c podem ser eliminados e os dois calores específicos
 ENERGIA INTERNA, ENTALPIA E CALORES ESPECÍFICOS DE SÓLIDOS E LÍQUIDOS Uma substância cujo volume específico (ou densidade) é constante é chamada de substância incompressível. Os volumes específicos de
ENERGIA INTERNA, ENTALPIA E CALORES ESPECÍFICOS DE SÓLIDOS E LÍQUIDOS Uma substância cujo volume específico (ou densidade) é constante é chamada de substância incompressível. Os volumes específicos de
2. Considere um bloco de gelo de massa 300g á temperatura de 20 C, sob pressão normal. Sendo L F
 1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
MUDANÇAS DE ESTADO FÍSICO
 MUDANÇAS DE ESTADO FÍSICO MUDANÇAS DE ESTADO FÍSICO As mudanças de estado físico não ocorrem em qualquer temperatura, mas sim em temperaturas específicas de cada substância. E sempre é valida a seguinte
MUDANÇAS DE ESTADO FÍSICO MUDANÇAS DE ESTADO FÍSICO As mudanças de estado físico não ocorrem em qualquer temperatura, mas sim em temperaturas específicas de cada substância. E sempre é valida a seguinte
11/Mar/2016 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
QB70C:// Química (Turmas S71/S72) Termodinâmica. Prof. Dr. Eduard Westphal ( Capítulo 8 Atkins (5ª ed.
 QB70C:// Química (Turmas S71/S72) Termodinâmica Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 8 Atkins (5ª ed.) Entalpia Em um sistema rígido (onde não exista outra forma
QB70C:// Química (Turmas S71/S72) Termodinâmica Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 8 Atkins (5ª ed.) Entalpia Em um sistema rígido (onde não exista outra forma
3. Um gás ideal passa por dois processos em um arranjo pistão-cilindro, conforme segue:
 1. Um arranjo pistão-cilindro com mola contém 1,5 kg de água, inicialmente a 1 Mpa e título de 30%. Esse dispositivo é então resfriado até o estado de líquido saturado a 100 C. Calcule o trabalho total
1. Um arranjo pistão-cilindro com mola contém 1,5 kg de água, inicialmente a 1 Mpa e título de 30%. Esse dispositivo é então resfriado até o estado de líquido saturado a 100 C. Calcule o trabalho total
