Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA
|
|
|
- Ana Beatriz Cerveira Amaral
- 7 Há anos
- Visualizações:
Transcrição
1
2 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm
3 Os valores da pressão, do volume e da temperatura não são constantes, então, dizemos que PRESSÃO (P), VOLUME (V) e TEMPERATURA (T) são VARIÁVEIS DE ESTADO DE UM GÁS P 1 1 atm V 1 6 L T K P 2 2 atm V 2 3 L T K P 3 6 atm V 3 3 L T K
4 Denominamos de pressão de um gás a colisão de suas moléculas com as paredes do recipiente em que ele se encontra
5 mercúrio Experiência de TORRICELLI vácuo 1 atm 76 cmhg 760 mmhg 1 atm 100 cm 76 cm mercúrio
6 EQUAÇÃO GERAL DOS GASES Existem transformações em que todas as grandezas (T, P e V) sofrem mudanças nos seus valores simultaneamente Combinando-se as três equações vistas encontraremos uma expressão que relaciona as variáveis de estado neste tipo de transformação P 1 x T V 1 1 P 2 x T V 2 2
7 01) Um gás ideal, confinado inicialmente à temperatura de 27 C, pressão de 15 atm e volume de 100L sofre diminuição no seu volume de 20L e um acréscimo em sua temperatura de 20 C. A pressão final do gás é: a) 10 atm. b) 20 atm. c) 25 atm. d) 30 atm. e) 35 atm. T1 27ºC K P1 15 atm V1 100 L V2 100 L 20 L 80 L T2 27ºC + 20ºC 47 ºC K P2? 15 P 1 x 100 V 1 P 2 x 80 V T 1 T 2 P2 20 atm
8 02) (UFMT) Uma certa massa de gás ocupa um volume de 10 L numa dada temperatura e pressão. O volume dessa mesma massa gasosa, quando a temperatura absoluta diminuir de 2/5 da inicial e a pressão aumentar de 1/5 da inicial, será: a) 6 L. b) 4 L. c) 3 L. d) 5 L. e) 10 L. P x 10 T 30 V 6 V1 10 L V2 V L T1 T T2 T 2/5 T 3/5 T P1 P P2 P + 1/5 P 6/5 P T 1 V 1 P 2 P 1 x x V 2 T 2 6/5 P X V V 3/5 T V 5 L 30 x P x T 5 6 x P x T 5
9 P1 1 atm V1 6 L T1 300 K P2 2 atm V2 3 L T2 300 K ESTADO 2 ESTADO 1 TRANSFORMAÇÃO ISOTÉRMICA Mantemos constante a TEMPERATURA e modificamos a pressão e o volume de uma massa fixa de um gás
10 GRÁFICO DA TRANSFORMAÇÃO ISOTÉRMICA P 1 1 atm V 1 6 L T K P 2 2 atm V 2 3 L T K P 3 6 atm V 3 1 L T K P (atm) LEI DE BOYLE - MARIOTTE Pressão e Volume são inversamente proporcionais V (litros) P constante 1 x V 1 P 2 x V 2
11 01) Na respiração normal de um adulto, num minuto são inalados 4,0 litros de ar, medidos a 27 o C e 1 atm de pressão. Um mergulhador a 43 m abaixo do nível do mar, onde a temperatura é de 27 o C e a pressão de 5 atm, receberá a mesma massa de oxigênio se inalar: a) 4,0 litros de ar. b) 8,0 litros de ar. c) 3,2 litros de ar. d) 0,8 litro de ar. e) 20 litros de ar. V 1 4,0 L V 2? L T 1 27ºC T 2 27ºC P 1 1 atm P 2 5 atm P1 x V1 P2 x V2 1 x 4 5 x V2 V2 4 5 V2 0,8 L
12 02) Dois balões A e B, estão ligados por um tubo de volume desprezível, munido de uma torneira. O balão A, de volume igual a 400 ml, contém gás hélio. No balão B, de volume igual a 600 ml, existe vácuo. Mantendo-se a temperatura constante, a torneira é aberta e a pressão final do sistema atinge o valor de 600 mmhg. A pressão inicial do balão A deve ser igual a: a) 1500 mmhg. b) 1200 mmhg. c) 1000 mmhg. d) 900 mmhg. e) 760 mmhg. A B He vácuo He V A 400 ml V B 600 ml P1 x V1 P2 x V2 400 x P x 1000 T constante P F 600 mmhg V F 1000 ml P P mmhg
13 03) Ao subir do fundo de um lago para a superfície, o volume de uma bolha triplica. Supondo que a temperatura da água no fundo do lago seja igual à temperatura na superfície, e considerando que a pressão exercida por uma coluna de água de 10 m de altura corresponde, praticamente, à pressão de uma atmosfera, podemos concluir que a profundidade do lago é, é, aproximadamente. a) 2 m. b) 5 m. c) 10 m. d) 20 m. e) 30 m. P1 x V1 P2 x V2 P 1 x V 1 x 3 V P1 3 V V P 2 1 atm V 2 3 V P1 3 atm 20 m 3 atm V 1 V
14 04) A figura mostra um cilindro munido de um êmbolo móvel, que impede a saída do ar que há dentro do cilindro. Quando o êmbolo se encontra na sua altura H 12 cm, a pressão do ar dentro do cilindro é p 0. Supondo que a temperatura é mantida constante, até que a altura, do fundo do cilindro deve ser baixado o êmbolo para que a pressão do ar dentro do cilindro seja 3 p 0? a) 4/9 cm. b) 4 cm. c) 6 cm. d) 8 cm. e) 9 cm H 12 cm 0 H? cm P1 x V1 P2 x V2 p o x 12 3p o x V 2 V2 p o p o V2 4 cm
15 P1 1 atm V1 6 L T1 300 K P2 1 atm V2 3 L T2 150 K ESTADO 2 ESTADO 1 TRANSFORMAÇÃO ISOBÁRICA Mantemos constante a PRESSÃO e modificamos a temperatura absoluta e o volume de uma massa fixa de um gás
16 P 1 2 atm V 1 1 L T K P 2 2 atm V 2 2 L T K P 3 2 atm V 3 3 L T K 7 6 V (L) Volume e Temperatura Absoluta são diretamente proporcionais V T constante 2 1 LEI DE CHARLES E GAY-LUSSAC T (Kelvin)
17 Na matemática, quando duas grandezas são diretamente proporcionais, o quociente entre elas é constante V T 1 1 V T 2 2
18 01) Durante o inverno do Alasca, quando a temperatura é de 23 C, um esquimó enche um balão até que seu volume seja de 30 L. Quando chega o verão a temperatura chega a 27 C. Qual o inteiro mais próximo que representa o volume do balão, no verão, supondo que o balão não perdeu gás, que a pressão dentro e fora do balão não muda, e que o gás é ideal? V 1 30 L T 1 23 ºC 250 K V30 1 V T T 2 V 2? L T 2 27ºC 300 K 250 x V 2 30 x V V 2 36 L
19 02) Uma estudante está interessada em verificar as propriedades do hidrogênio gasoso a baixas temperaturas. Ela utilizou, inicialmente, um volume de 2,98 L de H 2(g), à temperatura ambiente (25 C) e 1atm de pressão, e resfriou o gás, à pressão constante, a uma temperatura de 200 C. Que volume desse gás a estudante encontrou no final do experimento? a) 0,73 ml. V 1 2,98 L 2,98 V 1 V 2 T b) 7,30 ml ºC 298 K 298 T 1 73 T 2 c) 73,0 ml. d) 730 ml. V 2? L 298 x V 2 2,98 x ,54 e) 7300 ml. T 2 200ºC 73 K V V 2 0,73 L V ml
20 P1 4 atm V1 6 L T1 300 K P2 2 atm V2 6 L T2 150 K ESTADO 1 ESTADO 2 TRANSFORMAÇÃO ISOCÓRICA Mantemos constante o VOLUME e modificamos a temperatura absoluta e a pressão de uma massa fixa de um gás
21 P 1 1 atm V 1 2 L T K P 2 2 atm V 2 2 L T K P 3 3 atm V 3 2 L T K P (atm) Pressão e Temperatura Absoluta são diretamente proporcionais T (Kelvin) P T constante LEI DE CHARLES E GAY-LUSSAC
22 Na matemática, quando duas grandezas são diretamente proporcionais, o quociente entre elas é constante P T 1 1 P T 2 2
23 01) Uma garrafa de 1,5 L, indeformável e seca, foi fechada com uma tampa plástica. A pressão ambiente era de 1,0 atm e a temperatura de 27 C. Em seguida, esta garrafa foi colocada ao sol e, após certo tempo, a temperatura em seu interior subiu para 57 C e a tampa foi arremessada pelo efeito da pressão interna. Qual a pressão no interior da garrafa no instante imediatamente anterior à expulsão da tampa plástica? O volume da garrafa é constante V 1 1,5 L P 1 1 atm T 1 27 ºC T 2 57ºC P 2? atm 300 K 330 K 1 P 1 P T T x P 2 1 x P P 2 1,1 atm
24 02) Em um dia de inverno, à temperatura de 0 C, colocou-se uma amostra de ar, à pressão de 1,0 atm, em um recipiente de volume constante. Transportando essa amostra para um ambiente a 60 C, que pressão ela apresentará? a) 0,5 atm. b) 0,8 atm. c) 1,2 atm. d) 1,9 atm. e) 2,6 atm. T1 0 C K P1 1 atm T2 60 C K P2? 1 P1 P2 273 T1 333 T2 273 x P2 1 x 333 P P2 1,2 atm
25 03) Um recipiente fechado contém hidrogênio à temperatura de 30 C e pressão de 606 mmhg. A pressão exercida quando se eleva a temperatura a 47 C, sem variar o volume será: T1 30 C K a) 120 mmhg. b) 240 mmhg. P1 606 mmhg T2 47 C K c) 303 mmhg. d) 320 mmhg. e) 640 mmhg. P2? 606 P1 P T1 320 T2 P2 2 x 320 P2 640 mmhg
26 Condições Normais de Temperatura e Pressão (CNTP ou CN) Dizemos que um gás se encontra nas CNTP quando: Exerce uma pressão de 1 atm ou 760 mmhg e Está submetido a uma temperatura de 0ºC ou 273 K Nestas condições... 1 mol de qualquer gás ocupa um volume de 22,4 L (volume molar)
27 01) (UNIMEP-SP) O volume ocupado, nas CNTP, por 3,5 mol de CO será aproximadamente igual a: Dado: volume molar dos gases nas CNTP 22,4 L. a) 33,6 L. b) 78,4 L. c) 22,4 L. d) 65,6 L. e) 48,0 L. 1 mol de CO ocupa 22,4 L nas CNTP 3,5 mols de CO ocupa V L nas CNTP 1 22,4 3,5 V V 3,5 x 22,4 V 78,4 L
28 02) (ACAFE SC) Têm-se 13,0g de etino (C 2 H 2 ) nas CNTP. O volume, em litros, deste gás é: Dados: massas atômicas: C 12g/mol; H 1 g/mol. Volume molar dos gases nas CNTP 22,4 L. a) 26,0 L. b) 22,4 L. c) 33,6 L. d) 40,2 L. e) 11,2 L. 1 mol 26 M g 22,4 L 13 g V V 11,2 L C 2 H 2 M 2 x x 1 26 g
29 03) (FEI-SP) Um frasco completamente vazio tem massa 820g e cheio de oxigênio tem massa 844g. A capacidade do frasco, sabendo-se que o oxigênio se encontra nas CNTP, é: Dados: massa molar do O 2 32 g/mol; volume molar dos gases nas CNTP 22,4 L. a) 16,8 L. b) 18,3 L. c) 33,6 L. d) 36,6 L. e) 54,1 L. m O g 32 g 22,4 L 24 g V 32 22,4 24 V V 24 x 22,4 32 V 16,8 L
30 Para uma certa massa de gás vale a relação P V T constante Se esta quantidade de gás for 1 MOL a constante será representada por R e receberá o nome de CONSTANTE UNIVERSAL DOS GASES
31 Podemos calcular o seu valor considerando-se um dos estados do gás nas CNTP, isto é, T K, P 0 1 atm ou 760 mmhg e V 0 22,4 L, assim teremos: P V T 1 x 22,4 0,082 para 1 mol 273 P V T P V T 0,082 x 2 para 2 mol 0,082 x n para n mol P V T R x n P x V n x R x T
32 Podemos calcular o seu valor considerando-se um dos estados do gás nas CNTP, isto é, T K, P 0 1 atm ou 760 mmhg e V 0 22,4 L, assim teremos: P V T 760 x 22,4 62,3 para 1 mol 273 P V T P V T 62,3 x 2 para 2 mol 62,3 x n para n mol P V T R x n P x V n x R x T
33 01) (UFRGS) Um extintor de incêndio contém 4,4 kg de CO 2. O volume máximo de gás liberado na atmosfera, a 27ºC e 1 atm, é, em litros: Dados: C 12 u.; O 16 u. a) 0,229. b) 2,46. c) 24,6. d) 229,4. m 4,4 kg V? L T 27ºC P 1 atm g n 100 mol K e) P x V n x R x T 1 x V 100 x 0,082 x 300 V 2460 L
34 02) 2,2g de um gás estão contidos num recipiente de volume igual a 1,75 litros, a uma temperatura de 77 o C e pressão e 623 mmhg. Este gás deve ser: Dados: H 1 u; C 12 u; O 16 u; N 14 u; S 32 u a) NO. b) H 2 S. c) SO 2. d) CO 2. e) NH 3. m 2,2 g V 1,75 L T 77ºC 350 K P 623 mmhg m P x V x R x T M 2,2 623 x 1,75 x 62,3 x 350 M M 2,2 x 62,3 x x 1,75 M 44 g/mol CO g/mol
35 HIPÓTESE DE AVOGADRO V 2 L V 2 L P 1 atm P 1 atm Gás METANO T 300 K Gás CARBÔNICO T 300 K Volumes IGUAIS de gases quaisquer, nas mesmas condições de TEMPERATURA e PRESSÃO contêm a mesma quantidade de MOLÉCULAS
36 01) Um balão A contém 8,8 g de CO 2 e um balão B contém N 2. Sabendo que os dois balões têm igual capacidade e apresentam a mesma pressão e temperatura, calcule a massa de N 2 no balão B. Dados: C 12 g/mol; O 16 g/mol; N 14 g/mol. a) 56g. b) 5,6g. c) 0,56g. d) 4,4g. e) 2,8g. A m 8,8g de CO 2 B N 2 V A V B P A P B T A T B m x g de N 2 n CO 2 N 2 m m n CO 2 N 2 M 8,8 m N M CO 2 N 2 8,8 x 28 m N ,6g
37 02) (Fatec SP) Dois frascos de igual volume, mantidos à mesma temperatura e pressão, contêm, respectivamente, os gases X e Y. A massa do gás X é 0,34g, e a do gás Y é 0,48g. Considerando que Y é o ozônio (O 3 ), o gás X é: H 1 g/mol; C 12 g/mol; N 14 g/mol; O 16 g/mol; S 32 g/mol. a) N 2. b) CO 2. c) H 2 S. d) CH 4. e) H 2. X Y m X 0,34g e m Y 0,48g V X V Y T X T Y P X P Y Y O 3 X? n X n Y m M X X m M Y Y 0,34 Mx 0,48 48 M X 0,34 x 48 0,48 34g/mol H 2 S : M g/mol
38
39 Mistura de Gases Estas misturas funcionam como se fosse um único gás P A V A T A n A P B V B T B n B P V T Podemos estudar a mistura gasosa ou relacionar a mistura gasosa com os gases nas condições iniciais pelas expressões P. V n T. R. T P x V P A x V A P B x V B + T T A T B
40 g 01) Dois gases perfeitos estão em recipientes diferentes. Um dos gases ocupa volume de 2,0 L sob pressão de 4,0 atm e 127 C. O outro ocupa volume de 6,0 L sob pressão de 8,0 atm a 27 C. Que volume deverá ter um recipiente para que a mistura dos gases a 227 C exerça pressão de 10 atm? gás A gás B P. V T PA. VA TA + PB. VB TB 10. V VA 2,0 L PA 4,0 atm TA K ºC VB 6,0 L PB 8,0 atm TB ºC K V? P 10 atm T ºC K 10. V V V V 9 L
41 02) Em um recipiente com capacidade para 80 L são colocados 4,06 mols de um gás X e 15,24 mols de um gás Y, exercendo uma pressão de 6,33 atm. Podemos afirmar que a temperatura em que se encontra essa mistura gasosa é: a) 300 K. V 80 L b) 320 K. n X 4,06 mols c) 150 K. n T 19,3 mols n Y 15,24 mols d) 273 K. P 6,33 atm e) 540 K. T x K P. V n T. R. T 6, ,3. 0,082. T 506,4 1,5826. T T 506,4 1,5826 T 320 K
42 Pressão Parcial de um Gás Gás A Gás B P x V n T x R x T P x V P A x V A P B x V B + T T A T B Mantendo o VOLUME e a TEMPERATURA P A é a pressão parcial do gás A P A x V n A x R x T P B é a pressão parcial do gás B P B x V n B x R x T P A x V P A x V A T T A P B x V P B x V B T T B Lei de DALTON: P P A + P B
43 01)(UEL-PR) Considere a mistura de 0,5 mol de CH 4 e 1,5 mol de C 2 H 6, contidos num recipiente de 30 L a 300K. A pressão parcial do CH 4, em atm, é igual a: a) 1,64 atm. b) 0,82 atm. c) 0,50 atm. d) 0,41 atm. e) 0,10 atm. P. V n CH4. R. T P. 30 0,5. 0, ,5. 0, P 30 P 0,41 atm
44 02) Um estudante de química armazenou em um cilindro de 10 L, 6g de hidrogênio e 28 g de hélio. Sabendo-se que a temperatura é de 27 C no interior do cilindro. Calcule: Dados: H 2 2 g/mol; He 4 g/mol I. O número de mol do H 2 e do He. 6 n H2 3 mol n He 2 II. A pressão total da mistura mol P x V n T x R x T P x x 0,082 x 300 P 24,6 atm III. A pressão parcial de cada componente da mistura P H2 x V n H2 x R x T P H2 x 10 3 x 0,082 x 300 P H2 7,38 atm P He x V n He x R x T P He x 10 7 x 0,082 x 300 P He 17,22 atm
45 Prof. Agamenon Roberto Volume Parcial de um Gás Gás A Gás B P x V n T x R x T P x V P A x V A P B x V B + T T A T B Mantendo a PRESSÃO e a TEMPERATURA V A é o volume parcial do gás A P x V A n A x R x T V B é o volume parcial do gás B P x V B n B x R x T P x V A T P A x V A T A P x V B T P B x V B T B Lei de AMAGAT: V V A + V B
46 01) Uma mistura gasosa contém 4 mols de gás hidrogênio, 2 mols de gás metano exercem uma pressão de 4,1 atm, submetidos a uma temperatura de 27 C. Calcule os volumes parciais destes dois gases. nh2 4 mols nch4 2 mols P 4,1 atm T C K V H2? V CH4? P X VH2 nh2 x R x T 4,1 X V H2 4 x 0,082 x x 0,082 x 300 V H2 4,1 V H2 24 L 4,1 X V CH4 2 x 0,082 x 300 V CH4 V CH4 12 L 2 x 0,082 x 300 4,1
47 02) Uma mistura gasosa contém 6 mols de gás hidrogênio, 2 mols de gás metano e ocupa um recipiente de 82 L. Calcule os volumes parciais destes dois gases. n n H2 CH4 V 82 L 6 mols 2 mols Podemos relacionar, também, o volume parcial com o volume total da mistura pela expressão abaixo V A x A x V x H ,75 V 0,75 x 82 H2 61,5 L x CH ,25 V 0,25 x 82 20,5 L CH4
48 Densidade dos Gases Gás hidrogênio (H 2 ) Gás carbônico (CO 2 ) O gás H 2 é menos denso que o ar atmosférico O gás CO 2 é mais denso que o ar atmosférico
49 A densidade absoluta de um gás é o quociente entre a massa e o volume deste gás medidos em certa temperatura e pressão P x V m n M x R x T P x M m d n x R x T V d P x M R x T
50 01) A densidade absoluta do gás oxigênio (O 2 ) a 27ºC e 3 atm de pressão é: Dado: O 16 u d x g/l a) 16 g/l. T 27 C K b) 32 g/l. P 3 atm c) 3,9 g/l. M O2 32 u d) 4,5 g/l. e) 1,0 g/l. d R 0,082 atm. L / mol. K P x M 3 x 32 R x T 0,082 x ,6 d 3,9 g/l
51 Densidade nas CNTP T 273 k P 1 atm ou 760 mmhg R 0,082 atm. L / mol. K ou R 62,3 mmhg. L / mol. K d 1 x M 0,082 x 273 d M 22,4
52 DENSIDADE RELATIVA É obtida quando comparamos as densidades de dois gases, isto é, quando dividimos as densidades dos gases, nas mesmas condições de temperatura e pressão Gás A Gás B d A P x M A R x T d B P x M B R x T d A P x M A R x T x d B R x T P x M B d A, B M A M B
53 01) A densidade do gás carbônico em relação ao gás metano é igual a: Dados: H 1u; C 12 u; O 16 u a) 44. b) 16. c) 2,75. d) 0,25 e) 5,46 d CO 2, CH 4 M 44 CO2 M 16 CH 4 2,75 M x u.m.a. CO 2 M CH x 1 16 u.m.a.
54 Uma densidade relativa muito importante é quando comparamos o gás com o ar atmosférico, que tem MASSA MOLAR MÉDIA de 28,96 g/mol d A, Ar M A 28,96
55 01) A densidade relativa do gás oxigênio (O 2 ) em relação ao ar atmosférico é: Dado: O 16 u a) 16. b) 2. c) 0,5. d) 1,1. e) 1,43 d, Ar O 2 M 32 O2 28,96 1,1
56 DIFUSÃO E EFUSÃO Quando abrimos um recipiente contendo um perfume, após certo tempo sentimos o odor do perfume Isso ocorre porque algumas moléculas do perfume passam para a fase gasosa e se dispersam no ar chegando até nossas narinas Esta dispersão recebe o nome de DIFUSÃO
57 DIFUSÃO E EFUSÃO Uma bola de festas com um certo tempo murcha, isto ocorre porque a bola tem poros e o gás que se encontrava dentro da bola sai por estes poros Este fenômeno denomina-se de EFUSÃO
58 A velocidade de difusão e de efusão é dada pela LEI DE GRAHAM que diz: A velocidade de difusão e de efusão de um gás é inversamente proporcional à raiz quadrada de sua densidade Nas mesmas condições de temperatura e pressão a relação entre as densidades é igual à relação entre suas massas molares, então: v A d B v A M B v B d A v B M A
59 01) A velocidade de difusão do gás hidrogênio é igual a 27 km/min, em determinadas condições de pressão e temperatura. Nas mesmas condições, a velocidade de difusão do gás oxigênio em km/h é de: Dados: H 1 g/mol; O 16 g/mol. a) 4 km/h. v H2 27 km/min 27 km / (1/60) h b) 108 km/h. v O2 x km/h c) 405 km/h. d) 240 km/h. e) 960 km/h. v H2 v O2 M O2 M H2 27 x 60 v O x 60 v O2 4 v O km/h
60 02) ( Mackenzie SP ) Um recipiente com orifício circular contém os gases y e z. O peso molecular do gás y é 4,0 e o peso molecular do gás z é 36,0. A velocidade de escoamento do gás y será maior em relação à do gás z: a) 3 vezes b) 8 vezes c) 9 vezes d) 10 vezes e) 12 vezes M y 4 u M z 36 u v y v z M z v y M y v z v y 3 x v z
Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: ESTUDO DOS GASES
 1º EM E.M. FÍSICA Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: Resumão com exercícios: ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que
1º EM E.M. FÍSICA Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: Resumão com exercícios: ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que
EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I
 Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que:
 01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE
 Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
LISTA DE EXERCÍCIOS FÍSICA 2º TRIMESTRE ESTUDO DOS GASES
 LISTA DE EXERCÍCIOS FÍSICA 2º TRIMESTRE Nome: nº: Ano: 2º EM Professor: Anderson ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que ocorrem no nosso cotidiano,
LISTA DE EXERCÍCIOS FÍSICA 2º TRIMESTRE Nome: nº: Ano: 2º EM Professor: Anderson ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que ocorrem no nosso cotidiano,
2º ano FÍSICA Prof. Márcio Marinho DIAGRAMA DE FASES E GASES PERFEITOS
 DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
Gases. 1) Assinale a alternativa CORRETA.
 Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
Estado Gasoso. Classe: 2 2 a série. Exercícios Complementares - Recuperação Paralela PARTE A
 Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
O ESTADO GASOSO - CARACTERÍSTICAS GERAIS
 Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estequiometria. Mestranda: Daniele Potulski Disciplina: Química da madeira I
 Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Luis Eduardo C. Aleotti. Química. Aula 38 - Transformações Gasosas
 Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Equação Geral dos Gases
 Equação Geral dos Gases EXERCÍCIOS DE APLICAÇÃO 01 (EEM-SP) Uma determinada massa gasosa, confinada em um recipiente de volume igual a 6,0 L, está submetida a uma pressão de 2,5 atm e sob temperatura de
Equação Geral dos Gases EXERCÍCIOS DE APLICAÇÃO 01 (EEM-SP) Uma determinada massa gasosa, confinada em um recipiente de volume igual a 6,0 L, está submetida a uma pressão de 2,5 atm e sob temperatura de
GASES. QUIMICA II a Unidade
 GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
Hipótese de Avogadro e Volume Molar
 Hipótese de Avogadro e Volume Molar EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H, N e O, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
Hipótese de Avogadro e Volume Molar EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H, N e O, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Química Prof. Giacometto
 Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Final 3ª Etapa 2013 Disciplina: Química Ano: 2 ANO Professora: Maria Luiza Ensino Médio Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Final 3ª Etapa 2013 Disciplina: Química Ano: 2 ANO Professora: Maria Luiza Ensino Médio Caro aluno, você está recebendo o conteúdo de recuperação.
Gases. 1 atm = 1 kpa. 1 mmhg = 1 Torr. 1 m = 1000 L 1 L = 1000 ml = 1000 cm ESTUDO DOS GASES
 1 ESUDO DOS GSES INRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que ocorrem no nosso cotidiano, tais como: um balão subir, uma bexiga murchar com o tempo, a pressão interna
1 ESUDO DOS GSES INRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que ocorrem no nosso cotidiano, tais como: um balão subir, uma bexiga murchar com o tempo, a pressão interna
HIPÓTESE DE AVOGADRO E VOLUME MOLAR
 HIPÓTESE DE AVOGADRO E VOLUME MOLAR EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H2, N2 e O2, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
HIPÓTESE DE AVOGADRO E VOLUME MOLAR EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H2, N2 e O2, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2
 QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
Vejamos agora alguns casos particulares dessas transformações com quantidade de gás constante.
 Setor 2306 Aula 06 Transformações Gasosas em sistemas fechados Complemento. Como vimos em aula, as transformações realizadas em sistemas fechados tem sua quantidade de gás constante. Nessa situação, a
Setor 2306 Aula 06 Transformações Gasosas em sistemas fechados Complemento. Como vimos em aula, as transformações realizadas em sistemas fechados tem sua quantidade de gás constante. Nessa situação, a
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
Transformações Gasosas
 Transformações Gasosas EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme mostra o diagrama abaixo. Sabendo-se que a transformação
Transformações Gasosas EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme mostra o diagrama abaixo. Sabendo-se que a transformação
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS
 GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
Lista Básica Transformações Gasosas
 1. (Pucrj 2017) Uma certa quantidade de gás ideal ocupa inicialmente um volume 0 com pressão P 0. Se sobre esse gás se realiza um processo isotérmico dobrando sua pressão para 2 P 0. qual será o volume
1. (Pucrj 2017) Uma certa quantidade de gás ideal ocupa inicialmente um volume 0 com pressão P 0. Se sobre esse gás se realiza um processo isotérmico dobrando sua pressão para 2 P 0. qual será o volume
LISTA DE EXERCÍCIOS ESTUDO DOS GASES
 GOVERNO DO ESTADO DE PERNAMBUCO GRÉ MATA NORTE UNIVERSIDADE DE PERNAMBUCO CAMPUS MATA NORTE ESCOLA DE APLICAÇÃO PROFESSOR CHAVES LISTA DE EXERCÍCIOS ALUNO(A): Nº NAZARÉ DA MATA, DE DE 2015 2º ANO ESTUDO
GOVERNO DO ESTADO DE PERNAMBUCO GRÉ MATA NORTE UNIVERSIDADE DE PERNAMBUCO CAMPUS MATA NORTE ESCOLA DE APLICAÇÃO PROFESSOR CHAVES LISTA DE EXERCÍCIOS ALUNO(A): Nº NAZARÉ DA MATA, DE DE 2015 2º ANO ESTUDO
Pressão (mmhg) T (K) x 12 5
 GASES IDEAIS 1- (UNIFOR) Para que a relação matemática P 1 V 1 = P 2 V 2, conhecida como Lei de Boyle para as transformações gasosas, seja válida é necessário que: I. A massa do gás seja constante II.
GASES IDEAIS 1- (UNIFOR) Para que a relação matemática P 1 V 1 = P 2 V 2, conhecida como Lei de Boyle para as transformações gasosas, seja válida é necessário que: I. A massa do gás seja constante II.
EXPERIÊNCIA 2 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO
 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
Soluções e Gases III. Gases
 Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Transformações Gasosas
 Transformações Gasosas Portal de Estudos em Química (PEQ) www.profpc.com.br Página 1 EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme
Transformações Gasosas Portal de Estudos em Química (PEQ) www.profpc.com.br Página 1 EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme
GASES. Maira Gazzi Manfro e Giseli Menegat
 GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
Fenômenos de Transporte PROF. BENFICA
 Fenômenos de Transporte PROF. BENFICA benfica@anhanguera.com www.marcosbenfica.com LISTA 1 Conceitos Iniciais 1) Faça as seguintes conversões de unidades: a) 45 km/h em m/s. b) 100 m/s em km/h. c) 600
Fenômenos de Transporte PROF. BENFICA benfica@anhanguera.com www.marcosbenfica.com LISTA 1 Conceitos Iniciais 1) Faça as seguintes conversões de unidades: a) 45 km/h em m/s. b) 100 m/s em km/h. c) 600
QUÍMICA 2 Prof Emanuele
 QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017
 ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 2º ano Nome Nº Turma Data 15/12 Nota Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 1. Um recipiente fechado
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 2º ano Nome Nº Turma Data 15/12 Nota Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 1. Um recipiente fechado
GASES PERFEITOS AULA INTRODUÇÃO
 AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
Fís. Professor: Leo Gomes Monitor: Guilherme Brigagão. Fís
 . Semana 18 Professor: Leo Gomes Monitor: Guilherme Brigagão Gases perfeitos 21 jun RESUMO Gases perfeitos ou ideais são aqueles cujas moléculas se movem ao acaso, todas com a mesma velocidade média, cujas
. Semana 18 Professor: Leo Gomes Monitor: Guilherme Brigagão Gases perfeitos 21 jun RESUMO Gases perfeitos ou ideais são aqueles cujas moléculas se movem ao acaso, todas com a mesma velocidade média, cujas
Estudo da Física. Prof. Railander Borges
 Estudo da Física Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges ASSUNTO: GASES 1. Uma panela de pressão com
Estudo da Física Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges ASSUNTO: GASES 1. Uma panela de pressão com
Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física Gases ideais e Termodinâmica
 Lista de Exercícios Pré Universitário Uni-Anhanguera Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física Gases ideais e Termodinâmica 01 - (ACAFE SC) No estudo da termodinâmica é
Lista de Exercícios Pré Universitário Uni-Anhanguera Aluno(a): Nº. Professor: Fabrízio Gentil Série: 2 o ano Disciplina: Física Gases ideais e Termodinâmica 01 - (ACAFE SC) No estudo da termodinâmica é
Ensino Médio. Gases 1ª séries Profª Cleciane
 Ensino Médio Gases 1ª séries Profª Cleciane 1) UEL-PR Para dada amostra de substância gasosa, quando se dobra a pressão, à temperatura constante, o volume se reduz à metade. Essa afirmação explicita o
Ensino Médio Gases 1ª séries Profª Cleciane 1) UEL-PR Para dada amostra de substância gasosa, quando se dobra a pressão, à temperatura constante, o volume se reduz à metade. Essa afirmação explicita o
ATMOSFERA. Volume molar; constante de Avogadro
 ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
MÓDULOS 25 e 26 QUÍMICA. Equação de Estado Leis dos Gases Densidade dos Gases. Ciências da Natureza, Matemática e suas Tecnologias
 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos Gases 1. Equação de Estado do Gás É uma equação que relaciona a pressão do gás (), o volume do
Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos Gases 1. Equação de Estado do Gás É uma equação que relaciona a pressão do gás (), o volume do
GOIÂNIA, / / PROFESSORA: Núbia de Andrade. DISCIPLINA:Química SÉRIE: 1º. ALUNO(a):
 GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 1º ALUNO(a): Lista de Recuperação Semestral No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 1º ALUNO(a): Lista de Recuperação Semestral No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
LISTA UERJ - GASES. No interior da bola cheia, a massa de ar, em gramas, corresponde a: a) 2,5 b) 5,0 c) 7,5 d) 10,0
 1. (Uerj 2012) Em um reator nuclear, a energia liberada na fissão de 1 g de urânio é 4 utilizada para evaporar a quantidade de 3,6 10 kg de água a 227ºC e sob 30 atm, necessária para movimentar uma turbina
1. (Uerj 2012) Em um reator nuclear, a energia liberada na fissão de 1 g de urânio é 4 utilizada para evaporar a quantidade de 3,6 10 kg de água a 227ºC e sob 30 atm, necessária para movimentar uma turbina
Turma: 2201 Turno: Manhã Professor: Douglas Baroni
 Colégio Zaccaria TELEFAX: (0 XX 21) 3235-9400 www.zaccaria.g12.br Lista de exercícios Física II (Recuperação) 1º Período 2014 Aluno(a): N.º Turma: 2201 Turno: Manhã Professor: Douglas Baroni QUESTÃO 1
Colégio Zaccaria TELEFAX: (0 XX 21) 3235-9400 www.zaccaria.g12.br Lista de exercícios Física II (Recuperação) 1º Período 2014 Aluno(a): N.º Turma: 2201 Turno: Manhã Professor: Douglas Baroni QUESTÃO 1
a) Avogadro. d) Boyle. b) Dalton. e) Lavoisier. c) Gay - Lussac.
 01) (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme mostra o diagrama abaixo. Sabendo-se que a transformação de A para B ocorre à temperatura constante,
01) (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme mostra o diagrama abaixo. Sabendo-se que a transformação de A para B ocorre à temperatura constante,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
Química B Extensivo V. 7
 Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA. Transformações Químicas. Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Princípio de Avogadro Parte 4
 QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC 2º TRI PRIMEIRO ANO FSC II
 1º EM E.M. FÍSICA Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC º TRI PRIMEIRO ANO FSC II Estudar FÍSICA II LIVRO PV = nrt Dilatação dos Sólidos e dos Líquidos
1º EM E.M. FÍSICA Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC º TRI PRIMEIRO ANO FSC II Estudar FÍSICA II LIVRO PV = nrt Dilatação dos Sólidos e dos Líquidos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
11/08/2014. Lei de Avogadro. Equação de Clayperon. CNTP 1 atm 0 C 273K
 Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
QUÍMICA I Gases
 QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Revisão para a prova (Gases) Questão 01 - (ACAFE SC/2017) Baseado nos conceitos sobre os gases,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Revisão para a prova (Gases) Questão 01 - (ACAFE SC/2017) Baseado nos conceitos sobre os gases,
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
QUÍMICA Profº JAISON
 QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
Professora : Elisângela Moraes
 UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
C7_ITA_PROF 30/03/10 15:27 Page I
 C7_ITA_ROF 30/03/10 15:27 age I C7_ITA_ROF 30/03/10 15:27 age II C7_ITA_ROF 30/03/10 15:27 age 1 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos
C7_ITA_ROF 30/03/10 15:27 age I C7_ITA_ROF 30/03/10 15:27 age II C7_ITA_ROF 30/03/10 15:27 age 1 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos
QUÍMICA - 3 o ANO MÓDULO 18 ESTUDO DOS GASES
 QUÍMICA - 3 o ANO MÓDULO 18 ESTUDO DOS GASES m m 1 = 2 mol mol 1 2 No que se refere à composição em volume da atmosfera terrestre há 2,5 bilhões de anos, Como pode cair no enem (ENEM) As áreas numeradas
QUÍMICA - 3 o ANO MÓDULO 18 ESTUDO DOS GASES m m 1 = 2 mol mol 1 2 No que se refere à composição em volume da atmosfera terrestre há 2,5 bilhões de anos, Como pode cair no enem (ENEM) As áreas numeradas
Apostila de Exercícios de Físico Química 4, Lei de Graham
 1) À mesma temperatura, um gás é quatro vezes mais denso que outro. Qual é a relação entre suas velocidades de efusão? (a) O gás mais denso difunde-se com metade da velocidade do gás menos denso. (b) O
1) À mesma temperatura, um gás é quatro vezes mais denso que outro. Qual é a relação entre suas velocidades de efusão? (a) O gás mais denso difunde-se com metade da velocidade do gás menos denso. (b) O
PROPRIEDADE DOS GASES
 RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
Equação de estado de um gás ideal e misturas gasosas
 Equação de estado de um gás ideal e misturas gasosas 01. Prove que a soma das frações molares de uma mistura gasosa é igual a 1. 02. Defina a pressão parcial de um gás. 03. Defina o volume parcial de um
Equação de estado de um gás ideal e misturas gasosas 01. Prove que a soma das frações molares de uma mistura gasosa é igual a 1. 02. Defina a pressão parcial de um gás. 03. Defina o volume parcial de um
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
LISTA 4: EXERCÍCIOS TRANSFORMAÇÕES TERMODINÂMICAS, MASSA MOLAR E EQUAÇÃO DE CLAPEYRON. PROF : José Lucas
 LISTA 4: EXERCÍCIOS TRANSFORMAÇÕES TERMODINÂMICAS, MASSA MOLAR E EQUAÇÃO DE CLAPEYRON PROF : José Lucas 1) Um gás ideal ocupa 6 litros em um recipiente, a pressão dentro do frasco é de 3 atm. Suponha que
LISTA 4: EXERCÍCIOS TRANSFORMAÇÕES TERMODINÂMICAS, MASSA MOLAR E EQUAÇÃO DE CLAPEYRON PROF : José Lucas 1) Um gás ideal ocupa 6 litros em um recipiente, a pressão dentro do frasco é de 3 atm. Suponha que
2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor dessa pressão em atm e kpa?
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
2. Considere um bloco de gelo de massa 300g á temperatura de 20 C, sob pressão normal. Sendo L F
 1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
1. Considere um bloco de gelo de massa 300g encontra-se a 0 C. Para que todo gelo se derreta, obtendo água a 0 C são necessárias 24.000 cal. Determine o calor latente de fusão do gelo. 2. Considere um
1,0 atm; 3,0 atm; 3,3 atm; 3,9 atm; 4,0 atm.
 1. Um tubo cilíndrico de oxigênio de um mergulhador contém 3,2 kg de O 2. Antes de mergulhar, verificou-se que a temperatura e a pressão no interior do cilindro valiam, respectivamente, 27 C e 1,5 atm.
1. Um tubo cilíndrico de oxigênio de um mergulhador contém 3,2 kg de O 2. Antes de mergulhar, verificou-se que a temperatura e a pressão no interior do cilindro valiam, respectivamente, 27 C e 1,5 atm.
c) qual o lado do cubo que ele teria que ocupar com essas bolinhas, de modo a representar 1cm 3 de gás? A) 1km B) 10km C) 100km D) 1000km E) 10000km
 1- Imagine que, na impossibilidade de reduzir seus alunos ao tamanho das moléculas de um gás, um professor resolva trazer as moléculas para o tamanho de seus alunos. Usa, para isso, bolinhas de gude, de
1- Imagine que, na impossibilidade de reduzir seus alunos ao tamanho das moléculas de um gás, um professor resolva trazer as moléculas para o tamanho de seus alunos. Usa, para isso, bolinhas de gude, de
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana.
 Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Questões de transformações gasosas - apostila K5
 Questões de transformações gasosas - apostila K5 Guilherme Limberg Apostila K5 Teste 67 ) MACKENZIE) Um pesquisador transferiu uma massa de gás perfeito à temperatura de 27 o C para outro recipiente de
Questões de transformações gasosas - apostila K5 Guilherme Limberg Apostila K5 Teste 67 ) MACKENZIE) Um pesquisador transferiu uma massa de gás perfeito à temperatura de 27 o C para outro recipiente de
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Características dos gases
 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2015
 ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2015 2º ano Nome Nº Turma Data Nota Disciplina QUÍMICA Prof. ORLANDO Valor TRABALHO DE ESTUDOS INDEPENDENTES DE RECUPERAÇÃO -2ºANO 01. (UNIVALI-SC) O
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2015 2º ano Nome Nº Turma Data Nota Disciplina QUÍMICA Prof. ORLANDO Valor TRABALHO DE ESTUDOS INDEPENDENTES DE RECUPERAÇÃO -2ºANO 01. (UNIVALI-SC) O
ESTUDOS INDEPENTES DE RECUPERAÇÃO QUÍMICA-2ºANO TRABALHO DE RECUPERAÇÃO
 ESTUDOS INDEPENTES DE RECUPERAÇÃO QUÍMICA-2ºANO TRABALHO DE RECUPERAÇÃO 2 ANO EM 1)Considere as reações abaixo e marque a alternativa que indica corretamente as reações endotérmicas: I. CH4(g) + 2 O2(g)
ESTUDOS INDEPENTES DE RECUPERAÇÃO QUÍMICA-2ºANO TRABALHO DE RECUPERAÇÃO 2 ANO EM 1)Considere as reações abaixo e marque a alternativa que indica corretamente as reações endotérmicas: I. CH4(g) + 2 O2(g)
Estudo dos gases. Prof. Leandro Zatta - Química Geral 1
 Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
a) A quantidade de calor que o corpo deve receber para que sua temperatura varie de 5 ºC para 35 ºC;
 SECRETARIA DE SEGURANÇA PÚBLICA/SECRETARIA DE EDUCAÇÃO POLÍCIA MILITAR DO ESTADO DE GOIÁS COMANDO DE ENSINO POLICIAL MILITAR COLÉGIO DA POLÍCIA MILITAR SARGENTO NADER ALVES DOS SANTOS SÉRIE/ANO: 2º TURMA(S):
SECRETARIA DE SEGURANÇA PÚBLICA/SECRETARIA DE EDUCAÇÃO POLÍCIA MILITAR DO ESTADO DE GOIÁS COMANDO DE ENSINO POLICIAL MILITAR COLÉGIO DA POLÍCIA MILITAR SARGENTO NADER ALVES DOS SANTOS SÉRIE/ANO: 2º TURMA(S):
QUÍMICA 2 Prof Emanuele
 QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS 1 RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Se um dentista usou em seu trabalho 30 mg de amálgama de prata, cujo teor em prata é de 72% (em massa), o número de
QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS 1 RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Se um dentista usou em seu trabalho 30 mg de amálgama de prata, cujo teor em prata é de 72% (em massa), o número de
é aproximadamente igual a:
 Professor: Renan Oliveira 1. (UERJ/2016) Para descrever o comportamento dos gases ideais em função do volume V, da pressão P e da temperatura T, podem ser utilizadas as seguintes equações: De acordo com
Professor: Renan Oliveira 1. (UERJ/2016) Para descrever o comportamento dos gases ideais em função do volume V, da pressão P e da temperatura T, podem ser utilizadas as seguintes equações: De acordo com
Estudo Estudo da Química
 Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 11 Estudo Geral dos Gases 1.
Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 11 Estudo Geral dos Gases 1.
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 3ª Etapa 2014 Disciplina: QUÍMICA Série: 1ª Professora: Maria Luiza Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 3ª Etapa 2014 Disciplina: QUÍMICA Série: 1ª Professora: Maria Luiza Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
Estado Gasoso. Características. Expansibilidade compressibilidade. Situação de um gás. Variáveis de estado
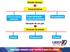 Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Colégio Santa Dorotéia Área de Ciências da Natureza Disciplina: Física Ano: 2º Ensino Médio Professor: Marcelo Caldas
 Área de Ciências da Natureza Disciplina: Física Ano: 2º Ensino Médio Professor: Marcelo Caldas Física Atividades para Estudos Autônomos Data: 5 / 6 / 2018 Aluno(a): Nº: Turma: Capítulo 23: Comportamento
Área de Ciências da Natureza Disciplina: Física Ano: 2º Ensino Médio Professor: Marcelo Caldas Física Atividades para Estudos Autônomos Data: 5 / 6 / 2018 Aluno(a): Nº: Turma: Capítulo 23: Comportamento
4,5 cm. 3,0 cm. 3,0 cm. 4,5 cm. 3,0 cm
 1. Uma bolha de ar, com volume de 1,5 cm, forma-se no fundo de um lago, a 20 m de profundidade, e sobe até atingir a superfície. A pressão atmosférica no local tem valor de 1,0 atm e a temperatura do lago
1. Uma bolha de ar, com volume de 1,5 cm, forma-se no fundo de um lago, a 20 m de profundidade, e sobe até atingir a superfície. A pressão atmosférica no local tem valor de 1,0 atm e a temperatura do lago
s e s a G a ic ím u Q G. A 1 P
 1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
Questão 01 - (ENEM/2015)
 Questão 01 - (ENEM/2015) Uma pessoa abre sua geladeira, verifica o que há dentro e depois fecha a porta dessa geladeira. Em seguida, ela tenta abrir a geladeira novamente, mas só consegue fazer isso depois
Questão 01 - (ENEM/2015) Uma pessoa abre sua geladeira, verifica o que há dentro e depois fecha a porta dessa geladeira. Em seguida, ela tenta abrir a geladeira novamente, mas só consegue fazer isso depois
Exercícios: gases (2)
 Química Ficha 8 2 os anos Rodrigo abril/12 Nome: Nº: Turma: Exercícios: gases (2) 1) (Unicamp) Após a limpeza do banheiro, Rango foi à sala e removeu todos os móveis e, de tão feliz e apaixonado, começou
Química Ficha 8 2 os anos Rodrigo abril/12 Nome: Nº: Turma: Exercícios: gases (2) 1) (Unicamp) Após a limpeza do banheiro, Rango foi à sala e removeu todos os móveis e, de tão feliz e apaixonado, começou
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
