Hipótese de Avogadro e Volume Molar
|
|
|
- Oswaldo Fernandes Alcântara
- 7 Há anos
- Visualizações:
Transcrição
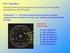
1 Hipótese de Avogadro e Volume Molar EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H, N e O, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura, assinale a alternativa com o número possível de moléculas de H, N e O contidas nos balões: a).10 3, e b) , e c).10 3,.10 3 e.10 3 d).10 3, e e).10 3, e Portal de Estudos em Química (PEQ) Página 1
2 0 (FEI-SP) Uma residência consumiu no ano 000, entre os meses de janeiro e março, 1,6 kg de gás natural. O volume consumido, em metros cúbicos (m 3 ) medido nas CNTP, considerando o gás natural como metano (CH 4 ) puro, é: (H = 1, C = 1, volume molar nas CNTP,4 L/mol) a),4 b),4 c) 44,8 d) 4,48 e),48 03 (Fuvest-SP) Certo gás X é formado apenas por nitrogênio e oxigênio. Para determinar sua fórmula molecular, comparou-se esse gás com o metano (CH 4 ). Verificou-se que volumes iguais dos gases X e metano, nas mesmas condições de pressão e temperatura, pesaram, respectivamente, 0,88 g e 0,3 g. Qual a fórmula molecular do gás X? Massas molares (g/mol): H = 1; C = 1; N = 14; O = 16 a) NO b) N O c) NO d) N O 3 e) N O 5 04 (Osec-SP) O número de moléculas existentes em 110 litros de gás carbônico, nas CNTP, é igual a: a) b), c) 8, d) 1, e) 8, (FEI-SP) Nas condições normais de pressão e temperatura (CNTP), o volume ocupado por 10 g de monóxido de carbono (CO) é de: Dados: C = 1 u, O = 16 u, volume molar =,4 L a) 6,0 L b) 8,0 L c) 9,0 L d) 10 L e) 1 L 06 (FM Catanduva-SP) Para que certo volume de SO nas CNTP contenha o mesmo número de moléculas que 88 g de CO é necessário que: I. Contenha 1, moléculas. II. Esse volume tenha a massa de 64 g. III. Esse volume corresponde a vezes o volume molar. Assinalar: (Dados: massas atômicas: O = 16, S = 3; constante de Avogadro: 6, ) a) São todas corretas. b) Somente a I é correta. c) Somente a II é correta. d) Somente a III é correta. e) Somente I e III são corretas. Portal de Estudos em Química (PEQ) Página
3 07 (PUC-SP) O quociente entre os números de átomos existentes em volumes iguais de oxigênio (O ) e propano (C 3 H 8 ), medidos nas mesmas condições de pressão e temperatura é: a) /8 b) /5 c) 1/11 d) 1/8 e) /11 08 (PUC-Campinas-SP) A hidrazina, substância usada como combustível em foguetes, apresenta fórmula mínima NH. Sabendo que 4,48 L dela, gasosa, nas CNTP, pesam 6,4g, pode-se deduzir que a fórmula molecular é: (Dados: N = 14; H = 1) a) NH b) NH 3 c) NH 4 d) N H 5 e) N H 4 09 (PUC-MG) O número de átomos existentes em 44,8 litros de nitrogênio (N ) nas CNTP, é igual a: a) 1, 10 b) 1, 10 3 c), d) 6, e) 6, Qual é o volume ocupado por 0,5 mol de H (g) nas CNTP? Portal de Estudos em Química (PEQ) Página 3
4 EXERCÍCIOS PROPOSTOS 11 Qual é o volume em m 3 ocupado por 8,0 kg de O (g) nas CNTP? (Dado: Massa molar do O = 3 g mol -1 ) 1 (PUC-SP) Têm-se dois balões, A e B, de mesmo volume. O balão A contém cloro (Cl ) e o balão B, ozone (O 3 ), à mesma temperatura e pressão. Pode-se afirmar que o que há de comum entre os dois balões é: a) a mesma massa. b) a mesma densidade. c) o mesmo número de moléculas. d) o mesmo número de átomos. e) a mesma coloração. 13 (EEM-SP) Massas iguais dos gases sulfrideto (H S) e fosfina, nas mesmas condições de pressão e temperatura, ocupam o mesmo volume. Qual a massa molecular da fosfina, sabendo que as massas atômicas do hidrogênio e do enxofre são iguais a 1 e 3 respectivamente? 14 Qual é o número de moléculas contidas em 56 ml de metano, CH 4 (g), nas CNTP? 15 Dois frascos de igual volume, mantidos à mesma temperatura e pressão, contêm, respectivamente, os gases X e Y. A massa do gás X é 0,34g, e a do gás Y é 0,48g. Considerando que Y é ozônio (O 3 ), o gás X é: (Dados: Massas atômicas H = 1,0; C = 1,0; N = 14,0: O = 16,0; S = 3,0) a) N b) CO c) H S d) CH 4 e) H Portal de Estudos em Química (PEQ) Página 4
5 16 (Acafe-SC) Nas Condições Normais de Temperatura e Pressão (CNTP), o volume ocupado por 48 g de metano (CH 4 ) é: (Massas atômicas: C = 1, H = 1; R = 0,08 atm. L mol -1. K -1 ) a) 4 L. b),4 L. c) 7 L. d) 67, L. e) 7,96 L. 17 Qual é o volume ocupado por 17,6 g de CO (g) nas condições ambientes (1 atm e 5 C)? (Dados: Massa molar do CO = 44 g.mol -1, volume molar a 5 C e 1 atm = 5 L.mol -1 ) 18 Sabendo-se que a concentração de O na atmosfera, ao nível do mar, é 0,9% em volume, justifique por que a afirmação adiante está CERTA ou ERRADA. O volume molar de ar à CNTP contém 6,7g de O. 19 Dois cilindros metálicos iguais contêm gases comprimidos em grau de elevada pureza, sendo que um deles contém 8 m 3 de gás nitrogênio, e o outro, 8 m 3 de gás hidrogênio. Considerando que os dois cilindros estão armazenados nas mesmas condições ambientais, podemos afirmar que: Dados: Massas atômicas H = 1,0 e N = 14,0 a) a massa de gás armazenado é a mesma. b) a pressão do cilindro contendo nitrogênio é maior. c) o número de moléculas é o mesmo. d) a velocidade média das moléculas dos dois gases é igual. e) a temperatura interna dos cilindros é menor que a temperatura ambiente. 0 Os principais constituintes do gás de lixo e do gás liquefeito de petróleo são, respectivamente, o metano e o butano. Comparando volumes iguais dos dois gases, nas mesmas condições de pressão e temperatura, qual deles fornecerá maior quantidade de energia da combustão? Justifique sua resposta a partir da hipótese de Avogadro para os gases. Massas molares: metano = 16 g/mol; butano = 58 g/mol Calores de combustão ( H): metano = 08 kcal/ mol; butano = 689 kcal/ mol Portal de Estudos em Química (PEQ) Página 5
6 1 (FATEC-SP) Três recipientes idênticos, fechados, I, II e III, mantidos nas mesmas condições de temperatura e pressão, contêm moléculas dos gases oxigênio (O ), monóxido de carbono (CO), e dióxido de carbono (CO ), respectivamente. O princípio de Avogadro permite-nos afirmar que o número: a) de átomos de oxigênio é maior em I. b) de átomos de carbono é maior em II. c) total de átomos é igual em II e III. d) moléculas é maior em III. e) moléculas é igual em I, II e III. (FATEC-SP) Dois recipientes A e B, de igual capacidade (V) e à mesma temperatura (T), contêm a mesma massa (m) dos gases H e Cl. A esse respeito são feitas as afirmações: I. Em ambos os recipientes, a pressão exercida pelos gases H e Cl é a mesma. II. No recipiente A, que contém H, a pressão é maior do que no recipiente B, que contém Cl. III. Embora as massas sejam iguais, o número de partículas em A é maior do que em B. É correto o que se afirma apenas em: a) I. b) I e II. c) III. d) I e III. e) II e III. 3 Usando os conceitos relacionados ao estudo dos gases, podemos afirmar CORRETAMENTE que: a) através da Lei de Boyle, é possível comprovar que, a uma temperatura constante, o volume ocupado por uma massa fixa de um gás é diretamente proporcional à pressão. b) de acordo com a Teoria Cinética Molecular dos gases, um gás é formado por moléculas em constante movimento e, em um gás ideal, não há atração nem repulsão entre as moléculas. c) pela Lei de Charles, para transformações isobáricas, o volume de um gás é inversamente proporcional à temperatura absoluta. d) pela Lei de Gay-Lussac, proposta em 180, quando uma massa variável de um gás sofre transformação isocórica, a pressão do gás será diretamente proporcional à temperatura absoluta do sistema. e) pela Hipótese de Avogadro, gases diferentes, nas mesmas condições de volume, de pressão e de temperatura, sempre apresentarão diferentes números de moléculas. Portal de Estudos em Química (PEQ) Página 6
7 4 (UNIFESP-SP) Considere recipientes com os seguintes volumes de substâncias gasosas, nas mesmas condições de pressão e temperatura. Com base no Princípio de Avogadro ("Volumes iguais de gases quaisquer, mantidos nas mesmas condições de temperatura e pressão, contêm o mesmo número de moléculas."), é possível afirmar que o número total de átomos é igual nos recipientes que contêm: a) CO e CO. b) CO e O. c) CO e C H 4. d) CO e O. e) CO e C H 4. 5 (FATEC-SP) Dois frascos de igual volume, mantidos à mesma temperatura e pressão, contêm, respectivamente, os gases X e Y. A massa do gás X é 0,34g, e a do gás Y é 0,48g. Considerando que Y é o ozônio (O 3 ), o gás X é: Dados: Massas atômicas H = 1,0; C = 1,0; N = 14,0; O = 16,0; S = 3,0 a) N b) CO c) H S d) CH 4 e) H 6 (FUVEST-SP) Têm-se três cilindros de volumes iguais e à mesma temperatura, com diferentes gases. Um deles contém 1,3kg de acetileno (C H ), o outro 1,6kg de óxido de dinitrogênio (N O) e o terceiro 1,6kg de oxigênio (O ). massas molares (g/mol): C H = 6; N O = 44; O = 3 Comparando-se as pressões dos gases nesses três cilindros, verifica-se que a) são iguais apenas nos cilindros que contêm C H e O. b) são iguais apenas nos cilindros que contêm N O e O. c) são iguais nos três cilindros. d) é maior no cilindro que contém N O. e) é menor no cilindro que contém C H. 7 (UFRGS-RS) Dois recipientes idênticos, mantidos na mesma temperatura, contêm o mesmo número de moléculas gasosas. Um dos recipientes contém hidrogênio, enquanto o outro contém hélio. Qual das afirmações abaixo está correta? (H=1, He=4) a) A massa de gás em ambos os recipientes é idêntica. b) A pressão é a mesma nos dois recipientes. c) Ambos os recipientes contêm o mesmo número de átomos. d) A massa gasosa no recipiente que contém hidrogênio é o dobro da massa gasosa no recipiente que contém hélio. e) A pressão no recipiente que contém hélio é o dobro da pressão no recipiente que contém hidrogênio. Portal de Estudos em Química (PEQ) Página 7
8 8 (UFRS-RS) Dois recipientes A e B, de paredes rígidas, apresentam iguais volumes. O recipiente A contém uma massa de hélio (He) igual a massa de metano (CH 4 ) contida no recipiente B. Inicialmente os dois gases estão a 100K. Elevando-se a temperatura do metano para 400K, sua pressão em relação ao hélio será, aproximadamente: (H=1, He=4, C=1) a) quatro vezes b) a metade c) a mesma d) o dobro e) quatro vezes maior 9 (UNESP-SP) Sabendo-se que o volume molar de um gás nas condições normais de temperatura e pressão (CNTP) é igual a,4l e que R = 0,08atm. L. K -1. mol -1, o maior número de moléculas está contido em 1,0L de a) H, nas CNTP. b) N, nas CNTP. c) H, a - 73 C e atm. d) H, a 7 C e 1 atm. e) Uma mistura equimolar de H e N, a 17 C e 1,5 atm. 30 (UFF-RJ) Tem-se uma amostra gasosa formada por um dos seguintes compostos: CH 4 ; C H 4 ; C H 6 ; C 3 H 6 ou C 3 H 8 Se g dessa amostra ocupam o volume de 4,6L à pressão de 0,5 atm e temperatura de 7 C (dado R = 0,08L.atm.K -1.mol -1 ), conclui-se que se trata do gás: Dados: Massas molares (g/mol): C = 1; H = 1 a) etano b) metano c) propano d) propeno e) eteno 31 (UFG-GO) Amadeo Avogadro sugeriu a hipótese, conhecida hoje como a lei, de que volumes iguais de gases sob as mesmas condições de pressão e temperatura, possuem o mesmo número de moléculas. Sobre a hipótese de Avogadro é correto afirmar: (H=1, C=1, Fe=56, Xe=131) (01) Dois recipientes fechados e idênticos, contendo hidrogênio e etano, a 5 C e atm de pressão interna, possuem a mesma massa. (0) O número de moléculas dos gases desses recipientes (proposição anterior) é idêntico. (04) A quarta parte do número de Avogadro de moléculas de hidrogênio estará presente num frasco de 5,6L nas CNTP. (08) Um número de Avogadro de átomos do gás xenônio possui massa igual a 1, kg. (16) Um número de Avogadro de moléculas do gás buteno possui a mesma massa que um número de átomos de ferro metálico. Soma ( ) Portal de Estudos em Química (PEQ) Página 8
9 3 (ITA-SP) Sabendo-se que a concentração de O na atmosfera ao nível do mar é 0,9% em volume. Justifique porque a afirmação adiante está CERTA ou ERRADA. "O volume molar de ar à CNTP contém 6,7g de O ". 33 (UFPR-PR) Considere os seguintes dados: - O ar atmosférico é uma mistura gasosa. Cem litros (100L) desta mistura contêm aproximadamente: 78,084% de N ; 0,948% de O ; 0,934% de Ar; 0,03% de CO e 0,00 de outros gases. - Devido aos efeitos da poluição, outros constituintes podem ser encontrados, tais como poeira, fumaça e dióxido de enxofre. - Para a separação de gases de uma mistura, utiliza-se o processo de liquefação, seguido de uma destilação fracionada. Este procedimento é empregado, por exemplo, na obtenção de O utilizado nos hospitais. - Massas atômicas: 0=16 ; C=1. Com base nesses dados, é correto afirmar que: 01) A liquefação é um processo físico e pode ser obtida com o aumento de pressão do sistema. 0) Considerando-se um balão contendo 1L de ar atmosférico a temperatura ambiente, a pressão parcial do N é menor que a pressão parcial do O. 04) Na mesma temperatura e pressão, volumes iguais de N e O irão conter o mesmo número de moléculas. 08) A 0 C e 1atm (C.N.T.P.), o volume molar de 44g de CO é 44,8L. 16) A presença de poluentes sólidos faz com que a mistura homogênea se transforme em heterogênea. Soma = ( ) 34 (UNESP-SP) Sabendo-se que o volume molar de um gás nas condições normais de temperatura e pressão (CNTP) é igual a,4l e que R = 0,08atm. L. K -1. mol -1, o maior número de moléculas está contido em 1,0L de: a) H, nas CNTP. b) N, nas CNTP. c) H, a - 73 C e atm. d) H, a 7 C e 1 atm. e) Uma mistura equimolar de H e N, a 17 C e 1,5 atm. 35 (PUCCAMP-SP) Um recipiente de 100 litros contém nitrogênio à pressão normal e temperatura de 30 C. A massa do gás, em gramas, é igual a: Dado: Volume molar dos gases a 1,0atm e 30 C=5,0L/mol a) 11 b) 56,0 c) 4,0 d) 8,0 e) 14,0 Portal de Estudos em Química (PEQ) Página 9
10 36 (FUVEST-SP) Certo refrigerante é engarrafado, saturado com dióxido de carbono (CO ) a 5 C e 1atm de CO e então fechado. Um litro desse refrigerante foi mantido algum tempo em ambiente à temperatura de 30 C. Em seguida, a garrafa foi aberta ao ar (pressão atmosférica=1atm) e agitada até praticamente todo CO sair. Nessas condições (30 C e 1atm), qual o volume aproximado de CO liberado? Dados: massa molar de CO = 44g/mol volume molar dos gases a 1atm e 30 C = 5L/mol solubilidade do CO no refrigerante a 5 C e sob 1atm de CO =3,0g/L a) 0,40 L b) 0,85 L c) 1,7 L d) 3,0 L e) 4,0 L 37 (UEL-PR) Um balão de vidro de 1 litro, com torneira, aberto ao ar foi ligado a uma "bomba de vácuo" durante algum tempo. Considerando-se que essa bomba é eficiente para baixar, a 5 C, a pressão até 10-4 mmhg, após fechar a torneira, quantos mols de oxigênio (O ) foram retirados do balão? (O que resta de ar no balão é desprezível). Dados: Volume molar dos gases a 1atm e 5 C=5L/mol Composição aproximada do ar = 80% de N e 0% de O (% em mols) a) mol b) 10 - mol c) mol d) mol e) mol 38 (PUCCAMP-SP) A massa de oxigênio necessária para encher um cilindro de capacidade igual a 5 litros, sob pressão de 10atm e a 5 C é de Dados: Massa molar do O = 3g/mol Volume molar de gás a 1atm e 5 C = 5 L/mol a) 960 g b) 30 g c) 48 g d) 3 g e) 16 g 39 (PUCCAMP-SP) Considerando 1, cabeças de gado, cada cabeça gerando anualmente cerca de 50 kg de gás metano, pode-se afirmar que o volume produzido desse gás, nas condições ambiente de temperatura e pressão, nesse tempo, é da ordem de: Dados: Massa molar do metano = 16 g/mol; Volume molar de gás nas condições ambiente = 5 L/mol a) L b) L c) L d) L e) L Portal de Estudos em Química (PEQ) Página 10
11 40 (FUVEST-SP) A efervescência observada, ao se abrir uma garrafa de champanhe, deve-se à rápida liberação, na forma de bolhas, do gás carbônico dissolvido no líquido. Nesse líquido, a concentração de gás carbônico é proporcional à pressão parcial desse gás, aprisionado entre o líquido e a rolha. Para um champanhe de determinada marca, a constante de proporcionalidade (k) varia com a temperatura, conforme mostrado no gráfico. Uma garrafa desse champanhe, resfriada a 1 C, foi aberta à pressão ambiente e 0,10 L de seu conteúdo foram despejados em um copo. Nessa temperatura, 0 % do gás dissolvido escapou sob a forma de bolhas. O número de bolhas liberadas, no copo, será da ordem de: a) 10 b) 10 4 c) 10 5 d) 10 6 e) 10 8 Dados: Gás carbônico: Pressão parcial na garrafa de champanhe fechada, a 1 C: 6 atm Massa molar: 44 g/mol Volume molar a 1 C e pressão ambiente: 4 L/mol Volume da bolha a 1 C e pressão ambiente: 6,0 x 10-8 L Portal de Estudos em Química (PEQ) Página 11
12 GABARITO 01- C 0- A 03- B 04- B 05- B 06- E 07- E 08- E 6,4 g,4 L. 3 g 4,48 L (NH ) 3g N H 3 14x + x = 3 x= X X X Por tanto, ficamos com : N H 09- C mol N mols átomos N 6.10 átomos N 4 44,8 L N...,4.10 átomos N,4 L N 1 mol N 1 mol átomos N 10-,4 L H 0,5 mol H. 5,6 L H 1 mol H g O 8 kg O. 1 mol O.,4 L O. 1 m O. 5,6 m O kg O 3 g O 1 mol O 1000 L O 1- C 13- como: m(h S)=m(fosfina), logo: n(h S)=n(fosfina), com isso: M(H S)=M(fosfina)=34g/mol L CH 1 mol CH 6.10 moléculas CH 56 ml CH... 1,5.10 moléculas CH ml CH4,4 L CH4 1 mol CH4 15- C m 0,48 Como : n(o 3) n(x), sabendo que: n(o 3) 0,01 mol O 3 M 48 m 0,34 com isso, ficamos com: n(x)=, onde: M(X)= 34 g/mol M 0,01 Sendo assim o gás X é o H S 16- D 1 mol CH 48 g CH.,4 L CH. 67, L CH g CH4 1 mol CH mol CO 17,6 g CO. 5 L CO. 10 L CO 44 g CO 1 mol CO 18- Afirmação verdadeira! 0,9 L O 1 mol O 3 g O,4 L AR... 6,7 g O 100 L AR,4 L O 1molO Portal de Estudos em Química (PEQ) Página 1
13 19- C 0- Pela Hipótese de Avogadro o número de moléculas será o mesmo. Aquele que fornecer maior quantidade de energia por mol será o butano (689kcal/mol). 1- E - E 3- B 4- E 5- C 6- A 7- B 8- C 9- C 30- C =30 3- Verdadeira. Um mol de ar contém 0,09 mol de oxigênio, portanto, 6,7g de O = C 35- A 36- C 3 g CO 1 mol CO 5 L CO 1L refrigerante... 1,7 L CO 1L refrigerante 44 g CO 1 mol CO 37- D 38- B 39- E 40- D g CO dissolvido 1 mol CO dissolvido 0, mol CO liberado 4 L CO liberado 1bolha atm bolhas.l 8 1L champanhe.1 atm 44 g CO dissolvido 1 mol CO dissolvido 1 mol CO liberado 6.10 L CO liberado 7.10 bolhas 6 0,1 L champanhe..10 bolhas 1 L champanhe Portal de Estudos em Química (PEQ) Página 13
HIPÓTESE DE AVOGADRO E VOLUME MOLAR
 HIPÓTESE DE AVOGADRO E VOLUME MOLAR EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H2, N2 e O2, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
HIPÓTESE DE AVOGADRO E VOLUME MOLAR EXERCÍCIOS DE APLICAÇÃO 01 (UFES-ES) Três balões contêm H2, N2 e O2, conforme ilustrado abaixo: Considerando-se que os gases estão sob pressão de 1 atm e à mesma temperatura,
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
Estado Gasoso. Classe: 2 2 a série. Exercícios Complementares - Recuperação Paralela PARTE A
 Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que:
 01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
QUÍMICA 2 Prof Emanuele
 QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA
 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2
 QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
Pressão (mmhg) T (K) x 12 5
 GASES IDEAIS 1- (UNIFOR) Para que a relação matemática P 1 V 1 = P 2 V 2, conhecida como Lei de Boyle para as transformações gasosas, seja válida é necessário que: I. A massa do gás seja constante II.
GASES IDEAIS 1- (UNIFOR) Para que a relação matemática P 1 V 1 = P 2 V 2, conhecida como Lei de Boyle para as transformações gasosas, seja válida é necessário que: I. A massa do gás seja constante II.
Qui. Semana. Allan Rodrigues Gabriel Pereira (Renan Micha)
 Qui. Semana 8 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Qui. Semana 8 Allan Rodrigues Gabriel Pereira (Renan Micha) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Revisão para a prova (Gases) Questão 01 - (ACAFE SC/2017) Baseado nos conceitos sobre os gases,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Revisão para a prova (Gases) Questão 01 - (ACAFE SC/2017) Baseado nos conceitos sobre os gases,
Deve-se esperar uma redução na velocidade de rotação do hidrômetro em dias frios.
 01. Considere que dez litros de cada um dos seguintes gases estão nas mesmas condições de pressão e temperatura: PH 3, C 2 H 6 O, H 2, NH 3, Ne, Cl 2 e SO 2. A alternativa que apresenta corretamente os
01. Considere que dez litros de cada um dos seguintes gases estão nas mesmas condições de pressão e temperatura: PH 3, C 2 H 6 O, H 2, NH 3, Ne, Cl 2 e SO 2. A alternativa que apresenta corretamente os
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
b) Tendo em conta a conclusão de Avogadro, selecione a opção que completa corretamente a frase seguinte. Em condições PTN,...
 QUESTÕES DE EXAME 4 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 4 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS
 GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
Química Prof. Giacometto
 Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
QUÍMICA 2 Prof Emanuele
 QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS 1 RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Se um dentista usou em seu trabalho 30 mg de amálgama de prata, cujo teor em prata é de 72% (em massa), o número de
QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS 1 RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Se um dentista usou em seu trabalho 30 mg de amálgama de prata, cujo teor em prata é de 72% (em massa), o número de
Química B Extensivo V. 7
 Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
QUÍMICA - 3 o ANO MÓDULO 18 ESTUDO DOS GASES
 QUÍMICA - 3 o ANO MÓDULO 18 ESTUDO DOS GASES m m 1 = 2 mol mol 1 2 No que se refere à composição em volume da atmosfera terrestre há 2,5 bilhões de anos, Como pode cair no enem (ENEM) As áreas numeradas
QUÍMICA - 3 o ANO MÓDULO 18 ESTUDO DOS GASES m m 1 = 2 mol mol 1 2 No que se refere à composição em volume da atmosfera terrestre há 2,5 bilhões de anos, Como pode cair no enem (ENEM) As áreas numeradas
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
Qui. Semana. Allan Rodrigues Gabriel Pereira (Victor Pontes)
 Semana 8 Allan Rodrigues Gabriel Pereira (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
Semana 8 Allan Rodrigues Gabriel Pereira (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados.
11/08/2014. Lei de Avogadro. Equação de Clayperon. CNTP 1 atm 0 C 273K
 Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
EXERCÍCIOS DE APLICAÇÃO
 Equilíbrio Químico EXERCÍCIOS DE APLICAÇÃO 01 (PUC-RS) Dada a expressão da constante de equilíbrio em termos de concentração de produtos e reagentes a equação química que pode ser representada por essa
Equilíbrio Químico EXERCÍCIOS DE APLICAÇÃO 01 (PUC-RS) Dada a expressão da constante de equilíbrio em termos de concentração de produtos e reagentes a equação química que pode ser representada por essa
AULA 05: Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa do carbono-12.
 SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
s e s a G a ic ím u Q G. A 1 P
 1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I
 Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
EXERCÍCIOS DE APLICAÇÃO
 Mistura Gasosa EXERCÍCIOS DE APLICAÇÃO 01 (EFEI-MG) Um mergulhador, numa profundidade de 76 000 metros, está sob uma pressão de 8,380 atmosferas. Qual deve ser a porcentagem em mol de oxigênio em um cilindro
Mistura Gasosa EXERCÍCIOS DE APLICAÇÃO 01 (EFEI-MG) Um mergulhador, numa profundidade de 76 000 metros, está sob uma pressão de 8,380 atmosferas. Qual deve ser a porcentagem em mol de oxigênio em um cilindro
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
a) Avogadro. d) Boyle. b) Dalton. e) Lavoisier. c) Gay - Lussac.
 01) (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme mostra o diagrama abaixo. Sabendo-se que a transformação de A para B ocorre à temperatura constante,
01) (FEI-SP) Certa massa de um gás perfeito sofre transformação de A para B e de B para C, conforme mostra o diagrama abaixo. Sabendo-se que a transformação de A para B ocorre à temperatura constante,
IX OSEQUIM - Olimpíada Sergipana de Química 2ª Etapa - Modalidade B
 Bom dia aluno! Está é a prova da segunda etapa da IX OSEQUIM, Olimpíada Sergipana de Química, modalidade B, para alunos que se encontram cursando o 2º. Ano do ensino médio em 2015. Confira se a sua prova
Bom dia aluno! Está é a prova da segunda etapa da IX OSEQUIM, Olimpíada Sergipana de Química, modalidade B, para alunos que se encontram cursando o 2º. Ano do ensino médio em 2015. Confira se a sua prova
Professora Talita Marcília Lista de Exercícios
 assa Atômica 1. (Unimontes 2014) O cloro presente no PVC tem dois isótopos estáveis. O cloro-35, com massa 34,97u, constitui 75,77% do cloro encontrado na natureza. O outro isótopo é o cloro-37, de massa
assa Atômica 1. (Unimontes 2014) O cloro presente no PVC tem dois isótopos estáveis. O cloro-35, com massa 34,97u, constitui 75,77% do cloro encontrado na natureza. O outro isótopo é o cloro-37, de massa
Estequiometria. Mestranda: Daniele Potulski Disciplina: Química da madeira I
 Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
QUESTÕES DE EXAME 4. Física e Química A. Domínio 2 - Propriedades e transformações da matéria. 2.2 Gases e dispersões
 QUESTÕES DE EXAME 4 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 4 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
Equação de estado de um gás ideal e conseqüências - Aprofundamento
 Equação de estado de um gás ideal e conseqüências - Aprofundamento 01. (Faap) Numa embalagem plástica de volume 2 litros, que pode suportar uma pressão interna de até 5 atm, foi embalado a vácuo um sólido
Equação de estado de um gás ideal e conseqüências - Aprofundamento 01. (Faap) Numa embalagem plástica de volume 2 litros, que pode suportar uma pressão interna de até 5 atm, foi embalado a vácuo um sólido
ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO ESTUDOS INDEPENDENTES DE RECUPERAÇÃO RESOLUÇÃO SEE Nº 2
 ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO ESTUDOS INDEPENDENTES DE RECUPERAÇÃO RESOLUÇÃO SEE Nº 2.197, DE 26 DE OUTUBRO DE 2012 ANO 2014 / 2015 PROFESSOR (a) Orlando DISCIPLINA
ESCOLA ESTADUAL DR JOSÉ MARQUES DE OLIVEIRA PLANO INDIVIDUAL DE ESTUDO ESTUDOS INDEPENDENTES DE RECUPERAÇÃO RESOLUÇÃO SEE Nº 2.197, DE 26 DE OUTUBRO DE 2012 ANO 2014 / 2015 PROFESSOR (a) Orlando DISCIPLINA
MASSA ATÔMICA. 1u corresponde a 1, g, que equivale aproximadamente à massa de um próton ou de um nêutron.
 Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
Cálculos Químicos MASSA ATÔMICA Na convenção da IUPAC (União Internacional de Química Pura e Aplicada) realizada em 1961, adotou-se como unidade padrão para massa atômica o equivalente a 1/12 da massa
Lista de Exercícios - Professor facebook.com/profrodrigoartuso. Grandezas Químicas e Estequiometria
 Grandezas Químicas e Estequiometria Criando base 1 - Em 100 gramas de alumínio, quantos átomos deste elemento estão presentes? Dados: M(Al) = 27 g/mol 1 mol = 6,02 x 10 23 átomos a) 3,7 x 10 23 b) 27 x
Grandezas Químicas e Estequiometria Criando base 1 - Em 100 gramas de alumínio, quantos átomos deste elemento estão presentes? Dados: M(Al) = 27 g/mol 1 mol = 6,02 x 10 23 átomos a) 3,7 x 10 23 b) 27 x
GASES. Maira Gazzi Manfro e Giseli Menegat
 GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
Exercícios: gases (2)
 Química Ficha 8 2 os anos Rodrigo abril/12 Nome: Nº: Turma: Exercícios: gases (2) 1) (Unicamp) Após a limpeza do banheiro, Rango foi à sala e removeu todos os móveis e, de tão feliz e apaixonado, começou
Química Ficha 8 2 os anos Rodrigo abril/12 Nome: Nº: Turma: Exercícios: gases (2) 1) (Unicamp) Após a limpeza do banheiro, Rango foi à sala e removeu todos os móveis e, de tão feliz e apaixonado, começou
GASES. QUIMICA II a Unidade
 GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2014 TRABALHO DE ESTUDOS INDEPENDENTES DE JANEIRO/2015 2ºCN Nome Nº
 ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2014 TRABALHO DE ESTUDOS INDEPENDENTES DE JANEIRO/2015 2ºCN Nome Nº Data Nota 2º eja Disciplina Química Prof Orlando Valor 30 1. (Ufpb) Em uma partida
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2014 TRABALHO DE ESTUDOS INDEPENDENTES DE JANEIRO/2015 2ºCN Nome Nº Data Nota 2º eja Disciplina Química Prof Orlando Valor 30 1. (Ufpb) Em uma partida
LISTA 02 - TEORIA ATÔMICA MOLECULAR
 LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
LISTA 02 - TEORIA ATÔMICA MOLECULAR 1º ano QUÍMICA PROF. PEDRO 2º Bimestre Questão 01) A massa de uma molécula de ácido acético, CH 3 COOH, é: a) 1,0. 10-21 g b) 1,0. 10-22 g c) 1,0. 10-23 g d) 1,0. 10-24
IME º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 IME - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. DETERMINE: A) A porcentagem em massa de vanádio
IME - 2003 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. DETERMINE: A) A porcentagem em massa de vanádio
numérico é: a) H 2 CO 3 b) H 4 P 2 O 7 c) C 6 H 12 O 6 d) Al 2 (SO 4 ) 3 e) Fe 2 (CO 3 ) 3 f) Ca 3 (PO 4 ) 2 g) (NH 4 ) 2 S
 Constante de Avogadro (antigamente chamada número de Avogadro é o número de átomos de 1 C contidos em 0,01 kg de 1 C. Seu valor numérico é: Cálculos Químicos Massa atômica, massa molecular e mol átomo
Constante de Avogadro (antigamente chamada número de Avogadro é o número de átomos de 1 C contidos em 0,01 kg de 1 C. Seu valor numérico é: Cálculos Químicos Massa atômica, massa molecular e mol átomo
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor dessa pressão em atm e kpa?
 EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
EB: QUÍMICA GERAL/ EQB: QUÍMICA GERAL I Capítulo 5. Gases Ficha de Exercícios 1. Converta 562 mmhg em atm. 2. A pressão atmosférica no cume do monte McKinley é 606 mmhg num determinado dia. Qual é o valor
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE
 Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
Solubilidade, estequiometria, misturas e gases
 Solubilidade, estequiometria, misturas e gases 1) O cientista italiano Amedeo Avogadro, na tentativa de compreender relações de volumes nas reações dos gases, propôs uma hipótese, estabelecendo que (CNTP
Solubilidade, estequiometria, misturas e gases 1) O cientista italiano Amedeo Avogadro, na tentativa de compreender relações de volumes nas reações dos gases, propôs uma hipótese, estabelecendo que (CNTP
Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. Determine: a) a porcentagem em massa de vanádio nesse mineral;
 1 a QUESTÃO Valor 1,0 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. Determine: a) a porcentagem em massa de vanádio nesse mineral; b) a massa em gramas de vanádio numa
1 a QUESTÃO Valor 1,0 Uma fonte de vanádio é o mineral vanadinita, cuja fórmula é Pb 5 (VO 4 ) 3 Cl. Determine: a) a porcentagem em massa de vanádio nesse mineral; b) a massa em gramas de vanádio numa
ESTUDOS INDEPENTES DE RECUPERAÇÃO QUÍMICA-2ºANO TRABALHO DE RECUPERAÇÃO
 ESTUDOS INDEPENTES DE RECUPERAÇÃO QUÍMICA-2ºANO TRABALHO DE RECUPERAÇÃO 2 ANO EM 1)Considere as reações abaixo e marque a alternativa que indica corretamente as reações endotérmicas: I. CH4(g) + 2 O2(g)
ESTUDOS INDEPENTES DE RECUPERAÇÃO QUÍMICA-2ºANO TRABALHO DE RECUPERAÇÃO 2 ANO EM 1)Considere as reações abaixo e marque a alternativa que indica corretamente as reações endotérmicas: I. CH4(g) + 2 O2(g)
Professora Sonia Equação de estado de um gás ideal (Clapeyron) e densidade
 Equação de estado de um gás ideal (Clapeyron) e densidade 01. (UFF) O hélio, depois do hidrogênio, é o gás mais leve que existe. Dentre suas diversas aplicações, é utilizado para encher balões que transportam
Equação de estado de um gás ideal (Clapeyron) e densidade 01. (UFF) O hélio, depois do hidrogênio, é o gás mais leve que existe. Dentre suas diversas aplicações, é utilizado para encher balões que transportam
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
Prof. Msc. João Neto
 Prof. Msc. João Neto Massa atômica Prof. Msc. João Neto 2 1u = 1,66x -24 g Prof. Msc. João Neto 3 Prof. Msc. João Neto 4 Massa atômica: massa de um átomo Prof. Msc. João Neto 5 Isótopos: átomos de mesmo
Prof. Msc. João Neto Massa atômica Prof. Msc. João Neto 2 1u = 1,66x -24 g Prof. Msc. João Neto 3 Prof. Msc. João Neto 4 Massa atômica: massa de um átomo Prof. Msc. João Neto 5 Isótopos: átomos de mesmo
1ª Parte: Questões resolvidas
 ANÁLISE ELEMENTAR QUANTITATIVA DISCIPLINA: QUÍMICA GERAL / TURMA: 1º ano Ensino Médio 1ª Parte: Questões resolvidas Nota: A massa molecular de um composto, pode ser calculada em função da densidade de
ANÁLISE ELEMENTAR QUANTITATIVA DISCIPLINA: QUÍMICA GERAL / TURMA: 1º ano Ensino Médio 1ª Parte: Questões resolvidas Nota: A massa molecular de um composto, pode ser calculada em função da densidade de
Professor Marcus Ennes. -Estequiometria
 Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
Professor Marcus Ennes -Estequiometria - RELAÇÕES FUNDAMENTAIS RAZÃO E PROPORÇÃO 1) Um formigueiro é composto por 2.000 formigas. Cada formiga consome por dia, 1.500 moléculas de glicose (C 6 H 12 O 6
MÓDULOS 25 e 26 QUÍMICA. Equação de Estado Leis dos Gases Densidade dos Gases. Ciências da Natureza, Matemática e suas Tecnologias
 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos Gases 1. Equação de Estado do Gás É uma equação que relaciona a pressão do gás (), o volume do
Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos Gases 1. Equação de Estado do Gás É uma equação que relaciona a pressão do gás (), o volume do
EXERCÍCIOS DE APLICAÇÃO
 Equação do Gás Ideal EXERCÍCIOS DE APLICAÇÃO 01 (UFSCar-SP) Tem-se 0,8 mol de um gás ideal, ocupando o volume de 8,2 litros. Sabendo que a pressão exercida é de 5 atm, calcule em que temperatura o gás
Equação do Gás Ideal EXERCÍCIOS DE APLICAÇÃO 01 (UFSCar-SP) Tem-se 0,8 mol de um gás ideal, ocupando o volume de 8,2 litros. Sabendo que a pressão exercida é de 5 atm, calcule em que temperatura o gás
2º ano FÍSICA Prof. Márcio Marinho DIAGRAMA DE FASES E GASES PERFEITOS
 DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
Equação de estado de um gás ideal e misturas gasosas
 Equação de estado de um gás ideal e misturas gasosas 01. Prove que a soma das frações molares de uma mistura gasosa é igual a 1. 02. Defina a pressão parcial de um gás. 03. Defina o volume parcial de um
Equação de estado de um gás ideal e misturas gasosas 01. Prove que a soma das frações molares de uma mistura gasosa é igual a 1. 02. Defina a pressão parcial de um gás. 03. Defina o volume parcial de um
Resolução de Questões de Provas Específicas de Química (Aula 7)
 Resolução de Questões de Provas Específicas de Química (Aula 7) Resolução de Questões de Provas Específicas (Aula 7) 1. (UECE) A tabela periódica já era objeto das preocupações dos antigos químicos a partir
Resolução de Questões de Provas Específicas de Química (Aula 7) Resolução de Questões de Provas Específicas (Aula 7) 1. (UECE) A tabela periódica já era objeto das preocupações dos antigos químicos a partir
02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a
![02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a 02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a](/thumbs/48/23999624.jpg) 01)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a variação de entalpia é [3] que zero. Completa-se corretamente essa frase substituindo-se
01)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a variação de entalpia é [3] que zero. Completa-se corretamente essa frase substituindo-se
O ESTADO GASOSO - CARACTERÍSTICAS GERAIS
 Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
ATMOSFERA Temperatura, pressão, densidade e volume molar
 ATMOSFERA Temperatura, pressão, densidade e volume molar As camadas na atmosfera são: Troposfera. Estratosfera. Mesosfera Termosfera Exosfera A variação da temperatura com a altitude permite definir 5
ATMOSFERA Temperatura, pressão, densidade e volume molar As camadas na atmosfera são: Troposfera. Estratosfera. Mesosfera Termosfera Exosfera A variação da temperatura com a altitude permite definir 5
FUVEST 1991 Primeira fase e Segunda fase
 FUVEST 1991 Primeira fase e Segunda fase CNHECIMENTS GERAIS 01. ar gás carbônico naftaleno iodo latão ouro 18 quilates Se esses materiais forem classificados em substâncias puras e misturas, pertencerão
FUVEST 1991 Primeira fase e Segunda fase CNHECIMENTS GERAIS 01. ar gás carbônico naftaleno iodo latão ouro 18 quilates Se esses materiais forem classificados em substâncias puras e misturas, pertencerão
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
QUÍMICA GERAL PROF. PAULO VALIM
 QUÍMICA GERAL PROF. PAULO VALIM 3 QUANTIDADADES E MEDIDAS Gás Nobre para catalisar sua reação, vamos disponibilizar alguns exercícios com gabarito ao final de cada capítulo de estudo. Eles não fazem parte
QUÍMICA GERAL PROF. PAULO VALIM 3 QUANTIDADADES E MEDIDAS Gás Nobre para catalisar sua reação, vamos disponibilizar alguns exercícios com gabarito ao final de cada capítulo de estudo. Eles não fazem parte
MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINHONHA E MUCURI
 UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINONA E MUCURI PROVA DE QUÍMICA Questão 01 Um recipiente de volume desconhecido V contém um gás ideal sob pressão de 760 torr. Uma válvula reguladora é aberta, permitindo
UNIVERSIDADE FEDERAL DOS VALES DO JEQUITINONA E MUCURI PROVA DE QUÍMICA Questão 01 Um recipiente de volume desconhecido V contém um gás ideal sob pressão de 760 torr. Uma válvula reguladora é aberta, permitindo
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
GOIÂNIA, / / PROFESSORA: Núbia de Andrade. DISCIPLINA:Química SÉRIE: 1º. ALUNO(a):
 GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 1º ALUNO(a): Lista de Recuperação Semestral No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 1º ALUNO(a): Lista de Recuperação Semestral No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 3ª Etapa 2014 Disciplina: QUÍMICA Série: 1ª Professora: Maria Luiza Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 3ª Etapa 2014 Disciplina: QUÍMICA Série: 1ª Professora: Maria Luiza Turma: FG Caro aluno, você está recebendo o conteúdo de recuperação.
VII Olimpíada Catarinense de Química Etapa I - Colégios
 VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
VII Olimpíada Catarinense de Química 2011 Etapa I - Colégios Fonte: Chemistryland Segunda Série 1 01 200 ml de uma solução de hidróxido de alumínio são diluídos em água destilada até a sua concentração
TERMOQUÍMICA. 1 Fenômenos endotérmicos e exotérmicos
 TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
1. (Fuvest modificado) Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química:
 Química Avaliação Mensal 3 os anos Décio e Vivian mar/12 Nome: Nº: Turma: GABARITO PROVA MENSAL 1º BIMESTRE 1. (Fuvest 2012 - modificado) Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação
Química Avaliação Mensal 3 os anos Décio e Vivian mar/12 Nome: Nº: Turma: GABARITO PROVA MENSAL 1º BIMESTRE 1. (Fuvest 2012 - modificado) Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação
Exercícios de Revisão Ensino Médio 2º Bimestre Química: Setor A 1ª Série Professor Diego
 Exercícios de Revisão Ensino Médio 2º Bimestre Química: Setor A 1ª Série Professor Diego 1. (UFES) Na perfuração de uma jazida petrolífera, a pressão dos gases faz com que o petróleo jorre para fora. Ao
Exercícios de Revisão Ensino Médio 2º Bimestre Química: Setor A 1ª Série Professor Diego 1. (UFES) Na perfuração de uma jazida petrolífera, a pressão dos gases faz com que o petróleo jorre para fora. Ao
1 a Questão: Valor : 1,0 FOLHA DE DADOS. I ) Entalpias de Formação (H o f ) H 2. O (líquida) = - 68,3 kcal / mol. CO 2 (gasoso) = - 94,1 kcal / mol
 PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
PROVA DE QUÍMICA DO VESTIBULAR 96/97 DO INSTITUTO MILITAR DE ENGENHARIA (04/12/96) FOLHA DE DADOS I ) Entalpias de Formação (H o f ) H 2 O (líquida) = - 68,3 kcal / mol CO 2 (gasoso) = - 94,1 kcal / mol
Gases. 1) Assinale a alternativa CORRETA.
 Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
Gases 1) Assinale a alternativa CORRETA. (A) Uma determinada massa de gás ideal, ocupando um volume constante, tem sua pressão inversamente proporcional à sua temperatura absoluta. (B) Em uma transformação
C (grafite) + 2 H 2(g) + ½ O 2(g) CH 3 OH (l) + 238,6 kj. CO 2(g) C (grafite) + O 2(g) 393,5 kj. H 2(g) + ½ O 2(g) H 2 O (l) + 285,8 kj
 Questão 1 (PUC SP) Num calorímetro de gelo, fizeram-se reagir 5,400 g de alumínio (Al) e 16,000 g de óxido férrico, Fe 2 O 3. O calorímetro continha, inicialmente, 8,000 Kg de gelo e 8,000 Kg de água.
Questão 1 (PUC SP) Num calorímetro de gelo, fizeram-se reagir 5,400 g de alumínio (Al) e 16,000 g de óxido férrico, Fe 2 O 3. O calorímetro continha, inicialmente, 8,000 Kg de gelo e 8,000 Kg de água.
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS DE RECUPERAÇÃO PARCIAL 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM)
 NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
RELAÇÕES DE MASSA E MOL
 RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
EXPERIÊNCIA 2 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO
 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
ESTEQUIOMETRIA. 1. Introdução
 ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
ESTEQUIOMETRIA 1. Introdução A palavra estequiometria vem do grego stoikheion (elemento) e metriā (medida). A estequiometria baseia-se na Lei da Conservação das Massas e na Lei das Proporções Definidas
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
Professora Sonia IME 1972 FOLHA DE DADOS
 IME 1972 FOLHA DE DADOS Constante dos Gases Perfeitos cal atm L R 2,0 0,082 mol K mol K Pesos atômicos H 1,008; He 4,0026; O 16,000; Zn 65,4; Cu 6,5; I 127; C 5,5; Na 2,0; Ca 40,0; P 1,0; Ag 107,9; K 9,1.
IME 1972 FOLHA DE DADOS Constante dos Gases Perfeitos cal atm L R 2,0 0,082 mol K mol K Pesos atômicos H 1,008; He 4,0026; O 16,000; Zn 65,4; Cu 6,5; I 127; C 5,5; Na 2,0; Ca 40,0; P 1,0; Ag 107,9; K 9,1.
Combustíveis Energia e Ambiente. Combustíveis gasosos, líquidos e sólidos: compreender as diferenças
 Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Lista de Exercício Para a Prova Trimestral Setor A. 1- Um elemento X apresenta os seguintes isótopos:
 Disciplina: Química Professor: Cássio Pacheco 1 Ano Lista de Exercício Para a Prova Trimestral Setor A 1- Um elemento X apresenta os seguintes isótopos: 40 X 80% 42 X 15% 44 X 5% Qual a massa atômica de
Disciplina: Química Professor: Cássio Pacheco 1 Ano Lista de Exercício Para a Prova Trimestral Setor A 1- Um elemento X apresenta os seguintes isótopos: 40 X 80% 42 X 15% 44 X 5% Qual a massa atômica de
Luis Eduardo C. Aleotti. Química. Aula 38 - Transformações Gasosas
 Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
O aluno deverá elaborar resumos teóricos dos textos do livro e de outras fontes sobre os tópicos do conteúdo.
 Disciplina QUÍMICA Curso ENSINO MÉDIO Professor GUILHERME Série 1ª SÉRIE ROTEIRO DE ESTUDOS DE RECUPERAÇÃO E REVISÃO 1º SEMESTRE / 2012 Aluno (a): Número: 1 - Conteúdo: Ácidos e bases propriedades, conceito
Disciplina QUÍMICA Curso ENSINO MÉDIO Professor GUILHERME Série 1ª SÉRIE ROTEIRO DE ESTUDOS DE RECUPERAÇÃO E REVISÃO 1º SEMESTRE / 2012 Aluno (a): Número: 1 - Conteúdo: Ácidos e bases propriedades, conceito
EXERCÍCIOS DE APLICAÇÃO
 EQUAÇÃO DO GÁS IDEAL EXERCÍCIOS DE APLICAÇÃO 01 (UFSCar-SP) Tem-se 0,8 mol de um gás ideal, ocupando o volume de 8,2 litros. Sabendo que a pressão exercida é de 5 atm, calcule em que temperatura o gás
EQUAÇÃO DO GÁS IDEAL EXERCÍCIOS DE APLICAÇÃO 01 (UFSCar-SP) Tem-se 0,8 mol de um gás ideal, ocupando o volume de 8,2 litros. Sabendo que a pressão exercida é de 5 atm, calcule em que temperatura o gás
Química. 01. Quantos prótons há na espécie química (A) 2 (D) 32 (B) 28 (E) 60 (C) 30
 Química 01. Quantos prótons há na espécie química (A) 2 (D) 32 (B) 28 (E) 60 (C) 30 02. Para que um átomo de número atômico 55 e número de massa 137 seja eletricamente neutro, ele deverá ter, necessariamente:
Química 01. Quantos prótons há na espécie química (A) 2 (D) 32 (B) 28 (E) 60 (C) 30 02. Para que um átomo de número atômico 55 e número de massa 137 seja eletricamente neutro, ele deverá ter, necessariamente:
LISTA DE EXERCÍCIOS DE RECUPERAÇÃO 1º TRIMESTRE QUÍMICA
 LISTA DE EXERCÍCIOS DE RECUPERAÇÃO 1º TRIMESTRE QUÍMICA ALUNO(a): Nº: SÉRIE: 2ª TURMA: UNIDADE: VV JC JP PC DATA: / /2017 Obs.: Esta lista deve ser entregue resolvida no dia da prova de recuperação. Valor:
LISTA DE EXERCÍCIOS DE RECUPERAÇÃO 1º TRIMESTRE QUÍMICA ALUNO(a): Nº: SÉRIE: 2ª TURMA: UNIDADE: VV JC JP PC DATA: / /2017 Obs.: Esta lista deve ser entregue resolvida no dia da prova de recuperação. Valor:
COLÉGIO DA POLÍCIA MILITAR
 COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS
 ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
Equilíbrio Químico. início x 2x 0 0
 Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
EXERCÍCIOS DE APLICAÇÃO
 Densidade dos Gases EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Um gás, que está inicialmente a uma pressão de 1 atm e temperatura de 273 K, sofre uma transformação de estado adquirindo uma pressão de 3 atm e
Densidade dos Gases EXERCÍCIOS DE APLICAÇÃO 01 (FEI-SP) Um gás, que está inicialmente a uma pressão de 1 atm e temperatura de 273 K, sofre uma transformação de estado adquirindo uma pressão de 3 atm e
Termoquímica. Química 10/08/2015. Enem 15 Semanas. 1. Observando o diagrama a seguir, é correto afirmar que:
 Termoquímica 1. Observando o diagrama a seguir, é correto afirmar que: [Dadas as massas molares (g/mol): H=1 e O=16] a) para vaporizar 18g de água são liberados 10,5 kcal. b) o calor de reação, na síntese
Termoquímica 1. Observando o diagrama a seguir, é correto afirmar que: [Dadas as massas molares (g/mol): H=1 e O=16] a) para vaporizar 18g de água são liberados 10,5 kcal. b) o calor de reação, na síntese
