Estudo dos gases. Profa. Kátia Aquino
|
|
|
- Carmem Bergmann Gusmão
- 7 Há anos
- Visualizações:
Transcrição
1 Estudo dos gases Profa. Kátia Aquino
2 Vapor ou Gás? O CO2 um gás Vapor de água Industrias em Yokohama-Japão: O homem injeta somente 3% de todo CO2. (foto:paul Davdson) O calor liberado na condensação do vapor de água dá ao furacão a sua potência. (Fonte: ) (Fonte: Remover frame )
3 As transformações gasosas e a história Os principais cientistas que estudaram as transformações gasosas relacionadas às variáveis dos gases como volume, pressão e temperatura foram Charles, Boyle e Gay-Lussac (da esquerda para a direita, na figura acima)
4 Transformação isotérmica T=cte (Fonte: )
5 Transformação isobárica P=cte (Fonte: ) (Fonte: )
6 Transformação isométrica (ou isovolumétrica ou isocórica) V=cte (Fonte: ) (Fonte: )
7 Equação Geral dos Gases
8 Gás Real e Gás Ideal Gás ideal segue a teoria cinética dos gases: 1) um gás está em constante movimento desordenado e ininterrupto; 2) As moléculas do gás em questão estão bastante distanciadas, o que existe um imenso vazio entre elas; 3) Um gás dentro de um recipiente descreve um movimento retilíneo uniforme. Os choques entre as moléculas do gás e a parede do recipiente e entre as próprias moléculas (colisões) são completamente elásticos, isto é, não há perda de energia cinética durante estes choques ou colisões. 4) Não há interação ou atração entre as moléculas dos gases. Choque elástico Um gás real tende a ideal quando a pressão diminui e a temperatura aumenta. (Fonte: labfisica-cefetmg.zip.net/images/11.png )
9 Equação de Clapeyron Benoit Paul Emile Clapeyron ( ) (fonte: ) PV=nRT onde: R=constate dos gases 0,082 atm.l/mol.k ou 62,3 mmhg.l/mol.k Constante Universal dos Gases: 8,31 J/mol.K
10 Volume molar Condições normais de temperatura e pressão (CNTP) T=0 C ou 273K P=1 atm ou 760 mmhg Nas CNTP 1 mol de qualquer gás ocupa o volume de aproximados 22,4 L
11 Pressão parcial de um gás Lei de Dalton Ptotal= soma das pressões parciais (Fonte: Sendo: na-número de mol XA= fração molar PA=pressão parcial P=Pressão total
12 Densidade de um gás d = P MM R T MMar=29 g/mol T( C) d em kg/m³ P= 1atm (Fonte:
13 Efusão e Difusão gasosa Difusão é a propriedade que todos os gases têm de se misturar espontaneamente com outros gases resultando em misturas ou soluções homogêneas. Efusão é a propriedade que os gases têm de passar através de pequenos orifícios.
14 Efusão Efusão no corpo humano He N2 Alvéolos: o oxigênio passa do ar para o sangue e o gás carbônico do sangue para o ar. (Fonte: ) (Fonte: )
15 Lei da efusão ou difusão de Graham Relação entre as velocidades entre dois gases
16 Por que há efusão no......co2 da bola de festa...ar do pneu? (vendas.goodyear.com.br/upload/pneueaglenct5gr.jpg ) MMar = 29 g/mol (images.quebarato.com.br/.../big/3/e/580c3e_1.jpg ) MMCO2 = 44 g/mol
17 Uma curiosidade envolvendo Por que as pipocas estouram? vapor A "explosão" de um grão de pipoca quando aquecido é o resultado da combinação de 3 características: 1. O interior do grão (endosperma) contém, além do amido, cerca de 14% de água. 2. O endosperma é um excelente condutor de calor. 3. O exterior do grão (pericarpo) apresenta grande resistência mecânica e raramente possui falhas (rachaduras). Quando aquecido intensamente, a água no endosperma sofre vaporização, criando uma grande pressão dentro do grão. O pericarpo atua como uma panela de pressão, evitando a saída do vapor de água até que uma certa pressão limite seja atingida. Neste ponto, ocorrem duas coisas: o grão explode, com som característico (pop!) e o amido do endosperma incha abruptamente, criando aquela textura macia. Hummm... bateu uma vontade de comer pipoca!!! (Fonte: Revista QMC Web
18 Vamos aplicar o conhecimento
19 (OBQ) Durante a II Guerra Mundial desenvolveu-se uma técnica de enriquecimento de urânio, baseada na Lei de Graham. Para separar 235 U do isótopo mais abundante, 238 U, todo o urânio era transformado em um fluoreto (UF x ), cujo ponto de ebulição é 56 C e, a partir das diferenças de velocidades na efusão dos dois fluoretos ( 235 UF x e 238 UF x ), ocorria a separação. Sabendo que a velocidade de efusão do 238 UF x é de 17,7 mg/h e, nas mesmas condições, a velocidade de efusão do I 2 é de 15 mg/h, determine o valor de "x" no 238 UF x
20 Resposta Existe uma inconsistência no enunciado da questão. Sabe-se que moléculas mais leves possuem maior velocidade de efusão do que moléculas mais pesadas. No caso o I 2 é mais leve do que o 238 UF x basta observar as massas molares abaixo. Logo houve uma troca nos valores das velocidades associadas a cada molécula. Considerando então que : Massa molar do I=127 g/mol Massa molar do F= 19 g/mol Logo: I 2 = 254 g/mol 238 UF x = ( x) g/mol Pela lei de Graham temos: Temos então: 238 UF 6 V1 (I 2 )=17,7 mg/h mais leve V2 ( 238 UF x )=15 mg/h mais pesado ou hexafluoreto de urânio
21 Bons estudos!
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Luis Eduardo C. Aleotti. Química. Aula 38 - Transformações Gasosas
 Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana.
 Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Estequiometria. Mestranda: Daniele Potulski Disciplina: Química da madeira I
 Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
QUÍMICA. Transformações Químicas. Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Princípio de Avogadro Parte 4
 QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
QUÍMICA Transformações Químicas Sistemas Gasosos Lei, Teoria Cinética, Equação e Mistura dos Gases Parte 4 Prof a. Giselle Blois Dúvida: O ar é um gás?! Resposta: Não, o ar é uma MISTURA DE GASES. Composição:
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que:
 01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
01) (UPE-2011-Q1) Em relação à teoria cinética molecular dos gases, é CORRETO afirmar que: a) a energia cinética média de um conjunto de moléculas de um gás depende, apenas e exclusivamente, das massas
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
GASES. QUIMICA II a Unidade
 GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
Fís. Professor: Leo Gomes Monitor: Guilherme Brigagão. Fís
 . Semana 18 Professor: Leo Gomes Monitor: Guilherme Brigagão Gases perfeitos 21 jun RESUMO Gases perfeitos ou ideais são aqueles cujas moléculas se movem ao acaso, todas com a mesma velocidade média, cujas
. Semana 18 Professor: Leo Gomes Monitor: Guilherme Brigagão Gases perfeitos 21 jun RESUMO Gases perfeitos ou ideais são aqueles cujas moléculas se movem ao acaso, todas com a mesma velocidade média, cujas
ESTUDOS DOS GASES. * Um dos estados físicos da matéria, com mais energia.
 ESTUDOS DOS GASES O QUE É UM GÁS??? * Um dos estados físicos da matéria, com mais energia. * Não possui forma nem volume definido. * Apresenta uma estrutura desorganizada. * É considerado um fluido por
ESTUDOS DOS GASES O QUE É UM GÁS??? * Um dos estados físicos da matéria, com mais energia. * Não possui forma nem volume definido. * Apresenta uma estrutura desorganizada. * É considerado um fluido por
O ESTADO GASOSO - CARACTERÍSTICAS GERAIS
 Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA
 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
GASES. Maira Gazzi Manfro e Giseli Menegat
 GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
GASES Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br Características dos Gases São menos densos que os sólidos e os líquidos; Sempre se misturam entre
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
Gases. Teoria cinética
 Gases Teoria cinética Para os gases, muitas propriedades podem ser explicadas com o auxílio de um modelo microscópico muito rudimentar, criado quase um século antes da teoria atômica. Em 1738, o suíço
Gases Teoria cinética Para os gases, muitas propriedades podem ser explicadas com o auxílio de um modelo microscópico muito rudimentar, criado quase um século antes da teoria atômica. Em 1738, o suíço
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS
 GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
GASES MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS GASES GASES IDEAIS OU PERFEITOS Um gás perfeito é um gás hipotético. Por definição, é aquele que obedece, rigorosamente, às leis de Boyle e Charles, ou seja: As moléculas
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
GASES PERFEITOS AULA INTRODUÇÃO
 AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
AULA 5 GASES PERFEIOS - INRODUÇÃO Neste capítulo, vamos estudar as transformações gasosas e as leis elaboradas por Boyle e ariotte, Clapeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos
Estado Gasoso. Características. Expansibilidade compressibilidade. Situação de um gás. Variáveis de estado
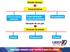 Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
ESTUDO DOS GASES. Energia cinética de um gás. Prof. Patricia Caldana
 ESTUDO DOS GASES Prof. Patricia Caldana Gases são fluidos no estado gasoso, a característica que o difere dos fluidos líquidos é que, quando colocado em um recipiente, este tem a capacidade de ocupa-lo
ESTUDO DOS GASES Prof. Patricia Caldana Gases são fluidos no estado gasoso, a característica que o difere dos fluidos líquidos é que, quando colocado em um recipiente, este tem a capacidade de ocupa-lo
Química Prof. Giacometto
 Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Química Prof. Giacometto LISTA DE EXERCÍCIOS SOBRE O ESTADO GASOSO (SÓ UEM) OBS: SEMPRE QUE JULGAR NECESSÁRIO O VALOR DA MASSA ATÔMICA DE UM ELEMENTO QUÍMICO, UTILIZAR A TABELA PERIÓDICA 01) (UEM) Considerando
Vejamos agora alguns casos particulares dessas transformações com quantidade de gás constante.
 Setor 2306 Aula 06 Transformações Gasosas em sistemas fechados Complemento. Como vimos em aula, as transformações realizadas em sistemas fechados tem sua quantidade de gás constante. Nessa situação, a
Setor 2306 Aula 06 Transformações Gasosas em sistemas fechados Complemento. Como vimos em aula, as transformações realizadas em sistemas fechados tem sua quantidade de gás constante. Nessa situação, a
Gases UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG120. Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI
 UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
11/08/2014. Lei de Avogadro. Equação de Clayperon. CNTP 1 atm 0 C 273K
 Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Disciplina de Físico Química I - Equação de Clapeyron Misturas Gases reais. Prof. Vanderlei Inácio de Paula contato: vanderleip@anchieta.br Lei de Avogadro 1 Lei de Avogadro Equação de Clayperon CNTP 1
Soluções e Gases III. Gases
 Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
PROPRIEDADE DOS GASES
 RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
LISTA 4: EXERCÍCIOS TRANSFORMAÇÕES TERMODINÂMICAS, MASSA MOLAR E EQUAÇÃO DE CLAPEYRON. PROF : José Lucas
 LISTA 4: EXERCÍCIOS TRANSFORMAÇÕES TERMODINÂMICAS, MASSA MOLAR E EQUAÇÃO DE CLAPEYRON PROF : José Lucas 1) Um gás ideal ocupa 6 litros em um recipiente, a pressão dentro do frasco é de 3 atm. Suponha que
LISTA 4: EXERCÍCIOS TRANSFORMAÇÕES TERMODINÂMICAS, MASSA MOLAR E EQUAÇÃO DE CLAPEYRON PROF : José Lucas 1) Um gás ideal ocupa 6 litros em um recipiente, a pressão dentro do frasco é de 3 atm. Suponha que
EXPERIÊNCIA 2 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO
 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
QUÍMICA Profº JAISON
 QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
QUÍMICA Profº JAISON GASES O gás ideal As equações que utilizamos para estudar o comportamento dos gases nunca fornecem valores exatos. Na tentativa de nos aproximarmos mais do valor exato, estabelecemos
Físico-Química I. Profa. Dra. Carla Dalmolin. Gases. Gás perfeito (equações de estado e lei dos gases) Gases reais
 Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Metal, Não Metal e Metaloide
 Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Metal, Não Metal e Metaloide 1 Metal, Não Metal e Metaloide Metal: conduz eletricidade, tem brilho, é maleável e dúctil Ex: cobre Não metal: não... Ex: Enxofre Metaloide: aparência e algumas propriedades
Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: ESTUDO DOS GASES
 1º EM E.M. FÍSICA Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: Resumão com exercícios: ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que
1º EM E.M. FÍSICA Aluno (a): nº: Professor: Fernanda Tonetto Surmas Data: Turma: Resumão com exercícios: ESTUDO DOS GASES INTRODUÇÃO O estudo dos gases é de grande importância na compreensão de fatos que
Estado Gasoso. Classe: 2 2 a série. Exercícios Complementares - Recuperação Paralela PARTE A
 Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série QUÍMICA Estado Gasoso PARTE A 1. Explique o fato de uma bola de futebol parecer mais "cheia" durante o dia e mais murcha
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Química B Extensivo V. 7
 Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
Química B Extensivo V. 7 Exercícios 0) E 07) A Fe + Fe 0) A 0) D x + y xy x y 0,5 x y. 0,5 x y 0 g de x 0 y y 60 x + y xy 0 g + 60 g 90 g Foram adicionados 90 g de y, ou seja, 0 g em excesso (90 g 60 g).
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO
 REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
REVISIONAL DE QUÍMICA 1º ANO PROF. RICARDO 1- Um aluno de química, ao investigar as propriedades de gases, colocou uma garrafa plástica (PET), contendo ar e devidamente fechada, em um freezer e observou
EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I
 Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
QUÍMICA 2 Prof Emanuele
 QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
QUÍMICA 2 Prof Emanuele LISTA DE EXERCÍCIOS RELAÇÕES DE MASSA E ESTUDO DOS GASES 1) Silicatos são compostos de grande importância nas indústrias de cimento, cerâmica e vidro. Quantos gramas de silício
1,0 atm; 3,0 atm; 3,3 atm; 3,9 atm; 4,0 atm.
 1. Um tubo cilíndrico de oxigênio de um mergulhador contém 3,2 kg de O 2. Antes de mergulhar, verificou-se que a temperatura e a pressão no interior do cilindro valiam, respectivamente, 27 C e 1,5 atm.
1. Um tubo cilíndrico de oxigênio de um mergulhador contém 3,2 kg de O 2. Antes de mergulhar, verificou-se que a temperatura e a pressão no interior do cilindro valiam, respectivamente, 27 C e 1,5 atm.
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
COLÉGIO APHONSIANO. Educando com Seriedade Alunos (as) Nº Profº Renato Moura Data. / / 1ª Série do E. M.
 COLÉGIO APHONSIANO Educando com Seriedade Alunos (as) Nº Profº Renato Moura Data. / / 1ª Série do E. M. Lista de Exercícios de Física Prova Substitutiva (Conteúdo: Transformações gasosas, Equação de Clapeyron,
COLÉGIO APHONSIANO Educando com Seriedade Alunos (as) Nº Profº Renato Moura Data. / / 1ª Série do E. M. Lista de Exercícios de Física Prova Substitutiva (Conteúdo: Transformações gasosas, Equação de Clapeyron,
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2
 QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
Propriedades de uma substância pura
 Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
s e s a G a ic ím u Q G. A 1 P
 1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
1. 2. 3. a) o que caracteriza um gás ideal? b) o que acontece com um gás ideal se baixarmos sua temperatura a, por exemplo, 20 K? E com um gás real? 4. Um balão rígido (não-elástico) é capaz de resistir
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Conceitos Básicos sobre gases
 Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
GOIÂNIA, / / PROFESSORA: Núbia de Andrade. DISCIPLINA:Química SÉRIE: 1º. ALUNO(a):
 GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 1º ALUNO(a): Lista de Recuperação Semestral No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
GOIÂNIA, / / 2015 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 1º ALUNO(a): Lista de Recuperação Semestral No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE
 Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
Estudo dos Gases 1º ANO QUÍMICA PROF. CIRILO 4º BIMESTRE 1. Um cilindro com êmbolo móvel contém 100mL de CO 2 a 1,0 atm. Mantendo a temperatura constante, se quisermos que o volume diminua para 25 ml,
Ob. As questões discursiva deve ser apresentado os cálculos.
 GOIÂNIA, 16_ / _11 / 2016 PROFESSOR: Jonas Tavares DISCIPLINA: Física SÉRIE: 2ª ALUNO(a): L2 4º Bimestre Data da prova: 16/11/16 No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia
GOIÂNIA, 16_ / _11 / 2016 PROFESSOR: Jonas Tavares DISCIPLINA: Física SÉRIE: 2ª ALUNO(a): L2 4º Bimestre Data da prova: 16/11/16 No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
3º Trimestre Sala de Estudo Data: 09/11/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Tarefa (Gases) Questão 01 - (Faculdade Guanambi BA/2017) Um dos tipos mais comum de autoclave,
1ª QUESTÃO Valor 1,0 = 1. Dados: índice de refração do ar: n 2. massa específica da cortiça: 200 kg/m 3. 1 of :36
 1ª QUESTÃO Valor 1,0 Uma lâmpada é colocada no fundo de um recipiente com líquido, diretamente abaixo do centro de um cubo de cortiça de 10 cm de lado que flutua no líquido. Sabendo que o índice de refração
1ª QUESTÃO Valor 1,0 Uma lâmpada é colocada no fundo de um recipiente com líquido, diretamente abaixo do centro de um cubo de cortiça de 10 cm de lado que flutua no líquido. Sabendo que o índice de refração
2º ano FÍSICA Prof. Márcio Marinho DIAGRAMA DE FASES E GASES PERFEITOS
 DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
DIAGRAMA DE FASES 1º) Uma determinada porção de uma substância passa do estado líquido para o estado sólido. A porção de sólido obtida flutua sobre a parte que ainda está líquida. Pode-se afirmar que:
C7_ITA_PROF 30/03/10 15:27 Page I
 C7_ITA_ROF 30/03/10 15:27 age I C7_ITA_ROF 30/03/10 15:27 age II C7_ITA_ROF 30/03/10 15:27 age 1 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos
C7_ITA_ROF 30/03/10 15:27 age I C7_ITA_ROF 30/03/10 15:27 age II C7_ITA_ROF 30/03/10 15:27 age 1 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos
Fís. Fís. Monitor: Guilherme Brigagão
 Fís. Professor: Leonardo Gomes Monitor: Guilherme Brigagão Termodinâmica 18/20 jun RESUMO Termodinâmica é parte da Física que estuda as leis que regem as relações entre calor, trabalho e outras formas
Fís. Professor: Leonardo Gomes Monitor: Guilherme Brigagão Termodinâmica 18/20 jun RESUMO Termodinâmica é parte da Física que estuda as leis que regem as relações entre calor, trabalho e outras formas
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
PROVAS DA SEGUNDA ETAPA PS2007/UFG
 UFG-PS/7 PROVAS DA SEGUNDA ETAPA PS7/UFG Esta parte do relatório mostra o desempenho dos candidatos do grupo na prova de Química da ª etapa do PS7. Inicialmente, são apresentados os dados gerais dos candidatos
UFG-PS/7 PROVAS DA SEGUNDA ETAPA PS7/UFG Esta parte do relatório mostra o desempenho dos candidatos do grupo na prova de Química da ª etapa do PS7. Inicialmente, são apresentados os dados gerais dos candidatos
Física E Semiextensivo V. 2
 GABARIO Física E Semiextensivo Exercícios 1) C ) A I erdadeira Caso ocorra a redução de temperatura do ambiente, o fio sofrerá contração, com o risco de rompimento II Falsa A distância entre os fios é
GABARIO Física E Semiextensivo Exercícios 1) C ) A I erdadeira Caso ocorra a redução de temperatura do ambiente, o fio sofrerá contração, com o risco de rompimento II Falsa A distância entre os fios é
AULA 15 GASES PERFEITOS 1- INTRODUÇÃO
 AULA 5 GASES PERFEIOS - INRODUÇÃO Neste caítulo, vamos estudar as transformações gasosas e as leis elaboradas or Boyle e ariotte, Claeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos considerar
AULA 5 GASES PERFEIOS - INRODUÇÃO Neste caítulo, vamos estudar as transformações gasosas e as leis elaboradas or Boyle e ariotte, Claeyron, Gay-Lussac e Charles, que regem estas transformações. Vamos considerar
LISTA UERJ - GASES. No interior da bola cheia, a massa de ar, em gramas, corresponde a: a) 2,5 b) 5,0 c) 7,5 d) 10,0
 1. (Uerj 2012) Em um reator nuclear, a energia liberada na fissão de 1 g de urânio é 4 utilizada para evaporar a quantidade de 3,6 10 kg de água a 227ºC e sob 30 atm, necessária para movimentar uma turbina
1. (Uerj 2012) Em um reator nuclear, a energia liberada na fissão de 1 g de urânio é 4 utilizada para evaporar a quantidade de 3,6 10 kg de água a 227ºC e sob 30 atm, necessária para movimentar uma turbina
Termodinâmica. Lucy V. C. Assali
 Termodinâmica Gases Ideais Física II 2016 - IO Propriedades dos Gases: Equação de Estado dos Gases Ideais Fluido homogêneo: caracterizado por qualquer par das três variáveis (P, V, T) uma relação funcional
Termodinâmica Gases Ideais Física II 2016 - IO Propriedades dos Gases: Equação de Estado dos Gases Ideais Fluido homogêneo: caracterizado por qualquer par das três variáveis (P, V, T) uma relação funcional
Termo- estatística REVISÃO DE TERMODINÂMICA. Alguns conceitos importante que aparecem nesta lei:
 Lei Zero da Termodinâmica 4300259 Termo- estatística REVISÃO DE TERMODINÂMICA Se dois sistema estão em equilíbrio térmico com um terceiro sistema, então eles também estão em equilíbrio entre si. Alguns
Lei Zero da Termodinâmica 4300259 Termo- estatística REVISÃO DE TERMODINÂMICA Se dois sistema estão em equilíbrio térmico com um terceiro sistema, então eles também estão em equilíbrio entre si. Alguns
Termodinâmica. Prof.: POMPEU
 1. DEFINIÇÃO A estuda a relação entre calor e trabalho que um sistema (por exemplo, um gás) troca com o meio exterior. 2. ENERGIA INTERNA (U) É a soma das várias formas de energia das moléculas que constituem
1. DEFINIÇÃO A estuda a relação entre calor e trabalho que um sistema (por exemplo, um gás) troca com o meio exterior. 2. ENERGIA INTERNA (U) É a soma das várias formas de energia das moléculas que constituem
ATMOSFERA. Volume molar; constante de Avogadro
 ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
AULA 01 - GASES QUÍMICA GERAL II QGE2001 Profa. Marcia Margarete Meier
 1 AULA 01 - GASES QUÍMICA GERAL II QGE2001 Profa. Marcia Margarete Meier 2 CONCEITOS QUE VOCÊ DEVE DOMINAR PARA ACOMPANHAR AS AULAS -Matemática básica -Noções de gráficos -Forças intermoleculares HABILIDADES
1 AULA 01 - GASES QUÍMICA GERAL II QGE2001 Profa. Marcia Margarete Meier 2 CONCEITOS QUE VOCÊ DEVE DOMINAR PARA ACOMPANHAR AS AULAS -Matemática básica -Noções de gráficos -Forças intermoleculares HABILIDADES
Características dos gases
 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Calorimetria Estudo dos gases. Professores: Ariany França/ Bruno Leite
 Calorimetria Estudo dos gases Professores: Ariany França/ Bruno Leite Calor Fases da matéria RELEMBRANDO Equilíbrio Térmico latente Calor Específico Capacidade Térmica sensível Princípios da Igualdade
Calorimetria Estudo dos gases Professores: Ariany França/ Bruno Leite Calor Fases da matéria RELEMBRANDO Equilíbrio Térmico latente Calor Específico Capacidade Térmica sensível Princípios da Igualdade
Professora : Elisângela Moraes
 UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
Gases. Compostos orgânicos de baixa massa molar são gases a temperatura ambiente. CH 4 (metano gás natural), C 3 H 8
 Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO
 AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
Estudo Estudo da Química
 Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 11 Estudo Geral dos Gases 1.
Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 11 Estudo Geral dos Gases 1.
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011
 André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
André Silva Franco ASF EOQ Escola Olímpica de Química Julho de 2011 Conceitos Básicos Gás é um estado da matéria; as partículas de massa m estão em movimento incessante e caótico; O tamanho das partículas
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RN CAMPUS: CURSO: ALUNO: Lista de exercícios 20
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RN CAMPUS: CURSO: ALUNO: DISCIPLINA: FÍSICA I PROFESSOR: EDSON JOSÉ Lista de exercícios 20 1. Numa transformação sob pressão constante de 800 N/m
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA DO RN CAMPUS: CURSO: ALUNO: DISCIPLINA: FÍSICA I PROFESSOR: EDSON JOSÉ Lista de exercícios 20 1. Numa transformação sob pressão constante de 800 N/m
Aula do Curso Noic de Física, feito pela parceria do Noic com o Além do Horizonte. Esta aula tratará de gases e termodinâmica:
 Esta aula tratará de gases e termodinâmica: Estudando a matéria, os cientistas definiram o mol. Um mol corresponde a 6,02. 10 " unidades de algo, número conhecido por N A, número de Avogadro. A importância
Esta aula tratará de gases e termodinâmica: Estudando a matéria, os cientistas definiram o mol. Um mol corresponde a 6,02. 10 " unidades de algo, número conhecido por N A, número de Avogadro. A importância
Física II FEP 112 ( ) 1º Semestre de Instituto de Física - Universidade de São Paulo. Professor: Valdir Guimarães
 Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
QUÍMICA CÁLCULOS ESTEQUIOMÉTRICOS
 QUÍMICA CÁLCULOS ESTEQUIOMÉTRICOS CÁLCULOS ESTEQUIOMÉTRICOS Os cálculos estequiométricos correspondem aos cálculos de massa, de quantidade de matéria e em alguns casos, de volumes das substâncias envolvidas
QUÍMICA CÁLCULOS ESTEQUIOMÉTRICOS CÁLCULOS ESTEQUIOMÉTRICOS Os cálculos estequiométricos correspondem aos cálculos de massa, de quantidade de matéria e em alguns casos, de volumes das substâncias envolvidas
MÓDULOS 25 e 26 QUÍMICA. Equação de Estado Leis dos Gases Densidade dos Gases. Ciências da Natureza, Matemática e suas Tecnologias
 Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos Gases 1. Equação de Estado do Gás É uma equação que relaciona a pressão do gás (), o volume do
Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA Equação de Estado Leis dos Gases Densidade dos Gases 1. Equação de Estado do Gás É uma equação que relaciona a pressão do gás (), o volume do
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
Exercícios Resolvidos FISICA E - Apostila 2 Semi
 Exercícios Resolvidos FISICA E - Apostila 2 Semi 01. (corrigir gabarito) I. Verdadeira. Caso ocorra a redução de temperatura do ambiente, o fio sofreria contração, com o risco de rompimento. II. Falsa.
Exercícios Resolvidos FISICA E - Apostila 2 Semi 01. (corrigir gabarito) I. Verdadeira. Caso ocorra a redução de temperatura do ambiente, o fio sofreria contração, com o risco de rompimento. II. Falsa.
1ª Parte: Questões resolvidas
 ANÁLISE ELEMENTAR QUANTITATIVA DISCIPLINA: QUÍMICA GERAL / TURMA: 1º ano Ensino Médio 1ª Parte: Questões resolvidas Nota: A massa molecular de um composto, pode ser calculada em função da densidade de
ANÁLISE ELEMENTAR QUANTITATIVA DISCIPLINA: QUÍMICA GERAL / TURMA: 1º ano Ensino Médio 1ª Parte: Questões resolvidas Nota: A massa molecular de um composto, pode ser calculada em função da densidade de
Prof. Renato. EME Prof. Vicente Bastos SESI Carrão. Física 2ª. Série Aula 13
 Aula 13 Medindo o calor 1. Mudança de estado físico (solidificação) (liquefação) Sólido - Líquido - Gás (fusão) (ebulição) 2. Curvas de aquecimento Gráfico de Temperatura x Quantidade de calor: T x Q Exemplos:
Aula 13 Medindo o calor 1. Mudança de estado físico (solidificação) (liquefação) Sólido - Líquido - Gás (fusão) (ebulição) 2. Curvas de aquecimento Gráfico de Temperatura x Quantidade de calor: T x Q Exemplos:
Deve-se esperar uma redução na velocidade de rotação do hidrômetro em dias frios.
 01. Considere que dez litros de cada um dos seguintes gases estão nas mesmas condições de pressão e temperatura: PH 3, C 2 H 6 O, H 2, NH 3, Ne, Cl 2 e SO 2. A alternativa que apresenta corretamente os
01. Considere que dez litros de cada um dos seguintes gases estão nas mesmas condições de pressão e temperatura: PH 3, C 2 H 6 O, H 2, NH 3, Ne, Cl 2 e SO 2. A alternativa que apresenta corretamente os
Físico-Química Farmácia 2014/02
 Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
Físico-Química Farmácia 2014/02 1 2 Aspectos termodinâmicos das transições de fase A descrição termodinâmica das misturas Referência: Peter Atkins, Julio de Paula, Físico-Química Biológica 3 Condição de
1) Trabalho de um gás (W) F A. Para F = cte: cos. F = cte. p = cte. Variação de Volume. Para p = cte.
 TERMODINÂMICA 1) Trabalho de um gás () p F A Para F = cte: F p. A F d cos F = cte. p Ad V Variação de Volume d V Ad p = cte. p V Para p = cte. 1) Trabalho de um gás () N/m = Pa Joule p V m 3 p V Expansão:
TERMODINÂMICA 1) Trabalho de um gás () p F A Para F = cte: F p. A F d cos F = cte. p Ad V Variação de Volume d V Ad p = cte. p V Para p = cte. 1) Trabalho de um gás () N/m = Pa Joule p V m 3 p V Expansão:
TERMODINÂMICA. Módulo 6 1ª Lei da Termodinâmica Módulo 7 2ª Lei da Termodinâmica
 TERMODINÂMICA Módulo 6 1ª Lei da Termodinâmica Módulo 7 ª Lei da Termodinâmica 1) Trabalho de um gás () p F A Para F = cte: F p. A F d cos F = cte. p Ad V Variação de Volume d V Ad p = cte. p V Para p
TERMODINÂMICA Módulo 6 1ª Lei da Termodinâmica Módulo 7 ª Lei da Termodinâmica 1) Trabalho de um gás () p F A Para F = cte: F p. A F d cos F = cte. p Ad V Variação de Volume d V Ad p = cte. p V Para p
= 6, mol de moléculas de um gás possui aproximadamente 6, moléculas deste gás, ou seja, seiscentos e dois sextilhões de moléculas;
 TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida
 Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
Química Fascículo 05 Elisabeth Pontes Araújo Elizabeth Loureiro Zink José Ricardo Lemes de Almeida Índice Gases...1 Exercícios...4 Gabarito...7 Gases I Estado gasoso = partículas sem interação f Velocidade
Prof. Vanderlei I Paula -
 Centro Universitário Anchieta Engenharia Química Físico Química I Prof. Vanderlei I Paula Gabarito 3 a lista de exercícios 01 Alimentos desidratados apresentam maior durabilidade e mantêm a maioria das
Centro Universitário Anchieta Engenharia Química Físico Química I Prof. Vanderlei I Paula Gabarito 3 a lista de exercícios 01 Alimentos desidratados apresentam maior durabilidade e mantêm a maioria das
Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2. prof. Daniela Szilard 23 de maio de 2016
 Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2 prof. Daniela Szilard 23 de maio de 2016 1. Julgue os itens: verdadeiro ou falso. ( ) A lei de Stevin é válida para qualquer
Universidade Federal do Rio de Janeiro Instituto de Física Lista 1 Física 2 prof. Daniela Szilard 23 de maio de 2016 1. Julgue os itens: verdadeiro ou falso. ( ) A lei de Stevin é válida para qualquer
