Universidade Federal Rural de Pernambuco
|
|
|
- Fábio Anjos da Mota
- 5 Há anos
- Visualizações:
Transcrição
1 Universidade Federal Rural de Pernambuco 1 SISTEMAS RESTAURADORES Prof. Romildo Nogueira 1. Mecanismos de retroalimentação (feedback) Existem nos seres vivos sistemas (sistemas de controle), nos quais o valor de uma variável (variável de controle) controla o valor de uma outra variável (variável controlada). Os sistemas de controle podem ser agrupados em duas categorias: sistemas de laço aberto e sistemas de laço fechado. No primeiro caso, a variável controlada não atua sobre a variável de controle. Nos sistemas de laço fechado a variável controlada atua sobre a variável de controle. Um exemplo de laço aberto é a manutenção de um nível estacionário numa caixa de água devido ao fluxo vindo de uma outra. Observe que o balanço (taxa de entrada taxa de saída) é nulo, e portanto, alterações na entrada ou na saída ou em ambas podem alterar a manutenção desse estado estacionário. Um exemplo de laço fechado é considerar agora que a primeira caixa tenha um flutuador que atuando sobre uma válvula possa modificar o fluxo de entrada na segunda caixa de maneira a manter o nível desta estacionário. Um tipo de sistema de controle de laço fechado é constituído por um aparato denominado de circuito de retroalimentação ou de realimentação ou ainda de feedback. Um exemplo de um sistema de feedback é aquele utilizado para fixar a voltagem através das membranas celulares (voltage - clamp). Em linhas gerais, a técnica do voltage - clamp consiste no uso de um circuito eletrônico que através de um sistema de retroalimentação (feedback) negativa mantém a voltagem da célula constante. Este circuito de retroalimentação negativa é constituído por dois eletrodos empalados na célula e conectados a amplificadores operacionais configurados de maneira a produzir a fixação de voltagem. Um desses eletrodos, usado para medir a voltagem através da membrana, é conectado a um amplificador operacional configurado como um seguidor de voltagem. A saída desse amplificador é conectada a outro amplificador, denominado de amplificador de clamp. O outro terminal do amplificador de clamp recebe um pulso de voltagem, comandado eletronicamente. Quando o valor do potencial de membrana é diferente daquele do comando de voltagem, uma corrente é produzida na saída do amplificador de clamp e fluirá através do microeletrodo de corrente que se encontra empalado na célula. Estas ações manterão constante a voltagem transmembrana. Os circuitos de retroalimentação podem produzir retroalimentação negativa ou positiva. Se diz que um circuito é de retroalimentação negativa se ao produzir-se uma modificação na variável controlada, o sistema provoca nesta uma variação em sentido contrário. No exemplo do voltage-clamp, quando o potencial da membrana é maior do que o do controle o sistema envia uma corrente através da membrana de maneira a compensar este aumento na voltagem e vice-versa. Um sistema tem retroalimentação
2 2 positiva se em resposta a uma variação no valor da variável controlada, o sistema produz, nesta variável, uma variação no mesmo sentido. Por exemplo, uma diminuição na temperatura corporal produz um decréscimo da taxa metabólica que, por sua vez, tende a reduzir ainda mais a temperatura corporal, fechando-se, assim o circuito de retroalimentação positiva. Um circuito de retroalimentação pode ser representado, no esquema abaixo. Neste diagrama pode-se observar que o circuito é integrado por uma variável controlada y, um controlador C, que compara sua magnitude com o valor de referência R e modifica adequadamente a variável x, chamada variável manipulada. Esta atua sobre um efetor E que recebe o sinal e determina o valor da variável y em função de x. Os circuitos de retroalimentação podem apresentar respostas do tipo tudo ou nada ou contínua. No caso da resposta tudo ou nada, o controlador só tem duas respostas possíveis : uma se a variável controlada não alcança o valor de referência e outra se o alcança ou o ultrapassa. Nos sistemas de resposta contínua, o sinal de saída do controlador é uma função contínua e que age como um seguidor da variável controlada. Assim, qualquer alteração da variável controlada pode ser compensada pontualmente pela resposta contínua do controlador. Um exemplo de um sistema de retroalimentação com resposta tudo ou nada é um aparelho de ar condicionado controlado por um termostato, pois o mesmo só dispara o equipamento no momento que a temperatura atingir um determinado valor. Como exemplo de retroalimentação com resposta contínua pode-se citar os vários sistemas que controlam a freqüência cardíaca. Nos organismos os circuitos de realimentação são muito complexos. Por exemplo, no sistema locomotor a posição de cada parte do corpo, a força, a velocidade do movimento, etc. estão controladas por uma infinidade de circuitos de retroalimentação no sistema nervoso e que, podem agir sobre essas variáveis controladas. No reflexo miotáctico, aquele no qual o quadríceps se opõe a flexão do joelho, a variável controlada y é o comprimento das fibras musculares do quadríceps os quais se alongam com a flexão do joelho. O comprimento das fibras é controlado pelos fusos neuromusculares. Estas estruturas são constituídas por fibras musculares modificadas (fibras intrafusais), as quais, ao alongar-se em paralelo com as demais fibras do músculo, enviam impulsos nervosos por vias aferentes que entram na medula espinal. O sinal de retroalimentação é constituído pelo sinal nervoso que viaja por estas vias e fazem sinapses na medula com os motoneurônios. A atividade desses neurônios que inervam as fibras musculares e cuja excitação provoca a contração do músculo, é a variável manipulada. Do exposto surge que qualquer alongamento dos quadríceps provocaria sua contração de maneira que, se unicamente este fenômeno ocorresse, uma pessoa não poderia flexionar o joelho. No entanto, isto não
3 3 ocorre porque as fibras eferentes provenientes dos motoneurônios podem regular a sensibilidade do fuso. Os motoneurônios e recebem mensagens de diferentes centros nervosos superiores por diversas vias eferentes da medula. Um outro exemplo de mecanismo de feedback é o controle das gonadotropinas pelo hipotálamo. Tomando-se o caso do macho, a testosterona é o sinal primário que fala ao hipotálamo acerca do status dos testículos. O nível elevado de testosterona inibe a secreção GnRH pelo hipotálamo e também reduz a resposta da pituitária ao GnRH e como conseqüência reduz os níveis de LH nos testículos e a produção da própria testosterona. Num nível baixo de testosterona ocorre o inverso. Este sistema constitui um feedback negativo. 2. Sistemas tampões Na secção anterior tratou-se do controle de algumas variáveis no organismo (níveis hormonais, respostas motoras etc.) através do mecanismo da retroalimentação e agora será analisada uma outra estratégia desenvolvida pelos organismos visando à regulação de outras variáveis (o ph, pco 2 ) que são os sistemas tampões. Tampões são soluções capazes de impedir acentuadas variações de ph num sistema aquoso. Um sistema eficiente na manutenção do ph de uma solução aos ataques de substâncias ácidas ou alcalinas é obtido através da combinação de um ácido fraco e seu sal forte (ou uma base fraca e seu sal forte). A solução de ácido acético (CH 3 COOH) e acetato de sódio (CH 3 COONa) age como um tampão, porque o ácido acético, sendo fraco, dissocia pouco, porém o acetato de sódio é totalmente dissociado. Quando um ácido forte como o ácido clorídrico (HCl) é colocado nesta solução tampão, o ácido se dissocia em H + e Cl - e os íons hidrogênio reagem com os íons acetatos e forma o CH 3 COOH que é um ácido fraco, enquanto os íons cloreto reagem com os íons sódio e forma o sal cloreto de sódio. No processo o ácido forte (HCl) é transformado num ácido fraco (CH 3 COOH) de maneira que a variação do ph da solução é mínima. Durante a titulação de um ácido com hidróxido de sódio observamos que o gráfico do ph contra equivalentes de OH - adicionados, denominado de curva de titulação, apresenta um valor de ph correspondente ao ponto médio da curva de titulação que é numericamente igual ao pk do ácido titulado e as concentrações das espécies doadoras (H A) e receptoras (A - ) de prótons, são equimolares neste ponto. Na equação de Henderson-Hasselbalch descrita abaixo se pode observar que o pk pode ser calculado em qualquer ponto da curva de titulação a partir do ph e desde que se conheça as concentrações de ácido e base neste ponto. A equação de Henderson-Hasselbalch pode ser escrita como segue: PH = pk + log ([A - ] / [H A]).
4 4 É interessante observar na equação de Henderson-Hasselbalch que no ponto médio da curva de titulação o ph é obrigatoriamente igual ao pk uma vez que a [A - ] = [H A]. As curvas de titulação de cada ácido apresentam uma região achatada em torno do seu ponto médio. Nessa zona o ph do sistema muda relativamente pouco quando incrementos de H + ou OH - são adicionados. Essa é a região na qual o par ácido-básico conjugado age como um tampão, ou seja, um sistema que tende a opor-se à mudança no ph quando se adiciona H + ou OH -. A capacidade tamponante é máxima exatamente no ponto médio da curva de titulação, onde o ph = pk. A capacidade tamponante se reduz à medida que o ph se afasta do ponto médio. A manutenção do ph em torno de 7 tanto no sangue como nas várias células que constituem os tecidos dos diferentes órgãos é conseguida através de estratégias desenvolvidas pelo organismo no sentido de não permitir variações do ph mesmo quando ele é agredido por substâncias ácidas ou alcalinas. Vários mecanismos são utilizados pelo organismo com o objetivo de regular o equilíbrio ácido-básico, entre os principais encontram-se: o sistema HCO 3 - CO 2, que é o mais importante sistema-tampão do organismo, é responsável por cerca de 75% da capacidade tamponante do plasma sanguíneo e por 30 % da capacidade tamponante dos glóbulos vermelhos; a hemoglobina que é responsável por 60 % da capacidade tamponante dos glóbulos vermelhos; os pulmões, que mantendo o nível de CO 2 do meio interno, tem importante papel na regulação do tampão bicarbonato- CO 2. Um outro importante órgão na regulação do equilíbrio ácido-básico são os rins, capazes de eliminar a sobrecarga de ácidos fixos do organismo através da ação do epitélio tubular renal. São vários os mecanismos que levam a eliminação de anions de ácidos fixos com a recuperação para o organismo de tampões e cátions importantes para manutenção da concentração hidrogeniônica e volume do meio interno. Entre os mais importantes podese citar: a reabsorção de bicarbonato, a formação de acidez titulável e a excreção de amônia. O sistema HCO - 3 CO 2 O CO 2 sendo o produto final do metabolismo celular, está presente em concentrações significantes em todas as células. Por esta razão o estudo da hidratação do CO 2 a ácido carbônico e por conseqüência a íons hidrogênio e bicarbonato é fundamental para compreensão do seu papel tamponante tanto no plasma sanguíneo, como nos glóbulos vermelhos e nas diferentes células do organismo. A reação de hidratação de CO 2 é a seguinte: K 1 CO 2 + H 2 O H 2 CO 3 H + + HCO 3 -. K - 1
5 5 Nesta reação os passos limitantes da seqüência são: a reação de hidratação do CO 2 e de desidratação do ácido carbônico. A dissociação do ácido carbônico é instantânea dentro da precisão de ocorrência do fenômeno. A descrição das características cinéticas de hidratação do CO 2 e desidratação do ácido carbônico, tem sido estudada in vitro, e fornecido meios para compreender-se o funcionamento desse sistema-tampão. A análise da cinética da reação, nos informa que a velocidade de formação de H 2 CO 3 a partir da hidratação do CO 2 (tendo em vista que a reação segue uma cinética de 1 a ordem) é dada por: - d[co 2 ] / dt = K 1 [CO 2 ] A velocidade de hidratação do ácido carbônico é dada pela seguinte expressão: - d[h 2 CO 3 ] /dt = K - 1 [H 2 CO 3 ] Com os valores de K 1 e K 1 obtidos através da análise da cinética da reação de 1 a ordem, como sendo 0.15 s -1 e 50 s -1, respectivamente, para uma temperatura de 37 o C é possível determinar a velocidade de hidratação do CO 2 como segue: - d[co 2 ] / dt = K 1. a.pco 2, onde a = é o coeficiente de solubilidade do CO 2 a 37 o C numa solução fisiológica e pco 2 é a pressão parcial do CO 2 a 37 o C no meio fisiológico, que é igual a 40 mmhg. Portanto, -d[co 2 ] / dt = 0,18 mm l -1 s -1, ou seja, em cada litro de solução haverá a formação de 0,18 mm de ácido carbônico por segundo nos tecidos e no sangue. Em condições de equilíbrio as velocidades de hidratação do CO 2 e de desidratação do ácido carbônico são iguais e a seguinte expressão pode ser escrita: [CO 2 ]/ [H 2 CO 3 ] = K 1 / K 1 = K eq, onde K eq é a constante de equilíbrio da reação. Desta maneira, como K 1 / K 1 [CO 2 ] será 330 vezes maior do que a concentração de [H 2 CO 3 ] na condição de equilíbrio. 330, a concentração de Uma característica da reação de hidratação do CO 2 e desidratação do ácido carbônico é que ela é catalisada pela enzima anidrase carbônica, que acelera as reações em cerca de vezes, porém não altera a constante de equilíbrio K eq. A anidrase carbônica é inibida por drogas derivadas de sulfas, tais como a acetazolamida, benzolamida, metazolamida, diclorofenamida e etoxzolamida. Os tampões do sangue
6 6 Além do tampão bicarbonato o sangue apresenta tampões protéicos como a hemoglobina, devido aos grupos ácidos presentes na sua molécula- carboxila (-COOH), amino (-NH 2 ), amônio (-NH 3 ), guanidino (- NH-CNH-NH 2 ) e o grupo imidazol da histidina. Em dependência do ph do meio estes grupos podem funcionar como ânions ou cátions.em presença de ácidos os íons hidrogênio se combinam com os grupos COO - da hemoglobina, tamponando a concentração hidrogeniônica num valor abaixo daquele esperado na ausência da hemoglobina. Ao contrário em presença de uma base, os grupos NH 3 + cedem seus íons hidrogênio, os quais se combinam com as hidroxilas (OH - ) formando água, impedindo, desta forma, um aumento tão grande quanto esperado na ausência da hemoglobina. No entanto, a grande capacidade tamponante da hemoglobina se deve aos grupos imidazólicos, os quais são influenciados pelo estado do átomo de ferro contido em sua molécula. Desta forma, quando o grupo imidazol está oxidado torna-se mais ácido e portanto libera H + em solução e quando a oxihemoglobina é reduzida, modificações ocorrem na estrutura eletrônica dos átomos de ferro de maneira que o grupo imidazol e outros grupos tamponantes são influenciados por esta nova distribuição eletrônica e se tornam menos ácidos, e fixam íons hidrogênio. Esta propriedade da hemoglobina de reagir com o oxigênio para formar a oxihemoglobina, permite ao sangue arterial chegar aos tecidos com alta taxa de oxihemoglobina e baixa de dióxido de carbono devido às trocas gasosas ocorridas ao nível dos alvéolos. Nos tecidos a oxihemoglobina libera oxigênio e este libera CO 2 para o sangue. O CO 2 produzido pelos tecidos é transferido ao sangue dissolvido e ao chegar no plasma os seguintes eventos ocorrem: (1) a maior parte do CO 2 se difunde para os eritrócitos, onde vários mecanismos de tamponamento atuarão sobre eles; (2) uma pequena quantidade forma carbamino- CO 2 com as proteínas do plasma (R-NH 2 + CO 2 no plasma é hidratado (CO 2 + H 2 O R- NHCOO - + H + ); (3) o restante do CO 2 dissolvido H 2 CO HCO 3 -. O dióxido de carbono que se difunde para dentro dos eritrócitos é transportado de três maneiras: (1) uma porção fica no eritrócito como dióxido de carbono dissolvido; (2) outra fração considerável de CO 2 se combina com a hemoglobina para formar carbamino- CO 2 ( a medida que a oxihemoglobina se desoxigena, ao transferir oxigênio para os tecidos, ela se torna capaz de combinar-se com quantidades crescentes de dióxido de carbono) e os hidrogênios liberados na formação destes compostos carbamino são tamponados dentro dos eritrócitos pela própria hemoglobina; (3) e a maior quantidade de CO 2 que entra nos eritrócitos é hidratada para formar ácido carbônico, que em seguida se ioniza formando íons hidrogênio e íons bicarbonato, os quais são removidos dos eritrócitos a medida que são formados, por intermédio da hemoglobina que tampona os íons hidrogênio e da difusão da maior parte do bicarbonato para o plasma. A hemoglobina antes de tamponar os íons hidrogênio tem um certo número de cargas negativas efetivas ao ph fisiológico. Estas cargas negativas são contrabalançadas pelas cargas positivas dos cátions que existem dentro dos eritrócitos, os quais são principalmente o sódio e o potássio. Contudo, com a
7 7 ionização do ácido carbônico os íons hidrogênio se combinam com a hemoglobina e a carga efetiva da hemoglobina se reduz. Os íons sódio e potássio que eram balanceados eletricamente contra os anions bicarbonatos formados na ionização do ácido carbônico, de maneira que a neutralidade elétrica é mantida. Contudo, como a concentração de bicarbonato dos eritrócitos ficou aumentada em relação ao plasma estes se difundem dos eritrócitos para o plasma. Uma vez que os íons bicarbonato estão carregados negativamente, a neutralidade elétrica dos eritrócitos e plasma será desfeita, a não ser que um número igual de íons positivos também se difundam dos eritrócitos para o plasma ou que íons negativos passem do plasma para os eritrócitos. Um trocador bicarbonato-cloreto realiza este trabalho de compensar a saída de bicarbonato para o plasma com a entrada de cloreto para os eritrócitos, pelo trabalho de um trocador bicarbonato-cloreto. Ao contrário do que ocorre nos tecidos, nos pulmões a hemoglobina oxigenar-se-á dissociando os íons H + nela ligados. Estes cátions ao reagirem com íons bicarbonato presente nos eritrócitos formarão o ácido carbônico que se desidratará num processo catalizado pela anidrase carbônica, formando CO 2 que se difundirá nos alvéolos. A redução da concentração de bicarbonato e a dissociação da hemoglobina modificarão novamente entre ânions fixos que podem difundir-se, de maneira que o bicarbonato entrará nos glóbulos a favor de seu gradiente de concentração e íons cloreto deixarão os glóbulos para manter a eletroneutralidade. Os pulmões e os rins e a regulação do equilíbrio ácido-básico Os pulmões através das trocas gasosas que ocorrem entre os alvéolos e o ar atmosférico regulam a concentração da pco 2 e po 2 no sangue arterial que se encontra em equilíbrio com o ar alveolar. Desta maneira, na hiperventilação pulmonar ocorre mistura do ar atmosférico com o ar alveolar, levando a redução da pressão parcial de CO 2 nos alvéolos, uma vez que o ar atmosférico tem baixa pco 2. Por conseguinte, a pco 2 no sangue arterial também se reduz e assim o ph sanguíneo se eleva, acarretando uma alcalose de origem respiratória. Por outro lado, a hipoventilação pulmonar acarretará uma elevação da pco 2 nos alvéolos e, portanto, no sangue arterial. A elevação da pco 2 causa uma redução do ph sanguíneo levando a uma acidose de origem respiratória. A ventilação pulmonar, por sua vez, é controlada por um sistema de feedback que identifica a pco 2 do sangue arterial, cujo aumento ou redução dessa pressão vai se refletir na concentração hidrogeniônica do líquido cerebrospinal que é pobremente tamponado. Desta maneira, se a concentração de íons hidrogênio se eleva os quimioreceptores respiratórios respondem estimulando o centro respiratório e ocasionando um aumento na ventilação alveolar e em caso contrário, reduzindo a ventilação. O metabolismo celular produz uma série de outros ácidos não voláteis (ácidos fixos), que não podem ser regulados pela ventilação pulmonar e neste caso o organismo utiliza o rim como regulador do equilíbrio
8 8 ácido-básico. Para isto, o rim lança mão de alguns mecanismos como a reabsorção de bicarbonato, a excreção da acidez titulável e a excreção de amônia. 3. A manutenção da homeostasia O termo homeostasia foi empregado pela primeira vez por Claude Bernard, em meados do século dezenove, para referir-se à constância relativa da composição do meio interno dos animais. Ao longo do tempo, o termo o conceito de homeostasia (como constância do meio interno), foi sendo modificado, basicamente, (a) porque em muitos casos a suposta constância do meio interno não existe, nem sequer de maneira aproximada como ocorre, por exemplo, com a concentração das gonadotropinas durante o ciclo menstrual e (b) também porque a constância do meio interno em algumas situações depende de uma infinidade de outras variáveis, como a pressão, a temperatura corporal, a posição do corpo, etc. Por este motivo, é mais adequado atualmente falar de homeostasia associando-a aos mecanismos de regulação e controle que contribuem a adequar os valores das variáveis as necessidades das circunstâncias, mantendo-as, em cada caso, dentro de limites que permitam a sobrevivência do indivíduo e da espécie. Os seres vivos não se encontram em equilíbrio com o seu meio ambiente, porém em estado estacionário. Esse estado se caracteriza por uma condição de equilíbrio aparente de uma parte do sistema, onde as variáveis de estado características (concentração, densidade, temperatura, volume, etc.), se mantêm inalteradas com o tempo às custas de outros processos. Assim, o nível da água num reservatório poderá não mudar com o tempo porque não entra nem sai água do mesmo (equilíbrio) ou porque a quantidade de água que sai é bombeada de volta (estado estacionário). As células mantêm seus gradientes eletroquímicos as custas de um processo dinâmico (estacionário), onde a degradação do gradiente eletroquímico de cada íon é compensada por transporte ativo desse íon (com consumo de ATP). Esse processo dinâmico que ocorre nos seres vivos é denominado de homeostasia. Algumas vezes são necessários sistemas sofisticados de regulação e controle, envolvendo retroalimentação e outros tipos de regulação, bastante complexos (como descritos nos tópicos 1 e 2), para a manutenção da homeostasia nos organismos. A vida se mantém devido a processos homeostásicos e não a processos envolvendo o equilíbrio das células e organismos com o meio ambiente. Equilíbrio celular (e dos organismos) significa morte da célula (se dos organismos). Viver é lutar contra a condição de equilíbrio.
9 9
Universidade Federal Rural de Pernambuco
 Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Universidade Federal Rural de Pernambuco Departamento de Morfologia e Fisiologia Animal Área de Biofísica Medindo o potencial Hidrogeniônico Prof. Romildo Nogueira 1. Entendendo as bases A manutenção da
Sistema Respiratório. Superior. Língua. Inferior
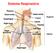 Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
Sistema Respiratório Língua Superior Inferior Funções 1. Troca de gases entre a atmosfera e o sangue. 2. Regulação homeostática do ph corporal 3. Proteção contra substâncias irritantes e patógenos 4. Vocalização
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes
 ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
ph SISTEMAS TAMPÕES Faculdade de Medicina PUC-Campinas Profa. Dra. Celene Fernandes Bernardes ph = potencial hidrogeniônico ph = -log [H + ] Sorenson 1909 A escala de ph é logarítma; portanto, quando duas
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Natal/RN SOLUÇÃO TAMPÃO
 QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
QUÍMICA ANALÍTICA APLICADA - QUI 111 SOLUÇÃO TAMPÃO Prof a. Nedja Suely Fernandes 2014.1 Natal/RN SOLUÇÃO TAMPÃO É uma solução que resiste a uma modificação da concentração de íon hidrogênio ou de ph,
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS
 SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
SISTEMA TAMPÃO NOS ORGANISMOS ANIMAIS Regulação do Equilíbrio Ácido-Básico ph = Potencial Hidrogeniônico Concentração de H + Quanto mais ácida uma solução maior sua concentração de H + e menor o seu ph
Equilíbrio ácido-básico. Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF
 Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
Equilíbrio ácido-básico Monitor: Tarcísio Alves Teixeira Professor: Guilherme Soares Fisiologia Veterinária / MFL / IB / UFF O que são Ácidos e Bases Ácido: substância que, em solução, é capaz de doar
ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões
![ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões ph arterial entre 7,35 e 7,45 [H+] ~ 40 nanomoles/l (10-9) CO2 (Ácido volátil) O CO 2 não se acumula no organismo, é eliminado pelos pulmões](/thumbs/60/44575873.jpg) Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
Regulação do ph dos líquidos Regulação do ph dos líquidos ph = log[ ] LEC =, ±, (, mm) ph , Alcalose Ojetivo: Manutenção do ph sistêmico na faixa de normalidade. ph arterial entre, e, [H]
BIOQUÍMICA PARA ODONTO
 BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
BIOQUÍMICA PARA ODONTO Aula 1: ph, pk a e Sistemas tampão Aminoácidos Autoria: Luiza Higa Programa de Biologia Estrutural Instituto de Bioquímica Médica Universidade Federal do Rio de Janeiro Reprodução
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS
 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO ARINOS MINAS GERAIS 2016 INSTITUTO FEDERAL DO NORTE DE MINAS GERAIS KAMILA MARCIANO DE SOUZA SOLUÇÃO TAMPÃO PROFESSOR:
Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent
![Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent Conceito de ph ph = - Log [H + ] Aumento [H + ] => diminuição do ph => acidose Diminuição [H + ] => aumento do ph => alcalose Alterações são dependent](/thumbs/50/27125458.jpg) Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
Equilíbrio ácido-básico A concentração de H no FEC é mantida dentro de um limite extremamente estreito: 40 nmol/l = 1.000.000 menor que a Concentração dos outros íons!! [H] tem profundo efeito nos eventos
TEORIA DE ÁCIDOS E BASES
 TEORIA DE ÁCIDOS E BASES Proposição de S. Arrhenius (1887) Substâncias produtoras de íons hidrogênio em água fossem chamadas de ácidos Substâncias produtoras de íons hidroxila em água fossem chamadas de
TEORIA DE ÁCIDOS E BASES Proposição de S. Arrhenius (1887) Substâncias produtoras de íons hidrogênio em água fossem chamadas de ácidos Substâncias produtoras de íons hidroxila em água fossem chamadas de
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 4ª AULA PRÁTICA CONCEITO DE SOLUÇÕES TAMPÃO, ph E pk 1. Conceito de soluções tampão (ph e pk) 2. Principais
BIOQUÍMICA II SISTEMAS TAMPÃO NOS ORGANISMOS ANIMAIS 3/1/2012
 BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
BIOQUÍMICA II Professora: Ms. Renata Fontes Medicina Veterinária 3º Período O conteúdo de Bioquímica II utiliza os conhecimentos adquiridos referentes ao estudo do metabolismo celular e fenômenos físicos
FISIOLOGIA DO EXERCÍCIO
 FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
FISIOLOGIA DO EXERCÍCIO 1 Ventilação e metabolismo energético Equivalente ventilatório de oxigênio: Relação entre volume de ar ventilado (VaV) e a quantidade de oxigênio consumida pelos tecidos (VO2) indica
ph do sangue arterial = 7.4
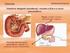 Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
Regulação do Equilíbrio Ácido Base ph do sangue arterial = 7.4 < 6.9 ou > 7.7 = MORTE 1 Importância do ph nos processos biológicos Protonação ou desprotonação de radicais proteicos Variação da carga total
O plasma sanguíneo contém uma reserva ("pool") total de carbonato (essencialmente HCO 3-
 Exercícios 1. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é 1,6 x 10-6. Calcular: a) O grau de ionização do ácido para uma solução 10-3 M. b) O ph 2. Segel, Biochemical
Exercícios 1. Segel, Biochemical Calculations, Capítulo 1, Problema 1-19. O Ka do ácido fraco HA é 1,6 x 10-6. Calcular: a) O grau de ionização do ácido para uma solução 10-3 M. b) O ph 2. Segel, Biochemical
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO. Profa. Dra. Celene Fernandes Bernardes
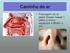 TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
TROCAS GASOSAS TRANSPORTE DE O 2 E CO 2 FUNÇOES DA HEMOGLOBINA QUÍMICA DA RESPIRAÇÃO Profa. Dra. Celene Fernandes Bernardes Plasma sanguíneo ph normal Acidose Alcalose Líquido extracelular Sangue arterial
Regulação renal do equilíbrio ácido base
 Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Universidade de São Paulo Faculdade de Medicina de Ribeirão Preto Informática Biomédica Regulação renal do equilíbrio ácido base Gabriela Silva Borges O que é ácido e base? Função Química conjunto de compostos
Homeostase do ph. Ácidos e Bases. HA H + + A - HCl H + + Cl - H 2 CO 3 H + + HCO H + + NH 3. Escala de ph
 Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Frederico Gueiros Filho Formação: Bacharelado em Biologia - UERJ Mestrado em Genética - UFRJ Doutorado - Harvard Medical School - EUA Pós-doutorado - Harvard, Depto. MCB - EUA Interesse de pesquisa: Mecanismo
Equilíbrio Ácido-base. Controle de ph por meio de soluções tampão
 Equilíbrio Ácido-base Controle de ph por meio de soluções tampão Conceitos Soluções tampão = são sistemas aquosos que tendem a resistir a mudanças no seu ph quando pequenas quantidades de ácido ( H + )
Equilíbrio Ácido-base Controle de ph por meio de soluções tampão Conceitos Soluções tampão = são sistemas aquosos que tendem a resistir a mudanças no seu ph quando pequenas quantidades de ácido ( H + )
tampão Prof a Alessandra Smaniotto QMC Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B
 Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Cap 3: Equilíbrio Químico Soluções tampão Prof a Alessandra Smaniotto QMC 5325 - Química Analítica Curso de Graduação em Farmácia Turmas 02102A e 02102B Água:excepcional habilidade em dissolver grande
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera o ph
FISIOLOGIA RESPIRATÓRIA REVISÃO
 FISIOLOGIA RESPIRATÓRIA REVISÃO Fisioterapia FMRPUSP Paulo Evora Revisão Anatômica O sistema respiratório consiste no nariz, faringe, laringe, traquéia, brônquios e pulmões. A pleura visceral cobre a superfície
FISIOLOGIA RESPIRATÓRIA REVISÃO Fisioterapia FMRPUSP Paulo Evora Revisão Anatômica O sistema respiratório consiste no nariz, faringe, laringe, traquéia, brônquios e pulmões. A pleura visceral cobre a superfície
Os sais são neutros, ácidos ou básicos? Íons como Ácidos e Bases
 Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Lembrando. Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico
 GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
GASOMETRIA Lembrando Ácidos são quaisquer substâncias capazes de ceder H+ Exemplos: ácido clorídrico, ácido lático, ácido úrico Lembrando Bases são quaisquer substâncias capazes de captar H+ Exemplos:
Aula Teórica 3 Cálculo de ph de Ácidos Fracos e Bases Fracas
 Aula Teórica 3 Cálculo de ph de Ácidos Fracos e Bases Fracas JRM Como calcular o ph de soluções de ácidos e bases fracas? Considere um ácido fraco (monoácido), HA H 2 O H OH - ------ Keq ~ 10-14 HA H A
Aula Teórica 3 Cálculo de ph de Ácidos Fracos e Bases Fracas JRM Como calcular o ph de soluções de ácidos e bases fracas? Considere um ácido fraco (monoácido), HA H 2 O H OH - ------ Keq ~ 10-14 HA H A
FCAV/ UNESP Jaboticabal. Disciplina: Química Geral Assunto: Solução Tampão. Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. SOLUÇÃO TAMPÃO Um tampão ou solução tampão é uma solução cujo ph varia muito pouco
05)Quanto ao ciclo de Krebs é INCORRETO afirmar que:
 FISIOLOGIA DO EXERCÍCIO Questões de Avaliação Parte I 01)Compare a energia produzida pela degradação da glicose pela via aeróbica e pela via anaeróbica terminando com o lactato, destacando quais as vantagens
FISIOLOGIA DO EXERCÍCIO Questões de Avaliação Parte I 01)Compare a energia produzida pela degradação da glicose pela via aeróbica e pela via anaeróbica terminando com o lactato, destacando quais as vantagens
Fisiologia do Sistema Urinário
 Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Sistema Urinário Fisiologia do Sistema Urinário Funções do sistema urinário Anatomia fisiológica do aparelho urinário Formação de urina pelos rins Filtração glomerular Reabsorção e secreção tubular Equilíbrio
Gabaritos Resolvidos Energia Química Semiextensivo V4 Frente C
 01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
01) E Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF < HCl < HBr < HI Ordem crescente de acidez (mais fraco para o mais forte) a) Errada é o HI (ácido mais forte); b) Errada
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA
 Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Disciplina de BIOQUÍMICA do Ciclo Básico de MEDICINA Universidade dos Açores 1º Ano ENSINO PRÁTICO 5ª AULA PRÁTICA EQUILÍBRIO ÁCIDO-BASE NO ORGANISMO HUMANO REGULAÇÃO DA CONCENTRAÇÃO HIDROGENIÓNICA - IMPORTÂNCIA
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
FCAV/ UNESP Jaboticabal Disciplina: Química Fisiológica Assunto: Solução Tampão Docente: Prof a. Dr a. Luciana M. Saran 1 1. INTRODUÇÃO Por que a adição de 0,01 mol de HCl à 1L de sangue humano, altera
Distúrbios Ácido Básicos
 Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Distúrbios Ácido Básicos Prof. Vinicius Coca Fisioterapeuta Especialista em Pneumofuncional Mestre em Terapia Intensiva - SOBRATI Mestre em Ensino na Saúde - UGF Equilíbrio Acidobásico O Equilíbrio acidobásico
Ciclo Respiratório Normal. Como Respiramos? Prova de Função Pulmonar. Que diz a espirometria? Espirômetro. Sensível ao volume.
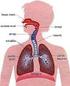 Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
Ciclo Respiratório Normal Como Respiramos? Prova de Função Pulmonar Que diz a espirometria? Espirômetro Sensível ao volume Sensível ao fluxo 1 FEV1 / FVC % Visão Geral da Hematose O índice espirométrico
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICOPRÁTICO 5ª AULA TEÓRICOPRÁTICA RESOLUÇÃO
CINÉTICA QUÍMICA Folha 15 Prof.: João Roberto Mazzei
 01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
Manutenção do ph do sangue
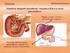 Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Manutenção do ph do sangue Muitos dos fluidos biológicos, quer no interior, quer no exterior das células, apresentam intervalos de ph muito apertados, ou seja um valor de ph praticamente constante, uma
Introdução à Bioquímica
 Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Introdução à Bioquímica Água Dra. Fernanda Canduri Laboratório de Sistemas BioMoleculares. Departamento de Física. UNESP São José do Rio Preto. SP. A água é fundamental para os seres vivos, atua como solvente
Acidez e Basicidade de Compostos Orgânicos
 Acidez e Basicidade de Compostos Orgânicos 1. Teorias sobre ácidos e bases Teoria de Arrhenius (1884) Substâncias neutras dissolvidas em água formam espécies carregadas ou íons através de dissociação iônica
Acidez e Basicidade de Compostos Orgânicos 1. Teorias sobre ácidos e bases Teoria de Arrhenius (1884) Substâncias neutras dissolvidas em água formam espécies carregadas ou íons através de dissociação iônica
CAPÍTULO 3 SISTEMA TAMPÃO
 17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
17 CAPÍTULO 3 SISTEMA TAMPÃO Introdução: As reações químicas no organismo estão sujeitas a certas limitações como faixas estreitas de ph e temperatura, devido à necessidade de se preservar o ambiente fisiológico.
Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016
 Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016 Tamponamento Substâncias que se dissociam em solução e liberam H + são denominadas ácidos Compostos que
Testes de Consumo máximo de Oxigênio (Vo 2 máx) Fisiologia Do Esforço Prof.Dra. Bruna Oneda 2016 Tamponamento Substâncias que se dissociam em solução e liberam H + são denominadas ácidos Compostos que
ROTEIRO PRÁTICO DE QUÍMICA GERAL
 ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
ROTEIRO PRÁTICO DE QUÍMICA GERAL 1- Objetivo 1. Estimar o ph de água destilada e de soluções aquosas usando indicadores ácidobase. 2. Diferenciar o comportamento de uma solução tampão. 2 Introdução Eletrólitos
AULA 3. Tratamento Sistemático do Equilíbrio Químico
 AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
1- Reação de auto-ionização da água
 Equilíbrio Iônico 1- Reação de auto-ionização da água A auto- ionização da água pura produz concentração muito baixa de íons H 3 O + ou H + e OH -. H 2 O H + (aq) + OH - (aq) (I) ou H 2 O + H 2 O H 3 O
Equilíbrio Iônico 1- Reação de auto-ionização da água A auto- ionização da água pura produz concentração muito baixa de íons H 3 O + ou H + e OH -. H 2 O H + (aq) + OH - (aq) (I) ou H 2 O + H 2 O H 3 O
Tampão. O que é? MISTURA DE UM ÁCIDO FRACO COM SUA BASE CONJUGADA, QUE ESTABILIZA O P H DE UMA SOLUÇÃO
 Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Tampões biológicos Relembrar os conceitos de ácido e base (Brönsted-Lowry), ph, pka; Compreender a importância do ph na manutenção da estrutura tridimensional das biomoléculas; Conhecer os valores de ph
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes)
 Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
Reações envolvendo substâncias em solução aquosa: (reações por via úmida) e reações por via seca (substâncias não dissolvidas em solventes) OBJETIVO: é possível fazer generalizações a respeito da ocorrência
Composição Química das Células: Água e Sais Minerais
 Composição Química das Células: Água e Sais Minerais Uma das evidências da evolução biológica e da ancestralidade comum dos seres vivos é que todas as formas de vida possuem composição química semelhante.
Composição Química das Células: Água e Sais Minerais Uma das evidências da evolução biológica e da ancestralidade comum dos seres vivos é que todas as formas de vida possuem composição química semelhante.
Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro:
 TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
TROCAS GASOSAS E CONTROLE DO TRANSPORTE DE GASES Objetivo: Estudar os mecanismos fisiológicos responsáveis pelas trocas gasosas e pelo controle do transporte de gases Roteiro: 1. Trocas gasosas 1.1. Locais
Água, ph e tampão. Profa. Alana Cecília
 Água, ph e tampão Profa. Alana Cecília Água: Estrutura e Propriedades Físico-químicas A água é o principal componente da maioria das células; Permeia todas as porções de todas as células; Importância em
Água, ph e tampão Profa. Alana Cecília Água: Estrutura e Propriedades Físico-químicas A água é o principal componente da maioria das células; Permeia todas as porções de todas as células; Importância em
QUI109 QUÍMICA GERAL (Ciências Biológicas) 10ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 10ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) EQUILÍBRIO QUÍMICO T 1 T 2 T 2 > T 1 N 2 O 4 (g) 2NO 2 (g) EQUILÍBRIO
QUI109 QUÍMICA GERAL (Ciências Biológicas) 10ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) EQUILÍBRIO QUÍMICO T 1 T 2 T 2 > T 1 N 2 O 4 (g) 2NO 2 (g) EQUILÍBRIO
Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG
 Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
Gasometria Arterial Profª Allana dos Reis Corrêa Enfermeira SAMU BH Mestranda em Enfermagem UFMG Gasometria arterial Por quê a Gasometria se temos o Oxímetro de pulso e Capnógrafo? Gasometria Arterial
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei
 EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
EQUILÍBRIOS: QUÍMICO E IÔNICO Profº Jaison Mattei Reações completas ou irreversíveis São reações nas quais os reagentes são totalmente convertidos em produtos, não havendo sobra de reagente, ao final da
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
Química C Semiextensivo V. 4
 Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
Química C Semiextensivo V. Exercícios 01) E 02) B 0) D 0) C 05) B Quanto maior a constante ácida, maior a força do ácido (acidez). Assim, HF
Ácidos e Bases. Funções Inorgânicas
 Ácidos e Bases Funções Inorgânicas Funções Inorgânicas As substâncias podem ser classificadas em duas classes: Substâncias orgânicas: aquelas que contém carbono. Substâncias inorgânicas: aquelas formadas
Ácidos e Bases Funções Inorgânicas Funções Inorgânicas As substâncias podem ser classificadas em duas classes: Substâncias orgânicas: aquelas que contém carbono. Substâncias inorgânicas: aquelas formadas
ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL. Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal.
 1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
1 ESTUDO DIRIGIDO SOBRE FISIOLOGIA RENAL Abaixo, encontram-se os pontos que precisam ser estudados na área de Fisiologia Renal. Anatomia funcional do rim As diferenças entre a circulação cortical e medular
Balanço Eletrolítico e Equilíbrio Ácido-Base
 Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Balanço Eletrolítico e Equilíbrio Ácido-Base Junio Flávio Barroso DSM Nutritional Products Realização Balanço Eletrolítico e Equilíbrio Ácido-Base Agenda: -O que é BE? -Cálculo do BE: -Níveis de BE: -Equilíbrio
Experimentalmente, definimos a FAIXA DE TAMPONAMENTO de um tampão, sendo o intervalo de 1 unidade acima e 1 unidade abaixo do pka:
 3a LISTA DE EXERCÍCIOS DE TRANSFORMAÇÕES BIOQUÍMICAS PROF. Ana Paula de Mattos Arêas Dau 22/02/2010 03. Defina faixa de tamponamento e poder tamponante. Do que depende cada um? Estes tampões diferem entre
3a LISTA DE EXERCÍCIOS DE TRANSFORMAÇÕES BIOQUÍMICAS PROF. Ana Paula de Mattos Arêas Dau 22/02/2010 03. Defina faixa de tamponamento e poder tamponante. Do que depende cada um? Estes tampões diferem entre
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE
 Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Petr Soares de Alencar DISTÚRBIOS DO EQUILÍBRIO ÁCIDO BASE GASOMETRIA ARTERIAL GASOMETRIA ARTERIAL Paciente com os seguintes valores na gasometria arterial: ph = 7,08; HCO - 3 = 10mEq/litro; PCO 2 = 35
Capítulo by Pearson Education
 QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
QUÍMICA A Ciência Central 9ª Edição Aspectos adicionais dos equilíbrios aquosos David P. White O efeito do íon comum A solubilidade de um sal parcialmente solúvel diminui quando um íon comum é adicionado.
EQUILÍBRIO ÁCIDO BASE. Profa. Marcia M. Meier QUÍMICA GERAL II
 EQUILÍBRIO ÁCIDO BASE Profa. Marcia M. Meier QUÍMICA GERAL II 1 EQUILÍBRIO ÁCIDO BASE Ácidos e bases são dois tipos muito comuns de substâncias encontradas no laboratório e no mundo cotidiano. Inclusive
EQUILÍBRIO ÁCIDO BASE Profa. Marcia M. Meier QUÍMICA GERAL II 1 EQUILÍBRIO ÁCIDO BASE Ácidos e bases são dois tipos muito comuns de substâncias encontradas no laboratório e no mundo cotidiano. Inclusive
QUÍMICA GERAL Ácidos e Bases
 QUÍMICA GERAL Ácidos e Bases Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia 1 Produto iônico da água A água
QUÍMICA GERAL Ácidos e Bases Prof. Dr. Anselmo E. de Oliveira Instituto de Química, UFG anselmo.quimica.ufg.br anselmo.disciplinas@gmail.com 8 de Novembro de 2018 Agronomia 1 Produto iônico da água A água
Exercícios de Aprofundamento Biologia Trocas Gasosas
 1. (Unesp 2014) Os gráficos representam a concentração de três gases no sangue assim que passam pelos alvéolos pulmonares. É correto afirmar que os gráficos que representam as concentrações dos gases O
1. (Unesp 2014) Os gráficos representam a concentração de três gases no sangue assim que passam pelos alvéolos pulmonares. É correto afirmar que os gráficos que representam as concentrações dos gases O
P4 - PROVA DE QUÍMICA GERAL 05/12/12
 P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
P4 - PROVA DE QUÍMICA GERAL 05/12/12 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: 273,15 K = 0 C R = 0,0821
21/07/14. Processos metabólicos. Conceitos Básicos. Respiração. Catabolismo de proteínas e ácidos nucleicos. Catabolismo de glicídios
 Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
Prof. Dr. Adriano Bonfim Carregaro Medicina Veterinária FZEA USP www.anestesia.vet.br Processos metabólicos Respiração Catabolismo de proteínas e ácidos nucleicos Ácidos acético, sulfúrico, fosfórico e
INTRODUÇÃO À FISIOLOGIA HUMANA CMF-1
 INTRODUÇÃO À FISIOLOGIA HUMANA CMF-1 Professores: Clarissa, Lillian, Lucinda e Ricardo O QUE É FISIOLOGIA HUMANA? Estudo do funcionamento dos órgãos e sistemas que constituem o organismo humano. ANATOMIA
INTRODUÇÃO À FISIOLOGIA HUMANA CMF-1 Professores: Clarissa, Lillian, Lucinda e Ricardo O QUE É FISIOLOGIA HUMANA? Estudo do funcionamento dos órgãos e sistemas que constituem o organismo humano. ANATOMIA
4. Ácidos e Bases em Química Orgânica
 4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
Ácidos, bases e sistemas tampão
 Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Ácidos, bases e sistemas tampão Ionização da água A água pura tem uma baixa concentração de iões hidrónio (H 3 O + ) e uma igual concentração de iões hidróxido (OH - ) Os ácidos são dadores de protões
Equilíbrio Ácido Base. Definição de Brønsted-Lowry. O íon H + (aq) é simplesmente um próton sem elétrons. Em água, o H + (aq) forma aglomerados.
 Equilíbrio Ácido Base Definição de Brønsted-Lowry Ácidos têm gosto azedo e bases têm gosto amargo. Definição de Arrhenius: os ácidos aumentam a [H + ] e as bases aumentam a [OH ] em solução. Arrhenius:
Equilíbrio Ácido Base Definição de Brønsted-Lowry Ácidos têm gosto azedo e bases têm gosto amargo. Definição de Arrhenius: os ácidos aumentam a [H + ] e as bases aumentam a [OH ] em solução. Arrhenius:
CRONOGRAMA DE RECUPERAÇÃO ATIVIDADE DE RECUPERAÇÃO
 CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
CRONOGRAMA DE RECUPERAÇÃO SÉRIE: 2ª série do EM DISCIPLINA: QUÍMICA 1 Caderno Número(s) da(s) Assuntos aula(s) 06 15, 16 e 17 Misturas de soluções com reação e titulação. 06 18 e 19 Termoquímica 07 28
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I
 Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Modelos Gerais de Ácidos, Bases e Reações Ácido-Base
 Modelos Gerais de Ácidos, Bases e Reações Ácido-Base Prof.: Willame Bezerra A Química dos Ácidos e Bases Os ácidos e as bases estão presentes em toda parte. Os vulcões e as fontes térmicas podem ser muito
Modelos Gerais de Ácidos, Bases e Reações Ácido-Base Prof.: Willame Bezerra A Química dos Ácidos e Bases Os ácidos e as bases estão presentes em toda parte. Os vulcões e as fontes térmicas podem ser muito
Fundamentos de Química Profa. Janete Yariwake. Equilíbrio químico em solução aquosa. Soluções-tampão. Soluções tampão
 Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
Equilíbrio químico em solução aquosa Soluções-tampão 1 Soluções tampão Definição: soluções que podem resistir a variações significativas de ph. (se adicionamos quantidades pequenas de ácidos fortes ou
QUÍMICA ANALÍTICA SOLUÇÃO TAMPÃO E PRODUTO DE SOLUBILIDADE. Prof.a. Dra. Renata P. Herrera Brandelero. Dois Vizinhos - PR 2012
 QUÍMICA ANALÍTICA SOLUÇÃO TAMPÃO E PRODUTO DE SOLUBILIDADE Prof.a. Dra. Renata P. Herrera Brandelero Dois Vizinhos - PR 2012 Soluções Tampões Soluções tampões são formadas por uma mistura de um ácido e
QUÍMICA ANALÍTICA SOLUÇÃO TAMPÃO E PRODUTO DE SOLUBILIDADE Prof.a. Dra. Renata P. Herrera Brandelero Dois Vizinhos - PR 2012 Soluções Tampões Soluções tampões são formadas por uma mistura de um ácido e
Ácidos e Bases. a) Produto iônico da água
 1 Ácidos e Bases a) Produto iônico da água A água é anfiprótica. Ou seja, ela tanto doa, com aceita prótons Reação direta: 2H 2O(l) H 3O + (aq) + OH (aq) autoprotólise: uma molécula transfere um próton
1 Ácidos e Bases a) Produto iônico da água A água é anfiprótica. Ou seja, ela tanto doa, com aceita prótons Reação direta: 2H 2O(l) H 3O + (aq) + OH (aq) autoprotólise: uma molécula transfere um próton
CONCEITO DE ÁCIDOS E BASES 1
 CONCEITO DE ÁCIDOS E BASES 1 1. Conceito de Arrhenius A primeira definição de ácidos e bases foi dada pelo químico sueco Svante Arrhenius ao redor de 1884: Substâncias ácidas são aquelas que em solução
CONCEITO DE ÁCIDOS E BASES 1 1. Conceito de Arrhenius A primeira definição de ácidos e bases foi dada pelo químico sueco Svante Arrhenius ao redor de 1884: Substâncias ácidas são aquelas que em solução
EQUILÍBRIO ÁCIDO-BASE 1
 EQUILÍBRIO ÁCIDO-BASE 1 1- Definição de ph Os possíveis valores da concentração de H + e OH -, em uma solução aquosa, podem ser de várias ordens de magnitude, variando de cerca de 10 1,3 a 10-15,3. Assim
EQUILÍBRIO ÁCIDO-BASE 1 1- Definição de ph Os possíveis valores da concentração de H + e OH -, em uma solução aquosa, podem ser de várias ordens de magnitude, variando de cerca de 10 1,3 a 10-15,3. Assim
10/22/2013. Segunda Avaliação (20/11): Precipitações Fracionadas. - Precipitações Fracionadas. - Auto-Ionização da Água
 Segunda Avaliação (20/11): - Precipitações Fracionadas - Auto-Ionização da Água - Equílíbrio Químico Tratamento Sistemático - Equilíbrio Ácido-Base e cálculos de ph - Sistemas Tamponantes - Hidrólise 1
Segunda Avaliação (20/11): - Precipitações Fracionadas - Auto-Ionização da Água - Equílíbrio Químico Tratamento Sistemático - Equilíbrio Ácido-Base e cálculos de ph - Sistemas Tamponantes - Hidrólise 1
COVEST/UFPE ª ETAPA
 COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
 Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
AULA 3 ANATOMIA E FUNÇÕES DAS VIAS RESPIRATÓRIAS.
 AULA 3 ANATOMIA E FUNÇÕES DAS VIAS RESPIRATÓRIAS. A perfeita compreensão do funcionamento dos métodos e das técnicas de assistência respiratória extracorpórea pelo emprego de aparelhos que são genericamente
AULA 3 ANATOMIA E FUNÇÕES DAS VIAS RESPIRATÓRIAS. A perfeita compreensão do funcionamento dos métodos e das técnicas de assistência respiratória extracorpórea pelo emprego de aparelhos que são genericamente
Origens do potencial de membrana Excitabilidade celular
 Origens do potencial de membrana Excitabilidade celular Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana. Alterações na permeabilidade
Origens do potencial de membrana Excitabilidade celular Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana. Alterações na permeabilidade
Equilíbrio Ácido-base
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina Química das Soluções QUI084 I semestre 2017 AULA 03 Equilíbrio Ácido-base Solução Tampão Profa. Maria
Introdução ao estudo de neurofisiologia
 Introdução ao estudo de neurofisiologia Introdução ao estudo de neurofisiologia Peixe Réptil Ave Boi Humano Por que os cérebros são diferentes entre as espécies? Introdução ao estudo de neurofisiologia
Introdução ao estudo de neurofisiologia Introdução ao estudo de neurofisiologia Peixe Réptil Ave Boi Humano Por que os cérebros são diferentes entre as espécies? Introdução ao estudo de neurofisiologia
BCL 0307 Transformações Químicas
 BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 11 Por favor, deixem as calculadoras a postos! http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html
BCL 0307 Transformações Químicas Prof. Dr. André Sarto Polo Bloco B S. 1014 ou L202 andre.polo@ufabc.edu.br Aula 11 Por favor, deixem as calculadoras a postos! http://pesquisa.ufabc.edu.br/pologroup/transformacoes_quimicas.html
Bioquímica: Componentes orgânicos e inorgânicos necessários à vida. Leandro Pereira Canuto
 Bioquímica: orgânicos e inorgânicos necessários à vida Leandro Pereira Canuto Toda matéria viva: C H O N P S inorgânicos orgânicos Água Sais Minerais inorgânicos orgânicos Carboidratos Proteínas Lipídios
Bioquímica: orgânicos e inorgânicos necessários à vida Leandro Pereira Canuto Toda matéria viva: C H O N P S inorgânicos orgânicos Água Sais Minerais inorgânicos orgânicos Carboidratos Proteínas Lipídios
André Silva Franco ASF Escola Olímpica de Química Julho de 2011
 André Silva Franco ASF Escola Olímpica de Química Julho de 011 Origem Termodinâmica do Equilíbrio Numa reação, o equilíbrio ocorre quando a energia livre é nula. A O que é Q? a B B Quociente reacional:
André Silva Franco ASF Escola Olímpica de Química Julho de 011 Origem Termodinâmica do Equilíbrio Numa reação, o equilíbrio ocorre quando a energia livre é nula. A O que é Q? a B B Quociente reacional:
Reações ácido-base. Ácidos. Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre).
 Ácidos Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre). H + é conhecido como próton Ácidos com um próton ácido são chamados monopróticos (por
Ácidos Ácido = substâncias que se ionizam para formar H + em solução (por exemplo, HCl, HNO 3, CH 3 CO 2 H - vinagre). H + é conhecido como próton Ácidos com um próton ácido são chamados monopróticos (por
Cronograma. Introdução à disciplina de FISIOLOGIA. Conceito de Homeostasia AULA 1 - FISIOLOGIA APLIC. A ATIV. MOTORA
 Cronograma Introdução à disciplina de FISIOLOGIA Conceito de Homeostasia EMENTA: Estudo do funcionamento dos órgãos e sistemas orgânicos (cardiovascular, respiratório, muscular e neuroendócrino) no repouso
Cronograma Introdução à disciplina de FISIOLOGIA Conceito de Homeostasia EMENTA: Estudo do funcionamento dos órgãos e sistemas orgânicos (cardiovascular, respiratório, muscular e neuroendócrino) no repouso
Fundamentos de Química Profa. Janete Yariwake
 Soluções. Equilíbrio químico em solução aquosa Equilíbrio químico: ácidos e bases 1 ácidos e bases cf. Arrhenius Exemplo: Preparo de uma solução de HCl em água HCl (aq) + H 2 O H 3 O + (aq) + Cl (aq) íon
Soluções. Equilíbrio químico em solução aquosa Equilíbrio químico: ácidos e bases 1 ácidos e bases cf. Arrhenius Exemplo: Preparo de uma solução de HCl em água HCl (aq) + H 2 O H 3 O + (aq) + Cl (aq) íon
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos
 Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
Função de proteínas As funções de muitas proteínas envolvem a ligação reversível de outras moléculas - ligandos Um ligando liga-se ao local de ligação que lhe é complementar. A interacção é específica.
ALCALOSES 1. Introdução HA H + +A -.
 ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
ALCALOSES 1 Introdução Acidose e alcalose referem-se aos mecanismos fisiopatológicos que causam acúmulo de ácido ou base no organismo. Os termos acidemia e alcalemia referem-se ao ph no fluido extracelular.
EXAMES COMPLEMENTARES GASOMETRIA GASOMETRIA ARTERIAL EQUILÍBRIO ÁCIDO - BÁSICO EQUILÍBRIO ÁCIDO - BÁSICO
 GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
GASOMETRIA ARTERIAL EXAMES COMPLEMENTARES GASOMETRIA A gasometria arterial é um exame invasivo que mede as concentrações de oxigênio, a ventilação e o estado ácido-básico. Prof. Carlos Cezar I. S. Ovalle
06) Considere a aparelhagem desenhada a seguir, empregada para testes de condutividade elétrica. O teste deu positivo com qual dos líquidos?
 TEORIA DE ARRHENIUS 01) (Puc-SP) Dados os compostos A: CH 3 COONa (Sal: acetato de sódio) B: CH 3 COOH (ácido acético) C: CH 3 CH 2 OH (álcool etílico) D: C 6 H 12 O 6 (glicose) Pede-se: a) Quais os que
TEORIA DE ARRHENIUS 01) (Puc-SP) Dados os compostos A: CH 3 COONa (Sal: acetato de sódio) B: CH 3 COOH (ácido acético) C: CH 3 CH 2 OH (álcool etílico) D: C 6 H 12 O 6 (glicose) Pede-se: a) Quais os que
Resolução UNIFESP 2015
 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
