Guia para Realização de Estudos não Clínicos e Clínicos para Registro de Heparinas como Produto Biológico pela Via de Desenvolvimento por
|
|
|
- Dina Chagas Marinho
- 6 Há anos
- Visualizações:
Transcrição
1 Guia para Realização de Estudos não Clínicos e Clínicos para Registro de Heparinas como Produto Biológico pela Via de Desenvolvimento por Comparabilidade
2 Agência Nacional de Vigilância Sanitária Anvisa Guia para Realização de Estudos Não Clínicos e Clínicos para Registro de Heparinas como Produto Biológico pela Via de Desenvolvimento por Comparabilidade Brasília 2011
3 Copyright Agência Nacional de Vigilância Sanitária. É permitida a reprodução parcial ou total desta obra, desde que citada a fonte. Diretor-Presidente Dirceu Aparecido Brás Barbano Diretores Jaime César de Moura Oliveira José Agenor Álvares da Silva Maria Cecília Martins Brito Adjunto do Diretor-Presidente Luiz Roberto da Silva Klassmann Adjuntos de Diretores Luciana Shimizu Takara Neilton Araujo de Oliveira Luiz Armando Erthal Chefe de Gabinete Vera Maria Borralho Bacelar Gerência Geral de Medicamentos Norberto Rech Gerência de Avaliação de Segurança e Eficácia Laura Gomes Castanheira Elaboração e edição AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA SIA Trecho 5, Área Especial 57, Lote , Brasília DF Tel.: (61) Home page: Participação direta: Coordenação de Registro de Produtos Biológicos Coordenação de Pesquisa, Ensaios Clínicos e Registro de Medicamentos Novos
4 Sumário 1 Introdução Considerações Gerais Estudos não clínicos Estudos clínicos Extrapolação da Indicação Plano de Farmacovigilância Referências...9 Guia para realização de estudos não clínicos e clínicos para registro de heparinas como produto biológico pela via de desenvolvimento por comparabilidade 3
5 1 Introdução O presente guia estabelece as exigências clínicas e não-clínicas para o registro de heparinas na Anvisa, como produto biológico, utilizando a via da desenvolvimento por comparabilidade. A seção não-clínica trata das exigências fármaco-toxicológicas, e a seção clínica aborda as exigências para os estudos de farmacocinética, farmacodinâmica, eficácia e de segurança, assim como os aspectos de farmacovigilância. É apresentada ainda sugestão de um protocolo clínico Fase III. Neste guia trazemos orientações gerais para a condução de estudos não-clínicos e clíncos para registro de heparinas pela via de desenvolvimento por comparabilidade. Porém, caso o pesquisador/instituição consiga comprovar a eficácia e segurança desses fármacos por outros estudos científica e tecnicamente mais viáveis, os dados apresentados serão avaliados pela ANVISA e o desvio das orientações do guia deverá sempre ser justificado. São abordados neste Guia somente os requisitos para os estudos não-clínicos e clínicos aplicáveis para o registro de heparinas pela via de desenvolvimento por comparabilidade, sendo que todos os demais itens das normas específicas devem ser cumpridos para o registro sanitário do produto. 2 Considerações Gerais A heparina é um membro heterogêneo e sulfatado da família dos glicosaminoglicanos de carboidratos contendo várias unidades de dissacarídeos. A unidade de dissacarídeo mais comum é composta de um ácido α-l-idurônico 2-O-sulfatado e α-d-glucosamina N-sulfatada, IdoA (2S)-GlcNS(6S). A heparina endógena é sintetizada em grânulos de mastócitos e possui a densidade de carga negativa mais alta de todas as moléculas biológicas conhecidas. A heparina usada para fins terapêuticos é proveniente de animais domésticos, principalmente da mucosa intestinal do suíno. A heparina cataliza a inibição de várias serina proteases do sistema de coagulação plasmática pela antitrombina (AT). Para a ligação da heparina à AT, uma sequência de pentassacarídeos, que contém um resíduo de glucosamina 3-O-sulfatada, é importante. Mediante a ligação à antitrombina III, a heparina causa uma mudança conformacional na molécula de antitrombina, que resulta no aumento da afinidade de ligação trombina-antitrombina III. Além disso, a heparina age como um modelo catalítico ao qual se liga o inibidor e a serina protease ativada, tais como a trombina e os fatores IXa e XIa. Esse efeito depende essencialmente do número de monossacarídeos na molécula de heparina. As moléculas de heparina que contêm menos de 18 monossacarídeos não aumentam a inibição da trombina pela antitrombina III, mas ainda inativam o fator Xa. A heparina aumenta a taxa da reação trombina-antitrombina em pelo menos mil vezes, o que resulta em um complexo 1:1, depois que a serina protease reage com uma ligação peptídica Arg-Ser específica. Além disso, a heparina possui outras inúmeras interações celulares e plasmáticas, mas, sobretudo, em comparação ao efeito anticoagulante, a relevância clínica dessas interações é incerta e insuficientemente investigada. Administra-se a heparina por via parenteral, uma vez que essa se degrada quando tomada por via oral. Pode ser injetada por via intravenosa, intra-arterial ou subcutânea, enquanto as injeções intramusculares devem ser evitadas, por causa do risco de induzir hematomas. As heparinas de baixo peso molecular são preparadas de heparina não-fracionada por vários processos de despolimerização enzimática ou química. Desse modo, o material de partida das heparinas de baixo peso molecular é de origem biológica, e o processo de fabricação define as características de uma substância medicamentosa. A complexidade da heparina resulta amplamente da natureza do material de partida (heparina não-fracionada extraída da mucosa de suíno ou de outros tecidos animais), da extração, do fracionamento e dos processos de produção. Dispõe-se de métodos de última geração para a caracterização físico-química dos produtos de heparina. No entanto, no momento, não se sabe até que ponto os múltiplos diferentes polissacarídeos contribuem com os efeitos clínicos relevantes para a eficácia e segurança do produto. Uma heparina de baixo peso molecular específica difere da heparina não-fracionada e de outras heparinas de baixo peso molecular em suas propriedades farmacocinéticas e farmacodinâmicas. Como um resultado do processo de despolimerização, 4 Guia para realização de estudos não clínicos e clínicos para registro de heparinas como produto biológico pela via de desenvolvimento por comparabilidade
6 elas são principalmente enriquecidas em moléculas com menos de 18 unidades de monossacarídeos. Essa redução do tamanho da molécula está associada a uma perda da atividade de inibição da trombina em comparação à heparina padrão e a um aumento de inibição do FXa. Em virtude das dificuldades na detecção física da heparina, não se pode realizar estudos farmacocinéticos convencionais. Em vez disso, a absorção e eliminação das heparinas são estudadas usando-se testes farmacodinâmicos, incluindo a medição da atividade de anti-fxa e anti-fiia. Existem várias heparinas registradas que diferem em seu material fonte, processo de fabricação, propriedades farmacocinética/ farmacodinâmica e indicações terapêuticas, as quais incluem tratamento e profilaxia para trombose venosa profunda e prevenção de complicações de síndromes coronarianas agudas (angina instável, não-stemi (Infarto agudo do miocárdio sem elevação ST e STEMI (infarto agudo do miocárdio com elevação ST). As reações adversas mais comuns induzidas pelas heparinas são hemorragias, das quais a mais séria é a raramente observada trombocitopenia tipo II induzida pela heparina (HIT II). Esse processo é ativado pela indução de anticorpos direcionados contra neo-antígenos dos complexos heparina-fator plaquetário-4 (PF). A ligação desses complexos de anticorpo-heparina-pf4 pode ativar as plaquetas e gerar microagregados plaquetários trombogênicos. Os pacientes que desenvolvem trombocitopenia correm o risco de complicações tromboembólicas - venosa e arterial (trombose e trombocitopenia induzidas pela heparina, HITT). Embora os riscos dessas reações adversas pareçam estar reduzidos em comparação à heparina não-fracionada, é obrigatório monitorar a contagem de plaquetas regularmente em todos os pacientes usando heparinas de baixo peso molecular, e realizar testes quanto aos anticorpos do complexo heparina PF4 naqueles que desenvolverem trombocitopenia ou complicações tromboembólicas durante o tratamento com heparina. Concluindo, a heterogeneidade da heparina é muito alta, o modo de ação não está completamente compreendido,e é incerto se os marcadores farmacodinâmicos são representativos para o resultado clínico. Desse modo, a melhor forma de demonstração de similaridade entre heparinas é por meio de um estudo clínico. Este guia não trata das exigências de qualidade. Para os aspectos relativos à qualidade, aplicam-se os princípios conforme dispostos no Guia para realização do exercício de comparabilidade para registro de produtos biológicos pela via da comparabilidade e a RDC n 55/10 e suas atualizações. De acordo com a RDC n 55/10 o produto biológico comparador (PBC) citado no decorrer deste guia é a heparina registrada na Anvisa mediante apresentação de um dossiê completo. 3 Estudos não clínicos Antes de iniciar o desenvolvimento clínico, devem-se realizar estudos não-clínicos. Os estudos não-clíncos devem ser de natureza comparativa e projetados para detectar diferenças na resposta fármaco-toxicológica entre a heparina e o PBC, e não apenas para avaliar a resposta propriamente dita. A abordagem adotada precisará ser completamente justificada no resumo não-clínico. Estudos farmacodinâmicos Estudos in vitro: A fim de comparar as alterações na atividade entre a heparina que se pretende registrar e o PBC, deve-se fornecer dados de uma série de bioensaios comparativos (com base no conhecimento mais avançado sobre os efeitos farmacodinâmicos clinicamente relevantes da heparina e incluindo, pelo menos, avaliações da atividade do anti-fxa e anti-fiia), sendo que vários destes ensaios já farão parte do dossiê de qualidade no exercício de comparabilidade. Estudos in vivo: Deve-se comparar a atividade farmacodinâmica in vivo da heparina que se pretende registrar e do PBC em: um modelo farmacodinâmico in vivo adequado, que leve em consideração o conhecimento mais avançado sobre Guia para realização de estudos não clínicos e clínicos para registro de heparinas como produto biológico pela via de desenvolvimento por comparabilidade 5
7 os efeitos farmacodinâmicos clinicamente relevantes da heparina e incluir, pelo menos, uma avaliação da atividade do anti-fxa e anti-fiia e da liberação do inibidor da via do fator tecidual. Se possível, essas avaliações devem ser realizadas como parte de um estudo de toxicidade de dose repetida. e/ou de acordo com a(s) indicação(ões) clínica(s) pretendida(s), um modelo animal venoso ou um modelo de trombose arterial adequado. Estudos de Toxicologia Deve-se fornecer dados de, pelo menos, um estudo de toxicidade de dose repetida em espécies relevantes (por exemplo, rato). Deve-se escolher a duração do estudo de acordo com a duração pretendida da aplicação clínica, no entanto, esse deve durar pelo menos 4 semanas. Deve-se dar uma ênfase especial para a determinação dos efeitos na coagulação sanguínea/hemostasia. Uma vez que, em virtude de dificuldades na detecção física das heparinas, os estudos de toxicocinética convencionais não podem ser realizados, deve-se monitorar a exposição dos animais de estudo avaliando-se adequadamente os marcadores farmacodinâmicos (veja, estudos farmacodinâmicos in vivo). Devem-se fornecer os dados sobre a tolerância local em pelo menos uma espécie. Se possível, esses testes de tolerância local podem ser realizados como parte de um estudo de toxicidade de dose repetida. Estudos de farmacologia de segurança, toxicologia de reprodução, mutagenicidade e carcinogenicidade não são exigências de rotina para os testes não-clínicos de um produto medicinal biológico que contenha heparina. 4 Estudos clínicos Estudos de Farmacocinética/ Farmacodinâmica Em virtude da heterogeneidade das heparinas, não se podem realizar estudos farmacocinéticos convencionais. Em vez disso, as características de absorção e eliminação das heparinas devem ser comparadas pela determinação das atividades farmacodinâmicas (incluindo anti-fxa e anti-fiia), como marcadores substitutivos (surrogate) por suas concentrações circulantes. Além disso, outros testes de farmacodinâmica, tais como a atividade do Inibidor da Via do Fator Tecidual (TFPI), assim como a razão da atividade anti-fxa e anti-fiia devem ser comparadas. A avaliação desses parâmetros farmacodinâmicos fornecerá uma evidência do perfil do polissacarídeo. Essas propriedades farmacocinéticas / farmacodinâmicas da heparina que se pretende registrar e do PBC devem ser comparadas em um estudo randomizado, de dose única e cruzado, em voluntários saudáveis usando administração subcutânea. No caso de o PBC ser também licenciado para as vias intravenosa e intra-arterial, deve-se realizar um estudo comparativo adicional por meio da via intravenosa, caso se deseje utilizar esta via. As doses selecionadas devem estar na parte sensível da curva de dose-resposta e dentro das variações de dose recomendadas para as diferentes indicações. As margens de equivalência devem ser pré-especificadas e apropriadamente justificadas. Eficácia Clínica Uma vez que não se tem estabelecido uma clara correlação entre os parâmetros substitutos (anti-fxa ou anti-fiia) e os resultados clínicos, um produto biológico que contenha heparina deve demonstrar eficácia e segurança equivalentes ao PBC. Essa equivalência terapêutica deve ser demonstrada em, pelo menos, um estudo clínico, adequadamente desenvolvido, randomizado, duplo cego e de grupos paralelos. Para o caso de heparinas de baixo peso molecular (enoxaparinas), isso poderia ser feito em um quadro de prevenção de 6 Guia para realização de estudos não clínicos e clínicos para registro de heparinas como produto biológico pela via de desenvolvimento por comparabilidade
8 trombolembolismo venoso ou arterial, ou em um quadro de tratamento de tromboembolismo venoso. No entanto, deve-se selecionar o modelo mais sensível para detectar as diferenças potenciais na eficácia entre a heparina que se pretende registrar e o PBC. Os pacientes cirúrgicos têm a prevalência mais alta de tromboembolismo venoso (TEV). Além disso, a vasta maioria dos estudos clínicos publicados foi realizada em pacientes cirúrgicos com alto risco de TEV, especialmente em pacientes com cirurgia de joelho ou quadril, e, desse modo, o conhecimento sobre a influência dos tipos de cirurgia, duração dos estudos clínicos e riscos de hemorragia é o mais exato para essa população de pacientes. Portanto, recomenda-se demonstrar a eficácia na prevenção do TEV nos pacientes submetidos à cirurgia com alto risco de desenvolverem tal condição. Preferivelmente, deve-se conduzir o estudo clínico em cirurgia ortopédica de grande porte, como a cirurgia de quadril. Neste quadro clínico, os pacientes com fratura no quadril devem ser bem representados no estudo, uma vez que apresentam tanto um alto risco trombótico quanto um alto risco de hemorragia perioperatória. A posologia e a administração devem seguir as recomendações de bula para profilaxia com o produto biológico comparador em pacientes que necessitem de profilaxia prolongada para o TEV. No quadro de prevenção de TEV, o desfecho [endpoint] clinicamente mais relevante consiste em trombose venosa profunda (TVP) proximal, embolismo pulmonar (EP) e morte relacionada ao TEV. No entanto, a eficácia e a segurança comparativas de dois produtos podem também ser avaliadas usando o desfecho substituto composto, que consiste em um número total de eventos tromboembólicos (total de TVP, EP e morte relacionada à TEV). A adjudicação dos eventos de TEV deve ser realizada por um comitê central de especialistas, independente e em caráter cego. O estudo deve seguir um desenho de equivalência estrita, no qual as margens de equivalência devem ser definidas a priori e justificadas adequadamente, em primeiro lugar, por fundamentos clínicos. O estudo deve ser desenvolvido para demonstrar a equivalência terapêutica em um dos desfechos recomendados, mencionados acima. A técnica de imagem de última geração deve ser usada para a avaliação do desfecho. Enquanto as TVPs proximais podem ser diagnosticadas com uma alta especificidade e sensibilidade usando ultra-sonografia, uma avaliação clara da TVP distal é possível apenas usando venografia bilateral. Por isso, o procedimento diagnóstico é obrigatório em estudos clínicos que incluam a TVP total no desfecho. Os componentes mais relevantes do desfecho primário (em particular no número de TVPs, EP e mortes) devem apoiar favoravelmente a similaridade dos dois produtos. A avaliação do desfecho primário deve ser realizada no momento da ocorrência dos sintomas sugestivos de TVE ou em pacientes assintomáticos no final do tratamento. O acompanhamento geral deve ser pelo menos de 60 dias para detectar os eventos tromboembólicos tardios. Para o caso das heparinas, após o exercício de comparabilidade, os estudos não clínicos e os estudos clínicos Fase I e II (quando necessário) a Anvisa considera viável um modelo de estudo Fase III de não inferioridade, duplo cego e comparativo de eficácia entre a heparina registrada na ANVISA com base em um dossiê completo (produto biológico comparador) e a heparina que se pretende registrar. A população alvo deverá ser composta por pacientes adultos de ambos os sexos submetidos a cirurgia cardiovascular com necessidade de auxílio de circulação extracorpórea. Os objetivos primários do estudo serão a verificação da eficácia e segurança da heparina que se pretende registrar em relação ao produto biológico comparador registrado na ANVISA. Os defechos (enpoints) primários de eficácia deverão ser a verificação do controle da hemostasia durante e após o procedimento cirúrgico através do acompanhamento de dados da evolução do sangramento do paciente e a avaliação da atividade da heparina durante e após o procedimento cirúrgico baseado no doseamento de marcadores específicos de coagulação (Tempo de Coagulação Ativada-TCA, Tempo de Tromboplastinaparcial Ativada-TTPa e alteração do fator anti-xa) em relação à heparinemia, doseamento de heparina sérica e sua correlação com os marcadores de atividade. Deverá ser avaliada também a correlação dos parâmetros laboratoriais de atividade de coagulação (TTPa, TCA e anti-xa) e heparina total circulante após o uso de protamina. Os parâmetros clínicos relevantes são verificação da perda sanguínea (ocorrência de hemorragia) até a retirada dos drenos por 48 horas após a cirurgia (de 6 em 6 horas), medida periódica do peso das compressas e sangramento cirúrgico durante a cirurgia, surgimento de complicações relacionadas a coagulação sanguínea, transfusão de sangue e hemocomponentes intra e pós operatório. Como desfecho secundário deverá ser avaliada a relação da dose total de heparina utilizada, sua atividade e a adequada reversão com o uso de protamina.ainda em relação aos parâmetros de segurança deverá ser avaliada a ocorrência de eventos adversos durante e após a cirurgia, devendo ser considerados o tipo, a incidência e a intensidade dos eventos e estes devem manter um perfil equivalente ao do produto biológico comparador e que este seja compatível com os descritos atualmente na literatura para o produto em questão. Em relação a eficácia espera-se que a dose total de heparina utilizada no paciente durante a cirurgia esteja adequadamente biodisponível e que esta dose seja adequada para alterar de maneira eficaz os parâmetros coagulométricos marcadores de Guia para realização de estudos não clínicos e clínicos para registro de heparinas como produto biológico pela via de desenvolvimento por comparabilidade 7
9 atividade da heparina sódica TCA, TTPa e Anti Xa. Ao final da cirurgia espera-se a adequada reversão da atividade da heparina com a devida redução dos níveis de heparina circulante e queda adequada dos parâmetros coagulométricos e marcadores de atividade de heparina TCA, TTPa e Anti Xa. Ainda, depois da reversão da atividade da heparina com protamina espera-se que a quantidade de sangue perdida pelo paciente esteja dentro dos valores aceitáveis pela literatura e que o paciente não sofra sangramento excessivo (hemorragia). Assim, o paciente não deve necessitar de transfusões de sangue e hemoderivados e não deve haver formação de fibrina na linha arterial. O cálculo de tamanho de amostra deve realizado em relação aos desfechos primários de eficácia e segurança e todos os parâmetros utilizados para tal cálculo deve ter justificativa científica, o mesmo é válido para a determinação da margem de não inferioridade. Segurança clínica Mesmo se for demonstrado que a eficácia é comparável, o produto medicinal biológico similar pode exibir uma diferença no perfil de segurança. Devem-se obter dados de segurança antes da licença em um número de pacientes suficiente para determinar os perfis de efeito adverso do produto medicinal em teste. Deve-se ter cuidado ao comparar o tipo, a frequência e a gravidade das reações adversas entre o produto biológico e o produto biológico comparador. Em geral, os dados de segurança comparativos do estudo clínico de eficácia serão suficientes para fornecer um banco de dados de segurança pré-comercialização. Os eventos de hemorragias importantes e eventos de hemorragias não-significativas de relevância clínica devem ser cuidadosamente avaliados e documentados. Deve-se usar uma classificação de hemorragias clinicamente relevante e compatível. Semelhante à avaliação de eficácia, a adjudicação dos eventos de hemorragia deve ser realizada por um comitê central independente, em caráter cego, de especialistas, usando limites pré-especificados. Para a detecção da trombocitopenia induzida pela heparina do tipo imune-mediada (HIT tipo II), devem-se realizar o monitoramento da contagem de plaquetas e um procedimento diagnóstico adequado em pacientes que desenvolvam trombocitopenia e ou tromboembolismo (HITT) durante o estudo clínico. Recomendam-se testes da função hepática. 5 Extrapolação da Indicação A demonstração da eficácia e segurança comparáveis em pacientes cirúrgicos com alto risco de TEV, conforme recomendado, pode permitir a extrapolação para outras indicações do produto medicinal de referência, se justificado adequadamente pelo solicitante. 6 Plano de Farmacovigilância Dentro do procedimento de autorização, o solicitante deve apresentar sempre um plano de farmacovigilância e um plano de minimização de risco sempre que necessário de acordo com a legislação vigente e as diretrizes de farmacovigilância. O plano de gerenciamento de risco deve enfocar particularmente eventos adversos sérios, raros, conhecidos por estarem associados às heparinas, tais como a Trombocitopenia induzida pela Heparina, de Tipo II (HIT II, HITT), assim como as reações anafiláticas e anafilactóides. 8 Guia para realização de estudos não clínicos e clínicos para registro de heparinas como produto biológico pela via de desenvolvimento por comparabilidade
10 7 Referências Directive 2001/83/EC, as amended Guideline on similar biological medicinal products (CHMP/437/04/draft) Guideline on Similar Biological Medicinal Products Containing Biotechnology-Derived Proteins as Active Substance: Quality Issues (EMEA/CHMP/BWP/49348/2005) Guideline on clinical investigation of medicinal products for prophylaxis of high intra and post-operative venous thromboembolic risk (CPMP/EWP/707/98 Rev. 1) Note for guidance on non-clinical locale tolerance testing of medicinal products (CPMP/SWP/ 2145/00). Note for guidance on repeated dose toxicity (CPMP/SWP/1042/99) Note for guidance for toxicokinetics: A guidance for assessing systemic exposure in toxicological studies (CPMP/ICH/384/95) Guideline on Immunogenicity Assessment of Biotechnology-derived Therapeutic Proteins (CHMP/BMWP/14327/06) Guideline on risk management systems for medicinal products for human use (EMEA/CHMP 96286/2005) Note for Guidance on Good Clinical Safety Data Management: Definitions and Standards for Expedited Reporting (CPMP/ ICH/377/95) ICH Note for /guidance on Planning Pharmacovigilance Activities (CPMP/ICH/5716/03) Guia para realização de estudos não clínicos e clínicos para registro de heparinas como produto biológico pela via de desenvolvimento por comparabilidade 9
11 Ministério da Saúde
Guia para realização de estudos não clínicos e clínicos para registro de alfainterferona como produto biológico pela via de desenvolvimento por
 Guia para realização de estudos não clínicos e clínicos para registro de alfainterferona como produto biológico pela via de desenvolvimento por comparabilidade Agência Nacional de Vigilância Sanitária
Guia para realização de estudos não clínicos e clínicos para registro de alfainterferona como produto biológico pela via de desenvolvimento por comparabilidade Agência Nacional de Vigilância Sanitária
Trombocitopenia induzida pela heparina
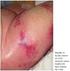 Trombocitopenia induzida pela heparina Novembro 2012 ULSM Hospital Pedro Hispano, Matosinhos Distinguir Terapêutica curta duração: Profilática Emergência Heparina via parentérica Heparinas baixo peso molecular
Trombocitopenia induzida pela heparina Novembro 2012 ULSM Hospital Pedro Hispano, Matosinhos Distinguir Terapêutica curta duração: Profilática Emergência Heparina via parentérica Heparinas baixo peso molecular
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Venorix 100, 100 mg /2 ml, Solução injectável Venorix 200, 200 mg /2 ml, Solução injectável Venorix 300, 300 mg /3 ml, Solução injectável Sulfato de dermatano
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Venorix 100, 100 mg /2 ml, Solução injectável Venorix 200, 200 mg /2 ml, Solução injectável Venorix 300, 300 mg /3 ml, Solução injectável Sulfato de dermatano
Cartão de Alerta do Paciente
 Cartão de Alerta do Paciente Hemcibra MD (emicizumabe) Injeção subcutânea Cartão de Alerta do Paciente para garantir o uso seguro de Hemcibra MD (emicizumabe) no tratamento da hemofilia A. Este material
Cartão de Alerta do Paciente Hemcibra MD (emicizumabe) Injeção subcutânea Cartão de Alerta do Paciente para garantir o uso seguro de Hemcibra MD (emicizumabe) no tratamento da hemofilia A. Este material
Workshop Implementação do CTD no Brasil Introdução aos guias M4S (R2) e M4E (R2) Juliana Schwarz Rocha
 Workshop Implementação do CTD no Brasil Introdução aos guias M4S (R2) e M4E (R2) Juliana Schwarz Rocha 14 de março de 2018 Agenda 13:30 14:00 Introdução aos Guias do ICH M4S (R2) e M4E (R2) Módulo 4: organização
Workshop Implementação do CTD no Brasil Introdução aos guias M4S (R2) e M4E (R2) Juliana Schwarz Rocha 14 de março de 2018 Agenda 13:30 14:00 Introdução aos Guias do ICH M4S (R2) e M4E (R2) Módulo 4: organização
Agência Nacional de Vigilância Sanitária Anvisa Gerência-Geral de Tecnologia de Produtos para a Saúde - GGTPS
 Agência Nacional de Vigilância Sanitária Anvisa Gerência-Geral de Tecnologia de Produtos para a Saúde - GGTPS NOTA TÉCNICA N 004/2016/GGTPS/DIREG/ANVISA Objeto: Requisitos para determinar a necessidade
Agência Nacional de Vigilância Sanitária Anvisa Gerência-Geral de Tecnologia de Produtos para a Saúde - GGTPS NOTA TÉCNICA N 004/2016/GGTPS/DIREG/ANVISA Objeto: Requisitos para determinar a necessidade
Diagnóstico de TEV Perspetiva do Laboratório: o papel dos D-Dímeros no diagnóstico. Luísa Lopes dos Santos IPO-Porto
 Diagnóstico de TEV Perspetiva do Laboratório: o papel dos D-Dímeros no diagnóstico Luísa Lopes dos Santos IPO-Porto Tema Impacto do diagnóstico de TEV. Probabilidade pré- teste. Diagnóstico de TEV e formação
Diagnóstico de TEV Perspetiva do Laboratório: o papel dos D-Dímeros no diagnóstico Luísa Lopes dos Santos IPO-Porto Tema Impacto do diagnóstico de TEV. Probabilidade pré- teste. Diagnóstico de TEV e formação
Anexo III. Alterações à informação do medicamento
 Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
Anexo III Alterações à informação do medicamento Nota: Estas alterações às secções relevantes da informação do medicamento são o resultado do processo de arbitragem. A informação do medicamento pode ser
PROFILAXIA MEDICAMENTOSA DA TROMBOSE VENOSA PROFUNDA NO POLITRAUMA
 PROFILAXIA MEDICAMENTOSA DA TROMBOSE VENOSA PROFUNDA NO POLITRAUMA SANTOS, Thiago, Discente do Curso de Graduação em Medicina do UNIFESO HENRIQUE, Alexandre, Docente do Curso de Graduação em Medicina do
PROFILAXIA MEDICAMENTOSA DA TROMBOSE VENOSA PROFUNDA NO POLITRAUMA SANTOS, Thiago, Discente do Curso de Graduação em Medicina do UNIFESO HENRIQUE, Alexandre, Docente do Curso de Graduação em Medicina do
Guia do paciente / cuidador
 Guia do paciente / cuidador Hemcibra MD (emicizumabe) Injeção subcutânea Guia do paciente / cuidador para garantir o uso seguro de Hemcibra MD (emicizumabe) no tratamento da hemofilia A. Este material
Guia do paciente / cuidador Hemcibra MD (emicizumabe) Injeção subcutânea Guia do paciente / cuidador para garantir o uso seguro de Hemcibra MD (emicizumabe) no tratamento da hemofilia A. Este material
Porto Alegre/RS
 UNIDADE DE PESQUISA CLÍNICA Centro de Medicina Reprodutiva Carlos Isaia Filho LTDA. A Pesquisa Clinica e suas Fases Carlos Isaia Filho Unidade de Pesquisa Clínica CMR Da Molécula ao Mercado. Aproximadamente
UNIDADE DE PESQUISA CLÍNICA Centro de Medicina Reprodutiva Carlos Isaia Filho LTDA. A Pesquisa Clinica e suas Fases Carlos Isaia Filho Unidade de Pesquisa Clínica CMR Da Molécula ao Mercado. Aproximadamente
Alterações laboratoriais nos pacientes com trombocitopenia associada à heparina (HIT)
 LABORATÓRIO DE HEMOSTASIA PARA PACIENTES HOSPITALIZADOS Alterações laboratoriais nos pacientes com trombocitopenia associada à heparina (HIT) ICHCFMUSP Tania Rubia Flores da Rocha Farmacêutica Bioquímica
LABORATÓRIO DE HEMOSTASIA PARA PACIENTES HOSPITALIZADOS Alterações laboratoriais nos pacientes com trombocitopenia associada à heparina (HIT) ICHCFMUSP Tania Rubia Flores da Rocha Farmacêutica Bioquímica
Novos Antiagregantes e Anticoagulantes Orais Manejo na endoscopia - maio 2015
 Um grande número de pacientes tem feito uso de antiagregação plaquetária e anticoagulação contínuas em situações clínicas como fibrilação atrial, implante de valvas mecânicas, trombose venosa profunda
Um grande número de pacientes tem feito uso de antiagregação plaquetária e anticoagulação contínuas em situações clínicas como fibrilação atrial, implante de valvas mecânicas, trombose venosa profunda
[Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA
![[Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA [Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA](/thumbs/82/85863199.jpg) [Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO - RDC Nº 205, DE 28 DE DEZEMBRO DE 2017 DOU de 29/12/2017 [Página
[Este texto não substitui o publicado no DOU] MINISTÉRIO DA SAÚDE AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO - RDC Nº 205, DE 28 DE DEZEMBRO DE 2017 DOU de 29/12/2017 [Página
RDC 315/05 ANÁLISES E PROCESSOS x LOCAL DE PRODUÇÃO
 RDC 315/05 ANÁLISES E PROCESSOS x LOCAL DE PRODUÇÃO 1º FÓRUM DE ATUALIZAÇÃO EM MEDICAMENTOS BIOLÓGICOS NÃO NOVOS Dra. Vanda Dolabela de Magalhães, PhD Gerente de Biotecnologia EUROFARMA LABORATÓRIOS ltda
RDC 315/05 ANÁLISES E PROCESSOS x LOCAL DE PRODUÇÃO 1º FÓRUM DE ATUALIZAÇÃO EM MEDICAMENTOS BIOLÓGICOS NÃO NOVOS Dra. Vanda Dolabela de Magalhães, PhD Gerente de Biotecnologia EUROFARMA LABORATÓRIOS ltda
Fases da pe squi qu s i a c a lín í i n c i a na i a i dú dú tr t ia far f mac êut u i t c i a
 Fases da pesquisa clínica na indústria farmacêutica Eduardo Motti Sumário Por que das Fases de pesquisa clínica Fase 1 a 4 Outros conceitos: Fase 0, Fase 5 Para onde vamos Objetivos da Pesquisa Clínica
Fases da pesquisa clínica na indústria farmacêutica Eduardo Motti Sumário Por que das Fases de pesquisa clínica Fase 1 a 4 Outros conceitos: Fase 0, Fase 5 Para onde vamos Objetivos da Pesquisa Clínica
Perspectiva dos ensaios clínicos
 Regulação de Produtos Biológicos no Brasil Perspectiva dos ensaios clínicos Fanny Nascimento Moura Viana Especialista em Regulação e Vigilância Sanitária COPEC/GGMED 27 de outubro de 2016 1. Regulamento
Regulação de Produtos Biológicos no Brasil Perspectiva dos ensaios clínicos Fanny Nascimento Moura Viana Especialista em Regulação e Vigilância Sanitária COPEC/GGMED 27 de outubro de 2016 1. Regulamento
Peticionamento eletrônico de cosméticos
 Cosméticos Manual do Usuário Peticionamento eletrônico de cosméticos Agência Nacional de Vigilância Sanitária Anvisa Manual do Usuário Peticionamento eletrônico de cosméticos Agência Nacional de Vigilância
Cosméticos Manual do Usuário Peticionamento eletrônico de cosméticos Agência Nacional de Vigilância Sanitária Anvisa Manual do Usuário Peticionamento eletrônico de cosméticos Agência Nacional de Vigilância
Mini Curso 2: LEGISLAÇÃO E REGULAMENTAÇÃO EM BIOTECNOLOGIA Izabel Vianna Villela, PhD Miriana da Silva Machado, PhD
 Mini Curso 2: LEGISLAÇÃO E REGULAMENTAÇÃO EM BIOTECNOLOGIA Izabel Vianna Villela, PhD Miriana da Silva Machado, PhD Agenda: Introdução Áreas de Atividade Registro de Produtos Legislações específicas: Controle
Mini Curso 2: LEGISLAÇÃO E REGULAMENTAÇÃO EM BIOTECNOLOGIA Izabel Vianna Villela, PhD Miriana da Silva Machado, PhD Agenda: Introdução Áreas de Atividade Registro de Produtos Legislações específicas: Controle
BioChimico MODELO DE BULA - VPS I. IDENTFICAÇÃO DO MEDICAMENTO. CUTENOX enoxaparina sódica
 MODELO DE BULA - VPS I. IDENTFICAÇÃO DO MEDICAMENTO CUTENOX enoxaparina sódica APRESENTAÇÕES Cutenox é uma solução injetável apresentada em seringas pré-enchidas com ou sem sistema de segurança nas seguintes
MODELO DE BULA - VPS I. IDENTFICAÇÃO DO MEDICAMENTO CUTENOX enoxaparina sódica APRESENTAÇÕES Cutenox é uma solução injetável apresentada em seringas pré-enchidas com ou sem sistema de segurança nas seguintes
1. INTRODUÇÃO. 2. OBJETIVO Os objetivos desse protocolo são:
 Página: 1/5 1. INTRODUÇÃO A anticoagulação é um procedimento frequente em unidades de terapia intensiva e sua utilização implica em riscos para o paciente. Assim, é importante que esse procedimento seja
Página: 1/5 1. INTRODUÇÃO A anticoagulação é um procedimento frequente em unidades de terapia intensiva e sua utilização implica em riscos para o paciente. Assim, é importante que esse procedimento seja
Como assegurar a Farmacovigilância adequada de medicamentos biotecnológicos. Prof. Dr. Marco Antonio Stephano
 Como assegurar a Farmacovigilância adequada de medicamentos biotecnológicos. Prof. Dr. Marco Antonio Stephano stephano@usp.br PARADIGMAS ASSOCIADOS A MEDICAMENTOS BIOTECNOLÓGICOS 1º O PRODUTO É IGUAL AO
Como assegurar a Farmacovigilância adequada de medicamentos biotecnológicos. Prof. Dr. Marco Antonio Stephano stephano@usp.br PARADIGMAS ASSOCIADOS A MEDICAMENTOS BIOTECNOLÓGICOS 1º O PRODUTO É IGUAL AO
Revisão dos regulamentos em Farmacovigilância
 Revisão dos regulamentos em Farmacovigilância Gerência de Farmacovigilância GFARM São Paulo Abril/2019 Compromissos Anvisa - ICH 3 Guias do ICH (Farmacovigilância) Implementação até 2021 E2B: elementos
Revisão dos regulamentos em Farmacovigilância Gerência de Farmacovigilância GFARM São Paulo Abril/2019 Compromissos Anvisa - ICH 3 Guias do ICH (Farmacovigilância) Implementação até 2021 E2B: elementos
Classificando as crises epilépticas para a programação terapêutica Farmacocinética dos fármacos antiepilépticos... 35
 Índice Parte 1 - Bases para a terapêutica com fármacos antiepilépticos Classificando as crises epilépticas para a programação terapêutica... 19 Classificação das Crises Epilépticas (1981)... 20 Classificação
Índice Parte 1 - Bases para a terapêutica com fármacos antiepilépticos Classificando as crises epilépticas para a programação terapêutica... 19 Classificação das Crises Epilépticas (1981)... 20 Classificação
Regulação de Medicamentos Biológicos no Brasil Farmacovigilância
 Regulação de Medicamentos Biológicos no Brasil Farmacovigilância Márcia Gonçalves de Oliveira Gerente de Farmacovigilancia BIO Latin America Conference São Paulo, 27 de outubro de 2016 Regulação de Medicamentos
Regulação de Medicamentos Biológicos no Brasil Farmacovigilância Márcia Gonçalves de Oliveira Gerente de Farmacovigilancia BIO Latin America Conference São Paulo, 27 de outubro de 2016 Regulação de Medicamentos
PROCEDIMENTO CONCURSAL DE INGRESSO NO IM 2019 PROVA NACIONAL DE SERIAÇÃO JÚRI DE RECURSO HEMATOLOGIA
 PROCEDIMENTO CONCURSAL DE INGRESSO NO IM 2019 PROVA NACIONAL DE SERIAÇÃO JÚRI DE RECURSO HEMATOLOGIA A análise das reclamações foi baseada na informação presente no livro de texto Harrison s Principles
PROCEDIMENTO CONCURSAL DE INGRESSO NO IM 2019 PROVA NACIONAL DE SERIAÇÃO JÚRI DE RECURSO HEMATOLOGIA A análise das reclamações foi baseada na informação presente no livro de texto Harrison s Principles
BioChimico. Cutenox enoxaparina sódica I. IDENTIFICAÇÃO DO MEDICAMENTO II. INFORMAÇÕES TÉCNICAS AOS PROFISSIONAIS DE SAÚDE
 Cutenox enoxaparina sódica I. IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES E FORMA FARMACÊUTICA Cutenox é uma solução injetável apresentada em seringas pré-enchidas com ou sem sistema de segurança nas seguintes
Cutenox enoxaparina sódica I. IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES E FORMA FARMACÊUTICA Cutenox é uma solução injetável apresentada em seringas pré-enchidas com ou sem sistema de segurança nas seguintes
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg)
 HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
Data Versão/Revisões Descrição Autor 06/06/ Proposta inicial F.A.A.C; M.C.V, S.R.P.T
 UTIPrCL06 1 de 6 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 1.00 Proposta inicial F.A.A.C; M.C.V, S.R.P.T 1 Objetivo Fornecer um sistema seguro de administração de heparina por
UTIPrCL06 1 de 6 Histórico de Revisão / Versões Data Versão/Revisões Descrição Autor 1.00 Proposta inicial F.A.A.C; M.C.V, S.R.P.T 1 Objetivo Fornecer um sistema seguro de administração de heparina por
Profa. Dra. Larissa Gorayb F Mota
 COAGULOPATIAS Profa. Dra. Larissa Gorayb F Mota COAGULOPATIAS Doenças hemorrágicas: alteração no mecanismo de coagulação Congênitas: hemofilia, doença de von Willebrand, deficiência de fatores de coagulação
COAGULOPATIAS Profa. Dra. Larissa Gorayb F Mota COAGULOPATIAS Doenças hemorrágicas: alteração no mecanismo de coagulação Congênitas: hemofilia, doença de von Willebrand, deficiência de fatores de coagulação
CENTRO DE APOIO OPERACIONAL DE DEFESA DA SAÚDE CESAU ORIENTAÇÃO TÉCNICA N.º 019/ CESAU
 ORIENTAÇÃO TÉCNICA N.º 019/2016 - CESAU Salvador, 18 de fevereiro de 2016 OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: Promotoria de Justiça de Serrina / Dispensação
ORIENTAÇÃO TÉCNICA N.º 019/2016 - CESAU Salvador, 18 de fevereiro de 2016 OBJETO: Parecer. - Centro de Apoio Operacional de Defesa da Saúde- CESAU REFERÊNCIA: Promotoria de Justiça de Serrina / Dispensação
ÁCIDO TRANEXÂMICO. Blau Farmacêutica S.A. Solução Injetável 50 mg/ml. Blau Farmacêutica S/A.
 ÁCIDO TRANEXÂMICO Solução Injetável 50 mg/ml MODELO DE BULA PACIENTE RDC 47/09 ácido tranexâmico Medicamento Genérico Lei n 9.787, de 1999 APRESENTAÇÕES Solução injetável 50 mg/ml. Embalagens com 5 ou
ÁCIDO TRANEXÂMICO Solução Injetável 50 mg/ml MODELO DE BULA PACIENTE RDC 47/09 ácido tranexâmico Medicamento Genérico Lei n 9.787, de 1999 APRESENTAÇÕES Solução injetável 50 mg/ml. Embalagens com 5 ou
Art. 1º Publicar proposta de Norma para Estudo da Toxicidade e da Eficácia de Produtos Fitoterápicos (Anexos I e II)
 Portaria nº 116/MS/SNVS, de 8 de agosto de 1996 DOU DE 12/08/96 O Secretário de Vigilância Sanitária do Ministério da Saúde, no uso de suas atribuições legais, considerando o disposto na Portaria nº 6,
Portaria nº 116/MS/SNVS, de 8 de agosto de 1996 DOU DE 12/08/96 O Secretário de Vigilância Sanitária do Ministério da Saúde, no uso de suas atribuições legais, considerando o disposto na Portaria nº 6,
por Prof. Rosemilia Cunha Princípios Gerais Hemostasia consiste na interrupção fisiológica de uma hemorragia, evitando
 ANTICOAGULANTES, ANTIAGREGANTES PLAQUETÁRIO E TROMBOLÍTICO Princípios Gerais Hemostasia consiste na interrupção fisiológica de uma hemorragia, evitando perdas de sangue de uma lesão vascular, e também
ANTICOAGULANTES, ANTIAGREGANTES PLAQUETÁRIO E TROMBOLÍTICO Princípios Gerais Hemostasia consiste na interrupção fisiológica de uma hemorragia, evitando perdas de sangue de uma lesão vascular, e também
I Curso de Choque Faculdade de Medicina da UFMG INSUFICIÊNCIA DE MÚLTIPLOS ÓRGÃOS MODS
 I Curso de Choque Faculdade de Medicina da UFMG INSUFICIÊNCIA DE MÚLTIPLOS ÓRGÃOS MODS Alterações Hematológicas Anatomia. Circulação. Distribuição. Função. Adaptação x Disfunção. Alterações Hematológicas
I Curso de Choque Faculdade de Medicina da UFMG INSUFICIÊNCIA DE MÚLTIPLOS ÓRGÃOS MODS Alterações Hematológicas Anatomia. Circulação. Distribuição. Função. Adaptação x Disfunção. Alterações Hematológicas
SANGUE PLAQUETAS HEMOSTASIA
 SANGUE PLAQUETAS HEMOSTASIA Fisiologia Molecular BCT 2S/2011 Universidade Federal de São Paulo EPM/UNIFESP DISTÚRBIOS RELACIONADOS ÀS HEMÁCEAS CASO 1: Paciente portador de úlcera péptica Diagnóstico: Anemia
SANGUE PLAQUETAS HEMOSTASIA Fisiologia Molecular BCT 2S/2011 Universidade Federal de São Paulo EPM/UNIFESP DISTÚRBIOS RELACIONADOS ÀS HEMÁCEAS CASO 1: Paciente portador de úlcera péptica Diagnóstico: Anemia
Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 58, DE 20 DE DEZEMBRO DE 2013.
 ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 58, DE 20 DE DEZEMBRO
ADVERTÊNCIA Este texto não substitui o publicado no Diário Oficial da União Ministério da Saúde Agência Nacional de Vigilância Sanitária RESOLUÇÃO DA DIRETORIA COLEGIADA - RDC Nº 58, DE 20 DE DEZEMBRO
cloridrato de protamina
 Protamina 1000 cloridrato de protamina APRESENTAÇÕES Solução Injetável 10 mg/ml - embalagem contendo 25 ampolas de 5 ml. USO INJETÁVEL USO ADULTO COMPOSIÇÃO Cada ml contém 10 mg de cloridrato de protamina
Protamina 1000 cloridrato de protamina APRESENTAÇÕES Solução Injetável 10 mg/ml - embalagem contendo 25 ampolas de 5 ml. USO INJETÁVEL USO ADULTO COMPOSIÇÃO Cada ml contém 10 mg de cloridrato de protamina
DESENVOLVIMENTO. P&D de medicamentos. P&D de medicamentos. farmacêutico. IBM1031 Bioestatística e Ensaios Clínicos. Prof. Edson Zangiacomi Martinez 1
 P&D de medicamentos DESENVOLVIMENTO Edson Zangiacomi Martinez edson@fmrp.usp.br Depto. de Medicina Social FMRP - USP Desenvolvimento químico e farmacêutico Síntese Purificação Formulação Estudos em animais
P&D de medicamentos DESENVOLVIMENTO Edson Zangiacomi Martinez edson@fmrp.usp.br Depto. de Medicina Social FMRP - USP Desenvolvimento químico e farmacêutico Síntese Purificação Formulação Estudos em animais
QUÍMICA MEDICINAL. Em temos etimológicos pode considerar-se um ramo da farmacologia (de pharmakon + logos = estudo dos fármacos).
 QUÍMICA MEDICINAL Sentido prospectivo envolve o planeamento e produção de compostos que podem ser usados em medicina para a prevenção, tratamento e/ou cura de doenças humanas ou de animais. Em temos etimológicos
QUÍMICA MEDICINAL Sentido prospectivo envolve o planeamento e produção de compostos que podem ser usados em medicina para a prevenção, tratamento e/ou cura de doenças humanas ou de animais. Em temos etimológicos
INFARMED. Circular Informativa. N.º 011/CA Data: Assunto: Ceftriaxona - Informação de segurança
 INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
INFARMED Circular Informativa N.º 011/CA Data: 2007-02-02 Assunto: Ceftriaxona - Informação de segurança Para: Público e Profissionais de Saúde (Sítio do INFARMED) Contacto no INFARMED: DGREE/ Departamento
PIROXICAM. Anti-Inflamatório, Analgésico e Antipirético. Descrição
 PIROXICAM Anti-Inflamatório, Analgésico e Antipirético Descrição Piroxicam é um anti-inflamatório não esteroide (AINE), indicado para uma variedade de condições que requeiram atividade anti-inflamatória
PIROXICAM Anti-Inflamatório, Analgésico e Antipirético Descrição Piroxicam é um anti-inflamatório não esteroide (AINE), indicado para uma variedade de condições que requeiram atividade anti-inflamatória
PESQUISA CLÍNICA (PESQUISA EM SERES HUMANOS) CNS/Res 196/1996
 PESQUISA CLÍNICA (PESQUISA EM SERES HUMANOS) CNS/Res 196/1996 Pesquisa que, individual ou coletivamente, envolva o ser humano, de forma direta ou indireta, em sua totalidade ou parte dele, incluindo o
PESQUISA CLÍNICA (PESQUISA EM SERES HUMANOS) CNS/Res 196/1996 Pesquisa que, individual ou coletivamente, envolva o ser humano, de forma direta ou indireta, em sua totalidade ou parte dele, incluindo o
Cutenox (enoxaparina sódica) Mylan Laboratórios Ltda. Solução injetável 20 mg, 40 mg, 60 mg ou 80 mg
 Cutenox (enoxaparina sódica) Mylan Laboratórios Ltda. 20 mg, 40 mg, 60 mg ou 80 mg Cutenox enoxaparina sódica I. IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES E FORMA FARMACÊUTICA Cutenox é uma solução injetável
Cutenox (enoxaparina sódica) Mylan Laboratórios Ltda. 20 mg, 40 mg, 60 mg ou 80 mg Cutenox enoxaparina sódica I. IDENTIFICAÇÃO DO MEDICAMENTO APRESENTAÇÕES E FORMA FARMACÊUTICA Cutenox é uma solução injetável
Comitês de Monitoramento de Dados e de Segurança
 Comitês de Monitoramento de Dados e de Segurança Apresentação: Natália Moreira Vieira RDC n 9 de 2015 (ANVISA) Dispõe sobre o Regulamento para a realização de ensaios clínicos com medicamentos no Brasil.
Comitês de Monitoramento de Dados e de Segurança Apresentação: Natália Moreira Vieira RDC n 9 de 2015 (ANVISA) Dispõe sobre o Regulamento para a realização de ensaios clínicos com medicamentos no Brasil.
Anexo II. Conclusões científicas
 Anexo II Conclusões científicas 36 Conclusões científicas A enoxaparina sódica é uma heparina de baixo peso molecular comercializada sob a designação comercial Lovenox e nomes associados. Este anticoagulante
Anexo II Conclusões científicas 36 Conclusões científicas A enoxaparina sódica é uma heparina de baixo peso molecular comercializada sob a designação comercial Lovenox e nomes associados. Este anticoagulante
USO SUBCUTÂNEO OU INTRAVENOSO (a via de administração varia de acordo com a indicação do produto). USO ADULTO.
 Esta bula sofreu aumento de tamanho para adequação à legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina
Esta bula sofreu aumento de tamanho para adequação à legislação vigente da ANVISA. Esta bula é continuamente atualizada. Favor proceder a sua leitura antes de utilizar o medicamento. CLEXANE enoxaparina
Debater o uso da fosfoetanolamina sintética para o tratamento do câncer
 Debater o uso da fosfoetanolamina sintética para o tratamento do câncer Audiência Pública Comissão de Seguridade Social e Família Meiruze Sousa Freitas Superintendente de Medicamentos e Produtos Biológicos
Debater o uso da fosfoetanolamina sintética para o tratamento do câncer Audiência Pública Comissão de Seguridade Social e Família Meiruze Sousa Freitas Superintendente de Medicamentos e Produtos Biológicos
Regulamento sanitário para a realização de ensaios clínicos com medicamentos no Brasil
 Regulamento sanitário para a realização de ensaios clínicos com medicamentos no Brasil Patrícia Ferrari Andreotti Coordenação de Pesquisa Clínica em Medicamentos e Produtos Biológicos - COPEC Superintendência
Regulamento sanitário para a realização de ensaios clínicos com medicamentos no Brasil Patrícia Ferrari Andreotti Coordenação de Pesquisa Clínica em Medicamentos e Produtos Biológicos - COPEC Superintendência
Anexo IV. Conclusões científicas
 Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
Anexo IV Conclusões científicas 1 Conclusões científicas Foram relatados quatro casos de lesão hepática grave que conduziram a transplantes hepáticos desde a autorização de introdução no mercado do Esmya.
Ministério da Saúde - MS Agência Nacional de Vigilância Sanitária - ANVISA
 RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RESOLUÇÃO DA DIRETORIA COLEGIADA RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016
 RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
RESOLUÇÃO - RDC N 98, DE 1 DE AGOSTO DE 2016 Dispõe sobre os critérios e procedimentos para o enquadramento de medicamentos como isentos de prescrição e o reenquadramento como medicamentos sob prescrição,
Fármacos Anticoagulantes, Trombolíticos e Antiplaquetários
 Fármacos Anticoagulantes, Trombolíticos e Antiplaquetários COAGULAÇÃO SANGUÍNEA A coagulação sanguínea trata-se de uma serie de castas enzimáticas que vão se ativando gradativamente e aumentando os fatores
Fármacos Anticoagulantes, Trombolíticos e Antiplaquetários COAGULAÇÃO SANGUÍNEA A coagulação sanguínea trata-se de uma serie de castas enzimáticas que vão se ativando gradativamente e aumentando os fatores
14/04/2013. Biofarmacotécnica. Introdução. Introdução. Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos
 Biofarmacotécnica Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos Introdução Resoluções: RDC 16/07: Regulamento Técnico para Medicamentos Genéricos RDC 17/07: Regulamento
Biofarmacotécnica Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos Introdução Resoluções: RDC 16/07: Regulamento Técnico para Medicamentos Genéricos RDC 17/07: Regulamento
Distúrbios da Coagulação
 Distúrbios da Coagulação Hemofilias HEMOFILIAS Doenças hemorrágicas resultantes da deficiência quantitativa e/ou qualitativa do fator VIII ou fator IX da coagulação Genética (cromossomo X) / adquirida
Distúrbios da Coagulação Hemofilias HEMOFILIAS Doenças hemorrágicas resultantes da deficiência quantitativa e/ou qualitativa do fator VIII ou fator IX da coagulação Genética (cromossomo X) / adquirida
COMUNICADO DE RISCO CONJUNTO Nº 001/2013 Grecs/GGTES/Anvisa e Gemat/GGTPS/Anvisa
 COMUNICADO DE RISCO CONJUNTO Nº 001/2013 Grecs/GGTES/Anvisa e Gemat/GGTPS/Anvisa Assunto: utilização de agulhas de crochet como instrumental cirúrgico em procedimento de cirurgia vascular periférica. Gerência
COMUNICADO DE RISCO CONJUNTO Nº 001/2013 Grecs/GGTES/Anvisa e Gemat/GGTPS/Anvisa Assunto: utilização de agulhas de crochet como instrumental cirúrgico em procedimento de cirurgia vascular periférica. Gerência
Protocolo de Heparina para pacientes cardiológicos
 Protocolo de Heparina para pacientes cardiológicos Definição Garantir um sistema seguro de heparinização. Objetivos Os objetivos do protocolo são de fornecer um sistema seguro de heparinização por via
Protocolo de Heparina para pacientes cardiológicos Definição Garantir um sistema seguro de heparinização. Objetivos Os objetivos do protocolo são de fornecer um sistema seguro de heparinização por via
TROMBOPROFILAXIA DURANTE A GRAVIDEZ, PARTO E PUERPÉRIO
 TROMBOPROFILAXIA DURANTE A GRAVIDEZ, PARTO E PUERPÉRIO FRANCISCO EDSON DE LUCENA FEITOSA IDENTIFICAÇÃO DE FATORES DE RISCO A gestação é fator de risco para tromboembolismo venoso (TEV) e está associada
TROMBOPROFILAXIA DURANTE A GRAVIDEZ, PARTO E PUERPÉRIO FRANCISCO EDSON DE LUCENA FEITOSA IDENTIFICAÇÃO DE FATORES DE RISCO A gestação é fator de risco para tromboembolismo venoso (TEV) e está associada
Curso Técnico em Zootecnia
 Curso Técnico em Zootecnia Aula: 01/01 SUB TEMA: INTRODUÇÃO À Professor: Vitor Hugo SUB TEMA: HISTÓRIA DA HÁ MUITO TEMPO MAIS DE 5 MIL ANOS PROCURAM-SE SUBSTÂNCIAS QUÍMICAS COM O OBJETIVO DE CURAR AS MAIS
Curso Técnico em Zootecnia Aula: 01/01 SUB TEMA: INTRODUÇÃO À Professor: Vitor Hugo SUB TEMA: HISTÓRIA DA HÁ MUITO TEMPO MAIS DE 5 MIL ANOS PROCURAM-SE SUBSTÂNCIAS QUÍMICAS COM O OBJETIVO DE CURAR AS MAIS
Manuseio Peri-operatório do Doente medicado com Outros Anticoagulantes
 Manuseio Peri-operatório do Doente medicado com Outros Anticoagulantes I. Bloqueio do Neuroeixo e Outros Anticoagulantes a) Bloqueio do Neuroeixo e HEPARINAS NÃO FRACIONADAS (HNF) Tabela 1. HNF-Tempos
Manuseio Peri-operatório do Doente medicado com Outros Anticoagulantes I. Bloqueio do Neuroeixo e Outros Anticoagulantes a) Bloqueio do Neuroeixo e HEPARINAS NÃO FRACIONADAS (HNF) Tabela 1. HNF-Tempos
MODELO DE BULA PROFISSIONAIS DE SAÚDE RDC 47/09
 MODELO DE BULA PROFISSIONAIS DE SAÚDE RDC 47/09 ENOXALOW enoxaparina sódica APRESENTAÇÕES Solução injetável. Embalagens contendo 20, 40, 60, 80 ou 100 mg de enoxaparina sódica em cada seringa preenchida.
MODELO DE BULA PROFISSIONAIS DE SAÚDE RDC 47/09 ENOXALOW enoxaparina sódica APRESENTAÇÕES Solução injetável. Embalagens contendo 20, 40, 60, 80 ou 100 mg de enoxaparina sódica em cada seringa preenchida.
REGULAMENTAÇÃO DE PRODUTOS BIOTECNOLÓGICOS & SUAS IMPLICAÇÕES PARA O DESENVOLVIMENTO E A COMPETITIVIDADE DO SETOR PRODUTIVO
 REGULAMENTAÇÃO DE PRODUTOS BIOTECNOLÓGICOS & SUAS IMPLICAÇÕES PARA O DESENVOLVIMENTO E A COMPETITIVIDADE DO SETOR PRODUTIVO GT COMSAUDE FIESP Fernanda Francischetti Piza 14 de junho de 2010 Objetivo CP
REGULAMENTAÇÃO DE PRODUTOS BIOTECNOLÓGICOS & SUAS IMPLICAÇÕES PARA O DESENVOLVIMENTO E A COMPETITIVIDADE DO SETOR PRODUTIVO GT COMSAUDE FIESP Fernanda Francischetti Piza 14 de junho de 2010 Objetivo CP
Impurezas e Degradação Forçada
 Impurezas e Degradação Forçada Aspectos regulatórios no Brasil Introdução Aspectos legais Lei n 6.360, de 23 de setembro de 1976: Art. 16. O registro de drogas, medicamentos, insumos farmacêuticos e correlatos,
Impurezas e Degradação Forçada Aspectos regulatórios no Brasil Introdução Aspectos legais Lei n 6.360, de 23 de setembro de 1976: Art. 16. O registro de drogas, medicamentos, insumos farmacêuticos e correlatos,
COMUNICADO DE RISCO N O 003/ GVIMS/GGTES-ANVISA
 Agência Nacional de Vigilância Sanitária COMUNICADO DE RISCO N O 003/2013 - GVIMS/GGTES-ANVISA Atualização do Comunicado de Risco n o 002/2013 - GVIMS/GGTES-Anvisa, que trata da circulação de micro-organismos
Agência Nacional de Vigilância Sanitária COMUNICADO DE RISCO N O 003/2013 - GVIMS/GGTES-ANVISA Atualização do Comunicado de Risco n o 002/2013 - GVIMS/GGTES-Anvisa, que trata da circulação de micro-organismos
Material desenvolvido de acordo com a RDC Nº 58, DE 10 DE OUTUBRO DE 2014.
 INTERCAMBIALIDADE 1. O que são medicamentos referência, similar e genérico? É todo medicamento originador, cuja eficácia, segurança e qualidade foram comprovadas cientificamente. Todo medicamento referência
INTERCAMBIALIDADE 1. O que são medicamentos referência, similar e genérico? É todo medicamento originador, cuja eficácia, segurança e qualidade foram comprovadas cientificamente. Todo medicamento referência
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. DENOMINAÇÂO DO MEDICAMENTO Procto-Glyvenol 50 mg/g + 20 mg/g Creme rectal 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada grama de Procto-Glyvenol creme rectal
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. DENOMINAÇÂO DO MEDICAMENTO Procto-Glyvenol 50 mg/g + 20 mg/g Creme rectal 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada grama de Procto-Glyvenol creme rectal
CLEXANE. (enoxaparina sódica) Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.
 CLEXANE (enoxaparina sódica) Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml CLEXANE enoxaparina sódica APRESENTAÇÕES - Solução injetável
CLEXANE (enoxaparina sódica) Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml CLEXANE enoxaparina sódica APRESENTAÇÕES - Solução injetável
MEDICAMENTOS. Agência Nacional de Vigilância Sanitária Anvisa. Assunto: Análise de resíduos de agrotóxicos em fitoterápicos
 MEDICAMENTOS Agência Nacional de Vigilância Sanitária Anvisa Assunto: Análise de resíduos de agrotóxicos em fitoterápicos 2ª edição Brasília, 18 de setembro de 2017 Gerência de Medicamentos Específicos,
MEDICAMENTOS Agência Nacional de Vigilância Sanitária Anvisa Assunto: Análise de resíduos de agrotóxicos em fitoterápicos 2ª edição Brasília, 18 de setembro de 2017 Gerência de Medicamentos Específicos,
RESOLUÇÃO-RE Nº 91, DE 16 DE MARÇO DE 2004.
 RESOLUÇÃO-RE Nº 91, DE 16 DE MARÇO DE 2004. O Adjunto da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição, que lhe confere a Portaria n.º 13, de 16 de janeiro de 2004,
RESOLUÇÃO-RE Nº 91, DE 16 DE MARÇO DE 2004. O Adjunto da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária, no uso da atribuição, que lhe confere a Portaria n.º 13, de 16 de janeiro de 2004,
Diário Oficial Imprensa Nacional
 RESOLUÇÃO-RDC No- 69, DE 21DEZEMBRO DE 2009 Institui instruções sobre registro, fabricação, controle de qualidade, comercialização e uso de Dispositivo Intra-Uterino (DIU) contendo cobre. A Diretoria Colegiada
RESOLUÇÃO-RDC No- 69, DE 21DEZEMBRO DE 2009 Institui instruções sobre registro, fabricação, controle de qualidade, comercialização e uso de Dispositivo Intra-Uterino (DIU) contendo cobre. A Diretoria Colegiada
Cada ampola contém mg de undecanoato de testosterona em solução oleosa injetável de 4 ml (250 mg de undecanoato de testosterona/ml).
 Nebido SCHERING Atualizado em 09/12/2014 Nebido Undecanoato de testosterona Composição do Nebido Cada ampola contém 1.000 mg de undecanoato de testosterona em solução oleosa injetável de 4 ml (250 mg de
Nebido SCHERING Atualizado em 09/12/2014 Nebido Undecanoato de testosterona Composição do Nebido Cada ampola contém 1.000 mg de undecanoato de testosterona em solução oleosa injetável de 4 ml (250 mg de
IMPORTÂNCIA DO ACOMPANHAMENTO FARMACOTERAPÊUTICO DE PACIENTES QUE UTILIZAM VARFARINA
 IMPORTÂNCIA DO ACOMPANHAMENTO FARMACOTERAPÊUTICO DE PACIENTES QUE UTILIZAM VARFARINA Sandra Navarro Ferro, Suleimy Marinho Fernandes, Stela Ramirez de Oliveira Faculdade Alfredo Nasser sandra.tecpav@gmail.com
IMPORTÂNCIA DO ACOMPANHAMENTO FARMACOTERAPÊUTICO DE PACIENTES QUE UTILIZAM VARFARINA Sandra Navarro Ferro, Suleimy Marinho Fernandes, Stela Ramirez de Oliveira Faculdade Alfredo Nasser sandra.tecpav@gmail.com
Gestão Farmacêutica & Farmacoeconomia
 Universidade de Brasília Gestão Farmacêutica & Farmacoeconomia Farmacoeconomia Aplicada à Pesquisa Clínica Prof. Pós-Doutor HUGO CAMPOS Faculdade de Ciências da Saúde Brasília, 2017 Introdução Métodos
Universidade de Brasília Gestão Farmacêutica & Farmacoeconomia Farmacoeconomia Aplicada à Pesquisa Clínica Prof. Pós-Doutor HUGO CAMPOS Faculdade de Ciências da Saúde Brasília, 2017 Introdução Métodos
Biofarmacotécnica. Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos
 Biofarmacotécnica Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos Introdução RES 60/14: Dispõe sobre os critérios para concessão e renovação de registro de medicamentos
Biofarmacotécnica Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos Introdução RES 60/14: Dispõe sobre os critérios para concessão e renovação de registro de medicamentos
UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS DA SAÚDE DEPARTAMENTO DE CI ÊNCIAS FARMACÊUTICAS DISSERTAÇÃO DE MESTRADO
 UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS DA SAÚDE DEPARTAMENTO DE CI ÊNCIAS FARMACÊUTICAS DISSERTAÇÃO DE MESTRADO Avaliação da Atividade Antineoplásica sobre o Sarcoma de Yoshida de Formas
UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS DA SAÚDE DEPARTAMENTO DE CI ÊNCIAS FARMACÊUTICAS DISSERTAÇÃO DE MESTRADO Avaliação da Atividade Antineoplásica sobre o Sarcoma de Yoshida de Formas
Fragmin dalteparina sódica. Fragmin solução injetável UI/mL (anti-xa) em embalagem contendo 10 seringas pré-enchidas com 0,2 ml (2500 UI).
 Fragmin dalteparina sódica I IDENTIFICAÇÃO DO PRODUTO Nome comercial: Fragmin Nome genérico: dalteparina sódica APRESENTAÇÕES Fragmin solução injetável 12500 UI/mL (anti-xa) em embalagem contendo 10 seringas
Fragmin dalteparina sódica I IDENTIFICAÇÃO DO PRODUTO Nome comercial: Fragmin Nome genérico: dalteparina sódica APRESENTAÇÕES Fragmin solução injetável 12500 UI/mL (anti-xa) em embalagem contendo 10 seringas
No Brasil, de qual biossimilar necessitamos? Visão da indústria de pesquisa. Solange Nappo
 No Brasil, de qual biossimilar necessitamos? Visão da indústria de pesquisa Solange Nappo Por que discutir Medicamentos Biológicos? CARACTERÍSTICAS DOS MEDICAMENTOS BIOLÓGICOS MOLÉCULAS COMPLEXAS Moléculas
No Brasil, de qual biossimilar necessitamos? Visão da indústria de pesquisa Solange Nappo Por que discutir Medicamentos Biológicos? CARACTERÍSTICAS DOS MEDICAMENTOS BIOLÓGICOS MOLÉCULAS COMPLEXAS Moléculas
FARMACOCINÉTICA. Prof. Glesley Vito Lima Lemos
 FARMACOCINÉTICA Prof. Glesley Vito Lima Lemos (glesleyvito@hotmail.com) RESPOSTA TERAPÊUTICA Fase Farmacêutica MEDICAMENTO Liberação do princípio ativo da formulação Interação Fármaco Sítio alvo Fase Farmacodinâmica
FARMACOCINÉTICA Prof. Glesley Vito Lima Lemos (glesleyvito@hotmail.com) RESPOSTA TERAPÊUTICA Fase Farmacêutica MEDICAMENTO Liberação do princípio ativo da formulação Interação Fármaco Sítio alvo Fase Farmacodinâmica
22ª JORNADA DE GINECOLOGIA E OBSTETRÍCIA MATERNIDADE SINHÁ JUNQUEIRA UNIFESP
 22ª JORNADA DE GINECOLOGIA E OBSTETRÍCIA MATERNIDADE SINHÁ JUNQUEIRA ROSIANE MATTAR INDICAÇÕES DO USO PROFILÁTICO DE ANTICOAGULANTES EM GESTANTES Departamento de Obstetrícia Escola Paulista de Medicina
22ª JORNADA DE GINECOLOGIA E OBSTETRÍCIA MATERNIDADE SINHÁ JUNQUEIRA ROSIANE MATTAR INDICAÇÕES DO USO PROFILÁTICO DE ANTICOAGULANTES EM GESTANTES Departamento de Obstetrícia Escola Paulista de Medicina
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA. RESOLUÇÃO-RDC No- 2, DE 2 DE FEVEREIRO DE 2011
 AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO-RDC No- 2, DE 2 DE FEVEREIRO DE 2011 Dispõe sobre os procedimentos no âmbito da ANVISA para acompanhamento, instrução e análise dos
AGÊNCIA NACIONAL DE VIGILÂNCIA SANITÁRIA DIRETORIA COLEGIADA RESOLUÇÃO-RDC No- 2, DE 2 DE FEVEREIRO DE 2011 Dispõe sobre os procedimentos no âmbito da ANVISA para acompanhamento, instrução e análise dos
CLEXANE Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml
 CLEXANE Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml Esta bula sofreu aumento de tamanho para adequação à legislação vigente da
CLEXANE Sanofi-Aventis Farmacêutica Ltda. Solução Injetável 20 mg/0.2 ml 40 mg/0.4 ml 60 mg/0.6 ml 80 mg/0.8 ml 100 mg/1.0 ml Esta bula sofreu aumento de tamanho para adequação à legislação vigente da
Indicadores Estratégicos
 Indicadores Estratégicos DR. ALEXANDRE VIEIRA RIBEIRO DA SILVA INDICADORES ESTRATÉGICOS INDICADORES E AVALIAÇÃO ASSISTENCIAL Monitoramento da Informação Assistêncial Discussão dos resultados Padrões assistenciais
Indicadores Estratégicos DR. ALEXANDRE VIEIRA RIBEIRO DA SILVA INDICADORES ESTRATÉGICOS INDICADORES E AVALIAÇÃO ASSISTENCIAL Monitoramento da Informação Assistêncial Discussão dos resultados Padrões assistenciais
Fragmin (dalteparina sódica) Fragmin solução injetável UI/mL (anti-xa) em embalagem contendo 10 seringas préenchidas com 0,2 ml (5000 UI).
 Fragmin (dalteparina sódica) PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Fragmin Nome genérico: dalteparina sódica Forma farmacêutica e apresentações: Fragmin solução injetável 12500 UI/mL (anti-xa) em embalagem
Fragmin (dalteparina sódica) PARTE I IDENTIFICAÇÃO DO PRODUTO Nome: Fragmin Nome genérico: dalteparina sódica Forma farmacêutica e apresentações: Fragmin solução injetável 12500 UI/mL (anti-xa) em embalagem
I- IDENTIFICAÇÃO DO MEDICAMENTO. TRANSAMIN ácido tranexâmico. APRESENTAÇÕES Solução Injetável de 50 mg/ml. Embalagem contendo 5 ampolas com 5 ml.
 I- IDENTIFICAÇÃO DO MEDICAMENTO TRANSAMIN ácido tranexâmico APRESENTAÇÕES Solução Injetável de 50 mg/ml. Embalagem contendo 5 ampolas com 5 ml. VIA ENDOVENOSA USO ADULTO E PEDIÁTRICO COMPOSIÇÃO Cada ml
I- IDENTIFICAÇÃO DO MEDICAMENTO TRANSAMIN ácido tranexâmico APRESENTAÇÕES Solução Injetável de 50 mg/ml. Embalagem contendo 5 ampolas com 5 ml. VIA ENDOVENOSA USO ADULTO E PEDIÁTRICO COMPOSIÇÃO Cada ml
Caso clínico. S.A.G, 35 anos
 Caso clínico S.A.G, 35 anos Negra, casada, prendas domésticas. Natural de Poços de Caldas - MG, Procedente de Botucatu - SP. G4 P3 A0 C0 DUM: 23/07/2014 1º US: 27/10/2014 (14s 1d DUM correta) IG: 32s 5d
Caso clínico S.A.G, 35 anos Negra, casada, prendas domésticas. Natural de Poços de Caldas - MG, Procedente de Botucatu - SP. G4 P3 A0 C0 DUM: 23/07/2014 1º US: 27/10/2014 (14s 1d DUM correta) IG: 32s 5d
XAROPE DE GUACO NATULAB. Espécie vegetal: Mikania glomerata Nome popular: Guaco Família: Asteraceae Parte utilizada: folhas. FORMA FARMACÊUTICA Xarope
 XAROPE DE GUACO NATULAB Espécie vegetal: Mikania glomerata Nome popular: Guaco Família: Asteraceae Parte utilizada: folhas FORMA FARMACÊUTICA Xarope APRESENTAÇÃO XAROPE DE GUACO NATULAB 35 mg/ml (equivalente
XAROPE DE GUACO NATULAB Espécie vegetal: Mikania glomerata Nome popular: Guaco Família: Asteraceae Parte utilizada: folhas FORMA FARMACÊUTICA Xarope APRESENTAÇÃO XAROPE DE GUACO NATULAB 35 mg/ml (equivalente
Quais as novas opções para tratamento da doença tromboembólica venosa
 Quais as novas opções para tratamento da doença tromboembólica venosa Daniel Mendes Pinto Cirurgia Vascular Hospital Mater Dei Hospital Felício Rocho Disponível em www.vascularbh.com.br Não tenho conflito
Quais as novas opções para tratamento da doença tromboembólica venosa Daniel Mendes Pinto Cirurgia Vascular Hospital Mater Dei Hospital Felício Rocho Disponível em www.vascularbh.com.br Não tenho conflito
BIOEQUIVALÊNCIA / BIODISPONIBILIDADE DE MEDICAMENTOS ASSOCIADOS
 BIOEQUIVALÊNCIA / BIODISPONIBILIDADE DE MEDICAMENTOS ASSOCIADOS Mai-Jun/2013 Márcia Sayuri Takamatsu Freitas Introdução 1999 Criação da Agência Nacional de Vigilância Sanitária (ANVISA) Lei no. 9782, de
BIOEQUIVALÊNCIA / BIODISPONIBILIDADE DE MEDICAMENTOS ASSOCIADOS Mai-Jun/2013 Márcia Sayuri Takamatsu Freitas Introdução 1999 Criação da Agência Nacional de Vigilância Sanitária (ANVISA) Lei no. 9782, de
Arixtra GlaxoSmithKline Brasil Ltda. Solução injetável 2,5mg e 7,5mg
 Arixtra GlaxoSmithKline Brasil Ltda. Solução injetável 2,5mg e 7,5mg LEIA ESTA BULA ATENTAMENTE ANTES DE INICIAR O TRATAMENTO. I - IDENTIFICAÇÃO DO MEDICAMENTO Arixtra fondaparinux sódico APRESENTAÇÃO
Arixtra GlaxoSmithKline Brasil Ltda. Solução injetável 2,5mg e 7,5mg LEIA ESTA BULA ATENTAMENTE ANTES DE INICIAR O TRATAMENTO. I - IDENTIFICAÇÃO DO MEDICAMENTO Arixtra fondaparinux sódico APRESENTAÇÃO
ENFERMAGEM E A PRÁTICA TRANSFUSIONAL UM HOSPITAL DE ALTA COMPLEXIDADE EM MACEIÓ-AL. Enfermeira do HUPAA,
 ENFERMAGEM E A PRÁTICA TRANSFUSIONAL UM HOSPITAL DE ALTA COMPLEXIDADE EM MACEIÓ-AL. Magalhães, Daniela 1 ; Almeida, Ingryd Leilane 2 1 Enfermeira do HUPAA, e-mail: daniermi@gmail.com 2 Enfermeira do HUPPA,
ENFERMAGEM E A PRÁTICA TRANSFUSIONAL UM HOSPITAL DE ALTA COMPLEXIDADE EM MACEIÓ-AL. Magalhães, Daniela 1 ; Almeida, Ingryd Leilane 2 1 Enfermeira do HUPAA, e-mail: daniermi@gmail.com 2 Enfermeira do HUPPA,
Dimensão Segurança do Doente Check-list Procedimentos de Segurança
 Check-list Procedimentos de Segurança 1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar
Check-list Procedimentos de Segurança 1. 1.1 1.2 Cultura de Segurança Existe um elemento(s) definido(s) com responsabilidade atribuída para a segurança do doente Promove o trabalho em equipa multidisciplinar
Dispõe sobre os critérios de indicação, inclusão e exclusão de medicamentos na Lista de Medicamentos de Referência.
 RESOLUÇÃO - RDC Nº 35, DE 15/06/2012 DOU 19/06/2012 Dispõe sobre os critérios de indicação, inclusão e exclusão de medicamentos na Lista de Medicamentos de Referência. A Diretoria Colegiada da Agência
RESOLUÇÃO - RDC Nº 35, DE 15/06/2012 DOU 19/06/2012 Dispõe sobre os critérios de indicação, inclusão e exclusão de medicamentos na Lista de Medicamentos de Referência. A Diretoria Colegiada da Agência
Workshop Implementação do CTD no Brasil. Juliana Schwarz Rocha
 Workshop Implementação do CTD no Brasil Juliana Schwarz Rocha 14 de março de 2018 Agenda 9:00 10:20 Guia do ICH M4 (R4) Organização do Documento Técnico Comum para Registro de Medicamento para Uso Humano
Workshop Implementação do CTD no Brasil Juliana Schwarz Rocha 14 de março de 2018 Agenda 9:00 10:20 Guia do ICH M4 (R4) Organização do Documento Técnico Comum para Registro de Medicamento para Uso Humano
Fragmin dalteparina sódica
 Fragmin dalteparina sódica I IDENTIFICAÇÃO DO PRODUTO Nome comercial: Fragmin Nome genérico: dalteparina sódica APRESENTAÇÕES Fragmin solução injetável 12.500 UI/mL (anti-xa) em embalagem contendo 10 seringas
Fragmin dalteparina sódica I IDENTIFICAÇÃO DO PRODUTO Nome comercial: Fragmin Nome genérico: dalteparina sódica APRESENTAÇÕES Fragmin solução injetável 12.500 UI/mL (anti-xa) em embalagem contendo 10 seringas
Fármaco Qualquer substância alterar função de 20/05/2013. Estudo da interação de drogas com
 Farmacologia Prof. Herval de Lacerda Bonfante Departamento de Farmacologia Pharmakon Logos Estudo dos fármacos Estudo da interação de drogas com organismos vivos Propriedades dos medicamentos e seus efeitos
Farmacologia Prof. Herval de Lacerda Bonfante Departamento de Farmacologia Pharmakon Logos Estudo dos fármacos Estudo da interação de drogas com organismos vivos Propriedades dos medicamentos e seus efeitos
MONOCORDIL Laboratórios Baldacci S.A. Comprimido 20mg e 40mg
 MONOCORDIL Laboratórios Baldacci S.A. Comprimido 20mg e 40mg MONOCORDIL mononitrato de isossorbida APRESENTAÇÕES Comprimidos simples de 20mg cartucho com 20 ou 30 comprimidos. Comprimidos simples de 40mg
MONOCORDIL Laboratórios Baldacci S.A. Comprimido 20mg e 40mg MONOCORDIL mononitrato de isossorbida APRESENTAÇÕES Comprimidos simples de 20mg cartucho com 20 ou 30 comprimidos. Comprimidos simples de 40mg
