Físico-Química Experimental. Camilo Andréa Angelucci
|
|
|
- Pedro Alencastre Borja
- 7 Há anos
- Visualizações:
Transcrição
1 Físico-Química Experimental Camilo Andréa Angelucci São Cristóvão/SE 2009
2 Físico-Química Experimental Elaboração de Conteúdo Camilo Andréa Angelucci Projeto Gráfico e Capa Hermeson Alves de Menezes Diagramação Lucílio do Nascimento Freitas Ilustração Luzileide Silva Santos Reimpressão Copyright 2009, Universidade Federal de Sergipe / CESAD. Nenhuma parte deste material poderá ser reproduzida, transmitida e gravada por qualquer meio eletrônico, mecânico, por fotocópia e outros, sem a prévia autorização por escrito da UFS. FICHA CATALOGRÁFICA PRODUZIDA PELA BIBLIOTECA CENTRAL UNIVERSIDADE FEDERAL DE SERGIPE A585f Angelucci, Camilo Andréa. Físico-química experimental / Camilo Andréa Angelucci -- São Cristóvão: Universidade Federal de Sergipe, CESAD, Físico-química. I. Título. CDU 544
3 Presidente da República Luiz Inácio Lula da Silva Ministro da Educação Fernando Haddad Secretário de Educação a Distância Carlos Eduardo Bielschowsky Reitor Josué Modesto dos Passos Subrinho Chefe de Gabinete Ednalva Freire Caetano Coordenador Geral da UAB/UFS Diretor do CESAD Antônio Ponciano Bezerra Vice-coordenador da UAB/UFS Vice-diretor do CESAD Fábio Alves dos Santos Vice-Reitor Angelo Roberto Antoniolli Diretoria Pedagógica Clotildes Farias (Diretora) Hérica dos Santos Mota Iara Macedo Reis Daniela Souza Santos Janaina de Oliveira Freitas Diretoria Administrativa e Financeira Edélzio Alves Costa Júnior (Diretor) Sylvia Helena de Almeida Soares Valter Siqueira Alves Coordenação de Cursos Djalma Andrade (Coordenadora) Núcleo de Formação Continuada Rosemeire Marcedo Costa (Coordenadora) Coordenadores de Curso Denis Menezes (Letras Português) Eduardo Farias (Administração) Haroldo Dorea (Química) Hassan Sherafat (Matemática) Hélio Mario Araújo (Geografia) Lourival Santana (História) Marcelo Macedo (Física) Silmara Pantaleão (Ciências Biológicas) Núcleo de Avaliação Guilhermina Ramos (Coordenadora) Carlos Alberto Vasconcelos Elizabete Santos Marialves Silva de Souza Núcleo de Serviços Gráficos e Audiovisuais Giselda Barros Núcleo de Tecnologia da Informação João Eduardo Batista de Deus Anselmo Marcel da Conceição Souza Assessoria de Comunicação Guilherme Borba Gouy Coordenadores de Tutoria Edvan dos Santos Sousa (Física) Geraldo Ferreira Souza Júnior (Matemática) Janaína Couvo T. M. de Aguiar (Administração) Priscilla da Silva Góes (História) Rafael de Jesus Santana (Química) Ronilse Pereira de Aquino Torres (Geografia) Trícia C. P. de Sant ana (Ciências Biológicas) Vanessa Santos Góes (Letras Português) NÚCLEO DE MATERIAL DIDÁTICO Hermeson Menezes (Coordenador) Edvar Freire Caetano Isabela Pinheiro Ewerton Lucas Barros Oliveira Neverton Correia da Silva Nycolas Menezes Melo UNIVERSIDADE FEDERAL DE SERGIPE Cidade Universitária Prof. José Aloísio de Campos Av. Marechal Rondon, s/n - Jardim Rosa Elze CEP São Cristóvão - SE Fone(79) Fax(79)
4
5 Sumário AULA 1 Gases...07 AULA 2 Determinação da constante universal dos gases R AULA 3 Determinação da massa molar de um líquido volátil AULA 4 Conceitos gerais da primeira lei da termodinâmica AULA 5 Determinação do calor específico de metais AULA 6 Calor de neutralização de ácidos e bases AULA 7 Quantidades parciais molares AULA 8 Diagrama de fases binário AULA 9 Eletroquímica AULA 10 Condutimetria
6
7 GASES Aula 1 META Conhecer um pouco da historia e como as variáveis temperatura, pressão, volume e composição de gás interagem entre si. OBJETIVOS Ao final desta aula, o aluno deverá: ver como se desenvolveu o pensamento químico sobre a matéria a partir dos estudos de gases e quais variáveis são importantes para descrevê-los chegando a equação dos gases ideais. PRÉ-REQUISITO Ter visto todo o conteúdo de Fundamentos de Química. (Fonte:
8 Físico-Química Experimental INTRODUÇÃO Nesta primeira aula sobre físico-química vamos introduzir os conceitos mais gerais da termodinâmica para nos aprofundarmos com o decorrer do semestre. Falaremos sobre a lei dos Gases, que são simplesmente expressões matemáticas que correlacionam variáveis, como pressão, temperatura, volume e composição, capazes de descrever o comportamento de um gás. Foi a partir do estudo de gases que a química teve os primeiros insigths da separação do pensamento alquimista, predominante na época (1600). Cobre e como reagente ácido nítrico formando gás de dióxido de nitrogênio. (Fonte: 8
9 Gases EQUAÇÕES DE ESTADO Aula 1 Nos estudos das ciências exatas é muito comum se utilizar de equações matemáticas que nos ajudem a descrever um determinado sistema em estudo. Por isso, será comum a partir de agora todo o seu conhecimento de calculo e álgebra para estudar química. Para um dado material, esteja ele na forma sólida, líquida ou gasosa, seu volume (V) é determinado por seu número de mols (n), pressão (p) e temperatura (T) em que se encontra, conhecidos como grandezas do material. Podemos escrever então uma expressão matemática que relacione essas grandezas entre si; a esta relação matemática damos o nome de equação de estado e é simbolicamente expressa como: (Eq.1) Podemos interpretar a Eq. 1 da seguinte forma: o volume de um material é função de 3 variáveis (número de mols, pressão e temperatura). Assim, deve haver uma equação matemática que relacione essas três variáveis de modo a podermos determinar o volume do material. Para o caso de líquidos e sólidos, as equações de estado podem ser muito complexas, apresentando formas diferentes de uma substância para a outra. Para os gases, em particular, a equação para baixas pressões é conhecida, e apresentam formas praticamente idênticas para todos os gases. Essa equação é simples e extremamente útil. Discutiremos mais adiante nesta aula. PRESSÃO DOS GASES Para determinarmos uma equação de estado dos gases é necessário medirmos a pressão, que nada mais é que a força por unidade de área exercida sobre as paredes do recipiente que o contem. (Eq.2) Sendo p a pressão, F a força exercida sobre as paredes do recipiente e A a área desse recipiente. Por exemplo, em um balão de festa cheio, o gás presente em seu interior empurra as paredes do balão com tal força que faz com que as paredes estiquem. Quanto maior a pressão agindo numa dada área, maior é a pressão. A origem da força exercida pelo gás é a incessante colisão das moléculas e/ou átomos nas paredes do recipiente. As colisões são tão numerosas que a força exercida permanece estacionaria, ou seja, sem alterações, o qual resulta numa pressão também estacionaria. 9
10 Físico-Química Experimental Curiosidade: Você já se perguntou por que a faca corta? O conceito de pressão nos permite entender muito dos fenômenos físicos que nos rodeiam. Por exemplo, para cortar um pedaço de tomate, utilizamos o lado afiado da faca (menor área de contato), pois, para uma mesma força, quanto menor a área, maior a pressão produzida. Logo, a pressão sobre o tomate será maior quanto mais afiada for a faca. Figura 1: Ao usar uma faca, buscamos sempre o lado afiado, justamente para exercer a mesma força sobre uma área menor. (Fonte: A pressão dos gases é geralmente expressa em unidades de atmosfera, abreviado por atm, ou milímetros de mercúrio (mm Hg), mas no sistema internacional de unidades (SI do inglês: International System of Units) utiliza-se o pascal (Pa) o qual é definido como 1 newton por metro quadrado. (Eq.3) Na Tabela 1 estão algumas unidades de pressão e suas conversões Tabela 1: Unidades de Pressão e algumas conversões. Uma maneira de medir a pressão atmosférica terrestre é pelo uso de um barômetro. Este instrumento pode medir a pressão exercida pela atmosfera usando água, ar ou mercúrio (Veja Figura 2). A versão original do 10
11 Gases barômetro foi construída por Evangelista Torricelli, em 1643, que consiste de um tubo vertical de vidro, selado em uma das extremidades e preenchido de mercúrio, o qual a extremidade aberta fica em contato com um reservatório também contendo mercúrio. A pressão do ar sobre o reservatório é balanceada pela pressão atmosférica terrestre o qual empurra o peso da coluna de mercúrio acima do nível do reservatório. Quanto maior a pressão do ar, maior será a altura da coluna de mercúrio. Aula 1 Figura 2: Exemplo de um barômetro de mercúrio. Figura 3: Tubo de Torricelli ou barômetro (do grego baros : peso e metron : medida), gravura retirada do livro de Camille Flammarion (1923): Fonte: 11
12 Físico-Química Experimental Curiosidade: Evangelista Torricelli nasceu em Faenza, Itália, em 15 de outubro de Aos 19 anos iniciou seus estudos na Universidade de Roma e que anos depois veio a tornar-se professor. Em 1641 publicou seu primeiro livro. Suas obras mais importantes são o Tratado dol Movimento e Obras geométricas Apesar de uma vida relativamente curta, produziu importantes trabalhos na área física e matemática. Foi aluno de Galileu Galilei durante seus últimos três meses de vida. Faleceu em Florência, Itália, em 25 de outubro de 1647: Figura 4: Gravura de Evangelista Torricelli (Fonte: ATIVIDADES Calcule a pressão exercida por uma coluna preenchida por um líquido de densidade ñ (modelo de barômetro de Torricelli) e altura da coluna h. Derive uma equação para a pressão na base da coluna. Resolução: Sabemos que e, sendo g a aceleração da gravidade. Precisamos saber a massa da coluna formada pelo líquido. A densidade ñ é dada por: (Eq.4) No entanto necessitamos saber o volume ocupado pelo líquido. Considerando a coluna tendo uma forma cilíndrica, escrevemos seu volume como sendo: V = A h (Eq.5) Sendo h a altura da coluna preenchida pelo líquido e A a área da base da coluna. Assim, substituindo a Eq.5 na Eq.6, temos: (Eq.6) 12
13 Rearranjando a Eq. 6: Gases (Eq.7) Aula 1 De posse da Eq.7, podemos inserí-la na Equação da Força: (Eq.8) E por fim podemos calcular a pressão exercida na base de uma coluna preenchida por um líquido de densidade ñ. Pela Eq.2: (Eq.9) Note que a pressão é independente da forma e área da coluna. A LEI DOS GASES LEI DE BOYLE (RELAÇÃO PRESSÃO-VOLUME) A relação matemática existente entre a pressão e o volume de uma determinada quantidade de gás numa dada temperatura foi descoberta por Robert Boyle em 1662, agindo sob sugestão de John Townley, Boyle mediu o volume de uma dada quantidade de gás a uma dada pressão, em seguida mudou a pressão para medir o volume de novo. Ele obteve um conjunto de dados similar aos mostrados na Tabela 2. Após repetir o processo diversas vezes para diferentes gases ele concluiu que: A temperatura e composição constante, o volume de uma dada amostra de um gás é inversamente proporcional a sua pressão. Esta afirmação é conhecida como Lei de Boyle. Tabela 2: Típico conjunto de dados que ilustra a Lei de Boyle O termo inversamente proporcional é uma afirmação da Lei de Boyle que significa que com o aumento da pressão, o volume se torna 13
14 Físico-Química Experimental menor pelo mesmo fator. Por exemplo, se a pressão é duplicada, o volume diminui pela metade; se a pressão aumenta em cinco vezes, o volume cai para 1/5 do valor inicial. Essa relação pode ser representada matematicamente por: ( T e n constante) (Eq.10) sendo p a pressão, V o volume e k uma constante. Note que a constante k leva consigo os subíndices T e n, indicando que o processo ocorre temperatura e composição constante. ATIVIDADES Qual é o valor da constante k T,n para os dados presentes na Tabela 2 gerados a partir da expansão isotérmica de um gás? Resposta: Para cada caso, multiplique a pressão observada pelo volume. Você verá que o valor será constante de 8,0 atm L. Assim a constante k T,n é 8,0 atm L. COMENTÁRIO SOBRE AS ATIVIDADES Se uma amostra de um gás a uma certa temperatura o produto pv é constante, então a mudança de pressão de um valor inicial p 1 para um valor final p 2 causará consequentemente uma mudança de volume de uma valor inicial V 1 para um novo valor V 2, de forma que podemos escrever matematicamente: p 1 V 1 = k T,n p 2 V 2 = k T,n p 1 V 1 = p 2 V 2 (Eq.11) Para exercícios envolvendo transformações isotérmicas, pode-se utilizar a Eq. 11 se tornando desnecessário resolver numericamente por k T,n. Auto teste: Uma amostra de 2 L de um gás sob pressão de 675 torr é comprimida a temperatura constante até que sua pressão atinja 925 torr. Qual é o seu novo volume? Resp: 1,46 L 14
15 Gases REPRESENTAÇÃO GRÁFICA DE DADOS EXPERIMENTAIS Aula 1 Frequentemente em trabalhos científicos é extremamente útil apresentar os dados experimentais na forma de um gráfico que permita imediata visualização das tendências gerais e suas relações. Outra vantagem de se representar graficamente um conjunto de dados em um gráfico é ser capaz de estimar valores para os pontos entre, e além, daqueles adquiridos de forma experimental. Por exemplo, na Figura 5 os dados presentes na Tabela 2 estão representados graficamente usando p como eixo vertical (normalmente conhecido por eixo y) e V como eixo vertical (eixo x). Note que ao representar graficamente os valores experimentais é possível verificar que o decréscimo da pressão, a magnitude dos valores de volume aumentam. Além do mais, é possível obter valores intermediários de volume simplesmente lendo entre os pontos da curva e relacionando com o da pressão, é o que chamamos de interpolação. Figura 4: Gráfico de p-v para o conjunto de valores presente na Tabela 2. A LEI DE CHARLES (RELAÇÃO VOLUME-TEMPERARTURA) O cientista francês Jacques Charles estabeleceu uma nova e importante propriedade dos gases. Ele estudou o efeito da temperatura na variação do volume de um gás, mantendo sua pressão constante. Se uma certa quantidade de um gás é aquecido em um recipiente de volume vari- 15
16 Físico-Química Experimental ável, como um pistão, o volume do gás aumentará. De modo contrário, resfriando um gás a pressão constante leva a uma diminuição do volume. J.A.Charles observou que quando uma amostra de um gás é resfriada a pressão constante, seu volume diminui de 1/273 vezes a cada grau Celsius que é resfriado. De modo inverso, quando a amostra é aquecida, ele se expande de 1/273 vezes seu volume para cada grau Celsius. A mudança no volume com a temperatura de duas diferentes amostras de gás é mostrada na Figura 5. Figura 5: Gráfico de V-T de 3 amostras de gás, ilustrando a Lei de Charles. A identidade química do gás não tem influência na mudança do seu volume, tanto quanto o gás não se liquefaça no intervalo de temperaturas estudadas. Pode se ver pela Figura 6, que o volume do gás muda linearmente com a temperatura. Uma reta pode ser traçada através dos pontos. Se assumíssemos que o gás não se liquefaz a baixas temperaturas, cada amostra deveria ter um volume nulo -273 ºC. É claro que para gases reais não se alcançaria nunca um volume nulo (gases se liquefazem quando alcançam temperaturas muito frias). No entanto, -273 K é a temperatura na qual o gás teria teoricamente um volume nulo. A temperatura de -273 K é considerada como o zero absoluto de temperatura. A escala de temperatura usando esta consideração foi chamada de Escala Kelvin ou Escala Absoluta de temperatura. Assim, podemos converter temperaturas em graus Celsius para Kelvin: T (K) = è (ºC)+ 273 (Eq.12 ) sendo è a temperatura em graus Celsius. 16
17 Gases Vale ressaltar que não se usa o símbolo de graus (º) para temperaturas em Kelvin, e a unidade é chamada apenas de kelvins. O fato do volume do gás variar linearmente com a temperatura e o conceito de temperatura absoluta podem ser combinados para dar o enunciado conhecido como a Lei de Charles: Aula 1 A pressão constante, o volume de uma amostra de gás é diretamente proporcional a sua temperatura absoluta. Podemos expressar matematicamente da seguinte maneira: V=k p,n T ( p e n constante) (Eq. 13) Note que a constante k leva consigo os subíndices p e n, indicando que o processo ocorre em temperatura e composição constante. Rearranjando a Eq. 13, podemos escrever: (Eq.14) Uma vez que V/T é uma constante, a razão para uma amostra a um volume e temperatura é igual a mesma razão de qualquer outro volume e temperatura. (Veja a Tabela 3): Tabela 3: Típico conjunto de dados que ilustra a Lei de Charles. ATIVIDADES Uma amostra de gás de 22,5 L é aquecida a pressão constante de 291 K a 309 K, qual é seu volume final? Pela Eq. 14, sabemos que a relação entre a temperatura e volume iniciais é: E temperatura e volume finais: (Eq.15) (Eq.16) 17
18 Físico-Química Experimental Podemos igualar as Eq.15 e Eq.16: (Eq.17) Agora, substituindo os valores, e resolvendo para V 2 : Note que, como esperado, o volume da amostra aumentou de 22,5 ml para 23,9 ml. A LEI DE AVOGADRO (RELAÇÃO VOLUME-NÚMERO DE MOLS) A peça final da informação experimental que nós precisamos é que a uma dada pressão e temperatura, o volume molar, V m = V/n, o volume por mol de moléculas de um gás é aproximadamente o mesmo, independente da identidade do gás. Esta observação implica que o volume de uma amostra de gás é proporcional a quantidade de moléculas (em mols) presente, e que a constante de proporcionalidade é independente da identidade do gás. V=k p,t n ( p e T constante) (Eq.18) Esta conclusão é a forma moderna do Princípio de Avogadro, que diz que volumes iguais de gases a mesma temperatura e pressão contém o mesmo número de moléculas. Para nossa conveniência, foi adotado condições padrões para nos referirmos aos conjuntos de dados experimentais. Para experimentos transcorridos a temperatura de 0 ºC e 1 atm de pressão, chamamos de condições normais de temperatura e pressão (CNTP), e muito dos resultados apresentados em livros e artigos científicos são realizados nessas condições. O volume molar de um gás ideal nas CNTP é 22,41 mol L
19 Gases AS LEIS COMBINADAS Aula 1 De posse das 3 Leis dos gases apresentadas até o momento: As Equações podem ser combinadas em uma única expressão: (Eq.19) Esta expressão está de acordo com as Leis de Charles, Boyle e Avogrado. E que a constante de proporcionalidade, o qual é experimentalmente encontrado para todos os gases é indicado por R e é chamado de constante universal dos gases, e independe da pressão, temperatura ou do número de mols contidos na amostra, resultando na expressão: (Eq.20) A Eq.20 é chamada de Equação de Estado dos Gases Ideais ou Perfeitos. É uma equação de estado aproximada de qualquer gás, e se torna extremamente exata com a diminuição da pressão, ou aumento da temperatura. Isto é, a equação é um exemplo de uma lei limite, uma lei que se torna válida com a diminuição da pressão, e é obedecida exatamente no limite de pressão nula (p!0). Uma substância hipotética que obedece a Eq. 20 para todas as pressões é chamado de Gás Ideal ou Perfeito. Na prática, a pressões normais ao nível do mar (p H 100 kpa) são pequenas o suficiente para a maioria dos Gases Reais se comportar quase que perfeitamente. Voltando a Eq.20 podemos ver a extensão na qual um gás real se afasta do comportamento ideal ao reordenar a equação do gás ideal: (Eq.21) Para um mol de um gás ideal (n = 1), a quantidade de é igual a 1 para todas as pressões. Se representarmos graficamente por p, 19
20 Físico-Química Experimental teremos uma reta com valor constante de 1 para qualquer intervalo de pressão. No entanto, os gases reais não se comportam idealmente a altas pressões ou baixas temperaturas. Veja Figura 7, para os gases H 2, N 2 CO 2 ou mesmo CH 4, todos eles se afastam da idealidade assim que sua pressão aumenta. No entanto, a baixas pressões, o desvio da idealidade é menor e pode-se usar a equação dos gases ideais sem que seja gerado erros muito sérios. Figura 6: Gráfico de por p para ilustrar os desvios de idealidade dos gases reais. OS GASES REAIS E A EQUAÇÃO DE VAN DER WAALS Quando nos referimos aos gases Ideais não nos preocupamos com o volume da molécula que compõe o gás nem tão pouco com as interações que podem ocorrem entre si. Essas duas característica, quando ignoradas, levam a desvios como os vistos na Figura 7. Por isso muitos esforços foram feitos para se encontrar uma equação de estado que descrevesse o comportamento dos gases reais. O físico Holandês Johannes Diderik van der Waals propôs uma equação de estado levando em conta o tamanho e as forças de interações das moléculas constituintes do gás. A Equação é normalmente escrita como: (Eq.22) Esta equação é um exemplo excelente de uma expressão que pode ser obtida pelo pensamento científico sobre um problema matematicamente complicado, mas fisicamente simples. van der Waals identificou 20
21 Gases que para um gás real a expressão dos Gases Ideais teria de ser corrigida para um volume finito ocupado pelas moléculas e por suas interações, introduziu 2 constantes a e b para fazer essas correções. Na Equação de van der Waals, o volume é diminuído por um fator nb que explica o volume finito ocupado pelas moléculas. A constante b é uma medida do volume real ocupado por um mol de moléculas de gás. Sua unidade é L mol -1. Aula 1 Já a pressão é diminuída pelo fator que explica o fato das forças intermoleculares aumentarem com o quadrado do número de moléculas. A magnitude de a reflete a força com que as moléculas se atraem. A constante a tem unidades de L 2 atm mol -2. As constantes a e b possui valores positivos e são características individuais de cada gás Na Tabela 4 estão alguns valores dos coeficientes da Equação de van der Waals. Analisando a Equação 22 podemos ver que ela se aproxima da Equação dos gases ideais assim que os valores das constantes a e b se aproximam de zero. Figura 7: Selo comemorativo a Johannes Diderik van der Waals pela sua contribuição a ciência. Johannes Diderik van der Waals, físico e matemático, nasceu em 23 de novembro de 1837 em Leyden, nos Países Baixos. Ficou famoso por seu trabalho com gases, o qual supôs que átomos e moléculas são reais, uma proposição que, em 1873, ainda era considerada uma ideia controversa. Mas sua derivação puramente teórica da equação de estado de um gás, levando o volume finito das partículas constituintes do gás e as possíveis interações entre si, foi suficiente para derivar a massa do átomo de hidrogênio. van der Waals serviu de grande influência para cientistas que viriam a seguir, como James Clerk Maxwell, Ludwig Boltzmann, and Willard Gibbs. Pelo seu trabalho, recebeu o prêmio Nobel de Física em Morreu em 8 de março de 1923 aos 85 anos em Amsterdã. 21
22 Físico-Química Experimental ATIVIDADES Se 1,0 mol de um Gás Ideal estivesse confinado em um volume de 22,4 L a 0 ºC, exerceria uma pressão de 1,0 atm. Use a Equação de van der Waals e os valores de a e b para estimar a pressão exercida por 1,0 mol de H 2(g) em 22,4 L a 0 ºC. Dado: a = 0,244 L 2 atm mol -2 e b = 0,027 L mol -1. Veja que a diferença entre usar a Equação dos Gases Ideais ou a de van der Waals, para o caso de baixas pressões é menor que 1%. Auto-Teste: Calcule a pressão exercida por 1 mol de H 2 S que se comporta como: (a) um gás ideal, e (b) um gás de van der Waals, nas seguintes condições: (i) a 273 K e 22,41 L e (ii) a 500 K em 150 cm 3. Dados: coeficientes de van der Waals para a = 4,49 L 2 atm mol -2 e b= 0,04287 L mol -1. Discuta a diferença do uso das duas equações para o cálculo da pressão para as diferentes temperaturas. Resp: para Gas Ideal: (i) 1 atm (ii) 273,33 atm. Para van der Waals (i) 0,99 atm e (ii) 183,16 atm. Tabela 4: Coeficientes de van der Waals. (Fonte: Physical Chemistry, P.W.Atkins, Oxford, 1994). a (L 2 atm mol -2 ) b (L mol -1 ) Ar 1,363 3,219 CO 2 3,640 4,267 H 2 0,2476 2,661 H2O 5,536 3,049 H 2 S 4,490 4,287 CONCLUSÃO Nesta Aula tivemos a oportunidade de conhecer a evolução das Leis dos Gases, suas limitações e consequências. Aprendemos a relacionar os dados experimentais em tabelas e como representá-los graficamente de forma a nos ajudar nas suas interpretações. Esse conhecimento nos será útil não apenas nesta disciplina, mas sim em todas as outras que virão no decorrer do curso. A partir de agora temos condições de nos aventurar em mais experimentos sem ser prejudicado pela falta de conhecimento dos conteúdos mínimos. 22
23 Gases RESUMO Aula 1 Foi possível ver, pelos conteúdos abordados na aula de hoje, o desenvolvimento das Leis dos gases até culminar na Equação de Estado que descreve um Gás Ideal. Vimos que esta equação possui suas limitações em altas pressões, mas que para o nosso propósito ela pode ser utilizada sem muita imprecisão para os gases reais. Também a partir da Equação dos Gases Ideais, podemos expandir sua complexidade considerando o volume finito das espécies que compõe o gás e suas interações, como visto na Equação de van der Waals representados pelos coeficientes a e b. PRÓXIMA AULA Na próxima aula veremos os conceitos gerais envolvidos nas leis dos Gases e como usá-los na determinação da constante geral dos gases (R). REFERÊNCIAS PILLA, L. Físico-Química I. Rio de Janeiro: Livros Técnicos e Científicos Editora S.A., BALL, D. W. Físico Química, v. 1. São Paulo: Pioneira Thomson Learning, ATKINS, P. W. Physical Chemistry. 6 ed. Oxford: Oxford University Press, Físico-Química e Fundamentos. 3 ed. Rio de Janeiro: Livros Técnicos e Científicos Editora.,
Geomorfologia Estrutural. Hélio Mário de Araújo Ana Claudia da Silva Andrade
 Geomorfologia Estrutural Hélio Mário de Araújo Ana Claudia da Silva Andrade São Cristóvão/SE 2011 Geomorfologia Estrutural Elaboração de Conteúdo Hélio Mário de Araújo Ana Claudia da Silva Andrade Hermeson
Geomorfologia Estrutural Hélio Mário de Araújo Ana Claudia da Silva Andrade São Cristóvão/SE 2011 Geomorfologia Estrutural Elaboração de Conteúdo Hélio Mário de Araújo Ana Claudia da Silva Andrade Hermeson
!,* $ 4 Aldo Dinucci São Cristóvão/SE 2007
 Aldo Dinucci São Cristóvão/SE 2007 Elaboração de Conteúdo Aldo Dinucci Cícero Cunha Bezerra Hermeson Alves de Menezes Diagramação Neverton correia da Silva Ilustração Arlan Clecio dos Santos Clara Suzana
Aldo Dinucci São Cristóvão/SE 2007 Elaboração de Conteúdo Aldo Dinucci Cícero Cunha Bezerra Hermeson Alves de Menezes Diagramação Neverton correia da Silva Ilustração Arlan Clecio dos Santos Clara Suzana
Métodos de Física Teórica II. Osmar S. Silva Jr.
 Métodos de Física Teórica II Osmar S. Silva Jr. São Cristóvão/SE 2009 Métodos de Física Teórica II Elaboração de Conteúdo Osmar S. Silva Jr. Capa Hermeson Alves de Menezes Copyright 2009, Universidade
Métodos de Física Teórica II Osmar S. Silva Jr. São Cristóvão/SE 2009 Métodos de Física Teórica II Elaboração de Conteúdo Osmar S. Silva Jr. Capa Hermeson Alves de Menezes Copyright 2009, Universidade
Elementos de Anatomia Humana. José Aderval Aragão
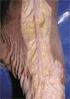 Elementos de Anatomia Humana José Aderval Aragão São Cristóvão/SE 2007 Elementos de Anatomia Humana Elaboração de Conteúdo José Aderval Aragão Karina Conceição Gomes Machado Araújo Danilo Ribeiro Guerra
Elementos de Anatomia Humana José Aderval Aragão São Cristóvão/SE 2007 Elementos de Anatomia Humana Elaboração de Conteúdo José Aderval Aragão Karina Conceição Gomes Machado Araújo Danilo Ribeiro Guerra
Didática e Metodologia para o Ensino de Física II. Divanizia do Nascimento Souza
 Didática e Metodologia para o Ensino de Física II Divanizia do Nascimento Souza São Cristóvão/SE 2011 Didática e Metodologia para o Ensino de Física II Elaboração de Conteúdo Divanizia do Nascimento Souza
Didática e Metodologia para o Ensino de Física II Divanizia do Nascimento Souza São Cristóvão/SE 2011 Didática e Metodologia para o Ensino de Física II Elaboração de Conteúdo Divanizia do Nascimento Souza
Matemática para o Ensino Médio I. Ângelo Alberti
 Matemática para o Ensino Médio I Ângelo Alberti São Cristóvão/SE 2010 Matemática para o Ensino Médio I Elaboração de Conteúdo Ângelo Alberti Copyright 2010, Universidade Federal de Sergipe / CESAD. Nenhuma
Matemática para o Ensino Médio I Ângelo Alberti São Cristóvão/SE 2010 Matemática para o Ensino Médio I Elaboração de Conteúdo Ângelo Alberti Copyright 2010, Universidade Federal de Sergipe / CESAD. Nenhuma
Métodos de Física Teórica I. Osmar de Souza e Silva Júnior
 Métodos de Física Teórica I Osmar de Souza e Silva Júnior São Cristóvão/SE 2009 Métodos de Física Teórica I Elaboração de Conteúdo Osmar de Souza e Silva Júnior Projeto Gráfico e Capa Hermeson Alves de
Métodos de Física Teórica I Osmar de Souza e Silva Júnior São Cristóvão/SE 2009 Métodos de Física Teórica I Elaboração de Conteúdo Osmar de Souza e Silva Júnior Projeto Gráfico e Capa Hermeson Alves de
Instrumentação para o Ensino de Física IV. Vera Lucia Martins de Mello
 Instrumentação para o Ensino de Física IV Vera Lucia Martins de Mello São Cristóvão/SE 2012 Instrumentação para o Ensino de Física IV Elaboração de Conteúdo Vera Lucia Martins de Mello Neverton Correia
Instrumentação para o Ensino de Física IV Vera Lucia Martins de Mello São Cristóvão/SE 2012 Instrumentação para o Ensino de Física IV Elaboração de Conteúdo Vera Lucia Martins de Mello Neverton Correia
Introdução à Ciência da Computação. Hendrik Teixeira Macedo
 Introdução à Ciência da Computação Hendrik Teixeira Macedo São Cristóvão/SE 2009 Introdução à Ciência da Computação Elaboração de Conteúdo Hendrik Teixeira Macedo Capa Hermeson Alves de Menezes Reimpressão
Introdução à Ciência da Computação Hendrik Teixeira Macedo São Cristóvão/SE 2009 Introdução à Ciência da Computação Elaboração de Conteúdo Hendrik Teixeira Macedo Capa Hermeson Alves de Menezes Reimpressão
Equações Diferenciais Ordinárias. Lúcia de Fátima de Medeiros Brandão Dias
 Equações Diferenciais Ordinárias Lúcia de Fátima de Medeiros Brandão Dias São Cristóvão/SE 2009 Equações Diferenciais Ordinárias Elaboração de Conteúdo Lúcia de Fátima de Medeiros Brandão Dias Capa Hermeson
Equações Diferenciais Ordinárias Lúcia de Fátima de Medeiros Brandão Dias São Cristóvão/SE 2009 Equações Diferenciais Ordinárias Elaboração de Conteúdo Lúcia de Fátima de Medeiros Brandão Dias Capa Hermeson
Matemática para o Ensino Fundamental. Éder Matheus de Souza
 Matemática para o Ensino Fundamental Éder Matheus de Souza São Cristóvão/SE 2010 Matemática para o Ensino Fundamental Elaboração de Conteúdo Éder Matheus de Souza Capa Hermeson Alves de Menezes Copyright
Matemática para o Ensino Fundamental Éder Matheus de Souza São Cristóvão/SE 2010 Matemática para o Ensino Fundamental Elaboração de Conteúdo Éder Matheus de Souza Capa Hermeson Alves de Menezes Copyright
História do Brasil Colônia. Maria Izabel Ladeira Silva
 História do Brasil Colônia Maria Izabel Ladeira Silva São Cristóvão/SE 2010 História do Brasil Colônia Elaboração de Conteúdo Maria Izabel Ladeira Silva Hermeson Alves de Menezes Diagramação Nycolas Menezes
História do Brasil Colônia Maria Izabel Ladeira Silva São Cristóvão/SE 2010 História do Brasil Colônia Elaboração de Conteúdo Maria Izabel Ladeira Silva Hermeson Alves de Menezes Diagramação Nycolas Menezes
QUÍMICA I Gases
 QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
QUÍMICA I 106201 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre
Química Ambiental. Carlos Alexandre Borges Garcia Elisangela de Andrade Passos
 Química Ambiental Carlos Alexandre Borges Garcia Elisangela de Andrade Passos São Cristóvão/SE 2012 Química Ambiental Elaboração de Conteúdo Carlos Alexandre Borges Garcia Elisangela de Andrade Passos
Química Ambiental Carlos Alexandre Borges Garcia Elisangela de Andrade Passos São Cristóvão/SE 2012 Química Ambiental Elaboração de Conteúdo Carlos Alexandre Borges Garcia Elisangela de Andrade Passos
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Botânica Sistemática e Econômica. Ana Paula do Nascimento Prata
 Botânica Sistemática e Econômica Ana Paula do Nascimento Prata São Cristóvão/SE 2010 Botânica Sistemática e Econômica Elaboração de Conteúdo Ana Paula do Nascimento Prata Hermeson Alves de Menezes Diagramação
Botânica Sistemática e Econômica Ana Paula do Nascimento Prata São Cristóvão/SE 2010 Botânica Sistemática e Econômica Elaboração de Conteúdo Ana Paula do Nascimento Prata Hermeson Alves de Menezes Diagramação
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Geologia Geral. José Wallace Bezerra Nascimento Ana Cláudia da Silva Andrade
 Geologia Geral José Wallace Bezerra Nascimento Ana Cláudia da Silva Andrade São Cristóvão/SE 2007 Geologia Geral Elaboração de Conteúdo José Wallace Bezerra Nascimento Ana Cláudia da Silva Andrade Hermeson
Geologia Geral José Wallace Bezerra Nascimento Ana Cláudia da Silva Andrade São Cristóvão/SE 2007 Geologia Geral Elaboração de Conteúdo José Wallace Bezerra Nascimento Ana Cláudia da Silva Andrade Hermeson
Estruturas Algébricas I. Natanael Oliveira Dantas
 Estruturas Algébricas I Natanael Oliveira Dantas São Cristóvão/SE 2009 Estruturas Algébricas I Elaboração de Conteúdo Natanael Oliveira Dantas Capa Hermeson Alves de Menezes Reimpressão Copyright 2009,
Estruturas Algébricas I Natanael Oliveira Dantas São Cristóvão/SE 2009 Estruturas Algébricas I Elaboração de Conteúdo Natanael Oliveira Dantas Capa Hermeson Alves de Menezes Reimpressão Copyright 2009,
Características dos gases
 Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Gases Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão, seu volume diminui. Os gases sempre formam misturas
Laboratório para o Ensino de Gêneros Textuais. Maria Aparecida Silva Ribeiro
 Laboratório para o Ensino de Gêneros Textuais Maria Aparecida Silva Ribeiro São Cristóvão/SE 2010 Laboratório para o Ensino de Gêneros Textuais Elaboração de Conteúdo Maria Aparecida Silva Ribeiro Projeto
Laboratório para o Ensino de Gêneros Textuais Maria Aparecida Silva Ribeiro São Cristóvão/SE 2010 Laboratório para o Ensino de Gêneros Textuais Elaboração de Conteúdo Maria Aparecida Silva Ribeiro Projeto
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
Estrutura e Funcionamento da Educação Básica. Maria José Nascimento Soares Valtênio Paes de Oliveira
 Estrutura e Funcionamento da Educação Básica Maria José Nascimento Soares Valtênio Paes de Oliveira São Cristóvão/SE 2009 Estrutura e Funcionamento da Educação Básica Elaboração de Conteúdo Maria José
Estrutura e Funcionamento da Educação Básica Maria José Nascimento Soares Valtênio Paes de Oliveira São Cristóvão/SE 2009 Estrutura e Funcionamento da Educação Básica Elaboração de Conteúdo Maria José
Físico-Química II. Glauber Silva Godoi Kleber Bergamaski
 Físico-Química II Glauber Silva Godoi Kleber Bergamaski São Cristóvão/SE 2013 Físico-Química II Elaboração de Conteúdo Glauber Silva Godoi Kleber Bergamaski Projeto Gráfico e Capa Neverton Correia da Silva
Físico-Química II Glauber Silva Godoi Kleber Bergamaski São Cristóvão/SE 2013 Físico-Química II Elaboração de Conteúdo Glauber Silva Godoi Kleber Bergamaski Projeto Gráfico e Capa Neverton Correia da Silva
META Determinar o volume molar parcial de uma mistura binária de água/etanol pela medida de diferentes composições da mistura.
 QUANTIDADES PARCIAIS MOLARES META Determinar o volume molar parcial de uma mistura binária de água/etanol pela medida de diferentes composições da mistura. OBJETIVOS Ao final desta aula, o aluno deverá:
QUANTIDADES PARCIAIS MOLARES META Determinar o volume molar parcial de uma mistura binária de água/etanol pela medida de diferentes composições da mistura. OBJETIVOS Ao final desta aula, o aluno deverá:
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
Termodinâmica 7. Alexandre Diehl. Departamento de Física - UFPel
 Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
Termodinâmica 7 Alexandre Diehl Departamento de Física - UFPel Robert Boyle (1627-1691) Experimentos com tubo manométrico mercúrio 2 Robert Boyle (1627-1691) Experimentos com tubo manométrico 3 Robert
Professora : Elisângela Moraes
 UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
UNIVERSIDADE DE SÃO PAULO ESCOLA DE ENGENHARIA DE LORENA -EEL Professora : Elisângela Moraes 02/03/2012 PROGRAMA RESUMIDO 1. Gases Ideais; 2. Gases Reais; 3. Termodinâmica; 4. Termoquímica; 5. Entropia;
Laboratório de Mecânica Quântica e de Física Nuclear. Petrucio Barrozo
 Laboratório de Mecânica Quântica e de Física Nuclear Petrucio Barrozo São Cristóvão/SE 2012 Laboratório de Mecânica Quântica e de Física Nuclear Elaboração de Conteúdo Petrucio Barrozo Projeto Gráfico
Laboratório de Mecânica Quântica e de Física Nuclear Petrucio Barrozo São Cristóvão/SE 2012 Laboratório de Mecânica Quântica e de Física Nuclear Elaboração de Conteúdo Petrucio Barrozo Projeto Gráfico
Estágio Supervisionado em Ensino de Biologia I e II. Claudiene Santos Guilherme Guimarães Junior
 Estágio Supervisionado em Ensino de Biologia I e II Claudiene Santos Guilherme Guimarães Junior São Cristóvão/SE 2011 Estágio Supervisionado em Ensino de Biologia I e II Elaboração de Conteúdo Claudiene
Estágio Supervisionado em Ensino de Biologia I e II Claudiene Santos Guilherme Guimarães Junior São Cristóvão/SE 2011 Estágio Supervisionado em Ensino de Biologia I e II Elaboração de Conteúdo Claudiene
Físico-Química I. Profa. Dra. Carla Dalmolin. Gases. Gás perfeito (equações de estado e lei dos gases) Gases reais
 Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Física Experimental II. Exercícios
 Física Experimental II Lista de exercícios e problema preparatório para a Prova P2 Exercícios 1) Foi realizado um experimento para determinar o tipo de movimento de um corpo. Mediu-se a posição deste corpo
Física Experimental II Lista de exercícios e problema preparatório para a Prova P2 Exercícios 1) Foi realizado um experimento para determinar o tipo de movimento de um corpo. Mediu-se a posição deste corpo
Estágio Supervisionado em Ensino de História I. Marcos Silva
 Estágio Supervisionado em Ensino de História I Marcos Silva São Cristóvão/SE 2011 Estágio Supervisionado em Ensino de História I Elaboração de Conteúdo Marcos Silva Projeto Gráfico e Capa Hermeson Alves
Estágio Supervisionado em Ensino de História I Marcos Silva São Cristóvão/SE 2011 Estágio Supervisionado em Ensino de História I Elaboração de Conteúdo Marcos Silva Projeto Gráfico e Capa Hermeson Alves
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO
 AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
AULA 03 GASES Cap. 4 Russel PROF. MARCELL MARIANO CORRÊA MACENO Características dos gases Os gases são altamente compressíveis e ocupam o volume total de seus recipientes. Quando um gás é submetido à pressão,
Soluções e Gases III. Gases
 Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Soluções e Gases III Gases Gases Gás é um material que preenche todo o espaço ou volume do recipiente em que se encontra, independentemente do tamanho do recipiente. Ar 78 % de N 2 21% de O 2 1% de outros
Gases UNIVERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG120. Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI
 UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
UNIERSIDADE FEDERAL DO RIO DE JANEIRO UFRJ INSTITUTO DE QUÍMICA IQG10 http://www.met.reading.ac.uk/~swrmethn/balloon/ Gases Prof. Antonio Guerra Departamento de Química Geral e Inorgânica - DQI A Estrutura
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Termodinâmica Química. Anne Michelle G. P. Souza
 Termodinâmica Química Anne Michelle G. P. Souza São Cristóvão/SE 2009 Termodinâmica Química Elaboração de Conteúdo Anne Michelle G. P. Souza Projeto Grá co e Capa Hermeson Alves de Menezes Diagramação
Termodinâmica Química Anne Michelle G. P. Souza São Cristóvão/SE 2009 Termodinâmica Química Elaboração de Conteúdo Anne Michelle G. P. Souza Projeto Grá co e Capa Hermeson Alves de Menezes Diagramação
QUÍMICA MÓDULO 18 RELAÇÕES NUMÉRICAS. Professor Edson Cruz
 QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
QUÍMICA Professor Edson Cruz MÓDULO 18 RELAÇÕES NUMÉRICAS INTRODUÇÃO Precisamos compreender que houve uma necessidade de se definir uma nova unidade de massa para átomos e moléculas. É importante que você
Geografia da População. José Eloísio da Costa
 Geografia da População José Eloísio da Costa São Cristóvão/SE 2009 Geografia da População Elaboração de Conteúdo José Eloísio da Costa Projeto Gráfico e Capa Hermeson Alves de Menezes Diagramação Nycolas
Geografia da População José Eloísio da Costa São Cristóvão/SE 2009 Geografia da População Elaboração de Conteúdo José Eloísio da Costa Projeto Gráfico e Capa Hermeson Alves de Menezes Diagramação Nycolas
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
4. Propriedades dos gases experimentos e modelo microscópico simples para a temperatura
 PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
Estudos Culturais da Biologia e Educação. Marlécio Maknamara
 Estudos Culturais da Biologia e Educação Marlécio Maknamara São Cristóvão/SE 2012 Estudos Culturais da Biologia e Educação Elaboração de Conteúdo Marlécio Maknamara Projeto Gráfico Neverton Correia da
Estudos Culturais da Biologia e Educação Marlécio Maknamara São Cristóvão/SE 2012 Estudos Culturais da Biologia e Educação Elaboração de Conteúdo Marlécio Maknamara Projeto Gráfico Neverton Correia da
ATMOSFERA. Volume molar; constante de Avogadro
 ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
ATMOSFERA Volume molar; constante de Avogadro 25-01-2011 Dulce Campos 2 O ar é uma solução gasosa Enquanto solução gasosa tem comportamentos semelhantes aos das substâncias gasosas 25-01-2011 Dulce Campos
Capítulo 1. Propriedades dos Gases
 Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Capítulo 1. Propriedades dos Gases Baseado no livro: Atkins Physical Chemistry Eighth Edition Peter Atkins Julio de Paula 14-03-2007 Maria da Conceição Paiva 1 O estado físico de uma substância A equação
Temas Estruturadores para o Ensino de Química I. Luiz Oliveira Passos
 Temas Estruturadores para o Ensino de Química I Luiz Oliveira Passos São Cristóvão/SE 2009 Temas Estruturadores para Ensino de Química I Elaboração de Conteúdo Luiz Oliveira Passos Projeto Gráfico e Capa
Temas Estruturadores para o Ensino de Química I Luiz Oliveira Passos São Cristóvão/SE 2009 Temas Estruturadores para Ensino de Química I Elaboração de Conteúdo Luiz Oliveira Passos Projeto Gráfico e Capa
Física Básica Experimental. Menilton Menezes
 Física Básica Experimental Menilton Menezes São Cristóvão/SE 2009 Física Básica Experimental Elaboração de Conteúdo Menilton Menezes Projeto Gráfico Neverton Correia da Silva Nycolas Menezes Melo Capa
Física Básica Experimental Menilton Menezes São Cristóvão/SE 2009 Física Básica Experimental Elaboração de Conteúdo Menilton Menezes Projeto Gráfico Neverton Correia da Silva Nycolas Menezes Melo Capa
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal.
 Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
Módulo V Equações de Estado, Fator de Compressibilidade e Modelo de Gás Ideal. Equações de Estado Não é fácil trabalhar com as tabelas termodinâmicas. A dificuldade está associada ao volume delas e a possibilidade
O ESTADO GASOSO - CARACTERÍSTICAS GERAIS
 Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Estado Gasoso O ESTADO GASOSO - CARACTERÍSTICAS GERAIS Os gases sempre tendem a ocupar todo o volume do recipiente que os contém (capacidade de expansão) Os gases têm massa (Volumes iguais de gases diferentes
Prática 03 Determinação do Zero Absoluto
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 03 Determinação do Zero Absoluto 1. Introdução
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 03 Determinação do Zero Absoluto 1. Introdução
Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC 2º TRI PRIMEIRO ANO FSC II
 1º EM E.M. FÍSICA Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC º TRI PRIMEIRO ANO FSC II Estudar FÍSICA II LIVRO PV = nrt Dilatação dos Sólidos e dos Líquidos
1º EM E.M. FÍSICA Aluno(a): nº: Professor: Fernanda TonettoSurmas Data: Turma: ORIENTAÇÕES DE ESTUDO REC º TRI PRIMEIRO ANO FSC II Estudar FÍSICA II LIVRO PV = nrt Dilatação dos Sólidos e dos Líquidos
Quimiometria. Iara de Fátima Gimenez Nivan Bezerra da Costa Jr.
 Quimiometria Iara de Fátima Gimenez Nivan Bezerra da Costa Jr. São Cristóvão/SE 2007 Quimiometria Elaboração de Conteúdo Iara de Fátima Gimenez Nivan Bezerra da Costa Jr. Projeto Gráfico Hermeson Alves
Quimiometria Iara de Fátima Gimenez Nivan Bezerra da Costa Jr. São Cristóvão/SE 2007 Quimiometria Elaboração de Conteúdo Iara de Fátima Gimenez Nivan Bezerra da Costa Jr. Projeto Gráfico Hermeson Alves
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
COMPORTAMENTO DOS GASES
 BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
PME 3344 Termodinâmica Aplicada
 PME 3344 Termodinâmica Aplicada 3) Substâncias Puras 1 v. 2.0 Diagramas de propriedades Vamos elaborar um experimento para relacionar temperatura e volume específico a pressão constante. Pressão no fluido
PME 3344 Termodinâmica Aplicada 3) Substâncias Puras 1 v. 2.0 Diagramas de propriedades Vamos elaborar um experimento para relacionar temperatura e volume específico a pressão constante. Pressão no fluido
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Combustíveis Energia e Ambiente. Combustíveis gasosos, líquidos e sólidos: compreender as diferenças
 Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
PRÁTICA: DETERMINAÇÃO DA CONSTANTE R DOS GASES. pv= nrt (01) Gás Ideal : obedece pv=n RT em qualquer condição de T e p.
 PRÁTICA: DETERMINAÇÃO DA CONSTANTE R DOS GASES 1. Introdução A matéria pode se apresentar nos estados sólido, líquido e gasoso. A temperatura e a pressão são as variáveis responsáveis pelo seu estado físico.
PRÁTICA: DETERMINAÇÃO DA CONSTANTE R DOS GASES 1. Introdução A matéria pode se apresentar nos estados sólido, líquido e gasoso. A temperatura e a pressão são as variáveis responsáveis pelo seu estado físico.
Física I 2010/2011. Aula 18. Mecânica de Fluidos I
 Física I 2010/2011 Aula 18 Mecânica de Fluidos I Sumário Capítulo 14: Fluidos 14-1 O que é um Fluido? 14-2 Densidade e Pressão 14-3 Fluidos em Repouso 14-4 A Medida da pressão 14-5 O Princípio de Pascal
Física I 2010/2011 Aula 18 Mecânica de Fluidos I Sumário Capítulo 14: Fluidos 14-1 O que é um Fluido? 14-2 Densidade e Pressão 14-3 Fluidos em Repouso 14-4 A Medida da pressão 14-5 O Princípio de Pascal
Estequiometria. Mestranda: Daniele Potulski Disciplina: Química da madeira I
 Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estequiometria Mestranda: Daniele Potulski Disciplina: Química da madeira I Estequiometria Estequiometria é o cálculo da quantidade de reagentes e produtos da reação, baseado nas leis das reações químicas.
Estudo dos gases. Prof. Leandro Zatta - Química Geral 1
 Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Estudo dos gases Prof. Leandro Zatta - Química Geral 1 Modelo molecular dos gases Há pouca matéria em um dado volume Existência de muito espaço vazio entre as moléculas individuais São tão facilmente comprimidos
Métodos Quantitativos em Biologia I. Samuel de Oliveira Ribeiro
 Métodos Quantitativos em Biologia I Samuel de Oliveira Ribeiro São Cristóvão/SE 2009 Métodos Quantitativos em Biologia I Elaboração de Conteúdo Samuel de Oliveira Ribeiro Projeto Gráfico e Capa Hermeson
Métodos Quantitativos em Biologia I Samuel de Oliveira Ribeiro São Cristóvão/SE 2009 Métodos Quantitativos em Biologia I Elaboração de Conteúdo Samuel de Oliveira Ribeiro Projeto Gráfico e Capa Hermeson
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
3º Trimestre Sala de estudo Química Data: 26/03/19 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Gases (equação geral dos gases) Questão 01 - (Mackenzie SP/2018) Certa massa fixa de um
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Física II FEP 112 ( ) 1º Semestre de Instituto de Física - Universidade de São Paulo. Professor: Valdir Guimarães
 Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA
 Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Todo gás exerce uma PRESSÃO, ocupando um certo VOLUME à determinada TEMPERATURA Aos valores da pressão, do volume e da temperatura chamamos de ESTADO DE UM GÁS Assim: V 5 L T 300 K P 1 atm Os valores da
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
2 Temperatura Empírica, Princípio de Carnot e Temperatura Termodinâmica
 2 Temperatura Empírica, Princípio de Carnot e Temperatura Termodinâmica 2.1 Temperatura empírica: medidas de temperatura Termômetro: Sistema com uma propriedade mensurável que varia com a temperatura (propriedade
2 Temperatura Empírica, Princípio de Carnot e Temperatura Termodinâmica 2.1 Temperatura empírica: medidas de temperatura Termômetro: Sistema com uma propriedade mensurável que varia com a temperatura (propriedade
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS
 ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
ELEMENTOS QUE FORMAM GASES NAS CONDIÇÕES NORMAIS Substância no estado gasoso é definida por 4 qualidades: Volume Quantidade de matéria (mol) Temperatura Pressão 1. fase gasosa Átomos He Ar (gases nobres)
Disciplina: Sistemas Térmicos
 Disciplina: Sistemas Térmicos Definição de Substância Pura Equilíbrio de Fases Líquido-Vapor de uma Substância Pura Diagrama de Temperatura versus Volume Específico Título de uma Substância com Fases Líquida
Disciplina: Sistemas Térmicos Definição de Substância Pura Equilíbrio de Fases Líquido-Vapor de uma Substância Pura Diagrama de Temperatura versus Volume Específico Título de uma Substância com Fases Líquida
Conceitos Básicos sobre gases
 Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Conceitos Básicos sobre gases ara este estudo não vamos fazer distinção entre gás e vapor, desta forma neste capítulo, o estado gasoso (gás ou vapor) será sempre referido como gás... ressão dos gases Suponha
Temas de História Econômica. Ruy Belém de Araújo Lourival Santana Santos
 Temas de História Econômica Ruy Belém de Araújo Lourival Santana Santos São Cristóvão/SE 2011 Temas de História Econômica Elaboração de Conteúdo Ruy Belém de Araújo Lourival Santana Santos Projeto Gráfico
Temas de História Econômica Ruy Belém de Araújo Lourival Santana Santos São Cristóvão/SE 2011 Temas de História Econômica Elaboração de Conteúdo Ruy Belém de Araújo Lourival Santana Santos Projeto Gráfico
Teoria Cinética dos Gases
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II Teoria Cinética dos Gases Prof. Bruno Farias Introdução Termodinâmica é o estudo das transformações
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II Teoria Cinética dos Gases Prof. Bruno Farias Introdução Termodinâmica é o estudo das transformações
GASES. QUIMICA II a Unidade
 GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
GASES QUIMICA II a Unidade Estado Físico de uma Substância sólido > líquido > gasoso Aumento do volume O estado de agregação da matéria varia com a distância entre as partículas que compõem a substância
ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA
 ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA Camilo Andrea Angelucci META Compreender os conceitos relacionados as leis de velocidade e seus modelos matematicos. compreender as aplicações conjuntas dessas
ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA Camilo Andrea Angelucci META Compreender os conceitos relacionados as leis de velocidade e seus modelos matematicos. compreender as aplicações conjuntas dessas
6/Mar/2013 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
META Estudar o comportamento de reações químicas que envolvem mais de uma etapa.
 EQUÇÕES CINÉTICS COMPOSTS Camilo ndrea ngelucci ula MET Estudar o comportamento de reações químicas que envolvem mais de uma etapa. OBJETIVOS o fi nal desta aula, o aluno deverá: compreender e determinar
EQUÇÕES CINÉTICS COMPOSTS Camilo ndrea ngelucci ula MET Estudar o comportamento de reações químicas que envolvem mais de uma etapa. OBJETIVOS o fi nal desta aula, o aluno deverá: compreender e determinar
EXPERIÊNCIA 2 DETERMINAÇÃO DA MASSA MOLECULAR DE UM GÁS EFEITO DA PRESSÃO NO PONTO DE EBULIÇÃO
 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: Interpretar as leis que regem o comportamento dos gases ideais. Utilizar a equação da lei do gás ideal, PV = nrt Medir o volume e a
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Descrição Macroscópica de um Gás ideal
 Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
PROPRIEDADE DOS GASES
 RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I
 Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Aluno (a): Profº: RICARDO Série: Data: / / Disc: QUÍMICA EXERCÍCIOS DE FIXAÇÃO QUÍMICA GASES I 1. Uma Massa fixa de um gás ideal foi submetida a uma série de transformações isotérmicas e alguns dos valores
Aula 14 Equilíbrio de Fases: Substâncias Puras
 Aula 14 Equilíbrio de Fases: Substâncias Puras 1. A condição de estabilidade Inicialmente precisamos estabelecer a importância da energia de Gibbs molar na discussão das transições de fase. A energia de
Aula 14 Equilíbrio de Fases: Substâncias Puras 1. A condição de estabilidade Inicialmente precisamos estabelecer a importância da energia de Gibbs molar na discussão das transições de fase. A energia de
LOQ Fenômenos de Transporte I
 LOQ 4083 - Fenômenos de Transporte I FT I 04 Pressão e Estática dos fluidos Prof. Lucrécio Fábio dos Santos Departamento de Engenharia Química LOQ/EEL Atenção: Estas notas destinam-se exclusivamente a
LOQ 4083 - Fenômenos de Transporte I FT I 04 Pressão e Estática dos fluidos Prof. Lucrécio Fábio dos Santos Departamento de Engenharia Química LOQ/EEL Atenção: Estas notas destinam-se exclusivamente a
Cinética Química. Camilo Andrea Angelucci Glauber Silva Godoi
 Cinética Química Camilo ndrea ngelucci Glauber Silva Godoi São Cristóvão/SE 21 Cinética Química Elaboração de Conteúdo Camilo ndrea ngelucci Glauber Silva Godoi Projeto Gráfico e Capa Hermeson lves de
Cinética Química Camilo ndrea ngelucci Glauber Silva Godoi São Cristóvão/SE 21 Cinética Química Elaboração de Conteúdo Camilo ndrea ngelucci Glauber Silva Godoi Projeto Gráfico e Capa Hermeson lves de
GASES: DETEMINAÇÃO DA RELAÇÃO DO VOLUME COM A PRESSÃO DE UMA AMOSTRA DE AR À TEMPERATURA CONSTANTE (LEI DE BOYLE)
 GASES: DETEMINAÇÃO DA RELAÇÃO DO VOLUME COM A PRESSÃO DE UMA AMOSTRA DE AR À TEMPERATURA CONSTANTE (LEI DE BOYLE) 1. Introdução 1.1) Lei de Boyle: à temperatura constante, o volume ocupado por uma determinada
GASES: DETEMINAÇÃO DA RELAÇÃO DO VOLUME COM A PRESSÃO DE UMA AMOSTRA DE AR À TEMPERATURA CONSTANTE (LEI DE BOYLE) 1. Introdução 1.1) Lei de Boyle: à temperatura constante, o volume ocupado por uma determinada
ENERGIA INTERNA, CALOR, TEMPERATURA...
 ENERGIA INTERNA, CALOR, TEMPERATURA... ENERGIA INTERNA As moléculas 1 de um corpo estão em constante agitação. Essa agitação pode ser maior ou menor dependendo tanto da temperatura quanto do estado físico
ENERGIA INTERNA, CALOR, TEMPERATURA... ENERGIA INTERNA As moléculas 1 de um corpo estão em constante agitação. Essa agitação pode ser maior ou menor dependendo tanto da temperatura quanto do estado físico
Gás Ideal (1) PMT2305 Físico-Química para Metalurgia e Materiais I César Yuji Narita e Neusa Alonso-Falleiros 2012
 Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Geografia Cultural. Christian Jean-Marie Boudou
 Geografia Cultural Christian Jean-Marie Boudou São Cristóvão/SE 2011 Geografia Cultural Elaboração de Conteúdo Christian Jean-Marie Boudou Projeto Gráfico e Capa Hermeson Alves de Menezes Diagramação Neverton
Geografia Cultural Christian Jean-Marie Boudou São Cristóvão/SE 2011 Geografia Cultural Elaboração de Conteúdo Christian Jean-Marie Boudou Projeto Gráfico e Capa Hermeson Alves de Menezes Diagramação Neverton
Questão 4. Questão 5
 Questão 1 Um mol de gás ideal sofre transformação AëBëC indicada no diafragma pressão x volume da figura a seguir. a) qual é a temperatura do gás no estado A? b) Qual é o trabalho realizado pelo gás na
Questão 1 Um mol de gás ideal sofre transformação AëBëC indicada no diafragma pressão x volume da figura a seguir. a) qual é a temperatura do gás no estado A? b) Qual é o trabalho realizado pelo gás na
Equilíbrio Químico. início x 2x 0 0
 Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
Capítulo 7 Equilíbrio Químico. (ITA) Uma mistura gasosa é colocada a reagir dentro de um cilindro provido de um pistão móvel, sem atrito e sem massa, o qual é mantido à temperatura constante. As reações
Capítulo 11 - Teoria Cinética dos Gases. O número de Avogrado é número de moléculas contido em 1 mol de qualquer substãncia
 Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
Filosofia da História. Marcos André de Barros
 Filosofia da História Marcos André de Barros São Cristóvão/SE 2009 Filosofia da História Elaboração de Conteúdo Marcos André de Barros Projeto Gráfico e Capa Hermeson Alves de Menezes Diagramação Neverton
Filosofia da História Marcos André de Barros São Cristóvão/SE 2009 Filosofia da História Elaboração de Conteúdo Marcos André de Barros Projeto Gráfico e Capa Hermeson Alves de Menezes Diagramação Neverton
Gases. Compostos orgânicos de baixa massa molar são gases a temperatura ambiente. CH 4 (metano gás natural), C 3 H 8
 Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
Gases CAPÍTULO 4 AS PROPRIEDADES DOS GASES / A NATUREZA DOS GASES/ AS LEIS DOS GASES / O MOVIMENTO MOLECULAR / O MODELO CINÉTICO DOS GASES / OS GASES REAIS Introdução Gases Atmosfera 11 elementos são encontrados
17/08/ /08/2011 Prof. Dr. Ricardo A. Mazza 3
 Propriedades de Uma Substância Pura Prof. Dr. Ricardo A. Mazza DE/FEM/UNICAMP 17/08/2011 Prof. Dr. Ricardo A. Mazza 1 Substância Pura Substância pura é a aquela que tem composição química invariável e
Propriedades de Uma Substância Pura Prof. Dr. Ricardo A. Mazza DE/FEM/UNICAMP 17/08/2011 Prof. Dr. Ricardo A. Mazza 1 Substância Pura Substância pura é a aquela que tem composição química invariável e
