Teoria Cinética dos Gases
|
|
|
- Júlio Paiva Antas
- 5 Há anos
- Visualizações:
Transcrição
1 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II Teoria Cinética dos Gases Prof. Bruno Farias
2 Introdução Termodinâmica é o estudo das transformações de energia envolvendo calor e trabalho e como essas transformações podem ser relacionadas com as propriedades da matéria. Um dos tópicos mais importantes da Termodinâmica é a Física dos Gases. Engenharia Mecânica Meteorologia
3 Engenharia Alimentos Engenharia Ambiental
4 Um gás é formado por moléculas (que podem ser formadas por um ou mais átomos) que ocupam totalmente o volume do recipiente em que se encontram e exercem pressão sobre suas paredes. Na descrição macroscópica de um gás investigamos grandezas de grande escala, tais como: pressão, volume, temperatura e massa da substância. Já na descrição microscópica trabalhamos com grandezas em pequena escala, tais como: massa, velocidade, energia cinética e o momento linear das moléculas individuais que compõem a substância.
5 As variáveis volume, pressão e temperatura, são consequências do movimento dos átomos. Volume é resultado da liberdade que os átomos têm para se espalhar por todo recipiente. Pressão é causada por colisões dos átomos com as paredes do recipiente. Temperatura está associada à energia cinética dos átomos. A teoria cinética dos gases, foco deste capítulo, relaciona as descrições macroscópicas e microscópicas para o estudo do comportamento dos gases.
6 Número de Avogadro Quando estamos trabalhando com moléculas usamos o mol como medida da quantidade de uma substância. Um mol é o número de átomos em uma amostra de 12 g de carbono-12. Em um mol de qualquer substância existem o seguinte número de partículas onde mol -1 representa por mol. O número N A é chamado de número de avogadro.
7 O número de mols n contidos em uma amostra de qualquer substância é igual à razão entre o número de moléculas N da amostra e o número de moléculas N A em 1 mol: Também podemos determinar o número de mols n em uma amostra dividindo a massa da amostra M am pela massa molar M (a massa por mol) Onde a massa M de 1 mol é o produto da massa m de uma molécula pelo número de moléculas N A em 1 mol.
8 Gases Ideais Experimentos mostram que para densidades suficientemente baixas, todos os gases obedecem à relação onde p é a pressão absoluta (e não manométrica), n é o número de mols do gás e T é a temperatura em kelvins. O fator R é chamado de constante dos gases ideais, e possui o mesmo valor para todos os gases Em termos da constante de Boltzmann, temos Como R = k N A, então podemos escrever nr = NK e consequentemente temos que
9 Para massa constante (ou número de moles constante) o produto nr de um gás ideal é constante, de modo que pv/t também é constante. Designando pelos índices 1 e 2 dois estados da mesma massa do gás, podemos escrever
10 Exemplo
11 Exemplo
12 Pressão, Temperatura e Velocidade Média Quadrática Vamos determinar a relação entre a pressão p exercida por um gás ideal (com n mols) sobre as paredes de uma caixa cúbica e a velocidades da moléculas do gás. As paredes da caixa são mantidas a uma temperatura T.
13 Por simplicidade, vamos ignorar as colisões das moléculas umas com as outras e considerar apenas as colisões elásticas com as paredes. A figura abaixo mostra uma molécula do gás, de massa m e velocidade v, que colide com a parede sombreada da caixa. Em cada colisão o momento transferido para a parede pela molécula é Δp x = 2mv x.
14 O intervalo de tempo Δt entre colisões é o tempo que a molécula leva para se deslocar até a parede oposta e voltar (percorrendo uma distância 2L), movendo-se com uma velocidade v x. Assim, temos que t 2L v x Portanto, a taxa média com a qual o momento é transferido para a parede, ou seja, a força que a molécula exerce sobre a parede é dada por
15 A força total que age sobre a parede é dada pela soma das contribuições de todas as moléculas que colidem com a parede Dividindo o módulo da força total F x pela área da parede L 2, temos a pressão p a que é submetida a parede onde N é o número de moléculas que existem na caixa.
16 Substituindo a soma por nn A (v x2 ) méd, temos ou ainda, Como há muitas moléculas e elas se movem em direções aleatórias v x2 = 1/3 v 2, assim
17 A raiz quadrada de (v 2 ) méd, é uma espécie de velocidade média, conhecida como velocidade média quadrática das moléculas e representada pelo símbolo v rms. Logo A partir da equação acima podemos calcular v rms
18
19 Exemplo
20 Energia Cinética de Translação Considerando agora uma situação mais realista vamos supor que a velocidade da molécula na caixa varia quando a mesma colide com outras moléculas. Nesse caso, a energia cinética de translação média da molécula é dada por K méd mv méd 3 2 kt.
21 A Distribuição de Velocidades das Moléculas Cada partícula tem uma velocidade diferente, e cada colisão entre partículas altera a velocidade das partículas. Assim, para que se compreenda as propriedades de um gás é necessário compreender a distribuição das velocidades da partículas. A distribuição de velocidades das moléculas de um gás é descrita pela lei de distribuição de velocidades de Maxwell, que é dada por
22 A grandeza P(v) é uma função distribuição de probabilidade: para uma dada velocidade v, o produto P(v) dv é a fração de moléculas cujas velocidades estão no intervalo dv no entorno de v. A distribuição de velocidades das moléculas de um gás mostra de que forma os possíveis valores da velocidade estão distribuídos pelas moléculas.
23 A fração (frac) de moléculas com velocidades no intervalo, digamos, de v 1 a v 2, é Como todas moléculas possuem velocidades que estão no intervalo de zero a infinito, temos que
24 Três medidas da distribuição de velocidades das moléculas de um gás são: a velocidade média A velocidade média quadrática A velocidade mais provável
25 Exemplo
26 Energia Interna E int de um Gás Ideal A energia interna E int de um gás ideal monoatômico é soma das energias cinéticas de translação dos átomos que compõem o gás. Para um gás com n mols temos que E int nn K nrt A méd 3 2 A partir da expressão da acima podemos calcular os calores específicos molares de um gás ideal.
27 Livre Caminho Médio Vamos considerar um modelo mais realista no qual cada molécula é uma esfera de raio r que pode colidir com as outras moléculas do gás. Um parâmetro útil para descrever o movimento aleatório das moléculas de um gás é o livre caminho médio λ das moléculas. O livre caminho médio λ é a distância média percorrida por uma molécula entre duas colisões sucessivas.
28 Consideremos N moléculas esféricas com raio r e volume V. Vamos supor inicialmente que somente uma molécula esteja se movendo com velocidade constante v. Durante um intervalo de tempo dt a molécula se desloca uma distância e colide com qualquer molécula que possua centro no interior de um cilindro de raio 2r e comprimento vdt. O volume do cilindro é 4πr 2 vdt.
29 O número de moléculas no interior do cilindro é dado pelo produto do volume do cilindro vezes o número de moléculas por unidade de volume, assim temos dn 4r 2 vdt N V Esse também é o número de colisões que acontecem no intervalo de tempo dt, ou seja, número de colisões 4r 2 vdt N V
30 O livre caminho médio é o comprimento da trajetória (e do cilindro) dividido por este número de colisões distância percorrida em dt número de colisões em dt 4r 1 N 2 / V r N / V
31 O tempo médio t méd entre duas colisões é dado por t méd v A frequência das colisões f é dada por f 1 t méd
32 Exemplo a) Estime o livre caminho médio λ de moléculas de ar a 27 oc e 1 atm. Considere as moléculas como esferas de raio r = 2 x m. b) Estime o tempo livre médio de uma molécula de ar com velocidade v = 484 m/s. c) Qual é a frequência das colisões?
33 Os Calores Específicos Molares de um Gás Ideal Veremos agora como o calor específico molar de substância pode ser previsto usando a teoria cinética dos gases. Consideremos um gás ideal monoatômico de energia interna E int = 3/2nRT.
34 Calor Específico Molar a Volume Constante Para variar a temperatura de n mols de um gás ideal a pressão p e a uma de temperatura T, confinados em volume V de ΔT é necessária uma transferência de calor de Q nc V T Por outro lado, tal variação de temperatura leva a variação da energia interna do gás de E int 3 2 nrt
35 Comparando as duas expressões anteriores temos que C V 3 R 12, 5 2 J mol K
36
37 Calor Específico Molar a Pressão Constante Vamos supor agora que a temperatura de nosso gás ideal aumenta do mesmo valor ΔT mantendo a pressão do gás constante. Nesse caso a quantidade de calor transferida é dada por Q ncpt Simultaneamente é realizado um trabalho pelo dado por W pv nrt
38 Pela primeira lei da termodinâmica E int Q W Através de manipulações matemáticas simples obtemos que C V C P R E finalmente que C P C V R
A teoria Cinética dos Gases
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II A teoria Cinética dos Gases Prof. Bruno Farias Gases Um gás é formado de átomos (isolados
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA II A teoria Cinética dos Gases Prof. Bruno Farias Gases Um gás é formado de átomos (isolados
Neste modelo o gás é estudado de uma forma microscópica, onde a temperatura, a pressão e a. o resultado do movimento dos átomos e moléculas.
 TEORIA CINÉTICA Neste modelo o gás é estudado de uma forma microscópica, onde a temperatura, a pressão e a energia interna são interpretadas como o resultado do movimento dos átomos e moléculas. Pressão
TEORIA CINÉTICA Neste modelo o gás é estudado de uma forma microscópica, onde a temperatura, a pressão e a energia interna são interpretadas como o resultado do movimento dos átomos e moléculas. Pressão
UFABC - BC Prof. Germán Lugones. AULA 7 Teoria Cinética dos Gases I
 UFABC - BC0205 - Prof. Germán Lugones AULA 7 Teoria Cinética dos Gases I Teoria cinética dos gases o Um gás consiste em partículas (e.g. átomos ou moléculas) que preenchem o volume de seu recipiente e
UFABC - BC0205 - Prof. Germán Lugones AULA 7 Teoria Cinética dos Gases I Teoria cinética dos gases o Um gás consiste em partículas (e.g. átomos ou moléculas) que preenchem o volume de seu recipiente e
19.2 Número de Avogadro mol número de átomos em uma amostra de 12g do carbono-12. Num mol de qualquer substância existem
 Cap. 19 Um gás consiste em átomos que preenchem o volume de seu recipiente. As variáveis volume, pressão e temperatura, são conseqüências do movimento dos átomos. Volume resultado da liberdade dos átomos;
Cap. 19 Um gás consiste em átomos que preenchem o volume de seu recipiente. As variáveis volume, pressão e temperatura, são conseqüências do movimento dos átomos. Volume resultado da liberdade dos átomos;
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
Universidade Federal do Pampa UNIPAMPA Teoria Cinética do Gases Introdução A descrição de um gás por inteiro (descrição macroscópica) pode ser feito estabelecendo as grandezas macroscópicas que caracterizam
AULA 8 Teoria Cinética dos Gases II
 UFABC - BC0205 Prof. Germán Lugones AULA 8 Teoria Cinética dos Gases II James Clerk Maxwell 1831-1879 A Distribuição de Velocidades Moleculares A velocidade média quadrática V rms nos fornece uma ideia
UFABC - BC0205 Prof. Germán Lugones AULA 8 Teoria Cinética dos Gases II James Clerk Maxwell 1831-1879 A Distribuição de Velocidades Moleculares A velocidade média quadrática V rms nos fornece uma ideia
Física Geral II. Aula 1 - Teoria cinética dos gases. D. Valin 1. Universidade do Estado de Mato Grosso. Sinop-MT, April 25, 2017
 Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
Física Geral II Aula 1 - Teoria cinética dos gases D. Valin 1 1 Faculdade de Ciências Exatas - FACET Universidade do Estado de Mato Grosso Sinop-MT, April 25, 2017 D. Valin (Universidade do Estado de Mato
UFABC Fenômenos Térmicos Prof. Germán Lugones. Aula 5: Livre caminho médio, distribuição de Maxwell-Boltzmann
 UFABC Fenômenos Térmicos Prof. Germán Lugones Aula 5: Livre caminho médio, distribuição de Maxwell-Boltzmann Caminho Livre Médio A Figura mostra a trajetória de uma molécula típica quando ela se move através
UFABC Fenômenos Térmicos Prof. Germán Lugones Aula 5: Livre caminho médio, distribuição de Maxwell-Boltzmann Caminho Livre Médio A Figura mostra a trajetória de uma molécula típica quando ela se move através
GASES. https://www.youtube.com/watch?v=wtmmvs3uiv0. David P. White. QUÍMICA: A Ciência Central 9ª Edição Capítulo by Pearson Education
 GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
GASES PV nrt https://www.youtube.com/watch?v=wtmmvs3uiv0 David P. White QUÍMICA: A Ciência Central 9ª Edição volume, pressão e temperatura Um gás consiste em átomos (individualmente ou ligados formando
Física II FEP 112 ( ) 1º Semestre de Instituto de Física - Universidade de São Paulo. Professor: Valdir Guimarães
 Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
Física II FEP 11 (4300110) 1º Semestre de 01 Instituto de Física - Universidade de São Paulo Professor: Valdir Guimarães E-mail: valdir.guimaraes@usp.br Fone: 3091-7104(05) Aula 1 Temperatura e Teoria
As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana.
 Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
Estudo dos gases Gás Ideal As moléculas se encontram em movimento desordenado, regido pelos princípios fundamentais da Mecânica newtoniana. As moléculas não exercem força uma sobre as outras, exceto quando
4. Propriedades dos gases experimentos e modelo microscópico simples para a temperatura
 PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
PV T = nr, onde R é um número (a constante dos gases). Repare que esta é uma lei universal para qualquer gás em pressão e temperatura próxima da atmosférica: não aparece nenhuma dependência de características
BIK0102: ESTRUTURA DA MATÉRIA. Crédito: Sprace GASES. Professor Hugo B. Suffredini Site:
 BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
BIK0102: ESTRUTURA DA MATÉRIA Crédito: Sprace GASES Professor Hugo B. Suffredini hugo.suffredini@ufabc.edu.br Site: www.suffredini.com.br Pressão Atmosférica A pressão é a força atuando em um objeto por
Moléculas em Movimento
 Físico-Química II Profa. Dra. Carla Dalmolin Moléculas em Movimento Modelo Cinético dos Gases Modelo Cinético dos Gases A única contribuição para a energia do gás vem das energias cinéticas das moléculas
Físico-Química II Profa. Dra. Carla Dalmolin Moléculas em Movimento Modelo Cinético dos Gases Modelo Cinético dos Gases A única contribuição para a energia do gás vem das energias cinéticas das moléculas
= 6, mol de moléculas de um gás possui aproximadamente 6, moléculas deste gás, ou seja, seiscentos e dois sextilhões de moléculas;
 TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
TEORIA CINÉTICA DOS GASES PROF. LEANDRO NECKEL NÚMERO DE AVOGADRO Mol é a quantidade de substância de um sistema que contém tantas entidades elementares quanto são os átomos contidos em 0,012 quilograma
FIS-14 Mecânica I. Ronaldo Rodrigues Pela
 FIS-14 Mecânica I Ronaldo Rodrigues Pela Objetivos Visão geral: Termodinâmica e Mecânica Velocidade rms Equipartição da Energia e calor específico Origem microscópica da distribuição de Maxwell-Boltzmann
FIS-14 Mecânica I Ronaldo Rodrigues Pela Objetivos Visão geral: Termodinâmica e Mecânica Velocidade rms Equipartição da Energia e calor específico Origem microscópica da distribuição de Maxwell-Boltzmann
25/Fev/2015 Aula 2. 20/Fev/2015 Aula 1
 /Fe/15 Aula 1 Temperatura e a Lei Zero da Termodinâmica Sistema Termodinâmico Termómetros e Escalas de Temperatura Descrição macroscópica dos gases ideais Equação dos gases ideais 5/Fe/15 Aula Teoria Cinética
/Fe/15 Aula 1 Temperatura e a Lei Zero da Termodinâmica Sistema Termodinâmico Termómetros e Escalas de Temperatura Descrição macroscópica dos gases ideais Equação dos gases ideais 5/Fe/15 Aula Teoria Cinética
As bases da Dinâmica Molecular - 8
 As bases da Dinâmica Molecular - 8 Alexandre Diehl Departamento de Física - UFPel Hipóteses fundamentais da teoria cinética Qualquer porção pequena do gás contém um número N enorme de moléculas. Número
As bases da Dinâmica Molecular - 8 Alexandre Diehl Departamento de Física - UFPel Hipóteses fundamentais da teoria cinética Qualquer porção pequena do gás contém um número N enorme de moléculas. Número
Resolução das questões objetivas* da 1ª e da 2ª Prova de Física II Unificada do Período UFRJ
 Resolução das questões objetivas* da ª e da ª Prova de Física II Unificada do Período 0.-UFRJ *Assuntos: Termodinâmica, Hidrodinâmica e Hidrostática. Resolução: João Batista F. Sousa Filho (Graduando Engenharia
Resolução das questões objetivas* da ª e da ª Prova de Física II Unificada do Período 0.-UFRJ *Assuntos: Termodinâmica, Hidrodinâmica e Hidrostática. Resolução: João Batista F. Sousa Filho (Graduando Engenharia
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia. Aula Interlúdio molecular
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula Interlúdio molecular Energia Interna somatório de energias (cinética + potencial) Energia cinética relacionada
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula Interlúdio molecular Energia Interna somatório de energias (cinética + potencial) Energia cinética relacionada
Universidade Estadual do Sudoeste da Bahia
 Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais 4 Termodinâmica Física II Ferreira 1 ÍNDICE 1. Conceitos Fundamentais; 2. Sistemas Termodinâmicos; 3. Leis da
Universidade Estadual do Sudoeste da Bahia Departamento de Estudos Básicos e Instrumentais 4 Termodinâmica Física II Ferreira 1 ÍNDICE 1. Conceitos Fundamentais; 2. Sistemas Termodinâmicos; 3. Leis da
Capítulo 21 Temperatura
 Capítulo 21 Temperatura 21.1 Temperatura e equilíbrio térmico Mecânica: lida com partículas. Variáveis microscópicas: posição, velocidade, etc. Termodinâmica: lida com sistemas de muitas partículas. Variáveis
Capítulo 21 Temperatura 21.1 Temperatura e equilíbrio térmico Mecânica: lida com partículas. Variáveis microscópicas: posição, velocidade, etc. Termodinâmica: lida com sistemas de muitas partículas. Variáveis
Física II Teoria Cinética dos Gases
 Física II Teoria Cinética dos Gases João Francisco Fuzile Rodrigues Garcia -- 8549323 Maiara Fernanda Moreno -- 8549344 Otávio Massola Sumi -- 8549452 Ex. 18.63 Explique, em termos do movimento molecular,
Física II Teoria Cinética dos Gases João Francisco Fuzile Rodrigues Garcia -- 8549323 Maiara Fernanda Moreno -- 8549344 Otávio Massola Sumi -- 8549452 Ex. 18.63 Explique, em termos do movimento molecular,
Capítulo 11 - Teoria Cinética dos Gases. O número de Avogrado é número de moléculas contido em 1 mol de qualquer substãncia
 Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
Capítulo 11 - Teoria Cinética dos Gases Em 1811, o italiano Amedeo Avogrado enunciou 2 hipóteses: 1) As moléculas de um gás podem ser compostas por mais de um único átomo. 2) Nas mesmas condições de temperatura
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Journal Club Teoria do funcional da densidade A energia do estado fundamental é um funcional
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Journal Club Teoria do funcional da densidade A energia do estado fundamental é um funcional
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Mecânica Mecânica: estuda o estado de movimento (ou repouso) de corpos sujeitos à ação
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Mecânica Mecânica: estuda o estado de movimento (ou repouso) de corpos sujeitos à ação
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS. Prof. MSc. Danilo Cândido
 FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
FÍSICO-QUÍMICA GASES IDEAIS E GASES REAIS Prof. MSc. Danilo Cândido CONCEITOS DE GASES Um gás representa a forma mais simples da matéria, de baixa densidade e que ocupa o volume total de qualquer recipiente
Calor Específico Molar, Transformações Adiabáticas e Expansão Livre
 Calor Específico Molar, Transformações Adiabáticas e Expansão Livre Revisando Deduzimos que a temperatura determina a energia cinética média (via a velocidade média). O modelo de gás ideal não considera
Calor Específico Molar, Transformações Adiabáticas e Expansão Livre Revisando Deduzimos que a temperatura determina a energia cinética média (via a velocidade média). O modelo de gás ideal não considera
CENTRO DE MASSA E MOMENTO LINEAR
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I CENTRO DE MASSA E MOMENTO LINEAR Prof. Bruno Farias Introdução Neste módulo vamos discutir
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I CENTRO DE MASSA E MOMENTO LINEAR Prof. Bruno Farias Introdução Neste módulo vamos discutir
03/Mar/2017 Aula 3. 01/Mar/2017 Aula 2
 01/Mar/2017 Aula 2 Teoria Cinética dos Gases Teoria Cinética e Equação dos Gases Ideais Gás Ideal num Campo Gravitacional Distribuição de Boltzmann; distribuição de velocidades de Maxwell e Boltzmann Velocidades
01/Mar/2017 Aula 2 Teoria Cinética dos Gases Teoria Cinética e Equação dos Gases Ideais Gás Ideal num Campo Gravitacional Distribuição de Boltzmann; distribuição de velocidades de Maxwell e Boltzmann Velocidades
Luis Eduardo C. Aleotti. Química. Aula 38 - Transformações Gasosas
 Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
Luis Eduardo C. Aleotti Química Aula 38 - Transformações Gasosas TRANSFORMAÇÕES GASOSAS Gás e Vapor - Gás: Substância gasosa em temperatura ambiente. - Vapor: Estado gasoso de uma substância líquida ou
2/Mar/2016 Aula 4. 26/Fev/2016 Aula 3
 6/Fev/016 Aula 3 Calor e Primeira Lei da Termodinâmica Calor e energia térmica Capacidade calorífica e calor específico Calor latente Diagrama de fases para a água Primeira Lei da Termodinâmica Trabalho
6/Fev/016 Aula 3 Calor e Primeira Lei da Termodinâmica Calor e energia térmica Capacidade calorífica e calor específico Calor latente Diagrama de fases para a água Primeira Lei da Termodinâmica Trabalho
Halliday Fundamentos de Física Volume 2
 Halliday Fundamentos de Física Volume 2 www.grupogen.com.br http://gen-io.grupogen.com.br O GEN Grupo Editorial Nacional reúne as editoras Guanabara Koogan, Santos, Roca, AC Farmacêutica, LTC, Forense,
Halliday Fundamentos de Física Volume 2 www.grupogen.com.br http://gen-io.grupogen.com.br O GEN Grupo Editorial Nacional reúne as editoras Guanabara Koogan, Santos, Roca, AC Farmacêutica, LTC, Forense,
INTRODUÇÃO À ASTROFÍSICA
 Introdução à Astrofísica INTRODUÇÃO À ASTROFÍSICA LIÇÃO 21 O EQUILÍBRIO HIDROSTÁTICO Lição 20 O Equilíbrio Hidrostático As estrelas se formam a partir de regiões densas e frias, chamadas de nebulosas.
Introdução à Astrofísica INTRODUÇÃO À ASTROFÍSICA LIÇÃO 21 O EQUILÍBRIO HIDROSTÁTICO Lição 20 O Equilíbrio Hidrostático As estrelas se formam a partir de regiões densas e frias, chamadas de nebulosas.
Um mol é o número de átomos em uma amostra de 12 g de carbono 12.
 NOTA DE AULA 07 UNIVERSIDADE CATÓLICA DE GOIÁS DEPARTAMENTO DE MATEMÁTICA E FÍSICA Disciplina: FÍSICA GERAL E EXPERIMENTAL II (MAF 0) Coordenação: Prof. Dr. Elias Calixto Carrijo CAPÍTULO 0 A TEORIA CINÉTICA
NOTA DE AULA 07 UNIVERSIDADE CATÓLICA DE GOIÁS DEPARTAMENTO DE MATEMÁTICA E FÍSICA Disciplina: FÍSICA GERAL E EXPERIMENTAL II (MAF 0) Coordenação: Prof. Dr. Elias Calixto Carrijo CAPÍTULO 0 A TEORIA CINÉTICA
a = 2, Física Questão 53 - Alternativa D Devido ao tempo de reação, o carro percorre uma distância , antes de
 Física 53. No instante t =, o motorista de um carro que percorre uma estrada retilínea, com velocidade constante de m/s, avista um obstáculo m a sua frente. O motorista tem um tempo de reação t = s, após
Física 53. No instante t =, o motorista de um carro que percorre uma estrada retilínea, com velocidade constante de m/s, avista um obstáculo m a sua frente. O motorista tem um tempo de reação t = s, após
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Journal Club Teoria do funcional da densidade A energia do estado fundamental é um funcional
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Journal Club Teoria do funcional da densidade A energia do estado fundamental é um funcional
Físico-Química I. Profa. Dra. Carla Dalmolin. Gases. Gás perfeito (equações de estado e lei dos gases) Gases reais
 Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Físico-Química I Profa. Dra. Carla Dalmolin Gases Gás perfeito (equações de estado e lei dos gases) Gases reais Gás Estado mais simples da matéria Uma forma da matéria que ocupa o volume total de qualquer
Interpretação Molecular da Temperatura de um Gás Ideal
 Interpretação Molecular da Temperatura de um Gás Ideal Já vimos que a pressão está relacionada com a energia cinética média das moléculas. Agora relacionaremos a temperatura à uma descrição microscópica
Interpretação Molecular da Temperatura de um Gás Ideal Já vimos que a pressão está relacionada com a energia cinética média das moléculas. Agora relacionaremos a temperatura à uma descrição microscópica
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Avenida Lourival Alfredo, 176, Poeira, Marechal Deodoro, Alagoas, Brasil,
 1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
1 ESTUDO DOS GASES 1 INTRODUÇÃO Vários processos que ocorrem na natureza e nos organismos vivos são fenômenos pertinentes aos gases, como, por exemplo: o metabolismo nos animais exige a presença de oxigênio,
6/Mar/2013 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
6/Mar/01 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
Física Geral. Trabalho, Energia e Momentum Linear.
 Física Geral Trabalho, Energia e Momentum Linear. l Energia e Momentum Há muitas formas de energia como por exemplo, energia nuclear, energia elétrica, energia sonora, energia luminosa. Quando você levanta
Física Geral Trabalho, Energia e Momentum Linear. l Energia e Momentum Há muitas formas de energia como por exemplo, energia nuclear, energia elétrica, energia sonora, energia luminosa. Quando você levanta
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
A Teoria Cinética dos Gases
 CAPÍTULO 19 A Teoria Cinética dos Gases 19-1 O NÚMERO DE AVOGADRO Objetivos do Aprendizado Depois de ler este módulo, você será capaz de... 19.01 Conhecer o número de Avogadro N A. 19.02 Conhecer a relação
CAPÍTULO 19 A Teoria Cinética dos Gases 19-1 O NÚMERO DE AVOGADRO Objetivos do Aprendizado Depois de ler este módulo, você será capaz de... 19.01 Conhecer o número de Avogadro N A. 19.02 Conhecer a relação
UFABC Fenômenos Térmicos Prof. Germán Lugones. Aula 7: Capacidades caloríficas de gases ideais, processos adiabáticos, equipartição da energia.
 UFABC Fenômenos Térmicos Prof. Germán Lugones Aula 7: Capacidades caloríficas de gases ideais, processos adiabáticos, equipartição da energia. Energia interna de um gás ideal Energia interna: Do ponto
UFABC Fenômenos Térmicos Prof. Germán Lugones Aula 7: Capacidades caloríficas de gases ideais, processos adiabáticos, equipartição da energia. Energia interna de um gás ideal Energia interna: Do ponto
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 217 Gás = conjunto de moléculas ou átomos
Termodinâmica II - FMT 259
 Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2009 Lista 3 GABARITO (revisado em 22/04/0). Se as moléculas contidas em,0 g de água fossem distribuídas uniformemente sobre a superfície
Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2009 Lista 3 GABARITO (revisado em 22/04/0). Se as moléculas contidas em,0 g de água fossem distribuídas uniformemente sobre a superfície
Descrição Macroscópica de um Gás ideal
 Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
Descrição Macroscópica de um Gás ideal O gás não tem volume fixo ou uma pressão fixa O volume do gás é o volume do recipiente A pressão do gás depende do tamanho do recipiente A equação de estado relaciona
Propriedades de uma substância pura
 Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Propriedades de uma substância pura Substância pura possui composição química invariável e homogênea, independentemente da fase em que está. Ex.: água Equilíbrio de fases em uma substância pura, as fases
Teoria Cinética dos Gases. Lucy V. C. Assali. Física II IO
 Teoria Cinética dos Gases Física II 2016 - IO Teoria Atômica da Matéria 1. Hipótese atômica na antiguidade: ideia de elementos primordiais que comporiam a matéria matéria constituída de minúsculas partículas,
Teoria Cinética dos Gases Física II 2016 - IO Teoria Atômica da Matéria 1. Hipótese atômica na antiguidade: ideia de elementos primordiais que comporiam a matéria matéria constituída de minúsculas partículas,
Teoria Cinética dos gases
 Estrutura da Matéria Unidade II: A matéria fragmentada Aula 5: Origem estatística e corpuscular da termodinâmica http://professor.ufabc.edu.br/~pieter.westera/estrutura.html Teoria Cinética dos gases Bernoulli
Estrutura da Matéria Unidade II: A matéria fragmentada Aula 5: Origem estatística e corpuscular da termodinâmica http://professor.ufabc.edu.br/~pieter.westera/estrutura.html Teoria Cinética dos gases Bernoulli
Física Experimental III. Compressão isotérmica de um gás ideal
 Física Experimental III Compressão isotérmica de um gás ideal Lei dos Gases Ideias Definimos um gás ideal como um gás para o qual a razão PV/nT é constante em todas as pressões. Portanto, essas variáveis
Física Experimental III Compressão isotérmica de um gás ideal Lei dos Gases Ideias Definimos um gás ideal como um gás para o qual a razão PV/nT é constante em todas as pressões. Portanto, essas variáveis
Física II-P1 INTRODUÇÃO 1 ENTROPIA
 Física II-P1 INTRODUÇÃO Fala, galera!! Fizemos aqui um resumão com o que mais tem caído nas P1s de Física II, abordando os temas de entropia, reversibilidade, cinética dos gases e distribuição de Maxwell.
Física II-P1 INTRODUÇÃO Fala, galera!! Fizemos aqui um resumão com o que mais tem caído nas P1s de Física II, abordando os temas de entropia, reversibilidade, cinética dos gases e distribuição de Maxwell.
11/Mar/2016 Aula 7 Entropia Variação da entropia em processos reversíveis Entropia e os gases ideais
 11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
11/Mar/016 Aula 7 Entropia ariação da entropia em processos reversíveis Entropia e os gases ideais Entropia no ciclo de Carnot e em qualquer ciclo reversível ariação da entropia em processos irreversíveis
Lista de Exercícios 9 Teoria cinética dos gases, Primeira e Segunda leis da Termodinâmica
 Lista de Exercícios 9 Teoria cinética dos gases, Primeira e Segunda leis da Termodinâmica Exercícios Sugeridos (14 de novembro de 2008) A numeração corresponde ao Livro Texto. 16.19 Um balão de ar quente
Lista de Exercícios 9 Teoria cinética dos gases, Primeira e Segunda leis da Termodinâmica Exercícios Sugeridos (14 de novembro de 2008) A numeração corresponde ao Livro Texto. 16.19 Um balão de ar quente
Notas de aula - Profa. Zélia Aulas 07,08,09 e 10. Capítulo 3 Relações formais e sistemas amostrais (exemplares)
 Notas de aula - Profa. Zélia Aulas 07,08,09 e 10 Livro texto: Thermodynamics and an Introduction to Thermostatistics (2nd edition) H. B. Callen. Capítulo 3 Relações formais e sistemas amostrais (exemplares)
Notas de aula - Profa. Zélia Aulas 07,08,09 e 10 Livro texto: Thermodynamics and an Introduction to Thermostatistics (2nd edition) H. B. Callen. Capítulo 3 Relações formais e sistemas amostrais (exemplares)
Primeira Lista de Exercícios de Biofísica II. c n
 Primeira Lista de Exercícios de Biofísica II 1. Considere uma célula composta por um corpo celular ao qual está preso um longo e fino processo tubular (por exemplo, o axônio de um neurônio ou o flagelo
Primeira Lista de Exercícios de Biofísica II 1. Considere uma célula composta por um corpo celular ao qual está preso um longo e fino processo tubular (por exemplo, o axônio de um neurônio ou o flagelo
Estudo Físico-Químico dos Gases
 19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
19/08/009 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer
Aula 20 TEORIA CINÉTICA DOS GASES. Frederico Guilherme de Carvalho Cunha. META Introduzir os conceitos relativos à Teoria Cinética dos Gases.
 Aula 20 TEORIA CINÉTICA DOS GASES META Introduzir os conceitos relativos à Teoria Cinética dos Gases. OBJETIVOS Ao final desta aula, o aluno deverá idescrever o modelo molecular do gás ideal; enunciar
Aula 20 TEORIA CINÉTICA DOS GASES META Introduzir os conceitos relativos à Teoria Cinética dos Gases. OBJETIVOS Ao final desta aula, o aluno deverá idescrever o modelo molecular do gás ideal; enunciar
COMPORTAMENTO DOS GASES
 BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
BC0102: ESTRUTURA DA MATÉRIA COMPORTAMENTO DOS GASES hueder.paulo@ufabc.edu.br Hueder Paulo Moisés de Oliveira 1 Calendário Semana Aulas expositivas 1 07/06 Introdução ao curso (Informações sobre provas,
Gases ideais. Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Gases ideais Professora: Melissa Soares Caetano Disciplina QUI 317 Gás = conjunto de moléculas ou átomos
Aula do Curso Noic de Física, feito pela parceria do Noic com o Além do Horizonte. Esta aula tratará de gases e termodinâmica:
 Esta aula tratará de gases e termodinâmica: Estudando a matéria, os cientistas definiram o mol. Um mol corresponde a 6,02. 10 " unidades de algo, número conhecido por N A, número de Avogadro. A importância
Esta aula tratará de gases e termodinâmica: Estudando a matéria, os cientistas definiram o mol. Um mol corresponde a 6,02. 10 " unidades de algo, número conhecido por N A, número de Avogadro. A importância
Formalismo microcanônico ( ensemble microcanônico) Formalismo canônico ( ensemble canônico)
 Formalismo microcanônico ( ensemble microcanônico) sist(j) estado j f j = Ω j Ω Formalismo canônico ( ensemble canônico) reservatório de temperatura tot res sistema f j = Ω res+sist(j) Ω tot sist(j) Física
Formalismo microcanônico ( ensemble microcanônico) sist(j) estado j f j = Ω j Ω Formalismo canônico ( ensemble canônico) reservatório de temperatura tot res sistema f j = Ω res+sist(j) Ω tot sist(j) Física
Física do Calor. Processos Termodinâmicos Quase Estáticos
 4300159 Física do Calor Processos Termodinâmicos Quase Estáticos Gás Ideal Monoatômico Energia Interna: U(T )= 3 2 Nk BT = 3 2 nrt Calor específico molar a volume constante (C V ): dq = du ) nc V dt =
4300159 Física do Calor Processos Termodinâmicos Quase Estáticos Gás Ideal Monoatômico Energia Interna: U(T )= 3 2 Nk BT = 3 2 nrt Calor específico molar a volume constante (C V ): dq = du ) nc V dt =
Elementos de Termodinâmica
 TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir uma escala de temperaturas
TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir uma escala de temperaturas
Gases. Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, slides : il.
 Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Gases Reis, Oswaldo Henrique Barolli. R375g Gases / Oswaldo Henrique Barolli. Varginha, 2015. 21 slides : il. Sistema requerido: Adobe Acrobat Reader Modo de Acesso: World Wide Web 1. Dinâmica dos gases.
Termodinâmica. Prof.: POMPEU
 1. DEFINIÇÃO A estuda a relação entre calor e trabalho que um sistema (por exemplo, um gás) troca com o meio exterior. 2. ENERGIA INTERNA (U) É a soma das várias formas de energia das moléculas que constituem
1. DEFINIÇÃO A estuda a relação entre calor e trabalho que um sistema (por exemplo, um gás) troca com o meio exterior. 2. ENERGIA INTERNA (U) É a soma das várias formas de energia das moléculas que constituem
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2
 FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2 [texto baseado nas seções 3.5, 3.6 e 3.9 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] As energias livres de Helmholtz
FUNÇÕES DE ESTADO TERMODINÂMICAS: ENTALPIA E ENERGIA LIVRE Parte 2 [texto baseado nas seções 3.5, 3.6 e 3.9 de Physical Chemistry, P. Atkins e J. de Paula, Freeman 2006] As energias livres de Helmholtz
2 bt2 20 o C. O calor trocado pelo sistema é, fazendo a = 5,4 cal/g.k, b = 0,0024 cal/g.k 2, c = 0, cal.k/g, dt, T 2. = 230,2kcal.
 FÍSICA BÁSICA II - LISTA 3 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância
FÍSICA BÁSICA II - LISTA 3 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância
FÍSICA TÉRMICA. Prof. Neemias Alves de Lima Instituto de Pesquisa em Ciência dos Materiais Universidade Federal do Vale do São Francisco 1
 FÍSICA TÉRMICA Prof. Neemias Alves de Lima Instituto de Pesquisa em Ciência dos Materiais Universidade Federal do Vale do São Francisco 1 Domínio da Física Térmica Como pode água aprisionada ser ejetada
FÍSICA TÉRMICA Prof. Neemias Alves de Lima Instituto de Pesquisa em Ciência dos Materiais Universidade Federal do Vale do São Francisco 1 Domínio da Física Térmica Como pode água aprisionada ser ejetada
Capítulo 22 Propriedades Moleculares dos Gases (Teoria Cinética dos Gases)
 Capítulo Propriedades Moleculares dos Gases (Teoria Cinética dos Gases). A natureza atômica da matéria If, in some cataclysm, all of scientific knowledge were to be destroyed, and only one sentence passed
Capítulo Propriedades Moleculares dos Gases (Teoria Cinética dos Gases). A natureza atômica da matéria If, in some cataclysm, all of scientific knowledge were to be destroyed, and only one sentence passed
MOVIMENTO RETILÍNEO. Prof. Bruno Farias
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I MOVIMENTO RETILÍNEO Prof. Bruno Farias Introdução Por que estudar mecânica? Porque o mundo,
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I MOVIMENTO RETILÍNEO Prof. Bruno Farias Introdução Por que estudar mecânica? Porque o mundo,
Física 3. Cap 18: Conexão Micro-Macro (Teoria Cinética dos gases)
 Física 3 Cap 18: Conexão Micro-Macro (Teoria Cinética dos gases) Conexão Micro-Macro Teoria Cinética dos Gases Objetivo: Analisar como a agitação microscópica de moléculas e átomos invisíveis a olho nu
Física 3 Cap 18: Conexão Micro-Macro (Teoria Cinética dos gases) Conexão Micro-Macro Teoria Cinética dos Gases Objetivo: Analisar como a agitação microscópica de moléculas e átomos invisíveis a olho nu
UFABC - BC Prof. Germán Lugones. AULA 9 Teoria Cinética dos Gases III
 UFABC - BC0205 - Prof. Germán Lugones AULA 9 Teoria Cinética dos Gases III Graus de liberdade e Calores Específicos Molares A previsão de que c v = 3/2 R concorda com o experimento para gases monoatômicos,
UFABC - BC0205 - Prof. Germán Lugones AULA 9 Teoria Cinética dos Gases III Graus de liberdade e Calores Específicos Molares A previsão de que c v = 3/2 R concorda com o experimento para gases monoatômicos,
Termodinâmica Olímpica. João C. Carvalho 2018
 Termodinâmica Olímpica João C. Carvalho 2018 Albert Einstein (1949): Uma teoria tem tanto mais impacto quanto maior for a simplicidade das suas premissas, quanto mais diversas forem as coisas relacionadas
Termodinâmica Olímpica João C. Carvalho 2018 Albert Einstein (1949): Uma teoria tem tanto mais impacto quanto maior for a simplicidade das suas premissas, quanto mais diversas forem as coisas relacionadas
2 bt2 20 o C. O calor trocado pelo sistema é, fazendo a = 5,4 cal/g.k, b = 0,0024 cal/g.k 2, c = 0, cal.k/g, dt, T 2. = 230,2kcal.
 FÍSICA - LISTA 4 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância se a temperatura
FÍSICA - LISTA 4 Termodinâmica 1. Uma substância possui calor específico dado por c = a+bt, em cal/g., com a = 0,1 cal/g., b = 0,005 cal/g. 2. Calcule o calor trocado por 100 g dessa substância se a temperatura
Instituto de Física USP. Física Moderna I. Aula 03. Professora: Mazé Bechara
 Instituto de Física USP Física Moderna I Aula 03 Professora: Mazé Bechara Aula 03 AVISOS. Na página da disciplina há uma programação aula a aula até a ª prova em de abril.. Alguns dos alunos matriculados
Instituto de Física USP Física Moderna I Aula 03 Professora: Mazé Bechara Aula 03 AVISOS. Na página da disciplina há uma programação aula a aula até a ª prova em de abril.. Alguns dos alunos matriculados
ELEMENTOS DE TERMODINÂMICA
 ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
INTRODUÇÃO À ASTROFÍSICA LIÇÃO 19 A DISTRIBUIÇÃO DE MAXWELL-BOLZTMANN
 Introdução à Astrofísica Lição 18 A Distribuição de Maxwell INTRODUÇÃO À ASTROFÍSICA LIÇÃO 19 A DISTRIBUIÇÃO DE MAXWELL-BOLZTMANN Um estado de um gás é especificado por suas coordenadas, de modo que representemos
Introdução à Astrofísica Lição 18 A Distribuição de Maxwell INTRODUÇÃO À ASTROFÍSICA LIÇÃO 19 A DISTRIBUIÇÃO DE MAXWELL-BOLZTMANN Um estado de um gás é especificado por suas coordenadas, de modo que representemos
18 1ª LEI DA TERMODINÂMICA
 FÍSICA Professor Ricardo Fagundes MÓDULO 18 1ª LEI DA TERMODINÂMICA 1ª LEI DA TERMODINÂMICA Energia interna (U): a energia interna de um gás é a soma das energias cinéticas das partículas que o compõe
FÍSICA Professor Ricardo Fagundes MÓDULO 18 1ª LEI DA TERMODINÂMICA 1ª LEI DA TERMODINÂMICA Energia interna (U): a energia interna de um gás é a soma das energias cinéticas das partículas que o compõe
Transporte Iônico e o Potencial de Membrana
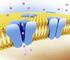 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
ENERGIA CINÉTICA E TRABALHO
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ENERGIA CINÉTICA E TRABALHO Prof. Bruno Farias Introdução Neste módulo concentraremos nossa
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ENERGIA CINÉTICA E TRABALHO Prof. Bruno Farias Introdução Neste módulo concentraremos nossa
Lei de Gauss. O produto escalar entre dois vetores a e b, escrito como a. b, é definido como
 Lei de Gauss REVISÃO DE PRODUTO ESCALAR Antes de iniciarmos o estudo do nosso próximo assunto (lei de Gauss), consideramos importante uma revisão sobre o produto escalar entre dois vetores. O produto escalar
Lei de Gauss REVISÃO DE PRODUTO ESCALAR Antes de iniciarmos o estudo do nosso próximo assunto (lei de Gauss), consideramos importante uma revisão sobre o produto escalar entre dois vetores. O produto escalar
Balanço de Energia. Conceitos Básicos
 Balanço de Energia Conceitos Básicos Sistema: arte de equipamento ou porção de material, escolhida arbitrariamente, onde a observação dos fenômenos é feita. Um sistema é delimitado por fronteiras. Um sistema
Balanço de Energia Conceitos Básicos Sistema: arte de equipamento ou porção de material, escolhida arbitrariamente, onde a observação dos fenômenos é feita. Um sistema é delimitado por fronteiras. Um sistema
Estado Gasoso. Características. Expansibilidade compressibilidade. Situação de um gás. Variáveis de estado
 Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Estado Gasoso Características Forma/volume variáveis Expansibilidade compressibilidade Situação de um gás Difusibilidade Variáveis de estado Volume emperatura Pressão Mudança de estado de uma certa massa
Fenômenos de Transporte Departamento de Engenharia Mecânica Angela Ourivio Nieckele
 Fenômenos de Transporte 2014-1 Departamento de Engenharia Mecânica Angela Ourivio Nieckele sala 163- L ramal 1182 e-mail: nieckele@puc-rio.br Site: http://mecflu2.usuarios.rdc.puc-rio.br/fentran_eng1011.htm
Fenômenos de Transporte 2014-1 Departamento de Engenharia Mecânica Angela Ourivio Nieckele sala 163- L ramal 1182 e-mail: nieckele@puc-rio.br Site: http://mecflu2.usuarios.rdc.puc-rio.br/fentran_eng1011.htm
ESTUDO DO COMPORTAMENTO DE UM GÁS POR DINÂMICA MOLECULAR.
 ESTUDO DO COMPORTAMENTO DE UM GÁS POR DINÂMICA MOLECULAR. João Paulo Smykaluk (ICV-UNICENTRO), Eduardo Vicentini (Orientador), e-mail: evicentini@unicentro.br. Universidade Estadual do Centro-Oeste, Setor
ESTUDO DO COMPORTAMENTO DE UM GÁS POR DINÂMICA MOLECULAR. João Paulo Smykaluk (ICV-UNICENTRO), Eduardo Vicentini (Orientador), e-mail: evicentini@unicentro.br. Universidade Estadual do Centro-Oeste, Setor
O modelo cinético molecular para gases e a difusão: o passeio aleatório
 O modelo cinético molecular para gases e a difusão: o passeio aleatório O modelo mecânico para a pressão que consideramos ignora as interações entre moléculas, uma molécula não vê a outra há choques apenas
O modelo cinético molecular para gases e a difusão: o passeio aleatório O modelo mecânico para a pressão que consideramos ignora as interações entre moléculas, uma molécula não vê a outra há choques apenas
Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal
 Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal Ano Letivo 2017/2018 Física e Química A 10º ano Teste de Avaliação 4 20/03/2018 Duração: 90 minutos Página 1 de 8 Teste 4A Tabela
Agrupamento de Escolas de Alcácer do Sal Escola Secundária de Alcácer do Sal Ano Letivo 2017/2018 Física e Química A 10º ano Teste de Avaliação 4 20/03/2018 Duração: 90 minutos Página 1 de 8 Teste 4A Tabela
Data e horário da realização: 19/05/2016 das 14 às 17 horas
 re UNIVERSIDADE DO ESTADO DO RIO GRANDE DO NORTE DEPARTAMENTO DE FÍSICA PROGRAMA DE PÓS-GRADUAÇÃO EM FÍSICA Exame de Seleção para o curso de mestrado em Física - 2016-1/2 Data e horário da realização:
re UNIVERSIDADE DO ESTADO DO RIO GRANDE DO NORTE DEPARTAMENTO DE FÍSICA PROGRAMA DE PÓS-GRADUAÇÃO EM FÍSICA Exame de Seleção para o curso de mestrado em Física - 2016-1/2 Data e horário da realização:
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO. Prof.
 CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO Prof. Bruno Farias Introdução Neste capítulo vamos aprender: Como descrever a rotação
CENTRO DE CIÊNCIAS E TECNOLOGIA AGROALIMENTAR UNIDADE ACADÊMICA DE TECNOLOGIA DE ALIMENTOS DISCIPLINA: FÍSICA I ROTAÇÃO Prof. Bruno Farias Introdução Neste capítulo vamos aprender: Como descrever a rotação
TEORIA CINÉTICA E TERMODINÂMICA
 UNIVERSIDADE FEDERAL DE SANTA MARIA DEPARTAMENTO DE FÍSICA GRUPO DE ENSINO DE FÍSICA TEORIA CINÉTICA E TERMODINÂMICA Joecir Palandi Dartanhan Baldez Figueiredo João Carlos Denardin Paulo Roberto Magnago
UNIVERSIDADE FEDERAL DE SANTA MARIA DEPARTAMENTO DE FÍSICA GRUPO DE ENSINO DE FÍSICA TEORIA CINÉTICA E TERMODINÂMICA Joecir Palandi Dartanhan Baldez Figueiredo João Carlos Denardin Paulo Roberto Magnago
Instituto de Física USP. Física Moderna I. Aula 4. Professora: Mazé Bechara
 Instituto de Física USP Física Moderna I Aula 4 Professora: Mazé Bechara Aula 04 Modelos de estrutura da matéria e a mecânica estatística clássica 1. Uma teoria para a dinâmica de um sistema de muitas
Instituto de Física USP Física Moderna I Aula 4 Professora: Mazé Bechara Aula 04 Modelos de estrutura da matéria e a mecânica estatística clássica 1. Uma teoria para a dinâmica de um sistema de muitas
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do ampa UNIAMA Teoria inética do Gases 7.alores específicos molares de um gás ideal A quantidade de gás ideal é medida pelo número de moles n, em vez da massa m O gás é submetido
Universidade Federal do ampa UNIAMA Teoria inética do Gases 7.alores específicos molares de um gás ideal A quantidade de gás ideal é medida pelo número de moles n, em vez da massa m O gás é submetido
O Espaço: contínuo ou discreto? João Penedones
 O Espaço: contínuo ou discreto? João Penedones CERN Master Class Universidade do Porto, 15 de Março de 2014 O Espaço: plasticina ou Legos? Matéria contínua Matéria discreta Espaço discreto Espaço contínuo
O Espaço: contínuo ou discreto? João Penedones CERN Master Class Universidade do Porto, 15 de Março de 2014 O Espaço: plasticina ou Legos? Matéria contínua Matéria discreta Espaço discreto Espaço contínuo
LISTA DE EXERCÍCIOS 3º ANO
 Condições iniciais do gás: v0 vp0 pè0 è Condições finais do gás: vf 0,v p f? èf è Letra E p0 v0 pf vf p v pf 0, v p f 2 èo èf è è p0 a) Como foi informado que o processo ocorre em temperatura constante,
Condições iniciais do gás: v0 vp0 pè0 è Condições finais do gás: vf 0,v p f? èf è Letra E p0 v0 pf vf p v pf 0, v p f 2 èo èf è è p0 a) Como foi informado que o processo ocorre em temperatura constante,
Física - 1. Dados numéricos
 Física - 1 Dados numéricos celeração da gravidade: 1 m/s Densidade da água: 1, g/cm 3 Velocidade da luz no vácuo: 3, x 1 8 m/s 1 atm = 1, x 1 5 N/m = 1 4 π o = 9, x 1 9 N.m C 1. O gráfico da velocidade
Física - 1 Dados numéricos celeração da gravidade: 1 m/s Densidade da água: 1, g/cm 3 Velocidade da luz no vácuo: 3, x 1 8 m/s 1 atm = 1, x 1 5 N/m = 1 4 π o = 9, x 1 9 N.m C 1. O gráfico da velocidade
