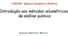
REAGENTES H 2 C N CH 2 CH 2 N CH 2
|
|
|
- Luiz Gustavo Beretta Amaro
- 7 Há anos
- Visualizações:
Transcrição
1 PRÁTICA 2 DETERMINAÇÃ DE CÁLCI EM LEITE Metodologia de análise: Volumetria de Complexação MATERIAIS Bureta de 25 ml Béquer 100 e 250 ml Erlenmeyer de 250 ml Proveta de 50 ml Balão volumétrico 100 ml Pipetas volumétricas de 10, 15 e 20 ml Agitador Barra magnética REAGENTES Amostras de leite EDTA 0,0200 mol/l Tampão de amônio (ph=10) Indicador ErioT 0,5% (m/v) em etanol CaC 3 p.a. NaH 1mol/L HCl 6 mol/l MgCl 2.6H 2 INTRDUÇÃ A complexometria é um método analítico volumétrico que compreende a titulação de íons metálicos com agentes complexantes ou quelantes. agente complexante mais utilizado é o EDTA. ácido etilenodiaminotetracético (EDTA) forma complexos estáveis de estequiometria 1:1 com um grande número de íons metálicos em solução aquosa. EDTA pode ser obtido com alta pureza, na forma do ácido propriamente dito ou na forma do sal dissódico diidratado. As duas formas possuem alto massa molecular, mas o sal dissódico tem a vantagem de ser mais solúvel em água. Um composto orgânico que tenha dois ou mais grupos capazes de complexar (formar ligantes) com um íon metálico é chamado de agente quelante e o complexo formado é chamado de quelato. A titulação com um agente quelante é chamada de titulação complexométrica. A estrutura química do EDTA é apresentada na Figura 1. HC HC H 2 C H 2 C N N CH CH Figura 1. Estrutura química do EDTA. Um par de elétrons disponível capaz de complexar com o íon metálico, está presente em cada um dos dois nitrogênios e em cada um dos quatro grupos carboxílicos (é um ácido tetraprótico). Assim, existem seis grupos complexantes no EDTA. Este agente complexante pode ser representado pelo símbolo H 4 Y. ligante não protonado Y 4 é o que forma complexos com os íons metálicos. A Figura 2 ilustra a estrutura do complexo de cálcio EDTA. ponto de viragem das titulações complexométricas é determinado com indicadores metalocrômicos. s indicadores mais comumente usados são: negro de eriocromo T, alaranjado de xilenol, calcon, calmagita, murexida, violeta de pirocatecol e outros. s indicadores metalocrômicos são corantes orgânicos coloridos que formam quelatos com os íons metálicos. quelato tem uma cor diferente daquela do indicador livre. Para que este processo ocorra na prática, é necessário que a estabilidade do
2 complexo metal indicador seja menor que a do complexo EDTA. Se isto não acontecer, o EDTA não conseguirá deslocar o metal do complexo com o indicador. Me Ind + EDTA Me EDTA + Ind (cor A) (cor B) indicador negro de eriocromo T não pode ser empregado na titulação direta do cálcio com EDTA porque a formação do complexo cálcio indicador provoca uma mudança de cor pouco definida no ponto final da titulação. Para evitar este problema, costuma-se adicionar uma pequena quantidade de Mg 2+ à solução contendo Ca 2+. complexo Ca EDTA é mais estável do que o complexo Mg EDTA e, portanto, é titulado primeiro. Neste caso, deve-se fazer uma correção para compensar a quantidade de EDTA usada para a complexação do Mg 2+ adicionado. Uma técnica melhor consiste em adicionar o Mg 2+ à solução de EDTA e não à solução de cálcio como descrito anteriormente. Estes íons Mg 2+ reagem rapidamente com o EDTA formando o complexo Mg EDTA, causando uma redução na concentração molar do EDTA, de tal modo que esta solução deve ser padronizada após a adição do Mg 2+. Esta padronização pode ser feita por meio de uma titulação com CaC 3 dissolvido em ácido clorídrico, ajustando-se o ph, adicionando o indicador a solução e titulando com EDTA. Nesta segunda alternativa não há necessidade de se efetuar nenhuma correção para a quantidade de Mg 2+ adicionado, pois este já é considerado na padronização do EDTA. Ca N C C N C C Figura 2. Estrutura do complexo cálcio EDTA. PRCEDIMENT 1. Tampão de amônio ph = 10. Calcular e pesar a massa de NH 4 Cl (MM=53,49 g/mol) e o volume de NH 3 concentrado necessário para preparar 100 ml de uma solução tampão de amônio ph=10 na concentração 0,1 mol/l. Este tampão é melhor armazenar em frasco de polietileno para evitar a passagem de íons metálicos do vidro para a solução. 2. Solução de Ério T. 0,5% (m /v) de negro de eriocromo T em etanol. A solução de indicador deve ser preparada recentemente, pois é instável.
3 3. Solução de EDTA 0,02 mol/l. Calcular e pesar uma massa do sal Na 2 H 2 Y.2H 2 (MM=372,24 g/mol) necessária para preparar 100 ml de uma solução 0,02 mol/l. Dissolver com água destilada contendo 0,005g de MgCl 2.6H 2, agitar até a dissolução total do sal e completar o volume num balão volumétrico de 100 ml. Esta solução deve ser armazenada em frasco de polietileno. 4. Padronização da solução de EDTA 0,02 mol/l. Pesar 180 mg de CaC 3 p.a. previamente dessecado e dissolver num béquer utilizando a mínima quantidade de solução de HCl 1:1. Evaporar até quase a secura, redissolver em água destilada e transferir para um balão volumétrico de 100 ml. Pipetar uma alíquota de 20 ml desta solução, acrescentar 10 ml de tampão de amônio, 6 a 8 gotas de negro de eriocromo T e titular com a solução de EDTA. 5. Análise de Leite Pré-titulação da amostra. Pipetar 1,0 ml da amostra, acrescentar 25 ml de água destilada, 2 ml de tampão amônio, 3 a 4 gotas de Erio T e titular com a solução de EDTA padrão. Determinar a concentração aproximada de cálcio no leite. Calcular o volume de amostra que deve ser pipetado para consumir cerca de 15 ml de solução de EDTA padrão Análise da amostra. Pipetar o volume da amostra calculado no item 5.1., acrescentar 10 ml de tampão de amônio, 6 a 8 gotas de negro de eriocromo T e titular com a solução de EDTA.
4 Relatório: prática n o Introdução 2. bjetivo(s) 3. Procedimento experimental 4. Resultados e discussão 4.1. Padronização da solução de EDTA Massa (mg) de CaC 3 utilizada Volumes gastos (ml) de solução de EDTA (Tabela1) Tabela 1. Resultados da padronização da solução de EDTA EDTA Equipes V (ml) M (mol/l) Aplicar teste Q 90% para as molaridades encontradas (Tabela1) Concentração molar média da solução de EDTA ± s 4.2. Análise da amostra de Leite Tabela 2. Volumes de EDTA gastos na titulação de amostras de leite. EDTA (ml) Equipes Amostra I Amostra II
5 Pré-titulação Volume (ml) de amostra analisada Volumes gastos de solução de EDTA (Tabela 2) Aplicar o teste Q 90% para os volumes encontrados Volume médio ± s Massa média (mg) de cálcio por 100 ml de leite ± s. 5. Conclusões 6. Bibliografia
PRÁTICA 04 - DETERMINAÇÃO DA DUREZA TOTAL E TEOR DE CÁLCIO E MAGNÉSIO EM ÁGUA
 PRÁTICA 04 - DETERMINAÇÃO DA DUREZA TOTAL E TEOR DE CÁLCIO E MAGNÉSIO EM ÁGUA Aula 14 METAS Familiarizar com as técnicas de preparo e padronização de solução de edta; determinar a dureza total e o teor
PRÁTICA 04 - DETERMINAÇÃO DA DUREZA TOTAL E TEOR DE CÁLCIO E MAGNÉSIO EM ÁGUA Aula 14 METAS Familiarizar com as técnicas de preparo e padronização de solução de edta; determinar a dureza total e o teor
QUI095 - Análises Volumétricas
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUI095 - Análises Volumétricas Titulação por Complexação Prof. Renato Camargo Matos Download aulas:
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUI095 - Análises Volumétricas Titulação por Complexação Prof. Renato Camargo Matos Download aulas:
Universidade Federal de Sergipe Departamento de Química Química Analítica Experimental Prof. Marcelo da Rosa Alexandre Alunos:
 Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
Alunos: DETERMINAÇÃO DA ACIDEZ TOTAL EM BEBIDAS 1. Padronizar a solução de NaOH 0,1 mol.l -1 com biftalato de potássio (P.M. KHC8H4O4 = 204). Lembre-se de calcular a massa de biftalato de potássio para
Titulação de cálcio e magnésio no leite com EDTA. Ilustrar: Titulação por retorno Titulação complexométrica, com EDTA
 TRABALHO PRÁTICO Titulação de cálcio e magnésio no leite com Ilustrar: Titulação por retorno Titulação complexométrica, com PARTE EXPERIMENTAL Procedimento para determinação do teor de cálcio mais magnésio
TRABALHO PRÁTICO Titulação de cálcio e magnésio no leite com Ilustrar: Titulação por retorno Titulação complexométrica, com PARTE EXPERIMENTAL Procedimento para determinação do teor de cálcio mais magnésio
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) Determinando cada espécie em solução com EDTA Calcule a concentração, mol.l -1, de Y 4- em uma solução 0,02 mol.l -1
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) Determinando cada espécie em solução com EDTA Calcule a concentração, mol.l -1, de Y 4- em uma solução 0,02 mol.l -1
Aula EQUILÍBRIO E TITULAÇÃO DE COMPLEXAÇÃO
 EQUILÍBRIO E TITULAÇÃO DE COMPLEXAÇÃO Aula 8 METAS Apresentar os princípios da titulação de complexação; apresentar uma típica titulação de complexação; calcular a curva de titulação; apresentar indicadores
EQUILÍBRIO E TITULAÇÃO DE COMPLEXAÇÃO Aula 8 METAS Apresentar os princípios da titulação de complexação; apresentar uma típica titulação de complexação; calcular a curva de titulação; apresentar indicadores
Prof a. Dr a. Luciana M. Saran
 HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 ANÁLISE TITRIMÉTRICA O QUE
HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 ANÁLISE TITRIMÉTRICA O QUE
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell
 LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
TITULAÇÃO POR COMPLEXAÇÃO
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química I semestre 2018 TITULAÇÃO POR COMPLEXAÇÃO Profa. Maria Auxiliadora
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química I semestre 2018 TITULAÇÃO POR COMPLEXAÇÃO Profa. Maria Auxiliadora
Preparação e padronização de soluções
 INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
INSTITUTO POLITÉCNICO DE TOMAR ESCOLA SUPERIOR DE TECNOLOGIA Departamento de Engenharia Química e do Ambiente QUÍMICA I (1º Ano 1º Semestre) Trabalho Prático nº 2 Preparação e padronização de soluções
UÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA
 UÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA Q TITULAÇÃO DE COMPLEXAÇÃO Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br QUÍMICA ANALÍTICA QUÍMICA ANALÍTICA
UÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA Q TITULAÇÃO DE COMPLEXAÇÃO Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br QUÍMICA ANALÍTICA QUÍMICA ANALÍTICA
VOLUMETRIA DE COMPLEXAÇÃO
 VOLUMETRIA DE COMPLEXAÇÃO I-Introdução A volumetria com formação de complexos, ou complexometria, baseia-se em reações que envolvem um íon metálico M e um ligante L com formação de um complexo suficientemente
VOLUMETRIA DE COMPLEXAÇÃO I-Introdução A volumetria com formação de complexos, ou complexometria, baseia-se em reações que envolvem um íon metálico M e um ligante L com formação de um complexo suficientemente
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica
 PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do aluno:
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do aluno:
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica
 PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do
PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO
 PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO Aula 15 METAS Familiarizar com as técnicas de preparo e padronização de solução de tiossulfato de
PRÁTICA 05 - DETERMINAÇÃO DE CLORO ATIVO EM ÁGUA SANITÁRIA E DETERMINAÇÃO IODOMÉTRICA DE ÁCIDO ASCÓRBICO Aula 15 METAS Familiarizar com as técnicas de preparo e padronização de solução de tiossulfato de
MÓDULO 2 2ª aula. Equilíbrio e Titulações de complexação Introdução ao Preparo de Amostras
 QUÍMICA ANALÍTICA AVANÇADA 1S 2017 MÓDULO 2 2ª aula Equilíbrio e Titulações de complexação Introdução ao Preparo de Amostras Prof. Rafael Arromba de Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br
QUÍMICA ANALÍTICA AVANÇADA 1S 2017 MÓDULO 2 2ª aula Equilíbrio e Titulações de complexação Introdução ao Preparo de Amostras Prof. Rafael Arromba de Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br
INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES. META Determinar a concentração de ácido clorídrico por titulometria de neutralização.
 Aula INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES META Determinar a concentração de ácido clorídrico por titulometria de neutralização. OBJETIVOS Ao final desta aula o aluno deverá: detectar o ponto
Aula INTRODUÇÃO À TITULOMETRIA PADRONIZAÇÃO DE SOLUÇÕES META Determinar a concentração de ácido clorídrico por titulometria de neutralização. OBJETIVOS Ao final desta aula o aluno deverá: detectar o ponto
LCE0182 Química Analítica Quantitativa. Volumetria. Wanessa Melchert Mattos
 LCE0182 Química Analítica Quantitativa Volumetria Wanessa Melchert Mattos Volumetria Titulante: Solução estável e de concentração conhecida de um reagente que é adicionado sobre a solução da amostra que
LCE0182 Química Analítica Quantitativa Volumetria Wanessa Melchert Mattos Volumetria Titulante: Solução estável e de concentração conhecida de um reagente que é adicionado sobre a solução da amostra que
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO FATOR DA SOLUÇÃO DE AZUL DE METILENO POR TITULAÇÃO COM SOLUÇÃO DE CLORETO TITANOSO (TiCl 3 )
 Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Introdução aos métodos volumétricos de análise química
 LCE0108 Química Inorgânica e Analítica Introdução aos métodos volumétricos de análise química Wanessa Melchert Mattos Titulometria: inclui um grupo de métodos analíticos baseados na determinação da quantidade
LCE0108 Química Inorgânica e Analítica Introdução aos métodos volumétricos de análise química Wanessa Melchert Mattos Titulometria: inclui um grupo de métodos analíticos baseados na determinação da quantidade
1 Titulação Complexométrica com EDTA (Volumetria de Complexação com EDTA)
 1 Titulação Complexométrica com EDTA (Volumetria de Complexação com EDTA) Considere a titulação de 25,0 ml de solução 10-2 M de Ca 2+ com uma solução de EDTA 10-2 em ph = 12 Dados: K f = 5,0 x 10 10 ;
1 Titulação Complexométrica com EDTA (Volumetria de Complexação com EDTA) Considere a titulação de 25,0 ml de solução 10-2 M de Ca 2+ com uma solução de EDTA 10-2 em ph = 12 Dados: K f = 5,0 x 10 10 ;
A análise de muitos cátions metálicos, incluindo o cátion cálcio,
 DETERMINAÇÃ DE CÁLCI N LEITE 1. INTRDUÇÃ A análise de muitos cátions metálicos, incluindo o cátion cálcio, Ca, pode ser feita através da formação de complexos estáveis e solúveis em água. Um agente complexante
DETERMINAÇÃ DE CÁLCI N LEITE 1. INTRDUÇÃ A análise de muitos cátions metálicos, incluindo o cátion cálcio, Ca, pode ser feita através da formação de complexos estáveis e solúveis em água. Um agente complexante
MÉTODO DE ANÁLISE LL-WM 80 L NOVO PROCESSO PARA ANODIZAÇÃO DO ALUMÍNIO. Procedimento para a padronização da solução de Sulfato Cérico 0,1N
 Reagentes Necessários Solução de Ácido Sulfúrico 50% Solução de Sulfato Cérico 0,1 N Solução de Ácido Oxálico 0,1 N Solução de Sulfato Ferroso de Amônia (F.A.S.), 0,1 N Solução Ferroin como indicador Modo
Reagentes Necessários Solução de Ácido Sulfúrico 50% Solução de Sulfato Cérico 0,1 N Solução de Ácido Oxálico 0,1 N Solução de Sulfato Ferroso de Amônia (F.A.S.), 0,1 N Solução Ferroin como indicador Modo
MÉTODO DE ANÁLISE. MÉTODO VOLHARD Pág.: 1/6
 MÉTODO VOLHARD Pág.: 1/6 1.0. OBJETIVO Determinar teor de cloreto em Óxido de Zinco e Terra de Zinco.. 2.0. ABRANGÊNCIA Laboratório de Controle de Qualidade. 3.0 DEFINIÇÕES Branco: É o volume gasto de
MÉTODO VOLHARD Pág.: 1/6 1.0. OBJETIVO Determinar teor de cloreto em Óxido de Zinco e Terra de Zinco.. 2.0. ABRANGÊNCIA Laboratório de Controle de Qualidade. 3.0 DEFINIÇÕES Branco: É o volume gasto de
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
12/01/2014. Equilíbrio e volumetria de complexação VOLUMETRIA DE COMPLEXAÇÃO. Reações. M n+ + L y- ML n-y. Composto de Coordenação
 Reações Equilíbrio e volumetria de complexação Profa itória Soares TIPOS Classificação das reações químicas em titulometria volumétrica Reações de neutralização: entre ácidos e bases Ex:NaOHeHCl Reações
Reações Equilíbrio e volumetria de complexação Profa itória Soares TIPOS Classificação das reações químicas em titulometria volumétrica Reações de neutralização: entre ácidos e bases Ex:NaOHeHCl Reações
VOLUMETRIA DE NEUTRALIZAÇÃO.
 13 Técnica 1. VOLUMETRIA DE NEUTRALIZAÇÃO. PADRONIZAÇÃO DA SOLUÇÃO APROXIMADAMENTE 0,1 M DE HCl COM SOLUÇÃO PADRÃO 0,05 M DE Na 2 CO 3. Colocar no erlenmeyer exatamente 10 ml de solução padrão 0,05 M de
13 Técnica 1. VOLUMETRIA DE NEUTRALIZAÇÃO. PADRONIZAÇÃO DA SOLUÇÃO APROXIMADAMENTE 0,1 M DE HCl COM SOLUÇÃO PADRÃO 0,05 M DE Na 2 CO 3. Colocar no erlenmeyer exatamente 10 ml de solução padrão 0,05 M de
Metodologia Analítica
 Metodologia Analítica Espectrofotometria UV-vis Prof. Renato Camargo Matos http://www.ufjf.br/nupis Prática Otimização de um Método Espectrofotométrico para Quantificação de Ferro Objetivo Estudar as propriedades
Metodologia Analítica Espectrofotometria UV-vis Prof. Renato Camargo Matos http://www.ufjf.br/nupis Prática Otimização de um Método Espectrofotométrico para Quantificação de Ferro Objetivo Estudar as propriedades
TITULAÇÕES de COMPLEXAÇÃO ou TITULAÇÕES COMPLEXOMÉTRICAS ou COMPLEXOMETRIA
 TITULAÇÕES de COMPLEXAÇÃO ou TITULAÇÕES COMPLEXOMÉTRICAS ou COMPLEXOMETRIA Adição de EDTA ROXO Próximo do P.V. COMPLEXO [MeInd] COMPLEXO [MeEDTA] + Ind indicador livre: azul 1 Material não calcinado (in-natura)
TITULAÇÕES de COMPLEXAÇÃO ou TITULAÇÕES COMPLEXOMÉTRICAS ou COMPLEXOMETRIA Adição de EDTA ROXO Próximo do P.V. COMPLEXO [MeInd] COMPLEXO [MeEDTA] + Ind indicador livre: azul 1 Material não calcinado (in-natura)
TÍTULO: ANÁLISE TITRIMÉTRICA (Volumétrica)
 Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
Volumetria. Procedimentos gerais
 Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
Equilíbrio de complexação e titulações de complexação Aula 2
 Universidade Federal do Paraná (UFPR) Programa de Pós-Graduação em Química Departamento de Química Equilíbrio de complexação e titulações de complexação Aula 2 Prof. Luiz Humberto Marcolino Junior 1 Titulações
Universidade Federal do Paraná (UFPR) Programa de Pós-Graduação em Química Departamento de Química Equilíbrio de complexação e titulações de complexação Aula 2 Prof. Luiz Humberto Marcolino Junior 1 Titulações
Padronizar uma solução aquosa de hidróxido de sódio 0,1mol/L para posteriormente determinar a acidez de amostras.
 Pág. 1 de 6 I - OBJETIVOS Padronizar uma solução de ácido clorídrico 0,1mol/L para posterior determinação de pureza de amostras alcalinas. Padronizar uma solução aquosa de hidróxido de sódio 0,1mol/L para
Pág. 1 de 6 I - OBJETIVOS Padronizar uma solução de ácido clorídrico 0,1mol/L para posterior determinação de pureza de amostras alcalinas. Padronizar uma solução aquosa de hidróxido de sódio 0,1mol/L para
QUI 153 Química Analítica IV. Volumetria de Complexação Parte I
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 15 Química Analítica IV Volumetria de Complexação Parte I Lilian Silva Juiz de Fora, 016 Titulações Complexométricas
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 15 Química Analítica IV Volumetria de Complexação Parte I Lilian Silva Juiz de Fora, 016 Titulações Complexométricas
EXPERIÊNCIA 7 TITULAÇÃO
 CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 7 TITULAÇÃO 1. INTRODUÇÃO Na ciência
CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 7 TITULAÇÃO 1. INTRODUÇÃO Na ciência
UNIVERSIDADE FEDERAL DE OURO PRETO INSTITUTO DE CIÊNCIAS EXATAS E BIOLÓGICAS DEPARTAMENTO DE QUÍMICA
 UNIVERSIDADE FEDERAL DE OURO PRETO INSTITUTO DE CIÊNCIAS EXATAS E BIOLÓGICAS DEPARTAMENTO DE QUÍMICA Nota: Valor Total = 3,00 1ª AVALIAÇÃO DE QUI-232 (QUÍMICA ANALÍTICA EXPERIMENTAL) t. 43 e 45 28 e 30/06/17
UNIVERSIDADE FEDERAL DE OURO PRETO INSTITUTO DE CIÊNCIAS EXATAS E BIOLÓGICAS DEPARTAMENTO DE QUÍMICA Nota: Valor Total = 3,00 1ª AVALIAÇÃO DE QUI-232 (QUÍMICA ANALÍTICA EXPERIMENTAL) t. 43 e 45 28 e 30/06/17
1. PREPARO DE SOLUÇÕES E TITULAÇÃO
 1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
Introdução à Análise Química QUI semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE COMPLEXAÇÃO
 Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE COMPLEXAÇÃO 1 TITULAÇÕES POR COMPLEXAÇÃO Titulometria de complexação ou titulações por complexação
Introdução à Análise Química QUI 094 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE COMPLEXAÇÃO 1 TITULAÇÕES POR COMPLEXAÇÃO Titulometria de complexação ou titulações por complexação
Calcule o ph de uma solução de HCl 1x10-7 mol L-1
 Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
PRODUTO DE SOLUBILIDADE
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química PRODUTO DE SOLUBILIDADE Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química PRODUTO DE SOLUBILIDADE Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
PRÁTICA: EQUILÍBRIO QUÍMICO EM SOLUÇÕES. CH3COOCH2CH3 + H2O CH3COOH + CH3CH2OH (1) Acetato de etila água ácido acético etanol
 PRÁTICA: EQUILÍBRIO QUÍMICO EM SOLUÇÕES 1. Introdução Uma investigação experimental detalhada mostra que a maioria das reações químicas não avança até a realização completa, isto é, quantidades mensuráveis
PRÁTICA: EQUILÍBRIO QUÍMICO EM SOLUÇÕES 1. Introdução Uma investigação experimental detalhada mostra que a maioria das reações químicas não avança até a realização completa, isto é, quantidades mensuráveis
NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE
 NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE O que se pretende Determinar a concentração desconhecida de uma solução aquosa de um ácido forte por titulação com uma base forte através de dois métodos. Num dos
NEUTRALIZAÇÃO: UMA REACÇÃO DE ÁCIDO BASE O que se pretende Determinar a concentração desconhecida de uma solução aquosa de um ácido forte por titulação com uma base forte através de dois métodos. Num dos
AULA PRÁTICA Nº / Fevereiro / 2016 Profª Solange Brazaca DETERMINAÇÃO DE VITAMINA C
 AULA PRÁTICA Nº - 01 25 / Fevereiro / 2016 Profª Solange Brazaca DETERMINAÇÃO DE VITAMINA C FUNDAMENTO: O teor de ácido Ascórbico pode ser determinado pelo método de Tillmans que é um método titulométrico.
AULA PRÁTICA Nº - 01 25 / Fevereiro / 2016 Profª Solange Brazaca DETERMINAÇÃO DE VITAMINA C FUNDAMENTO: O teor de ácido Ascórbico pode ser determinado pelo método de Tillmans que é um método titulométrico.
Experiência nº 8: Titulações Ácido-Base
 Experiência nº 8: Titulações Ácido-Base 1. Questões de estudo - Como determinar com precisão a concentração de uma solução (ácida ou básica)? Explique detalhadamente. - Como determinar experimentalmente
Experiência nº 8: Titulações Ácido-Base 1. Questões de estudo - Como determinar com precisão a concentração de uma solução (ácida ou básica)? Explique detalhadamente. - Como determinar experimentalmente
Introdução aos métodos titulométricos volumétricos. Prof a Alessandra Smaniotto QMC Química Analítica - Farmácia Turmas 02102A e 02102B
 Introdução aos métodos titulométricos volumétricos Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Definições ² Métodos titulométricos: procedimentos quantitativos
Introdução aos métodos titulométricos volumétricos Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Definições ² Métodos titulométricos: procedimentos quantitativos
QUÍMICA ANALÍTICA LISTA DE EXERCÍCIOS SOBRE GRAVIMETRIA, VOLUMETRIA DE NEUTRALIZAÇÃO, VOLUMETRIA DE COMPLEXAÇÃO, OXIDAÇÃO- REDUÇÃO E PRECIPITAÇÃO
 LISTA DE EXERCÍCIOS SOBRE GRAVIMETRIA, VOLUMETRIA DE NEUTRALIZAÇÃO, VOLUMETRIA DE COMPLEXAÇÃO, OXIDAÇÃO- REDUÇÃO E PRECIPITAÇÃO 1. Dentre as vária vantagens da análise gravimétrica em relação a análise
LISTA DE EXERCÍCIOS SOBRE GRAVIMETRIA, VOLUMETRIA DE NEUTRALIZAÇÃO, VOLUMETRIA DE COMPLEXAÇÃO, OXIDAÇÃO- REDUÇÃO E PRECIPITAÇÃO 1. Dentre as vária vantagens da análise gravimétrica em relação a análise
PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES
 PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES 1- INTRODUÇÃO Análise volumétrica refere-se a todo procedimento no qual o volume de um reagente necessário para reagir com um constituinte em análise é medido. - Em
PRÁTICA 07: PADRONIZAÇÃO DE SOLUÇÕES 1- INTRODUÇÃO Análise volumétrica refere-se a todo procedimento no qual o volume de um reagente necessário para reagir com um constituinte em análise é medido. - Em
Química Analítica Avançada. Volumetria de Complexação Parte 2
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química Química Analítica Avançada Volumetria de Complexação Parte 2 Lilian Silva Juiz de Fora, 2011 Curvas de titulação
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química Química Analítica Avançada Volumetria de Complexação Parte 2 Lilian Silva Juiz de Fora, 2011 Curvas de titulação
RESINA FENÓLICA PARA FUNDIÇÃO - DETERMINAÇÃO DO TEOR DE FENOL LIVRE
 SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
SUMÁRIO Método de Ensaio Folha : 1 de 5 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Resultados 7_ Anexo A 1_ OBJETIVO 1.1_ Esta recomendação prescreve
5ª mini avaliação para ser entregue manuscrita na aula do dia 03/02/17 até às 12:00h.
 5ª mini avaliação para ser entregue manuscrita na aula do dia 03/02/17 até às 12:00h. 1. O conteúdo de ferro de um minério pode ser determinado por gravimetria pesando o minério, atacando a amostra com
5ª mini avaliação para ser entregue manuscrita na aula do dia 03/02/17 até às 12:00h. 1. O conteúdo de ferro de um minério pode ser determinado por gravimetria pesando o minério, atacando a amostra com
Qui. Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa
 Semana 19 Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa EXERCÍCIOS DE AULA 1. Para determinar a pureza de uma amostra de ácido sulfúrico (H2SO 4), uma analista dissolveu 14,0 g do ácido
Semana 19 Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa EXERCÍCIOS DE AULA 1. Para determinar a pureza de uma amostra de ácido sulfúrico (H2SO 4), uma analista dissolveu 14,0 g do ácido
DEPARTAMENTO DE QUÍMICA UFJF QUI102 Metodologia Analítica
 DEPARTAMENTO DE QUÍMICA UFJF QUI102 Metodologia Analítica OTIMIZAÇÃO DE UM MÉTODO ESPECTROFOTOMÉTRICO PARA QUANTIFICAÇÃO DE FERRO Data do experimento: Grupo: Objetivo: Estudar as propriedades colorimétricas
DEPARTAMENTO DE QUÍMICA UFJF QUI102 Metodologia Analítica OTIMIZAÇÃO DE UM MÉTODO ESPECTROFOTOMÉTRICO PARA QUANTIFICAÇÃO DE FERRO Data do experimento: Grupo: Objetivo: Estudar as propriedades colorimétricas
Ministério da Educação Universidade Federal do Paraná Setor Palotina. Soluções e cálculos de soluções
 Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA
 Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta
 3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
3 AULA PRÁTICA N 15: DETERMINAÇÃO DE PERÓXIDO DE HIDROGÊNIO NA ÁGUA OXIGENADA Volumetria de oxirredução permanganimetria volumetria direta REAGENTES: Solução de permanganato de potássio 0,02 mol L -1,
MÉTODOS ENVOLVENDO O IODO, I 2 TITULAÇÃO IODOMÉTRICA. O par redox iodo/iodeto pode ser caracterizado pela semi- reação,
 MÉTODOS ENVOLVENDO O IODO, I 2 TITULAÇÃO IODOMÉTRICA As aplicações do iodo como reagente redox são bastante extensas, principalmente porque: (1) o potencial padrão de redução do par I 2 /I - é intermediário,
MÉTODOS ENVOLVENDO O IODO, I 2 TITULAÇÃO IODOMÉTRICA As aplicações do iodo como reagente redox são bastante extensas, principalmente porque: (1) o potencial padrão de redução do par I 2 /I - é intermediário,
VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO
 VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO A volumetria de precipitação envolve a reação na qual forma-se um produto de baixa solubilidade. Sua principal aplicação
VOLUMETRIA DE PRECIPITAÇÃO: DETERMINAÇÃO DE CLORETO DE SÓDIO EM SORO FISIOLÓGICO A volumetria de precipitação envolve a reação na qual forma-se um produto de baixa solubilidade. Sua principal aplicação
Relatório: Volumétrica
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico De Química E Biologia Bacharelado em Química Tecnológica Licenciatura Química Relatório: Preparação, Padronização e Análise Volumétrica
Universidade Tecnológica Federal do Paraná Departamento Acadêmico De Química E Biologia Bacharelado em Química Tecnológica Licenciatura Química Relatório: Preparação, Padronização e Análise Volumétrica
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em , Prof. Mauricio
 Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
Questões dos exercícios avaliativos para QUI232 t. 43, 44 e 45 em 2017-1, Prof. Mauricio Questões dos exercícios avaliativos para QUI232 t. 43 a 45 em 2017-1, Prof. Mauricio GABARITO Prof. Mauricio 1º)
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO ÓXIDO DE FERRO
 Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
Folha : 1 de 5 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Definição 4_ Aparelhagem / reagentes 5_ Execução do ensaio 6_ Padronização da solução de dicromato de potássio 0,05 N 7_ Resultados 1_ OBJETIVO
Análise dos teores totais de CaO e MgO em rochas calcárias da região do Campo das Vertentes, em Minas Gerais
 Análise dos teores totais de CaO e MgO em rochas calcárias da região do Campo das Vertentes, em Minas Gerais Introdução Giulia Mara Silva e Souza 1, Leandra de Oliveira Cruz da Silva 1 1 Instituto Federal
Análise dos teores totais de CaO e MgO em rochas calcárias da região do Campo das Vertentes, em Minas Gerais Introdução Giulia Mara Silva e Souza 1, Leandra de Oliveira Cruz da Silva 1 1 Instituto Federal
QUI201 QUÍMICA ANALÍTICA B (Farmácia) Prof. Mauricio X. Coutrim
 QUI201 QUÍMICA ANALÍTICA B (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) INDICADORES PARA TITULAÇÃO DE COMPLEXAÇÃO São corantes orgânicos (ácidos fracos) = metalocrômicos: formam quelatos
QUI201 QUÍMICA ANALÍTICA B (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) INDICADORES PARA TITULAÇÃO DE COMPLEXAÇÃO São corantes orgânicos (ácidos fracos) = metalocrômicos: formam quelatos
PRÁTICA 02 - DETERMINAÇÃO DA ACIDEZ EM VINAGRE E ÁCIDO FOSFÓRICO EM REAGENTE COMERCIAL
 PRÁTICA 02 - DETERMINAÇÃO DA ACIDEZ EM VINAGRE E ÁCIDO FOSFÓRICO EM REAGENTE COMERCIAL METAS Determinar a porcentagem de acidez total volátil em vinagre; determinar a concentração de ácido fosfórico em
PRÁTICA 02 - DETERMINAÇÃO DA ACIDEZ EM VINAGRE E ÁCIDO FOSFÓRICO EM REAGENTE COMERCIAL METAS Determinar a porcentagem de acidez total volátil em vinagre; determinar a concentração de ácido fosfórico em
PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES
 PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES METAS Apresentar o objetivo da parte prática da disciplina; apresentar as instruções de trabalho
PRÁTICA 01 - INTRODUÇÃO AO TRABALHO NO LABORATÓRIO DE QUÍMICA ANALÍTICA E PREPARO E PADRONIZAÇÃO DE SOLUÇÕES METAS Apresentar o objetivo da parte prática da disciplina; apresentar as instruções de trabalho
Experiência nº 8: Titulações Ácido-Base
 1 UFSC Departamento de Química Área de Educação Química QMC 5119 Introdução ao Laboratório de Química 2011/1 Prof. Marcos Aires de Brito Prof. Fábio Peres Gonçalves Prof. José Carlos Gesser 1. Questões
1 UFSC Departamento de Química Área de Educação Química QMC 5119 Introdução ao Laboratório de Química 2011/1 Prof. Marcos Aires de Brito Prof. Fábio Peres Gonçalves Prof. José Carlos Gesser 1. Questões
Volumetria de Neutralização
 Volumetria de Neutralização Titulação Ácido-base Determinação da concentração de uma solução a partir da quantidade e concentração de uma solução conhecida Alíquota de volume conhecido (20 ml) e concentração
Volumetria de Neutralização Titulação Ácido-base Determinação da concentração de uma solução a partir da quantidade e concentração de uma solução conhecida Alíquota de volume conhecido (20 ml) e concentração
MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações
 MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações sobre a composição de uma amostra. Método: é a aplicação
MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações sobre a composição de uma amostra. Método: é a aplicação
DETERMINAÇÃO DA DUREZA TOTAL (Dureza de Cálcio e Magnésio)
 DETERMINAÇÃO DA DUREZA TOTAL (Dureza de Cálcio e Magnésio) Por Rui de Oliveira / Carlos Fernandes (*) 1. INTRODUÇÃO Águas duras são aquelas que exigem consideráveis quantidades de sabão para produzir espuma
DETERMINAÇÃO DA DUREZA TOTAL (Dureza de Cálcio e Magnésio) Por Rui de Oliveira / Carlos Fernandes (*) 1. INTRODUÇÃO Águas duras são aquelas que exigem consideráveis quantidades de sabão para produzir espuma
PREPARAÇÃO, DILUIÇÃO E PADRONIZAÇÃO DE SOLUÇÕES
 Porto, 21 de Março, 2014 Mestrado Integrado em Engenharia do Ambiente Laboratórios de Ciências do Ambiente I Módulo Química PREPARAÇÃO, DILUIÇÃO E PADRONIZAÇÃO DE SOLUÇÕES Relatório Turma 1 - Grupo 4 Docente:
Porto, 21 de Março, 2014 Mestrado Integrado em Engenharia do Ambiente Laboratórios de Ciências do Ambiente I Módulo Química PREPARAÇÃO, DILUIÇÃO E PADRONIZAÇÃO DE SOLUÇÕES Relatório Turma 1 - Grupo 4 Docente:
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
Exercícios Complementares - Recuperação Paralela. Soluções parte Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é
 Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Soluções parte 1 01 Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é a) ar atmosférico.
Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Soluções parte 1 01 Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é a) ar atmosférico.
Concentração de soluções e diluição
 Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
QUÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA
 QUÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA TITULAÇÃO DE NEUTRALIZAÇÃO Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br QUÍMICA ANALÍTICA QUÍMICA ANALÍTICA
QUÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA TITULAÇÃO DE NEUTRALIZAÇÃO Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br QUÍMICA ANALÍTICA QUÍMICA ANALÍTICA
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) REAÇÃO / TITULAÇÃO DE COMPLEXAÇÃO O QUE É UM COMPLEXO (COMPOSTO DE COORDENAÇÃO)? São compostos formado entre metais
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) REAÇÃO / TITULAÇÃO DE COMPLEXAÇÃO O QUE É UM COMPLEXO (COMPOSTO DE COORDENAÇÃO)? São compostos formado entre metais
Manual de Métodos de Análise de Solo
 Empresa Brasileira de Pesquisa Agropecuária Ministério da Agricultura, Pecuária e Abastecimento Manual de Métodos de Análise de Solo 3ª edição revista e ampliada Paulo César Teixeira Guilherme Kangussu
Empresa Brasileira de Pesquisa Agropecuária Ministério da Agricultura, Pecuária e Abastecimento Manual de Métodos de Análise de Solo 3ª edição revista e ampliada Paulo César Teixeira Guilherme Kangussu
Química Analítica IV INTRODUÇÃO A VOLUMETRIA
 Química Análítica IV - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos INTRODUÇÃO A VOLUMETRIA VOLUMETRIA Química Análítica IV - II sem/2012
Química Análítica IV - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos INTRODUÇÃO A VOLUMETRIA VOLUMETRIA Química Análítica IV - II sem/2012
QUIO95 - Análises Volumétricas II semestre 2018
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO95 - Análises Volumétricas II semestre 2018 Preparo e padronização da solução de NaOH Profa. Maria
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO95 - Análises Volumétricas II semestre 2018 Preparo e padronização da solução de NaOH Profa. Maria
TITRIMETRIA (VOLUMETRIA) 24/07/2013. Definição. Princípio da volumetria. n o de mols do titulante = n o de mols do titulado
 Definição TITRIMETRIA (VOLUMETRIA) Processo da análise química em que o teor do analito é determinado através de uma reação química quantitativa com uma solução padrão, em uma técnica denominada titulação.
Definição TITRIMETRIA (VOLUMETRIA) Processo da análise química em que o teor do analito é determinado através de uma reação química quantitativa com uma solução padrão, em uma técnica denominada titulação.
Livro:Fundamentals of Analytical Chemistry,7Ed Skoog, Wests, Holler
 Livro:Fundamentals of Analytical Chemistry,7Ed Skoog, Wests, Holler FORMAÇÃO DE COMPLEXOS MUITOS ÍONS METÁLICOS REAGEM COM LIGANTES FORMANDO COMPOSTOS DE COORDENAÇÃO OU COMPLEXOS O LIGANTE DEVE CONTER
Livro:Fundamentals of Analytical Chemistry,7Ed Skoog, Wests, Holler FORMAÇÃO DE COMPLEXOS MUITOS ÍONS METÁLICOS REAGEM COM LIGANTES FORMANDO COMPOSTOS DE COORDENAÇÃO OU COMPLEXOS O LIGANTE DEVE CONTER
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
Prática 11 Ácidos, bases e curvas de titulação potenciométrica
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 11 Ácidos, bases e curvas de titulação potenciométrica
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 11 Ácidos, bases e curvas de titulação potenciométrica
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA
 PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
Determinação de acidez em mel por potenciometria
 Página 1 de 5 1 Escopo Este método tem como objetivo determinar a acidez em mel. 2 Fundamentos Este método consiste na neutralização da solução ácida de mel, mediante o uso de uma solução de hidróxido
Página 1 de 5 1 Escopo Este método tem como objetivo determinar a acidez em mel. 2 Fundamentos Este método consiste na neutralização da solução ácida de mel, mediante o uso de uma solução de hidróxido
MÉTODO DE ANÁLISE LL-HARDWALL F. Determinação Potenciométrica de F -
 Determinação Potenciométrica de F - Comentários: O LL - Hardwall F contém 7,5% de F -, isto é, adicionando-se 1 g/lt aumenta-se o F - contido no tanque em cerca de 75 ppm Quando o equipamento Dosing Cad
Determinação Potenciométrica de F - Comentários: O LL - Hardwall F contém 7,5% de F -, isto é, adicionando-se 1 g/lt aumenta-se o F - contido no tanque em cerca de 75 ppm Quando o equipamento Dosing Cad
TITULAÇÕES POTENCIOMÉTRICAS DE CÁTIONS METÁLICOS EM MEIO NÃO AQUOSO. Palavras chave: Potenciometria, interação soluto-solvente, eletrodo de vidro.
 TITULAÇÕES POTENCIOMÉTRICAS DE CÁTIONS METÁLICOS EM MEIO NÃO AQUOSO Anderson Martin dos Santos 1 ; Edemar Benedetti Filho 2 1 Estudante do Curso de Química Industrial da UEMS, Unidade Universitária de
TITULAÇÕES POTENCIOMÉTRICAS DE CÁTIONS METÁLICOS EM MEIO NÃO AQUOSO Anderson Martin dos Santos 1 ; Edemar Benedetti Filho 2 1 Estudante do Curso de Química Industrial da UEMS, Unidade Universitária de
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL).
 MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
MF-420.R-3 - MÉTODO DE DETERMINAÇÃO DE AMÔNIA (MÉTODO DO INDOFENOL). Notas: Aprovada pela Deliberação CECA nº 686, de 25 de julho de 1985. Publicada no DOERJ de 14 de julho de 1985. 1. OBJETIVO O objetivo
LISTA DE EXERCÍCIOS 12
 UNIVERSIDADE DE SÃO PAULO ESCOLA SUPERIOR DE AGRICULTURA LUIZ DE QUEIROZ DEPARTAMENTO DE CIÊNCIAS EXATAS LCE 151 FUNDAMENTOS DE QUÍMICA INORGÂNICA E ANALÍTICA LISTA DE EXERCÍCIOS 12 1. A partir de uma
UNIVERSIDADE DE SÃO PAULO ESCOLA SUPERIOR DE AGRICULTURA LUIZ DE QUEIROZ DEPARTAMENTO DE CIÊNCIAS EXATAS LCE 151 FUNDAMENTOS DE QUÍMICA INORGÂNICA E ANALÍTICA LISTA DE EXERCÍCIOS 12 1. A partir de uma
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
Introdução ao tema: Diluição
 Introdução ao tema: Diluição Uma pessoa abriu um envelope de pó para refresco e acrescentou seu conteúdo em uma certa quantidade de água. Mexeu bem até obter uma mistura com uma única fase, ou seja, uma
Introdução ao tema: Diluição Uma pessoa abriu um envelope de pó para refresco e acrescentou seu conteúdo em uma certa quantidade de água. Mexeu bem até obter uma mistura com uma única fase, ou seja, uma
ROTEIROS DE AULAS PRÁTICAS QUÍMICA ANALÍTICA QAN CURSO TÉCNICO EM ANÁLISES QUÍMICAS
 ROTEIROS DE AULAS PRÁTICAS QUÍMICA ANALÍTICA QAN CURSO TÉCNICO EM ANÁLISES QUÍMICAS Prof. Dr. Marcel Piovezan LAGES 2017 VERSÃO 1.0 MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA
ROTEIROS DE AULAS PRÁTICAS QUÍMICA ANALÍTICA QAN CURSO TÉCNICO EM ANÁLISES QUÍMICAS Prof. Dr. Marcel Piovezan LAGES 2017 VERSÃO 1.0 MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA
INTRODUÇÃO AOS MÉTODOS VOLUMÉTRICOS DE ANÁLISE
 INTRODUÇÃO AOS MÉTODOS VOLUMÉTRICOS DE ANÁLISE Os métodos volumétricos de análise consistem na medida do volume de uma solução, de concentração exatamente conhecida (solução padrão), necessário para reagir
INTRODUÇÃO AOS MÉTODOS VOLUMÉTRICOS DE ANÁLISE Os métodos volumétricos de análise consistem na medida do volume de uma solução, de concentração exatamente conhecida (solução padrão), necessário para reagir
FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV/ UNESP
 1 FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV/ UNESP Curso: Engenharia Agronômica Disciplina: Química Analítica Turma: TP3 Docente Responsável: Prof a. Dr a. Luciana Maria Saran Roteiro 6: Análise
1 FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV/ UNESP Curso: Engenharia Agronômica Disciplina: Química Analítica Turma: TP3 Docente Responsável: Prof a. Dr a. Luciana Maria Saran Roteiro 6: Análise
Introdução aos métodos volumétricos de análise química
 LCE-190 Química Analítica Aplicada Introdução aos métodos volumétricos de análise química Wanessa Melchert Mattos Titulometria: inclui um grupo de métodos analíticos baseados na determinação da quantidade
LCE-190 Química Analítica Aplicada Introdução aos métodos volumétricos de análise química Wanessa Melchert Mattos Titulometria: inclui um grupo de métodos analíticos baseados na determinação da quantidade
PORCENTAGEM DE ÓXIDO DE CÁLCIO (CaO) EM CAL HIDRATADA
 PORCENTAGEM DE ÓXIDO DE CÁLCIO (CaO) EM CAL HIDRATADA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 001-13 09/2014 T 001-13 pg 1 - Centro de Desenvolvimento Tecnológico
PORCENTAGEM DE ÓXIDO DE CÁLCIO (CaO) EM CAL HIDRATADA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 001-13 09/2014 T 001-13 pg 1 - Centro de Desenvolvimento Tecnológico
conhecida como molaridade é redefinida como concentração em quantidade de matéria. A quantidade de matéria do soluto (nsoluto anteriormente chamada nu
 SEGURANÇA E TÉCNICA DE LABORATÓRIO AULA 03: CONCENTRAÇÃO DE SOLUÇÕES TÓPICO 02: UNIDADES DE CONCENTRAÇÃO Uma solução é uma mistura homogênea de duas ou mais substancias. Uma destas substâncias é chamada
SEGURANÇA E TÉCNICA DE LABORATÓRIO AULA 03: CONCENTRAÇÃO DE SOLUÇÕES TÓPICO 02: UNIDADES DE CONCENTRAÇÃO Uma solução é uma mistura homogênea de duas ou mais substancias. Uma destas substâncias é chamada
Funcionamento de um sistema tampão
 Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
Funcionamento de um sistema tampão Actividade Laboratorial Química 12. ANO 1. Questão problema o o Verificar experimentalmente o funcionamento de um sistema tampão, por titulação ácido forte-base fraca
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
