ESTUDO DA SOLUBILIDADE DO POLIESTIRENO (PS) E DA POLICAPROLACTONA (PCL) EM DIFERENTES SOLVENTES ORGÂNICOS
|
|
|
- Ivan Fraga Rocha
- 6 Há anos
- Visualizações:
Transcrição
1 ESTUDO DA SOLUBILIDADE DO POLIESTIRENO (PS) E DA POLICAPROLACTONA (PCL) EM DIFERENTES SOLVENTES ORGÂNICOS A. A. C. PEREIRA 1, E. R. M. SANTOS 1, A. A. JESUS 1, A. M. MEDEIROS 1, E.M.B.D. SOUZA 1, I.S. PASSOS 1, J.A.OLIVEIRA 1 1 Universidade Federal do Rio Grande do Norte, Departamento de Engenharia Química. Programa de Pós-Graduação em Engenharia Química. Avenida Senador Salgado Filho S/N; Bairro Lagoa Nova; Natal/RN; CEP: para contato: andre_antsu@yahoo.com.br RESUMO O estudo da solubilidade de materiais poliméricos é uma importante área que possui relevantes aplicações na manipulação de fármacos, ciência das membranas, reciclagem plástica,e mais recentemente, na produção de tecidos humanos. Dito isto, o presente trabalho tem como objetivo analisar o comportamento do poliestireno (PS) (Mw= 192, 280 e 350 kda) e da policaprolactona (PCL) (Mn = 10 e 80 kda) em diferentes solventes orgânicos (acetona, acetato de etila, etanol e isopropanol). O estudo foi iníciado com a abordagem dos parâmetros de solubilidade de Hansen. Em seguida, teste de solubilidade foi aplicado e, por fim, dados de solubilidade foram obtidos a partir do ponto de névoa (turbidimetria). Pôde-se constar que os dados experimentais foram condizentes com os parametros de Hansen. As massa moleculares do polimeros, bem como, miscibilidade entre solventes foram considerados fatores determinantes do estudo da solubilidade. Palavras-chave: Poliestireno (PS), Policaprolactona (PCL), Turbidimetria, Paramêtros de Hansen. INTRODUÇÃO A solubilização polimérica é uma importante área de estudo no tocante ao manuseamento e observação das características de um polímero. Este processo é utilizado na produção e controle da qualidade de tintas e vernizes (1). Também possui 7969
2 importantes aplicações na manipulação de fármacos, ciência das membranas, reciclagem plástica, e mais recentemente na produção de tecidos humanos (2). Mas para que haja estas importantes aplicações, o par polímero-solvente deve ser termodinamicamente (1). Além de diferentes solventes utilizados no estudo, existem outros fatores que influenciam na solubilidade do polímero que incluem estrutura, composição e conformação do polímero, peso molecular, polidispersividade e diferentes aditivos utilizados (1). Durante o contato de um polímero com um solvente termodinamicamente compatível, quatro camadas superficiais podem ser formadas: camada de infiltração, camada do polímero inchado, camada de gel e a camada de liquido. Inicialmente, o solvente irá se infiltrar através do polímero, preenchendo inicialmente os espaços vazios, acarretando em um inchamento do sistema polímero-solvente. Nas camadas iniciais, o polímero apresenta um aspecto vítreo, enquanto que ao passar para a fase gelificada, seguida da liquida, o polímero possui propriedades elásticas (2). Parâmetros de solubilidade Os parâmetros de solubilidade são empregados como ferramentas de previsão da compatibilidade entre polímeros e solventes, ou seja, através destes parâmetros é possível indicar quais solventes possuem potencial para solubilizar certo polímero. Sendo assim, os parâmetros de solubilidade devem considerar qualquer interação molecular, cristalinidade e ligações cruzadas (2). Segundo Hansen, estas interações moleculares se apresentam em três tipos parâmetros, relacionando-os a três forças de ligação: forças de dispersão (δd), forças de pontes de hidrogênio (δh) e forças dipolodipolo (δp) (3). A forma mais comum de representação e, consequentemente, avaliação destes parâmetros é por representação gráfica. Na qual o centro corresponde aos parâmetros δd, δh e δp do polímero que se deseja prever a solubilidade, bem como, o raio R de interação que delimita a fronteira a qual determinado solvente é considerado bom solvente (2). Desta forma, um dado solvente necessita que seus parâmetros de solubilidade estejam numa região entre o centro e a fronteira para se avaliar uma possível interação com o polímero desejado (2). 7970
3 É importante salientar que este método de determinação dos parâmetros de solubilidade, não é completamente eficaz, uma vez que os solventes podem possuir maiores e menores moléculas, não apresentando uniformidade na solubilização. Por este motivo, é possível que um determinado solvente esteja fora do raio de interação de um polímero, mas que mesmo assim seja capaz de solubilizá-lo (2). Sendo assim, o presente trabalho teve como foco principal avaliar o comportamento do PS e PCL em solução. Para isto, foi avaliado: os bons solventes para estes polímeros mediante a construção do gráfico de Hansen, o comportamento em solução destes polímeros com diferentes massas moleculares e, por fim, foram analisados as quantidades de solventes e não-solventes necessários para manter a solução polimérica homogenia (Ponto de Névoa). Os resultados demonstraram que é possível obter soluções homogenias condizentes com os parâmetros de solubilidade de Hansen para baixas concentrações poliméricas. MATERIAIS E MÉTODOS Neste trabalho, as atividades experimentais foram realizadas em três etapas principais: (i) seleção dos parâmetros de solubilidade de Hansen, (ii) Teste de solubilidade para os polímeros considerados e (iii) determinação do ponto de névoa. Parâmetros de solubilidade de Hansen Esta primeira etapa correspondeu a seleção dos parâmetros de solubilidade de Hansen de uma série de solventes, bem como, os parâmetros e raios de interação correspondentes aos polímeros PS e PCL. A partir destes dados foi possível construir gráficos bidimensionais para cada polímero, sendo o eixo x representado pelo parâmetro referente às forças de ligação dipolo-dipolo, δp, e o eixo y representado pelo parâmetro referente às forças, de ligação do tipo ponte de hidrogênio, δh. Os parâmetros dos solventes e dos polímeros utilizados na construção dos gráficos estão contidos nas Tabelas 1 e
4 Tabela 1 - Parâmetros de solubilidade dos solventes (1,4) Solvente δp(cal/cm 3 ) 1/2 δh(cal/cm 3 ) 1/2 Solvente δp(cal/cm 3 ) 1/2 δh(cal/ cm 3 ) 1/2 Acetato de Etila 2,59 3,52 Eter Etílico 2,90 4,60 Acetato de Pentila 1,61 3,37 Etileno Glicol 5,40 12,70 Acetona 5,08 3,42 Formamida 12,80 9,30 Acetonitrila 8,80 3,00 Isopropanol 6,10 16,40 Água 15,30 16,70 Metanol 6,00 10,90 Ciclohexanol 2,00 6,60 n-butanol 2,80 7,70 Dietileno Glicol 7,20 10,00 n-propanol 3,30 8,50 Dimetilftalato (DMP) 5,28 2,39 Propileno Glicol 4,60 11,40 Etanol 4,30 9,48 Tricloroetano 2,10 1,00 Tabela 2 - Parâmetros de solubilidade e raios de interação dos polímeros (1,4) Polímero δp(cal/cm 3 ) 1/ 2 δh(cal/cm 3 ) 1/ 2 R(cal/cm 3 ) 1/ 2 PS 3 2 3,5 PCL (10 kda) PCL (80 kda) 6,1 7,8 7,1 6,2 7,7 5,5 Vale salientar que nesta etapa foram avaliados os potenciais solventes destes polímeros, baseando-se nas respectivas localizações dos seus parâmetros nos 7972
5 gráficos. Além disso, os parâmetros de dispersão não foram levados em consideração. Uma vez que seus valores pouco diferem de um solvente para outro. Teste de solubilidade Para a realização desta etapa, foi utilizado PS (Mw =192, 280 e 350kDa) e PCL (Mn = 10 e 80kDa). Uma pequena porção, cerca de 2 grãos ou 0,06 g, referente a uma massa especifica de polímero foi colocada em diferentes tubos de ensaios previamente contidos de um solvente a ser avaliado (acetona, acetato de etila, etanol, isopropanol e água). Esta etapa foi realizada com o auxilio de uma micropipeta. Em seguida, deixou-se a massa polimérica em contato com o solvente por um período de três horas e trinta minutos a temperatura ambiente de 25 o C. Após decorrido este tempo, foi observado se houve inchamento, dissolução ou se o polímero permaneceu inerte ao solvente, e então se construiu uma tabela com os dados obtidos. É importante salientar que os tubos de ensaio foram vedados com rolhas, a fim de se evitar a evaporação dos líquidos. Ponto de névoa Para esta última etapa, foi tomada como base a mudança de coloração da solução polimérica através da adição de anti-solvente na mesma (Turbidimetria ou Ponto de Névoa). Inicialmente, as soluções poliméricas foram preparadas em tubos de ensaios e mantidas a 30ºC, até sua total solubilização. Em seguida, com o auxilio de uma seringa, gotas de um anti-solvente foram adicionadas a solução. A determinação do ponto de viragem foi realizada a olho nu, por meio da observação do turvamento (ou embranquecimento) da solução. No final, a quantidade de antisolvente adicionado foi mensurada pelo massa remanescente na seringa. É importante dizer que os solventes utilizados nesta etapa foram pré-definidos na etapa de solubilização (Tabela 3). Tabela 3 - Pares polímero/solvente e anti-solventes utilizados na precipitação Polímero Solvente Anti-Solvente 7973
6 PCL (10 kda) Acetona Àgua PCL (80 kda) Acetona Àgua PCL (10 kda) Acetato de Etila Etanol PCL (80 kda) Acetato de Etila Isopropanol PS (192 kda) Acetato de Etila Etanol PS (280 kda) Acetato de Etila Isopropanol PS (350 kda) Acetato de Etila Etanol RESULTADOS E DISCUSSÃO Nesta seção serão apresentados os resultados obtidos na parte experimental que incluem as representações em duas dimensões (2D) dos para parâmetros de Hansen, teste de solubilidade para os solventes escolhidos, bem como, a análise dos dados obtidos no Ponto de névoa em contraste com os parâmetros de Hansen. Representação 2D dos parâmetros de Hansen Analisando a representação gráfica dos parâmetros de solubilidade de Hansen para os diferentes solventes, e considerando o raio de interação R igual a 3,5 (cal/cm 3 ) 1/2 para o PS (Figura 1). É possível constatar que poucos solventes estão inseridos na esfera de interação e, consequentemente, apenas estes possuem potencial de solubilização. Dentre os mesmos, o que mais se destaca é o acetato de etila. Uma vez que está localizado próximo ao centro do círculo. 7974
7 Figura 1- Representação gráfica 2D dos parâmetros de solubilidade de Hansen para OS. Como o raio de solubilidade para determinado polímero é dependente de sua massa molecular, cada massa distinta possui um raio também distinto. Sendo assim, para um mesmo polímero, quanto maior sua massa molecular, menor será seu raio de interação (1). Tal fato pode ser constatado ao se observar a Figura 2 referente à PCL(10kDa e 80kDa). Nesta representação foi considerado um raio de interação de 7,1(cal/cm 3 ) 1/2 e 5,5 (cal/cm 3 ) 1/2 para as massas de 10kDa e 80kDa, respectivamente. 7975
8 Figura 2 Representação gráfica 2D dos parâmetros de solubilidade de Hansen para PCL. Comparando-se os dois polímeros PS e PCL com os solventes utilizados, é possível perceber que a PCL pode ser solubilizado por uma gama muito maior de solventes do que o PS. Uma vez que possui um raio de interação que chega a ser duas vezes maior, de R = 7,1(cal/cm 3 ) 1/2. Vale salientar que valores de parâmetros de solubilidade para massas moleculares distintas para o PS não foram encontrados na literatura. É importante dizer também que os parâmetros utilizados nestas representações pouco variam com a temperatura (1). Avaliação da solubilidade em solventes definidos A partir dos solventes contidos no raio de interação do polímero, quatro solventes foram avaliados, bem como, água conforme a tabela 4 abaixo. Tais solventes foram 7976
9 utilizados tendo como critério de seleção os parâmetros de solubilidade de Hansen, assim como, o grau de toxicidade. Tabela 4 Testes de solubilidade do PS e PCL em alguns solventes. Solvente (Tempo de Experimento = 3h30min), T = 25 o C Polímero (Mw e Mn)* Acetona AcetatodeEtila Etanol Isopropanol Água PCL (10 kda) Solubilizou Solubilizou Inerte Inerte Inerte PCL (80 kda) Solubilizou Solubilizou Inchou Inerte Inerte PS (192 kda) Inchou Solubilizou Inerte Inerte Inerte PS (280 kda) Inchou Solubilizou Inerte Inerte Inerte PS (350 kda) Inchou Solubilizou Inerte Inerte Inerte De acordo com a tabela, a inércia da água e do isopropanol no tocante à solubilização dos polímeros já era esperada, uma vez que ambos solventes estão fora dos círculos de solubilização, tanto do poliestireno, quanto da policaprolactona. O acetato de etila solubilizou todas as diferentes massas moleculares avaliadas, pois seus parâmetros de solubilidade se encontram bem próximos a aqueles encontrados para esse polímero. Da mesma forma, a acetona solubilizou as diferentes massas de policaprolactona. Cabe salientar que, mediante esta constatação, a acetona e o acetato de etila foram escolhidos para a avaliação do Ponto de névoa. Uma vez que os mesmos se apresentam comuns as duas representações. Para o par acetona/ps não ocorreu uma solubilização total, pois apesar de estar dentro do círculo de solubilidade do poliestireno, o ponto correspondente aos parâmetros da acetona está relativamente distante do centro do circulo do PS. Provavelmente, com um maior tempo de solubilização ou uma maior temperatura, a solução se tornaria totalmente solubilizada. Determinação do Ponto de névoa Após a definição dos potenciais solventes e anti-solventes (S/AS) para os polímeros estudados, uma nova avaliação foi realizada. Esta avaliação consistiu na determinação 7977
10 das proporções S/AS limite, as quais permitem o aspecto homogêneo das soluções poliméricas após a total solubilização, ou seja, aspecto transparente. Para isto, foi utilizada a técnica de Turbidimetria (Ponto de névoa) e os parâmetros de solubilidade foram determinados com o auxílio da regra da alavanca. Conforme a Tabela 5 observa-se que houve proporcionalidade entre os valores calculados e experimentais, principalmente, a que se referi ao PS. Quanto ao PCL estes valores diferem no par acetona/água. Enquanto a regra da alavanca nos informa que quanto maior a massa polimérica menor o valor anti-solvente é necessária para manter a solução homogênea, experimentalmente isto não se constata. Polímero (Mn e Mw) Solvente Tabela 5 Proporções de Anti-Solventes Não- Solvente Proporção de Não- Solvente (%) Proporção de Não-Solvente (%)* Erro (%)** PCL (10 kda) Acetona Água 24,2 35,0 30,7 PCL (80 kda) Acetona Água 18,0 44,3 59,3 PCL (10 kda) PCL (80 kda) PS (192 kda) PS (280 kda) PS (350 kda) Acetato de Etila Acetato de Etila Acetato de Etila Acetato de Etila Acetato de Etila Etanol 61,0 *** *** Isopropanol 52,1 34,3 51,5 Etanol 29,5 33,3 11,4 Isopropanol 18,6 15,4 21,0 Etanol 23,3 33,3 30,0 * Dados da literatura (1) ** Valor percentual da razão entre as proporções de não solvente encontradas nos experimentos e as proporções de não-solventes da literatura. *** Não se considerou tal solvente como anti-solvente, pois o mesmo encontra-se no interior do circulo de solubilidade do polímero em questão. Ainda na Tabela 5, analisando os diferentes alcoóis como anti-solvente para as soluções poliméricas do PS, pode-se considerar os resultados já como esperados. Uma vez que o isopropanol possui um índice de miscibilidade próximo a do acetato. Esta afinidade leva a redução do poder de solvatação do acetato junto ao PS, fazendo com que este anti-solvente promova a precipitação do polímero utilizando menor volume (5-7). 7978
11 CONCLUSÃO Este trabalho teve como objetivo avaliar o comportamento do PS de três massas moleculares diferentes (Mw = 192, 280 e 350 kda) e PCL de duas massas moléculas moleculares médias distintas (Mn = 10 e 80 kda) em diversos solventes orgânicos. Tais solventes foram selecionados a partir de seus parâmetros de Hansen e grau de toxicidade. Em geral, os resultados demonstraram que os parâmetros solubilidade de Hansen podem ser levados em consideração quando levados a prática. Vale salientar que os polímeros utilizados podem ter influenciado em determinados resultados. Uma vez que sua polidispersividade não foi levada em consideração. Quanto às massas moleculares dos polímeros estudados, pôde-se concluir que estas se apresentaram como o principal fator determinante da solubilidade. Outro fator também determinante é a miscibilidade entre os pares de solventes envolvidos. REFERÊNCIAS 1.CANEVAROLO Jr, S.V., Ciência dos Polímeros. São Paulo: Artliber, MILLER-CHOU, B.A.; KOENING, J. L. A review of polymer dissolution. Progress in Polymer Science, v. 28(8), p , HANSEN, C. M., Hansen Solubility Parameters: A User's Handbook. Boca Raton: CRC Press, BORDES, C.; FRÉVILLE, V.; RUFFIN, E.; MAROTE, P.; GAUVRIT, J. Y.; BRIANÇON, S.; LANTÉRI, P. Determination of poly(ɛ-caprolactone) solubility parameters: Application to solvent substitution in a microencapsulation process. International Journal of Pharmaceutics, v. 383(1 2), p ,
12 5.YEO, S.; KIRAN, E. Formation of polymer particles with supercritical fluids: A review. The Journal of Supercritical Fluids, v. 34(3), p , JUNG, J.; PERRUT, M. Particle design using supercritical fluids: Literature and patent survey. The Journal of Supercritical Fluids, v. 20(3), p , TAI, C.Y.; CHENG, C. Supersaturation and crystal growth in gas anti-solvent crystallization. Journal of Crystal Growth, v. 183(4), p , STUDY OF POLYSTYRENE SOLUBILITY (PS) AND POLYCAPROLACTONE (PCL) IN DIFERENT ORGANIC SOLVENTS ABSTRACT The study of the solubility of polymeric materials is an important area that has significant applications in the handling of drugs, Science membranes, plastics recycling, and more recently, in the production of human tissues. That said, this study aims to analyze the Polystyrene behavior (PS) (Mw = 192, 280 and 350 kda) and polycaprolactone (PCL) (Mn = 10 and 80 kda) in different organic solvents (acetone, ethyl acetate, ethanol and isopropanol). The study was initiated with the approach of Hansen solubility parameters. Then solubility test was applied and, finally, solubility data were obtained from the cloud point (turbidity). It might be noted that the experimental data were consistent with the parameters of Hansen. The molecular weight of the polymers, as well as, miscibility between solvents were considered factors determining the solubility study. Keyword: Polystyrene (PS), Polycaprolactone (PCL), turbidimetry, Hansen parameters. 7980
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE TECNOLOGIA - CT DEPARTAMENTO DE ENGENHARIA QUÍMICA - DEQ CAIO ELLER PAZZINI
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE TECNOLOGIA - CT DEPARTAMENTO DE ENGENHARIA QUÍMICA - DEQ CAIO ELLER PAZZINI ESTUDO DE SOLUBILIDADE DO POLIESTIRENO (PS) EDA POLICAPROLACTONA
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE - UFRN CENTRO DE TECNOLOGIA - CT DEPARTAMENTO DE ENGENHARIA QUÍMICA - DEQ CAIO ELLER PAZZINI ESTUDO DE SOLUBILIDADE DO POLIESTIRENO (PS) EDA POLICAPROLACTONA
Química de Polímeros. Prof a. Dr a. Carla Dalmolin Polímeros em Solução
 Química de Polímeros Prof a. Dr a. Carla Dalmolin carla.dalmolin@udesc.br Polímeros em Solução Polímeros em Solução Indústria de tintas / vernizes / adesivos Formulação e controle de qualidade Baixo custo
Química de Polímeros Prof a. Dr a. Carla Dalmolin carla.dalmolin@udesc.br Polímeros em Solução Polímeros em Solução Indústria de tintas / vernizes / adesivos Formulação e controle de qualidade Baixo custo
ESTUDO DA SOLUBILIDADE DO PARACETAMOL EM ALGUNS SOLVENTES UTILIZANDO O MODELO NRTL
 ESTUDO DA SOLUBILIDADE DO PARACETAMOL EM ALGUNS SOLVENTES UTILIZANDO O MODELO NRTL H. A. R. GOMES 1, A. B. N. BRITO 1 1 Universidade Federal do Espírito Santo, Centro Universitário Norte do Espírito Santo,
ESTUDO DA SOLUBILIDADE DO PARACETAMOL EM ALGUNS SOLVENTES UTILIZANDO O MODELO NRTL H. A. R. GOMES 1, A. B. N. BRITO 1 1 Universidade Federal do Espírito Santo, Centro Universitário Norte do Espírito Santo,
Obtenção da curva de solubilidade de sistemas relacionados com a produção de biodiesel
 https://eventos.utfpr.edu.br//sicite/sicite2017/index Obtenção da curva de solubilidade de sistemas relacionados com a produção de biodiesel RESUMO Daniele Cobus danicobus@hotmail.com Universidade Tecnológica
https://eventos.utfpr.edu.br//sicite/sicite2017/index Obtenção da curva de solubilidade de sistemas relacionados com a produção de biodiesel RESUMO Daniele Cobus danicobus@hotmail.com Universidade Tecnológica
Química Aplicada. QAP0001 Licenciatura em Química Prof a. Dr a. Carla Dalmolin Tintas Industriais
 Química Aplicada QAP0001 Licenciatura em Química Prof a. Dr a. Carla Dalmolin carla.dalmolin@udesc.br carla.dalmolin@gmail.com Tintas Industriais Estética Segurança Tintas Industriais Identificação de
Química Aplicada QAP0001 Licenciatura em Química Prof a. Dr a. Carla Dalmolin carla.dalmolin@udesc.br carla.dalmolin@gmail.com Tintas Industriais Estética Segurança Tintas Industriais Identificação de
DETERMINAÇÃO DO COEFICIENTE DE DIFUSÃO DO ETANOL 1 DETERMINATION OF THE ETHANOL DIFFUSION COEFFCIENT
 DETERMINAÇÃO DO COEFICIENTE DE DIFUSÃO DO ETANOL 1 DETERMINATION OF THE ETHANOL DIFFUSION COEFFCIENT Anderson Luís Gay 2, Gabriela Zorzetto Do Nascimento 3, Mônica Lima Gonçalves 4, Fernanda Da Cunha Pereira
DETERMINAÇÃO DO COEFICIENTE DE DIFUSÃO DO ETANOL 1 DETERMINATION OF THE ETHANOL DIFFUSION COEFFCIENT Anderson Luís Gay 2, Gabriela Zorzetto Do Nascimento 3, Mônica Lima Gonçalves 4, Fernanda Da Cunha Pereira
LÍQUIDOS: DETERMINAÇÃO DA TENSÃO SUPERFICIAL. 1. Introdução
 LÍQUIDOS: DETERMINAÇÃO DA TENSÃO SUPERFICIAL 1. Introdução Uma propriedade característica dos líquidos é possuir uma superfície plana bem definida, o que os distingue dos gases. Uma medida da rigidez do
LÍQUIDOS: DETERMINAÇÃO DA TENSÃO SUPERFICIAL 1. Introdução Uma propriedade característica dos líquidos é possuir uma superfície plana bem definida, o que os distingue dos gases. Uma medida da rigidez do
DETERMINAÇÃO EXPERIMENTAL DA SOLUBILIDADE DO FERTILIZANTE URÉIA EM SOLVENTES PUROS
 DETERMINAÇÃO EXPERIMENTAL DA SOLUBILIDADE DO FERTILIZANTE URÉIA EM SOLVENTES PUROS F. M. A. S. COSTA 1, A. P. SILVA 1, M. R. FRANCO JÚNIOR 1 e R. A. MALAGONI 1 1 Universidade Federal de Uberlândia, Faculdade
DETERMINAÇÃO EXPERIMENTAL DA SOLUBILIDADE DO FERTILIZANTE URÉIA EM SOLVENTES PUROS F. M. A. S. COSTA 1, A. P. SILVA 1, M. R. FRANCO JÚNIOR 1 e R. A. MALAGONI 1 1 Universidade Federal de Uberlândia, Faculdade
Parte 1. Diagrama de fases ternário
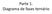 Parte 1. Diagrama de fases ternário Três componentes : água, citrato e poli(etileno glicol) 400 g/mol Observar passagem de sistema homogêneo para turvo cloud-point ou ponto de névoa em função da variação
Parte 1. Diagrama de fases ternário Três componentes : água, citrato e poli(etileno glicol) 400 g/mol Observar passagem de sistema homogêneo para turvo cloud-point ou ponto de névoa em função da variação
DETERMINAÇÃO DA SOLUBILIDADE DE UREIA EM MISTURAS ETANOL-ÁGUA EM TEMPERATURAS DE 278,15 A 333,15 K
 DETERMINAÇÃO DA SOLUBILIDADE DE UREIA EM MISTURAS ETANOL-ÁGUA EM TEMPERATURAS DE 278,15 A 333,15 K V.E. DINIZ 1, A.P. SILVA 1, R.A. MALAGONI 1 1 Universidade Federal de Uberlândia / Faculdade de Engenharia
DETERMINAÇÃO DA SOLUBILIDADE DE UREIA EM MISTURAS ETANOL-ÁGUA EM TEMPERATURAS DE 278,15 A 333,15 K V.E. DINIZ 1, A.P. SILVA 1, R.A. MALAGONI 1 1 Universidade Federal de Uberlândia / Faculdade de Engenharia
AJUSTE DE DADOS EXPERIMENTAIS DA SOLUBILIDADE DA UREIA EM SOLUÇÕES DE ISOPROPANOL+ÁGUA COM O USO DE EQUAÇÕES EMPÍRICAS
 AJUSTE DE DADOS EXPERIMENTAIS DA SOLUBILIDADE DA UREIA EM SOLUÇÕES DE ISOPROPANOL+ÁGUA COM O USO DE EQUAÇÕES EMPÍRICAS L. G. FONSECA 1, J. B. RODRIGUES 1 e R. A. MALAGONI 1 1 Universidade Federal de Uberlândia,
AJUSTE DE DADOS EXPERIMENTAIS DA SOLUBILIDADE DA UREIA EM SOLUÇÕES DE ISOPROPANOL+ÁGUA COM O USO DE EQUAÇÕES EMPÍRICAS L. G. FONSECA 1, J. B. RODRIGUES 1 e R. A. MALAGONI 1 1 Universidade Federal de Uberlândia,
INSTITUTO FEDERAL DA BAHIA
 Curso de Engenharia Disciplina: Laboratório de Engenharia I Período: 2016.2 rev. 1.2 1. Objetivo Determinação do Peso Molecular Viscosimétrico (Mv) Determinar o Peso Molecular Viscosimétrico de um polímero
Curso de Engenharia Disciplina: Laboratório de Engenharia I Período: 2016.2 rev. 1.2 1. Objetivo Determinação do Peso Molecular Viscosimétrico (Mv) Determinar o Peso Molecular Viscosimétrico de um polímero
1) As substâncias puras benzeno, clorofórmio, hexano e álcool etílico encontram-se em frascos identificados apenas pelas letras A, B, C e D.
 Química Gabarito Avaliação de Sala 1B 1 os anos Décio mar/12 Nome: Nº: Turma: 1) As substâncias puras benzeno, clorofórmio, hexano e álcool etílico encontram-se em frascos identificados apenas pelas letras
Química Gabarito Avaliação de Sala 1B 1 os anos Décio mar/12 Nome: Nº: Turma: 1) As substâncias puras benzeno, clorofórmio, hexano e álcool etílico encontram-se em frascos identificados apenas pelas letras
EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS
 1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015.1 EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS 1. Densidade Densidade (d) é uma grandeza expressa pela
1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015.1 EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS 1. Densidade Densidade (d) é uma grandeza expressa pela
Química FUVEST ETAPA. Resposta QUESTÃO 1 QUESTÃO 2
 Química FUVEST QUESTÃO 1 Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água. Após a montagem de uma aparelhagem como a da figura a seguir, e antes de iniciar
Química FUVEST QUESTÃO 1 Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água. Após a montagem de uma aparelhagem como a da figura a seguir, e antes de iniciar
PRÁTICA: LÍQUIDOS: DETERMINAÇÃO DA VISCOSIDADE
 PRÁTICA: LÍQUIDOS: DETERMINAÇÃO DA VISCOSIDADE 1. Introdução No estado líquido as moléculas estão mais próximas uma das outras e entre elas existem forças atrativas. Para um líquido fluir suas moléculas
PRÁTICA: LÍQUIDOS: DETERMINAÇÃO DA VISCOSIDADE 1. Introdução No estado líquido as moléculas estão mais próximas uma das outras e entre elas existem forças atrativas. Para um líquido fluir suas moléculas
Sinopse das funções orgânicas
 Sinopse das funções orgânicas - Funções orgânicas oxigenadas: Álcoois - 7ª Aula- E.M. 1 1- Propriedades Físicas dos Álcoois Os álcoois possuem pontos de ebulição muito mais altos que éteres ou hidrocarbonetos
Sinopse das funções orgânicas - Funções orgânicas oxigenadas: Álcoois - 7ª Aula- E.M. 1 1- Propriedades Físicas dos Álcoois Os álcoois possuem pontos de ebulição muito mais altos que éteres ou hidrocarbonetos
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
O Estado Coloidal. Química dos Colóides e Superfícies. M.Sc. Maron Stanley Silva O. Gomes Site: marongomes.wix.
 Química dos Colóides e Superfícies Profº Janilson Lima Souza E-mail: Prof. janilsonlima@ifma.edu.br M.Sc. Maron Stanley Silva O. Gomes E-mail: maron@ifma.edu.br Site: marongomes.wix.com/maron A Ciência
Química dos Colóides e Superfícies Profº Janilson Lima Souza E-mail: Prof. janilsonlima@ifma.edu.br M.Sc. Maron Stanley Silva O. Gomes E-mail: maron@ifma.edu.br Site: marongomes.wix.com/maron A Ciência
APLICAÇÃO DOS POLÍMEROS EM ODONTOLOGIA CLASSIFICAÇÃO DOS POLÍMEROS REQUISITOS PARA UMA RESINA ODONTOLÓGICA. 1. Compatibilidade Biológicos:
 APLICAÇÃO DOS POLÍMEROS EM ODONTOLOGIA Próteses totais Base, reembasadores, dentes artificiais. Materiais restauradores de cavidades Resinas compostas 2016-1 - Anusavice, Cap. 7 p. 136 Selantes Materiais
APLICAÇÃO DOS POLÍMEROS EM ODONTOLOGIA Próteses totais Base, reembasadores, dentes artificiais. Materiais restauradores de cavidades Resinas compostas 2016-1 - Anusavice, Cap. 7 p. 136 Selantes Materiais
RESOLUÇÃO DA LISTA COMPLEMENTAR INTERAÇÕES INTERMOLECULARES E SUA ASSOCIAÇÃO COM PROPRIEDADES FÍSICAS DAS SUBSTÂNCIAS
 RESOLUÇÃO DA LISTA COMPLEMENTAR INTERAÇÕES INTERMOLECULARES E SUA ASSOCIAÇÃO COM PROPRIEDADES FÍSICAS DAS SUBSTÂNCIAS 1 E Molécula A: apesar de essa molécula apresentar somente ligações polares (entre
RESOLUÇÃO DA LISTA COMPLEMENTAR INTERAÇÕES INTERMOLECULARES E SUA ASSOCIAÇÃO COM PROPRIEDADES FÍSICAS DAS SUBSTÂNCIAS 1 E Molécula A: apesar de essa molécula apresentar somente ligações polares (entre
Portfolio sustentável aliado à tecnologia de solubilização: motores de soluções para a cadeia produtiva de tintas e vernizes
 Portfolio sustentável aliado à tecnologia de solubilização: motores de soluções para a cadeia produtiva de tintas e vernizes Presented by: Author Company Sérgio Martins Sérgio Martins/Suelbi Silva/Diana
Portfolio sustentável aliado à tecnologia de solubilização: motores de soluções para a cadeia produtiva de tintas e vernizes Presented by: Author Company Sérgio Martins Sérgio Martins/Suelbi Silva/Diana
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO
 UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
UNIVERSIDADE DO ESTADO DO RIO DE JANEIRO INSTITUTO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE SELEÇÃO/2011 DO CURSO DE MESTRADO 08/11/2010 PROVA ESCRITA Assinatura do candidato: Área de concentração:
QBQ Prática de Ensino de Química e Bioquímica
 Daniel Fernandez Zanchetta Nº USP: 7264161 08/07/2010 QBQ5825 - Prática de Ensino de Química e Bioquímica Relatório de sugestão para Disciplina QFL2453 Físico Química Experimental Objetivos Esse experimento
Daniel Fernandez Zanchetta Nº USP: 7264161 08/07/2010 QBQ5825 - Prática de Ensino de Química e Bioquímica Relatório de sugestão para Disciplina QFL2453 Físico Química Experimental Objetivos Esse experimento
Prática 08 Determinação da Massa Molar da Ureia via Ebuliometria
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
META Determinar o volume molar parcial de uma mistura binária de água/etanol pela medida de diferentes composições da mistura.
 QUANTIDADES PARCIAIS MOLARES META Determinar o volume molar parcial de uma mistura binária de água/etanol pela medida de diferentes composições da mistura. OBJETIVOS Ao final desta aula, o aluno deverá:
QUANTIDADES PARCIAIS MOLARES META Determinar o volume molar parcial de uma mistura binária de água/etanol pela medida de diferentes composições da mistura. OBJETIVOS Ao final desta aula, o aluno deverá:
ESTUDO DA CRISTALIZAÇÃO DA LACTOSE A PARTIR DA ADIÇÃO DE ETANOL RESUMO
 ESTUDO DA CRISTALIZAÇÃO DA LACTOSE A PARTIR DA ADIÇÃO DE ETANOL G. R. OLIVEIRA 1, M. S. SANTOS 1, A. L. BALIEIRO 1, O. L. S. ALSINA 1*, A. S. LIMA 1, C. M. F. SOARES 1 1 Universidade Tiradentes, ITP/ENGENHARIA
ESTUDO DA CRISTALIZAÇÃO DA LACTOSE A PARTIR DA ADIÇÃO DE ETANOL G. R. OLIVEIRA 1, M. S. SANTOS 1, A. L. BALIEIRO 1, O. L. S. ALSINA 1*, A. S. LIMA 1, C. M. F. SOARES 1 1 Universidade Tiradentes, ITP/ENGENHARIA
Propriedades Físicas de Compostos Orgânicos
 Os principais fatores que influenciam nas propriedades físicas dos compostos orgânicos são: O tamanho das moléculas; Os tipos de interação intermolecular. Temperatura de Ebulição e Fusão Quanto mais fortes
Os principais fatores que influenciam nas propriedades físicas dos compostos orgânicos são: O tamanho das moléculas; Os tipos de interação intermolecular. Temperatura de Ebulição e Fusão Quanto mais fortes
REOLOGIA DE SOLUÇÕES DE ESPUMA SEMIRRÍGIDA DE POLIESTIRENO DISSOLVIDA EM D-LIMONENO
 REOLOGIA DE SOLUÇÕES DE ESPUMA SEMIRRÍGIDA DE POLIESTIRENO DISSOLVIDA EM D-LIMONENO R.F. CELLA 1 ; P.F. OLIVEIRA 1 ; R.A.F. MACHADO 1 ; A. BOLZAN 1 1 Universidade Federal de Santa Catarina, Departamento
REOLOGIA DE SOLUÇÕES DE ESPUMA SEMIRRÍGIDA DE POLIESTIRENO DISSOLVIDA EM D-LIMONENO R.F. CELLA 1 ; P.F. OLIVEIRA 1 ; R.A.F. MACHADO 1 ; A. BOLZAN 1 1 Universidade Federal de Santa Catarina, Departamento
Aula 2 Materiais Poliméricos. Pesos moleculares. 10/8/2005 Prof. Dr. Hamilton M. Viana 1
 Aula 2 Materiais Poliméricos Pesos moleculares 10/8/2005 Prof. Dr. Hamilton M. Viana 1 Pesos Moleculares Numa reação de polimerização, as cadeias vão aumentando de forma diferenciada! E por que isso acontece?
Aula 2 Materiais Poliméricos Pesos moleculares 10/8/2005 Prof. Dr. Hamilton M. Viana 1 Pesos Moleculares Numa reação de polimerização, as cadeias vão aumentando de forma diferenciada! E por que isso acontece?
Viscosidade. Quando um fluido escoa entre duas paredes fixas, podemos dividir o corpo deste fluido em várias camadas ou laminas.
 Viscosidade Quando um fluido escoa entre duas paredes fixas, podemos dividir o corpo deste fluido em várias camadas ou laminas. Tensão de cisalhamento deformação A constante de proporcionalidade é a VISCOSIDADE
Viscosidade Quando um fluido escoa entre duas paredes fixas, podemos dividir o corpo deste fluido em várias camadas ou laminas. Tensão de cisalhamento deformação A constante de proporcionalidade é a VISCOSIDADE
Soluções Curva de solubilidade, concentrações e preparo de soluções Professor Rondinelle Gomes Pereira
 Soluções Definição: São misturas homogêneas, ou seja, mistura de dois ou mais componentes apresentando uma única fase contínua. As soluções são compostas por um ou mais soluto e um ou mais solvente. Soluto:
Soluções Definição: São misturas homogêneas, ou seja, mistura de dois ou mais componentes apresentando uma única fase contínua. As soluções são compostas por um ou mais soluto e um ou mais solvente. Soluto:
FCAV/UNESP. ASSUNTO: Forças Intermoleculares e Propriedades Físicas de Compostos Orgânicos. Prof a. Dr a. Luciana Maria Saran
 FCAV/UNESP ASSUNTO: Forças Intermoleculares e Propriedades Físicas de Compostos Orgânicos Prof a. Dr a. Luciana Maria Saran 1 FORÇAS INTERMOLECULARES Fonte: BARBOSA, 2004. 2 FORÇAS INTERMOLECULARES 1.
FCAV/UNESP ASSUNTO: Forças Intermoleculares e Propriedades Físicas de Compostos Orgânicos Prof a. Dr a. Luciana Maria Saran 1 FORÇAS INTERMOLECULARES Fonte: BARBOSA, 2004. 2 FORÇAS INTERMOLECULARES 1.
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS
 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS As propriedades físicas dos compostos orgânicos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS As propriedades físicas dos compostos orgânicos podem ser interpretadas, e muitas vezes até previstas, a partir do conhecimento das ligações químicas que unem
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA EXPERIMENTAL
 INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA EXPERIMENTAL ESTRUTURA DA MATÉRIA O termo matéria refere-se a todos os
INSTITUTO FEDERAL DE EDUCAÇÃO CIÊNCIA E TECNOLOGIA DO RIO GRANDE DO NORTE IFRN CAMPUS MOSSORÓ PROFESSOR: ALBINO DISCIPLINA: QUÍMICA EXPERIMENTAL ESTRUTURA DA MATÉRIA O termo matéria refere-se a todos os
Química de Polímeros LOM3058 PROF. FÁBIO HERBST FLORENZANO
 Química de Polímeros LOM3058 PROF. FÁBIO HERBST FLORENZANO Estrutura da disciplina Aulas Expositivas Listas de Exercícios Provas teóricas Apoio didático por meio do STOA Avaliação Provas teóricas (26/4
Química de Polímeros LOM3058 PROF. FÁBIO HERBST FLORENZANO Estrutura da disciplina Aulas Expositivas Listas de Exercícios Provas teóricas Apoio didático por meio do STOA Avaliação Provas teóricas (26/4
- TEMPERATURA DE EBULIÇÃO - SOLUBILIDADE
 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS - TEMPERATURA DE EBULIÇÃO - SOLUBILIDADE TEMPERATURA DE EBULIÇÃO Depende do tipo de -LIGAÇÃO INTERMOLECULAR e do - TAMANHO DAS MOLÉCULAS LIGAÇÕES INTERMOLECULARES
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS - TEMPERATURA DE EBULIÇÃO - SOLUBILIDADE TEMPERATURA DE EBULIÇÃO Depende do tipo de -LIGAÇÃO INTERMOLECULAR e do - TAMANHO DAS MOLÉCULAS LIGAÇÕES INTERMOLECULARES
Seminário de Química Orgânica Experimental I. Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002
 Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
APLICAÇÃO DE MODELOS TERMODINÂMICOS NO ESTUDO
 APLICAÇÃO DE MODELOS TERMODINÂMICOS NO ESTUDO DA SOLUBILIDADE DO PARACETAMOL THERMODYNAMIC MODELS OF APPLICATION IN THE STUDY ISSN: 447-558 THE SOLUBILITY OF PARACETAMOL Vinícius Molini Benedito ; Ana
APLICAÇÃO DE MODELOS TERMODINÂMICOS NO ESTUDO DA SOLUBILIDADE DO PARACETAMOL THERMODYNAMIC MODELS OF APPLICATION IN THE STUDY ISSN: 447-558 THE SOLUBILITY OF PARACETAMOL Vinícius Molini Benedito ; Ana
IPT. Sumário. Ligações intermoleculares. Polaridade das ligações covalentes. Electronegatividade. Química 1
 IPT Sumário Electronegatividade Química 1 Polaridade das ligações covalentes Dipolos moleculares Momento dipolar Ligações intermoleculares Polarizabilidade das moléculas Ligações secundárias e intermoleculares
IPT Sumário Electronegatividade Química 1 Polaridade das ligações covalentes Dipolos moleculares Momento dipolar Ligações intermoleculares Polarizabilidade das moléculas Ligações secundárias e intermoleculares
Prof. Willame Bezerra
 1. Os feromônios são compostos emitidos por animais para atrair outros da mesma espécie e sexo oposto. Um dos tipos de feromônios são os chamados atraentes sexuais de insetos, que facilitam sua reprodução.
1. Os feromônios são compostos emitidos por animais para atrair outros da mesma espécie e sexo oposto. Um dos tipos de feromônios são os chamados atraentes sexuais de insetos, que facilitam sua reprodução.
ANÁLISE DA VARIAÇÃO DA SOLUBILIDADE DE ALFA- TOCOFEROL COM A TEMPERATURA EM MISTURA ETANOL+ÁGUA
 ANÁLISE DA VARIAÇÃO DA SOLUBILIDADE DE ALFA- TOCOFEROL COM A TEMPERATURA EM MISTURA ETANOL+ÁGUA L. G. FONSECA 1, J. B. RODRIGUES 1, C. V. da SILVA 1 e R. A. MALAGONI 1 1 Universidade Federal de Uberlândia,
ANÁLISE DA VARIAÇÃO DA SOLUBILIDADE DE ALFA- TOCOFEROL COM A TEMPERATURA EM MISTURA ETANOL+ÁGUA L. G. FONSECA 1, J. B. RODRIGUES 1, C. V. da SILVA 1 e R. A. MALAGONI 1 1 Universidade Federal de Uberlândia,
30/03/2017 Química Licenciatura Prof. Udo Eckard Sinks SOLUÇÕES E SOLUBILIDADE
 SOLUÇÕES E SOLUBILIDADE 1. Objetivos Aprender a preparar soluções usando balão volumétrico Reconhecer soluções diluídas, saturadas e supersaturadas Observar a termodinâmica do processo de dissolução 2.
SOLUÇÕES E SOLUBILIDADE 1. Objetivos Aprender a preparar soluções usando balão volumétrico Reconhecer soluções diluídas, saturadas e supersaturadas Observar a termodinâmica do processo de dissolução 2.
Universidade Federal do Rio Grande do Norte Centro de Tecnologia Departamento de Engenharia Química Programa de Pós-Graduação em Engenharia Química
 Universidade Federal do Rio Grande do Norte Centro de Tecnologia Departamento de Engenharia Química Programa de Pós-Graduação em Engenharia Química TESE DE DOUTORADO DESENVOLVIMENTO DE SISTEMA DE ATOMIZAÇÃO
Universidade Federal do Rio Grande do Norte Centro de Tecnologia Departamento de Engenharia Química Programa de Pós-Graduação em Engenharia Química TESE DE DOUTORADO DESENVOLVIMENTO DE SISTEMA DE ATOMIZAÇÃO
H 2 C OCH 3 H 2 C OH EXERCÍCIOS DE CLASSE
 EXERCÍCIOS DE CLASSE 1- De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: COMPOSTO PESO MOLECULAR
EXERCÍCIOS DE CLASSE 1- De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: COMPOSTO PESO MOLECULAR
Figura 1. Variação da solubilidade dos compostos em função da temperatura. fonte: 2010, 2008, 2005, 2002 por P. W. Atkins e L. L. Jones.
 Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Aula 2 - Introdução à Bioquímica
 Aula 2 - Introdução à Bioquímica -Interações intermoleculares: interação eletrostática, interações de van der Waals -Solubilidade de compostos polares em água -Solubilidade de compostos apolares em água
Aula 2 - Introdução à Bioquímica -Interações intermoleculares: interação eletrostática, interações de van der Waals -Solubilidade de compostos polares em água -Solubilidade de compostos apolares em água
QUÍMICA. Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. Parte 1. Prof a.
 QUÍMICA Soluções: características, tipos de concentração, Parte 1 Prof a. Giselle Blois SOLUÇÃO As soluções são misturas homogêneas (que apresentam uma única fase) de duas ou mais substâncias, sendo que
QUÍMICA Soluções: características, tipos de concentração, Parte 1 Prof a. Giselle Blois SOLUÇÃO As soluções são misturas homogêneas (que apresentam uma única fase) de duas ou mais substâncias, sendo que
QUESTÕES DISSERTATIVAS - GABARITO RESOLVIDO
 Química Avaliação Bimestral 1 o ano Vivian março/ 2011 Nome: Turma: QUESTÕES DISSERTATIVAS - GABARITO RESOLVIDO Substância T. F. (ºC) T.E. (ºC) Densidade a 20ºC (g/cm 3 ) Solubilidade (g/100 g de água)
Química Avaliação Bimestral 1 o ano Vivian março/ 2011 Nome: Turma: QUESTÕES DISSERTATIVAS - GABARITO RESOLVIDO Substância T. F. (ºC) T.E. (ºC) Densidade a 20ºC (g/cm 3 ) Solubilidade (g/100 g de água)
Desenvolvimento de um sistema de aquecimento baseado em placa de Peltier para microdispositivos
 Desenvolvimento de um sistema de aquecimento baseado em placa de Peltier para microdispositivos G.B. SANCHEZ 1, H. S. SANTANA 1, D.S. TORTOLA 1 e O. P. TARANTO 1 1 Universidade Estadual de Campinas, Faculdade
Desenvolvimento de um sistema de aquecimento baseado em placa de Peltier para microdispositivos G.B. SANCHEZ 1, H. S. SANTANA 1, D.S. TORTOLA 1 e O. P. TARANTO 1 1 Universidade Estadual de Campinas, Faculdade
PAG Química Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é
 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
13/04/2017. Instrumentação/Características. Extração por Soxhlet Soxhlet extraction. Automatizado ou Soxtec. Automatizado ou Soxtec
 Instrumentação/Características Extração por Soxhlet Soxhlet extraction Extração com solvente resfriado Ausência de pressão Extração demorada (6 a 48h) Baixo poder de extração Grande volume extraído (diluição
Instrumentação/Características Extração por Soxhlet Soxhlet extraction Extração com solvente resfriado Ausência de pressão Extração demorada (6 a 48h) Baixo poder de extração Grande volume extraído (diluição
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS
 PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
FUVEST ª Fase (Questões 8 a 13)
 1ª Fase (Questões 8 a 13) 1. (Questão 8) Um funcionário de uma empresa ficou encarregado de remover resíduos de diferentes polímeros que estavam aderidos a diversas peças. Após alguma investigação, o funcionário
1ª Fase (Questões 8 a 13) 1. (Questão 8) Um funcionário de uma empresa ficou encarregado de remover resíduos de diferentes polímeros que estavam aderidos a diversas peças. Após alguma investigação, o funcionário
UTILIZAÇÃO DE MODELOS PARA CORRELACIONAR DADOS EXPERIMENTAIS DE SOLUBILIDADE DO FERTILIZANTE NITROGENADO UREIA EM MISTURAS HIDRO-ALCOÓLICAS
 UTILIZAÇÃO DE MODELOS PARA CORRELACIONAR DADOS EXPERIMENTAIS DE SOLUBILIDADE DO FERTILIZANTE NITROGENADO UREIA EM MISTURAS HIDRO-ALCOÓLICAS M.C. OLIVEIRA 1, A.P. SILVA 1, R.A. MALAGONI 1 1 Universidade
UTILIZAÇÃO DE MODELOS PARA CORRELACIONAR DADOS EXPERIMENTAIS DE SOLUBILIDADE DO FERTILIZANTE NITROGENADO UREIA EM MISTURAS HIDRO-ALCOÓLICAS M.C. OLIVEIRA 1, A.P. SILVA 1, R.A. MALAGONI 1 1 Universidade
ESTUDO DO COMPORTAMENTO DE FASES DE BLENDAS DE POLI(ETILENO-CO-ÁLCOOL VINÍLICO) E POLIMETACRILATOS
 ESTUDO DO COMPORTAMENTO DE FASES DE BLENDAS DE POLI(ETILENO-CO-ÁLCOOL VINÍLICO) E POLIMETACRILATOS Débora Nisiyama 1, Juliana A. de Lima, Maria I. Felisberti 3 * Instituto de Química, Universidade Estadual
ESTUDO DO COMPORTAMENTO DE FASES DE BLENDAS DE POLI(ETILENO-CO-ÁLCOOL VINÍLICO) E POLIMETACRILATOS Débora Nisiyama 1, Juliana A. de Lima, Maria I. Felisberti 3 * Instituto de Química, Universidade Estadual
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I
 Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
Aula: 03 Temática: Componentes Inorgânicos das Células Parte I As substâncias inorgânicas existem na natureza, independentemente dos seres vivos, mas algumas delas podem ser encontradas nas células. Acompanhe!
UNIVERSIDADE SALGADO DE OLIVEIRA Campus RECIFE. Curso: Engenharia de Produção Disciplina: Materiais para Produção Industrial
 UNIVERSIDADE SALGADO DE OLIVEIRA Campus RECIFE Curso: Disciplina: Aula 3 - Diagramas de Fases Por que estudar Diagramas de Fases? Uma das razões pelas quais o conhecimento e compreensão dos diagramas de
UNIVERSIDADE SALGADO DE OLIVEIRA Campus RECIFE Curso: Disciplina: Aula 3 - Diagramas de Fases Por que estudar Diagramas de Fases? Uma das razões pelas quais o conhecimento e compreensão dos diagramas de
Solventes. Armando Meyer NESC/UFRJ
 Armando Meyer NESC/UFRJ O que são? São substâncias químicas ou uma mistura líquida de substâncias químicas capazes de dissolver outro material de utilização industrial. Geralmente refere-se a compostos
Armando Meyer NESC/UFRJ O que são? São substâncias químicas ou uma mistura líquida de substâncias químicas capazes de dissolver outro material de utilização industrial. Geralmente refere-se a compostos
DETERMINAÇÃO DE DADOS EXPERIMENTAIS DE EQUILÍBRIO DE FASES À ALTA PRESSÃO DO SISTEMA DIÓXIDO DE CARBONO SUPERCRÍTICO + ETANOL + L- LACTÍDEO
 DETERMINAÇÃO DE DADOS EXPERIMENTAIS DE EQUILÍBRIO DE FASES À ALTA PRESSÃO DO SISTEMA DIÓXIDO DE CARBONO SUPERCRÍTICO + ETANOL + L- LACTÍDEO E. A. REBELATTO 1, J. P. BENDER 2, J. V. OLIVEIRA 1, M. LANZA
DETERMINAÇÃO DE DADOS EXPERIMENTAIS DE EQUILÍBRIO DE FASES À ALTA PRESSÃO DO SISTEMA DIÓXIDO DE CARBONO SUPERCRÍTICO + ETANOL + L- LACTÍDEO E. A. REBELATTO 1, J. P. BENDER 2, J. V. OLIVEIRA 1, M. LANZA
USO DE PLANEJAMENTO COMPOSTO CENTRAL NA AVALIAÇÃO DAS VARIÁVEIS TEMPERAURA E CONCENTRAÇÃO DE SOLVENTES NO ESTUDO DA SOLUBILIDADE DA UREIA
 USO DE PLANEJAMENTO COMPOSTO CENTRAL NA AVALIAÇÃO DAS VARIÁVEIS TEMPERAURA E CONCENTRAÇÃO DE SOLVENTES NO ESTUDO DA SOLUBILIDADE DA UREIA F. M. A. S. COSTA 1, A. P. SILVA 1, M. R. FRANCO JÚNIOR 1 e R.
USO DE PLANEJAMENTO COMPOSTO CENTRAL NA AVALIAÇÃO DAS VARIÁVEIS TEMPERAURA E CONCENTRAÇÃO DE SOLVENTES NO ESTUDO DA SOLUBILIDADE DA UREIA F. M. A. S. COSTA 1, A. P. SILVA 1, M. R. FRANCO JÚNIOR 1 e R.
Produção de nanofibras de policaprolactona/kmno 4 obtidas por eletrofiação
 https://eventos.utfpr.edu.br//sicite/sicite2017/index Produção de nanofibras de policaprolactona/kmno 4 obtidas por eletrofiação RESUMO Larissa Fernanda Quintino larif.q@live.com Universidade Tecnológica
https://eventos.utfpr.edu.br//sicite/sicite2017/index Produção de nanofibras de policaprolactona/kmno 4 obtidas por eletrofiação RESUMO Larissa Fernanda Quintino larif.q@live.com Universidade Tecnológica
Maria do Anjo Albuquerque
 ispersões na atmosfera Maria do Anjo Albuquerque Atmosfera A atmosfera é uma solução gasosa de vários gases (sobretudo oxigénio, dióxido de carbono e vapor de água) dispersos em azoto (componente maioritário);
ispersões na atmosfera Maria do Anjo Albuquerque Atmosfera A atmosfera é uma solução gasosa de vários gases (sobretudo oxigénio, dióxido de carbono e vapor de água) dispersos em azoto (componente maioritário);
DIAGRAMA DE FASES. 4) (ITA) Considere as seguintes afirmações relativas aos sistemas descritos a seguir, sob
 DIAGRAMA DE FASES 1) O gráfico abaixo apresenta a variação das pressões de vapor do sulfeto de carbono, metanol, etanol e água em função da temperatura. De acordo com o gráfico, assinale a afirmativa INCORRETA.
DIAGRAMA DE FASES 1) O gráfico abaixo apresenta a variação das pressões de vapor do sulfeto de carbono, metanol, etanol e água em função da temperatura. De acordo com o gráfico, assinale a afirmativa INCORRETA.
Etapa Analítica Tarefa
 Etapa Analítica Tarefa Tendo por base o artigo disponibilizado (Kano, E.K.; Serra, C.H.D.R.; Koono, E.E.M.; Fukuda, K.; Porta, V. An efficient HPLC-UV method for the quantitative determination of cefadroxil
Etapa Analítica Tarefa Tendo por base o artigo disponibilizado (Kano, E.K.; Serra, C.H.D.R.; Koono, E.E.M.; Fukuda, K.; Porta, V. An efficient HPLC-UV method for the quantitative determination of cefadroxil
Gabarito das Questões
 II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
II OLIMPÍADA BAIANA DE QUÍMICA 19 DE MAIO DE 2007 Gabarito das Questões Para cada questão de 1 a 5, marque com um X a alternativa correta e justifique porque as outras duas estão erradas. QUESTÃO 1 a)
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico
 PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
As ligações intermoleculares devem-se a forças de natureza eletrostática e explicam a coesão (ligação) entre moléculas.
 2.1.3 Ligações intermoleculares (com alterações no original) As ligações intermoleculares devem-se a forças de natureza eletrostática e explicam a coesão (ligação) entre moléculas. As ligações intermoleculares
2.1.3 Ligações intermoleculares (com alterações no original) As ligações intermoleculares devem-se a forças de natureza eletrostática e explicam a coesão (ligação) entre moléculas. As ligações intermoleculares
Escola Secundária / 3º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO. Ano de Escolaridade : 11
 Escola Secundária / 3º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO Ano de Escolaridade : 11 AL 2.5 Solubilidade: solutos e solventes Apesar da água
Escola Secundária / 3º CEB da Batalha ACTIVIDADE LABORATORIAL DE FÍSICA E QUÍMICA A FORMAÇÃO ESPECÍFICA ENSINO SECUNDÁRIO Ano de Escolaridade : 11 AL 2.5 Solubilidade: solutos e solventes Apesar da água
2 o CONGRESSO BRASILEIRO DE P&D EM PETRÓLEO & GÁS
 2 o CONGRESSO BRASILEIRO DE P&D EM PETRÓLEO & GÁS USO DA REFRATOMETRIA NA AVALIAÇÃO DE NÃO CONFORMIDADES DA GASOLINA TIPO C SANTOS, K. M ¹, ANDRADE, J. M. ², SEVERIANO, M. L. ³, MEDEIROS, M.A O 4, FERNANDES,
2 o CONGRESSO BRASILEIRO DE P&D EM PETRÓLEO & GÁS USO DA REFRATOMETRIA NA AVALIAÇÃO DE NÃO CONFORMIDADES DA GASOLINA TIPO C SANTOS, K. M ¹, ANDRADE, J. M. ², SEVERIANO, M. L. ³, MEDEIROS, M.A O 4, FERNANDES,
ABSORÇÃO DE ÁGUA EM FILMES DE GOMA GUAR RETICULADOS COM 1-ETIL-3-(3-DIMETILAMINOPROPIL) CARBODIIMIDA (EDC)
 ABSORÇÃO DE ÁGUA EM FILMES DE GOMA GUAR RETICULADOS COM 1-ETIL-3-(3-DIMETILAMINOPROPIL) CARBODIIMIDA (EDC) Rodrigo S. Banegas 1, Adriana de Melo 1, Valdir Soldi 1 1 Universidade Federal de Santa Catarina
ABSORÇÃO DE ÁGUA EM FILMES DE GOMA GUAR RETICULADOS COM 1-ETIL-3-(3-DIMETILAMINOPROPIL) CARBODIIMIDA (EDC) Rodrigo S. Banegas 1, Adriana de Melo 1, Valdir Soldi 1 1 Universidade Federal de Santa Catarina
LIGAÇÕES INTERMOLECULARES
 Chama-se ligações intermoleculares, ou forças intermoleculares, a forças atrativas entre moléculas ou átomos sem que haja partilha significativa de eletrões. As ligações intermoleculares devem-se a forças
Chama-se ligações intermoleculares, ou forças intermoleculares, a forças atrativas entre moléculas ou átomos sem que haja partilha significativa de eletrões. As ligações intermoleculares devem-se a forças
8 Apêndice Propriedades termofisicas de soluções aquosas
 Apêndice 89 8 Apêndice 8.1. Propriedades termofisicas de soluções aquosas São adicionados gráficos com as propriedades de soluções aquosas de propileno glicol, etileno glicol e etanol. As propriedades
Apêndice 89 8 Apêndice 8.1. Propriedades termofisicas de soluções aquosas São adicionados gráficos com as propriedades de soluções aquosas de propileno glicol, etileno glicol e etanol. As propriedades
Representações de probabilidade (ψ 2 ) ESTRUTURA MOLECULAR. Observar que orbitais são tridimensionais!! Fases dos orbitais
 Representações de probabilidade (ψ 2 ) ESTRUTURA MOLECULAR Observar que orbitais são tridimensionais!! Fases dos orbitais 1 TEORIA DO ORBITAL MOLECULAR LCAO: Linear Combination of Molecular Orbitals Exemplo
Representações de probabilidade (ψ 2 ) ESTRUTURA MOLECULAR Observar que orbitais são tridimensionais!! Fases dos orbitais 1 TEORIA DO ORBITAL MOLECULAR LCAO: Linear Combination of Molecular Orbitals Exemplo
Lista de Exercícios - Monitorias
 Monitoria de Química - 18/12 1) (UFRGS-2017) Observe a figura abaixo, sobre o perfil de energia de uma reação em fase gasosa. Considere as seguintes afirmações a respeito dessa reação. I - A posição de
Monitoria de Química - 18/12 1) (UFRGS-2017) Observe a figura abaixo, sobre o perfil de energia de uma reação em fase gasosa. Considere as seguintes afirmações a respeito dessa reação. I - A posição de
Solubilidade Solventes
 Solubilidade Solventes Definição São misturas homogêneas de duas ou mais substâncias. Terminologia e Generalidades Dissolver um sólido ou um líquido, em um líquido, é fazer com que aqueles "desapareçam"
Solubilidade Solventes Definição São misturas homogêneas de duas ou mais substâncias. Terminologia e Generalidades Dissolver um sólido ou um líquido, em um líquido, é fazer com que aqueles "desapareçam"
Diagramas de Fases. Universidade de São Paulo. Escola de Engenharia de São Carlos. Departamento de Engenharia de Materiais
 Universidade de São Paulo Escola de Engenharia de São Carlos Departamento de Engenharia de Materiais Diagramas de Fases Engenharia e Ciência dos Materiais I Prof. Dr. Cassius O.F.T. Ruchert Revisão: Prof.
Universidade de São Paulo Escola de Engenharia de São Carlos Departamento de Engenharia de Materiais Diagramas de Fases Engenharia e Ciência dos Materiais I Prof. Dr. Cassius O.F.T. Ruchert Revisão: Prof.
AULA PRÁTICA 05 Solubilidade: Misturas homogêneas e heterogêneas
 UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA PRÁTICAS DE QUÍMICA GERAL QB71J ROTEIRO DE AULA PRÁTICA AULA PRÁTICA 05 Solubilidade: Misturas homogêneas e heterogêneas
UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA PRÁTICAS DE QUÍMICA GERAL QB71J ROTEIRO DE AULA PRÁTICA AULA PRÁTICA 05 Solubilidade: Misturas homogêneas e heterogêneas
MATERIAIS POLIMÉRICOS COMO ELETRÓLITOS PARA CÉLULAS A COMBUSTÍVEL: GERAÇÃO DE ENERGIA A PARTIR DE FONTES RENOVÁVEIS
 EXATAS E DA TERRA MATERIAIS POLIMÉRICOS COMO ELETRÓLITOS PARA CÉLULAS A COMBUSTÍVEL: GERAÇÃO DE ENERGIA A PARTIR DE FONTES RENOVÁVEIS PAZ LOPEZ, Dennis Paul. Estudante do Curso de Engenharia de Energias
EXATAS E DA TERRA MATERIAIS POLIMÉRICOS COMO ELETRÓLITOS PARA CÉLULAS A COMBUSTÍVEL: GERAÇÃO DE ENERGIA A PARTIR DE FONTES RENOVÁVEIS PAZ LOPEZ, Dennis Paul. Estudante do Curso de Engenharia de Energias
COMPÓSITOS DE MATRIZ PDMS PREPARADOS COM TEOS POR IRRADIAÇÃO GAMA
 Encontro Nacional de Materiais e Estruturas Compósitas ENMEC2010 A. J. M. Ferreira (Editor) FEUP, Porto, 2010 COMPÓSITOS DE MATRIZ PDMS PREPARADOS COM TEOS POR IRRADIAÇÃO GAMA F.M.A. Margaça *, I.M. Miranda
Encontro Nacional de Materiais e Estruturas Compósitas ENMEC2010 A. J. M. Ferreira (Editor) FEUP, Porto, 2010 COMPÓSITOS DE MATRIZ PDMS PREPARADOS COM TEOS POR IRRADIAÇÃO GAMA F.M.A. Margaça *, I.M. Miranda
FCAV/UNESP. ASSUNTO: Forças Intermoleculares. Prof a. Dr a. Luciana Maria Saran
 FCAV/UNESP ASSUNTO: Forças Intermoleculares Prof a. Dr a. Luciana Maria Saran 1 2 FLUXOGRAMA PARA RECONHECER OS PRINCIPAIS TIPOS DE FORÇAS INTERMOLECULARES 3 ENERGIA TÍPICA REQUERIDA PARA O ROMPIMENTO
FCAV/UNESP ASSUNTO: Forças Intermoleculares Prof a. Dr a. Luciana Maria Saran 1 2 FLUXOGRAMA PARA RECONHECER OS PRINCIPAIS TIPOS DE FORÇAS INTERMOLECULARES 3 ENERGIA TÍPICA REQUERIDA PARA O ROMPIMENTO
PREPARAÇÃO DE NANOCOMPÓSITOS DE POLIESTIRENO INTERCALADOS EM MONTMORILONITA. Paulo S. R. C. da Silva, Maria I. B. Tavares.
 PREPARAÇÃO DE NANOCOMPÓSITOS DE POLIESTIRENO INTERCALADOS EM MONTMORILONITA Paulo S. R. C. da Silva, Maria I. B. Tavares. Instituto de Macromoléculas Eloísa Mano, Universidade Federal do Rio de Janeiro
PREPARAÇÃO DE NANOCOMPÓSITOS DE POLIESTIRENO INTERCALADOS EM MONTMORILONITA Paulo S. R. C. da Silva, Maria I. B. Tavares. Instituto de Macromoléculas Eloísa Mano, Universidade Federal do Rio de Janeiro
Disciplina: Química A
 Disciplina: Química A EXTENSIVO E TERCEIRÃO PÁGINA: 6 EXERCÍCIO: 28.01 O álcool apresenta interações por ligações de hidrogênio, enquanto o hidrocarboneto interage por forças de dipolo induzido, dessa
Disciplina: Química A EXTENSIVO E TERCEIRÃO PÁGINA: 6 EXERCÍCIO: 28.01 O álcool apresenta interações por ligações de hidrogênio, enquanto o hidrocarboneto interage por forças de dipolo induzido, dessa
Figura 1: Ilustração do processo de dissolução do NaCl em água.
 Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
ESTUDO DOS EFEITOS DOS PARÂMETROS DA NANOPRECIPITAÇÃO SOBRE O DIÂMETRO DE PARTÍCULA DE POLICAPROLACTONA (PCL) USANDO O PLANEJAMENTO PLACKETT-BURMAN
 ESTUDO DOS EFEITOS DOS PARÂMETROS DA NANOPRECIPITAÇÃO SOBRE O DIÂMETRO DE PARTÍCULA DE POLICAPROLACTONA (PCL) USANDO O PLANEJAMENTO PLACKETT-BURMAN A. A. C. Pereira 1,, E. M. B. D. de Sousa 1, I. S. Passos
ESTUDO DOS EFEITOS DOS PARÂMETROS DA NANOPRECIPITAÇÃO SOBRE O DIÂMETRO DE PARTÍCULA DE POLICAPROLACTONA (PCL) USANDO O PLANEJAMENTO PLACKETT-BURMAN A. A. C. Pereira 1,, E. M. B. D. de Sousa 1, I. S. Passos
Profa. Márcia A. Silva Spinacé
 1º Quadrimestre 2017 Profa. Márcia A. Silva Spinacé AULA 03 Natureza dos monômeros, Reações de polimerização, Polidispersidade. Primária: constituição química, ordenamento dos segmentos, Secundária: disposição
1º Quadrimestre 2017 Profa. Márcia A. Silva Spinacé AULA 03 Natureza dos monômeros, Reações de polimerização, Polidispersidade. Primária: constituição química, ordenamento dos segmentos, Secundária: disposição
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 30 de Junho de 2003 Versão 1
 Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
Proposta de resolução do Exame Nacional de Química do 12º ano Prova 142, 1ª chamada, 0 de Junho de 200 Versão 1 Grupo 1 1. A afirmação verdadeira é a (E). Estes dois elementos pertencem ao mesmo grupo
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA
 PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
T constante 0 1 X 1. líquido. Líquido + vapor. vapor X 1
 1 PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ - UTFPR DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA BACHARELADO EM QUÍMICA / LICENCIATURA
1 PR UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE TECNOLÓGICA FEDERAL DO PARANÁ - UTFPR DEPARTAMENTO ACADÊMICO DE QUÍMICA E BIOLOGIA BACHARELADO EM QUÍMICA / LICENCIATURA
Tensão Superficial e Molhamento
 Pós-Graduação em Ciência de Materiais Faculdade UnB - Planaltina Tensão Superficial e Molhamento Prof. Alex Fabiano C. Campos, Dr Tensão Superficial Tensão superficial O aumento da área interfacial eleva
Pós-Graduação em Ciência de Materiais Faculdade UnB - Planaltina Tensão Superficial e Molhamento Prof. Alex Fabiano C. Campos, Dr Tensão Superficial Tensão superficial O aumento da área interfacial eleva
Equilíbrio Químico (2)
 Equilíbrio Químico 1. Introdução Para a reação hipotética geral: aa + bb cc + dd (1) a constante de equilíbrio é dada pela expressão: K = a C c. a D d a A a. a B b (2) Se considerarmos que uma reação ocorra
Equilíbrio Químico 1. Introdução Para a reação hipotética geral: aa + bb cc + dd (1) a constante de equilíbrio é dada pela expressão: K = a C c. a D d a A a. a B b (2) Se considerarmos que uma reação ocorra
OBTENÇÃO E CARACTERIZAÇÃO DE BLENDAS DE POLI(m-FENILENO. SANTOS, Sandra Cruz dos; LOGUERCIO, Lara Fernandes; GARCIA, Irene Teresinha Santos 1 ;
 OBTENÇÃO E CARACTERIZAÇÃO DE BLENDAS DE POLI(m-FENILENO ISOFTALAMIDA) E POLI(p-CRESOLFORMALDEÍDO) SANTOS, Sandra Cruz dos; LOGUERCIO, Lara Fernandes; GARCIA, Irene Teresinha Santos 1 ; 1 Deptº de Química
OBTENÇÃO E CARACTERIZAÇÃO DE BLENDAS DE POLI(m-FENILENO ISOFTALAMIDA) E POLI(p-CRESOLFORMALDEÍDO) SANTOS, Sandra Cruz dos; LOGUERCIO, Lara Fernandes; GARCIA, Irene Teresinha Santos 1 ; 1 Deptº de Química
FORÇAS INTERMOLECULARES QUÍMICA GERAL
 FORÇAS INTERMOLECULARES QUÍMICA GERAL FORÇAS INTERMOLECULARES As forças intermoleculares, forças que existem entre as moléculas, contribuem em grande parte com as propriedades físicas apresentadas pelos
FORÇAS INTERMOLECULARES QUÍMICA GERAL FORÇAS INTERMOLECULARES As forças intermoleculares, forças que existem entre as moléculas, contribuem em grande parte com as propriedades físicas apresentadas pelos
LIBERAÇÃO DE ÁCIDO SALICÍLICO UTILIZANDO FILMES DE ACETATO DE CELULOSE EM SISTEMAS RESERVATÓRIO E MATRICIAL: EFEITO DO PLASTIFICANTE E NÃO-SOLVENTE.
 LIBERAÇÃO DE ÁCIDO SALICÍLICO UTILIZANDO FILMES DE ACETATO DE CELULOSE EM SISTEMAS RESERVATÓRIO E MATRICIAL: EFEITO DO PLASTIFICANTE E NÃO-SOLVENTE. Rodrigo Cercená 1 *, Larissa Andreani 2, Márcia M. Meier
LIBERAÇÃO DE ÁCIDO SALICÍLICO UTILIZANDO FILMES DE ACETATO DE CELULOSE EM SISTEMAS RESERVATÓRIO E MATRICIAL: EFEITO DO PLASTIFICANTE E NÃO-SOLVENTE. Rodrigo Cercená 1 *, Larissa Andreani 2, Márcia M. Meier
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES
 MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
Unidade São Judas Tadeu
 Unidade São Judas Tadeu Professor: Me. DIOGO LOPES Aluno (a): Ano: 9º Data: / / 2017. Lista de QUÍMICA Orientações: - A lista deverá ser respondida na própria folha impressa ou em folha de papel almaço.
Unidade São Judas Tadeu Professor: Me. DIOGO LOPES Aluno (a): Ano: 9º Data: / / 2017. Lista de QUÍMICA Orientações: - A lista deverá ser respondida na própria folha impressa ou em folha de papel almaço.
Álcool etílico. Alcoometria. Etanol. Expressão de concentrações. Expressão de concentrações. Álcool etílico
 Álcool etílico Alcoometria Também chamado de álcool, etanol e etano-1-ol. Obtido após fermentação de amido, açúcar (sacarose) e outros carboidratos: C6H12O6 2 C2H5OH + 2 CO2. Líquido límpido, incolor,
Álcool etílico Alcoometria Também chamado de álcool, etanol e etano-1-ol. Obtido após fermentação de amido, açúcar (sacarose) e outros carboidratos: C6H12O6 2 C2H5OH + 2 CO2. Líquido límpido, incolor,
