ESTRUTURA CRISTALINA DOS MATERIAIS CERÂMICOS
|
|
|
- Adelino Jardim Brezinski
- 7 Há anos
- Visualizações:
Transcrição
1 ESTRUTURA CRISTALINA DOS MATERIAIS CERÂMICOS PMT5783 Samuel M. Toffoli Antonio Carlos Vieira Coelho PMT EPUSP 2014
2 ESTRUTURA DOS MATERIAIS CERÂMICOS Referência Bibliográfica: Chiang, Y.-M.; Birnie, D.P.; Kingery, W.D. - Physical Ceramics Principles for Ceramic Science and Engineering, John Wiley & Sons, New York, Opção simples: L.H. Van Vlack Propriedades dos Materiais Cerâmicos Editora Edgard Blücher Ltda. e EDUSP, São Paulo, 1973 (Original: Physical Ceramics for Engineers, Addison Wesley Publ. Co., Reading, MA, 1964). Excelente opção (menos estruturas, mas mais extensivo) : W.D. Kingery, H.K. Bowen, D.R. Uhlmann Introduction to Ceramics, 2 nd Edition John Wiley & Sons, New York,
3 ESTRUTURA DOS MATERIAIS CERÂMICOS Considerações Iniciais as estruturas encontradas nos materiais cerâmicos são diferentes daquelas presentes nas outras classes de materiais, porque os materiais cerâmicos são compostos: Inorgânicos Contendo pelo menos dois e com muita frequência, mais elementos químicos Em aplicações tecnológicas podem ser usadas em uma variedade de morfologias: monolitos, pós finos, filmes finos ou espessos, fibras longas ou curtas Cada um desses pode ser um monocristal ou ser policristalino, ou ainda pode ser amorfo Podem ainda apresentar uma ou várias fases (pela quantidade de componentes, o número de fase presentes é geralmente maior do que o n de fases encontrado em sistemas exclusivamente metálicos) 3
4 ESTRUTURA DOS MATERIAIS CERÂMICOS Revisão Sólidos cristalinos e amorfos Estruturas cristalinas simples (CCC, CFC, HC) 4
5 Sólidos Cristalinos e Sólidos Amorfos Segundo a distribuição espacial dos átomos, moléculas ou íons, os materiais sólidos podem ser classificados em: Cristalinos: compostos por átomos, moléculas ou íons arranjados de uma forma periódica nas três dimensões. As posições ocupadas seguem uma ordenação que se repete para grandes distâncias atômicas (de longo alcance). Amorfos: compostos por átomos, moléculas ou íons que não apresentam uma ordenação de longo alcance. Podem, no entanto, apresentar ordenação de curto alcance. 5
6 Sólidos Cristalinos e Sólidos Amorfos Estruturas da sílica cristobalita vidro de sílica quartzo 6
7 Reticulado Cristalino Um cristal é constituído por motivos estruturais que se repetem regularmente. Esses motivos podem ser átomos, moléculas, íons, ou grupos de átomos, de moléculas ou de íons. Um reticulado cristalino é a figura formada, no espaço, pelos pontos que definem a localização desses motivos. O reticulado cristalino é, na realidade, um esqueleto abstrato da estrutura cristalina. 7
8 Reticulado Cristalino Cada ponto do reticulado determina a localização de um motivo estrutural (um átomo, íon, molécula ou grupo de átomos, íons ou moléculas). O reticulado é formado pelo conjunto de pontos. 8
9 Célula (Cela) Unitária A cela unitária é um paralelepípedo imaginário que constitui uma unidade fundamental com a qual se constrói todo o cristal somente por deslocamentos de translação (tal como os tijolos numa parede). 9
10 Célula (Cela) Unitária Halita 10
11 Célula (Cela) Unitária Sólido cristalino CFC Célula unitária representada por esferas rígidas Célula unitária de um reticulado cristalino. Qualquer ponto da célula unitária que for transladado de um múltiplo inteiro de parâmetros de rede ocupará uma posição equivalente em outra célula unitária. 11
12 Parâmetros de rede Geometricamente uma célula unitária pode ser representada por um paralelepípedo. A geometria da célula unitária é univocamente descrita em termos de seis parâmetros: o comprimento das três arestas do paralelepípedo (a, b, c) e os três ângulos entre as arestas (,, ). Esses parâmetros são chamados parâmetros de rede. 12
13 Reticulados de Bravais (c) 2003 Brooks/Cole Publishing / Thomson Learning 13
14 Resumo Sistemas Cristalinos 14
15 ...falando de estruturas cristalinas... Dado um composto, existe somente uma estrutura possível? Qual é a estrutura mais estável para um composto? 15
16 REGRAS DE PAULING As 5 Regras de Pauling ( em ordem decrescente de importância): PREMISSAS Baseadas na estabilidade geométrica do empacotamento de íons de diferentes tamanhos + estabilidade eletrostática. Íons são considerados esferas rígidas (uma simplificação). Raios iônicos mantêm-se constantes para uma mesma valência e mesmo número de coordenação (também uma simplificação). 16
17 REGRAS DE PAULING REGRA 1 Cada íon se coordenará com um poliedro de íons de carga oposta. Esse poliedro possuirá um número de íons determinado pela relação entre os tamanhos dos íons. Configurações estáveis são aquelas em que os íons menores (normalmente os cátions) têm dimensão similar ou ligeiramente maior do que os interstícios que devem ocupar na estrutura cristalina. 17
18 Número de Coordenação Coordenação Cúbica (NC=8) Coordenação Octaédrica (NC=6) x 0,732 x 0,414 18
19 Número de Coordenação Coordenação Tetraédrica (NC=4) Coordenação Triangular (NC=3) x 0,225 x 0,155 19
20 Número de Coordenação Coordenação Linear (NC=2) Exceções à Regra 1 não são difíceis de serem encontradas... átomos não são esferas rígidas neutralidade local (particularmente no caso de átomos muito grandes) x 0 tipo de ligação ligações covalentes e metálicas tendem a diminuir a distância interatômica 20
21 REGRAS DE PAULING REGRA 2 Numa estrutura cristalina estável, os poliedros de coordenação se arranjam nas três dimensões de forma a preservar a neutralidade de carga local. Contribuição de cada íon (e.v.) e.v. = z / NC A carga contrária que cada íon sente é igual (em módulo) à sua própria carga. r Na = 0,102nm r Cl = 0,181nm r Na /r Cl = 0,564 Regra 1: Coordenação Octaédrica Estrutura da Halita (NaCl) 21
22 REGRAS DE PAULING r Ca = 0,112nm r F = 0,131nm r Ca /r F = 0,855 Regra 1: Coordenação Cúbica Para preservar a neutralidade de carga local, como os íons tem valências diferentes, existem duas coordenações diferentes. Estrutura da Fluorita (CaF 2 ) 22
23 REGRAS DE PAULING Coordenação tetraédrica REGRA 3 Os poliedros de coordenação preferem, em ordem de estabilidade, compartilhar vértices a compartilhar arestas, e compartilhar aresta a compartilhar faces inteiras. Razão: aumento da distância entre cátions!! Coordenação octaédrica 23
24 REGRAS DE PAULING REGRA 4 A Regra 3 torna-se tanto mais importante quanto menor é o número de coordenação e mais elevada é a valência do íon menor (que geralmente é o cátion). Em cristais contendo diferentes cátions, aqueles com valência maior e menor número de coordenação tendem a não compartilhar poliedros com os outros, e, se isso ocorrer, as arestas dos poliedros se contraem (para concentrar carga negativa entre os cátions), e os cátions podem se deslocar de suas posições no centro dos poliedros na direção contrária à aresta ou face compartilhada (para minimizar a repulsão entre os cátions). 24
25 REGRAS DE PAULING REGRA 5 Estruturas simples são sempre preferidas em relação a estruturas mais complicadas (... keep it simple...). Por exemplo: Quando diferentes cátions de dimensões similares e de mesma valência estão presentes em um cristal, eles freqüentemente ocupam o mesmo tipo de sítio, porém distribuídos de forma aleatória, formando um tipo de solução sólida. No entanto, se esses diferentes cátions forem suficientemente distintos em dimensões e em valência, eles podem ocupar sítios com coordenações diferentes, aumentando a complexidade da estrutura. 25
26 Aplicação das Regras de Pauling Quem é o maior: cátion ou ânion? Se o ânion é o maior (o que é o mais comum), supõe-se um arranjo compacto de ânions (HC ou CFC), com os cátions ocupando sítios intersticiais. A relação entre os raios iônicos vai indicar quais serão as posições ocupadas as mais comuns são as tetraédricas e as octaédricas. 26
27 ESTRUTURAS CRISTALINAS MAIS COMUNS Grande parte dos compostos que formam as cerâmicas cristalizam-se em estruturas baseadas no empacotamento compacto de ao menos um dos elementos que os compõem (com o outro íon ocupando um conjunto específico de sítios intersticiais). Os empacotamentos: CFC (em inglês FCC ); HC (em inglês HCP ). OBS: as estruturas de cerâmicas com ligações altamente covalentes não são determinadas pelas regras de Pauling, mas sim pelas direções das ligações. 27
28 Empacotamento HC (HCP) Posições C 28
29 Empacotamento HC (HCP) Posições A Posições B Posições C 29
30 Empacotamento CFC (FCC) 30
31 Posições A Posições B Posições C 31
32 SAL DE ROCHA (NaCl) : baseado em CFC 32
33 SAL DE ROCHA (NaCl) : baseado em CFC Haletos Óxidos Sulfetos LiF, LiCl, LiBr, LiI, NaF, NaCl, NaBr, NaI, KF, KCl, KBr, KI, RbF, RbCl, RbBr, RbI MgO, CaO, SrO, BaO, NiO, CoO, MnO, PbO MgS, CaS, MnS, PbS, FeS 2 ( pirita ) Compostos baseados no empacotamento CFC posições octaédricas ocupadas; posições tetraédricas vazias 33
34 SAL DE ROCHA (NaCl): baseada em CFC Plano (110) da estrutura da halita 34
35 FLUORITA ( MX 2 ) E ANTI-FLUORITA ( M 2 X ) Compostos baseados no empacotamento CFC posições tetraédricas ocupadas; posições octaédricas vazias Fluorita (CaF 2 ): ânions nas posições tetraédricas, e cátions formando empacotamento CFC; Antifluorita: posições dos íons invertidas posições com coordenações diferentes. COMPOSTOS : Li 2 O, Na 2 O, K 2 O (antifluorita); ZrO 2, UO 2, CeO 2 (fluorita) Fluorita Antifluorita vazia CÁTION NC = 8 NC = 4 ÂNION NC = 4 NC = 8 ocupada (F) (Ca) 35
36 FLUORITA ( MX 2 ) E ANTI-FLUORITA ( M 2 X ) Plano (110) do ZrO 2 estrutura da fluorita 36
37 ESFALERITA (ZnS) Zincblende Esfalerita ou blenda, mineral, é o principal minério de zinco. Estrutura cúbica Cátions ocupam apenas a metade das posições tetraédricas cátions pequenos têm maior estabilidade em coordenação tetraédrica Cátions e ânions têm coordenação tetraédrica Tetraedros compartilham vértices COMPOSTOS: óxidos e sulfetos (ZnO, ZnS, BaO); SiC; compostos semicondutores III-V, de forte caráter covalente (GaAs, CdS, GaP, InSb) Derivativo da estrutura do diamante 37
38 ESFALERITA (Zincblende) Estrutura da esfalerita Estrutura do diamante 38
39 ESFALERITA (Zincblende) Projeção da cela no plano (c) 2003 Brooks/Cole Publishing / Thomson Learning 39
40 WURTZITA (também ZnS) Wurtzite Estrutura da Esfalerita (Cúbica) vazia EM AMBAS: Metade das posições tetraédricas ocupadas Coordenação dos íons igual a 4 ocupada Estrutura da Wurtzita (HC) Também é ZnS (mas pode ser FeS) 40
41 POLIMORFOS E POLITIPOS POLIMORFISMO : transformações entre as fases ocorrem simplesmente pelos deslocamentos de átomos (= displacive transformations). Fases polimorfas apresentam simetria cristalina diferente e diferentes distâncias interatômicas e interplanares, MAS fases polimorfas tem sempre a mesma coordenação de cátions e de ânions. Exemplos: Os três polimorfos da zircônia (ZrO 2 ): cúbica, tetragonal e monoclínica Quartzos low e high ; cristobalitas low e high. Obs: outras transformações de fases requerem quebra de ligações e rearranjo e são conhecidas como reconstructive transformations (ver à frente) 41
42 POLIMORFISMO Algumas características das Displacives Transformations (nem sempre todas são verificadas): A forma de alta temperatura ( high ) é a forma com estrutura mais aberta. A forma high tem maior volume específico A forma high tem maior capacidade calorífica e maior entropia A forma high tem maior simetria Como pode existir mais de uma forma de estrutura low (uma imagem de espelho da outra), transformações no resfriamento podem formar defeitos de macla ( twins ). formas low high 42
43 Exemplo: ZrO 2 Três polimorfos da zircônia Importância da zircônia: entre outros, uso em condutores iônicos de oxigênio para sensores de O 2 e células à combustível e como gema, substituindo o diamante. 43
44 POLIMORFOS E POLITIPOS Transformation toughening Transformação de tetragonal a monoclínico envolve expansão volumétrica de 4,7% 44
45 Transformation toughening Transformação de tetragonal a monoclínico envolve expansão volumétrica de 4,7% 45
46 POLITIPISMO Tipo especial de polimorfismo. Para que possam ocorrer as transformações entre as fases é necessária a quebra de ligações e rearranjos Reconstructive Transformation. Algumas das características das Reconstrutive Transformations : Necessidade de energia de ativação para quebra de ligações. Transformações lentas. Estruturas de alta temperatura podem ser mantidas em baixa temperatura sem que haja a reversão à forma termodinamicamente estável. 46
47 Reconstructive transformations podem se dar de diversas formas: Nucleação e crescimento no estado sólido. Vaporização condensação. Precipitação a partir de fase líquida na qual a fase instável tem maior solubilidade. Fornecimento de energia mecânica. Qualquer estratégia que permita que a barreira de energia da transformação seja suplantada facilita transformações reconstrutivas. 47
48 EXEMPLO : Polimorfos da Sílica 48
49 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS ALUMINA Al 2 O 3 Cela unitária do córindon ( -alumina), mostrando apenas as posições catiônicas 49
50 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS ALUMINA Al 2 O 3 Existem diversos polimorfos da alumina, sendo a forma alfa a mais comum e a única estável a partir de 1200 C. 50
51 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS ALUMINA Al 2 O 3 Geralmente, o monocristal de -alumina é chamado de safira, sendo também a base para o rubi (vermelho, por causa das impurezas de cromo) e para a safira azul (com impurezas de ferro e titânio). A dureza é 9, na escala de Mohs (diamante = 10) Monocristais de safira 51
52 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS RUTILO, TiO 2 Rutilo (um dos polimorfos do TiO 2, ao lado do anatásio e brookita) Estrutura HC com metade das posições de cátions preenchida Índice de refração altamente anisotrópico Grande poder de espalhamento de luz na forma de pó micrométrico Uso como opacificante em tintas e papéis. 52
53 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS ESPINÉLIO AB 2 O 4 Quando os cátions A e B são bivalentes e trivalentes (AO.B 2 O 3 ) Estrutura CFC com uma fração dos sítios tetraédricos e octaédricos preenchida Cela unitária representada por oito celas CFC de oxigênio 53
54 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS ESPINÉLIO AB 2 O 4 54
55 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS O membro do grupo mais comum e importante ESPINÉLIO AB 2 O 4 (encontrado em refratários cerâmicos, p.ex.): MgAl 2 O 4 Além desse, existem outros espinélios de alumínio (ex., ganita, ZnAl 2 O 4 ) e também outras famílias: Espinélios de ferro (ex., magnetita, Fe 3 O 4, ou seja, FeO.Fe 2 O 3, ou ainda, Fe 2+ Fe 3+ 2O 4 ) Espinélios de cromo (ex., cromita, FeCr 2 O 4, colorante verde para vidros) Etc. Espinélios de magnésio e alumínio (dureza Mohs = 8) ocorrem na forma de gemas, frequentemente vermelhas, brilhantes, e são muito confundidas com rubis (Al 2 O 3, dureza Mohs = 9), pela coloração e porque frequentemente ocorrem nas MgAl 2 O 4 mesmas regiões (mas podem ser incolores ou de várias outras cores) 55
56 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS PEROVSKITA ABO 3 Muitos compostos ternários que têm os cátions A e B de tamanhos muito diferentes cristalizam nessa estrutura Estrutura pode ser considerada como derivada de um CFC, com o cátion grande (A) e os oxigênios formando o retículo O cátion menor B ocupa um sítio octaédrico, rodeado apenas por oxigênios Exemplos: BaTiO 3, CaTiO 3, PbTiO 3, PbZrO 3, etc. Representa também a unidade estrutural parcial de supercondutores à base de cobre 56
57 EXEMPLOS DE ESTRUTURAS MAIS COMPLEXAS PEROVSKITA ABO 3 O Pb ou Ba (NC=12) Ti (NC=6) Distorção do retículo piezoeletricidade Constante Dielétrica: vácuo = 1; quartzo = 5; BaTiO 3 =
58 CERÂMICAS COVALENTES Muitas das estruturas mais duras, mais refratárias e mais tenazes dentre os materiais cerâmicos Exemplos: Nitretos Nitreto de silício (Si 3 N 4 ) Oxinitretos: soluções sólidas entre nitretos e óxidos (tais como os sialons, compostos do sistema Si-Al-O-N) Nitreto de boro (BN) Carbetos Etc. Carbeto de boro (B 4 C) Carbeto de silício e seus vários polimorfos (SiC) 58
59 CERÂMICAS COVALENTES NITRETOS Nitreto de silício (Si 3 N 4 ): três polimorfos, usado em ferramentas de corte, rolamentos, tubeiras de foguetes, partes de motores a combustão, rotores de turbo, etc. Decompõe a 1900 C. Fase difícil de obter. azuis = N ; cinza = Si trigonal -Si 3 N 4 hexagonal β-si 3 N 4 cubic γ-si 3 N 4 59
60 CERÂMICAS COVALENTES NITRETOS Nitreto de boro (BN): o polimorfo hexagonal (~grafite) é mole, mas o CBN (cubic boron nitride, estrutura da esfalerita) tem dureza próxima à do diamante) Hexagonal: grafite branco 60
61 CERÂMICAS COVALENTES CARBETOS Carbeto de boro (B 4 C): quase tão duro quanto o CBN, usado em veículos militares blindados, coletes à prova de bala, etc. A estrutura é complexa: icosaedros constituídos por 12 átomos de boro formam uma estrutura romboédrica, o centro da cela unitária contém um grupo C-B-C (o carbono é a esfera preta, a esfera verde e os icosaedros são boro) 61
62 CERÂMICAS COVALENTES CARBETOS Carbeto de silício (SiC): material muito duro (decompõe-se a 2730 C), usado em abrasivos, rebolos e ferramentas de corte há muito tempo: variedade industrial em produção desde 1893 (processo Acheson: areia + carvão em forno de arco), mas variedades mais puras e usadas em coletes à prova de balas, como elementos de aquecimento e, em eletrônica, como semicondutores para aplicações em alta temperatura / alta tensão, bem mais recentes. Politipo -SiC (~blenda de zinco) (porém, a variedade mais comum é a alfa, com estrutura hexagonal, ~wurtzita) 62
63 ANEXO - Características dos reticulados de Bravais - Densidades atômicas: Volumétrica No plano Linear
64 Sistema Cúbico a = b = c = = = 90 0 cúbico simples cúbico de corpo centrado (CCC) cúbico de faces centradas (CFC) Detalhes de reticulados de Bravais 64
65 Sistema Hexagonal a = b c = = 90 0 e = hexagonal Detalhes de reticulados de Bravais 65
66 Sistema Tetragonal a = b c = = = 90 0 tetragonal simples tetragonal de corpo centrado Detalhes de reticulados de Bravais 66
67 Sistema Romboédrico a = b = c = = 90 0 romboédrico (R) Detalhes de reticulados de Bravais 67
68 a b c Sistema Ortorrômbico = = = 90 0 ortorrômbico de corpo centrado ortorrômbico simples Detalhes de reticulados de Bravais ortorrômbico de faces centradas ortorrômbico de bases centradas 68
69 Sistema Monoclínico a b c = = 90 0 monoclínico simples monoclínico de bases centradas Detalhes de reticulados de Bravais 69
70 Sistema Triclínico a b c triclínico Detalhes de reticulados de Bravais 70
71 71 Fator de empacotamento atômico (FEA) célula átomos V V FEA 0,74 2) ( R R a R FEA CFC
72 Densidade Atômica Planar (DP) DP Área átomos no plano Área plano A C A P A P A C 2 AC AD (4R) 2R 2 8R 2 ( 2) R 2 cela unitária CFC Assim : DP A A C P 2 R 8R ,555 CFC plano (110) 72
73 Densidade Atômica Linear (DL) D L L L atomos linha L L A L L L aresta 4R 3 cela unitária CCC L A 2 R Assim : D L L L A L 3 R 2R 0,866 CCC direção [100] 73
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I
 SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I
 SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais. Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas
 Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
PMT Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
Estruturas baseadas na HC Wurtzita ZnS
 Estruturas baseadas na HC Wurtzita ZnS Baseada num arranjo HC dos ânions com metade dos interstícios tetraedrais ocupados por cátions O número de coordenação de cada íon é 4 Se somente a metade das posições
Estruturas baseadas na HC Wurtzita ZnS Baseada num arranjo HC dos ânions com metade dos interstícios tetraedrais ocupados por cátions O número de coordenação de cada íon é 4 Se somente a metade das posições
30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
 IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
ARRANJOS ATÔMICOS. Química Aplicada. Profº Vitor de Almeida Silva
 ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
Estrutura de cristais iônicos. Regras de Pauling
 Estrutura de cristais iônicos Regras de Pauling Estabilidade energética Por que os íons preferem ficar juntos, formando um cristal, do que moléculas isoladas? formar A Constante de Madelung é uma definição
Estrutura de cristais iônicos Regras de Pauling Estabilidade energética Por que os íons preferem ficar juntos, formando um cristal, do que moléculas isoladas? formar A Constante de Madelung é uma definição
ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 CMA CIÊNCIA DOS MATERIAIS 2º Semestre de 2014 Prof.
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 CMA CIÊNCIA DOS MATERIAIS 2º Semestre de 2014 Prof.
ESTRUTURA DOS SÓLIDOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
Fotografia de vários cristais de fluorita CaF 2 3-0
 Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
Sólidos iônicos. Química Geral. Prof. Edson Nossol
 Sólidos iônicos Química Geral Prof. Edson Nossol Uberlândia, 07/10/2016 Sólido cristalino: possui ordem a longa distância: átomos, moléculas ou íons ocupam posições específicas Sólido não-cristalino: não
Sólidos iônicos Química Geral Prof. Edson Nossol Uberlândia, 07/10/2016 Sólido cristalino: possui ordem a longa distância: átomos, moléculas ou íons ocupam posições específicas Sólido não-cristalino: não
Materiais Cerâmicos Estruturas Cristalinas. Conceitos Gerais
 Materiais Cerâmicos Estruturas Cristalinas Conceitos Gerais CHOCOLATE O chocolate, quando fica na geladeira costuma formar uma camada branca na superfície: O que você acha que pode ser? (a) Mofo? (b) Precipitados
Materiais Cerâmicos Estruturas Cristalinas Conceitos Gerais CHOCOLATE O chocolate, quando fica na geladeira costuma formar uma camada branca na superfície: O que você acha que pode ser? (a) Mofo? (b) Precipitados
ESTRUTURA DOS SÓLIDOS CRISTALINOS. Mestranda: Marindia Decol
 ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC. Estrutura Interna. Prof Karine P.
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC Estrutura Interna Prof Karine P. Naidek Estrutura Cristalina Os materiais sólidos podem ser classificados
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC Estrutura Interna Prof Karine P. Naidek Estrutura Cristalina Os materiais sólidos podem ser classificados
Professora: Daniela Becker Mestranda: Jéssica de Aguiar
 Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
Os materiais no estado sólido ocupam geralmente menos volume que no estado líquido (fundido).
 Instituto de Ciência e Tecnologia de Sorocaba Materiais e Reciclagem 3 Arranjo Atômico e Cristalografia Professor Sandro Donnini Mancini Sorocaba, Fevereiro de 2018. Os materiais no estado sólido ocupam
Instituto de Ciência e Tecnologia de Sorocaba Materiais e Reciclagem 3 Arranjo Atômico e Cristalografia Professor Sandro Donnini Mancini Sorocaba, Fevereiro de 2018. Os materiais no estado sólido ocupam
A4 Estrutura cristalina perfeição
 A4 Estrutura cristalina perfeição TEM Muitos dos materiais aplicados em engenharia têm estrutura cristalina: os átomos do material estão dispostos de modo regular e repetitivo Estrutura cristalina A célula
A4 Estrutura cristalina perfeição TEM Muitos dos materiais aplicados em engenharia têm estrutura cristalina: os átomos do material estão dispostos de modo regular e repetitivo Estrutura cristalina A célula
ESTRUTURA CRISTALINA DOS MATERIAIS CERÂMICOS
 ESTRUTURA CRISTALINA DOS MATERIAIS CERÂMICOS PMT5783 Antonio Carlos Vieira Coelho & Samuel M. Toffoli PMT EPUSP 2013 ESTRUTURA DOS MATERIAIS CERÂMICOS Referência Bibliográfica: Chiang, Y.-M.; Birnie, D.P.;
ESTRUTURA CRISTALINA DOS MATERIAIS CERÂMICOS PMT5783 Antonio Carlos Vieira Coelho & Samuel M. Toffoli PMT EPUSP 2013 ESTRUTURA DOS MATERIAIS CERÂMICOS Referência Bibliográfica: Chiang, Y.-M.; Birnie, D.P.;
Ciências dos materiais- 232
 1 Ciências dos materiais- 232 2 a aula - Ligações químicas - Estruturas Cristalinas Quinta Quinzenal Semana par 10/03/2015 1 Professor: Luis Gustavo Sigward Ericsson Curso: Engenharia Mecânica Série: 5º/
1 Ciências dos materiais- 232 2 a aula - Ligações químicas - Estruturas Cristalinas Quinta Quinzenal Semana par 10/03/2015 1 Professor: Luis Gustavo Sigward Ericsson Curso: Engenharia Mecânica Série: 5º/
Introdução a Engenharia e Ciência dos Materiais
 Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
estrutura atômica cristalino
 Aula 0b estrutura atômica cristalina ZEA 1038 Ciência e Tecnologia dos Materiais Prof. João Adriano Rossignolo Profa. Eliria M.J.A. Pallone estrutura atômica cristalino 1 CRISTAL ESTRUTURA CRISTALINA Muitos
Aula 0b estrutura atômica cristalina ZEA 1038 Ciência e Tecnologia dos Materiais Prof. João Adriano Rossignolo Profa. Eliria M.J.A. Pallone estrutura atômica cristalino 1 CRISTAL ESTRUTURA CRISTALINA Muitos
Estrutura Cristalina dos Sólidos (Arranjos Atômicos)
 Estrutura Cristalina dos Sólidos (Arranjos Atômicos) INTRODUÇÃO As propriedades dos materiais dependem dos arranjos dos seus átomos. Esses arranjos podem ser classificados em: Estruturas moleculares: agrupamento
Estrutura Cristalina dos Sólidos (Arranjos Atômicos) INTRODUÇÃO As propriedades dos materiais dependem dos arranjos dos seus átomos. Esses arranjos podem ser classificados em: Estruturas moleculares: agrupamento
ORDEM. Periocidade. SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico de átomos, moléculas ou iões, formando uma estrutura cristalina regular
 Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
COMPOSTOS IÓNICOS A-B
 COMPOSTOS IÓNICOS AB B (baixa E i, logo baixa χ) B B A (alta E i, logo alta χ) 1s 1 Hidrogénio i Metalóides 1s 2 1s 2 Metais alcalinos Não metais 1s 2 2s 1 1s 2 2s 2 Metais alcalino terrosos Gases raros
COMPOSTOS IÓNICOS AB B (baixa E i, logo baixa χ) B B A (alta E i, logo alta χ) 1s 1 Hidrogénio i Metalóides 1s 2 1s 2 Metais alcalinos Não metais 1s 2 2s 1 1s 2 2s 2 Metais alcalino terrosos Gases raros
FCM 208 Física (Arquitetura)
 Universidade de São Paulo Instituto de Física de São Carlos - IFSC FCM 208 Física (Arquitetura) Estruturas e constituintes da Materia Prof. Dr. José Pedro Donoso Classificação dos Materiais Metais : São
Universidade de São Paulo Instituto de Física de São Carlos - IFSC FCM 208 Física (Arquitetura) Estruturas e constituintes da Materia Prof. Dr. José Pedro Donoso Classificação dos Materiais Metais : São
LIGAÇÃO IÔNICA Resulta da atração eletrostática de íons com cargas opostas
 LIGAÇÃO IÔNICA Resulta da atração eletrostática de íons com cargas opostas NaCl(s) tem energia menor do que os átomos gasosos isolados Na(g) e Cl(g) 3 etapas hipotéticas: kj/mol 1) Na (g) Na + (g) + e
LIGAÇÃO IÔNICA Resulta da atração eletrostática de íons com cargas opostas NaCl(s) tem energia menor do que os átomos gasosos isolados Na(g) e Cl(g) 3 etapas hipotéticas: kj/mol 1) Na (g) Na + (g) + e
LISTA DE EXERCÍCIOS 6 1 (UNIDADE III INTRODUÇÃO À CIÊNCIA DOS MATERIAIS)
 UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
SOLIDOS CRISTALINOS. Conceitos Gerais
 SOLIDOS CRISTALINOS Conceitos Gerais CAPA Liga de Magnésio CAPA ligas de magnésio O sistema da ASTM estabelece que as ligas de magnésio, divididas em fundidas e trabalhadas, são designadas por um conjunto
SOLIDOS CRISTALINOS Conceitos Gerais CAPA Liga de Magnésio CAPA ligas de magnésio O sistema da ASTM estabelece que as ligas de magnésio, divididas em fundidas e trabalhadas, são designadas por um conjunto
Estrutur Es a trutur e Propriedades Pr dos materiais cerâmicos
 Estrutura e Propriedades dos materiais cerâmicos Fator de Empacotamento Atômico: FEA R a atoms unit cell FEA = 0,68 APF = Close-packed directions: length = 4R = 3 a Unit cell contains: 1 + 8 x 1/8 = 2
Estrutura e Propriedades dos materiais cerâmicos Fator de Empacotamento Atômico: FEA R a atoms unit cell FEA = 0,68 APF = Close-packed directions: length = 4R = 3 a Unit cell contains: 1 + 8 x 1/8 = 2
Estrutura de Sólidos Cristalinos. Profa. Dra Daniela Becker
 Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
Ciência dos Materiais Estrutura Cristalina Difração de raios X. Professora: Maria Ismenia Sodero
 Ciência dos Materiais Estrutura Cristalina Difração de raios X Professora: Maria Ismenia Sodero maria.ismenia@usp.br Assuntos abordados Coordenação atômica Arranjo das estruturas sólidas: cristalinos ou
Ciência dos Materiais Estrutura Cristalina Difração de raios X Professora: Maria Ismenia Sodero maria.ismenia@usp.br Assuntos abordados Coordenação atômica Arranjo das estruturas sólidas: cristalinos ou
Ligações químicas e estrutura dos materiais
 Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Física dos Materiais FMT0502 ( )
 Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Estruturas Cristalinas Comuns em Cerâmicas
 Estruturas Cristalinas Comuns em Cerâmicas Prof. Dr. Ubirajara Pereira Rodrigues Filho Ligações Químicas em Cerâmicas Predominatemente Covalentes BN Predominantemente Iônicas BeO Geralmente, sólidos iônicos
Estruturas Cristalinas Comuns em Cerâmicas Prof. Dr. Ubirajara Pereira Rodrigues Filho Ligações Químicas em Cerâmicas Predominatemente Covalentes BN Predominantemente Iônicas BeO Geralmente, sólidos iônicos
Aula 6: Estrutura Cristalina dos Metais
 Aula 6: Estrutura Cristalina dos Metais - Como a ligação metálica é não-direcional, não há restrições quanto ao número e posições dos vizinhos mais próximos. - A estrutura cristalina dos metais têm um
Aula 6: Estrutura Cristalina dos Metais - Como a ligação metálica é não-direcional, não há restrições quanto ao número e posições dos vizinhos mais próximos. - A estrutura cristalina dos metais têm um
Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid
 Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid Introdução: Diversas propriedades dos sólidos estão relacionadas à Estrutura Cristalina. Não somente
Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid Introdução: Diversas propriedades dos sólidos estão relacionadas à Estrutura Cristalina. Não somente
UNIVERSIDADE FEDERAL DO ABC BC-1105: MATERIAIS E SUAS PROPRIEDADES
 UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES Estrutura Cristalina - direções e planos cristalográficos - alotropia
UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES Estrutura Cristalina - direções e planos cristalográficos - alotropia
Materiais cerâmicos. Introdução. Princípios gerais. Estruturas cristalinas. J. D. Santos, FEUP
 Materiais cerâmicos Introdução. Princípios gerais. Estruturas cristalinas. J. D. Santos, FEUP jdsantos@fe.up.pt Ligação química Typical elements in Ceramics 2 Ligação química 3 Conceitos básicos Definição
Materiais cerâmicos Introdução. Princípios gerais. Estruturas cristalinas. J. D. Santos, FEUP jdsantos@fe.up.pt Ligação química Typical elements in Ceramics 2 Ligação química 3 Conceitos básicos Definição
ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 Parte II
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
PROPRIEDADES DOS SÓLIDOS ESTRUTURA E TIPO DE LIGAÇÕES
 PROPRIEDADES DOS SÓLIDOS ESTRUTURA E TIPO DE LIGAÇÕES 1 REPRESENTAÇÃO Diferentes estados da matéria gás pouca ordem, movimentos rápidos. Sólido cristalino altamente ordenado líquido polar mais ordenado,
PROPRIEDADES DOS SÓLIDOS ESTRUTURA E TIPO DE LIGAÇÕES 1 REPRESENTAÇÃO Diferentes estados da matéria gás pouca ordem, movimentos rápidos. Sólido cristalino altamente ordenado líquido polar mais ordenado,
TP064 - CIÊNCIA DOS MATERIAIS PARA EP. FABIANO OSCAR DROZDA
 TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
 Ligações Químicas Por que os átomos formam ligações químicas? Distância de equilíbrio Comprimento da ligação H-H r o = 74 pm distância internuclear Uma ligação química entre dois átomos é formada se
Ligações Químicas Por que os átomos formam ligações químicas? Distância de equilíbrio Comprimento da ligação H-H r o = 74 pm distância internuclear Uma ligação química entre dois átomos é formada se
Volume e forma - não são tão fixos como na teoria. Os sólidos sofrem dilatação com o aumento da temperatura, embora outros se contraem.
 Roberto Márcio Assinado de forma digital por Roberto Márcio DN: CN = Roberto Márcio, C = BR, O = Área 1, OU = Faculdade de Ciência e Tecnologia Motivo: Sou o autor deste documento Dados: 2004.08.10 21:56:32-03'00'
Roberto Márcio Assinado de forma digital por Roberto Márcio DN: CN = Roberto Márcio, C = BR, O = Área 1, OU = Faculdade de Ciência e Tecnologia Motivo: Sou o autor deste documento Dados: 2004.08.10 21:56:32-03'00'
Física do Estado Sólido
 Física do Estado Sólido 2003-2004 Folha 3 - Estruturas cristalinas. Indique a rede subjacente aos desenhos da fig.. Encontre três conjuntos distintos de vectores fundamentais primitivos para cada um dos
Física do Estado Sólido 2003-2004 Folha 3 - Estruturas cristalinas. Indique a rede subjacente aos desenhos da fig.. Encontre três conjuntos distintos de vectores fundamentais primitivos para cada um dos
CAP.13 MATERIAIS CERÂMICOS
 CAP.13 MATERIAIS CERÂMICOS Smith cap 10 13. 1 13. 2 MATERIAIS CERÂMICOS São materiais inorgânicos não metálicos. Constituídos por elementos metálicos e nãometálicos, ligados quimicamente entre si. Ligações:
CAP.13 MATERIAIS CERÂMICOS Smith cap 10 13. 1 13. 2 MATERIAIS CERÂMICOS São materiais inorgânicos não metálicos. Constituídos por elementos metálicos e nãometálicos, ligados quimicamente entre si. Ligações:
Estruturas cristalinas - Reticulado cristalino
 Página 1 de 9 MENU PRINCIPAL CONTEUDO TÉCNICO DOWNLOAD CONTATO ENTRETENIMENTO LOGIN search.... Home PAINEL Ciência dos Materiais Estruturas cristalinas - Reticulado cristalino Estruturas cristalinas -
Página 1 de 9 MENU PRINCIPAL CONTEUDO TÉCNICO DOWNLOAD CONTATO ENTRETENIMENTO LOGIN search.... Home PAINEL Ciência dos Materiais Estruturas cristalinas - Reticulado cristalino Estruturas cristalinas -
MATERIAIS CERÂMICOS E POLIMÉRICOS
 MATERIAIS CERÂMICOS E POLIMÉRICOS Curso: Engenharia Mecânica - Terceiro Semestre Letivo Período: Primeiro Semestre 2010 Carga Horária: 60 horas Docente: Prof. Dr. Wagner M. Pachekoski MATERIAIS CERÂMICOS:
MATERIAIS CERÂMICOS E POLIMÉRICOS Curso: Engenharia Mecânica - Terceiro Semestre Letivo Período: Primeiro Semestre 2010 Carga Horária: 60 horas Docente: Prof. Dr. Wagner M. Pachekoski MATERIAIS CERÂMICOS:
MATERIAIS CERÂMICOS. Curso: Engenharia de Produção / Engenharia Civil 1. ESTRUTURAS E PROPRIEDADES DE CERÂMICAS
 Curso: Engenharia de Produção / Engenharia Civil MATERIAIS CERÂMICOS 1. ESTRUTURAS E PROPRIEDADES DE CERÂMICAS Materiais cerâmicos são materiais inorgânicos e não-metálicos. A maioria dos materiais cerâmicos
Curso: Engenharia de Produção / Engenharia Civil MATERIAIS CERÂMICOS 1. ESTRUTURAS E PROPRIEDADES DE CERÂMICAS Materiais cerâmicos são materiais inorgânicos e não-metálicos. A maioria dos materiais cerâmicos
GEOLOGIA. Professor: Adilson Soares Site:
 GEOLOGIA Professor: Adilson Soares E-mail: adilson.soares@unifesp.br Site: www.geologia.wiki.br Minerais e Rochas 1. Minerais e Rochas - conceito - propriedades dos minerais - tipos de rochas - ciclo das
GEOLOGIA Professor: Adilson Soares E-mail: adilson.soares@unifesp.br Site: www.geologia.wiki.br Minerais e Rochas 1. Minerais e Rochas - conceito - propriedades dos minerais - tipos de rochas - ciclo das
Centro Universitário da Fundação Educacional de Barretos. Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida
 Centro Universitário da Fundação Educacional de Barretos Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida Porque estudar estrutura atômica? Ligação atômica e as propriedades dos materiais
Centro Universitário da Fundação Educacional de Barretos Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida Porque estudar estrutura atômica? Ligação atômica e as propriedades dos materiais
FÍSICA DA MATÉRIA CONDENSADA 2009/10 Folha 1 I Redes e Estruturas Cristalinas
 FÍSICA DA MATÉRIA CONDENSADA 2009/10 Folha 1 I Redes e Estruturas Cristalinas 1 - Indicar a rede subjacente aos desenhos das figuras la) e lb). Encontrar três conjuntos de vectores fundamentais primitivos
FÍSICA DA MATÉRIA CONDENSADA 2009/10 Folha 1 I Redes e Estruturas Cristalinas 1 - Indicar a rede subjacente aos desenhos das figuras la) e lb). Encontrar três conjuntos de vectores fundamentais primitivos
Estrutura Cristalina
 Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
Sólidos. Prof. Fernando R. Xavier
 Sólidos Prof. Fernando R. Xavier UDESC 2015 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Sólidos Prof. Fernando R. Xavier UDESC 2015 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Materiais de Engenharia Michel Ashby e David Jones Copyright Elsevier, 2018
 Lista de Exercícios Por Prof. Pedro Nascente (Revisor Técnico) 1. Considere um fio de uma liga de níquel com 5 m de comprimento e diâmetro de 0,75 mm. Os valores do módulo de Young e do coeficiente de
Lista de Exercícios Por Prof. Pedro Nascente (Revisor Técnico) 1. Considere um fio de uma liga de níquel com 5 m de comprimento e diâmetro de 0,75 mm. Os valores do módulo de Young e do coeficiente de
Teoria das Bandas. Energia de Coesão e Propriedades. Grau de preenchimento da banda vs. Ordem de ligação
 Sumário 13 Metais 1 Teoria das Bandas. Energia de Coesão e Propriedades Hidrogénio metálico TOM/CLOA aplicada aos metais Energia de coesão vs. Energia de ligação Grau de preenchimento da banda vs. Ordem
Sumário 13 Metais 1 Teoria das Bandas. Energia de Coesão e Propriedades Hidrogénio metálico TOM/CLOA aplicada aos metais Energia de coesão vs. Energia de ligação Grau de preenchimento da banda vs. Ordem
Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid
 Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid Introdução Os sólidos contém inúmeras imperfeições nas estruturas cristalinas e muitas propriedades são alteradas
Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid Introdução Os sólidos contém inúmeras imperfeições nas estruturas cristalinas e muitas propriedades são alteradas
Estruturas dos Materiais
 Sumário Conceitos 1 Constituição de um átomo.......................... 1 Propriedade dos átomos........................... 1 Ligações químicas 2 Ligações Primárias............................... 2 Ligação
Sumário Conceitos 1 Constituição de um átomo.......................... 1 Propriedade dos átomos........................... 1 Ligações químicas 2 Ligações Primárias............................... 2 Ligação
Sólidos iônicos. Classificações de solidos iônicos pela razão radial razão radial = raio do íon menor dividido pelo raio do íon maior
 Sólidos iônicos Sólidos iônicos são construídos pela atração mútua de cátions a ânions. Sólidos reticulares consistem de átomos ligados aos seus vizinhos covalentemente através da extensão do sólido. Sólidos
Sólidos iônicos Sólidos iônicos são construídos pela atração mútua de cátions a ânions. Sólidos reticulares consistem de átomos ligados aos seus vizinhos covalentemente através da extensão do sólido. Sólidos
ESTADO SÓLIDO. paginapessoal.utfpr.edu.br/lorainejacobs. Profª. Loraine Jacobs
 ESTADO SÓLIDO lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª. Loraine Jacobs Estado Sólido Tradicionalmente, um sólido é definido como uma substância que mantém um volume e uma
ESTADO SÓLIDO lorainejacobs@utfpr.edu.br paginapessoal.utfpr.edu.br/lorainejacobs Profª. Loraine Jacobs Estado Sólido Tradicionalmente, um sólido é definido como uma substância que mantém um volume e uma
GMG 106 Cristalografia Fundamental. Polimorfos. Adriana Alves
 GMG 106 Cristalografia Fundamental Polimorfos Adriana Alves A partir das observações iniciais eu Pertita Plagioclásio zonado Estruturas minerais Da definição tem- se que minerais possuem arranjo atômico
GMG 106 Cristalografia Fundamental Polimorfos Adriana Alves A partir das observações iniciais eu Pertita Plagioclásio zonado Estruturas minerais Da definição tem- se que minerais possuem arranjo atômico
Defeitos em Cristais Iônicos. Prof Ubirajara Pereira Rodrigues Filho
 Defeitos em Cristais Iônicos Prof Ubirajara Pereira Rodrigues Filho Defeitos Os defeitos perturbam a ordem a longa distância da rede cristalina e afetam as propriedades dos compostos cristalinos que dependem
Defeitos em Cristais Iônicos Prof Ubirajara Pereira Rodrigues Filho Defeitos Os defeitos perturbam a ordem a longa distância da rede cristalina e afetam as propriedades dos compostos cristalinos que dependem
Ligação metálica corrente elétrica
 Ligações Metálicas Ligação metálica É o tipo de ligação que ocorre entre os átomos de metais. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada.
Ligações Metálicas Ligação metálica É o tipo de ligação que ocorre entre os átomos de metais. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada.
Capítulo 1 - Cristais
 1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
Ideias e Conceitos Iniciais. CF086 - Introdução a Física do Estado Sólido 1
 Ideias e Conceitos Iniciais CF086 - Introdução a Física do Estado Sólido 1 Introdução O estudo de matéria condensada investiga propriedades de sólidos em geral. Tais propriedades emergem por causa do comportamento
Ideias e Conceitos Iniciais CF086 - Introdução a Física do Estado Sólido 1 Introdução O estudo de matéria condensada investiga propriedades de sólidos em geral. Tais propriedades emergem por causa do comportamento
Ciência dos Materiais Lista de Exercícios II - Estrutura dos Sólidos Cristalinos
 1. Qual a diferença entre estrutura atômica e estrutura cristalina? 2. Considere os sistemas cristalinos (a) Cúbico Simples (CS), (b) Cúbico de Faces Centradas (CFC) e (c) Cúbico de Corpo Centrado (CCC).
1. Qual a diferença entre estrutura atômica e estrutura cristalina? 2. Considere os sistemas cristalinos (a) Cúbico Simples (CS), (b) Cúbico de Faces Centradas (CFC) e (c) Cúbico de Corpo Centrado (CCC).
Universidade Estadual de Ponta Grossa Departamento de Engenharia de Materiais Disciplina: Ciência dos Materiais 1. Estruturas dos sólidos cristalinos
 Universidade Estadual de Ponta Grossa Departamento de Engenharia de Materiais Disciplina: Ciência dos Materiais 1 Estruturas dos sólidos cristalinos 1º semestre / 2016 Estruturas dos sólidos cristalinos
Universidade Estadual de Ponta Grossa Departamento de Engenharia de Materiais Disciplina: Ciência dos Materiais 1 Estruturas dos sólidos cristalinos 1º semestre / 2016 Estruturas dos sólidos cristalinos
MATERIAIS CERÂMICOS Características Gerais
 MATERIAIS CERÂMICOS Cubo de sílica de isolamento térmico. O interior do cubo está a 1250ºC e pode ser manuseado sem protecção. Usada no isolamento térmico do Space Shuttle MATERIAIS CERÂMICOS Características
MATERIAIS CERÂMICOS Cubo de sílica de isolamento térmico. O interior do cubo está a 1250ºC e pode ser manuseado sem protecção. Usada no isolamento térmico do Space Shuttle MATERIAIS CERÂMICOS Características
Defeitos cristalinos. (monocristais) Ponto. Superfície
 [7] Defeitos cristalinos 1> Ligações atômicas propriedades resistência teórica (monocristais) causa da discrepância > resistência experimental defeitos cristalinos Ponto Defeitos cristalinos Linha Superfície
[7] Defeitos cristalinos 1> Ligações atômicas propriedades resistência teórica (monocristais) causa da discrepância > resistência experimental defeitos cristalinos Ponto Defeitos cristalinos Linha Superfície
Sólidos. Prof. Fernando R. Xavier
 Sólidos Prof. Fernando R. Xavier UDESC 2013 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Sólidos Prof. Fernando R. Xavier UDESC 2013 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Física da Matéria Condensada
 Física da Matéria Condensada II Redes e estruturas cristalinas 1. Indique a rede subjacente aos desenhos das figuras 1 e 2. Encontre três conjuntos de vectores fundamentais primitivos para a fig. 1 e dois
Física da Matéria Condensada II Redes e estruturas cristalinas 1. Indique a rede subjacente aos desenhos das figuras 1 e 2. Encontre três conjuntos de vectores fundamentais primitivos para a fig. 1 e dois
Informações estruturais de compostos iônicos. Arranjos entre os íons dos compostos iônicos.
 Arranjos entre os íons dos compostos iônicos. a Tendências gerais para os raios iônicos na tabela periódica: 1- Os raios iônicos aumentam para baixo em um grupo (coluna) na T.P. 2- Os raios dos íons de
Arranjos entre os íons dos compostos iônicos. a Tendências gerais para os raios iônicos na tabela periódica: 1- Os raios iônicos aumentam para baixo em um grupo (coluna) na T.P. 2- Os raios dos íons de
4- IMPERFEIÇÕES CRISTALINAS
 ASSUNTO 4- IMPERFEIÇÕES CRISTALINAS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) Eleani Maria da Costa
ASSUNTO 4- IMPERFEIÇÕES CRISTALINAS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) Eleani Maria da Costa
CMS-301 Física do Estado sólido
 CMS-301 Física do Estado sólido Engenharia e Tecnologia Espaciais ETE Ciência e Tecnologia de Materiais e Sensores 07.10.2008 L.F.Perondi Engenharia e Tecnologia Espaciais ETE Ciência e Tecnologia de Materiais
CMS-301 Física do Estado sólido Engenharia e Tecnologia Espaciais ETE Ciência e Tecnologia de Materiais e Sensores 07.10.2008 L.F.Perondi Engenharia e Tecnologia Espaciais ETE Ciência e Tecnologia de Materiais
Célula Unitária e 14 Retículos de Bravais
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Química e Física Molecular Célula Unitária e 14 Retículos de Bravais SQM 409 - Cristalografia Prof. Dr. Maria Teresa do Prado
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Química e Física Molecular Célula Unitária e 14 Retículos de Bravais SQM 409 - Cristalografia Prof. Dr. Maria Teresa do Prado
A Dualidade Onda-Partícula
 A Dualidade Onda-Partícula O fato de que as ondas têm propriedades de partículas e viceversa se chama Dualidade Onda-Partícula. Todos os objetos (macroscópicos também!) são onda e partícula ao mesmo tempo.
A Dualidade Onda-Partícula O fato de que as ondas têm propriedades de partículas e viceversa se chama Dualidade Onda-Partícula. Todos os objetos (macroscópicos também!) são onda e partícula ao mesmo tempo.
Ciência dos materiais Aula 3. Profª Mª Patrícia Cristina Costa Ladeira
 Ciência dos materiais Aula 3 Profª Mª Patrícia Cristina Costa Ladeira patricia.ladeira@educadores.net.br patricia.ladeira@yahoo.com.br Recapitulando 2 Na Unidade 1 nós vimos: Aspectos históricos da Ciência
Ciência dos materiais Aula 3 Profª Mª Patrícia Cristina Costa Ladeira patricia.ladeira@educadores.net.br patricia.ladeira@yahoo.com.br Recapitulando 2 Na Unidade 1 nós vimos: Aspectos históricos da Ciência
Sólidos: Estudo de Estruturas Cristalinas
 UnB - Universidade de Brasília IQD - Instituto de Química Curso de Graduação Disciplina: Química Inorgânica 1 Experimental (Código 114073) Sólidos: Estudo de Estruturas Cristalinas A estrutura dos materiais
UnB - Universidade de Brasília IQD - Instituto de Química Curso de Graduação Disciplina: Química Inorgânica 1 Experimental (Código 114073) Sólidos: Estudo de Estruturas Cristalinas A estrutura dos materiais
CAPÍTULO 3 ESTRUTURA CRISTALINA
 CAPÍTULO 3 ESTRUTURA CRISTALINA Ciência dos Materiais-DEMAT-EE-UFRGS 3. ESTRUTURA CRISTALINA 3-1 INTRODUÇÃO 3-2 ORDENAÇÃO DOS ÁTOMOS 3-3 CÉLULAS UNITÁRIAS 3-4 DIREÇÕES E PLANOS NO CRISTAL 3-5 METAIS 3-6
CAPÍTULO 3 ESTRUTURA CRISTALINA Ciência dos Materiais-DEMAT-EE-UFRGS 3. ESTRUTURA CRISTALINA 3-1 INTRODUÇÃO 3-2 ORDENAÇÃO DOS ÁTOMOS 3-3 CÉLULAS UNITÁRIAS 3-4 DIREÇÕES E PLANOS NO CRISTAL 3-5 METAIS 3-6
ESTRUTURA CRISTALINA 1
 ESTRUTURA CRISTALINA ARRANJAMENTO ATÔMICO Por que estudar? As propriedades de alguns materiais estão diretamente associadas à sua estrutura cristalina (ex: magnésio e berílio que têm a mesma estrutura
ESTRUTURA CRISTALINA ARRANJAMENTO ATÔMICO Por que estudar? As propriedades de alguns materiais estão diretamente associadas à sua estrutura cristalina (ex: magnésio e berílio que têm a mesma estrutura
Física dos Materiais FMT0502 ( )
 Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
SOLIDOS METÁLICOS E SÓLIDOS IÔNICOS
 SOLIDOS METÁLICOS E SÓLIDOS IÔNICOS GASES e LÍQUIDOS: As moléculas têm movimentos contínuos e aleatórios e também giram e vibram, portanto não têm disposição organizada alonga distância. SÓLIDOS: As moléculas,
SOLIDOS METÁLICOS E SÓLIDOS IÔNICOS GASES e LÍQUIDOS: As moléculas têm movimentos contínuos e aleatórios e também giram e vibram, portanto não têm disposição organizada alonga distância. SÓLIDOS: As moléculas,
Principais Tipos de Ligações Químicas. Iônicas Covalentes Metálicas
 Principais Tipos de Ligações Químicas Iônicas Covalentes Metálicas Principais Tipos de Ligações Químicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações de Lewis Numa
Principais Tipos de Ligações Químicas Iônicas Covalentes Metálicas Principais Tipos de Ligações Químicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações de Lewis Numa
Propriedades dos sólidos metálicos. C. E. Housecroft, cap. 6
 C. E. Housecroft, cap. 6 O caráter metálico refere-se às propriedades dos metais (brilhante ou lustroso, maleável e dúctil, os óxidos formam sólidos iônicos básicos e tendem a formar cátions em solução
C. E. Housecroft, cap. 6 O caráter metálico refere-se às propriedades dos metais (brilhante ou lustroso, maleável e dúctil, os óxidos formam sólidos iônicos básicos e tendem a formar cátions em solução
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA FMJ
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA FMJ 03. Item C O equador da figura mostrada pode ser representado como abaixo. 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 02 TURMA FMJ 03. Item C O equador da figura mostrada pode ser representado como abaixo. 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS
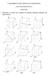 FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
SISTEMA HEXAGONAL SIMPLES
 SISTEMA HEXAGONAL SIMPLES Os metais não cristalizam no sistema hexagonal simples porque o fator de empacotamento é muito baixo Entretanto, cristais com mais de um tipo de átomo cristalizam neste sistema
SISTEMA HEXAGONAL SIMPLES Os metais não cristalizam no sistema hexagonal simples porque o fator de empacotamento é muito baixo Entretanto, cristais com mais de um tipo de átomo cristalizam neste sistema
Ligações Químicas. No hidrônio, quantos pares de elétrons pertencem, no total, tanto ao hidrogênio quanto ao oxigênio? a) 1 b) 2 c) 3 d) 4 e) 6
 Aluno(a): Prof.: Éderson Ligações Químicas Questão 1) Abaixo temos as fórmulas de Lewis para átomos de cinco elementos químicos. Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que
Aluno(a): Prof.: Éderson Ligações Químicas Questão 1) Abaixo temos as fórmulas de Lewis para átomos de cinco elementos químicos. Fórmulas eletrônicas de Lewis para alguns elementos Podemos afirmar que
Compreendendo a Terra
 Frank Press Raymond Siever John Grotzinger Thomas H. Jordan Compreendendo a Terra 4a Edição Mineral: matéria prima da Terra Lecture Slides prepared by Peter Copeland Bill Dupré Copyright 2004 by W. H.
Frank Press Raymond Siever John Grotzinger Thomas H. Jordan Compreendendo a Terra 4a Edição Mineral: matéria prima da Terra Lecture Slides prepared by Peter Copeland Bill Dupré Copyright 2004 by W. H.
MATERIAIS DE CONSTRUÇÃO MECÂNICA II (EM307) 2º Semestre 2005/ Materiais para Ferramentas
 MATERIAIS DE CONSTRUÇÃO MECÂNICA II (EM307) 2º Semestre 2005/06 6. Materiais para Ferramentas F. Jorge Lino Alves 1 Resumo 6. Materiais para ferramentas de corte. Materiais cerâmicos para abrasivos. 2
MATERIAIS DE CONSTRUÇÃO MECÂNICA II (EM307) 2º Semestre 2005/06 6. Materiais para Ferramentas F. Jorge Lino Alves 1 Resumo 6. Materiais para ferramentas de corte. Materiais cerâmicos para abrasivos. 2
Lista de Exercícios
 ---------------------------------Lista de Exercícios 1----------------------------------- Introdução a ciências dos materiais 1 - Com que se ocupa a Ciência dos Materiais e qual sua importância na engenharia
---------------------------------Lista de Exercícios 1----------------------------------- Introdução a ciências dos materiais 1 - Com que se ocupa a Ciência dos Materiais e qual sua importância na engenharia
GRUPO 13 Ga CQ133 FSN
 GRUPO 13 Ga CQ133 FSN GRUPO 13 boro, alumínio, gálio, índio e tálio. PROPRIEDADES GERAIS GRUPO 13 Boro é um semi-metal Os outros membros são metálicos e o caráter metálico aumenta no grupo. A configuração
GRUPO 13 Ga CQ133 FSN GRUPO 13 boro, alumínio, gálio, índio e tálio. PROPRIEDADES GERAIS GRUPO 13 Boro é um semi-metal Os outros membros são metálicos e o caráter metálico aumenta no grupo. A configuração
Ligações Químicas. Ligações iônicas Polarização e sólidos iônicos Ligação covalente Estrutura de Lewis Carga formal
 Ligações Químicas Ligações iônicas Polarização e sólidos iônicos Ligação covalente Estrutura de Lewis Carga formal Estrutura molecular As propriedades físicas dos elementos (como o raio, a energia de ionização
Ligações Químicas Ligações iônicas Polarização e sólidos iônicos Ligação covalente Estrutura de Lewis Carga formal Estrutura molecular As propriedades físicas dos elementos (como o raio, a energia de ionização
Estrutura cristalina = Rede + Base
 Estrutura cristalina = Rede + Base 14 redes de Bravais base b parâmetros de rede a posições atômicas: (0, 0, 0) (1/4, 1/4, 0) (3/4, 0,82, 0) base rede figura de difração Estrutura cristalina de elementos
Estrutura cristalina = Rede + Base 14 redes de Bravais base b parâmetros de rede a posições atômicas: (0, 0, 0) (1/4, 1/4, 0) (3/4, 0,82, 0) base rede figura de difração Estrutura cristalina de elementos
Ligação iônica Ligação covalente Ligação metálica
 Principais Tipos de Ligações Químicas Ligação iônica Ligação covalente Ligação metálica Iônicas Covalentes Metálicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações
Principais Tipos de Ligações Químicas Ligação iônica Ligação covalente Ligação metálica Iônicas Covalentes Metálicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações
Sugestões de estudo para a P1
 Sugestões de estudo para a P1 1) Considere a curva de energia potencial da ligação entre dois átomos (E) apresentada ao lado, e as três afirmações a Seguir: I. Na distância interatômica r o as forças de
Sugestões de estudo para a P1 1) Considere a curva de energia potencial da ligação entre dois átomos (E) apresentada ao lado, e as três afirmações a Seguir: I. Na distância interatômica r o as forças de
Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO
 Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO PROGRAMA DE DISCIPLINA SETOR: Ciências Agrárias e de Tecnologia DEPARTAMENTO: Engenharia de Materiais DISCIPLINA: Ciência
Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO PROGRAMA DE DISCIPLINA SETOR: Ciências Agrárias e de Tecnologia DEPARTAMENTO: Engenharia de Materiais DISCIPLINA: Ciência
