MATERIAIS CERÂMICOS. Curso: Engenharia de Produção / Engenharia Civil 1. ESTRUTURAS E PROPRIEDADES DE CERÂMICAS
|
|
|
- Renata Liliana Bayer Laranjeira
- 6 Há anos
- Visualizações:
Transcrição
1 Curso: Engenharia de Produção / Engenharia Civil MATERIAIS CERÂMICOS 1. ESTRUTURAS E PROPRIEDADES DE CERÂMICAS Materiais cerâmicos são materiais inorgânicos e não-metálicos. A maioria dos materiais cerâmicos são compostos por elementos metálicos e não-metálicos, para os quais as ligações interatômicas são totalmente iônicas ou predominantemente iônicas mas tendo algum caráter covalente. O termo cerâmica vem da palavra grega keramikos, que significa "material queimado", indicando que as desejáveis propriedades destes materiais são normalmente encontradas através de um processo de tratamento térmico de alta temperatura denominado queima ESTRUTURAS CERÂMICAS A ligação atômica em materiais cerâmicos é parcialmente ou totalmente iônica, a maioria das estruturas cerâmicas é composta de íons eletricamente carregados em vez de átomos. Os íons metálicos, ou cátions, são positivamente carregados, eles cedem os seus elétrons de valência aos íons não-metálicos, ou ânions, que são negativamente carregados. Cerâmicas são formadas de pelo menos dois elementos, suas estruturas cristalinas são geralmente complexas ESTRUTURAS CRISTALINAS Duas características influenciam a estrutura cristalina dos materiais cerâmicos: magnitude da carga elétrica em cada um dos íons e os tamanhos relativos dos cátions e ânions. Com relação à primeira característica, o cristal deve ser eletricamente neutro; isto é, todas as cargas positivas do cátion devem ser contrabalançadas por igual número de cargas negativas do ânion. O segundo critério envolve os tamanhos ou os raios iônicos dos cátions e ânions, r C e r A, respectivamente. Uma vez que os elementos metálicos fornecem elétrons quando ionizados, cátions são menores do que ânions e, consequentemente, a razão r C /r A é menor do que um. As estruturas cristalinas cerâmicas estáveis se formam quando os ânions que circundam um cátion estão todos em contato com aquele cátion, como ilustrado na Figura 1. O número de coordenação está relacionado à razão entre os raios iônicos do cátion e do ânion. Para um número de coordenação específico, existe uma razão crítica ou mínima para a qual este contato cátion-ânion
2 é estabelecido (Figura 1), cuja razão pode ser determinada a partir de considerações puramente geométricas. Figura 1 - Configurações de coordenação ânion-cátion estáveis e não-estáveis Estruturas Cristalinas Tipo AX Alguns dos materiais cerâmicos comuns são aqueles nos quais existem iguais números de cátion e de ânion. Estes são conhecidos como os compostos AX, onde A denota o cátion e X o ânion. Existem várias diferentes estruturas cristalinas para os compostos AX; cada uma é normalmente denominada de acordo com um material comum que assume a particular estrutura. - Estrutura de Sal-gema. Talvez a estrutura cristalina AX mais comum é a do tipo cloreto de sódio (NaCl) ou do sal de rocha. O número de coordenação tanto para cátions quanto para ânions é 6 e, portanto, a razão de raios iônicos se situa entre aproximadamente 0,414 e 0,732. Uma célula unitária para esta estrutura cristalina (Figura 2) é gerada a partir de um arranjo CFC de ânions com um cátion situado no centro do cubo e um no centro de cada uma das arestas do cubo. Uma estrutura cristalina equivalente resulta, a partir de um arranjo cúbico de face centrada de cátions. Assim, pode-se pensar que a estrutura cristalina de sal de rocha seja constituída de duas redes CFC interpenetrantes. Uma composta de cátions e a outra composta de ânions. Alguns dos materiais cerâmicos comuns que formam esta estrutura cristalina são NaCl,MgO, MnS, LiF e FeO. Figura 2 - Uma célula unitária de estrutura cristalina do sal de rocha, ou cloreto de sódio (NaCl).
3 - Estrutura de Cloreto de Césio. A Figura 3 mostra uma célula unitária para a estrutura cristalina do cloreto de sódio (CsCl); o número de coordenação é 8 para ambos os tipos de íons. Os ânions estão localizados em cada um dos cantos de um cubo, enquanto que no centro do cubo se encontra um único cátion. Intertroca de ânions com cátions, e vice-versa, produz a mesma estrutura cristalina. Esta não é uma estrutura CCC porque íons de 2 diferentes tipos estão envolvidos. Figura 3 - Uma célula unitária da estrutura cristalina do cloreto de césio (CsCl). - Estrutura da Blenda de Zinco. Uma terceira estrutura AX é uma na qual o número de coordenação é 4; isto é, todos os íons estão tetraedricamente coordenados. É denominado estrutura de blenda de zinco, ou esfarelita, de acordo com o termo mineralógico para o sulfeto de zinco (ZnS). Uma célula unitária está apresentada na Figura 4; todas as posições dos cantos e das faces da célula cúbica estão ocupadas por átomos de S, enquanto que os átomos de Zn preenchem as posições tetraédricas interiores. Uma estrutura equivalente resulta quando as posições dos átomos de Zn e de S forem revertidas. Assim cada átomo de Zn está ligado a 4 átomos de S e vice-versa. Na maioria das vezes, a ligação atômica é altamente covalente em compostos exibindo esta estrutura cristalina, os quais incluem ZnS, ZnTe e SiC. Figura 4 - Uma célula unitária para a estrutura cristalina da blenda de zinco (ZnS).
4 Estruturas Cristalinas do Tipo A m X p : Cátions e ânions com cargas diferentes, podem gerar compostos com a fórmula A m X p, onde m e/ou p são diferentes de 1. Um exemplo seria AX 2, para a qual uma estrutura cristalina comum é encontrada na fluorita (CaF 2 ) (Figura 5). A razão de raios iônicos r C / r A para CaF 2 é de cerca de 0,8 que dá um número de coordenação de 8. Íons cálcio estão posicionados nos centros de cubos, com íons fluoreto nos cantos. A fórmula química mostra que o número de íons Ca 2+ que existem é apenas a metade do número de íons F - e, portanto, a estrutura cristalina seria similar àquela do CsCl (Figura 3), exceto que apenas a metade das posições de centros dos cubos são ocupadas por íons Ca 2+. Outros compostos que têm esta estrutura cristalina incluem UO2, PuO2 e ThO2. Figura 5 - Uma célula unitária para a estrutura cristalina da fluorita (CaF 2 ) Estruturas Cristalinas do Tipo A m B n X p : É também possível para compostos cerâmicos terem mais de um tipo de cátion; para dois tipos de cátions (representados por A e B), suas fórmulas químicas podem ser designadas por A m B n X p. Titanato de bário (BaTiO 3 ), tendo cátions tanto de Ba 2+ quando de Ti 4+, cai nesta classificação. Este material tem uma estrutura cristalina de perovskita e propriedades eletromecânicas bastante interessantes. Em temperaturas superiores a 120ºC (248ºF), a estrutura cristalina é cúbica. Uma célula unitária desta estrutura é mostrada na Figura 6; íons Ba 2+ estão situados em todos os oito cantos do cubo e um único cátion Ti 4+ encontra-se no centro do cubo, com íons O 2- localizados no centro de cada uma da 6 faces. Figura 6: Uma célula unitária para a estrutura cristalina da perovskita.
5 A Tabela 1 sumaria as estruturas cristalinas de sal de rocha, cloreto de césio, blenda de zinco, fluorita e perovskita em termos de razões de raios iônicos cátion-ânion e números de coordenação e dá exemplos para cada. Naturalmente, muitas outras estruturas cristalinas cerâmicas são possíveis. Tabela 1 - Resumo de algumas estruturas cristalinas cerâmicas comuns. Estrutura Tipo de Estrutura Empacotamento do ânion Nº de Coordenação Exemplos Cátion Ânion Sal-gema (cloreto de sódio) AX CFC 6 6 NaCl, MgO, FeO Cloreto de césio AX Cúbica simples 8 8 CsCl Blenda de zinco AX CFC 4 4 ZnS, SiC Fluorita AX 2 Cúbica simples 8 4 CaF 2, UO 2,ThO 2 Perovskita ABX 3 CFC 12 (A) 6 (B) Espinélio AB 2 X 4 CFC 4 (A) 6 (B) 6 BaTiO 3, SrZrO 3, SrSnO 3 4 MgAl 2 O 4, FeAl 2 O 4 2. CERÂMICAS DE SILICATO Silicatos são materiais compostos principalmente de silício e oxigênio, os dois mais abundantes elementos na crosta terrestre; consequentemente, a maior parte dos solos, rochas, argilas e areias se enquadram na classificação de silicato. Em lugar de caracterização das estruturas cristalinas destes materiais em termos de células unitárias, é mais conveniente usar vários arranjos de um tetraedro de SiO 4-4 (Figura 7). Cada átomo de silício está ligado a quatro átomos de oxigênio, que estão situados nos cantos do tetraedro; os átomos do silício estão posicionados no centro. Uma vez que esta é a unidade básica dos silicatos, ela é às vezes tratada com uma entidade negativamente carregada. Figura 7: Um tetraedro silício-oxigênio (SiO 4 4- ).
6 2.1. SÍLICA Quimicamente, o material silicato mais simples é o dióxido de silício (SiO 2 ). Estruturalmente, ele é uma rede tri-dimensional que é gerada quando cada átomos de oxigênio do canto em cada tetraedro é compartilhado por tetraedros adjacentes. Assim, o material é eletricamente neutro e todos os átomos têm estruturas eletrônicas estáveis. Sob estas circunstâncias a razão de átomos de Si para átomos de O é de 1:2, como indicado pela fórmula química. Se esses tetraedros forem arranjados de uma maneira regular e ordenada, uma estrutura cristalina é formada. Existem três principais formas cristalinas polimorfas de sílica: quartzo, cristobalita (Figura 8) e tridimita. Suas estruturas são relativamente complicadas e comparativamente abertas; isto é, os átomos estão estreitamente compactados entre si. Como uma consequência, estas sílicas cristalinas têm relativamente baixas densidades; por exemplo, à temperatura ambiente o quartzo tem uma densidade de apenas 2,65 g/cm 3. A resistência das ligações interatômicas Si-O está refletida numa relativamente alta temperatura de fusão, 1710ºC (3110ºF). Figura 8: O arranjo de átomos de silício e de oxigênio numa célula unitária de cristobalita, um polimorfo do SiO VIDROS À BASE DE SÍLICA A sílica também pode existir como um sólido ou vidro não-cristalino, tendo um alto grau de aleatoriedade atômica, que é característico do líquido; tal material é chamado sílica fundida ou sílica vítrea. Os vidros inorgânicos comuns que são usados para recipientes, janelas e assim por diante, são vidros de sílica aos quais foram adicionados óxidos, tais como CaO e Na 2 O. Esses óxidos não formados por redes poliédricas. Ao invés disso, os seus cátions são incorporados e modificam a rede de SiO -4 4 ; por esta razão, esses óxidos aditivos são denominados modificadores de rede. Outros óxidos tais como o TiO 2 e o Al 2 O 3, ainda que não sejam formadores de rede, substituem o silício e se tornam uma parte da rede e a estabilizam; esses são chamados de
7 intermediários. De uma perspectiva práticas, a adição desses modificadores e intermediários reduz o ponto de fusão e a viscosidade de um vidro, tornando mais fácil a sua conformação em temperaturas mais baixas OS SILICATOS Para os vários minerais à base de silicato, um, dois ou três átomos de oxigênio nos vértices 4- dos tetraedros SiO 4 são compartilhados por outros tetraedros para formar estruturas bastantes complexas. Algumas destas, representadas na Figura 9. Cátions positivamente carregados tais como Ca 2+, Mg 2+ e Al 3+ servem para dois propósitos, primeiro, eles compensam as cargas negativas das unidades SiO 4-4 de maneira que a neutralidade elétrica seja encontrada; e, segundo, estes cátions 4- unem ionicamente os tetraedros SiO 4 entre si. Figura 9: Cinco estruturas iônicas formadas a partir de tetraedros SiO IMPERFEIÇÕES EM CERÂMICAS 3.1. DEFEITOS PONTUAIS ATÔMICOS Os compostos cerâmicos também podem apresentar defeitos atômicos envolvendo átomos hospedeiros. Tal como com metais, são possíveis tanto defeitos por lacunas quanto intersticiais; entretanto, uma vez que materiais cerâmicos contenham íons de pelo menos dois tipos, podem ocorrer defeitos para cada um dos tipos de íons (Figura 10). Por exemplo, em NaCl, podem existir defeitos intersticiais e de lacunas para o Na e defeitos intersticiais e de lacunas para o Cl. É altamente improvável que existam consideráveis concentrações de ânions intersticiais para o ânion (Cl -1 ).
8 Figura 10: Representação esquemática de lacunas catiônicas e aniônicas, e de um cátion intersticial. A expressão estrutura de defeito é utilizada para designar os tipos e concentrações de defeitos atômicos em cerâmicas. Uma vez que átomos existem como íons carregados, quando estruturas de defeitos são consideradas, condições de eletroneutralidade devem ser mantidas. Eletroneutralidade é o estado que existe quando tem-se iguais números de cargas positivas e negativas dos íons. Como uma consequência, defeitos em cerâmicas não ocorrem sozinhos. Um destes tipos de defeito envolve o par constituído de uma lacuna catiônica e um cátion intersticial. Este tipo de defeito é chamado de defeito de Frenkel (Figura 11). Podemos considerar ele, como sendo, formado por um cátion que deixa a sua posição normal e se movendo para um sítio intersticial. Um outro tipo de defeito encontrado em materiais cerâmicos do tipo AX consiste em um par composto por uma lacuna catiônica e uma lacuna aniônica; esse defeito é conhecido como um defeito Schottky (Figura 11). Este defeito pode ser considerado como tendo sido criado pela remoção de um cátion e de um ânion do interior do cristal, seguido pela colocação de ambos os íons em uma superfície externa.
9 Figura 11: Diagrama esquemático mostrando defeitos de Frenkel e Schottky IMPUREZAS EM CERÂMICAS Átomos de impureza podem formar soluções sólidas em materiais cerâmicos do mesmo modo que eles fazem em metais. São possíveis soluções sólidas dos tipos substitucional e intersticial (Figura 12). Figura 12: Representações esquemáticas de átomos de impurezas intersticial, substitucional aniônica e substitucional catiônica em um composto iônico.
10 4. PROPRIEDADES MECÂNICAS Na temperatura ambiente, tanto as cerâmicas cristalinas quanto as cerâmicas não-cristalinas quase sempre fraturam antes que qualquer deformação plástica possa ocorrer em resposta à aplicação de um carga de tração. O processo de fratura frágil consiste na formação e na propagação de trincas ao longo da seção transversal de um material, em uma direção perpendicular a da carga aplicada. O crescimento das trincas nas cerâmicas cristalinas pode ser tanto transgranular (através dos grãos) como intergranular (ao longo dos contornos de grãos). Nas fraturas transgranulares, as trincas se propagam ao longo de planos cristalográficos específicos, que são planos com alta densidade atômica. 5. VIDROS Os vidros são um grupo de cerâmicas familiares; recipientes, janelas, lentes e fibra de vidro, representam aplicações típicas deste grupo. Eles são silicatos não cristalinos contendo outros óxidos, como CaO, Na 2 O, K 2 O e Al 2 O 3, os quais influenciam em suas propriedades. Um vidro de soda de cal consiste, tipicamente, de aproximadamente 70% p SiO 2, e o restante sendo basicamente Na 2 O (soda) e CaO (cal). As composições de vários materiais de vidro estão contidas na Tabela 2. Tabela 2: Composições e Características de Alguns dos Vidros Comerciais Comuns. Tipo de vidro Composição (%p) Características e Aplicações SiO 2 NaO CaO Al 2 O 3 B 2 O 3 Outros Sílica fundida >99,5 Alta temp. de fusão, baixa resistência a choques térmicos. 96% de sílica (Vycor TM ) 96 4 Resistência a choques térmicos e a ataque químico (vidraria lab.) Borossilicato (Pyrex TM ) 81 3,5 2,5 13 Resistência a choques térmicos e a ataque químico (vidraria para fornos). Recipientes (cal de soda) MgO Baixa temp. de fusão, facilmente trabalháveis e duráveis. Fibra de vidro MgO Facilmente estirada na forma de fibra (compósito de fibra de vidro e resina) Sílex óptico PbO, 8K 2 O Alta massa específica e índice de refração (lentes ópticas) Vidrocerâmica (Pyroceram TM ) 43, ,5 6,5TiO 2, 0,5As 2 O 3 Facilmente fabricada, resistente, resistência a choques térmicos. A maioria dos produtos a base de argila se enquadra em duas classificações abrangentes: os produtos estruturais a base de argila e as louças brancas. Os produtos estruturais a base de argila incluem tijolos de construção, as telhas e tubulações de esgoto. As cerâmicas das louças brancas se tornam brancas após um cozimento em alta temperatura, como exemplo, teremos a louça de barro, louça de mesa, louças vitrificadas e louças de sanitário.
11 - Cerâmicas refratárias: capacidade de suportar temperaturas elevadas sem se fundir ou se decompor e a capacidade de permanecer não-reativos e inertes quando expostos a ambientes severos; proporcionam isolamento térmico. - Cerâmicas abrasivas: utilizadas para desgastar, polir ou cortar outros materiais. - Cimentos: quando misturado a água, ele forma uma pasta que pode assumir qualquer forma desejada. Fibras ópticas: feita em sílica com pureza extremamente elevada. 6. FABRICAÇÃO DO VIDRO O vidro é produzido pelo aquecimento da matéria-prima até uma temperatura elevada, acima daquela na qual ocorre a fusão. A maioria dos vidros comerciais é do tipo sílica-soda-cal. Existem quatro tipos de conformação diferentes para a fabricação do vidro: a prensagem, sopro, estiramento e conformação de fibras TRATAMENTO TÉRMICO DE VIDROS Quando um material cerâmico é resfriado a partir de uma temperatura elevada, tensões internas, denominadas tensões térmicas, podem ser introduzidas como um resultado da diferença na taxa de resfriamento e contração térmica entre as regiões da superfície e do interior. Estas tensões térmicas são importantes em cerâmicas frágeis, especialmente vidros, uma vez que elas podem enfraquecer o material ou, em casos extremos, conduzir à fratura, que é denominada choque térmico. Normalmente, tentativas são feitas para evitar tensões térmicas, o que podem ser realizadas por resfriamento da peça numa taxa suficientemente baixa. Uma vez tais tensões sejam introduzidas, sua eliminação, ou pelo menos a redução da sua magnitude, é possível por um tratamento de recozimento no qual a vidraria é aquecida ao ponto de recozimento e em seguida resfriada lentamente até à temperatura ambiente.
Professora: Daniela Becker Mestranda: Jéssica de Aguiar
 Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
Física dos Materiais FMT0502 ( )
 Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas
 Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais MATERIAIS CERÂMICOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais MATERIAIS CERÂMICOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de 2005
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais MATERIAIS CERÂMICOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de 2005
Disciplina: MAF 2130 Química aplicada às engenharias
 Pontifícia Universidade Católica de Goiás Av. Universitária 1.440, Setor Universitário Goiânia-GO, CEP: 74605-010 Fone: +55 62 3946-1000 Disciplina: MAF 2130 Química aplicada às engenharias Prof. Dr. Julio
Pontifícia Universidade Católica de Goiás Av. Universitária 1.440, Setor Universitário Goiânia-GO, CEP: 74605-010 Fone: +55 62 3946-1000 Disciplina: MAF 2130 Química aplicada às engenharias Prof. Dr. Julio
MATERIAIS CERÂMICOS Características Gerais
 MATERIAIS CERÂMICOS Cubo de sílica de isolamento térmico. O interior do cubo está a 1250ºC e pode ser manuseado sem protecção. Usada no isolamento térmico do Space Shuttle MATERIAIS CERÂMICOS Características
MATERIAIS CERÂMICOS Cubo de sílica de isolamento térmico. O interior do cubo está a 1250ºC e pode ser manuseado sem protecção. Usada no isolamento térmico do Space Shuttle MATERIAIS CERÂMICOS Características
Materiais cerâmicos. Introdução. Princípios gerais. Estruturas cristalinas. J. D. Santos, FEUP
 Materiais cerâmicos Introdução. Princípios gerais. Estruturas cristalinas. J. D. Santos, FEUP jdsantos@fe.up.pt Ligação química Typical elements in Ceramics 2 Ligação química 3 Conceitos básicos Definição
Materiais cerâmicos Introdução. Princípios gerais. Estruturas cristalinas. J. D. Santos, FEUP jdsantos@fe.up.pt Ligação química Typical elements in Ceramics 2 Ligação química 3 Conceitos básicos Definição
UNIVERSIDADE FEDERAL DO ABC. Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES
 UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES MATERIAIS CERÂMICOS Materiais Cerâmicos A característica comum a estes
UNIVERSIDADE FEDERAL DO ABC Centro de Engenharia, Modelagem e Ciências Sociais Aplicadas (CECS) BC-1105: MATERIAIS E SUAS PROPRIEDADES MATERIAIS CERÂMICOS Materiais Cerâmicos A característica comum a estes
Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid
 Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid Introdução Os sólidos contém inúmeras imperfeições nas estruturas cristalinas e muitas propriedades são alteradas
Introdução aos Materiais Imperfeições em Sólidos Metais DEMEC TM229 Prof Adriano Scheid Introdução Os sólidos contém inúmeras imperfeições nas estruturas cristalinas e muitas propriedades são alteradas
Estrutur Es a trutur e Propriedades Pr dos materiais cerâmicos
 Estrutura e Propriedades dos materiais cerâmicos Fator de Empacotamento Atômico: FEA R a atoms unit cell FEA = 0,68 APF = Close-packed directions: length = 4R = 3 a Unit cell contains: 1 + 8 x 1/8 = 2
Estrutura e Propriedades dos materiais cerâmicos Fator de Empacotamento Atômico: FEA R a atoms unit cell FEA = 0,68 APF = Close-packed directions: length = 4R = 3 a Unit cell contains: 1 + 8 x 1/8 = 2
Estrutura de Sólidos Cristalinos. Profa. Dra Daniela Becker
 Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
EVOLUÇÃO DA UTLIZAÇÃO DOS MATERIAIS. Figura copiada do material do Prof. Arlindo Silva do Instituto Superior Técnico da Universidade de Portugal
 EVOLUÇÃO DA UTLIZAÇÃO DOS MATERIAIS Figura copiada do material do Prof. Arlindo Silva do Instituto Superior Técnico da Universidade de Portugal Tensão (MPa) Propriedades mecânicas de polímeros Tensão x
EVOLUÇÃO DA UTLIZAÇÃO DOS MATERIAIS Figura copiada do material do Prof. Arlindo Silva do Instituto Superior Técnico da Universidade de Portugal Tensão (MPa) Propriedades mecânicas de polímeros Tensão x
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I
 SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
A4 Estrutura cristalina perfeição
 A4 Estrutura cristalina perfeição TEM Muitos dos materiais aplicados em engenharia têm estrutura cristalina: os átomos do material estão dispostos de modo regular e repetitivo Estrutura cristalina A célula
A4 Estrutura cristalina perfeição TEM Muitos dos materiais aplicados em engenharia têm estrutura cristalina: os átomos do material estão dispostos de modo regular e repetitivo Estrutura cristalina A célula
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I
 SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
SMM-0194 ENGENHARIA E CIÊNCIA DOS MATERIAIS II I Ligação química Estrutura cristalina de cerâmicas cristalinas 2 Ligação química Ligação química 3 % de caráter iônico = {1-exp[-(0,25)(X A -X B ) 2 ]}.100
Estrutura Cristalina dos Sólidos (Arranjos Atômicos)
 Estrutura Cristalina dos Sólidos (Arranjos Atômicos) INTRODUÇÃO As propriedades dos materiais dependem dos arranjos dos seus átomos. Esses arranjos podem ser classificados em: Estruturas moleculares: agrupamento
Estrutura Cristalina dos Sólidos (Arranjos Atômicos) INTRODUÇÃO As propriedades dos materiais dependem dos arranjos dos seus átomos. Esses arranjos podem ser classificados em: Estruturas moleculares: agrupamento
ESTRUTURA DOS SÓLIDOS CRISTALINOS. Mestranda: Marindia Decol
 ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
Física dos Materiais
 4300502 1º Semestre de 2014 Instituto de Física Universidade de São Paulo Professor: Luiz C C M Nagamine E-mail: nagamine@if.usp.br Fone: 3091.6877 homepage: http://disciplinas.stoa.usp.br/course/view.php?id=10070
4300502 1º Semestre de 2014 Instituto de Física Universidade de São Paulo Professor: Luiz C C M Nagamine E-mail: nagamine@if.usp.br Fone: 3091.6877 homepage: http://disciplinas.stoa.usp.br/course/view.php?id=10070
Sólidos iônicos. Química Geral. Prof. Edson Nossol
 Sólidos iônicos Química Geral Prof. Edson Nossol Uberlândia, 07/10/2016 Sólido cristalino: possui ordem a longa distância: átomos, moléculas ou íons ocupam posições específicas Sólido não-cristalino: não
Sólidos iônicos Química Geral Prof. Edson Nossol Uberlândia, 07/10/2016 Sólido cristalino: possui ordem a longa distância: átomos, moléculas ou íons ocupam posições específicas Sólido não-cristalino: não
Estrutura de cristais iônicos. Regras de Pauling
 Estrutura de cristais iônicos Regras de Pauling Estabilidade energética Por que os íons preferem ficar juntos, formando um cristal, do que moléculas isoladas? formar A Constante de Madelung é uma definição
Estrutura de cristais iônicos Regras de Pauling Estabilidade energética Por que os íons preferem ficar juntos, formando um cristal, do que moléculas isoladas? formar A Constante de Madelung é uma definição
CAP.13 MATERIAIS CERÂMICOS
 CAP.13 MATERIAIS CERÂMICOS Smith cap 10 13. 1 13. 2 MATERIAIS CERÂMICOS São materiais inorgânicos não metálicos. Constituídos por elementos metálicos e nãometálicos, ligados quimicamente entre si. Ligações:
CAP.13 MATERIAIS CERÂMICOS Smith cap 10 13. 1 13. 2 MATERIAIS CERÂMICOS São materiais inorgânicos não metálicos. Constituídos por elementos metálicos e nãometálicos, ligados quimicamente entre si. Ligações:
Disciplina: Ciência dos Materiais. Prof. Alex Bernardi
 Disciplina: Ciência dos Materiais Prof. Alex Bernardi 1 Aula Atividade Tele Aula 1 Questão 1. A Ciência dos Materiais é definida como o estudo das relações entre as estruturas e propriedades dos materiais
Disciplina: Ciência dos Materiais Prof. Alex Bernardi 1 Aula Atividade Tele Aula 1 Questão 1. A Ciência dos Materiais é definida como o estudo das relações entre as estruturas e propriedades dos materiais
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS
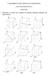 FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
FUNDAMENTOS DE CIÊNCIA DOS MATERIAIS LISTA DE EXERCÍCIOS CRISTAIS 1 Determine os índices e/ou desenhe as direções cristalinas indicadas nas figuras abaixo. 2 Determineos índices dos planos cristalinos
2. Considerando a figura dada na questão 2, explique a principal dificuldade de conformação da sílica fundida em relação ao vidro de borosilicato.
 Lista de Exercícios Materiais Cerâmicos 1. Num vidro, a deformação pode ocorrer por meio de um escoamento isotrópico viscoso se a temperatura for suficientemente elevada. Grupos de átomos, como por exemplo
Lista de Exercícios Materiais Cerâmicos 1. Num vidro, a deformação pode ocorrer por meio de um escoamento isotrópico viscoso se a temperatura for suficientemente elevada. Grupos de átomos, como por exemplo
4- IMPERFEIÇÕES CRISTALINAS
 ASSUNTO 4- IMPERFEIÇÕES CRISTALINAS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) Eleani Maria da Costa
ASSUNTO 4- IMPERFEIÇÕES CRISTALINAS - Defeitos pontuais - Defeitos de linha (discordâncias) - Defeitos de interface (grão e maclas) - Defeitos volumétricos (inclusões, precipitados) Eleani Maria da Costa
ARRANJOS ATÔMICOS. Química Aplicada. Profº Vitor de Almeida Silva
 ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
Ligações Químicas. Ligações iônicas Polarização e sólidos iônicos Ligação covalente Estrutura de Lewis Carga formal
 Ligações Químicas Ligações iônicas Polarização e sólidos iônicos Ligação covalente Estrutura de Lewis Carga formal Estrutura molecular As propriedades físicas dos elementos (como o raio, a energia de ionização
Ligações Químicas Ligações iônicas Polarização e sólidos iônicos Ligação covalente Estrutura de Lewis Carga formal Estrutura molecular As propriedades físicas dos elementos (como o raio, a energia de ionização
DEFEITOS CRISTALINOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais DEFEITOS CRISTALINOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º Semestre de 2005
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais DEFEITOS CRISTALINOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º Semestre de 2005
Ligação iônica Ligação covalente Ligação metálica
 Principais Tipos de Ligações Químicas Ligação iônica Ligação covalente Ligação metálica Iônicas Covalentes Metálicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações
Principais Tipos de Ligações Químicas Ligação iônica Ligação covalente Ligação metálica Iônicas Covalentes Metálicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações
ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 Parte II
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS
 CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS CONCEITO DE LIGAÇÃO IÔNICA UNIÃO ENTRE ÁTOMOS METÁLICOS E AMETÁLICOS OXIDAÇÃO ESTABILIZAÇÃO DO METAL REDUÇÃO ESTABILIZAÇÃO DO AMETAL LIGAÇÃO IÔNICA
CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS CONCEITO DE LIGAÇÃO IÔNICA UNIÃO ENTRE ÁTOMOS METÁLICOS E AMETÁLICOS OXIDAÇÃO ESTABILIZAÇÃO DO METAL REDUÇÃO ESTABILIZAÇÃO DO AMETAL LIGAÇÃO IÔNICA
Materiais I INTRODUÇÃO INTRODUÇÃO. materiais inorgânicos e não-metálicos. A palavra cerâmica vem do idioma grego keramikos
 Materiais I Fases cerâmicas e suas propriedades Grupo 4: Bruno Perez Caue Negrão Gabriel Zen Guilherme Moraes Pedro Rubio Rodrigo Ferrari INTRODUÇÃO materiais inorgânicos e não-metálicos A palavra cerâmica
Materiais I Fases cerâmicas e suas propriedades Grupo 4: Bruno Perez Caue Negrão Gabriel Zen Guilherme Moraes Pedro Rubio Rodrigo Ferrari INTRODUÇÃO materiais inorgânicos e não-metálicos A palavra cerâmica
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC. Estrutura Interna. Prof Karine P.
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC Estrutura Interna Prof Karine P. Naidek Estrutura Cristalina Os materiais sólidos podem ser classificados
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE QUÍMICA - DQMC Estrutura Interna Prof Karine P. Naidek Estrutura Cristalina Os materiais sólidos podem ser classificados
AULA 04 IMPERFEIÇÕES CRISTALINAS Capítulo 04
 AULA 04 IMPERFEIÇÕES CRISTALINAS Capítulo 04 1 IMPERFEIÇÕES CRISTALINAS Estrutura perfeita no arranjo atômico, existe?? Material Cristalino 2 IMPERFEIÇÕES CRISTALINAS 3 Imagem representagva de um plano
AULA 04 IMPERFEIÇÕES CRISTALINAS Capítulo 04 1 IMPERFEIÇÕES CRISTALINAS Estrutura perfeita no arranjo atômico, existe?? Material Cristalino 2 IMPERFEIÇÕES CRISTALINAS 3 Imagem representagva de um plano
Estruturas baseadas na HC Wurtzita ZnS
 Estruturas baseadas na HC Wurtzita ZnS Baseada num arranjo HC dos ânions com metade dos interstícios tetraedrais ocupados por cátions O número de coordenação de cada íon é 4 Se somente a metade das posições
Estruturas baseadas na HC Wurtzita ZnS Baseada num arranjo HC dos ânions com metade dos interstícios tetraedrais ocupados por cátions O número de coordenação de cada íon é 4 Se somente a metade das posições
Centro Universitário da Fundação Educacional de Barretos. Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida
 Centro Universitário da Fundação Educacional de Barretos Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida Porque estudar estrutura atômica? Ligação atômica e as propriedades dos materiais
Centro Universitário da Fundação Educacional de Barretos Princípio de Ciências dos Materiais Prof.: Luciano H. de Almeida Porque estudar estrutura atômica? Ligação atômica e as propriedades dos materiais
IMPERFEIÇÕES EM SÓLIDOS. Bento Gonçalves, 2014.
 IMPERFEIÇÕES EM SÓLIDOS Bento Gonçalves, 2014. O QUE É UM DEFEITO? É uma imperfeição ou um "erro" no arranjo cristalino dos átomos em um cristal. Podem envolver uma irregularidade: Na posição dos átomos
IMPERFEIÇÕES EM SÓLIDOS Bento Gonçalves, 2014. O QUE É UM DEFEITO? É uma imperfeição ou um "erro" no arranjo cristalino dos átomos em um cristal. Podem envolver uma irregularidade: Na posição dos átomos
Estrutura de silicatos
 Estrutura de silicatos Tetraedros de SiO 2. ângulo de 109,2 o. O silício ocupa o centro do tetraedro e os oxigênios, os vértices do tetraedro Silicatos Átomos de silício e oxigênio Cadeias estruturais
Estrutura de silicatos Tetraedros de SiO 2. ângulo de 109,2 o. O silício ocupa o centro do tetraedro e os oxigênios, os vértices do tetraedro Silicatos Átomos de silício e oxigênio Cadeias estruturais
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais. Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais Unidade 4 ESTRUTURA DOS SÓLIDOS CRISTALINOS PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais
Sólidos. Prof. Fernando R. Xavier
 Sólidos Prof. Fernando R. Xavier UDESC 2015 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Sólidos Prof. Fernando R. Xavier UDESC 2015 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Materiais Cerâmicos Estruturas Cristalinas. Conceitos Gerais
 Materiais Cerâmicos Estruturas Cristalinas Conceitos Gerais CHOCOLATE O chocolate, quando fica na geladeira costuma formar uma camada branca na superfície: O que você acha que pode ser? (a) Mofo? (b) Precipitados
Materiais Cerâmicos Estruturas Cristalinas Conceitos Gerais CHOCOLATE O chocolate, quando fica na geladeira costuma formar uma camada branca na superfície: O que você acha que pode ser? (a) Mofo? (b) Precipitados
Aulas Multimídias Santa Cecília. Profº Tiago Quick
 Aulas Multimídias Santa Cecília Profº Tiago Quick Ligações Químicas Conceitos Iniciais Prof. Tiago Quick Valência Chamamos de valência a quantidade de ligações químicas que um átomo pode fazer para atingir
Aulas Multimídias Santa Cecília Profº Tiago Quick Ligações Químicas Conceitos Iniciais Prof. Tiago Quick Valência Chamamos de valência a quantidade de ligações químicas que um átomo pode fazer para atingir
Física dos Materiais FMT0502 ( )
 Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Física dos Materiais FMT0502 (4300502) 1º Semestre de 2010 Instituto de Física Universidade de São Paulo Professor: Antonio Dominguesdos Santos E-mail: adsantos@if.usp.br Fone: 3091.6886 http://plato.if.usp.br/~fmt0502n/
Sólidos iônicos. Classificações de solidos iônicos pela razão radial razão radial = raio do íon menor dividido pelo raio do íon maior
 Sólidos iônicos Sólidos iônicos são construídos pela atração mútua de cátions a ânions. Sólidos reticulares consistem de átomos ligados aos seus vizinhos covalentemente através da extensão do sólido. Sólidos
Sólidos iônicos Sólidos iônicos são construídos pela atração mútua de cátions a ânions. Sólidos reticulares consistem de átomos ligados aos seus vizinhos covalentemente através da extensão do sólido. Sólidos
Ligações químicas e estrutura dos materiais
 Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Disciplina : - MFI Professores: Guilherme Ourique Verran - Dr. Eng. Metalúrgica Aula 02 Revisão de alguns conceitos fundamentais da Ciência dos Materiais Ligações químicas e estrutura dos materiais Conceitos
Defeitos em Cristais Iônicos. Prof Ubirajara Pereira Rodrigues Filho
 Defeitos em Cristais Iônicos Prof Ubirajara Pereira Rodrigues Filho Defeitos Os defeitos perturbam a ordem a longa distância da rede cristalina e afetam as propriedades dos compostos cristalinos que dependem
Defeitos em Cristais Iônicos Prof Ubirajara Pereira Rodrigues Filho Defeitos Os defeitos perturbam a ordem a longa distância da rede cristalina e afetam as propriedades dos compostos cristalinos que dependem
LISTA DE EXERCÍCIOS 6 1 (UNIDADE III INTRODUÇÃO À CIÊNCIA DOS MATERIAIS)
 UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
UNIVERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO CENTRO DE ENGENHARIAS DEPARTAMENTO DE ENGENHARIA E TECNOLOGIA DISCIPLINA: QUÍMICA APLICADA À ENGENHARIA PROFESSOR: FREDERICO RIBEIRO DO CARMO Estrutura cristalina
Compreendendo a Terra
 Frank Press Raymond Siever John Grotzinger Thomas H. Jordan Compreendendo a Terra 4a Edição Mineral: matéria prima da Terra Lecture Slides prepared by Peter Copeland Bill Dupré Copyright 2004 by W. H.
Frank Press Raymond Siever John Grotzinger Thomas H. Jordan Compreendendo a Terra 4a Edição Mineral: matéria prima da Terra Lecture Slides prepared by Peter Copeland Bill Dupré Copyright 2004 by W. H.
CONCEITOS. Prof. Roberto Monteiro de Barros Filho. Prof. Roberto Monteiro de Barros Filho
 CONCEITOS Materiais e Processos de Produção ESTRUTURA DA MATÉRIA ÁTOMOS PRÓTONS NÊUTRONS ELÉTRONS MOLÉCULAS ESTADOS DA MATÉRIA TIPO DE LIGAÇÃO ESTRUTURA (ARRANJO) IÔNICA COVALENTE METÁLICA CRISTALINO AMORFO
CONCEITOS Materiais e Processos de Produção ESTRUTURA DA MATÉRIA ÁTOMOS PRÓTONS NÊUTRONS ELÉTRONS MOLÉCULAS ESTADOS DA MATÉRIA TIPO DE LIGAÇÃO ESTRUTURA (ARRANJO) IÔNICA COVALENTE METÁLICA CRISTALINO AMORFO
As propriedades elétricas desses materiais são extremamente sensíveis à presença de impurezas, mesmo em muito pequenas concentrações.
 SEMICONDUTORES A condutividade dos semicondutores não é mais alta daquela dos condutores, (metais), entretanto, eles têm algumas características elétricas que os tornam especiais. As propriedades elétricas
SEMICONDUTORES A condutividade dos semicondutores não é mais alta daquela dos condutores, (metais), entretanto, eles têm algumas características elétricas que os tornam especiais. As propriedades elétricas
CTM P OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER.
 Nome: Assinatura: CTM P1 2014.2 Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
Nome: Assinatura: CTM P1 2014.2 Matrícula: Turma: OBS: Esta prova contém 7 páginas e 6 questões. Verifique antes de começar. VOCÊ DEVE ESCOLHER APENAS 5 QUESTÕES PARA RESOLVER. VOCÊ DEVE RISCAR NA TABELA
Ligação iônica = transfere elétrons (um doa outro recebe) 1, 2, 3 e - c.v. 5, 6, 7 e - c.v. Doar e - Receber e - Íon+ Íon - Cl - : NaCl.
 LIGAÇÕES QUÍMICAS Os gases nobres aparecem isolados na natureza, ou seja, são estáveis na forma atômica. Isso ocorre em razão de possuírem 8 elétrons na última camada (exceção do hélio, que possui 2 elétrons
LIGAÇÕES QUÍMICAS Os gases nobres aparecem isolados na natureza, ou seja, são estáveis na forma atômica. Isso ocorre em razão de possuírem 8 elétrons na última camada (exceção do hélio, que possui 2 elétrons
Ciências dos materiais- 232
 1 Ciências dos materiais- 232 2 a aula - Ligações químicas - Estruturas Cristalinas Quinta Quinzenal Semana par 10/03/2015 1 Professor: Luis Gustavo Sigward Ericsson Curso: Engenharia Mecânica Série: 5º/
1 Ciências dos materiais- 232 2 a aula - Ligações químicas - Estruturas Cristalinas Quinta Quinzenal Semana par 10/03/2015 1 Professor: Luis Gustavo Sigward Ericsson Curso: Engenharia Mecânica Série: 5º/
Aula 6: Estrutura Cristalina dos Metais
 Aula 6: Estrutura Cristalina dos Metais - Como a ligação metálica é não-direcional, não há restrições quanto ao número e posições dos vizinhos mais próximos. - A estrutura cristalina dos metais têm um
Aula 6: Estrutura Cristalina dos Metais - Como a ligação metálica é não-direcional, não há restrições quanto ao número e posições dos vizinhos mais próximos. - A estrutura cristalina dos metais têm um
Materiais de Engenharia Michel Ashby e David Jones Copyright Elsevier, 2018
 Lista de Exercícios Por Prof. Pedro Nascente (Revisor Técnico) 1. Considere um fio de uma liga de níquel com 5 m de comprimento e diâmetro de 0,75 mm. Os valores do módulo de Young e do coeficiente de
Lista de Exercícios Por Prof. Pedro Nascente (Revisor Técnico) 1. Considere um fio de uma liga de níquel com 5 m de comprimento e diâmetro de 0,75 mm. Os valores do módulo de Young e do coeficiente de
Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO
 Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO PROGRAMA DE DISCIPLINA SETOR: Ciências Agrárias e de Tecnologia DEPARTAMENTO: Engenharia de Materiais DISCIPLINA: Ciência
Universidade Estadual de Ponta Grossa PRÓ-REITORIA DE GRADUAÇÃO DIVISÃO DE ENSINO PROGRAMA DE DISCIPLINA SETOR: Ciências Agrárias e de Tecnologia DEPARTAMENTO: Engenharia de Materiais DISCIPLINA: Ciência
exp E η = η 0 1. Num vidro, a deformação pode ocorrer por meio de um escoamento isotrópico viscoso se a temperatura
 Lista de Exercícios 09 / 2018 Materiais Cerâmicos 1. Num vidro, a deformação pode ocorrer por meio de um escoamento isotrópico viscoso se a temperatura for suficientemente elevada. Grupos de átomos, como,
Lista de Exercícios 09 / 2018 Materiais Cerâmicos 1. Num vidro, a deformação pode ocorrer por meio de um escoamento isotrópico viscoso se a temperatura for suficientemente elevada. Grupos de átomos, como,
Estrutura Cristalina
 Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
A5 Estrutura nãocristalina. -imperfeição. Materiais são preparados com algum grau de impurezas químicas
 A5 Estrutura nãocristalina -imperfeição Materiais são preparados com algum grau de impurezas químicas Além das impurezas, existem numerosos tipos de defeitos estruturais que representam uma perda da perfeição
A5 Estrutura nãocristalina -imperfeição Materiais são preparados com algum grau de impurezas químicas Além das impurezas, existem numerosos tipos de defeitos estruturais que representam uma perda da perfeição
MATERIAIS CERÂMICOS E POLIMÉRICOS
 MATERIAIS CERÂMICOS E POLIMÉRICOS Curso: Engenharia Mecânica - Terceiro Semestre Letivo Período: Primeiro Semestre 2010 Carga Horária: 60 horas Docente: Prof. Dr. Wagner M. Pachekoski MATERIAIS CERÂMICOS:
MATERIAIS CERÂMICOS E POLIMÉRICOS Curso: Engenharia Mecânica - Terceiro Semestre Letivo Período: Primeiro Semestre 2010 Carga Horária: 60 horas Docente: Prof. Dr. Wagner M. Pachekoski MATERIAIS CERÂMICOS:
Principais Tipos de Ligações Químicas. Iônicas Covalentes Metálicas
 Principais Tipos de Ligações Químicas Iônicas Covalentes Metálicas Principais Tipos de Ligações Químicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações de Lewis Numa
Principais Tipos de Ligações Químicas Iônicas Covalentes Metálicas Principais Tipos de Ligações Químicas Ligações químicas A maioria dos compostos situa-se dentro do triângulo Representações de Lewis Numa
Prof. Willyan Machado Giufrida Curso de Engenharia Química. Ciências dos Materiais. Introdução
 Ciências dos Materiais Introdução O que são Materiais? Uma parte da matéria no universo; São as substâncias cujas propriedades as tornam utilizáveis em estruturas, máquinas, dispositivos ou produtos consumíveis.
Ciências dos Materiais Introdução O que são Materiais? Uma parte da matéria no universo; São as substâncias cujas propriedades as tornam utilizáveis em estruturas, máquinas, dispositivos ou produtos consumíveis.
Atividade extra. Questão 1 Cecierj Questão 2 Adaptado de UFRJ. Ciências da Natureza e suas Tecnologias Química
 Atividade extra Questão 1 Cecierj - 2013 Veja a seguir as distribuições eletrônicas para o magnésio e o oxigênio: Mg: K = 2 L = 8 M = 2 12 O: K = 2 L = 6 8 Explique como o composto MgO é formado e indique
Atividade extra Questão 1 Cecierj - 2013 Veja a seguir as distribuições eletrônicas para o magnésio e o oxigênio: Mg: K = 2 L = 8 M = 2 12 O: K = 2 L = 6 8 Explique como o composto MgO é formado e indique
ESZM Processamento de Materiais Cerâmicos
 ESZM039-17 Processamento de Materiais Cerâmicos Profa. Dra. Vânia Trombini Hernandes Sala 711 Bloco A torre 1 vtrombini@ufabc.edu.br Ementa do curso ESZM039-17 - Processamento de Materiais cerâmicos Introdução
ESZM039-17 Processamento de Materiais Cerâmicos Profa. Dra. Vânia Trombini Hernandes Sala 711 Bloco A torre 1 vtrombini@ufabc.edu.br Ementa do curso ESZM039-17 - Processamento de Materiais cerâmicos Introdução
Aula 5: Propriedades e Ligação Química
 Aula 5: Propriedades e Ligação Química Relacionar o tipo de ligação química com as propriedades dos materiais Um entendimento de muitas propriedades físicas dos materiais é previsto através do conhecimento
Aula 5: Propriedades e Ligação Química Relacionar o tipo de ligação química com as propriedades dos materiais Um entendimento de muitas propriedades físicas dos materiais é previsto através do conhecimento
GMEC7301-Materiais de Construção Mecânica Introdução
 GMEC7301-Materiais de Construção Mecânica Introdução TIPOS DE MATERIAIS Quais são os materiais disponíveis para o engenheiro? Classificação dos materiais. i O sistema de classificação mais comum considera
GMEC7301-Materiais de Construção Mecânica Introdução TIPOS DE MATERIAIS Quais são os materiais disponíveis para o engenheiro? Classificação dos materiais. i O sistema de classificação mais comum considera
Sólidos. Prof. Fernando R. Xavier
 Sólidos Prof. Fernando R. Xavier UDESC 2013 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
Sólidos Prof. Fernando R. Xavier UDESC 2013 Sólidos Sob um aspecto simples e prático, é dito sólido o estado da matéria onde seu volume e forma são bem definidos. Dentro de um sólido, os átomos ou moléculas
30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
 IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
Fotografia de vários cristais de fluorita CaF 2 3-0
 Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
Sólidos: Estudo de Estruturas Cristalinas
 UnB - Universidade de Brasília IQD - Instituto de Química Curso de Graduação Disciplina: Química Inorgânica 1 Experimental (Código 114073) Sólidos: Estudo de Estruturas Cristalinas A estrutura dos materiais
UnB - Universidade de Brasília IQD - Instituto de Química Curso de Graduação Disciplina: Química Inorgânica 1 Experimental (Código 114073) Sólidos: Estudo de Estruturas Cristalinas A estrutura dos materiais
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS
 ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. M.Sc.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. M.Sc.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
Aula 7: Cristais 0,0,1 1/2,1/2,1/2 0,0,0 0,1/2,0 0,1,0 1/2,1/2,0 1,0,0. Aula 7 - Profa. Adélia
 Aula 7: Cristais Para poder descrever a estrutura cristalina é necessário escolher uma notação para posições, direções e planos As posições são definidas dentro de um cubo com lado unitário. 0,0,1 1/2,1/2,1/2
Aula 7: Cristais Para poder descrever a estrutura cristalina é necessário escolher uma notação para posições, direções e planos As posições são definidas dentro de um cubo com lado unitário. 0,0,1 1/2,1/2,1/2
Regra do Octeto: (Lewis e Koosel)
 Ligações Químicas Regra do Octeto: (Lewis e Koosel) Um átomo estará estável quando sua última camada possuir 8 elétrons (ou 2, caso se trate da camada K). Os átomos não estáveis unem-se uns aos outros
Ligações Químicas Regra do Octeto: (Lewis e Koosel) Um átomo estará estável quando sua última camada possuir 8 elétrons (ou 2, caso se trate da camada K). Os átomos não estáveis unem-se uns aos outros
T v. T f. Temperatura. Figura Variação da viscosidade com a temperatura para materiais vítreos e cristalinos (CARAM, 2000).
 7 ESTRUTURAS AMORFAS 7.1 Introdução Também chamadas de estruturas vítreas, as estruturas amorfas são formadas por arranjos atômicos aleatórios e sem simetria ou ordenação de longo alcance. Esse tipo de
7 ESTRUTURAS AMORFAS 7.1 Introdução Também chamadas de estruturas vítreas, as estruturas amorfas são formadas por arranjos atômicos aleatórios e sem simetria ou ordenação de longo alcance. Esse tipo de
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS
 ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. Dr.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. Dr.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
Vitrocerâmicas (glass ceramics)
 Vitrocerâmicas (glass ceramics) São materiais inorgânicos policristalinos contendo fração minoritária de fase vítrea, obtidos através da cristalização controlada de certos vidros (50 a 90% cristalinos
Vitrocerâmicas (glass ceramics) São materiais inorgânicos policristalinos contendo fração minoritária de fase vítrea, obtidos através da cristalização controlada de certos vidros (50 a 90% cristalinos
Necessária onde a sinterização no estado sólido não é possível (Si 3
 Líquido tem a função de cobrir as partículas dos pós e causar uma rápida densificação a temperaturas mais baixas que as necessárias para a sinterização no estado sólido Necessária onde a sinterização no
Líquido tem a função de cobrir as partículas dos pós e causar uma rápida densificação a temperaturas mais baixas que as necessárias para a sinterização no estado sólido Necessária onde a sinterização no
ESTADOS EXCITADOS: fonões, electrões livres
 Capítulo III.1 DEFEITOS (IMPERFEIÇÕES) NOS SÓLIDOS CRISTALINOS ESTADOS EXCITADOS: fonões, electrões livres DEFEITOS TRANSIENTES: fotões, electrões, neutrões tõ IMPERFEIÇÕES ESTRUTURAIS IMPORTÂNCIA DEFEITOS
Capítulo III.1 DEFEITOS (IMPERFEIÇÕES) NOS SÓLIDOS CRISTALINOS ESTADOS EXCITADOS: fonões, electrões livres DEFEITOS TRANSIENTES: fotões, electrões, neutrões tõ IMPERFEIÇÕES ESTRUTURAIS IMPORTÂNCIA DEFEITOS
Ligações Químicas elementos químicos átomos moléculas
 Ligações Químicas Ligações Químicas Os diferentes elementos químicos combinam-se de várias maneiras formando uma grande variedade de substâncias, por meio das ligações químicas. Através das ligações químicas
Ligações Químicas Ligações Químicas Os diferentes elementos químicos combinam-se de várias maneiras formando uma grande variedade de substâncias, por meio das ligações químicas. Através das ligações químicas
APONTAMENTOS PRIMEIRA PROVA DE MATERIAIS DE CONSTRUÇÃO I
 APONTAMENTOS PRIMEIRA PROVA DE MATERIAIS DE CONSTRUÇÃO I Normalização na construção civil Normalizar: É padronizar atividades específicas e repetitivas. Normas técnicas: Documentos aprovados por instituições
APONTAMENTOS PRIMEIRA PROVA DE MATERIAIS DE CONSTRUÇÃO I Normalização na construção civil Normalizar: É padronizar atividades específicas e repetitivas. Normas técnicas: Documentos aprovados por instituições
Materiais cerâmicos Definições
 MATERIAIS CERÂMICOS Materiais cerâmicos Definições São compostos inorgânicos formados pela combinação de elementos metálicos e não metálicos. Do ponto de vista das ligações químicas, estas podem ser totalmente
MATERIAIS CERÂMICOS Materiais cerâmicos Definições São compostos inorgânicos formados pela combinação de elementos metálicos e não metálicos. Do ponto de vista das ligações químicas, estas podem ser totalmente
Ligações Químicas. Professor Haroldo
 Ligações Químicas Professor Haroldo 1. A regra do dueto e do octeto: Para se estabilizar um elemento precisa possuir sua camada de valência igual à camada de valência do GÁS NOBRE MAIS PRÓXIMO (8 e -,
Ligações Químicas Professor Haroldo 1. A regra do dueto e do octeto: Para se estabilizar um elemento precisa possuir sua camada de valência igual à camada de valência do GÁS NOBRE MAIS PRÓXIMO (8 e -,
Ligação metálica corrente elétrica
 Ligações Metálicas Ligação metálica É o tipo de ligação que ocorre entre os átomos de metais. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada.
Ligações Metálicas Ligação metálica É o tipo de ligação que ocorre entre os átomos de metais. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada.
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 10 TURMA ANUAL 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
Introdução a Engenharia e Ciência dos Materiais
 Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
Hoje é praticamente impossível encontrar alguma área da atividade humana na qual o metal não esteja presente e intimamente ligado ao desenvolvimento.
 Hoje é praticamente impossível encontrar alguma área da atividade humana na qual o metal não esteja presente e intimamente ligado ao desenvolvimento. Mas para isso, o homem percorreu um longo caminho.
Hoje é praticamente impossível encontrar alguma área da atividade humana na qual o metal não esteja presente e intimamente ligado ao desenvolvimento. Mas para isso, o homem percorreu um longo caminho.
Estrutura atômica e ligação interatômica. Profa. Daniela Becker
 Estrutura atômica e ligação interatômica Profa. Daniela Becker Referências Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 2, 2002. Shackelford, J.F. Ciências dos
Estrutura atômica e ligação interatômica Profa. Daniela Becker Referências Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 2, 2002. Shackelford, J.F. Ciências dos
Diferenças entre o C, Si e os demais elementos do grupo 14
 Diferenças entre o C, Si e os demais elementos do grupo 14 O carbono também difere dos demais elementos do grupo pela sua capacidade de formar cadeias (catenação). Isso porque as ligações C-C são fortes,
Diferenças entre o C, Si e os demais elementos do grupo 14 O carbono também difere dos demais elementos do grupo pela sua capacidade de formar cadeias (catenação). Isso porque as ligações C-C são fortes,
QUÍMICA. LIGAÇÕES QUÍMICAS Prof Francisco Sallas
 QUÍMICA LIGAÇÕES QUÍMICAS Prof Francisco Sallas chicosallas@hotmail.com Porque os átomos se ligam? A grande variedade de materiais que conhecemos, são formados pela combinação de átomos de elementos químicos.
QUÍMICA LIGAÇÕES QUÍMICAS Prof Francisco Sallas chicosallas@hotmail.com Porque os átomos se ligam? A grande variedade de materiais que conhecemos, são formados pela combinação de átomos de elementos químicos.
PROPRIEDADES DOS SÓLIDOS ESTRUTURA E TIPO DE LIGAÇÕES
 PROPRIEDADES DOS SÓLIDOS ESTRUTURA E TIPO DE LIGAÇÕES 1 REPRESENTAÇÃO Diferentes estados da matéria gás pouca ordem, movimentos rápidos. Sólido cristalino altamente ordenado líquido polar mais ordenado,
PROPRIEDADES DOS SÓLIDOS ESTRUTURA E TIPO DE LIGAÇÕES 1 REPRESENTAÇÃO Diferentes estados da matéria gás pouca ordem, movimentos rápidos. Sólido cristalino altamente ordenado líquido polar mais ordenado,
28/09/2017. Ewaldo Luiz de Mattos Mehl. Departamento de Engenharia Elétrica
 Ewaldo Luiz de Mattos Mehl Departamento de Engenharia Elétrica mehl@ufpr.br 1 Agenda: Arranjos atômicos Estrutura cristalina Tipos de estruturas Influência nas propriedades Defeitos na estrutura cristalina
Ewaldo Luiz de Mattos Mehl Departamento de Engenharia Elétrica mehl@ufpr.br 1 Agenda: Arranjos atômicos Estrutura cristalina Tipos de estruturas Influência nas propriedades Defeitos na estrutura cristalina
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais UNIDADE 6 DEFEITOS DO SÓLIDO CRISTALINO
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais UNIDADE 6 DEFEITOS DO SÓLIDO CRISTALINO PMT 3110 - Introdução à Ciência dos Materiais para Engenharia
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais UNIDADE 6 DEFEITOS DO SÓLIDO CRISTALINO PMT 3110 - Introdução à Ciência dos Materiais para Engenharia
Processos Metalúrgicos
 Processos Metalúrgicos AULA 5 ESTRUTURA E PROPRIEDADE DOS MATERIAIS PROF.: KAIO DUTRA Constituição da Matéria A matéria do universo é constituída de átomos. A maioria dos elementos existe na forma de moléculas
Processos Metalúrgicos AULA 5 ESTRUTURA E PROPRIEDADE DOS MATERIAIS PROF.: KAIO DUTRA Constituição da Matéria A matéria do universo é constituída de átomos. A maioria dos elementos existe na forma de moléculas
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 13 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 13 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 13 TURMA INTENSIVA 01. Item B I Correto. A energia para quebrar a ligação H F (568 kj/mol) é a maior da tabela. Isto torna mais difícil a sua quebra, portanto ionizando
CERÂMICAS As Cerâmicas compreendem todos os materiais inorgânicos, não-metálicos, obtidos geralmente após tratamento térmico em temperaturas elevadas.
 CERÂMICAS As Cerâmicas compreendem todos os materiais inorgânicos, não-metálicos, obtidos geralmente após tratamento térmico em temperaturas elevadas. DEFINIÇÃO Cerâmica vem da palavra grega keramus que
CERÂMICAS As Cerâmicas compreendem todos os materiais inorgânicos, não-metálicos, obtidos geralmente após tratamento térmico em temperaturas elevadas. DEFINIÇÃO Cerâmica vem da palavra grega keramus que
Conceitos Básicos de Semicondutores
 Conceitos Básicos de Semicondutores Daniel Montechiesi RA. 3679-2 Eduardo Oliveira RA. 2065-5 Leandro Gomes Silva RA. 2073-9 Sumário Introdução Objetivo Diferenças entre um Material Semicondutor e um Condutor
Conceitos Básicos de Semicondutores Daniel Montechiesi RA. 3679-2 Eduardo Oliveira RA. 2065-5 Leandro Gomes Silva RA. 2073-9 Sumário Introdução Objetivo Diferenças entre um Material Semicondutor e um Condutor
A6 Estrutura não cristalina imperfeição: defeitos lineares, planares e em volume
 A6 Estrutura não cristalina imperfeição: defeitos lineares, planares e em volume Deslocações no KCl. O KCl é transparente e as deslocações (linhas brancas) foram decoradas com impurezas para as tornar
A6 Estrutura não cristalina imperfeição: defeitos lineares, planares e em volume Deslocações no KCl. O KCl é transparente e as deslocações (linhas brancas) foram decoradas com impurezas para as tornar
Ligações Químicas. Ligações Químicas. Sólidos. Como os átomos se combinam e quais as forças que os mantêm unidos?
 Ligações Químicas Como os átomos se combinam e quais as forças que os mantêm unidos? Estudaremos as ligações entre os átomos com base em suas estruturas eletrônicas e periodicidade. Para ilustrar os diferentes
Ligações Químicas Como os átomos se combinam e quais as forças que os mantêm unidos? Estudaremos as ligações entre os átomos com base em suas estruturas eletrônicas e periodicidade. Para ilustrar os diferentes
INTRODUÇÃO À QUÍMICA
 INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
INTRODUÇÃO À QUÍMICA O QUE É QUÍMICA? É a ciência que estuda a matéria, suas propriedades, transformações e interações, bem como a energia envolvida nestes processos. QUAL A IMPORTÂNCIA DA QUÍMICA? Entender
