FÍSICA DA MATÉRIA CONDENSADA 2009/10 Folha 1 I Redes e Estruturas Cristalinas
|
|
|
- Gabriel Henrique Milton de Caminha Arantes
- 6 Há anos
- Visualizações:
Transcrição
1 FÍSICA DA MATÉRIA CONDENSADA 2009/10 Folha 1 I Redes e Estruturas Cristalinas 1 - Indicar a rede subjacente aos desenhos das figuras la) e lb). Encontrar três conjuntos de vectores fundamentais primitivos para a figura la) e dois conjuntos para a figura lb). Verificar que o conteúdo das várias células unitárias definidas por esse conjunto de vectores é idêntico para cada desenho. Indicar ainda, para cada desenho, um conjunto de vectores fundamentais não primitivos. Qual é o conteúdo das células unitárias definidas por esses vectores? Figura 1 a) Figura 1 b)
2 2 - Considerar a figura 2. a) Indicar a rede e definir uma célula unitária para o desenho. b) Encontrar quatro pontos distintos por onde passem eixos de rotação binários. c) Verificar graficamente que qualquer que sejam ae b escolhidos para definirem uma célula unitária primitiva, os quatro pontos referidos em b) estão à distância uns dos outros de 0; 1 2 a ; 1 2 b ; 1 2 a +b. d) Qual o conteúdo de uma célula unitária primitiva do desenho (motivo)? e) Definir uma célula unitária assimétrica (parte do desenho que por aplicação dos vários elementos de simetria - neste caso translações e rotações - permite gerar todo o desenho). f) Quantas células unitárias assimétricas têm cada célula unitária primitiva? Figura 2
3 3 - Considerar o desenho da figura 3. a) Identificar a rede, uma célula unitária primitiva e o seu conteúdo. b) Verificar que as figuras "semelhantes" não estão relacionadas por um eixo de rotação. c) Identificar os elementos de simetria presentes no desenho. d) Comparar estes elementos de simetria com os da figura anterior. Que diferença fundamental existe entre eles? Figura Considerar a rede tipo "favo de mel" da figura 4. Será uma rede de Bravais? Justificar. Definir uma célula unitária primitiva para a estrutura representada pela figura 4. Qual o motivo que a célula contém? (Considerar que o desenho se repete indefinidamente). Figura 4
4 5 - Considerar o desenho da figura 5. a) Mostrar que o padrão possui simetria de translação, indicando a rede subjacente ao desenho. b) Apesar de as flores admitirem como elemento de simetria um eixo de rotação de grau 5, será que algum desses eixos é um elemento de simetria para o desenho como um todo? Haverá outros elementos de simetria no desenho? c) Escolher uma célula unitária primitiva e marcar nela os elementos de simetria que encontrar. Figura Mostrar que não são cristalograficamente possíveis eixos de rotação de grau 5 ou de grau superior a 6, como elementos de simetria de uma estrutura cristalina. (slides da teórica)
5 7 - Desenhar a célula unitária convencional da rede cúbica de faces centradas e da rede cúbica centrada. a) Estas células unitárias são primitivas? Justificar. b) Encontrar um conjunto de vectores fundamentais para as redes acima mencionadas. Desenhar a célula unitária por eles definida. c) Qual a relação de volume entre as células unitárias primitivas e as células unitárias convencionais para as referidas redes? 8 - Numa rede cúbica simples definida pelos vectores fundamentais primitivos convencionais a, b e c definiu-se uma célula unitária à custa dos seguintes vectores u a 2b c v a b w a c a) Será que estes vectores ainda definem uma célula unitária primitiva? b) Qual a multiplicidade da rede que estes vectores geram em relação à rede cúbica simples? 9 - Uma célula unitária primitiva tem de dimensões: a=5å b=6å c=7 Å e = = =90º Escolhe-se uma nova célula unitária com vectores fundamentais que vão da origem até aos pontos de coordenadas (3,1,0), (1,2,0) e (0,0,1). a) Calcular a relação entre os volumes das duas células unitárias. b) Dizer se a segunda rede é ou não primitiva e indicar quantos motivos contém cada célula unitária. c) Quais os ângulos que formam os vectores fundamentais a', b'e c' que definem a nova célula unitária A rede cristalina do crómio é cúbica de corpo centrado, com a=2.28 Å. Desenhar a célula unitária; marcar nela os planos (200) e (110), bem como as posições ocupadas pelos átomos de crómio Desenhar uma célula unitária tetragonal centrada e marcar nela os seguintes planos: (100), (00 1 ), (021) e (312). Quais são os índices de MilIer do plano que corta os eixos a, b e c em 2 3 a, 4 5b e 1 6c?
6 12 - Considerar uma rede ortorrômbica de bases centradas, monoatómica, com: a=2.0å b=1.5å c=2.5å a) Desenhar os planos (230), ( 1 21) e (100). b) Calcular a densidade planar atómica para os planos (200), (010) e (001) O óxido de potássio cristaliza numa rede cúbica de faces centradas (a=6.44 Å) sendo o motivo constituído por: O: (0, 0, 0) K: (1/4, 1/4, 1/4) (1/4, 1/4, 3/4) a) Calcular as distâncias interatómicas O-O, K-K e O-K mais curtas. b) Determinar qual dos dois planos (110) e (004) possui menor densidade planar de átomos de potássio O NaCl cristaliza segundo uma rede cúbica de faces centradas de parâmetro de rede a=5.64å. Os iões Na + ocupam os nós da rede e os iões Cl - ocupam as posições (x,y,z) Na +(1/2,1/2,1/2). a) Esboçar um modelo da célula unitária do NaCl. b) Determinar a densidade planar atómica do plano (110) O carbono cristaliza, na forma alotrópica do diamante, segundo uma rede cúbica de faces centradas. O motivo da rede é constituído por dois átomos de carbono nas seguintes posições: C 1 : (0,0,0) C 2 : (¼,¼,¼) a) Quantos átomos de carbono tem a célula unitária convencional do diamante? b) Fazer uma projecção da célula unitária do diamante segundo o eixo [001]. c) Determinar o comprimento da ligação C-C no diamante, sabendo que a=3.56å. d) Calcular o ângulo das ligações C-C no diamante O sulfureto de zinco cristaliza numa rede cúbica de faces centradas (a=5.41å), com o seguinte motivo: Zn: (0,0,0) S: (¼,¼,¼). a) Quantos átomos de Zn e S estão contidos numa célula unitária convencional do ZnS? Indicar as suas coordenadas fraccionárias e desenhar uma projecção da célula unitária segundo o eixo [001]. b) Calcular o comprimento da ligação Zn-S e o ângulo da ligação Zn-S-Zn. c) Sendo m a (Zn)=65.38 e m a (S)=32.06, determinar a densidade do ZnS.
7 17 - O elemento lítio (m a (Li)=6.94) cristaliza numa rede cúbica de corpo centrado, de parâmetro a=3.48å. a) Representar a distribuição dos átomos nos planos atómicos (100), (110) e (111) e determinar qual dos 3 planos apresenta um maior número de átomos por unidade de área. b) Calcular o raio atómico e a massa específica do lítio O titanato de bário (BaTiO 3 ) é um material com interessantes propriedades ferro eléctricas. A estrutura cristalina deste composto consiste em átomos de Ba dispostos nos vértices de um cubo, átomos de O no centro de cada uma das faces e um átomo de Ti no centro do cubo. a) Fazer um esquema da célula unitária do BaTiO 3. b) Qual a rede de Bravais em que este composto cristaliza? c) Qual é o motivo associado à rede? 19 - Mostrar que o valor máximo da fracção de volume que pode ser preenchida por um empacotamento de esferas rígidas dispostas nos tipos de redes seguintes, é: (slides da teórica) cúbica simples: 52% cúbica de faces centradas: 74% cúbica de corpo centrado: 68% 20 - O ferro cristaliza numa rede cúbica de corpo centrado a temperaturas inferiores a 910 o C, numa rede cúbica de faces centradas para temperaturas compreendidas entre 910 o C e 1400 o C, e numa rede cúbica simples para temperaturas superiores a 1400 o C. Supondo que o raio atómico do Fe não se altera nestas transições de fase, calcular como varia a densidade do Fe nesta gama de temperaturas.
Física da Matéria Condensada
 Física da Matéria Condensada II Redes e estruturas cristalinas 1. Indique a rede subjacente aos desenhos das figuras 1 e 2. Encontre três conjuntos de vectores fundamentais primitivos para a fig. 1 e dois
Física da Matéria Condensada II Redes e estruturas cristalinas 1. Indique a rede subjacente aos desenhos das figuras 1 e 2. Encontre três conjuntos de vectores fundamentais primitivos para a fig. 1 e dois
ORDEM. Periocidade. SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico de átomos, moléculas ou iões, formando uma estrutura cristalina regular
 Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
Capítulo I ESTRUTURA CRISTALINA DE SÓLIDOS ORDEM curto alcance médio alcance longo alcance Periocidade unidimensional bidimensional tridimensional SÓLIDO CRISTALINO OU CRISTAL agregado ordenado e periódico
ESTRUTURA DOS SÓLIDOS CRISTALINOS. Mestranda: Marindia Decol
 ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
ESTRUTURA DOS SÓLIDOS CRISTALINOS Mestranda: Marindia Decol Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
Capítulo 1 - Cristais
 1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
1. Cristais 1.1. Introdução O materiais no estado sólido podem apresentar estruturas cristalinas ou amorfas. Na estrutura cristalina os átomo (moléculas) apresentam um ordenamento periódico nas posições
estrutura atômica cristalino
 Aula 0b estrutura atômica cristalina ZEA 1038 Ciência e Tecnologia dos Materiais Prof. João Adriano Rossignolo Profa. Eliria M.J.A. Pallone estrutura atômica cristalino 1 CRISTAL ESTRUTURA CRISTALINA Muitos
Aula 0b estrutura atômica cristalina ZEA 1038 Ciência e Tecnologia dos Materiais Prof. João Adriano Rossignolo Profa. Eliria M.J.A. Pallone estrutura atômica cristalino 1 CRISTAL ESTRUTURA CRISTALINA Muitos
Introdução a Engenharia e Ciência dos Materiais
 Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
Introdução a Engenharia e Ciência dos Materiais Estrutura Cristalina Prof. Vera L Arantes 2014 25/3/2014 ESTRUTURA CRISTALINA 2 ARRANJO ATÔMICO Por que estudar? As propriedades de alguns materiais estão
Ciência dos Materiais Lista de Exercícios II - Estrutura dos Sólidos Cristalinos
 1. Qual a diferença entre estrutura atômica e estrutura cristalina? 2. Considere os sistemas cristalinos (a) Cúbico Simples (CS), (b) Cúbico de Faces Centradas (CFC) e (c) Cúbico de Corpo Centrado (CCC).
1. Qual a diferença entre estrutura atômica e estrutura cristalina? 2. Considere os sistemas cristalinos (a) Cúbico Simples (CS), (b) Cúbico de Faces Centradas (CFC) e (c) Cúbico de Corpo Centrado (CCC).
ARRANJOS ATÔMICOS. Química Aplicada. Profº Vitor de Almeida Silva
 ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
ARRANJOS ATÔMICOS Química Aplicada Profº Vitor de Almeida Silva 1. Arranjo Periódico de Átomos SÓLIDO: Constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido;
ESTRUTURA DOS SÓLIDOS
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais ESTRUTURA DOS SÓLIDOS PMT 2100 - Introdução à Ciência dos Materiais para Engenharia 2º semestre de
PMT Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014
 ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
ESCOLA POLITÉCNICA DA UNIVERSIDADE DE SÃO PAULO Departamento de Engenharia Metalúrgica e de Materiais PMT 3100 - Fundamentos de Ciência e Engenharia dos Materiais 2º semestre de 2014 ESTRUTURA DOS SÓLIDOS
Índices de Miller - Planos
 Os índices de Miller (hkl) definem a orientação de um plano de átomos na célula unitária. Os índices de Miller são definidos pela intersecção desse plano com os eixos do sistema de coordenadas da célula.
Os índices de Miller (hkl) definem a orientação de um plano de átomos na célula unitária. Os índices de Miller são definidos pela intersecção desse plano com os eixos do sistema de coordenadas da célula.
Capítulo 6 Estrutura dos materiais
 Capítulo Estrutura dos materiais. O Molibdénio (Mo) apresenta estrutura cristalina cúbica de corpo centrado (CCC) sendo o seu raio atómico 0, nm. O peso atómico do Mo é 95,94 g/mol e a sua densidade é
Capítulo Estrutura dos materiais. O Molibdénio (Mo) apresenta estrutura cristalina cúbica de corpo centrado (CCC) sendo o seu raio atómico 0, nm. O peso atómico do Mo é 95,94 g/mol e a sua densidade é
ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 CMA CIÊNCIA DOS MATERIAIS 2º Semestre de 2014 Prof.
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 CMA CIÊNCIA DOS MATERIAIS 2º Semestre de 2014 Prof.
Fotografia de vários cristais de fluorita CaF 2 3-0
 Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
Arranjos Atômicos Fotografia de vários cristais de fluorita CaF 2 3-0 Conceito de Cristalinidade Cristalinidade corresponde a forma de organização da estrutura em um modelo ordenado e repetitivo de longo
TP064 - CIÊNCIA DOS MATERIAIS PARA EP. FABIANO OSCAR DROZDA
 TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
TP064 - CIÊNCIA DOS MATERIAIS PARA EP FABIANO OSCAR DROZDA fabiano.drozda@ufpr.br 1 AULA 03 ESTRUTURA DOS SÓLIDOS CRISTALINOS 2 BREVE REVISÃO AULA PASSADA LIGAÇÕES QUÍMICAS Ligações primárias ou fortes
30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
 IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
IFRS - Mestrado em Tecnologia e Engenharia de Materiais DISCIPLINA: Ciência dos Materiais PROFESSOR: Juliano Toniollo ALUNO: PAULO CESAR FRITZEN 30 Exercícios Resolvidos CAPÍTULO 3 ESTRUTURA CRISTALINA
ESTRUTURA DOS SÓLIDOS CRISTALINOS CAP. 03 Parte II
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS DEPARTAMENTO DE ENGENHARIA MECÂNICA PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA E ENGENHARIA DE MATERIAIS - PGCEM ESTRUTURA DOS SÓLIDOS
Rede de Bravais. Cap 1 KITTEL Cap 4 ASHCROFT- MERMIN (todo) Cap 7 ASHCROFT- MERMIN (parte) Cap 4 IVAN
 Rede de Bravais Cap 1 KITTEL Cap 4 ASHCROFT- MERMIN (todo) Cap 7 ASHCROFT- MERMIN (parte) Cap 4 IVAN Veremos hoje Rede de Bravais.. Vetores primitivos Redes 2D e 3D Célula unitária primitiva célula primitiva
Rede de Bravais Cap 1 KITTEL Cap 4 ASHCROFT- MERMIN (todo) Cap 7 ASHCROFT- MERMIN (parte) Cap 4 IVAN Veremos hoje Rede de Bravais.. Vetores primitivos Redes 2D e 3D Célula unitária primitiva célula primitiva
Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid
 Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid Introdução: Diversas propriedades dos sólidos estão relacionadas à Estrutura Cristalina. Não somente
Introdução aos Materiais A Estrutura em Sólidos Cristalinos Metais DEMEC TM229 Prof. Adriano Scheid Introdução: Diversas propriedades dos sólidos estão relacionadas à Estrutura Cristalina. Não somente
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de Informações e instruções para a resolução da prova
 Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de 2015 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de 2015 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Estrutura de Sólidos Cristalinos. Profa. Dra Daniela Becker
 Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
Estrutura de Sólidos Cristalinos Profa. Dra Daniela Becker Bibliografia Callister Jr., W. D. Ciência e engenharia de materiais: Uma introdução. LTC, 5ed., cap 3, 2002. Shackelford, J.F. Ciências dos Materiais,
 Ligações Químicas Por que os átomos formam ligações químicas? Distância de equilíbrio Comprimento da ligação H-H r o = 74 pm distância internuclear Uma ligação química entre dois átomos é formada se
Ligações Químicas Por que os átomos formam ligações químicas? Distância de equilíbrio Comprimento da ligação H-H r o = 74 pm distância internuclear Uma ligação química entre dois átomos é formada se
Estrutura Cristalina
 Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
Estrutura Cristalina Para todos os tipos de sólidos (metálicos, iónicos, covalentes ou moleculares), a energia de ligação é máxima para uma distância de equílibrio específica r 0. Um sistema de átomos
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS
 ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. M.Sc.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
ESTRUTURA CRISTALINA E IMPERFEIÇÕES NOS SÓLIDOS Prof. M.Sc.: Anael Krelling 1 CONCEITOS FUNDAMENTAIS Materiais sólidos podem ser classificados de acordo com a regularidade com que os seus átomos ou íons
Professora: Daniela Becker Mestranda: Jéssica de Aguiar
 Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
Professora: Daniela Becker Mestranda: Jéssica de Aguiar JOINVILLE SC BRASIL 2016 Estruturas Cerâmicas São compostas por pelo menos dois elementos; Em geral são mais complexas do que a dos metais; Ex.:
Cursos Profissionais-Física e Química 10º ano
 3.1.4. Parâmetros da ligação covalente A. O comprimento da ligação nas moléculas diatómicas Como já se referiu, quando os átomos se aproximam formando ligações dão origem a uma nova unidade estrutural-
3.1.4. Parâmetros da ligação covalente A. O comprimento da ligação nas moléculas diatómicas Como já se referiu, quando os átomos se aproximam formando ligações dão origem a uma nova unidade estrutural-
Ligação metálica corrente elétrica
 Ligações Metálicas Ligação metálica É o tipo de ligação que ocorre entre os átomos de metais. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada.
Ligações Metálicas Ligação metálica É o tipo de ligação que ocorre entre os átomos de metais. Quando muitos destes átomos estão juntos num cristal metálico, estes perdem seus elétrons da última camada.
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de Informações e instruções para a resolução da prova
 Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de 2013 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Programa de Pós-graduação em Ciência e Tecnologia de Materiais 2º semestre de 2013 Informações e instruções para a resolução da prova 1. A prova deve ser realizada sem consulta; 2. A duração da prova é
Faculdade de Ciências da Universidade do Porto Departamento de Química. Programa do 10º ano e do 11º ano de Química do Ensino Secundário
 Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
Faculdade de Ciências da Universidade do Porto Departamento de Química Programa da Prova de Acesso de Química (2016): Exemplos de exercícios 1.Indique a afirmação correcta. Programa do 10º ano e do 11º
DESENVOLVIMENTO DE UM SOFTWARE DE GERAÇÃO E VISUALIZAÇÃO DE NANOESTRUTURAS
 DESENVOLVIMENTO DE UM SOFTWARE DE GERAÇÃO E VISUALIZAÇÃO DE NANOESTRUTURAS Aluno: Marcos Paulo Moraes Orientador: André Silva Pimentel Introdução A nanotecnologia está associada a diversas áreas de pesquisa
DESENVOLVIMENTO DE UM SOFTWARE DE GERAÇÃO E VISUALIZAÇÃO DE NANOESTRUTURAS Aluno: Marcos Paulo Moraes Orientador: André Silva Pimentel Introdução A nanotecnologia está associada a diversas áreas de pesquisa
Forças intermoleculares
 Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio As ligações de hidrogênio são responsáveis pela: Flutuação do gelo
Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio Forças intermoleculares Ligação de hidrogênio As ligações de hidrogênio são responsáveis pela: Flutuação do gelo
Célula Unitária e 14 Retículos de Bravais
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Química e Física Molecular Célula Unitária e 14 Retículos de Bravais SQM 409 - Cristalografia Prof. Dr. Maria Teresa do Prado
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Química e Física Molecular Célula Unitária e 14 Retículos de Bravais SQM 409 - Cristalografia Prof. Dr. Maria Teresa do Prado
Aula 3 Estrutura electrónica e cristalográfica
 Aula 3 Estrutura electrónica e cristalográfica Tópicos a abordar Estrutura electrónica, cristalográfica e metalo(materialo)gráfica Estrutura electrónica Estrutura cristalográfica Organização dos átomos
Aula 3 Estrutura electrónica e cristalográfica Tópicos a abordar Estrutura electrónica, cristalográfica e metalo(materialo)gráfica Estrutura electrónica Estrutura cristalográfica Organização dos átomos
Provinhas de Introdução a Física do Estado Sólido I:
 Universidade de São Paulo Instituto de Física Provinhas de Introdução a Física do Estado Sólido I: Resoluções Monitor: Alexsandro Kirch Professora: Drª. Lucy Vitória Credidio Assali São Paulo 01 Sumário
Universidade de São Paulo Instituto de Física Provinhas de Introdução a Física do Estado Sólido I: Resoluções Monitor: Alexsandro Kirch Professora: Drª. Lucy Vitória Credidio Assali São Paulo 01 Sumário
MÓDULOS 45 e 46 QUÍMICA. Cristais. Ciências da Natureza, Matemática e suas Tecnologias 1. CONCEITO DE CELA OU CÉLULA UNITÁRIA
 II Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 45 e 46 Cristais. CONCEITO DE CELA OU CÉLULA UNITÁRIA É a menor unidade que se repete em um cristal, isto é, o retículo cristalino
II Ciências da Natureza, Matemática e suas Tecnologias QUÍMICA MÓDULOS 45 e 46 Cristais. CONCEITO DE CELA OU CÉLULA UNITÁRIA É a menor unidade que se repete em um cristal, isto é, o retículo cristalino
Tabela Periódica e Propriedades Periódicas dos Elementos. periódico permite fazer previsões gerais sobre seu comportamento químico e físico.
 Tabela Periódica e Propriedades Periódicas dos Elementos Agrupar os elementos num quadro Agrupar os elementos num quadro periódico permite fazer previsões gerais sobre seu comportamento químico e físico.
Tabela Periódica e Propriedades Periódicas dos Elementos Agrupar os elementos num quadro Agrupar os elementos num quadro periódico permite fazer previsões gerais sobre seu comportamento químico e físico.
COMPOSTOS IÓNICOS A-B
 COMPOSTOS IÓNICOS AB B (baixa E i, logo baixa χ) B B A (alta E i, logo alta χ) 1s 1 Hidrogénio i Metalóides 1s 2 1s 2 Metais alcalinos Não metais 1s 2 2s 1 1s 2 2s 2 Metais alcalino terrosos Gases raros
COMPOSTOS IÓNICOS AB B (baixa E i, logo baixa χ) B B A (alta E i, logo alta χ) 1s 1 Hidrogénio i Metalóides 1s 2 1s 2 Metais alcalinos Não metais 1s 2 2s 1 1s 2 2s 2 Metais alcalino terrosos Gases raros
2) Um átomo T apresenta menos 2 prótons que um átomo Q. Com base nessa informação, assinale a opção falsa.
 1) Um átomo, cujo número atômico é 18, está classificado na Tabela Periódica como: a) metal alcalino b) metal alcalinoterroso c) metal terroso d) ametal e) gás nobre 2) Um átomo T apresenta menos 2 prótons
1) Um átomo, cujo número atômico é 18, está classificado na Tabela Periódica como: a) metal alcalino b) metal alcalinoterroso c) metal terroso d) ametal e) gás nobre 2) Um átomo T apresenta menos 2 prótons
Aumento do número de níveis eletrónicos, n, nas orbitais de valência
 Causas da variação das propriedades periódicas dos elementos Aumento do número de níveis eletrónicos, n, nas orbitais de valência Eletrões de valência menos energéticos mais próximos do núcleo n aumenta
Causas da variação das propriedades periódicas dos elementos Aumento do número de níveis eletrónicos, n, nas orbitais de valência Eletrões de valência menos energéticos mais próximos do núcleo n aumenta
No final do enunciado, encontrarás um anexo com alguma informação relevante à sua realização. Bom Trabalho!
 Escola Secundária Filipa de Vilhena 2010/2011 Curso: Gestão e Programação de Sistemas Informáticos Física e Química TESTE DE AVALIAÇÃO Módulo Q1 Estrutura atómica. Tabela periódica. Ligação Química. 11ºAno
Escola Secundária Filipa de Vilhena 2010/2011 Curso: Gestão e Programação de Sistemas Informáticos Física e Química TESTE DE AVALIAÇÃO Módulo Q1 Estrutura atómica. Tabela periódica. Ligação Química. 11ºAno
INTRODUÇÃO À FÍSICA DO ESTADO SÓLIDO
 FÍSICA PARA ENGENHARIA ELÉTRICA José Fernando Fragalli Departamento de Física Udesc/Joinville INTRODUÇÃO À FÍSICA DO ESTADO SÓLIDO É errado pensar que a tarefa da física é descobrir como a natureza é.
FÍSICA PARA ENGENHARIA ELÉTRICA José Fernando Fragalli Departamento de Física Udesc/Joinville INTRODUÇÃO À FÍSICA DO ESTADO SÓLIDO É errado pensar que a tarefa da física é descobrir como a natureza é.
3ª Série / Vestibular _ TD 08 _ 19 de abril
 3ª Série / Vestibular _ TD 08 _ 19 de abril 01. A corrosão de um metal é a sua destruição ou deterioração, devida à reação com o meio ambiente. O enferrujamento é o nome dado à corrosão do ferro: Fe(s)
3ª Série / Vestibular _ TD 08 _ 19 de abril 01. A corrosão de um metal é a sua destruição ou deterioração, devida à reação com o meio ambiente. O enferrujamento é o nome dado à corrosão do ferro: Fe(s)
Líquido Sólido Amorfo Sólido Cristalino
 INTRODUÇÃO AOS MATERIAIS METÁLICOS Os processos de fabricação que se encarregam de dar forma à matéria-prima, entre outras coisas, modificam a estrutura interna da mesma apresentada em cada etapa do processamento,
INTRODUÇÃO AOS MATERIAIS METÁLICOS Os processos de fabricação que se encarregam de dar forma à matéria-prima, entre outras coisas, modificam a estrutura interna da mesma apresentada em cada etapa do processamento,
Física do Estado Sólido Capítulo 2 ESTRUTURA CRISTALINA
 CAPÍTULO 2 ESTRUTURA CRISTALINA 2.1 INTRODUÇÃO Numa pequena porção de matéria existe um enorme número de átomos 1. Como se distribuirão esses átomos, nos vários tipos de sólidos, líquidos e gases conhecidos?
CAPÍTULO 2 ESTRUTURA CRISTALINA 2.1 INTRODUÇÃO Numa pequena porção de matéria existe um enorme número de átomos 1. Como se distribuirão esses átomos, nos vários tipos de sólidos, líquidos e gases conhecidos?
10 testes - GABARITO. Estrutura Atômica e Ligação Interatômica
 10 testes - GABARITO Estrutura Atômica e Ligação Interatômica 1) Calcule o número de átomos de Cu em um cilindro de cobre maciço com 1 m de altura e 1 m de diâmetro. densidade do Cu = 8,9 g/cm ; massa
10 testes - GABARITO Estrutura Atômica e Ligação Interatômica 1) Calcule o número de átomos de Cu em um cilindro de cobre maciço com 1 m de altura e 1 m de diâmetro. densidade do Cu = 8,9 g/cm ; massa
Escola Secundária c/3º CEB de Lousada
 Escola Secundária c/3º CEB de Lousada Planificação Anual da Disciplina de Matemática 9º Ano Ano Lectivo: 2011/2012 CONTEÚDOS 1º PERÍODO OBJECTIVOS E COMPETÊNCIAS Nº de Tempos (45min.) Equações -Equações
Escola Secundária c/3º CEB de Lousada Planificação Anual da Disciplina de Matemática 9º Ano Ano Lectivo: 2011/2012 CONTEÚDOS 1º PERÍODO OBJECTIVOS E COMPETÊNCIAS Nº de Tempos (45min.) Equações -Equações
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas
 Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
Aula 02 (Revisão): Ligação Química e Estruturas Cristalinas Prof. Dr. André Luiz Molisani Curso de Engenharia de Materiais e-mail: andre.molisani@fsa.br 2017 1 MATERIAL RECOMENDADO PARA ESTUDO: Capítulo
Aula 7: Cristais 0,0,1 1/2,1/2,1/2 0,0,0 0,1/2,0 0,1,0 1/2,1/2,0 1,0,0. Aula 7 - Profa. Adélia
 Aula 7: Cristais Para poder descrever a estrutura cristalina é necessário escolher uma notação para posições, direções e planos As posições são definidas dentro de um cubo com lado unitário. 0,0,1 1/2,1/2,1/2
Aula 7: Cristais Para poder descrever a estrutura cristalina é necessário escolher uma notação para posições, direções e planos As posições são definidas dentro de um cubo com lado unitário. 0,0,1 1/2,1/2,1/2
CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS
 CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS CONCEITO DE LIGAÇÃO IÔNICA UNIÃO ENTRE ÁTOMOS METÁLICOS E AMETÁLICOS OXIDAÇÃO ESTABILIZAÇÃO DO METAL REDUÇÃO ESTABILIZAÇÃO DO AMETAL LIGAÇÃO IÔNICA
CONFIGURAÇÃO DOS GASES NOBRES ÁTOMOS ESTÁVEIS E ISOLADOS CONCEITO DE LIGAÇÃO IÔNICA UNIÃO ENTRE ÁTOMOS METÁLICOS E AMETÁLICOS OXIDAÇÃO ESTABILIZAÇÃO DO METAL REDUÇÃO ESTABILIZAÇÃO DO AMETAL LIGAÇÃO IÔNICA
RELAÇÕES DE MASSA E MOL
 RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
RELAÇÃO DE MASSA E MOL A relação entre massa e quantidade Em uma gota de água de 0,05 ml há 1,67 sextilhão (1,67 x 10 21 ) de moléculas de água. A relação entre massa e quantidade A unidade de massa atômica
04 - DIFRAÇÃO DE RAIO X E DETERMINAÇÃO DA ESTRUTURA CRISTALINA
 04 - DIFRAÇÃO DE RAIO X E DETERMINAÇÃO DA ESTRUTURA CRISTALINA PROF. CÉSAR AUGUSTO DARTORA - UFPR E-MAIL: CADARTORA@ELETRICA.UFPR.BR CURITIBA-PR Roteiro do Capítulo: Por que utilizar Raios X para determinar
04 - DIFRAÇÃO DE RAIO X E DETERMINAÇÃO DA ESTRUTURA CRISTALINA PROF. CÉSAR AUGUSTO DARTORA - UFPR E-MAIL: CADARTORA@ELETRICA.UFPR.BR CURITIBA-PR Roteiro do Capítulo: Por que utilizar Raios X para determinar
Sólidos metálicos. Fe Hg
 Sólidos metálicos Fe Hg Quais são? Metalóides Não-metais Metais Sólidos metálicos partilha de e - s por muitos átomos iguais (muitos átomos e poucos electrões). Energias de ionização baixas. Propriedades
Sólidos metálicos Fe Hg Quais são? Metalóides Não-metais Metais Sólidos metálicos partilha de e - s por muitos átomos iguais (muitos átomos e poucos electrões). Energias de ionização baixas. Propriedades
5 Discussão de resultados 5.1. Variação dos parâmetros de rede com a composição (x)
 5 Discussão de resultados 5.1. Variação dos parâmetros de rede com a composição (x) As análises de difração de raios-x, a temperatura ambiente, para as soluções sólidas: Cr 2x Fe 2-2x Mo 3 O 12, Al 2x
5 Discussão de resultados 5.1. Variação dos parâmetros de rede com a composição (x) As análises de difração de raios-x, a temperatura ambiente, para as soluções sólidas: Cr 2x Fe 2-2x Mo 3 O 12, Al 2x
TEORIA DA LIGAÇÃO QUÍMICA
 TERIA DA LIGAÇÃ QUÍMICA s exercícios seguintes estão directamente relacionados com a matéria exposta no capítulo do manual da disciplina de Química Geral. São apresentados vários tipos de exercícios resposta
TERIA DA LIGAÇÃ QUÍMICA s exercícios seguintes estão directamente relacionados com a matéria exposta no capítulo do manual da disciplina de Química Geral. São apresentados vários tipos de exercícios resposta
CORRECÇÃO do 1º Teste de Ciência de Materiais COTAÇÕES. Cotaçãoo
 CORRECÇÃO do 1º Teste de Ciência de Materiais COTAÇÕES Pergunta Cotaçãoo 1. (a) 0,50 1. (b) 0,50 2. (a) 0,50 2. (b) 0,50 2. (c) 0,50 2. (d) 0,50 3. (a) 0,50 3. (b) 0,50 3. (c) 0,50 3. (d) 0,50 3. (e) 0,50
CORRECÇÃO do 1º Teste de Ciência de Materiais COTAÇÕES Pergunta Cotaçãoo 1. (a) 0,50 1. (b) 0,50 2. (a) 0,50 2. (b) 0,50 2. (c) 0,50 2. (d) 0,50 3. (a) 0,50 3. (b) 0,50 3. (c) 0,50 3. (d) 0,50 3. (e) 0,50
ESTADOS EXCITADOS: fonões, electrões livres
 Capítulo III.1 DEFEITOS (IMPERFEIÇÕES) NOS SÓLIDOS CRISTALINOS ESTADOS EXCITADOS: fonões, electrões livres DEFEITOS TRANSIENTES: fotões, electrões, neutrões tõ IMPERFEIÇÕES ESTRUTURAIS IMPORTÂNCIA DEFEITOS
Capítulo III.1 DEFEITOS (IMPERFEIÇÕES) NOS SÓLIDOS CRISTALINOS ESTADOS EXCITADOS: fonões, electrões livres DEFEITOS TRANSIENTES: fotões, electrões, neutrões tõ IMPERFEIÇÕES ESTRUTURAIS IMPORTÂNCIA DEFEITOS
Sistema de coordenadas
 Sistema de coordenadas Sistema de coordenadas Coordenadas cartesianas Coordenadas polares Transformação sistema de coordenadas Coordenadas relativas Sistema de coordenadas cartesianas Sistema de coordenadas
Sistema de coordenadas Sistema de coordenadas Coordenadas cartesianas Coordenadas polares Transformação sistema de coordenadas Coordenadas relativas Sistema de coordenadas cartesianas Sistema de coordenadas
UNIDADE 1 ESTATÍSTICA E PROBABILIDADES 9 tempos de 45 minutos
 EBIAH 9º ANO PLANIFICAÇÃO A LONGO E MÉDIO PRAZO EBIAH PLANIFICAÇÃO A MÉDIO PRAZO 9º ANO - 1º Período Integração dos alunos 1 tempo ESTATÍSTICA A aptidão para entender e usar de modo adequado a linguagem
EBIAH 9º ANO PLANIFICAÇÃO A LONGO E MÉDIO PRAZO EBIAH PLANIFICAÇÃO A MÉDIO PRAZO 9º ANO - 1º Período Integração dos alunos 1 tempo ESTATÍSTICA A aptidão para entender e usar de modo adequado a linguagem
10º Ano de Matemática A Geometria no Plano e no Espaço I 2º Teste de avaliação Proposta de resolução. Grupo I
 10º Ano de Matemática A Geometria no Plano e no Espaço I º Teste de avaliação Proposta de resolução Grupo I 8 1. (B) Os pontos A 3,7 e B 5,7 são simétricos em A B relação à recta de equação 1 6 4. (D)
10º Ano de Matemática A Geometria no Plano e no Espaço I º Teste de avaliação Proposta de resolução Grupo I 8 1. (B) Os pontos A 3,7 e B 5,7 são simétricos em A B relação à recta de equação 1 6 4. (D)
PRINCÍPIOS DA ESTRUTURA EM SÓLIDOS. QFL-4010 Prof. Gianluca C. Azzellini
 PRINCÍPIOS DA ESTRUTURA EM SÓLIDOS Estrutura dos Sólidos Tipo Exemplo Unidades Natureza Estruturais da ligação Iônico NaCl, CaCl 2 Íons positivos Iônica - Atração e negativos Eletrostática forte Metálico
PRINCÍPIOS DA ESTRUTURA EM SÓLIDOS Estrutura dos Sólidos Tipo Exemplo Unidades Natureza Estruturais da ligação Iônico NaCl, CaCl 2 Íons positivos Iônica - Atração e negativos Eletrostática forte Metálico
2 Características e propriedades de um sistema cúbico
 Características e propriedades de um sistema cúbico 17 2 Características e propriedades de um sistema cúbico Nesse capítulo serão apresentadas as características e propriedades de um sistema cúbico necessárias
Características e propriedades de um sistema cúbico 17 2 Características e propriedades de um sistema cúbico Nesse capítulo serão apresentadas as características e propriedades de um sistema cúbico necessárias
Resolução do 1º Teste de Ciência de Materiais. Lisboa, 27 de Abril de 2010 COTAÇÕES
 Resolução do 1º Teste de Ciência de Materiais Lisboa, 27 de Abril de 2010 COTAÇÕES Pergunta Cotação 1. (a) 0,50 1. (b) 0,50 1. (c) 0,50 1. (d) 0,50 2. (a) 0,50 2. (b) 0,50 2. (c) 0,50 2. (d) 0,50 2. (e)
Resolução do 1º Teste de Ciência de Materiais Lisboa, 27 de Abril de 2010 COTAÇÕES Pergunta Cotação 1. (a) 0,50 1. (b) 0,50 1. (c) 0,50 1. (d) 0,50 2. (a) 0,50 2. (b) 0,50 2. (c) 0,50 2. (d) 0,50 2. (e)
Descrição das Atividades
 Criminalística - A Física auxiliando a Polícia a desvendar crimes Bloco - Difração de Raio-X O estudo da difração do laser a partir do LP, DVD e do CD será utilizado como forma analógica a fim de sensibilizar
Criminalística - A Física auxiliando a Polícia a desvendar crimes Bloco - Difração de Raio-X O estudo da difração do laser a partir do LP, DVD e do CD será utilizado como forma analógica a fim de sensibilizar
No desenvolvimento deste guião, procure sempre colocar as denominações referidas em cada ponto.
 1 Este 3º guião contém atividades elementares com a finalidade de favorecer o reconhecimento e a consolidação das funções de algumas ferramentas do programa de geometria dinâmica Geogebra. Neste guião,
1 Este 3º guião contém atividades elementares com a finalidade de favorecer o reconhecimento e a consolidação das funções de algumas ferramentas do programa de geometria dinâmica Geogebra. Neste guião,
Disciplina: Vias de Comunicação. Parte I - Traçado em Planta (2/2)
 Licenciatura em Engenharia Civil e em Engenharia do Território Disciplina: Vias de Comunicação Prof. Responsável: Prof. Paulino Pereira Parte I - Traçado em Planta (/) Instituto Superior Técnico / Licenciaturas
Licenciatura em Engenharia Civil e em Engenharia do Território Disciplina: Vias de Comunicação Prof. Responsável: Prof. Paulino Pereira Parte I - Traçado em Planta (/) Instituto Superior Técnico / Licenciaturas
Ano letivo 2014/2015 8º ano Ficha formativa de Ciências Físico-Químicas 8º ano Átomos, moléculas, iões e substâncias iónicas
 Ano letivo 2014/2015 8º ano Ficha formativa de Ciências Físico-Químicas 8º ano Átomos, moléculas, iões e substâncias iónicas Átomos e moléculas 1. Completa as frases: O átomo é uma partícula eletricamente,
Ano letivo 2014/2015 8º ano Ficha formativa de Ciências Físico-Químicas 8º ano Átomos, moléculas, iões e substâncias iónicas Átomos e moléculas 1. Completa as frases: O átomo é uma partícula eletricamente,
QUESTÕES DE EXAME Tabela Periódica. Física e Química A
 QUESTÕES DE EXAME 2 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
QUESTÕES DE EXAME 2 Física e Química A Questões de provas nacionais realizadas entre 2008 e 2014 organizados por subdomínio e por secção, por ordem cronológica. Os itens estão identificados por data e
Arranjos Atômicos 26/3/2006 CM I 1
 Arranjos Atômicos 26/3/2006 CM I 1 26/3/2006 CM I 2 Arranjo Periódico de Átomos Sólido: constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido; Esta regularidade:»
Arranjos Atômicos 26/3/2006 CM I 1 26/3/2006 CM I 2 Arranjo Periódico de Átomos Sólido: constituído por átomos (ou grupo de átomos) que se distribuem de acordo com um ordenamento bem definido; Esta regularidade:»
Disciplina de Didáctica da Química I
 Disciplina de Didáctica da Química I Texto de Apoio Estrutura dos átomos no ensino básico e secundário Visão crítica / síntese dos tópicos de química nos ensinos básico e secundário A - ESTRUTURA DOS ÁTOMOS
Disciplina de Didáctica da Química I Texto de Apoio Estrutura dos átomos no ensino básico e secundário Visão crítica / síntese dos tópicos de química nos ensinos básico e secundário A - ESTRUTURA DOS ÁTOMOS
36ª Olimpíada Brasileira de Matemática GABARITO Segunda Fase
 36ª Olimpíada Brasileira de Matemática GABARITO Segunda Fase Soluções Nível 2 Segunda Fase Parte A CRITÉRIO DE CORREÇÃO: PARTE A Na parte A serão atribuídos 5 pontos para cada resposta correta e a pontuação
36ª Olimpíada Brasileira de Matemática GABARITO Segunda Fase Soluções Nível 2 Segunda Fase Parte A CRITÉRIO DE CORREÇÃO: PARTE A Na parte A serão atribuídos 5 pontos para cada resposta correta e a pontuação
Espectroscopia de Raios X
 Espectroscopia de Raios X 1. Introdução Raios X O conhecimento da estrutura dos materiais, a maioria dos quais são cristalinos no estado sólido, s é fundamental para a caracterização das propriedades físicas
Espectroscopia de Raios X 1. Introdução Raios X O conhecimento da estrutura dos materiais, a maioria dos quais são cristalinos no estado sólido, s é fundamental para a caracterização das propriedades físicas
Figura 9.1: Corpo que pode ser simplificado pelo estado plano de tensões (a), estado de tensões no interior do corpo (b).
 9 ESTADO PLANO DE TENSÕES E DEFORMAÇÕES As tensões e deformações em um ponto, no interior de um corpo no espaço tridimensional referenciado por um sistema cartesiano de coordenadas, consistem de três componentes
9 ESTADO PLANO DE TENSÕES E DEFORMAÇÕES As tensões e deformações em um ponto, no interior de um corpo no espaço tridimensional referenciado por um sistema cartesiano de coordenadas, consistem de três componentes
Lista 2 de Exercícios Geometria Analítica e Cálculo Vetorial
 Lista 2 de Exercícios Geometria Analítica e Cálculo Vetorial 9 de abril de 2017 1. Dados os pontos R = (1, 2) e S = ( 2, 2) (a) Encontrar as coordenadas do vetor que tem origem no ponto R e o extremos
Lista 2 de Exercícios Geometria Analítica e Cálculo Vetorial 9 de abril de 2017 1. Dados os pontos R = (1, 2) e S = ( 2, 2) (a) Encontrar as coordenadas do vetor que tem origem no ponto R e o extremos
Unidade Tabela Periódica
 10.º ano - Física e Química A História da Tabela Periódica De onde veio a Tabela Periódica? A tentativa de organizar os elementos químicos já vem desde o pai da Química, Lavoisier. No entanto, durante
10.º ano - Física e Química A História da Tabela Periódica De onde veio a Tabela Periódica? A tentativa de organizar os elementos químicos já vem desde o pai da Química, Lavoisier. No entanto, durante
MINISTÉRIO DA EDUCAÇÃO E DO DESPORTO UNIVERSIDADE FEDERAL DE VIÇOSA DEPARTAMENTO DE MATEMÁTICA
 MINISTÉRIO DA EDUCAÇÃO E DO DESPORTO UNIVERSIDADE FEDERAL DE VIÇOSA DEPARTAMENTO DE MATEMÁTICA 1 a LISTA DE EXERCÍCIOS DE MAT 17 1. Suponha que uma força de 1 newtons é aplicada em um objeto ao longo do
MINISTÉRIO DA EDUCAÇÃO E DO DESPORTO UNIVERSIDADE FEDERAL DE VIÇOSA DEPARTAMENTO DE MATEMÁTICA 1 a LISTA DE EXERCÍCIOS DE MAT 17 1. Suponha que uma força de 1 newtons é aplicada em um objeto ao longo do
1. Algumas Propriedades dos Líquidos
 1. Algumas Propriedades dos Líquidos 1.1 Viscosidade Alguns líquidos, como o melaço e o óleo de motor, fluem lentamente; enquanto que outros, como a água e a gasolina, fluem rapidamente. A resistência
1. Algumas Propriedades dos Líquidos 1.1 Viscosidade Alguns líquidos, como o melaço e o óleo de motor, fluem lentamente; enquanto que outros, como a água e a gasolina, fluem rapidamente. A resistência
Exercícios de Programação e Computação para Arquitectura. António Menezes Leitão
 Exercícios de Programação e Computação para Arquitectura António Menezes Leitão 7 de Novembro de 2008 Figura 1: Treliça composta por elementos triangulares iguais. b a 0 b 0 a 1 1 a 2 c 0 c 1 c 2 Figura
Exercícios de Programação e Computação para Arquitectura António Menezes Leitão 7 de Novembro de 2008 Figura 1: Treliça composta por elementos triangulares iguais. b a 0 b 0 a 1 1 a 2 c 0 c 1 c 2 Figura
Matemática 3º Ciclo. Planificação Anual 7.º ano. N.º de aulas. Objectivos 1.º PERÍODO. Ano Lectivo 2009/2010. Apresentação 1. Teste Diagnóstico 2
 i Temas Sub-temas Objectivos 1.º PERÍODO Apresentação 1 Teste Diagnóstico 2 Múltiplos e divisores. Critérios de divisibilidade. Obter números, a partir de outros, por composição e decomposição; Números
i Temas Sub-temas Objectivos 1.º PERÍODO Apresentação 1 Teste Diagnóstico 2 Múltiplos e divisores. Critérios de divisibilidade. Obter números, a partir de outros, por composição e decomposição; Números
Coordenadas no espaço - 10.º Ano. Num referencial cartesiano Oxyz foi representado o cubo [OEFGDABC] de medida do comprimento da aresta igual a 6.
![Coordenadas no espaço - 10.º Ano. Num referencial cartesiano Oxyz foi representado o cubo [OEFGDABC] de medida do comprimento da aresta igual a 6. Coordenadas no espaço - 10.º Ano. Num referencial cartesiano Oxyz foi representado o cubo [OEFGDABC] de medida do comprimento da aresta igual a 6.](/thumbs/56/38954920.jpg) Coordenadas no espaço - 10.º Ano Condições no espaço I Num referencial cartesiano Oxyz foi representado o cubo [OEFGDABC] de medida do comprimento da aresta igual a 6. De acordo com a figura: a) Indica
Coordenadas no espaço - 10.º Ano Condições no espaço I Num referencial cartesiano Oxyz foi representado o cubo [OEFGDABC] de medida do comprimento da aresta igual a 6. De acordo com a figura: a) Indica
Atividade complementar. Substâncias e transformações químicas, entendendo os aspectos quantitativos
 Atividade complementar Substâncias e transformações químicas, entendendo os aspectos quantitativos Esta atividade tem como objetivo complementar e aprofundar os estudos sobre as transformações químicas,
Atividade complementar Substâncias e transformações químicas, entendendo os aspectos quantitativos Esta atividade tem como objetivo complementar e aprofundar os estudos sobre as transformações químicas,
Cristalografia do Si. Célula unitária. Tipo Diamante
 3.2 Cristalografia do Si Do ponto de vista atômico, o silício faz um arranjo atômico onde cada átomo faz 4 ligações. Num cristal de Si, esses átomos se ligam mantendo as orientações relativas ao longo
3.2 Cristalografia do Si Do ponto de vista atômico, o silício faz um arranjo atômico onde cada átomo faz 4 ligações. Num cristal de Si, esses átomos se ligam mantendo as orientações relativas ao longo
ESTRUTURAS CRISTALINAS - TEORIA
 ESTRUTURAS CRISTALINAS - TEORIA Introdução Sólidos são compostos que apresentam uma alta regularidade estrutural. Com exceção dos sólidos amorfos, nos quais essa regularidade só existe em um curto espaço,
ESTRUTURAS CRISTALINAS - TEORIA Introdução Sólidos são compostos que apresentam uma alta regularidade estrutural. Com exceção dos sólidos amorfos, nos quais essa regularidade só existe em um curto espaço,
QUÍMICA - 3 o ANO MÓDULO 07 LIGAÇÕES QUÍMICAS
 QUÍMICA - 3 o ANO MÓDULO 07 LIGAÇÕES QUÍMICAS O C Na Cl + - Na Cl Mg Cl Cl 2+ Mg Cl - 2 F Al F Al F F +x -y B y x Fórmula Eletrônica ou de Lewis Fórmula Estrutural Fórmula Molecular 2 s O O O O s O O O
QUÍMICA - 3 o ANO MÓDULO 07 LIGAÇÕES QUÍMICAS O C Na Cl + - Na Cl Mg Cl Cl 2+ Mg Cl - 2 F Al F Al F F +x -y B y x Fórmula Eletrônica ou de Lewis Fórmula Estrutural Fórmula Molecular 2 s O O O O s O O O
Escola Secundária com 3º ciclo D. Dinis 10º Ano de Matemática A TEMA 1 GEOMETRIA NO PLANO E NO ESPAÇO I. TPC nº 7 entregar no dia
 Escola Secundária com 3º ciclo D. Dinis 10º Ano de Matemática A TEMA 1 GEOMETRIA NO PLANO E NO ESPAÇO I TPC nº 7 entregar no dia 4 0 013 1. O cubo da figura tem as faces paralelas aos planos coordenados
Escola Secundária com 3º ciclo D. Dinis 10º Ano de Matemática A TEMA 1 GEOMETRIA NO PLANO E NO ESPAÇO I TPC nº 7 entregar no dia 4 0 013 1. O cubo da figura tem as faces paralelas aos planos coordenados
GERAIS. Para além dos objectivos do domínio dos valores e atitudes, Desenvolver a capacidade de comunicar; Usar Noções de lógica.
 TEMA I GEOMETRIA NO PLANO E NO ESPAÇO Unidade 1: Lógica e Raciocínio Matemático (Programa pags 36 e 37) LÓGICA GERAIS. Noções de Termo e de Proposição;. Conectivos Lógicos:Negação, Disjunção e Conjunção;.
TEMA I GEOMETRIA NO PLANO E NO ESPAÇO Unidade 1: Lógica e Raciocínio Matemático (Programa pags 36 e 37) LÓGICA GERAIS. Noções de Termo e de Proposição;. Conectivos Lógicos:Negação, Disjunção e Conjunção;.
MATEMÁTICA Plano anual 2008/2009 7º Ano 1º PERÍODO. Nº de Segmentos Conhecer melhor os números 12 Proporcionalidade directa
 MATEMÁTICA Plano anual 2008/2009 7º Ano 1º PERÍODO Temas Segmentos Conhecer melhor os números 12 Proporcionalidade directa Semelhança de figuras Números racionais 10 14 8 Apresentação/Revisões/Testes/Correcções
MATEMÁTICA Plano anual 2008/2009 7º Ano 1º PERÍODO Temas Segmentos Conhecer melhor os números 12 Proporcionalidade directa Semelhança de figuras Números racionais 10 14 8 Apresentação/Revisões/Testes/Correcções
Versão 1. Utiliza apenas caneta ou esferográfica de tinta indelével, azul ou preta.
 Teste Intermédio de Ciências Físico-Químicas Versão 1 Teste Intermédio Ciências Físico-Químicas Caderno 1 Versão 1 Duração do Teste: 40 min (Caderno 1) + 10 min (pausa) + 40 min (Caderno 2) 19.05.2011
Teste Intermédio de Ciências Físico-Químicas Versão 1 Teste Intermédio Ciências Físico-Químicas Caderno 1 Versão 1 Duração do Teste: 40 min (Caderno 1) + 10 min (pausa) + 40 min (Caderno 2) 19.05.2011
numérico é: a) H 2 CO 3 b) H 4 P 2 O 7 c) C 6 H 12 O 6 d) Al 2 (SO 4 ) 3 e) Fe 2 (CO 3 ) 3 f) Ca 3 (PO 4 ) 2 g) (NH 4 ) 2 S
 Constante de Avogadro (antigamente chamada número de Avogadro é o número de átomos de 1 C contidos em 0,01 kg de 1 C. Seu valor numérico é: Cálculos Químicos Massa atômica, massa molecular e mol átomo
Constante de Avogadro (antigamente chamada número de Avogadro é o número de átomos de 1 C contidos em 0,01 kg de 1 C. Seu valor numérico é: Cálculos Químicos Massa atômica, massa molecular e mol átomo
1.º Teste de Física e Química A 10.º A Out minutos /
 .º Teste de Física e Química A 0.º A Out. 202 90 minutos / Nome: n.º Classificação Professor E.E. As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas cinco hipóteses
.º Teste de Física e Química A 0.º A Out. 202 90 minutos / Nome: n.º Classificação Professor E.E. As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas cinco hipóteses
FIGURAS PLANAS E O CÁLCULO DE ÁREAS
 unifmu Nome: Professor: Ricardo Luís de Souza Curso de Design Matemática Aplicada Atividade Exploratória III Turma: Data: FIGURAS PLANAS E O CÁLCULO DE ÁREAS Objetivo: Rever o conceito de área de figuras
unifmu Nome: Professor: Ricardo Luís de Souza Curso de Design Matemática Aplicada Atividade Exploratória III Turma: Data: FIGURAS PLANAS E O CÁLCULO DE ÁREAS Objetivo: Rever o conceito de área de figuras
ISOMETRIAS - TRANSLAÇÃO, ROTAÇÃO E REFLEXÃO -
 ISOMETRIAS - TRANSLAÇÃO, ROTAÇÃO E REFLEXÃO - MATEMÁTICA 8º Ano Professora: Patrícia Isidoro Antes de Começar para recordar Posição relativa de duas retas no plano Retas Concorrentes Perpendiculares Oblíquas
ISOMETRIAS - TRANSLAÇÃO, ROTAÇÃO E REFLEXÃO - MATEMÁTICA 8º Ano Professora: Patrícia Isidoro Antes de Começar para recordar Posição relativa de duas retas no plano Retas Concorrentes Perpendiculares Oblíquas
Os orbitais 2p (3 orb p = px + py + pz ) estão na segunda camada energética, portanto mais afastados que o orbital esférico 2s, logo mais energético.
 1 - Introdução Os elementos mais importantes para a química orgânica são C, H, N e O. Estes elementos estão nos dois primeiros períodos da tabela periódica e os seus elétrons estão distribuídos próximos
1 - Introdução Os elementos mais importantes para a química orgânica são C, H, N e O. Estes elementos estão nos dois primeiros períodos da tabela periódica e os seus elétrons estão distribuídos próximos
TM229 - Introdução aos Materiais
 TM229 - Introdução aos Materiais 2009.2 Ana Sofia C. M. D Oliveira Introdução aos materiais O que determina o comportamento/propriedades dos materiais? Composição química e microestrutura Cada uma destas
TM229 - Introdução aos Materiais 2009.2 Ana Sofia C. M. D Oliveira Introdução aos materiais O que determina o comportamento/propriedades dos materiais? Composição química e microestrutura Cada uma destas
3ª Série do Ensino Médio
 3ª Série do Ensino Médio 01. Num laboratório, foi feito um estudo sobre a evolução de uma população de vírus. Ao final de um minuto do início das observações, existia 1 elemento na população; ao final
3ª Série do Ensino Médio 01. Num laboratório, foi feito um estudo sobre a evolução de uma população de vírus. Ao final de um minuto do início das observações, existia 1 elemento na população; ao final
As reações de oxidação e redução, também chamadas de reações redox, são fenômenos muito frequentes no nosso cotidiano. Como exemplo, temos: - Um
 Números de Oxidação As reações de oxidação e redução, também chamadas de reações redox, são fenômenos muito frequentes no nosso cotidiano. Como exemplo, temos: - Um material sofrendo combustão (queima);
Números de Oxidação As reações de oxidação e redução, também chamadas de reações redox, são fenômenos muito frequentes no nosso cotidiano. Como exemplo, temos: - Um material sofrendo combustão (queima);
F I C H A D E D I A G N O S E. Curso CCS e CCT Componente de Formação Geral Data / / Nome Nº GRUPO I
 COLÉGIO INTERNACIONAL DE VILAMOURA INTERNATIONAL SCHOOL Disciplina Matemática A T E S T E D E A V A L I A Ç Ã O F I C H A D E D I A G N O S E Ensino Secundário Ano 11º - A e B Duração 90 min Curso CCS
COLÉGIO INTERNACIONAL DE VILAMOURA INTERNATIONAL SCHOOL Disciplina Matemática A T E S T E D E A V A L I A Ç Ã O F I C H A D E D I A G N O S E Ensino Secundário Ano 11º - A e B Duração 90 min Curso CCS
EXAME DE SELEÇÃO PARA O PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA DA UNIVERSIDADE FEDERAL DO CEARÁ (PPGQ-UFC)/2015.2
 Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. (085)3366.9981 CEP 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA
Universidade Federal do Ceará Centro de Ciências Programa de Pós-Graduação em Química Caixa Postal 12.200 Tel. (085)3366.9981 CEP 60.450-970 Fortaleza - Ceará - Brasil EXAME DE SELEÇÃO PARA O PROGRAMA
Metais no Organismo Humano
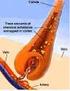 Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Metais no Organismo Humano Relativamente à necessidade biológica podem classificar-se Metais Essenciais: Metais Tóxicos: sódio, potássio, cálcio, magnésio, ferro, crómio, zinco, cobalto, manganês e níquel.
Ciência de Materiais. LEGI. ESTRUTURA CRISTALINA. 1. I) Desenhe em cubos unitários os planos com os seguintes índices de Miller:
 1. I) Desenhe em cubos unitários os planos com os seguintes índices de Miller: a) ( 1 0 1) b) ( 0 3 1) c) ( 1 2 3) II) Desenhe em cubos unitários as direcções com os seguintes índices: a) [ 1 0 1] b) [
1. I) Desenhe em cubos unitários os planos com os seguintes índices de Miller: a) ( 1 0 1) b) ( 0 3 1) c) ( 1 2 3) II) Desenhe em cubos unitários as direcções com os seguintes índices: a) [ 1 0 1] b) [
Olimpíadas de Química+ Final, Aveiro 9 de maio de 2015
 Olimpíadas de Química+ Final, Aveiro 9 de maio de 2015 Nome:.... Escola:....... Classificação teórica (60%) Classificação prática (40%) Classificação final universidade de aveiro departamento de química
Olimpíadas de Química+ Final, Aveiro 9 de maio de 2015 Nome:.... Escola:....... Classificação teórica (60%) Classificação prática (40%) Classificação final universidade de aveiro departamento de química
