Química Reações Orgânicas Vestibular - FUVEST
|
|
|
- Manuel Francisco Silveira Alencastre
- 7 Há anos
- Visualizações:
Transcrição
1 Química Reações Orgânicas Vestibular - FUVEST 1. (Fuvest 2015) Compostos com um grupo NO 2 ligado a um anel aromático podem ser reduzidos, sendo o grupo NO 2 transformado em NH 2, como representado abaixo. Compostos alifáticos ou aromáticos com grupo NH 2, por sua vez, podem ser transformados em amidas ao reagirem com anidrido acético. Essa transformação é chamada de acetilação do grupo amino, como exemplificado abaixo. Essas transformações são utilizadas para a produção industrial do paracetamol, que é um fármaco empregado como analgésico e antitérmico. a) Qual é o reagente de partida que, após passar por redução e em seguida por acetilação, resulta no paracetamol? Escreva a fórmula estrutural desse reagente. O fenol (C6H5OH) também pode reagir com anidrido acético. Nessa transformação, forma se acetato de fenila. b) Na etapa de acetilação do processo industrial de produção do paracetamol, formam se, também, ácido acético e um subproduto diacetilado (mas monoacetilado no nitrogênio). Complete o esquema a seguir, de modo a representar a equação química balanceada de formação do subproduto citado. 2. (Fuvest 2015) A preparação de um biodiesel, em uma aula experimental, foi feita utilizando se etanol, KOH e óleo de soja, que é constituído principalmente por triglicerídeos. A reação que ocorre nessa preparação de biodiesel é chamada transesterificação, em que um 1
2 éster reage com um álcool, obtendo se um outro éster. Na reação feita nessa aula, o KOH foi utilizado como catalisador. O procedimento foi o seguinte: 1ª etapa: Adicionou se 1,5 g de KOH a 35 ml de etanol, agitando se continuamente a mistura. 2ª etapa: Em um erlenmeyer, foram colocados 100 ml de óleo de soja, aquecendo se em banho maria, a uma temperatura de 45 C. Adicionou se a esse óleo de soja a solução de catalisador, agitando se por mais 20 minutos. 3ª etapa: Transferiu se a mistura formada para um funil de separação, e esperou se a separação das fases, conforme representado na figura abaixo. a) Toda a quantidade de KOH, empregada no procedimento descrito, se dissolveu no volume de etanol empregado na primeira etapa? Explique, mostrando os cálculos. b) Considere que a fórmula estrutural do triglicerídeo contido no óleo de soja é a mostrada a seguir. Escreva a fórmula estrutural do biodiesel formado. c) Se, na primeira etapa desse procedimento, a solução de KOH em etanol fosse substituída por um excesso de solução de KOH em água, que produtos se formariam? Responda, completando o esquema a seguir com as fórmulas estruturais dos dois compostos que se formariam e balanceando a equação química. 2
3 Dado: solubilidade do KOH em etanol a 25 C 40 g em 100 ml 3. (Fuvest 2015) O glicerol pode ser polimerizado em uma reação de condensação catalisada por ácido sulfúrico, com eliminação de moléculas de água, conforme se representa a seguir: a) Considerando a estrutura do monômero, pode se prever que o polímero deverá ser formado por cadeias ramificadas. Desenhe a fórmula estrutural de um segmento do polímero, mostrando quatro moléculas do monômero ligadas e formando uma cadeia ramificada. Para investigar a influência da concentração do catalisador sobre o grau de polimerização do glicerol (isto é, a porcentagem de moléculas de glicerol que reagiram), foram efetuados dois ensaios: 25 g de glicerol agitação e aquecimento Ensaio 1: polímero 1 0,5% (em mol) de H durante 4h 2SO4 25 g de glicerol agitação e aquecimento Ensaio 2 : polímero 2 3% (em mol) de H durante 4h 2SO4 Ao final desses ensaios, os polímeros 1 e 2 foram analisados separadamente. Amostras de cada um deles foram misturadas com diferentes solventes, observando se em que extensão ocorria a dissolução parcial de cada amostra. A tabela a seguir mostra os resultados dessas análises: Amostra Solubilidade (% em massa) Hexano (solvente apolar) polímero polímero Etanol (solvente polar) b) Qual dos polímeros formados deve apresentar menor grau de polimerização? Explique sua resposta, fazendo referência à solubilidade das amostras em etanol. 4. (Fuvest 2014) Ésteres podem reagir com álcoois ou com aminas, como exemplificado a seguir: 3
4 a) Escreva as fórmulas estruturais dos produtos da reação entre acetato de etila (CH3CO2CH2CH3) e metilamina (CH3NH2). Considere o seguinte esquema de reação: O composto intermediário se transforma no produto final, por meio de uma reação intramolecular que resulta na formação de um novo ciclo na estrutura molecular do produto. b) Escreva, nos espaços indicados, as fórmulas estruturais dos compostos e. 5. (Fuvest 2013) Os chamados compostos de Grignard foram preparados, pela primeira vez, por Victor Grignard no final do século XIX. Esses compostos podem ser obtidos pela reação de um haleto de alquila ou haleto de arila com magnésio metálico, utilizando um éter como solvente, conforme representado pelas seguintes equações químicas: Os compostos de Grignard são muito úteis, por exemplo, para preparar alcoóis a partir de cetonas ou aldeídos, conforme representado abaixo: 4
5 Os compostos de Grignard também reagem com aminas, alcoóis e ácidos carboxílicos, conforme representado pelas seguintes equações químicas: RNH2 R'MgBr R'H RNHMgBr ROH R'MgBr R'H ROMgBr RCO2H R'MgBr R'H RCOOMgBr Assim sendo, para preparar um composto de Grignard, é preciso escolher corretamente o haleto orgânico, que não deve conter grupos funcionais que reajam com o composto de Grignard que se pretende preparar. a) Dentre os cinco compostos representados abaixo, apenas dois são adequados para reagir com magnésio e preparar compostos de Grignard. Indique esses dois compostos, justificando sua escolha. b) Escreva a fórmula estrutural do produto orgânico da reação representada abaixo. 6. (Fuvest 2010) Na dupla hélice do DNA, as duas cadeias de nucleotídeos são mantidas unidas por ligações de hidrogênio entre as bases nitrogenadas de cada cadeia. Duas dessas bases são a citosina (C) e a guanina (G). 5
6 a) Mostre a formula estrutural do par C-G, indicando claramente as ligações de hidrogênio que nele existem. No nosso organismo, a síntese das proteínas e comandada pelo RNA mensageiro, em cuja estrutura estão presentes as bases uracila (U), citosina (C), adenina (A) e guanina (G). A ordem em que aminoácidos se ligam para formar uma proteína e definida por tríades de bases, presentes no RNA mensageiro, cada uma correspondendo a um determinado aminoácido. Algumas dessas tríades, com os aminoácidos correspondentes, estão representadas na tabela da folha de respostas. Assim, por exemplo, a tríade GUU corresponde ao aminoácido valina. Letra da esquerda Letra do meio Letra da direita G U U b) Com base na tabela da folha de respostas e na estrutura dos aminoácidos aqui apresentados, mostre a fórmula estrutural do tripeptídeo, cuja sequência de aminoácidos foi definida pela ordem das tríades no RNA mensageiro, que era GCA, GGA, GGU. O primeiro aminoácido desse tripeptídeo mantém livre seu grupo amino. Letra da esquerda Letra do meio U C A G G Val Ala Asp Gly U G Val Ala Asp Gly C G Val Ala Glu Gly A G val Ala Glu Gly G Letra da direita 7. (Fuvest 2010) Pesquisadores da Universidade de São Paulo mostraram que as bromélias, que vivem no alto de árvores e acumulam água entre suas folhas, obtêm nitrogênio da ureia presente nessa água e que é proveniente da urina dos anfíbios que aí habitam. Nessas plantas, a ureia sofre uma reação catalisada pela enzima uréase, que origina amônia e gás carbônico. Em outra reação, catalisada pela enzima sintetase de glutamina, a amônia formada é utilizada na produção do aminoácido glutamina. 6
7 Revista Pesquisa FAPESP, 157, março de Adaptado. a) Escreva a equação química balanceada que representa a reação, citada no texto, em que são produzidos amônia e gás carbônico. b) Em que processos, associados ao crescimento das plantas, as bromélias podem utilizar o gás carbônico e a glutamina? 8. (Fuvest 2010) A hidroxicetona (I) pode ser oxidada à dicetona (II), pela ação de ácido nítrico concentrado, com formação do gás N2O4. Utilizando formulas moleculares, a) escreva a equação química balanceada que representa a semirreação de oxidação da hidroxicetona (I). b) escreva a equação química balanceada que representa a semirreação de redução do íon nitrato. c) com base nas semirreações dos itens a) e b), escreva a equação química global balanceada que representa a transformação de (I) em (II) e do íon nitrato em N2O4. 9. (Fuvest 2010) O endosperma do grão de milho armazena amido, um polímero natural. A hidrólise enzimática do amido produz glicose. a) Em que fase do desenvolvimento da planta, o amido do grão de milho é transformado em glicose? b) Cite o processo celular em que a glicose é utilizada. O amido de milho é utilizado na produção industrial do polímero biodegradável PLA, conforme esquematizado: O PLA é um poliéster, no qual moléculas de ácido láctico se uniram por sucessivas reações de esterificação. c) Escreva a equação química balanceada que representa a reação de esterificação entre duas moléculas de ácido láctico. 7
8 10. (Fuvest 2011) A espectrometria de massas é uma técnica muito utilizada para a identificação de compostos. Nesse tipo de análise, um feixe de elétrons de alta energia provoca a quebra de ligações químicas, gerando fragmentos das moléculas da amostra, os quais são registrados como linhas verticais em um gráfico, chamado espectro de massas. Nesse gráfico, em abscissas, são representadas as massas molares dos fragmentos formados e, em ordenadas, as abundâncias desses fragmentos. Quando alcoóis secundários são analisados por espectrometria de massas, resultam várias quebras de ligações, sendo a principal a que ocorre entre o átomo de carbono ligado ao grupo OH e o átomo de carbono vizinho. Para o 3-octanol, por exemplo, há duas possibilidades para essa quebra, como mostrado abaixo. Forma-se, em maior abundância, o fragmento no qual o grupo OH está ligado à cadeia carbônica mais curta. A reação de hidratação do cis-2-penteno produz dois alcoóis secundários que podem ser identificados por seus espectros de massas (A e B), os quais estão apresentados no espaço destinado à resposta desta questão. a) Escreva a equação química que representa a reação de hidratação do cis-2-penteno, mostrando os dois alcoóis secundários que se formam. b) Atribua, a cada espectro de massas, a fórmula estrutural do álcool correspondente. Indique, em cada caso, a ligação que foi rompida para gerar o fragmento mais abundante. H C O massa molar g mol (Fuvest 2011) A borracha natural apresenta propriedades que limitam o seu uso. Por exemplo, ao ser aquecida, torna-se mole e pegajosa. O processo de vulcanização da borracha, desenvolvido a partir de 1839 e exemplificado na figura abaixo, permitiu a produção de pneus, mangueiras e outros utensílios incorporados à vida cotidiana. A utilidade industrial da borracha estimulou sua exploração comercial a partir das seringueiras da Amazônia. A produção brasileira desse produto dominou o mercado mundial até 1913, quando foi superada pela produção proveniente do cultivo de seringueiras na Ásia. a) Por que a adição de enxofre, no processo de vulcanização, altera as características mecânicas da borracha natural? b) Supondo que 16 g de enxofre foram adicionados a 1000 g de borracha natural pelo processo de vulcanização, exemplificado no esquema acima, responda: Que porcentagem de 8
9 unidades de isopreno foi modificada por ligações cruzadas? (Massas molares: H = 1 g/mol, C = 12 g/mol e S = 32 g/mol) c) Cite e explique uma consequência social provocada pela exploração da borracha na Amazônia até (Fuvest 2011) Aldeídos aromáticos reagem com anidrido acético, produzindo ácidos com uma ligação dupla entre os dois átomos de carbono adjacentes ao grupo carboxila, como exemplificado: Fenóis também podem reagir com anidrido acético, como exemplificado: Um novo polímero, PAHF, foi preparado a partir da vanilina, por uma sequência de etapas. Na primeira delas, ocorrem duas transformações análogas às já apresentadas. Seguem as representações da vanilina e do PAHF. a) Escreva a equação química balanceada que representa a reação da vanilina com anidrido acético. O composto aromático obtido na reação descrita no item a pode ser transformado no polímero PAHF pela seguinte sequência de reações: hidrogenação, hidrólise e polimerização. b) Considerando a ligação entre duas unidades monoméricas no polímero, como se pode classificar o PAHF? Seria: poliamida, poliálcool, poliácido, poliéster ou polialdeído? Explique. 13. (Fuvest 2011) Os componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica: 9
10 Nessa fórmula, os grupos R, R' e R" representam longas cadeias de carbono, com ou sem ligações duplas. A partir dos óleos vegetais, pode-se preparar sabão ou biodiesel, por hidrólise alcalina ou transesterificação, respectivamente. Para preparar sabão, tratam-se os triglicerídeos com hidróxido de sódio aquoso e, para preparar biodiesel, com metanol ou etanol. a) Escreva a equação química que representa a transformação de triglicerídeos em sabão. b) Escreva uma equação química que representa a transformação de triglicerídeos em biodiesel. 14. (Fuvest 2012) Peptídeos são formados por sequências de aminoácidos, como exemplificado para o peptídeo a seguir: Para identificar os dois primeiros aminoácidos desse peptídeo e também a sequência de tais aminoácidos, foram efetuadas duas reações químicas. Na primeira reação, formaram-se uma hidantoína e um novo peptídeo com um aminoácido a menos. Esse novo peptídeo foi submetido a uma segunda reação, análoga à anterior, gerando outra hidantoína e outro peptídeo: O mesmo tipo de reação foi utilizado para determinar a sequência de aminoácidos em um outro peptídeo de fórmula desconhecida, que é formado por apenas três aminoácidos. Para tanto, três reações foram realizadas, formando-se três hidantoínas, na ordem indicada na página de resposta. Preencha a tabela da página de resposta, escrevendo a) as fórmulas dos três aminoácidos que correspondem às três respectivas hidantoínas formadas; 10
11 b) a fórmula estrutural do peptídeo desconhecido formado pelos três aminoácidos do item a). 15. (Fuvest 2012) Dois tipos de reação, bastante utilizados na síntese e transformação de moléculas orgânicas, são: - Ozonólise: reação química em que cada carbono da ligação dupla de um composto orgânico forma uma ligação dupla com oxigênio, como exemplificado: - Condensação aldólica: reação química em que dois compostos carbonílicos se unem e perdem água, formando um novo composto carbonílico com uma ligação dupla adjacente ao grupo carbonila, como exemplificado: Em 1978, esses dois tipos de reação foram utilizados na síntese do hormônio progesterona, de acordo com a sequência ao lado, em que A e A identificam, respectivamente, partes das fórmulas estruturais dos produtos I e II, cujas representações, abaixo, não estão completas. Na página de resposta, complete as fórmulas estruturais a) do composto I; b) do composto II, em que A é um anel constituído por 6 átomos de carbono, e em que o anel B não possui grupo carbonila. 16. (Fuvest 2013) Uma vela foi colocada dentro de um recipiente cilíndrico e com raio igual a 10 cm, sem tampa, ao qual também foi adicionado hidrogenocarbonato de sódio sólido, NaHCO3. A vela foi acesa e adicionou-se ao recipiente, lentamente, solução aquosa de ácido acético, C2H4O2, de tal forma que o nível da solução atingiu somente a parte inferior da vela, ficando distante da chama. Após 3 segundos, observou-se que a chama apagou. 11
12 a) Apresente a fórmula estrutural do ácido acético. b) Escreva a equação química balanceada da reação entre o sólido e a solução aquosa de ácido acético. c) O experimento foi repetido com outra vela de mesma altura e com as mesmas quantidades de reagentes utilizadas anteriormente. Mudou-se apenas o recipiente, que foi substituído por outro, de mesma altura que o anterior, mas com raio igual a 20 cm. Dessa vez, após os mesmos 3 segundos, observou-se que a chama não apagou. Proponha uma explicação para esse fato, considerando a densidade das substâncias gasosas presentes. Dados: Massa molar (g/mol): C=12; N=14; O=16. 12
13 Gabarito: Resposta da questão 1: a) De acordo com as equações fornecidas no texto, tem-se redução e em seguida acetilação: b) Formação do subproduto: Resposta da questão 2: a) Dados: Solubilidade do KOH em etanol a 25 C 40 g em 100 ml. Adicionou-se 1,5 g de KOH a 35 ml de etanol, agitando-se continuamente a mistura. 100 ml (e tanol) 40 g (KOH) 35 ml (e tanol) mkoh mkoh 14 g (valor máximo que pode ser dissolvido) Foi colocado 1,5 g. 1,5 g 14 g Conclusão: toda a quantidade de KOH empregada no procedimento descrito, se dissolveu. b) Tem-se a seguinte reação de transesterificação: 13
14 c) Utilizando-se excesso de solução de KOH em água, vem: Resposta da questão 3: a) A formação do polímero ocorre a partir do glicerol, conforme indicado no texto. 14
15 Possível polímero de cadeia ramificada: b) Quanto maior for o grau de polimerização menor o número de hidroxilas restantes, já que estas são utilizadas na polimerização e menor será a solubilidade deste polímero em etanol. 15
16 Quanto menor for o grau de polimerização maior o número de hidroxilas restantes, já que estas são utilizadas na polimerização e maior será a solubilidade deste polímero em etanol (polar dissolve polar - pontes de hidrogênio entre as hidroxilas). Analisando a tabela, Solubilidade (% em massa) Amostra Hexano (solvente apolar) Etanol (solvente polar) polímero (mais solúvel) polímero > 3, conclui-se que o polímero 1 é o mais solúvel, ou seja, possui maior quantidade de hidroxilas não utilizadas no processo de polimerização, consequentemente é o polímero de menor grau de polimerização. Resposta da questão 4: a) Reação entre acetato de etila (CH3CO2CH2CH3) e metilamina (CH3NH2) e seus produtos: b) Fórmula de A e C: 16
17 Resposta da questão 5: a) De acordo com o enunciado, para formar composto de Grignard, o reagente tem que apresentar o bromo ligado diretamente a carbono saturado e não pode apresentar grupos funcionais que reajam com o composto formado, ou seja, carboxila, carbinol e amino. Neste caso os compostos I e IV se encaixam. b) Teremos: Observação teórica: 17
18 Resposta da questão 6: a) Teremos as seguintes ligações de hidrogênio (pontes de hidrogênio): b) Teremos: Letra da esquerda Letra do meio Letra da direita Aminoácido G C A Alanina G G A Glicina G G U Glicina Resposta da questão 7: a) A equação química balanceada que representa a reação, citada no texto, em que são produzidos amônia e gás carbônico é dada por: 18
19 b) As bromélias podem utilizar o gás carbônico e a glutamina nos seguintes processos: - Fotossíntese (gás carbônico). - Síntese de proteínas nos ribossomos (glutamina). Resposta da questão 8: a) Podemos verificar que o número de oxidação do carbono varia de zero para +2 na hidroxicetona. Consequentemente temos uma oxidação. b) Equação química balanceada que representa a semirreação de redução do íon nitrato: 2NO 4H 2e N O 2H O (Re dução) c) Equação química global balanceada da transformação citada: C14H12O2 C14H10O2 2H 2e (Oxidação) 2NO 2e 4H N O 2H O (Re dução) C H O 2NO 2H C H O N O 2H O Global Resposta da questão 9: a) O amido é transformado em glicose durante a germinação da semente. b) A glicose é utilizada no processo de respiração celular. c) Na reação de esterificação entre duas moléculas de ácido láctico, o grupo álcool de uma molécula interage com a carboxila de outra: Resposta da questão 10: a) A equação química, que representa a reação de hidratação do cis-2-penteno, pode ser representada por: 19
20 b) Para o 3- pentanol: Verificamos que o fragmento de massa molar 59 é mais abundante: A ligação rompida foi entre o carbono 2 e 3. Para o 2-pentanol Verificamos que o fragmento de massa molar 45 é mais abundante: A ligação rompida foi entre o carbono 2 e 3. 20
21 Resposta da questão 11: a) A adição do enxofre forma ligações tridimensionais cruzadas. Os átomos de enxofre funcionam como pontes de ligação entre uma cadeia carbônica e sua vizinha. Estas ligações aumentam a resistência mecânica, a elasticidade, e diminuem a sensibilidade ao calor e aos agentes naturais. b) De acordo com a figura fornecida no enunciado, podemos observar a adição de enxofre a quatro átomos de carbono: Para 2 monômeros temos 4 átomos de enxofre g 128 g m 16 g m = 17 g Para 16 g de enxofre adicionados a 1000 g de borracha natural, teremos: 1000 g 100 % 17 g p p = 1,7 % c) Dentre as diversas consequências do Ciclo da Borracha iniciado no século XIX e, como afirma o próprio enunciado da questão, enfraquecido em 1913, podemos citar um grande fluxo migratório do sertão nordestino para a região amazônica quando um grande número de retirantes da seca foi em busca de melhores condições de vida extraindo o ouro branco da floresta. Porém, boa parte dessas pessoas foi dizimada pelas insalubres condições da floresta, como pela malária por exemplo. Além das condições naturais os seringueiros foram submetidos a um regime de trabalho conhecido como aviamento, quando ele tinha sua viagem paga por atravessadores e suas primeiras despesas pelo dono do seringal. Tais encargos constituíam-se em dívidas impagáveis e acabavam por prender o trabalhador ao seringal, pois com seu trabalho deveria saldá-las, mas como isso não era possível nunca poderia parar de trabalhar. Resposta da questão 12: a) A equação química balanceada que representa a reação da vanilina com anidrido acético pode ser representada por: 21
22 b) O PAHF seria um poliéster: Reação de hidrogenação do composto formado: Reação de hidrólise: Reação de polimerização: Resposta da questão 13: a) Escreva a equação química que representa a transformação de triglicerídeos em sabão pode ser dada por: 22
23 b) Uma equação química que representa a transformação de triglicerídeos em biodiesel pode ser dada por: Resposta da questão 14: a) As moléculas das hidantoínas produzidas nas reações podem ser utilizadas na descoberta dos aminoácidos que as compõe. Por exemplo: A partir da tabela da página de resposta obtemos os aminoácidos. 23
24 b) A condensação dos três aminoácidos obtidos na tabela anterior, na ordem dada, gerando o peptídeo desconhecido pode ser representada Resposta da questão 15: a) De acordo com a reação de ozonólise descrita no texto, teremos: b) De acordo com a reação de condensação aldólica descrita no texto, teremos: 24
25 Resposta da questão 16: a) Fórmula estrutural do ácido acético: b) Teremos: c) Massa molares dos gases envolvidos: CO O N g/ mol (produzido) 32 g/mol (presentes no ar) 28 g/mol Nas mesmas condições de pressão e temperatura, a densidade de um gás pode ser dada por: M d V (molar) (molar) Como o volume molar é o mesmo, quanto maior a massa molar, mais denso será o gás e vice-versa. O gás carbônico formado é mais denso do que os outros gases presentes no sistema e se acumula na parte de baixo do recipiente. Quando o gás carbônico alcança o pavio da vela impede o contato do gás oxigênio com o pavio e a combustão cessa. Com o aumento do raio do recipiente, e supondo o mesmo volume de gás carbônico (em 3 segundos), o gás se acomodará na parte de baixo do recipiente e não atingirá o pavio e a vela continuará acessa. 25
FUVEST 2015 (Questões 1 a 6)
 (Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
(Questões 1 a 6) Provas de Vestibular 1. O metabissulfito de potássio (K 2 S2O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando
Gabarito-R Profº Jaqueline Química. a) Dados: Solubilidade do KOH em etanol a 25 C
 1: a) Dados: Solubilidade do KOH em etanol a 25 C 40 g em 100 ml. Adicionou-se 1,5 g de KOH a 35 ml de etanol, agitando-se continuamente a mistura. 100 ml (etanol) 40 g (KOH) 35 ml (etanol) mkoh mkoh 14
1: a) Dados: Solubilidade do KOH em etanol a 25 C 40 g em 100 ml. Adicionou-se 1,5 g de KOH a 35 ml de etanol, agitando-se continuamente a mistura. 100 ml (etanol) 40 g (KOH) 35 ml (etanol) mkoh mkoh 14
Seu pé direito nas melhores faculdades
 Seu pé direito nas melhores faculdades FUVEST 2 a Fase 11/janeiro/2011 QUÍMICA 01. s componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica: Nessa fórmula,
Seu pé direito nas melhores faculdades FUVEST 2 a Fase 11/janeiro/2011 QUÍMICA 01. s componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica: Nessa fórmula,
Revisão Específicas Fuvest
 Revisão Específicas Fuvest Material de Apoio para Monitoria 1. Um aluno efetuou um experimento para avaliar o calor envolvido na reação de um ácido com uma base. Para isso, tomou 8 tubos de ensaio e a
Revisão Específicas Fuvest Material de Apoio para Monitoria 1. Um aluno efetuou um experimento para avaliar o calor envolvido na reação de um ácido com uma base. Para isso, tomou 8 tubos de ensaio e a
Questão 1. Questão 2. Resposta
 Questão 1 Os componentes principais dos óleos vegetais são os triglicerídeos, que possuem a fórmula genérica ao lado: Nessa fórmula, os grupos R, R e R representam longas cadeias de carbono, com ou sem
Questão 1 Os componentes principais dos óleos vegetais são os triglicerídeos, que possuem a fórmula genérica ao lado: Nessa fórmula, os grupos R, R e R representam longas cadeias de carbono, com ou sem
QUÍMICA (19) O ELITE RESOLVE FUVEST ª FASE PROVA ESPECÍFICA QUÍMICA
 (19) 351-101 ELITE ESLVE FUVEST 011 ª FASE PVA ESPEÍFIA QUÍMIA QUÍMIA QUESTÃ 01 s componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica: '' Nessa fórmula,
(19) 351-101 ELITE ESLVE FUVEST 011 ª FASE PVA ESPEÍFIA QUÍMIA QUÍMIA QUESTÃ 01 s componentes principais dos óleos vegetais são os triglicerídeos, que possuem a seguinte fórmula genérica: '' Nessa fórmula,
Propriedades e Usos dos Materiais
 Propriedades e Usos dos Materiais Propriedades e Usos dos Materiais 1. O rótulo de uma lata de desodorante em aerosol apresenta, entre outras, as seguintes principal razão dessa advertência é: a) O aumento
Propriedades e Usos dos Materiais Propriedades e Usos dos Materiais 1. O rótulo de uma lata de desodorante em aerosol apresenta, entre outras, as seguintes principal razão dessa advertência é: a) O aumento
Química Cálculo Estequiométrico Vestibular - FUVEST
 Química Cálculo Estequiométrico Vestibular - FUVEST 1. (Fuvest 2015) O sistema de airbag de um carro é formado por um sensor que detecta rápidas diminuições de velocidade, uma bolsa inflável e um dispositivo
Química Cálculo Estequiométrico Vestibular - FUVEST 1. (Fuvest 2015) O sistema de airbag de um carro é formado por um sensor que detecta rápidas diminuições de velocidade, uma bolsa inflável e um dispositivo
1- Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química
 Questões 1 a 6 Provas de Vestibular 1- Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as substâncias presentes nessa mistura, apenas
Questões 1 a 6 Provas de Vestibular 1- Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as substâncias presentes nessa mistura, apenas
FUVEST Resolvida 2 a Fase 08/janeiro/2013
 Seu Pé Direito nas Melhores Faculdades FUVEST Resolvida 2 a Fase 08/janeiro/2013 QUIMIA 01. Um recipiente contém 100 ml de uma solução aquosa de 2 SO 4 de concentração 0,1 mol/l. Duas placas de platina
Seu Pé Direito nas Melhores Faculdades FUVEST Resolvida 2 a Fase 08/janeiro/2013 QUIMIA 01. Um recipiente contém 100 ml de uma solução aquosa de 2 SO 4 de concentração 0,1 mol/l. Duas placas de platina
DIVERSOS Folha D-10 - Prof.: João Roberto Mazzei
 Reações orgânicas 1. A prática de esportes promove modificações orgânicas significativas no corpo dos atletas, o que leva à necessidade de ajustes metabólicos e fisiológicos que atendam à grande demanda
Reações orgânicas 1. A prática de esportes promove modificações orgânicas significativas no corpo dos atletas, o que leva à necessidade de ajustes metabólicos e fisiológicos que atendam à grande demanda
Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química
 Questão 1 Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as substâncias presentes nessa mistura, apenas o bromo possui cor e, quando
Questão 1 Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as substâncias presentes nessa mistura, apenas o bromo possui cor e, quando
FUVEST Prova A 10/janeiro/2012
 Seu Pé Direito nas Melhores Faculdades FUVEST Prova A 10/janeiro/2012 QUÍMICA 01. Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as
Seu Pé Direito nas Melhores Faculdades FUVEST Prova A 10/janeiro/2012 QUÍMICA 01. Ao misturar acetona com bromo, na presença de ácido, ocorre a transformação representada pela equação química Dentre as
COVEST/UFPE ª ETAPA
 COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
COVEST/UFPE 2000 2ª ETAPA. A partir das entalpias padrão das reações de oxidação do ferro dadas abaixo: determine a quantidade de calor liberada a 298K e 1 atm na reação:. Iguais volumes de amônia e cloreto
UFSC. Química (Amarela) Resposta: = 05
 Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
Resposta: 01 + 04 = 05 01. Correto. Apresenta carboxila e grupamento amino no carbono alfa. 02. Incorreto. Com a elevação do ph ocorre a desprotonação da carboxila formando carga negativa. 04. Correto.
UFSC. Química (Amarela) , temos 10 mol de Mg, ou seja, 243 g de Mg. Resposta: = 98. Comentário
 Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
Resposta: 02 + 32 + 64 = 98 01. Incorreta. carbonato de magnésio é um sal insolúvel em H 2, logo não dissocia-se em Mg 2+ e (aq) C2. 3(aq) 02. Correta. 12 Mg 2+ = 1s 2 2s 2 2p 6 K L 04. Incorreta. É um
Observe o gráfico, cujas curvas representam as variações das massas desses radioisótopos ao longo das duas horas de duração do experimento.
 Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
Revisão Específicas 1. (UERJ 2015) Os preços dos metais para reciclagem variam em função da resistência de cada um à corrosão: quanto menor a tendência do metal à oxidação, maior será o preço. Na tabela,
Química FUVEST ETAPA. Resposta QUESTÃO 1 QUESTÃO 2
 Química FUVEST QUESTÃO 1 Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água. Após a montagem de uma aparelhagem como a da figura a seguir, e antes de iniciar
Química FUVEST QUESTÃO 1 Em uma aula de laboratório de Química, a professora propôs a realização da eletrólise da água. Após a montagem de uma aparelhagem como a da figura a seguir, e antes de iniciar
Aula teórica sobre: Biopolímeros. Biopolímeros
 Disciplina: Química Prof.: Arthur Kael Turma: T / R 11/07/2017 Aula teórica sobre: Biopolímeros Biopolímeros Polímeros Definição: Polímeros são macromoléculas formadas por repetições de unidades moleculares
Disciplina: Química Prof.: Arthur Kael Turma: T / R 11/07/2017 Aula teórica sobre: Biopolímeros Biopolímeros Polímeros Definição: Polímeros são macromoléculas formadas por repetições de unidades moleculares
O que você deve saber sobre REAÇÕES ORGÂNICAS
 O que você deve saber sobre São reações químicas que ocorrem com compostos orgânicos, e normalmente são lentas. Para que haja uma reação, é necessária a quebra das ligações moleculares dos reagentes. Tais
O que você deve saber sobre São reações químicas que ocorrem com compostos orgânicos, e normalmente são lentas. Para que haja uma reação, é necessária a quebra das ligações moleculares dos reagentes. Tais
Ferro de construção, Latas de alumínio, Garrafas de cerveja, Casca de ovo, Areia e cimento. Restos de comida, Embalagens de plástico, Casca de coco.
 01 Inorgânico Primeiro Ferro de construção, Latas de alumínio, Garrafas de cerveja, Casca de ovo, Areia e cimento. Orgânico Segundo Restos de comida, Embalagens de plástico, Casca de coco. Resposta: D
01 Inorgânico Primeiro Ferro de construção, Latas de alumínio, Garrafas de cerveja, Casca de ovo, Areia e cimento. Orgânico Segundo Restos de comida, Embalagens de plástico, Casca de coco. Resposta: D
Química Orgânica. Química orgânica: Estrutura das moléculas. Grupos funcionais. Estereoquímica. Reatividade..
 Química Orgânica X Química orgânica: Estrutura das moléculas. Grupos funcionais. Estereoquímica. Reatividade.. Química Orgânica Os compostos orgânicos são as substâncias químicas que contêm carbono e hidrogénio,
Química Orgânica X Química orgânica: Estrutura das moléculas. Grupos funcionais. Estereoquímica. Reatividade.. Química Orgânica Os compostos orgânicos são as substâncias químicas que contêm carbono e hidrogénio,
Exercícios de Aprofundamento 2015 Qui - Orgânica
 1. (Enem 2014) O potencial brasileiro para transformar lixo em energia permanece subutilizado apenas pequena parte dos resíduos brasileiros é utilizada para gerar energia. Contudo, bons exemplos são os
1. (Enem 2014) O potencial brasileiro para transformar lixo em energia permanece subutilizado apenas pequena parte dos resíduos brasileiros é utilizada para gerar energia. Contudo, bons exemplos são os
UFSC. Química (Amarela) Reposta: 70
 Reposta: 70 01. Incorreta. Ferroso é o íon Fe +2 e sulfato é o íon SO 4 2. Logo a fórmula é Fe +2 SO 4 2 = FeSO 4 02. Correta. 04. Correta. 08. Incorreta. O átomo central é o enxofre que forma duas ligações
Reposta: 70 01. Incorreta. Ferroso é o íon Fe +2 e sulfato é o íon SO 4 2. Logo a fórmula é Fe +2 SO 4 2 = FeSO 4 02. Correta. 04. Correta. 08. Incorreta. O átomo central é o enxofre que forma duas ligações
Química: Reações Orgânicas
 Química: Reações Orgânicas 1. (Ufrgs 2015) Dois hidrocarbonetos I e II reagem com bromo, conforme mostrado abaixo. C H Br C H Br HBr x y 2 x y 1 I CzHn Br2 C2HnBr 2 II É correto afirmar que I e II são,
Química: Reações Orgânicas 1. (Ufrgs 2015) Dois hidrocarbonetos I e II reagem com bromo, conforme mostrado abaixo. C H Br C H Br HBr x y 2 x y 1 I CzHn Br2 C2HnBr 2 II É correto afirmar que I e II são,
APOSTILA DE QUÍMICA ORGÂNICA 3º BIMESTRE
 Nome: nº: Bimestre: 3º Ano/série: 3ª série Ensino: Médio Componente Curricular: Química Professor: Ricardo Honda Data: / / APOSTILA DE QUÍMICA ORGÂNICA 3º BIMESTRE TEORIA 22 OZONÓLISE EM ALCENOS A ozonólise
Nome: nº: Bimestre: 3º Ano/série: 3ª série Ensino: Médio Componente Curricular: Química Professor: Ricardo Honda Data: / / APOSTILA DE QUÍMICA ORGÂNICA 3º BIMESTRE TEORIA 22 OZONÓLISE EM ALCENOS A ozonólise
Química. Xandão (Victor Pontes) Compostos Orgânicos
 Compostos Orgânicos Compostos Orgânicos 1. Três frascos não-rotulados encontram-se na prateleira de um laboratório. Um contém benzeno, outro, tetracloreto de carbono e o terceiro, metanol. Sabe-se que
Compostos Orgânicos Compostos Orgânicos 1. Três frascos não-rotulados encontram-se na prateleira de um laboratório. Um contém benzeno, outro, tetracloreto de carbono e o terceiro, metanol. Sabe-se que
Fuvest 2009 (Questão 1 a 8)
 (Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
(Questão 1 a 8) 1. Água pode ser eletrolisada com a finalidade de se demonstrar sua composição. A figura representa uma aparelhagem em que foi feita a eletrólise da água, usando eletrodos inertes de platina.
Exercíciosde Funções Orgânicas 1) Identifique as funções químicas presentes em cada uma das estruturas seguintes. Faça um círculo e dê o nome da
 Exercíciosde Funções Orgânicas 1) Identifique as funções químicas presentes em cada uma das estruturas seguintes. Faça um círculo e dê o nome da função. REVISÃO DE ISOMERIA PLANA E GEOMETRICA 1) Indique
Exercíciosde Funções Orgânicas 1) Identifique as funções químicas presentes em cada uma das estruturas seguintes. Faça um círculo e dê o nome da função. REVISÃO DE ISOMERIA PLANA E GEOMETRICA 1) Indique
FUVEST 98 SEGUNDA FASE PROVA DE QUÍMICA
 Q.01 A vitamina C é muito utilizada como aditivo de alimentos processados. Sua propriedade antioxidante se deve à capacidade de ser oxidada pelo oxigênio do ar, protegendo da oxidação outras substâncias
Q.01 A vitamina C é muito utilizada como aditivo de alimentos processados. Sua propriedade antioxidante se deve à capacidade de ser oxidada pelo oxigênio do ar, protegendo da oxidação outras substâncias
Luis Eduardo C. Aleotti. Química. Aula 61 - Propriedades Físicas dos Compostos Orgânicos
 Luis Eduardo C. Aleotti Química Aula 61 - Propriedades Físicas dos Compostos Orgânicos PROPRIEDADES FÍSICAS O que é? - Características da matéria, determinadas de forma experimental. - Não são alteradas,
Luis Eduardo C. Aleotti Química Aula 61 - Propriedades Físicas dos Compostos Orgânicos PROPRIEDADES FÍSICAS O que é? - Características da matéria, determinadas de forma experimental. - Não são alteradas,
Quí. Monitor: Gabriel Pereira
 Quí. Professor: Xandão Monitor: Gabriel Pereira Reação orgânica: Reação de eliminação (exercícios) 09 out EXERCÍCIOS DE AULA 1. Quando o -bromopentano sofre reação de eliminação, os produtos A e B, abaixo,
Quí. Professor: Xandão Monitor: Gabriel Pereira Reação orgânica: Reação de eliminação (exercícios) 09 out EXERCÍCIOS DE AULA 1. Quando o -bromopentano sofre reação de eliminação, os produtos A e B, abaixo,
Gabaritos Resolvidos Energia Química Semiextensivo V4 Frente E
 01) D A preferência de substituição obedece a ordem: C terciário C secundário C primário. A halogenação de um alcano se dá por substituição de um átomo de hidrogênio por um halogênio, resultando em um
01) D A preferência de substituição obedece a ordem: C terciário C secundário C primário. A halogenação de um alcano se dá por substituição de um átomo de hidrogênio por um halogênio, resultando em um
REAÇÕES ORGÂNICAS As principais reações orgânicas são classificadas em: 1. Adição 2. Eliminação 3. Substituição 4. Esterificação 5. Saponificação 6.
 As principais reações orgânicas são classificadas em: 1. Adição 2. Eliminação 3. Substituição 4. Esterificação 5. Saponificação 6. Oxidação. 1. Adição Na reação de adição, há um aumento no número de grupos
As principais reações orgânicas são classificadas em: 1. Adição 2. Eliminação 3. Substituição 4. Esterificação 5. Saponificação 6. Oxidação. 1. Adição Na reação de adição, há um aumento no número de grupos
Reações Orgânicas. 1. (Uerj 2014) Considere a adição de um átomo X na oxidação da guanina, conforme esquematizado na equação química:
 1. (Uerj 2014) Considere a adição de um átomo X na oxidação da guanina, conforme esquematizado na equação química: final do século XIX. Esses compostos podem ser obtidos pela reação de um haleto de alquila
1. (Uerj 2014) Considere a adição de um átomo X na oxidação da guanina, conforme esquematizado na equação química: final do século XIX. Esses compostos podem ser obtidos pela reação de um haleto de alquila
FUVEST 1989 Primeira fase e Segunda fase
 FUVEST 1989 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 85. Assinale a alternativa que apresenta dois produtos caseiros com propriedade alcalinas. a) detergente e vinagre b) sal e coalhada c) leite
FUVEST 1989 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 85. Assinale a alternativa que apresenta dois produtos caseiros com propriedade alcalinas. a) detergente e vinagre b) sal e coalhada c) leite
LISTA DE EXERCÍCIOS DE RECUPERAÇÃO FINAL QUÍMICA
 LISTA DE EXERCÍCIOS DE RECUPERAÇÃO FINAL QUÍMICA ALUNO(a): Valor: Nº: SÉRIE: 2ª TURMA: 20,0 UNIDADE: VV JC JP PC DATA: / /2018 Obs.: Esta lista deve ser entregue resolvida no dia da prova de Recuperação.
LISTA DE EXERCÍCIOS DE RECUPERAÇÃO FINAL QUÍMICA ALUNO(a): Valor: Nº: SÉRIE: 2ª TURMA: 20,0 UNIDADE: VV JC JP PC DATA: / /2018 Obs.: Esta lista deve ser entregue resolvida no dia da prova de Recuperação.
Lipídeos. Carboidratos (Açúcares) Aminoácidos e Proteínas
 BIOQUÍMICA Lipídeos Carboidratos (Açúcares) Aminoácidos e Proteínas LIPÍDEOS São ÉSTERES derivados de ácidos graxos superiores. Ex1: São divididos em: Cerídeos Glicerídeos Fosfatídeos Esteroides CERÍDEOS
BIOQUÍMICA Lipídeos Carboidratos (Açúcares) Aminoácidos e Proteínas LIPÍDEOS São ÉSTERES derivados de ácidos graxos superiores. Ex1: São divididos em: Cerídeos Glicerídeos Fosfatídeos Esteroides CERÍDEOS
SOLUÇÃO COMECE DO BÁSICO
 SOLUÇÃO OMEE DO BÁSIO SOLUÇÃO B1. [B] Adolf Von Baeyer (1835-1917), diz que: quanto maior a diferença entre o ângulo real e o teórico (afastamento em relação ao ângulo de estabilidade) de um ciclano, maior
SOLUÇÃO OMEE DO BÁSIO SOLUÇÃO B1. [B] Adolf Von Baeyer (1835-1917), diz que: quanto maior a diferença entre o ângulo real e o teórico (afastamento em relação ao ângulo de estabilidade) de um ciclano, maior
Química. Questão 17 A gasolina é uma mistura de hidrocarbonetos diversos que apresenta, dentre outros, os seguintes componentes:
 Questão 16 Uma molécula de água, isolada, não apresenta certas propriedades físicas - como ponto de fusão e de ebulição - que dependem de interações entre moléculas. Em 1998, um grupo de pesquisadores
Questão 16 Uma molécula de água, isolada, não apresenta certas propriedades físicas - como ponto de fusão e de ebulição - que dependem de interações entre moléculas. Em 1998, um grupo de pesquisadores
QUÍMICA. Prof. Jorginho. QUESTÃO 1 Considere o composto abaixo responda as perguntas:
 QUÍMICA Prof. Jorginho QUESTÃO 1 Considere o composto abaixo responda as perguntas: I Acidez e basicidade: a) Identifique o grupo funcional de caráter básico acentuado. b) Identifique o grupo de caráter
QUÍMICA Prof. Jorginho QUESTÃO 1 Considere o composto abaixo responda as perguntas: I Acidez e basicidade: a) Identifique o grupo funcional de caráter básico acentuado. b) Identifique o grupo de caráter
Polimerização e Reações Orgânicas
 Polimerização e Reações Orgânicas Material de Apoio para Monitoria 1. (FATEC-SP) A polimerização por adição consiste na reação entre moléculas de uma mesma substância, na qual em sua estrutura, ocorre
Polimerização e Reações Orgânicas Material de Apoio para Monitoria 1. (FATEC-SP) A polimerização por adição consiste na reação entre moléculas de uma mesma substância, na qual em sua estrutura, ocorre
CPV seu pé direito também na Medicina
 seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
seu pé direito também na Medicina UNIFESP 17/dezembro/2010 QUÍMICA 06. Ligas metálicas são comuns no cotidiano e muito utilizadas nas indústrias automobilística, aeronáutica, eletrônica e na construção
XII Olimpíada Baiana de Química Exame 2017
 Questão 01 (Peso 1) Questões objetivas (QUESTÕES DE 01 A 30) A fórmula estrutural condensada, CH 3 CH 2 CH 2 COOCH 3, representa: A) um éster B) uma amida C) um aldeído D) um anidrido E) um ácido carboxílico
Questão 01 (Peso 1) Questões objetivas (QUESTÕES DE 01 A 30) A fórmula estrutural condensada, CH 3 CH 2 CH 2 COOCH 3, representa: A) um éster B) uma amida C) um aldeído D) um anidrido E) um ácido carboxílico
3ª Série / Vestibular. As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar que, na reação:
 3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
3ª Série / Vestibular 01. I _ 2SO 2(g) + O 2(g) 2SO 3(g) II _ SO 3(g) + H 2O(l) H 2SO 4(ag) As equações (I) e (II), acima, representam reações que podem ocorrer na formação do H 2SO 4. É correto afirmar
FUVEST 1978 Primeira fase e Segunda fase
 FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
FUVEST 1978 Primeira fase e Segunda fase CNECIMENTS GERAIS 61. Bolinhas de naftalina ao serem colocadas em armários, com o decorrer do tempo, diminuem de tamanho. A causa desse comportamento deve-se ao
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
QUÍMICA. Questão 01. Questão 02
 Questão 01 QUÍMICA A fenil-etil-amina é considerada um componente responsável pela sensação do bem-estar decorrente da ingestão do chocolate, que contém, também, substâncias inorgânicas. Na tabela a seguir
Questão 01 QUÍMICA A fenil-etil-amina é considerada um componente responsável pela sensação do bem-estar decorrente da ingestão do chocolate, que contém, também, substâncias inorgânicas. Na tabela a seguir
4. UNESP) Um estudante montou a célula eletroquímica ilustrada na figura, com eletrodos de Cu(s) e Ni(s) de massas conhecidas.
 Revisão Específicas 1. (UNESP-2013) O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador. Com base no esquema,
Revisão Específicas 1. (UNESP-2013) O esquema apresentado descreve os diagramas energéticos para uma mesma reação química, realizada na ausência e na presença de um agente catalisador. Com base no esquema,
FUVEST Segunda Fase. Química 06/01/2003
 FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
FUVEST 2003 Segunda Fase Química 06/01/2003 Q.01 Em 1861, o pesquisador Kekulé e o professor secundário Loschmidt apresentaram, em seus escritos, as seguintes fórmulas estruturais para o ácido acético
O DIAMANTE POSSUI HIBRIDIZAÇÃO
 QUÍMICA ORGÂNICA Pode-se afirmar com certeza que se não fosse pelo Carbono você não estaria lendo essa breve descrição agora. A química orgânica se preocupa com o entendimento da vida dada pelo Carbono
QUÍMICA ORGÂNICA Pode-se afirmar com certeza que se não fosse pelo Carbono você não estaria lendo essa breve descrição agora. A química orgânica se preocupa com o entendimento da vida dada pelo Carbono
Exercícios Sobre ReaÇões Orgânicas: mecanismo da adição
 Exercícios Sobre ReaÇões rgânicas: mecanismo da adição Enunciado dos exercícios de 01 a 24: Dê as equações químicas globais das reações orgânicas listadas a seguir. 01. H 2= + l 2 02. H 2= + Br 2 03. H
Exercícios Sobre ReaÇões rgânicas: mecanismo da adição Enunciado dos exercícios de 01 a 24: Dê as equações químicas globais das reações orgânicas listadas a seguir. 01. H 2= + l 2 02. H 2= + Br 2 03. H
REVISÃO UNIOESTE QUIMICA PROF. SANTANA
 REVISÃO UNIOESTE QUIMICA PROF. SANTANA 01-Abaixo são mostradas as estruturas dos compostos orgânicos X e Y. O composto X é o responsável pelo sabor azedo do vinagre e o composto Y é utilizado como material
REVISÃO UNIOESTE QUIMICA PROF. SANTANA 01-Abaixo são mostradas as estruturas dos compostos orgânicos X e Y. O composto X é o responsável pelo sabor azedo do vinagre e o composto Y é utilizado como material
UFSC. Resposta: 76. Comentário. 01. Incorreta. É formado pela reação de neutralização entre o hidróxido de potássio e ácido carbônico.
 Resposta: 76 01. Incorreta. É formado pela reação de neutralização entre o hidróxido de potássio e ácido carbônico. H 2 CO 3 + KOH = K 2 CO 3 + H 2 0 02. Incorreta. O nox do carbono é +4. 04. Correta.
Resposta: 76 01. Incorreta. É formado pela reação de neutralização entre o hidróxido de potássio e ácido carbônico. H 2 CO 3 + KOH = K 2 CO 3 + H 2 0 02. Incorreta. O nox do carbono é +4. 04. Correta.
FUVEST ª fase - Prova V
 FUVEST 2016 1ª fase - Prova V Questão 11 Dispõe-se de 2 litros de uma solução aquosa de soda cáustica que apresenta ph 9. O volume de água, em litros, que deve ser adicionado a esses 2 litros para que
FUVEST 2016 1ª fase - Prova V Questão 11 Dispõe-se de 2 litros de uma solução aquosa de soda cáustica que apresenta ph 9. O volume de água, em litros, que deve ser adicionado a esses 2 litros para que
Solução Comentada Prova de Química
 34. A histamina, estrutura mostrada abaixo, é uma substância orgânica que provoca inchaço e coceira, e que é liberada pelas células de defesa, quando somos picados por insetos. N NH 2 N H Se quisermos
34. A histamina, estrutura mostrada abaixo, é uma substância orgânica que provoca inchaço e coceira, e que é liberada pelas células de defesa, quando somos picados por insetos. N NH 2 N H Se quisermos
Exercícios de Propriedades Físicas dos Compostos Orgânicos
 Exercícios de Propriedades Físicas dos Compostos Orgânicos Material de apoio do Extensivo 1. Assinale a opção que apresenta o ácido mais forte, considerando que todos se encontram nas mesmas condições
Exercícios de Propriedades Físicas dos Compostos Orgânicos Material de apoio do Extensivo 1. Assinale a opção que apresenta o ácido mais forte, considerando que todos se encontram nas mesmas condições
O hidrogênio é usado na fabricação de inúmeros produtos importantes:
 Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Q.01 O hidrogênio é usado na fabricação de inúmeros produtos importantes: I. H 2 + X metanol II. H 2 + Y ciclo-hexano III. H 2 + Z tripalmitato de glicerila (gordura saturada) a) Identifique X, Y e Z.
Ácidos,sais carboxílicos e ésteres. Karla Gomes Diamantina-MG
 Ácidos,sais carboxílicos e ésteres Karla Gomes Diamantina-MG ÁCIDOS CARBOXÍLICOS São compostos que possuem como grupo funcional a carbonila (C=O), ligada a uma hidroxila (-OH),e que se denomina grupo carboxila.
Ácidos,sais carboxílicos e ésteres Karla Gomes Diamantina-MG ÁCIDOS CARBOXÍLICOS São compostos que possuem como grupo funcional a carbonila (C=O), ligada a uma hidroxila (-OH),e que se denomina grupo carboxila.
29/03/ TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A
 29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
Aparecida de Goiânia, / /2016. Aluno(a): 2ª Série Professor(a): Anderson Castro. Lista de Química II CH 2 O C(O) R CH O C(O) R
 UIDADE - I Aparecida de Goiânia, / /2016. Aluno(a): 2ª érie Professor(a): Anderson astro Lista de Química II Questão 01) Xampus e condicionadores utilizam as propriedades químicas de surfatantes para aumentar
UIDADE - I Aparecida de Goiânia, / /2016. Aluno(a): 2ª érie Professor(a): Anderson astro Lista de Química II Questão 01) Xampus e condicionadores utilizam as propriedades químicas de surfatantes para aumentar
RESPOSTAS DAS TAREFAS 2ª SÉRIE. Química - Setor A. Aulas 43 e 44. Aula 43. Aula 44 ENSINO MÉDIO 1. D 2. C
 ESI MÉDI RESPSTAS DAS TAREFAS 2ª SÉRIE 16 Química - Setor A Aulas 43 e 44 Aula 43 1. D 2. 3. a) idrólise alcalina ou saponificação b) Sais de ácidos carboxílicos Aula 44 1. A interação intermolecular que
ESI MÉDI RESPSTAS DAS TAREFAS 2ª SÉRIE 16 Química - Setor A Aulas 43 e 44 Aula 43 1. D 2. 3. a) idrólise alcalina ou saponificação b) Sais de ácidos carboxílicos Aula 44 1. A interação intermolecular que
APOSTILA DE QUÍMICA ORGÂNICA 4º BIMESTRE
 Nome: nº: Bimestre: 4º Ano/série: 3ª série Ensino: Médio Componente Curricular: Química Professor: Ricardo Honda Data: / / APOSTILA DE QUÍMICA ORGÂNICA 4º BIMESTRE TEORIA 28 POLÍMEROS Alguns tipos de moléculas
Nome: nº: Bimestre: 4º Ano/série: 3ª série Ensino: Médio Componente Curricular: Química Professor: Ricardo Honda Data: / / APOSTILA DE QUÍMICA ORGÂNICA 4º BIMESTRE TEORIA 28 POLÍMEROS Alguns tipos de moléculas
QUÍMICA (A) (B) (C) (D) (E)
 QUÍMICA A octanagem é uma medida da resistência à compressão da gasolina. O isoctano é utilizado como padrão de índice de octanagem por ser o composto que mais resiste à compressão sem explodir. A respeito
QUÍMICA A octanagem é uma medida da resistência à compressão da gasolina. O isoctano é utilizado como padrão de índice de octanagem por ser o composto que mais resiste à compressão sem explodir. A respeito
- TEMPERATURA DE EBULIÇÃO - SOLUBILIDADE
 PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS - TEMPERATURA DE EBULIÇÃO - SOLUBILIDADE TEMPERATURA DE EBULIÇÃO Depende do tipo de -LIGAÇÃO INTERMOLECULAR e do - TAMANHO DAS MOLÉCULAS LIGAÇÕES INTERMOLECULARES
PROPRIEDADES FÍSICAS DOS COMPOSTOS ORGÂNICOS - TEMPERATURA DE EBULIÇÃO - SOLUBILIDADE TEMPERATURA DE EBULIÇÃO Depende do tipo de -LIGAÇÃO INTERMOLECULAR e do - TAMANHO DAS MOLÉCULAS LIGAÇÕES INTERMOLECULARES
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG
 PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
Q.02 Considere uma solução aquosa diluída de dicromato de potássio, a 25 ºC. Dentre os equilíbrios que estão presentes nessa solução, destacam-se:
 Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004
 Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Escola Secundária de Alcácer do Sal Química 12º ano teste 5 25/05/2004 I Escreva na sua folha de respostas a letra correspondente à alternativa correcta que seleccionar para cada item. A indicação de mais
Simuladinho de Química 2ª FASE DA FUVEST. (Sugestão: Tempo máximo de prova: 4 horas)
 1. (Fuvest 2013) Observe a imagem, que apresenta uma situação de intensa poluição do ar que danifica veículos, edifícios, monumentos, vegetação e acarreta transtornos ainda maiores para a população. Trata-se
1. (Fuvest 2013) Observe a imagem, que apresenta uma situação de intensa poluição do ar que danifica veículos, edifícios, monumentos, vegetação e acarreta transtornos ainda maiores para a população. Trata-se
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande diversidade
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande diversidade
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
QUÍMICA QUESTÃO O oxigênio e o enxofre podem ser encontrados como moléculas O 2 QUESTÃO 32
 T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
Exercícios sobre reações orgânicas de adição
 Exercícios sobre reações orgânicas de adição Enunciado dos exercícios de 01 a 16: Dê as equações químicas globais das reações orgânicas listadas a seguir. bservação: a regra de Markovinikov, resumidamente,
Exercícios sobre reações orgânicas de adição Enunciado dos exercícios de 01 a 16: Dê as equações químicas globais das reações orgânicas listadas a seguir. bservação: a regra de Markovinikov, resumidamente,
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
QUÍMICA PRIMEIRA ETAPA - 1999 QUESTÃO 46 Um limão foi espremido num copo contendo água e as sementes ficaram no fundo do recipiente. A seguir, foi adicionado ao sistema um pouco de açúcar, que se dissolveu
Reações de Substituição Folha 01 Prof.: João Roberto Mazzei
 www.professormazzei.com Reações de Substituição Folha 01 Prof.: João Roberto Mazzei 01. (UFC 2009) A cânfora é uma cetona que possui um odor penetrante característico. É aplicada topicamente na pele como
www.professormazzei.com Reações de Substituição Folha 01 Prof.: João Roberto Mazzei 01. (UFC 2009) A cânfora é uma cetona que possui um odor penetrante característico. É aplicada topicamente na pele como
QUÍMICA ORGÂNICA QUÍMICA ORGÂNICA REAÇÕES ORGÂNICAS DE ELIMINAÇÃO PROF. JACKSON ALVES.
 QUÍMICA ORGÂNICA QUÍMICA ORGÂNICA REAÇÕES ORGÂNICAS DE ELIMINAÇÃO E POLÍMEROS REAÇÕES ORGÂNICAS DE ELIMINAÇÃO PROF. JACKSON ALVES PROF. JACKSON ALVES REAÇÕES ORGÂNICAS DE ELIMINAÇÃO São as reações em que
QUÍMICA ORGÂNICA QUÍMICA ORGÂNICA REAÇÕES ORGÂNICAS DE ELIMINAÇÃO E POLÍMEROS REAÇÕES ORGÂNICAS DE ELIMINAÇÃO PROF. JACKSON ALVES PROF. JACKSON ALVES REAÇÕES ORGÂNICAS DE ELIMINAÇÃO São as reações em que
Química D Extensivo V. 8
 Química D Extensivo V. 8 Exercícios 01) B 02) D 1 mol ALCENO 4 mol CO 2 (4 carbonos) Conclui-se que o alceno possui 4 carbonos. 03) E Combustão: C 4 H 8 + 6O 2 4CO 2 + 4H 2 O Forma-se cetona quando o carbono
Química D Extensivo V. 8 Exercícios 01) B 02) D 1 mol ALCENO 4 mol CO 2 (4 carbonos) Conclui-se que o alceno possui 4 carbonos. 03) E Combustão: C 4 H 8 + 6O 2 4CO 2 + 4H 2 O Forma-se cetona quando o carbono
PPGQTA. Prof. MGM D Oca
 PPGQTA Prof. Compostos Carbonílicos O grupo carbonila é um dos mais importantes grupos funcionais e está envolvido em muitas reações. Reações envolvendo grupos carbonila também são particularmente importantes
PPGQTA Prof. Compostos Carbonílicos O grupo carbonila é um dos mais importantes grupos funcionais e está envolvido em muitas reações. Reações envolvendo grupos carbonila também são particularmente importantes
QUÍMICA PRIMEIRA ETAPA
 QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
QUÍMICA PRIMEIRA ETAPA - 1998 QUESTÃO 01 Uma mistura de hidrogênio, H 2 (g), e oxigênio, O 2 (g), reage, num recipiente hermeticamente fechado, em alta temperatura e em presença de um catalisador, produzindo
S 2 O 5 (aq) + 2 H + (aq) " 2 SO 2(aq) + H 2 O (,) 2 (aq) + 2 OH (aq) " 2 SO 3 2 (aq) + H 2 O (,) QUESTÃO 2. Combustível.
 Química QUESTÃO 1 O metabissulfito de potássio (K 2 S 2 O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando a deterioração provocada
Química QUESTÃO 1 O metabissulfito de potássio (K 2 S 2 O 5 ) e o dióxido de enxofre (SO 2 ) são amplamente utilizados na conservação de alimentos como sucos de frutas, retardando a deterioração provocada
QUÍMICA. UFBA 99 2ª etapa Quím. 12
 QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
QUÍMICA UFBA 99 2ª etapa Quím. 12 QUESTÕES DE 11 A 20 QUESTÕES DE 11 A 18 INSTRUÇÃO: Assinale as proposições verdadeiras, some os números a elas associados e marque o resultado na Folha de Respostas. Questão
AULA 17. Reações Orgânicas. Prof Taynara Oliveira
 AULA 17 Reações Orgânicas Prof Taynara Oliveira Para que ocorra uma reação química, é necessário que as ligações existentes entre os átomos de uma molécula se rompam e esses átomos se rearranjem, formando
AULA 17 Reações Orgânicas Prof Taynara Oliveira Para que ocorra uma reação química, é necessário que as ligações existentes entre os átomos de uma molécula se rompam e esses átomos se rearranjem, formando
PSVS/UFES 2014 MATEMÁTICA 1ª QUESTÃO. O valor do limite 2ª QUESTÃO. O domínio da função real definida por 3ª QUESTÃO
 MATEMÁTICA 1ª QUESTÃO O valor do limite 3 x 8 lim é x 2 x 2 2ª QUESTÃO O domínio da função real definida por é 3ª QUESTÃO A imagem da função real definida por, para todo, é GRUPO 2 PROVA DE MATEMÁTICA
MATEMÁTICA 1ª QUESTÃO O valor do limite 3 x 8 lim é x 2 x 2 2ª QUESTÃO O domínio da função real definida por é 3ª QUESTÃO A imagem da função real definida por, para todo, é GRUPO 2 PROVA DE MATEMÁTICA
UNESP 2014 Vestibular de verão - 1ª fase - Conhecimentos gerais
 UNESP 204 Vestibular de verão - ª fase - Conhecimentos gerais Questão 69 Em 203 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual
UNESP 204 Vestibular de verão - ª fase - Conhecimentos gerais Questão 69 Em 203 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual
Ciência que estuda a química da vida
 Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física que regem
Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física que regem
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular)
 Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
Curso Preparatório para o Ingresso no Ensino Superior (Pré-Vestibular) Os conteúdos conceituais de Química estão distribuídos em 5 frentes. Química Extensivo A)Meio ambiente; estrutura atômica; Classificação
Especial Específicas (UNIFESP, UNESP, UEPG)
 Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
Especial Específicas (UNIFESP, UNESP, UEPG) 1. (UNIFESP) Os polímeros fazem parte do nosso cotidiano e suas propriedades, como temperatura de fusão, massa molar, densidade, reatividade química, dentre
PROVA K. Questão 81. Resolução
 RES_17_10_ALICE 29/09/10 14:01 Página 32 - Questão 81 Considere o fluxograma abaixo, relativo à separação dos componentes de uma mistura constituída de biodiesel e de frutose totalmente dissolvida em água.
RES_17_10_ALICE 29/09/10 14:01 Página 32 - Questão 81 Considere o fluxograma abaixo, relativo à separação dos componentes de uma mistura constituída de biodiesel e de frutose totalmente dissolvida em água.
Compostos Carbonílicos I (Ácidos carboxílicos e seus derivados) Aula 2
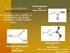 Universidade Federal de Ouro Preto Compostos Carbonílicos I (Ácidos carboxílicos e seus derivados) Aula 2 Flaviane Francisco Hilário 1 1 Haletos de acila 1.1 - Preparação 2 O objetivo é converter o grupo
Universidade Federal de Ouro Preto Compostos Carbonílicos I (Ácidos carboxílicos e seus derivados) Aula 2 Flaviane Francisco Hilário 1 1 Haletos de acila 1.1 - Preparação 2 O objetivo é converter o grupo
Ciência que estuda a química da vida (características dos seres vivos)
 Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
Ciência que estuda a química da vida (características dos seres vivos) Características dos seres vivos 1 - Complexidade química e organização microscópica Elementos químicos comuns C, O, N, H e P Grande
REAÇÕES ORGÂNICAS. Prof: WELLINGTON DIAS
 REAÇÕES ORGÂNICAS Prof: WELLINGTON DIAS REAÇÕES ORGÂNICAS 1. REAÇÕES DE SUBSTITUIÇÃO. 1.1. ALCANOS: Por serem apolares sofrem cisão homolítica e a reação ocorre por meio de radicais livres. EXEMPLO: Halogenação
REAÇÕES ORGÂNICAS Prof: WELLINGTON DIAS REAÇÕES ORGÂNICAS 1. REAÇÕES DE SUBSTITUIÇÃO. 1.1. ALCANOS: Por serem apolares sofrem cisão homolítica e a reação ocorre por meio de radicais livres. EXEMPLO: Halogenação
QUÍMICA Prof. Alison Cosme Souza Gomes. Funções Orgânicas Resumo UERJ
 QUÍMICA Prof. Alison Cosme Souza Gomes Funções Orgânicas Resumo UERJ A Química Orgânica é a parte da química que estuda os diversos compostos de carbonos existentes. São compostos com sua base nos átomos
QUÍMICA Prof. Alison Cosme Souza Gomes Funções Orgânicas Resumo UERJ A Química Orgânica é a parte da química que estuda os diversos compostos de carbonos existentes. São compostos com sua base nos átomos
Lista de Exercícios Prova Mensal
 Lista de Exercícios Prova Mensal Nome: nº: Ano: 3º A E.M. Professor: Cassio Pacheco Oxidação de Álcoois 1- (Vunesp-SP) Considere o seguinte arranjo experimental: 2- (Fuvest-SP) Para distinguir o butan-1-ol
Lista de Exercícios Prova Mensal Nome: nº: Ano: 3º A E.M. Professor: Cassio Pacheco Oxidação de Álcoois 1- (Vunesp-SP) Considere o seguinte arranjo experimental: 2- (Fuvest-SP) Para distinguir o butan-1-ol
Resoluções Química. - Cálculo da massa de ferro que restou na peça sem ter sido oxidada (z): z = 56,0 2,8 = 53,2 g
 Resoluções Química Comentários sobre as questões de Química. 19 Resposta E. - Cálculo da quantidade de ferrugem formada, em mol (x): Fe 2 O 3.H 2 O (s) + 2H 3 PO 4 (aq) 2FePO 4 (s) + 4H 2 O (l) 1mol 2.
Resoluções Química Comentários sobre as questões de Química. 19 Resposta E. - Cálculo da quantidade de ferrugem formada, em mol (x): Fe 2 O 3.H 2 O (s) + 2H 3 PO 4 (aq) 2FePO 4 (s) + 4H 2 O (l) 1mol 2.
LISTA DAS FUNÇÕES ORGÂNICAS
 Orgânica Na pré-história, o ser humano se limitava a usar materiais que encontrava na natureza, sem provocar neles grandes modificações. A descoberta do fogo trouxe ao ser humano a primeira maneira efetiva
Orgânica Na pré-história, o ser humano se limitava a usar materiais que encontrava na natureza, sem provocar neles grandes modificações. A descoberta do fogo trouxe ao ser humano a primeira maneira efetiva
química FUVEST ETAPA Resposta QUESTÃO 1 QUESTÃO 2 c) Determine o volume adicionado da solução
 Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
Química QUESTÃO 1 Um recipiente contém 100 ml de uma solução aquosa de H SO 4 de concentração 0,1 mol/l. Duas placas de platina são inseridas na solução e conectadas a um LED (diodo emissor de luz) e a
Resposta: D Resolução comentada: Ci x Vi = Cf x Vf Ci = 0,5 mol/l Cf = 0,15 mol/l Vf = 250 ml Vi = 0,5 x Vi = 0,15 x 250 Vi = 75 ml.
 Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
Unesp 1-Em 2013 comemora-se o centenário do modelo atômico proposto pelo físico dinamarquês Niels Bohr para o átomo de hidrogênio, o qual incorporou o conceito de quantização da energia, possibilitando
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
Funções orgânicas oxigenadas e nitrogenadas.
 Funções orgânicas oxigenadas e nitrogenadas Funções que possuem ou derivam do grupo funcional hidroxila ( OH) Ex: a) Etanol Álcool b) Prop 2 en 1 ol Ex:... estiver ligado a um carbono saturado...... estiver
Funções orgânicas oxigenadas e nitrogenadas Funções que possuem ou derivam do grupo funcional hidroxila ( OH) Ex: a) Etanol Álcool b) Prop 2 en 1 ol Ex:... estiver ligado a um carbono saturado...... estiver
Ciência que estuda a química da vida
 Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
Ciência que estuda a química da vida Mostra como o conjunto de moléculas inanimadas que constituem os seres vivos interagem para manter e perpetuar a vida seguindo as leis da química e da física e conferindo
