O USO DE TÉCNICAS VOLTAMÉTRICAS NA ANÁLISE DE SOLOS E ÁGUA
|
|
|
- Alana Peres Santarém
- 7 Há anos
- Visualizações:
Transcrição
1 O USO DE TÉCNICAS VOLTAMÉTRICAS NA ANÁLISE DE SOLOS E ÁGUA Susanne Rath Instituto de Química da Universidade Estadual de Campinas Campinas, SP, Brasil, raths@iqm.unicamp.br Resumo Nesse trabalho é apresentado um breve histórico da polarografia, fundamentos das técnicas voltamétricas, assim como algumas aplicações destas na análise de amostras de interesse ambiental. Palavras-chave:Voltametria, voltametria de redissolução, análise de traços, água, solos Histórico A voltametria é uma técnica de mercúrio (DME, do inglês eletroquímica que estuda a dropping mercury electrode) e relação entre a corrente e o denominou a técnica de potencial durante a eletrólise de polarografia (Heyrovský, 1956). uma espécie química de Um dos primeiros interesse. polarógrafos construídos por Os primeiros estudos sobre Heyrovský e Shikata, que curvas corrente versus potencial, com aplicação na identificação e atualmente encontra-se no Museu J. Heyrovský Institute of Physical quantificação de espécies Chemistry (Jaroslav..., 2003), está eletroativas, foram realizados apresentado na Figura 1. pelo químico tchecoslovaco Jaroslav Heyrovský (Foto ao lado) em 1922, que empregou como microeletrodo de trabalho, não polarizável, o eletrodo gotejante
2 As primeiras descrições da técnica foram: Um eletrodo gotejante de mercúrio (DME, do inglês dropping mercury electrode) é introduzido em uma célula de eletrólise, contendo de 5 a 10 ml de solução; O DME é constituído de um capilar com diâmetro interno de 0,05 a 0,08 mm; O capilar é conectado a um reservatório de mercúrio, posicionado de 30 a 80 cm acima do orifício do capilar; Variando-se a altura do reservatório, altera-se a pressão do mercúrio e com isso regula-se o tempo de gota de 2 a 8 s; O oxigênio é removido da solução; Emprega-se um eletrodo de referência e conecta-se a cela a um potenciômetro, o qual permite variar o potencial; A corrente que circula pela cela é medida através de um galvanômetro; Registra-se um gráfico corrente (i) x potencial (E).
3 Figura 1. Polarógrafo construído por Heyrovský e Shikata (Museu J. Heyrovský Institute of Physical Chemistry) e o capilar com a gota de mercúrio (Jaroslav..., 2003). Um polarograma característico, obtido na determinação de Tl(I), Cd(II), Zn(II) e Mn(II), está apresentado na Figura 2. Figura 2. Polarograma típico obtido com o polarógrafo construído por Heyrovsky (Jaroslav..., 2003). Em condições experimentais definidas, as substâncias eletroativas apresentam um potencial característico, no qual ocorre a transferência de carga analito/superfície do eletrodo, gerando uma corrente proporcional à concentração do analito em solução. A
4 facilidade de redução ou oxidação difere de substância para substância e é refletida pela posição da onda em relação ao eixo do potencial e expressa pelo potencial de meia onda (E 1/2 ). Portanto, além de conferir informações qualitativas sobre o analito, a técnica poderia ser empregada para fins quantitativos, onde a relação entre a corrente de difusão (corrente faradaíca) em função da concentração da espécie eletroativa em solução é dada pela equação de Ilkovic: I d = 7,08 x 10 4 n CD ½ m 2/3 t 1/6 Eq (1) Onde: n: número de elétrons envolvidos no processo de transferências de carga; C: concentração da espécie eletroativa no seio da solução (mmol/l); D: coeficiente de difusão (m 2 /s); m: taxa de escoamento do mercúrio (mg/s); t: tempo de gota (s). A descoberta e o desenvolvimento da polarografia, que futuramente seria a base para o desenvolvimento de muitas outras técnicas voltamétricas, foi reconhecido pela comunidade científica que condecorou, em 1956, Heyrovský com o Premio Nobel em Química. Considerações teóricas sobre a polarografia clássica A polarografia clássica ou de corrente contínua envolve a aplicação de um potencial, linearmente variável em função do tempo, entre o eletrodo de trabalho (EGM) e um eletrodo de referência, imersos no eletrólito suporte que contém a espécie eletroativa. A corrente que circula entre os eletrodos como conseqüência da transferência de elétrons entre o eletrodo e os componentes da solução é registrada em função do potencial aplicado. Para o entendimento dos fenômenos que acontecem na superfície
5 eletrodo/solução está apresentado um polarograma (Figura 3) decorrente do registro da curva corrente versus potencial de uma solução contendo Cd(II) em uma solução de ácido clorídrico (eletrólito suporte). A curva A é decorrente do eletrólito suporte e a curva B após a adição de Cd(II). B 10 5 E 1/2 i max i l I d /2 i d A 0 0-0,3-0,6-0,9-1,2 E/V A Eletrólito suporte B Espécie eletroativa Figura 3. Polarograma característico para o Cd(II) em ácido clorídrico. E 1/2 : potencial de meia-onda; i d: corrente de difusão, i max : corrente limite. As oscilações que aparecem no polarograma (Figura 3, curva B) são decorrentes da variação da área superficial da gota no eletrodo. 1. E > 0: verifica-se uma corrente anódica decorrente da oxidação do mercúrio do eletrodo de trabalho (Hg - 2e - Hg 2+ ) 2. 0 V < E < 0,5 V: nesta região constata-se uma pequena corrente, denominada de corrente residual, que é a somatória de duas outras. Uma componente é a faradaíca proveniente da redução ou oxidação de impurezas contidas no eletrólito suporte. A segunda é a corrente capacitiva que se origina do contínuo carregamento da dupla camada de Helmholtz, devido a constante renovação e aumento superficial da gota de mercúrio, a qual possui uma densidade de carga constante a
6 um determinado potencial. 3. E=- 0,6 V: aumento brusco da corrente em função da redução da espécie eletroativa na superfície do eletrodo (Cd e - Cd (Hg)) ,7 V < E < -1,2 V: a corrente é independente do potencial aplicado (corrente limite). Nesse intervalo de potencial a espécie eletroativa é reduzida tão rapidamente como essa pode difundir do seio da solução até a superfície do eletrodo. Quando o gradiente de concentração gerado em função do processo de transferência de carga na superfície do eletrodo é o responsável pelo transporte de massa da substância eletroativa até a superfície do mesmo, a corrente resultante é denominada de corrente de difusão. A proporcionalidade da corrente de difusão e a espécie eletroativa é a base para a análise polarográfica quantitativa. 5. E > -1,2 V: a corrente aumenta em função do potencial devido a redução do solvente do eletrólito suporte. O potencial no qual a corrente equivale à metade do valor da corrente de difusão é conhecido como potencial de meia-onda e é uma característica da espécie eletroativa, assim como do eletrólito suporte. É importante ressaltar que as espécies eletroativas a serem reduzidas ou oxidadas podem, em princípio, atingir o eletrodo por: Difusão: devido a um gradiente de concentração na camada adjacente ao eletrodo, que se inicia na eletrólise quando a concentração da espécie eletroativa circunvizinha ao eletrodo vai diminuindo. De acordo com a lei de Fick (Brett & Brett, 1996), a velocidade de movimento de qualquer espécie, devido a difusão, é proporcional ao gradiente de concentração, que é a razão entre a diferença de concentração de dois pontos pela distância entre eles. Migração: é decorrente da força elétrica pelas quais as espécies eletroativas alcançam a superfície do eletrodo de mercúrio. Esta corrente é
7 indesejável e deve ser eliminada, pela adição de um eletrólito suporte, em uma concentração de pelo menos 100 vezes maior do que a do analito. Convexão: resultante do transporte de massa determinado pela agitação da solução a ser analisada, deve ser eliminada. Técnicas polarográficas modernas As desvantagens da polarografia clássica, no contexto da análise quantitativa, inicialmente estavam associadas aos pobres limites de detecção (na ordem de 10-4 mol L -1 ). Em soluções diluídas a corrente capacitiva originada na dupla camada (interface eletrodo/solução) era significativa em relação a corrente faradaíca originada pelo processo de transferência de carga na superfície do eletrodo. Até então, na polarografia clássica, o potencial era aplicado através da cela toda e não somente na interface eletrodo-solução, e, portanto, a técnica estava limitada a análise em soluções aquosas ou em sistemas de baixa resistência. Para eliminar estes efeitos indesejáveis, os instrumentos modernos incorporam um potenciostato para controlar o potencial na interface eletrodo de trabalho-solução e evitar uma possível polarização do eletrodo de referência. O potenciostato (Flato, 1972) compreende um sistema de 3 eletrodos, como pode ser observado na Figura 4. Todas as dificuldades associadas a polarografia clássica foram superadas somente a partir da década de 60, quando a disponibilidade de amplificadores operacionais de baixo custo permitiu o desenvolvimento de novas técnicas polarográficas visando minimizar a corrente capacitiva.
8 RE AE WE Figura 4. Sistema potenciostático de três eletrodos (RE: eletrodo de referência, AE: eletrodo auxiliar e WE: eletrodo de trabalho. Entre as técnicas polarográficas consideradas modernas destacam-se: (i) polarografia de corrente contínua amostrada (DC tast ); (ii) polarografia de pulso normal; (iii) polarografia de pulso diferencial (DPP), (iv) polarografia de corrente alternada (AC) e polarografia de ondas quadrada. A diferença básica entre as técnicas é forma da variação de potencial durante a varredura (Figura 5). Cabe destacar que quando o DME é substituído pelo eletrodo de gota pendente de mercúrio (HMDE, do inglês hanging mercury drop electrode) ou outro eletrodo sólido a técnica passa a ser denominada de voltametria.
9 Figura 5. Forma da aplicação do potencial nas diferentes técnicas. Entre essas técnicas, a polarografia de pulso diferencial tem sido uma das mais utilizadas na análise quantitativa de uma grande variedade de substâncias orgânicas e inorgânicas. Na voltametria de pulso diferencial (Skoog et al, 2002), pulsos pequenos são sobrepostos em uma rampa linear de potencial como está mostrado na Figura 6A. A altura do pulso é chamada de amplitude de modulação. O pulso, com valores de 5 a 100 mv de amplitude, é aplicado durante os últimos 60 ms da vida da gota de mercúrio. A gota é então desalojada mecanicamente do capilar. A corrente é medida uma vez antes do pulso ser aplicado e novamente nos últimos 17 ms de duração do pulso. O polarógrafo subtrai a segunda corrente da primeira e registra essa diferença versus o potencial aplicado, como mostra a Figura 6B. Uma vantagem do polarograma em forma pico é que máximos individuais podem ser observados para substâncias com potenciais de meia-onda que diferem entre si por valores pequenos, como 40 a 50 mv. Ao contrário, a polarografia clássica e de pulso normal requerem uma diferença de potencial de cerca de 200 mv para resolução das ondas ou picos.
10 A B Figura 6. (A) Sinais de excitação para polarografia de pulso diferencial e (B) forma característica de um voltamograma (Skoog et al, 2002). A maior sensibilidade da voltametria de pulso diferencial pode ser atribuída a duas fontes: (i) aumento da corrente faradáica e (ii) decréscimo da corrente de carga capacitiva, ou seja, não faradáica. Cabe ressaltar que apenas a corrente faradaíca é proporcional à concentração do analito. Atualmente uma das técnicas voltamétricas de pulso mais sensíveis e rápidas é a voltametria de onda quadrada (SWV, do inglês Square Wave Voltammetry). As formas de onda consistem de uma onda quadrada simétrica de amplitude Esw sobreposta a uma rampa de potencial. O período completo da onda quadrada ocorre para cada período. Um voltamograma característico está apresentado na Figura 7.
11 VOLTAMETRIA DE ONDA QUADRADA E E E sw Série de pulsos E s t t Rampa de potencial E 1 E i = i 1 - i 2 i 1 E s + E sw 2 i = i 1 - i 2 t Sinal de excitação i 2 t Voltamograma característico Figura 7. Série de pulsos, rampa de potencial, sinal de excitação e voltamograma característico obtido na SWV. A SWV apresenta vantagens frente a outras técnicas voltamétricas no que que concerne a sensibilidade e velocidade de varredura, além de permitir a obtenção de informações a respeito do mecanismo eletroquímico. Voltametria de Redissolução Nos últimos anos, houve uma demanda crescente pela detecção e quantificação de componentes traços em matrizes complexas. A conscientização de efeitos prejudiciais de alguns elementos traços em
12 matrizes como alimentos, águas naturais, solos, efluentes industriais e esgotos domésticos, fez com que surgissem rigorosas legislações públicas direcionadas ao monitoramento destes componentes em amostras a níveis de parte por bilhão (ppb). Para isso, métodos analíticos mais sensíveis eram necessários. Uma nova técnica voltametrica destinada à análise de traços foi desenvolvida, a voltametria de redissolução. Apesar de outras técnicas analíticas sensíveis e confiáveis (como espectrometria de absorção atômica e outras) terem sido utilizadas na análise de traços, fatores, tais como alto custo de instrumentação, extensiva preparação das amostras e seletividade limitada, reduzem a eficácia destas técnicas principalmente quando aplicadas à análise de multi-componentes em matrizes de amostras complexas. De modo geral, a sensibilidade de toda técnica analítica pode ser aumentada introduzindo uma etapa preliminar de pré-concentração no preparo de amostra, por exemplo, uma extração líquido-líquido, líquidosólido ou extração em fase sólida. Na voltametria de redissolução, uma técnica eletroquímica de pré-concentração é usada anterior a varredura de potencial. A etapa de pré-concentração ou de deposição consiste na eletrodeposição, a potencial constante, da espécie de interesse em um eletrodo estacionário ou rotatório, sob agitação da solução, durante um tempo pré-determinado. Durante esta deposição, a solução é agitada pelo movimento do próprio eletrodo, no caso dele ser rotatório, ou por uma barra magnética usando-se um agitador magnético, no caso dele ser estacionário. Após a eletrodeposição, a solução é deixada em repouso por alguns segundos, para que os metais depositados tenham um tempo suficiente para difundir-se no mercúrio, tornando a amalgama homogênea. Esse tempo é chamado de tempo de repouso ou de equilíbrio. Isto é seguido pela etapa da determinação que consiste na redissolução eletrolítica, voltando a espécie depositada à solução de onde
13 havia sido retirada. Os eletrodos mais populares são o HMDE, o eletrodo de filme de mercúrio (MFE, do inglês, mercury film electrode,) suportado em ouro, platina e eletrodos de carbono, incluindo pasta do carbono e carbono vítreo. A faixa de potencial em que esses eletrodos podem ser usados em solução aquosa, ou seja, o domínio de eletroatividade, depende tanto do material do eletrodo como da composição do eletrólito suporte (Skoog et al, 2002) (Figura 8). Pt H 2 SO 4 1 mol/l Tampão ph 7 NaOH 1 mol/l Hg H 2 SO 4 1 mol/l KCl 1 mol/l C HClO 4 1 mol/l KCl 0,1 mol/l E (V vs SCE) Figura 8. Faixa de potencial para três tipos de eletrodos em diferentes eletrólitos. Os eletrodos do mercúrio oferecem a vantagem na análise de determinados íons metálicos, de que o produto da deposição, ou seja, o metal reduzido, se dissolve no mercúrio para formar uma amálgama. Durante a eletrólise, a corrente que flui é descrita pela equação de LEVICH (Bard & Faulkner, 1980) Eq. (2): i (t) = 0,62 n F A D 2/3 1/2 1/6 C A(t) Eq. (2) Onde n é o número de elétrons transferidos durante a reação, F é a
14 constante de Faraday, A é a área geométrica do eletrodo, D é o coeficiente de difusão, é a velocidade de rotação, é a viscosidade cinemática e C A(t) é a concentração do analito. Recomenda-se, em geral, usar o eletrodo de mercúrio de gota pendente para concentrações acima de 1 ppb e o de filme de mercúrio para concentrações abaixo desta. O potencial a ser aplicado no processo de deposição permite controlar a seletividade na análise de uma solução que contém vários íons metálicos. Assim, somente um metal ou um grupo de metais pode ser depositado, evitando a deposição de outros metais que possam vir a interferir na etapa de redissolução. Quanto mais catódico o potencial, maior o número de elementos depositados e maior a possibilidade de interferência. A Figura 9a ilustra a forma do sinal de excitação de potencial usualmente aplicado no método de redissolução anódica de varredura linear para a determinação de cádmio e cobre em soluções aquosas. Inicialmente é aplicado, no microeletrodo, um potencial catódico de 1,0 V por um tempo definido e sob agitação. Após um tempo de repouso ou equilíbrio, sem agitação, o potencial do eletrodo é alterado linearmente para valores menos negativos e a corrente é registrada em função do potencial. A Figura 9b mostra o voltamograma resultante (Skoog et al, 2002). Entretanto cabe mencionar, que a presença de oxigênio dissolvido no eletrólito de suporte interfere na determinação das espécies eletroativas, visto que o oxigênio sofre redução, em duas etapas, no domínio de eletroatividade empregando o eletrodo de mercúrio. Para tanto, faz-se necessário anterior medidas voltamétricas, a remoção do oxigênio dissolvido, por arraste com um gás inerte (nitrogênio) por um tempo de 5 a 10 minutos.
15 Figura 9. a) Sinal de excitação para determinação de Cd(II) e Cu(II) por voltametria de redissolução. b) Voltamograma obtido para a redissolução dos elementos previamente depositados na superfície do eletrodo (Skoog et al, 2002). A sensibilidade da voltametria de redissolução depende da combinação da pré-concentração obtida na etapa de deposição e da técnica voltamétrica empregada na etapa de redissolução. Entre as técnicas voltamétricas, a de pulso diferencial permite registrar maiores intensidades de corrente para uma mesma concentração de analito frente à de corrente contínua ou pulso normal. De modo geral, a sensibilidade é elevada e é limitada freqüentemente pela pureza dos reagentes, técnicas de amostragem e abertura da amostra. Os limites típicos da detecção para as técnicas de redissolução situam-se na faixa de mol L -1. Na voltametria de redissolução anódica (ASV, do inglês anodic stripping voltammetry) um potencial mais negativo que o potencial de
16 pico da espécie eletroativa é aplicado na etapa de pré-concentração e as principais reações envolvidas são: M n+ + n e - M(Hg) (Etapa de pré-concentração - Redução) M M n+ + n e - (Etapa de redissolução - Oxidação) Metais que apresentam solubilidade no mercúrio podem ser determinados por ASV, entre esses se destacam Cu, Cd, Pb, As, Sb, Bi, Zn, Mn e Sn. A voltametria de redissolução catódica (CSV, do inglês cathodic stripping voltammetry) é usada para a determinação de substâncias que formam sais pouco solúveis com os íons do mercúrio do eletrodo de trabalho. A técnica consiste na polarização anódica do eletrodo cuja superfície se deposita uma camada de composto pouco solúvel, formada por anions da espécie e cátions do eletrodo, seguida da eletroredução da camada depositada através da varredura de potencial no sentido catódico. Entre as espécies que podem ser determinadas por essa técnica, ao nível de traços, destacam-se As, Se, cloreto, brometo, iodeto, sulfeto, cianeto e outros. Enquanto na voltametria de redissolução os compostos são acumulados por eletrólise na superfície do eletrodo, na voltametria de redissolução adsortiva (AdSV, do inglês adsorptive stripping voltammetry), o analito, na presença de um agente complexante seletivo é adsorvido na superfície do eletrodo de trabalho por intermédio de um processo não eletrolítico. A principal vantagem da AdSV é a alta sensibilidade, sendo especialmente adequada para a determinação daqueles metais que não são eletroativos no eletrodo de mercúrio como Pd, Ti, Co, Ni, Pt, Sb, Fe, Cr, V, U, Mo, Mn e outros. Através da reação química destes elementos com um agente complexante específico gera-se a espécie a ser adsorvida na superfície do eletrodo. O processo de adsorção é espontâneo e a quantidade da espécie acumulada na superfície
17 do eletrodo depende do material do eletrodo, solvente, ph, potencial, tempo, força iônica, transporte de massa e temperatura. A etapa de redissolução é semelhante à CSV e ASV, onde se aplica uma varredura de potencial na direção catódica ou anódica, dependendo das propriedades redox da espécie acumulada. Cabe destacar que a redissolução pode ou não envolver a transferência de elétrons. Para medidas voltamétricas podem também ser empregadas celas em fluxo, como apresentado na Figura 10A. Um voltamograma característico obtido com essa cela para a determinação simultânea de U, V, Sb e Mo, obtido pela técnica de AdSV, empregando ácido cloranílico está apresentado na Figura 10 (Sander, 1999). U V M Sb A B Figura 10. (A) Cela voltamétrica em fluxo. (B) Voltamograma para a determinação simultânea de U, V, Sb e Mo, empregando cela em fluxo. Técnica AdSV, emprego de ácido cloroanílico (Sander, 1999). Voltametria orgânica As técnicas voltamétricas têm grande aplicação não somente na determinação de elementos inorgânicos, mas também moléculas orgânicas em matrizes diversas. Para que a substância seja eletroativa é necessário que tenha um grupo funcional que possa sofrer oxidação ou redução no domínio de eletroatividade. Na Tabela 1 são apresentadas
18 algumas substâncias que podem ser determinadas empregando-se o eletrodo de mercúrio. Tabela 1. Exemplos de compostos orgânicos que podem ser determinados por voltametria. Espécie oxidada Espécie reduzida R-CH 2 =CH 2 + 2e - R-CH 2 -CH 3 R-CH 2 -X + H + + e - R-CH 3 + X - (X: halogênio) C 6 H 5 -N=N-C 6 H 5 + 2H + + 2e - C 6 H 5 -NH-NH-C 6 H 5 C 6 H 5 -CHO + 2H + + 2e - C 6 H 5 -CH 2 OH R-NO + 2H + + 2e - R-NOH Espécie oxidada Espécie reduzida R-NO 2 + 4H + + 4e - R-NHOH R-S-S-R + 2H + + 2e - 2RSH A voltametria também tem sido empregada com sucesso na determinação de compostos orgânicos entre esses pesticidas como linuron, paration, paraquat, clorofenol picloram, imidacloprid, apresentando menor manipulação de amostras e menor custo de análise quando comparadas as técnicas cromatográficas. Para tanto, diferentes materiais de eletrodos têm sido empregados, entre esses o HMDE, carbono vítreo, diamante dopado com boro e outros (Jehring et al, 1989; Guiberteau et al, 2001; Massaroppi & Machado, 2003; Pedrosa et al, 2003; Souza & Machado, 2003). Análise de amostras ambientais As técnicas voltamétricas têm grande aplicação na análise de amostras ambientais como águas naturais, neve, solo, sedimentos,
19 plantas, tanto na determinação de elementos inorgânicos ao nível de traços, quanto na especiação destes elementos (Locatelli et al, 1999; Emons et al, 2000; Ghoneim et al, 2000; Locatelli et al, 2000; Silva et al, 2001; Baranowska et al, 2002). Embora as técnicas voltamétricas apresentam elevada sensibilidade, sofrem interferência da matéria orgânica presente na matriz. Para tanto, faz-se necessário a destruição ou separação da parte orgânica da amostra anterior a determinação voltamétrica, a qual pode ser feita através de digestão via seca, digestão via úmida, digestão assistida por microondas, digestão assistida por ultra-som, extração em fase sólida e outras. A não destruição completa da matéria orgânica proveniente da amostra pode vir a deformar as curvas voltamétricas de tal forma que não seja mais possível a quantificação da espécie de interesse. Essa interferência é decorrente da adsorção da matéria orgânica sobre superfície do eletrodo, afetando o processo de deposição dos íons metálicos sobre o mesmo. No entanto, na determinação de metais (Cu, Pb, Zn e Ni) em solos, quando a separação dos analitos é realizada por extração com ácido clorídrico, foi verificado que não ocorre interferência da matéria orgânica (Colombo & Van Den Berg, 1998). Uma área promissora da voltametria na análise de amostras ambientais é a determinação in situ de espécies eletroativas, que está sendo possível mediante o desenvolvimento de microeletrodos. Neste tipo de análise o microeletrodo é introduzido diretamente na amostra de solo, sedimento, etc. A análise in situ é especialmente atraente uma vez que permite a eliminação de artefatos decorrentes do preparo de amostras, bem como viabiliza a análise em tempo real para uma rápida detecção de poluentes em amostras ambientais.
20 Considerações finais As técnicas eletroanalíticas, em particular a voltametria, têm potencial para a determinação de elementos orgânicos e inorgânicos em uma ampla faixa de concentração em matrizes ambientais. A voltametria têm sido empregada na determinação de metais e pesticidas em águas e solos. A voltametria de redissolução permite a análise de elementos traços (concentrações na ordem de mol/l). A voltametria permite realizar estudos de especiação que são importantes do ponto de vista toxicológico. O emprego de microeletrodos permite a análise in situ em tempo real. O custo de análise por amostra é via de regra menor do que por técnicas cromatográficas, no entanto, em matrizes ambientais como solo e plantas é necessária a destruição de matéria orgânica anterior determinação voltamétrica. Ainda, existe a vantagem da determinação seqüencial de elementos em uma única análise. Os instrumentos empregados na voltametria são relativamente simples e permitem mecanização e/ou automatização. Referências BARANOWSKA, I.; SROGI, K.; WLOCHOWICZ, A.; SZZEPANIK, K. Determination of heavy metal contents in samples of medicinal herbs. Polish Journal of Environmental Studies, Olsztyn, v. 11, n. 5, p , BARD, A. J.; FAULKNER, L. R. Electrochemical methods: fundamentals and applications. New York: John Wiley, p. il. BRETT, A. M. O.; BRETT, C. M. A. Eletroquímica: princípios métodos e aplicações. Coimbra: Almedina, p.
21 COLOMBO, C.; VAN DEN BERG, C. M. G. Determination of trace metals (Cu, Pb, Zn and Ni) in soil extracts by flow analysis with voltammetric determination. International Journal of Environmental Analytical Chemistry, London, v. 7, p. 1-17, EMONS, H.; BAADE, A.; SCHONING, M. J. Voltammetric determination of heavy metals in microvolumes of rain water. Electroanalysis, New York, v. 12, n. 15, p , FLATO, J. B. Renaissance in polarographic and voltammetric analysis. Analytical Chemistry, Washington, v. 44, n. 11, p. 75a, GHONEIM, M. M.; HASSANEIN, A. M.; HAMMAM, E.; BELTAGI, A. M. Simultaneous determination of Cd, Pb, Cu, Sb, Bi, Se, Zn, Mn, Ni, Co and Fe in water samples by differential pulse stripping voltammetry at a hanging mercury drop electrode. Fresenius Journal of Analytical Chemistry, Berlin, v. 367, n. 4, p , GUIBERTEAU, A.; GALEANO, T.; MORA, N.; PARRILLA, P.; SALINAS, F. Study and determination of the pesticide imidacloprid by square wave adsorptive stripping voltammetry. Talanta, London, v. 53, n. 5, p , HEYROVSKÝ, J. The development of polarographic analysis. Analyst, London, v. 81, n. 961, p.189, JAROSLAV Heyrovský. Disponível em: < Acesso em: 10 out JEHRING, H.; LA CHEVALLERIE-HAAF, A. de; MEYER, A.; HENZE, G. Polarographic-behavior of pesticides with carbon-halogen bonds. Fresenius Zeitschrift für Analytische Chemie, Heidelberg, v. 332, p , LOCATELLI, C.; ASTARA, A.; VASCA, E.; CAMPANELLA, V. Voltammetric and spectroscopic determination of toxic metals in sediments and sea water of Salerno Gulf. Environmental Monitoring and Assessment, Dordrecht, v. 58, p , LOCATELLI, C.; TORSI, G.; ROSSI, F. A. A new analytical procedure for simultaneous voltammetric metal determinations in sea water, sediments, algae and fishes. Fresenius Environmental Bulletin, Munich, v. 9, n , p , MASSAROPPI, M. R. C.; MACHADO, S. A. S. Electroanalytical determination of the herbicide picloram in natural waters by square wave voltammetry. Journal of the Brazilian Chemical Society, São Paulo, v. 14, p , PEDROSA, V. D.; CODOGNOTO, L.; AVACA, L. A. Determinação
22 voltamétrica de 4-clorofenol sobre o eletrodo de diamante dopado com boro utilizando a voltametria de onda quadrada. Química Nova, São Paulo, v. 26, n. 6, p , SANDER, S. Simultaneous adsorptive stripping voltammetric determination of molybdenum(vi), uranium(vi), vanadium(v), and antimony(iii). Analytica Chimica Acta, Amsterdam, v. 394, n. 1, p , SILVA, P. R. M.; EL KHAKANI, M. A.; CHAKER, M.; DUFRESNE, A. Simultaneous determination of Cd, Pb, and Cu metal trace concentrations in water certified samples and soil extracts by means of Hg-electroplated-Ir microelectrode array based sensors. Sensors and Actuators B-Chemical, Lausanne, v. 76, n. 1-3, p , SKOOG, D. A.; HOLLER, F. J.; NIEMAN, T. A. Princípios de análise instrumental. 5. ed. Porto Alegre: Bookman, p. il. SOUZA, D.; MACHADO, S. A. S. Estudo eletroanalítico do paraqueat em soluções aquosas por voltametria de onda quadrada. Química Nova, São Paulo, v. 26, n. 5, p , VARGAS, M. C. M. Determinação qualitativa e quantitativa de metais em plantas medicinais por fluorescência de raios-x e voltametria de redissolução anódica. 133 p Dissertação (Mestrado) Instituto de Química, Unicamp, Campinas.
5.1. Estudos preliminares e otimização.
 105 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
105 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
5.1. Estudos preliminares e otimização.
 106 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
106 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
UNIVERSIDADE ESTADUAL DE CAMPINAS
 UNIVERSIDADE ESTADUAL DE CAMPINAS Faculdade de Engenharia Civil Arquitetura e Urbanismo Instituto de Química Especiação e remoção de arsênio inorgânico de águas de superfície e subterrânea empregando fotocatálise
UNIVERSIDADE ESTADUAL DE CAMPINAS Faculdade de Engenharia Civil Arquitetura e Urbanismo Instituto de Química Especiação e remoção de arsênio inorgânico de águas de superfície e subterrânea empregando fotocatálise
Métodos voltamétricos
 VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
Métodos Eletroanalíticos. Voltametria
 Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
MÉTODOS ELETROANALÍTICOS PARTE II
 Aula 7 MÉTODOS ELETROANALÍTICOS PARTE II META Apresentar os fundamentos da titulação potenciométrica; apresentar a localização do ponto fi nal da titulação potenciométrica; apresentar os fundamentos da
Aula 7 MÉTODOS ELETROANALÍTICOS PARTE II META Apresentar os fundamentos da titulação potenciométrica; apresentar a localização do ponto fi nal da titulação potenciométrica; apresentar os fundamentos da
Tipos de métodos eletroanalíticos
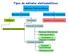 Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
ESTUDOS POLAROGRÁFICOS DO HERBICIDA IMAZAQUIN
 ISSN 1413-6244 Empresa Brasileira de Pesquisa Agropecuária Centro Nacional de Pesquisa e Desenvolvimento de Instrumentação Agropecuária Ministério da Agricultura e do Abastecimento Rua XV de Novembro,
ISSN 1413-6244 Empresa Brasileira de Pesquisa Agropecuária Centro Nacional de Pesquisa e Desenvolvimento de Instrumentação Agropecuária Ministério da Agricultura e do Abastecimento Rua XV de Novembro,
Sendo O a forma oxidada do analito e R a forma reduzida.
 2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
5 Determinação da primaquina em ECV.
 5 Determinação da primaquina em ECV. 5.1 Estudos preliminares Tentou-se inicialmente realizar a determinação direta da primaquina no EGPM. Apesar de já existirem vários trabalhos publicados na literatura
5 Determinação da primaquina em ECV. 5.1 Estudos preliminares Tentou-se inicialmente realizar a determinação direta da primaquina no EGPM. Apesar de já existirem vários trabalhos publicados na literatura
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
Potencial de Eletrodo Parte I
 Potencial de Eletrodo Parte I 1. Gentil V. Corrosão. 3 edição. 2. Denaro A. R. Fundamentos de eletroquímica. Ed Edgar Blucher Ltda e Ed. Universidade de São Paulo, Brasil, 1974. 3. Ander P. e Sonnessa
Potencial de Eletrodo Parte I 1. Gentil V. Corrosão. 3 edição. 2. Denaro A. R. Fundamentos de eletroquímica. Ed Edgar Blucher Ltda e Ed. Universidade de São Paulo, Brasil, 1974. 3. Ander P. e Sonnessa
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto
 122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Nas determinações voltamétricas de espécies químicas tais como Cd (II) e Pb (II), o ajuste das
122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Nas determinações voltamétricas de espécies químicas tais como Cd (II) e Pb (II), o ajuste das
Universidade Federal de Uberlândia Programa de Pós-Graduação em Química Instituto de Química
 Universidade Federal de Uberlândia Programa de Pós-Graduação em Química Instituto de Química DETERMINAÇÃO VOLTAMÉTRICA DE ZINCO EMPREGANDO ELETRODOS QUIMICAMENTE MODIFICADOS COM BISMUTO WILSON TIAGO DA
Universidade Federal de Uberlândia Programa de Pós-Graduação em Química Instituto de Química DETERMINAÇÃO VOLTAMÉTRICA DE ZINCO EMPREGANDO ELETRODOS QUIMICAMENTE MODIFICADOS COM BISMUTO WILSON TIAGO DA
6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto
 122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Ao se ajustar a concentração de Bi (III) para a formação in situ do eletrodo de bismuto (BiFE)
122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Ao se ajustar a concentração de Bi (III) para a formação in situ do eletrodo de bismuto (BiFE)
QUI 070 Química Analítica V Análise Instrumental. Aula 4 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 4 Química Eletroanalítica Julio C. J. Silva 2o semestre
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 4 Química Eletroanalítica Julio C. J. Silva 2o semestre
Eletroanalítica: Condutometria (ou Condutimetria)
 Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
2. POLAROGRAFIA 2.1 CONCEITOS GERAIS
 2. POLAROGRAFIA 2.1 CONCEITOS GERAIS A eletroanalítica é um ramo do conhecimento da química em que são estabelecidas relações diretas entre as concentrações do analito e alguma propriedade elétrica como
2. POLAROGRAFIA 2.1 CONCEITOS GERAIS A eletroanalítica é um ramo do conhecimento da química em que são estabelecidas relações diretas entre as concentrações do analito e alguma propriedade elétrica como
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR
 INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
Determinação voltamétrica do nedocromil de sódio utilizando eletrodo de carbono vítreo
 Volume 28 (2003) número 2 www.scielo.br/eq Determinação voltamétrica do nedocromil de sódio utilizando eletrodo de carbono vítreo T. F. Rosa 1, A. A. Saczk 1, M. V. B. Zanoni 1, N. R. Stradiotto 1 1 Departamento
Volume 28 (2003) número 2 www.scielo.br/eq Determinação voltamétrica do nedocromil de sódio utilizando eletrodo de carbono vítreo T. F. Rosa 1, A. A. Saczk 1, M. V. B. Zanoni 1, N. R. Stradiotto 1 1 Departamento
ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA. Resumo 800
 ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA Resumo 800 Este trabalho objetivou a caracterização eletroquímica do carrapaticida fipronil, por meio da técnica de
ESTUDO ELETROANALÍTICO DO CARRAPATICIDA FIPRONIL PELA TÉCNICA DE VOLTAMETRIA CÍCLICA Resumo 800 Este trabalho objetivou a caracterização eletroquímica do carrapaticida fipronil, por meio da técnica de
QUI 154 Química Analítica V Análise Instrumental. Aula 4 Potenciometria
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Análise Instrumental Aula 4 Potenciometria Julio C. J. Silva Juiz de Fora, 1 o sem
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Análise Instrumental Aula 4 Potenciometria Julio C. J. Silva Juiz de Fora, 1 o sem
Polarização e cinética de eletrodo
 Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
CQ049 FQ Eletroquímica.
 CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti A Eletroquímica pode ser dividida em duas áreas: Iônica: Está
CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti LEAP Laboratório de Eletroquímica e Polímeros mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti A Eletroquímica pode ser dividida em duas áreas: Iônica: Está
QUI 070 Química Analítica V Análise Instrumental. Aula 7 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
LISTA DE EXERCÍCIOS Eletroquímica
 DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
DISCIPLINA: Química Geral e Inorgânica PERÍODO: LISTA DE EXERCÍCIOS Eletroquímica CURSO: Engenharia de Produção e sistemas 1. Indique o número de oxidação de cada átomo nos compostos abaixo: a) CO; C:
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
APLICAÇÃO DA ANÁLISE DE COMPONENTES PRINCIPAIS NO ESTUDO DA VOLTAMETRIA ADSORTIVA DE ÍONS METÁLICOS
 APLICAÇÃO DA ANÁLISE DE COMPONENTES PRINCIPAIS NO ESTUDO DA VOLTAMETRIA ADSORTIVA DE ÍONS METÁLICOS Leandra de Oliveira Cruz da Silva 1, Efraim Lázaro Reis 1, Paulo Henrique Fidêncio 2 César Reis 1, Fernanda
APLICAÇÃO DA ANÁLISE DE COMPONENTES PRINCIPAIS NO ESTUDO DA VOLTAMETRIA ADSORTIVA DE ÍONS METÁLICOS Leandra de Oliveira Cruz da Silva 1, Efraim Lázaro Reis 1, Paulo Henrique Fidêncio 2 César Reis 1, Fernanda
Estudo do comportamento eletroquímico do herbicida ametrina utilizando a técnica de voltametria de onda quadrada
 Volume 28 (2003) número 2 www.scielo.br/eq Estudo do comportamento eletroquímico do herbicida ametrina utilizando a técnica de voltametria de onda quadrada M. F. Cabral 1, D. de Souza 2, C. R. Alves 1,
Volume 28 (2003) número 2 www.scielo.br/eq Estudo do comportamento eletroquímico do herbicida ametrina utilizando a técnica de voltametria de onda quadrada M. F. Cabral 1, D. de Souza 2, C. R. Alves 1,
QUI 070 Química Analítica V Análise Instrumental. Aula 7 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
HIDROMETALURGIA E ELETROMETALURGIA. Prof. Carlos Falcão Jr.
 HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
HIDROMETALURGIA E ELETROMETALURGIA Prof. Carlos Falcão Jr. de um sólido em fase aquosa natureza do sólido (iônico, covalente ou metálico) processo: físico químico eletroquímico de redução eletrolítico
Estudo das reações químicas para geração de energia.
 Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Estudo das reações químicas para geração de energia. Células Galvânicas (Pilhas e Baterias): Conversão de Energia Química em Energia Elétrica (Reações Espontâneas) Células Eletrolíticas: Conversão de Energia
Respondem à atividade do analito, de forma rápida e reprodutível. Assim... ΔE = função da atividade do analito
 Respondem à atividade do analito, de forma rápida e reprodutível. Assim... ΔE = função da atividade do analito Idealmente, estes eletrodos deveriam ser específicos. Entretanto, a maioria deles são seletivos
Respondem à atividade do analito, de forma rápida e reprodutível. Assim... ΔE = função da atividade do analito Idealmente, estes eletrodos deveriam ser específicos. Entretanto, a maioria deles são seletivos
UTILIZAÇÃO DO ELETRODO SÓLIDO DE AMÁLGAMA NA OTIMIZAÇÃO EXPERIMENTAL E VOLTAMETRIA PARA O DESENVOLVIMENTO DE MÉTODO DE ANALÍSE DO PESTICIDA TIRAM
 UTILIZAÇÃO DO ELETRODO SÓLIDO DE AMÁLGAMA NA OTIMIZAÇÃO EXPERIMENTAL E VOLTAMETRIA PARA O DESENVOLVIMENTO DE MÉTODO DE ANALÍSE DO PESTICIDA TIRAM 1 Vanessa Cristina Pereira Maia, 2 Lucas Moreira Silva,
UTILIZAÇÃO DO ELETRODO SÓLIDO DE AMÁLGAMA NA OTIMIZAÇÃO EXPERIMENTAL E VOLTAMETRIA PARA O DESENVOLVIMENTO DE MÉTODO DE ANALÍSE DO PESTICIDA TIRAM 1 Vanessa Cristina Pereira Maia, 2 Lucas Moreira Silva,
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Voltametria Ciclica: Fundamentos Básicos e Aplicações
 Voltametria Ciclica: Fundamentos Básicos e Aplicações rof. Alzir Azevedo Batista Universidade Federal de São Carlos - Brasil Introdução A técnica de voltametria c cclica é mais própria para fins qualitativos
Voltametria Ciclica: Fundamentos Básicos e Aplicações rof. Alzir Azevedo Batista Universidade Federal de São Carlos - Brasil Introdução A técnica de voltametria c cclica é mais própria para fins qualitativos
AMOSTRA METODOLOGIA ANALITOS TÉCNICA Óleo diesel Emulsificação em Cr, Mo, Ti e V PN-ICP OES. Ni, Ti, V e Zn
 163 9 Conclusões Neste trabalho, duas abordagens diferentes para análise de amostras de óleos e gorduras foram estudadas visando o desenvolvimento de métodos analíticos baseados em técnicas que utilizam
163 9 Conclusões Neste trabalho, duas abordagens diferentes para análise de amostras de óleos e gorduras foram estudadas visando o desenvolvimento de métodos analíticos baseados em técnicas que utilizam
REAÇÕES DE ÓXIDO-REDUÇÃO
 REAÇÕES DE ÓXIDO-REDUÇÃO A Química Analítica moderna tem por base a medida dos Sinais Analíticos, relacionados às transformações de propriedades dos materiais ao longo de uma Análise Química. Entre estes
REAÇÕES DE ÓXIDO-REDUÇÃO A Química Analítica moderna tem por base a medida dos Sinais Analíticos, relacionados às transformações de propriedades dos materiais ao longo de uma Análise Química. Entre estes
Programa Analítico de Disciplina QMF110 Química Analítica I
 0 Programa Analítico de Disciplina Campus de Florestal - Campus de Florestal Número de créditos: 6 Teóricas Práticas Total Duração em semanas: 15 Carga horária semanal 6 Períodos - oferecimento: I Carga
0 Programa Analítico de Disciplina Campus de Florestal - Campus de Florestal Número de créditos: 6 Teóricas Práticas Total Duração em semanas: 15 Carga horária semanal 6 Períodos - oferecimento: I Carga
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
UNIVERSIDADE FEDERAL DO PARANÁ DEONIR AGUSTINI
 UNIVERSIDADE FEDERAL DO PARANÁ DEONIR AGUSTINI NANOESTRUTURAS DE BISMUTO SUPORTADAS EM BIOCHAR PARA DETERMINAÇÃO DE ÍONS CHUMBO POR VOLTAMETRIA DE REDISSOLUÇÃO ADSORTIVA CURITIBA 2014 DEONIR AGUSTINI NANOESTRUTURAS
UNIVERSIDADE FEDERAL DO PARANÁ DEONIR AGUSTINI NANOESTRUTURAS DE BISMUTO SUPORTADAS EM BIOCHAR PARA DETERMINAÇÃO DE ÍONS CHUMBO POR VOLTAMETRIA DE REDISSOLUÇÃO ADSORTIVA CURITIBA 2014 DEONIR AGUSTINI NANOESTRUTURAS
MÉTODOS COULOMÉTRICOS
 MÉTODOS COULOMÉTRICOS São realizados por meio da medida de quantidade de carga elétrica requerida para converter uma amostra de um analito quantitativamente a um diferente estado de oxidação. A coulometria
MÉTODOS COULOMÉTRICOS São realizados por meio da medida de quantidade de carga elétrica requerida para converter uma amostra de um analito quantitativamente a um diferente estado de oxidação. A coulometria
02/10/2017 ELETRÓLISE AQUOSA
 ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
Reações em Soluções Aquosas
 Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
Reações em Soluções Aquosas Classificação Reações sem transferência de elétrons: Reações de precipitação; Reações de neutralização. Reações com transferência de elétrons: Reações de oxirredução. Reações
PROMILITARES 20/09/2018 QUÍMICA. Professora Caroline Azevedo ELETROQUÍMICA. Eletroquímica. Você precisa saber o que é oxidação e redução!
 QUÍMICA Professora Caroline Azevedo ELETROQUÍMICA Eletroquímica Você precisa saber o que é oxidação e redução! Pilha É o nome dado ao dispositivo que aproveita a transferência de elétrons em uma reação
QUÍMICA Professora Caroline Azevedo ELETROQUÍMICA Eletroquímica Você precisa saber o que é oxidação e redução! Pilha É o nome dado ao dispositivo que aproveita a transferência de elétrons em uma reação
ELETROQUÍMICA Profº Jaison Mattei
 ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
ELETROQUÍMICA Profº Jaison Mattei ELETROQUÍMICA 1) Eletrólise: reações provocadas pela corrente elétrica. 2) Pilhas: reações que produzem corrente elétrica. Eletrólise é a reação não espontânea provocada
Química. Eletroquímica
 CIC Colégio Imaculada Conceição Química Eletroquímica Msc. Camila Soares Furtado Couto Eletrólise Inverso da Pilha; Reação de oxi-redução que é provocada pela corrente elétrica; Não espontânea!!!! Eletrólise
CIC Colégio Imaculada Conceição Química Eletroquímica Msc. Camila Soares Furtado Couto Eletrólise Inverso da Pilha; Reação de oxi-redução que é provocada pela corrente elétrica; Não espontânea!!!! Eletrólise
Departamento de Química Inorgânica IQ / UFRJ IQG 128 / IQG ELETRÓLISE
 10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
10. ELETRÓLISE I. INTRODUÇÃO Como já mencionado na aula prática de reações de oxirredução, a eletricidade também pode ser usada para realizarmos reações de transferência de elétrons não espontâneas. Por
AVALIAÇÃO DO EFEITO DOS PARÂMETROS OPERACIONAIS DENSIDADE DE CORRENTE E ph DO BANHO SOBRE AS PROPRIEDADES DA LIGA Mo-Co-Fe
 AVALIAÇÃO DO EFEITO DOS PARÂMETROS OPERACIONAIS DENSIDADE DE CORRENTE E ph DO BANHO SOBRE AS PROPRIEDADES DA LIGA Mo-Co-Fe Alison Silva Oliveira 1 ; José Anderson Machado Oliveira 1 ; Anamélia de Medeiros
AVALIAÇÃO DO EFEITO DOS PARÂMETROS OPERACIONAIS DENSIDADE DE CORRENTE E ph DO BANHO SOBRE AS PROPRIEDADES DA LIGA Mo-Co-Fe Alison Silva Oliveira 1 ; José Anderson Machado Oliveira 1 ; Anamélia de Medeiros
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroforese Capilar 01/05/2016. L T = cm. - Transporte eletrocinético - Uso de bombas/válvulas. Aula 03. Detector Capilar Controle
 Aula 03 1 Eletroforese Capilar Detector Capilar Controle Fonte de Alta Tensão Tampão Amostra Tampão L T = 30-50 cm 2 Eletroforese Capilar - Transporte eletrocinético - Uso de bombas/válvulas 3 1 Separação
Aula 03 1 Eletroforese Capilar Detector Capilar Controle Fonte de Alta Tensão Tampão Amostra Tampão L T = 30-50 cm 2 Eletroforese Capilar - Transporte eletrocinético - Uso de bombas/válvulas 3 1 Separação
QUÍMICA ELETROANALÍTICA
 QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
Resposta Capítulo 17: Eletroquímica: Pilhas
 Resposta Capítulo 7: Eletroquímica: Pilhas. B Correta. O óxido de LiCoO é oxidado a CoO, na recarga da pilha. Li e Li. Reação global da pilha eletroquímica formada por cobre e ferro:,34 V >,44 V Cu e Cu
Resposta Capítulo 7: Eletroquímica: Pilhas. B Correta. O óxido de LiCoO é oxidado a CoO, na recarga da pilha. Li e Li. Reação global da pilha eletroquímica formada por cobre e ferro:,34 V >,44 V Cu e Cu
PMT2423 FÍSICO-QUÍMICA PARA METALURGIA E MATERIAIS III. PMT Físico-Química para Metalurgia e Materiais III - Neusa Alonso-Falleiros
 PMT2423 FÍSICO-QUÍMICA PARA METALURGIA E MATERIAIS III 1 Reações Eletroquímicas e suas Aplicações Corrosão Eletrodeposição Hidrometalurgia (ex.: cobre; níquel; zinco) Reações Metal / Escória Eletroconformação
PMT2423 FÍSICO-QUÍMICA PARA METALURGIA E MATERIAIS III 1 Reações Eletroquímicas e suas Aplicações Corrosão Eletrodeposição Hidrometalurgia (ex.: cobre; níquel; zinco) Reações Metal / Escória Eletroconformação
Métodos Eletroanalíticos. Condutometria
 Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
APOSTILA QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes
 1 APOSTILA 1-2009 QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes I. Polarografia Objetivos: Obter e interpretar as curvas corrente versus
1 APOSTILA 1-2009 QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes I. Polarografia Objetivos: Obter e interpretar as curvas corrente versus
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
4. Resultados e Discussão
 Absorbância 4. Resultados e Discussão 4.1. Obtenção da curva de calibração A obtenção da curva de calibração, absorbância vs. concentração de Paraquat, é necessária para a análise química do pesticida.
Absorbância 4. Resultados e Discussão 4.1. Obtenção da curva de calibração A obtenção da curva de calibração, absorbância vs. concentração de Paraquat, é necessária para a análise química do pesticida.
REVISÃO DE QUÍMICA CEIS Prof. Neif Nagib
 REVISÃO DE QUÍMICA CEIS 2017 Prof. Neif Nagib CÁLCULO DO ph e do poh EXERCÍCIOS DE FIXAÇÃO 01. O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de ph no
REVISÃO DE QUÍMICA CEIS 2017 Prof. Neif Nagib CÁLCULO DO ph e do poh EXERCÍCIOS DE FIXAÇÃO 01. O estômago produz suco gástrico constituído de ácido clorídrico, muco, enzimas e sais. O valor de ph no
QUI 070 Química Analítica V Análise Instrumental. Aula 11 Cromatografia Líquida de Alta Eficiência (CLAE)
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 11 Cromatografia Líquida de Alta Eficiência (CLAE) Julio
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 11 Cromatografia Líquida de Alta Eficiência (CLAE) Julio
Eletrodo redox. Eletrodos construídos com metais inertes: platina, ouro, paládio. do sistema de óxido-redução presente na solução.
 Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
ELETRODO OU SEMIPILHA:
 ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
PMT CORROSÃO E PROTEÇÃO DOS MATERIAIS
 2.5 Tipos de corrosão: generalizada Detalhes: Perda de massa efeito dos produtos de corrosão: polarização e despolarização das reações parciais efeito do aumento da área morfologia da corrosão generalizada
2.5 Tipos de corrosão: generalizada Detalhes: Perda de massa efeito dos produtos de corrosão: polarização e despolarização das reações parciais efeito do aumento da área morfologia da corrosão generalizada
2ª SÉRIE roteiro 1 SOLUÇÕES
 2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
TRANSPORTE DE MASSA Eletroquímica Aula 6 Prof a. Dr a. Carla Dalmolin
 TRANSPORTE DE MASSA Eletroquímica Aula 6 Prof a. Dr a. Carla Dalmolin Velocidade de Reação de Eletrodo v = k a [R] k c [O] Dependem do transporte de espécies Difusão: movimento térmico de espécies neutras
TRANSPORTE DE MASSA Eletroquímica Aula 6 Prof a. Dr a. Carla Dalmolin Velocidade de Reação de Eletrodo v = k a [R] k c [O] Dependem do transporte de espécies Difusão: movimento térmico de espécies neutras
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA Porque estudar eletroquímica para o ENEM? 2015 81 2016 64 2107 95; 121 2018 93; 116 A relação entre as reações
Programa Analítico de Disciplina QUI310 Métodos Instrumentais de Análise
 0 Programa Analítico de Disciplina Departamento de Química - Centro de Ciências Exatas e Tecnológicas Número de créditos: 4 Teóricas Práticas Total Duração em semanas: 15 Carga horária semanal 4 0 4 Períodos
0 Programa Analítico de Disciplina Departamento de Química - Centro de Ciências Exatas e Tecnológicas Número de créditos: 4 Teóricas Práticas Total Duração em semanas: 15 Carga horária semanal 4 0 4 Períodos
Química Geral e Inorgânica. QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin. Eletroquímica
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Eletroquímica Reações Redox Reações onde ocorre a transferência de elétrons entre átomos Fluxo de elétrons
Análise Instrumental. Prof. Elias da Costa
 Análise Instrumental Prof. Elias da Costa 1-Introdução a Análise Instrumental CLASSIFICAÇÃO DOS MÉTODOS ANALÍTICOS CLASSIFICAÇÃO DOS MÉTODOS INSTRUMENTAIS INSTRUMENTOS PARA ANÁLISE SELEÇÃO DE UM MÉTODO
Análise Instrumental Prof. Elias da Costa 1-Introdução a Análise Instrumental CLASSIFICAÇÃO DOS MÉTODOS ANALÍTICOS CLASSIFICAÇÃO DOS MÉTODOS INSTRUMENTAIS INSTRUMENTOS PARA ANÁLISE SELEÇÃO DE UM MÉTODO
LCE0182 Química Analítica Quantitativa. Informações Gerais. Wanessa Melchert Mattos.
 LCE0182 Química Analítica Quantitativa Informações Gerais Wanessa Melchert Mattos wanemelc@usp.br Aprovação Para que o aluno possa ser aprovado exige-se média mínima de 5,0 em notas e 70% de frequência
LCE0182 Química Analítica Quantitativa Informações Gerais Wanessa Melchert Mattos wanemelc@usp.br Aprovação Para que o aluno possa ser aprovado exige-se média mínima de 5,0 em notas e 70% de frequência
~..l:. ..","".. ~ Yq STORAENSO ~ Votoranlim ICelulose e Papel 4QANOA. === Fc.z HM! BONGE ,.,...,.
 ';'"'1 XXXI. CONGRESSOCONQUISTAS BRASILEIRO & DESAFIOS u DECIÊNCIAda Ciência do DOSOLO Solo brasileira ~~ ~..l:. Promoção, i UFRGS II> l "".,.. ", '" ~:.. Apoio,..","".. ~FAPERGS _...at Al Gramado ===
';'"'1 XXXI. CONGRESSOCONQUISTAS BRASILEIRO & DESAFIOS u DECIÊNCIAda Ciência do DOSOLO Solo brasileira ~~ ~..l:. Promoção, i UFRGS II> l "".,.. ", '" ~:.. Apoio,..","".. ~FAPERGS _...at Al Gramado ===
Índice. Agradecimentos... Prefácio da Edição Revisada... Prefácio...
 Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
Índice Agradecimentos... Prefácio da Edição Revisada... Prefácio... VII IX XI CAPÍTULO 1 INTRODUÇÃO... 1 1.1 Definição da Corrosão... 1 1.2 Importância Econômica da Corrosão... 3 1.3 Análise Econômica
RESUMO. Junivaldo Mendonça Lemos (IC) 1, Jaldyr de Jesus Gomes Varela Júnior(PG) 1 e Auro Atsushi Tanaka(PQ) 1
 RESUMO ESTUDOS DA ELETROOXIDAÇÃO DO ETILENO GLICOL SOBRE CATALISADORES Pt/C 20%, Pt 1 Rh 1 /C 20%, Pt 2 Rh 1 /C 20%, Pt 3 RH 1 /C 20% PREPARADOS PELO MÉTODO DE REDUÇÃO POR ÁLCOOL. Junivaldo Mendonça Lemos
RESUMO ESTUDOS DA ELETROOXIDAÇÃO DO ETILENO GLICOL SOBRE CATALISADORES Pt/C 20%, Pt 1 Rh 1 /C 20%, Pt 2 Rh 1 /C 20%, Pt 3 RH 1 /C 20% PREPARADOS PELO MÉTODO DE REDUÇÃO POR ÁLCOOL. Junivaldo Mendonça Lemos
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 09 TURMA INTENSIVA
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 9 TURMA INTENSIVA 1. Item [C] Q De acordo com a definição de corrente elétrica, temos: i =, em que 1 A = 1 C/s: Δt Cálculo da carga fornecida pela bateria. 1 C ----------
ELETROQUÍMICA OU. Profa. Marcia M. Meier QUÍMICA GERAL II
 ELETROQUÍMICA OU REAÇÕES DE TRANSFERÊNCIA DE ELÉTRONS Profa. Marcia M. Meier QUÍMICA GERAL II 1 Objetivo Compreender: Balanceamento de equações redox em solução ácida e básica. Células galvânicas e potencial
ELETROQUÍMICA OU REAÇÕES DE TRANSFERÊNCIA DE ELÉTRONS Profa. Marcia M. Meier QUÍMICA GERAL II 1 Objetivo Compreender: Balanceamento de equações redox em solução ácida e básica. Células galvânicas e potencial
PMT AULAS 1 E 2 Augusto Camara Neiva. PMT Augusto Neiva
 PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
PMT3130 2017 - AULAS 1 E 2 Augusto Camara Neiva 1 2 3 4 AS AULAS NÃO SEGUIRÃO LINEARMENTE A APOSTILA HOJE: ELETROQUÍMICA 5 MOLÉCULA DE ÁGUA A molécula de água é polar e, portanto, a água pode alojar íons
Aula 13: Prof. Rafael Sousa
 Analítica V: Aula 13: 20-08-13 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan 1 A TÉCNICA DE POTENCIOMETRIA Baseada na medida
Analítica V: Aula 13: 20-08-13 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan 1 A TÉCNICA DE POTENCIOMETRIA Baseada na medida
química química na abordagem do cotidiano
 1 Respostas dos exercícios essenciais 1 Alternativa E. I. é incorreta, pois a eletrólise não é espontânea; ela é forçada com o uso de um gerador de corrente apropriado. II. é incorreta, pois o zinco tem
1 Respostas dos exercícios essenciais 1 Alternativa E. I. é incorreta, pois a eletrólise não é espontânea; ela é forçada com o uso de um gerador de corrente apropriado. II. é incorreta, pois o zinco tem
Aula 20 Eletrodeposição
 Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Aula 20 Eletrodeposição Dr. Tiago P. Camargo Eletrólise Eletroquímica Processo inverso das pilhas. Células galvânicas
Prova de conhecimento em Química Analítica DQ/UFMG
 CÓDIGO DO(A) CANDIDATO(A): Questão 1A. Considere os seguintes reagentes: I) KF sólido com teor de pureza de 95,0% m/m II) HF 28,0% m/m, d = 1,02 kg L -1, pk a = 3,17 III) KOH 0,400 mol L -1 a) Calcule
CÓDIGO DO(A) CANDIDATO(A): Questão 1A. Considere os seguintes reagentes: I) KF sólido com teor de pureza de 95,0% m/m II) HF 28,0% m/m, d = 1,02 kg L -1, pk a = 3,17 III) KOH 0,400 mol L -1 a) Calcule
Química Analítica Avançada
 Química Analítica Avançada Volumetria de Óxido-redução Profa. Lilian Silva LMBRANDO Reações de Oxi-redução Oxidação e redução 0 0 +1-1 0 0 +1-1 Reações redox e semi-células Zn 0 + Cu 2+ Zn 2+ + Cu 0 semi-célula
Química Analítica Avançada Volumetria de Óxido-redução Profa. Lilian Silva LMBRANDO Reações de Oxi-redução Oxidação e redução 0 0 +1-1 0 0 +1-1 Reações redox e semi-células Zn 0 + Cu 2+ Zn 2+ + Cu 0 semi-célula
CROMATOGRAFIA GASOSA PÓS-DOUTORANDO: DANILO SANTOS SOUZA
 CROMATOGRAFIA GASOSA PÓS-DOUTORANDO: DANILO SANTOS SOUZA SETEMBRO 2015 1 2 3 4 FE / FM 5 FM = LÍQUIDO CROMATOGRAFIA LÍQUIDA FM = GÁS CROMATOGRAFIA GASOSA (CG) SÓLIDA CGS FE em CG LÍQUIDA CGL 6 VANTAGENS
CROMATOGRAFIA GASOSA PÓS-DOUTORANDO: DANILO SANTOS SOUZA SETEMBRO 2015 1 2 3 4 FE / FM 5 FM = LÍQUIDO CROMATOGRAFIA LÍQUIDA FM = GÁS CROMATOGRAFIA GASOSA (CG) SÓLIDA CGS FE em CG LÍQUIDA CGL 6 VANTAGENS
Aula 9 FÍSICO-QUÍMICA DE SUPERFÍCIES PARTE 2: PROCESSOS EM ELETRODOS. Kleber Bergamaski
 Aula 9 FÍSICO-QUÍMICA DE SUPERFÍCIES PARTE 2: PROCESSOS EM ELETRODOS META Apresentar os principais conceitos à físico-química de superfícies envolvidos nos processos de eletrodos. Entendimento da interface
Aula 9 FÍSICO-QUÍMICA DE SUPERFÍCIES PARTE 2: PROCESSOS EM ELETRODOS META Apresentar os principais conceitos à físico-química de superfícies envolvidos nos processos de eletrodos. Entendimento da interface
Métodos Clássicos de Separação
 Analítica V: Aula 9: 22-07-13 Métodos Clássicos de Separação Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan Plano de aula Importância da extração
Analítica V: Aula 9: 22-07-13 Métodos Clássicos de Separação Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan Plano de aula Importância da extração
CQ049 FQ Eletroquímica. prof. Dr. Marcio Vidotti Terça / Quarta: 15:30 17:30
 CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti Terça / Quarta: 15:30 17:30 Espontaneidade de reações eletroquímicas redução A + e - A - oxidação A A + + e
CQ049 FQ Eletroquímica prof. Dr. Marcio Vidotti mvidotti@ufpr.br www.quimica.ufpr.br/mvidotti Terça / Quarta: 15:30 17:30 Espontaneidade de reações eletroquímicas redução A + e - A - oxidação A A + + e
Volumetria de Óxido-redução
 Volumetria de Óxido-redução LMBRANDO Reações de Oxi-redução Oxidação e redução 0 0 +1-1 0 0 +1-1 Reações redox e semi-células Zn 0 + Cu 2+ Zn 2+ + Cu 0 semi-célula do zinco: Zn 0 Zn 2+ + 2e - semi-célula
Volumetria de Óxido-redução LMBRANDO Reações de Oxi-redução Oxidação e redução 0 0 +1-1 0 0 +1-1 Reações redox e semi-células Zn 0 + Cu 2+ Zn 2+ + Cu 0 semi-célula do zinco: Zn 0 Zn 2+ + 2e - semi-célula
Processo de Seleção e Admissão aos Cursos de Mestrado e de Doutorado para o Semestre Edital n 001/PPGQMC/2015
 Processo de Seleção e Admissão aos Cursos de Mestrado e de Doutorado para o Semestre 2015-2 Edital n 001/PPGQMC/2015 EXAME DE SELEÇÃO PARA O MESTRADO Primeira Etapa: Provas de Química Analítica e de Físico-Química
Processo de Seleção e Admissão aos Cursos de Mestrado e de Doutorado para o Semestre 2015-2 Edital n 001/PPGQMC/2015 EXAME DE SELEÇÃO PARA O MESTRADO Primeira Etapa: Provas de Química Analítica e de Físico-Química
Eletroquímica. Eletroquímica: Pilhas Galvânicas. Potencial de redução. Força eletromotriz. Equação de Nernst. Electrólise.
 Eletroquímica IX Eletroquímica: Pilhas Galvânicas. Potencial de redução. Força eletromotriz. Equação de Nernst. Electrólise. Eletroquímica A Eletroquímica estuda a relação entre a eletricidade e as reações
Eletroquímica IX Eletroquímica: Pilhas Galvânicas. Potencial de redução. Força eletromotriz. Equação de Nernst. Electrólise. Eletroquímica A Eletroquímica estuda a relação entre a eletricidade e as reações
Prof André Montillo
 Prof André Montillo www.montillo.com.br Reações de Oxido-Redução Definição: São as reações químicas onde ocorre a variação dos números de oxidação (Nox) das substâncias envolvidas. Portanto haverá transferência
Prof André Montillo www.montillo.com.br Reações de Oxido-Redução Definição: São as reações químicas onde ocorre a variação dos números de oxidação (Nox) das substâncias envolvidas. Portanto haverá transferência
Desenvolvimento de um método
 Desenvolvimento de um método -Espectro: registro de um espectro na região de interesse seleção do comprimento de onda -Fixação de comprimento de onda: monitoramento da absorbância no comprimento de onda
Desenvolvimento de um método -Espectro: registro de um espectro na região de interesse seleção do comprimento de onda -Fixação de comprimento de onda: monitoramento da absorbância no comprimento de onda
INTRODUÇÃO À ELETROQUÍMICA
 QFL0230 2014 INTRODUÇÃO À ELETROQUÍMICA REAÇÕES DE OXIDAÇÃOREDUÇÃO (REDOX)! transferência de e de um reagente para o outro Ce 4+ + Fe 2+ D Ce 3+ + Fe 3+ SEMIREAÇÕES: e Ce 4+ + 1 e D Ce 3+, redução agente
QFL0230 2014 INTRODUÇÃO À ELETROQUÍMICA REAÇÕES DE OXIDAÇÃOREDUÇÃO (REDOX)! transferência de e de um reagente para o outro Ce 4+ + Fe 2+ D Ce 3+ + Fe 3+ SEMIREAÇÕES: e Ce 4+ + 1 e D Ce 3+, redução agente
PAGQuímica 2011/1 Exercícios de Eletroquímica
 PAGQuímica 2011/1 Exercícios de Eletroquímica 1. a) Que tipo de transformação faz uma célula galvânica e uma célula eletrolítica? b) Qual o sinal de G de cada uma? c) Qual o sinal de e de cada uma? d)
PAGQuímica 2011/1 Exercícios de Eletroquímica 1. a) Que tipo de transformação faz uma célula galvânica e uma célula eletrolítica? b) Qual o sinal de G de cada uma? c) Qual o sinal de e de cada uma? d)
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL
 RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
RESOLUÇÃO DE EXERCÍCIOS PROPOSTOS AULA 28 TURMA ANUAL 01. Item [C] Análise das alternativas; a) Incorreta. Durante a descarga, o número de oxidação do cobalto passa de +4 para +3. ( + 4)( 4) + + + ( 1)(
1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e determine o número de valência de cada elemento: a) Fe (26):.
 FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
FOLHA DE EXERCÍCIOS CURSO: Otimizado ASS.: Exercícios de Conteúdo DISCIPLINA: Fundamentos de Química e Bioquímica NOME: TURMA: 1SAU 1º Questão: Escreva a distribuição eletrônica dos elementos abaixo e
2005 by Pearson Education. Capítulo 04
 QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
QUÍMICA A Ciência Central 9ª Edição Capítulo 4 Reações em soluções aquosas e estequiometria de soluções David P. White Propriedades gerais das soluções aquosas Propriedades eletrolíticas As soluções aquosas
