MÉTODOS ELETROANALÍTICOS PARTE II
|
|
|
- Cármen Osório Beltrão
- 6 Há anos
- Visualizações:
Transcrição
1 Aula 7 MÉTODOS ELETROANALÍTICOS PARTE II META Apresentar os fundamentos da titulação potenciométrica; apresentar a localização do ponto fi nal da titulação potenciométrica; apresentar os fundamentos da condutimetria; apresentar os fundamentos da voltametria. OBJETIVOS Ao fi nal desta aula, o aluno deverá: defi nir e classifi car as titulações potenciométricas; entender a localização do ponto fi nal na titulação potenciométrica; defi nir os fundamentos da condutimetria; defi nir os fundamentos da voltametria; distinguir os tipos de voltametria. analisar o tratamento de dados em polarografi a e voltametria. PRÉ-REQUISITOS Saber os fundamentos de eletroquímica. Elisangela de Andrade Passos
2 Métodos Instrumentais de Análise INTRODUÇÃO Na aula anterior foram relatados acerca os princípios da química eletroanalítica, definido e classificado as células eletroquímicas. Além disso, foram apresentados os fundamentos da potenciometria e definido e classificado os eletrodos. Nesta aula serão definidas e classificadas as titulações potenciométricas. Ainda será apresentada a localização do ponto final na titulação potenciométrica. Por fim, serão apresentados os fundamentos da condutimetria e voltametria. Ao final desta aula, você deverá saber distinguir os tipos de titulações potenciométricas e entender como encontrar o ponto final destas titulações. Você será capaz de representar entende o principio da condutimetria, por fim, compreender os princípios da voltametria. Além de distinguir os tipos de voltametria e analisar o tratamento de dados desta técnica eletroanalítica TITULAÇÃO POTENCIOMÉTRICA Na titulação potenciométrica a força eletromotriz da célula é medida no curso da titulação. Estas são acompanhadas de variações bruscas de concentração nas imediações do ponto de equivalência, o que provoca uma variação brusca no potencial do eletrodo indicador e, portanto, também na força eletromotriz da célula. A solução titulante é adicionada e em seguida o potencial é medido. Esses potenciais são relacionados com o volume de solução titulante consumida. A variação do potencial estabelece com precisão o ponto de equivalência que determinará a concentração da espécie de interesse. A titulação potenciométrica requer equipamento especial e é mais trabalhosa do que a técnica volumétrica com indicadores visuais. Apesar disso, apresenta uma série de vantagens sobre a técnica convencional: maior sensibilidade; como se quer a variação de potencial, e não sua medida absoluta, o potencial de junção e o coeficiente de atividade não causam problema nesse tipo de análise; pode ser empregada para soluções coloridas ou turvas; pode ser aplicada para certas reações que não disponham de indicadores visuais adequados; podem-se determinar sucessivamente vários componentes; pode ser aplicada em meio não aquoso, e, pode ser adaptada a instrumentos automáticos. Atualmente, as titulações potenciométricas podem ser executadas manual ou automaticamente, com ou sem registro da curva. Na titulação manual, utiliza-se um phmetro e um conjunto de titulação, que compreende uma bureta de pistão, montada junto com um agitador sobre uma base compacta. Esse tipo de titulação potenciométrica requer o controle constante das diversas etapas, anotando o volume de reagente dosado e o respectivo 98
3 Métodos Eletroanalíticos Parte II Aula 7 potencial, dados que posteriormente são utilizados para construir a curva de titulação, de onde é calculado o volume de reagente gasto até o ponto de equivalência e a concentração da espécie analisada. Titulações automáticas dispensam todas as operações manuais e representam um grande avanço sobre as automatizadas, que dependem de operações manuais e são comumente encontradas nos laboratórios de controle de qualidade de matériasprimas ou de produtos finais, enquanto que as titulações automáticas são empregadas na área industrial. As titulações potenciométricas são aplicáveis em vários tipos de reações, estas devem ser estequiométricas, rápidas e completas no ponto de equivalência. TIPOS DE TITULAÇÃO POTENCIOMÉTRICA As técnicas de titulação potenciométrica são largamente aplicadas e podem se basear em vários tipos de reação: neutralização ácido-base, precipitação, oxidação-redução e complexação. Como nos métodos clássicos, essas reações têm que ser relativamente rápidas e completas. Do mesmo modo, as soluções em análise têm que ter concentrações relativamente altas, embora o método potenciométrico possa dosar teores um pouco menores do que o método clássico. Titulações de neutralização. Podem ser empregados eletrodos indicador de ph e o eletrodo de calomelano é em geral, o eletrodo de referência tanto para titulações de ácidos como base com a vantagem frente as clássicas de aplicação em amostras coloridas e turvas. A exatidão com que o ponto final pode ser localizado potenciometricamente depende da grandeza da variação da força eletrotriz nas vizinhanças do ponto de equivalência, e esta variação dependem da concentração e da força do analito (ácido ou base). Em todos os casos os resultados são satisfatórios exceto: os que se obtêm com um ácido, ou com uma base muito fracos (K<10-8 ) e com soluções muito diluídas e os que se obtém com o ácido e a base, ambos fracos. Neste último caso, pode-se conseguir uma exatidão da ordem 1 % com soluções 0,1 mol L -1. Ainda podem ser empregados para determinação da constante de dissociação de ácidos. Gráfico obtido: ph x V titulante. Titulações de Formação de complexos. São exemplos deste tipo de titulação as titulações de cátions que formam complexos com EDTA usando eletrodos de mercúrio de gota pendente e de filme de Hg. Deve se ter cuidados com o armazenamanto e o manuseio do Hg pois seus vapores são tóxicos. A concentração do íon no ponto de equivalência é determinada pelo constante de formação do complexo formado durante a titulação. Titulações de precipitação. São empregados entre outras nas titulações de medidas de cloretos, sulfetos, fluoretos etc. usando AgNO 3 como titulante e eletrodos indicadores de Cl -, S 2- e F -, respectivamente. A concentração do íon no ponto de equivalência é determinada pelo produto de solubilidade 99
4 Métodos Instrumentais de Análise do material pouco solúvel formado durante a titulação. Na precipitação do íon na solução, pela adição de um reagente apropriado, a concentração deste na solução sofrerá modificação mais rápida na região do ponto final. O Gráfico obtido é E x V titulante. Titulações redox. É exemplo deste tipo de titulação a determinação de Ferro (II) com Cério (IV). O eletrodo indicador, em geral, é um fio, ou uma lâmina, de platina polida, e o agente oxidante fica na bureta. O fator determinante é a razão entre as concentrações das formas oxidadas e reduzidas de certa espécie iônica. O potencial do eletrodo indicador na solução é, então, controlado pela razão entre as concentrações. Durante a oxidação de um agente redutor, ou durante a redução de uma agente oxidante, a razão se altera com maior rapidez nas vizinhanças do ponto final da reação e assim o potencial também se altera rapidamente. Por isso as titulações que envolvem estas reações podem ser acompanhadas potenciometricamente e proporcionam curvas de titulações caracterizadas por uma brusca modificação do potencial no ponto de equivalência. Gráfico obtido: E x V titulante. LOCALIZAÇÃO DO PONTO FINAL NA TITULAÇÃO POTENCIOMÉTRICA As curvas das titulações potenciométricas, isto é, o gráfico das leituras da força eletromotriz, contra o volume adicionado de titulante, pode ser levantado ou pela plotagem manual dos dados experimentais, ou pela plotagem automática, mediante instrumentação apropriada, durante o decorrer de qualquer titulação. A curva, em geral, tem a mesma forma que a curva de neutralização de um ácido, ou seja, é uma curva sigmóide. O ponto final está localizado na meia altura do salto sobre a curva de titulação. Esta se caracteriza por uma variação grande de potencial (ou de ph) nas proximidades do ponto final, sendo que a variação depende, entre outros fatores, das concentrações do titulante e do titulado. A precisão e a exatidão de uma titulação potenciométrica dependem, muitas vezes, da escolha apropriada do método de análise da curva potenciométrica para encontrar o ponto final da titulação. Existem diferentes formas de se fazer isto, sendo que as mais empregadas são os métodos geométricos (o método das bissetrizes, das tangentes paralelas e o método dos círculos tangentes), o método da primeira e da segunda derivada e o método de Gran. Métodos geométricos. A exatidão dos resultados na determinação do ponto final empregando os métodos geométricos depende da habilidade com que a curva de titulação foi desenhada. Estes métodos podem ser aplicados às curvas potenciométricas simétricas. O ponto final deve coincidir com o ponto de inflexão da sigmóide que se origina de E (mv) V (ml), onde E (mv) é o potencial lido e V (ml) é o volume de titulante adicionado. 100
5 Métodos Eletroanalíticos Parte II Aula 7 Na Figura 1 estão esquematizados o método das tangentes paralelas e o método dos círculos tangentes Esquema do método das tangentes paralelas (a) e o método dos círculos tangentes (b). Métodos analíticos. Os métodos analíticos são de três tipos: primeira derivada, segunda derivada e método de Gran. O método da primeira derivada consiste na plotagem de ^E/^V contra V. O ponto de equivalência está localizado pelo máximo, que corresponde à inflexão da curva de titulação. O método da segunda derivada consiste na plotagem de ^2E/^V 2 contra V. A segunda derivada é nula no ponto de inflexão e proporciona uma localização mais exata do ponto de equivalência. Na Figura 2 está apresentada a determinação gráfica do ponto de equivalência pelo método analítico da primeira e segunda derivada. 101
6 Métodos Instrumentais de Análise Determinação gráfica do ponto de equivalência pelos métodos analíticos (a) da curva, (b) primeira derivada e (c) segunda derivada. (Fonte: SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos de Química Analítica. Tradução da 8ª edição Americana. Ed. Thomson; São Paulo, Página 588.) O método de Gran, ou o método de inclinação, utiliza o anti-logarítmo do potencial ou do ph em função do volume de titulante para a construção da curva de titulação. Desta maneira, a curva de titulação potenciométrica, que inicialmente possui um formato semelhante a um S, é convertida em duas retas com inclinações diferentes. No ponto final, os dois ramos da curva cortam-se no ponto correspondente ao ponto de equivalência. Na Figura 3 está apresentada a determinação gráfica do ponto de equivalência pelo método de Gran. Determinação gráfica do ponto de equivalência pelo método analítico de Gran. Fonte: acessado em 12/02/
7 Métodos Eletroanalíticos Parte II Aula 7 CONDUTIMETRIA A condutometria mede a condutância elétrica de soluções iônicas. A condução da eletricidade através das soluções iônicas se dá à custa da migração de íons positivos e negativos, com a aplicação de um campo eletrostático. A condutância de uma solução iônica depende do número de íons presentes, da carga e da mobilidade dos íons. A condutância elétrica de uma solução é a soma das condutâncias individuais da totalidade das espécies iônicas presentes, portanto, a condutância não é específica. A condutância de uma solução iônica é dada pela equação 01: L = k A / l (01) onde: k = condutância específica 1/ cm = Scm -1. A = área da seção transversal l = comprimento A condutância específica das soluções eletrolíticas é função da concentração. Para eletrólitos fortes, a condutância específica aumenta marcadamente com a concentração. Para eletrólitos fracos a condutância específica aumenta gradualmente com a concentração. A resistência e a condutância variam com a temperatura. Na condução eletrônica (metálica) a resistência cresce com o aumento da temperatura. Na condução iônica a resistência decresce com o aumento da temperatura. Em geral as resistências específicas dos eletrólitos são muito maiores do que as dos metais. A resistência de uma solução iônica é dada pela seguinte equação: R = ρ l / A (ohms) (02) onde: A = área da seção transversal l = comprimento ρ = resistência específica do material (Ω. cm). VOLTAMETRIA A voltametria é uma técnica eletroanalítica qualitativa e quantitativa obtida a partir do registro de curvas corrente-potencial. Esta ocorre durante a eletrólise da espécie de interesse em uma cela eletroquímica constituída de pelo menos dois eletrodos. O primeiro é um microeletrodo (o eletrodo de trabalho) e o segundo é um eletrodo de superfície relativamente grande (o eletrodo de referência). Quando o microeletrodo é constituído de um eletrodo gotejante de mercúrio, a técnica é chamada de polarografia. O potencial é aplicado entre os dois eletrodos em forma de varredura, isto é, 103
8 Métodos Instrumentais de Análise variando-o a uma velocidade constante em função do tempo. O potencial e a corrente resultante são registrados simultaneamente. A curva corrente verso potencial obtida é chamada de voltamograma. Em 1922, foram feitos por Heyrovsky e Kuceras os primeiros estudos voltamétricos usando um eletrodo gotejante de mercúrio como eletrodo de trabalho e como eletrodo de referência um eletrodo de calomelano saturado. Assim, a primeira técnica voltamétrica desenvolvida foi a polarografia. A curva corrente versos voltagem obtida nesse caso é chamada de polarograma. AS CÉLULAS VOLTAMÉTRICAS As células eletroquímicas utilizadas em voltametria/polarografia são, evidentemente, do tipo eletrolítico e podem ter dois ou três eletrodos. Na célula de dois eletrodos tem-se um eletrodo de trabalho, de superfície pequena, ou seja, um microeletrodo. No caso da polarografia o eletrodo de trabalho é um microeletrodo gotejante de mercúrio. As células de dois eletrodos tem algumas limitações e por isso foi desenvolvida a célula de três eletrodos. O terceiro eletrodo é chamado de eletrodo auxiliar, podendo ser de platina, ouro, carbono vítreo, etc. Ele foi introduzido na célula voltamétrica para assegurar o sistema potenciostático. De um modo geral, a célula de três eletrodos apresenta as vantagens: é mais adequada para soluções diluídas, pode ser usada para soluções de alta resistência (solventes orgânicos, mistura água mais solvente orgânico) e pode ser usada com eletrólitos de suporte mais diluídos. ELETRODO GOTEJANTE DE MERCÚRIO O eletrodo gotejante de mercúrio é constituído por um reservatório de mercúrio conectado a um tubo capilar de vidro com comprimento variando entre 5 cm e 20 cm. O mercúrio, forçado pela gravidade, passa através desse tubo, formando um fluxo constante de gotas idênticas, que se formam entre 1 e 5 segundos, devido à pressão constante exercida pelo mercúrio. Este tipo de meia-célula de mercúrio nasceu com a polarografia e é principalmente utilizado nos instrumentos de células com dois eletrodos. Nos polarógrafos modernos não se usa a gravidade para controlar o gotejamento do mercúrio. O capilar é quase que conectado diretamente ao reservatório de mercúrio. Todo o conjunto de operações, envolvendo formação da gota, tempo de duração da gota, varredura de potencial, medida da corrente e registro do polarograma/voltamograma é feito de maneira sincronizada e automática, em razão dos recursos eletrônicos presentes nos polarógrafos. Este tipo de meia-célula de mercúrio praticamente é o preferido para ser usado em sistemas de células de três eletrodos. 104
9 Métodos Eletroanalíticos Parte II Aula 7 O MÁXIMO POLAROGRÁFICO E REMOÇÃO DO OXIGÊNIO DISSOLVIDO O máximo polarográfico é um fenômeno que ocorre durante o registro do polarograma devido a turbulências envolvendo a gota de mercúrio e a camada de difusão adjacente a ela. Na maior parte das vezes ele tem uma forma aguda. A maneira de evitar a formação de máximos na prática é utilizar os chamados supressores de máximo, que são substâncias tensoativas. As moléculas dessas substâncias são adsorvidas junto à superfície da gota de mercúrio formando um filme protetor. O supressor mais comum é a gelatina, o vermelho de metila e o triton X-100. Quando se trabalha na região catódica, como é o caso da polarografia, há a necessidade da remoção do oxigênio atmosférico dissolvido nas soluções. Isto porque o O 2 é eletroativo e produz duas ondas polarográficas nessa região. Por isso é necessário remover o O 2 dissolvido na solução antes das medidas serem feitas. Isto é feito desaerando-se a solução pela passagem de um gás inerte isento de O 2. O gás é borbulhado na solução durante alguns minutos, remove o O 2, e fica dissolvido em seu lugar. É eletroquimicamente inerte e não produzirá nenhuma corrente polarográfica ou voltamétrica. Os gases mais usados para esse fim são: N 2, Ar, Ne e He. O Nitrogênio é o mais usado principalmente por ser mais barato. TIPOS DE VOLTAMETRIA Voltametria (Polarografia) Clássica. Na voltametria Clássica, o potencial aplicado ao eletrodo de trabalho varia linearmente com o tempo, esta técnica possibilita a aplicação de velocidades de varredura relativamente altas (até 1000 mv s-1), no entanto não é uma técnica muito sensível. A corrente é lida de forma direta, em função do potencial aplicado, desta forma a corrente total lida possui contribuições tanto da corrente faradaica quanto da corrente capacitiva (ruído). A corrente de fundo faradaica pode ser reduzida ou mesmo eliminada usando-se reagentes mais puros e removendo-se o oxigênio pela passagem de um gás inerte. Voltametria (Polarografia) de Pulso Diferencial. Na voltametria de pulso diferencial, pulsos de amplitude fixos sobrepostos a uma rampa de potencial crescente são aplicados ao eletrodo de trabalho. No primeiro tipo, ocorre a sobreposição de pulsos periódicos sobre uma rampa linear, esta forma de excitação é utilizado em equipamentos analógicos. O segundo tipo é usado em equipamentos digitais, nestes equipamentos combina-se um pulso de saída com um sinal em degrau. A corrente é medida duas vezes, uma antes da aplicação do pulso (S1) e outra ao final do pulso (S2). A primeira corrente é instrumentalmente subtraída da segunda, e a diferença das correntes é plotada versus o potencial aplicado, o voltamograma resultante consiste 105
10 Métodos Instrumentais de Análise de picos de corrente de forma gaussiana, cuja área deste pico é diretamente proporcional à concentração do analito. Voltametria de Onda Quadrada. Esta técnica pode ser usada para realizar experimentos de um modo bem mais rápido do que a técnica de pulso diferencial, com sensibilidade semelhante ou um pouco melhor, pois aqui também ocorrem compensações da corrente capacitiva. Um experimento típico que requer cerca de três minutos para ser feito pela polarografia de pulso diferencial pode ser feito em segundos pela voltametria de onda quadrada. A medida de corrente na voltametria de onda quadrada é feita amostrando-se a mesma duas vezes durante cada ciclo da onda quadrada, uma vez no final do pulso direto e a outra no final do pulso reverso. Na voltametria de onda quadrada moderna usa-se o eletrodo de mercúrio no modo estático. Neste eletrodo a gota é formada rapidamente de tal modo que ela permanece de tamanho constante durante todo o tempo despendido para a medida experimental, não apresentando os problemas de área superficial que ocorrem com o eletrodo gotejante de mercúrio. Voltametria cíclica. A voltametria cíclica é a técnica mais comumente usada para adquirir informações qualitativas sobre os processos eletroquímicos. Nesta técnica, o potencial é varrido linearmente com o tempo no eletrodo de trabalho estacionário, em uma solução sem agitação, usando um potencial em forma de triângulo. A onda triangular produz a varredura no sentido direto e depois no sentido inverso. Os potenciais em que a reversão ocorre são chamados de potenciais de inversões. A direção da varredura inicial pode tanto ser negativa (varredura direta) quanto positiva (varredura inversa). Dependendo da informação desejada, simples ou múltiplos ciclos podem ser utilizados. Durante a varredura do potencial, o potenciostato mede a corrente resultante desta corrente versus o potencial aplicado. Vários eletrodos de trabalhos podem ser empregados nesta técnica são eles: eletrodo de platina, filme de mercúrio, carbono vítreo, ouro, grafite e pasta de carbono. Na Figura 4 estão representados os tipos de voltametria mencionados acima. Representação da voltametria clássica (a), voltametria de pulso diferencial (b), voltametria de onde quadrada (c) e voltametria cíclica (d). Fonte: SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos de Química Analítica. Tradução da 8ª edição Americana. Ed. Thomson; São Paulo, Página
11 Métodos Eletroanalíticos Parte II Aula 7 Voltametria de Redissolução Anódica. Uma das técnicas que se utiliza de processos de pré-concentração é a voltametria de redissolução anódica, muito utilizada na determinação de metais pesados, uma vez que vários deles podem ser depositados no eletrodo de mercúrio através de eletrólise de soluções de seus íons. Nesta técnica a etapa de pré-concentração consiste de uma eletrodeposição o potencial constante e controlado da espécie eletroativa sobre um eletrodo estacionário. Esta etapa é seguida por uma etapa de repouso e uma de determinação, sendo que esta última consiste na redissolução de volta à solução da espécie anteriormente eletrodepositada. A pré-concentração faz com que a concentração, na gota de mercúrio, devido ao seu volume minúsculo, seja muito maior que na solução, obtendo-se assim um sinal analítico bem maior relativamente à concentração presente na solução, explicando-se o aumento da sensibilidade da técnica. Voltametria Adsortiva por Redissolução. A voltametria adsortiva por redissolução foi desenvolvida mais recentemente. Esta técnica a pré-concentração é feita pela adsorção da espécie eletroativa na superfície do eletrodo. No caso de metais isto é feito através de seus íons complexos. Adiciona-se então à solução contendo o íon metálico um complexante adequado e o complexo formado (metal-ligante) é que será acumulado junto à superfície do eletrodo. Dessa maneira a pré-concentração não depende da solubilidade do metal no mercúrio, como no caso da voltametria de redissolução convencional, e metais pouco solúveis (no mercúrio) poderão ser determinados. Devido a essas características, a técnica também é aplicável a um número ilimitado de substâncias orgânicas, bastando que elas apenas tenham propriedades superfície-ativa, para poderem ser adsorvidas na superfície do eletrodo de trabalho, e que sejam, evidentemente, eletroativas. Quanto à detectabilidade, o limite de detecção pode chegar a valores ao redor de 100 vezes menor dos que os observados na voltametria de redissolução anódica. Para entender as informações acima citadas leiam os artigos intitulados Voltametria de onda quadrada. Primeira parte: aspectos teóricos e Voltametria de onda quadrada. Segunda parte: aplicações que estão disponíveis na plataforma. Em seguida, faça um resumo sucinto das principais idéias de cada texto. TRATAMENTO DE DADOS EM POLAROGRAFIA E VOLTAMETRIA O tratamento de dados em polarografia e voltametria para fins de análise quantitativa consistem em medir-se a corrente de difusão ou as correntes de pico no caso de outras técnicas polarográficas/voltamétricas como pulso diferencial e onda quadrada. As correntes obtidas são então relacionadas às concentrações de soluções padrões da espécie eletroativa e à concentração dessa espécie na amostra de interesse. Os três tipos de tratamento são método da curva padrão, adição padrão e padrão interno ou íon piloto. 107
12 Métodos Instrumentais de Análise Método da curva padrão. Nesse método, também chamado de curva de calibração ou ainda curva analítica, mede-se a corrente polarográfica/ voltamétrica de soluções padrão de várias concentrações da substância em estudo (analito), colocando-se os valores de corrente versus os valores de concentração em um gráfico de coordenadas cartesianas. A curva obtida apresenta um comportamento linear na região de concentração de interesse, passando pela origem no caso das técnicas clássicas. No caso de técnicas mais sensíveis, devido às correntes de fundo, ela pode não passar pela origem, o que não afeta o uso do método. A concentração é calculada pela interpolação da corrente medida da amostra na curva padrão. Método da adição de padrão. O método da adição de padrão é usado com o objetivo de minimizar-se o problema de efeito de matriz. Nesse procedimento, a amostra é adicionada à célula polarográfica/voltamétrica juntamente com o eletrólito de suporte e a corrente referente à espécie de interesse (analito) é registrada. A seguir, adiciona-se sobre a solução da amostra uma alíquota de alguns microlitros da solução padrão do analito, de tal modo que a variação do volume total seja desprezível. Após a adição do padrão, lê-se a corrente referente à soma da concentração do analito mais a concentração adicional da solução padrão do analito adicionada. Método do padrão interno ou íon piloto. Em voltametria/polarografia pode-se também usar o método do padrão interno para minimizar o efeito de matriz. Nesse método usa-se uma substância padrão diferente da substância a ser determinada (analito) que é adicionada à amostra. Essa substância (piloto) deve ter um potencial de meia onda ou de pico diferente do analito, mas não muito distante, para que não se use uma varredura de potencial muito longa. A corrente devido à onda ou ao pico polarográfico é registrada para ambos em um mesmo voltamograma. Assim, assume-se que tudo o que afetar o pico (ou onda) do analito afetará também do mesmo modo o pico (ou onda) do piloto. É claro que o método pode ser aplicado tanto para espécies iônicas quanto moleculares. A concentração do analito é determinada pela razão entre a corrente de pico do analito e do íon piloto. PARA SABER MAIS Se você se interessou pelo tema e deseja saber mais, consulte os capítulos 21 e 23 do livro Fundamentos de Química Analítica, 8a Edição, Editora Thomson, escrito pelos autores Skoog, West, Holler e Crouch. 108
13 Métodos Eletroanalíticos Parte II Aula 7 CONCLUSÃO Nessa sessão foi apresentada a definição e classificação das titulações potenciométricas. Foram também apresentadas maneiras de encontrar o ponto final destas titulações através dos métodos geométricos e analíticos. Os métodos eletroanalícos condutimetria e voltametria foram fundamentados. Foram apresentados os tipos de voltametria e o tratamento de dados que podem ser empregados nesta técnica eletroanalítica. RESUMO A titulação potenciométrica consite no acompanhamento da variação do potencial de uma cela eletroquímica com a adição de um titulante. A curva de titulação se caracteriza por uma variação grande de potencial (ou de ph) nas proximidades do ponto final, sendo que esta variação depende, entre outros fatores, das concentrações do titulante e do titulado. As titulações potenciométricas são aplicáveis em vários tipos de reações, estas devem ser estequiométricas, rápidas e completas no ponto de equivalência. O ponto final da titulação pode ser encontrado por diferentes formas, sendo que as mais empregadas são o método da bissetriz, o método da primeira e da segunda derivada e o método de Gran. As técnicas de titulação potenciométrica são largamente aplicadas e podem se basear em vários tipos de reação: neutralização ácido-base, precipitação, oxidação-redução e complexação. A condutometria mede a condutância elétrica de soluções iônicas. A condução da eletricidade através das soluções iônicas se dá à custa da migração de íons positivos e negativos, com a aplicação de um campo eletrostático. A voltametria é uma técnica eletroanalítica qualitativa e quantitativa que ocorre durante a eletrólise da espécie de interesse em uma cela eletroquímica constituída de pelo menos dois eletrodos. O eletrodo de trabalho e o eletrodo de referência. Quando o eletrodo indicador é constituído de um eletrodo gotejante de mercúrio, a técnica é chamada de polarografia.. A curva gerada pela corrente aplicada entre os dois eletrodos em forma de varredura é chamada de voltamograma. A voltametria pode ser classificada em voltametria clássica, voltametria de pulso diferencial, voltametria de onde quadrada, voltametria cíclica, voltametria de redissolução e voltametria adsortiva de redissolução. O tratamento de dados em voltametria é, em geral, de três tipos: a curva padrão, a adição padrão e o uso padrão interno. 109
14 Métodos Instrumentais de Análise ATIVIDADES A polarografia consiste no emprego do eletrodo gotejante de mercúrio como eletrodo de referência. Por que essa técnica pode ser considerada de risco eminente ao analista? COMENTARIO SOBRE AS ATIVIDADES O eletrodo gotejante de mercúrio é constituído por um reservatório de mercúrio conectado a um tubo capilar de vidro com comprimento de até 20 cm. O mercúrio, forçado pela gravidade, passa através desse tubo, e é gotejada na solução problema. O risco associado a esta técnica é devido ao emprego do mercúrio. O mercúrio é um metal pesado tóxico, principalmente na forma gasosa. Deve ser manuseado com muito cuidado e seu descarte deve ser controlado. AUTO-AVALIAÇÃO - Sou capaz de definir e classificar as titulações potenciométricas? - Consigo entender a localização do ponto final na titulação potenciométrica? - Entendo os princípios da condutimetria? - Sinto-me capaz de definir os fundamentos da voltametria? - Distingo os tipos de voltametria? - Consigo analisar o tratamento de dados em polarografia e voltametria? PRÓXIMA AULA Na próxima aula iremos abordar os aspectos gerais da cromatografia e seus princípios. 110
15 Métodos Eletroanalíticos Parte II Aula 7 REFERÊNCIAS COMPLETAS: HARRIS, D. Analise Química Quantitativa. Ed. LTC, 5 ed.; Rio de Janeiro, SKOOG, D. A.; WEST, D. M.; HOLLER, F. J.; CROUCH, S. R. Fundamentos de Química Analítica. Tradução da 8 ed. Americana. Ed. Thomson; São Paulo, SOUZA, D.; MACHADO S.A.S.; AVACA, L.A. Voltametria de onda quadrada. Primeira parte: aspectos teórico. Química Nova, v.26, n. 1, 81-89, SOUZA, D.; CODOGNOTO, L.; MALAGUTTI, A.R. TOLEDO, R.A. PEDROSA, V.A. OLIVEIRA, R.T.S.; MAZO, L.H.; AVACA, L.A.; Voltametria de onda quadrada. Segunda parte: aplicações. Química Nova, v.27, n.5, ,
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Métodos Eletroanalíticos. Condutometria
 Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
TIPOS DE MÉTODOS ELETROANALÍTICOS
 CONDUTOMETRIA TIPOS DE MÉTODOS ELETROANALÍTICOS CONDUTOMETRIA Baseia-se em medições de condutância das soluções iônicas(seio da solução). A condução de eletricidade através das soluções iônicas é devida
CONDUTOMETRIA TIPOS DE MÉTODOS ELETROANALÍTICOS CONDUTOMETRIA Baseia-se em medições de condutância das soluções iônicas(seio da solução). A condução de eletricidade através das soluções iônicas é devida
5.1. Estudos preliminares e otimização.
 106 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
106 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
Eletroanalítica: Condutometria (ou Condutimetria)
 Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
5.1. Estudos preliminares e otimização.
 105 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
105 5 Resultados: Determinação de azoxistrobina e dimoxistrobina por voltametria adsortiva de redissolução catódica em eletrodo de gota pendente de mercúrio e varredura no modo de onda quadrada. 5.1. Estudos
MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações
 MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações sobre a composição de uma amostra. Método: é a aplicação
MÉTODOS CLÁSSICOS DE ANÁLISE QUÍMICA QUANTITATIVA A análise química pode ser definida como o uso de um ou mais processos que fornecem informações sobre a composição de uma amostra. Método: é a aplicação
Introdução aos métodos titulométricos volumétricos. Prof a Alessandra Smaniotto QMC Química Analítica - Farmácia Turmas 02102A e 02102B
 Introdução aos métodos titulométricos volumétricos Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Definições ² Métodos titulométricos: procedimentos quantitativos
Introdução aos métodos titulométricos volumétricos Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Definições ² Métodos titulométricos: procedimentos quantitativos
Eletroquímica. Condutometria
 Eletroquímica Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutometria Titulações Condutométricas Potenciometria
Eletroquímica Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutometria Titulações Condutométricas Potenciometria
Coulometria 03/10/2011. Eletroquímica. Tipos de métodos eletroanalíticos
 Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Eletroquímica Coulometria Estáticos Potenciometria Métodos Interfaciais Titulações Potenciométricas Dinâmicos Potencial Controlado Corrente Constante
Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Eletroquímica Coulometria Estáticos Potenciometria Métodos Interfaciais Titulações Potenciométricas Dinâmicos Potencial Controlado Corrente Constante
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Aula 13 PRÁTICA 03 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: LEI DE BEER. Elisangela de Andrade Passos
 Aula 13 PRÁTICA 03 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: LEI DE BEER META Habilitar o aluno na utilização da espectrofotômetria em determinações quantitativas; redigir o relatório prático.
Aula 13 PRÁTICA 03 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: LEI DE BEER META Habilitar o aluno na utilização da espectrofotômetria em determinações quantitativas; redigir o relatório prático.
Aula 13: Prof. Rafael Sousa
 Analítica V: Aula 13: 20-08-13 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan 1 A TÉCNICA DE POTENCIOMETRIA Baseada na medida
Analítica V: Aula 13: 20-08-13 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan 1 A TÉCNICA DE POTENCIOMETRIA Baseada na medida
Eletroquímica. Coulometria
 Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Eletroquímica Coulometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas Potenciometria
Métodos voltamétricos
 VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
VOLTAMETRIA Métodos voltamétricos Dentre o grupo de técnicas que se baseiam na aplicação de um programa de potencial aplicado aos eletrodos e a corrente faradaica que resulta neste processo, destacam-se:
APOSTILA QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes
 1 APOSTILA 1-2009 QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes I. Polarografia Objetivos: Obter e interpretar as curvas corrente versus
1 APOSTILA 1-2009 QFL3601 Eletroquímica e Métodos Eletroanalíticos Docentes Responsáveis: Roberto Manuel Torresi e Lúcio Angnes I. Polarografia Objetivos: Obter e interpretar as curvas corrente versus
Condutividade Elétrica
 FQE1 Exp. 1 Condutividade Elétrica 1. Introdução A condução elétrica é um fenômeno de transporte em que a carga elétrica (elétrons ou íons) se move através do sistema. A condutividade elétrica, também
FQE1 Exp. 1 Condutividade Elétrica 1. Introdução A condução elétrica é um fenômeno de transporte em que a carga elétrica (elétrons ou íons) se move através do sistema. A condutividade elétrica, também
Desenvolvimento de um método
 Desenvolvimento de um método -Espectro: registro de um espectro na região de interesse seleção do comprimento de onda -Fixação de comprimento de onda: monitoramento da absorbância no comprimento de onda
Desenvolvimento de um método -Espectro: registro de um espectro na região de interesse seleção do comprimento de onda -Fixação de comprimento de onda: monitoramento da absorbância no comprimento de onda
Métodos Eletroanalíticos. Voltametria
 Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Voltametria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Introdução à Volumetria. Profa. Lilian Lúcia Rocha e Silva
 Introdução à Volumetria Profa. Lilian Lúcia Rocha e Silva INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução que contém um soluto
Introdução à Volumetria Profa. Lilian Lúcia Rocha e Silva INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução que contém um soluto
Calcule o ph de uma solução de HCl 1x10-7 mol L-1
 Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
Calcule o ph de uma solução de HCl 1x10-7 mol L-1 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste
MÉTODOS DE DOSEAMENTO
 MÉTODOS DE DOSEAMENTO 1) Métodos clássicos de doseamento Os ensaios de potência ou doseamento são aqueles que visam quantificar o teor de substância ativa em medicamentos; A crescente demanda por matérias-primas
MÉTODOS DE DOSEAMENTO 1) Métodos clássicos de doseamento Os ensaios de potência ou doseamento são aqueles que visam quantificar o teor de substância ativa em medicamentos; A crescente demanda por matérias-primas
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
Processo de Seleção e Admissão aos Cursos de Mestrado e de Doutorado para o Semestre Edital n 001/PPGQMC/2015
 Processo de Seleção e Admissão aos Cursos de Mestrado e de Doutorado para o Semestre 2015-2 Edital n 001/PPGQMC/2015 EXAME DE SELEÇÃO PARA O MESTRADO Primeira Etapa: Provas de Química Analítica e de Físico-Química
Processo de Seleção e Admissão aos Cursos de Mestrado e de Doutorado para o Semestre 2015-2 Edital n 001/PPGQMC/2015 EXAME DE SELEÇÃO PARA O MESTRADO Primeira Etapa: Provas de Química Analítica e de Físico-Química
INTRODUÇÃO A TITULAÇÃO
 Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
5 Determinação da primaquina em ECV.
 5 Determinação da primaquina em ECV. 5.1 Estudos preliminares Tentou-se inicialmente realizar a determinação direta da primaquina no EGPM. Apesar de já existirem vários trabalhos publicados na literatura
5 Determinação da primaquina em ECV. 5.1 Estudos preliminares Tentou-se inicialmente realizar a determinação direta da primaquina no EGPM. Apesar de já existirem vários trabalhos publicados na literatura
QUI 070 Química Analítica V Análise Instrumental. Aula 8 Potenciometria
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 8 Potenciometria Julio C. J. Silva Juiz de Fora, 2014 Potenciometria
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 8 Potenciometria Julio C. J. Silva Juiz de Fora, 2014 Potenciometria
FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV/ UNESP
 1 FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV/ UNESP Curso: Engenharia Agronômica Disciplina: Química Analítica Turma: TP3 Docente Responsável: Prof a. Dr a. Luciana Maria Saran Roteiro 6: Análise
1 FACULDADE DE CIÊNCIAS AGRÁRIAS E VETERINÁRIAS FCAV/ UNESP Curso: Engenharia Agronômica Disciplina: Química Analítica Turma: TP3 Docente Responsável: Prof a. Dr a. Luciana Maria Saran Roteiro 6: Análise
Eletrodo redox. Eletrodos construídos com metais inertes: platina, ouro, paládio. do sistema de óxido-redução presente na solução.
 Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim
 QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÃO TAMPÃO Tampão Ácido Qual o ph de uma solução de ácido fórmico 1,00.10-1 mol.l -1 e formiato de sódio 1,00 mol.l
QUI219 QUÍMICA ANALÍTICA (Farmácia) Prof. Mauricio X. Coutrim (mcoutrim@iceb.ufop.br) SOLUÇÃO TAMPÃO Tampão Ácido Qual o ph de uma solução de ácido fórmico 1,00.10-1 mol.l -1 e formiato de sódio 1,00 mol.l
MÉTODOS COULOMÉTRICOS
 MÉTODOS COULOMÉTRICOS São realizados por meio da medida de quantidade de carga elétrica requerida para converter uma amostra de um analito quantitativamente a um diferente estado de oxidação. A coulometria
MÉTODOS COULOMÉTRICOS São realizados por meio da medida de quantidade de carga elétrica requerida para converter uma amostra de um analito quantitativamente a um diferente estado de oxidação. A coulometria
TÍTULO: ANÁLISE TITRIMÉTRICA (Volumétrica)
 Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin TÉCNICAS DE DEGRAU E VARREDURA DE POTENCIAL Degrau e Impulso Degrau: alteração instantânea no potencial ou na corrente de um sistema eletroquímico A análise da
Sendo O a forma oxidada do analito e R a forma reduzida.
 2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
2 Voltametria Os métodos eletroanalíticos fazem uso das propriedades elétricas mensuráveis (corrente, potencial e carga) de um analito quando este é submetido a uma diferença de potencial entre eletrodos
Aula 12 PRÁTICA 02 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: OPERAÇÃO E RESPOSTA DO ESPECTROFOTÔMETRO. Elisangela de Andrade Passos
 Aula 12 PRÁTICA 02 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: OPERAÇÃO E RESPOSTA DO ESPECTROFOTÔMETRO META Proporcionar o contato do aluno com a instrumentação analítica empregada em análises
Aula 12 PRÁTICA 02 ESPECTROFOTOMETRIA DE ABSORÇÃO MOLECULAR NO UV VIS: OPERAÇÃO E RESPOSTA DO ESPECTROFOTÔMETRO META Proporcionar o contato do aluno com a instrumentação analítica empregada em análises
QUI 070 Química Analítica IV Análise Quantitativa. Volumetria de Precipitação
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica IV Análise Quantitativa Volumetria de Precipitação Lilian Silva Juiz de Fora, 2011 VOLUMETRIA
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica IV Análise Quantitativa Volumetria de Precipitação Lilian Silva Juiz de Fora, 2011 VOLUMETRIA
INTRODUÇÃO A TITULAÇÃO
 Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Introdução a Analise Química I sem/2018 Profa Ma Auxiliadora - 1 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Disciplina QUIO94 - Introdução à Análise Química
Volumetria. Procedimentos gerais
 Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
Volumetria Procedimentos gerais Métodos volumétricos de análise Consistem na medida do volume de uma solução de concentração conhecida (titulante), necessário para reagir completamente com o a espécie
TITULAÇÕES POTENCIOMÉTRICAS DE CÁTIONS METÁLICOS EM MEIO NÃO AQUOSO. Palavras chave: Potenciometria, interação soluto-solvente, eletrodo de vidro.
 TITULAÇÕES POTENCIOMÉTRICAS DE CÁTIONS METÁLICOS EM MEIO NÃO AQUOSO Anderson Martin dos Santos 1 ; Edemar Benedetti Filho 2 1 Estudante do Curso de Química Industrial da UEMS, Unidade Universitária de
TITULAÇÕES POTENCIOMÉTRICAS DE CÁTIONS METÁLICOS EM MEIO NÃO AQUOSO Anderson Martin dos Santos 1 ; Edemar Benedetti Filho 2 1 Estudante do Curso de Química Industrial da UEMS, Unidade Universitária de
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
TITULAÇÃO EM QUÍMICA ANALÍTICA
 TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
TITULAÇÃO EM QUÍMICA ANALÍTICA Titulação Procedimento analítico, no qual a quantidade desconhecida de um composto é determinada através da reação deste com um reagente padrão ou padronizado. Titulante
muda de marrom para azula (medida pela absorvância da luz em um comprimento de onda de 595 nm) é proporcional à concentração de proteína presente.
 ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO ADAPTADOS DE LIVROS E APOSTILAS CITADOS ABAIXO. 1 Na determinação de uma proteína pelo método de Bradford, a cor de um corante muda de marrom para
ALGUNS EXERCÍCIOS SÃO DE AUTORIA PRÓPRIA. OS DEMAIS SÃO ADAPTADOS DE LIVROS E APOSTILAS CITADOS ABAIXO. 1 Na determinação de uma proteína pelo método de Bradford, a cor de um corante muda de marrom para
-0,1-0,2-0,3-0,4-0,5. 0, mol contidos na alíquota de 10 ml. 0,00525 mol contidos no balão de 100 ml. M = 72,0 g/mol
 1) Um ácido monoprótico puro desconhecido foi analisado por titulação potenciométrica. Para isso,,378g do ácido foi dissolvido em água e o volume foi completado até 1,mL. Uma alíquota de 1, ml do ácido
1) Um ácido monoprótico puro desconhecido foi analisado por titulação potenciométrica. Para isso,,378g do ácido foi dissolvido em água e o volume foi completado até 1,mL. Uma alíquota de 1, ml do ácido
6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto
 122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Nas determinações voltamétricas de espécies químicas tais como Cd (II) e Pb (II), o ajuste das
122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Nas determinações voltamétricas de espécies químicas tais como Cd (II) e Pb (II), o ajuste das
2. POLAROGRAFIA 2.1 CONCEITOS GERAIS
 2. POLAROGRAFIA 2.1 CONCEITOS GERAIS A eletroanalítica é um ramo do conhecimento da química em que são estabelecidas relações diretas entre as concentrações do analito e alguma propriedade elétrica como
2. POLAROGRAFIA 2.1 CONCEITOS GERAIS A eletroanalítica é um ramo do conhecimento da química em que são estabelecidas relações diretas entre as concentrações do analito e alguma propriedade elétrica como
CÉLULAS ELETROLÍTICAS
 QUÍMICAELETROANALÍTICA CÉLULAS ELETROLÍTICAS REPRESENTAÇÃOESQUEMÁTICA dois limites, um em cada extremidade da ponte salina Cu Cu 2+ (0,0200 mol L -1 ) Ag + (0,0200 mol L -1 ) Ag limite entres fases, ou
QUÍMICAELETROANALÍTICA CÉLULAS ELETROLÍTICAS REPRESENTAÇÃOESQUEMÁTICA dois limites, um em cada extremidade da ponte salina Cu Cu 2+ (0,0200 mol L -1 ) Ag + (0,0200 mol L -1 ) Ag limite entres fases, ou
Introdução à Análise Química QUI semestre 2011 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE PRECIPITAÇÃO
 Introdução à Análise Química QUI 094 2 semestre 2011 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE PRECIPITAÇÃO 1 TITULOMETRIA DE PRECIPITAÇÃO Volumetria de precipitação envolve a titulação com
Introdução à Análise Química QUI 094 2 semestre 2011 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE PRECIPITAÇÃO 1 TITULOMETRIA DE PRECIPITAÇÃO Volumetria de precipitação envolve a titulação com
QUÍMICA ELETROANALÍTICA
 QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
CROMATOGRAFIA INTRODUÇÃO, CLASSIFICAÇÃO E PRINCÍPIOS BÁSICOS
 Aula 8 CROMATOGRAFIA INTRODUÇÃO, CLASSIFICAÇÃO E PRINCÍPIOS BÁSICOS META Discutir a história da Cromatografi a e sua evolução; entender e classifi car os diferentes tipos de cromatografi a; entender os
Aula 8 CROMATOGRAFIA INTRODUÇÃO, CLASSIFICAÇÃO E PRINCÍPIOS BÁSICOS META Discutir a história da Cromatografi a e sua evolução; entender e classifi car os diferentes tipos de cromatografi a; entender os
Estudo realizado durante a disciplina de Química Analítica, UNIJUÍ. 2
 TITULAÇÃO POTENCIOMÉTRICA PARA DETERMINAÇÃO DE ÁCIDO FOSFÓRICO EM REFRIGERANTE TIPO COLA 1 POTENTIOMETRIC TITRATION FOR PHOSPHORIC ACID DETERMINATION IN COLA REFRIGERANT Guilherme Henrique Wendland 2,
TITULAÇÃO POTENCIOMÉTRICA PARA DETERMINAÇÃO DE ÁCIDO FOSFÓRICO EM REFRIGERANTE TIPO COLA 1 POTENTIOMETRIC TITRATION FOR PHOSPHORIC ACID DETERMINATION IN COLA REFRIGERANT Guilherme Henrique Wendland 2,
Tipos de métodos eletroanalíticos
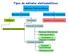 Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Sensores Condutimétricos Sensores Potenciométricos Potencial Controlado Sensores
Análise Instrumental. Prof. Elias da Costa
 Análise Instrumental Prof. Elias da Costa 1-Introdução a Análise Instrumental CLASSIFICAÇÃO DOS MÉTODOS ANALÍTICOS CLASSIFICAÇÃO DOS MÉTODOS INSTRUMENTAIS INSTRUMENTOS PARA ANÁLISE SELEÇÃO DE UM MÉTODO
Análise Instrumental Prof. Elias da Costa 1-Introdução a Análise Instrumental CLASSIFICAÇÃO DOS MÉTODOS ANALÍTICOS CLASSIFICAÇÃO DOS MÉTODOS INSTRUMENTAIS INSTRUMENTOS PARA ANÁLISE SELEÇÃO DE UM MÉTODO
6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto
 122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Ao se ajustar a concentração de Bi (III) para a formação in situ do eletrodo de bismuto (BiFE)
122 6 Determinação voltamétrica de Cu (II) utilizando eletrodo de filme de bismuto 6.1. Estudos preliminares Ao se ajustar a concentração de Bi (III) para a formação in situ do eletrodo de bismuto (BiFE)
Aula 13: Prof. Rafael Sousa
 Analítica V: Aula 13: 19-03-13 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan Consolidando os conceitos da Aula 12... Questões
Analítica V: Aula 13: 19-03-13 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan Consolidando os conceitos da Aula 12... Questões
Química Analítica IV INTRODUÇÃO A VOLUMETRIA
 Química Análítica IV - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos INTRODUÇÃO A VOLUMETRIA VOLUMETRIA Química Análítica IV - II sem/2012
Química Análítica IV - II sem/2012 Profa Ma Auxiliadora - 1 Química Analítica IV 1 semestre 2012 Profa. Maria Auxiliadora Costa Matos INTRODUÇÃO A VOLUMETRIA VOLUMETRIA Química Análítica IV - II sem/2012
QUI 070 Química Analítica V Análise Instrumental. Aula 4 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 4 Química Eletroanalítica Julio C. J. Silva 2o semestre
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 4 Química Eletroanalítica Julio C. J. Silva 2o semestre
Análise Química Aplicada
 Análise Química Aplicada Fundamentos de Potenciometria Profº Msc. Wesley de Paula Análise Química Aplicada Introdução Técnica baseada na medida dos potenciais desenvolvidos em uma célula eletroquímica,
Análise Química Aplicada Fundamentos de Potenciometria Profº Msc. Wesley de Paula Análise Química Aplicada Introdução Técnica baseada na medida dos potenciais desenvolvidos em uma célula eletroquímica,
Aula 15 PRÁTICA 05 - CROMATOGRAFIA. Elisangela de Andrade Passos. META Estudar o princípio básico da cromatografi a; redigir o relatório prático.
 Aula 15 PRÁTICA 05 - CROMATOGRAFIA META Estudar o princípio básico da cromatografi a; redigir o relatório prático. OBJETIVOS Ao fi nal desta aula, o aluno deverá: entender o processo de separação cromatográfi
Aula 15 PRÁTICA 05 - CROMATOGRAFIA META Estudar o princípio básico da cromatografi a; redigir o relatório prático. OBJETIVOS Ao fi nal desta aula, o aluno deverá: entender o processo de separação cromatográfi
Prof a. Dr a. Luciana M. Saran
 HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 ANÁLISE TITRIMÉTRICA O QUE
HCl 0,1N FCAV/UNESP CURSO: Agronomia DISCIPLINA: Química Analítica Fundamentos da Análise Titrimétrica (Volumétrica) NaOH 0,1N Prof a. Dr a. Luciana M. Saran Fenolftaleína 1 ANÁLISE TITRIMÉTRICA O QUE
MÓDULO 2 2ª aula. Equilíbrio e Titulações de complexação Introdução ao Preparo de Amostras
 QUÍMICA ANALÍTICA AVANÇADA 1S 2017 MÓDULO 2 2ª aula Equilíbrio e Titulações de complexação Introdução ao Preparo de Amostras Prof. Rafael Arromba de Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br
QUÍMICA ANALÍTICA AVANÇADA 1S 2017 MÓDULO 2 2ª aula Equilíbrio e Titulações de complexação Introdução ao Preparo de Amostras Prof. Rafael Arromba de Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br
Química Analítica Avançada. Volumetria de Complexação Parte 2
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química Química Analítica Avançada Volumetria de Complexação Parte 2 Lilian Silva Juiz de Fora, 2011 Curvas de titulação
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química Química Analítica Avançada Volumetria de Complexação Parte 2 Lilian Silva Juiz de Fora, 2011 Curvas de titulação
Domínios / Objetivos Conceitos/ Conteúdos Calendarização
 DEPARTAMENTO DE FÍSICA-QUÍMICA DISCIPLINA: FÍSICA E QUÍMICA A - 11º ANO OBJETIVOS / CONTEÚDOS... 1º PERÍODO Domínios / Objetivos Conceitos/ Conteúdos Calendarização 1. MECÂNICA (FÍSICA) 1.1. Tempo, posição
DEPARTAMENTO DE FÍSICA-QUÍMICA DISCIPLINA: FÍSICA E QUÍMICA A - 11º ANO OBJETIVOS / CONTEÚDOS... 1º PERÍODO Domínios / Objetivos Conceitos/ Conteúdos Calendarização 1. MECÂNICA (FÍSICA) 1.1. Tempo, posição
Analítica V: POTENCIOMETRIA. Prof. Rafael Sousa Departamento de Química - ICE Notas de aula:
 Analítica V: 31-05-12 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan POTENCIOMETRIA Baseada na medida do potencial elétrico
Analítica V: 31-05-12 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan POTENCIOMETRIA Baseada na medida do potencial elétrico
Aula EQUILÍBRIO DE SAIS POUCO SOLÚVEIS
 EQUILÍBRIO DE SAIS POUCO SOLÚVEIS Aula 6 METAS Apresentar a definição de solubilidade e produto de solubilidade; apresentar os fatores que afetam a solubilidade de um sal; apresentar as interações ácido-base
EQUILÍBRIO DE SAIS POUCO SOLÚVEIS Aula 6 METAS Apresentar a definição de solubilidade e produto de solubilidade; apresentar os fatores que afetam a solubilidade de um sal; apresentar as interações ácido-base
Prática 11 Ácidos, bases e curvas de titulação potenciométrica
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 11 Ácidos, bases e curvas de titulação potenciométrica
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 11 Ácidos, bases e curvas de titulação potenciométrica
Titulação de precipitação
 Titulação de precipitação Volumetria de precipitação é baseada em reações que geram compostos de baixa solubilidade. Velocidade de formação de muitos precipitados limita o uso de reagentes que podem ser
Titulação de precipitação Volumetria de precipitação é baseada em reações que geram compostos de baixa solubilidade. Velocidade de formação de muitos precipitados limita o uso de reagentes que podem ser
Aula 12. Prof. Rafael Sousa
 Analítica V: Aula 12 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan POTENCIOMETRIA Baseada na medida do potencial elétrico
Analítica V: Aula 12 POTENCIOMETRIA Prof. Rafael Sousa Departamento de Química - ICE rafael.arromba@ufjf.edu.br Notas de aula: www.ufjf.br/baccan POTENCIOMETRIA Baseada na medida do potencial elétrico
Química Analítica Avançada: Volumetria de precipitação
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química Química Analítica Avançada: Volumetria de precipitação Lilian Silva Juiz de Fora, 2011 Definição de solubilidade
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química Química Analítica Avançada: Volumetria de precipitação Lilian Silva Juiz de Fora, 2011 Definição de solubilidade
Metas/Objetivos/Domínios Conteúdos/Competências/Conceitos Número de Aulas
 DEPARTAMENTO DE C. FÍSICO-QUÍMICAS DISCIPLINA: FÍSICA E QUÍMICA A ANO: 11º Planificação (Conteúdos)... Período Letivo: 1º Metas/Objetivos/Domínios Conteúdos/Competências/Conceitos Número de Aulas 1. MECÂNICA
DEPARTAMENTO DE C. FÍSICO-QUÍMICAS DISCIPLINA: FÍSICA E QUÍMICA A ANO: 11º Planificação (Conteúdos)... Período Letivo: 1º Metas/Objetivos/Domínios Conteúdos/Competências/Conceitos Número de Aulas 1. MECÂNICA
AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL
 AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL Documento(s) Orientador(es): Programa de Física e Química A/ Metas Curriculares, MEC-2014 ENSINO SECUNDÁRIO 11º ANO-FQ-A
AGRUPAMENTO de ESCOLAS de SANTIAGO do CACÉM Ano Letivo 2016/2017 PLANIFICAÇÃO ANUAL Documento(s) Orientador(es): Programa de Física e Química A/ Metas Curriculares, MEC-2014 ENSINO SECUNDÁRIO 11º ANO-FQ-A
Prova de conhecimento em Química Analítica DQ/UFMG
 CÓDIGO DO(A) CANDIDATO(A): Questão 1A. Considere os seguintes reagentes: I) KF sólido com teor de pureza de 95,0% m/m II) HF 28,0% m/m, d = 1,02 kg L -1, pk a = 3,17 III) KOH 0,400 mol L -1 a) Calcule
CÓDIGO DO(A) CANDIDATO(A): Questão 1A. Considere os seguintes reagentes: I) KF sólido com teor de pureza de 95,0% m/m II) HF 28,0% m/m, d = 1,02 kg L -1, pk a = 3,17 III) KOH 0,400 mol L -1 a) Calcule
QUÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA
 QUÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA TITULAÇÃO DE NEUTRALIZAÇÃO Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br QUÍMICA ANALÍTICA QUÍMICA ANALÍTICA
QUÍMICA ANALÍTICA QUANTITATIVA: TITULOMETRIA TITULAÇÃO DE NEUTRALIZAÇÃO Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br QUÍMICA ANALÍTICA QUÍMICA ANALÍTICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA PROF. RODRIGO BANDEIRA
 REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
REAÇÕES QUÍMICAS PRODUZINDO CORRENTE ELÉTRICA CORRENTE ELÉTRICA PRODUZINDO REAÇÃO QUÍMICA A relação entre as reações químicas e a corrente elétrica é estudada por um ramo da química chamado ELETROQUÍMICA
Aula EQUILÍBRIO DE OXIDAÇÃO E REDUÇÃO METAS
 EQUILÍBRIO DE OXIDAÇÃO E REDUÇÃO METAS Apresentar a definição de oxidação e redução; apresentar a definição e classificação de celula eletroquímica; apresentar a equação de nernst; apresentar outros equilíbrios
EQUILÍBRIO DE OXIDAÇÃO E REDUÇÃO METAS Apresentar a definição de oxidação e redução; apresentar a definição e classificação de celula eletroquímica; apresentar a equação de nernst; apresentar outros equilíbrios
ESTUDOS POLAROGRÁFICOS DO HERBICIDA IMAZAQUIN
 ISSN 1413-6244 Empresa Brasileira de Pesquisa Agropecuária Centro Nacional de Pesquisa e Desenvolvimento de Instrumentação Agropecuária Ministério da Agricultura e do Abastecimento Rua XV de Novembro,
ISSN 1413-6244 Empresa Brasileira de Pesquisa Agropecuária Centro Nacional de Pesquisa e Desenvolvimento de Instrumentação Agropecuária Ministério da Agricultura e do Abastecimento Rua XV de Novembro,
Relatório 7 Determinação do produto de solubilidade do AgBrO3
 UNIVERSIDADE DE SÃO PAULO QUÍMICA GERAL Prof. Maria Regina Alcântara Relatório 7 Determinação do produto de solubilidade do AgBrO3 Mayara Moretti Vieira Palmieri 7159862 Rodrigo Tonon 7993766 Outubro,
UNIVERSIDADE DE SÃO PAULO QUÍMICA GERAL Prof. Maria Regina Alcântara Relatório 7 Determinação do produto de solubilidade do AgBrO3 Mayara Moretti Vieira Palmieri 7159862 Rodrigo Tonon 7993766 Outubro,
QUI 070 Química Analítica V Análise Instrumental. Aula 7 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
(Subdomínio.módulo.conteúdo)
 Escolas João de Araújo Correia ORGANIZAÇÃO DO ANO LETIVO 16 17 GESTÃO CURRICULAR DEPARTAMENTO Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 11º ANO 1º Período (Início: 15-09-2016; Fim: 16-12-2016)
Escolas João de Araújo Correia ORGANIZAÇÃO DO ANO LETIVO 16 17 GESTÃO CURRICULAR DEPARTAMENTO Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 11º ANO 1º Período (Início: 15-09-2016; Fim: 16-12-2016)
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR
 INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
INTRODUÇÃO À ELETROQUÍMICA Prof. Dr. Patricio R. Impinnisi Departamento de engenharia elétrica UFPR REAÇÕES ELETROQUÍMICAS Uma reação eletroquímica é um processo químico heterogêneo (que envolve uma interface
MATRIZ DE CONTEÚDOS E DE PROCEDIMENTOS
 Mecânica Agrupamento de Escolas General Humberto Delgado Sede na Escola Secundária/3 José Cardoso Pires Santo António dos Cavaleiros 11º Ano Planificação Anual 2016-2017 Física e Química A MATRIZ DE CONTEÚDOS
Mecânica Agrupamento de Escolas General Humberto Delgado Sede na Escola Secundária/3 José Cardoso Pires Santo António dos Cavaleiros 11º Ano Planificação Anual 2016-2017 Física e Química A MATRIZ DE CONTEÚDOS
Introdução aos métodos instrumentais
 Introdução aos métodos instrumentais Métodos instrumentais Métodos que dependem da medição de propriedades elétricas, e os que estão baseados na: determinação da absorção da radiação, na medida da intensidade
Introdução aos métodos instrumentais Métodos instrumentais Métodos que dependem da medição de propriedades elétricas, e os que estão baseados na: determinação da absorção da radiação, na medida da intensidade
Volumetria de precipitação
 LCE0182 Química Analítica Quantitativa Volumetria de precipitação Wanessa Melchert Mattos Volumetria de precipitação É baseada nas reações que produzem os compostos iônicos de solubilidade limitada. Volumetria
LCE0182 Química Analítica Quantitativa Volumetria de precipitação Wanessa Melchert Mattos Volumetria de precipitação É baseada nas reações que produzem os compostos iônicos de solubilidade limitada. Volumetria
APLICAÇÕES DOS POTENCIAIS PADRÃO DE ELETRODO
 APLICAÇÕES DOS POTENCIAIS PADRÃO DE ELETRODO POTENCIAL TERMODINÂMICO! definido como o potencial do catodo menos o potencial do anodo (semi-reações escritas como redução; despreza queda ôhmica e potencial
APLICAÇÕES DOS POTENCIAIS PADRÃO DE ELETRODO POTENCIAL TERMODINÂMICO! definido como o potencial do catodo menos o potencial do anodo (semi-reações escritas como redução; despreza queda ôhmica e potencial
Experiência 11 PILHA DE DANIELL PILHA DE DANIELL
 PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
PILHA DE DANIELL 1. Objetivos - Compreensão do funcionamento de uma pilha - Medir o potencial de uma pilha de Daniell - Montagem de uma pilha - Aplicar os conceitos de oxi-redução ao experimento comparando
Escolas João de Araújo Correia ORGANIZAÇÃO DO ANO LETIVO GESTÃO CURRICULAR. 1.º Período (Início: ; Fim: ) - 13 Semanas
 Escolas João de Araújo Correia ORGANIZAÇÃO DO ANO LETIVO 18 19 GESTÃO CURRICULAR DEPARTAMENTO Matemática e Ciências Experimentais DISCIPLINA (FÍSICA E QUÍMICA A) ANO (11.º) DOMÍNIO 1: Mecânica. 1.º Período
Escolas João de Araújo Correia ORGANIZAÇÃO DO ANO LETIVO 18 19 GESTÃO CURRICULAR DEPARTAMENTO Matemática e Ciências Experimentais DISCIPLINA (FÍSICA E QUÍMICA A) ANO (11.º) DOMÍNIO 1: Mecânica. 1.º Período
Métodos Instrumentais de Análise
 Métodos Instrumentais de Análise Aula 01 08/04/2013 1 Métodos Analíticos - MÉTODOS CLÁSSICOS - MÉTODOS INSTRUMENTAIS -INSTRUMENTAÇÃO MODERNA -Portabilidade -Baixo Custo -Miniaturização -Análise no campo
Métodos Instrumentais de Análise Aula 01 08/04/2013 1 Métodos Analíticos - MÉTODOS CLÁSSICOS - MÉTODOS INSTRUMENTAIS -INSTRUMENTAÇÃO MODERNA -Portabilidade -Baixo Custo -Miniaturização -Análise no campo
E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O
 E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O OBJETIVO Pretende-se com este trabalho experimental que os alunos avaliem as características de um eléctrodo sensível a ião
E S T U D O D E U M E L É C T R O D O S E L E T I V O D E I Ã O N I T R A T O OBJETIVO Pretende-se com este trabalho experimental que os alunos avaliem as características de um eléctrodo sensível a ião
P L A N I F I C A Ç Ã O A N U A L
 P L A N I F I C A Ç Ã O A N U A L DEPARTAMENTO: MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS ÁREA DISCIPLINAR: 510 - CIÊNCIAS FÍSICO-QUÍMICAS DISCIPLINA: Física e Química A NÍVEL DE ENSINO: Secundário CURSO: Ciências
P L A N I F I C A Ç Ã O A N U A L DEPARTAMENTO: MATEMÁTICA E CIÊNCIAS EXPERIMENTAIS ÁREA DISCIPLINAR: 510 - CIÊNCIAS FÍSICO-QUÍMICAS DISCIPLINA: Física e Química A NÍVEL DE ENSINO: Secundário CURSO: Ciências
QUI 154 Química Analítica V Análise Instrumental. Aula 4 Potenciometria
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Análise Instrumental Aula 4 Potenciometria Julio C. J. Silva Juiz de Fora, 1 o sem
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 154 Química Analítica V Análise Instrumental Aula 4 Potenciometria Julio C. J. Silva Juiz de Fora, 1 o sem
Lista de Exercício 1ª TVC Química Analítica V Teoria (1º Sem 2017) Entregar antes do início da 1ª TVC Terça-feira as 8:00 hs.
 Lista de Exercício 1ª TVC Química Analítica V Teoria (1º Sem 2017) Entregar antes do início da 1ª TVC Terça-feira as 8:00 hs. Skoog Capítulo 5: Erros em análises químicas 5-1. Explique a diferença entre:
Lista de Exercício 1ª TVC Química Analítica V Teoria (1º Sem 2017) Entregar antes do início da 1ª TVC Terça-feira as 8:00 hs. Skoog Capítulo 5: Erros em análises químicas 5-1. Explique a diferença entre:
CURRÍCULOS 2016/2017
 CURRÍCULOS 2016/2017 Ensino Regular Departamento: Matemática e Ciências Experimentais Disciplina: Física e Química A Ano de Escolaridade: 11º Conteúdos Programáticos: Domínio: Mecânica Subdomínio 1: Tempo,
CURRÍCULOS 2016/2017 Ensino Regular Departamento: Matemática e Ciências Experimentais Disciplina: Física e Química A Ano de Escolaridade: 11º Conteúdos Programáticos: Domínio: Mecânica Subdomínio 1: Tempo,
Polarização e cinética de eletrodo
 Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
Polarização e cinética de eletrodo RESUMO DA POLARIZAÇÃO O eletrodo sai da condição de equilíbrio pela passagem de corrente pelo circuito externo; A cinética da reação interfacial é mais lenta que o fluxo
Centro de Educação Superior do Oeste - CEO. CURSO: Engenharia de Alimentos ANO/SEMESTRE: 2012/1 DISCIPLINA: Química Analítica
 CURSO: Engenharia de Alimentos ANO/SEMESTRE: 2012/1 DISCIPLINA: Química Analítica FASE: 4 a CARGA HORÁRIA: 90 TURNO: Noturno PROFESSOR (A): Alexandre T. Paulino CRÉDITOS: 6 PLANO DE ENSINO 1 HORÁRIO DAS
CURSO: Engenharia de Alimentos ANO/SEMESTRE: 2012/1 DISCIPLINA: Química Analítica FASE: 4 a CARGA HORÁRIA: 90 TURNO: Noturno PROFESSOR (A): Alexandre T. Paulino CRÉDITOS: 6 PLANO DE ENSINO 1 HORÁRIO DAS
E cel = E catodo - E anodo E cel = 0,337 ( 0,763) E cel = 1,100 V. ZnSO 4(aq) 1,0 mol L -1 CuSO 4(aq) 1,0 mol L -1
 QMC5351 Química Analítica Instrumental POTENCIOMETRIA Análise Potenciométrica Conceitos Iniciais CÉLULA ELETROQUÍMICA sistema onde dois eletrodos, cada um deles imerso em uma solução eletrolítica (interligadas
QMC5351 Química Analítica Instrumental POTENCIOMETRIA Análise Potenciométrica Conceitos Iniciais CÉLULA ELETROQUÍMICA sistema onde dois eletrodos, cada um deles imerso em uma solução eletrolítica (interligadas
QUI 070 Química Analítica V Análise Instrumental. Aula 7 Química Eletroanalítica
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 7 Química Eletroanalítica Julio C. J. Silva Juiz de Fora,
Volumetria de Neutralização
 Volumetria de Neutralização Titulação Ácido-base Determinação da concentração de uma solução a partir da quantidade e concentração de uma solução conhecida Alíquota de volume conhecido (20 ml) e concentração
Volumetria de Neutralização Titulação Ácido-base Determinação da concentração de uma solução a partir da quantidade e concentração de uma solução conhecida Alíquota de volume conhecido (20 ml) e concentração
