ALTERNATIVAS NUTRICIONAIS PARA O CRESCIMENTO PRIMÁRIO IN VITRO E PARA A IDENTIFICAÇÃO DE PROTOZOÁRIOS DO GÊNERO LEISHMANIA.
|
|
|
- Alexandra Cruz Leveck
- 5 Há anos
- Visualizações:
Transcrição
1 ANDREA DOS SANTOS GARCIA ALTERNATIVAS NUTRICIONAIS PARA O CRESCIMENTO PRIMÁRIO IN VITRO E PARA A IDENTIFICAÇÃO DE PROTOZOÁRIOS DO GÊNERO LEISHMANIA. Dissertação apresentada ao Programa de Pós-Graduação em Ciências da Coordenadoria de Controle de Doenças da Secretaria de Estado da Saúde de São Paulo, para obtenção do Título de Mestre em Ciências. Área de Concentração: Pesquisas laboratoriais em Saúde Pública Orientador: Prof o Dr o José Eduardo Tolezano São Paulo
2 DEDICATÓRIAS À minha mãe Benedita, por todo amor e carinho. Ao meu pai Geraldo, pelo carinho e incentivo aos estudos. Ao meu marido Odair, dedicado companheiro sempre. À minhas filhas Maria Clara e Ana Letícia, alicerces da minha sobrevivência. 2
3 Agradecimentos Ao Prof. Dr. José Eduardo Tolezano pela orientação e por mostrar-me como assumir posturas científicas. Á Assistente de Pesquisa Eleane Larosa Garcia, da Diretoria da Seção de Parasitologia Médica, do Instituto Adolfo Lutz Central, pelos conhecimentos, pelo apoio e sugestão nas novas formulações de meios de cultura. A Pesquisadora Júlia T.U. Yoshida do Setor de Meios de Cultura, pelo trabalho em conjunto na elaboração do novo meio utilizado nos experimentos. Á Prof a. Dra. Vera Lúcia Chioccola por permitir a utilização do Laboratório de Biologia Molecular da Seção de Parasitologia Médica, do Instituto Adolfo Lutz Central. Ao Prof. Dr. Roberto Mitsuyoshi Hiramoto, chefe do Setor de Parasitoses Sistêmicas, da Seção de Parasitologia Médica, do Instituto Adolfo Lutz Central, pela amizade, apoio e por permitir a utilização do Laboratório de Leishmanioses. Á todos os funcionários do Laboratório de Leishmanioses da Seção de Parasitologia Médica do Instituto Adolfo Lutz Central, por me receberem e por colaborarem com a realização dos experimentos. Ao Técnico de Laboratório Sansão da Rocha Westphalen pela amizade, apoio, pelos seus ensinamentos e pela execução das fotos. Á equipe de Campo do Laboratório de Leishmanioses da Seção de Parasitologia Médica do Instituto Adolfo Lutz Central, formada pela Pesquisadora Helena Hilomi Taniguchi, pelos técnicos Carlos Roberto Elias 3
4 e Rui Larosa, pelo veterinário Dr. José Augusto R. Barbosa, pela realização dos trabalhos em campo. Ao veterinário Dr. José Eduardo R. Barbosa do Biotério do Instituto Adolfo Lutz Central, pela colaboração em ceder os animais de laboratório e pela ajuda nos experimentos realizados com esses animais. 4
5 RESUMO Garcia AS. Alternativas nutricionais para o crescimento primário in vitro e para identificação de protozoários do gênero Leishmania. [Dissertação]. São Paulo: Coordenadoria de Controle de Doenças da Secretaria de Estado da Saúde de São Paulo; Introdução. O crescimento primário e a proliferação de Leishmania são ferramentas valiosas para estudos sobre desenvolvimento e padronização de técnicas diagnósticas, identificação, classificação, análise bioquímica, análise molecular, biologia celular, insumos imunológicos e quimioterápicos. Objetivos: a) estudar diferentes formulações e suplementações de meios de cultura para o crescimento primário de Leishmania; b) avaliar a criopreservação como alternativa para preservar amostras biológicas para o crescimento primário de Leishmania. Materiais e métodos. Meios de cultura: a. bifásico com fase sólida de ágar sangue (BAB) e fase líquida de infusão de cérebro e coração (BHI), TGGY-1 (nova formulação) e solução de uréia-creatinina-sódio-potássio a 5% (UCNaK); b. monofásico: novos meios líquidos TGGY-1 e TGGY-2. Suplementos: urina humana estéril; urina canina estéril; solução de UCNaK a 5%; ácido fólico e hemina. Amostras: a) aspirado de baço de 51 cães de áreas endêmicas para Leishmaniose Visceral canina para os experimentos de crescimento primário e para a identificação de Leishmania spp; b) cepas de referência de Leishmania (L.) chagasi, L. (L.) amazonensis, L. (V.) braziliensis e Trypanosoma (S.)cruzi para os experimentos de proliferação; Resultados e conclusões. Exceção feita à solução UCNaK a 5% todas as demais formulações avaliadas permitiram o crescimento primário de Leishmania spp., isoladas de 27 (52,9%) cães examinados. O melhor desempenho foi obtido com o meio bifásico BAB-BHI. Nos experimentos sobre proliferação parasitária, o crescimento exponencial foi obtido nas formulações BAB-BHI com diferentes suplementos; BAB-TGGY-1; TGGY-1 e TGGY-2 com hemina e ácido fólico. A criopreservação da amostra de 5
6 aspirado de baço apresentou-se como alternativa viável para o crescimento primário de Leishmania. De alguns dos 27 cães infectados L. (L.) chagasi foi identificada como agente causal pela reação em cadeia da polimerase. Formas amastigotas-like foram obtidas nos meios líquidos TGGY-1 e TGGY- 2 acrescidos de hemina e ácido fólico. Palavras chaves: Leishmania spp., crescimento primário, meio de cultura, suplemento, criopreservação e reação em cadeia da polimerase. 6
7 ABSTRACT Garcia, AS. Nutritious alternatives to primary growth in vitro and to identification of Leishmania genus protozoan. [Dissertation]. São Paulo: Coordenadoria de Controle de Doenças da Secretaria de Saúde do Estado de São Paulo; Introduction: Primary growth and Leishmania proliferation are precious tools in order to standardize diagnosis techniques, to develop studies of identification, classification, biochemistry assays, molecular analysis, cellular biology, immunological and chemotherapic products.objective: a) to investigate different culture media formulatings and supplements for primary growth of Leishmania; b) to evaluate cryopreservation as an alternative to keep biological samples until posterior procedure to primary growth of Leishmania spp. Material and Methods: Culture media: a) Biphasic media with solid phase agar blood (BAB) and the liquid phase is brain and heart infusion (BHI), TGGY-1 (new formula) and urea-creatinekalium-sodium 5% (UCNaK); b) Monophasic media: new liquid media TGGY-1 and TGGY-2. Supplements: human sterile urine; canine sterile urine; UCNaK 5% solution; Folic acid and haemin. Samples: a) spleen aspirate of 51 dogs from Visceral Leishmaniasis endemic area employed to primary growth and identification of Leishmania studies; b) reference strain of Leishmania (L) chagasi, L.(L) amazonensis, L.(V) braziliensis and Trypanosoma (S) cruzi employed in the proliferation experiments. Results and conclusions: Except UCNaK 5% solution all kind of formulas evaluated allowed the primary growth of Leishmania spp, isolated from 27 (52,9%) dogs examinated. The best performance was obtained from the biphasic media BAB-BHI. In respect to Leishmania proliferation, the exponential growth was obtained in the BAB-BHI media with different supplements; BAB-TGGY- 1; TGGY-1 and TGGY-2 with haemin and folic acid. The cryopreservation seems to be a possible alternative to keep going spleen aspirate samples feasible to obtain primary Leishmania spp growth. It was possible identify L. (L) chagasi as etiological agent among the 27 infected dogs using Polymerase Chain Reaction. Amastigotelike shapes were obtained in the liquid media TGGY-1 and TGGY-2 plus haemin and folic acid. Keys words: Leishmania spp., primary growth, cryopreservation and Polymerase Chain Reaction. media culture, supplement, 7
8 LISTA DE ABREVIATURAS E SIGLAS UHE Urina Humana Estéril BAB Blood Agar Base BHI Brain Heart Infusion TGGY-1 Denominação de nova formulação de meio acelular TGGY-2 Denominação de nova formulação de meio acelular UCE Urina Canina Estéril UCNaK Solução de uréia, creatinina, sódio e potássio LVA Leishmaniose Visceral Americana LVc Leishmaniose Visceral canina PCR Polymerase Chain Reaction LTA Leishmaniose Tegumentar Americana L.(V) braziliensis Leishmania (Viannia) braziliensis L.(V) guyanensis Leishmania (Viannia) guyanensis L. (L) amazonensis - Leishmania (Leishmania) amazonensis L. (L) chagasi Leishmania (Leishmania) chagasi LCD Leishmaniose cutânea difusa PKDL Leishmaniose dérmica pós-calazar ºC grau Celsius DNA Ácido Desoxirribonucléico GENTA Gentamicina BSA Soro Albumina Bovina PNP Penápolis ATB - Araçatuba KDNA DNA do cinetoplasto 8
9 LISTA DE FIGURAS Pág. Figura 1 - Formas amastigotas intracelulares. 18 Figura 2 - Formas promastigotas em meio de cultura acelular. 18 Figura 3 - Ciclo biológico de Leishmania. 24 Figura 4 - Média da densidade parasitária máxima obtida no crescimento 72 primário. Figura 5 - Curvas de crescimento de L. (L.) chagasi em diferentes meios 75 de cultura. Figura 6 - Curvas de crescimento de L. (L.) amazonensis em diferentes 75 meios de cultura. Figura 7 - Curvas de crescimento de L. (V.) braziliensis em diferentes 76 meios de cultura. Figura 8 - Curvas de crescimento de T. (S.) cruzi em diferentes meios de 76 cultura. Figura 9 - Média da densidade parasitária máxima obtida no crescimento 78 primário. Figura 10 - Curvas de crescimento de L. (L.) chagasi em diferentes meios 79 de cultura. Figura 11 - Curvas de crescimento de L. (L.) amazonensis em diferentes 80 meios de cultura. Figura 12 - Curvas de crescimento de L. (V.) braziliensis em diferentes 80 meios de cultura. Figura 13 - Curvas de crescimento de T. (S.) cruzi em diferentes meios de 81 cultura. Figura 14 - Curvas de crescimento de L. (L) chagasi em diferentes meios 83 de cultura. Figura 15 - Curvas de crescimento de L. (L) amazonensis em diferentes 83 meios de cultura. Figura 16 - Curvas de crescimento de L. (V.) braziliensis em diferentes meios de cultura. 84 9
10 Figura 17 - Curvas de crescimento de T. (S.) cruzi em diferentes meios de 84 cultura. Figura 18 - Curvas de crescimento de L. (L.) chagasi 1a. subpassagem. 85 Figura 19 - Curvas de crescimento de T. (S.) cruzi 1 a. subpassagem. 86 Figura 20 - Amplificação dos produtos da PCR. Amostras de fragmento de 92 baço de cães provenientes de Campo Grande, no Estado de Mato Grosso do Sul. Figura 21 - Amplificação dos produtos da PCR realizada a partir das 93 amostras de fragmento de baço de cães provenientes do Município de Penápolis, no Estado de São Paulo. Figura 22 - Amplificação dos produtos da PCR realizada a partir das 94 amostras de fragmento de baço de cães provenientes dos Municípios de Penápolis e Araçatuba, no Estado de São Paulo. Figura 23 - Formas promastigotas de L. (L.) amazonensis em meio 95 TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) 7 o dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação e (D) Grupo de Leishmania, formação típica observada durante o 28 o dia de inoculação. Figura 24 - Formas promastigotas de L. (L.) chagasi, em meio líquido 96 TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico, aumento de 1000X. (A) 7 o dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação; (D) 28 o dia de inoculação. Figura 25 - Formas promastigotas de L. (V.) braziliensis em meio líquido 96 TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 o dia após inoculação e (B) 14 o dia após inoculação. Figura 26 - Formas promastigotas de L. (V.) braziliensis em meio líquido TGGY-1 com hemina, coradas pelo método Panótico, vizualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação 97 10
11 Figura 27 - Figura 28 - Figura 29 - Figura 30 - Figura 31 - e (B) 14 o dia de inoculação. Formas promastigotas de L. (L.) amazonensis, não coradas, em meio líquido TGGY-1 com hemina, aumento 400X. (A) 14 0 dia de inoculação e (B) 21 o dia de inoculação. T.(S.) cruzi em meio líquido TGGY-1 com ácido fólico, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação e (D) 28 o dia de inoculação. T.(S) cruzi em meio líquido TGGY-1 com ácido fólico, não coradas, visualizadas sob aumento de 400X, 28 0 dia após a inoculação. Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-1 com ácido fólico, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 10 o dia de inoculação; (C) 14 o dia de inoculação; (D) 21 o dia de inoculação Figura 32 - Figura 33 - Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-1 com hemina, corados pelo Método Panótico e visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. Formas promastigotas de L. (L) chagasi em meio líquido TGGY-2 com ácido fólico e hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação
12 Figura 34 - Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-2 com ácido fólico, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. 104 Figura 35 - Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-2 com hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. Figura 36 - T. (S) cruzi com 9 o dia de inoculação em meio TGGY-1 com ácido fólico, coradas pelo método Panótico e visualizadas sob aumento de 1000X. Figura 37 - T.(S) cruzi com 12 o dia de inoculação em meio TGGY-1 com ácido fólico, coradas pelo método Panótico e visualizadas sob aumento de 1000X. Figura 38 - T.(S) cruzi com 12 o dia de inoculação em meio TGGY-2 com hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X. Figura 39 - L. (L.) chagasi, após 21 o dia de inoculação, coradas pelo Método Panótico e visualizadas em microscópio óptico Olympus CBA sob aumento de 1000X. (A) meio TGGY-1 com ácido fólico e hemina; (B) meio TGGY-2 com ácido fólico e hemina. Figura 40 - Amostras de referência no 21 o dia de inoculação em meio BAB com BHI, UHEF, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) T. (S) cruzi; (B) L. (V.) braziliensis; (C) L. (L.) chagasi e (D) L. (L.) amazonensis
13 LISTA DE TABELAS Tabela 1 - Principais agentes etiológicos e distribuição geográfica das leishmanioses no Novo Mundo*. Pág. 20 Tabela 2 - Resultados obtidos para o crescimento primário de Leishmania spp., a partir de aspirado de baço de cães de Penápolis, inoculadas em diferentes meios de cultura. 71 Tabela 3 - Tabela 4 - Tabela 5 - Média da densidade parasitária máxima obtida no crescimento primário de Leishmania spp. a partir de amostras de aspirado de baço de cães de Penápolis. Resultados obtidos a partir da proliferação de amostras de referência utilizadas como controle. Densidade parasitária máxima obtida com a proliferação de algumas espécies de tripanossomatídeos, segundo formulação de meio de cultura e tempo de cultivo, a partir de um inóculo inicial de 2 X 10 5 cel./ml Tabela 6 - Resultados obtidos para o crescimento primário de Leishmania spp., a partir de aspirado de baço de cães de Penápolis e Araçatuba, inoculadas em meio bifásico e meio líquido. 77 Tabela 7 - Tabela 8 - Tabela 9 - Tabela 10 - Tabela 11 - Média da densidade parasitária máxima obtida no crescimento primário de Leishmania spp. isoladas de aspirado de baço de cães de Penápolis e Araçatuba Densidade parasitária máxima obtida com a proliferação de algumas espécies de tripanossomatídeos, segundo formulação de meio de cultura e tempo de cultivo, a partir de um inóculo inicial de 2 X 10 5 cel./ml. Densidade parasitária máxima obtida para algumas espécies de tripanossomatídeos, segundo formulação de meio de cultura e tempo de cultivo, a partir de um inóculo inicial de 2 X 10 5 cel./ml. Cultivo de L. (L.) chagasi em diferentes meios de culturas - 1 a subpassagem. Cultivo de T.(S.) cruzi em diferentes meios de culturas - 1 a subpassagem
14 Tabela 12 - Tabela 13 - Tabela 14 - Tabela 15 - Crescimento primário de Leishmania spp. a partir de amostras de aspirado de baço de cães de Campo Grande* e Penápolis** antes e após a criopreservação. Resultados dos aspirados de baço dos cães de Campo Grande* e Penápolis**, criopreservados em diferentes períodos e inoculados em diferentes meios de cultura. Inoculação de amostra, criopreservada, de aspirado de baço de cães de Penápolis. Inoculação de amostras de aspirado de baço de hamster, em meio de cultura Tabela 16 - Proliferação de L. (L.) chagasi e determinação do ph 90 Tabela 17 - Tabela 18 - Tabela 19 - Resultados da PCR comparados com o isolamento em cultura das amostras criopreservadas de aspirado de baço coletados de cães de Campo Grande. Resultados de PCR comparados com o isolamento de Leishmania em cultura das amostras de aspirado de baço coletados de cães de Penápolis, no Estado de São Paulo. Resultados de PCR comparados com o crescimento primário de Leishmania em cultura, a partir das amostras de aspirado de baço coletados de cães de Penápolis e Araçatuba, no Estado de São Paulo
15 ÍNDICE 1. Introdução Agente etiológico Transmissores / vetores de Leishmania Ciclo biológico de Leishmania spp Reservatórios de Leishmania Epidemiologia Leishmanioses Aspectos Laboratorias Detecção e isolamento de Leishmania spp Meio de cultura Criopreservação de Leishmania spp Objetivos gerais Objetivos específicos Material e Métodos Origem das amostras incluídas no estudo Material biológico coletado dos cães incluídos no estudo sobre crescimento primário de Leishmania spp Amostras de referência de tripanossomatídeos incluídas no estudo sobre proliferação parasitária Animais de laboratório utilizados no estudo sobre infectividade de amostras biológicas criopreservadas Determinação do ph Meios de cultivo (formulações) Grupos experimentais Metodologia utilizada na inoculação de cepas de referência Identificação de Leishmania Extração de DNA 63 15
16 3.8.2 Iniciadores Reação em cadeia da polimerase Eletroforese em gel de agarose Análise dos resultados Resultados Resultados da Reaçção em cadeia da polimerase Morfologia de cepas de referência em meio de cultura TGGY-1 com diferentes suplementos Morfologia de cepas de referência nos meios de cultura líquidos TGGY-1 e TGGY-2 com diferentes suplementos Morfologia de cepas de referência em meio de cultura BAB- BHI-UHEF suplementos Discussão Meios de cultivo acelular utilizados nos experimentos de crescimento primário e proliferação de tripanossomatídeos Avaliação da eficiência da criopreservação Análise dos resultados da PCR Análise Morfológica Conclusão 123 Referências Bibliográficas 125 Anexo Anexo
17 1. INTRODUÇÃO A leishmaniose é uma protozoose causada por hemoflagelados parasitas pertencentes ao gênero Leishmania (Badaró & Reed, 2001). Esse protozoário é digenético, com seu ciclo biológico realizado em dois hospedeiros, um vertebrado e outro invertebrado, apresentando morfologias típicas para cada hospedeiro. No hospedeiro vertebrado infectado, Leishmania é encontrada sob a forma amastigota no interior de células do sistema retículo endotelial. No trato alimentar do inseto vetor, hospedeiro invertebrado, são encontradas as formas extracelulares paramastigotas e promastigotas. As formas amastigotas (Figura 01) e promastigotas (Figura 02) podem ser cultivadas in vitro, mas as promastigotas são aquelas mais usualmente cultivadas (Taylor & Baker, 1987). No gênero Leishmania estão incluídas mais de 30 espécies, das quais, ao menos, 20 são incriminadas como agentes causais de leishmaniose. Nos seres humanos as leishmanioses caracterizam-se por manifestações clínicas que podem variar desde lesões cutâneas ou mucocutâneas, até a forma visceral, na dependência da interação do complexo imunológico do hospedeiro e da espécie envolvida (Gallego, 2004). Os parasitas do gênero Leishmania podem ser agrupados como dermotrópicos, incluindo as espécies que causam as formas cutâneas, mucocutâneas, disseminada e difusa; e espécies viscerotrópicas que causam a forma visceral que atinge principalmente baço, fígado, medula óssea e linfonodos (Degrave et al, 1994). 17
18 Figura 1 Formas amastigotas intracelulares Figura 2 Formas promastigotas em meio de cultura acelular 18
19 1.1 Agente etiológico Os protozoários do gênero Leishmania (Ross, 1903) são classificados como parasitas pertencentes ao Sub-filo Mastigophora (Desing, 1866), Classe Zoomastigophorea (Calkins, 1909), Ordem Kinetoplastida (Honigberg, 1963, emend. Vickerman, 1976), Sub-ordem Trypanosomatina (Kent, 1880), Família Trypanosomatidae (Doflein, 1901, emend. Grobben, 1905). São pleomórficos, adotando vários estágios no decorrer do seu ciclo de vida; diferindo na forma, localização do cinetoplasto e na extensão do flagelo. De acordo com o comportamento no tubo digestivo do vetor, Lainson e Shaw (1979), apresentaram uma proposta de classificação para Leishmania com a divisão em três categorias: - a. Suprapilária, em que as formas promastigotas desenvolvemse no trato digestivo na parte anterior ao piloro; - b. Peripilária, com o desenvolvimento das promastigotas no intestino médio abdominal e região pilórica; - c. Hipopilária, com o desenvolvimento das promastigotas na porção posterior ao piloro. Lainson e Shaw, em 1987, classificaram as leishmanias em dois subgêneros, Viannia com o desenvolvimento parasitário na região peripilária e Leishmania com o desenvolvimento na região suprapilária. No Novo Mundo o gênero Leishmania está presente com representantes dos dois grupos taxonômicos: (1) Sub-gênero Viannia e (2) Sub-gênero Leishmania. Tabela 1: Principais agentes etiológicos e distribuição geográfica das leishmanioses no Novo Mundo*. 19
20 Espécies de Leishmania L.(Viannia) braziliensis Distribuição geográfica América Central e do Sul até o norte da Argentina L. (V.) peruviana Altos vales andinos e encosta ocidental dos Andes L. (V.) guyanensis Noroeste e Norte da América do Sul até o rio Amazonas L. (V.) panamensis América Central e costa pacífica da América do Sul L. (V.) lainsoni Norte do Estado do Pará L. (V.) shawi Região Amazônica L. (V.) naiffi Região Amazônica L. (V.) colombiensis Colômbia Panamá e Venezuela L.(Leishmania) mexicana México e América Central L. (L.) amazonensis América Central e norte nordeste e sul do Brasil L. (L.) pifanoi Venezuela L. (L.) venezuelensis Venezuela L. (L.) garnhami Andes Venezuelanos L. (L.) infantum = L.(L.) chagasi Sul do México ao Norte da Argentina, com predominância no Nordeste Brasileiro * A partir de Marzochi et al., Espécies como L. (V.) equatoriensis, L (L.). hertigi, L.( L.) deanei, L. (L.)aristedesi,e L. forattini, foram descritas, na América do Sul, apenas em animais silvestres. Uma nova espécie, recentemente descrita, foi L. (V.) lindenbergi isolada de soldados por ocasião de um surto de leishmaniose no Estado do Pará, Brasil (Silveira et al.,2002). 20
21 1.2 Transmissores / Vetores de Leishmania Os flebotomíneos incriminados na transmissão das leishmanioses são artrópodes da Classe Insecta, Ordem Díptera, Família Psychodidae, Subfamília Phlebotominae, Gênero Phlebotomus (Velho Mundo) e Lutzomyia (Novo Mundo) com vasta distribuição nos climas quentes e temperados. Os flebotomíneos são insetos holometábolos, cujas formas jovens ovos, larvas e pupas vivem, na natureza, em ambiente úmido, rico em matéria orgânica de onde obtém abrigo e alimento (Taniguchi, 2000). Estes insetos têm hábito crepuscular e pós-crepuscular, abrigando-se durante o dia em lugares úmidos e protegidos (Cardoso, 2003). Em relação aos adultos, somente as fêmeas são hematófagas, sendo que algumas espécies apresentam acentuada antropofilia e domiciliação, o que as tornam epidemiologicamente importantes na transmissão de doenças (Taniguchi, 2000). Cada fêmea pode produzir entre 40 e 70 ovos, que permanecerão aderidos ao substrato graças à substância produzida pelas glândulas acessórias. O período de incubação é de aproximadamente uma semana sob condições ótimas de temperatura, entre 25ºC e 27ºC, e elevada umidade relativa do ar. Na ausência de umidade os ovos não resistem por 48 horas (Rodas, 2006). De acordo com a região geográfica em que se encontram os flebotomíneos são popularmente chamados de birigui, mosquito palha, cangalhinha, etc (Taniguchi, 2000). Os flebotomíneos têm o poder de adaptação a ambientes modificados pela ação do homem tendo sido encontrado cerca de doze espécies diferentes dentro das casas e no peridomicílio (Rodas, 2006). 21
22 Dentre as características incriminadoras de uma dada espécie de flebotomíneo como transmissor de Leishmania para o homem, Killick- Kendrick & Wad, 1981, destacam: - Considerável grau de antropofilia; - Distribuição espacial dos flebotomíneos coincidente com a distribuição de casos humanos de leishmaniose; - Os exemplares encontrados, naturalmente infectados, devem apresentar a mesma espécie de Leishmania encontrada nos casos humanos naquela região geográfica; - Deve ser possível reproduzir em laboratório todas as etapas de desenvolvimento parasitário nessa espécie de flebotomíneo; - Essa espécie de flebotomíneo, experimentalmente infectado pelo mesmo agente encontrado nos casos humanos, deve ser capaz de transmitir, também, experimentalmente, essa Leishmania através da picada. De maneira geral, pode-se apontar que somente os gêneros Phlebotomus, para o Velho Mundo, e Lutzomyia, para o Novo Mundo, incluem espécies de flebotomíneos incriminados como vetores de Leishmania, por preencherem todos ou quase todos os critérios e características acima relacionados. A distribuição geográfica desses dípteros da subfamilia Phlebotominae é bastante ampla, são predominantes nas regiões tropicais e subtropicais, onde o índice pluviométrico anual alcança nível superior a mm (Taniguchi, 2000). 22
23 Na área urbana do município de Araçatuba, e em mais de 34 municípios da região oeste do Estado de São Paulo, Lutzomyia longipalpis tem sido apontada como a única espécie vetora da Leishmaniose Visceral Americana (LVA), sendo encontrada no peridomicílio e no intradomicílio das áreas urbanas desses municípios (Rodas, 2006). No Brasil, duas espécies de flebotomíneos são incriminadas com a transmissão da LVA: L. longipalpis e L. cruzi. Esta última espécie foi identificada como transmissora de L.(L.) chagasi em algumas regiões no Estado do Mato Grosso do Sul. Lu. longipalpis apresenta ampla distribuição nas quatro regiões geográficas do País: Nordeste, Norte, Sudeste e Centro- Oeste (Ministério da Saúde, 2003). Quanto a LTA, no Brasil, é transmitida por diferentes espécies de flebotomíneos: - L. whitmani, L. wellcomei e L. intermedia: responsáveis pela transmissão de L. (Viannia) braziliensis, espécie mais prevalente em regiões endêmicas para a Leishmaniose Tegumentar Americana (LTA); - L. umbratilis, L. anduzei e L. whitmani: principais transmissores de L. (V.) guyanensis; - L. squamiventris, L. paraensis e L. ayrozai: principais vetores de L. (V.) naiffi; - L. whitmani: principal vetor de L. (V.) shawi; - L. ubiquitalis: vetor de L. (V.) lainsoni e, - L flaviscutellata e L. olmeca: responsáveis pela transmissão de L. (Leishmania) amazonensis (Rodas, 2006). A morfologia, a fisiologia, a bioquímica e o metabolismo de Leishmania refletem os hábitos e necessidades dos estágios de desenvolvimento nos diferentes hospedeiros (vertebrado ou invertebrado). 23
24 1.3 Ciclo biológico da leishmania A leishmaniose é transmitida pela picada da fêmea do inseto flebotomíneo, que injeta formas promastigotas durante o respasto sanguíneo em mamíferos. As formas promastigotas são fagocitadas por macrófagos, e no seu interior transformam-se em formas amastigotas que se multiplicam. As fêmeas dos flebotomíneos tornam-se infectadas quando realizam o repasto sangüíneo em hospedeiros infectados ingerindo macrófagos com amastigotas. No intestino dos flebotomíneos, amastigotas diferenciam-se em promastigotas, multiplicam-se e migram para a probóscide do inseto reiniciando o ciclo. A manifestação clínica da doença depende da espécie de Leishmania envolvida. Figura 3 Ciclo biológico de Leishmania - Fonte: CDC 24
25 1.4 Reservatórios de Leishmania Para ser considerado reservatório de Leishmania, o hospedeiro deve ter vida longa e estar presente em grande quantidade na área de transmissão, constituindo uma fonte constante de alimentação para o inseto vetor. Além disso, deve estar parasitado e estar próximo ao inseto transmissor, facilitando a veiculação do agente entre os hospedeiros reservatórios. De maneira geral, dá-se o nome de reservatório natural, ou fonte de infecção, a todo animal que infectado por um determinado agente etiológico o torne passível de veiculação a outros seres vivos. Todavia, essa definição não é completa, nem é consensualmente aceita. Os conhecimentos atuais sobre as leishmanioses indicam serem estas moléstias essencialmente zoonóticas, pois ocorrem na natureza entre populações de animais silvestres. Os protozoários do gênero Leishmania possuem uma vasta escala de hospedeiros, não sendo regra a estabilidade na relação entre o parasita e o hospedeiro. O termo reservatório natural tem sido usado para explicar diferentes situações, assim é, que muitos autores têm chamado de reservatório de Leishmania qualquer animal (hospedeiro vertebrado) que venha a ser encontrado naturalmente infectado. Um reservatório natural de Leishmania deve ser aquele no qual o parasita encontre condições para ser mantido, indefinidamente, em um ciclo ecológico com a participação de uma ou algumas espécies de vetores com os quais mantenha um relacionamento permanente, garantindo, assim, a perpetuação do protozoário como espécie (Ashford & Bettini, 1987; Shaw & Lainson, 1987). 25
26 Dentre os fatores necessários para o sucesso de um hospedeiro vertebrado como reservatório natural de Leishmania podemos destacar (Falqueto, 1995, Tolezano, 2000): - Necessidade de relação com o parasita: para isto é necessário que o animal mantenha algum contato com o flebotomíneo vetor, pois se os hábitos do vetor e do suspeito candidato a reservatório não tiverem alguma concordância a transmissão jamais ocorrerá. Como conseqüência desta observação, fica claro que a ausência de infecção natural em uma determinada espécie vertebrada, por alguma espécie de Leishmania, não necessariamente indicará resistência natural deste animal a esta Leishmania; - Uma vez infectado, o hospedeiro vertebrado deverá propiciar condições para que, nesta interação parasita-hospedeiro, seja possível a manutenção do parasita; ou seja, possibilitar sua permanência no ambiente natural; Desta forma poderemos entender que apenas poucas espécies de hospedeiros vertebrados poderão de fato preencher esta condição, devendo as demais espécies ser colocadas na condição de hospedeiros ocasionais ou acidentais (Tolezano,2000). Muitas vezes, a descrição de encontro de infecção natural por Leishmania em animais silvestres constitui-se em achado isolado, sem uma maior compreensão dos demais aspectos epidemiológicos. Nesta mesma condição, existem regiões onde o registro da doença no homem constitui o único dado indicador de presença da zoonose (Falqueto, 1995). De maneira geral, espera-se de um animal identificado como reservatório natural de Leishmania, que ele represente uma fonte permanente de infecção, e que, uma proporção considerável de seus 26
27 membros presentes em áreas endêmicas, seja encontrado infectado ao menos em parte de sua existência (Ashford & Bettini, 1987). Os reservatórios primários são os mamíferos, responsáveis pela manutenção da infecção no ambiente silvestre e peridomiciliar, mas geralmente não se constituem na fonte de infecção para os insetos que transmitem o agente para o homem (Pinto, 2004). Os animais considerados reservatórios secundários são aqueles que adquirem a infecção, mas são incapazes de manter o ciclo enzoótico indefinidamente (Pinto, 2004). As várias espécies de Leishmania ocorrem em uma grande variedade de mamíferos silvestres e domésticos como roedores, canídeos, marsupiais, edentados, procionídeos, ungulados, morcegos e primatas, incluindo o homem, diferindo nestes particularmente quanto à patogenicidade e infectividade (Pinto, 2004). No Brasil há registros da presença tanto de reservatórios silvestres como domésticos, sendo alguns específicos de determinadas regiões, para várias espécies causadoras da leishmaniose tegumentar americana (LTA) e da leishmaniose visceral americana (LVA). No ciclo silvestre e rural os canídeos, como a raposa Dusicyon vetulus (= Lycalopex vetulus), são os principais reservatórios de L.(L.) chagasi, especialmente no nordeste do Brasil (Deane e Deane, 1956; Alencar, 1961) e outra espécie de raposa, Cerdocyon thous, no Estado do Pará (Lainson e Shaw, 1971; Silveira et al., 1982), no Estado de Mato Grosso do Sul, em Corumbá (Mello et al., 1988). Esta última espécie também já foi encontrada naturalmente infectada em Araçatuba, no Estado de São Paulo (Tolezano,et al., 1999). 27
28 Os gambás também foram apontados como reservatórios do parasita no Estado da Bahia, onde Sherlock e colaboradores (1984) isolaram Leishmania de Didelphis albiventris; Travi et al.(1994), na Colômbia, identificaram Didelphis marsupialis como importante elo na cadeia epidemiológica da doença. O fato destes animais apresentarem hábitos sinantrópicos poderia explicar a ligação entre os ciclos silvestre e doméstico. No entanto, para se determinar a sua atuação na manutenção da transmissão da LV, são necessários estudos mais aprofundados (Gontijo e Melo, 2004). Tanto no Brasil como nas Américas o cão Canis familiaris - é considerado o principal reservatório doméstico da L. (L) chagasi no ciclo rural e, especialmente no ciclo urbano da LVA, traduzindo-se em destacada importância epidemiológica, principalmente pela proximidade de relacionamento com o homem e a dispersão da doença (Camargo-Neves, 2004 e Rodas, 2006). Como reservatório doméstico o cão é identificado como o principal hospedeiro em áreas rurais próximas aos centros urbanos, exercendo o papel de fonte de infecção para os vetores, sendo um dos alvos nas estratégias de controle (Arias et al., 1996; Lainson e Shaw, 1987 b). Na leishmaniose visceral, os cães muitas vezes são infectados a partir de um reservatório silvestre, como a raposa. Após a inoculação de Leishmania, em cães susceptíveis, esta se dissemina por todo organismo com posterior desenvolvimento dos sintomas (Coordenadoria de Controle de Doenças, 2006). A alta patogenicidade pode levar os cães doentes a óbito (Pinto, 2004). Para a L.(V.) braziliensis, os principais reservatórios silvestres são os pequenos roedores e marsupiais (Pinto, 2004). A infecção de cães e 28
29 eqüinos é freqüente em regiões consideradas endêmicas para LTA (Pinto, 2004). 1.5 Epidemiologia A leishmaniose é uma das principais doenças infecciosas que afetam regiões pobres do mundo. São cerca de dois milhões de novos casos a cada ano em 88 países onde a doença é endêmica (Davies, 2003). As leishmanioses apresentam distribuição cosmopolita, encontradas nos cinco continentes. São endêmicas nas regiões tropicais e subtropicais, estimando-se 12 milhões de casos no mundo, com distribuição geográfica limitada pelas áreas de distribuição natural do vetor (Sundar, 2002). A forma cutânea é a mais comum representando cerca de 50 a 75% de todos os novos casos (Sundar, 2002). No Estado de São Paulo, Brasil, há registros de surtos esporádicos de LTA em áreas consideradas endêmicas, como o Vale do Ribeira (Pinto, 2004). Devido à capacidade de assumirem diversas formas de evolução clínica como lesões desfigurantes e incapacitantes, que podem repercutir no estado psicossocial do indivíduo, as leishmanioses tegumentares assumem grande importância em saúde pública (Pinto, 2004). Nos últimos anos os casos de co-infecção Leishmania/HIV têm aumentado (Gállego, 2004). A co-infecção Leishmania/HIV é identificada como uma doença emergente, especialmente no sudeste da Europa, atingindo entre 25 e 70% dos adultos com AIDS. 29
30 O paciente HIV pode apresentar manifestação da LVA após infecção primária por Leishmania spp ou após reativação de infecção pregressa devido à imunodeficiência (Coordenadoria de Controle de Doenças, 2006). A presença de Leishmania fora do sistema reticuloendotelial, no sangue periférico, em pacientes infectados com HIV, torna tais pacientes em potenciais reservatórios ou fontes de infecção para os vetores. Já foi demonstrada a transmissão deste protozoário entre usuários de drogas intravenosas, particularmente em pacientes que apresentavam elevada parasitemia no sangue periférico (Sundar, 2002). Em algumas regiões do Mediterrâneo em que a leishmaniose estava controlada, desde a realização de campanhas de desinsetização para o controle da malária, ocorreu, nos últimos anos, um aumento de até 50% nos casos de leishmaniose visceral e coinfecção com HIV (Gállego, 2004). Existem diversos fatores que podem explicar a presença de casos de enfermidades parasitárias em locais em que eram ausentes. Esses fatores incluem a migração populacional, desflorestamento, construção de rodovias, a existência de conflitos causando a migração em massa da população afetada, condição sócio-econômica, desenvolvimento comercial, modificação do comportamento humano, mudanças ambientais decorrentes da atividade humana alterando temperatura, vegetação, precipitação pluviométrica, umidade relativa do ar, tipo de solo, grau e ph da água (Gállego, 2004). Tanto no Velho Mundo como no Novo Mundo, mamíferos silvestres e domésticos são apontados como reservatórios de várias espécies de Leishmania. 30
31 A LVA manifesta-se nas populações tropicais e subtropicais da América Latina sob forma endêmica. Os surtos são decorrentes da concomitância de diversas situações, tais como resposta imune precária por parte dos hospedeiros (Grimaldi e Tesh, 1993), condições ecoepidemiológicas favoráveis ao aumento da densidade de vetores infectados (Tesh e Papaevangelou, 1977). A LVA é uma infecção zoonótica que afeta animais e o homem. Inicialmente, era uma doença de ambientes silvestres ou rurais, e atualmente muitos casos já ocorrem em centros urbanos, em áreas residenciais. Entre esses animais, especial destaque tem sido atribuído ao cão, em conseqüência de sua proximidade com o homem. O cão doméstico já foi encontrado naturalmente parasitado por: L. (L.) infantum, principalmente nos países do Mediterrâneo e Oriente Médio; L. (L) tropica e L. (L.) donovani no Velho Mundo; L.(L) chagasi, L.(V) braziliensis, L.(V) panamensis, L.(L) mexicana e L. (V) peruviana no Novo Mundo (Gállego, 2004 e Neogy et al., 1992). Apesar destes achados, aos cães tem sido definida ou suspeitada importância epidemiológica na cadeia de transmissão de L. (L.) infantum, L.(L) chagasi, L.(V) braziliensis e L. (V) peruviana (Gállego, 2004 e Neogy et al., 1992). No caso da LVA, quando o cão apresenta-se infectado, a regra é a constatação de um parasitismo cutâneo intenso, tornando-o uma excelente fonte de infecção para os flebotomíneos vetores. Como principal reservatório de L.(L) chagasi, o cão pode albergar esse agente e não apresentar manifestações clínicas (Neogy et al., 1992). 31
32 No Brasil o Ministério da Saúde (2003), preconiza que todo cão proveniente de área endêmica ou onde esteja ocorrendo surto de Leishmaniose Visceral canina (LVc), com manifestações clínicas como febre, apatia, emagrecimento, descamação furfurácea e úlceras na pele, conjuntivite, paresia do trem posterior, fezes sanguinolentas e unhas longas, sejam definidos como caso suspeito. Para que um cão identificado como caso suspeito possa ser classificado como caso confirmado, deverá apresentar manifestações clínicas compatíveis com LVc, e também testes sorológicos reagentes e/ou exame parasitológico positivo (Ministério da Saúde, 2003). Na América Latina, a doença já foi descrita em pelo menos 12 países sendo que 90% dos casos ocorrem no Brasil, especialmente na região Nordeste. O primeiro registro da doença no Brasil data de 1913, quando foi descrito o primeiro caso, a partir de necropsia de paciente oriundo de Boa Esperança, Mato Grosso. Posteriormente, em 1934 em um estudo para o diagnóstico e a distribuição da febre amarela no Brasil, 41 casos de LV foram identificados em lâminas de viscerotomias praticadas post-mortem, em indivíduos provenientes das Regiões Norte e Nordeste. A doença, desde então, vem sendo descrita em vários municípios, de todas as regiões do Brasil, com exceção da Região Sul. No Brasil, a LVA está registrada em 19 dos 26 estados com aproximadamente municípios apresentando transmissão autóctone. Deve ser salientado que no período compreendido entre 1980 e 2005, foram confirmados casos, sendo que a região Nordeste contribuiu com (82,33%) casos dessa totalidade e as regiões Norte, Sudeste e Centro Oeste com (7,03%), (7,60%), (3,04%), respectivamente (Ministério da Saúde, 2006). 32
33 Segundo o Ministério da Saúde (2003) de 1984 a 2002, foram notificados casos de leishmaniose visceral americana com maior incidência nos estados da Bahia, Ceará, Maranhão e Piauí. A leishmaniose visceral, no Brasil, que inicialmente apresentava características de uma endemia rural, vem se expandindo para as áreas urbanas de médio e grande porte (Ministério da Saúde, 2003). Para os últimos dez anos, observa-se uma verdadeira periurbanização e urbanização da leishmaniose visceral, com surtos ocorridos em centros urbanos dos municípios do: Rio de Janeiro (RJ), Belo Horizonte (MG), Araçatuba (SP), Santarém (PA), Corumbá (MS), Teresina (PI), Natal (RN), São Luís (MA), Fortaleza (CE), Camaçari (BA) e recentemente epidemias ocorridas em Três Lagoas (MS), Campo Grande (MS) e Palmas (TO) (Ministério da Saúde, 2003). 1.6 As Leishmanioses Os parasitas do gênero Leishmania, transmitidos ao homem por insetos flebotomíneos nas regiões quentes do Velho e do Novo Mundo, causam infecções denominadas leishmanioses, afetando em particular o sistema fagocítico mononuclear (Rey, 2002). Em geral, as leishmanioses são reconhecidas como zoonoses acometendo o homem quando este entra em contato com o ciclo de transmissão do parasito. Atualmente as leishmanioses encontram-se entre as seis endemias consideradas de maior importância no mundo (Ministério da Saúde, 2003). 33
34 A doença já foi descrita em pelo menos 12 países da América Latina, com 90% dos casos registrados no Brasil, especialmente na região Nordeste (Ministério da Saúde, 2003). As leishmanioses podem permanecer clinicamente inaparentes por meses, ou mesmo anos, dependendo da resistência do hospedeiro. Os sinais clínicos variam muito, sendo muitas vezes inespecíficos; o que faz com que a leishmaniose possa ser confundida com outras doenças infectocontagiosas como dermatopatias, doenças mielo e linfoproliferativas, desordens endócrinas e lupus eritematoso sistêmico (Pinto, 2004). As leishmanias são responsáveis por elevada morbidade em todo o mundo. Quando há um parasitismo duradouro, geralmente se observa uma relação equilibrada entre o parasito e o hospedeiro, com sinais clínicos isolados ou totalmente ausentes (Pinto, 2004). A evolução clínica das leishmanioses, no hospedeiro humano, depende de alguns fatores, como: a espécie de Leishmania envolvida, a relação parasita-hospedeiro e o estado imunológico do hospedeiro. As leishmanioses apresentam características clínicas e epidemiológicas diferentes em cada área geográfica, sendo consideradas doenças distintas, podendo ser reunidas em quatro grupos: leishmaniose cutânea, leishmaniose mucocutânea ou cutâneo-mucosa, leishmaniose visceral ou calazar e leishmaniose cutâneo-difusa (Rey, 2002). Na leishmaniose cutânea em sua forma clássica observa-se a ocorrência de lesões ulcerativas limitadas ao local próximo da picada do inseto vetor, com lesões exclusivamente na pele (Pinto, 2004) Após um período de incubação, que pode variar de 10 dias a três meses, surge a lesão papulo-eritematosa que progride lentamente para a 34
35 formação nodular. São freqüentes as lesões denominadas clássicas, que têm características ulcerativas com bordas elevadas, endurecidas e com fundo composto por tecido de granulação grosseira presentes nas áreas corpóreas descobertas. Na maioria dos casos, a infecção evolui e, após o período de incubação, surgem as lesões cutâneas e/ou mucosas devido à disseminação hematogenica e/ou linfática do parasita (Tolezano, 2000; Pinto, 2004). Na leishmaniose cutâneo-mucosa, também denominada espúndia, há lesões severas em diversos locais, devido à disseminação metastática, com destruição de mucosas. Ocorre devido à infecção por L. (V.) braziliensis e estabelece um quadro clínico de difícil tratamento e prognóstico reservado quanto à possibilidade de cura. O acometimento mucoso pode surgir paralelamente à evolução das lesões cutâneas ou muito tempo após a cicatrização das mesmas. No homem, as lesões mucosas podem ser da forma úlceroinfiltrante, poliposa ou telebrante, que acometem, geralmente, a mucosa nasal com comprometimento do septo e, secundariamente, a mucosa oral. De qualquer forma, o risco de surgirem deformidades permanentes é alto. O comprometimento de outros tecidos, como o ósseo, é raro, e quando ocorre é devido à continuidade das lesões dérmicas ou mucosas (Rodriguez et al., 1988). A leishmaniose tegumentar pode ainda apresentar-se sob a forma disseminada, não-ulcerosa, que se apresentam em indivíduos anérgicos, ou que aparecem após o tratamento em pacientes com calazar (Rey, 2002). Estas manifestações clínicas dependem de fatores como: a espécie de Leishmania envolvida e a relação do parasita com seu hospedeiro. A LTA apresenta um amplo espectro de lesões, o que muitas vezes desfavorece o diagnóstico clínico imediato, tanto no homem quanto em animais (Pinto, 2004). 35
36 Na leishmaniose cutânea difusa (LCD), forma menos observada de leishmaniose tegumentar, verifica-se a formação de lesões nodulares e infiltrações cutâneas exuberantes, mimetizando o quadro de hanseníase. Tais lesões são de difícil cicatrização e resistentes ao tratamento medicamentoso (Pinto, 2004). A leishmaniose visceral é a forma mais severa da doença, podendo levar o paciente a óbito se não for tratada corretamente. Os sintomas, em geral, iniciam-se após um período de incubação que varia de um a cinco meses (Cardoso, 2003). Quanto à manifestação clínica no curso da infecção por L. (L.) chagasi, pode ser constatada a completa ausência de sinais e sintomas nos casos classificados como assintomáticos, manifestações clínicas discretas, denominadas de oligossintomáticas, e moderadas a graves nos sintomáticos (Ministério da Saúde, 2003). Os sintomas geralmente se iniciam com febre irregular, hemorragia gengival, sudorese, anorexia, fraqueza, emagrecimento, aumento do volume abdominal. Em casos em que há o avanço da doença observa-se esplenomegalia, hepatomegalia, linfoadenopatia e anemia (Cardoso, 2003). Nas Américas, a leishmaniose visceral é também denominada leishmaniose visceral americana (LVA) ou calazar, mesmo apesar do termo calazar significar pele negra e essa alteração ser somente observada em pacientes com LV do tipo indiano. No Brasil, as principais espécies de Leishmania responsáveis pela LTA são: L. (V) braziliensis, L. (V) guyanensis, L. (V) lainsoni, L. (V) naiffi, L. (V) shawi, L. (V) lindenbergi e L. (L) amazonensis. O agente etiológico L. (L) chagasi é responsável pela forma visceral nas Américas (Rodas, 2006) 36
37 1.7 Aspectos laboratoriais Leishmaniose Visceral A leishmaniose visceral é uma doença de notificação compulsória com características clínicas de evolução grave devendo ser diagnosticada de forma precisa e o mais precocemente possível com a confirmação parasitológica da doença precedendo o tratamento (Portaria 1100/96. do Ministério da Saúde DOU 29/05/96). Quando o diagnóstico sorológico e/ou parasitológico não for possível ou o resultado obtiver demora em sua liberação, o tratamento deverá ser iniciado (Ministério da Saúde, 2003). Em todas as áreas onde há transmissão ou risco de transmissão, as rotinas de diagnóstico, tratamento e acompanhamento dos pacientes necessitam ser implantadas e/ou implementadas (Ministério da Saúde, 2003). O diagnóstico pode ser feito por critérios clínicos e laboratoriais. Os critérios clínicos baseiam-se em sinais, sintomas inespecíficos e origem geográfica, que na maioria das vezes devem ser confirmados pelo diagnóstico laboratorial com a demonstração do parasita ou a detecção de anticorpos. Diagnóstico laboratorial O diagnóstico apresenta inúmeras limitações e não existe um método ideal, sendo a coloração de amostras em lâminas, juntamente com a cultura acelular o método mais confiável na identificação do parasita. Os critérios de diagnóstico baseiam-se em manifestações clínicas; epidemiologia; testes parasitológicos como microscopia de esfregaços, 37
38 culturas axênicas de amostras de biópsias e aspirado de: medula óssea, linfonodo, baço e fígado; testes de hipersensibilidade tardia (Reação Intradérmica de Montenegro); análise histopatológica marcada com corante comum ou com imunoperoxidase (Degrave et al, 1994). Dentre os materiais utilizados para o diagnóstico do parasita, o mais sensível é o aspirado de baço com 98% de resultados positivos, mas apresenta risco fatal de hemorragia em mãos inexperientes (Sundar, 2002; Davies, 2003). O diagnóstico laboratorial pode ser dividido em: a) Método Parasitológico - Demonstração direta do parasita: é o método de escolha. Os materiais utilizados são aspirados de baço, medula óssea, linfonodos, biópsia de fígado e creme leucocitário, em que se pode encontrar formas amastigotas por diversos métodos de coloração como o Giemsa, Leishmann e Wright (Badaró & Reed, 2002). A sensibilidade do esfregaço de medula óssea é cerca de 60 a 85%. Em cães também são utilizados punção de gânglios ou biópsia ou escarificação da pele (Camargo-Neves, 2004). Em pacientes portadores de coinfecção HIV/leishmania o exame de punção de medula óssea é o mais recomendado (Badaró & Reed, 2002); - Demonstração do parasita em imprint citológico sobre lâmina de microscopia fixada e corada com Giemsa. Os materiais utilizados são baço, fígado, linfonodo (Sundar, 2002); - Demonstração do parasita de tecido de baço, fígado, linfonodo em histologia com coloração de hematoxilina e eosina. A 38
39 sensibilidade do teste pode ser aumentada com uso de anticorpos marcados com substâncias fluorescentes como isotiocianto de fluoresceína ou isotiocianto B-rodamina contra os receptores de superfície do parasita. Anticorpo monoclonal conjugado com substância fluorescente também é usado (Sundar, 2002); - Demonstração do parasita em biópsia de lesão pela coloração com imunoperoxidase utilizando conjugado anti-leishmania marcado com peroxidase. Facilita a visualização dos parasitas (Badaró & Reed, 2001); - Isolamento em cultivo in vitro. A amostra deve ser inoculada diretamente em meios de cultivo apropriados que podem ser monofásico, bifásico ou em meio líquido. Quando se inocula material proveniente do baço e medula óssea, a positividade é bastante elevada, cerca de 80% (Badaró & Reed, 2001), e - Isolamento em cultivo in vivo. A amostra é inoculada intraperitonealmente em animais susceptíveis como o hamster dourado, camundongo ou cobaia. O isolamento de cepas pode ser realizado após seis meses de inoculação quando geralmente o animal apresenta evidências de sinais sugestivos de infecção. Este método, geralmente, não tem sido utilizado na rotina devido à demora no resultado (Sundar, 2002). b) Método Imunológico As técnicas imunológicas são empregadas como auxiliares no diagnóstico da leishmaniose visceral detectando anticorpos específicos no sangue ou no soro de indivíduos ou de cães infectados. Utilizam antígenos 39
40 em extratos solúveis ou o parasito inteiro de Leishmania spp., podendo apresentar reações cruzadas com várias espécies de tripanosomatídeos (Carmargo-Neves, 2004). Os métodos imunológicos podem ser divididos em: 1) Teste intradérmico Avalia a hipersensibilidade tardia de pacientes com leishmaniose. É um método simples e bastante útil na leishmaniose tegumentar. Neste método 0,5 ml de parasita total morto em fenol é injetado no braço do paciente. Depois de 48 a 72 horas, mede-se o tamanho da enduração (a partir de 5 mm considera-se positivo), porém não há avaliação do reagente leishmanina. Na leishmaniose visceral a resposta é quase sempre negativa na fase aguda da doença e permanece negativa em média até 12 meses após o tratamento. É positivo somente em casos onde houve a cura do calazar (Sundar, 2002). 2) Detecção de antígeno: método usado no diagnóstico de pacientes com deficiência de produção de anticorpos. Teste de aglutinação em latex (KATEX) antígeno de Leishmania na urina. Uma fração polipeptídica de Kda e 123 Kda é detectada na urina de paciente com calazar. Alto valor prognóstico, pois estes antígenos não foram detectados após três semanas de tratamento anti-calazar (Sundar, 2002). 3) Detecção de anticorpos: - DAT (Teste de Aglutinação Direta): usado na rotina diagnóstica em vários países. Consiste na aglutinação do soro do paciente com o antígeno fixado com formalina e 40
41 corado com Coomasie blue. Apresenta algumas desvantagens como a aplicação difícil em campo; fragilidade do antígeno; falta de câmara fria; variações de grupo a grupo no antígeno; não padronização da leitura do teste, limitado-o na aplicabilidade em regiões endêmicas (Sundar, 2002); - RIFI (Reação de Imunofluorescência Indireta). Esta técnica utiliza antígenos como formas promastigotas fixadas em lâminas ou amastigotas provenientes de fígado e baço de hamsters infectados. É considerada positiva com título igual ou superior a 1:32, porém pode apresentar reatividade cruzada com tripanossomíase, tuberculose e hanseníase. Títulos iguais ou superiores a 1:1024 são sugestivos no diagnóstico da leishmaniose visceral. Em pacientes com leishmaniose tegumentar os títulos são geralmetnte baixos <1:512 (Badaró & Rees, 2001); - ELISA com antígeno solúvel bruto (CSA). Apresenta reação cruzada com tripanossomíase, tuberculose e toxoplasmose. Quando massas antigênicas de 116 Kda, 72 Kda e 66 Kda são usadas, a especificidade é de 100% mais a sensibilidade é baixa 37,5% (Sundar, 2002); - ELISA com antígeno recombinante rk39 (região conservada do cinetoplasto de L.(L) donovani) altamente sensível e específica em LVA e leishmaniose dérmica pós calazar (PKDL) (Sundar, 2002); - Western blotting : esta técnica utiliza promastigotas lisadas de Leishmania donovani na fase log de crescimento, formando uma solução protéica que é colocada para correr em um gel de eletroforese. As proteínas separadas na membrana de nitrocelulose são testadas com o soro do 41
42 paciente. É um teste de elevado custo e que consome tempo, podendo ocorrer reação cruzada (Sundar, 2002); - Teste Imunocromatográfico: o Strip teste baseia-se em diagnóstico rápido com antígeno recombinante imobilizado em uma pequena tira de membrana de nitrocelulose, formando uma banda na presença de soro ou sangue positivo e uma gota de anti-proteína A conjugada com ouro coloidal (controle da reação) formando outra banda. Este teste apresenta sensibilidade desde de 67% a 100%, provavelmente devido às diferenças na resposta a anticorpos, observadas em diferentes grupos étnicos. O IgG anti-rk39 pode estar presente no soro por um extenso período pós-tratamento não podendo ser usado como valor prognóstico (Sundar, 2002). O paciente com leishmaniose visceral, devido a ativação policlonal de células B, produz hipergamaglobulinemia com elevação de níveis no soro de IgG e IgM contra várias proteínas não específicas e haptenos podendo simplificar o diagnóstico (Sundar, 2002). A sensibilidade dos testes sorológicos depende da metodologia empregada, e a especificidade depende do antígeno ou epítopo, usados para estimular a produção destes anticorpos; incluindo anticorpos de grupo, gênero e espécies-específico, e do procedimento sorológico usado (Sundar, 2002). Os testes baseados em detecção de anticorpos não podem ser usados como valor prognóstico, pois podem continuar com resultado positivo por longo tempo após a cura (Sundar, 2002). 42
43 Em indivíduos sem manifestações clínicas aparentemente provenientes de áreas endêmicas, onde há evidência epidemiológica e imunológica da infecção, o diagnóstico é feito através da coleta de sangue para exames sorológicos como Imunofluorescência Indireta (IFI), Enzyme Linked Immunosordent Assay (ELISA) ou através da intradermorreação de Montenegro reativa; porém os títulos de anticorpos geralmente são baixos e podem permanecer positivos por anos, bem como pacientes com cura clínica e com leishmaniose tegumentar podem apresentar reatividade positiva em exames sorológicos e na intradermorreação de Montenegro (Ministério da Saúde, 2003). 3) Diagnóstico etiológico (Testes Moleculares) - Reação em Cadeia pela Polimerase (PCR): tem sido a técnica de escolha para a identificação etiológica dos agentes causais das leishmanioses. A PCR é uma técnica que propicia a amplificação in vitro de uma seqüência específica do DNA e contém, em geral, DNA da amostra com a seqüência alvo a ser amplificada, dois primers ou iniciadores que são complementares para a seqüência alvo do DNA, nucleotídeos e uma DNA polimerase termo-estável. Essa mistura é acondicionada em flaconetes e colocada em um termociclador onde são repetidos ciclos que com alternância de tempo e temperatura (denaturação, anelamento e extensão) resultarão na amplificação exponencial da seqüência alvo do DNA; - Hibridização de DNA: técnica que utiliza primers (oligonucleotídeos) para amplificar seqüências conservadas encontradas em minicírculos do KDNA de diferentes espécies de Leishmania. A sensibilidade e especificidade dependem do tipo de amostra: em aspirado de linfonodo e medula óssea é mais sensível que a microscopia; em sangue é de 70%; em 43
44 sangue total com primers espécie-específico é de 96%; em pele de pacientes com PKDL é de 93,8% (Sundar, 2002). Os procedimentos diagnósticos para os casos de co-infecção HIV- Leishmania são os mesmos utilizados para os pacientes imunocompetentes. Entretanto, na co-infecção pode-se também investigar a presença de formas amastigotas em diversas amostras biológicas, tais como: lavado broncoalveolar, fluído pleural e biópsias do trato gastrointestinal. Nessas situações, a sensibilidade dos testes imunológicos para detecção de anticorpos poderá ser baixa, sendo possível a utilização da PCR em sangue total como um bom teste diagnóstico (Sundar, 2002). Leishmaniose Tegumentar Americana A leishmaniose tegumentar americana é uma doença de notificação compulsória devendo ser diagnosticada de forma precisa e o mais precocemente possível com a confirmação parasitológica da doença para preceder o tratamento (Portaria 1100/96. do Ministério da Saúde DOU 29/05/96). Diagnóstico clínico sintomas. Presuntivo e incerto devido a inespecificidade de sinais e As lesões cutâneas ou mucosas devem ser examinadas quanto à sua característica e devem ser diferenciadas de outros quadros clínicos. No diagnóstico clínico das lesões cutâneas, devem ser excluídas as úlceras traumáticas, úlceras de estase, úlcera tropical, úlceras de membros inferiores por anemia falciforme, piodermites, 44
45 paracoccidioidomicose, esporotricose, cromomicose, neoplasias cutâneas, sífilis, tuberculose cutânea e hanseníase virchowiana (Ministério da Saúde, 2001). Nas lesões de mucosas, o diagnóstico diferencial deve ser feito com a paracoccidioidomicose, hanseníase virchowiana, rinoscleroma, bouba, sífilis terciária, granuloma médio facial e neoplasias (Ministério da Saúde, 2001). Durante o diagnóstico clínico do paciente, a epidemiologia é de extrema importância, devendo ser analisados a existência de casos de LTA na região, procedência de área endêmica, referência de cães ou eqüinos com lesões e residindo nas proximidades; inserção em áreas florestais. Em casos de lesões cutâneas, os dados epidemiológicos referidos devem ser recentes com média de dois meses. Quando se tratar de lesão mucosa é essencial buscar também a história de ulceração de pele de longa duração, além da existência de cicatriz e utilização de medicamentos para leishmaniose (Ministério da Saúde, 2001). Diagnóstico laboratorial Para o diagnóstico da LTA podem ser utilizados os mesmos métodos e técnicas laboratoriais acima citados para LVA. No exame parasitológico o material utilizado pode ser o fragmento de tecido obtido por biópsia ou por raspado da lesão e aspiração da borda da lesão após assepsia local. Adicionalmente o teste de hipersensibilidade tardia para leishmaniose tegumentar é bastante útil. Pacientes com comprometimento de mucosa geralmente apresentam reações com área extensa de hiperemia 45
46 podendo haver formação de flictema e mesmo necrose no local da enduração (Badaró & Reed, 2001). Considerando a diversidade de formas clínicas observadas nas leishmanioses, um dos principais problemas enfrentados tem sido o desenvolvimento de estratégias que viabilizem a identificação das espécies de parasitas responsáveis por essas formas. Em algumas situações já foi relatada a ocorrência de infecções mistas, com mais de uma espécie de Leishmania parasitando o mesmo hospedeiro, sendo essencial a identificação taxonômica para estudos epidemiológicos (Rodriguez et al, 1994). Além das contribuições para a epidemiologia e para o controle das leishmanioses, o diagnóstico etiológico ao nível subespecífico pode repercutir nas decisões sobre condutas terapêuticas. Sabe-se, por exemplo, que as úlceras causadas por L. (V) braziliensis são geralmente mais virulentas e respondem às drogas antimoniais pentavalentes, enquanto lesões por L.(L) mexicana tende a ser menos severas, com cura, muitas vezes, espontânea (Rodriguez et al, 1994). A infecção por L. (V) braziliensis pode recorrer como lesão mucocutânea destrutiva aparecendo meses ou anos após a cura da úlcera inicial. A técnica de PCR pode ser de grande valor para indicar nestes pacientes, portadores de úlceras contendo tal parasita, a estratégia de tratamento adequado com antimonial pentavalente, visando prevenir a recorrência da infecção como doença mucocutânea (Rodriguez et al, 1994). Quando lesões mucocutâneas estão presentes, o diagnóstico é dificultado pela baixa densidade parasitária em biópsias. A técnica de PCR, com alto grau de sensibilidade, pode ser especialmente importante para diagnosticar a doença nestas condições (Rodriguez et al, 1994). 46
47 1.8 Detecção e isolamento de Leishmania spp. Como o homem apresenta lesões de pele conspícuas quando infectado com parasitas das espécies L. (V.) braziliensis e L.(L) amazonensis, a detecção e isolamento destes organismos oferece poucos problemas, contudo é preciso prática e paciência em encontrar as escassas amastigotas típicas de muitas infecções por L. (V.) braziliensis. Em biópsias ou aspirados usados para impressão em lâmina, ou para cultivo in vitro, cuidados devem ser tomados para evitar a área central de lesões ulceradas, onde contaminantes bacterianos e fúngicos podem causar grande confusão na identificação dos esfregaços, podendo inibir o crescimento em cultura. Esfregaços bem corados são de máxima importância. O isolamento dos parasitas depende do cultivo in vitro da amostra em um meio adequado, ou a inoculação em animais de laboratório susceptíveis, em particular o hamster. Todavia estes métodos separadamente podem não demonstrar o parasita quando há multiplicação escassa ou não detectável, sendo recomendável a utilização dos dois métodos. Quando se pretende isolar protozoários do gênero Leishmania, responsáveis por causar a leishmaniose na forma cutânea ou mucocutânea, prioriza-se coletar aspirado de lesões de pele ou fragmentos de lesões de pele após assepsia local. Em pacientes suspeitos duas a três biópsias pequenas devem ser feitas, sendo uma para inoculação em hamster, uma para cultura e a outra para histologia. A impressão da biópsia em lâmina deve ser preparada da amostra extraída e corada pelo método padrão como o Giemsa que consiste em secar a lâmina com imprint em temperatura ambiente, fixar com álcool metílico absoluto e corar por aproximadamente 47
48 uma hora com Giemsa (duas gotas do corante em 1 ml de água destilada) (Lainson & Shaw, 1979). Na leishmaniose visceral, o método de diagnóstico de escolha é usualmente a cultura de medula óssea aspirada por punção do esterno, podendo-se coletar, aspirado de linfonodo, ou, mais raramente aspirado de baço, quando o objetivo for o isolamento do agente causal da parasitose (Taylor & Baker, 1987). Parte do material deve ser inoculado intraperitonealmente em hamster e outra parte deve-se preparar um esfregaço em lâmina. Os tecidos do baço ou fígado são os órgãos geralmente ricos em parasitas, porém a punção esplênica deve ser justificada devido aos riscos envolvidos (Lainson & Shaw, 1979). Nos hospedeiros não humanos de Leishmania, animais domésticos ou silvestres, o isolamento do parasita poderá ser obtido a partir de biópsias ou aspirados de lesões cutâneas ou mesmo após eutanásia, coletando fragmento ou aspirado de baço e/ou fígado, durante a necropsia (Lainson & Shaw, 1979) Meio de cultura Nos estudos sobre desenvolvimento e padronização de técnicas diagnósticas, identificação, classificação, análise bioquímica, análise molecular, biologia celular, insumos imunológicos e quimioterápicos, em que se pretende utilizar protozoários do gênero Leishmania, é condição fundamental o isolamento e proliferação, usualmente envolvendo o cultivo destes parasitas in vitro (Araújo et al, 2002). O isolamento de Leishmania pode ser feito por inoculação em meios de cultivo acelular, celular e em animal de laboratório como cultivo in vivo. 48
49 O método de cultura in vitro é o mais rápido e sensível caminho de isolamento de Leishmania, com os resultados usualmente obtidos de uma a três semanas. Tecnicamente apresenta algumas restrições, particularmente no campo, devido à contaminação bacteriana ou fúngica, que são extremamente prejudiciais para o crescimento de promastigotas de Leishmania. A contaminação pode ser controlada pela incorporação de baixas concentrações de antibióticos na fase líquida do meio (200 ųg/ml), ou pelo armazenamento de amostras em solução salina contendo antibiótico. A contaminação fúngica é o maior problema sendo muitas vezes impossível sua irradicação das culturas (Lainson & Shaw, 1979). O crescimento primário e o estabelecimento inicial de protozoários do gênero Leishmania em condições artificiais de cultivo constituem-se em etapas obrigatórias para o sucesso no isolamento de algumas espécies. Dentre as etapas importantes a serem seguidas, destacam-se: o método utilizado para obtenção de tecidos ou outras amostras biológicas contendo amastigotas a serem inoculadas, a coleta e preservação das amostras para o isolamento, a escolha do meio de cultura, a temperatura de incubação, uso de antibióticos e o tipo de tubo para a cultura (Taylor & Baker, 1987). O meio de cultura escolhido deve possibilitar a transformação eficiente de formas amastigotas para promastigotas viáveis e suportar a divisão das promastigotas (Taylor & Baker, 1987). O crescimento e divisão celulares necessitam de um ambiente adequado composto por elementos químicos e físicos ideais para o seu metabolismo. O meio de cultura contém uma mistura de nutrientes necessário ao crescimento celular. Na preparação de meios artificiais para o cultivo de microrganismos alguns componentes essenciais devem ser incluídos na sua 49
50 formulação básica como: substâncias orgânicas (carboidratos, proteínas, vitaminas) e substâncias inorgânicas (solução salina) (Taylor & Baker, 1987). Além da composição qualitativa, o meio de cultura artificial deve obedecer aos limites de cada componente suportável pelos microrganismos. Protozoários do gênero Leishmania são cultivados na forma promastigota ou mesmo amastigota em uma variedade de meios a temperaturas abaixo de 28ºC (Schuster & Sullivan, 2002, Taylor & Baker, 1987). Para o crescimento inicial de uma cepa de Leishmania em condições artificiais é indicada a adoção de meio bifásico com sangue, que é um componente essencial. O sangue de coelho é o de preferência devendo ser coletado com anticoagulante e inativado a 56ºC antes do seu uso, por conter substâncias que inibem o crescimento de Leishmania. O primeiro meio utilizado foi o NNN (Nicolle, Novy e Mac Neal) que é bifásico, com uma fase sólida com base de ágar e sangue de coelho desfibrinado e uma fase líquida de água destilada (Schuster & Sullivan, 2002). Os meios de culturas são divididos em três categorias: - Meios não definidos, em que seus componentes são desconhecidos; - Meios semi-definidos, em que seus componentes são conhecidos parcialmente; - Meios definidos, em que todos os seus componentes são definidos (Schuster & Sullivan, 2002). Também podem ser divididos em semi-sólido, bifásico e líquido. Enquanto os meios bifásicos e semi-sólidos necessitam de sangue, fator importante para a reprodução dos parasitas, o meio líquido requer soro fetal bovino ou lisado de eritrócito (Limoncu et al, 1997). 50
51 Em geral, os meios mais utilizados para o isolamento e crescimento das espécies de Leishmania sob a forma promastigota, contém uma fase sólida que é enriquecida com uma variedade de componentes orgânicos incluindo peptona, infusão de carne, glicose, triptose, extrato de fígado, infusão de cérebro de coração, aminoácidos individuais, nutrientes ou agar Tripticase de soja e sangue de coelho em uma concentração que varia de 2,5 a 50%. A fase líquida pode ser água de condensação formada na superfície do ágar ou solução de Locke s que contêm cloreto de sódio, cloreto de cálcio, cloreto de potássio, NaHCO 3, glicose e água destilada (Schuster & Sullivan, 2002). Diferentes formulações de meios para cultivo de Leishmania spp. são conhecidas. Os meios usados para o crescimento primário de formas promastigotas além do NNN (Nicolle s Novy e MacNeal s) são meios bifásicos como USMARU, Evan s modificado por Tobie s, todos eles utilizando uma base de ágar e sangue desfibrinado, e meios líquidos como o MEM (Minimum Essential Medium): soro fetal bovino: EBLB, HO-MEM (Schuster & Sullivan, 2002). Meios líquidos utilizados para o cultivo de células, como o meio de Schneider, formulado para o cultivo de células de Drosophila, Meio 199, MEM e RPMI 1640, têm sido empregados com adição de soro fetal bovino inativado, para alguns organismos mais exigentes quanto aos requisitos nutricionais, principalmente L.(V) braziliensis, ou L.(L) donovani (Schuster & Sullivan, 2002). A água de coco (Cocos nucifera) isoladamente, ou suplementada com substâncias químicas definidas como ácido fólico, hemina e aminoácidos ou ainda como suplemento de meios já utilizados na rotina como o NNN já foi testada em formulações para o isolamento de Leishmania spp (Schuster & Sullivan, 2002). 51
52 A eficiência da água de coco foi avaliada quando do cultivo de seis subespécies de Leishmania obtidas de fase de crescimento em meio líquido LIT (Liver Infusion Trypticase) com BHI (Brain Heart Infusion) muito utilizado para outros tripanossomatídeos. O meio LIT é considerado muito eficiente, porém demanda repiques em intervalos de tempo menores do que o necessário para os meios bifásicos tradicionais com base de ágar e sangue desfibrinado (Schuster & Sullivan, 2002). As formas amastigotas parasitam normalmente as células do sistema fagocítico mononuclear dos hospedeiros mamíferos, por isso são cultivadas em meios contendo este tipo de célula. Alguns meios, livres de células, vêm sendo usados, mas somente números limitados de cepas podem crescer em meio extracelular (Taylor & Baker, 1987). As formas promastigotas podem ser induzidas, pelo choque térmico e pela alteração de ph, a transformarem-se em formas amastigotas, entretanto existem variações na susceptibilidade entre espécies de Leishmania. O ph utilizado na transformação varia entre 4 a 5,5 e a temperatura entre 32ºC e 34ºC (Schuster & Sullivan, 2002). O inóculo de escolha, ao qual se pretende cultivar formas amastigotas, em geral tem sido semeado em meios de cultura celular como Schneider, 199 e RPMI 1640 com macrófagos. Todos esses meios utilizam soro fetal bovino adicionado em uma proporção que pode variar de 10% a 30% (Schuster & Sullivan, 2002). A maioria de meios para cultivo de Leishmania spp. classificados como não definidos, incluem soro fetal bovino como um dos ingredientes essenciais, reconhecido como agente estimulador de crescimento. O soro fetal bovino é um produto de custo elevado e de difícil obtenção em alguns países. Em geral, é utilizado em concentrações que variam entre 10% a 52
53 30%, sendo adicionado ao meio líquido ou à fase líquida do meio bifásico (Taylor & Baker, 1987). A urina humana estéril tem sido apontada como um possível fator de crescimento substituto ao soro fetal bovino, e que é adicionada ao meio líquido ou à fase líquida do meio bifásico em uma concentração de 5%. Particularmente em relação à utilização de urina como fator de crescimento de Leishmania segue-se a lógica da conhecida importância da urina de insetos vetores na metaciclogênese de tripanossomatídeos (Howard et al., 1991). Vários estudos têm sido realizados para avaliar o efeito estimulador de citocinas ou substâncias citocinas-like para crescimento de promastigotas in vitro. Outros agentes estimuladores de crescimento já testados foram colônia de macrófago-granulócito para a proliferação de L.(L.)amazonensis, e insulina para L.(V.) pananamensis, L. (L.) chagasi e L.(L.) mexicana. Também foi demonstrado que o tamanho do inóculo tem influência no crescimento de Leishmania (Schuster & Sullivan, 2002). De acordo com Berens et al (1976), para obter seu valor máximo o meio de cultura semidefinido deveria atender aos seguintes critérios: (1) facilidade de preparo e esterilização (2) custo relativamente baixo; (3) crescimento celular superior ao meio previamente usado; (4) meio monofásico simplificando o cultivo e o estudo de células; (5) presença de poucas ou nenhuma substância particulada facilitando a determinação do número de células e economia de tempo; (6) crescimento adequado de duas ou mais espécies de hemoflagelados possibilitando estudos comparativos e, 53
54 (7) suficientemente definido para permitir eventuais modificações para um meio quimicamente definido. 1.9 Criopreservação de Leishmania spp. preservação. Após o crescimento inicial do parasita é importante realizar a sua As leishmanias podem ser conservadas sob congelamento mecânico a - 70ºC, em recipientes contendo dióxido de carbono sólido (- 76ºC) ou em nitrogênio líquido (-196ºC) (OMS, 1990). Para manipular amostras que serão criopreservadas ou que já estão sob criopreservação são necessárias algumas precauções para evitar acidentes com explosões de recipientes e com queimaduras durante o congelamento ou descongelamento. Deve-se usar equipamentos de proteção individual como máscaras e óculos de proteção. Os tubos de criopreservação devem ser manipulados com pinças apropriadas (OMS, 1990). Os isolados devem ser registrados em planilhas apropriadas e os tubos etiquetados. As amostras devem ficar sob responsabilidade de uma única pessoa que anotará todo o procedimento desde a entrada do material a ser criopreservado até a saída do mesmo quando houver necessidade de descongelamento (OMS, 1990). O congelamento das leishmanias é um processo simples que não exige aparelhagem complexa. O processo é lento em presença de um produto crioprotetor que pode ser glicerina estéril sob autoclavagem ou dimetilsulfoxido estéril (OMS, 1990). 54
55 2. OBJETIVOS GERAIS Estudar diferentes formulações de meios de cultura para o crescimento primário e para proliferação de protozoários do gênero Leishmania; Estudar alternativa para coleta, acondicionamento e preservação de amostras biológicas visando o isolamento de protozoários do gênero Leishmania; 2.1 Objetivos específicos Avaliar o desempenho de diferentes formulações de meios para o cultivo acelular de protozoários do gênero Leishmania, com ou sem suplementação; Propor e estudar uma nova formulação de meio, isento de proteínas de origem animal, para o cultivo acelular de Leishmania; Construir curvas de crescimento primário de Leishmania spp. para os diferentes meios utilizados; Realizar a identificação específica das amostras de Leishmania spp. isoladas neste projeto. 55
56 3. MATERIAL E MÉTODOS 3.1 Origem das amostras incluídas no estudo sobre crescimento primário de Leishmania spp. a. Cães domiciliados e/ou errantes recolhidos nos Centros de Zoonoses dos Municípios de Araçatuba (ATB) e Penápolis (PNP) no Estado de São Paulo, com ou sem sinais clínicos e/ou diagnóstico prévio para LVc. Todos os animais incluídos no estudo foram submetidos à eutanásia, pelos municípios, como parte da execução do Programa de Controle da LVc. Para a realização da eutanásia foi utilizado o seguinte protocolo: aplicação de anestesia com Thiopental Sódico (CRISTALIA ) na dose de 25 mg/kg para relaxamento e/ou tranquilização dos cães, com um posterior aprofundamento da anestesia e, finalmente aplicação de cloreto de potássio 1,9% em dose suficiente para provocar parada cardíaca, de acordo com a Resolução nº 714 de 20 de junho de 2002, do Conselho Federal de Medicina Veterinária. Os dois municípios encontram-se situados à margem esquerda do Rio Tietê, na região extremo noroeste do Estado de São Paulo com registro de transmissão de LVc e presença de Lutzomyia longipalpis. b. Cães domiciliados recolhidos ou entregues ao Centro de Zoonoses do Município de Campo Grande no Estado de Mato Grosso do Sul (MS), com ou sem sinais clínicos e/ou diagnóstico prévio para LVc, todos submetidos à eutanásia, conforme protocolo acima mencionado. O Município de Campo Grande localiza-se na parte central do Estado, nas imediações do divisor de águas das bacias dos rios Paraná e Paraguai, com transmissão de LVc e presença de Lutzomyia longipalpis; 56
57 3.1.1 Material biológico coletado dos cães incluídos no estudo sobre crescimento primário de Leishmania spp. As amostras biológicas utilizadas para o crescimento primário e identificação de Leishmania spp. foram definidas de acordo com o processamento em: 1. Amostras para processamento imediato aspirado e fragmento de baço coletados, após a eutanásia, de cães provenientes dos municípios de Araçatuba e Penápolis, no Estado de São Paulo, aliquotadas e acondicionadas em: a) flaconetes de polipropileno estéreis contendo solução salina 0,85% para inoculação em meio de cultura até 48 horas após a coleta; b) flaconetes de polipropileno estéreis e secos para extração de DNA. 2. Amostras para processamento imediato e para criopreservação aspirado e fragmento de baço coletados, após a eutanásia, de cães provenientes do município de Penápolis/SP, aliquotadas e acondicionadas em: a) flaconetes de polipropileno estéreis contendo solução salina 0,85% para inoculação em meio de cultura até 48 horas após a coleta; b) flaconetes de polipropileno estéreis contendo solução salina glicerinada a 10% (0,9 ml de solução salina e 0,1 ml de glicerina) e submetidos ao congelamento a 20 o C por períodos de 5 dias e de 4 meses; c) flaconetes de polipropileno estéreis e secos para extração de DNA. 57
58 3. Amostras criopreservadas para processamento posterior aspirado e fragmento de baço coletados, após a eutanásia, de cães provenientes de Campo Grande, no Estado do Mato Grosso do Sul, aliquotadas e acondicionadas em: a) flaconetes de polipropileno estéreis contendo solução salina glicerinada a 10% submetidos ao congelamento a 70 o C por 12 meses; b) flaconetes de polipropileno estéreis contendo solução salina glicerinada a 10% submetidos ao congelamento a 70 o C por 12 meses e a 20 o C por mais 6 meses; c) flaconetes de polipropileno estéreis e secos para extração de DNA. 3.2 Amostras de referência de tripanossomatídeos incluídas no estudo sobre proliferação parasitária Formas promastigotas de Leishmania (L.) chagasi (MHOM/BR74/PP75), Leishmania (L.) amazonensis (MHOM/BR/73/m-2269) Leishmania (V.) braziliensis (MHOM/84/LTB300) e formas epimastigotas de Trypanosoma (Schizotrypanum) cruzi cepa Y - (Silva & Nussenzweig, 1953), mantidas em temperatura de 25 o C +/- 1 o C por várias subpassagens em meio de cultura bifásico Blood Agar Base (BAB) com Brain Heart Infusion (BHI) e Urina Humana Estéril Feminina (UHEF) acrescida de gentamicina. Estas amostras foram utilizadas como controle nos experimentos de proliferação (curvas de crescimento). Morfologia dos parasitas A proliferação parasitária foi avaliada qualitativamente por observações microscópicas na morfologia e motilidade dos parasitas e, quantitativamente, pela contagem dos organismos em hemocitômetro, usando câmara de Neubauer, com aumento de 400X (Ismaeel et al., 1998). 58
59 Alíquotas de 20 ųl de cada cultura foram utilizadas para a confecção de esfregaços em lâminas de microscopia, coradas pela técnica do Panótico rápido (Coelho et al, 2006). As lâminas coradas foram examinadas em microscópio de campo claro, com objetiva de imersão em óleo, em aumento de 1000X. O registro fotomicrográfico das características morfológicas das amostras controle, cultivadas nos diferentes meios e suplementos para cultivo, foi realizado em microscópio óptico Olympus modelo BX 40 equipado com máquina fotográfica e o modelo BX 60 acoplado com máquina digital Olympus Animais de laboratório utilizados no estudo sobre infectividade de amostras biológicas criopreservadas Foram utilizados hamsters dourados (Mesocricetus auratus), recém desmamados, fornecidos pelo Serviço de Biotério do Instituto Adolfo Lutz, sendo mantidos em gaiolas de polipropileno com cama de maravalha, recebimento de água e alimento ad libitum. Os animais foram infectados por via intraperitonial com amostras de aspirado de baço coletado de cães provenientes do Município de Penápolis criopreservadas a 20 0 C, por 04 meses. Após esse período os animais foram sacrificados, sendo o aspirado de baço semeado em meio de cultura para confirmação e isolamento da espécie de Leishmania. 3.4 Determinação do ph Cepas de referência de L. (L.) chagasi foram inoculadas em meios de cultura acelular: bifásico BAB com BHI e UHEF; líquidos TGGY-1 e 59
60 TGGY-2 acrescidos de suplementos. Em intervalos de 7 (sete) dias alíquotas de 30 ųl, de cada meio de cultura, foram acondicionadas em tubos de prolipropileno para a medição do ph por papel indicador especial (Universalindikator ph 0-14 da Merck). A proliferação foi acompanhada por contagens em hemocitômetro com câmara de Neubauer (Niño, 2005) Meios de cultivo (formulações): Todos os experimentos foram realizados em tubos de ensaios de 16 x 160 milímetros. Foram utilizados os seguintes meios de cultura: a) Meio Bifásico: - Fase sólida => BAB - Fase líquida => BHI =>TGGY - 1 (nova formulação Quadro I) =>Solução de uréia-creatinina-sódio-potássio a 5% b) Meio Líquido: - Solução de uréia-creatinina-sódio-potássio a 5% (Solução UCNaK) - BHI (Brain Heart Infusion) - TGGY TGGY - 2 (nova formulação - Quadro II). Suplementos Foram acrescidos aos meios de cultura os seguintes suplementos: a) Urina Humana estéril feminina (UHEF) b) Urina Humana estéril masculina (UHEM) c) Urina Canina estéril fêmea (UCEF) d) Urina Canina estéril macho (UCEM) e) Hemina f) Ácido fólico 60
61 As formulações dos novos meios líquidos semi-definidos, TGGY-1 e TGGY-2, desenvolvidas para o cultivo de promastigotas de Leishmania spp. e Trypanossoma cruzi, estão demonstrados nos quadros I e II. Na composição destes meios foram incluídas fontes de açúcares, de aminoácidos, sais e água. Após o ajuste do ph em +/- 7,2, os meios foram esterilizados em papel filtro Millipore de 0.22 ųm. A contaminação bacteriana foi controlada pela adição de antibiótico gentamicina na concentração final de 200 µg/ml. 3.6 Grupos experimentais Na constituição dos grupos de experimentos, abaixo descritos, foi considerada a necessidade de realizar: a) A comparação entre diferentes meios de cultivo acelular para o crescimento primário e para a proliferação de tripanossomatídeos: Grupo de experimentos 1: Meio bifásico BAB acrescidos com diferentes suplementos, meio líquido BHI, solução UCNaK a 5% e meio líquido TGGY-1 para o cultivo de Leishmania spp. Amostras: aspirado de baço colhidas de 22 cães de Penápolis, para crescimento primário; cepas de referência de tripanossomatídeos utilizadas como controle. Grupo de experimentos 2: Meio líquido TGGY - 1 acrescido com diferentes suplementos e meio bifásico BAB com BHI e UHEF. Amostras: aspirado de baço de 29 cães de Penápolis e de Araçatuba, para crescimento primário de Leishmania spp.; cepas de referência de tripanossomatídeos utilizadas como controle. 61
62 Grupo de experimentos 3: Meio líquido TGGY - 2 acrescido com diferentes suplementos, meio líquido TGGY - 1 e meio bifásico BAB-BHI e UHEF em cepas de referência de tripanossomatídeos utilizadas como controle. b) A avaliação da eficiência da criopreservação como alternativa para crescimento primário e para manutenção da infectividade de Leishmania spp em amostras biológicas coletadas de cães com suspeita de LVc. Grupo de experimentos 4: amostras de aspirado de baço de cães de Penápolis e Campo Grande, criopreservados por períodos de 5 dias e 12 meses, respectivamente, para crescimento primário de Leishmania spp. em meio bifásico BAB acrescidos com diferentes suplementos, meio líquido BHI, solução UCNaK a 5% e meio líquido TGGY-1 para o cultivo de Leishmania spp. Grupo de experimentos 5: amostras de aspirado de baço de cães de Penápolis e Campo Grande, criopreservadas por um período de 6 meses e 18 meses, respectivamente, para crescimento primário de Leishmania spp. em meio bifásico BAB-BHI-UHEF e TGGY-1 acrescido de suplementos. Grupo de experimentos 6: amostra de aspirado de baço de dois cães de Penápolis, criopreservadas por quatro meses, foi descongelada e inoculada em hamsters (Mesocricetus auratus) que permaneceram sob observação por 3 (três) meses. Após este período, aspirados de baço desses animais foram inoculados em meio BAB-BHI-UHEF e, TGGY-1 com ácido fólico e hemina para confirmação do diagnóstico. c) Determinação do ph de diferentes meios de cultura acelular 62
63 Grupo de experimentos 7: determinação do ph dos meios de cultura bifásico BAB-BHI-UHEF, TGGY-1 e TGGY-2 acrescidos de suplementos, inoculados com amostra de referência de L. (L.) chagasi, por um período 21 dias. 3.7 Metodologia utilizada na inoculação de cepas de referência (controle) Em todos os experimentos realizados, uma alíquota de cada cepa de referência, mantidas em meio bifásico BAB-BHI-UHEF por várias subpassagens, utilizada como controle, foi diluída em solução salina e contada em câmara de Newbauer estabelecendo o inóculo inicial de: Trypanosoma cruzi cepa Y = 2 X 10 5 parasitas/ml Leishmania (V) braziliensis = 2 X 10 5 parasitas/ml Leishmania (L) chagasi = 2 X 10 5 parasitas/ ml Leishmania (L) amazonensis = 2 X 10 5 parasitas/ml. 3.8 Identificação de Leishmania Extração de DNA As amostras de fragmento de baço colhidas no momento da necropsia foram acondicionadas em flaconetes seco e armazenadas sob temperatura de 20ºC. Após a realização dos experimentos, algumas amostras foram selecionadas aleatoriamente para a realização da identificação da leishmania isolada, e também para confirmação das culturas negativas. 63
64 As amostras foram maceradas em tubos de polipropileno de 1,5 ml, com auxílio de pistilo plástico. Aos macerados adicionou-se 300 µl de proteinase K, homogeinizando-se no vórtex e incubando a 56ºC, em banhomaria, por 5 horas. As amostras retiradas do banho-maria foram mantidas sob refrigeração a 4ºC em overnight. Após este período, os sobrenadantes foram retirados e acondicionados em tubos limpos, aos quais foram acrescentados 1 ml de fenol para retirar as impurezas. Os tubos foram agitados e centrifugados por 10 minutos a rpm, sendo os sobrenadantes, cuidadosamente, removidos e colocados em outros tubos. Aos sobrenadantes obtidos no passo anterior adicionou-se 200 µl de clorofórmio preparado na proporção de 0,2 ml de isopropanol para 4,8 ml de clorofórmio. Os tubos foram agitados e centrifugados por 10 minutos a rpm. Após a centrifugação, os sobrenadantes foram transferidos para outros tubos; adicionando-se isopropanol na quantidade equivalente a 3 vezes mais o volume contido nos tubos, misturando-se por inversão dos tubos. Após a mistura, os tubos foram centrifugados por 10 minutos a rpm, com posterior remoção dos sobrenadantes. Aos tubos contendo sobrenadantes acrescentou-se 200 µl de etanol a 70% e centrifugou-se por 10 minutos a rpm retirando-se os sobrenadantes cuidadosamente. As amostras foram mantidas sob refrigeração cobertas com papel toalha para a evaporação do etanol residual. Após a secagem foram adicionados 50 µl de água destilada com RNAse. O DNA extraído foi conservado a -20 C até o momento da amplificação Iniciadores Para a amplificação do fragmento de DNA extraído foram utilizados os oligonucleotídeos iniciadores com as seguintes características: - DNA alvo do PCR: kdna minicirculo ( cópias) - Tamanho do produto: 145 pares de bases 64
65 - Especificidade: Leishmania (L) donovani sensu lato (L. infantum, L. chagasi e L.donovani) (Lachaud et al, 2002) - Sequência de oligonucleotídeos: RV1 5 CTTTTCTGGTCCCGCGGGTAGG 3 RV2 5 CCACCTGGCCTATTTTACACCA Reação em Cadeia da Polimerase Para a identificação das amostras foi utilizada a Reação em Cadeia pela Polimerase (PCR), que é uma técnica para a amplificação de uma seqüência específica do DNA contido no material a ser analisado. Foi utilizado Kit - puretaq Ready-To-Go-PCR Beads TM Amersham Biosciences Limited com um glóbulo (bead) em cada flaconete contendo: BSA, datp, dctp, dgtp, dttp, ~2,5 unidades de puretaq DNA polimerase e tampão. Em cada flaconete contendo o glóbulo adicionou-se 18 µl de água bidestilada, 1µL de cada iniciador (RV1 e RV2), 5 µl do DNA extraído, perfazendo um total de 25 µl. Cada flaconete foi centrifugado rapidamente (spin) e colocado no termociclador programado para L.(L) chagasi com: Denaturação inicial a 95ºC por 5 minutos; 35 ciclos com temperatura de 95ºC por 30 segundos para denaturação, 60ºC por 30 segundos para anelamento e 72ºC por 30 segundos para extensão; Um ciclo com temperatura de 72ºC por 5 minutos para extensão final, e 65
66 Resfriamento a 4ºC até a retirada dos flaconetes (tempo máximo de 99 horas) Eletroforese em gel de agarose Os produtos do PCR (3 µl do DNA com 2 µl de corante azul de bromofenol) foram submetidos à eletroforese em gel de agarose a 0,8% preparado com tampão TBE, adicionando-se 2 µl de brometo de etídio, durante 40 minutos, a 100 V. sob luz Ultravioleta. Após a eletroforese, a análise do produto da reação foi visualizada 3.9 Análise dos resultados O desempenho dos meios de cultivo e suplementos utilizados nos diferentes grupos experimentais foi avaliado a partir de observações realizadas ao longo de todo o período de estudo, considerando sobrevivência, crescimento primário, proliferação parasitária e morfologia das amostras de Leishmania isoladas. Como parte das avaliações sobre o desempenho das formulações estudadas, amostras de referência de Leishmania spp. e T. cruzi foram inoculadas em todos os meios e suplementos, constituindo um grupo controle. Para confirmação, e demonstração, de diferenças morfológicas nas amostras de Leishmania, cultivadas em diferentes condições de meios de cultivo e de suplementos, foi realizado o registro fotomicrográfico em 66
67 microscópio óptico, modelo BX 40 equipado com máquina fotográfica, e o modelo BX 60 acoplado com máquina digital Olympus 5.0. Para a avaliação da intensidade da proliferação e sobrevivência de Leishmania spp. foram construídas curvas de crescimento primário para cada uma das formulações estudadas. O mesmo procedimento foi adotado em relação às amostras de referência utilizadas como controle neste estudo. 67
68 Quadros Quadro I Composição do meio líquido TGGY - 1 Extrato de levedura Extrato de malte Peptona de soja Peptona de caseína do leite Fosfato bibásico de potássio Fosfato bibásico de sódio Cloreto de sódio MgSO 4.7H 2 O CaCl 2 2,00 g 3,00 g 3,00 g 17,00 g 2,50 g 2,50 g 6,00 g 0,20 g 0,07 g Água destilada 1000 ml ph +/- 7,2 gentamicina 200 µg/ml 68
69 Quadro II Composição do meio líquido TGGY - 2 Extrato de levedura Extrato de malte Peptona de soja Fosfato bibásico de potássio Fosfato bibásico de sódio Cloreto de sódio MgSO 4.7H 2 O CaCl 2 2,00 g 3,00 g 20,00 g 2,50 g 2,50 g 6,00 g 0,20 g 0,07 g Água destilada 1000 ml ph +/- 7,2 gentamicina 200 µg/ml 69
70 4. RESULTADOS No grupo de experimentos 1 avaliou-se a eficiência de diferentes meios, com ou sem adição de suplementos nutricionais, para o cultivo de tripanossomatídeos. Em relação ao crescimento primário de Leishmania, os resultados do desempenho de cada formulação estão demonstrados na Tabela 2, e a média das densidades parasitárias máxima obtida no crescimento primário, apresentadas na Tabela 3 e Figura 4. Na Tabela 4 são apresentados os resultados da avaliação de proliferação das cepas de referência. A densidade parasitária máxima e as curvas de crescimento das amostras controle estão representadas na Tabela 5 e nas figuras de 05 a
71 Tabela 2 Resultados obtidos para o crescimento primário de Leishmania spp., a partir de aspirado de baço de cães de Penápolis, inoculadas em diferentes meios de cultura. Amostras Meios de culturas BAB BAB BAB BAB BHI BAB Solução BAB TGGY-1 BHI+UHEF BHI+UHEM BHI+UCEM BHI+UCEF TGGY-1 UCNaK 5% solução UCNaK 5% PNP 104 Negativa Positiva Negativa Negativa Negativa Negativa Negativa Negativa Negativa PNP 105 Negativa Negativa Negativa Negativa Negativa Negativa Negativa Negativa Positiva PNP 106 Positiva Positiva Positiva Positiva Negativa Positiva Negativa Negativa Negativa PNP 108 Positiva Positiva Negativa Positiva Negativa Positiva Negativa Negativa Negativa PNP 109 Positiva Positiva Positiva Positiva Positiva Positiva Negativa Negativa Negativa PNP 110 Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa Negativa PNP 112 Positiva Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa PNP 113 Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa Negativa PNP 115 Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa Negativa PNP 116 Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa Negativa PNP 117 Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa Negativa PNP 120 Negativa Negativa Negativa Positiva Negativa Negativa Negativa Negativa Negativa * amostras 99, 100, 101, 102, 103, 107, 111, 114, 118 e 119 foram negativas em todos os meios de cultivos utilizados neste experimento. 71
72 Tabela 3 - Média da densidade parasitária máxima obtida no crescimento primário de Leishmania spp. a partir de amostras de aspirado de baço de cães de Penápolis. Meios de Cultura Parasitas X 10 5 /ml BAB+BHI+UHE Feminina 5,0 BAB+BHI+UHE Masculina 5,7 BAB+BHI+UCE Fêmea 3,0 BAB+BHI+UCE Macho 10,3 BHI 1,0 BAB+TGGY-1 1,6 TGGY-1 1,0 Figura 4 Média das densidades parasitárias obtidas no crescimento primário. 72
73 Tabela 4 Resultados obtidos a partir da proliferação de amostras de referência utilizadas como controle. Meios de culturas Amostras controle BAB BAB BAB BAB BHI BAB BAB TGGY-1 BHI+UHEF BHI+UHEM BHI+UCEM BHI+UCEF TGGY-1 solução UCNaK 5% L. (V.) braziliensis Positiva Positiva Positiva Positiva Positiva Positiva Positiva Positiva L. (L.) amazonensis Positiva Positiva Positiva Positiva Positiva Positiva Positiva Positiva L. (L.) chagasi Positiva Positiva Positiva Positiva Positiva Positiva Positiva Positiva T. (S.) cruzi Positiva Positiva Positiva Positiva Positiva Positiva Positiva Positiva * as amostras controle não foram inoculadas no meio de solução UCNaK a 5%. 73
74 Tabela 5 - Densidade parasitária máxima obtida com a proliferação de algumas espécies de tripanossomatídeos, segundo formulação de meio de cultura e tempo de cultivo, a partir de um inóculo inicial de 2 X 10 5 cel./ml. Meios de Cultura L.(L.) chagasi L.(L.) amazonensis L.(V.) braziliensis T.(S.)cruzi BAB + BHI + UHE feminina 1,2 X 10 7c 1,1 X 10 7c 8,2 X 10 7b 4,4 X 10 7c BAB + BHI + UHE masculina 1,7 X 10 7a 2,0 X 10 7a 1,0 X 10 8c 4,3 X 10 7c BAB + BHI + UCE fêmea 1,8 X 10 7a 2,9 X 10 7b 1,2 X 10 8c 6,0 X 10 7c BAB + BHI + UCE macho 2,5 X 10 7b 7,9 X 10 7b 3,7 X 10 8c 1,0 X 10 8c BHI 1,6 X 10 6a 9,0 X 10 6c 4,0 X 10 5c 2,0 X 10 7c BAB + TGGY-1 1,3 X 10 7a 1,0 X 10 7b 6,0 X 10 7c 5,0 X 10 7b Solução UCNaK 5% 4,0 X 10 5b 1,2 X 10 6a 1,2 X 10 6b 8,0 X 10 5a TGGY-1 7,0 X 10 5a 2,0 X 10 5c 1,7 X 10 6b 1,0 X 10 7c a 168 horas ; b 336 horas; c 504 horas 74
75 parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF BAB+BHI+UHEM BAB+BHI+UCEF BAB+BHI+UCEM TGGY-1 BHI SOL.UCNaK 5% BAB+TGGY-1 Figura 5 - Curvas de crescimento de L. (L.) chagasi em diferentes meios de cultura. parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF BAB+BHI+UHEM BAB+BHI+UCEF BAB+BHI+UCEM TGGY-1 BHI SOL.UCNaK 5% BAB+TGGY-1 Figura 6 Curvas de crescimento de L. (L.) amazonensis em diferentes meios de cultura. 75
76 parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF BAB+BHI+UHEM BAB+BHI+UCEF BAB+BHI+UCEM TGGY-1 BHI SOL.UCNaK 5% BAB+TGGY-1 Figura 7 Curvas de crescimento de L. (V.) braziliensis em diferentes meios de cultura. parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF BAB+BHI+UHEM BAB+BHI+UCEF BAB+BHI+UCEM TGGY-1 BHI SOL.UCNaK 5% BAB+TGGY-1 Figura 8 Curvas de crescimento de T. (S.) cruzi em diferentes meios de cultura. 76
77 No grupo de experimento 2 a eficiência do meio líquido TGGY - 1 acrescido de diferentes suplementos foi comparada ao meio bifásico BAB- BHI-UHEF. Nas Tabelas 6, 7 e 8 são demonstrados os resultados da avaliação realizada a partir de amostras de aspirado de baço, colhidas de cães de Penápolis e de Araçatuba, e de cepas de referência utilizadas como controle. A figura 9 mostra a média da densidade parasitária máxima obtida com o crescimento primário, e nas figuras de 10 a 13 estão representadas as curvas de crescimento das amostras de referência. Tabela 6 - Resultados obtidos para o crescimento primário de Leishmania spp., a partir de aspirado de baço de cães de Penápolis e Araçatuba, inoculadas em meio bifásico e meio líquido. Amostras Meios de Culturas BAB TGGY-1 TGGY-1 TGGY-1 TGGY-1 BHI+UHEF hemina ácido fólico Ácido fólico e hemina PNP 34 Negativa Negativa Negativa Negativa Positiva PNP 35 Positiva Negativa Positiva Positiva Positiva PNP 37 Positiva Negativa Negativa Negativa Negativa ATB 41 Negativa Negativa Negativa Negativa Positiva ATB 42 Positiva Positiva Negativa Negativa Positiva ATB 43 Positiva Negativa Positiva Positiva Positiva ATB 44 Negativa Negativa Negativa Positiva Positiva ATB 45 Positiva Positiva Positiva Negativa Positiva ATB 47 Positiva Positiva Positiva Positiva Positiva ATB 48 Positiva Negativa Positiva Negativa Positiva ATB 49 Positiva Negativa Positiva Negativa Positiva ATB 50 Negativa Negativa Positiva Positiva Negativa ATB 51 Positiva Negativa Positiva Positiva Negativa ATB 53 Positiva Positiva Positiva Positiva Positiva ATB 58 Positiva Positiva Positiva Positiva Positiva PNP = Penápolis ATB = Araçatuba amostras PNP 31, 32, 33 e ATB 38, 39, 40, 46, 52, 54, 55, 56, 57, 59 e 60 foram negativas em todos os meios utilizados neste experimento 77
78 Tabela 7 Média da densidade parasitária máxima obtida no crescimento primário de Leishmania spp. isoladas de aspirado de baço de cães de Penápolis e Araçatuba. Meios de cultura Parasitas X 10 5 /ml BAB + BHI + UHEF 4,5 TGGY-1 1,8 TGGY-1 + hemina 1,2 TGGY-1 + ácido fólico TGGY-1 + ácido fólico + hemina 1,9 4,2 Figura 9 Média da densidade parasitária máxima obtida no crescimento primário. 78
79 Tabela 8 - Densidade parasitária máxima obtida com a proliferação de algumas espécies de tripanossomatídeos, segundo formulação de meio de cultura e tempo de cultivo, a partir de um inóculo inicial de 2 X 10 5 cel./ml. Meios de cultura L. (L.) chagasi L. (L.) amazonensis L. (V.) braziliensis T. (S.) cruzi maior maior maior maior densidade densidade densidade densidade celular celular celular celular BAB + BH I + UHE feminina 5,6 X 10 7b 8,3 X 10 7a 8,2 X 10 7c 1,4 X 10 8d TGGY-1 1,0 X 10 5a 1,0 X 10 5a 5,0 X 10 5a 1,0 X 10 5a TGGY-1 + hemina 1,0 X 10 5a 1,0 X 10 5a 4,0 X 10 5a 2,0 X 10 5a TGGY-1 + ácido fólico 5,0 X 10 6c 1,0 X 10 5a 1,0 X 10 5a 1,0 X 10 5a TGGY-1+ácido fólico+hemina 7,0 X 10 6c 6,5 X 10 6a 1,0 X 10 5a 8,5 X 10 6d a 168 horas ; b 336 horas; c 504 horas; d 672 horas parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY+ ácido fólico+hemina Figura 10 Curvas de crescimento de L. (L.) chagasi em diferentes meios de cultura. 79
80 parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina Figura 11 Curvas de crescimento de L. (L.) amazonensis em diferentes meios de cultura. parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina Figura 12 Curvas de crescimento de L. (V.) braziliensis em diferentes meios de cultura. 80
81 pa rasita s X 10 5 /ml BAB+BHI+UHEF Horas de incubação TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina Figura 13 Curvas de crescimento de T. (S.) cruzi em diferentes meios de cultura. No grupo de experimentos 3 foi comparado o desempenho do meio líquido TGGY - 2 acrescido com diferentes suplementos com o meio líquido TGGY - 1 e com o meio bifásico BAB-BHI-UHEF. Na Tabela 9 é apresentada a densidade parasitária máxima obtida no crescimento das amostras de referência nos diferentes meios utilizados neste experimento. As amostras positivas nos meios TGGY-1, com e sem suplementação, foram observadas em subpassagem realizada no 5 o dia de crescimento. Os resultados referentes a L. (L.) chagasi e T. (S.) cruzi estão demonstrados nas Tabelas 10 e 11. L. (L.) amazonensis e L. (V.) braziliensis não apresentaram crescimento na subpassagem. As curvas de crescimento estão representadas nas figuras de 14 a
82 Tabela 9 - Densidade parasitária máxima obtida para algumas espécies de tripanossomatídeos, segundo formulação de meio de cultura e tempo de cultivo, a partir de um inóculo inicial de 2 X 10 5 cel./ml. Meios de cultura L. (L.) chagasi L. (L.) amazonensis L. (V.) braziliensis T. (S.) cruzi maior maior maior maior densidade densidade densidade densidade celular celular celular celular BAB + BHI + UHEF 1,6 X 10 7e 1,2 X 10 7e 9,9 X 10 6e 3,2 X 10 7e TGGY-1 9,0 X 10 5c 1,0 X 10 5a 2,5 X 10 5a 2,4 X 10 6e TGGY-1 + hemina 8,5 X 10 5c 5,5 X 10 5c 4,5 X 10 5b 1,4 X 10 6e TGGY-1 + ácido fólico 3,0 X 10 6d 1,5 X 10 5a 4,0 X 10 5b 2,7 X 10 6e TGGY-1 + ácido fólico + hemina 6,0 X 10 6e 1,2 X 10 6e 4,0 X 10 5b 1,5 X 10 6e TGGY-2 2,0 X 10 6c 1,0 X 10 5a 2,0 X 10 5c 1,0 X 10 6e TGGY-2 + ácido fólico 1,7 X 10 6b 1,0 X 10 5a 3,0 X 10 5a 1,9 X 10 6e TGGY-2 + hemina 4,6 X 10 6d 1,6 X 10 6c 2,2 X 10 6c 2,8 X 10 6e TGGY-2 + ácido fólico + hemina 3,0 X 10 6b 1,3 X 10 6a 1,6 X 10 6c 1,9 X 10 6e a 48 horas; b 120 horas; c 168 horas; d 216 horas; e 288 horas 82
83 parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina TGGY-2 TGGY-2+ácido fólico TGGY-2+hemina TGGY-2+ácido fólico+hemina Figura 14 Curvas de crescimento de L. (L) chagasi em diferentes meios de cultura parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF TGGY-1 TGGY-1+ácido fólico TGGY-1+ hemina TGGY-1+ácido fólico+hemina TGGY-2+ácido fólico TGGY-2 TGGY-2+ácido fólico+hemina TGGY-2+ hemina Figura 15 Curvas de crescimento de L. (L) amazonensis em diferentes meios de cultura. 83
84 parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina TGGY-2+ácido fólico TGGY-2 TGGY-2+ácido fólico+hemina TGGY-2+ hemina Figura 16 Curvas de crescimento de L. (V.) braziliensis em diferentes meios de cultura. parasitas X 10 5 /ml Horas de incubação BAB+BHI+UHEF TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina TGGY-2+ácido fólico TGGY-2 TGGY-2+ácido fólico+hemina TGGY-2+ hemina Figura 17 Curvas de crescimento de T. (S.) cruzi em diferentes meios de cultura. 84
85 Tabela 10 - Cultivo de L. (L.) chagasi em diferentes meios de culturas - 1 a subpassagem Meios de cultura Tempo de inoculação 0 horas 48 horas 120 horas 168 horas (10 5 /ml) (10 5 /ml) (10 5 /ml) (10 5 /ml) TGGY-1 0,6 0,5 0 0 TGGY-1 + ácido fólico 0, TGGY-1 + hemina 0,8 2,5 7 0 TGGY-1 + ácido fólico + hemina 2, parasitas X 10 5 /ml Horas de incubação TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina Figura 18 Curvas de crescimento de L. (L.) chagasi 1a. subpassagem 85
86 Tabela 11 - Cultivo de T.(S.) cruzi em diferentes meios de culturas - 1 a subpassagem. Meios de cultura Tempo de inoculação 0 horas 48 horas 120 horas 168 horas (10 5 /ml) (10 5 /ml) (10 5 /ml) (10 5 /ml) TGGY-1 0,2 2,5 2 4,5 TGGY-1 + ácido fólico 0,7 1,5 4 7,5 TGGY-1 + hemina 0, TGGY-1 + ácido fólico + hemina 1, parasitas X 10 5 /ml Horas de incubação TGGY-1 TGGY-1+ácido fólico TGGY-1+hemina TGGY-1+ácido fólico+hemina Figura 19 - Curvas de crescimento de T. (S.) cruzi 1 a. subpassagem No grupo de experimentos 4 foi avaliado uma nova alternativa para coleta e preservação de amostras biológicas visando o isolamento de protozoários do gênero Leishmania. Na Tabela 12 estão demonstrados os resultados referentes à viabilidade das amostras para o crescimento primário de Leishmania spp.. 86
87 Tabela 12 Crescimento primário de Leishmania spp. a partir de amostras de aspirado de baço de cães de Campo Grande* e Penápolis** antes e após a criopreservação Amostras Meios de culturas BAB BAB BAB BAB BAB BHI BAB Solução BAB TGGY-1 BHI+UHEF a BHI+UHEF BHI+UHEM BHI+UCEM UCNaK BHI+UCEF TGGY-1 5% solução UCNaK 5% MS 26 Positiva Negativa Negativa Negativa Positiva Positiva Positiva Negativa Positiva Positiva MS 37 Positiva Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa Negativa PNP 113 Positiva Positiva Positiva Positiva Negativa Negativa Negativa Negativa Negativa Negativa PNP 104 Positiva Negativa Negativa Negativa Negativa Negativa Negativa Negativa Negativa Negativa * amostras criopreservadas por 12 meses ** amostras criopreservadas por 05 dias a resultado das culturas realizadas antes da criopreservação das amostras 87
88 No grupo de experimentos 5 avaliou-se a viabilidade das amostras colhidas de cães de Penápolis e Campo Grande, criopreservadas por um período de 6 (seis) meses e 18 (dezoito) meses, inoculadas nos meios BAB-BHI-UHEF e no TGGY-1 com suplementação. Os resultados estão apresentados na tabela 13. Tabela 13 Resultados dos aspirados de baço dos cães de Campo Grande* e Penápolis**, criopreservados em diferentes períodos e inoculados em diferentes meios de cultura. Amostras Meios de Cultura BAB BAB TGGY-1 TGGY-1 TGGY-1 BHI+ UHEF a BHI+UHEF Hemina Ácido fólico ácido fólico e hemina MS 11 Positiva Positiva Positiva Negativa Positiva MS 27 Positiva Negativa Negativa Negativa Negativa MS 55 Negativa Negativa Negativa Negativa Negativa MS 131 Negativa Negativa Negativa Negativa Negativa MS 134 Negativa Negativa Negativa Negativa Negativa MS 35 Positiva Positiva Não realizada Não realizada Não realizada MS 14 Positiva Positiva Não realizada Não realizada Não realizada MS 91 Negativa Negativa Não realizada Não realizada Não realizada MS 93 Positiva Negativa Não realizada Não realizada Não realizada PNP 106 Positiva Positiva Não realizada Não realizada Não realizada PNP 113 Positiva Positiva Não realizada Não realizada Positiva PNP 117 Positiva Positiva Não realizada Não realizada Positiva * amostras criopreservadas por 18 meses ** amostras criopreservadas por 6 meses a resultado das culturas realizadas antes da criopreservação das amostras No grupo de experimentos 6 avaliou-se a infectividade das amostras de cães provenientes de Penápolis, criopreservadas por um período de 4 meses. Os resultados estão apresentados nas tabelas 14 e
89 Tabela 14 - Inoculação de amostra, criopreservada, de aspirado de baço de cães de Penápolis. Amostra Aspirado de baço Inóculo Via de inoculação Achado de necropsia PNP 113 0,3 ml Intra-peritoneal Esplenomegalia PNP 117 0,3 ml Intra-peritoneal Esplenomegalia Tabela 15 - Inoculação de amostras de aspirado de baço de hamster, em meio de cultura. Amostra Inóculo TGGY-1 BAB Aspirado de baço hemina e ácido fólico BHI-UHEF PNP 113 0,3 ml Positiva Positiva PNP 117 0,3 ml Positiva Positiva No grupo de experimentos 7 foi determinado o ph de diferentes meios de cultura acelular durante a proliferação de L. (L.) chagasi. Os resultados estão apresentados na Tabela
90 Tabela 16 Proliferação de L. (L.) chagasi e determinação do ph Dias de BAB-BHI ph TGGY-1 ph TGGY-1 ph TGGY-1 ph TGGY-2 ph TGGY-2 ph TGGY-2 ph Inocul a-ção UHEF hemina ácido fólico ácido fólico ácido fólico hemina ácido fólico hemina hemina 0 2,0 X ,3 2,0 X ,3 2,0 X ,3 2,0 X ,3 2,0 X ,3 2,0 X ,3 2,0 X ,3 7 9,3 X ,3 8,9 X ,3 2,8 X ,3 7,6 X ,3 6,5 X ,3 5,4 X ,3 1,3 X ,3 14 2,7 X ,3 6,0 X ,3 3,0 X ,3 1,0 X ,3 1,9 X ,3 2,0 X ,3 9,0 X ,0 21 6,0 X ,0 2,0 X ,3 7,0 X ,3 2,2 X ,3 7,0 X ,3 1,0 X ,3 1,5 X ,0 90
91 4.1 Resultados da reação em cadeia da polimerase Identificação de Leishmania Alguns dos cães incluídos nos experimentos (1, 2, 4 e 5) foram selecionados ao acaso para a realização da reação em cadeia da polimerase (PCR) para confirmação da presença de L.(L.) chagasi em amostra de fragmento de baço. A comparação entre os resultados da PCR (figuras 20, 21 e 22) e crescimento primário estão demonstrados nas tabelas 17, 18 e 19. Tabela 17 Resultados da PCR comparados com o isolamento em cultura das amostras criopreservadas de aspirado de baço coletados de cães de Campo Grande. AMOSTRAS PCR CULTURA MS 11 Positiva Positiva MS 14 Positiva Positiva MS 26 Positiva Positiva MS 27 Positiva Positiva MS 35 Positiva Positiva MS 91 Negativa Negativa MS 93 Negativa Positiva MS 131 Positiva Negativa MS 134 Positiva Negativa A 91
92 B Figura 20 Amplificação dos produtos da PCR. Amostras de fragmento de baço de cães provenientes de Campo Grande, no Estado de Mato Grosso do Sul. 92
93 Tabela 18 Resultados de PCR comparados com o isolamento de Leishmania em cultura das amostras de aspirado de baço coletados de cães de Penápolis, no Estado de São Paulo. Amostras PCR Cultura PNP 100 Negativa Negativa PNP 102 Positiva Negativa PNP 104 Positiva Positiva PNP 106 Positiva Positiva PNP 112 Positiva Positiva PNP 113 Positiva Positiva PNP 116 Positiva Positiva PNP 117 Positiva Positiva PNP 120 Positiva Positiva Figura 21 - Amplificação dos produtos da PCR realizada a partir das amostras de fragmento de baço de cães provenientes do Município de Penápolis, no Estado de São Paulo. 93
94 Tabela 19 Resultados de PCR comparados com o crescimento primário de Leishmania em cultura, a partir das amostras de aspirado de baço coletados de cães de Penápolis e Araçatuba, no Estado de São Paulo. AMOSTRAS PCR CULTURA PNP 34 Negativa Positiva PNP 37 Positiva Positiva PNP 39 Negativa Negativa ATB 44 Positiva Positiva ATB 51 Positiva Positiva Figura 22 Amplificação dos produtos da PCR realizada a partir das amostras de fragmento de baço de cães provenientes dos Municípios de Penápolis e Araçatuba, no Estado de São Paulo. 94
95 4.2 Morfologia de cepas de referência em meio de cultura TGGY- 1 com diferentes suplementos A avaliação qualitativa, quanto a morfologia, da proliferação parasitária estão demonstradas nas Figuras 23 a 29. Figura 23 - Formas promastigotas de L. (L.) amazonensis em meio TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) 7 o dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação e (D) Grupo de Leishmania, formação típica observada durante o 28 o dia de inoculação. 95
96 Figura 24 - Formas promastigotas de L. (L.) chagasi, em meio líquido TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico, aumento de 1000X. (A) 7 o dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação; (D) 28 o dia de inoculação. 96
97 Figura 25 - Formas promastigotas de L. (V.) braziliensis em meio líquido TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 o dia após inoculação e (B) 14 o dia após inoculação. Figura 26 - Formas promastigotas de L. (V.) braziliensis em meio líquido TGGY-1 com hemina, coradas pelo método Panótico, vizualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação e (B) 14 o dia de inoculação. Figura 27 - Formas promastigotas de L. (L.) amazonensis, não coradas, em meio líquido TGGY-1 com hemina, aumento 400X. (A) 14 0 dia de inoculação e (B) 21 o dia de inoculação. 97
98 Figura 28 - T.(S.) cruzi em meio líquido TGGY-1 com ácido fólico, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação e (D) 28 o dia de inoculação. 98
99 Figura 29 T.(S) cruzi em meio líquido TGGY-1 com ácido fólico, não coradas, visualizadas sob aumento de 400X, 28 0 dia após a inoculação. 99
100 4.3 Morfologia de cepas de referência em meios de cultura líquidos TGGY-1 e TGGY-2 com diferentes suplementos. A avaliação qualitativa, quanto a morfologia, da proliferação parasitária estão demonstradas nas Figuras 30 a 42. Figura 30 Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-1 com ácido fólico e hemina, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. 100
101 Figura 31 - Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-1 com ácido fólico, coradas pelo método Panótico, visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 10 o dia de inoculação; (C) 14 o dia de inoculação; (D) 21 o dia de inoculação. 101
102 Figura 32 Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-1 com hemina, coradas pelo Método Panótico e visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. 102
103 Figura 33 Formas promastigotas de L. (L) chagasi em meio líquido TGGY-2 com ácido fólico e hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. 103
104 Figura 34 Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-2 com ácido fólico, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. 104
105 Figura 35 - Formas promastigotas de L. (L.) chagasi em meio líquido TGGY-2 com hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) 7 0 dia de inoculação; (B) 14 o dia de inoculação; (C) 21 o dia de inoculação. 105
106 Figura 36 T. (S) cruzi com 9 o dia de inoculação em meio TGGY-1 com ácido fólico, coradas pelo método Panótico e visualizadas sob aumento de 1000X. Figura 37 - T.(S) cruzi com 12 o dia de inoculação em meio TGGY-1 com ácido fólico, coradas pelo método Panótico e visualizadas sob aumento de 1000X. 106
107 Figura 38 - T.(S) cruzi com 12 o dia de inoculação em meio TGGY-2 com hemina, coradas pelo método Panótico e visualizadas sob aumento de 1000X.. Figura 39 L. (L.) chagasi, após 21 o dia de inoculação, coradas pelo Método Panótico e visualizadas em microscópio óptico Olympus CBA sob aumento de 1000X. (A) meio TGGY-1 com ácido fólico e hemina; (B) meio TGGY-2 com ácido fólico e hemina. 107
108 4.4 Morfologia das cepas de referência em meio de cultura BAB- BHI-UHEF Figura 40 - Amostras de referência no 21 o dia de inoculação em meio BAB com BHI, UHEF, coradas pelo método Panótico e visualizadas sob aumento de 1000X. (A) T. (S) cruzi; (B) L. (V.) braziliensis; (C) L. (L.) chagasi e (D) L. (L.) amazonensis. 108
109 5. DISCUSSÃO Os protozoários do gênero Leishmania são parasitas responsáveis por diversas manifestações clínicas variando desde uma simples lesão cutânea à forma visceral que pode ser fatal (Sengupta, 1999). O diagnóstico laboratorial das leishmanioses pode ser realizado mediante provas parasitológicas, imunológicas e de biologia molecular (Sampaio, 2002). Com a finalidade de confirmar a causa da doença busca-se evidenciar a presença do parasita por meio de exames parasitológicos como a pesquisa de esfregaço em lâmina e o crescimento de Leishmania em cultura obtida pela inoculação da amostra (Sampaio, 2002). Dependendo da espécie e da forma clínica da leishmaniose, o achado do parasito torna-se ainda mais difícil, e muitas vezes praticamente impossível, o que requer meios de cultura ricos com diferentes componentes. Diversas formulações têm sido utilizadas para o cultivo de tripanossomatídeos. As necessidades nutricionais para o crescimento primário diferem qualitativa e quantitativamente para cada espécie de Leishmania, requerendo muitas vezes meios enriquecidos para um cultivo continuado (Merlem et al, 1999). A padronização do cultivo in vitro de membros do gênero Leishmania é extremamente importante para um rendimento adequado de parasitas visando: o diagnóstico, o conhecimento da relação entre parasitahospedeiro e, a determinação de características biológicas e imunológicas do parasita (Merlem et al, 1999). 109
110 Os primeiros ensaios de cultivo de promastigotas de Leishmania foram estabelecidos em meios bifásicos contendo sangue em suas formulações (Novy, 1908; Nicolle, 1908). A partir de então, uma grande diversidade de aditivos bacteriológicos, como infusão de cérebro e coração, além de modificações da fase líquida, vem sendo adicionadas à fase sólida (Merlen et al, 1999). Uma grande variedade de meios apresenta em sua composição sangue desfibrinado, soro fetal bovino ou soro albumina bovina para obtenção de grandes massas parasitárias. Meios bifásicos com tais modificações ainda hoje são as formulações de escolha para o isolamento e manutenção de Leishmania obtida diretamente de hospedeiros vertebrados e invertebrados (Melo, 1985). No entanto algumas desvantagens podem ser relacionadas: complexidade no preparo; difícil padronização; diferentes aditivos bacteriológicos, a presença de sangue e soro fetal bovino, tornando-os inapropriados para determinados estudos biológicos e imunológicos (Sadigursky & Brodskyn, 1986; Merlen et al, 1999). O soro fetal é um ingrediente de elevado custo, de difícil obtenção em muitos países (Howard, 1991 and Shamsuzzaman, 1999), é um reagente complexo, altamente variável e requer a morte de um animal (Armstrong and Patterson, 1994). A complexidade dos meios usados para cultivo dos membros do gênero Leishmania dificulta estudos comparativos sobre requerimentos nutricionais, metabolismo, antígenos e outras características destes organismos, especialmente aqueles isolados de mamíferos. Muitos estudos realizados com isolados de Leishmania, que necessitam de um grande número de promastigotas em curtos períodos, requerem meios de cultura líquidos como RPMI 1640, 199 e Scheneider s 110
111 Drosophila. No entanto estes meios apresentam elevado custo, podem não estar disponíveis quando preciso ou estar impossibilitado de ser usado devido ao prazo de validade vencido (Limoncu et al, 1997). Formulações de meios de cultura livres de sangue e seus produtos são essenciais para a superação destas dificuldades, como também para a diminuição dos custos de produção. A UHE vem sendo usada como suplemento alternativo substituindo o soro fetal bovino no cultivo de formas promastigotas. A urina humana é um potencial estimulante para a proliferação de muitos patógenos incluindo Leishmania sp (Shamsuzzaman et al, 1999). 5.1 Meios de cultivo acelular utilizados nos experimentos de crescimento primário e proliferação de tripanossomatídeos A urina humana estéril tem sido adicionada aos meios de cultura, em várias concentrações, como agente estimulador de crescimento, substituindo o soro fetal bovino. Howard e colaboradores (1991) demonstraram que a urina humana estéril estimula a divisão celular de Leishmania in vitro e cultivos podem ser estabelecidos a partir de lesões com pouco mais de 10 amastigotas/ml. Em estudo anterior, realizado no laboratório de Leishmanioses, da Seção de Parasitoses Sistêmicas do Instituto Adolfo Lutz, já havia sido demonstrada a ação da UHE como fator responsável pelo melhor desempenho do meio bifásico BAB-BHI em tentativas de crescimento primário de Leishmania spp a partir de amostras de aspirado de baço 111
112 coletadas de cães naturalmente infectados, procedentes de áreas endêmicas para LVc (Araújo et al, 2004). De maneira idêntica, os resultados obtidos neste trabalho, a utilização da formulação BAB-BHI suplementado com urina estéril humana ou canina a 5% possibilitou o crescimento primário e proliferação de Leishmania e Trypanosoma (S.) cruzi. As demais formulações e controles mostraram-se incapazes de alcançar o desempenho obtido com BAB-BHI (Tabelas 2-5 e Figura 4-8). No presente estudo, para o grupo de experimentos 1, em que se procurou avaliar o desempenho de formulações e suplementos, foram inoculadas 22 amostras de aspirado de baço de cães, sendo obtida positividade de 54,6%. A formulação de meio bifásico BAB-BHI suplementado com urina estéril de diferentes procedências (humana e canina) permitiu o crescimento primário de Leishmania de um maior número de amostras, entre 27,3 e 50% (Tabela 2). As maiores médias de densidades parasitárias foram observadas quando da presença de UCEM (Tabela 3 e figura 4). Shamsuzzaman e colaboradores (1999), observaram semelhantes curvas de proliferação de Leishmania com urina canina a 8% ou com soro fetal bovino a 10% como suplementos ao meio RPMI Ainda como parte do grupo de experimentos 1, a inoculação das amostras de referência (Tabelas 4 e 5, figuras de 5 a 8), mostrou que todas as formulações testadas com BAB-BHI foram suficientes para permitir a proliferação exponencial das diferentes espécies de tripanossomatídeos ou ao menos, para mantê-los em densidade próxima ao inóculo inicial. 112
113 L. (L.) chagasi apresentou maiores registros de densidade parasitária nas formulações com fase sólida (BAB). L. (L.) amazonensis apresentou maiores registros de densidade parasitária nas formulações com fase sólida (BAB), porém também apresentou exuberante crescimento no meio líquido BHI. L. (V.) braziliensis foi a espécie de tripanossomatídeo que apresentou as maiores taxas de proliferação, principalmente nas formulações com fase sólida (BAB). T. (S.) cruzi apresentou crescimento consistente e exuberante em todas as formulações, exceção feita na solução UCNaK a 5%. Da mesma forma que o observado por Araújo et al (2004), para todas as amostras de referência, na maioria das formulações com suplementação de urina estéril como fator de crescimento, a fase logarítimica prolongou-se pelo menos até o 14 o dia e 21 o dia de cultivos (Figuras 5 a 8). Araújo et al (2002) demonstraram que a urina humana estéril como alternativa de enriquecimento em meios de cultura favorece o prolongamento da fase exponencial de proliferação de protozoários do gênero Leishmania. Todas as formulações utilizadas neste experimento contiveram proteínas de origem animal com exceção a solução UCNaK a 5%. A complexidade dos meios em que são cultivados rotineiramente os membros do gênero Leishmania é um dos fatores limitantes para estudos comparativos sobre requerimentos nutricionais, metabolismo e outras características (Melo et al,1985). 113
114 O cultivo de Leishmania em um meio semidefinido com redução do número de componentes de origem animal pode abrir novas perspectivas para realização de estudos sobre determinadas características biológicas, imunológicas e bioquímicas destes organismos. Entretanto, em vista destas necessidades a nova formulação elaborada e utilizada no grupo de experimentos 1, como fase líquida do meio BAB e como meio líquido (Tabela 2, 3 e Figura 4) não apresentou um desempenho satisfatório no crescimento primário. Segundo Kar (1997) a hemina e ácido fólico são suplementos essenciais para a proliferação de Leishmania spp. A hemina tem importante participação em dois dos mais importantes processos fisiológicos que são a síntese de proteínas e a respiração (Pal & Purandare, 2001). Em comum com a maioria dos tripanossomatídeos, Leishmania necessita de heme de origem exógena, pois todos apresentam inabilidade para sintetizar esse requerimento nutricional para seu crescimento contínuo (Sengupta et al, 1999; Pal & Purandare,2001) No hospedeiro vertebrado, heme está presente principalmente como hemopexina e hemoglobina, sendo esta última o reservatório mais importante (Sengupta et al, 1999). A hemina supre o requerimento heme para atividade de multiplicação das promastigotas in vitro. Culturas livres de hemina somente podem ser mantidas por um número limite de passagens. Por ser um requerimento obrigatório para a transformação de amastigotas para promastigotas e para o crescimento de promastigotas, 114
115 outras fontes de heme como o sangue e o soro são adicionadas ao meio de cultura, in vitro (Pal e Purandare, 2001). Pal e Purandare (2001) demonstraram que a concentração de hemina tem efeito na síntese de proteínas e proliferação de promastigotas de L.donovani in vitro com particular referência ao controle da expressão gênica da proteína ß-tubulina e hsp90 responsáveis por mudanças morfológicas que ocorrem no parasita, indicando que a alta concentração de heme em macrófagos in vivo pode ser um dos fatores disparadores para a transformação de promastigota em amastigota no hospedeiro mamífero. Neste mesmo trabalho apontaram para a possibilidade do uso de hemina em uma concentração de 10 um como um substituto de soro fetal bovino em cultivo destes parasitas. Kar (1997), em seu trabalho relatou que o meio BHI deve ser suplementado com ácido fólico e soro fetal bovino inativado ou sangue ou hemina para proliferação de Leishmania. No grupo de experimentos 2, a nova formulação com e sem adição de hemina e ácido fólico, foi avaliada frente ao meio BAB-BHI e UHEF. Das 29 amostras inoculadas, 15 (51,7%) foram positivas. O meio TGGY-1 com ácido fólico e hemina permitiu o crescimento primário em 12 (41,4%) amostras. No BAB-BHI e UHEF, utilizado como padrão, 11 (37,9%) foram positivas. A densidade parasitária máxima obtida pelos dois meios foi similar (Tabela 7). A adição de ácido fólico e hemina à formulação TGGY-1 possibilitou um melhor desempenho no crescimento exponencial das amostras de referência, porém não superior ao observado para BAB-BHI (Figuras 10, 11, 12 e 13). 115
116 Nos grupos de experimentos 1 e 2, sobre o crescimento primário em diferentes formulações de meio de cultura, Leishmania spp foi isolada de 27 dos 51 cães examinados. No grupo de experimentos 3, como parte dos objetivos deste estudo foi elaborado um meio acelular, agora isento de componentes de origem animal, resultando no meio denominado TGGY-2, ao qual também foi adicionado hemina e ácido fólico tendo em vista as necessidades nutricionais do parasita. A densidade parasitária máxima obtida para a proliferação das amostras de referência nos diferentes meios utilizados (Tabela 9) mostrou L. (L.) chagasi e T. (S.) cruzi com crescimento exponencial em todos os meios (Figuras 14 e 17). L. (L.) amazonensis apresentou crescimento exponencial contínuo no meio BAB-BHI e UHEF, TGGY-1 com ácido fólico e hemina e, TGGY-1 com hemina, não sobrevivendo nos demais formulações (Figura 15). L. (V.) braziliensis manteve crescimento exponencial contínuo apenas no meio BAB com BHI e UHEF, obtendo um crescimento exponencial até o 7 o dia nos meios TGGY-2 com hemina e TGGY-2 com hemina e ácido fólico (Figura 16). Dentre as formulações do TGGY-2 a que permitiu desempenho satisfatório foi aquela suplementada com hemina confirmando a sua necessidade na proliferação de tripanossomatídeos. A manutenção das amostras de referência em subpassagem no TGGY-1, foi alcançada para L. (L.) chagasi e T. (S.) cruzi. L.(L.) chagasi não apresentou crescimento exponencial, apenas no meio TGGY-1 sem suplementação. T. (S.) cruzi cresceu exponencialmente até o 7 o dia de contagem (Figuras 18 e 19). 116
117 As formulações TGGY-1 e TGGY-2, sem suplementação, não forneceram condições suficientes para proliferação e manutenção L.(L.) amazonenzis e L.(V.) braziliensis, tornando-se um ambiente hostil. Steiger & Steiger (1977) e Niño & Camacho (2005), relataram que altas concentrações de ácido fólico são requeridas por L.(V.)braziliensis, para cultivo in vitro. 5.2 Avaliação da eficiência da criopreservação A criopreservação é uma técnica importante usada para preservar o organismo após o isolamento inicial. É um processo simples que não requer equipamentos sofisticados. Na presença de um agente criopreservante, as amostras de parasitas podem ser armazenadas sob baixas temperaturas em freezer (-70 o C), em botijões contendo dióxido de carbono sólido (-76 o C) ou nitrogênio líquido (-196 o C) (Evans, 1989). Neste trabalho, uma nova alternativa para preservação de amostras coletadas e enviadas para o laboratório, para inoculação em meio de cultura, foi estudada. Algumas das amostras de aspirado de baço de cães com diagnóstico positivos no cultivo imediato ou testes sorológicos (Anexo I), foram inoculadas in vitro e in vivo após diferentes períodos de congelamento.. No grupo de experimentos 4, das 4 (quatro) amostras inoculadas apenas uma (PNP 104) não foi positiva para o crescimento primário de Leishmania (Tabela 12). No grupo de experimentos 5 verificou-se que em 12 (doze) amostras descongeladas, 6 (seis) foram positivas para o crescimento primário de Leishmania spp (Tabela 13). As amostras MS 27 e MS 93, das 117
118 quais já houvera sido obtido o crescimento primário quando do cultivo imediato (Tabela 13) foram negativas após o descongelamento da alíquota da amostra criopreservada. As amostras dos cães MS 55, 91, 131 e 134 foram sempre negativas nas tentativas de cultivo, imediato e após o descongelamento, ainda que tivessem testes sorológicos positivos (Anexo I). Nesse experimento, o meio TGGY-1, suplementado com ácido fólico e hemina, mostrou-se tão eficiente quanto o meio BAB- BHI-UHEF. O insucesso no cultivo primário de Leishmania a partir de amostras criopreservadas pode-se interpretado como perda de sensibilidade em função da metodologia de criopreservação; ausência ou insuficiência de formas amastigotas para o crescimento primário em meio de cultura ou ainda, a não sobrevivência do parasita ao processo de congelamento e descongelamento. No grupo de experimentos 6 verificou-se que Leishmania spp presente em amostras criopreservadas por um período de 4 meses, mantém a infectividade em hamsters, podendo posteriormente ser isolada em meio de cultura (Tabela 14 e 15). O acondicionamento de amostras destinadas ao diagnóstico etiológico, em flaconetes com solução glicerinada e mantidas sob baixas temperaturas, mostrou-se alternativa viável para a recuperação do parasita. Em muitas regiões endêmicas para a LV, os laboratórios locais não possuem condições para o isolamento de parasitas e necessitam enviar suas amostras para centros maiores, excedendo muitas vezes 48 horas após a coleta, prejudicando o crescimento primário. 118
119 5.3 Análise dos resultados da PCR A identificação e caracterização de Leishmania spp. é uma etapa indispensável para a compreensão da epidemiologia e transmissão das leishmanioses. Protocolos da PCR com primers específicos de kdna de espécies do Novo Mundo ou do Velho Mundo tem sido utilizados com sucesso, no entanto PCR espécie-específico requer a construção de seqüências de oligonucleotídeos individuais e específicas para cada espécie. Outras técnicas, como a amplificação polimórfica randômica (RAPD) ou primer arbitrário (AP), não são usadas no diagnóstico direto devido aos resultados falsos positivos que ocorrem com contaminação do DNA do hospedeiro (Strauss-Ayali & Baneth, 2000). Os métodos de biologia molecular, como a PCR aplicados para o diagnóstico das leishmanioses apresentam grande sensibilidade, mas necessitam de técnicos especializados, instalações adequadas, o que o torna pouco prático e oneroso (Sampaio, 2002). A PCR foi mais sensível que a cultura, sendo capaz de detectar quantidades mínimas de formas amastigotas presentes na amostra. Assim, as amostras MS 131 e 134 (Tabela 17) embora negativas nas tentativas de cultivo confirmaram na PCR o resultado positivo nos testes imunológicos. A amostra PNP 102 (Tabela 18) negativa no cultivo e no teste imunológico apresentou resultado positivo na PCR (Anexo I). Os resultados apresentados na Tabela 17 e 19 indicam que as amostras MS 93 e PNP 34 positivas na cultura resultaram negativas na PCR. Considerando a sensibilidade e especificidade da PCR poder-se-ia admitir que a alíquota da amostra congelada não tivesse Leishmania em quantidade mínima para ser detectada por essa técnica. De outra parte há que se considerar que o protocolo utilizado incluiu primers RV1 e RV2 específicos para o grupo L. (L.) chagasi = L. (L.) donovani sensu lato 119
120 (Lauchaud et al, 2002) o que pode significar a presença de uma espécie distinta de L. (L.) chagasi. 5.4 Análises morfológicas Formas amastigota-like de Leishmania são obtidas quando o parasita é submetido a mudanças extremas de temperatura, acima de 28 o C, e/ou diminuição do ph do meio (Balanco et al, 1998). Em todos os estágios de vida Leishmania encontra ambiente hostil caracterizado por alta atividade hidrolítica e proteolítica. Experimentam temperaturas entre 22 e 28 o C no hospedeiro invertebrado e, são expostas ao aumento de temperatura a 36,8 o C no interior de hospedeiros mamíferos (Zilberstein, 1994). A elevada temperatura encontrada dentro do hospedeiro mamífero serve como um disparador para o desenvolvimento de promastigotas em formas amastigotas intracelulares em espécies de Leishmania (Zilberstein, 1994). O isolamento de amastigotas de ambas, lesões ou macrófagos infectados, usualmente produzem baixo número de parasitas, contaminados por componentes do hospedeiro. Culturas axênicas de formas amastigotas têm sido obtidas de várias espécies de Leishmania com mudanças de temperatura e ph (Puentes et al, 2000). Leishmania (L.) donovani quando exposta apenas à temperatura de 37 o C, não se transforma em amastigotas, devendo o meio ser acidificado em ph 5,5 (Krobitsch, 1998). A resposta ao estresse provocada por alterações de temperatura e ph traduz-se em mudanças na expressão gênica, incluindo o bloqueio celular de síntese de proteínas e expressão de um grupo distinto de proteínas do estresse (Shapira, 1988). 120
121 Formas amastigota-like de L. (L.) chagasi foram observadas durante o cultivo em meios TGGY-1 e TGGY-2 com ácido fólico (Figuras 31 e 34), TGGY-1 e TGGY-2 com hemina (Figuras 32 e 35). Essas observações foram realizadas em condições de manutenção destas culturas sob temperatura de 25ºC ±1, com ph entre 7,0 e 7,3 medidos a cada sete dias, por um período de 28 dias. O cultivo in vitro de formas amastigotas origina organismo viáveis, livres de contaminantes derivados do hospedeiro, podendo ser usado em avaliação de drogas, identificação de genes, produção de vacinas, etc. No meio TGGY-1 com suplementação de ácido fólico e hemina, foram observadas formas promastigotas de comprimento maior do que aquelas obtidas no meio TGGY-2 com idêntica suplementação (Figura 39). Esses meios diferiram em sua formulação, respectivamente, apenas na presença ou ausência do componente de origem animal peptona de caseína do leite. Nas duas condições de cultivo as culturas foram mantidas sob temperatura de 25ºC ±1 e com ph 7,3 por um período de 28 dias. A exemplo de outros tripanossomatídeos, Leishmania requer hemina para a transformação de promastigotas em amastigotas e como fator de crescimento. Na presença de alta concentração de hemina ocorre um estímulo na produção da proteína do choque térmico (Hsp 90) e diminuição de ß-tubulina acarretando mudanças morfológicas. Nos experimentos com hemina a concentração utilizada foi de 2 mg (3µM) diluída, adicionada em um litro do meio de cultura TGGY-1 e TGGY-2. Em todos os experimentos realizados neste estudo, os meios ou suplementos utilizados foram comparados ao meio BAB com BHI e Urina 121
122 Humana Estéril Feminina avaliada em trabalhos anteriores e tido como um excelente meio para o crescimento primário, manutenção de cepas isoladas e para obtenção de massas parasitárias (Araújo et al, 2002). Novos estudos deverão ser desenvolvidos com o intuito de aperfeiçoar as novas formulações elaboradas para que se torne adequada ao cultivo de grandes massas parasitárias, assim como para suportar a realização de subpassagens. Em um de seus trabalhos, Berens et al (1976) propuseram sete critérios para escolha de uma formulação de meio de cultura semidefinido. As formulações TGGY-1 e TGGY-2 acrescidos de ácido fólico e hemina preencheram seis desses critérios, pois são facilmente preparados e esterilizados; apresentam baixo custo; ambas são monofásicas; sem presença de material particulado para dificultar a contagem dos organismos; permitiram crescimento exponencial de L. (L.) chagasi e Trypanossoma (S.) cruzi e, com possível substituição de alguns dos componentes não definidos. 122
123 6. CONCLUSÃO concluir que: Com base nos resultados obtidos no presente estudo é lícito - A formulação de meio bifásico BAB-BHI com suplemento de urina estéril foi aquela que apresentou o melhor desempenho para o crescimento primário e para a proliferação de Leishmania sp.; - A suplementação de urina estéril possibilitou, ao meio bifásico BAB-BHI, o prolongamento da fase logarítimica de proliferação de Leishmania spp. - A formulação TGGY-1 com suplementação de ácido fólico e hemina mostrou-se adequada para permitir o crescimento primário de Leishmania e mesmo razoável proliferação in vitro; - A formulação TGGY-2 com suplementação de hemina apresentou desempenho satisfatório permitindo a proliferação das amostras de referência; - L.(L.) amazonensis e L.(V.) braziliensis exigiram hemina e ácido fólico como fatores de crescimento em meio de cultura; - L.(L.) chagasi e T.(S.) cruzi apresentaram proliferação na presença e na ausência de hemina e ácido fólico nos meios de cultura; 123
124 - A ausência de materiais suspenso neste dois meios facilitou a observação microscópica; - Os meios TGGY-1 e TGGY-2, com ou sem suplementação, são facilmente preparados e esterilizados; - A criopreservação das amostras de aspirado de baço de cães, em solução glicerinada, mostrou-se alternativa viável para a recuperação do parasita; - Mudanças na morfologia podem ocorrer devido ao estresse provocada pela falta de algum componente no meio de cultura e não apenas por alteração de ph e temperatura. - Os meios de cultura TGGY-1 e TGGY-2, com suplementação, possibilitaram a obtenção de parasitas livres de sangue, soro ou outros contaminantes, podendo ser adequado para estudos bioquímicos e imunológicos. - Necessidade de novas avaliações de desempenho em passagens seriadas nas formulações TGGY-1 e TGGY-2 entre o 5 o e 7 o dia do crescimento; - Necessidade de estudos sobre a composição da membrana de formas amastigota-like obtidas nos meios TGGY-1 e TGGY-2 com ácido fólico e com hemina. 124
125 REFERÊNCIAS BIBLIOGRÁFICAS Alencar JE. Leishmaniose Visceral no Novo Mundo. Publicações Médicas. Rio de Janeiro 1956, v 196, p Alencar JE. Profilaxia do Calazar no Ceará, Brasil. Rev Inst Med Trop São Paulo 1961;3: Araújo MFL, Taniguchi HH, Bisugo MC, Cunha EA, Garcia EL, Tolezano JE, et al. Human sterile urine as Leishmania enrichment factor for Leishmania development in vitro in absence of foetal serum calf. Rev Inst Med Trop São Paulo 2002; 44 (Suppl.12). Araújo MFL, Oliveira OR, Garcia AS, Castelão KG; Bisugo MC, Cunha EA, et al. Urina Humana estéril como fator de enriquecimento para o crescimento primário de Leishmania. Influência da fonte de urina humana e do procedimento para a coleta de amostras biológicas de cães naturalmente infectados em regiões endêmicas para leishmaniose visceral. Bol. Inst. Adolfo Lutz 2004: 14; Araújo MFL, Colombo FA, Cunha EA, Taniguchi HH, Bisugo MC, Garcia EL, et al. Isolamento de Leishmania sp em meios acelulares de cultura, suplementados com urina humana estéril e, na ausência de soro fetal bovino. Boletim do Instituto Adolfo Lutz 2004: 14; Arias JR, Monteiro PS, Zicker F. Reemergence of visceral leishmaniasis in Brazil. EID 1996; 2 (2). 125
126 Armstrong TC, Patterson JL. Cultivation of Leishmania braziliensis in an economical serum-free medium containg human urine. J Parasitol 1994; 80 (6): Ashford RW, Bettini S. Ecology and Epidemiology: Old world. In: The Leishmaniasis in Biology and Medicine. Biology and Epidemiology. Peters W & Killick-Kendrick R (editors). Academic Press. Inc. London 1987: vol 1; Balanco JMF, Pral EMF, Silva S, Bijovsky AT, Mortara RA, Alfieri SC. Axenic cultivation and partial characterization of Leishmania braziliensis amastigote-like stages. Parasitology 1998: 116; Badaró R, Reed SG. Leishmanioses In: Diagnóstico Laboratorial das Principais Doenças Infecciosas e Auto-Imunes. Rio de Janeiro; Guanabara Koogan; p Berens RL, Brun R, Krassner SM. A simple monophasic medium for axenic culture of hemoflagelates.the J Parasitol 1976 June; 62 (3): Camargo-Neves VLF. Aspectos epidemiológicos e avaliação das medidas de controle da Leishmaniose Visceral Americana no Estado de São Paulo, Brasil. [dissertação de Mestrado]. São Paulo: Faculdade de Saúde Pública da Universidade de São Paulo; Carvalho MLR et al. Leishmaniose tegumentar no Estado de Mato Grosso (Brasil): estudo clínico, laboratorial e terapêutico. An Bras Derm 2002; 77 (1):
127 Center Disease Control Acesso em 11/04/2007 Disponível em Coelho LIAR, Paes MG, Souza JU, Oliveira RS. Diagnóstico Parasitológico de Leishmanioses por Método de Coloração Alternativo. NewsLab 2006; 75: Comité OMS d experts sur la lutte contre la leishmanioses. Lutte contre les leishmanioses: apporte d un Comité OMS déxperts. Organization Mondiale de la Santé. Série de rapports techniques, 793, Genéve, Suisse, Coordenadoria de Controle de Doenças. Manual de Vigilância e Controle da Leishmaniose Visceral Americana do Estado de São Paulo. São Paulo, Davies CR, Kaye P, Croft S, & Sundar S. Leishmaniais: new approaches to disease control. BMJ 2003 febry; 326: Deane LM, Deane MP. Leishmaniose Visceral no Brasil. Estudos sobre reservatórios e transmissores realizados no Estado do Ceará. Serviço Nacional de Educação Sanitária, Rio de Janeiro Degrave W, Fernandes O, Campbell D, Bozza M, Lopes U. Use of Molecular Probes and PCR for Detection and Typing of Leishmania a Mini Review. Memórias do Instituto Adolfo Lutz Jul/sep 1994; 89 (3):
128 Evans DA.. Leishmania. In: Vitro methods for parasite cultivation. In AER Taylor, JR Baker (ed.) Academic Press Inc, New York,1987; p Falqueto A. Especificidade alimentar de flebotomíneos em duas áreas endêmicas de Leishmaniose Tegumentar no Estado de Espírito Santo. Tese. Rio de Janeiro. Instituo Oswaldo Cruz Fundação Oswaldo Cruz; Gállego M. Zoonoses emergentes por patógenos parásitos: las leishmaniasis. Rev Sci Tech Off Int Epiz 2004; 23: Gontijo CM, Melo MN. Leishmaniose Visceral no Brasil: quadro atual, desafios e perspectivas. Rev Bras Epidemiol 2004; 7 (3): Grimaldi G Jr, Tesh RB. leishmaniasis of the new world: current concepts and implications for future research. Clin Microbiol Reviews1993; 7: Howard MK, Pharoah MM, Ashall F, Miles AM. Human urine stimulates growth of Leishmania in vitro.trans R S Trop Med Hyg 1991; 86: Ismaeel AY, Garmson JC, Molyneux DH, Bates PA. Transformation, development, and transmission of axenically cultured amastigotes of Leishmania mexicana in vitro and in Lutzomyia longipalpis. Am J Trop Med Hyg 1998; 59 (3): Kar K. Folic acid the essential supplement to brain heart infusion broth for cultivation and cloning of Leishmania donovani promastigotes. Parasitology 1997; 115:
129 Killick-Kendrick R & Ward RD. Ecology of Leishmania. Parasitology 1981; 82: Krobitsch S, Brandau S, Hoyer C, Schmetz C, Hübel A, Clos J. Leishmania donovani Heat Shock Protein 100 Characterization and function in amastigote stage differentiation. The J Biol Chem 1998 Mar; 273 (11): Lachaud L, Marchergui-Hammami S, Chabbert E, Dereure J, Dedet JP, Bastien P. Comparaison of Six PCR Methods Using Peripheral Blood for Detection of Canine Visceral Leishmaniasis. J Clinical Microbiology 2002 Jan; 40 (1): Lainson R, Shaw JJ, Epidemiological considerations of the leishmaniasis with particular reference to New World. In Ecology and Physiology of Parasites. AM Fallis eds, University of Toronto Press; p Lainson R, Shaw JJ. The Role of Animals in the Epidemiology of South American Leishmaniasis. In: Biology of the Kinetoplastida. W.H.R. Lumsden and D.A. Evans (Editor).Academic Press 1979: vol 2; pag Lainson R, Shaw JJ. Evolution, classification and geographical distribution. In: The Leishmaniasis in Biology and Medicine. Vol 1 Biology and Epidemiology. London Eds : Peters W, Killick Kendrick R. Academic Press, 1987 a. p Lainson R, Shaw JJ. Ecology and epidemiology: New World. In: The Leishmaniasis in Biology and Medicine. Vol 1 Biology and Epidemiology. London: Eds : Peters W, Killick Kendrick R. Academic Press, 1987 b. p
130 Lainson R, Shaw JJ. A brief history of the genus Leishmania (Protozoa: Kinetoplastida) in the Americas with particular reference to Amazonian Brazil. Ciência e Cultura 1992: 44; Limoncu ME, Balcioglu C, Yereli K, Ozbel Y, Özbilgin A. A New Experimental In Vitro Culture Medium for Cultivation of Leishmania Species. Journal of Clinical Microbiology, 1997 Sept; 35 (9): Marzochi MCA, Shubach AO, Marzochi KBF. Leishmaniose Tegumentar Americana In: Parasitologia humana e seus fundamentos gerais. Cimerman B e Cimerman S eds São Paulo, Editora Atheneu. Mello DA, Rego FA, Oshiro E, Nunes VLB. Cerdocyon thous (Carnívora) Canidae naturally infected with Leishmania donovani Chagasi (Cunha e Chagas, 1937) in Corumbá (Mato Grosso do Sul, Brasil). Mem Inst Oswaldo Cruz 1988; 83: 259. Melo NM, Azevedo HP, Roitman I, Mayrink W, A new defined médium for cultivating Leishmania promastiogtes. Acta Trop 1985; 42: Merlen T, Sereno D, Brajon N, Rostand F, Lemesre JL. Leishmania spp.: Completely defined medium without serum and macromolecules (CDM/LP) for the continuous in vitro cultivation of infective promastigote forms. Am J Trop Med Hyg 1999; 60 (1):
131 Ministério da Saúde. Manual de Controle da Leishmaniose Tegumentar. Brasília (DF); Ministério da Saúde. Manual de Vigilância e Controle da Leishmaniose Visceral. Brasília (DF); Neogy AB, Vouldoukis I, Silva OA, Tselentis Y, Lascombe JC, Segalen T, et al. Serodiagnosis and screening of canine visceral leishmaniasis in an endemic area of Corsica: aplicabilitys of a direct agglutination test and immunoblot analysis. Am J Trop Med Hyg. 1992; 47 (6): Nicole CH. Culture du parasite du Bouton d Orient. CR Hebdom Sci Acad Sci Paris. 1908; 146: Novy FG, MacNeal WJ. On the cultivation of Trypanosoma brucei. J Infect Dis. 1904; 1: Pal JK, Joshi-Purandare M. Dose-dependent differential effect of hemin on protein synthesis and cell proliferation in Leishmania donovani promastigotes cultured in vitro. Pinto CM. Ocorrência de Leishmania sp. Em animais domésticos e silvestres em Capão Bonito, são Paulo, Brasil. [Tese de Doutorado]. São Paulo: Faculdade de Medicina Veterinária e Zootecnica da Universidade de São Paulo; Puentes F, Diaz D, Hoya RD, Gutiérrez JA, Lozano JM, Patarroyo ME, Moreno A. Cultivation and Characterization of stable Leishmania guyanensis complex axenic amastigotes derived from infected U937 cells. Am J Trop Med Hyg 2000; 63 (1,2):
132 Rodriguez et al. Diagnosis of Cutaneous Leishmaniais and Species Discrimination of Parasites by PCR and Hybridization. Journal of Clinical Microbiology 1994 Sept; 32: Sadigursky M, Brodskyn C. A new liquid medium without blood and serum for culture of hemoflagellates. Am J Trop Med Hyg 1986; 35 (5): Sampaio RNR, Andrade GB, Pereira AC, Silva EA, Cuba CAC. Estudo Comparativo de técnicas de demonstração de amastigotas e isolamento de promastigotas no diagnóstico da leishmaniose tegumentar americana. An brás Dermatol 2002 Set/out; 77 (5): Schnur LF, Jacobson RL. Appendix III Parasitological techniques In: The Leishmaniases in Biology and Medicine. W.Peters & R.Killick-Kendrick (Editor) Vol.I pag ; Schuster FL, Sullivan JJ. Cultivation of Clinically Significant Hemoflagellates. Amaerican Society for Microbiology. Rev. Clin Microbiol 2002July; 15 (3): Sengupta S, Tripathi J, Tandon R, Raje M, Roy RP, Basu SK, Mukhopadhyay A. Hemoglobin endocytosis in Leishmania is mediated through a 46 kda protein located in the flagellar pocket. The J of Biol Chem 1999 Jan; 274 (5): Shamsuzzaman SM, Furuya M, Korenaga M, Imamura K, Hashiguchi. Use of urine samples from healthy humana, nephritis patients or other animals as an alternative to foetal calf serum in the culture of Leishmania (L) donovani in vitro. Ann Trop Med & Paras 1999: 93 (6);
133 Shapira M, McEwen JG, Jaffe CL. Temperature effects on molecular processes which lead to stage differentiation in Leishmania. The EMBO J 1988: 7 (9); Strauss-Ayali D, Baneth G. Canine Visceral Leishmaniasis. In: Recent advances in canine infections diseases. L. Carmichael (ED). International Veterinary Information Service. [Acesso em: 26/07/2006] Disponível em: Sundar S, Rai M. Laboratory Diagnosis of Visceral Leishmaniasis. Clinical and Diagnostic Laboratory Immunology 2002 Sept: 9 (5): Taniguchi HH. Observações ecológicas de flebotomíneos em área endêmica de Leishmaniose Tegumentar Americana no Município de Eldorado, Vale do Ribeira, Estado de São Paulo, Brasil, Período de [dissertação de Mestrado]. São Paulo: Faculdade de Saúde Pública da Universidade de São Paulo; Tolezano JE. Ecoepidemiologia da Leishmaniose Tegumentar Americana (LTA).Perpetuação da LTA no Estado de São Paulo, região endêmica de colonização antiga. [Tese de Doutorado]. São Paulo. Instituto de Ciências Biomédicas da Universidade de São Paulo; Travi BL, Jaramillo C, Montoya JAA, Segura IZEA, Gonçalves A, Vélez ID. Didelphis marsupialis, an important reservoir of Trypanosoma (Schizotrypanum) cruzi and Leishmania 133
134 (Leishmania) chagasi in Colômbia. Am J Trop Med and Hyg 1994; 50: Zilberstein D, Shapira M. The role of ph and temperature in the development of Leishmania parasites. Annu Rev Microbiol 1994: 48;
135 ANEXO I 135
136
137 Planilha com os dados de todos os cães utilizados nestes estudos Amostras RAÇA SEXO Avaliação clínica em campo Achados de necrópsia rk-39 cultura PCR RIFI Cães em campo sangue total L.(L) chagasi PNP 99 SRD Macho emagrecimento, conjuntivite esplenomegalia negativo negativa negativo não realizado PNP 100 SRD Macho assintomático nódulos no baço negativo negativa negativo não realizado PNP 101 SRD Fêmea unhas longas baço rugoso negativo negativa não realizado não realizado PNP 102 SRD Fêmea emagrecimento esplenomegalia negativo negativa negativo não realizado PNP 103 SRD Fêmea lesões, unhas longas esplenomegalia positivo negativa não realizado não realizado PNP 104 Pincher Macho caquexia, unhas longas negativo positivo positiva não realizado não realizado PNP 105 SRD Macho emagrecimento, conjuntivite, unhas longas negativo positivo negativa não realizado não realizado PNP 106 SRD Fêmea emagrecimento e unhas longas negativo positivo positiva positivo não realizado PNP 107 Boxer Fêmea unhas longas esplenomegalia positivo negativa não realizado não realizado PNP 108 Poodle Macho unhas longas esplenomegalia positivo positiva negativo não realizado PNP 109 SRD Fêmea lesões, unhas longas negativo negativo positivo não realizado não realizado PNP 110 Boxer Fêmea caquexia, unhas longas, unhas longas negativo positivo positivo não realizado não realizado PNP 111 SRD Macho assintomático esplenomegalia negativo negativa não realizado não realizado PNP 112 Pincher Macho emagrecimento e unhas longas esplenomegalia positivo positiva positivo não realizado PNP 113 SRD Macho dermatite, conjuntivite, unhas longas esplenomegalia positivo positiva positivo não realizado PNP 114 SRD Macho assintomático esplenomegalia negativo positiva não realizado não realizado PNP 115 SRD Macho unhas longas esplenomegalia positivo positivo não realizado não realizado PNP 116 Daschound Macho unhas longas esplenomegalia positivo positiva positivo não realizado PNP 117 Daschound Fêmea unhas longas esplenomegalia positivo positiva não realizado não realizado PNP 118 SRD Macho emagrecimento, unhas longas esplenomegalia fraco positivo negativa não realizado não realizado PNP 119 SRD Fêmea assintomático esplenomegalia negativo negativa não realizado não realizado PNP 120 SRD Macho caquexia, unhas longas baço espessado negativo positiva não realizado não realizado PNP 31 Poodle Fêmea emagrecimento e convulsão negativo não realizado negativa não realizado não realizado PNP 32 SRD Fêmea emagrecimento, caquexia, diarréia c/sangue baço segmentado não realizado negativa não realizado não realizado PNP 33 SRD Macho unhas longas, dermatite esplenomegalia não realizado negativa não realizado não realizado 137
138 Amostras RAÇA SEXO Avaliação clínica em campo Achados de necrópsia rk-39 cultura PCR RIFI Cães em campo sangue total PNP 34 SRD Fêmea assintomático mesentério hemorrágico não realizado positiva negativo positivo PNP 35 Poodle Macho assintomático esplenomegalia não realizado positiva não realizado não realizado PNP 36 SRD Macho unhas longas, dermatite esplenomegalia não realizado negativa não realizado positivo PNP 37 SRD Macho emagrecimento, unhas longas Negativo não realizado positiva positivo positivo PNP 38 Basset Macho emagrecimento, unhas longa, dermatite esplenomegalia não realizado negativa não realizado positivo PNP 39 Pastor Macho mesentério hemorrágico hepatoesplenomegalia não realizado negativa negativo não realizado hepatoesplenomegalia, ATB 40 SRD Macho lesões, dermatite, conjuntivite lesões não realizado negativa não realizado não realizado ATB 41 SRD Macho dermatite, conjuntivite, unhas longas esplenomegalia não realizado positiva não realizado positivo ATB 42 SRD Fêmea assintomático mesentério hemorrágico não realizado positiva não realizado positivo ATB 43 Pincher Macho conjuntivite, lesões, ascite Negativo não realizado positiva não realizado esplenomegalia, baço ATB 44 SRD Macho emagrecimento, unhas longas, lesões c/lesões não realizado positiva positivo não realizado ATB 45 SRD Fêmea dermatite, lesões, unhas longas esplenomegalia não realizado positiva não realizado não realizado ATB 46 SRD Macho unhas longas, conjuntivite, emagrecimento esplenomegalia não realizado negativa não realizado não realizado ATB 47 SRD Macho emagrecimento, unhas longas, dermatitie esplenomegalia não realizado positiva não realizado não realizado esplenomegalia com ATB 48 Poodle Macho assintomático nodulos não realizado positiva não realizado não realizado ATB 49 SRD Macho emagrecimento esplenomegalia não realizado positiva não realizado não realizado ATB 50 SRD Macho dermatite, unhas longas hepatoesplenomegalia não realizado positiva não realizado não realizado ATB 51 SRD Fêmea dermatite, unhas longas, conjuntivite hepatoesplenomegalia não realizado positiva positivo não realizado ATB 52 SRD Fêmea alopecia, unhas longas hepatoesplenomegalia não realizado negativa não realizado não realizado ATB 53 coocker Macho emagrecimento, conjuntivite hepatoesplenomegalia não realizado positiva não realizado não realizado ATB 54 SRD Macho emagrecimento, unhas longas esplenomegalia não realizado negativa não realizado não realizado ATB 55 SRD Macho Lesões hepatoesplenomegalia não realizado negativa não realizado não realizado ATB 56 SRD Macho assintomático mesentério hemorrágico não realizado negativa não realizado não realizado ATB 57 SRD Macho emagrecimento hepatoesplenomegalia não realizado negativa não realizado não realizado ATB 58 SRD Macho assintomático esplenomegalia não realizado positiva não realizado não realizado esplenomegalia com ATB 59 Poodle Fêmea unhas longas, conjuntivite nodulos não realizado negativa não realizado não realizado 138
139 Amostras RAÇA SEXO Avaliação clínica em campo Achados de necrópsia rk-39 cultura PCR RIFI Cães em campo sangue total ATB 60 SRD Fêmea unhas longas hepatoesplenomegalia não realizado negativa não realizado não realizado MS 11 SRD Macho assintomático esplenomegalia e ictérico positivo positiva positivo positivo MS 14 SRD Macho emagrecim., unhas longas,dermatite,caquex esplenomegalia positivo negativa positivo positivo MS 26 SRD Fêmea unhas longas esplenomegalia negativo positiva positivo positivo MS 27 SRD Fêmea Dermatite esplenomegalia positivo positiva positivo positivo MS 35 SRD Macho Caquexia Negativo positivo positiva positivo positivo MS 55 SRD Macho unhas longas esplenomegalia e nódulos positivo negativa não realizado negativo MS 91 Pastor Macho assintomático esplenomegalia negativo negativa negativo positivo MS 93 SRD Macho assintomático esplenomegalia positivo positiva negativo negativo MS 131 Pastor Macho lesões, patas traseiras edemaciadas esplenomegalia positivo negativa positivo negativo MS 134 SRD Macho emagrecim.,lesão base ouvido espleno, nódulos negativo negativa positivo positivo PNP = Penápolis ATB = Araçatuba MS = Mato Grosso do Sul (Campo Grande) rk 39 = teste rápido para Leishmania (L.) chagasi RIFI = Reação de Imunofluorescência Indireta 139
140 ANEXO II 140
141 141
Complexo Leishmania donovani Forte tendência a visceralização (baço, fígado, medula óssea e órgãos linfóides).
 ORDEM: KINETOPLASTIDA FAMÍLIA: TRYPANOSOMATIDAE GÊNERO: Leishmania Classificações: A) SUBGÊNEROS: Leishmania Viannia B) COMPLEXOS: Parasitologia (Nutrição) Aula 4 (26/03) Leishmania Profa. Adriana Pittella
ORDEM: KINETOPLASTIDA FAMÍLIA: TRYPANOSOMATIDAE GÊNERO: Leishmania Classificações: A) SUBGÊNEROS: Leishmania Viannia B) COMPLEXOS: Parasitologia (Nutrição) Aula 4 (26/03) Leishmania Profa. Adriana Pittella
Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública
 Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública LEISHMANIOSE CANINA Leishmanose Tegumentar America LTA Leishmania Visceral - LV Adivaldo
Universidade Federal Rural do Rio de Janeiro Instituto de Veterinária Departamento de Epidemiologia e Saúde Pública LEISHMANIOSE CANINA Leishmanose Tegumentar America LTA Leishmania Visceral - LV Adivaldo
Gênero Leishmania. século XIX a febre negra ou Kala-azar era temida na Índia. doença semelhante matava crianças no Mediterrâneo
 Leishmaniose Leishmaniose é um espectro de doenças produzidas por Leishmania sp. cuja manifestação clínica varia de infecção assintomática tica à morte Gênero Leishmania Histórico século XIX a febre negra
Leishmaniose Leishmaniose é um espectro de doenças produzidas por Leishmania sp. cuja manifestação clínica varia de infecção assintomática tica à morte Gênero Leishmania Histórico século XIX a febre negra
Relações Parasitas e Hospedeiros. Aula 06 Profº Ricardo Dalla Zanna
 Relações Parasitas e Hospedeiros Aula 06 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 2 Hemoparasitoses o Seção 2.1 Toxoplasmose e Doença de Chagas o Seção 2.2 Leishmaniose oseção 2.3 Malária
Relações Parasitas e Hospedeiros Aula 06 Profº Ricardo Dalla Zanna Conteúdo Programático Unidade 2 Hemoparasitoses o Seção 2.1 Toxoplasmose e Doença de Chagas o Seção 2.2 Leishmaniose oseção 2.3 Malária
Leishmanioses. Zoonoses e Administração em Saúde Pública Universidade Federal de Pelotas. Prof. Fábio Raphael Pascoti Bruhn
 Leishmanioses Zoonoses e Administração em Saúde Pública Universidade Federal de Pelotas Prof. Fábio Raphael Pascoti Bruhn Porque estudar a leishmaniose? Leishmaniose visceral Doença negligenciada associada
Leishmanioses Zoonoses e Administração em Saúde Pública Universidade Federal de Pelotas Prof. Fábio Raphael Pascoti Bruhn Porque estudar a leishmaniose? Leishmaniose visceral Doença negligenciada associada
SITUAÇÃO ATUAL DA LEISHMANIOSE VISCERAL NO ESTADO DO CEARÁ
 SITUAÇÃO ATUAL DA LEISHMANIOSE VISCERAL NO ESTADO DO CEARÁ Ana Paula Cunha Gomes Bouty Médica Veterinária Assessora Técnica GT-Leishmanioses NUVET/COVIG/SESA Leishmaniose Visceral A leishmaniose visceral
SITUAÇÃO ATUAL DA LEISHMANIOSE VISCERAL NO ESTADO DO CEARÁ Ana Paula Cunha Gomes Bouty Médica Veterinária Assessora Técnica GT-Leishmanioses NUVET/COVIG/SESA Leishmaniose Visceral A leishmaniose visceral
Universidade de São Paulo -USP. Leishmanioses. Luciana Benevides. Ribeirão Preto- 2013
 Universidade de São Paulo -USP Leishmanioses Luciana Benevides Ribeirão Preto- 2013 Tópicos abordados Definição Leishmaniose Vetores Parasita Manifestações clínicas Epidemiologia Classificação das doenças
Universidade de São Paulo -USP Leishmanioses Luciana Benevides Ribeirão Preto- 2013 Tópicos abordados Definição Leishmaniose Vetores Parasita Manifestações clínicas Epidemiologia Classificação das doenças
Leishmaniose. Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi, causador de Chagas).
 Leishmaniose Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Kinetoplastida (porque tem cinetoplasto) Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi,
Leishmaniose Parasito Reino: Protozoa Filo: Sarcomastigophora (porque possui flagelo) Ordem: Kinetoplastida (porque tem cinetoplasto) Família: Trypanosomatidae (da mesma família que o Trypanosoma cruzi,
Agente etiológico. Leishmania brasiliensis
 Leishmaniose Agente etiológico A leishmaniose é causada por protozoários flagelados chamados Leishmania brasiliensis e Leishmania chagasi, que invadem e se reproduzem dentro das células que fazem parte
Leishmaniose Agente etiológico A leishmaniose é causada por protozoários flagelados chamados Leishmania brasiliensis e Leishmania chagasi, que invadem e se reproduzem dentro das células que fazem parte
TÍTULO: OCORRÊNCIA DE LEISHMANIA SP DETECTADA POR PCR EM LABORATÓRIO DE PATOLOGIA CLÍNICA PARTICULAR DE SP
 Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: OCORRÊNCIA DE LEISHMANIA SP DETECTADA POR PCR EM LABORATÓRIO DE PATOLOGIA CLÍNICA PARTICULAR
Anais do Conic-Semesp. Volume 1, 2013 - Faculdade Anhanguera de Campinas - Unidade 3. ISSN 2357-8904 TÍTULO: OCORRÊNCIA DE LEISHMANIA SP DETECTADA POR PCR EM LABORATÓRIO DE PATOLOGIA CLÍNICA PARTICULAR
11 a 14 de dezembro de 2012 Campus de Palmas
 SENSIBILIDADE E ESPECIFICIDADE DA IMUNOFLUORESCÊNCIA INDIRETA UTILIZANDO CEPA DE LEISHMANIA SPP. ISOLADA DE CÃO DA CIDADE DE ARAGUAÍNA-TO NO DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA. Emerson Danillo
SENSIBILIDADE E ESPECIFICIDADE DA IMUNOFLUORESCÊNCIA INDIRETA UTILIZANDO CEPA DE LEISHMANIA SPP. ISOLADA DE CÃO DA CIDADE DE ARAGUAÍNA-TO NO DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA. Emerson Danillo
Leishmaniose Tegumentar Americana
 Leishmaniose Tegumentar Americana (Leishmania) Prfª. M.Sc. Yara Bandeira Azevedo UNIFAN Leishmania Filo: Sarcomastigophora Subfilo: Mastigophora Ordem: Kinetoplastida Família: Trypanosomatidae Gênero:
Leishmaniose Tegumentar Americana (Leishmania) Prfª. M.Sc. Yara Bandeira Azevedo UNIFAN Leishmania Filo: Sarcomastigophora Subfilo: Mastigophora Ordem: Kinetoplastida Família: Trypanosomatidae Gênero:
FAMÍLIA TRYPANOSOMATIDAE
 FAMÍLIA TRYPANOSOMATIDAE CLASSIFICAÇÃO: FILO SARCOMASTIGOPHORA(flagelos, pseudópodes ou ambos) SUBFILO MASTIGOPHORA (protozoários com 1 ou + flagelos) FAMÍLIA TRYPANOSOMATIDAE: São nove gêneros que parasitam
FAMÍLIA TRYPANOSOMATIDAE CLASSIFICAÇÃO: FILO SARCOMASTIGOPHORA(flagelos, pseudópodes ou ambos) SUBFILO MASTIGOPHORA (protozoários com 1 ou + flagelos) FAMÍLIA TRYPANOSOMATIDAE: São nove gêneros que parasitam
Módulo: Nível Superior Dezembro/2014 GVDATA
 Módulo: Nível Superior Dezembro/2014 GVDATA Classificada no grupo de doenças extremamente negligenciadas Leishmanioses Volta Redonda Barra Mansa Rio de Janeiro Niterói Definição de Caso suspeito Todo individuo
Módulo: Nível Superior Dezembro/2014 GVDATA Classificada no grupo de doenças extremamente negligenciadas Leishmanioses Volta Redonda Barra Mansa Rio de Janeiro Niterói Definição de Caso suspeito Todo individuo
Eficiência da PCR convencional na detecção de Leishmania spp em sangue, pele e tecidos linfoides
 Eficiência da PCR convencional na detecção de Leishmania spp em sangue, pele e tecidos linfoides Aluna: Carina de Mattos Soares Orientadora: Dra Cídia Vasconcellos Supervisora: Dra Vânia Lucia Ribeiro
Eficiência da PCR convencional na detecção de Leishmania spp em sangue, pele e tecidos linfoides Aluna: Carina de Mattos Soares Orientadora: Dra Cídia Vasconcellos Supervisora: Dra Vânia Lucia Ribeiro
Manual de Vigilância e Controle das Leishmanioses
 Secretaria Estadual de Saúde de Mato Grosso Superintendência de Vigilância em Saúde Coordenadoria de Vigilância em Saúde Ambiental Gerência de Vigilância de Vetores e Antropozoonoses Manual de Vigilância
Secretaria Estadual de Saúde de Mato Grosso Superintendência de Vigilância em Saúde Coordenadoria de Vigilância em Saúde Ambiental Gerência de Vigilância de Vetores e Antropozoonoses Manual de Vigilância
ESTUDO DO PERFIL EPIDEMIOLÓGICO DA LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE
 ESTUDO DO PERFIL EPIDEMIOLÓGICO DA LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE Raquel Costa e Silva 1 ; Karla Gomes Cunha 2 ; Gerlane Guedes Delfino da Silva³; Lucas Ermando Ricardo da Silva 4 ; Josimar dos
ESTUDO DO PERFIL EPIDEMIOLÓGICO DA LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE Raquel Costa e Silva 1 ; Karla Gomes Cunha 2 ; Gerlane Guedes Delfino da Silva³; Lucas Ermando Ricardo da Silva 4 ; Josimar dos
LEISHMANIOSE CANINA Prof. Rafael Fighera
 LEISHMANIOSE CANINA Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Leishmaniose
LEISHMANIOSE CANINA Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria Leishmaniose
NOVO CONCEITO. Nova proposta para a prevenção da Leishmaniose Visceral Canina UMA DUPLA PROTEÇÃO PARA OS CÃES. CONTRA O VETOR E O PATÓGENO!
 NOVO CONCEITO Nova proposta para a prevenção da Leishmaniose Visceral Canina UMA DUPLA PROTEÇÃO PARA OS CÃES. CONTRA O VETOR E O PATÓGENO! Repelente de uso tópico para cães Vacina recombinante contra Leishmaniose
NOVO CONCEITO Nova proposta para a prevenção da Leishmaniose Visceral Canina UMA DUPLA PROTEÇÃO PARA OS CÃES. CONTRA O VETOR E O PATÓGENO! Repelente de uso tópico para cães Vacina recombinante contra Leishmaniose
ASSOCIAÇÃO DA CARGA PARASITÁRIA NO EXAME CITOLÓGICO DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO COM O PERFIL CLÍNICO DE CÃES COM LEISHMANIOSE VISCERAL.
 ASSOCIAÇÃO DA CARGA PARASITÁRIA NO EXAME CITOLÓGICO DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO COM O PERFIL CLÍNICO DE CÃES COM LEISHMANIOSE VISCERAL. WALESSON DE ARAUJO ABREU 1 ; HELCILEIA DIAS SANTOS
ASSOCIAÇÃO DA CARGA PARASITÁRIA NO EXAME CITOLÓGICO DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO COM O PERFIL CLÍNICO DE CÃES COM LEISHMANIOSE VISCERAL. WALESSON DE ARAUJO ABREU 1 ; HELCILEIA DIAS SANTOS
Disciplina de Parasitologia
 Disciplina de Parasitologia Curso de Medicina 2018 Tema: Leishmanioses Profa. Dra. Juliana Quero Reimão Generalidades O que é Leishmaniose? Doença infecciosa, de manifestação cutânea ou visceral, causada
Disciplina de Parasitologia Curso de Medicina 2018 Tema: Leishmanioses Profa. Dra. Juliana Quero Reimão Generalidades O que é Leishmaniose? Doença infecciosa, de manifestação cutânea ou visceral, causada
Vigilância da Leishmaniose Tegumentar Americana no estado do Rio de Janeiro 01/01/2007 a 07/11/2017
 SECRETARIA DE ESTADO DE SAÚDE DO RIO DE JANEIRO SUBSECRETARIA DE VIGILÂNCIA EM SAÚDE SUPERINTENDÊNCIA DE VIGILÂNCIA EPIDEMIOLÓGICA E AMBIENTAL COORDENAÇÃO DE VIGILÂNCIA EPIDEMIOLÓGICA GERÊNCIA DE DOENÇAS
SECRETARIA DE ESTADO DE SAÚDE DO RIO DE JANEIRO SUBSECRETARIA DE VIGILÂNCIA EM SAÚDE SUPERINTENDÊNCIA DE VIGILÂNCIA EPIDEMIOLÓGICA E AMBIENTAL COORDENAÇÃO DE VIGILÂNCIA EPIDEMIOLÓGICA GERÊNCIA DE DOENÇAS
MÉTODOS DE DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA
 MÉTODOS DE DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA DOTTA, Silvia Cristina Nardy Discente do Curso de Medicina Veterinária da FAMED Garça LOT, Rômulo Francis Estangari ZAPPA, Vanessa Docentes da Associação
MÉTODOS DE DIAGNÓSTICO DA LEISHMANIOSE VISCERAL CANINA DOTTA, Silvia Cristina Nardy Discente do Curso de Medicina Veterinária da FAMED Garça LOT, Rômulo Francis Estangari ZAPPA, Vanessa Docentes da Associação
Aula Prática II: Protozoários - Família Trypanosomatidae.
 UFF Universidade Federal Fluminense. PUNF - Polo Universitário de Nova Friburgo. Curso de Biomedicina. Disciplina: Parasitologia Professora: Aline Caseca Volotão. Monitora: Lorraine Herdy Heggendornn.
UFF Universidade Federal Fluminense. PUNF - Polo Universitário de Nova Friburgo. Curso de Biomedicina. Disciplina: Parasitologia Professora: Aline Caseca Volotão. Monitora: Lorraine Herdy Heggendornn.
Leishmanioses. Silvia Reni B. Uliana ICB - USP
 Leishmanioses Silvia Reni B. Uliana ICB - USP Síndromes clínicas Localizada L. braziliensis L. amazonensis etc. Leishmaniose tegumentar Mucocutânea Disseminada L. braziliensis L. braziliensis Difusa L.
Leishmanioses Silvia Reni B. Uliana ICB - USP Síndromes clínicas Localizada L. braziliensis L. amazonensis etc. Leishmaniose tegumentar Mucocutânea Disseminada L. braziliensis L. braziliensis Difusa L.
LEISHMANIOSE LEISHMANIOSE LEISHMANIOSE LEISHMANIOSE. Protista SUB-REINO: REINO: Protozoa FILO: Sarcomastigophora SUBFILO: Mastigophora CLASSE:
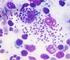 PROTOZOÁRIOS Sarcomastigophora Apicomplexa Ciliophora Mastigophora Sarcodina Babesia Balantidium Trypanosoma Giardia Entamoeba Acanthamoeba Naegleria Eimeria Isospora Sarcocystis Trichomonas Endolimax
PROTOZOÁRIOS Sarcomastigophora Apicomplexa Ciliophora Mastigophora Sarcodina Babesia Balantidium Trypanosoma Giardia Entamoeba Acanthamoeba Naegleria Eimeria Isospora Sarcocystis Trichomonas Endolimax
14/06/12. Esta palestra não poderá ser reproduzida sem a referência do autor
 14/06/12 Esta palestra não poderá ser reproduzida sem a referência do autor ESTA PALESTRA NÃO PODERÁ SER REPRODUZIDA SEM A REFÊNCIA DO AUTOR. LEISHMANIOSE VISCERAL TRANSMISSÃO EM BANCO DE SANGUE Dra. Margarida
14/06/12 Esta palestra não poderá ser reproduzida sem a referência do autor ESTA PALESTRA NÃO PODERÁ SER REPRODUZIDA SEM A REFÊNCIA DO AUTOR. LEISHMANIOSE VISCERAL TRANSMISSÃO EM BANCO DE SANGUE Dra. Margarida
Trypanosoma cruzi Doença de Chagas
 Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
Disciplina de Parasitologia Trypanosoma cruzi Doença de Chagas Profa. Joyce Fonteles Histórico Histórico 1908- Carlos Chagas MG encontrou o parasito no intestino de triatomíneos. 1909- descrição do primeiro
INFORME TÉCNICO PARA MÉDICOS VETERINÁRIOS LEISHMANIOSE VISCERAL AMERICANA
 PREFEITURA MUNICIPAL DE CAMPINAS SECRETARIA MUNICIPAL DE SAÚDE COORDENADORIA DE VIGILÂNCIA EM SAÚDE Avenida Anchieta, 200 11º andar Centro CEP: 13015-904 Tel. (19) 2116-0187 / 0286 E-mail: covisa@campinas.sp.gov.br
PREFEITURA MUNICIPAL DE CAMPINAS SECRETARIA MUNICIPAL DE SAÚDE COORDENADORIA DE VIGILÂNCIA EM SAÚDE Avenida Anchieta, 200 11º andar Centro CEP: 13015-904 Tel. (19) 2116-0187 / 0286 E-mail: covisa@campinas.sp.gov.br
Nota Técnica nº 13 LEISHIMANIOSE VICERAL
 CENTRO DE INFORMAÇÕES ESTRATÉGICAS E RESPOSTA EM VIGILÂNCIA EM SAÚDE Nota Técnica nº 13 LEISHIMANIOSE VICERAL Centro de Informações Estratégicas e Resposta em Vigilância em Saúde Departamento de Epidemiologia/
CENTRO DE INFORMAÇÕES ESTRATÉGICAS E RESPOSTA EM VIGILÂNCIA EM SAÚDE Nota Técnica nº 13 LEISHIMANIOSE VICERAL Centro de Informações Estratégicas e Resposta em Vigilância em Saúde Departamento de Epidemiologia/
Semi-Árido (UFERSA). 2 Farmacêutico bioquímico, Mestre em Ciência Animal. UFERSA 3
 DIAGNÓSTICO CITOPATOLÓGICO DE LEISHMANIOSE VISCERAL CANINA EM REGIÃO ENDÊMICA DO NORDESTE DO BRASIL CITOPATHOLOGICAL DIAGNOSIS OF CANINE VISCERAL LEISHMANIOSIS IN NORTHEAST BRAZIL'S ENDEMIC REGION Yannara
DIAGNÓSTICO CITOPATOLÓGICO DE LEISHMANIOSE VISCERAL CANINA EM REGIÃO ENDÊMICA DO NORDESTE DO BRASIL CITOPATHOLOGICAL DIAGNOSIS OF CANINE VISCERAL LEISHMANIOSIS IN NORTHEAST BRAZIL'S ENDEMIC REGION Yannara
LEISHMANIOSES 31/08/2015. Leishmanioses: etiologia. Leishmanioses: distribuição mundial
 LEISHMANIOSES L E I S H M A N I O S E T E G U M E N T A R A M E R I C A N A L E I S H M A N I O S E V I S C E R A L http://www.zoonoses.org.br/ Fonte: http://www.mdsaude.com/ Fonte: http://www.wspabrasil.org/
LEISHMANIOSES L E I S H M A N I O S E T E G U M E N T A R A M E R I C A N A L E I S H M A N I O S E V I S C E R A L http://www.zoonoses.org.br/ Fonte: http://www.mdsaude.com/ Fonte: http://www.wspabrasil.org/
ALERTA EPIDEMIOLÓGICO
 ALERTA EPIDEMIOLÓGICO Gerência de Vigilância Epidemiológica - Diretoria de Vigilância em Saúde SMS Florianópolis, SC 13 de dezembro de 2017 Leishmaniose Visceral Humana Em 08/12/2017 foi confirmado mais
ALERTA EPIDEMIOLÓGICO Gerência de Vigilância Epidemiológica - Diretoria de Vigilância em Saúde SMS Florianópolis, SC 13 de dezembro de 2017 Leishmaniose Visceral Humana Em 08/12/2017 foi confirmado mais
Levantamento epidemiológico da leishmaniose tegumentar na região Nordeste, Brasil, de 2001 a 2010
 Levantamento epidemiológico da leishmaniose tegumentar na região Nordeste, Brasil, de 2001 a 2010 1 Médico Veterinário UFRPE. E-mail: vagne_melo@hotmail.com Vagne de Melo Oliveira 1 Resumo: Doença parasitária
Levantamento epidemiológico da leishmaniose tegumentar na região Nordeste, Brasil, de 2001 a 2010 1 Médico Veterinário UFRPE. E-mail: vagne_melo@hotmail.com Vagne de Melo Oliveira 1 Resumo: Doença parasitária
LEISHMANIOSE CANINA (continuação...)
 LEISHMANIOSE CANINA (continuação...) Prof. Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria CRITÉRIOS CLÍNICOS PARA SUSPEITA DE
LEISHMANIOSE CANINA (continuação...) Prof. Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria CRITÉRIOS CLÍNICOS PARA SUSPEITA DE
RESUMOS DE PROJETOS
 181 RESUMOS DE PROJETOS... 182 RESUMOS DE PROJETOS 182 ATIVIDADE ANTIPARASITÁRIA DE BYRSONIMA INTERMEDIA SOBRE FORMAS EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 183 EFEITO IN VITRO DE INIBIDORES DE PROTEASES
181 RESUMOS DE PROJETOS... 182 RESUMOS DE PROJETOS 182 ATIVIDADE ANTIPARASITÁRIA DE BYRSONIMA INTERMEDIA SOBRE FORMAS EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 183 EFEITO IN VITRO DE INIBIDORES DE PROTEASES
Palavras- chave: Leishmaniose; qpcr; cães. Keywords: Leishmaniases; qpcr; dogs.
 CONFIRMAÇÃO DO PRIMEIRO CASO DE INFECÇÃO CANINA POR Leishmania infantum NO MUNICÍPIO DE LAVRAS MG. Guilherme Campos de CASTRO¹; Carlos Alberto Silvestre SANTOS²; Thiago Pasqua NARCISO³, Ricardo Toshio
CONFIRMAÇÃO DO PRIMEIRO CASO DE INFECÇÃO CANINA POR Leishmania infantum NO MUNICÍPIO DE LAVRAS MG. Guilherme Campos de CASTRO¹; Carlos Alberto Silvestre SANTOS²; Thiago Pasqua NARCISO³, Ricardo Toshio
ENFERMAGEM DOENÇAS INFECCIOSAS E PARASITÁRIAS. OUTRAS DOENÇAS INFECCIOSAS E PARASITÁRIAS Aula 3. Profª. Tatiane da Silva Campos
 ENFERMAGEM DOENÇAS INFECCIOSAS E PARASITÁRIAS Aula 3 Profª. Tatiane da Silva Campos Poliomielite Doença viral aguda; paralisia flácida de início súbito; déficit motor instala-se subitamente e a evolução
ENFERMAGEM DOENÇAS INFECCIOSAS E PARASITÁRIAS Aula 3 Profª. Tatiane da Silva Campos Poliomielite Doença viral aguda; paralisia flácida de início súbito; déficit motor instala-se subitamente e a evolução
SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE VISCERAL NA PARAÍBA: UMA QUESTÃO DE SAÚDE PÚBLICA
 SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE VISCERAL NA PARAÍBA: UMA QUESTÃO DE SAÚDE PÚBLICA EPIDEMIOLOGICAL SITUATION OF VISCERAL LEISHMANIASIS IN PARAÍBA: A PUBLIC HEALTH QUESTION Suzanna Cavalcante LINS
SITUAÇÃO EPIDEMIOLÓGICA DA LEISHMANIOSE VISCERAL NA PARAÍBA: UMA QUESTÃO DE SAÚDE PÚBLICA EPIDEMIOLOGICAL SITUATION OF VISCERAL LEISHMANIASIS IN PARAÍBA: A PUBLIC HEALTH QUESTION Suzanna Cavalcante LINS
Vestibular1 A melhor ajuda ao vestibulando na Internet Acesse Agora! Leishmaniose
 Leishmaniose Sob a denominação genérica de leishmaniose, a ciência médica descreve um grupo de doenças infecciosas causadas por protozoários do gênero Leishmania, transmitidos ao homem por mosquitos do
Leishmaniose Sob a denominação genérica de leishmaniose, a ciência médica descreve um grupo de doenças infecciosas causadas por protozoários do gênero Leishmania, transmitidos ao homem por mosquitos do
INFECÇÃO SIMULTÂNEA POR Leishmania chagasi E Ehrlichia canis EM CÃES NATURALMENTE INFECTADOS EM SÃO LUÍS, MARANHÃO, BRASIL
 INFECÇÃO SIMULTÂNEA POR Leishmania chagasi E Ehrlichia canis EM CÃES NATURALMENTE INFECTADOS EM SÃO LUÍS, MARANHÃO, BRASIL SIMULTANEOUS INFECTION BY Leishmania chagasi AND Ehrlichia canis IN NATURALLY
INFECÇÃO SIMULTÂNEA POR Leishmania chagasi E Ehrlichia canis EM CÃES NATURALMENTE INFECTADOS EM SÃO LUÍS, MARANHÃO, BRASIL SIMULTANEOUS INFECTION BY Leishmania chagasi AND Ehrlichia canis IN NATURALLY
Unir forças para não expandir
 Alerta à População A leishmaniose visceral (LV) é uma doença grave, causada por um parasito transmitido para pessoas e cães por meio da picada de um inseto (vetor) muito pequeno, conhecido como mosquito
Alerta à População A leishmaniose visceral (LV) é uma doença grave, causada por um parasito transmitido para pessoas e cães por meio da picada de um inseto (vetor) muito pequeno, conhecido como mosquito
Palavras-chaves: Doença cutânea, mosquito-palha, doenças tropicais, Leishmania.
 HISTÓRIA DA LEISHMANIOSE TEGUMENTAR AMERICANA NO ESTADO DE GOIÁS JANINE VARGAS RESUMO O presente projeto visa realizar o levantamento histórico da doença leishmaniose tegumentar americana no Brasil, especificamente
HISTÓRIA DA LEISHMANIOSE TEGUMENTAR AMERICANA NO ESTADO DE GOIÁS JANINE VARGAS RESUMO O presente projeto visa realizar o levantamento histórico da doença leishmaniose tegumentar americana no Brasil, especificamente
BIOLOGIA. Qualidade de Vida das Populações Humanas. Principais doenças endêmicas no Brasil. Prof. ª Daniele Duó.
 BIOLOGIA Qualidade de Vida das Populações Humanas Principais doenças endêmicas no Brasil Prof. ª Daniele Duó - História da Epidemiologia Hipócrates (mais de 2000 anos) fatores ambientais influenciam a
BIOLOGIA Qualidade de Vida das Populações Humanas Principais doenças endêmicas no Brasil Prof. ª Daniele Duó - História da Epidemiologia Hipócrates (mais de 2000 anos) fatores ambientais influenciam a
AVALIAÇÃO EPIDEMIOLOGICA DA LEISHMANIOSE VISCERAL NA CIDADE DE IMPERATRIZ, MARANHÃO. Natã Silva dos Santos 1 Graduando em Enfermagem
 AVALIAÇÃO EPIDEMIOLOGICA DA LEISHMANIOSE VISCERAL NA CIDADE DE IMPERATRIZ, MARANHÃO. Natã Silva dos Santos 1 Graduando em Enfermagem Universidade Federal do Maranhão-natan.silva0@gmail.com Gustavo de Almeida
AVALIAÇÃO EPIDEMIOLOGICA DA LEISHMANIOSE VISCERAL NA CIDADE DE IMPERATRIZ, MARANHÃO. Natã Silva dos Santos 1 Graduando em Enfermagem Universidade Federal do Maranhão-natan.silva0@gmail.com Gustavo de Almeida
Aprimorando em Medicina Veterinária, Fundação Educacional de Ituverava Faculdade Dr. Francisco Maeda (FAFRAM),
 LEVANTAMENTO EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL AMERICANA, NOS ANOS DE 2009 E 2010 EM MUNICÍPIO DE REGIÃO ENDÊMICA DO NOROESTE DO ESTADO DE SÃO PAULO. Karine Lopes PINTO 1 ; Aline Gomes de CAMPOS
LEVANTAMENTO EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL AMERICANA, NOS ANOS DE 2009 E 2010 EM MUNICÍPIO DE REGIÃO ENDÊMICA DO NOROESTE DO ESTADO DE SÃO PAULO. Karine Lopes PINTO 1 ; Aline Gomes de CAMPOS
RESUMOS COM RESULTADOS ARTIGOS COMPLETOS (RESUMOS)
 217 RESUMOS COM RESULTADOS... 218 ARTIGOS COMPLETOS (RESUMOS)... 220 RESUMOS COM RESULTADOS 218 ATIVIDADE ANTIPARASITÁRIA DA VIOLETA GENCIANA SOBRE EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 219 219 Pesquisa
217 RESUMOS COM RESULTADOS... 218 ARTIGOS COMPLETOS (RESUMOS)... 220 RESUMOS COM RESULTADOS 218 ATIVIDADE ANTIPARASITÁRIA DA VIOLETA GENCIANA SOBRE EPIMASTIGOTAS DE TRYPANOSOMA CRUZI... 219 219 Pesquisa
LEISHMANIOSE HUMANA E CANINA
 LEISHMANIOSE HUMANA E CANINA O QUE É LEISHMANIOSE? É uma doença CAUSADA por protozoários do gênero Leishmania No Brasil existem atualmente seis espécies de protozoários responsáveis por causar doença humana.
LEISHMANIOSE HUMANA E CANINA O QUE É LEISHMANIOSE? É uma doença CAUSADA por protozoários do gênero Leishmania No Brasil existem atualmente seis espécies de protozoários responsáveis por causar doença humana.
AVALIAÇÃO HISTOLÓGICA DE LEISHMANIOSE VISCERAL EM GATOS DOMÉSTICOS (Felis catus domesticus).
 AVALIAÇÃO HISTOLÓGICA DE LEISHMANIOSE VISCERAL EM GATOS DOMÉSTICOS (Felis catus domesticus). Alves, M. L.¹,* ; Alves-Martin, M. F.²; Silva, D. T.¹; Ferreira, A. G. 1 ; Lucheis, S. B.³; Buzetti, W. A. S.¹;
AVALIAÇÃO HISTOLÓGICA DE LEISHMANIOSE VISCERAL EM GATOS DOMÉSTICOS (Felis catus domesticus). Alves, M. L.¹,* ; Alves-Martin, M. F.²; Silva, D. T.¹; Ferreira, A. G. 1 ; Lucheis, S. B.³; Buzetti, W. A. S.¹;
MALÁRIA. Agentes etiológicos (Protozoários) Plasmodium vivax Plasmodium falciparum Plasmodium malariae Plasmodium ovale
 MALÁRIA Agentes etiológicos (Protozoários) Plasmodium vivax Plasmodium falciparum Plasmodium malariae Plasmodium ovale Vetores (Insetos) Culicidae gênero Anopheles A. (Nyssorhincus) darlingi A. (N) aquasalis
MALÁRIA Agentes etiológicos (Protozoários) Plasmodium vivax Plasmodium falciparum Plasmodium malariae Plasmodium ovale Vetores (Insetos) Culicidae gênero Anopheles A. (Nyssorhincus) darlingi A. (N) aquasalis
LEISHMANIOSE VISCERAL REVISÃO DE LITERATURA VISCERAL LEISHMANIASIS REVIEW
 LEISHMANIOSE VISCERAL REVISÃO DE LITERATURA VISCERAL LEISHMANIASIS REVIEW BRANDÃO, Talita Galvão Evaristo Acadêmica do curso de Medicina Veterinária da Faculdade de Medicina Veterinária e Zootecnia de
LEISHMANIOSE VISCERAL REVISÃO DE LITERATURA VISCERAL LEISHMANIASIS REVIEW BRANDÃO, Talita Galvão Evaristo Acadêmica do curso de Medicina Veterinária da Faculdade de Medicina Veterinária e Zootecnia de
SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M CALAZAR GERMANO DA SILVA DE SOUZA R 2
 SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M EM PEDIATRIA CALAZAR GERMANO DA SILVA DE SOUZA R 2 www.paulomargotto.com.br CALAZAR DEFINIÇÃO ÃO: Zoonose
SECRETARIA DE ESTADO DE SAÚDE - DF HOSPITAL REGIONAL DA ASA SUL PROGRAMA DE RESIDÊNCIA MÉDICA M EM PEDIATRIA CALAZAR GERMANO DA SILVA DE SOUZA R 2 www.paulomargotto.com.br CALAZAR DEFINIÇÃO ÃO: Zoonose
LEISHMANIOSE: Uma Grande Endemia. Beatriz S Stolf Depto de Parasitologia ICB II- USP
 LEISHMANIOSE: Uma Grande Endemia Beatriz S Stolf Depto de Parasitologia ICB II- USP Endêmica em 98 países ~12 milhões de pessoas infectadas 2 milhões de casos novos / ano 350 milhões de pessoas ameaçadas
LEISHMANIOSE: Uma Grande Endemia Beatriz S Stolf Depto de Parasitologia ICB II- USP Endêmica em 98 países ~12 milhões de pessoas infectadas 2 milhões de casos novos / ano 350 milhões de pessoas ameaçadas
MORTALIDADE E LETALIDADE POR LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE DO BRASIL
 MORTALIDADE E LETALIDADE POR LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE DO BRASIL Allan Batista Silva 1, Ana Carolina da Silva Monteiro 2, Waldner Gomes Barbosa Filho 3, Mirian Marques Vieira 4, Caliandra
MORTALIDADE E LETALIDADE POR LEISHMANIOSE VISCERAL NA REGIÃO NORDESTE DO BRASIL Allan Batista Silva 1, Ana Carolina da Silva Monteiro 2, Waldner Gomes Barbosa Filho 3, Mirian Marques Vieira 4, Caliandra
PROJETO TURMINHA DA SAÚDE. Ronaldo Kroeff Daghlawi. São Luís-MA
 PROJETO TURMINHA DA SAÚDE Ronaldo Kroeff Daghlawi São Luís-MA Janeiro/2014 PROJETO TURMINHA DA SAÚDE Estamos lançando em todo o Maranhão a Revista Turminha da Saúde na qual serão abordados variados temas
PROJETO TURMINHA DA SAÚDE Ronaldo Kroeff Daghlawi São Luís-MA Janeiro/2014 PROJETO TURMINHA DA SAÚDE Estamos lançando em todo o Maranhão a Revista Turminha da Saúde na qual serão abordados variados temas
PERFIL EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL CANINA NO MUNICÍPIO DE SELVÍRIA/MS DE 2011 A 2015
 PERFIL EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL CANINA NO MUNICÍPIO DE SELVÍRIA/MS DE 2011 A 2015 Talita Barbosa de Amorim Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas FITL/AEMS
PERFIL EPIDEMIOLÓGICO DE LEISHMANIOSE VISCERAL CANINA NO MUNICÍPIO DE SELVÍRIA/MS DE 2011 A 2015 Talita Barbosa de Amorim Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas FITL/AEMS
Aluna: Carina de Mattos Soares Orientadora: Dra Cídia Vasconcellos Supervisora: Dra Vânia Lucia Ribeiro da Matta
 Comparação da eficácia da PCR convencional e em tempo real na identificação de espécies de Leishmania sp do Novo Mundo, usando diferentes alvos moleculares luna: Carina de Mattos Soares Orientadora: Dra
Comparação da eficácia da PCR convencional e em tempo real na identificação de espécies de Leishmania sp do Novo Mundo, usando diferentes alvos moleculares luna: Carina de Mattos Soares Orientadora: Dra
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA
 COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 33/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 33/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
Medico Vet..: HAYANNE K. N. MAGALHÃES Idade...: 11 Ano(s) CRMV...: 2588 Data da conclusão do laudo.:05/08/2019
 Análise Clínica No.005053808 Data de Coleta: 18/07/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Análise Clínica No.005053808 Data de Coleta: 18/07/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Palavras-chave: Diagnostico molecular; Mosquito-palha; Epidemiologia; Leishmania spp.
 IMPLEMENTAÇÃO DE REAÇÃO EM CADEIA DA POLIMERASE EM TEMPO REAL PARA DETECÇÃO E QUANTIFICAÇÃO DE LEISHMANIOSE VISCERAL Resumo Vinicius Proença da Silveira 1 Patrícia de Freitas Salla 2 Nilo Ikuta 3 Vagner
IMPLEMENTAÇÃO DE REAÇÃO EM CADEIA DA POLIMERASE EM TEMPO REAL PARA DETECÇÃO E QUANTIFICAÇÃO DE LEISHMANIOSE VISCERAL Resumo Vinicius Proença da Silveira 1 Patrícia de Freitas Salla 2 Nilo Ikuta 3 Vagner
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA
 COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 34/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 34/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
Vigilância da Leishmaniose Visceral. (calazar, esplenomegalia tropical, febre Dundun)
 Vigilância da Leishmaniose Visceral (calazar, esplenomegalia tropical, febre Dundun) LEISHMANIOSE VISCERAL Doença infecciosa causada por Leishmania infantum e transmitida pela picada de fêmeas de Lutzomyia
Vigilância da Leishmaniose Visceral (calazar, esplenomegalia tropical, febre Dundun) LEISHMANIOSE VISCERAL Doença infecciosa causada por Leishmania infantum e transmitida pela picada de fêmeas de Lutzomyia
Instituto de Pesquisas em Patologias Tropicais IPEPATRO/FIOCRUZ. Ferida Brava (Leishmaniose): Conheça e Aprenda a se proteger
 Instituto de Pesquisas em Patologias Tropicais IPEPATRO/FIOCRUZ Ferida Brava (Leishmaniose): Conheça e Aprenda a se proteger Janeiro de 2013 O que é? É uma doença infecciosa, não contagiosa, que afeta
Instituto de Pesquisas em Patologias Tropicais IPEPATRO/FIOCRUZ Ferida Brava (Leishmaniose): Conheça e Aprenda a se proteger Janeiro de 2013 O que é? É uma doença infecciosa, não contagiosa, que afeta
As leishmanioses são doenças infecto-parasitárias que acometem o homem, causadas por várias espécies de protozoários do gênero Leishmania
 LEISHMANIOSES As leishmanioses são doenças infecto-parasitárias que acometem o homem, causadas por várias espécies de protozoários do gênero Leishmania A doença pode apresentar diferentes formas clínicas,
LEISHMANIOSES As leishmanioses são doenças infecto-parasitárias que acometem o homem, causadas por várias espécies de protozoários do gênero Leishmania A doença pode apresentar diferentes formas clínicas,
RESPONSABILIDADE NA CONDUTA TERAPÊUTICA EM CASOS DE LVC. Dra Liliane Carneiro Diretora do CENP/IEC/MS CRMV/PA Nº 1715
 RESPONSABILIDADE NA CONDUTA TERAPÊUTICA EM CASOS DE LVC Dra Liliane Carneiro Diretora do CENP/IEC/MS CRMV/PA Nº 1715 A leishmaniose visceral canina (LVC) é uma doença infecciosa provocada pelo protozoário
RESPONSABILIDADE NA CONDUTA TERAPÊUTICA EM CASOS DE LVC Dra Liliane Carneiro Diretora do CENP/IEC/MS CRMV/PA Nº 1715 A leishmaniose visceral canina (LVC) é uma doença infecciosa provocada pelo protozoário
TRYPANOSOMA EVANSI EM EQUINOS
 TRYPANOSOMA EVANSI EM EQUINOS INTRODUÇÃO A trypanosomose equina, também conhecida como mal-das-cadeiras ou surra é uma doença que tem uma distribuição geográfica extremamente ampla. Ela ocorre no norte
TRYPANOSOMA EVANSI EM EQUINOS INTRODUÇÃO A trypanosomose equina, também conhecida como mal-das-cadeiras ou surra é uma doença que tem uma distribuição geográfica extremamente ampla. Ela ocorre no norte
26 a 29 de novembro de 2013 Campus de Palmas
 SENSIBILIDADE E ESPECIFICIDADE DA REAÇÃO EM CADEIA DE POLIMERASE (PCR) UTILIZANDO AMOSTRAS DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO DE CÃES PARA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL Gessica Hoanna Cunha
SENSIBILIDADE E ESPECIFICIDADE DA REAÇÃO EM CADEIA DE POLIMERASE (PCR) UTILIZANDO AMOSTRAS DE PUNÇÃO BIÓPSIA ASPIRATIVA DE LINFONODO DE CÃES PARA DIAGNÓSTICO DA LEISHMANIOSE VISCERAL Gessica Hoanna Cunha
PUBVET, Publicações em Medicina Veterinária e Zootecnia. Leishmaniose visceral canina no município de São Vicente Férrer, Estado de Pernambuco, Brasil
 PUBVET, Publicações em Medicina Veterinária e Zootecnia. Leishmaniose visceral canina no município de São Vicente Férrer, Estado de Pernambuco, Brasil Otamires Alves da Silva* e Geovania Maria da Silva
PUBVET, Publicações em Medicina Veterinária e Zootecnia. Leishmaniose visceral canina no município de São Vicente Férrer, Estado de Pernambuco, Brasil Otamires Alves da Silva* e Geovania Maria da Silva
Leishmaniose Tegumentar Americana no Estado de São Paulo: Situação Epidemiológica
 Leishmaniose Tegumentar Americana no Estado de São Paulo: Situação Epidemiológica 2001 2002 Vera Lucia Fonseca de Camargo-Neves¹ e Mitie Tada L.R.F Brasil² No Estado de São Paulo a Leishmaniose Tegumentar
Leishmaniose Tegumentar Americana no Estado de São Paulo: Situação Epidemiológica 2001 2002 Vera Lucia Fonseca de Camargo-Neves¹ e Mitie Tada L.R.F Brasil² No Estado de São Paulo a Leishmaniose Tegumentar
Análise Clínica No Data de Coleta: 22/03/2019 1/5 Prop...: RAIMUNDO JURACY CAMPOS FERRO Especie...: CANINA Fone...: 0
 Análise Clínica No.005048230 Data de Coleta: 22/03/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Análise Clínica No.005048230 Data de Coleta: 22/03/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
do Vale do Araguaia UNIVAR - LEISHMANIOSE TEGUMENTAR AMERICANA HUMANA NO MUNICÍPIO DE GENERAL CARNEIRO MATO GROSSO
 1 JORDANA BELOS DOS SANTOS 1, ANDRÉ LUIZ FERNANDES DA SILVA 2, PATRÍCIA GELLI FERES DE MARCHI 2, ISABELLA RODRIGUES DA SILVA CONDE 1 1 Acadêmicas do Curso de Medicina Veterinária das Faculdades Unidas
1 JORDANA BELOS DOS SANTOS 1, ANDRÉ LUIZ FERNANDES DA SILVA 2, PATRÍCIA GELLI FERES DE MARCHI 2, ISABELLA RODRIGUES DA SILVA CONDE 1 1 Acadêmicas do Curso de Medicina Veterinária das Faculdades Unidas
LEISHMANIOSE VISCERAL EM ANIMAIS E HUMANOS
 LEISHMANIOSE VISCERAL EM ANIMAIS E HUMANOS Mayara Barbosa Santiago Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas - FITL/AEMS Íria Maria Abel Santos Graduanda em Medicina Veterinária,
LEISHMANIOSE VISCERAL EM ANIMAIS E HUMANOS Mayara Barbosa Santiago Graduanda em Medicina Veterinária, Faculdades Integradas de Três Lagoas - FITL/AEMS Íria Maria Abel Santos Graduanda em Medicina Veterinária,
Anexo Parecer IEC
 6 RELATÓRIO CONSOLIDADO DE ANDAMENTO DO PBA E DO ATENDIMENTO DE CONDICIONANTES CAPÍTULO 2 ANDAMENTO DO PROJETO BÁSICO AMBIENTAL Anexo 12.3.4 4 Parecer IEC Seção de Parasitologia Laboratório de Leishmanioses
6 RELATÓRIO CONSOLIDADO DE ANDAMENTO DO PBA E DO ATENDIMENTO DE CONDICIONANTES CAPÍTULO 2 ANDAMENTO DO PROJETO BÁSICO AMBIENTAL Anexo 12.3.4 4 Parecer IEC Seção de Parasitologia Laboratório de Leishmanioses
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA
 COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 35/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 35/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
Leishmaniose Visceral
 Leishmaniose Visceral Introdução As Leishmanioses são protozooses de grande importância em nosso meio Causadas por protozoários do gênero Leishmania São zoonoses e que afetam o homem acidentalmente Trasmitidas
Leishmaniose Visceral Introdução As Leishmanioses são protozooses de grande importância em nosso meio Causadas por protozoários do gênero Leishmania São zoonoses e que afetam o homem acidentalmente Trasmitidas
Diagnóstico Laboratorial de Infecções Virais. Profa. Claudia Vitral
 Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
LEISHMANIOSE VISCERAL E TEGUMENTAR AMERICANA VISCERAL AND CUTANEOUS LEISHMANIASIS
 40 LEISHMANIOSE VISCERAL E TEGUMENTAR AMERICANA VISCERAL AND CUTANEOUS LEISHMANIASIS Gustavo Pereira da Rocha¹ Tatiane Ferreira Petroni¹ RESUMO: A leishmaniose é causada por parasitas do gênero Leishmania
40 LEISHMANIOSE VISCERAL E TEGUMENTAR AMERICANA VISCERAL AND CUTANEOUS LEISHMANIASIS Gustavo Pereira da Rocha¹ Tatiane Ferreira Petroni¹ RESUMO: A leishmaniose é causada por parasitas do gênero Leishmania
ECOEPIDEMIOLOGIA DA LEISHMANIOSE VISCERAL AMERICANA E SUA DISTRIBUIÇÃO ESPACIAL NO ESTADO DE MATO GROSSO DO SUL
 SUELY APARECIDA CORREA ANTONIALLI ECOEPIDEMIOLOGIA DA LEISHMANIOSE VISCERAL AMERICANA E SUA DISTRIBUIÇÃO ESPACIAL NO ESTADO DE MATO GROSSO DO SUL 1994-2003 SÃO PAULO 2006 SUELY APARECIDA CORREA ANTONIALLI
SUELY APARECIDA CORREA ANTONIALLI ECOEPIDEMIOLOGIA DA LEISHMANIOSE VISCERAL AMERICANA E SUA DISTRIBUIÇÃO ESPACIAL NO ESTADO DE MATO GROSSO DO SUL 1994-2003 SÃO PAULO 2006 SUELY APARECIDA CORREA ANTONIALLI
Ciclo. A Leishmaniose. Leevre. A Leishmaniose canina é causada, no Brasil, pela Leishmania infantum chagasi (L. chagasi), um protozoário intracelular
 é a coleira da Ourofino Saúde Animal que acompanha o cão para o que der e vier, protegendo-o das picadas do vetor da Leishmaniose e de infestações por carrapatos e pulgas nos ambientes que ele frequenta.
é a coleira da Ourofino Saúde Animal que acompanha o cão para o que der e vier, protegendo-o das picadas do vetor da Leishmaniose e de infestações por carrapatos e pulgas nos ambientes que ele frequenta.
Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2017
 Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2017 OMS doenças tropicais negligenciadas Bouba Doença de Chagas Dengue Dracunculíase Equinococose (Hidatidose)
Vigilância Epidemiológica das Doenças Negligenciadas e das Doenças relacionadas à pobreza 2017 OMS doenças tropicais negligenciadas Bouba Doença de Chagas Dengue Dracunculíase Equinococose (Hidatidose)
Estudo retrospectivo da epidemiologia da leishmaniose visceral no Rio Grande do Sul: revisão de literatura
 Estudo retrospectivo da epidemiologia da leishmaniose visceral no Rio Grande do Sul: revisão de literatura Ana Paula Lino de Souza Jairo Ramos de Jesus Mariana Caetano Teixeira RESUMO A leishmaniose visceral
Estudo retrospectivo da epidemiologia da leishmaniose visceral no Rio Grande do Sul: revisão de literatura Ana Paula Lino de Souza Jairo Ramos de Jesus Mariana Caetano Teixeira RESUMO A leishmaniose visceral
Cerca de 6000 espécies conhecidas - ~10000 são parasitas. Eucariotos unicelulares
 Cerca de 6000 espécies conhecidas - ~10000 são parasitas. Eucariotos unicelulares Apresentam variadas formas, processo de alimentação, reprodução e locomoção De acordo com a estrutura de locomoção Sarcodina
Cerca de 6000 espécies conhecidas - ~10000 são parasitas. Eucariotos unicelulares Apresentam variadas formas, processo de alimentação, reprodução e locomoção De acordo com a estrutura de locomoção Sarcodina
Lamentável caso de Mormo, em Minas Gerais
 Lamentável caso de Mormo, em Minas Gerais O Mormo é uma doença infecto-contagiosa que acomete os Equinos e Asininos e tem como agente causador a bactéria Burkholderia mallei; Mormo é uma Zoonose porque
Lamentável caso de Mormo, em Minas Gerais O Mormo é uma doença infecto-contagiosa que acomete os Equinos e Asininos e tem como agente causador a bactéria Burkholderia mallei; Mormo é uma Zoonose porque
Leishmaniose visceral: Complexidade na relação Homemanimal-vetor-ambiente
 Leishmaniose visceral: Complexidade na relação Homemanimal-vetor-ambiente em municípios de Minas Gerais Eduardo Sergio da Silva silvaedu@ufsj.edu.br Agosto de 2016 Introdução Epidemiologia das Leishmanioses
Leishmaniose visceral: Complexidade na relação Homemanimal-vetor-ambiente em municípios de Minas Gerais Eduardo Sergio da Silva silvaedu@ufsj.edu.br Agosto de 2016 Introdução Epidemiologia das Leishmanioses
DIEGO CARLOS ANDRADE PEREIRA
 UNIVERSIDADE FEDERAL DE SÃO JOÃO DEL-REI UFSJ CAMPUS CENTRO-OESTE DONA LINDU CCO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE DIEGO CARLOS ANDRADE PEREIRA ASPECTOS EPIDEMIOLÓGICOS DA TRANSMISSÃO DE LEISHMANIOSE
UNIVERSIDADE FEDERAL DE SÃO JOÃO DEL-REI UFSJ CAMPUS CENTRO-OESTE DONA LINDU CCO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE DIEGO CARLOS ANDRADE PEREIRA ASPECTOS EPIDEMIOLÓGICOS DA TRANSMISSÃO DE LEISHMANIOSE
LUIZ CLAUDIO FERREIRA
 COMPARAÇÃO DA SENSIBILIDADE ENTRE AS TÉCNICAS DE HIBRIDIZAÇÃO IN SITU, HISTOPATOLOGIA E IMUNO-HISTOQUÍMICA PARA DIAGNÓSTICO DE LEISHMANIOSE TEGUMENTAR AMERICANA EM AMOSTRAS DE PELE LUIZ CLAUDIO FERREIRA
COMPARAÇÃO DA SENSIBILIDADE ENTRE AS TÉCNICAS DE HIBRIDIZAÇÃO IN SITU, HISTOPATOLOGIA E IMUNO-HISTOQUÍMICA PARA DIAGNÓSTICO DE LEISHMANIOSE TEGUMENTAR AMERICANA EM AMOSTRAS DE PELE LUIZ CLAUDIO FERREIRA
FEBRE AMARELA O QUE É FEBRE AMARELA?
 FEBRE AMARELA Combatida por Oswaldo Cruz no início do século 20 e erradicada dos grandes centros urbanos desde 1942, a Febre Amarela voltou a assustar os brasileiros nos últimos tempos, com a proliferação
FEBRE AMARELA Combatida por Oswaldo Cruz no início do século 20 e erradicada dos grandes centros urbanos desde 1942, a Febre Amarela voltou a assustar os brasileiros nos últimos tempos, com a proliferação
LEISHMANIOSE TEGUMENTAR AMERICANA HUMANA NOS MUNICÍPIOS DE CAMPINÁPOLIS, GENERAL CARNEIRO, NOVA XAVANTINA E NOVO SÃO JOAQUIM EM MATO GROSSO
 LEISHMANIOSE TEGUMENTAR AMERICANA HUMANA NOS MUNICÍPIOS DE CAMPINÁPOLIS, GENERAL CARNEIRO, NOVA XAVANTINA E NOVO SÃO JOAQUIM EM MATO GROSSO Jordana Belos dos SANTOS 1, André Luiz Fernandes da SILVA 1,
LEISHMANIOSE TEGUMENTAR AMERICANA HUMANA NOS MUNICÍPIOS DE CAMPINÁPOLIS, GENERAL CARNEIRO, NOVA XAVANTINA E NOVO SÃO JOAQUIM EM MATO GROSSO Jordana Belos dos SANTOS 1, André Luiz Fernandes da SILVA 1,
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA
 COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 39/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
COES Febre Amarela CENTRO DE OPERAÇÕES DE EMERGÊNCIAS EM SAÚDE PÚBLICA SOBRE FEBRE AMARELA INFORME Nº 39/2017 MONITORAMENTO DOS CASOS E ÓBITOS DE FEBRE AMARELA NO BRASIL INÍCIO DO EVENTO: Dezembro de 2016
ARTIGO ORIGINAL. Resumo INTRODUÇÃO. Waneska Alexandra Alves 1. anteriormente de caráter rural, se expandiu para zonas urbanas,
 ARTIGO ORIGINAL Waneska Alexandra Alves 1 Resumo : INTRODUÇÃO A Leishmaniose Visceral (LV) é uma doença sistêmica que afeta tanto animais quanto o homem, sendo o cão o protozoários heteroxênicos e intracelulares
ARTIGO ORIGINAL Waneska Alexandra Alves 1 Resumo : INTRODUÇÃO A Leishmaniose Visceral (LV) é uma doença sistêmica que afeta tanto animais quanto o homem, sendo o cão o protozoários heteroxênicos e intracelulares
Nélio Batista de Morais Presidente da Comissão Nacional de Saúde Publica Veterinária
 Nélio Batista de Morais Presidente da Comissão Nacional de Saúde Publica Veterinária Orientações do Conselho Federal de Medicina Veterinária com Relação a Leishmanioses Visceral Canina! Leishmanioses Doença
Nélio Batista de Morais Presidente da Comissão Nacional de Saúde Publica Veterinária Orientações do Conselho Federal de Medicina Veterinária com Relação a Leishmanioses Visceral Canina! Leishmanioses Doença
Avaliação da infecção natural de flebotomíneos (Diptera: Psychodidae) por Leishmania spp. no Município de São Vicente Férrer, Pernambuco
 FUNDAÇÃO OSWALDO CRUZ CENTRO DE PESQUISAS AGGEU MAGALHÃES MESTRADO ACADÊMICO EM SAÚDE PÚBLICA Vanessa Cristina Fitipaldi Veloso Guimarães Avaliação da infecção natural de flebotomíneos (Diptera: Psychodidae)
FUNDAÇÃO OSWALDO CRUZ CENTRO DE PESQUISAS AGGEU MAGALHÃES MESTRADO ACADÊMICO EM SAÚDE PÚBLICA Vanessa Cristina Fitipaldi Veloso Guimarães Avaliação da infecção natural de flebotomíneos (Diptera: Psychodidae)
1º EM BIOLOGIA PROFESSOR JOÃO C5, 8 H19, 29, 30 PROTOZOOSES. Biologia Professor João
 1º EM BIOLOGIA PROFESSOR JOÃO PROTOZOOSES Biologia Professor João DOENÇA DE CHAGAS Sinônimo: Tripanossomíase americana Agente Etiológico: Trypanosoma cruzi (protozoário flagelado) Vetor (transmissor):
1º EM BIOLOGIA PROFESSOR JOÃO PROTOZOOSES Biologia Professor João DOENÇA DE CHAGAS Sinônimo: Tripanossomíase americana Agente Etiológico: Trypanosoma cruzi (protozoário flagelado) Vetor (transmissor):
DISTRIBUIÇÃO DA LEISHMANIOSE VISCERAL CANINA NA CIDADE DE PRESIDENTE PRUDENTE, ESTADO DE SÃO PAULO.
 EIXO TEMÁTICO: ( ) Biodiversidade e Unidade de Conservação ( ) Gestão e Gerenciamento dos Resíduos ( ) Campo, Agronegócio e as Práticas Sustentáveis ( ) Planejamento e Gestão dos Recursos Hídricos ( )
EIXO TEMÁTICO: ( ) Biodiversidade e Unidade de Conservação ( ) Gestão e Gerenciamento dos Resíduos ( ) Campo, Agronegócio e as Práticas Sustentáveis ( ) Planejamento e Gestão dos Recursos Hídricos ( )
Classificação ALGAS PROTOZOÁRIOS
 Reino Protista Classificação PROTOZOÁRIOS ALGAS Antigamente, estes organismos eram agrupados nos reinos Animal e Vegetal, respectivamente. Hoje em dia, sabemos que fazem parte dos protistas devido a características
Reino Protista Classificação PROTOZOÁRIOS ALGAS Antigamente, estes organismos eram agrupados nos reinos Animal e Vegetal, respectivamente. Hoje em dia, sabemos que fazem parte dos protistas devido a características
Palavras-chave: canino, tripanossomíase, Doença de Chagas Key-words: canine, trypanosomiasis, chagas disease
 1 OCORRÊNCIA DE ANTICORPOS ANTI-Trypanosoma cruzi EM CÃES DE UMA ÁREA RURAL NO MUNICÍPIO DE RIO BRANCO, ACRE Mirlane da Silva SANTOS 1, Carolina Couto BARQUETE 2, Michelinne Medeiros de Oliveira DANTAS
1 OCORRÊNCIA DE ANTICORPOS ANTI-Trypanosoma cruzi EM CÃES DE UMA ÁREA RURAL NO MUNICÍPIO DE RIO BRANCO, ACRE Mirlane da Silva SANTOS 1, Carolina Couto BARQUETE 2, Michelinne Medeiros de Oliveira DANTAS
PROGRAMA DE PG EM BIOLOGIA EXPERIMENTAL - PGBIOEXP
 QUESTÕES ESPECÍFICAS Questão 5 Observou-se recentemente, nos anos de 2017 e 2018, uns dos eventos epidêmicos de febre amarela mais graves no Brasil, considerando-se a série histórica de 1980-2018. O vírus
QUESTÕES ESPECÍFICAS Questão 5 Observou-se recentemente, nos anos de 2017 e 2018, uns dos eventos epidêmicos de febre amarela mais graves no Brasil, considerando-se a série histórica de 1980-2018. O vírus
PREVALÊNCIA ESPACIAL DE CASOS DE LEISHMANIOSE VISCERAL CANINA (LVC) EM PRESIDENTE PRUDENTE SP, BRASIL
 PREVALÊNCIA ESPACIAL DE CASOS DE LEISHMANIOSE VISCERAL CANINA (LVC) EM PRESIDENTE PRUDENTE SP, BRASIL Patricia Sayuri Silvestre Matsumoto Mestranda do PPGEO/UNESP - Presidente Prudente pamatsumot@gmail.com
PREVALÊNCIA ESPACIAL DE CASOS DE LEISHMANIOSE VISCERAL CANINA (LVC) EM PRESIDENTE PRUDENTE SP, BRASIL Patricia Sayuri Silvestre Matsumoto Mestranda do PPGEO/UNESP - Presidente Prudente pamatsumot@gmail.com
ENFERMAGEM SAÚDE DA MULHER. Doenças Sexualmente Transmissíveis Parte 2. Profª. Lívia Bahia
 ENFERMAGEM SAÚDE DA MULHER Doenças Sexualmente Transmissíveis Parte 2 Profª. Lívia Bahia Sífilis Agente Etiológico: Treponema pallidum Morfologicamente o Treponema pallidum é uma bactéria espiral fina
ENFERMAGEM SAÚDE DA MULHER Doenças Sexualmente Transmissíveis Parte 2 Profª. Lívia Bahia Sífilis Agente Etiológico: Treponema pallidum Morfologicamente o Treponema pallidum é uma bactéria espiral fina
