UNIVERSIDADE FEDERAL DE GOIÁS CAMPUS JATAÍ TCCG GRADUAÇÃO EM MEDICINA VETERINÁRIA
|
|
|
- Bárbara Maria Eduarda Delgado Macedo
- 7 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DE GOIÁS CAMPUS JATAÍ TCCG GRADUAÇÃO EM MEDICINA VETERINÁRIA A IMPORTÂNCIA DA PATOLOGIA CLÍNICA NA VETERINÁRIA: HEMATOLOGIA E URINÁLISE EM PEQUENOS ANIMAIS Tatiane Furtado de Carvalho Orientadora: Prof.ª Dr.ª Cecília Nunes Moreira Sandrini JATAÍ 2008
2 ii TATIANE FURTADO DE CARVALHO A IMPORTÂNCIA DA PATOLOGIA CLÍNICA NA VETERINÁRIA: HEMATOLOGIA E URINÁLISE EM PEQUENOS ANIMAIS Trabalho de Conclusão de Curso de Graduação apresentado para a obtenção do título de Médica Veterinária junto à Universidade Federal de Goiás, Campus Jataí. Orientadora: Prof.ª Dr.ª Cecília Nunes Moreira Sandrini Supervisor: Prof.º Dr.º Antônio Vicente Mundim JATAÍ 2008
3 iii Dados Internacionais de Catalogação-na-Publicação (CIP) (GPT/BSCAJ/UFG) Bibliotecário responsável: Enderson Medeiros CRB Carvalho, Tatiane Furtado de. ( ) C3311a A importância da patologia cliníca na veterinária: hematologia e urinálise em pequenos animais. / Tatiane Furtado de Carvalho. Jataí : [S.n], f. : il.; figs.; tabs. Orientador: Prof. Dra. Cecília Nunes Moreira Sandrini. Trabalho de Conclusão de Curso (Mestrado) Universidade Federal de Goiás, Campus Jataí, Pequenos Animais. 2. Medicina Veterinaria. 3. Patologia Cliníca. 4. Hematologia. 5. Urinálise. 6. Contagem automatizada hematológica. 7. Bioquímica sérica automatizada. 8. Hematozoários. 9. Sedimestoscopia. I. Sandrini, Cecília Nunes Moreira. II. Universidade Federal de Goiás, Campus Jataí. III. Título. CDU : 619:
4 iv TATIANE FURTADO DE CARVALHO Trabalho de Conclusão de Curso de Graduação defendido e aprovado em 26 de novembro de 2008, pela seguinte Banca Examinadora: Profa. Drª. Cecília Nunes Moreira Sandrini UFG Presidente da Banca Prof a. Drª. Vera Lúcia Dias da Silva Fontana Membro da Banca Profº. Edismair Carvalho Garcia Membro da Banca
5 v A você, que me deu a vida e me ensinou a vivê-la, com dignidade, não bastaria um obrigada. A você, que ilumina os caminhos obscuros com afeto e dedicação para que eu trilhasse sem medo e cheia de esperanças, não bastaria um muito obrigada. A você, que se doou inteira e renunciou aos seus sonhos, para que, muitas vezes, pudesse realizar os meus. Pela longa espera e compreensão durante minhas longas viagens, não bastaria um muitíssimo obrigada. A você, mãe por natureza, por opção e amor, não bastaria dizer, que não teria palavras para agradecer tudo isso. Mas é o que me acontece agora, quando procuro arduamente uma forma verbal de exprimir uma emoção ímpar. Uma emoção que jamais seria traduzida por palavras. Amo você!
6 vi AGRADECIMENTOS Em primeiro lugar a Deus, sempre estiveste ao meu lado, nas minhas quedas, nas minhas fraquezas, nas lutas e controvérsias, vitórias e derrotas. Sei que, principalmente agora, estais ao meu lado. Obrigada por este presente que agora me ofereces. Obrigado por tudo que vi, ouvi e aprendi. Obrigada pela Vida! A você mãe, que trilhou comigo este caminho, meu sincero agradecimento pelo apoio, pelo carinho, pela onipresença, pela força, enfim, pelo amor incondicional. Agradeço também a minha família, ao meu irmão, pela existência em minha vida. Aos colegas, em especial, que nesses anos juntos com dificuldades, inseguranças, erros, acertos, vitórias e alegrias. Chegamos ao final com a certeza do dever cumprido. Mesmo que a vida venha nos separar, jamais estaremos longe para sermos esquecidos. No coração de cada um haverá saudade, recordação, companheirismo... Em especial as minhas amigas Thays, Éllen, Valéria e Dalila pelas alegrias que partilhamos em nosso caminhar. À profª. Drª. Cecília, minha orientadora, pelos ensinamentos de dedicação profissional, e pela imensa contribuição na minha vida acadêmica e profissional. Também pela amizade e atenção constante durante esta jornada. Aos professores pelos preciosos conhecimentos ensinados. Registro o meu profundo agradecimento ao meu supervisor profº Mundim e ao profº. Fernando Cristino, as residentes Cristiane e Danielli, aos técnicos Tiãozinho e Felipe, a funcionária Celinha e mestranda Renata, pessoas que tão gentilmente me receberam no laboratório de patologia clínica da UFU e me repassaram as informações essenciais para o desenvolvimento deste estudo, pela paciência e amizade. Em especial aos professores, funcionários e amigos da UFG, em especial o Cabral, Patrícia e Sidney, pela diversão, pelo aprendizado, pela convivência e pela amizade. A todos que, de alguma forma estiveram presentes em minha vida. Meu muito obrigada!!!
7 vii SUMÁRIO 1 INTRODUÇÃO DESENVOLVIMENTO Estágio curricular na área de Laboratório de Análises Clínicas, realizado no Hospital Veterinário da UFU (HV/UFU) Localização, estrutura e funcionamento Atividades desenvolvidas Exames laboratoriais acompanhados no HV-UFU durante o estágio supervisionado Procedimentos para realização dos Exames HEMOGRAMA Colheita de sangue Interpretação do Hemograma na clínica de pequenos animais Eritrograma Alterações morfológicas dos eritrócitos Parasitas eritrocitários LEUCOGRAMA Neutrofilia Neutropenia Linfocitose Leucemia linfocítica Linfopenia Eosinofilia Basofilia Monocitose Os mais comuns Hematozoários em leucócitos Inclusões virais Anomalias de Pelger-Huet URINÁLISE DE ROTINA Colheita e armazenamento Exame físico da urina Exame químico da urina Exame do sedimento urinário Elementos organizados Elementos inorganizados DISCUSSÃO CONCLUSÃO REFERÊNCIAS BIBLIOGRÁFICAS
8 viii LISTA DE FIGURAS FIGURA 1 HV/UFU vista frontal... 2 FIGURA 2 Contador Sanguíneo veterinário ABC Vet... 6 FIGURA 3 Localização da contagem das células sanguíneas na camara de Neubauer (L= leucócitos; E = eritrócitos)... 8 FIGURA 4 Contador semi automático leucócitos, hemácias e hemoglobina... 9 FIGURA 5 Esquema de contagem diferencial de leucócitos em esfregaço sanguíneo FIGURA 6 Suporte com lâminas, para realização de fixação do corante May Gruenwald em esfregaços sanguíneo FIGURA 7 Aparelho automatizado para bioquímica sérica Chem Well FIGURA 8 Formação do anel na urina do tubo à esquerda, já no tubo à direita não houve formação de anel FIGURA 9 Formação de cristais de nitrato de uréia na urina FIGURA 10 A esquerda um macroconídeo, e a direita uma hifa septada, presente em raspado de pele de cão FIGURA 11 Tubos para hemograma e bioquímica sérica FIGURA 12 Esfregaço sanguíneo de cão, evidenciando a presença de Hemácias jovens (Policromatófilos) FIGURA 13 Hemácia nucleada (seta maior branca), policromatófilo (seta menor), e corpúsculo de Howell Jolly ( seta preta), em esfregaço de sangue periférico de cão FIGURA 14 Eritrócitos crenados ou equinócitos em esfregaço de sangue periférico de cão FIGURA 15 Esfregaço sangüíneo de gato com eritrócitos parasitados com Mycoplasma haemofelis FIGURA 16 Esfregaço sangüíneo de cão com eritrócito parasitado com Mycoplasma haemocanis FIGURA 17 Esfregaços sangüíneos de cão com eritrócitos parasitados com Babesia canis FIGURA 18 Esfregaço sangüíneo de eqüino com eritrócito parasitado com Babesia equi... 38
9 ix LISTA DE FIGURAS FIGURA 19 Esfregaço sangüíneo de um puma com eritrócito parasitado com piroplasmas de Citauxzoon FIGURA 20 Esfregaço sangüíneo de uma cadela com linfossarcoma. Presença de linfoblastos (setas pretas) e linfócitos (seta branca) FIGURA 21 Esfregaço sangüíneo de cão com monócitos com mórulas Erlichia spp FIGURA 22 A esquerda um esfregaço sanguíneo de cão, com leucócito parasitado com Hepatozoon canis. A direita esfregaço sangüíneo de um jacaré, evidenciando um eritrócito parasitado com Hepatozoon roullex FIGURA 23 Esfregaço sanguíneo de cão evidenciando eritrócito com Corpúsculo de Lentz FIGURA 24 Esfregaço sanguíneo de cão evidenciando neutrófilos com Corpúsculo de Lentz FIGURA 25 Granulócitos de cão com anomalia de Pelger-Huet há quatro neutrófilos hipossegmentados FIGURA 26 Leucócitos (seta) no sedimento urinário de cão FIGURA 27 Cilindro hialino(seta) no sedimento urinário de cão FIGURA 28 Cilindro epitelial (seta) no sedimento urinário de cão FIGURA 29 Cilindros granulosos (seta) em sedimento urinário de cão FIGURA 30 Espermatozóides (seta) no sedimento urinário de cão FIGURA 31 Cristais de oxalato de cálcio (seta) no sedimento urinário de cão FIGURA 32 Cristais de Fosfato triplo (setas) no sedimento urinário de cão FIGURA 33 Cristais de carbonato de cálcio (seta) no sedimento urinário de cão 91 FIGURA 34 Cristais de tirosina (seta) no sedimento urinário de cão FIGURA 35 Cristais de bilirrubina (seta) no sedimento urinário de cão... 93
10 x LISTA DE TABELAS TABELA 1 TABELA 2 Exames realizados no laboratório de análises clínicas do HV/UFU, no período de 17 de agosto a 18 de outubro de 2008, relativos a rotina interna do HV/ UFU e requisitações externas... 5 Exames realizados no laboratório de análises clínicas do HV/UFU, no período de 17 de agosto a 18 de outubro de 2008, relativos à pesquisa dos alunos da graduação e da pós-graduação... 5
11 1 INTRODUÇÃO Inúmeras dificuldades encontra o clínico, quando, após examinar um animal, procura formular um diagnóstico. Os sintomas observados nem sempre são típicos. Outras vezes, existem complicações que dificultam o diagnóstico. Por outro lado, por meio dos exames de laboratório, o clínico pode prescrever um tratamento adequado e observar o desenrolar da doença (FERREIRA NETO et al., 1977). O estágio curricular supervisionado foi realizado no Hospital Veterinário da Universidade Federal de Uberlândia (HV/UFU), na área de Laboratório Clínico, no período de 18 de agosto a 17 de outubro de 2008, perfazendo um total de 490 horas. Tive como supervisor o Prof. Drº Antônio Vicente Mundim, da UFU, e como orientadora, a Prof a. Drª. Cecília Nunes Moreira, da UFG. A escolha do HV/UFU para o local de estágio foi feita por ser uma Instituição de Ensino Superior, encontrando o apoio de professores, os quais são profissionais capacitados nas várias áreas da Medicina Veterinária, dispostos a passar seus conhecimentos aos estagiários. Além de oferecer grande liberdade de atuação para o estagiário, possibilitando o aprendizado diversificado. Foi escolhida também pela qualidade de sua infra-estrutura, devido à sua grande demanda de exames que possibilita ao estagiário a realização e acompanhamento de inúmeros e diversos casos clínicos e principalmente ao comprometimento dos bons profissionais que atuam no laboratório. O estágio no laboratório teve por objetivo a aplicação e ampliação dos conhecimentos relativos à patologia clínica devido ao gosto e interesse por futura especialização nesse segmento veterinário.
12 2 2 DESENVOLVIMENTO 2.1 Estágio curricular na área de Laboratório de Análises Clínicas, realizado no Hospital Veterinário da UFU (HV/UFU) Localização, estrutura e funcionamento. O HV/UFU localiza-se na Avenida Mato Grosso, n 3286, Campus Umuarama, Uberlândia-MG (Figura 1). Funcionam todos os dias incluindo os feriados. Seu horário de funcionamento é de sete às 19 horas de segunda a sábado e aos domingos até meio dia. O atendimento começa às sete e encerra as 18:30 h. Realiza atendimento nas áreas de Clínica, Cirurgia e Patologia Clínica de pequenos e grandes animais e também animais silvestres. FIGURA 1 - HV/UFU vista frontal O ambiente interno é constituído por uma recepção, onde o cliente tem o primeiro contato com o Hospital, cinco consultórios, um local de vacinação, uma enfermaria, uma farmácia, uma UTI, um laboratório clínico, um ambiente de estudos e sala de televisão para residentes e três salas do setor administrativo.
13 3 O laboratório clínico conta com três salas, uma com ar condicionado para permanência dos equipamentos automáticos de bioquímica (Chem Well ), hematologia (ABC VET ) e computador. Uma sala com maior área onde se encontra os microscópios, bancadas, geladeiras, pias e reagentes em prateleiras. E uma terceira sala, com armários, estufa, microscópios de reserva, e é nesta sala que se colocam os resultados dos exames, em uma pasta com divisórias e identificações por nome do Residente, Médico Veterinário ou Professor que requisitou o exame, ficando à disposição destes. Há um centro cirúrgico constituído de quatro ambientes de mesmo tamanho equipados com aparelhos sofisticados de anestesia inalatória e respiração artificial, um canil da cirurgia, composto de oito gaiolas, uma sala de tricotomia, uma sala para confecção de curativos, gesso e talas, duas salas de Raio x, uma sala para ultra-sonografia e uma sala de técnica operatória utilizada pelos professores para ministrarem suas aulas. O ambiente externo é constituído por currais de recepção para animais de grande porte, um brete para eqüinos e um para bovinos, um centro cirúrgico e dez baias destinadas a pré e pós-operatório. O Hospital no seu quadro técnico conta com duas Médicas Veterinárias, três Residentes de clínica, dois Residentes de patologia, dois Residentes de cirurgia, dois Técnicos de enfermagem e dois Técnicos de radiologia. Neste momento, o laboratório conta com a presença das residentes Cristiane de Brito Silva e Danielli Luana Scherer, além dos técnicos Sebastião Firmiano de Araújo, Felipe César Gonçalves e Célia e uma mestranda Renata Lima de Miranda. Conta também com os professores plantonistas do laboratório Prof. MSc. Fernando Cristino Barbosa e Prof. Dr. Antônio Vicente Mundim. No Laboratório de Análises Clínicas o estagiário pode realizar todos os exames, mediante acompanhamento de um técnico ou de um residente. Os exames feitos são os de rotina, como hemograma completo com pesquisa de hemoparasitos, urinálise, análise de raspado cutâneo, exame parasitológico de fezes, bioquímicas diversas, testes específicos de função hepática, e testes para avaliação do líquido cavitário. A rotina é composta tanto por exames solicitados pelos Médicos Veterinários autônomos, quanto pelos residentes e professores. Incluem-se
14 4 também na rotina solicitações externas de outras clínicas e propriedades rurais além da execução de projetos científicos de alunos da graduação e pós-graduação Atividades desenvolvidas O Laboratório de Análises Clínicas (LAC) faz parte da infra-estrutura do Hospital Veterinário de Uberlândia. A demanda de exames consiste primariamente das solicitações internas, ou seja, de amostras provenientes de consultas realizadas dentro do HV/UFU. Para uma solicitação de exame, o animal primeiramente passa por uma consulta onde é realizada a completa anamnese e exame clínico do animal. Essa consulta é realizada ou por um Veterinário contratado, ou em horário de aula pelos alunos e com o acompanhamento dos professores ou pelos Médicos Veterinários residentes ou estagiários plantonistas. Outra parte da demanda de exames consiste de solicitações externas, ou seja, amostras enviadas de outras clínicas, fazendas ou Veterinários autônomos. Elas apenas são recebidas devidamente embaladas, nos recipientes adequados e bem identificados e com uma solicitação por escrito do exame. Por fim, uma parcela da demanda de exames dos laboratórios consiste de projetos científicos realizados por alunos da graduação e pós - graduação, sob orientação dos professores responsáveis pelo laboratório Exames laboratoriais acompanhados no HV-UFU durante o estágio supervisionado. O estágio foi realizado na área de Patologia Clínica Veterinária do período de 18 de agosto até 17 de outubro de O aproveitamento foi considerado bom, pois durante este período foi possível acompanhar quase todos os procedimentos laboratoriais totalizando exames que estão expostos nas Tabelas 1 e 2.
15 5 TABELA 1 Exames realizados no laboratório de análises clínicas do HV/UFU, no período de 17 de agosto a 18 de outubro de 2008, relativos a rotina interna do HV/ UFU e requisitações externa Rotina Quantidade Freq. (%) Hemograma ,36 Contagem de plaquetas ,36 Pesquisa de hemoparasita 261 8,04 Urinálise 122 3,76 Bioquímica ,16 Raspado de pele 46 1,42 Fezes 53 1,63 Outros 9 0,28 Total TABELA 2 Exames realizados no laboratório de análises clínicas do HV/UFU, no período de 17 de agosto a 18 de outubro de 2008, relativos à pesquisa dos alunos da graduação e da pós-graduação Pesquisa Quantidade Freq. (%) Hemograma 77 5,6 Bioquímica ,2 Fezes Pesquisa de hemoparasita 23 1,66 Dosagem de hemoglobina 21 1,52 Raspado de pele 01 0,07 Total Serão descritos os procedimentos técnicos realizados no laboratório para execução dos exames laboratoriais requisitados. Foram escolhidos o
16 6 hemograma e a urinálise para revisão de literatura, devido a grande importância na interpretação destes para o Clínico de Pequenos Animais Procedimentos para realização dos exames a) Realização do Hemograma A contagem dos eritrócitos e da hemoglobina pode ser realizada por métodos automáticos, semi-automáticos ou manuais. Na rotina do LAC-HV/UFU utiliza-se o ABC Vet (Contador Sanguíneo Animal Veterinário), (Figura 2), que é um analisador hematológico completamente automatizado (controlado por microprocessador) usado para o teste de diagnóstico in-vitro de amostras de sangue composto. O aparelho é totalmente automatizado, com um sistema interno de diluição e uma impressora gráfica para o registro de todos os resultados de testes, incluindo a impressão de marcas e de gráficos. FIGURA 2 - Contador Sanguíneo veterinário ABC Vet O aparelho ABC Vet permite o processamento de 45 amostras por hora, podendo processar amostras sanguíneas de 10 tipos de animais como, gato, cachorro, cavalo, rato, camundongo, coelho, porco, vaca, ovelha e macaco. Sendo que fornece 16 parâmetros hematológicos para gato, cachorro e cavalo, sendo estes:
17 7 WBC (Contagem de glóbulos brancos), RBC (Contagem de glóbulos vermelhos), HGB (Hemoglobina), HCT (Hematócrito), VCM (Volume celular médio), CHCM (Concentração média de hemoglobina corpuscular), HCM (Hemoglobina Corpuscular média), PLT (Contagem de plaquetas), MPV (Volume médio de plaquetas), RDW (Amplitude da distribuição vermelha), LYM# (Número de linfócitos), LYM% (Porcentagem de linfócitos), MON% (Porcentagem de monóciotos), MON# (Número de monócitos), GRA% (Porcentagem de granulócitos) e GRA# (Número de granulócitos). E fornecem somente 8 parâmetros para rato, camundongo, coelho, porco, vaca, ovelha e macaco, sendo estes WBC, RBC, HGB, HCT, VCM, CHCM, HCM e PLT (Manual do fabricante). O instrumento mantém na memória a última espécie de animal registrado com o cartão inteligente veterinário. Cada cartão inteligente veterinário contém as seguintes informações: espécie do animal, limites inferiores e superiores para cada parâmetro, limiares das marcas de plaquetas e eosinófilos e limites de marcas para WBC, RBC, HGB, HCT e PLT. A qualquer momento, antes de passar uma amostra, pode ser inserido um cartão inteligente para mudar a espécie (Manual do fabricante). Este aparelho automatizado de hematologia (ABC Vet ) trabalha com manuseio da amostra em tubo aberto, ou seja, necessita que se homogeneíze a amostra, que se verifique a presença de coágulo na amostra para posterior retirada da tampa do tubo e permitindo que a agulha do aparelho possa aspirar o sangue. Necessita somente de 12 µl de sangue total de cada amostra, sem necessidade de pré-diluição. É utilizado o método semi-automático para contagem de eritrócitos e hemoglobina através da diluição e leitura no ISOCELM-CELM CC530 se faz leitura também dos leucócitos totais. Esse método é utilizado quando o analisador hematológico automático esta com defeito. O método manual também é utilizado na rotina do HV/UFU para contagem de eritrócitos por µl de sangue através da seguinte técnica: diluição de 10µl de sangue com EDTA em um tubo contendo 1990µl de solução fisiológica (aberta sempre no dia para evitar a precipitação de solutos que pode interferir na contagem) e homogeneização. Após, é realizado o preenchimento da câmara de Neubauer, colocando a ponta da pipeta na abertura lateral desta câmara, formando
18 8 um ângulo de 45º, fazendo o líquido penetrar por capilaridade entre a lâmina e a lamínula. Após, são contados 5 quadrantes de 16 subunidades sendo preciso multiplicar o resultado por 10 6, encontrando assim o total de células por mm 3 de sangue (Figura 3). Já a leitura da hemoglobina manualmente é procedida da seguinte maneira: diluição de 20 µl de sangue com EDTA em tudo com 5ml de solução especial de hemoglobina, sendo está ácido clorídrico, diluído n/10. Homogeneização e em seguida procedida à leitura em espectrofotômetro. FIGURA 3 - Localização da contagem das células sangüíneas na câmara de Neubauer (L= leucócitos; E = eritrócitos) Fonte: LACVET UFRGS, Para obtenção do hematócrito é preenchido 2/3 de um tubo capilar com sangue com EDTA e o fechamento com auxílio do bico de Bunsen na chama azul, girando o tubo entre os dedos até o fechamento completo. Após, é centrifugado por 5 minutos (tubos posicionados de modo que a extremidade vedada fique voltada para a borda da centrífuga) e em seguida procedida a leitura em uma escala de leitura especial, determinando assim o volume globular ou hematócrito.
19 9 O método manual para contagem de leucócitos utilizado consiste em diluir 100µl de sangue com EDTA em um tubo com 1900µl de ácido acético glacial, preenchendo a câmara de Neubauer com a solução bem homogeneizada e em um microscópio óptico, na objetiva de 10X ou 40X contar o número de leucócitos contidos nos quatro quadrantes laterais da câmara (Figura 3). No HV/UFU além do método manual para contagem total de leucócitos, há também o já mencionado ISOCELM-CELM CC350 (Figura 4) que faz a contagem pelo meio de diluição e leitura. FIGURA 4 - Contador semi-automático de leucócitos, hemácias e hemoglobina Fonte: LACVET UFRGS, Para contar leucócitos por este método, é primeiramente necessário eliminar as hemácias da suspensão. Isso é feito através da adição de um agente hemolítico na alíquota de diluição dos leucócitos. Esse agente destrói as membranas celulares e dissolvem o citoplasma, deixando somente os núcleos (dos leucócitos) como partículas contáveis. Isso ocorre porque os contadores por impedância não podem ser usados para contagem de leucócitos em aves e répteis o núcleo das hemácias também permanece em suspensão, sobrepondo-se completamente aos núcleos dos leucócitos. Depois da lise, a contagem procede como a contagem de hemácias. Assim inicialmente é feita uma diluição inicial de 1:500 da amostra, que será usada para contar os leucócitos e mensurar, fotometricamente, a
20 10 hemoglobina. Imediatamente, uma alíquota dessa diluição é removida e diluída novamente para obter uma segunda diluição de 1: para contagem de hemácias. Existem diluidores automáticos que simplificam esse processo. A diluição mais alta é usada inalterada, com o instrumento no seletor para hemácias. A primeira diluição é adicionalmente tratada com a adição de um volume fixo de agente lisante. Isso faz com que os núcleos dos leucócitos fiquem em suspensão para a contagem e libera a hemoglobina de dentro das hemácias. Um reagente de hemoglobina é incluído no agente lisante. Depois de esperar, geralmente 30s, para que ocorra a lise completa e para que a reação com cianometemoglobina seja finalizada, essa diluição é passada no instrumento no seletor para leucócitos e hemoglobina. O fluxo da amostra é dividido, com parte dela indo para o fotômetro de fluxo celular para a mensuração da hemoglobina e parte indo para o transdutor para a contagem de leucócitos. A contagem diferencial de leucócitos é feita em esfregaços de sangue corado. O esfregaço é feito estendendo-se uma pequena gota de sangue com EDTA sobre uma lâmina, formando uma fina película de sangue que depois é corada (May Grünwald Giemsa) e examinada ao microscópio na objetiva de imersão, onde são contadas 100 células, revelando assim a porcentagem de cada tipo de leucócito por mm 3 de sangue. Para a realização da contagem diferencial dos leucócitos no esfregaço, segue-se o trajeto da Figura 5, isto para tornar menor a margem de erro, pois no momento da realização do esfregaço os neutrófilos tendem a localizar-se na periferia deste, os linfócitos na parte central, enquanto os eosinófilos distribuem-se homogeneamente (MATOS & MATOS, 1995). FIGURA 5 - Esquema de contagem diferencial de Fonte: LACVET UFRGS, leucócitos em esfregaço sanguíneo
21 11 O esfregaço deve ser fino, homogêneo, ter uma distribuição uniforme das células, sem sobreposições, apresentar pelo menos uma das bordas livre. Sendo confeccionado o mais rápido possível, no máximo 30 minutos após a colheita, para evitar alterações na morfologia celular. É utilizado o Método de May Grünwald Giemsa para a realização da coloração do esfregaço sangüíneo. Que consiste na seguinte técnica: é colocado o esfregaço voltado para cima sobre um suporte (Figura 6), é depositado sobre ele 15 a 20 gotas de May Grünwald deixando agir por três minutos. Esse é o tempo de fixação. E depois é colocado igual quantidade de água destilada e assopra por cima com a pipeta ou a boca, para que ela se misture ao corante. Deixa corar por 2 minutos. Por último é derramado o líquido da lâmina e a coloca numa cuba com suporte para lâminas. Nesta cuba contém Giemsa na concentração de 4%. Deixase corar por 20 minutos, retira-se a lâmina, é lavada em água, secando por agitação e examinando ao microscópio. FIGURA 6 - Suporte com lâminas, para realização de fixação do corante May Grünwald em esfregaços sanguíneo Existem duas classes de corantes utilizadas: corantes básicos e corantes ácidos. Os corantes básicos de Wright são uma complexa mistura de tiazinas, principalmente azula de metileno e azure B. O corante ácido é uma solução metil alcoólica de eosina. Quando o núcleo e outras estruturas no esfregaço de sangue periférico absorvem o corante básico, eles são denominados basofílicos; estruturas que adquirem os corantes ácidos são denominados acidofílicos ou eosinofílicos. Outras estruturas nucleadas que são coradas por uma combinação dos dois são denominadas neutrofílicas. Coletivamente, esses termos
22 12 são usados para classificar os leucócitos: basofílicos, eosinofilicos e neutrofilicos (SINK & FELDMAN, 2006). Contando também 5 campos mais limpos do esfregaço, é realizada a contagem de plaquetas. O número encontrado é multiplicado depois por e pelo número de hemácias, achando assim o número de plaquetas por mm 3 de sangue. Entretanto o ideal seria a contagem de plaquetas na câmara de Neubauer. Porém, o aparelho automático de hematologia já fornece o número de plaquetas da amostra sangüínea. b) Realização da Bioquímica Sérica No HV/ UFU, a bioquímica sérica é realizada por meio de um aparelho automatizado chamado Chem Well (Figura 7). Que é um analisador automático de bioquímica e Elisa imunoensaio (dosando hormônios, teste para toxoplasmose). No momento no Laboratório de Análises Clínicas do HV/UFU, esta sendo implantada a realização de testes para a dosagem de T 3 e T 4. O equipamento bioquímico Chem Well, funciona em sistema aberto, isso significa que pode trabalhar com reagentes de várias marcas, que no caso se fosse um sistema fechado teria que trabalhar com um reagente específico. Necessita de uma pequena quantidade da amostra, menos de 250 µl. Tem capacidade para 200 L de volume de reagentes. É de fácil manuseio e fácil programação. Tem um sistema automático de adição de amostra e reagentes para evitar contaminações. A precisão de pipetagem de amostras e reagentes é superior a 99%. Possui uma bandeja para 96 amostras, e uma bandeja para até 40 reagentes. Possui detecção automática do nível de reagentes. Tem capacidade para diluição, pré-diluição, dispensa simples ou múltipla de reagente, controle de temperatura 25º e 37º graus e armazenamento de dados ilimitados. Os resultados são impressos por paciente ou por teste. Possui calibração automática. É um analisador automático de bioquímica multicanal, pois, realiza vários ensaios ao mesmo tempo, como por exemplo: uréia, creatinina, alanina aminotransferase e outros. Podendo assim obter os resultados de um paciente com maior rapidez. No caso de analisador monocanal, este faz só um
23 13 ensaio por vez, como por exemplo, ele faz todos de creatinina, tendo que lavar o equipamento para realizar outro teste. Tem acesso randômico, que permite parada no processo que esta sendo realizado para requisitar um teste de urgência. Esse acesso randômico, também permite a verificação das telas de outros processos que estão sendo realizados, sem parar o processo requisitado. Possui interfaceamento, ou seja, o aparelho é ligado a um programa, que permite a leitura em código de barra da identificação do animal. FIGURA 7 - Aparelho automatizado para bioquímica sérica Chem Well Para realização da bioquímica, a amostra era centrifugada, para separar o soro ou plasma. Algumas bioquímicas eram feitas a partir do plasma, obtido de amostras com EDTA. Após a centrifugação, não é preciso colocar o soro em outro recipiente, podendo levar ao aparelho o próprio tubo de ensaio, desde que se tenha uma boa quantidade de soro, para que a agulha do aparelho não sugue o coágulo. O tubo era colocado na bandeja para amostras, e preparado o reagente como indica o fabricante e colocado na bandeja para reagentes. Posteriormente identifica-se a amostra no programa do computador, com os dados do animal: nome, número da ficha clínica e sexo. E em seguida o teste desejado é requisitado ao aparelho automatizado de bioquímica. O resultado é rápido, e é anotado na ficha do animal, e gravado no sistema, para que ao final do dia seja impresso a relação de exames e seus devidos resultados, para controle interno do laboratório.
24 14 c) Realização do Exame de Fezes Vários métodos são feitos no laboratório, para a realização do exame de fezes, como o método de Willis, método de sedimentação e método de Baermann modificado. Método de Willis: era realizado dissolvendo 2g de fezes com solução de cloreto de sódio ou açúcar em um frasco de boca larga. O frasco era colocado em posição perfeitamente vertical e sobre ele uma lâmina bem limpa e desengordurada. Após um período de aproximadamente 15 minutos, a lâmina era retirada, coberta com uma lamínula e examinada ao microscópio. Por esse processo, os ovos de helmintos e cistos de protozoários flutuam e aderem à lâmina, sendo um bom método para herbívoros. Método de sedimentação: ao contrário do anterior, esse método é baseado na sedimentação, na deposição do material a pesquisar, no fundo do frasco. Dissolvendo 1 ou 2g de fezes em solução fisiológica ou em água e passando através de uma gaze, diretamente para um frasco cônico ou um tubo de centrifugação. No primeiro caso, era deixado em repouso por 15 a 30 minutos (tempo mais longos dão resultados mais seguros); no segundo, centrifugado a 1500 r.p.m. por 5 minutos. Em qualquer um dos casos, era retirado do fundo do tubo o material sedimentado, colocado entre lâmina e lamínula limpas e examinado ao microscópio, observando a presença de parasitos ou de seus ovos. Método de Baermann modificado: esse método é baseado no aproveitamento da motilidade e no termotropismo das larvas, que são estimuladas ao se usar água aquecida. É colocado um funil de 20 a 25 cm de diâmetro em um suporte e conectado a sua extremidade, com o auxílio de um tubo de borracha, a um tubo de hemólise de 8 a 12 mm de diâmetro. Enchendo o sistema até a superfície do funil com água a 45ºC, evitando-se que se formem bolhas de ar. É colocada uma peneira forrada de gaze por cima da superfície da água e, sobre a gaze 10g ou mais de fezes recentes, retiradas diretamente do reto do animal; 1 hora após, retira-se o tubo de hemólise, e centrifugada-se a 1000 r.p.m. por 5 minutos, desprezado o sobrenadante cuidadosamente,
25 15 colocado o sedimento entre lâmina e lamínula e examinado ao microscópio com pequeno aumento ou com auxílio de uma lupa. d) Realização da Urinálise No HV/UFU as amostras são processadas em um prazo máximo de 30 minutos para que não haja alterações em suas propriedades. Primeiramente o tubo de ensaio com a urina é recebido já identificado, com o nome do paciente (animal), o número da ficha clínica e a data. Posteriormente é preenchida a ficha de urinálise, com esses dados, e iniciado o exame físico, que consiste da determinação de volume, cheiro, cor, aspecto, densidade e reação (ph) da urina. Para obter a densidade é colocado uma gota de urina no refratômetro, e feita a leitura diretamente na escala do aparelho, na coluna a direita, que vai de 1000 a Quando a densidade ultrapassa 1040, é observada a marca na coluna a esquerda e some ao do Para realizar a análise química é utilizada uma tira reagente da seguinte forma: É removida uma tira reagente do recipiente; O recipiente é tampado imediatamente; A tira reagente é mergulhada em uma amostra de urina não centrifugada. A tira reagente deve ficar saturada de urina; Sem hesitação, a tira reagente é removida da amostra de urina usando a lateral do recipiente para eliminar o excesso de líquido; A tira é segurada horizontalmente para evitar que os líquidos de reação dos quadradinhos se misturem; É lido e registrado os resultados para cada teste; O fabricante também fornecerá uma cartela de cores para ser consultada, a fim de graduar as reações e relatar os resultados; As tiras reagentes secas estão disponíveis em diversas configurações de testes, incluindo ph, proteína, cetonas, glicose, bilirrubina, gravidade especifica, sangue, urobilinogênio, leucócitos e nitritos. Em seguida a urina é colocada em um tubo cônico de centrifuga, e levada a centrifuga, contrabalanceando com outro tubo contendo água no mesmo
26 16 volume da urina; a amostra é centrifugada por 5 minutos a r.p.m.. Posteriormente a urina é decantada lentamente, evitando-se a saída do sedimento. O sedimento é agitado, e é transferida uma gota para uma lâmina, cobrindo a em seguida, com uma lamínula. É levada ao microscópio e examinada com um pequeno aumento, usando luz fraca. Em seguida, é mudado para o médio aumento e utilizada luz mais forte. Tanto com o médio como o pequeno aumento, é percorrido todo o campo. Os elementos encontrados no sedimento podem ser agrupados em: Organizados (eritrócitos, leucócitos, células epiteliais, bactérias, protozoários, ovos de parasitas, leveduras, fungos, espermatozóides e cilindros) E não organizados (cristais e material amorfo). Esses elementos são observados e anotados, e registrados por cruzes. Uma cruz: quantidade reduzida; duas cruzes: presença um pouco aumentada; três cruzes: quantidade aumentada de forma importante e quatro cruzes: quantidade muito aumentada. A urina decantada é colocada em dois tubos, em um tubo é colocado apenas 2 ml de urina, e adicionado 2 ml de ácido nítrico nitroso no fundo do tubo, com uma pipeta de vidro, evitando qualquer agitação. Essa técnica é conhecida como Teste de Gmelin, para detecção de pigmentos biliares na urina (Figura 8). Para detecção de proteína na urina é utilizado o método de Heller, que consiste da seguinte técnica: É colocada uma pequena quantidade de acido nítrico puro num tubo de ensaio; É estratificado (é colocado uma pequena camada em cima) um pouco de urina sobre o ácido; Se houver a formação de um anel branco no ponto de contato, há a presença de albumina; O ácido úrico e a uréia aparecem sob a forma cristalina (Figura 9).
27 17 FIGURA 8 - Formação do anel na urina do tubo à esquerda, já no tubo da direita não houve formação de anel FIGURA 9 - Formação de cristais de nitrato de uréia na urina Com a urina decantada que não foi utilizada e colocada em um outro tubo de ensaio, é realizado o Teste de Hay, para sais biliares. O teste de Hay é utilizado para analisar a presença de sais biliares na urina. No tubo de ensaio, com o restante da urina, é deixado cair flor de enxofre sobre a superfície. Isso é conseguido facilmente, quando se coloca a flor do enxofre dentro de um tubo de ensaio, cuja boca é tampada com uma camada de gaze, de modo a permitir a saída do enxofre, como se fosse numa peneira.
28 18 e) Realização do Raspado de Pele O esfregaço direto é realizado colocando o material tratado com uma solução de 10% de hidróxido de sódio (NaOH) sobre a lâmina. È triturado com um bastão, por 1 minuto com o intuito de amolecer a ceratina. É espalhado o material, e coberto com uma lamínula, comprimindo suavemente e examinando com pequeno aumento, para a verificação da presença ou não de esporos (conídeos ou macroconídeos) e hifas (Figura 10). FIGURA 10 - A esquerda um macroconídeo, e a direita uma hifa septada, em raspado de pele de cão presente
29 19 3 HEMOGRAMA 3.1 Colheita de sangue O local de punção varia de acordo com a espécie, quantidade de sangue a ser colhido e a finalidade laboratorial da amostra. As amostras sempre devem estar corretamente identificadas. Os tubos (Figura 11) mais utilizados na Medicina Veterinária são: EDTA: Preserva melhor o volume celular e as características morfológicas das células nos esfregaços corados. Uso universal, quelante de cálcio; Cor da tampa do frasco: roxa. Heparina: Possui ação antitrombina e antitrompoplastina, não muito utilizado na rotina hematológica, pois afetam de forma intensa as qualidades de coloração dos leucócitos sendo utilizado mais em bioquímica; Cor da tampa do frasco: verde. Fluoreto de sódio: Não é um anticoagulante. Inibe enzimas que participam da via glicolítica, impedindo a metabolização da glicose pelos eritrócitos durante o período de transporte até o laboratório. Cor da tampa do frasco: cinza. Citrato de sódio: combina com o cálcio formando citrato de cálcio insolúvel, utilizado em algumas provas hematológicas e de coagulação; Cor da tampa do frasco: azul (THRALL et al., 2006). O EDTA é o anticoagulante de eleição, quando a preservação das células e de suas características são os aspectos considerados (COLES, 1984). As causas de hemólise por erro de colheita incluem o uso de seringas e frascos quentes ou molhados, inadequada descarga da seringa, contaminação bacteriana, calor excessivo e transporte antes de completa coagulação (MUNDIM, 2008). Outro erro comum é a presença insuficiente de anticoagulante ou o seu não funcionamento. Para evitar esse inconveniente, observar sempre que a quantidade de sangue colhida corresponda à do anticoagulante utilizado e agitar suavemente a amostra, para permitir a mistura do anticoagulante com o sangue (GARCIA- NAVARRO, 2005a).
30 20 FIGURA 11 - Tubos para hemograma e bioquímica sérica Para coleta de sangue podem ser utilizados outros tubos, como, o tubo de tampa vermelha (Figura 11), destinado à obtenção de amostra de soro, não contem anticoagulante. O sangue nele contido deve coagular para que se obtenha o soro. Esse tubo é utilizado para obtenção de soro necessário as análises bioquímicas comuns (THRALL et al., 2006). O Tubo de tampa amarela, (Figura 11), é uma variação do tubo de tampa vermelha que não contém anticoagulante. Contém um gel que separa a fração de células compactadas daquela fração do soro quando a amostra é centrifugada. É indicado em situações em que se deseja fazer a centrifugação no local da coleta e o transporte para o laboratório sem a transferência do soro para outro tubo. O gel separa fisicamente as células e o soro evitando que ocorra o metabolismo do componente de interesse célula/soro (THRALL et al., 2006). 3.2 Interpretação do Hemograma na clínica de pequenos animais O hemograma é constituído pelas informações quantitativas (número total de células, contagem diferencial, índices hematimétricos, etc.) e qualitativas (morfologia das células sanguíneas no esfregaço sanguíneo). Uma interpretação adequada depende da integração de ambas (REBAR, 2003). O hemograma completo inclui todos os testes laboratoriais utilizados para examinar as células contidas no sangue periférico. As células são
31 21 classificadas como eritrócitos (células vermelhas do sangue), leucócitos (células brancas do sangue) ou plaquetas. Os valores de proteína plasmática e de fibrinogênio são frequentemente incluídos nos hemogramas completos em Medicina Veterinária (SINK & FELDMAN, 2006) Eritrograma É a avaliação dos eritrócitos, do hematócrito e da hemoglobina, assim como a contagem e avaliação dos reticulócitos, nos casos necessários. A mensuração primária das hemácias que fornece uma avaliação básica do tamanho do éritron (circulante) é o volume globular (VG) ou hematócrito (Ht), que está incluso no eritrograma. Ele é simplesmente uma mensuração da fração do volume sanguíneo que é ocupada pelos eritrócitos (KERR, 2003). Numa centrífuga o sangue é separado em três partes distintas: massa de eritrócitos ao fundo, uma camada branca ou cinza de leucócitos e trombócitos, imediatamente acima e referida como botão leucocitário e o plasma sanguíneo (COLES, 1984). As causas fisiológicas de aumento do hematócrito são: desidratação, medo/excitação, atividade intensa, altitudes e outras. As causas patológicas são: choque, policitemia absoluta (desvio cardíaco da direita para esquerda, doença alveolar crônica, tumores renais e distúrbios endócrinos), hipertireoidismo (gato) e esteróides anabólicos. As causas fisiológicas de diminuição do hematócrito são: estágio avançado de gestação, tranquilização, anestesia e erros na coleta como hemólise durante ou após a coleta. E uma causa patológica da diminuição do hematócrito é a anemia. As alterações no hematócrito dos animais refletirão em anemia ou policitemia (BUSH, 2004). a) ANEMIA São três os exames de laboratório utilizados no diagnóstico da anemia: o hematócrito, a taxa de hemoglobina e o número de eritrócitos por mm³ de sangue. Sempre que o hematócrito estiver abaixo do normal, o animal está com anemia. A taxa de hemoglobina circulante acompanha o valor do hematócrito,
32 22 permanecendo igualmente baixa na anemia. Quanto à contagem de eritrócitos por mm³ de sangue, esta pode estar diminuída ou não. A contagem encontra-se diminuída nas anemias não regenerativas ou aplásicas, que ocorrem por diminuição da produção de eritrócitos pela medula óssea. A contagem de eritrócitos pode permanecer no limite normal inferior no caso das anemias regenerativas, que ocorrem por perda aumentada de eritrócitos, através de hemorragia ou hemólise, quando os eritrócitos aparecem em número normal ou perto do normal, mas com uma quantidade de hemoglobina por eritrócito abaixo do normal, devido à falta de reposição de ferro na medula óssea (GARCIA- NAVARRO, 2005a). De acordo com MUNDIM (2008) as anemias ocorrem em razão de uma excessiva perda de sangue (hemorragias) ou destruição (hemólise) ou diminuição da produção de eritrócitos. Têm sido propostas muitas classificações para as anemias. No entanto 3 classificações têm sido mais usadas entre os clínicos: a classificação quanto à resposta da medula óssea, a morfologia e a etiologia. Quanto à resposta da medula óssea De acordo com a resposta da medula óssea as anemias são classificadas em regenerativas e não regenerativas. As anemias regenerativas ocorrem devido a uma perda aumentada de eritrócitos, mantendo normal sua produção. Nas anemias não regenerativas ocorre o inverso, isto é, há uma diminuição da produção dessas células, associada a uma perda das mesmas em quantidades normais (GARCIA-NAVARRO, 2005a). Anemia regenerativa Anemia regenerativa é causada por hemorragia ou hemólise. A hemorragia pode ser externa ou interna, bem como crônica ou aguda. A hemólise pode ser intra ou extravascular. As causas mais comuns de hemólise são mecanismos imunomediados, hemoparasitas e medicamentos ou substâncias químicas que provocam lesão oxidativa, resultando na formação de corpúsculo de Heinz (THRALL et al., 2006). São também conhecidas como anemias ferroprivas,
33 23 pois o ferro existente nos eritrócitos perdidos não se apresenta disponível para a formação de nova hemoglobina, como ocorre num indivíduo normal (GARCIA- NAVARRO, 2005a). Achados laboratoriais De acordo com KERR (2003), as anemias podem ser diferenciadas laboratorialmente da seguinte forma: Na anemia hemolítica aguda o Ht já está reduzido até mesmo nos estágios mais iniciais visto que o plasma não é perdido concomitantemente. Tanto a hemoglobina (vermelha) quanto a bilirrubina (amarelo-alaranjada) podem ser vistas no plasma de um tubo de micro-hematócrito. Quando houver hemoglobina livre no plasma, o CHCM terá um valor aumentado. Na anemia de início gradual o Ht cai lentamente em um período de dias ou semanas, o volume plasmático se expande concomitante para compensar. Pode ser dividida em anemia moderada/suave apresentando Ht abaixo do normal, mas ainda acima de 0,20-0,25, e anemia severa/muito severa apresenta Ht abaixo de 0,20-0,25 podendo diminuir para até 0,05-0,06. Na anemia hemorrágica crônica haverá evidências de regeneração, muitas células policromatófilas estão presentes junto com algumas hemácias nucleadas. Nos estágios inicias, as células policromatofílicas serão macrócitos e as células adultas serão normocíticas e normocrômicas. Entretanto, em casos de longa duração, a perda continua de constituintes das hemácias (ferro, proteínas) leva uma exaustão secundária da medula óssea. Isso acaba resultando no aparecimento de células cada vez mais hipocrômicas (isto é, CHCM reduzido, devido à deficiência de ferro) e menores e, em casos muito crônicos, até mesmo as células jovens, embora ainda policromatofílicas, ficam hipocrômicas e microcíticas. Células com formas alteradas podem aparecer. Nos casos em que a hemorragia não é causada por trombocitopenia, a contagem de plaquetas estará frequentemente elevada, devido ao consumo de plaquetas no sítio da lesão, causando uma retroalimentação positiva na produção. Na anemia hemolítica grave mostra um quadro eritrocitário regenerativo, e células marcantemente disformes até mesmo nos estágios iniciais
34 24 da condição. Na anemia hemolítica em casos infecciosos, pode ocorrer neutrofilia e/ou monocitose. De acordo com THRALL et al. (2006), a anemia hemorrágica aguda é caracterizada da seguinte forma: Na anemia hemorrágica aguda a avaliação hematológica tem pouca utilidade, inicialmente o hematócrito permanece normal, porque há perda simultânea de hemácias e do plasma. No entanto, em algumas horas o VG e o teor plasmático de proteínas diminuem em razão do efeito diluidor decorrente da transferência de fluido intersticial ao sangue. Aproximadamente 72 h após a hemorragia surgem hemácias policromatofílicas (reticulócitos) no sangue. Na anemia hemorrágica crônica caracterizada por anemia por deficiência de ferro ocorre diminuição do volume corpuscular médio (VCM). Notase microcitose porque os precursores das hemácias continuam se dividindo na tentativa de obter o conteúdo máximo de hemoglobina. As divisões adicionais resultam em hemácias menores do que o normal. O VCM de reticulócitos também está diminuído, pois o tamanho das hemácias imaturas deficientes em ferro é menor do que o normal. Embora nesses pacientes se espere diminuição da CHCM, pois as células contém menor teor de hemoglobina que o normal, esse parâmetro encontra-se na faixa de normalidade. No exame do esfregaço sangüíneo, principalmente nos estágios finais da anemia por deficiência de ferro, as hemácias da maioria das espécies, exceto de gatos, podem parecer pálidas, com aumento da palidez central; às vezes, nota-se apenas um fino bordo de hemoglobina. É comum encontrar anormalidades de membrana nas hemácias. Anemias não regenerativas Anemias não regenerativas são também chamadas anemias aplásicas e são causadas por hipoplasia eritrocitária, que é uma queda da produção de eritrócitos com uma diminuição no número de precursores nucleados dos eritrócitos na medula óssea. Do ponto de vista morfológico, são normocíticas e normocrômicas, e seu índice de reticulócitos é zero. Quanto a sua etiologia, podemos dividí-las em primárias, cuja origem está numa disfunção primária da
35 25 medula óssea, e secundárias, cuja origem se encontra em outro órgão ou sistema, com consequência sobre a eritropoiese (GARCIA-NAVARRO, 2005a). A anemia não regenerativa secundária pode ser decorrente de anormalidades extrínsecas à medula, inclusive anemia por doença inflamatória, por insuficiência renal crônica, associada à doença endócrina e, raramente, associada a deficiências nutricionais (THRALL et al., 2006). Na anemia hipoplásica/aplásica a morfologia das hemácias geralmente é caracterizada por uma completa ausência de células jovens, com células adultas mostrando, algumas vezes, anormalidades marcantes. Micrócitos e células hipocrômicas são frequentemente uma característica. Isso pode ser distinguido de exaustão secundária da medula óssea devido a uma hemorragia crônica pela ausência de células policromatofílicas ou de reticulócitos (KERR, 2003). A anemia aplásica verdadeira é uma condição séria, na qual a medula óssea inteira simplesmente paralisa. Devido às diferentes meias-vidas dos diferentes tipos celulares, os granulócitos (neutrófilos, eosinófilos e basófilos) e as plaquetas são afetados em primeiro lugar. A contagem total de leucócitos e a contagem de plaquetas serão bastante baixas e a maioria das células brancas que estiverem presentes será constituída de linfócitos. O hematócrito pode simplesmente estar na parte mais baixa da variação normal, mas mesmo que tenha havido uma hemorragia substancial, não haverá evidências de regeneração eritrocitária. Os fatores implicados na aplasia de medula óssea são irradiação, intoxicação aguda por samambaia, e certos medicamentos (estrógenos em cadelas para evitar prenhez indesejada, fenilbutazona e o cloranfenicol). Ocasionalmente, os casos de aplasia da medular se desenvolvem na ausência de qualquer um dos fatores causados ou de qualquer administração medicamentosa (KERR, 2003). Classificação quanto à morfologia Os índices hematimétricos são úteis na classificação das anemias e são calculados conforme as fórmulas a seguir: (em milhões) VCM (volume corpuscular médio) = Hematócrito (%) x 10 / nº eritrócitos
36 26 CHCM (concentração de hemoglobina corpuscular média) = Hemoglobina (g/dl) x 100 / hematócrito (%) Quanto ao VCM as anemias podem ser classificadas de acordo com o tamanho das hemácias em: macrocíticas, normocíticas e microcíticas. Quanto ao CHCM as anemias são classificadas de acordo com a cromia em: normocrômica ou hipocrômica (MUNDIM, 2008). Informações acerca da morfologia das hemácias são fornecidas pelos valores do VCM e CHCM. O VCM é uma mensuração do tamanho das hemácias e o CHCM é uma mensuração da concentração de hemoglobina nas hemácias (KERR, 2003). De acordo com SINK & FELDMAN (2006), a concentração média de hemoglobina (HCM) é o peso médio de hemoglobina em um eritrócito individual. Um valor de HCM menor que o limite inferior do intervalo de referência espécie - específico indica que os eritrócitos possuem menos que o peso médio de hemoglobina. Um valor de HCM maior que o limite superior do intervalo de referência espécie - específico indica que os eritrócitos possuem mais que o peso médio de hemoglobina. O HCM é menos preciso que o CHCM, pois é calculado a partir das duas medidas menos precisas: a contagem de hemácias e a concentração de hemoglobina. É raramente usada. Mas, na deficiência crônica de ferro, a queda na HCM é maior que a queda no VCM (BUSH, 2004). Um aumento no VCM implica células anormalmente grandes, isto é macrócitos. São principalmente células imaturas - reticulócitos e, possivelmente, hemácias nucleadas, em anemias regenerativas. Uma diminuição no VCM implica células anormalmente pequenas, ou seja, microcíticas. Raramente são vistas e isso se deve principalmente a anemia ferropriva. Células com VCM normal são chamadas normocíticas. Diminuição na CHCM implica células com uma quantidade reduzida de hemoglobina, chamadas hipocrômicas. As mais comumente encontradas são os reticulócitos; as hemácias em estágio avançado da deficiência de ferro são hipocrômicas. As células com quantidade normal de hemoglobina CHCM normal são chamadas normocrômicas (BUSH, 2004). O valor do CHCM é cerca de 35g/100mL independente da espécie ou do tamanho das hemácias, isto é, para qualquer valor de hematócrito fornecido, a
37 27 quantidade total de hemoglobina por unidade de volume de sangue será a mesma independente da espécie. Um CHCM anormalmente alto não é assim tão possível; não existe uma hemácia hipercrômica. Há três razões possíveis quando isso ocorrer: Amostra de sangue hemolisada (ou devido a uma coleta mal feita ou, mais raramente, hemólise intravascular genuína) Outras substâncias interferentes no plasma (por exemplo, plasma lipêmico) podem causar um valor erroneamente alto de hemoglobina. Erro laboratorial simples ou na determinação do hematócrito ou na mensuração da hemoglobina (KERR, 2003). Microcitose e hipocromia são dois fenômenos que geralmente andam juntos, sendo a microcitose a presença de eritrócitos menores que o tamanho normal da espécie, chamados micrócitos e a hipocromia a presença de eritrócitos com menos hemoglobina que o normal. Na verdade, é a falta de hemoglobina que deixa o eritrócito pequeno, tornando-o um micrócito hipocrômico. A microcitose hipocrômica faz baixar os índices VGM e CHCM, característica das anemias ferroprivas (GARCIA-NAVARRO, 2005a). Hemácias macrocíticas são maiores e apresentam maior volume corpuscular médio. A principal causa de macrocitose é o aumento da quantidade de hemácias imaturas, (Figura 12), que se apresentam policromatofílicas em esfregaços sanguíneos (THRALL et al., 2006).
38 28 FIGURA 12 - Esfregaço sanguíneo de cão, evidenciando a presença de Hemácias jovens (Policromatófilos) Classificação quanto ao mecanismo fisiopatológico ou etiologia Anemias por perda integral de sangue (anemias hemorrágicas). Anemias por destruição acelerada de eritrócitos (anemias hemolíticas). Anemia por deficiência de substâncias essenciais (a eritropoiese está ineficaz, porem a medula óssea está hiperproliferativa). Anemia por depressão da hematopoiese (a eritropoiese está reduzida devido a medula óssea estar hipoproliferativa) (MUNDIM, 2008).
39 29 Quanto à classificação morfoetiológica: QUADRO 1 Classificação das anemias quanto a morfoetiologia VCM CHCM CARACTERÍSTICAS Sempre regenerativas. HIPOCRÔMICA Perda aguda de sangue/anemia hemolítica aguda. MACROCÍTICA Deficiência de vitamina B12, ácido fólico, NORMOCRÔMICA niacina. Problemas nos fatores de multiplicação ( divisão) hemoglobina podem estar anormal. Deficiência de Ferro por perda: HIPOCRÔMICA - perda crônica de sangue: tumores, úlceras - parasitas: Ancylostoma spp, Haemonchus spp. MICROCÍTICA Deficiência de ferro por fatores que atuam no NORMOCRÔMICA seu uso: - piridoxina, riboflavina, Cobre. Doença infecciosa crônica. NORMOCRÔMICA Nefrite com uremia. Hemorragia sem resposta. NORMOCÍTICA Leucemias: invasão da médula óssea. HIPOCRÔMICA Anemias hipoplásticas: radiação, antibióticos. Intoxicação: chumbo, drogas. Fonte: MUNDIM, 2008 b) POLICITEMIA Policitemia é o aumento do número de hemácias. Pode ser absoluta ou meramente relativa (BUSH, 2004). Policitemia relativa É definida como um aumento no hematócrito sem ter havido nenhum aumento no tamanho real do éritron como um todo e é, sem dúvida, o tipo mais comum de policitemia. Nas espécies animais, há duas causas possíveis:
40 30 Deficiência de água (desidratação): em um animal desidratado, o conteúdo de líquido plasmático será reduzido e, visto que as hemácias não podem escapar da circulação, a sua concentração e, deste modo, o hematócrito, vão aumentar. As proteínas plasmáticas ficam também, em grande parte presas na circulação e, assim, em pacientes desidratados, a concentração de proteína total plasmática aumenta junto com o hematócrito aproximadamente na mesma porcentagem. Contração esplênica: excitação, apreensão ou medo faz com que a musculatura do baço se contraia, disponibilizando na circulação as hemácias armazenadas. Durante esta ocorrência, a concentração de proteína total plasmática permanece inalterada (KERR, 2003). Policitemia absoluta Deve-se a um aumento genuíno no número de hemácias, que eleva o Ht e também expande o volume total de sangue. Essa concentração excessiva de hemácias faz as membranas mucosas parecerem mais vermelhas e aumenta a viscosidade do sangue, causando lentidão no fluxo sangüíneo com conseqüente hipóxia tecidual. A policitemia absoluta é um quadro raro, relatado apenas em alguns cães e poucos gatos (BUSH, 2004). A policitemia absoluta pode ser primária ou secundária (THRALL et al., 2006). Policitemia absoluta primária (policitemia vera): é um tipo raro de alteração mieloproliferativa, caracterizada por uma superprodução marcante de hemácias adultas, de aparência normal. Poderia se pensar que ela é um tipo de neoplasia da medula óssea. Seu diagnóstico depende do achado de um hematócrito de cerca de 0,70 ou mais em um animal com hidratação normal, não excitado, na ausência de qualquer alteração respiratória, cardiovascular ou endócrina (KERR, 2003). Acredita-se que a fisiopatologia dessa disfunção envolva a presença de uma célula anormal e precursores eritróides capaz de proliferar independentemente da concentração de eritropoietina ou da hiper-responsividade à eritropoietina (THRALL et al., 2006).
41 31 Policitemia absoluta secundária: é o termo usado quando o aumento do tamanho do éritron é uma conseqüência de uma doença em outro sistema orgânico. A policitemia secundária pode, ela mesma, ser dividida em dois grupos, dependendo se ela acompanha ou não uma baixa tensão tecidual de oxigênio. Quando uma baixa tensão tecidual de oxigênio é uma conseqüência de doença, a cianose está geralmente presente e os órgãos envolvidos são ou o sistema respiratório ou o sistema cardiovascular. As causas de policitemia secundária não associadas com diminuição da tensão tecidual de oxigênio são principalmente alterações endócrinas, onde a anormalidade hormonal primária tem um efeito direto sobre a produção de eritropoietina, por exemplo, o excesso de cortisol na síndrome de Cushing. Em geral, os valores de hematócrito são menos espetacularmente anormais do que os vistos na policitemia vera (KERR, 2003). A produção de eritropoietina pode estar aumentada em pacientes com lesões renais (geralmente neoplasias indutoras de hipóxia renal localizada). Embora seja raro, também pode ocorrer aumento na produção de eritropoietina ou de uma substância semelhante à eritropoietina estimulada por neoplasias extra-renais (THRALL et al., 2006) Alterações morfológicas dos eritrócitos A morfologia do eritrócito é acessada pelo exame microscópico de um esfregaço sanguíneo. As principais alterações morfológicas vistas nos eritrócitos dos animais são a policromatofilia, anisocitose, o rouleaux, poiquilocitose, hemácias em alvo (codócitos ou target cells), esferócitos, acantócitos, esquisócitos além de corpúsculos de inclusões citoplasmática como os de Howell-Jolly, Heinz, ponteado basofílico e parasitas eritrocitários como Babesia spp, Anaplasma spp e Haemobartonella spp. Policromatofilia é a presença aumentada de policromatófitos no sangue. Os policromatófilos são eritrócitos jovens que, nas colorações de Wright ou Giemsa, aparecem com uma tonalidade levemente azul - acinzentada (Figura 12). Essas células indicam regeneração medular da linhagem vermelha e aparecem em
42 32 casos de anemias regenerativas. Policromatófilos e reticulócitos são as mesmas células com colorações diferentes (GARCIA- NAVARRO, 2005a). Anisocitose do grego, anisos, desigual, é uma variação acentuada no tamanho das hemácias (Figura 13) (GARCIA-NAVARRO, 2005a). Anisócitos são hemácias de tamanhos diferentes que aparecem no sangue do mesmo animal simultaneamente. Certo grau de anisocitose é normal nas hemácias de gato. A anisocitose deve-se à presença de um número significante de macrócitos ou, menos freqüentemente, de micrócitos entre as hemácias de tamanho normal. A maioria dos casos ocorre pela presença de reticulócitos nas anemias regenerativas. Os contadores eletrônicos de hemácias fornecem uma medida da variabilidade do tamanho destas anisocitose chamada de RDW, que é a faixa de distribuição do tamanho das hemácias (BUSH, 2004). Hemácias nucleadas (Figura 13) são também chamadas de rubrícitos, normoblastos ou eritroblastos com os prefixos apropriados. São hemácias imaturas, em desenvolvimento, que precedem os reticulócitos na escala maturativa; são liberadas pela medula óssea. Números elevados aparecem em anemia regenerativa grave (hemorrágica ou hemolítica) acompanhada de grande quantidade de reticulócitos (BUSH, 2004). Rouleaux eritrocitário é uma disposição dos eritrócitos formando cadeias como se fossem moedas colocadas em pilhas e que foram derrubadas. Ocorre em casos em que há um aumento da proteína plasmática, como em certos estados inflamatórios, em diversos tipos de câncer e na gestação. O Rouleaux aumenta a velocidade de hemossedimentação ou VHS, que mede a capacidade dos eritrócitos sedimentar em num tubo de vidro, durante um tempo determinado. Em animais sua utilização é limitada (GARCIA-NAVARRO, 2005a). Poiquilocitose é a variação no formato do eritrócito. Eritrócitos de formato anormal são chamados de poiquilócitos. Diversos termos são usados para conotar formatos específicos dos eritrócitos e podem ser associados com estados patológicos específicos (SINK& FELDMAN, 2006). As alterações morfológicas mais importantes incluem vários tipos de hemácias espiculadas, esferócitos e excentrócitos. As hemácias espiculadas apresentam um ou mais espículos na superfície e incluem equinócitos (Figura 14), acantócitos, ceratócitos e esquistócitos. Hemácias com alteração morfológica
43 33 menos importante incluem leptócitos (células dobradas ou células-alvo), codócitos (células-alvo), dacirócitos (hemácias em forma de lágrima) e torócitos (hemácias arredondadas) (THRALL et al., 2006). FIGURA 13 - Hemácia nucleada (seta maior branca), policromatófilo (seta menor), e corpúsculo de Howell Jolly ( seta preta), em esfregaço de sangue periférico de cão FIGURA 14 - Eritrócitos crenados ou equinócitos em esfregaço de sangue periférico de cão
44 34 De acordo com MUNDIM (2008), as alterações na forma das hemácias ocorrem nos seguintes casos: Esquisócitos: vistas nas vasculites, insuficiências renais, mielofibrose, deficiência crônica de ferro e glomerulonefrites. São fragmentos de células ou células deformadas (em capacete, em boné ou em gota). Esferócitos: no cão sugere anemia hemolítica imunomediada. São células pequenas, muito coradas, sem descoloração central. Acantócitos (burr cells): vistas nas doenças renais e esplênicas, hemangiossarcomas e cirrose hepática. São células de contorno irregular, em forma de estrela. Eliptócitos ou ovalócitos: ocorre nas leucemias. São células de forma oval ou elíptica. Equinócitos (crenados): indicam excesso de EDTA, exercícios, uremia, amostras velhas e coagulação intravascular disseminada (CID). São células com projeções finas na superfície. Os estomatócitos possuem palidez central semelhante a uma fenda envolvida por zona densa; resultam de defeitos de membranas dos eritrócitos; essas células podem estar presentes na anemia hemolítica. Os corpúsculos de Burr são equinócitos com múltiplas espículas de extremidade pontiaguda produzidos pela ruptura da membrana celular; eles podem ser observados na doença renal. As células alvo (leptócitos e codócitos) possuem uma única palidez central que dá à célula uma aparência de alvo; costumam ser observadas na doença hepática. Os dacrócitos são eritrócitos em formato de lágrima caindo e estão frequentemente associadas a doenças na medula óssea (SINK & FELDMAN, 2006). As inclusões encontradas nos eritrócitos podem ser os pontilhados basofílicos que aparecem como grânulos azuis de tamanho variáveis dentro dos eritrócitos. Na maioria dos casos, esses grânulos são RNA residual e representam reticulócitos. Os corpúsculos de Howell Jolly (Figura 13) são inclusões celulares roxo-escuras com aproximadamente 1 µm de diâmetro, são resquícios de fragmentos de cromatina nuclear. Os corpúsculos de Heinz não são identificados com facilidade pela coloração de Wright, mas quando corados com o novo azul de metileno, aparecem como inclusões em azul-claro, essa inclusões tem 1 a 4 µm de
45 35 diâmetro; são formados nos eritrócitos quando a hemoglobina desnatura e precipita, o que pode ser resultado de lesão oxidativa (SINK & FELDMAN, 2006). Os grânulos de Howell-Jolly raramente estão presentes em cães normais, mas aparecem em mais de 1% das hemácias de gatos aparentemente sadios. Números elevados estão associados, primariamente, com anemia degenerativa, mas também podem ocorrer: com função esplênica diminuída, por exemplo, esplenectomia e tumores esplênicos; após administração de glicocorticóides nos cães; nos quadros de macrocitose em Poodle (BUSH, 2004). O ponteado basofílico esta associado à resposta regenerativa exagerada observada em muitos casos de intoxicações por chumbo em cães (BUSH, 2004). Os grânulos de Heinz são raros em cães saudáveis, mas ocorrem em mais de 10% das hemácias de gatos aparentemente sãos (até em mais de 50% das hemácias em alguns gatos). Números anormais são causados primariamente por drogas oxidativas, e sua remoção pelos macrófagos (no baço) pode produzir anemia hemolítica. Números elevados também estão associados em gatos com: doenças intestinais; disautonomia felina (síndrome de Key-Gaskell) sem anemia. Em cães está associado com: terapia regular com prednisolona; e esplenectomia (redução da retirada de grânulos de Heinz do sangue) (BUSH, 2004). E também no cão indica intoxicação por cebola (MUNDIM, 2008) Parasitas eritrocitários A destruição de hemácias (hemólise) pode ser intra ou extravascular e decorrente de fatores intrínsecos (primários), como deficiências de membrana de enzima de origem hereditária ou de fatores extrínsecos (secundários), como hemoparasitas ou hemólise imunomediada. A hemólise intravascular representa a lise verdadeira de hemácias no sistema vascular. Ocorre hemólise extra-vascular quando as hemácias anormais são fagocitadas pelos macrófagos, geralmente no baço ou no fígado. Anticorpos contra os microorganismos, complexos imunes ou complemento se ligam às hemácias, resultando em fagocitose por macrófagos. Quando há hemólise intravascular, pode haver também hemoglobinemia, hemoglobinúria, hiperbilirrubinemia e bilirrubinúria. Além disso, o teor de
46 36 hemoglobina pode estar falsamente aumentado em relação ao volume globular, com falso aumento da CHCM. O VCM pode estar aumentado quando houver reticulocitose (THRALL et al., 2006). Mycoplasma haemofelis: Antigamente conhecido como Haemobartonellla felis, que aparecem como pequenos cocos ou bacilos de coloração escura, medindo entre 0,3 e 0,5 µm e localizados na periferia dos eritrócitos (Figura 15), no auge da parasitemia é rápido e os parasitas desaparecem em seguida, geralmente, apenas alguns poucos são vistos no momento do exame (GARCIA-NAVARRO, 2005a). É transmitido pelo sangue infectado, possivelmente pelo sangue que alimenta os artrópodos, como pulgas e carrapatos, por mordidas de gatos e pela exposição iatrogênica. É também transmitido pelas gatas aos seus filhotes, no útero, ao nascimento ou pelo aleitamento. Os sinais clínicos incluem aqueles de anemia, esplenomegalia, febre, letargia e às vezes, icterícia ( THRALL et al., 2006). Em gatos, a anemia hemolítica imunomediada é associada à infecção por Mycoplasma haemofelis. Os achados laboratoriais são variáveis, porém sempre incluem diminuição do volume globular, da contagem de hemácias e da concentração de hemoglobina (KERR, 2003). FIGURA 15 - Esfregaço sangüíneo de gato com eritrócitos parasitados com Mycoplasma haemofelis Mycoplasma haemocanis: é pouco comum em cães e pode ter a mesma aparência de M. haemofelis, mas, frequentemente, a bactéria forma cadeias atravessando a superfície das hemácias (Figura 16) (BUSH, 2004). Essa cadeia geralmente se ramifica em formato de Y (THRALL et al., 2006). Estão geralmente
47 37 associadas com anemia normocítica normocrômica e aparecem, particularmente, após a esplenectomia (BUSH, 2004). FIGURA 16 - Esfregaço sangüíneo de cão com eritrócito parasitado com Mycoplasma haemocanis Babesia spp, são protozoários, também chamados piroplasmas; que são hematozoários vistos no interior dos eritrócitos, na sua forma característica de gotas únicas ou duplas, unidas pelo vértice e presente no sangue de bovinos (B. bovis, B. bigemina), eqüinos (B. cabali, B. equi) e cães (B. canis) (Figura 17). Nos eqüinos, as babésias podem aparecer em número de quatro no mesmo eritrócito, unidas pelo vértice e formando a chamada Cruz de Malta (Figura 18) (GARCIA- NAVARRO, 2005a). Várias espécies de Babesia causam anemia hemolítica e trombocitopenia em animais domésticos. As babésias são transmitidas por vários tipos de carrapatos; sua patogenicidade é variável e representa a principal causa de hemólise intravascular e extravascular. Outros mecanismos de infecção incluem transmissão transplacentária e contaminação por sangue infectado. Pode ser diagnosticada por meio do esfregaço sanguíneo ou do exame do creme leucocitário obtido a partir da centrifugação do sangue; entretanto, um teste PCR é mais sensível e específico. É comum ocorrer hiperglobulinemia, trombocitopenia e neutropenia; portanto, a erliquiose também deve ser considerada no diagnóstico
48 38 diferencial, visto que tais achados laboratoriais também são comuns nessa doença (THRALL et al., 2006). FIGURA 17 - Esfregaços sangüíneos de cão com eritrócitos parasitados com Babesia canis FIGURA 18 - Esfregaço sangüíneo de eqüino com eritrócito parasitado com Babesia equi Citauxzoon felis: é um protozoário pertencente à mesma família da Theileria spp. Semelhante à Theileria spp, os merozoítos (piroplasmas) infectam hemácias, enquanto um estágio tecidual, os esquizontes, infectam e preenchem os macrófagos e os vasos sanguíneos adjacentes em todo o corpo. O diagnóstico se baseia na identificação de piroplasmas em forma de anel de sinete nas hemácias do esfregaço sangüíneo (Figura 19), em uma fase relativamente final da doença ou na constatação de esquizontes, em macrófagos no exame citológico de baço,
49 39 fígado, linfonodo ou aspirado de medula óssea. Linces, panteras e pumas, que atuam como reservatórios naturais, em geral apresentam infecção assintomática persistente, embora os linces ocasionalmente desenvolvam doença fatal (THRALL et al., 2006). FIGURA 19 - Esfregaço sangüíneo de um puma com eritrócito parasitado com piroplasmas de Citauxzoon Anaplasma marginale é uma riquétsia intra-eritrocitária que causa a Anaplasmose bovina, doença transmitida por carrapato mais prevalente em bovinos; é de ocorrência cosmopolita. É transmitido por carrapatos, picadas de moscas e iatrogenicamente. Anaplasma marginale se apresenta como pequenas inclusões azul-escuras (0,5 a 1 µm) nas margens das hemácias. Anaplasma centrale parece semelhante, mas está localizado em uma posição mais central das hemácias. A infecção pelo microorganismo pode causar anemia hemolítica fatal. O mecanismo fisiopatogênico da anemia pode ser imunomediado. O bovino não tratado e que sobreviveu a infecção pode se tornar hospedeiro crônico. O diagnóstico pode ser definido por PCR e pelo exame de esfregaço sangüíneo (THRALL et al., 2006).
50 40 4 LEUCOGRAMA O leucograma compreende a contagem total e diferencial de leucócitos e suas alterações morfológicas. Há uma grande variação na resposta leucocitária entre as espécies animais. O cão responde violentamente as infecções e às demais condições de stress. Contagens de a leucócitos/mm³, são comuns, não sendo raros os casos de mais de leucócitos/mm³. O gato responde mais discretamente, com contagens de a leucócitos/mm³ sendo considerada leucocitose de grande magnitude, raramente encontramos contagens de leucócitos/mm³ e acima de leucócitos/mm³, são contagens extremamente raras (MUNDIM, 2008). Existe uma série de fatores que influenciam tanto na contagem global como na diferencial de leucócitos entre eles: idade, raça e espécie, exercício muscular, sexo e digestão (MUNDIM, 2008). São as alterações observadas no leucograma que indicam a resposta leucocitária, como leucocitose, leucopenia, neutrofilia/penia, linfocitose/penia, monocitose/penia, eosinofilia/penia, desvio à esquerda regenerativo/degenerativo e desvio à direita (BUSH, 2004). O sufixo penia indica diminuição da contagem do tipo celular no sangue. As citopenias importantes para a interpretação das contagens celulares são neutropenia, linfopenia e eosinopenia. O termo citopenia não se aplica aos monócitos porque a diminuição na contagem desse tipo celular não é importante. O termo também não se aplica aos neutrófilos bastonetes, metamielócitos, basófilos e metarrubríciotos porque a ausência dessas células é um achado normal (THRALL et al., 2006). 4.1 Neutrófilos Os neutrófilos funcionam primariamente como fagócitos e são particularmente importantes em quadros infecciosos e na inflamação. Neutrófilos maduros estão presentes no organismo em três compartimentos: o compartimento circulante, o compartimento marginal e o compartimento da medula óssea. Quando há uma súbita demanda de neutrófilos, ocorre a mobilização do compartimento da
51 41 medula óssea, que pode corrigir a neutropenia em algumas horas, enquanto necessidades em longo prazo estimulam maior diferenciação das células precursoras em neutrófilos. Essas células levam de 4 a 6 dias para maturar e não há como acelerar o processo (KERR, 2003). A inflamação é a principal causa de resposta leucocitária. Quando se instala uma inflamação, um conjunto de mediadores químicos modula vários eventos. Vasodilatação e substâncias quimiotáticas facilitam a saída de neutrófilos do compartimento marginal em direção ao local inflamatório. As citocinas liberadas pelas células mononucleares locais se dirigem a medula óssea, aumentando a taxa de liberação de neutrófilos maduros e a taxa de produção, por exacerbar o ingresso de células-tronco e os eventos de proliferação e de maturação. Desse modo, a resposta medular aumenta intensamente a taxa de liberação de neutrófilos para o sangue. Nas lesões inflamatórias muito graves, tipicamente agudas, pode haver consumo muito rápido de neutrófilos, acima da capacidade de liberação de neutrófilos da medula óssea para o sangue. Quando isso acontece, ocorre neutropenia. Nesse caso, espera-se um desvio a esquerda (THRALL et al., 2006). Em um ou mais estágios da inflamação, a contagem de bastonetes pode ser maior do que a de neutrófilos segmentados (THRALL et al., 2006). De acordo com o número de leucócitos, a percentagem de neutrófilos e o seu grau de maturação na corrente sangüínea, podem classificar a resposta leucocitária em: desvio para a esquerda e desvio para a direita (MUNDIM, 2008). Desvio nuclear dos neutrófilos para a esquerda (DNNE) é o aumento na circulação, acima do número normal, dos neutrófilos jovens, chamados bastonetes. Existem dois tipos de DNNE, o regenerativo e o degenerativo. O DNNE regenerativo é o desvio dos neutrófilos à esquerda, que acompanha a neutrofilia, com o número de bastonetes sendo sempre menor que o de segmentados. Representa prognóstico bom, pois indica funcionamento normal do processo inflamatório. O DNNE degenerativo ocorre quando o número de bastonetes for superior ao de segmentados, independentemente do número total de neutrófilos (GARCIA-NAVARRO, 2005a). Ele revela uma incapacidade da medula óssea em maturar as células, frente às infecções, aparecendo assim às formas imaturas na circulação ou uma grande destruição ou seqüestro de neutrófilos (MUNDIM, 2008).
52 42 Desvio para a direita é o aumento no número de neutrófilos com núcleo hipersegmentados na circulação. Aumento no número de neutrófilos hipersegmentados indica neutrófilos permanecendo mais tempo na circulação. Isso pode ocorrer por presença de corticosteróides, reduzindo o movimento dos neutrófilos para os tecidos; deficiência de folato ou vitamina B12, causando redução na divisão celular; leucocitose por neutrofilia (ocasionalmente) (BUSH, 2004). Em cães e gatos existem normalmente mais neutrófilos do que linfócitos, numa proporção de 70:30, aproximadamente (KERR, 2003) Neutrofilia É o aumento do número de neutrófilos circulantes acima do máximo normal da espécie. Podem ser fisiológica ou patológica. A neutrofilia fisiológica não tem relação com doença e é causada por uma liberação súbita dos neutrófilos do pool marginal. Isso ocorre após as refeições, na gestação, após exercícios violentos ou prolongados, vômitos ou convulsões, no estresse e durante a taquicardia paroxística. A neutrofilia inflamatória, frequentemente causadora de uma leucocitose, é a principal característica laboratorial das infecções agudas, especialmente as causadas por microorganismos piogênicos, como a maioria dos cocos, e por outras bactérias, certos fungos, espiroquetas e parasitas (GARCIA- NAVARRO, 2005a). As principais neutrofilias patológicas são encontradas nas seguintes situações: Empiema uterino na cadela; Hipocalcemia puerperal; picadas de artrópodos peçonhetos; Fase inicial de regeneração das hemorragias e nas anemias hemolíticas, quando a liberação aumentada de eritrócitos jovens pode vir acompanhada de um maior número de neutrófilos; Lesões com necrose importante de órgãos e tecidos; Leucemia granulocítica, caso em que os neutrófilos maduros vêm frequentemente acompanhados de seus precursores;
53 43 Pós-operatório. A neutrofilia é um achado comum após cirurgias internas, mas que normalmente diminui com o tempo (GARCIA-NAVARRO, 2005a) Neutropenia É a diminuição do número de neutrófilos circulantes. A neutropenia é frequentemente, um sinal de agravamento clínico e, quando progressiva, deve ser encarada como um indício de desenlace desfavorável da doença (GARCIA- NAVARRO, 2005a). A diminuição de neutrófilos no sangue (neutropenia) ocorre principalmente com: Satisfação da demanda do tecido por neutrófilos para combater a infecção, a qual não pode ser rápida o suficiente; Produção da medula óssea diminuída devido a lesões por drogas, substâncias químicas, toxinas e neoplasia; Condições mais raras podem ser responsáveis: destruição de neutrófilos na circulação por anticorpos e choque anafilático (BUSH, 2004). Causas patológicas de neutropenia: Infecção viral: esta é a suposição mais comum quando se observa neutropenia em um animal. Frequentemente é uma suposição correta, já que muitas viroses realmente causam este efeito e algumas como o parvovírus felino e o parvovírus canino causam neutropenia em grau muito acentuado; Aumento da destruição de neutrófilos na circulação: pode ocorrer em casos de neutropenia auto-imune, um quadro incomum; Aumento do movimento dos neutrófilos para o compartimento marginal: isto ocorre logo após ingestão de endotoxinas, e é por isso que, frequentemente, encontra-se neutropenia em casos de intoxicação alimentar em cães e gatos; Aumento da demanda por neutrófilos sem liberação compensatória da medula óssea: isto pode acontecer nas primeiras horas de uma infecção aguda, antes que a medula óssea tenha tido tempo para responder, ou em um quadro crônico, no qual a medula óssea está ficando totalmente exaurida;
54 44 Diminuição da produção pela medula óssea: uma neutropenia marcante é uma característica proeminente de aplasia de medula óssea, juntamente com anemia e trombocitopenia (KERR, 2003); A neutropenia pode ser regenerativa ou não regenerativa. A neutropenia regenerativa obedece ao mesmo princípio da anemia regenerativa. Há um excesso de consumo dos neutrófilos em processos infecciosos graves e demorados. Neste caso há uma hiperplasia granulocítica com aumento do número de precursores dos neutrófilos da medula óssea. Essas células, no entanto, são consumidas no foco inflamatório a uma rapidez maior que sua reposição pela medula óssea, dando origem a neutropenia circulante. Por seu lado, a neutrofilia não regenerativa decorre de uma hipoplasia da série granulocítica da medula óssea. É um achado raro nos animais, geralmente apresentando um prognóstico desfavorável (GARCIA-NAVARRO, 2005a). 4.2 Linfócitos Ao contrário das outras células sangüíneas, os linfócitos desenvolvemse principalmente fora da medula óssea, nos linfonodos, baço e tecidos linfóides associados ao intestino (e timo nos animais jovens) e não na medula óssea. Este desenvolvimento compreende de seis a oito mitoses, mas um caminho maturativo mais curto, de duas a três mitoses, ocorre na medula óssea. As funções primárias dos linfócitos são imunológicas. Eles atuam na imunidade celular e produzem anticorpos na resposta humoral (KERR, 2003) Linfocitose A linfocitose é o aumento do número de linfócitos circulantes acima do máximo normal da espécie. Ocorre nas ocasiões a seguir: Linfocitose infanto-juvenil: a linfocitose é comum em animais jovens, pois a atividade imunogênica é mais elevada; Após vacinações ou imunizações de qualquer tipo, é comum aparecer uma linfocitose transitória;
55 45 Doenças infecciosas de natureza crônica ou que não foram bem curadas, como a tuberculose, a brucelose e as infecções crônicas inespecíficas; Doenças virais, onde o número de linfócitos começa a aumentar antes que nos outros tipos de infecções, devido a maior ação antigênica dos vírus; Protozoonoses, como a doença de Chagas e a toxoplasmose, caracterizam-se por linfocitose persistente, ainda que moderada (GARCIA- NAVARRO, 2005a). De acordo com THRALL et al. (2006), a linfocitose tem só duas causas comuns. A primeira é a resposta à excitação; a segunda é a leucemia linfocítica. Caso haja contagem celular apenas moderadamente aumentada e células morfologicamente pequenas, com linfócitos de aparência normal, deve-se considerar uma resposta a excitação. Como referência, considera-se aumento moderado quando a contagem de linfócitos estiver em torno de e células/µl, em cães e gatos, respectivamente. Quando a contagem exceder esse valor de referência e o animal não for excitado, deve-se considerar a ocorrência de leucemia linfocíica (THRALL et al., 2006). Um conceito errôneo comum é aquele que considera a possibilidade de linfocitose nas doenças inflamatórias crônicas. Essa concepção provavelmente é oriunda do conhecimento de que a doença inflamatória resulta em resposta do sistema imune, inclusive hiperplasia linfóide. Isso ocorre, mas a expansão se restringe aos tecidos linfóides e raramente se manifesta como linfocitose. Uma exceção é a forma crônica de erliquiose canina, que resulta em linfocitose. Em cães, deve-se considerar a possibilidade de erliquiose crônica quando a contagem de linfócitos chegar a a células/µl (THRALL et al., 2006) Leucemia Linfocítica É também chamada de leucose linfóide, linfossarcoma ou linfoma maligno. A denominação linfossarcoma e linfoma são dados a neoplasias de órgãos linfóides, produzindo tumores sólidos, podendo ou não ter a presença de blastos (Figura 20) na circulação. É o tipo de leucemia mais freqüente entre os animais domésticos. Aproximadamente 11% dos cães e 27% dos gatos com linfossarcoma apresentam quadros sanguíneos leucêmicos (MUNDIM, 2008).
56 46 FIGURA 20 - Esfregaço sangüíneo de uma cadela com linfossarcoma. Presença de linfoblastos (setas pretas) e linfócito (seta branca) Linfopenia A linfopenia é a diminuição do número de linfócitos circulantes abaixo do mínimo normal da espécie. A linfopenia ocorre geralmente quando há uma queda na capacidade de resposta imunológica, uma vez que os linfócitos são células participantes do processo imunológico. As principais causas de linfopenias são: Fase aguda da inflamação: é comum haver linfopenia na fase préaguda, que é o período incubatório do agente (bactéria) inflamatório, e na fase aguda, que é o período de multiplicação exponencial do agente; Linfopenia das doenças prolongadas; Linfopenia iatrogênica, causada pela administração de antagonistas do ácido fólico, de drogas antineoplásicas e uso excessivo de corticoesteroídes (GARCIA-NAVARRO, 2005a). 4.3 Eosinófilos A principal função dos eosinófilos é a desintoxicação por inativação de histamina e materiais com toxidade semelhante à histamina. Eles também inibem a
57 47 produção de edema e por isso são importantes na resposta alérgica, alem de serem capazes de fagocitar (KERR, 2003) Eosinofilia A eosinofilia é o estado caracterizado por um aumento no número de eosinófilos circulantes acima do normal da espécie (GARCIA-NAVARRO, 2005a). Causas de eosinofilia: Dano tecidual crônico, especialmente reações alérgicas; Doenças eosifílicas disseminadas de gatos (raras); Leucemia eosinofílica (muito rara); Parasitismo migratório / respiratório / hipersensibilidade cutânea / dirofilaríase; Reação leucemoíde eosinofílica em gatos (muito rara); Hipoadrenocroticismo; Terapia por drogas; Estro (cadela); Predisposição racial Distúrbios purulentos; Eosinofilia ressaltada (BUSH, 2004). 4.4 Basófilos O basófilo está diretamente relacionado ao mastócito tecidual e divide com ele a função de liberar grânulos de histamina e começar a resposta inflamatória (que então é modificada e mantida em equilíbrio pelos eosinófilos). Os basófilos são produzidos na medula óssea e duram de 10 a 12 dias (KERR, 2003) Basofilia Basofilia é incomum. Na verdade, os basófilos são tão raros em animais normais que geralmente não são encontrados no exame microscópico diferencial
58 48 de 100 leucócitos. A causa de basofilia é desconhecida ou não evidente e geralmente acompanha a eosinofiilia. Quando constatada, é descrita como eosinofilia e basofilia, mas a interpretação da eosinofilia que é importante (THRALL et al., 2006). 4.5 Monócitos Os monócitos são formados na medula óssea, de onde eles saem para o sangue e levam cerca de 2 a 3 dias antes de irem aos tecidos, para se transformarem em macrófagos. A principal função dos monócitos e dos macrófagos é a fagocitose, particularmente de partículas grandes tais como debris celulares e os patógenos mais difíceis de serem debelados, como fungos, protozoários e Brucella spp (KERR, 2003) Monocitose Monocitose é uma alteração relativamente insignificante e pode acompanhar respostas inflamatórias agudas e crônicas. Nesses casos, a monocitose é interpretada como uma resposta à maior demanda por células mononucleares nos tecidos. Monocitose também pode ser notada na resposta a esteróides, principalmente em cães (THRALL et al., 2006). 4.6 Os mais comuns Hematozoários em leucócitos Erlichia canis (Figura 21) é uma ricketsia trasmitida por carrapatos, causando a Erlichiose canina, que é uma doença parasitária dos leucócitos. Os achados de laboratório são de uma anemia não regenerativa, normocítica e normocrômica, acompanhada de leucopenia e trombocitopenia. Os leucócitos apresentam mórulas de parasitas, no citoplasma de monócitos e linfócitos (GARCIA-NAVARRO, 2005a). Erlichia canis pode induzir pancitopenia por dois mecanismos: destruição imunomediada de células circulantes e anemia aplásica (que também
59 49 pode ser causada por mecanismo imunomediado). Além disso, cães com erliquiose podem apresentar diminuição de apenas uma linhagem celular (por exemplo, trombocitopenia), manifestar linfocitose e, muitas vezes, hiperglobulinemia. Raramente nota-se o microorganismo no esfregaço sangüíneo (THRALL et al., 2006). Em cães, a principal causa infecciosa de trombocitopenia é a erliquiose. Infecção com Ehrlichia canis e, menos comum, com E. platys, E. ewingii e E. equis provoca trombocitopenia. Acredita-se que Ehrlichia canis inicialmente ocasione destruição de plaquetas por mecanismos imunomediados. Ao final da doença, o microorganismo provoca aplasia de medula óssea e consequentemente diminuição na produção de plaquetas. A aplasia de medula também pode ser imunomediada (THRALL et al., 2006). Várias espécies de Ehrlichia podem infectar os cães, incluindo a E. canis, agente da Ehrlichiose Monocítica Canina; E. chaffeensis, agente da Ehrlichiose Monocítica Humana e E. ewingii, agente da Trombocitopenia Cíclica Canina. Ainda há a E. platys, agente da Trombocitopenia Cíclica Canina, que de acordo com a nova classificação taxonômica proposta a partir de análise de genes do RNA ribossomal 16S, foi transferida para o gênero Anaplasma, sendo designada A. platys (DUMLER et al., 2001). FIGURA 21 - Esfregaço sangüíneo de cão com monócitos com mórulas Ehrlichia spp A denominação Erlichiose Monocítica Canina está relacionada à infecção de monócitos por E. canis (WANER & HARRUS, 2000). A anemia caracteriza-se pela redução no número de hemácias, ou no teor de hemoglobina,
60 50 ou em ambos. É um reflexo de um estado patológico. A anemia ocorre em razão a uma excessiva perda de sangue (hemorragias), destruição (hemólise), ou queda na produção de eritrócitos (BIRCHARD & SHERDING, 2003). Durante a fase aguda pode haver um aumento no seqüestro e destruição de células sangüíneas provocando uma pancitopenia transitória, já que a medula óssea continua a função de produção normalmente (BUHLES Jr. et al., 1975). Após o período de incubação que varia de 7 a 21 dias, mórulas podem ser isoladas no sangue. A bactéria multiplica-se nas células mononucleares, por divisão binária, principalmente nos linfonodos, baço e medula óssea, depois se espalha por todo o organismo como inclusões em forma de mórulas (BIRCHARD e SHERDING, 2003; NELSON e COUTO, 1998; ALMOSNY et al., 2002). Depois de um período de incubação de 8 a 20 dias, o cão infectado entra na fase aguda da erliquiose, que dura de duas a quatro semanas. Durante esse período, o microrganismo multiplica-se dentro das células mononucleares circulantes e dos tecidos fagocitários mononucleares do fígado, baço e linfonodos. O consumo, o seqüestro e a destruição das plaquetas parecem contribuir para a trombocitopenia durante a fase aguda. As contagens de leucócitos são variáveis, e a anemia, relacionada à supressão da produção de eritrócitos e à destruição acelerada dessas células, desenvolve-se progressivamente durante a fase aguda (ALMOSNY et al., 2002; ETTINGER & FELDMAN, 2004). Na fase crônica, nos exames hematológicos pode ser encontrar pancitopenia devido a hipoplasia da medula óssea, linfocitose ocasionalmente composta de grandes linfócitos granulares (BIRCHARD & SHERDING, 2003; NELSON & COUTO, 1998). A técnica de PCR permite um diagnóstico preciso, podendo ser usada para detectar o DNA específico do microorganismo em leucócitos de sangue periférico (NELSON & COUTO, 1998; ALVES et al., 2004). A Anaplasma platys é uma rickettsia específica de plaquetas de cães que causa trombocitopenia cíclica canina (HARVEY et al., 1978 citado por INOKUMA et al., 2002). É um microorganismo antigenicamente não relacionado com E. canis ou E. equi, consiste no agente causador da Trombocitopenia Cíclica Infecciosa dos cães (SWANGO et al., 1989).
61 51 Segundo WOODY & HOSKINS, (1991), A. Platys foram observados apenas em plaquetas, podendo ocorrer com uma, duas ou três inclusões. De coloração basofílica em esfregaços corados pelo Giemsa, mede entre 0,4 a 1,2 µm, podendo ser arredondada, oval ou achatada (RISTIC & HUXSOLL.,1984). Na Erliquiose Granulocítica Canina, o principal agente erliquial que infecta os granulócitos de cães (neutrófilos e eosinófilos) é a E. ewingii, tendo como possíveis vetores o carrapato Amblyomma americanum e o Otobius megnini. Ela causa doença moderada a grave, com claudicação, trombocitopenia e edema articular (STOCKHAM et al., 1990). A E. equi também causa Erliquiose Granulocítica Canina (EGC). A E. equi (LEWIS et al., 1975; MADIGAN, 1993) tem como hospedeiros naturais além do cão, o homem, eqüinos e lhamas e experimentais, os muares, ovinos, caprinos, gatos e primatas não humanos. As espécies de erliquias que naturalmente infectam felinos ainda não foram caracterizadas, entretanto, material genômico de E. canis proveniente de gatos naturalmente infectados foi amplificado, clonado e sequenciado. Corpúsculos de inclusão e mórulas já foram encontrados em células sangüíneas mononucleares e polimorfonucleares periféricas de gatos (BOULOY et al.,1994). Gênero Hepatozoon spp: os gametócitos são encontrados dentro dos leucócitos nos mamíferos (Figura 22) e das hemácias nos répteis (MUNDIM, 2008). Nos hospedeiros que são os canídeos domésticos e silvestres, a forma mais conhecida é o gametócito ou gamonte, visualizado no citoplasma dos neutrófilos e monócitos (Figura 22). Os gametócitos são estruturas alongadas, medindo de 8,0 a 12,0 µm de comprimento por 3,0 a 6,9 µm de largura, citoplasma corado em róseo, envolto por uma membrana, núcleo avermelhado localizado próximo a uma das extremidades. Os gametócitos são corados pelos corantes derivados de Romanowsky usados frequentemente nas rotinas hematológicas (MUNDIM et al., 2002).
62 52 FIGURA 22 - A esquerda um esfregaço sanguíneo de cão, com leucócito parasitado com Hepatozoon canis. À direita esfregaço sangüíneo de um jacaré, evidenciando um eritrócito parasitado com Hepatozoon roullex A transmissão do Hepatozoon spp ocorre principalmente pela ingestão de carrapatos contendo oocistos maduros. Assume-se que o Rhipicephalus sanguineus e Amblyoma spp sejam os principais vetores da doença em cãs na América do Sul. Outros vetores têm sido incriminados como piolhos, pulgas e mosquitos. Existe também a possibilidade da transmissão vertical (AGUIAR et al., 2004). Nos cães a doença geralmente é intercorrente a outras enfermidades imunossupressoras ou associadas a outros parasitos como Erlichia canis e Babesia canis. A doença pode manifestar-se de três formas: aguda que pode evoluir para morte em uma semana; crônica que é a forma com maior variedade de sinais clínicos e a subclínica ou inaparente que é a mais comum, ocorrendo em 70 a 80% dos animais infectados (MUNDIM et al., 2002; AGUIAR et al., 2004). Entre as alterações hematológicas, tem sido observada anemia de moderada a severa, sendo a arregenerativa a mais freqüente devido à cronicidade da infecção. No leucograma comumente é observado leucocitose com neutrofilia, podendo ser detectado também desvio nuclear de neutrófilos para a esquerda (O DWYER et al., 2006). Em estudo realizado por AGUIAR et al. (2004), os exames hematológicos revelaram anemia regenerativa, leucocitose por neutrofilia, linfopenia e monocitose. GAVAZZA et al. (2003) relataram que animais infectados por H. canis apresentaram leucocitose em casos severos da doença, eosinofilia, monocitose e linfocitose. Sendo que em alguns casos foram encontrados também
63 53 trombocitopenia e linfopenia, Já no eritrograma foram encontrados desde anemia arregenerativa normocítica normocrômica à anemia microcítica hipocrômica. 4.7 Inclusões virais Inclusões virais são raramente constatadas em cães com Cinomose. E apresentam variações de tamanho (1 a 2 µm), quantidade e cor (azul claro a magenta); são mais vistas em hemácias policromatofílicas (THRALL et al., 2006). Corpúsculo de Sinigalglia Lentz são proteínas do vírus da Cinomose, observados dentro do citoplasma de linfócitos, neutrófilos (Figura 24) e raramente dentro das hemácias (Figura 23) (MUNDIM, 2008). FIGURA 23 - Esfregaço sanguíneo de cão evidenciando eritrócito com Corpúsculo de Lentz FIGURA 24 - Esfregaço sanguíneo de cão evidenciando neutrófilos com Corpúsculo de Lentz
64 Anomalia de Pelger - Huet Notam-se neutrófilos maduros hipossegmentados em animais heterozigotos para a anomalia de Pelger-Huet. Essas células apresentam um núcleo com forma imatura (ou seja, forma de bastonete ou de mielócito), porém com um padrão de cromatina madura, grossa (Figura 25). A função dos neutrófilos é normal, e os animais acometidos são sadios. Geralmente, não há neutrófilos segmentados no esfregaço sangüíneo desses animais. Os eosinófilos também são afetados, e sua aparência é de bastonetes. O diagnóstico da anomalia de Pelger- Huet é importante para prevenir erro na identificação de um desvio à esquerda e a interpretação errônea de uma resposta inflamatória em um indivíduo portador do distúrbio, porém aparentemente sadio (THRALL et al., 2006). FIGURA 25 - Granulócitos de cão com anomalia de Pelger-Huet há quatro neutrófilos hipossegmentados
65 55 5 URINÁLISE DE ROTINA Os exames de urina são de grande importância como auxiliares no estabelecimento de diagnóstico de muitas moléstias sistêmicas ou do trato gênitourinário, sendo em muitos casos, de valor decisivo (FERREIRA NETO et al., 1977). A urinálise representa um componente vital no conjunto de informações laboratoriais de qualquer paciente cuja enfermidade justifique a determinação do perfil bioquímico sérico (THRALL et al., 2006). A análise da urina é composta de três partes distintas, que devem ser interpretadas em conjunto devido ao seu inter-relacionamento. São exames organolépticos e físico-químicos, exames químicos qualitativos (elementos anormais) e exame microscópico da urina (sedimentoscopia) (SILVA, 2004). O exame de urina deve ser solicitado nos seguintes casos: Presença de sinais clínicos de doença renal ou órgãos urinários; Suspeita de doença generalizada, com envolvimento de outros órgãos ou sistemas do organismo; Como exame de triagem nos internamentos, principalmente cirúrgicos; Quando houver interesse em complementar o diagnóstico, acompanhar quadro clínico e estabelecer um prognóstico (GARCIA-NAVARRO, 2005b). 5.1 Colheita e armazenamento As amostras de urina podem ser obtidas por cateterização, cistocentese ou por coleta de urina eliminada espontaneamente. As amostras devem ser coletadas em frascos limpos e à prova de vazamento e rotulados com a informação apropriada de identificação do paciente, horário e data da coleta (SINK & FELDMAN, 2006). A micção normal tem a vantagem de poder ser colhida pelo proprietário, mas pode apresentar maior número de contaminantes. A cateterização no caso de machos deve-se ser por meio de sondas de calibre menor para evitar irritação; em
66 56 fêmeas as sondas sempre oferecem riscos de irritação, devendo os animais ser sedados para colheita; colher o jato médio, realizar a limpeza prévia da genitália externa (BICALHO & CARNEIRO, 2007). A coleta de urina com o cateterismo uretral, todavia, apresenta riscos de introduzir novos germes no trato urinário e de contaminar uma urina potencialmente estéril (KUNIN, 1997; NABER et al., 2001). Cistocentese é o melhor método para colheita de urina em cães e gatos, avaliando a amostra sem interferência de fatores externos, pois a urina é colhida diretamente do conteúdo vesical (BICALHO & CARNEIRO, 2007). A colheita da urina por cistocentese pode provocar hematúria iatrogênica, possibilidade de provocar perfuração intestinal, e é contra indicada em casos de cálculos vesicais, neoplasias vesicais, peritonites e animais submetidos à cistocentese recentemente (menos de 15 dias) (SILVA, 2004). Os preservativos químicos, como tolueno e formalina, matam as bactérias impedindo sua cultura e interferem em alguns testes químicos (MATOS & MATOS, 1995; BUSH, 2004). Independente da forma de colheita, a urina deve ser refrigerada até trinta minutos após a colheita e pode permanecer em geladeira até seis horas, porém a mesma deverá estar na temperatura ambiente antes do exame, pois os aparelhos são calibrados para esta temperatura e a fita reagente com a baixa temperatura demora a responder a coloração (BICALHO & CARNEIRO, 2007). Qualquer que seja o método de conservação ou armazenamento, amostra deve ser sempre colocada ao abrigo da luz solar direta, já que os pigmentos biliares nela presentes são instáveis a sua ação (GARCIA-NAVARRO, 2005b). O exame de urina deve ser feito o mais rapidamente possível, devido à possibilidade de alterações químicas, físicas, e mesmo de sedimento, que podem ocorrer na amostra. A demora em realizar o exame pode, por exemplo, facilitar a multiplicação bacteriana com produção de amônia, alcalinização do ph e dissolução de cilindros eventualmente presentes. Pode fazer ainda com que haja, nos casos de glicosúria, uma diminuição da glicose devido à sua utilização pelas bactérias presentes (GARCIA-NAVARRO, 2005b).
67 Exame Físico da Urina itens: O exame físico da urina, na rotina laboratorial, constitui-se dos seguintes Quantidade diária de urina eliminada; Cor; Aspecto; Densidade especifica; Formação de sedimento (GARCIA-NAVARRO, 2005b) Volume da urina Para quantificar o volume urinário diário seria necessário manter o animal em uma gaiola metabólica durante um período de 24 horas (GONZÁLEZ & SILVA, 2006), em função disto sua quantificação fica restrita à pesquisa. A produção de urina diária varia com a ingestão de água, a dieta, atividade, temperatura externa e outros fatores (REECE, 1996). Sendo este procedimento considerado de difícil realização, tal parâmetro é estimado, de forma indireta, através de sua densidade. O aumento da quantidade de urina eliminada chama-se poliúria e sua diminuição oligúria. Na poliúria, a urina tem uma cor mais pálida e sua densidade específica é mais baixa, ao contrário do que ocorre na oligúria, quando a quantidade de água eliminada é menor e a urina mais concentrada. Ambas podem ser fisiológicas ou patológicas (GARCIA- NAVARRO, 2005b). Anúria é a supressão absoluta da produção de urina e deve ser distinguida da retenção urinária por bloqueio físico, como ocorre em casos de cálculos uretrais (BAUER et al., 1974; MATOS & MATOS, 1995). Causas de poliúria: Fisiológicas ou transitórias: terapia diurética; aumento da ingestão de líquidos ou de fluídos;
68 58 al., 1974; MATOS & MATOS, 1995). após administração de corticóides ou ACTH (BAUER et Patológica: nefrite aguda ou crônica; diabetes mellitus, diabetes insípidus; fase diurética da nefrose tóxica; glicosúria renal primária; piometra, amiloidose renal avançada; hiperadrenocorticismo, pielonefrite generalizada; hepatopatias graves com polidipsia; Sindrome de Fanconi e feacromocitoma (MUNDIM, 2007). Causas de oligúria: Fisiológica: redução da ingestão de líquidos; exercícios físicos intensos, com sudorese intensa; temperatura ambiente elevada; hiperventilação pulmonar (cão) (BAUER et al., 1974; MATOS & MATOS, 1995). Patológica: associada à desidratação nos episódios de vômito, diarréia; nefrites agudas (queda acentuada da pressão sangüínea no glomérulo); febres prolongadas, disfunção circulatória, edemas; nas enfermidades renais terminais (prognóstico desfavorável) (MUNDIM, 2007). 2007). Causas de anúria: bloqueio renal agudo e obstrução da uretra (MUNDIM,
69 59 Na poliúria fisiológica, a urina apresenta densidade baixa, embora dentro dos limites normais para a espécie. Na poliúria patológica, em casos de diabete melito, há presença de glicose na urina, a qual com sua intensa atividade osmótica faz com que o filtrado tubular seja hipertônico em relação ao meio extra-tubular, não permitindo que a água seja reabsorvida normalmente e produzindo, como conseqüência, uma diurese (ANDRADE, 2002). A diabete insípida consiste em uma falha na produção ou na secreção, do hormônio antidiurético pela neurohipófise, podendo ser total ou parcial, ou devido à ausência de resposta ao ADH a nível renal (BIRCHARD & SHERDING, 2003; SHAW & IHLE, 1999). Que faz com que haja uma reabsorção insuficiente de água na porção distal dos túbulos o que leva o paciente a uma perda de água abundante com conseqüência polidipsia. Nas doenças graves do fígado, bem como o empiema uterino da cadela podem também causar polidipsia com conseqüência poliúria (GARCIA-NAVARRO, 2005b). A oligúria fisiológica é geralmente passageira, aparecendo em situações nas qual o organismo tem necessidade de conservar água. A oligúria patológica de origem renal ocorre na fase oligúrica da nefrite aguda generalizada, bem como na fase terminal de qualquer doença renal. Neste caso, a diminuição progressiva do volume de urina eliminado, que pode chegar à anúria ou ausência total de urina, é sinal de falha completa do rim. Quanto à oligúria patológica secundária, trata-se de um grupo de distúrbios que têm a sua origem em outro órgão que não o rim, e cuja causa é uma diminuição do fluxo de sangue que chega ao glomérulo (GARCIA- NAVARRO, 2005b) Cor da urina Normalmente amarela devido à presença de urocromos. A presença de outros pigmentos e constituintes podem alterar a cor, assim como a concentração da amostra. A urina dos eqüídeos normalmente é amarela ao ser excretada, mas pode se tornar escura devido à oxidação da pirocatequina. Em casos de excesso de mioglobina (azotúria) pode apresentar coloração negra. A presença de medicamentos diversos podem também alterar a coloração da urina como o azul de metileno que a torna de coloração verde ou azulada; fenotiazínicos apresentando coloração avermelhada (BICALHO & CARNEIRO, 2007).
70 60 De acordo com SILVA (2004) as principais alterações da cor da urina são: Urinas descoradas, semelhante à água: observadas nas poliúrias com densidade baixa. São decorrentes do aumento da ingestão de líquidos ou da perda da capacidade tubular em reabsorver a água ou do aumento da taxa de filtração glomerular. São observadas principalmente nos seguintes casos: Piometras (devido à polidipsia); Doenças renais crônicas; Diabete insipidus; Hiperadrenocorticismo; Nefroses (fase poliúrica); Administração de diuréticos; Fluidoterapia; Reabsorção rápida de transudatos (SILVA, 2004); Ingestão excessiva de líquidos (JONES, 1992). Urinas amarelo-escuro ou âmbar: ocorre nas oligúrias com densidade elevada. Decorre da diminuição da ingestão de líquidos ou do aumento da reabsorção tubular da água ou da diminuição da taxa de filtração glomerular. São observadas principalmente nos seguintes casos: Diminuição da ingestão de líquidos; Doenças renais agudas; Febre, vômito e diarréia; Hemorragias graves; Nefroses (fase oligúrica); Insuficiência cardíaca. Urinas róseas ou vermelhas e turvas: ocorre nas hematúrias por incorporação de sangue a urina (CARR & DONE, 1996). São observadas principalmente nos seguintes casos: Cistites agudas; Traumatismos renais e das vias excretórias da urina; Urolitíases; Neoplasias do sistema urinário.
71 61 Obs: na hematúria, as urinas quando em repouso ou quando centrifugadas se tornam claras, formando depósitos de hemácias. Urinas de cor marrom ou de vinho e translúcidas: ocorre nas hemoglobinúrias decorrentes da incorporação da hemoglobina na urina na hemólise intravascular. São observadas principalmente nos seguintes casos: Doenças hemolíticas (hemoparasitoses); Anemia hemolítica autoimune; Hemólise pós transfusão de sangue. Obs: na hemoglobinúria, as urinas não se tornam claras por centrifugação ou quando colocadas em repouso e nem formam depósitos de hemácias. Urinas de coloração negra, semelhante ao café: ocorre nas mioglobinúrias em casos de lesões musculares graves, na alcaptonúria (melanosarcomas e melanocarcinomas). Urinas amarelo-esverdeada com espuma: ocorre na bilirrubinúria, nos casos de estase biliar, icterícias pós-hepáticas ou obstrutivas e hepatocelulares (SILVA, 2004) Odor da urina O odor da urina é característico para cada espécie ( sui generis ) e provavelmente é influenciado pela dieta (REECE, 1996). GONZÁLEZ & SILVA (2006) relatam que o odor urinário é influenciado pela quantidade e tipo de ácidos orgânicos voláteis presentes. Odores amoniacais fortes em urinas frescas, resultam de infecções por bactérias capazes de produzir a enzima urease, a qual é responsável pela transformação de uréia em amônia. O odor pútrido ocorre em decorrência da degradação bacteriana de proteínas urinárias (ALMOND & STEVENS, 1995; BUSH, 2004) e odor de acetona indica cetonúria (BUSH, 2004; GONZÁLEZ & SILVA, 2006).
72 Aspecto da urina A urina pode ser classificada como límpida, turva e floculenta. A turbidez da urina é causada pela presença de eritrócitos, leucócitos, células epiteliais, bactérias, muco, lipídeos ou cristais (COLES, 1984; ALMOND & STEVENS, 1995). A causa da turbidez somente poderá ser definida através da avaliação microscópica do sedimento. Segundo MATOS & MATOS (1995) o aspecto floculento geralmente é observado quando há aumento da quantidade de muco e ALMOND & STEVENS (1995) relatam que este aspecto ocorre devido à agregação de cristais, células descamadas, bactérias e leucócitos. PÔRTO (2003) classifica a urina floculenta em turva com grumos Densidade específica da urina É definida como sendo o peso da urina em relação à água destilada. Ela nos irá informar sobre a capacidade dos túbulos renais em concentrar a urina (MUNDIM, 2007). Na interpretação da urinálise toma-se como referência os seus valores médio (1025 para cães e 1030 para gatos) (SILVA, 2004). A densidade urinária varia conforme a concentração de substâncias dissolvidas e, consequentemente, tem uma ligação direta com o volume de ingestão de água. Quanto maior o volume ingerido, menor será a densidade e viceversa (REECE, 1996). A habilidade dos pacientes de concentrar a urina (densidade acima de 1015) é dependente do sistema de produção e liberação perfeito do ADH, suficiente população de néfrons funcionais para gerar e manter alta concentração de solutos na medula renal e suficiente população de túbulos funcionais para responder ao ADH. A urina tem a densidade maior que a água, pois possui água e vários solutos de diferentes densidades. A densidade urinária reflete não só o funcionamento renal, mas a ingestão de água, disfunções hormonais, intoxicações, uso de medicamentos, infecções (BICALHO & CARNEIRO, 2007).
73 63 Considerações importantes sobre a densidade urinária: De maneira geral as nefropatias agudas apresentam urinas com densidade elevada, alcançando valores superiores à média, em decorrência da febre, anorexia, e de outros sinais, que promovem a diminuição da taxa de filtração glomerular; As nefropatias crônicas geralmente apresentam urinas com densidade baixa (valores inferiores à média), decorrência da diminuição ou da perda da capacidade tubular em concentrar a urina; No diabete mellitus, apesar da polidipsia e da poliúria, as urinas apresentam densidade normal ou elevada em decorrência da presença da glicose (glicosúria); Nos processos agudos das vias urinárias a urina pode apresentar densidade elevada em decorrência da febre e da incorporação de células do trato urinário, pús e sangue; A densidade da urina é inversamente proporcional ao volume produzido; Processos febris de qualquer natureza apresentam urinas com densidades elevadas em decorrência da desidratação e de outros fatores correlatados a esta síndrome (SILVA, 2004). Aumento da densidade da urina e suas possíveis causas: Nefropatias agudas: em decorrência da febre e suas conseqüências (desidratação, hipovolemia e hipertonicidade plasmática). A taxa de filtração glomerular diminui em decorrência da pressão glomerular; Cistites agudas: em decorrência da febre e da incorporação à urina de produtos do processo inflamatório; Desidratação por vômito ou diarréia: através de um mecanismo de compensação, no qual há permeabilização dos túbulos contornados distais e tubos coletores, sob a ação do ADH, promovendo a reabsorção da água nestes locais; Desvio de grande quantidade de plasma para cavidades ou tecidos: principalmente nos casos de ascites ou anasarca promovendo a diminuição da pressão glomerular e a conseqüente queda da taxa de filtração glomerular;
74 64 Insuficiência cardíaca: em decorrência da estase sangüínea e a conseqüente diminuição da taxa de filtração glomerular; Pouca ingestão de líquidos: por diminuição da taxa de filtração glomerular (SILVA, 2004). Diabete mellitus: por incorporação da glicose a urina (ANDRADE, 2002); Diminuição da densidade da urina e suas possíveis causas: Nefropatias crônicas: por incapacidade dos rins em concentrar a urina, em decorrência do número de néfrons lesados irreversivelmente, superarem o número de néfrons normais; Diabete insípidus: por diminuição ou ausência do hormônio antidiurético (ADH) ou por lesões graves nos túbulos contornados distais e coletores impossibilitando a ação do hormônio nestes locais (BIRCHARD & SHERDING, 2003; SHAW & IHLE, 1999). Piometra: em decorrência da polidipsia, indutora da hipervolemia e hipotonicidade plasmática; Reabsorção rápida de transudatos: por hipervolemia e hipotonicidade plasmática; Ingestão excessiva de líquidos: por hipervolemia e hipotonicidade plasmática (SILVA, 2004). Diabete insípidus: por diminuição ou ausência do hormônio antidiurético (ADH) ou por lesões graves nos túbulos contornados distais e coletores impossibilitando a ação do hormônio nestes locais (BIRCHARD & SHERDING, 2003; SHAW & IHLE, 1999). Termos referentes à densidade específica da urina em relação à densidade do filtrado plasmático: Isostenúria: densidade entre 1007 a 1015, onde a concentração de solutos é igual a do filtrado glomerular. Hipostenúria: densidade inferior a 1007.
75 65 Barúria ou normostenúria: densidade superior a 1015 (MUNDIM, 2007). Na isostenúria quando o valor da densidade urinária se mantém por tempo significativo nos limites da densidade do filtrado glomerular ( ), sugerindo graus variáveis de incapacidade dos rins em concentrar a urina. Na hipostenúria quando o valor da densidade urinária, de forma persistente, se mantém abaixo do limite mínimo da densidade do filtrado glomerular (1008), sugerindo falência renal. Na hiperestenúria quando o valor da densidade urinária ultrapassar em muito, a média das densidades da urina de cães e gatos, como nos casos graves de hipovolemia e hipertonicidade plasmática que requerem a ação da aldosterona e do hormônio antidiurético (SILVA, 2004). 5.3 Exame Químico da Urina O exame químico da urina apresenta como função avaliar o grau de excreção de algumas substâncias orgânicas, que possuem significado clínico (COLES, 1984). As substâncias filtradas pelos glomérulos úteis ao organismo, como aminoácidos, glicose e vitaminas, são reabsorvidas pelos rins e somente aparecerão na urina se excederem o limiar renal de reabsorção ou caso os rins estejam com um mau funcionamento. Por outro lado, substâncias tóxicas ou desnecessárias ao organismo, como creatinina e alantoína, são excretadas pela urina. Outras substâncias, como eletrólitos e água, são regulados conforme as necessidades corpóreas (BUSH, 2004). Antigamente os testes químicos de urina eram realizados através de reações químicas com diferentes reagentes no interior de tubos de ensaio, num processo trabalhoso e demorado (BAUER et al., 1974; VALLADA, 1981). Atualmente, estas avaliações químicas são fácil e rapidamente realizadas através de fitas reagentes para urinálise. Estas são compostas por tiras de plástico cobertas com pedacinhos de papel de várias cores, embebidos em diferentes reagentes químicos, que mudam de cor quando em contato com determinadas substâncias eventualmente presentes na urina (GARCIA-NAVARRO, 1996).
76 66 Segundo ALMOND & STEVENS (1995), as tiras reagentes são a forma mais econômica e prática de realizar uma detecção semiquantitativa de vários constituintes urinários Reação (ph) O ph urinário está relacionado com a função renal de eliminação de álcalis e ácidos não voláteis, ajudando a manter o equilíbrio ácido-básico. O ph da urina é determinado pela dieta e pelo metabolismo corporal do animal. Com relação à dieta, a ingestão de grandes quantidades de proteína produz uma urina ácida, como ocorre com carnívoros, lactantes ou nas dietas ricas em grãos de cereais. Por outro lado, dietas ricas em carboidratos produzem uma urina alcalina, como acontece nos herbívoros. Em relação ao metabolismo orgânico, a urina geralmente acompanha o ph corporal (COLES, 1984; GARCIA-NAVARRO, 1996). A infecção do trato urinário ou a contaminação da urina com bactérias pode alterar o ph da urina. Várias bactérias (por exemplo, Proteus species, Pseudomonas species) produzem urease, a qual irá criar um ambiente alcalino. Inversamente, E. coli pode produzir urina ácida. Alterações falsas no ph podem ser causadas por amostras de urina contendo bactérias mantidas a temperatura ambiente, que podem causar proliferação bacteriana e resultar em alteração do ph urinário (SINK & FELDMAN, 2006). Urinas ácidas com ph abaixo de 6,0 possíveis causas: Alimentação excessivamente rica em proteínas; Administração de agentes acidificantes como o acido ascórbico, o cloreto de amônio e o fosfato ácido de sódio; Diabete mellitus; Inanição e doenças caquetizantes; Uremia (SILVA, 2004). Acidose metabólica ou respiratória; Gastroenterites e enterites (OSBORNE et al., 1995).
77 67 Na inanição, estado em que o organismo passa a utilizar as suas próprias proteínas plasmáticas, origina-se então o aparecimento de uma urina ácida. Na acidose respiratória ocorre acúmulo de CO 2 nos pulmões, na metabólica ocorre uma perda aumentada de bicarbonato ou ao acúmulo de ácidos no organismo, condição vista na diabete melito e na insuficiência renal crônica com uremia (GARCIA-NAVARRO, 2005b). Urinas alcalinas com ph acima de 7,0 possíveis causas: Alimentação excessivamente rica em vegetais; Alcalose metabólica ou respiratória; Retenção urinária; Infecção do trato urinário (SILVA, 2004); Administração de alcalizantes (bicarbonato de sódio, bicarbonato de cálcio, citrato de potássio) (DiBARTOLA, 2000). A demora em realizar o exame, resulta em alcalinização da amostra devido à transformação bacteriana da uréia em amônia. Em cistites, principalmente acompanhada de retenção urinária por obstrução parcial da uretra ou outro motivo, a alcalinização da urina ocorre pelo mesmo motivo acima exposto (GARCIA- NAVARRO, 2005b) Presença de Proteínas na urina As proteínas, principalmente a albumina normalmente não atravessam a membrana glomerular. Uma pequena quantidade que atravessa é logo em seguida reabsorvida nos túbulos renais. A quantidade que consegue escapar junto com a urina é tão pequena que não é detectada pelas provas laboratoriais de rotina (MUNDIM, 2007). Em geral a proteinúria deve ser avaliada junto com a densidade; densidade diminuída com presença de proteína significa valores mais altos para a mesma. A avaliação também se relaciona com o exame do sedimento, proteinúria sem presença de hemácias, leucócitos, espermatozóides geralmente significa lesão renal, podendo ser glomerular por aumento da permeabilidade tendendo essa proteinúria ser mais elevada; pode ser também de origem tubular pela
78 68 diminuição da capacidade de absorção, apresentando geralmente valores menos elevados (BICALHO & CARNEIRO, 2007). A proteinúria pode ser de origem renal ou pós renal. No primeiro caso a proteinúria é formada no rim, e no segundo, a sua origem são as vias urinárias ou órgãos genitais. A proteinúria renal pode ser ainda de origem fisiológica com caráter transitório, ou ter como causa uma lesão renal, quando é constante e se caracteriza pelo aparecimento de cilindros no sedimento. Os cilindros são formações protéicas e a sua presença na urina indica ser a proteinúria de origem renal. A simples proteinúria, sem cilindrúria, sugere ou que a proteinúria é de origem pós-renal ou que, sendo renal, é passageira sem maior lesão associada (GARCIA-NAVARRO, 2005b). A proteinúria pode ser fisiológica ou funcional e decorre do aumento transitório da permeabilidade glomerular como no exercício muscular intenso, nas convulsões e na ingestão excessiva de proteínas (COLES, 1984; GARCIA- NAVARRO, 1996). A proteinúria falsa ou acidental é decorrente da contaminação da urina por fluxo vulvo-vaginal, abcessos perineais e prepuciais e por matéria fecal. A proteinúria pré-renal é decorrente do aumento da permeabilidade glomerular por estase sanguínea, como acontece nas cardiopatias e hepatopatias graves (SILVA, 2004). A proteinúria renal é decorrente de alterações glomerulares, túbuloglomerulares e intersticiais, como ocorre nas nefrites, pielonefrites, amiloidose renal, glomerulonefrites imunomediadas, nefroses, rins policísticos, parasitose por Dioctophyma renale e na passagem de microfilária pelos rins (SILVA, 2004). Conforme GONZÁLEZ & SILVA (2006), para se diferenciar a proteinúria renal da pós-renal, além do quadro clínico, deve-se avaliar o sedimento urinário buscando indicadores de inflamação, como eritrócitos e leucócitos, que encontramse presentes no segundo caso Presença de Glicose na urina A glicose quando em quantidade normal no sangue, encontra-se ausente na urina devido ao fato dela ser totalmente reabsorvida nos túbulos
79 69 proximais renais (LOPES, 2004). O aparecimento de glicosúria ocorre quando a quantidade de glicose no filtrado glomerular é superior à capacidade de reabsorção do túbulo, ou quando a reabsorção tubular é insuficiente. A diferenciação dessas duas causas se faz pela dosagem de glicose no sangue (MATOS & MATOS, 1995; GONZÁLEZ & SILVA, 2006). A glicosúria pode ser metabólica, quando associada a uma hiperglicemia e renal quando associada à normoglicemia (MUNDIM, 2007). É classificada segundo SILVA (2004) em: Glicosúria fisiológica: ocorre transitoriamente na ingestão excessiva de açúcar ou de hidratos de carbono, nos exercícios musculares intensos e nas situações de estresse e medo; Glicosúria falsa: decorrentes da ação redutora de substâncias endógenas (ácido úrico, uratos e creatinina) e exógenas, na grande maioria, medicamentosas (ácido ascórbico, salicilatos, morfina, hidrato de cloral, estreptomicina, tetraciclinas, penicilinas, clorafenicol, lactose, maltose, pentose e epinefrina, entre outras); Glicosúria patológica: a glicosúria patológica pode ser classificada em metabólica ou hiperglicêmica e renal ou normoglicêmica, de acordo com o aumento concomitante ou não da glicose sangüínea. Suas principais causas são: Hipertireoidismo: por maior absorção da glicose no trato gastrointestinal; Hiperadrenocorticismo: por ação de glicocorticosteróides estimuladores da ação enzimática no aproveitamento de aminoácidos para a neoglicogênese hepática; Superatividade da medular das supra renais: através da formação excessiva da catecolaminas de ação hiperglicemiante, por estimularem a neoglicogênese; No feocromocitoma: tumor funcional da zona medular das supra renais por mecanismo semelhante ao anteriormente descrito; Superatividade da hipófise anterior: por liberação excessiva do hormônio adrenocorticotrófico, que atua na córtex da supra renais estimulando a síntese de glicocorticosteróides (SILVA, 2004); Diabete mellitus e necrose pancreática: por deficiência da insulina (LOPES, 2004).
80 Presença de Acetona na urina O estabelecimento de uma dieta pobre em carboidratos faz com que o organismo lance mão de suas reservas de gordura como fonte de energia. O metabolismo dos ácidos graxos tem como subprodutos a formação dos chamados corpos cetônicos que são o ácido acetoacético (diacético), o ácido betahidroxibutírico e a acetona (GARCIA-NAVARRO, 2005b). O teste de tira reagente para cetona pode detectar acetona e ácido cetoacético, mas não detecta um outro tipo de corpo cetônico, o ácido betahidroxibutírico. Consequentemente, alguns casos de cetonúria podem não ser detectados simplesmente porque esse ácido corresponde à cetona predominante (THRALL et al., 2006). A presença de corpos cetônicos não é um achado normal na urina, pois após serem filtrados no glomérulo, estes são totalmente absorvidos nos túbulos proximais (GONZÁLEZ & SILVA, 2006). A acetonúria está presente nos seguintes casos: Inanição: por mobilização da reserva lipídica orgânica, gerando os corpos cetônicos (MATOS & MATOS, 1995). Diabete mellitus: nesta doença metabólica os animais deixam de utilizar a glicose como fonte de energia, passando a utilizar os lipídios, gerando os corpos cetônicos (LOPES, 2004) Presença de Bilirrubina na urina A bilirrubina urinária é mais um indicador de enfermidade hepática do que de doença do sistema urinário (THRALL et al., 2006). A bilirrubinúria pode ser encontrada em casos de obstrução do ducto biliar, sendo que sua quantidade na urina é diretamente proporcional ao grau de obstrução, doença hepática envolvendo lesão dos hepatócitos e associado com hemólise intravascular aguda grave ou febre (BUSH, 2004), hepatites viral ou tóxica e cirrose (LOPES, 2004). Os níveis urinários de bilirrubina fornecem informações limitadas sobre a função hepática (BUSH, 2004).
81 71 É produzida pelo catabolismo de eritrócitos velhos e de proteínas que contém o grupo heme. No sangue existem dois tipos de bilirrubina, que são conhecidas como livre ou indireta (ligada à proteína) e conjugada ou direta. Esta substância quando livre é pouco solúvel no sangue, sendo transportada por proteínas, principalmente albumina, até o fígado, onde será conjugada com ácido glicurônico a diglicuronídeo de bilirrubina. A bilirrubina conjugada é solúvel no sangue, sendo excretada pela bile e pela urina. A bilirrubina livre está fortemente ligada à albumina e não poderá ser excretada pelo rim, pois não será filtrada pelos glomérulos. Um aumento de bilirrubina na urina é denominado de bilirrubinúria (COLES, 1984; GARCIA-NAVARRO, 1996; GONZÁLEZ & SILVA, 2006). A bilirrubina e seus derivados tomam o nome coletivo de pigmentos biliares (GARCIA-NAVARRO, 2005b). Normalmente, a bilirrubina não esta presente na urina do cão e do gato. Porém, o rim canino pode degradar a hemoglobina em bilirrubina, e o limiar renal da bilirrubina é baixo nos cães. A magnitude da bilirrubinúria deve sempre ser interpretada junto com a gravidade específica da urina. São comuns os resultados variarem de traços até leves reações para bilirrubina na urina do cão, com uma gravidade específica maior ou igual a Isso já não se verifica no caso dos gatos: urina altamente concentrada em gatos deve ainda ser negativa para bilirrubina. A bilirrubinúria em gatos é sempre patológica (SINK & FELDMAN, 2006). Na maioria das espécies, as células do epitélio tubular reabsorvem eficientemente essa bilirrubina; portanto, raramente se detecta bilirrubina na urina antes que ocorra hiperbilirrubinemia. Em cães, a capacidade de reabsorção tubular (o limiar renal) de bilirrubina é baixa. Essa capacidade é menor em cães machos; desse modo, traços de bilirrubina é normal na urina de cães, especialmente em machos, com densidade urinária superior a Além disso, é comum ocorrer hiperbilirrubinúria antes da manifestação de hiperbilirrubinemia (THRALL et al., 2006). De acordo com GARCIA-NAVARRO (2005b), as principais causas do aumento da bilirrubina na urina são:
82 72 A obstrução dos ductos biliares e/ou do canal biliar: quando a obstrução é total, há um refluxo da bile para a circulação, o que determina um aumento da bilirrubinúria, mas sem urobilinogenúria; quando a obstrução for parcial, ambos, a bilirrubina e o urobilinogênio aparecem na urina, aquela aumentada e este diminuído; Doenças hepáticas: como a hepatite infecciosa canina ou doença de Rubarth, a leptospirose, a cirrose hepática, as diversas neoplasias do fígado, as toxicoses e outras hepatopatias, quando pode haver aumento de bilirrubinúria antes de qualquer outro sinal clínico, e cuja urina contém ambos aumentados, a bilirrubina e o urobilinogênio. A icterícia hemolítica: que acompanha as anemias hemolíticas com aumento de hemólise, que dá como resultado um aumento na produção de bilirrubina e, como conseqüência, um aumento na produção de urobilinogênio intestinal e na sua eliminação urinária. Outras causas: como a obstrução intestinal, por diminuírem a eliminação de bilirrubina pela via intestinal, com conseqüente aumento da taxa de bilirrubina conjugada plasmática, que passa a ser eliminada pela urina Presença de Urobilinogênio na urina O urobilinogênio é formado pela ação de hidrolases bacterianas intestinais, que reduzem a bilirrubina conjugada dando origem a este composto incolor. Uma parte desta substância é oxidada até urobilina, sendo um dos pigmentos fecais. O restante volta à circulação, porta ou sistêmica, onde a maior parte vai ao fígado para ser novamente excretada pela bile e uma pequena porção será eliminada pelo rim (COLES, 1984; GARCIA-NAVARRO, 1996; GONZÁLEZ & SILVA, 2006). Do urobilinogênio produzido no intestino, apenas 20% são reabsorvidos. Destes, 90% são reexcretados pela bile e somente 10% voltam à circulação geral, podendo ser excretados na urina. Portanto, somente 1 a 2% do urobilinogênio total produzido estão presentes em condições normais na urina (GONZÁLEZ & SILVA, 2006). Segundo COLES (1984), se o urobilinogênio está
83 73 presente na urina, então o ducto biliar está aberto e a circulação entero-hepática de pigmento biliar está ocorrendo. Como foi visto o urobilinogênio é a forma reduzida da bilirrubina conjugada e as duas alterações urinárias devem ser interpretadas em conjunto. A eliminação de uma pequena parte do urobilinogênio pela urina é normal, sendo ele o principal pigmento que dá a cor amarela à urina (GARCIA-NAVARRO, 2005b). Cães e gatos apresentam até 1/32 de urobilinogênio na urina. O urobilinogênio depois de excretado na urina em contato com o ar oxida-se dando origem a urobilina (MUNDIM, 2007). Como principais causas do aumento do urobilinogênio urinário, podemos citar: Hepatopatias: por lesões instaladas nos hepatócitos que interferem no ciclo entero-hepático do urobilinogênio; Doenças hemolíticas: por excesso de produção do glucoronato de bilirrubina (SILVA, 2004). A ausência ou diminuição do urobilinogênio urinário ocorre principalmente nos seguintes casos: Obstrução das vias biliares; Inibição das bactérias intestinais; Diarréia (distúrbios na absorção intestinal) (GARCIA-NAVARRO, 1996; BUSH, 2004) Presença de Indican na urina O aumento da quantidade de indican na urina se denomina de indicanúria. O indican é um derivado do indol que por sua vez é um produto resultante da putrefação de proteínas no trato intestinal. Após a absorção do indol, o mesmo sofre oxidação no fígado originando o indoxil, que se combina com sulfato de potássio, formando o indoxil sulfato de potássio (Indican) que é excretado pela urina (SILVA, 2004). A indicanúria tem valor diagnóstico questionável por alguns autores, principalmente para herbívoros, onde sua eliminação é maior, enquanto que nos carnívoros, sua eliminação ocorre em pequenas quantidades ou mesmo nem ocorre nos animais saudáveis (MUNDIM, 2007).
84 74 O aumento de indican está associado a um aumento da putrefação protéica intestinal, como a verificada após a ingestão de alimentos excessivamente ricos em proteínas ou em decomposição, bem como na constipação e obstrução intestinais importantes ou crônicas. Ele acontece também nas lesões do aparelho digestivo, tais como gastrite, gastroenterites, intussucepção, vólvulo e etc. Outras situações como a peritonite, a febre tifóide e, principalmente, a gangrena com decomposição bacteriana de proteínas corporais podem também aumentar o indican eliminado na urina (GARCIA-NAVARRO, 2005b) Presença de Sais biliares na urina Os ácidos biliares são sintetizados nos hepatócitos a partir do colesterol. Na maioria dos animais, os ácidos cólico e quenodesoxicólico representam os ácidos biliares primários. Após sua síntese, eles são conjugados em aminoácidos. Essa conjugação torna os ácidos biliares mais hidrossolúveis e eles são secretados no sistema biliar. No momento da alimentação, fatores hormonais e neurohormonais estimulam a contração da vesícula biliar e a transferência dos ácidos biliares para o intestino delgado, onde sua desidroxilação pelos microorganismos anaeróbicos resulta na transformação dos ácidos biliares primários em secundários. No íleo, a maior parte dos ácidos biliares retorna ao sangue. Normalmente o fígado é muito eficiente na remoção dos ácidos biliares da circulação portal. Os ácidos biliares excretados pelos hepatócitos são secretados no sistema biliar e circulam novamente; uma molécula de ácido biliar circula novamente várias vezes após uma única refeição (THRALL et al., 2006). As possíveis causas do aumento na concentração de ácidos biliares na urina são: Desvio da circulação portal e conseqüente anormalidade na sua absorção pela circulação sistêmica (por exemplo, shunt portossistêmico, cirrose grave). Nessa situação, o sangue é desviado dos hepatócitos, impossibilitando a remoção dos ácidos biliares; Diminuição intrínseca da capacidade de absorção dos ácidos biliares pelos hepatócitos. Essa é a principal causa em várias doenças hepáticas
85 75 (por exemplo, hepatite, necrose, hepatopatia por glicocorticóides) e, em alguns casos, corresponde à redução da massa hepática funcional; Menor excreção de ácidos biliares pelo sistema biliar e conseqüente regurgitação a circulação sistêmica. Tal distúrbio em geral deve-se a colestase, mas também pode ocorrer quando houver extravasamento do ducto ou da vesícula biliar (THRALL et al., 2006). MUNDIM (2007) cita que nas icterícias tanto a hemolítica como a obstrutiva, se encontra sais biliares na urina. Os sais biliares estão presentes na urina nos casos de comprometimento hepático acompanhando a bilirrubina (SILVA, 2004) Presença de Sangue na urina Resultado positivo para sangue oculto na urina obtido em tira reagente deve-se a hemorragia no trato urinário, hemoglobinúria ou mioglobinúria. Hemorragia do trato urinário pode ser confirmada pelo achado de hemácias no sedimento urinário. No entanto, urina hipostenúrica pode resultar em lise hipotônica de hemácias, interferindo na sua detecção microscópica. Caso não haja hemorragia, deve-se diferenciar hemoglobinúria e mioglobinúria a partir da avaliação do hemograma e do histórico clínico. Hemoglobinúria resulta de intensa hemólise intravascular, geralmente acompanhada por anemia grave, podendo ser notada manifestação clínica de icterícia e colapso súbito. Geralmente nota-se mioglobinúria apenas quando há grave lesão muscular, acompanhada de aumento na atividade sérica de enzimas musculares (por exemplo, CK, LDH, AST) (THRALL et al., 2006). Hematúria: Cor da urina rósea ou avermelhada, formando depósito de hemácias quando centrifugadas ou colocadas em repouso. O número de eritrócitos é elevado no sedimento urinário. A cor do plasma é normal. A dosagem sérica da creatininoquinase (CK), sugestivas de alterações musculares é normal (SILVA, 2004). A ocorrência de hematúria acontece sempre que houver uma hemorragia renal ou das vias urogenitais (COLES, 1984). Ela pode ser vista
86 76 também em casos severos de glomerulonefrite, vasculite e infarto renal, quando há passagem de eritrócitos para dentro dos túbulos. Deve ser lembrado, ainda, que as amostras cateterizadas podem apresentar hematúria, como resultado do traumatismo não raro a essa técnica (GARCIA-NAVARRO, 2005b). Hemoglobinúria: Cor da urina variando do marrom ao vinho. O número de eritrócitos no sedimento urinário é normal. Não forma depósito quando centrifugadas ou em repouso. A cor do plasma é avermelhada. A dosagem sérica da CK é normal (SILVA, 2004). Dependendo de sua origem, a hemoglobinúria pode ser verdadeira ou falsa. Na forma verdadeira, a hemoglobinúria aparece como resultado da hemoglobinemia, que é a existência de hemoglobina livre no plasma. Essa hemoglobina atravessa a barreira glomerular e, estando em quantidade aumentada e não sendo toda reabsorvida, aparece na urina. A hemoglobinúria é indicativa de uma hemólise intravascular, fato que ocorre nas reações às transfusões incompatíveis e nas anemias hemolíticas com hemólise intravascular e hemoglobinemia. Entre estas últimas, podem ser citadas as babesioses e a doença hemolítica do recém- nascido. Pode aparecer ainda como resultado da ação de certos venenos de cobra, agentes tóxicos como cobre, o mercúrio e as sulfas, hemolisinas, produzidas pela Leptospira pomona, ingestão de certas plantas tóxicas, e finalmente queimaduras severas (GARCIA NAVARRO, 2005b). Hemoglobinúria falsa: a sua causa mais freqüente é a ruptura de glóbulos vermelhos, quando presentes em urinas muito diluídas ou alcalinas. Essa ruptura ocorre geralmente in vitro, mas pode acontecer ainda no interior da bexiga urinária. Trata-se, na verdade, de uma hematúria mascarada de hemoglobinúria. A diferenciação se faz procurando eritrócitos inteiros no sedimento, já que essa hemólise raramente é total (GARCIA-NAVARRO, 2005b). Mioglobinúria: Ocorre devido à excreção da mioglobina plasmática excedente, ou seja, quando a sua concentração no plasma excede 15 a 20 mg/dl. A mioglobina é o pigmento responsável pelo transporte de oxigênio nos músculos e quando ocorre uma lesão muscular, sua concentração no sangue pode aumentar (LOPES, 2004). A urina com esse pigmento deteriora-se rapidamente (BUSH, 2004).
87 Exame do sedimento urinário Nos animais saudáveis a urina contém poucas células ou elementos que podem ser formados ao longo do trato geniturinário, como cilindros e cristais. A urina normal é livre de microorganismos, podendo ocorrer contaminação quando esta é expelida. Neste momento, também pode ocorrer contaminação por ovos de parasitas intestinais, esporos vegetais e outras matérias orgânicas. O exame microscópico da urina é imprescindível para uma correta interpretação da urinálise. Frequentemente, urinas com aspecto físico normal revelam estruturas importantes ao diagnóstico clínico, que não são observadas em urinas muito turvas. A composição do sedimento urinário muda logo após sua coleta, portanto esta avaliação deve ser realizada em amostras recentes. Caso isto não seja possível, a amostra deve ser refrigerada para uma adequada manutenção das estruturas presentes e avaliada, preferencialmente, em 4 horas (COLES, 1984; DOXEY, 1985). Com o passar do tempo ocorre aumento da alcalinidade da urina, causando lise das células e cilindros e, eventualmente, alterações nos cristais (BUSH, 2004). O exame do sedimento urinário é o procedimento de maior sensibilidade no diagnóstico de doença do trato urinário, sendo útil na localização da lesão renal (THRALL et al., 2006). O sedimento urinário é composto pelos elementos sólidos existentes na urina, que se depositam no fundo do tubo após centrifugação da amostra (GARCIA-NAVARRO, 2005b). O objetivo da análise do sedimento em uma urinálise rotineira é identificar elementos formados na amostra de urina: células, cilindros e cristais (GARCIA-NAVARRO, 2005b). Além do registro de presença destas estruturas em uma amostra de urina, esse exame deve também permitir uma idéia numérica aproximada de tais estruturas particulares (COLES, 1984). O sedimento urinário pode ser dividido em elementos organizados (orgânico) e não organizados (inorgânico). No primeiro grupo estão presentes eritrócitos, leucócitos, células epiteliais, microorganismos (bactérias, protozoários, fungos, leveduras), cilindros, parasitos e espermatozóides. O segundo é composto por cristais e gotículas de gordura (MATOS & MATOS, 1995; GARCIA-NAVARRO, 1996).
88 78 A quantidade dos diversos elementos no sedimento varia muito conforme a situação, devendo ser interpretada subjetivamente. Ela é tradicionalmente registrada por cruzes; uma cruz: quantidade reduzida; duas cruzes: presença um pouco aumentada; três cruzes: quantidade aumentada de forma importante e quatro cruzes: quantidade muito aumentada (GARCIA-NAVARRO, 2005b) Elementos organizados a) Células epiteliais As células epiteliais são grandes em relação a outros constituintes do sedimento urinário (SINK & FELDMAN, 2006). Podem ser transicionais, descamativas, ou, mais raramente, de origem tubular renal (GARCIA-NAVARRO, 2005b). As células pavimentosas, também chamadas de descamativas, são provenientes da camada superficial da uretra e da vagina, aumentando de número durante o cio. São as maiores células observadas no sedimento. Apresenta bordas irregulares, núcleo visível, arredondado e pequeno em relação ao citoplasma (GARCIA-NAVARRO, 1996; GONZÁLEZ & SILVA, 2006). Estas células são finas, podendo apresentar-se de forma dobrada ou enrolada, sendo por vezes confundidas com cilindros (COLES, 1984; BUSH, 2004). As células descamativas são normalmente encontradas no sedimento, pois resultam da renovação tissular do sistema urinário. Quando estão em número elevado, podem sugerir a localização dos processos patológicos nos rins ou nas vias excretoras da urina (SILVA, 2004). As células de transição revestem a mucosa desde a pelve renal até a uretra. Apresentam vários tamanhos, sendo menores na região próxima aos rins, aumentando gradativamente até se encontrar com a vagina, porém são sempre menores que as pavimentosas. Sua forma é variável, podem ser redondas, ovais, fusiformes e caudadas. Seu citoplasma é granular e o núcleo redondo ou ligeiramente oval (GARCIA-NAVARRO, 1996), podendo ser visualizadas em agrupamentos ou folhas. As células da pelve renal podem ter o citoplasma em forma de cauda, adquirindo a aparência de uma vírgula, sendo chamadas de
89 79 caudadas (BUSH, 2004). Em condições normais, o número dessas células é muito reduzido na urina. Seu aumento pode estar relacionado com inflamação, irritação (LOPES, 2004) ou neoplasia (GARCIA-NAVARRO, 2005b). As células renais são provenientes dos túbulos renais. Possuem tamanhos semelhantes a um leucócito, são arredondadas e com núcleo grande, sendo difíceis de distinguir dos glóbulos brancos ou das células da bexiga (GONZÁLEZ & SILVA, 2006). Estas estruturas são identificadas mais facilmente quando incorporadas a cilindros (COLES, 1984) e degeneram-se com rapidez mesmo em amostras frescas, sendo que sua presença indica um processo de descamação tubular (GARCIA-NAVARRO, 1996). Se o número de células encontrado for grande, indica um processo degenerativo do órgão de onde provém (FERREIRA NETO et al., 1977). Causas da presença de células epiteliais na urina Renais: degeneração tubular aguda; Intoxicação renal; Isquemia renal; Processo inflamatório; Pelve: pielite, pielonefrite; Vesicais: cistite, cateterização agressiva; Uretrais: uretrite, cateterização agressiva; Tumorais: diagnóstico por morfologia citológica do sedimento (MUNDIM, 2007). b) Eritrócitos Não são encontrados com freqüência. Sua presença indica hemorragia no trato urogenital, devido a doenças infecciosas, nefrites agudas, cistites, parasitos, ingestão de venenos, traumas (LOPES, 2004), cálculos, exercícios violentos, ou pode ser devido a traumatismo por cateterismo (FERREIRA NETO et al., 1977). A presença de eritrócitos na urina pode resultar em teste de sangue oculto positivo, acompanhado de discreta proteinúria. Os animais normais apresentam menos de três eritrócitos por campo de grande aumento (THRALL et
90 80 al., 2006). São redondos e refráteis internamente, assemelham-se a gotas de gorduras. Sua forma no sedimento depende da densidade urinária, e do ph (MUNDIM, 2007). A aparência destas células é afetada pela concentração da urina. Tornam-se pequenas e crenadas em urinas concentradas e ingurgitadas e esféricas em urinas diluídas, onde serão visualizados anéis descoloridos e pálidos que podemos chamar de células fantasmas (ALMOND & STEVENS, 1995). Estas células fantasmas nem sempre são uniformes em dimensões e morfologia, embora tenham, geralmente, contorno circular (COLES, 1984). c) Leucócitos Piócitos Denomina-se de piúria o aumento do número de piócitos na urina (LOPES, 2004), ocorrendo nos casos das doenças do sistema urinário com envolvimento bacteriano (nefrites, pielonefrites, cistites, e etc) (SILVA, 2004). Ocorre sempre que houver inflamação, supurativa principalmente, ou necrose em qualquer ponto do aparelho urogenital, sendo que, se a amostra for cateterizada, apenas os órgãos urinários devem ser considerados. Se a piúria estiver acompanhada de cilindros leucocitários pode-se deduzir ser o rim o local da inflamação, lembrando-se ainda que, pacientes em tratamento prolongado com corticosteróides, podem fazer inflamação sem reação leucocitária importante na urina (GARCIA-NAVARRO, 2005b). Além da infecção, a febre ou o exercício intenso também podem aumentar, temporariamente, o número de leucócitos na urina (COLES, 1984; GARCIA-NAVARRO, 1996). Os leucócitos são redondos e com o citoplasma granular (Figura 26), maiores que os eritrócitos e menores que as células renais. Mais de 5 a 8 leucócitos por campo indica piúria e inflamação das vias geniturinárias (MUNDIM, 2007). A presença de um número elevado de piócitos, acompanhado de albuminúria e de numerosos cilindros, indica um processo inflamatório renal. A piúria, acompanhada de traços de albumina e ausência de cilindros, sugere um processo inflamatório localizado depois dos rins. Ocorrendo piúria, presença de
91 81 grande número de bactérias e células da bexiga, pode-se tratar de cistite (FERREIRA NETO et al., 1977). FIGURA 26 - Leucócitos (seta) no sedimento urinário de cão d) Cilindros Os cilindros são estruturas protéicas moldadas nos túbulos, sendo sua base a mucoproteína (proteína de Tamm-Horsfall) que é secretada na alça de Henle, no túbulo distal e no ducto coletor (BUSH, 2004). São formados a partir da proteína que atravessa a membrana glomerular, sendo que o ph ácido, encontrado nas inflamações e na porção terminal do néfron, favorece a formação destes (LOPES, 2004). Sua presença, principalmente na forma hialina pode ser esporádica e acompanhar uma proteinúria fisiológica. Quando encontrados frequentemente ou em grandes quantidades, geralmente estão relacionados à doença renal e tem grande valor diagnóstico. Além da quantidade, o tipo de cilindro presente e o seu diâmetro auxiliam na identificação e prognóstico da doença. Os que apresentam diâmetro menor provêm do néfron, indicando inflamações agudas, já os maiores foram formados nos túbulos coletores, indicando lesões mais avançadas e importantes, com prognóstico geralmente desfavorável (COLES, 1984; GARCIA-NAVARRO, 1996). Normalmente a urina não contém mais do que 1-2 cilindros hialinos ou granulares por campo de 400 X (GONZÁLEZ & SILVA, 2006). A grande maioria apresenta formato alongado, uma vez que adquirem a
92 82 forma do túbulo onde ocorreu a deposição protéica. O tipo de material incorporado à matriz protéica durante a formação destas estruturas, determinará qual cilindro será formado (DOXEY, 1985). Uma grande quantidade de cilindros é observada na urina de animais que tiveram seus rins afuncionais, tão logo suas funções retornarem ao normal, é chamada fase de lavagem dos túbulos (MUNDIM, 2007). Os cilindros podem ser hialinos, epiteliais, granulares, céreos, gordurosos, hemáticos, hemoglobínicos, leucocíticos e largos (GARCIA-NAVARRO, 2005b). Cilindros Hialinos Os cilindros hialinos não possuem coloração, são homogêneos, são semitransparentes e tem extremidades tipicamente arredondadas (Figura 27). Eles são formados por mucoproteína gelatinosa e não contem células (SINK & FELDMAN, 2006). São formados exclusivamente por proteínas, geralmente albumina (GARCIA-NAVARRO, 2005b), se dissolve rapidamente em urina diluída ou alcalina (BUSH, 2004). Não tem valor diagnóstico, sua presença indica uma forma leve de irritação renal, porém pequena quantidade pode ser visualizada em animais normais devido à febre, hiperemia renal e proteinúria fisiológica (COLES, 1984; GARCIA-NAVARRO, 1996), insuficiência cardíaca congestiva, estresse, desidratação, exercício físico intenso e exposição ao calor (LOPES, 2004). FIGURA 27 - Cilindro hialino (seta) no sedimento urinário de cão
93 83 Cilindros Epiteliais São cilindros hialinos que contém várias células epiteliais renais (Figura 28). Eles resultam da descamação das células tubulares que não se desintegraram, o que ocorre em qualquer doença que produz lesão ao epitélio tubular. Esses cilindros às vezes são difíceis de distinguir de cilindros leucocíticos, especialmente se as células epiteliais renais tiverem sofrido alguma degeneração (SINK & FELDMAN, 2006). Ocorrem nas nefrites agudas (DIETZ, 1997), nefroses, nas degenerações do epitélio tubular (MUNDIM, 2007). A gravidade do processo é proporcional ao número de cilindros por campo e ao número de células no seu interior (GARCIA-NAVARRO, 1996). FIGURA 28 - Cilindro epitelial (seta) no sedimento urinário de cão Cilindros Granulosos São formandos por proteínas e fragmentos celulares. Ao contrário dos cilindros epiteliais, neles não são observados contornos celulares (Figura 29). De acordo com a gravidade dos processos estes cilindros se dividem em granulosos grossos, que contém no seu interior granulações grosseiras e cilindros granulosos finos, granulações finas. Estes cilindros representam à desintegração das células tubulares (SILVA, 2004). São considerados indicadores de um estágio de doença
94 84 renal mais avançado que os dois anteriores, raramente sendo vistos nas inflamações agudas. Quando em grandes números, podem indicar doenças renais com necrose do epitélio tubular (MEYER & HARVEY, 1998), tais como a nefrite de qualquer natureza ou a nefrose por isquemia ou nefrotoxinas (GARCIA-NAVARRO, 2005b). São formados em função da estase urinária, em que os cilindros celulares permanecem nos túbulos com conseqüente desintegração e formação das granulações. A posterior desintegração do cilindro granuloso origina o cilindro céreo (LOPES, 2004). FIGURA 29 - Cilindros granulosos (seta) em sedimento urinário de cão Cilindros Céreos ou Cerosos São formações largas, homogêneas, opacas, constituídas de substância amorfa, fosca semelhante à cera (MUNDIM, 2007). São mais largos que os cilindros hialinos e parecem muito mais sólidos que estes. Eles usualmente apresentam extremidades quebradiças, com cantos em ângulo reto, e são fáceis de visualizar microscopicamente em virtude de sua natureza altamente refratária (SINK & FELDMAN, 2006). Ocorrem quando há estase prolongada por obstrução tubular e são freqüentemente chamados cilindros da insuficiência renal. São comumente encontrados nos pacientes com insuficiência renal crônica e também em rejeição de transplantes (MOTTA, 2003). Não são vistos nunca em doenças agudas, e sua presença indica cronicidade (LOPES, 2004). São cilindros que
95 85 apresentam no seu interior uma massa homogênea oriunda da desintegração das células tubulares. A sua presença na urina é sempre sugestiva de doenças renais graves, como as que ocorrem nos processos de natureza degenerativas (SILVA, 2004). Cilindros Gordurosos Os cilindros gordurosos é um tipo de cilindro granular grosseiro contendo gotas de gordura. Essas gotas são altamente refratárias e se acumulam nos cilindros como resultado de degeneração celular lipídica. Esses cilindros ocorrem na doença tubular degenerativa (SINK & FELDMAN, 2006). Aparecem nas doenças degenerativas dos túbulos, com deposição de material lipídico (COLES, 1984; GARCIA-NAVARRO, 1996; BUSH, 2004), como acontece na diabete melito do cão (LOPES, 2004) e na lipúria do gato (GARCIA-NAVARRO, 2005b). São vistos nos casos de envenenamento pelo fósforo e arsênico (FERREIRA NETO et al., 1977). Os cilindros gordurosos representam o estágio final da degeneração de células tubulares (THRALL et al., 2006). Cilindros Hemáticos e Hemoglobínicos São cilindros hialinos que contém eritrócitos. Esses cilindros se formam quando os eritrócitos se agregam dentro do lúmen tubular. São raros em cães e gatos e sua presença indica sangramento intra-renal (LOPES, 2004). São encontrados na hematúria e indicam nefrite hemorrágica (FERREIRA NETO, 1977). Podem estar associados com traumatismo (GONZÁLEZ & SILVA, 2006). Os cilindros hemáticos estão associados à doença renal intrínseca. Suas hemácias são freqüentemente de origem glomerular, como na glomerulonefrite, mas podem também resultar de dano tubular, como na nefrite intersticial aguda (MOTTA, 2003).
96 86 Cilindros Leucocíticos Indicam um processo inflamatório supurativo associado a uma lesão renal, como a pielonefrite e os abcessos renais. Em geral, vem acompanhado de cilindros de outros tipos e de piúria. Aparecem como formações cilíndricas em cujo interior estão os leucócitos (GARCIA-NAVARRO, 2005b). É necessário prestar atenção, pois em certas ocasiões, os leucócitos podem ser eliminados na urina, aderidos uns aos outros em massas alongadas (COLES, 1984; GARCIA- NAVARRO, 1996). Essas formações são chamadas cilindróides de pus e não são verdadeiros cilindros (GARCIA-NAVARRO, 2005b). Quando a origem dos leucócitos é glomerular como na glomerulonefrite, encontra-se no sedimento grande quantidade de cilindros leucocitários e cilindros hemáticos. Quando é tubular, como na pielonefrite, os leucócitos migram para o lúmen tubular e são incorporados na matriz do cilindro (MOTTA, 2003). e) Muco Os filetes de muco aparecem como linhas longas, delgadas e maleáveis no sedimento urinário. Originam-se nas superfícies mucosas, sendo comuns em pequena quantidade e muito aumentados com qualquer forma de irritação (SINK & FELDMAN, 2006). Não é considerado clinicamente significativo. Seu aumento na urina está comumente associado à contaminação vaginal (MOTTA, 2003). f) Bactérias Normalmente, a urina é estéril. Grande número de bactérias presentes em uma amostra de urina obtida após cateterização ou cistocentese é indicativo de uma infecção de trato urinário. Nesse caso, as bactérias costumam ser acompanhadas pelo número aumentado de leucócitos (WALLACH, 2000). Bacteriúria não acompanhada por número aumentado de leucócitos sugere contaminação bacteriana. A urina eliminada espontaneamente pode ser contaminada ao passar pela uretra distal ou pelo trato genital, que pode conter
97 87 bactérias. A contaminação pela uretra das amostras eliminadas de forma espontânea ou obtidas por cateterização em geral não resulta em número grande o suficiente para ser visualizado microscopicamente. Se a amostra de urina for deixada à temperatura ambiente e as bactérias estiverem presentes na amostra, elas irão proliferar (SINK & FELDMAN, 2006). São vistas como pequenos pontos ou traços que podem ficar parados ou em constante movimento (GOLDBERG, 2007). g) Espermatozóides Podem ser encontrados, embora geralmente sem valor de diagnóstico, principalmente na urina de cães (GARCIA-NAVARRO, 2005b) (Figura 30). Aparecem na urina por contaminação de sêmen em urinas coletadas após relação sexual (LOPES, 2004). FIGURA 30 - Espermatozóides (seta) no sedimento urinário de cão h) Parasitas Ovos de parasitas podem ser visualizados no sedimento urinário. As possibilidades incluem Dioctophyma renale (ovos do verme dos rins do cão), Capillaria plica (ovos do verme da vesícula urinaria do cão) e microfilárias de
98 88 Dirofilaria immitis. Diversos ovos de parasitas podem ser visualizados no sedimento urinário se este for contaminado com fezes infectadas (SINK & FELDMAN, 2006) Elementos inorganizados a) Cristais A presença de cristais na urina é conhecida como cristalúria. Estes se formam através da precipitação de substâncias minerais presentes na urina e podem adquirir o formato amorfo ou cristalino, sendo que sua formação pode ocorrer tanto in vivo, quanto in vitro. A identificação visual dos diferentes tipos pode ser difícil, pois vários deles apresentam morfologia semelhante. Na interpretação do seu significado deve-se levar em consideração que os cristais podem sofrer modificações entre a coleta e a análise, dependendo do período de armazenamento, temperatura, ph da amostra e dieta. O tipo de cristal formado e sua quantidade dependem da concentração da urina, da solubilidade dos sais e do ph (GOLDBERG, 2007). A cristalúria pode ser assintomática ou estar relacionada à formação de cálculos no sistema urinário (MATOS & MATOS, 1995). Raramente tendo valor diagnóstico (MUNDIM, 2007). A cristalúria pode significar urolitíase, mas não necessariamente a indica (SINK & FELDMAN, 2006). Na urina ácida pode-se encontrar: Cristais de ácido úrico: é comum nos dálmatas (nos quais não ocorre a conversão hepática deste ácido em alantoína, realizada pela enzima uricase) (GOLDBERG, 2007) e em casos de urolitíases (MUNDIM, 2007). Essa raça excreta maior quantidade de ácido úrico devido a uma deficiência no mecanismo de reabsorção nos túbulos renais (CHANTREL, 1984; NELSON & COUTO, 1994). O aparecimento de cristais de ácido úrico na urina de cães que não pertencem à raça dálmata é sugestivo de disfunção hepática, decorrente da impossibilidade parcial ou total do fígado na conversão do ácido úrico em alantoína. A literatura relata a possibilidade de se encontrar cristais de ácido úrico em urinas de felinos (SILVA,
99 ). Esses cristais são amarelados ou amarronzados quando visualizados microscopicamente. Eles aparecem como placas rombas, rosetas, prismas ou são ovais com extremidades pontiagudas (SINK & FELDMAN, 2006). Sua presença pode estar relacionada a casos de gota, febre e nefrite crônica (GOLDBERG, 2007). Cristais de uratos amorfos: aparecem sob a forma de grânulos de areia fina, numerosos na urina fortemente ácida (GOLDBERG, 2007). Como os cristais de ácido úrico, só se apresentam como componentes normais nos carnívoros (FERREIRA NETO et al., 1977). A constatação de cristais de urato amorfo é descrito em casos de desvio portossistêmico (JUHNSTON et al., 2004). Cristais de oxalato de cálcio: são encontrados em urina ácida (KRUGER & ALLEN, 2000), neutra ou alcalina e são incolores quando visualizados microscopicamente. Esses cristais são comuns na toxicidade por etilenoglicol (SINK & FELDMAN, 2006). O etilenoglicol quando ingerido é metabolizado pelo fígado e origina o ácido oxálico, esse ácido reage com o cálcio para formar oxalato de cálcio que, por sua vez, se precipita nos túbulos renais e pode ser excretado na forma de cristais na urina (THRALL et al., 2006). Podem estar aumentados na diabete melito, nas doenças do coração ou dos pulmões (GARCIA-NAVARRO, 2005b). Ocorre por níveis elevados de cálcio na urina devido uma hipercalcemia ou reabsorção tubular de cálcio inadequada (NELSON & COUTO, 1994). LULICH et al. (2000) citam que a ocorrência de urólito de oxalato de cálcio está relacionada com dietas ricas em cálcio, proteínas e sódio e pobres em fósforo e potássio. SLATTER (1998) descreve a ocorrência desses cristais no hiperadrenocorticismo. Pesquisadores apóiam a hipótese de que alguns dos fatores promotores da formação dos urólitos de oxalato de cálcio em cães sejam hereditários (LULICH et al., 2000). Apresentam uma forma característica de envelope de carta (Figura 31) ou balão de São João (GOLDBERG, 2007).
100 90 FIGURA 31 - Cristais de oxalato de cálcio (seta) no sedimento urinário de cão Na urina alcalina podem-se encontrar: Cristais de triplo-fosfatos: são também chamados de estruvita ou fosfato de amônia e magnésio. Podem estar presentes em ph neutro e levemente ácido. Apresentam-se na forma de prismas curtos ou alongados, podendo lembrar o telhado de uma casa (Figura 32). Eventualmente unem-se uns aos outros, lembrando uma folha de samambaia ou uma pena de ave. São formados em função da fermentação alcalina da urina podendo ocorrer antes ou depois da eliminação (GOLDBERG, 2007). Quando encontrados em urinas recém colhidas, podem sugerir retenção da urina na bexiga, como a verificada na cistite crônica (FELDMAN, 1997), paraplegia, aumento do volume da próstata ou pielite crônica. Em gatos, esses cristais podem aparecer na síndrome urológica felina, ou podem ainda indicar a presença de urolitíase por estruvita (GARCIA-NAVARRO, 2005b). Os urólitos por estruvita estão associados a infecções do trato urinário causada por microrganismos produtores de urease e à urina alcalina na maioria dos cães (LULICH et al., 2000).
101 91 FIGURA 32 - Cristais de Fosfato triplo (setas) no sedimento urinário de cão Cristais de carbonato de cálcio: podem estar presentes também em ph neutro e levemente ácido. Apresentam-se com o formato de halteres ou de corpos esferoidais estriados (Figura 33) de diversos tamanhos (GOLDBERG, 2007). São encontrados em casos de urolitíases (MUNDIM, 2007). FIGURA 33 - Cristais de carbonato de cálcio (seta) no sedimento urinário de cão
EXAME HEMATOLÓGICO Hemograma
 EXAME HEMATOLÓGICO Hemograma Profa Dra Sandra Zeitoun Aula 2 Na coleta de sangue para exames são usados anticoagulantes específicos, indicados pela cor da tampa dos frascos. Cor da Tampa Anticoagulante
EXAME HEMATOLÓGICO Hemograma Profa Dra Sandra Zeitoun Aula 2 Na coleta de sangue para exames são usados anticoagulantes específicos, indicados pela cor da tampa dos frascos. Cor da Tampa Anticoagulante
INFLUÊNCIA DO TEMPO DE ARMAZENAMENTO DA AMOSTRA SOBRE OS PARÂMETROS HEMATOLÓGICOS DE CÃES
 INFLUÊNCIA DO TEMPO DE ARMAZENAMENTO DA AMOSTRA SOBRE OS PARÂMETROS HEMATOLÓGICOS DE CÃES Liamara A. LEIDENTZ, Daiane LAZAROTTO. Orientador: Wanderson A. B. Pereira. Introdução O hemograma é um dos exames
INFLUÊNCIA DO TEMPO DE ARMAZENAMENTO DA AMOSTRA SOBRE OS PARÂMETROS HEMATOLÓGICOS DE CÃES Liamara A. LEIDENTZ, Daiane LAZAROTTO. Orientador: Wanderson A. B. Pereira. Introdução O hemograma é um dos exames
Sangue: funções gerais
 Sangue Sangue: funções gerais Transporte de nutrientes para órgãos e tecidos; Regulação térmica e hídrica; Transporte de gases para órgãos e tecidos; Defesa do organismo; Coagulação. Componentes do Sangue
Sangue Sangue: funções gerais Transporte de nutrientes para órgãos e tecidos; Regulação térmica e hídrica; Transporte de gases para órgãos e tecidos; Defesa do organismo; Coagulação. Componentes do Sangue
03/08/2016. Patologia Clínica e Análises Laboratoriais Prof. Me. Diogo Gaubeur de Camargo
 2 3 4 5 6 Patologia Clínica e Análises Laboratoriais Prof. Me. Diogo Gaubeur de Camargo Especialidade médica Exames complementares Análise: Sangue; Urina; Líquor; Liquído peritoneal; Etc... Hematologia
2 3 4 5 6 Patologia Clínica e Análises Laboratoriais Prof. Me. Diogo Gaubeur de Camargo Especialidade médica Exames complementares Análise: Sangue; Urina; Líquor; Liquído peritoneal; Etc... Hematologia
AVALIAÇÃO DE UM HEMOGRAMA COMPLETO - SÉRIE VERMELHA
 AVALIAÇÃO DE UM HEMOGRAMA COMPLETO - SÉRIE VERMELHA INTRODUÇÃO O hemograma completo inclui todos os testes laboratoriais utilizados para examinar as células contidas no sangue periférico. As células são
AVALIAÇÃO DE UM HEMOGRAMA COMPLETO - SÉRIE VERMELHA INTRODUÇÃO O hemograma completo inclui todos os testes laboratoriais utilizados para examinar as células contidas no sangue periférico. As células são
Peculiaridades do Hemograma. Melissa Kayser
 Peculiaridades do Hemograma Melissa Kayser melissa.kayser@ifsc.edu.br Introdução Simplicidade Baixo custo Automático ou manual Muita informação Introdução eritrócitos Componentes celulares plaquetas linfócitos
Peculiaridades do Hemograma Melissa Kayser melissa.kayser@ifsc.edu.br Introdução Simplicidade Baixo custo Automático ou manual Muita informação Introdução eritrócitos Componentes celulares plaquetas linfócitos
Avaliação Nutricional - Profa. Raquel Simões
 IEL - hematologia Profa. Raquel 1 S 2 1 3 Componentes do sangue Plasma - Água - Íons - Proteinas - Carboidratos - Gorduras - Vitaminas - Hormônios -Enzimas Células - Células vermelhas (Eritrócitos) - Células
IEL - hematologia Profa. Raquel 1 S 2 1 3 Componentes do sangue Plasma - Água - Íons - Proteinas - Carboidratos - Gorduras - Vitaminas - Hormônios -Enzimas Células - Células vermelhas (Eritrócitos) - Células
Primeira aula. Apresentação da Disciplina. Características do sangue. Coleta de sangue. Extensão sanguínea e coloração. Hemograma
 Primeira aula Apresentação da Disciplina Características do sangue Coleta de sangue Extensão sanguínea e coloração Hemograma Profa Elvira Shinohara Tecido líquido e renovável Plasma Células sanguíneas
Primeira aula Apresentação da Disciplina Características do sangue Coleta de sangue Extensão sanguínea e coloração Hemograma Profa Elvira Shinohara Tecido líquido e renovável Plasma Células sanguíneas
Outras Anemias: Vamos lá? NAC Núcleo de Aprimoramento científico Hemograma: Interpretação clínica e laboratorial do exame. Jéssica Louise Benelli
 Outras Anemias: A anemia por si só não é uma doença, e sim uma consequência de algum desequilíbrio entre os processos de produção e perda de eritrócitos, que leva a diminuição de hemoglobina. A inúmera
Outras Anemias: A anemia por si só não é uma doença, e sim uma consequência de algum desequilíbrio entre os processos de produção e perda de eritrócitos, que leva a diminuição de hemoglobina. A inúmera
Hematologia. 1. Coleta de sangue 14/08/2014. Coleta com anticoagulante adequado. Identificação do paciente. Rotulagem prévia dos frascos de coleta.
 Hematologia Marcos K. Fleury Laboratório de Hemoglobinas Faculdade de Farmácia - UFRJ mkfleury@ufrj.br Coleta com anticoagulante adequado. Identificação do paciente. Rotulagem prévia dos frascos de coleta.
Hematologia Marcos K. Fleury Laboratório de Hemoglobinas Faculdade de Farmácia - UFRJ mkfleury@ufrj.br Coleta com anticoagulante adequado. Identificação do paciente. Rotulagem prévia dos frascos de coleta.
O Hemograma. Hemograma: Interpretação clínica e laboratorial do exame. NAC Núcleo de Aprimoramento Científico Jéssica Louise Benelli
 Hemograma: Interpretação clínica e laboratorial do exame. NAC Núcleo de Aprimoramento Científico Jéssica Louise Benelli O que é? Faillace e cols., disse que o Hemograma é a hematologia ; Hematologia é
Hemograma: Interpretação clínica e laboratorial do exame. NAC Núcleo de Aprimoramento Científico Jéssica Louise Benelli O que é? Faillace e cols., disse que o Hemograma é a hematologia ; Hematologia é
Classificação das Anemias
 HEMATOLOGIA II Curso de Farmácia 8 º período Classificação das Anemias ANEMIA Problema de saúde de âmbito mundial Diminuição da capacidade de oxigenação tecidual pelas hemácias O Laboratório auxilia o
HEMATOLOGIA II Curso de Farmácia 8 º período Classificação das Anemias ANEMIA Problema de saúde de âmbito mundial Diminuição da capacidade de oxigenação tecidual pelas hemácias O Laboratório auxilia o
18/08/2016. Anemia e Policitemia Prof. Me. Diogo Gaubeur de Camargo
 1 Anemia e Policitemia Prof. Me. Diogo Gaubeur de Camargo 2 3 4 5 Principais achados clínicos Mucosas pálidas Fraqueza e apatia Taquicardia Sopro sistólico Polipnéia Hipersensibilidade ao frio Choque (perda
1 Anemia e Policitemia Prof. Me. Diogo Gaubeur de Camargo 2 3 4 5 Principais achados clínicos Mucosas pálidas Fraqueza e apatia Taquicardia Sopro sistólico Polipnéia Hipersensibilidade ao frio Choque (perda
Faculdade de Medicina. Bioquímica I
 Faculdade de Medicina Bioquímica I Aprofundar conhecimentos acerca da composição química do sangue Determinar o Hematócrito INTRODUÇÃO O sangue é constituído por plasma e células sanguíneas, de entre as
Faculdade de Medicina Bioquímica I Aprofundar conhecimentos acerca da composição química do sangue Determinar o Hematócrito INTRODUÇÃO O sangue é constituído por plasma e células sanguíneas, de entre as
ENFERMAGEM EXAMES LABORATORIAIS. Aula 4. Profª. Tatiane da Silva Campos
 ENFERMAGEM EXAMES LABORATORIAIS Aula 4 Profª. Tatiane da Silva Campos As principais causas de erro e de resultados falsos do exame de urina estão relacionadas à preparo do paciente, coleta, transporte
ENFERMAGEM EXAMES LABORATORIAIS Aula 4 Profª. Tatiane da Silva Campos As principais causas de erro e de resultados falsos do exame de urina estão relacionadas à preparo do paciente, coleta, transporte
O sangue e seus constituintes. Juliana Aquino. O sangue executa tantas funções que, sem ele, de nada valeria a complexa organização do corpo humano
 O sangue e seus constituintes Juliana Aquino O sangue executa tantas funções que, sem ele, de nada valeria a complexa organização do corpo humano O sangue e seus constituintes É através da circulação sanguínea
O sangue e seus constituintes Juliana Aquino O sangue executa tantas funções que, sem ele, de nada valeria a complexa organização do corpo humano O sangue e seus constituintes É através da circulação sanguínea
INTERPRETAÇÃO CLÍNICA DO HEMOGRAMA
 INTERPRETAÇÃO CLÍNICA DO COMPLETO: É a avaliação qualitativa e quantitativa dos elementos do sangue. Alterações fisiológicas podem ocorrer no hemograma por exercícios físicos e refeições gordurosas. Pode
INTERPRETAÇÃO CLÍNICA DO COMPLETO: É a avaliação qualitativa e quantitativa dos elementos do sangue. Alterações fisiológicas podem ocorrer no hemograma por exercícios físicos e refeições gordurosas. Pode
31/10/2013 HEMOGRAMA. Prof. Dr. Carlos Cezar I. S. Ovalle. Introdução. Simplicidade. Baixo custo. Automático ou manual.
 3//3 HEMOGRAMA Prof. Dr. Carlos Cezar I. S. Ovalle Introdução Simplicidade Baixo custo Automático ou manual Muita informação 3//3 Introdução Componentes celulares eritrócitos plaquetas linfócitos leucócitos
3//3 HEMOGRAMA Prof. Dr. Carlos Cezar I. S. Ovalle Introdução Simplicidade Baixo custo Automático ou manual Muita informação 3//3 Introdução Componentes celulares eritrócitos plaquetas linfócitos leucócitos
INTERPRETAÇÃO DO HEMOGRAMA
 INTERPRETAÇÃO DO HEMOGRAMA HEMOGRAMA COMPLETO Exame laboratorial simples, de baixo custo Utilidade em relação ao estado geral de saúde do paciente Auxilia no diagnóstico de várias doenças hematológicas
INTERPRETAÇÃO DO HEMOGRAMA HEMOGRAMA COMPLETO Exame laboratorial simples, de baixo custo Utilidade em relação ao estado geral de saúde do paciente Auxilia no diagnóstico de várias doenças hematológicas
Autonomia em diagnósticos para clínicas e hospitais veterinários
 Todos os seus resultados de diagnóstico em um único relatório de fácil leitura. Autonomia em diagnósticos para clínicas e hospitais veterinários Todos os seus resultados de diagnóstico em um único relatório
Todos os seus resultados de diagnóstico em um único relatório de fácil leitura. Autonomia em diagnósticos para clínicas e hospitais veterinários Todos os seus resultados de diagnóstico em um único relatório
Doença dos Eritrócitos
 Doença dos Eritrócitos Os Reticulócitos Introdução... 2 Avaliação de Anemia com Presença e Ausência de Reticulocitose... 5 1 OS RETICULÓCITOS Introdução As anemias podem ser resultantes de falhas na produção
Doença dos Eritrócitos Os Reticulócitos Introdução... 2 Avaliação de Anemia com Presença e Ausência de Reticulocitose... 5 1 OS RETICULÓCITOS Introdução As anemias podem ser resultantes de falhas na produção
PSA - ANTÍGENO ESPECÍFICO Coleta: 20/11/ :05 PROSTÁTICO LIVRE. PSA - ANTIGENO ESPECÍFICO Coleta: 20/11/ :05 PROSTÁTICO TOTAL
 AUTENTICIDADE: 31BA47 Set.Tecnico Imunoensaio PSA - ANTÍGENO ESPECÍFICO Coleta: 20/11/2004 07:05 PROSTÁTICO LIVRE Resultado 0.15 ng/ml Metodo: Eletroquimioluminescência (ECLIA) Referencial: Até 0.72 ng/ml
AUTENTICIDADE: 31BA47 Set.Tecnico Imunoensaio PSA - ANTÍGENO ESPECÍFICO Coleta: 20/11/2004 07:05 PROSTÁTICO LIVRE Resultado 0.15 ng/ml Metodo: Eletroquimioluminescência (ECLIA) Referencial: Até 0.72 ng/ml
2. Aplicabilidade: Bioquímicos/biomédicos do setor de Hematologia
 1. Sinonímia: Hemograma 2. Aplicabilidade: Bioquímicos/biomédicos do setor de Hematologia 3. Aplicação clínica Exame laboratorial de rotina para avaliação quantitativa e qualitativa dos elementos figurados
1. Sinonímia: Hemograma 2. Aplicabilidade: Bioquímicos/biomédicos do setor de Hematologia 3. Aplicação clínica Exame laboratorial de rotina para avaliação quantitativa e qualitativa dos elementos figurados
Prof. Dr. Adilson Donizeti Damasceno Professor Adjunto I DMV/EV/UFG
 Prof. Dr. Adilson Donizeti Damasceno Professor Adjunto I DMV/EV/UFG addamasceno@vet.ufg.br INTRODUÇÃO O que é o SANGUE? INTRODUÇÃO Composição do sangue? Plasma Leucócitos e Plaquetas Hemácias INTRODUÇÃO
Prof. Dr. Adilson Donizeti Damasceno Professor Adjunto I DMV/EV/UFG addamasceno@vet.ufg.br INTRODUÇÃO O que é o SANGUE? INTRODUÇÃO Composição do sangue? Plasma Leucócitos e Plaquetas Hemácias INTRODUÇÃO
AULA PRÁTICA 3-02/06/2015. Roteiro de aula prática. Infecção de macrófagos por Leishmania (Leishmania) amazonensis
 AULA PRÁTICA 3-02/06/2015 Roteiro de aula prática Infecção de macrófagos por Leishmania (Leishmania) amazonensis Macrófagos previamente plaqueados e infectados com formas promastigotas de Leishmania (Leishmania)
AULA PRÁTICA 3-02/06/2015 Roteiro de aula prática Infecção de macrófagos por Leishmania (Leishmania) amazonensis Macrófagos previamente plaqueados e infectados com formas promastigotas de Leishmania (Leishmania)
TÍTULO: DIFERENÇAS DE VOLUME SANGUÍNEO COLETADO E SUA INFLUÊNCIA NO HEMOGRAMA INSTITUIÇÃO: CENTRO UNIVERSITÁRIO DAS FACULDADES METROPOLITANAS UNIDAS
 TÍTULO: DIFERENÇAS DE VOLUME SANGUÍNEO COLETADO E SUA INFLUÊNCIA NO HEMOGRAMA CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: BIOMEDICINA INSTITUIÇÃO: CENTRO UNIVERSITÁRIO DAS FACULDADES
TÍTULO: DIFERENÇAS DE VOLUME SANGUÍNEO COLETADO E SUA INFLUÊNCIA NO HEMOGRAMA CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: BIOMEDICINA INSTITUIÇÃO: CENTRO UNIVERSITÁRIO DAS FACULDADES
Procedimentos Técnicos Código: PROHEM NOME FUNÇÃO ASSINATURA DATA ELABORADO POR
 Versão: 1 Pg: 1/6 NOME FUNÇÃO ASSINATURA DATA ELABORADO POR Dr. Renato L. Coordenador da Filho Qualidade 07/11/2016 DE ACORDO Dra. Débora Salles Supervisora da Qualidade 07/11/2016 APROVADO POR Dr. Renato
Versão: 1 Pg: 1/6 NOME FUNÇÃO ASSINATURA DATA ELABORADO POR Dr. Renato L. Coordenador da Filho Qualidade 07/11/2016 DE ACORDO Dra. Débora Salles Supervisora da Qualidade 07/11/2016 APROVADO POR Dr. Renato
44º Congresso Brasileiro de Análise Clínicas. Centro de Convenções de João Pessoa, PB - 11 a 14 de junho de 2017 WORKSHOP PNCQ
 44º Congresso Brasileiro de Análise Clínicas Centro de Convenções de João Pessoa, PB - 11 a 14 de junho de 2017 WORKSHOP PNCQ CONTROLE EXTERNO EM ROBSON FERREIRA FERRAZ SANTOS FARMACÊUTICO BIOQUÍMICO GRADUADO
44º Congresso Brasileiro de Análise Clínicas Centro de Convenções de João Pessoa, PB - 11 a 14 de junho de 2017 WORKSHOP PNCQ CONTROLE EXTERNO EM ROBSON FERREIRA FERRAZ SANTOS FARMACÊUTICO BIOQUÍMICO GRADUADO
Procedimentos de coleta de sangue. Práticas de Biomedicina ll Prof: Archangelo Padreca Fernandes
 Procedimentos de coleta de sangue Práticas de Biomedicina ll Prof: Archangelo Padreca Fernandes Fases da realização do exame Fase pré-analítica: 46-68% dos erros. Fase analítica: 7-13% dos erros. Fase
Procedimentos de coleta de sangue Práticas de Biomedicina ll Prof: Archangelo Padreca Fernandes Fases da realização do exame Fase pré-analítica: 46-68% dos erros. Fase analítica: 7-13% dos erros. Fase
Leucograma: Avaliação normal e alterações quantitativas
 Leucograma: Avaliação normal e alterações quantitativas Hemograma: Interpretação clínica e laboratorial do exame. NAC Núcleo de Aprimoramento Científico Jéssica Louise Benelli Leucograma O que é o leucograma?
Leucograma: Avaliação normal e alterações quantitativas Hemograma: Interpretação clínica e laboratorial do exame. NAC Núcleo de Aprimoramento Científico Jéssica Louise Benelli Leucograma O que é o leucograma?
Hemograma. Exame laboratorial que expressa a quantidade e a qualidade dos elementos figurados do sangue periférico em 1 microlitro
 Hemograma Exame laboratorial que expressa a quantidade e a qualidade dos elementos figurados do sangue periférico em 1 microlitro CBC = complete blood count Vantagens - Baixo custo - Avaliação inicial
Hemograma Exame laboratorial que expressa a quantidade e a qualidade dos elementos figurados do sangue periférico em 1 microlitro CBC = complete blood count Vantagens - Baixo custo - Avaliação inicial
Perfil Hematológico de ratos (Rattus novergicus linhagem Wistar) do Biotério da Universidade Luterana do Brasil
 Perfil Hematológico de ratos (Rattus novergicus linhagem Wistar) do Biotério da Universidade Luterana do Brasil Letícia da Silva, Médica Veterinária Residente em Patologia Clínica da Universidade Luterana
Perfil Hematológico de ratos (Rattus novergicus linhagem Wistar) do Biotério da Universidade Luterana do Brasil Letícia da Silva, Médica Veterinária Residente em Patologia Clínica da Universidade Luterana
ENFERMAGEM EXAMES LABORATORIAIS. Aula 2. Profª. Tatiane da Silva Campos
 ENFERMAGEM EXAMES LABORATORIAIS Aula 2 Profª. Tatiane da Silva Campos Leucograma - glóbulos brancos = papel na resposta imunológica - basófilos - Eosinófilos Granulócitos = polimorfonucleares; úteis na
ENFERMAGEM EXAMES LABORATORIAIS Aula 2 Profª. Tatiane da Silva Campos Leucograma - glóbulos brancos = papel na resposta imunológica - basófilos - Eosinófilos Granulócitos = polimorfonucleares; úteis na
TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED
 TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED I. COMENTÁRIOS A técnica parasitológica de TF-Test Conventional, utilizando o kit comercial TF- Test, foi avaliada para o
TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED I. COMENTÁRIOS A técnica parasitológica de TF-Test Conventional, utilizando o kit comercial TF- Test, foi avaliada para o
PROGRAMA DA DISCIPLINA
 UPE Campus Petrolina PROGRAMA DA DISCIPLINA 1. DADOS DA DISCIPLINA Curso: Bacharelado em Enfermagem Disciplina: Interpretação de Exames Laboratoriais Carga Horária: 45h. Semestre: 2016.2 Professora: Inalda
UPE Campus Petrolina PROGRAMA DA DISCIPLINA 1. DADOS DA DISCIPLINA Curso: Bacharelado em Enfermagem Disciplina: Interpretação de Exames Laboratoriais Carga Horária: 45h. Semestre: 2016.2 Professora: Inalda
Aulas e discussão dos casos.
 Aulas e discussão dos casos http://hematofmusp.weebly.com Hematologia Clínica Objetivos do curso Sintomas e Sinais Clínicos História e Exame Físico O que não está funcionando no Sistema Raciocínio Clínico
Aulas e discussão dos casos http://hematofmusp.weebly.com Hematologia Clínica Objetivos do curso Sintomas e Sinais Clínicos História e Exame Físico O que não está funcionando no Sistema Raciocínio Clínico
Sangue Prof. Dr. Ricardo Santos Simões Prof. Dr. Leandro Sabará de Mattos
 Sangue Prof. Dr. Ricardo Santos Simões Prof. Dr. Leandro Sabará de Mattos 1 Funções do sangue Local de formação do sangue Medula óssea (adulto) O sangue é um tecido conjuntivo líquido que circula pelo
Sangue Prof. Dr. Ricardo Santos Simões Prof. Dr. Leandro Sabará de Mattos 1 Funções do sangue Local de formação do sangue Medula óssea (adulto) O sangue é um tecido conjuntivo líquido que circula pelo
HEMOGRAMA COMPLETO Método : Análise realizada por Citometria de fluxo fluorescente e impedância "XE2100-Sysmex" Material: SANGUE TOTAL COM EDTA
 Unidade : VICENTE PIRES Página: 1/7 HEMOGRAMA COMPLETO Método : Análise realizada por Citometria de fluxo fluorescente e impedância "XE2100-Sysmex" Material: SANGUE TOTAL COM EDTA Eritrograma Valores de
Unidade : VICENTE PIRES Página: 1/7 HEMOGRAMA COMPLETO Método : Análise realizada por Citometria de fluxo fluorescente e impedância "XE2100-Sysmex" Material: SANGUE TOTAL COM EDTA Eritrograma Valores de
NOME FUNÇÃO ASSINATURA DATA. HISTÓRICO DAS REVISÕES Versão Revisado por Data Assinatura Aprovado por Data Assinatura
 Versão: 01 Pg: 1/5 NOME FUNÇÃO ASSINATURA DATA ELABORADO POR Dr. Ivo Gerente da Fernandes Qualidade 01/06/2011 DE ACORDO Dr. Renato de Lacerda Diretor Técnico 01/06/2011 APROVADO POR Dr. Jose Carlos dos
Versão: 01 Pg: 1/5 NOME FUNÇÃO ASSINATURA DATA ELABORADO POR Dr. Ivo Gerente da Fernandes Qualidade 01/06/2011 DE ACORDO Dr. Renato de Lacerda Diretor Técnico 01/06/2011 APROVADO POR Dr. Jose Carlos dos
DISCIPLINA DE HEMATOLOGIA HEMATÓCRITO
 DISCIPLINA DE HEMATOLOGIA HEMATÓCRITO Profª.: Aline Félix HEMATÓCRITO Indica a porcentagem do volume de glóbulos vermelhos presente em uma certa quantidade de sangue. Faz parte de um exame chamado de Hemograma
DISCIPLINA DE HEMATOLOGIA HEMATÓCRITO Profª.: Aline Félix HEMATÓCRITO Indica a porcentagem do volume de glóbulos vermelhos presente em uma certa quantidade de sangue. Faz parte de um exame chamado de Hemograma
INSUFICIÊNCIA HEPÁTICA AGUDA EM GATOS
 INSUFICIÊNCIA HEPÁTICA AGUDA EM GATOS Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria SUSPEITANDO DE INSUFICIÊNCIA HEPÁTICA AGUDA
INSUFICIÊNCIA HEPÁTICA AGUDA EM GATOS Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria SUSPEITANDO DE INSUFICIÊNCIA HEPÁTICA AGUDA
IPV.ESA Volume de Trabalho Total (horas): 132 Total Horas de Contacto: 60 T TP P PL Competências
 Unidade Curricular: Análises Clínicas Área Científica: Ciências Veterinárias Curso / Ciclo: Enfermagem Veterinária 1º Ciclo Docente Responsável: Diogo Moreira Rato Freire Themudo Ano Regime Tipo 2º Semestral
Unidade Curricular: Análises Clínicas Área Científica: Ciências Veterinárias Curso / Ciclo: Enfermagem Veterinária 1º Ciclo Docente Responsável: Diogo Moreira Rato Freire Themudo Ano Regime Tipo 2º Semestral
LABORATÓRIO BOM JESUS
 GLICEMIA...: 70 Material: Soro Metodo: Colorimetrico Valor de Referencia: 70 a 110,0 mg/dl CREATININA...: 0,57 Material:Soro Metodo : Picrato Alcalino Homens : 0,7 1,4 mg/dl Mulheres: 0,6 1,2 mg/dl Nota:
GLICEMIA...: 70 Material: Soro Metodo: Colorimetrico Valor de Referencia: 70 a 110,0 mg/dl CREATININA...: 0,57 Material:Soro Metodo : Picrato Alcalino Homens : 0,7 1,4 mg/dl Mulheres: 0,6 1,2 mg/dl Nota:
ANEMIA EM CÃES E GATOS
 ANEMIA EM CÃES E GATOS Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Departamento de Patologia Hospital Veterinário Universitário Universidade
ANEMIA EM CÃES E GATOS Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Departamento de Patologia Hospital Veterinário Universitário Universidade
Avaliação Hematológica, Interpretação e Importância em Nutrição
 Interpretação de Exames Laboratoriais Aplicados à Nutrição Clínica Avaliação Hematológica, Interpretação e Importância em Nutrição Prof. Marina Prigol 55% plasma 45% celulas: 99% Eritrócitos
Interpretação de Exames Laboratoriais Aplicados à Nutrição Clínica Avaliação Hematológica, Interpretação e Importância em Nutrição Prof. Marina Prigol 55% plasma 45% celulas: 99% Eritrócitos
Descrição do Procedimento VALOR (R$) Prazo de entrega Material enviado. Ácidos biliares totais (jejum ou pós prandial) 130,00 4 dias Soro sanguíneo
 Bioquímicos Ácidos biliares totais (jejum ou pós prandial) 130,00 4 dias Soro sanguíneo Ácidos biliares totais (2 dosagens- jejum e pós prandial) 250,00 4 dias Soro sanguíneo Ácido úrico 47,00 48 horas
Bioquímicos Ácidos biliares totais (jejum ou pós prandial) 130,00 4 dias Soro sanguíneo Ácidos biliares totais (2 dosagens- jejum e pós prandial) 250,00 4 dias Soro sanguíneo Ácido úrico 47,00 48 horas
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL
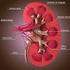 AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL AVALIAÇÃO LABORATORIAL DA FUNÇÃO RENAL 1. EXAME DE URINA Cor Aspecto Densidade urinária ph Glicosúria Proteinúria Pigmentos e Sais biliares Hemoglobinúria e Mioglobinúria
Análise Clínica No Data de Coleta: 22/03/2019 1/5 Prop...: RAIMUNDO JURACY CAMPOS FERRO Especie...: CANINA Fone...: 0
 Análise Clínica No.005048230 Data de Coleta: 22/03/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Análise Clínica No.005048230 Data de Coleta: 22/03/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Medico Vet..: HAYANNE K. N. MAGALHÃES Idade...: 11 Ano(s) CRMV...: 2588 Data da conclusão do laudo.:05/08/2019
 Análise Clínica No.005053808 Data de Coleta: 18/07/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Análise Clínica No.005053808 Data de Coleta: 18/07/2019 1/5 HEMOGRAMA COMPLETO Amostra: Sangue Total Método: Automação em equipamento Mindray BC- 2800 VET. Lâminas coradas (Panótico e Azul Cresil Brilhante).
Disciplina de Imunologia 2013 UNESP/FCAV-Jaboticabal. Msc: Ketherson Rodrigues Silva (Médico Veterinário) Orientador: Prof. Dr. Hélio José Montassier
 Disciplina de Imunologia 2013 UNESP/FCAV-Jaboticabal Msc: Ketherson Rodrigues Silva (Médico Veterinário) Orientador: Prof. Dr. Hélio José Montassier Antes de entrar no laboratório, o estudante deverá vestir
Disciplina de Imunologia 2013 UNESP/FCAV-Jaboticabal Msc: Ketherson Rodrigues Silva (Médico Veterinário) Orientador: Prof. Dr. Hélio José Montassier Antes de entrar no laboratório, o estudante deverá vestir
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012. Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano
 Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 1ª AULA PRÁTICA 1. Composição
Faculdade de Medicina da Universidade de Coimbra Ano Lectivo 2011/2012 Unidade Curricular de BIOQUÍMICA I Mestrado Integrado em MEDICINA 1º Ano ENSINO PRÁTICO E TEORICO-PRÁTICO 1ª AULA PRÁTICA 1. Composição
ORIENTAÇÕES PARA COLETA ACONDICIONAMENTO DAS AMOSTRAS DE SANGUE
 VetinLab ORIENTAÇÕES PARA COLETA ACONDICIONAMENTO DAS AMOSTRAS DE SANGUE PADRONIZAÇÃO DE TUBOS E COLETORES Como os resultados obtidos pelo laboratório são, em boa parte, consequência da qualidade das amostras
VetinLab ORIENTAÇÕES PARA COLETA ACONDICIONAMENTO DAS AMOSTRAS DE SANGUE PADRONIZAÇÃO DE TUBOS E COLETORES Como os resultados obtidos pelo laboratório são, em boa parte, consequência da qualidade das amostras
0. Situação de revisão: Situação Data Alteração Versão inicial Alterações no item 8.1 Gerar Folha de Trabalho
 1 de 6 0. Situação de revisão: Situação Data Alteração 0.0 23.11.2010 Versão inicial 0.1 09.02.2017 Alterações no item 8.1 Gerar Folha de Trabalho 1. Objetivo: Este documento descreve as etapas e requisitos
1 de 6 0. Situação de revisão: Situação Data Alteração 0.0 23.11.2010 Versão inicial 0.1 09.02.2017 Alterações no item 8.1 Gerar Folha de Trabalho 1. Objetivo: Este documento descreve as etapas e requisitos
Metodologias de Diagnóstico em Parasitologia
 Metodologias de Diagnóstico em Parasitologia 1) MÉTODOS PARASITOLÓGICOS MÉTODOS DIRETOS Tipo de amostra: a. Fezes Exame macroscópico Nesta análise é importante observar a presença de proglotes, vermes
Metodologias de Diagnóstico em Parasitologia 1) MÉTODOS PARASITOLÓGICOS MÉTODOS DIRETOS Tipo de amostra: a. Fezes Exame macroscópico Nesta análise é importante observar a presença de proglotes, vermes
2. Campo de Aplicação: Aplica-se ao setor técnico, na bancada de hematologia. 3. Responsabilidade: Técnicos e bioquímicos.
 1 de 11 0. Situação de revisão: Situação Data Alteração 0.0 11.04.2018 Versão inicial 0.1 25.05.2018 Inclusão do item 6.5.4 Instruções rápida de uso do Abx Micros e do anexo 8.6 Instruções do Aparelho
1 de 11 0. Situação de revisão: Situação Data Alteração 0.0 11.04.2018 Versão inicial 0.1 25.05.2018 Inclusão do item 6.5.4 Instruções rápida de uso do Abx Micros e do anexo 8.6 Instruções do Aparelho
Leucemias Agudas: 2. Anemia: na leucemia há sempre anemia, então esperamos encontrar valores diminuídos de hemoglobina, hematócrito e eritrócitos.
 Leucemias Agudas: Leucemias são disfunções graves da hematopoese, consideradas neoplasias hematológicas, que resultam em grandes alterações na composição do sangue. Na maioria das leucemias, todo o hemograma
Leucemias Agudas: Leucemias são disfunções graves da hematopoese, consideradas neoplasias hematológicas, que resultam em grandes alterações na composição do sangue. Na maioria das leucemias, todo o hemograma
O SANGUE HUMANO. Professora Catarina
 O SANGUE HUMANO Professora Catarina SANGUE Principais funções: Transportar O 2 e nutrientes a todas as células do corpo; Recolher CO 2 e excreções; Transportar hormônios; Proteger o corpo contra a invasão
O SANGUE HUMANO Professora Catarina SANGUE Principais funções: Transportar O 2 e nutrientes a todas as células do corpo; Recolher CO 2 e excreções; Transportar hormônios; Proteger o corpo contra a invasão
LABORATÓRIO BOM JESUS
 GLICEMIA...: 64 Material: Soro Metodo: Colorimetrico Valor de Referencia: 70 a 110,0 mg/dl Observacoes: Repetido e confirmado. GRUPO SANGUINEO Aglutinacao FATOR RH Aglutinacao A NEGATIVO PARCIAL DE URINA
GLICEMIA...: 64 Material: Soro Metodo: Colorimetrico Valor de Referencia: 70 a 110,0 mg/dl Observacoes: Repetido e confirmado. GRUPO SANGUINEO Aglutinacao FATOR RH Aglutinacao A NEGATIVO PARCIAL DE URINA
FACULDADE PITÁGORAS TÓPICOS ESPECIAIS EM NUTRIÇÃO I SOLICITAÇÃO E INTERPRETAÇÃO DE EXAMES LABORATORIAIS
 FACULDADE PITÁGORAS TÓPICOS ESPECIAIS EM NUTRIÇÃO I SOLICITAÇÃO E INTERPRETAÇÃO DE EXAMES LABORATORIAIS Profª. MSc. Karla Vanessa do Nascimento Silva Exames Bioquímicos Utilizados como complemento das
FACULDADE PITÁGORAS TÓPICOS ESPECIAIS EM NUTRIÇÃO I SOLICITAÇÃO E INTERPRETAÇÃO DE EXAMES LABORATORIAIS Profª. MSc. Karla Vanessa do Nascimento Silva Exames Bioquímicos Utilizados como complemento das
8/10/2009. Líquidos Cavitários
 Líquidos Cavitários Física e Química cor / transparência proteínas bilirrubina, uréia, triglicerídeos, amilase Avaliação Citológica n o células nucleadas diferencial GRAM 1 Células Encontradas célula mesotelial
Líquidos Cavitários Física e Química cor / transparência proteínas bilirrubina, uréia, triglicerídeos, amilase Avaliação Citológica n o células nucleadas diferencial GRAM 1 Células Encontradas célula mesotelial
Prof. Ms. Elton Pallone de Oliveira. Exames laboratoriais: definição, tipos, indicação, cuidados pré e pós exame. Urinálise
 Exames laboratoriais: definição, tipos, indicação, cuidados pré e pós exame. Urinálise Objetivos Saber a definição, tipos, indicações e principais cuidados pré e pós exame de urinálise e parasitológico.
Exames laboratoriais: definição, tipos, indicação, cuidados pré e pós exame. Urinálise Objetivos Saber a definição, tipos, indicações e principais cuidados pré e pós exame de urinálise e parasitológico.
Material: Sangue c/edta Método..: Citometria/Automatizado e estudo morfológico em esfregaço corado
 HEMOGRAMA COMPLETO Material: Sangue c/edta Método..: Citometria/Automatizado e estudo morfológico em esfregaço corado ERITROGRAMA V.R: Homens Mulheres Hemacias em milhoes/mm3...: 5,38 4,5 a 5,9 4,0 a 5,4
HEMOGRAMA COMPLETO Material: Sangue c/edta Método..: Citometria/Automatizado e estudo morfológico em esfregaço corado ERITROGRAMA V.R: Homens Mulheres Hemacias em milhoes/mm3...: 5,38 4,5 a 5,9 4,0 a 5,4
PLANO DE APRENDIZAGEM. CH Teórica: 40h CH Prática: 20h CH Total: 60h Créditos: 03 Pré-requisito(s): Período: IV Ano:
 PLANO DE APRENDIZAGEM 1. DADOS DE IDENTIFICAÇÃO: Curso: Bacharelado em Biomedicina Disciplina: Hematologia Básica Código: BIO35 Professor: Isabela Farias E-mail: isabela.farias@fasete.edu.br CH : 40h CH
PLANO DE APRENDIZAGEM 1. DADOS DE IDENTIFICAÇÃO: Curso: Bacharelado em Biomedicina Disciplina: Hematologia Básica Código: BIO35 Professor: Isabela Farias E-mail: isabela.farias@fasete.edu.br CH : 40h CH
HEMOGRAMA LUCAS WILBERT MARILIA DE N. C. BERGAMASCHI
 HEMOGRAMA ERITROGRAMA Hemácias milhões/mm3...: 4,67 4,00 a 5,10 Hemoglobina g/dl...: 13,00 11,20 a 15,10 Hematócrito %...: 37,80 34,00 a 43,00 Vol. Glob. Média em fl...: 80,94 78,00 a 92,00 Hem. Glob.
HEMOGRAMA ERITROGRAMA Hemácias milhões/mm3...: 4,67 4,00 a 5,10 Hemoglobina g/dl...: 13,00 11,20 a 15,10 Hematócrito %...: 37,80 34,00 a 43,00 Vol. Glob. Média em fl...: 80,94 78,00 a 92,00 Hem. Glob.
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária PAINEL TEMÁTICO: Parasitoses em cordeiros desmamados
 Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária PAINEL TEMÁTICO: Parasitoses em cordeiros desmamados Pelotas, abril de 2017. Doutorando Med. Vet. Lucas Balinhas Acadêmica
Universidade Federal de Pelotas Núcleo de Pesquisa, Ensino e Extensão em Pecuária PAINEL TEMÁTICO: Parasitoses em cordeiros desmamados Pelotas, abril de 2017. Doutorando Med. Vet. Lucas Balinhas Acadêmica
RESULTADOS DOS PACIENTES HANSENIANOS
 Anexo 1 RESULTADOS DOS PACIENTES HANSENIANOS Anexo 1 RESULTADOS DOS PACIENTES HANSENIANOS Anexo 1a - RESULTADOS DOS PACIENTES HANSENIANOS Anexo 1a - RESULTADOS DOS PACIENTES HANSENIANOS Anexo 2 - RESULTADOS
Anexo 1 RESULTADOS DOS PACIENTES HANSENIANOS Anexo 1 RESULTADOS DOS PACIENTES HANSENIANOS Anexo 1a - RESULTADOS DOS PACIENTES HANSENIANOS Anexo 1a - RESULTADOS DOS PACIENTES HANSENIANOS Anexo 2 - RESULTADOS
VDRL Data de Coleta: 05/11/2015
 VDRL Data de Coleta: 05/11/2015 Método: FLOCULAÇÃO Resultado...: Não reagente Valor de referência: Não Reagente Endereço: QD 06 CL 20, Lojas 1,2,5 e 6 - Sobradinho -DF. Tel: (61) 3387 4499. Página: 1 de
VDRL Data de Coleta: 05/11/2015 Método: FLOCULAÇÃO Resultado...: Não reagente Valor de referência: Não Reagente Endereço: QD 06 CL 20, Lojas 1,2,5 e 6 - Sobradinho -DF. Tel: (61) 3387 4499. Página: 1 de
GRUPO SANGUÍNEO e FATOR Rh VDRL. ANTÍGENO p24 e ANTICORPOS ANTI HIV1 + HIV2. Grupo Sanguíneo: "O" Fator Rh: Positivo. Resultado: Não Reagente
 GRUPO SANGUÍNEO e FATOR Rh Grupo Sanguíneo: "O" Fator Rh: Positivo Método: Aglutinação Material: Sangue Edta Exame assinado por Dr. Mauricio Carvalho Campos CRBM 0600 em 27/06/2013 às 17:54h VDRL Não Reagente
GRUPO SANGUÍNEO e FATOR Rh Grupo Sanguíneo: "O" Fator Rh: Positivo Método: Aglutinação Material: Sangue Edta Exame assinado por Dr. Mauricio Carvalho Campos CRBM 0600 em 27/06/2013 às 17:54h VDRL Não Reagente
Bactéria isolada: Não houve crescimento bacteriano nos meios utilizados. Bactéria isolada: Não houve crescimento bacteriano nos meios utilizados
 STREPTOCOCCUS B. HEMOLÍTICO, CULTURA Bactéria isolada: Não houve crescimento bacteriano nos meios utilizados Meios utilizados: Ágar chrom ID, Strepto B Material : Swab anal STREPTOCOCCUS B. HEMOLÍTICO,
STREPTOCOCCUS B. HEMOLÍTICO, CULTURA Bactéria isolada: Não houve crescimento bacteriano nos meios utilizados Meios utilizados: Ágar chrom ID, Strepto B Material : Swab anal STREPTOCOCCUS B. HEMOLÍTICO,
CURSO DE FARMÁCIA Autorizado pela Portaria nº 991 de 01/12/08 DOU Nº 235 de 03/12/08 Seção 1. Pág. 35 PLANO DE CURSO
 CURSO DE FARMÁCIA Autorizado pela Portaria nº 991 de 01/12/08 DOU Nº 235 de 03/12/08 Seção 1. Pág. 35 Componente Curricular: Hematologia Clínica Código: FAR - 121 Pré-requisito: Sem pré-requisitos Período
CURSO DE FARMÁCIA Autorizado pela Portaria nº 991 de 01/12/08 DOU Nº 235 de 03/12/08 Seção 1. Pág. 35 Componente Curricular: Hematologia Clínica Código: FAR - 121 Pré-requisito: Sem pré-requisitos Período
Material: Sangue c/edta Método..: Citometria/Automatizado e estudo morfológico em esfregaço corado
 HEMOGRAMA COMPLETO Material: Sangue c/edta Método..: Citometria/Automatizado e estudo morfológico em esfregaço corado ERITROGRAMA V.R: Homens Mulheres Hemacias em milhoes/mm3...: 6,31 4,5 a 5,9 4,0 a 5,4
HEMOGRAMA COMPLETO Material: Sangue c/edta Método..: Citometria/Automatizado e estudo morfológico em esfregaço corado ERITROGRAMA V.R: Homens Mulheres Hemacias em milhoes/mm3...: 6,31 4,5 a 5,9 4,0 a 5,4
Doença dos Eritrócitos
 Doença dos Eritrócitos Avaliação laboratorial dos Eritrócitos Introdução... 2 Coleta de amostra de Sangue... 4 A Avaliação do Eritrogramaa... 4 O Esfregaço do Sangue Periférico... 5 1 AVALIAÇÃ ÃO LABORATORIAL
Doença dos Eritrócitos Avaliação laboratorial dos Eritrócitos Introdução... 2 Coleta de amostra de Sangue... 4 A Avaliação do Eritrogramaa... 4 O Esfregaço do Sangue Periférico... 5 1 AVALIAÇÃ ÃO LABORATORIAL
UrináliseSedimentoscopia
 UrináliseSedimentoscopia FTC- Curso de Enfermagem Profa. Astria Ferrão 2018 3. Exame microscópico (sedimentoscopia) Células epiteliais Hemácias Leucócitos Cilindros Cristais Microrganismos Outros elementos.
UrináliseSedimentoscopia FTC- Curso de Enfermagem Profa. Astria Ferrão 2018 3. Exame microscópico (sedimentoscopia) Células epiteliais Hemácias Leucócitos Cilindros Cristais Microrganismos Outros elementos.
LABORATÓRIO BOM JESUS
 UREIA...: 27 Material: Soro Metodo : Urease/GluDH Valor de Referencia: 15 a 38 mg/dl CREATININA...: 0,59 Material:Soro Metodo : Picrato Alcalino Valores de Referencia: Homens : 0,7-1,4 mg/dl Mulheres:
UREIA...: 27 Material: Soro Metodo : Urease/GluDH Valor de Referencia: 15 a 38 mg/dl CREATININA...: 0,59 Material:Soro Metodo : Picrato Alcalino Valores de Referencia: Homens : 0,7-1,4 mg/dl Mulheres:
Hematologia Geral. Anemias Classificação Morfológica das Anemias NORMOCÍTICAS MICROCÍTICAS E E MACROCÍTICAS NORMOCRÔMICAS HIPOCRÔMICAS SIDEROBLÁSTICA
 Anemias Microcíticas e Hipocrômicas. Anemias Classificação Morfológica das Anemias ANEMIAS VCM HCM CHCM ANEMIAS NORMOCÍTICAS MICROCÍTICAS E E MACROCÍTICAS NORMOCRÔMICAS HIPOCRÔMICAS HEMOLÍTICA NÃO HEMOLÍTICA
Anemias Microcíticas e Hipocrômicas. Anemias Classificação Morfológica das Anemias ANEMIAS VCM HCM CHCM ANEMIAS NORMOCÍTICAS MICROCÍTICAS E E MACROCÍTICAS NORMOCRÔMICAS HIPOCRÔMICAS HEMOLÍTICA NÃO HEMOLÍTICA
TABELA DE PREÇOS. BIOQUÍMICA SÉRICA VALOR MATERIAL PRAZO Ácidos biliares totais (jejum) 115,00 Soro sanguíneo 5 dias
 TABELA DE PREÇOS ANÁLISE CITOLÓGICA VALOR MATERIAL PRAZO Líquidos cavitários (pleural, pericárdico e peritoneal) 100,00 Fluido em tubo seco e EDTA 24 horas Líquor 100,00 Fluido em tubo seco 24 horas Citologia
TABELA DE PREÇOS ANÁLISE CITOLÓGICA VALOR MATERIAL PRAZO Líquidos cavitários (pleural, pericárdico e peritoneal) 100,00 Fluido em tubo seco e EDTA 24 horas Líquor 100,00 Fluido em tubo seco 24 horas Citologia
Método: RESISTIVIDADE - IMPEDÂNCIA - MICROSCOPIA
 HEMOGRAMA COMPLETO Método: RESISTIVIDADE - IMPEDÂNCIA - MICROSCOPIA ERITOGRAMA: Referências Hemácias...: 5,19 milhões/mm³ 4,3 a 6,0 milhões/mm³ Hemoglobina...: 14,6 g/dl 13,5 a 17,8 g/dl Hematócrito...:
HEMOGRAMA COMPLETO Método: RESISTIVIDADE - IMPEDÂNCIA - MICROSCOPIA ERITOGRAMA: Referências Hemácias...: 5,19 milhões/mm³ 4,3 a 6,0 milhões/mm³ Hemoglobina...: 14,6 g/dl 13,5 a 17,8 g/dl Hematócrito...:
TECIDO HEMATOPOIÉTICO E SANGUÍNEO
 TECIDO HEMATOPOIÉTICO E SANGUÍNEO CARACTERÍSTICAS Denomina-se hematopoiese o processo de formação dos elementos figurados do sangue; A hematopoiese antes do nascimento ocorre no saco vitelínico do embrião
TECIDO HEMATOPOIÉTICO E SANGUÍNEO CARACTERÍSTICAS Denomina-se hematopoiese o processo de formação dos elementos figurados do sangue; A hematopoiese antes do nascimento ocorre no saco vitelínico do embrião
Escola: Nome: Turma: N.º: Data: / / FICHA DE TRABALHO 1A. leucócitos figurados dissolvidas. água eritrócitos nutrientes. plasma plaquetas metabolismo
 Conteúdo: Sangue FICHA DE TRABALHO 1A leucócitos figurados dissolvidas água eritrócitos nutrientes plasma plaquetas metabolismo O sangue é constituído por uma parte líquida, o, que transporta, em suspensão,
Conteúdo: Sangue FICHA DE TRABALHO 1A leucócitos figurados dissolvidas água eritrócitos nutrientes plasma plaquetas metabolismo O sangue é constituído por uma parte líquida, o, que transporta, em suspensão,
HBS-Ag - Antígeno Austrália Material: Soro VALOR DE REFERÊNCIA RESULTADO: SORO NÃO REAGENTE Soro Não Reagente TRANSAMINASE OXALACETICA (TGO)
 HBS-Ag - Antígeno Austrália VALOR DE REFERÊNCIA RESULTADO: SORO NÃO REAGENTE Soro Não Reagente Página: 1 de 6 Nota: Este é um teste de triagem, cujo resultado, em caso de positividade não pode ser considerado
HBS-Ag - Antígeno Austrália VALOR DE REFERÊNCIA RESULTADO: SORO NÃO REAGENTE Soro Não Reagente Página: 1 de 6 Nota: Este é um teste de triagem, cujo resultado, em caso de positividade não pode ser considerado
ESPECIALIZAÇÃO EM HEMATOLOGIA E BANCO DE SANGUE. Aulas Teóricas: On Line Práticas: Presenciais
 ESPECIALIZAÇÃO EM HEMATOLOGIA E BANCO DE SANGUE Aulas Teóricas: On Line Práticas: Presenciais Início: 21/05/2016 Término: 23/09/2017 PROGRAMAÇÃO DO CURSO 1ª AULA PRESENÇA OBRIGATÓRIA (P) 21 e 22 de maio
ESPECIALIZAÇÃO EM HEMATOLOGIA E BANCO DE SANGUE Aulas Teóricas: On Line Práticas: Presenciais Início: 21/05/2016 Término: 23/09/2017 PROGRAMAÇÃO DO CURSO 1ª AULA PRESENÇA OBRIGATÓRIA (P) 21 e 22 de maio
1/100 RP Universidade de São Paulo 1/1 INSTRUÇÕES PROCESSO SELETIVO PARA INÍCIO EM ª FASE: GRUPO 5: VETERINÁRIA
 1/100 1 1/1 RP 2018 2ª Fase Prova Dissertativa P2 (08/10/2017) ASSINATURA DO CANDIDATO I Universidade de São Paulo Brasil FABDEÇGH ABUIJKLUNÁKUE PEKE H IJLNUQAREK CO34556O 78 98547:;C4< 3M=T4>9O?4554O;
1/100 1 1/1 RP 2018 2ª Fase Prova Dissertativa P2 (08/10/2017) ASSINATURA DO CANDIDATO I Universidade de São Paulo Brasil FABDEÇGH ABUIJKLUNÁKUE PEKE H IJLNUQAREK CO34556O 78 98547:;C4< 3M=T4>9O?4554O;
Ciências Naturais, 6º Ano. Ciências Naturais, 6º Ano FICHA DE TRABALHO 1A. Escola: Nome: Turma: N.º: Escola: Nome: Turma: N.º: Conteúdo: Sangue
 Conteúdo: Sangue FICHA DE TRABALHO 1A leucócitos figurados dissolvidas Conteúdo: Sangue FICHA DE TRABALHO 1A leucócitos figurados dissolvidas água eritrócitos nutrientes água eritrócitos nutrientes plasma
Conteúdo: Sangue FICHA DE TRABALHO 1A leucócitos figurados dissolvidas Conteúdo: Sangue FICHA DE TRABALHO 1A leucócitos figurados dissolvidas água eritrócitos nutrientes água eritrócitos nutrientes plasma
INSTITUTO FORMAÇÃO Cursos Técnicos Profissionalizantes. Professora: Flávia Soares Disciplina: Imunologia Aluno (a): INTERPRETAÇÃO DO HEMOGRAMA
 INSTITUTO FORMAÇÃO Cursos Técnicos Profissionalizantes. Professora: Flávia Soares Disciplina: Imunologia Aluno (a): INTERPRETAÇÃO DO HEMOGRAMA Autor: Pedro Pinheiro» Artigo atualizado em 12 de fevereiro
INSTITUTO FORMAÇÃO Cursos Técnicos Profissionalizantes. Professora: Flávia Soares Disciplina: Imunologia Aluno (a): INTERPRETAÇÃO DO HEMOGRAMA Autor: Pedro Pinheiro» Artigo atualizado em 12 de fevereiro
PUBVET, Publicações em Medicina Veterinária e Zootecnia. Avaliação hematológica em cães errantes da região urbana de Maringá-PR
 PUBVET, Publicações em Medicina Veterinária e Zootecnia. Avaliação hematológica em cães errantes da região urbana de Maringá-PR Rejane Machado Cardozo 1, Raquel Reis 1, Maria José Baptista Barbosa 1, Camila
PUBVET, Publicações em Medicina Veterinária e Zootecnia. Avaliação hematológica em cães errantes da região urbana de Maringá-PR Rejane Machado Cardozo 1, Raquel Reis 1, Maria José Baptista Barbosa 1, Camila
ERITROGRAMA HEMOGRAMA 24/09/2010 INTERPRETAÇÃO DE EXAMES LABORATORIAIS EM NEONATOLOGIA E PEDIATRIA HEMOGRAMA HEMATOPOIESE HEMATOPOIESE
 INTERPRETAÇÃO DE EXAMES LABORATORIAIS EM NEONATOLOGIA E PEDIATRIA Edivan Rodrigo de Paula Ramos Mestre em Ciências Farmacêuticas - UEM Doutorando em Biologia Celular - UEM Farmacêutico e Bioquímico CRF
INTERPRETAÇÃO DE EXAMES LABORATORIAIS EM NEONATOLOGIA E PEDIATRIA Edivan Rodrigo de Paula Ramos Mestre em Ciências Farmacêuticas - UEM Doutorando em Biologia Celular - UEM Farmacêutico e Bioquímico CRF
Já neste mês estará disponível a troca do LOGIN e
 Novidade no acesso aos resultados on-line Já neste mês estará disponível a troca do LOGIN e SENHA para os resultados on line. Estamos assim concretizando um dos pedidos mais recorrentes em nossa pesquisa
Novidade no acesso aos resultados on-line Já neste mês estará disponível a troca do LOGIN e SENHA para os resultados on line. Estamos assim concretizando um dos pedidos mais recorrentes em nossa pesquisa
PATOLOGIA DO SISTEMA HEMATOPOIÉTICO
 PATOLOGIA DO SISTEMA HEMATOPOIÉTICO Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria LEUCEMIA LINFOBLÁSTICA AGUDA EM GATOS Rafael
PATOLOGIA DO SISTEMA HEMATOPOIÉTICO Rafael Fighera Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal de Santa Maria LEUCEMIA LINFOBLÁSTICA AGUDA EM GATOS Rafael
BAIRRO NOVA VIDA LUANDA. Observaram-se raros eritrócitos em alvo.
 Dra. Ana Sousa Direcção Técnica BAIRRO NOVA VIDA LUANDA Colheita: 08-07-2015 Relatório Final: 10-07-2015 Emissão: 10-07-2015 Posto: GMLAB Destino: E-mail 35 Anos PARTICULAR Requisitado por: Dr.(a) MARCOS
Dra. Ana Sousa Direcção Técnica BAIRRO NOVA VIDA LUANDA Colheita: 08-07-2015 Relatório Final: 10-07-2015 Emissão: 10-07-2015 Posto: GMLAB Destino: E-mail 35 Anos PARTICULAR Requisitado por: Dr.(a) MARCOS
UNIVERSIDADE FEDERAL DE GOIÁS CAMPUS JATAÍ UNIDADE JATOBÁ. Carga Horária Total Carga Horária Semestral Ano Letivo 48 hs Teórica: 32 Prática:
 UNIVERSIDADE FEDERAL DE GOIÁS CAMPUS JATAÍ UNIDADE JATOBÁ 1- DADOS DE IDENTIFICAÇÃO CURSO: MEDICINA VETERINÁRIA DISCIPLINA: LABORATÓRIO CLÍNICO VETERINÁRIO DEPARTAMENTO: CAMPUS JATAÍ PRÉ-REQUISITO: disciplina
UNIVERSIDADE FEDERAL DE GOIÁS CAMPUS JATAÍ UNIDADE JATOBÁ 1- DADOS DE IDENTIFICAÇÃO CURSO: MEDICINA VETERINÁRIA DISCIPLINA: LABORATÓRIO CLÍNICO VETERINÁRIO DEPARTAMENTO: CAMPUS JATAÍ PRÉ-REQUISITO: disciplina
Tecido Conjuntivo de Transporte
 Tecido Conjuntivo de Transporte Prof. a Sara Tatiana Moreira, Ph.D. UTFPR Campus Santa Helena 1 Elástico 1 Tecido Sanguíneo O sangue está contido em um compartimento fechado - aparelho circulatório - que
Tecido Conjuntivo de Transporte Prof. a Sara Tatiana Moreira, Ph.D. UTFPR Campus Santa Helena 1 Elástico 1 Tecido Sanguíneo O sangue está contido em um compartimento fechado - aparelho circulatório - que
Método: RESISTIVIDADE - IMPEDÂNCIA - MICROSCOPIA
 HEMOGRAMA COMPLETO Método: RESISTIVIDADE - IMPEDÂNCIA - MICROSCOPIA ERITOGRAMA: Referências Hemácias...: 4,19 milhões/mm³ 3,9 a 5,3 milhões/mm³ Hemoglobina...: 12,6 g/dl 12,0 a 16,0 g/dl Hematócrito...:
HEMOGRAMA COMPLETO Método: RESISTIVIDADE - IMPEDÂNCIA - MICROSCOPIA ERITOGRAMA: Referências Hemácias...: 4,19 milhões/mm³ 3,9 a 5,3 milhões/mm³ Hemoglobina...: 12,6 g/dl 12,0 a 16,0 g/dl Hematócrito...:
LEUCOGRAMA O que realmente precisamos saber?
 LEUCOGRAMA O que realmente precisamos saber? Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal
LEUCOGRAMA O que realmente precisamos saber? Prof. Rafael Fighera Serviço de Consultoria Diagnóstica Veterinária Laboratório de Patologia Veterinária Hospital Veterinário Universitário Universidade Federal
EFEITO DA CONDIÇÃO CORPORAL SOBRE A DINÂMICA DE HEMOGRAMA NO PERIPARTO DE VACAS DA RAÇA HOLANDÊS
 UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE VETERINÁRIA NUCLEO DE PESQUISA, ENSINO E EXTENSÃO EM PECUÁRIA EFEITO DA CONDIÇÃO CORPORAL SOBRE A DINÂMICA DE HEMOGRAMA NO PERIPARTO DE VACAS DA RAÇA HOLANDÊS
UNIVERSIDADE FEDERAL DE PELOTAS FACULDADE DE VETERINÁRIA NUCLEO DE PESQUISA, ENSINO E EXTENSÃO EM PECUÁRIA EFEITO DA CONDIÇÃO CORPORAL SOBRE A DINÂMICA DE HEMOGRAMA NO PERIPARTO DE VACAS DA RAÇA HOLANDÊS
Data de liberação: 02/02/ :55
 GLICOSE Glicose: 82 mg/dl 70-99 Método: Enzimático (GOD-POD) - Fusion - Química Seca Nota: Valor de referência alterado em 30/12/2003 segundo recomendação da Associação Americana de Diabetes (Diabetes
GLICOSE Glicose: 82 mg/dl 70-99 Método: Enzimático (GOD-POD) - Fusion - Química Seca Nota: Valor de referência alterado em 30/12/2003 segundo recomendação da Associação Americana de Diabetes (Diabetes
HEMOGRAMA COMPLETO Material: Sangue Total Método : Automação: ABX MICROS 60 REFERÊNCIAS
 Setor: HEMATOLOGIA HEMOGRAMA COMPLETO Total Método : Automação: ABX MICROS 60 SÉRIE VERMELHA HEMATÓCRITO... 49,8 % MASCULINO: 39 a 54 FEMININO : 37 a 46 HEMÁCIAS... 5,67 milhões/mm³ MASCULINO: 4,5 a 6
Setor: HEMATOLOGIA HEMOGRAMA COMPLETO Total Método : Automação: ABX MICROS 60 SÉRIE VERMELHA HEMATÓCRITO... 49,8 % MASCULINO: 39 a 54 FEMININO : 37 a 46 HEMÁCIAS... 5,67 milhões/mm³ MASCULINO: 4,5 a 6
Curso: FARMÁCIA Disciplina: Bioquímica Clínica Título da Aula: Doseamento de Uréia, Creatinina, AST e ALT. Professor: Dr.
 Curso: FARMÁCIA Disciplina: Bioquímica Clínica Título da Aula: Doseamento de Uréia, Creatinina, AST e ALT. Professor: Dr. Fernando Ananias NOME: RGM: ATIVIDADE PRÁTICA 2 1) DETERMINAÇÃO DE URÉIA E CREATININA
Curso: FARMÁCIA Disciplina: Bioquímica Clínica Título da Aula: Doseamento de Uréia, Creatinina, AST e ALT. Professor: Dr. Fernando Ananias NOME: RGM: ATIVIDADE PRÁTICA 2 1) DETERMINAÇÃO DE URÉIA E CREATININA
Urinálise Sedimentoscopia Identificação
 Caso Clínico Item EAS04 Paciente feminino, 8 anos foi levada pela mãe ao hospital com evidente edema nas pernas. Foram solicitados exames de rotina para avaliação do quadro da paciente entre estes o Exame
Caso Clínico Item EAS04 Paciente feminino, 8 anos foi levada pela mãe ao hospital com evidente edema nas pernas. Foram solicitados exames de rotina para avaliação do quadro da paciente entre estes o Exame
Elementos do hemograma
 Elementos do hemograma Thais Schwarz Gaggini Médica Veterinária, Msc., Dra. ELEMENTOS DO HEMOGRAMA CONTEÚDOS DE AULA 1) Leucometria global; 2) Leucometria diferencial; 3) Alteração morfológica de leucócitos;
Elementos do hemograma Thais Schwarz Gaggini Médica Veterinária, Msc., Dra. ELEMENTOS DO HEMOGRAMA CONTEÚDOS DE AULA 1) Leucometria global; 2) Leucometria diferencial; 3) Alteração morfológica de leucócitos;
Colheita e manuseamento de fluidos biológicos
 Colheita e manuseamento de fluidos biológicos Na aula de hoje, vamos falar de: 1. Importância da análise de amostras biológicas como ferramentas de diagnóstico 2. Composição dos dois fluidos mais analisados:
Colheita e manuseamento de fluidos biológicos Na aula de hoje, vamos falar de: 1. Importância da análise de amostras biológicas como ferramentas de diagnóstico 2. Composição dos dois fluidos mais analisados:
