MINISTÉRIO DA SAÚDE FUNDAÇÃO OSWALDO CRUZ INSTITUTO OSWALDO CRUZ PÓS-GRADUAÇÃO EM BIOLOGIA PARASITÁRIA
|
|
|
- Alexandra Ruth Santiago Marinho
- 8 Há anos
- Visualizações:
Transcrição
1 MINISTÉRIO DA SAÚDE FUNDAÇÃO OSWALDO CRUZ INSTITUTO OSWALDO CRUZ PÓS-GRADUAÇÃO EM BIOLOGIA PARASITÁRIA APOPTOSE E PERFIL DO REPERTÓRIO DA CADEIA VARIÁVEL ΒETA DO RECEPTOR DE CÉLULAS T EM LINFÓCITOS T CD8 + DE PACIENTES COM LEISHMANIOSE CUTÂNEA RAQUEL FERRAZ NOGUEIRA Rio de Janeiro 2011
2 INSTITUTO OSWALDO CRUZ Pós-Graduação em Biologia Celular e Molecular RAQUEL FERRAZ NOGUEIRA APOPTOSE E PERFIL DO REPERTÓRIO DA CADEIA VARIÁVEL ΒETA DO RECEPTOR DE CÉLULAS T EM LINFÓCITOS T CD8 + DE PACIENTES COM LEISHMANIOSE CUTÂNEA Dissertação apresentada ao Programa de Pósgraduação em Biologia Parasitária do Instituto Oswaldo Cruz, como requisito parcial para a obtenção do grau de Mestre, área de concentração: Imunologia e Patogenia Orientador: Dr. Álvaro Luiz Bertho dos Santos Rio de Janeiro 2011 ii
3 INSTITUTO OSWALDO CRUZ Pós-Graduação em Biologia Celular e Molecular APOPTOSE E PERFIL DO REPERTÓRIO DA CADEIA VARIÁVEL ΒETA DO RECEPTOR DE CÉLULAS T EM LINFÓCITOS T CD8 + DE PACIENTES COM LEISHMANIOSE CUTÂNEA AUTORA: RAQUEL FERRAZ NOGUEIRA ORIENTADOR: DR. ÁLVARO LUIZ BERTHO DOS SANTOS Banca Examinadora: Dra. Alda Maria da Cruz Instituto Oswaldo Cruz Fiocruz, RJ Dra. Andrea Henriques Pons Instituto Oswaldo Cruz Fiocruz, RJ Dr. Jorge Clarêncio Souza Andrade Centro de Pesquisa Gonçalo Muniz Fiocruz, BA Rio de Janeiro 2011 iii
4 AGRADECIMENTOS Ao meu orientador, Dr. Álvaro Luiz Bertho dos Santos, grande influência para a minha formação profissional e quem me deu a oportunidade e o privilégio de iniciar a carreira na FIOCRUZ. Obrigada pelas aulas de imunologia, de leishmaniose e de citometria de citometria de fluxo. Sua atenção, paciência e incentivo alimentaram a minha dedicação e envolvimento neste trabalho que você me confiou. Gratidão e amizade eterna; Agradeço à Clarissa Ferreira, fundamental em muitas etapas deste trabalho, sempre disposta a ajudar. Ganhei a oportunidade de ensiná-la o pouco que sei e tive o privilégio de aprender muito. Em pouco tempo se tornou uma grande companheira e amiga; Aos meus pais, agradeço o amor e carinho incondicionais, a confiança, o incentivo constante e o investimento de sempre na minha vida acadêmica. Agradeço a vocês e a minha irmã, Bianca Ferraz, por compreenderem a minha ausência nestes últimos anos e por me encorajar nos momentos difíceis; Aos amigos da turma de mestrado em Biologia Parasitaria ( ); À Tatiana Cury, Renata Ferraz, Mariana Faria, Thais Miquelino, Raquel Sepulveda e Bianca Ferraz, que moraram comigo e acompanharam de perto meu estudo; Aos pacientes que aceitaram participar deste estudo e aos voluntários sadios: obrigada pela doação das amostras de sangue periférico! Agradeço à equipe do Centro de Referência de Leishmanioses e do Ambulatório do IPEC: Dr. Armando Schubach, Dra. Claudia Valete, Dr. Marcelo Rosandisk, à equipe de Coleta do ambulatório, à Ginelza Perez, à Michelle Moreira, e em especial à Dra. Maria Inês Pimentel por disponibilizar o acesso às informações clínicas e epidemiológicas dos pacientes; À pós-graduação em Biologia Parasitária e sua equipe; À Plataforma de Citometria de Fluxo do IOC, à Dra. Andrea Henriques Pons e ao Alessandro Marins; À Plataforma de Citometria de Fluxo do PDTIS, à Dra Íris Marins Peixoto e ao Dr. Geraldo Pereira; A todos que fazem, ou fizeram, parte do laboratório de imunoparasitologia do IOC, pesquisadores, alunos e técnicos. A convivência com estas pessoas alimentou a minha alegria em trabalhar aqui; Ao Dr. Sérgio Mendonça, pela atenção, incentivo e pelas sugestões; iv
5 À Dra Léa Cysne pelas palavras amorosas de sempre e à Dra Fátima Conceição pelas sugestões e apoio antes das minhas apresentações; À Rosa Plácido agradeço pelo material necessário para a execução dos experimentos; e à Vera e à Rose, sempre bem humoradas. Obrigada pela atenção e disponibilidade em ajudar; À Thalita e a Simone, que foram tão atenciosas em, muitas vezes, trazer as amostras de sangue pra mim; À Simone agradeço ainda pela coleta das amostras de sangue dos voluntários sadios, assim como ao Ricardo Nogueira e à Dra Joseli Ferreira; Agradeço ao Juan Camilo que sempre trazia uma solução simples para os problemas que eu achava difíceis; à Amanda e à Elisângela, companheiras na alegria e no desespero; Aos integrantes do laboratório interdisciplinar de pesquisas médicas (LIP-MED), as primeiras pessoas que conheci quando iniciei o estágio curricular. Agradeço a convivência cordial, a cooperação e descontração. À Dra. Alda Maria Da-Cruz, pelas revisões, correções e sugestões, que tanto me ajudaram ao longo da elaboração deste trabalho; e ao Adriano Gomes e a Joanna Reis, pela colaboração, atenção, artigos e anticorpos monoclonais. Aos integrantes da Banca examinadora que aceitaram o convite para a avaliação do presente estudo À Dra. Marize Nunes, à Dra. Paula de Lucca, à Dra Roberta Olmo pela contribuição com os reagentes que precisei durante a execução deste trabalho. À Rosângela, à Sylvia e ao Ricardo pelo serviço de secretariado. À Beckman Coulter, pela doação do kit IOTest Beta Mark que possibilitou o estudo do repertório Vβ, e pelo financiamento das inscrições em congressos. À Fundação Oswaldo Cruz, meu endereço mais fixo no Rio de Janeiro. Ao IOC pelo financiamento de passagens aéreas para que eu pudesse participar de congressos. À CAPES pela concessão da bolsa de estudos. v
6 Não é o mais forte que sobrevive, nem o mais inteligente, mas o que melhor se adapta às mudanças. (Charles Darwin) vi
7 SUMÁRIO Lista de Abreviaturas...ix Resumo...xi Abstract...xii Lista de Tabelas...xiii Lista de Figuras...xiv 1. Introdução Epidemiologia das leishmanioses Agentes etiológicos e ciclo de vida Formas clínicas da leishmaniose tegumentar Leishmaniose subclínica Leishmaniose cutânea (LC) Leishmaniose mucosa (LM) Leishmaniose cutânea disseminada (Ldiss) Leishmaniose cutânea difusa (LCD) Diagnóstico da leishmaniose tegumentar Americana Tratamento da leishmaniose tegumentar Americana Imunopatogenia da leishmaniose tegumentar Americana Resposta imune inata Resposta imune adaptativa O repertório de linfócitos T Reconhecimento antigênico e ativação de clones específicos Os linfócitos T de memória A apoptose de linfócitos T na LTA Citometria de Fluxo Justificativa Objetivo geral Objetivos específicos Metodologia Casuística Coleta do material biológico Obtenção de células mononucleares de sangue periférico Ensaio ex vivo para avaliação fenotípica das subpopulações de linfócitos T CD8 +, repertório Vβ e apoptose Preparo de antígenos particulados de Leishmania (Viannia) braziliensis Ensaio in vitro para avaliação fenotípica das subpopulações de linfócitos T CD8 + e apoptose Citometria de Fluxo Definição de Regiões e Compensação de Cores Análise Citofluorimétrica das Amostras Obtidas Ex vivo Análise Citofluorimétrica das Amostras Obtidas Após Estimulação In vitro com Antígenos de Leishmania Análise Estatística Resultados Características clínicas e epidemiológicas dos indivíduos avaliados Avaliação do percentual de linfócitos T CD8 + obtidos ex vivo e in vitro vii
8 5.3 Perfil de distribuição das subpopulações de linfócitos T CD Análise comparativa das subpopulações de linfócitos T CD8 + entre os grupos estudados Avaliação do percentual dos linfócitos T CD8 + em apoptose Distribuição das subpopulações de linfócitos T CD8 + em apoptose Análise comparativa das subpopulações de linfócitos T CD8 + em apoptose entre os grupos estudados Avaliação do perfil do repertório Vβ de linfócitos T CD Comparação do repertório Vβ de linfócitos T CD Alterações do repertório Vβ das subpopulações de linfócitos T CD8 + durante e após o tratamento da leishmaniose cutânea Alteração da frequência de Vβ 12, Vβ 21.3 e/ou Vβ 22, em linfócitos T CD8 + efetores Alteração da frequência de Vβ2, Vβ 3, Vβ 5.3, Vβ 9, Vβ 13.2 e/ou Vβ 23, em linfócitos T CD8 + naïve Alteração da frequência de Vβ 2, Vβ 5.2, Vβ 9, Vβ 18 e/ou Vβ 22, em linfócitos T CD8 + de memória efetora Alteração da frequência de Vβ 2, Vβ 9, Vβ 13.2, Vβ 18 e/ou Vβ 23, em linfócitos T CD8 + de memória central em pacientes Discussão Conclusões Referências Bibliográficas Anexo I viii
9 Lista de Abreviaturas 7-AAD APC Ag-Lb AICD CD CDR Cols. 7-aminoactinomicina D Antigen Presenting Cell - Célula apresentadora de antígeno Antígeno de Leishmania Braziliensis Activated Induced Cell Death - Morte Celular Induzida por Ativação Cluster of Differentiation Complementarity-determining region Região determinante de complementariedade Colaboradores CMSP ConA CTRL DC ECD ELISA FITC FSC Células mononucleares do sangue periférico Concanavalina A Controle - Indivíduos Sadios Dendritic cell Electron Coupled Dye (similar ao PE-TR) Enzyme-Linked Immunosorbent Assay Ensaio imunoenzimático Isotiocianato de fluoresceína Forward Scatter gp-63 Glicoproteína 63 IDRM IFN-γ IgG IL LC LCD LDis LM LPG LT LTA LV MFI MHC NK Intradermorreação de Montenegro Interferon-gama Imunoglobulina G Interleucina Leishmaniose Cutânea Leishmaniose Cutânea Difusa Leishmaniose Disseminada Leishmaniose Mucosa Lipofosfoglicano Leishmaniose Tegumentar Leishmaniose Tegumentar Americana Leishmaniose Visceral Mean Fluorescence Intensity (Intensidade Média de Fluorescência) Major Histocompatibility complex - Complexo Principal de Histocompatibilidade Célula Natural-Killer NNN Meio de cultura McNeal, Novy & Nicolle ix
10 OMS PBS PBS AZ Sódica PCR Organização Mundial da Saúde Phosphate Buffered Saline Phosphate Buffered Saline Tampão Fosfato Salino - contendo 0,1% de Azida Polimerase Chain Reaction Reação em Cadeia da Polimerase PDT Pacientes Durante o Tratamento PE Ficoeritrina PE-TR Ficoeritrina-Texas Red RIFI Reação de imunofluorescência indireta SSC Side Scatter TCR T Cell Receptor - Receptor de célula T Th-1 Linfócitos T helper do tipo 1 Th-2 Linfócitos T helper do tipo 2 TLR Receptor do tipo Toll T ME T MC TNF-α Vβ Linfócitos T de Memória Efetora Linfócitos T de Memória Efetora Tumor Necrosis Factor alpha - Fator de necrose tumoral-alfa Cadeia varíavel Beta do TCR x
11 RESUMO A resposta imune envolve a participação de subpopulações de células T naïve, efetoras e de memória, as quais são funcionalmente distintas, e a atividade destas células depende do reconhecimento antigênico, que ocorre no contexto MHC-peptídeo-TCR. A manutenção destas subpopulações e a homeostasia do sistema imune são controlados, entre outros fatores, pela apoptose. No entanto, este processo de morte também tem sido relacionado à diversas patologias, sendo responsável pela modulação de eventos imunológicos, interferindo no curso da infecção. Em pacientes com leishmaniose cutânea (LC), apesar da indução preferencial de linfócitos T CD4 +, os linfócitos T CD8 + estão envolvidos nos processos de progressão e controle da infecção. Neste contexto, a citometria de fluxo foi utilizada definir simultaneamente as subpopulações de linfócitos T CD8 + naïve, efetora, de memória central e de memória efetora; a diversidade do repertório Vβ destes linfócitos; e a ocorrência de apoptose, na resposta imune da LC. Neste estudo foram analisadas amostras de sangue periférico, obtidas ex vivo de pacientes durante e após o tratamento, e de indivíduos sadios; e após cultivo in vitro frente a antígenos de Leishmania braziliensis. Os resultados mostram que a apoptose exerce um papel modulador, diminuindo a frequência de linfócitos T CD8 +, o que parece contribuir para a persistência da lesão ativa, no décimo dia de tratamento; enquanto a cura clínica parece ser consequência da diminuição de apoptose nestes linfócitos T CD8 + contribuindo para o restabelecimento da frequência destas células. A análise da distribuição das subpopulações de linfócitos T CD8 + revelou que a proporção de células naïve e efetoras é invertida ao longo do tratamento e do processo de resolução da lesão. Paralelamente, apesar do maior percentual de linfócitos T CD8 + efetores observados em pacientes durante o tratamento, a ocorrência de apoptose nestas células pode comprometer uma resposta imune eficaz, estando associada à presença de lesão ativa ulcerada. O caráter modulador que este processo de morte exerce na resposta imune em ambos os grupos de pacientes sugere que a ocorrência de apoptose, mais intensa na fase ativa da doença, esteja relacionada à manutenção da infecção. A reunião das análises de repertório Vβ nas diferentes subpopulações de linfócitos T CD8 + mostraram uma indução oligoclonal na qual as células que expressam Vβ 9, Vβ 13.2 ou Vβ 23 podem ser os clones selecionados a se diferenciar em células de memória central após a cura clínica; enquanto que os clones que expressam a cadeia Vβ 22, parecem ser preferencialmente selecionados a se diferenciar em células de memória efetora, durante a fase ativa da doença. Os únicos clones de linfócitos T CD8 + efetores que apresentaram uma expansão significativa foram aqueles que expressam a cadeia Vβ 12, a qual parece estar associada à resposta imune efetora desencadeada na fase ativa da LC. Sendo assim, a heterogeneidade entre o repertório Vβ das diferentes subpopulações de linfócitos T CD8 + ressalta a importância de avaliar separadamente o repertório das células naïve, efetoras, de memória central e de memória efetora. xi
12 ABSTRACT The immune response involves the participation of subpopulations of naïve effector and memory T cells, which are functionally distinct, and the activity of these cells depends on antigen recognition, which occurs in the context of MHC-peptide-TCR. The maintenance of these subpopulations and the homeostasis of the immune system are controlled, among other factors, by apoptosis. However, this process of death has also been linked to several diseases, being responsible for the modulation of immunological events, affecting the course of infection. In patients with cutaneous leishmaniasis (CL), despite of preferential induction of CD4 + T lymphocytes, CD8 + T cells are involved in the processes of progression and outcome of infection. In this context, flow cytometry was used to define the subpopulations of naive, effector, central memory and effector memory T CD8 + lymphocytes; the diversity of the Vβ repertoire of these lymphocytes, and the occurrence of apoptosis, during the immune response of the CL. We analyzed peripheral blood samples, obtained ex vivo from patients during and after treatment and from healthy individuals, and after in vitro against antigens of Leishmania braziliensis. The results show that apoptosis plays a modulating role, reducing the frequency of CD8 + T cells, which appears to contribute to the persistence of active lesions on the tenth day of treatment; while clinical cure appears to be the result of decreased apoptosis in these CD8 + T lymphocytes, contributing to the restoration of the frequency of these cells. The analysis of the distribution of subpopulations of CD8 + T cells showed that the proportion of naïve and effector cells is reversed during the treatment process and the resolution of the lesion. In parallel, despite the higher percentage of effector CD8 + T lymphocytes observed in patients during treatment, the occurrence of apoptosis in these cells may impair an effective immune response, being associated with the presence of active lesions ulcerated. The modulator character that this death process has on the immune response in both groups of patients suggests that the occurrence of apoptosis, more intense in the active phase of the disease, is related to the maintenance of infection. Taking together the data analysis of Vβ repertoire in different subsets of CD8 + T cells showed an oligoclonal induction, in which cells expressing Vβ 9, Vβ 13.2 and Vβ 23 can be the clones selected to differentiate into central memory cells after clinical cure; while clones expressing Vβ 22, seem to be preferentially selected to differentiate into effector memory cells during the active phase of the disease. The only clones of effector CD8 + T lymphocytes that showed a significant expansion were those that express the Vβ 12, which seems to be associated with an effector immune response triggered in the active phase of the CL. Thus, the heterogeneity between the Vβ repertoires of different subsets of CD8 + T cells underscores the importance of separately assessing the repertoire of naïve, effector, central memory and effector memory T cells. xii
13 Lista de Tabelas Tabela 1.1: Perfis de resposta imune celular associada às diferentes formas clínicas da leishmaniose tegumentar Americana...37 Tabela 4.1: Anticorpos monoclonais específicos para 24 cadeias Vβ utilizados no protocolo experimental, conforme distribuição em oito tubos de ensaio (A-H) contendo a mesma amostra. Kit IOTest Beta Mark...51 Tabela 4.2: Combinação de 7-AAD e anticorpos monoclonais, utilizados como marcadores para avaliar diferentes características celulares por citometria de fluxo, em ensaio experimental ex vivo...52 Tabela 4.3: Combinação de 7-AAD e anticorpos monoclonais, utilizados como marcadores para avaliar diferentes características celulares por análise citofluorimétrica, no ensaio in vitro...54 Tabela 5.1: Características clínicas e epidemiológicas dos 22 pacientes de leishmaniose cutânea incluídos no estudo...63 Tabela 5.2: Contrações (setas vermelhas) e expansões (setas azuis) de cadeias Vβ expressas por linfócitos T CD8 + e pelas subpopulações naïve; efetora; de memória efetora e de memória central...95 xiii
14 Lista de Figuras Figura 1.1: Distribuição geográfica da leishmaniose tegumentar nas Américas...19 Figura 1.2: Ciclo de vida da Leishmania SP...22 Figura 1.3: Fotografias do aspecto macroscópico de lesão de leishmaniose tegumentar Americana. Lesão de leishmaniose cutânea (A); lesão de leishmaniose mucosa (B); lesão de leishmaniose difusa (C); lesões de leishmaniose disseminada (D)...24 Figura 1.4: Estrutura do complexo receptor de célula T e cadeias que compõem o CD3 (TCR- CD3)...29 Figura 1.5: Apresentação e reconhecimento antigênico no contexto MHC-peptídeo- TCR...34 Figura 1.6: Resposta imune celular durante a leishmaniose tegumentar Americana...38 Figura 4.1: Esquema do protocolo citofluorimétrico utilizado no ensaio ex vivo...52 Figura 4.2: Esquema do protocolo citofluorimétrico utilizado no ensaio in vitro...54 Figura 4.3: Ajuste de quadrantes e compensação de cores...56 Figura 4.4: Estratégia do contra-gate para definição da região de análise (gate) nos linfócitos...57 Figura 4.5: Dot plot de granularidade (SSC) vs tamanho (FSC); com gate de linfócitos em azul (A); histograma baseado no gate de linfócitos, e linfócitos T CD8 + separados das células natural killer pela diferença entre alta e baixa intensidade de fluorescência; Dot plot de anti- CD8 vs FSC e gate de linfócitos T CD8 + com alta intensidade de fluorescência...59 Figura 4.6: Esquema representativo do protocolo citofluorimétrico utilizado na análise de cada amostra obtida ex vivo...64 Figura 4.7: Representação gráfica do protocolo citofluorimétrico de análise multiparamétrica das amostras obtidas após cultivo in vitro...60 xiv
15 Figura 5.1: Avaliação, ex vivo (A) e após cultivo in vitro (B), do percentual de linfócitos T CD Figura 5.2: Avaliação do percentual de linfócitos T CD8 + cultivados in vitro, sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...65 Figura 5.3: Perfil de distribuição de células efetoras (CD8 + CD45RA + CD27 - ), naïve (CD8 + CD45RA + CD27 + ), de memória efetora (T ME ) (CD8 + CD45RA - CD27 - ) e de memória central (T MC ) (CD8 + CD45RA - CD27 + )...67 Figura 5.4: Avaliação, ex vivo, do percentual de linfócitos T CD8 + CD45RA + CD27 - (efetores)...68 Figura 5.5: Avaliação do percentual de linfócitos (Linf.) T CD8 + CD45RA + CD27 - (efetores), cultivados in vitro, sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...69 Figura 5.6: Avaliação, ex vivo, do percentual de linfócitos (Linf) T CD8 + CD45RA + CD27 + (naïve)...70 Figura 5.7: Avaliação do percentual de linfócitos (Linf.) T CD8 + CD45RA + CD27 + (naïve), cultivados in vitro, sem estímulo antigênico (background- BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...70 Figura 5.8: Avaliação, ex vivo, do percentual de linfócitos T CD8 + CD45RA - CD27 - (de memória efetora - T ME )...71 Figura 5.9: Avaliação, ex vivo, do percentual de linfócitos T CD8 + CD45RA - CD27 + (de memória central T MC )...71 Figura 5.10: Avaliação do percentual de linfócitos (Linf.) T CD8 + CD45RA - (de memória) cultivados in vitro, sem estímulo antigênico (background- BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...72 Figura 5.11: Avaliação, ex vivo (A) e após cultivo in vitro (B), do percentual de linfócitos T CD8 + em apoptose...73 xv
16 Figura 5.12: Avaliação do percentual de linfócitos T CD8 + em apoptose, cultivados in vitro, sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...74 Figura 5.13: Perfil de distribuição das subpopulações de linfócitos T CD8 + efetora (CD8 + CD45RA + CD27 - ), naïve (CD8 + CD45RA + CD27 + ), de memória efetora (T ME ) (CD8 + CD45RA - CD27 - ) e de memória central (T MC ) (CD8 + CD45RA - CD27 + ) em apoptose...76 Figura 5.14: Avaliação, ex vivo, do percentual de linfócitos T (Linf.) CD8 + CD45RA + CD27 - (efetores) em apoptose...77 Figura 5.15: Avaliação do percentual de linfócitos T (Linf.) CD8 + CD45RA + CD27 - em apoptose, cultivados in vitro, sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...78 Figura 5.16: Avaliação, ex vivo, do percentual de linfócitos T CD8 + CD45RA + CD27 + (naïve) em apoptose...79 Figura 5.17: Avaliação do percentual de linfócitos T CD8 + CD45RA + CD27 + em apoptose, cultivados in vitro, sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...80 Figura 5.18: Avaliação, ex vivo, do percentual de linfócitos T CD8 + CD45RA - CD27 - (de memória efetora) em apoptose...81 Figura 5.19: Avaliação, ex vivo, do percentual de linfócitos T CD8 + CD45RA - CD27 + (de memória central) em apoptose...81 Figura 5.20: Avaliação do percentual de linfócitos T CD8 + CD45RA - em apoptose, cultivados in vitro, sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (Viannia) braziliensis (Lb-Ag)...82 Figura 5.21: Perfil do repertório de 24 cadeias Vβ em linfócitos T CD Figura 5.22: Percentual de expressão das cadeias Vβ 2; Vβ 13.2; Vβ 18; Vβ 9; Vβ 23; em linfócitos (linf.) T CD xvi
17 Figura 5.23: Percentual de expressão da cadeia Vβ 12; Vβ 21.3; e Vβ 22; em linfócitos (linf.) T CD8 + CD45RA + CD27 - (efetores)...88 Figura 5.24: Percentual de expressão da cadeia Vβ 2; Vβ 13.2; Vβ 5.3; Vβ 23; Vβ 3 e Vβ 9; em linfócitos (linf.) T CD8 + CD45RA + CD27 + (naïve)...90 Figura 5.25: Percentual de expressão da cadeia Vβ 2; Vβ 5.2; Vβ 9; Vβ 18 e Vβ 22; em linfócitos (linf.) T CD8 + CD45RA - CD27 - (memória efetora)...92 Figura 5.26: Percentual de expressão da cadeia Vβ 2; Vβ 13.2; Vβ 9; Vβ 18 e Vβ 23; em linfócitos (linf.) T CD8 + CD45RA - CD27 + (memória central)...94 xvii
18 1. INTRODUÇÃO 1.1 EPIDEMIOLOGIA DAS LEISHMANIOSES As leishmanioses constituem um grupo de doenças causadas por protozoários de diferentes espécies do gênero Leishmania, e caracterizam-se por apresentar um amplo espectro de manifestações clínicas que podem ser divididas em dois grupos: a leishmaniose visceral (LV) e a leishmaniose tegumentar (LT) (Lainson, 1983; Grimaldi & Tesh, 1993; Desjeux, 1996). As manifestações clínicas das leishmanioses dependem da espécie de Leishmania; da resposta imune e das características genéticas do hospedeiro vertebrado; e da espécie do inseto vetor envolvida na transmissão do parasito (Antinori et al, 2005; Reithinger et al, 2007). Atualmente a leishmaniose é considerada uma antropozoonose. Entretanto, historicamente esta doença constitui uma zoonose típica, com reservatórios silvestres e vetores bem definidos, enquanto os humanos assumem o papel de hospedeiros acidentais. A forma tegumentar da doença já foi descrita em animais sinantrópicos como cães, gatos e cavalos (Aguilar et al, 1987; Mancianti, 2004). Como as altas taxas de infecção nestes animais acompanham o aumento das infecções no ambiente doméstico, acredita-se que os mesmos atuem como reservatórios desta doença (Reithiger & Davis, 1999). Além disso, com o crescimento populacional, a urbanização, as mudanças ambientais, a devastação de florestas e a adaptação do vetor ao ambiente peridomiciliar, o homem passou a fazer parte do ciclo (SVS/MS, 2010). Segundo a Organização Mundial de Saúde (OMS) as leishmanioses estão entre as seis doenças tropicais de maior importância para a saúde pública, porém ainda estão inseridas no grupo das doenças negligenciadas. A doença está amplamente distribuída, atingindo oitenta e oito países, principalmente aqueles situados em regiões tropicais e subtropicais. De acordo com o Manual de Vigilância da Leishmaniose Tegumentar Americana (SVS/MS, 2010), estima-se que, no mundo, 350 milhões de indivíduos estejam expostos ao risco de se infectar, com registro anual de dois milhões de novos casos de leishmaniose. Devido às diferenças geográficas, epidemiológicas e clínicas da forma tegumentar, a doença tem sido classificada como Leishmaniose Tegumentar Americana (LTA) no Novo Mundo (Américas) e Leishmaniose Tegumentar do Velho Mundo (Europa, Ásia e África) (Grimaldi, Tesh & McMahon-Pratt, 1989; SVS/MS, 2010). No Brasil, são observadas as formas clínicas tegumentar e visceral, constituindo um quadro endêmico com características próprias relacionadas às questões de saúde pública. A LTA é observada desde o Sul dos Estados Unidos (Texas) até o norte da Argentina (Figura 1.1), alcançando maior importância no Peru e no Brasil, onde apresenta ampla distribuição 18
19 por todo o território nacional. De acordo com a última edição do Manual de Vigilância da Leishmaniose Tegumentar Americana (SVS/MS, 2010), no período de 1985 a 2005 foi verificada uma média anual de aproximadamente casos autóctones registrados, embora não haja dados mais recentes. A maioria dos casos é causada pela espécie L. (Viannia) braziliensis, incluindo também a L. (Leishmania) amazonensis e L. (V.) guyanensis como as principais espécies responsáveis pela doença no país (Da-Cruz & Pirmez, 2005). Figura 1.1: Distribuição geográfica da leishmaniose tegumentar nas Américas. Adaptado de World Healthy Org anization (WHO), Com a expansão geográfica da LTA, durante a década de 1980, a doença foi assinalada em 19 estados brasileiros e, em 2003, foi confirmada a autoctonia nos 27 estados do país. Apesar da ampla dispersão no território nacional há intensa concentração de casos em determinadas áreas, principalmente nas regiões Norte e Nordeste, enquanto que em outras, os casos apresentam-se isolados. A doença é incidente na Amazônia; na Bahia; em Minas Gerais, na região do Triângulo Mineiro e nas regiões próximas à bacia do rio Mucuri e do rio Doce; em São Paulo, na região sul que abrange a área de Mata Atlântica; bem como nos estados do Espírito Santo; Mato Grosso do Sul e Goiás. Também são encontrados focos da doença no estado do Rio de Janeiro, como, por exemplo, nos municípios de Mesquita; Paraty; Ilha Grande; Paracambi e na própria capital (Oliveira-Neto et al, 2000(a); Vieira-Gonçalves et al, 2008; Rangel & Lainson, 2009). Os casos autóctones e epidemias de LTA no estado do Rio de Janeiro podem ser explicados pela ocupação de áreas florestais e consequente urbanização das mesmas, expondo a população aos vetores infectados com L. braziliensis (Lutzomyia intermedia e Lu. migonei) ou L. amazonensis (Lu. flaviscutellata). 19
20 1.2 AGENTES ETIOLÓGICOS E CICLO DE VIDA Taxonomicamente, a Leishmania pertence ao reino Protista, filo Protozoa, subfilo Sarcomastigophora, classe Mastigophora, ordem Kinetoplastida, subordem Trypanosomatina, família Trypanosomatidae e gênero Leishmania (Maslov, Podlipaev & Lukes, 2001; Rey, 2008). Foram identificas pelo menos dezessete espécies patogênicas ao homem (Grimaldi, Tesh & McMahon-Pratt, 1989). As espécies de Leishmania podem pertencer ao subgênero Viannia ou ao subgênero Leishmania dependendo da localização no intestino do hospedeiro invertebrado em que se desenvolvem (Killick-Kendrick, 1979; Ryan et al, 1987). Os protozoários deste gênero são heteroxenos, incluindo em seu ciclo de vida a participação de um hospedeiro invertebrado e um hospedeiro vertebrado, e apresentam-se sob duas formas evolutivas: amastigota e promastigota (Rey, 2008). O homem e outros mamíferos, como os cães e roedores silvestres, representam os hospedeiros vertebrados da Leishmania, enquanto as fêmeas (hematófagas) de flebotomíneos são os vetores da doença. Estes insetos (Ordem: Díptera; Família: Psychodidae) pertencem à subfamília Phlebotominae e podem ser do gênero Lutzomyia no Novo Mundo ou do gênero Phlebotomus no Velho Mundo (Laison, 1983; Rey, 2008; Rangel & Lainson, 2009). Apesar das 500 espécies de flebotomíneos já identificadas, somente 40 participam do ciclo da Leishmania como vetores (Grimaldi & Tesh, 1993; Rocha et al, 2010). Poucas espécies são responsáveis pela transmissão dos agentes infecciosos da LTA, indicando que as espécies de Leishmania parecem ter preferência por espécies particulares de flebotomíneos (Rangel & Lainson, 2009). No flebotomíneo, os parasitos do gênero Leishmania localizam-se na luz do tubo digestório e se apresentam sob a forma promastigota. Nesta fase do ciclo, os parasitos têm forma alongada, medindo de 8 a 15 µm, com flagelo emergindo do pólo anterior do corpo celular que lhes confere motilidade, podendo chegar a 20 µm. As amastigotas parasitam células do sistema fagocítico do hospedeiro vertebrado, possuem forma arredondada ou ovóide, medem de 3 a 5 µm e possuem flagelo interiorizado (Rey, 2008). O ciclo evolutivo da Leishmania (Figura 1.2) é iniciado no momento que o inseto vetor (flebotomíneo), ao realizar o repasto sanguíneo em um hospedeiro vertebrado infectado, ingere monócitos/macrófagos contendo as formas amastigotas do parasito. Ao serem liberadas no trato digestivo do inseto, as amastigotas se diferenciam em promastigotas procíclicas que aderem ao epitélio intestinal graças à expressão de lipofosfoglicano (LPG), que facilita a sua fixação. Além deste glicoconjugado, a metaloprotease gp63 atua na proteção das promastigotas contra as enzimas hidrolíticas do intestino do inseto. Nesta fase, ocorre intensa 20
21 multiplicação que se reflete na expansão inicial da população dos parasitos (Descoteaux & Turco, 1999; Bates & Rogers, 2004). A fase seguinte, denominada metaciclogênese, se caracteriza pela diferenciação das promastigotas procíclicas em promastigotas metacíclicas, forma infectante para o hospedeiro vertebrado, na qual o LPG é alterado fazendo com que os parasitos se desprendam do intestino e migrem para a porção anterior do trato digestivo (Sacks & Perkins, 1984; Sacks & da Silva, 1987; Bates, 2007). Ao realizar o repasto sanguíneo, a fêmea de flebotomíneo regurgita as promastigotas metacicíclicas dando início ao processo infeccioso no homem. A saliva do inseto também está envolvida neste processo de transmissão e contribui para o desenvolvimento das lesões características da doença, através da supressão da produção de óxido nítrico (NO 2 ) nos macrófagos, aumentando a chance de sobrevivência do parasito (Alexander, Satoskar & Russel, 1999; Menezes et al, 2008). Após escaparem do meio extracelular, as promastigotas invadem as células do sistema fagocítico mononuclear, como macrófagos, células dendríticas e neutrófilos (Peters et al, 2008). No caso de infectarem os macrófagos, as leishmânias são interiorizadas no fagossoma, o qual se funde ao lisossomo formando uma estrutura chamada fagolisossomo ou vacúolo parasitóforo, onde se diferenciam em amastigotas. Dentro destes vacúolos, as formas amastigotas se multiplicam sucessivamente por divisão binária, rompem as células e são fagocitadas por novas células, propagando a infecção. Os neutrófilos infectados parecem funcionar como uma ponte entre o parasito e a célula hospedeira final, o macrófago, já que após a morte fisiológica dos neutrófilos (células de vida curta) as formas amastigotas liberadas são prontamente fagocitadas pelos macrófagos, assim como os neutrófilos apoptóticos contendo amastigotas (John & Hunter, 2008; Laskay, Van Zandbergem & Solbach, 2008). O ciclo se completa quando um flebotomíneo realiza um repasto sanguíneo em um hospedeiro infectado e ingere as células infectadas com as formas amastigotas. Novamente, no inseto vetor, as amastigotas se diferenciam em promastigotas, reiniciando o ciclo de vida da Leishmania (Bates, 2007; Silveira et al, 2009). 21
22 Figura 1.2: Ciclo de vida da Leishmania sp. Adaptado e traduzido de Sacks & Noben-Trauth, FORMAS CLÍNICAS DA LEISHMANIOSE As formas clínicas da leishmaniose dependem do tropismo da espécie de Leishmania infectante. A LV, também denominada calazar, é uma doença sistêmica, causada principalmente pelas espécies viscerotrópicas L. donovani, L. infantum (no Velho Mundo) e L. infantum chagasi (nas Américas) (Barral et al, 1986; Herwaldt, 1999). Já a LT apresenta, por sua vez, uma grande variedade de manifestações clínicas, histopatológicas e imunológicas que caracterizam as seguintes formas da doença: leishmaniose cutânea, leishmaniose mucosa, leishmaniose cutânea difusa e leishmaniose cutânea disseminada (Da-Cruz & Pirmez, 2005; Silveira et al, 2009) Leishmaniose Subclínica Alguns indivíduos, mesmo infectados por Leishmania, apresentam manifestação clínica discreta ou não apresentam nenhuma manifestação, com o controle da infecção, não havendo evolução e nem a necessidade de tratamento. Já foi relatado em área endêmica que 10% dos indivíduos sadios apresentavam Intradermoreação de Montenegro (IDRM) positiva, caracterizando uma forma subclínica da leishmaniose (Guerra et al, 1985; Follador et al, 2002; Fagundes et al, 2007). 22
23 1.3.2 Leishmaniose Cutânea (LC) A LC representa a forma mais frequente da doença. Possui como agente etiológico principalmente as espécies L. braziliensis e L. amazonensis, mas pode ser causada por qualquer espécie dermotrópica. A LC é caracterizada pelo desenvolvimento de lesões únicas ou escassas na pele, restritas ao(s) local(ais) de inoculação, geralmente em regiões do corpo expostas ao inseto vetor. O período de incubação varia de dez dias a três meses até o aparecimento de um eritema inicial da lesão. A seguir, a lesão avança para uma pápula ou nódulo com bordas elevadas, podendo formar uma úlcera centralizada (Figura 1.3A) com ou sem linfadenopatia regional (Barral et al, 1995; Reithinger et al, 2007). A doença evolui de forma crônica e usualmente a lesão cicatriza quando os pacientes recebem a terapia recomendada pelo Ministério da Saúde (SVS/MS, 2010), podendo ainda ser curada de forma espontânea (Marsden et al, 1984; Carvalho et al, 1985). As lesões cicatrizadas em geral são lisas, brilhantes e finas com dimensões que correspondem aos limites da úlcera. A ocorrência de traumatismo da cicatriz pode facilitar o surgimento de lesão leishmaniótica, levando à reativação da infecção, provavelmente relacionada à manutenção do parasito nestes locais (Oliveira-Neto et al, 1998). Foi demonstrado ainda que três anos após a cicatrização o padrão de celularidade da reação inflamatória da lesão leishmaniótica altera lentamente mesmo após a cura clínica, sugerindo um estabelecimento do equilíbrio parasito-hospedeiro somente após este período (Morgado et al, 2010). As lesões localizadas causadas por L. braziliensis, em geral, apresentam baixa carga parasitária, enquanto as lesões causadas por L. amazonensis e L. guyanensis apresentam-se mais ricas em parasitos (Silveira, Lainson & Corbett, 2005; Silveira et al, 2009; Matta et al, 2009) Leishmaniose Mucosa (LM) Cerca de 3% a 5% dos pacientes de LC, causada por L. braziliensis, desenvolvem leishmaniose mucosa (LM) (Marsden, 1986). A LM é uma forma mais grave, caracterizada por múltiplas ou extensas lesões destrutivas na cavidade oral e nasofaríngea associada à intensa resposta inflamatória (Figura 1.3B) (Amato, de Andrade & Duarte, 2003). Nesta forma clínica, a lesão geralmente não cura espontaneamente e os pacientes apresentam uma resposta celular exacerbada, intensa perda tecidual e baixa carga parasitária (Carvalho et al, 1985; Marsden, 1986; Oliveira-Neto et al, 1998; Silveira et al, 2009). A lesão causa deformidade devido ao intenso infiltrado inflamatório, geralmente da mucosa nasal, palato e faringe. Em alguns casos a infecção inicia-se na semimucosa exposta, como no lábio, e é denominanda LM primária (Marzochi,1992). 23
24 1.3.4 Leishmaniose cutânea disseminada (LDiss) A LDiss é uma forma rara da doença, na qual 1% dos pacientes com LC apresenta disseminação da lesão inicial. A LDiss é identificada quando há mais de dez lesões espalhadas pelo corpo (Figura 1.3C), pequenas, papulares ou acneiformes, com pequenas úlceras que apresentam escassez ou ausência de parasitos (Carvalho et al, 1994). O processo de difusão pode ocorrer em dois ou três meses, quando diversas lesões com pápulas eritematosas e/ou ulceradas podem aparecer (Costa et al, 1986; Turetz et al, 2002; Silveira, Lainson & Corbet, 2005; Vieira-Gonçalves et al. 2008) Leishmaniose cutânea difusa (LCD) A LCD é uma forma grave e rara da leishmaniose, causada pela espécie L. amazonensis. O início da doença é lento, com desenvolvimento de uma lesão nodular única que não responde ao tratamento e evolui progressivamente para a forma difusa, sem ulceração (Figura 1.3D). Esta lesão tende a se disseminar por toda a pele, com acentuada proliferação de parasitos e consequente disseminação da infecção. Os pacientes de LCD apresentam resposta imune anérgica, IDRM negativa e são refratários ao tratamento (Silveira et al, 2009). Figura 1.3: Fotografias do aspecto macroscópico de lesão de leishmaniose cutanea (A); lesão de leishmaniose mucosa (B); lesão de leishmaniose difusa (C); lesões de leishmaniose disseminada (D). Adaptado de Secretaria de Vigilância Sanitária; Ministério da Saúde (SVS/MS), 2007 e
25 A LTA, portanto, se mostra como uma doença de grande impacto na saúde pública não somente pela sua alta incidência e ampla distribuição geográfica, mas também pela possibilidade de assumir formas que podem levar a lesões destrutivas, desfigurantes e ainda incapacitantes. Os casos desta doença devem ser vistos sob uma perspectiva abrangente incluindo a espécie do parasito e a resposta imune de cada indivíduo, sendo a associação destes fatores determinante para a evolução da doença (SVS/MS, 2010). 1.4 DIAGNÓSTICO DA LEISHMANIOSE TEGUMENTAR AMERIACANA O diagnóstico clínico da LTA é baseado na aparência e localização das lesões e na epidemiologia, principalmente quando o paciente tem procedência de área endêmica ou visitou áreas onde há ou houve casos de leishmaniose. O padrão ouro de diagnóstico laboratorial da leishmaniose é realizado através de métodos diretos de isolamento e identificação do parasito. As formas amastigotas presentes na lesão podem ser identificadas por análise microscópica do tecido acometido, por multiplicação do parasito em cultura e/pu pelo inóculo de raspados de lesões ou de fragmento de tecido retirado por biópsia, em animais susceptíveis, como hamsters. A técnica de PCR também permite diagnosticar as leishmanioses através da amplificação de segmentos gênicos específicos do protozoário em questão (Uliana et al,1991; Fagundes et al, 2010). A IDRM é uma forma indireta de diagnóstico laboratorial baseado na mensuração da resposta imune celular com a injeção intradérmica de antígenos do parasito. O resultado é avaliado entre 48 e 72 horas, sendo consideradas positivas as reações com área de enduração maior ou igual a 5 mm. No entanto, nas primeiras semanas (4 a 6) após o surgimento da lesão, a reação pode ser negativa. Pacientes de LM usualmente apresentam resposta exacerbada, com vários centímetros de enduração, enquanto nos pacientes com a forma difusa a reação costuma ser negativa e nos pacientes de LC a resposta é moderada. Este método indireto complementa o diagnóstico clínico-epidemiológico, mas a confirmação da doença é realizada por métodos parasitológicos (Vega-Lopez, 2003; SVS/MS, 2010). Testes sorológicos para detecção de anticorpos anti-leishmania circulantes no soro dos pacientes também podem ser realizados, como a reação de imunofluorescência indireta (RIFI) e o ensaio imuno-enzimático (ELISA) (Barroso-Freitas et al, 2009; SVS/MS, 2010). 25
26 1.5 TRATAMENTO DA LEISHMANIOSE TEGUMENTAR AMERICANA Há seis décadas os antimoniais pentavalentes têm sido recomendados como a droga de primeira escolha no tratamento das leishmanioses (Herwaldt, 1999; Ashutosh, Sundar & Goyal, 2007), sendo que no Brasil o mais utilizado é o antimonial pentavalente N-metil glucamina (Glucantime Rhodia). Na maioria dos casos o tratamento com antimoniais é efetivo, apresentando taxa de cura entre 60 e 100%. Entretanto esta medicação possui algumas desvantagens, como alto custo, difícil administração e alta toxicidade, podendo desencadear efeitos adversos como artralgia, mialgia, anorexia, náusea, dor abdominal, pancreatite, distúrbios intestinais, cefaléia, alterações cardíacas e hepáticas, e insuficiência renal aguda (Nogueira & Sampaio, 2001; Mayrink et al, 2006). Por este motivo alguns pesquisadores têm buscado esquemas terapêuticos alternativos e doses menores para o uso de antimoniais com o objetivo de obter resultados satisfatórios, em casos de resistência à dosagem recomendada, e de minimizar os efeitos colaterais (Oliveira-Neto et al, 2000(b); Oliveira-Neto & Mattos, 2006 (a)(b); SVS/MS, 2010). A resposta ao tratamento é avaliada a partir de critérios clínicos. Os pacientes de LC são considerados curados quando apresentam epitelização completa da lesão (ou lesões) e regressão total da infiltração e eritema, até três meses após a conclusão do esquema terapêutico. Nos casos em que os pacientes não respondem ao tratamento, a segunda linha de escolha para tratar as leishmanioses são as drogas pentamidina e a anfotericina B (SVS/MS, 2010). 1.6 IMUNOPATOGENIA DA LEISHMANIOSE TEGUMENTAR AMERICANA A infecção produzida por espécies do gênero Leishmania gera respostas imunes muito complexas e a evolução da infecção pode tomar vários rumos dependendo das populações celulares envolvidas; tipo e quantidade de citocinas produzidas e secretadas; e da espécie de Leishmania envolvida no processo patogênico, a qual está diretamente relacionada com a forma clínica que a doença se apresenta (Silveira et al, 2009). O processo imunológico que ocorre durante a leishmaniose é mediado pela imunidade inata e adaptativa, e é iniciado assim que a fêmea de flebotomíneo regurgita as promastigotas metacíclicas de Leishmania no hospedeiro vertebrado durante o repasto sanguíneo. 26
27 1.6.1 Resposta Imune Inata A resposta imune inata é de baixa especificidade e é capaz de acionar rapidamente mecanismos celulares e bioquímicos durante a infecção por microorganismos. Esta resposta é realizada através de barreiras físicas e químicas; de células fagocíticas, que detectam os antígenos por suas regiões microbianas conservadas; de células Natural Killer (NK); de proteínas sanguíneas, como os membros do sistema complemento e mediadores inflamatórios; e das citocinas que regulam e coordenam diversas atividades desta resposta (Abbas & Litchman, 2007). A alteração da integridade da pele causada pelo inseto vetor gera uma resposta inflamatória inicial, a qual envolve o recrutamento e a migração de uma variedade de células, em especial células NK e células fagocíticas como as células dendríticas (denditric cell - DC)/ células de Langerhans, neutrófilos e macrófagos (Silveira et al, 2009). Nos três primeiros dias de infecção, após as leishmânias escaparem da lise mediada pelo sistema complemento (Sacks & da Silva, 1984), os neutrófilos são as células preponderantes e representam a primeira população celular a chegar ao sítio inflamatório e, portanto, as primeiras células a serem infectadas pelas formas promastigotas metacíclicas de Leishmania (John & Hunter, 2008; Laskay, Van Zandbergem & Solbach, 2008; Peters et al, 2008). A seguir, as DC (células de Langerhans epidérmicas e DC cutâneas) e os macrófagos, derivados de monócitos e residentes no tecido epitelial, também fagocitam estes parasitos e participam do processo inicial de resposta à infecção (Von Stebut et al, 1998; Baldwin et al, 2004; Van Zandbergen et al, 2004; Garg, Trudel & Trembley, 2007; Ritter & Osterloh, 2007; Von Stebut, 2007; Silveira et al, 2008). Os neutrófilos são células de vida curta que entram em processo de apoptose em torno de 6 a 10 horas. As promastigotas de Leishmania podem inicialmente ser fagocitadas por neutrófilos, que por sua vez adiam o processo de apoptose por aproximadamente três dias. Neste período há recrutamento de monócitos/macrófagos, através da secreção de quimiocinas, para o sítio inflamatório onde fagocitam os neutrófilos infectados em apoptose. Esta transferência de parasitos dos neutrófilos aos macrófagos, denominada Cavalo de Tróia, inclui um mistura de parasitos viáveis e mortos (Van Zandbergen et al, 2004; John & Hunter, 2008; Laskay, Van Zandbergen & Solbach, 2008; Ritter, Frieschknecht & Van Zandbergen, 2009). Em particular, os macrófagos desempenham um papel triplo durante a infecção por Leishmania, já que representam as células hospedeiras do parasito; atuam como células 27
28 apresentadoras de antígenos (APCs); além de exercer sua função de célula efetora de eliminação do patógeno (Bogdan & Rollinghoff, 1999; Cunningham, 2002; Ruiz & Becker, 2007). As promastigotas interiorizadas são abrigadas nos vacúolos parasitóforos dos macrófagos, permitindo que os microorganismos intracelulares sejam expostos à atividade leishmanicida desta célula, a qual inclui ação de enzimas lisossômicas, radicais de oxigênio e NO 2 (Weinberg, 1998; Liew, Xu & Chan, 1999; Bogdan et al, 2000). Paralelamente, o microambiente deste vacúolo induz a diferenciação das promastigotas em amastigotas, forma evolutiva mais resistente à resposta oxidativa desencadeada pela célula hospedeira (Cunnihghan, 2002). As APCs são capazes de reconhecer moléculas presentes na superfície do parasito, como o lipofosfoglicano (LPG), através de receptores tipo Toll-2 (Toll-like receptor 2 - TLR- 2) e TLR-4 (de Veer et al, 2003; Tuon et al, 2008). A partir deste reconhecimento, estas células são capazes de induzir a produção de citocinas proinflamatórias, como fator de necrose tumoral-α (Tumoral Necrosis Factor, TNF-α), Interferon-γ (IFN-γ), interleucina-12 (IL-12), IL-1, IL-6. Estas citocinas são decisivas tanto para o controle da disseminação do parasito como para a evolução das lesões já que estes mediadores inflamatórios, quando em níveis elevados, podem levar a destruição do tecido (Aebischer et al, 1994; Da-Cruz et al, 1996). Entretanto, não só a LPG, como também a gp63, presentes na superfície da Leishmania, são capazes de inibir a ativação de macrófagos, impedindo, alterando ou adiando a produção destas citocinas (Reiner & Malemud, 1985). O processo de infecção é dinâmico, ao ponto que, enquanto o sistema imune desencadeia mecanismos para neutralizar e/ou lisar os parasitos e recuperar a homeostasia, a própria Leishmania possui mecanismos de escape que alteram o processo imunológico que está sendo desencadeado. Sendo assim, os parasitos podem sofrer repetidas divisões binárias até que os macrófagos sejam lisados e, então, invadir células vizinhas promovendo a manutenção da infecção (Kima, 2007; Ritter & Osterloh, 2007) Resposta Imune Adaptativa A resposta imune adaptativa se caracteriza pela especificidade e memória e envolve a participação dos linfócitos T e B. Esta resposta é dividida nas seguintes fases: reconhecimento antigênico; ativação de linfócitos antígeno-específicos; fase efetora de eliminação e controle de patógenos; apoptose de clones de linfócitos efetores e manutenção de células de memória imunológica; e finalmente retorno à homeostase (Abbas & Litchman, 2007). Sendo assim, a diferenciação dos linfócitos naïve em subpopulações efetoras e de memória são processos fundamentais da imunidade celular adaptativa (Appay et al, 2008). 28
29 A resposta imune a patógenos intracelulares é mediada principalmente por linfócitos T (Abbas & Litchman, 2007). Nos pacientes de LTA, o desencadeamento de uma resposta imune eficaz é caracterizado por uma reação de hipersensibildiade tardia dependente da indução de linfócitos T circulantes específicos aos antígenos de Leishmania (Castés et al, 1983; Silveira et al, 1991; Convit et al. 1993, Carvalho et al, 1995; Castés & Tapia, 1998) O Repertório de Linfócitos T Os linfócitos T constituem um grupo de células caracterizado pela expressão do receptor de célula T (T cell receptor TCR) ligado de forma não covalente à molécula CD3 (Figura 1.4). Neste complexo molecular (TCR-CD3) o TCR é a unidade de reconhecimento antigênico, enquanto o CD3 é a unidade de transdução de sinais do linfócito T. Além deste complexo, os linfócitos T também se caracterizam pela expressão das moléculas adaptadoras CD4 ou CD8, as quais distinguem duas populações linfocitárias com funções efetoras distintas, mas que atuam de forma conjunta na resposta imune (Peakman & Vergani, 2011; Abbas & Litchman, 2007). Figura 1.4: Estrutura do complexo receptor de célula T e cadeias que compõem o CD3 (TCR-CD3). Os heterodímeros α:β do TCR estão associados com um complexo de quatro cadeias (duas ε, uma δ, uma γ), além de dois domínios intracelulares. Adaptado de Janeway, 2008(a). O TCR é especializado em reconhecer complexos moleculares compostos por peptídeos de origem intracelular apresentados pela molécula do complexo principal de histocompatibilidade (major histocompatibility complex MHC), ou CD1, e é incapaz de reconhecer antígenos solúveis (Loureiro & Ploegh, 2006). O MHC de classe I está presente em todas as células nucleadas do organismo, enquanto o MHC de classe II está presente somente nas APCs (Abbas & Litchman, 2007). 29
30 Para a indução de clones de linfócitos T específicos aos antígenos de Leishmania, as APCs infectadas migram para os órgãos linfóides secundários, principalmente linfonodos, onde os linfócitos T estão concentrados, e então apresentam os antígenos do parasito a estas células. Nestes órgãos ocorre uma interação célula-célula, conhecida como sinapse imunológica, e consequente apresentação antigênica no contexto MHC-peptídeo-TCR. Diferentes TCRs compõem o repertório de linfócitos T, garantindo que uma variedade de peptídeos não próprios seja reconhecida, o que permite que clones específicos sejam selecionados para proliferar e participar da resposta imune adaptativa (Abbas & Litchman, 2007; Nolte et al, 2009; Viola, Contento & Molon, 2010). O TCR é um heterodímero formado por duas cadeias de glicoproteínas ligadas de forma covalente. A maioria dos linfócitos T possui TCR do tipo αβ (90-99%), enquanto uma minoria expressa TCR do tipo γδ. Cada cadeia (α, β, γ, δ) é formada por uma região transmembrana hidrofóbica; uma região citoplasmática curta; um domínio constante (C); e um domínio variável (V), o qual possui o sítio de ligação ao antígeno. A porção extracelular deste heterodímero, similar ao fragmento de ligação ao antígeno das imunoglobulinas, é composta por regiões V e C da cadeia leve e da cadeia pesada (Meuer et al, 1983; Brenner, Trowbridge & Strominger, 1985). A diversidade necessária para o reconhecimento de uma variedade de antígenos pelo TCR é gerada no timo, durante a ontogenia dos linfócitos T (Kimura et al, 1987). A ampla variedade das cadeias α, β, γ, δ é dada pelo conjunto de segmentos gênicos descontínuos denominados V (variável); J (juncional); e D (diversidade), presente somente na cadeia β e na cadeia γ; além de um ou dois segmentos C (constante) (Abbas & Litchman, 2007). Os genes que codificam a cadeia α estão localizados no cromossomo 14 enquanto os genes que codificam a cadeia β localizam-se no cromossomo 7 (Collins et al, 1985; Kimura et al, 1987; Robinson et al, 1993; Rowen, Koop & Hood, 1996). A codificação da região variável é realizada através de um processo denominado recombinação somática, na qual os segmentos de um gene V, de um gene J e, no caso da cadeia β, de um gene D se combinam aleatoriamente. Em cada clone de linfócito T ocorre uma combinação diferente dos segmentos gênicos V, (D) e J, os quais se aproximam para formar um único gene V(D)J, que então se torna contíguo ao gene C para produzir uma das cadeias do receptor. Este processo inclui a excisão dos segmentos e junção de um segmento D a um segmento J. A seguir, ocorre a junção de DJ a um segmento V na recombinação da cadeia β (Hozumi & Tonegawa, 1976; Mak et al, 1987; Fugmann et al, 2000; Abbas & Litchman, 2007). Neste contexto, a diversidade destes segmentos e a imprecisão aleatória do processo de junção dos mesmos é que garantem a diversidade dos TCRs. A consequência deste processo promove uma 30
31 característica de combinação única e original ao TCR, expresso nos diferentes clones de linfócito T (Rowen, Koop & Hood, 1996). A variabilidade entre os diferentes TCRs se concentra no domínio V das cadeias α e β, que é composto por três regiões de variabilidade, denominadas regiões hipervariáveis ou determinantes da complementariedade (CDR1, 2 e 3). Estas regiões fornecem uma superfície complementar à superfície tridimensional do antígeno, sendo que o CDR3 é a região que confere maior diversidade ao TCR (van der Merwe & Davis, 2003; Abbas & Litchman, 2007; Murre, 2007; Peakman & Vergani, 2011). As propriedades de reconhecimento antigênico são testadas quanto à especificidade e avidez da interação do TCR ao complexo peptídeo-mhc, a fim de garantir que somente as células com tolerância a antígenos próprios sobrevivam e amadureçam. Quando esta interação é de baixa avidez, o linfócito é selecionado positivamente e, em contrapartida, as células cujo TCR tem alta avidez pelo MHC próprio são selecionadas negativamente (Hogquist, Baldwin & Jameson, 2005). Sendo assim, os diferentes linfócitos T podem ser selecionados para morrer por apoptose antes de atingir a maturidade, ou podem ser selecionados para sobreviver e desenvolver a população de linfócitos maduros. Após deixar o timo, os linfócitos T maduros, CD4 + ou CD8 +, concentram-se nos órgãos linfóides secundários, como baço e linfonodos, e recirculam continuamente pelos tecidos periféricos a fim de propiciar o encontro com possíveis antígenos (Peakman & Vergani, 2011; Murre, 2007). O repertório do TCR αβ que pode ser gerado pela recombinação gênica é da ordem de cem mil especificidades, entretanto, somente uma parte desta variedade de clones é selecionada para deixar o timo e migrar para os órgãos linfóides secundários. Após a seleção tímica de restrição do MHC, de auto-tolerância e de competência imunológica, aproximadamente 95% dos timócitos que sofreram o rearranjo V(D)J não amadurecem e sofrem apoptose, e somente os linfócitos maduros é que representam o repertório αβ do TCR de cada indivíduo (Davis & Bjorkman, 1988; Arstila et al, 2000). Apesar do baixo percentual de timócitos selecionados positivamente, estes linfócitos expressam um repertório de receptores de tal diversidade que os capacita a responder a uma quantidade ilimitada de antígenos não próprios, através da seleção clonal que atua na resposta imune adaptativa. Existe ainda, uma população de linfócitos T CD8 + cujo TCR é formado por um homodímero αα, os quais apresentam uma menor capacidade de interação com o MHC classe I e menor habilidade na transdução de sinais, quando comparados com o heterodímero αβ. Sendo assim, a cadeia β seria mais eficiente no processo de reconhecimento antigênico exercendo um importante papel na resposta imune (Das & Janeway, 1999; Bosselut et al, 31
32 2000). Neste cenário, diversas pesquisas baseadas na resposta imune adaptativa e na especificidade dos linfócitos T têm sido conduzidas através da análise da cadeia variável β do TCR, isto é, do repertório Vβ. Inicialmente os estudos do repertório Vβ estavam associados ao papel dos superantígenos na ativação do sistema imune e à proliferação e deleção de linfócitos T específicos em resposta à estimulação por antígenos dominantes (Gollob & Palmer, 1992; Fleischer et al, 1996). Posteriormente, o repertório Vβ passou a ser estudado principalmente no câncer (Stefanski & Mathur, 1996), nas doenças auto-imune (Martinez-Taboada, Goronzy & Weyand, 1996), na infecção pelo HIV (Gorochov et al, 1998), e nas doenças causadas por protozoários (Pirmez et al, 1993; Uyemura et al, 1993; Costa et al, 2000; Lumsden, Cranmer & Krzych, 2010). Na leishmaniose foi demonstrado que o repertório Vβ apresenta algumas expansões em mais de 50% dos pacientes infectados por L. braziliensis, embora tal avaliação não tenha sido realizada separadamente em linfócitos T CD4 + e T CD8 + (Uyemura et al, 1993). Neste cenário, o estudo do repertório Vβ, inicialmente realizado por biologia molecular, passou a ser realizado por citometria de fluxo devido a possibilidade de se definir os perfil de repertório Vβ em diferentes populações celulares em uma mesma amostra (van den Beemd et al, 2000; Lima et al, 2003; Menezes et al, 2004; Giacoia-Gripp et al, 2005; Clarêncio et al, 2006, Keesen et al, 2011; Tembhare et al, 2011). Ao longo dos últimos 25 anos, foi produzida uma variedade de anticorpos específicos para a cadeia variável do TCR, sendo que a maioria destes é reativa à cadeia β. Diferentes perfis de distribuição deste repertório já foram associados a algumas doenças, como leucemia (Plasilova, Risitano & Maciejewski, 2003); esclerose múltipla (Hong et al, 1999); artrite reumatóide (Goodall, Bledsoe & Gaston, 1999); psoríase (Bour et al, 1999); Doença de Chagas (Costa et al, 2000; Menezes et al, 2004); artrite reumatóide (Moss et al, 1992), e leishmaniose (Uyemura et al, 1993; Clarêncio et al, 2006; Kariminia et al, 2007; Xin et al, 2011). Além disso, alguns estudos vêm demonstrando uma expansão oligoclonal de linfócitos T antígeno-específicos e uma distribuição heterogênea dos clones durante diferentes processos infecciosos (Menezes et al, 2004; Giacoia-Gripp et al, 2005, Clarêncio et al, 2006; Keesen, 2010). Outra abordagem de caracterização do repertório Vβ de linfócitos T baseia-se na avaliação de indivíduos sadios com o intuito de definir a distribuição clonal normal e proporcionar uma melhor interpretação da frequência de clones de linfócitos em diferentes patologias (van den Beemd et al, 2000). Os segmentos gênicos Vβ são agrupados em 26 diferentes famílias, baseadas na homologia das sequências gênicas (75% de homologia), sendo que algumas destas consistem 32
33 de vários membros, como as famílias Vβ 5, Vβ 6, Vβ 8 e Vβ 13 (Arden et al, 1995). Uma avaliação do repertório Vβ em indivíduos sadios mostrou que a distribuição das famílias parece ser heterogênea, já que a expressão de determinados membros Vβ tendem a ser mais dominantes como Vβ 2, Vβ 6, Vβ 8, Vβ 17, enquanto as famílias Vβ 12 e Vβ 24 são menos expressas (Malhorta et al, 1992). Além disso, algumas cadeias são preferencialmente mais expressas em subpopulações de linfócitos T CD4 + como Vβ 5.1, Vβ 6.7, Vβ 8, Vβ 9 e Vβ 12, assim como as famílias Vβ 1, Vβ 5.2, Vβ 9, Vβ 14, e Vβ 23 são mais frequentes em linfócitos T CD8 + (Grunewald, Janson & Wigzell, 1991; Clarke et al, 1994; Muraro et al, 2000; van der Beemd et al, 2000; Melenhorst et al, 2002). A habilidade dos linfócitos T em detectar, eliminar e memorizar uma variedade de antígenos encontrados em vários patógenos é garantida por esta extraordinária diversidade do repertório de seus receptores, e pela capacidade de distinguir uma infinidade de sequências peptídicas (antígenos) diferentes, desencadeando uma cascata de eventos imunológicos (Murre, 2007) Reconhecimento Antigênico e Ativação de Clones Específicos Na LTA, o curso da doença é determinado pela natureza e magnitude das respostas orquestradas por linfócitos T, os quais precisam ser ativados, através da apresentação antigênica e da ação de citocinas, para exercer suas funções em total plenitude. A apresentação dos antígenos de Leishmania ocorre preferencialmente via MHC classe II para os linfócitos T CD4 + (Scott et al, 1989). Alguns autores já demonstraram que os linfócitos T CD8 + também são capazes de reconhecer estes antígenos através da apresentação via MHC classe I (Conceição-Silva et al, 1994; Rodriguez et al, 1999; Bertholet et al, 2006; Janeway, 2008b). Para isto, os antígenos de Leishmania são transportados do vacúolo parasitóforo para o citosol, onde são processados por proteossomos, para então serem apresentados no contexto do MHC classe I (Ruiz & Becker, 2007). A habilidade de um antígeno endocitado de escapar do compartimento endossomal para o citoplasma e ser apresentado via MHC classe I é chamada de apresentação cruzada (cross presentation) (Kovacsovics-Bankowski & Rock, 1995; Janeway, 2008b). Os linfócitos T, para os quais os peptídeos antigênicos são apresentados, são denominados de células naïve (virgens), ou seja, células que não tiveram contato prévio com nenhum antígeno relacionado, sendo assim também conhecidas como células em repouso (resting cells). A manutenção da viabilidade e da diversidade destes linfócitos T naïve é garantida pela seleção positiva, mencionada anteriormente, que também acontece nos 33
34 ambientes extratímicos através da constante interação TCR-MHC. Além da interação com MHC, os linfócitos naïve também dependem do contato com a IL-7 para se manterem vivos e neste estado funcional (Pinti et al, 2010; Kim, Hong & Park, 2011). O estado inativo das células naïve é mantido até que uma APC apresente algum peptídeo antigênico a estes linfócitos (Mescher et al, 2006; Sarkar et al, 2008). Após a interação do complexo MHC-peptídeo com o TCR, o CD3 se encarrega de transduzir os sinais para o interior do linfócito T, enquanto a molécula adaptadora CD4 ou CD8 (ligada ao MHC classe II ou MHC classe I, respectivamente) exercem a função de sustentar esta interação (Figura 1.5). Figura 1.5: Apresentação e reconhecimento antigênico no contexto MHC-peptídeo-TCR. APC (célula apresentadora de antígeno); MHC (complexo principal de histocompatibilidade classe I); TCR (receptor de célula T; CD8 + T (linfócito T CD8 + ); CD8 (molécula adaptadora); α e β (cadeias alfa e beta que compõem os heterodímeros MHC e TCR). Além destas interações, a ativação das células naïve requer outros dois sinais adicionais. Um deles é dado pela interação das moléculas co-estimulatórias, B7-1 (CD80) e B7-2 (CD86) presentes na superfície das APCs, à molécula CD28, expressa em 95% dos linfócitos T CD4 + e em 50% dos linfócitos T CD8 + (Bromley et al, 2010; van der Merwe & Cordoba, 2011). Esta interação regula positivamente os genes de sobrevivência, facilitando assim a progressão do ciclo celular e a produção de IL-2 (Sharpe & Freeman, 2002). Outra importante molécula co-estimulatória é o CD27, membro da superfamília de receptores do fator de necrose tumoral (TNF). Esta glicoproteína transmembrana de linfócitos T e B têm como único ligante o CD70, presente principalmente em células dendríticas. Após a interação com o CD70, a trimerização do CD27 contribui para a sinalização intracelular que 34
35 resulta na ativação do linfócito. Em consequência da ativação celular há um aumento da expressão de CD27 nos linfócitos naïve, entretanto, conforme estas células se diferenciam em efetoras, este receptor é liberado da superfície dos linfócitos, muito provavelmente por proteases ligadas à membrana (Loenen et al, 1992; Hamann et al, 1999; Schildknecht et al, 2007). Tanto em humanos como em modelos de infecção murinos, foi revelado que os linfócitos T CD8 + efetores apresentam baixa ou nenhuma expressão deste receptor (Kuijpers et al, 2003; Wherry et al, 2003; Baars et al, 2005). Neste contexto, a interação CD27-CD70 parece ser crucial para a regulação da resposta imune celular (Nolte et al, 2009). O outro sinal necessário para a ativação das células naïve é dado pela secreção de citocinas, pelas APCs, como por exemplo: IL-12, IFN tipo I (IFN-α e β) e IL-4. Após a ativação, os sinais co-estimulatórios precisam ser sustentados ou modificados para promover a expansão clonal e a diferenciação celular. Nos linfócitos T, o CD40L (ligante de CD40, presente na superfície das APCs) desempenha o papel de induzir a expressão de B7, que por sua vez contribui com a ativação celular. A IL-2, ao interagir com seu ligante (CD25), também participa deste processo, orientando a expansão do número de linfócitos T antígenoespecíficos e a diferenciação destas células. Assim como o CD25, a molécula CD69 também faz parte do fenótipo dos linfócitos ativados, sendo a quantificação destes receptores uma das ferramentas utilizadas para se determinar tal ativação. A caracterização fenotípica, não só das células naïve, mas também de outras subpopulações de linfócitos T, como células efetoras e de memória, são frequentemente realizadas através da determinação da expressão de isoformas de CD45 (CD45RA e CD45RO); de moléculas co-estimulatórias (CD27 e CD28); e/ou de moléculas associadas à migração celular, como CCR7 e CD62L, na membrana destas células. Desta forma, a expressão destas moléculas e a interação com seus ligantes são fortemente reguladas e dependentes do estado de ativação celular. Após o reconhecimento antigênico, as células ditas efetoras são linfócitos que foram ativados e executam suas funções de forma a eliminar o parasito (Hamann et al, 1997; Young et al, 1997; Sallusto et al, 1999; Baars et al, 2000; Hendriks et al, 2000; Boyman et al, 2009). Neste contexto, na infecção por Leishmania, a atividade efetora mútua e a cooperação entre os linfócitos T CD4 + e CD8 + parecem definir o curso da resposta imune responsável pela imunopatogenia na LTA. Os linfócitos T CD4 + (T helper Th) ativados, reativos aos antígenos de Leishmania, são responsáveis por orquestrar e direcionar a resposta imune celular. Em modelos murinos de infecção por Leishmania, foi estabelecida uma dicotomia de perfis de diferenciação de linfócitos T CD4 + baseado na produção de determinadas citocinas: 35
36 perfil de resposta do tipo Th1, caracterizada por um elevado nível das citocinas IL-2, IFN-γ e TNF-α; e perfil de reposta do tipo Th2, que é caracterizada pela secreção principalmente de IL-4, IL-5, IL-10 e IL-13 (Locksley & Scott, 1991; Reiner & Locksley, 1993). A secreção destas últimas resulta em ativação de linfócitos B, com consequente produção de anticorpos e em ausência de estímulo de ativação de macrófagos para destruição do parasito, sendo o perfil Th2 associado a uma anergia na resposta imune em relação ao parasito, observada na progressão da doença (Scott et al, 1989; Cáceres-Dittmar et al, 1993; Reiner & Locksley, 1993; Sacks & Noben-Trauth, 2002). Na resposta do tipo Th1, a produção de citocinas pró-inflamatórias tem sido associada à cura da doença, não só pela ativação de macrófagos através do IFN-γ, que aumenta sua habilidade em fagocitar e destruir os parasitos, mas também pela indução e manutenção de linfócitos T CD8 + citotóxicos, através da IL-2 (Ruiz & Becker, 2007). Estes linfócitos T CD8 + citotóxicos têm a propriedade de destruir as células infectadas por mecanismos de citotoxicidade, através da liberação de grânulos líticos, após o reconhecimento do antígeno na superfície da célula-alvo, ou por secreção de citocinas do tipo Th1. Tais grânulos compreendem a perforina, que é capaz de formar poros na membrana das células alvo, comprometendo assim a integridade das mesmas e induzindo morte celular por apoptose; e também a granzima, outra proteína citotóxica, que tem a capacidade de ativar caspases na célula-alvo, levando-a a morte por apoptose (Sacks & Noben-Trauth, 2002; Ruiz & Becker, 2007). Atualmente tem sido descrita uma terceira classe de grânulos líticos, chamada granulisina, cuja atividade antimicrobicida a torna capaz de induzir apoptose de células-alvo (Janeway, 2008(a)). Neste contexto, a secreção destes grânulos é fundamental para os mecanismos efetores destes linfócitos, induzindo apoptose nas células infectadas. Além da citotoxicidade, os linfócitos T CD8 + efetores participam do processo de resolução da infecção por Leishmania, através da secreção de IFN-γ que ativa os macrófagos, induzindo-os a destruir estes parasitos (Pompeu et al, 2001; Da-Cruz et al, 2002; Nateghi Rostamani et al, 2010). Os pacientes de LTA com menor capacidade de montar uma resposta imune celular do tipo Th1 tendem a um pior prognóstico da doença e a uma resposta terapêutica menos favorável (Scott et al, 1989; Coutinho et al, 1996). Já foi reportado que as células T de pacientes de LC que apresentaram cura espontânea apresentam uma intensa proliferação quando reestimuladas com antígenos de Leishmania (in vitro) e uma alta capacidade de produção de IFN-γ (Carvalho et al, 1995). Contudo, indivíduos naturalmente capazes de controlar a infecção apresentam mecanismos imunológicos que levam a um adequado 36
37 equilíbrio da produção de IFNγ e IL-10, associado a um controle da replicação parasitária sem causar danos teciduais (Gomes-Silva et al, 2007). Paralelamente, pacientes de LM apresentam produção exarcebada de IFN-γ e TNF-α, as quais parecem ser responsáveis pelos danos teciduais que caracterizam as manifestações clínicas desta forma da doença (Bacellar et al, 2002; Da-Cruz et al, 2002). Atualmente, se aceita, de maneira geral, que a diferença entre resistência e susceptibilidade à infecção por Leishmania está relacionada ao balanço entre as citocinas produzidas pelos linfócitos T CD4 + Th1 e Th2 (Pirmez et al, 1993; Bacellar et al 2002; Gomes-Silva, 2007). Além deste perfil de citocinas, a distribuição de linfócitos T CD4 + e CD8 + também está associada às diferentes manifestações clínicas da LTA, resultando em uma resposta celular de hipersensibilidade que pode ser avaliada pela intensidade do teste de IDRM (Barral et al, 1987; Coutinho et al, 1987; Hernández-Ruiz et al, 2010) (Tabela 1.1). Tabela 1.1: Perfis de resposta imune celular associada às diferentes formas clínicas da leishmaniose tegumentar Americana. LM (leishmaniose mucosa); LC (leishmaniose cutânea); LDiss (leishmaniose disseminada); LD (leishmaniose difusa); Th1 e Th2 (perfil de produção de citocinas, por linfócitos T CD4 +, do tipo 1 e do tipo 2); CD4 e CD8 (linfócitos T CD4 + e CD8 + ); IDRM (Teste de Intradermorreação de Montenegro). Em pacientes de LC, a evolução para a cura está associada a uma regulação aumentada de linfócitos T CD8 +, principalmente pela produção de IFN-γ (Uzonna, Joyce & Scott, 2004). Além disso, foi demonstrado, em modelo experimental, que os linfócitos T CD8 + contribuem para uma produção ótima de IFN-γ pelos linfócitos T CD4 + (Herath, Kropf & Muller, 2003). Segundo Uzonna, Joyce e Scott (2004) na ausência de linfócitos T CD8 + há uma sustentação do perfil Th2, e o perfil Th1 depende da produção de IFN-γ por linfócitos T CD8 +, os quais teriam então um papel regulador dos linfócitos T CD4 +. Entretanto, a produção exacerbada de IFN-γ pode estar envolvida com o dano tecidual e com as formas mais graves da doença (Brodskyn et al, 1997; Bacellar et al, 2002). Estes dados parecem confirmar o importante papel dos linfócitos T CD8 + em uma resposta equilibrada durante a LC, provavelmente relacionada à destruição de células infectadas, levando à resolução da infecção (Chan, 1993; Conceição-Silva et al, 1994; Da-Cruz et al, 1994; Coutinho et al, 1998; Agnelo et al 2003; Da-Cruz et al, 2005; Ruiz & Becker, 2007; Hernández-Ruiz et al, 2010) (Figura 1.6). 37
38 Figura 1.6: Resposta imune celular durante a leishmaniose tegumentar Americana. APC (célula apresentadora de antígeno); MHC (complexo principal de histocompatibilidade); TCR (receptor de célula T); IL (interleucina); IFN-γ (Interferon gama); TNF-α (Fator de necrose tumoral alfa) Linf T (linfócito T); Th1 e Th2 (linfócitos T helper - CD4 + - que produz citocinas do tipo 1 ou 2). Adaptado de Ruiz & Becker, Durante a fase efetora, os linfócitos T atuam de forma a promover a destruição das células-alvo através da secreção de citocinas e grânulos líticos, no caso dos linfócitos T CD8 +. Estas células possuem um fenótipo que se caracteriza pela modulação de determinadas moléculas de superfície. Para exercer suas funções efetoras, os linfócitos T deixam de expressar tanto o CD62L como o CCR7, porém passam a expressar VLA-4, que permite a ligação ao endotélio vascular em locais de inflamação. Da mesma forma, tanto o CD28 como o CD27 são liberados nesta fase, enquanto o CD45RA permanece na superfície celular destes linfócitos (Wowk & Trapani, 2004; Abbas & Litchman, 2007) Os Linfócitos T de Memória Após a atividade efetora, a maioria dos clones de linfócitos efetores que participaram do controle do patógeno sofre apoptose. Uma minoria destas células antígeno-específicas (1 a 3 %) se diferencia em linfócitos de memória como uma forma de armazenar as células com especificidade àqueles antígenos, promovendo um grau de proteção ao mesmo. Para tal função, característica da imunidade adaptativa, as células de memória possuem vida prolongada e apresentam altas taxas de divisão celular que contribuem para a sua renovação e manutenção (Tough & Sprent, 1994; Zielinski et al, 2011). 38
39 Além dos linfócitos efetores, os linfócitos naïve também podem se diferenciar em células de memória durante uma resposta imune antígeno-específica. O processo de diferenciação das células naïve em células de memória já foi demonstrado em linfócitos T CD4 + e sugerido para linfócitos T CD8 + (Sprent & Tough, 1994; Sallusto et al, 1999; Scott et al, 2004; Stemberger et al, 2007). Em ambos os casos, o antígeno previamente reconhecidos, caracteriza a especificidade das células de memória, as quais são capazes de montar uma resposta qualitativa e quantitativamente aumentada, em relação à resposta primária. O reconhecimento deste antígeno leva a uma ativação e intensa proliferação dos linfócitos de memória específicos aos mesmos, de forma que as atividades efetoras destas células resultam em rápida secreção de citocinas e/ou de grânulos líticos (Abbas & Litchman, 2007). A resposta imune celular de memória está diretamente relacionada com a proteção contra determinados patógenos, quando responde de forma eficaz a um antígeno previamente reconhecido pelo sistema imune (Gourley et al, 2004). Devido a estas propriedades, as células de memória são alvo de estudos para a elaboração de vacinas e estratégias para controle de doenças causadas não só por patógenos, como também por antígenos próprios como nas doenças auto-imune e no câncer (Zanetti, Castiglioni & Ingulli, 2010). Os mecanismos de geração e manutenção destes linfócitos T de memória ainda não estão completamente esclarecidos. Sabe-se que estas células fazem parte de uma população heterogênea que apresenta diferenças quanto à capacidade de responder a uma infecção e promover proteção, podendo ser diferenciadas por seus receptores de superfície, pela secreção de citocinas e pela atividade citotóxica (Hamann et al, 1997). Sendo assim, os linfócitos T de memória podem ser divididos em células de memória central (T MC ) e células de memória efetora (T ME ). Neste contexto, alguns estudos têm demonstrado a importância destas duas subpopulações celulares não só no controle de infecções, mas também na eficácia de vacinas (Lauvau et al, 2001; Seaman et al, 2004; Zaph et al, 2004). Fenotipicamente ambas as subpopulações de linfócitos de memória são CD45RA - CD45RO + e podem ser diferenciadas pelas moléculas co-estimulatórias CD27 ou CD28 e/ou pelas moléculas associadas à migração celular, como CD62L e CCR7, devido às diferentes características funcionais entre as células de memória efetora e central (Hamann et al, 1997; Young et al, 1997; Sallusto et al, 1999; Baars et al, 2000; Hendriks et al, 2000). Os linfócitos T MC estão concentrados nos órgãos linfóides secundários. A viabilidade destas células é mantida por longo período mesmo na ausência de estímulo antigênico, apresentando uma baixa atividade efetora. Entretanto, sob novo estímulo antígeno-específico, estas células podem ser prontamente ativadas. Algumas moléculas como CD27, CD62L, 39
40 CCR7 são expressas constitutivamente por estas células, além do CD45RO, mencionado anteriormente. Já os linfócitos T ME dependem de um estímulo antigênico contínuo para que a manutenção da sua viabilidade seja garantida. Estas células povoam preferencialmente tecidos periféricos e têm a capacidade de se diferenciar rapidamente em células efetoras sendo direcionadas para o sítio de infecção. Sendo assim, estas células expressam moléculas, como o CD25 e CD69, indicando seu estado ativado e são capazes de secretar IFN-γ, IL-4 e IL-5. Além disso, as células de memória podem ser caracterizadas pelo fenótipo CD45RO + CD45RA - CD27 - CCR7 - (Hamann et al, 1997; Sallusto et al, 1999; Sallusto et al, 2004). Apesar dos padrões característiscos de distribuição, no sangue as proporções relativas de linfócitos T MC de T ME variam entre os linfócitos T CD4 + e T CD8 +, sendo que as células T MC são predominatemente linfócitos T CD4 + e as células T ME, linfócitos T CD8 + (Sallusto et al, 2004). Uma terceira população de células de memória tem sido caracterizada pela sua produção de perforina, sendo chamadas de células de memória efetoras altamente diferenciadas (T EMRA ) (Geginat, Sallusto & Lanzavecchia, 2003; Harari et al, 2004). O sistema imune reúne uma variedade de fatores que são imporantes para a manutenção das subpopulações de células de memória, assim como de células efetoras e naïve. O controle deste processo envolve fatores de sobrevivência como IL-2, IL-7, e estimulação antigênica. Inversamente, a renovação celular e redução do número de células são controladas pela apoptose, a qual também exerce a função de manter ou recuperar a homeostase do sistema imune. A sobrevivência das células naïve, em repouso, durante alguns anos; a expansão de linfócitos T em resposta à estimulação antigênica, seguida da remoção e contração destas células; e a seleção de clones antígenos-específicos que são mantidos a longo prazo (células de memória) são exemplos do balanço destes processos de manutenção, renovação e redução das subpopulações (Sprent & Tough, 1994; Abbas & Lichtman, 2007) A apoptose de linfócitos T na Leishmaniose Cutânea A apoptose é um processo de morte comprometido com a manutenção da homeostase, responsável pela renovação; maturação e seleção do repertório de linfócitos; e diferenciação celular, mencionados anteriormente, assim como com a remoção de células infectadas, danificadas ou auto-reativas (Kerr, Willie & Currie, 1972; Cohen et al, 1992; Krammer et al, 1994; 2000; Parolin & Reason, 2001). A apoptose de linfócitos está envolvida nos processos fundamentais que regulam o sistema imune, atuando como um mecanismo capaz de controlar o curso da resposta imune celular (Krammer et al, 1994). Este processo de morte celular 40
41 programada, geneticamente controlado, depende da interação célula-meio externo e envolve a participação de uma família de proteínas, chamada Bcl-2, constituída por membros pró (Bax, Bak e Bid) e anti-apoptóticos (Bcl-2, Bcl-w e Bcl-x L ) (Cohen et al, 1992; Tsujimoto, 2003; Tichý, 2006). O processo apoptótico pode ocorrer através de duas vias principais: a via extrínseca ou dos receptores de morte; e a via intrínseca ou mitocondrial. Estas duas vias diferem no modo pelo qual são iniciadas, mas ambas convergem para a ativação de caspases efetoras (caspases 3, 6, 7), responsáveis pela proteólise observada no processo apoptótico. Após a ativação das caspases efetoras ocorrem alterações funcionais, expressas morfologicamente, por desorganização do citoesqueleto de maneira que a célula perde o contato com as células vizinhas; encolhimento celular; fragmentação do DNA; alteração da membrana plasmática de forma que o fosfolipídeo fosfatidilserina (PS) se desloca da porção interna para a porção externa da membrana plasmática; e formação de corpos apoptóticos contendo os fragmentos nucleares e as organelas condensadas em seu interior (Taylor, Cullen & Martin, 2008). De uma maneira geral, várias horas são necessárias do início do processo de morte celular até a fragmentação celular final, sendo que o cronograma correto depende do tipo celular, do estímulo e da via apoptótica desencadeada (Ziegler & Groscurth, 2004). O evento final do processo apoptótico consiste na remoção dos corpos apoptóticos por fagócitos, sem que haja a formação de um processo inflamatório, já que a integridade da membrana celular das células apoptóticas é mantida e, portanto não há liberação dos constituintes celulares potencialmente indutores de uma resposta inflamatória (Elmore, 2007). A indução e a inibição da apoptose de células hospedeiras tem um importante papel nas infecções parasitárias, podendo estar diretamente relacionadas com o controle e a eliminação dos parasitos (Guillermo et al, 2009). Diversos estudos vêm demonstrando que a exarcebação ou inibição da apoptose de determinadas populações celulares estariam relacionadas ao agravamento ou à cura de doenças como o câncer (Debatin et al,1993; Lane et al, 1994; Debatin, 2009); a AIDS (Gougeon & Montagnier, 1993; Sloand et al, 1997; Ross, 2001; Roshal, Zhu & Planelles, 2001; Gallo & Montagnier, 2003); a diabetes (Barreto et al, 2006); a Doença de Chagas (Lopes et al, 1995; Barcinski & DosReis, 1999; Lüder, Gross & Lope, 2001; de Meis et al, 2008); e as leishmanioses (Das et al, 1999; Bertho et al, 2000; Lüder, Groos & Lopes, 2001; Shaha, 2006; Hernández-Ruiz et al, 2010). A própria Leishmania pode sofrer apoptose como um mecanismo regulatório do número de parasitos durante o processo de divisão celular das promastigotas no trato digestivo do inseto vetor, impedindo que uma multiplicação excessiva comprometa a vida do 41
42 flebotomíneo. Nos macrófagos do hospedeiro vertebrado a apoptose das formas amastigotas pode atuar no controle da divisão celular, regulando o número de parasitos na célula hospedeira e minimizando a resposta imune (Shaha, 2006). Acredita-se que a exposição de fosfatisilserina pelas formas promastigotas está relacionada à capacidade da Leishmania de mimetizar uma morte apoptótica, induzindo a fagocitose das mesmas pelos macrófagos, que contribuiria para o estabelecimento da infecção (Wanderley et al, 2006, 2009). Tem sido observado níveis aumentados de apoptose em linfócitos T durante as infecções por Trypanosoma cruzi (Lopes & DosReis, 1994; Lopes et al, 1995; Martins et al, 1998; DosReis & Lopes, 2009), Toxoplasma gondii (Khan, Matsuura & Kasper, 1996; Luder, Gross, 2005; Lee et al, 1999), Plasmodium sp. (Baldé, Sarthou & Roussilhon, 1995; Matsumoto et al, 2000), e Leishmania sp. (Das et al,1999; Bertho et al, 2000). A morte destas células parece comprometer o processo de expansão clonal e diferenciação celular, resultando em produção insuficiente de citocinas e diminuição de atividade citotóxica que resultariam na persistência do parasito (Guillermo et al, 2009). Tanto em pacientes infectados por Leishmania como em infecções experimentais, tem sido descrita e discutida a influência da apoptose na imunopatogênese da doença. Em camundongos suscetíveis a L. donovani, foi observado um aumento da apoptose de linfócitos T CD4 + após a ativação destas células com conseqüente redução da produção de IL-2 e IFN-γ (Das et al, 1999). A resposta do tipo Th1 realizada pelos linfócitos T CD4 + em camundongos infectados por L. major ou por L. donovani parece ser modulada pela indução do processo apoptótico e modulação da produção de IFN-γ por estar células (Huang et al, 1998; Alexander, Kaye & Engwerda, 2001). Além disso, a anergia celular induzida por antígenos de L. amazonensis, principal agente etiológico da LCD, está associada à apoptose de linfócitos T, que prejudicaria a apresentação antigênica pelos macrófagos, resultando em uma ativação reduzida da resposta imune celular (Pinheiro et al, 2004).Em camundongos suscetíveis à infecção por L. major (BALB/c) foi observado um aumento progressivo deste processo de morte celular programada nos órgãos linfóides, enquanto nos camundongos resistentes a esta infecção (CBA), havia apenas uma apoptose transitória (Desbarats et al, 2000). Tanto os linfócitos T CD4 + como os linfócitos T CD8 +, presentes nos linfonodos de camundongos infectados por L. major, sofrem apoptose durante a infecção (Desbarats et al, 2000). Em lesões de pacientes infectados por L. braziliensis, estas células também sofrem apoptose sendo que este fenômeno de morte se mostra mais acentuado nos linfócitos T CD8 +, o que parece comprometer uma resposta imune eficiente (Bertho et al, 2000). Por sua vez, a morte de linfócitos T CD4 + interfere na produção adequada de citocinas do tipo Th1 42
43 reduzindo assim, a ativação dos linfócitos T CD8 +. Em humanos, a anergia celular e a apoptose, observadas durante a leishmaniose visceral, foram correlacionadas a uma baixa produção de IL-2 e níveis reduzidos de proteínas da família Bcl-2 em linfócitos T os quais poderiam estar entrando em processo de morte por falta do estímulo de ativação (IL-2) e de sobrevivência (Bcl-2) (Das et al, 1999; Mukherjee, Sen & Ghose, 2006). Sendo assim, a apoptose parece ter um papel imunomodulador do sistema imune, seja fisiologicamente, exercendo o papel de controlar a homeostase, seja influenciando a imunopatogenia de uma série de doenças como, por exemplo, a leishmaniose. 1.7 CITOMETRIA DE FLUXO Ao longo dos últimos quarenta anos, a citometria de fluxo veio ganhando espaço no cenário científico, apresentando-se como a principal ferramenta utilizada para a caracterização fenotípica e funcional de uma diversidade de populações celulares, tendo um importante papel no avanço dos conhecimentos na área da imunologia. Esta metodologia permite uma análise celular individual na qual diversas de características, fenotípica e funcional, podem ser avaliada simultaneamente. Particularmente na leishmaniose, a citometria de fluxo tem oferecido uma grande contribuição para o estudo da imunopatogenia desta doença, principalmente, no que diz respeito à frequência e proporção de linfócitos T CD4 + e T CD8 + e a produção de citocinas por estas células (Scott et al, 1989; Da-Cruz et al, 1994; Barral et al, 1995, Coutinho et al, 1996; Bertho et al, 2000; Bottrel et al, 2001; Toledo et al, 2001; Da- Cruz et al, 2002; 2005; Gomes-Silva et al, 2007; Mendes-Aguiar et al, 2009; Maretti-Mira et al, 2011). Com o avanço tecnológico dos equipamentos e com a evolução da produção dos anticorpos monoclonais e substâncias fluorescentes, os protocolos multiparamétricos se mostram cada vez mais elaborados envolvendo uma diversidade de marcadores que possibilitam uma avaliação fenotípica/funcional mais abrangente, envolvendo uma série de abordagens. O estudo da apoptose, inicialmente realizado por microscopia ótica e posteriormente através da microscopia eletrônica (Fesq et al, 1994; Walker et al, 1998) e eletroforese em gel (Wyllie, 1998), passou a ser realizado por citometria de fluxo (Schimid et al, 1994; Darzynkiewicz et al, 1997; Vermes et al, 1995; Douglas et al, 1998; Bertho, Santiago & Coutinho, 2000) a qual se mostra, como uma ferramenta adequada, no que tange a determinação e avaliação de células neste processo de morte e que é atualmente a metologia 43
44 de escolha preferencialmente utilizada (Schimid, Uittenbogaart & Jamienson, 2007; Gille et al, 2011; Zimmermann & Meyer, 2011). Alterações morfológicas, atividade das caspases, manutenção da integridade de membrana, e principalmente a detecção da fragmentação do DNA podem ser utilizados para identificar as células apoptóticas por citometria de fluxo. Além disso, do ponto de vista morfológico, a retração celular pode ser considerada uma característica de morte celular por apoptose. A célula dimunui seu tamanho e aumenta sua granulosidade, sendo facilmente evidenciadas através da citometria de fluxo (Bertho, Santiago & Coutinho, 2000). Entre outros marcadores do processo apoptótico, estão os anticorpos monoclonais anti-caspases iniciadoras (caspases 2, 8, 9 e 10) e anti-caspases efetoras (caspases 3, 6, 7) (Taylor, Cullen & Martin, 2008; Martinez, Reif & Pappas, 2010). Além das características morfológicas e ds anticorpos monoclonais (anti-caspase, anti-bcl, anti-fas); a Anexina-V; o Iodeto de Propídeo; e a 7-AAD também têm sido utilizados para a identificação destas células, podendo ainda ser utilizados concomitantemente a uma análise fenotípica (Nicoletti et al, 1991). O repertório de linfócitos T, o qual era avaliado por biologia molecular (Pantaleo et al, 1994; Hawke, Rast & Litman, 1996; Ria et al, 2001), passou a ser estudado também por citometria de fluxo, principalmente pela possibilidade de reunir informações fenotípicas aos perfis do TCR, através da marcação das células com uma combinação de anticorpos monoclonais (van den Beemd et al, 2000; Lima et al, 2003; Menezes et al, 2004; Giacoia- Gripp et al, 2005; Clarêncio et al, 2006, Keesen et al, 2011; Tembhare et al, 2011). Além disso, a fabricação de kits (kit IOTest Beta Mark TCR Vβ Repertoire Beckman Coulter, EUA) permitiu que o repertório Vβ fosse analisado a partir de um número reduzido de amostras, facilitando e otimizando tal estudo. As alterações fenotípicas que caracterizam o processo de diferenciação celular também têm sido exploradas para a identificação das subpopulações de linfócitos por citometria de fluxo, através de combinações de anticorpos monoclonais como anti-cd45ra, anti-cd45ro, anti-cd27, anti-cd28, anti-ccr7 e anti0cd62l (Hamann et al, 1997; 1999; Sallusto et al, 1999; Baars et al, 2000; Monsurrò et al, 2002; Mackus et al, 2003; Campbell et al, 2009; Nikolova et al, 2009; Libri et al, 2011). Neste cenário, a citometria de fluxo se apresenta como uma ferramenta adequada, moderna, e indispensável para o estudo fenotípico/funcional de diversas populações celulares, permitindo, a partir de protocolos multiparamétricos, determinar características e fenômenos imunológicos, em amostras obtidas de modelos experimentais e de humanos. 44
45 2. JUSTIFICATIVA A extensa distribuição geográfica da Leishmaniose Tegumentar Americana (LTA), sua alta incidência e o grande número de indivíduos expostos fazem desta morbidade uma questão de grande importância para a saúde pública mundial. No Brasil, são registrados anualmente cerca de novos casos de LTA (SVS/MS, 2010), tornando-se necessária uma atenção especial, por parte dos órgãos competentes, aos esforços direcionados para o controle desta doença. A LC é a forma clínica mais frequente da doença e é endêmica no Estado do Rio de Janeiro, onde a maioria dos casos é causada pela espécie Leishmania (Viannia) braziliensis. A estratégia mais expressiva para a profilaxia da LC seria o desenvolvimento de uma vacina capaz de proteger os indivíduos que se encontram nas áreas de risco de transmissão do parasito. Paralelamente, uma terapia menos agressiva, em termos de efeitos colaterais, se faz necessária, com o intuito de amenizar as consequências da terapia atualmente utilizada. A perspectiva de controle desta doença depende de um aprofundamento e detalhamento do conhecimento no que diz respeito aos fenômenos que ocorrem durante a resposta imune específica a Leishmania. Este conhecimento é fundamental para estabelecer parâmetros imunológicos associados com a patogênese, a cura e a resposta protetora da LC, para que possa então, ser aplicado em manipulações terapêuticas e no desenvolvimento de vacinas. Sabendo que a LC está em expansão e ainda sem controle efetivo, estudos mais detalhados em relação à resposta imune são extremamente relevantes para uma melhor compreensão e aprofundamento dos conhecimentos no que diz respeito à imunopatogenia desta doença. Ao longo dos anos, vários estudos vêm demonstrando a importância da resposta imune celular, mediada por linfócitos T, na LC. Os avanços no entendimento desta doença têm sido obtidos através de estudos baseados na avaliação da frequência de linfócitos T CD4 + e T CD8 +. No entanto, estes linfócitos T se diferenciam em células funcionalmente distintas, tornando-se importante uma avaliação das subpopulações naive, efetora, de memória central e de memória efetora (Hamann et al, 1997; Sallusto et al, 2004; Appay et al, 2008). Apesar dos linfócitos T CD4 + orquestrarem a resposta imune celular na LC, os linfócitos T CD8 + parecem estar diretamente relacionados à destruição de células infectadas, atuando não só através da sua atividade citotóxica, com secreção de grânulos citolíticos como, também, através de IFN-γ (Pirmez, 1992; Da-Cruz et al, 1994; Barral-Neto et al, 1995; Mendonça et al, 1995; Brodskyn et al 1997; Coutinho et al, 1998; Pompeu et al, 2001; Da- Cruz et al, 2002; Bertholet et al, 2005; Maretti-Mira et al, 2011). Além disso, já foi demonstrado que a progressão da doença está associada a uma maior ocorrência de apoptose dos linfócitos T CD8 +. Bertho e colaboradores (2000) demonstraram que, em lesões de 45
46 pacientes que evoluíram para a cura espontânea havia um menor percentual de apoptose dos linfócitos T CD8 + enquanto a maior ocorrência deste processo de morte, em lesões de pacientes, estava associada á progressão da doença. Sendo assim, a apoptose teria um papel modulador na resposta imune de pacientes de LC, podendo contribuir para a progressão da doença. Neste contexto, a ativação de linfócitos T; a diferenciação de células efetoras e de memória; e a apoptose são mecanismos envolvidos na resposta imune, os quais estão envolvidos na respoata imune durante a LC e que podem influenciar os processos de proteção, cura e progressão desta doença. Quanto à especificidade dos linfócitos T, diversas pesquisas baseadas na resposta imune adaptativa têm sido conduzidas através da análise da cadeia variável β do TCR, isto é, do repertório Vβ. Diferentes perfis de distribuição deste repertório já foram associados à doenças como leucemia (Plasilova, Risitano & Maciejewski, 2003); esclerose múltipla (Hong et al, 1999); artrite reumatóide (Goodall, Bledsoe & Gaston, 1999); e Doença de Chagas (Costa et al, 2000; Menezes et al, 2004). Na LC, poucos estudos têm sido realizados com o objetivo de avaliar possíveis alterações no perfil do repertório de linfócitos T em pacientes (Uyemura et al, 1993; Clarêncio et al, 2006). Além disso, ainda não há descritona literatura uma análise do repertório Vβ de subpopulações de linfócitos T em pacientes de leishmaniose, o que permitiria uma avaliação dos clones preferencialmente induzidos e que poderiam participar de uma resposta imune no sítio da infecção.. Sendo assim, a avaliação da diversidade dos clones de linfócitos T CD8 + entre subpopulações funcionalmente distintas (naïve, efetora e de memória) e a indução de apoptose nestas células, tornaram-se um importante foco de investigação que possibilita uma melhor compreensão e aprofundamento dos conhecimentos dos fenômenos envolvidos na resposta imune na LC, associados à progressão e à cura da doença. Neste contexto, as informações obtidas através de uma análise fenotípica/funcional multiparamétrica de linfócitos T CD8 + de pacientes, com doença ativa e em tratamento, e curados após o fim daterapia, trazem novas perspectivas para os estudos em vacina; terapias mais eficientes e menos agressivas; e melhores condições de avaliar a resposta terapêutica após o tratamento. Seguindo esta linha de pesquisa, o desenho experimental deste trabalho é fruto do interesse em aprofundar os conhecimentos acerca das características da resposta imune celular por linfócitos T CD8 +, durante a LC causada por L. braziliensis. Para isto, a citometria de fluxo mostra-se como a ferramenta ideal, que permite a realização de uma análise multiparamétrica para determinar características fenotípicas e funcionais dos linfócitos T CD
47 3. OBJETIVO GERAL Avaliar o papel da apoptose e a diversidade do repertório de linfócitos T CD8 + e de suas subpopulações naïve, efetora, de memória central e de memória efetora, na resposta imune de pacientes durante e após o tratamento da leishmaniose cutânea. 3.1 OBJETIVOS ESPECÍFICOS Avaliar a frequência de linfócitos T CD8 + e a ocorrência de apoptose nestas células, obtidas ex vivo e após estimulação in vitro com antígenos de L. braziliensis, nos dois grupos de pacientes e em indivíduos sadios; Determinar a razão da frequência de linfócitos T CD8 + naïve, efetores, de memóriacentral e de memória efetora, a fim de identificar se a distribuição/proporção destas subpopulações sofre alguma alteração, nos diferentes estados imunológicos que se encontram os indivíduos dos três grupos estudados; Avaliar a influência dos antígenos de L. brazliensis na indução de apoptose dos linfócitos T CD8 + naïve, efetores, de memória central e de memória efetora; e na frequência destas subpopulações; Caracterizar o perfil do repertório Vβ do TCR de linfócitos T CD8 +, obtidos ex vivo, através da avaliação do percentual de expressão de 24 cadeias Vβ e comparar a distribuição dos clones entre os indivíduos sadios; os pacientes em tratamento, com doença ativa; e os pacientes pós-tratados, clinicamente curados, a fim de identificar possíveis expansões ou contrações clonais nos diferentes estágios da doença; Caracterizar o perfil do repertório Vβ das células naïve, efetoras, de memória central e de memória efetora, e avaliar se a distribuição dos clones é heterogênea entre estas subpopulações dos linfócitos T CD
48 4. METODOLOGIA 4.1 CASUÍSTICA Participaram deste estudo, indivíduos adultos, maiores de 18 anos com média de idade de 38,1±17,6 anos entre os homens e de 38±13,4 anos entre as mulheres, os quais foram divididos em três grupos: Grupo I: Indivíduos sadios (Controles CTRL; n=18); sem histórico prévio de leishmaniose e que não residem em áreas endêmicas desta doença. Grupo II: Pacientes de leishmaniose cutânea (LC) em tratamento (décimo dia após o início do tratamento com Glucantime ) (pacientes durante tratamento - PDT; n=14), apresentando lesões cutâneas ulceradas, cujo diagnóstico de (LC) foi confirmado por critérios clínicos, epidemiológicos, e exames parasitológicos (cultivo, PCR e/ou imprint). Grupo III: Pacientes de LC após a conclusão da terapia, de acordo com critérios definidos pela equipe médica do IPEC (octagésimo dia após o início do tratamento), clinicamente curados (pacientes póstratamento - PPT; n=11). Todos os pacientes foram atendidos no ambulatório do Serviço de Referência em Leishmaniose do Instituto de Pesquisa Clínica Evandro Chagas (IPEC), FIOCRUZ, e foram submetidos a um ensaio clínico de tratamento, randomizado e duplo cego, com Glucantime. Foram investigadas informações epidemiológicas e clínicas, como idade e sexo; número e área das lesões durante a fase ativa; tempo de evolução; local de moradia dos indivíduos; resposta ao teste de Intradermorreação de Montenegro (IDRM); resposta ao tratamento; cura clínica; reativação e re-infecção, através de levantamento dos prontuários dos pacientes. O critério de cura clínica foi definido pela epitelização total das lesões ulceradas, regressão da infiltração e do eritema, após conclusão do esquema terapêutico (Ministério da Saúde, 2010). Com base nestas definições, as lesões cicatrizadas, em até três meses após a conclusão do esquema terapêutico, foi considerada como cura clínica recente. Em caso de ausência de cicatrização completa, após uso do Glucantime, o tratamento seria considerado insatisfatório, sendo necessário um esquema terapêutico alternativo ou a repetição de um ciclo da mesma terapia antimonial, o que não ocorreu neste estudo, já que todos os pacientes avaliados apresentaram cura clínica após a terapia, e ausência de reativação até o octagésimo dia após o início do tratamento. 48
49 Foram excluídos do estudo os pacientes com doenças sistêmicas concomitantes, que sabidamente interferem na capacidade imunológica do indivíduo; pacientes sob o uso de medicação tópica sobre a lesão cutânea; gravidez; tratamento prévio com leishmanicidas; e pacientes com contra-indicação para o uso do Glucantime, na dose e esquema terapêutico recomendados pelo Ministério da Saúde. Foram excluídos, ainda, os indivíduos que apresentaram resposta negativa à IDRM, a fim de incluir somente aqueles que apresentaram uma resposta imune celular preservada. O estudo segue a resolução 196/96 do Conselho Nacional de Saúde que trata das diretrizes e normas de pesquisas envolvendo seres humanos. O desenho experimental e o Termo de Consentimento Livre e Esclarecido (anexo 1) foram aprovados pelos Comitês de Ética em Pesquisa da FIOCRUZ (CEP-FIOCRUZ) sob o número 502/09 e do Instituto de Pesquisa Clínica Evandro Chagas (CEP-IPEC/FIOCRUZ) sob o número 057/ COLETA DO MATERIAL BIOLÓGICO Foram obtidas amostras de sangue periférico, através de punção venosa em tubos heparinizados (Becton Dickinson, Franklin Lakes, NJ, EUA), num volume máximo de 20 ml de sangue de cada indivíduo, as quais foram enviadas ao laboratório onde foram processadas. O tempo entre a coleta do material biológico e o processamento do mesmo foi no máximo 24 horas. Havendo necessidade os tubos com sangue foram deixados de um dia para o outro (overnight), à temperatura ambiente de 20ºC±2º C, sempre sob homogeneização (Arsec, São Paulo, SP, Brasil). 4.3 OBTENÇÃO DE CÉLULAS MONONUCLEARES DE SANGUE PERIFÉRICO A obtenção de células mononucleares de sangue periférico (CMSP), utilizadas nos ensaios experimentais ex vivo e in vitro, foi feita através de centrifugação em gradiente de Ficoll-Hypaque (Histopaque 1077, Sigma, St. Louis, MO, EUA), descrita a seguir: o sangue heparinizado foi diluído na proporção 1:1 em meio de cultura RPMI 1640 (Gibco, Carlsbad, CA, EUA), suplementado com HEPES (10mM; Sigma, EUA), 2-mercaptoetanol (1mM; Gibco, EUA), L glutamina (1,5mM; Sigma, EUA), penicilina (200UI; Sigma, EUA) e estreptomicina (200µg/mL; Sigma, EUA). O sangue diluído foi então depositado cuidadosamente sobre o Ficoll-Hypaque, numa proporção 2:1, em tubo de 50 ml (Corning Inc., México). Posteriormente, esta amostra foi submetida a uma centrifugação por 30 minutos, a 400 g na temperatura de 20ºC, sem freio (Thermo Fisher Scientific Inc., EUA.). As células mononucleares foram coletadas, com auxílio de uma pipeta Pasteur (Corning Inc., Corning, NY, EUA), a partir do anel de células formado na interface entre o soro e o Ficoll, 49
50 sendo a seguir submetidas a três lavagens, com meio RPMI suplementado, por centrifugação (10 minutos/250 g/20 C, com freio). O número de células viáveis foi determinado através da diluição em Azul de Tripan (Sigma, EUA) seguida da contagem em câmara de Neubauer com auxílio de microscópio óptico (Carl Zeiss Inc., Thornwood, NY, EUA). A concentração de células viáveis foi ajustada para 3x10 6 /ml de meio RPMI suplementado, acrescido de 10% de soro humano AB Rh+ inativado (Sigma, EUA). Estas células foram, então, utilizadas nos ensaios ex vivo e in vitro de caracterização fenotípica e e funciona dos linfócitos T CD ENSAIO EX VIVO PARA AVALIAÇÃO FENOTÍPICA DAS SUBPOPULAÇÕES DE LINFÓCITOS T CD8 +, REPERTÓRIO Vβ E APOPTOSE As CMSP obtidas dos indivíduos dos três grupos estudados foram sedimentadas por centrifugação (679 g, 5 minutos) e ressuspendidas numa solução de Tampão Fosfato contendo 0,1% de azida sódica (Merck, EUA) e 2% de Soro Fetal Bovino (SFB; Sigma, EUA) (PBSaz). Posteriormente, estas células foram distribuídas em tubos de microcentrifugação de 1,5 ml (Eppendorf, Hauppauge, NY, EUA) na concentração 5x10 5 células/50 µl de PBSaz e submetidas a um protocolo citofluorimétrico de marcação, que inclui a 7-AAD (7- aminoactinomicina D) e um painel de anticorpos monoclonais, descrito a seguir (Figura 4.1): para a determinação do repertório Vβ de linfócitos T foi utilizado o kit IOTest Beta Mark TCR Vβ Repertoire (gentilmente cedido pela Beckman Coulter, EUA), o qual é composto por anticorpos monoclonais específicos para um total de vinte e quatro (1, 2, 3, 4, 5.1, 5.2, 5.3, 7.1, 7.2, 8, 9, 11, 12, 13.1, 13.2, 13.6, 14, 16, 17, 18, 20, 21.3, 22, 23) (Tabela 4.1), pertencentes a 19 das 26 famílias Vβ conhecidas. Estas 24 cadeias abrangem 70% do repertório Vβ do TCR de linfócitos T CD3 + de um indivíduo normal, e são divididas em oito frascos de forma que os três anticorpos monoclonais contidos em cada frasco são conjugados ao FITC, ao PE ou ao FITC e PE. Além dos anticorpos anti-vβ, utilizou-se os anticorpos monoclonais anti-cd8/apc; e anti CD45RA/ECD (PE-TR) e anti-cd27/pe-cy7 para identificar as subpopulações naïve, efetora, e de memória (efetora e central), os quais foram adicionados às oito amostras. 50
51 Tabela 4.1: Designação dos anticorpos monoclonais específicos para 24 cadeias Vβ utilizadas no protocolo experimental, conforme distribuição em oito tubos d ensaio contendo a mesma amostra. (A-H). Kit IOTest Beta Mark. Cadeia Vβ* Fluorocromo conjugado Tubo Vβ 5.3 PE A Vβ7.1 FITC/PE A Vβ 3 FITC A Vβ9 PE B Vβ 16 FITC/PE B Vβ17 FITC B Vβ18 PE C Vβ5.1 FITC/PE C Vβ20 FITC C Vβ13.1 PE D Vβ13.6 FITC/PE D Vβ8 FITC D Vβ5.2 PE E Vβ 2 FITC/PE E Vβ 12 FITC E Vβ23 PE F Vβ 1 FITC/PE F Vβ21.1 FITC F Vβ 11 PE G Vβ 22 FITC/PE G Vβ 14 FITC G Vβ 13.2 PE H Vβ 4 FITC/PE H Vβ 7.2 FITC H *Nomenclatura segundo Wei et al (1994). FITC - Isotiocianato de fluoresceína; PE - Ficoeritrina. Após a marcação com os anticorpos monoclonais, as amostras foram incubadas por 30 minutos a 4 C (no gelo), protegidas da luz, e em seguida lavadas com PBSaz por centrifugação (670 g, 5 min.). Posteriormente as amostras foram submetidas à marcação com 20 µg/ml de 7-AAD, para identificação das células em apoptose, incubadas por 30 min a 4ºC, e adquiridas através do citômetro de fluxo em até 12 horas. Havendo a necessidade de realizar a aquisição das amostras posteriormente a este período, as amostras foram submetidas a um protocolo de fixação com actinomicina D (AD; Sigma, EUA) e paraformaldeído (PFA; Sigma, EUA) em PBS. Para isto, as células foram centrifugadas (670 g, 5 min) e o sedimento celular foi ressuspendido em 500 µl de PBS contendo 1% de parafolmaldeído e 20 µg/ml de AD (AD/PFA). As amostras fixadas foram armazenadas em geladeira (2 a 8 o C), protegidas da 51
52 luz, e adquiridas por citometria de fluxo em até cinco dias (Schimid et al, 1994). A combinação de marcadores utilizada na análise citofluorimétrica para avaliar as características celulares está descrita na Tabela 4.2. Figura 4.1: Esquema do protocolo citofluorimétrico utilizado no ensaio experimental ex vivo. São adicionados, em cada uma das oito amostras, anticorpos monoclonais específicos para 3 diferentes cadeias Vβ, anticorpos monoclonais anti-cd8, anticd27 e anti-cd45ra e a 7AAD. Fluorocromos: FITC - Isotiocianato de Fluoresceína; PE - Ficoeritrina; ECD Ficoeritrina-Texas red; PE-Cy7 - Ficoeritrina-Cianina 7; APC - Aloficocianina; 7-AAD - 7-Actinomicina D. Tabela 4.2: Combinação de anticorpos monoclonais e 7-AAD, utilizados como marcadores para avaliar diferentes características celulares por citometria de fluxo, em ensaio experimental ex vivo. Amostra Análise citofluorimétrica Característica celular avaliada CMSP Vβ-FITC + Vβ-PE - Vβ-FITC - PE - Vβ-FITC - Vβ-PE + Vβ-FITC - PE - Vβ-FITC - Vβ-PE - Vβ-FITC - PE + Cadeia Vβ do TCR (em 8 tubos contendo anticorpos monoclonais para 3 famílias Vβ) CD8 high* Linfócito T CD8 + CD45RA + CD27 + CD45RA + CD27 - CD45RA - CD27 - CD45RA - CD AAD low** Linfócito T naïve Linfócito T efetor Linfócito T de memória efetora Linfócito T de memória central Células em apoptose CMSP - Células mononucleares de sangue periférico; Cadeia Variável Beta do TCR (Vβ); Isotiocianato de Fluoresceína (FITC); Ficoeritrina (PE); * high - células que apresentam alta intensidade de fluorescência; ** low - células que apresentam baixa intensidade de fluorescência. 52
53 4.5 PREPARO DE ANTÍGENOS PARTICULADOS DE LEISHMANIA (VIANNIA) BRAZILIENSIS As formas promastigotas da cepa de referência de L. braziliensis (MHOM/BR/75/M2903) foram utilizadas para a obtenção de antígenos particulados, os quais foram utilizados no ensaio experimental in vitro. Os parasitos foram expandidos em garrafas de poliestireno de 25cm 2 contendo meio de cultura Schneider (ph 7,2; Sigma, EUA) suplementado com 1,5 mm de L-glutamina (Sigma, EUA); penicilina (200 UI; Sigma, EUA) e estreptomicina (200 µg/ml; Sigma, EUA); e 20% de soro fetal bovino (Sigma, EUA); 2% de urina. Após o 50º dia de cultivo, quando as leishmânias estão em fase estacionária, os parasitos foram submetidos a duas lavagens por centrifugação (15 minutos, 1900 g, 40º C) com PBS. A seguir foi realizada a contagem de leishmânias e ajuste para 10 8 promastigotas/ml, também em PBS. A suspensão foi submetida a 10 ciclos de congelamento em nitrogênio líquido e descongelamento em banho-maria a 70ºC, a fim de lisar os parasitos e obter o antígeno particulado. Após a confirmação da lise completa, através da ausência de parasitos íntegros, realizada através de microscopia óptica, o antígeno foi aliquotado e conservado a -20 o C. 4.6 ENSAIO IN VITRO PARA AVALIAÇÃO FENOTÍPICA DAS SUBPOPULAÇÕES DE LINFÓCITOS T CD8 + E APOPTOSE As CMSP obtidas dos indivíduos dos três grupos estudados, foram ajustadas em meio RPMI suplementado, acrescido com 10% de soro humano AB Rh+ inativado (Sigma, EUA). Estas células foram distribuídas (3x10 5 /poço) em placa de poliestireno de 96 poços de fundo chato (Beckton & Dickinson, EUA) e cultivadas em estufa com atmosfera úmida de 5% de CO 2 na temperatura de 37ºC (Napco, EUA). A cultura foi realizada em triplicatas sob três diferentes condições de cultivo, baseado no protocolo de resposta proliferativa de linfócitos (Mendonça et al, 1986): células sem estímulo antigênico, utilizadas como controle negativo (background- BG); células estimuladas com o mitógeno Concanavalina-A (Con-A) (1µg/poço) (Sigma, EUA), como controle positivo de proliferação; e células estimuladas com antígenos particulados de L. braziliensis (Ag-Lb) equivalente a 10 6 metacíclicas/poço, para um volume final de 200 µl/poço. 53 promastigotas O tempo de cultura das células estimuladas com Con-A foi de três dias, enquanto as células estimuladas com antígeno de L. braziliensis e as células sem estímulo foram cultivadas por cinco dias. O acompanhamento da cultura foi realizado por microscopia óptica e após o cultivo as células foram submetidas ao protocolo citofluorimétrico de marcação,
54 descrito a seguir: no 3 o dia de cultivo, as CMSP, estimuladas com Con-A, foram homogeneizadas e transferidas para tubos de 1,5 ml (Eppendorf, EUA) e lavadas por centrifugação (670 g, 5 min). As células sedimentadas foram ressuspendidas em PBSaz e submetidas ao protocolo de marcação com 7-AAD (Sigma, EUA) (Schimid et al, 1994), como controle positivo de apoptose. Posteriormente, no 5 o dia de cultivo, as CMSP estimuladas com Ag-Lb assim como as células do BG foram homogeneizadas e transferidas com pipeta Pasteur para tubos microcentrifugação de 1,5 ml (Eppendorf, EUA). Estas células foram sedimentadas por centrifugação (670 g, 5 minutos), ressuspendidas em 50µL de PBSaz e submetidas marcação com anti-cd8/pe, anti-cd45ra/ecd e anti-cd27/pe-cy7 (todos da Beckman Coulter, EUA). A seguir, as amostras foram incubadas por 30 minutos, a 4 o C e protegidas da luz. Após uma lavagem em PBSaz (670 g, 5 min.) foi realizada a marcação intracelular com 7-AAD (Sigma, EUA), para determinar as células em apoptose (Figura 4.2). Quando necessário, foi feita a fixação das células com AD/PFA (Sigma, EUA). A combinação da 7-AAD com os anticorpos monoclonais, utilizados como marcadores para a avaliação das características celulares por citometria de fluxo, após cultivo in vitro, está descrita na Tabela 4.3. Figura 4.2: Esquema do protocolo citofluorimétrico utilizado após o ensaio experimental in vitro. No 3 0 dia do cultivo in vitro, a 7-AAD é adicionada as amostras que contem as células estimuladas com concanavalina-a (Con-A). No 5 0 dia foram adicionados anticorpos monoclonais anti-cd8, anticd27 e anti-cd45ra, e 7-AAD as amostras que contem as celulas não estimuladas background (BG) e aquelas que contém as células estimuladas com antígenos de L. braziliensis (Ag-Lb). Tabela 4.3: Combinação de anticorpos monoclonais e de 7-AAD utilizados como marcadores para avaliar diferentes características celulares por citometria de fluxo, em ensaio experimental in vitro. Amostra Análise citofluorimétrica Característica celular avaliada CMSP CD8 high* Linfócito T CD8 + CD45RA + CD27 + Linfócito T naïve CD45RA + CD27 - CD45RA - CD27 - CD45RA - CD AAD low** 54 Linfócito T efetor Linfócito T de memória efetora Linfócito T de memória central Células em apoptose CMSP - Células mononucleares de sangue periférico * high - células que apresentam alta intensidade de fluorescência; ** low - células que apresentam baixa intensidade de fluorescência.
55 4.7 CITOMETRIA DE FLUXO As amostras foram adquiridas em um total de 50 mil eventos, nos citômetros de fluxo Cyan (Beckman Coulter, EUA), da Plataforma de Citometria de Fluxo do IOC, FIOCRUZ e no citômetro de fluxo FACS Aria (Becton and Dickinson, EUA), da Plataforma do PDTIS, FIOCRUZ. As análises citofluorimétricas foram realizadas utilizando os programas computacionais específicos Summit 4.3 e FACSDiva Definição de Regiões e Compensação de Cores Anticorpos monoclonais isotípicos anti-igg conjugados aos mesmos fluorocromos dos ensaios fenotípicos ex vivo e in vitro foram utilizados para controles negativos de marcação e para o ajuste da voltagem ideal, de forma que as células negativas ficaram representadas até grandeza de 10 1 no gráfico biparamétrico de intensidade de fluorescência. Feito isto, os cursores foram posicionados de modo a formar quatro quadrantes de análise (Figura 4.2B), sendo que as células duplo-negativas foram delimitadas pelo quadrante 3. Para ajustar a compensação de cores foram realizadas seis diferentes marcações simples, isto é, somente um tipo de anticorpo monoclonal e, portanto um fluorocromo, descritos a seguir: anti-cd4/fitc, anti-cd8/pe (Figuras 4.3E e 4.3F), anti-cd45/ecd (Figuras 4.2C e 4.2D), anti-cd3/pe-cy7 e anti-cd45/apc (todos da Beckman Coulter, EUA), além da marcação simples com 7-AAD (Sigma, EUA). A compensação dos sinais interferentes de fluorescência foi baseada nos critérios de aproximação dos valores da intensidade média de fluorescência (mean fluorescence intensity - MFI) entre os quadrantes 1 e 3 (Q1 e Q3), no eixo do x; e entre os quadrantes 3 e 4 (Q3 e Q4), no eixo do y (Figuras 4.3C e 4.3F). As amostras foram adquiridas individualmente e analisadas em gráficos biparamétricos de marcação (dot plot) para avaliar o fluorocromo utilizado na marcação simples versus todos os outros fluorocromos utilizados nas amostras submetidas ao protocolo multiparamétrico. As compensações foram ajustadas de modo que a MFI, no eixo do x, observada no quadrante um (Q1 Figuras 4.3E e 4.3F), represetando as células positivas para o anticorpo utilizado, deveriam ter um valor igual ou mais próximo possível da MIF do quadrante três (Q3 Figuras 4.3E e 4.3F), que representa as células negativas para o mesmo anticorpo. O mesmo procedimento foi feito em relação à MFI no eixo do y, observando-se os quadrantes três e quatro (Q3 e Q4 - Figuras 4.3C e 4.3D). A Figura 4.3G representa uma amostra devidamente compensada para dois fluorocromos. 55
56 Figura 4.3: Ajuste de quadrantes e compensação de cores. Dot plot dividido pelos quadrantes Q1, Q2, Q3 e Q4 (A); limite dos quadrantes posicionado de acordo com a amostra de CMSP não marcada (B); marcação simples com anti-cd45/ecd não compensada, com valores de MFI (intensidade média de fluorescência) diferentes entre o Q1 (quadrante 1) e o Q3 (C); amostra com marcação simples com anti-cd45/ecd compensada, com MFI entre o Q1 e o Q3 ajustada para valores próximos (D); marcação simples com anti- CD8/PE não compensada, com MFI diferentes entre o Q4 e o Q3 (E); a mesma amostra com marcação simples com anti-cd45/ecd compensada, com MFI entre o Q4 e o Q3 ajustada para valores próximos (F); amostra compensada contendo os dois anticorpos monoclonais, analisada em protocolo com compensação previamente ajustada (G). 56
57 4.7.2 Análise Citofluorimétrica das Amostras Obtidas Ex vivo Inicialmente, foi realizada uma marcação simples das CMSP com anticorpos monoclonais anti-cd3, a fim de definir a região de análise (gate) nos linfócitos T, através da estratégia do contra-gate. Para realizar esta estratégia foram criados simultaneamente, um gráfico biparamétrico (dot plot) de granularidade (side scatter SSC; eixo x) vs tamanho (forward scatter FSC; eixo y) (Figura 4.4A) e um histograma de intensidade de fluorescência para se definir a região positiva para CD3 (Figura 4.4B). A partir desta região CD3 positiva, foi possível identificar os linfócitos T no dot plot de SSC vs FSC (exemplificado na Figura 4.4C pela cor azul, correspondente às células CD3 + ). Esta região foi utilizada em todas as análises citofluorimétricas ex vivo realizadas no estudo (Figura 4.4D). Figura 4.4: Estratégia do contra-gate para definição da região de análise (gate) nos linfócitos. Gráfico (dot plot) de granularidade (SSC) vs tamanho (FSC) (A); histograma de marcação para o anticorpo monoclonal anti- CD3 (células negativas pico; e positivas pico, em azul) (B); população de linfócitos T CD3 + representados em azul no dot plot SSC vs FSC (C); dot plot com gate de linfócitos utilizado na análise de novas amostras (D). A partir disto, foi criado um protocolo citofluorimétrico multiparamétrico, no qual, primeiramente, foi feito um gate na região dos linfócitos (Figura 4.5A), baseado na marcação com anti-cd3 (como descrito anteriormente na Figura 4.4), a partir do qual foi identificada a população de linfócitos T CD8 +, com alta intensidade de fluorescência (high) (Figura 4.5B e 4.5C). 57
58 Figura 4.5: Dot plot de granularidade (SSC) vs tamanho (FSC), com gate de linfócitos em azul (A); histograma baseado no gate de linfócitos e linfócitos T CD8 + separados das células natural killer pela diferença entre alta e baixa intensidade de fluorescência delimitada por gate, respectivamente, (B); Dot plot de anti-cd8 vs FSC, baseado no gate de linfócitos, e gate de linfócitos T CD8 + com alta intensidade de fluorescência, em vermelho (C). A partir do gate de linfócitos T CD8 + (Figura 4.6B), outros dot plots foram criados com o intuito de avaliar: o percentual de expressão de três diferentes cadeias Vβ (PE + ; FITC + PE + ; e FITC + ) nos linfócitos T CD8 + (Figura 4.6C); o percentual de linfócitos T CD8 + efetores (CD8 + CD45RA + CD27 - ), naïve (CD8 + CD45RA + CD27 + ), de memória efetora (T CD8 + ME) (CD8 + CD45RA - CD27 - ), e de memória central (T CD8 + MC) (CD8 + CD45RA - CD27 + ) (Figura 4.6D); e o percentual de linfócitos T CD8 + em apoptose, com base na positividade para a marcação com 7-AAD, apresentando baixa intensidade de fluorescência (CD8 + 7-AAD low ) (Figura 4.6E). Adicionalmente, a partir de um gate em cada uma das quatro subpopulações de linfócitos T CD8 +, o percentual de apoptose e de expressão das três cadeias Vβ, representados graficmente pelos dot plots das Figuras 4.6F e 4.6G, respectivamente. Vale ressaltar que, apesar das células em apoptose também poderem ser identificadas na região do gráfico que representa um menor tamanho (baixo FCS), tais células não foram incluídas no gate de análise, devido ao fato destas células estarem em processo final de apoptose. Nesta etapa da morte celular as células apresentam alterações na membrana plasmática, e consequentemente, de moléculas e receptores de superfície, influenciando a avaliação fenotípica. 58
59 Figura 4.6: Esquema representativo do protocolo citofluorimétrico utilizado na análise de cada amostra obtida ex vivo: (A) dot plot de SSC vs FSC e gate nos linfócitos (azul); (B) gate nos linfócitos T CD8 +, (vermelho); (C) linfócitos T CD8 + que expressam a cadeia Vβ 5.3 (PE + ), ou Vβ 3 (FITC + PE + ), ou Vβ 7.1 (FITC + ); (D) linfócitos T CD8 + 7-AAD low, em apoptose; (E) linfócitos T CD8 + efetores (CD45RA + CD27 + ), naïve (CD45RA + CD27 + ), de memória efetora (CD45RA - CD27 - ) e de memória central (CD45RA - CD27 + ); (F) expressão de cadeia Vβ pelas quatro diferentes subpopulações; (G) subpopulações de linfócitos T CD8 + em apoptose. * Os anticorpos anti-vβ utilizados na amostra exemplificada, pertencem ao tubo A do kit IOTest Beta Mark: anti-vβ 5.3 (PE); anti-vβ 3 (FITC-PE); e anti-vβ 7.1(FITC). 59
60 4.7.3 Análise Citofluorimétrica das Amostras Obtidas Após Estimulação In vitro com Antígenos de Leishmania A identificação dos linfócitos T CD8 + das amostras cultivadas in vitro (Figura 4.7B) foi realizada a partir do gate nos linfócitos, delimitado pela mesma estratégia do contra-gate, descrita no item Nestas amostras, o gate de linfócitos foi criado de forma a incluir as células blásticas, observadas nestes experimentos, de acordo com seus perfis morfológicos (tamanho e granularidade) (Figura 4.7A). A partir do gate de linfócitos T CD8 + (Figura 4.7B) foram identificados as células em apoptose (Figura 4.7C); e as células naïve, efetoras, e de memória (Figura 4.7D). A seguir, foram identificadas as células em apoptose, a partir do gate em cada subpopulação (Figura 4.7E). Figura 4.7: Representação gráfica do protocolo citofluorimétrico de análise multiparamétrica das amostras obtidas após cultivo in vitro: (A) dot plot de SSC vs FSC e gate nos linfócitos (azul); (B) gate linfócitos T CD8 +, (vermelho); (C) linfócitos T CD8 + 7-AAD low, em apoptose; (D) linfócitos T CD8 + efetores (CD45RA + CD27 + ), naïve (CD45RA + CD27 + ), de memória (CD45RA - ); (E) subpopulações de linfócitos T CD8 + em apoptose. 60
61 4.8 ANÁLISE ESTATÍSTICA Os resultados foram expressos como média±desvio padrão e mediana. As análises de variância entre os três grupos estudados foram realizadas através do teste ANOVA, não paramétrico (teste Kruskal-Wallis) e do pósteste de Dunns. Os resultados do ensaio experimental in vitro foram avaliados pelo teste pareado, não paramétrico de Wilcoxon. Todos os cálculos estatísticos e representações gráficas destes resultados foram obtidos através do programa GraphPad Prism 5 (GraphPad Software Inc., La Jolla, CA, EUA). Foram consideradas estatisticamente significantes as diferenças que apresentaram valores de p<0,05. 61
62 5. RESULTADOS 5.1 CARACTERÍSTICAS CLÍNICAS E EPIDEMIOLÓGICAS DOS INDIVÍDUOS AVALIADOS Foi avaliado um total de 22 pacientes com leishmaniose cutânea (LC) provenientes do Estado do Rio de Janeiro. Deste total, 15 são do sexo feminino e 7 são do sexo masculino, com idade média ± desvio padrão de 38,1±16,2 anos. A maioria dos pacientes (54,4%) reside em Bangu e Campo Grande, na cidade do Rio de Janeiro; e em Friburgo e São Fidélis, no norte do estado. Nenhum dos pacientes apresentou a forma disseminada da doença, ou evolução para a forma mucosa. As principais características clínico-epidemiológicas dos pacientes estão representadas na Tabela 5.1. Os pacientes foram divididos em 2 grupos: um grupo de pacientes durante o tratamento (PDT), composto por 14 indivíduos; e outro grupo de pacientes póstratamento (PPT), composto por 11 indivíduos. A maioria dos pacientes apresentou apenas uma lesão (19 em 22 pacientes; 86,3%) e o tempo de evolução mais frequente foi de 2 meses (9 em 22 pacientes; 40,9%). Todos os pacientes avaliados durante o tratamento (PDT), ainda apresentavam lesão ulcerada, com infiltrado inflamatório, podendo ser observado que, mesmo após dez dias sob terapia antimonial, estes pacientes ainda apresentavam doença ativa. Ao fim da terapia antimonial (80 dias após o início do tratamento), todos os pacientes avaliados apresentaram resposta satisfatória ao tratamento e nenhum deles apresentou reativação da doença. Desta forma, o grupo de PPT foi composto por indivíduos com cura clínica recente. O grupo controle (CTRL) foi composto por 18 indivíduos sadios, sem diagnóstico prévio de leishmaniose, residentes no Estado do Rio de Janeiro, fora de áreas endêmicas. A idade média±desvio padrão deste grupo foi igual a 33,7 ± 10,7 anos. 62
63 Tabela 5.1: Características clínicas e epidemiológicas dos 22 pacientes de leishmaniose cutânea incluídos no estudo. Característica Freqüência (n) Percentual (%) Sexo Masculino 15 (22) 68,1 Feminino 7 (22) 31,8 Local de Residência Bangu 3 (22) 13,6 Campo Grande 3 (22) 13,6 Friburgo 3 (22) 13,6 Itaguaí 1 (22) 4,54 Japeri 1 (22) 4,54 Nova Iguaçu 1 (22) 4,54 Padre Miguel 1 (22) 4,54 São Fidélis 3 (22) 13,6 Saquarema 1 (22) 4,54 Senador Vasconcelos 1 (22) 4,54 Seropédica 1 (22) 4,54 Teresópolis 2 (22) 9,09 Tempo de Evolução 1 mês 6 (22) 27,2 2 meses 9 (22) 40,9 3 meses 4 (22) 18,1 5 meses 3 (22) 13,6 Número de lesões 1 lesão 19 (22) 86,3 3 lesões 2 (22) 9,09 8 lesões 1 (22) 4,54 Local da Lesão Antebraço 4 (22) 18,1 Braço 8 (22) 36,3 Face 4 (22) 18,1 Mão 3 (22) 13,6 Perna 4 (22) 18,1 (n) Número de pacientes avaliados 63
64 5.2 AVALIAÇÃO DO PERCENTUAL DE LINFÓCITOS T CD8 + OBTIDOS EX VIVO E IN VITRO A partir da determinação dos percentuais médios dos linfócitos T CD8 +, obtidos ex vivo, foi realizada uma análise comparativa entre os CTRL (n=18), os PDT (n=14) e os PPT (n=11). Foi observado um menor percentual médio de linfócitos T CD8 + nos PDT (15,2%±6,6%; mediana=18,1%), quando comparado ao percentual médio destas células nos CTRL (23,6%±5,4%; mediana=22,1%) (p<0,01). Já os PPT apresentaram um maior percentual médio destes linfócitos (21,1%±7,7%; mediana=19,8%) quando comparado aos PDT, e ligeiramente inferior, quando comparado aos CTRL. Estes dados sugerem que haja uma tendência ao restabelecimento da frequência destas células e que a maior frequência das mesmas pode estar associada à cura da lesão e controle da infecção (Figura 5.1A). Com o objetivo de avaliar a frequência de linfócitos T CD8 + sob estimulação antigênica, esta análise comparativa também foi realizada a partir das células obtidas após estímulo in vitro com antígenos de Leishmania braziliensis (Ag-Lb). Nestes experimentos foram analisadas amostras de oito CTRL, doze PDT e seis PPT. O padrão de resultados observados in vitro foi semelhante àqueles obtidos ex vivo. O percentual médio dos linfócitos T CD8 + nos PDT, após estímulo antigênico, foi inferior (13,9%±3,5%; mediana=14,2%) e estatisticamente significante quando comparado ao percentual destas células tanto nos CTRL (21,3%±2,7%; mediana=22%) (p<0,01), como nos PPT (25,7%±10,5%; mediana=28,0%) (Figura 5.1B). Os resultados in vitro sugerem que os Ag-Lb modulam de maneira oposta a frequência de linfócitos T CD8 + durante a doença e após a cura clínica, sendo que a diminuição destas células foi relacionada à fase ativa da doença e o aumento das mesmas após o fim da terapiare parece estar associado à resolução da lesão. Figura 5.1: Avaliação, ex vivo (A) e in vitro (B), do percentual de linfócitos T CD8 +. Foram avaliados CTRL (controles - indivíduos sadios) (A: n=18; B: n=8), PDT (pacientes durante o tratamento, com doença ativa) (A: n=14; B: n=12), e PPT (pacientes póstratamento) (A: n=11; B: n=6). * (p<0,05) e ** (p< 0,01). Valor de p obtido pelo teste ANOVA não-paramétrico de Kruskal-Wallis e pósteste de Dunns. A mediana foi representada por barras horizontais. Cada ponto representa um indivíduo. 64
65 A fim de avaliar a influência do estímulo antigênico sob a frequência de linfócitos T CD8 +, foi realizada uma análise pareada entre o percentual dos linfócitos T CD8 + não estimulados (background - BG) e aqueles estimulados com antígenos de Leishmania (Ag-Lb). Nos CTRL, não foi observada diferença entre os percentuais das células cultivadas sem estímulo (BG) (18,2%±4.6%; mediana=18,1%) e aquelas estimuladas com Ag-Lb (20,3%±4,7%; mediana=22%) (Figura 5.2A), demonstrando assim que estes antígenos não alteraram a frequência destas células. Já nos PDT, o percentual de linfócitos T CD8 + sob este estímulo antigênico (13,1%±3%; mediana=13,1%) apresentou uma diminuição significante em relação ao BG (16,7%±3,6%; mediana=16,7%) (p<0,001) (Figura 5.2B). Inversamente, nos PPT, o percentual de linfócitos T CD8 + estimulados com Ag-Lb (22,8%±11,9%; mediana=21,6%) foi superior ao percentual de células cultivadas sem estímulo antigênico (17,8%±9,1%; mediana=16,1%) (p<0,05) (Figura 5.2C). Estes resultados demonstram uma especificidade da resposta por linfócitos T CD8 + frente aos Ag-Lb, tanto nos PDT como nos PPT, levando a uma diminuição e a um aumento destas células, respectivamente. Figura 5.2: Avaliação do percentual de linfócitos T CD8 + cultivados in vitro, sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (viannia) braziliensis (Ag-Lb). Foram avaliados CTRL (controles - indivíduos sadios) (A) (n=8), PDT (pacientes durante o tratamento, com doença ativa) (B) (n=12), e pacientes póstratados (PPT) (C) (n=6). * (p<0,05) e ***(p<0,001). Valor de p obtido pelo teste pareado, não-paramétrico de Wilcoxon. As linhas contínuas ligam os resultados referentes ao mesmo indivíduo. 65
66 5.3 PERFIL DE DISTRIBUIÇÃO DAS SUBPOPULAÇÕES DE LINFÓCITOS T CD8 + A partir do gate de linfócitos T CD8 + totais (Figura 5.3B), foram identificadas as subpopulações naïve; efetora; de memória efetora; e de memória central com base na expressão das moléculas de superfície CD45RA e CD27 (Figura 5.3E). O perfil de distribuição destas quatro subpopulações foi avaliado individualmente nos 18 CTRL; nos 14 PDT, com doença ativa; e nos 11 PPT, curados clinicamente. Em relação aos linfócitos T CD8 + totais (percentual médio 23,6%±5,4%), foi observado que, nos CTRL, as células naïve representam a maioria destes linfócitos (35,6%±10%). Um percentual semelhante foi encontrado nas células de memória central (32,5%±11%), enquanto os linfócitos T CD8 + efetores (16,5%±14,5%) e de memória efetora (14,9%±7,5%), representaram as subpopulações minoritárias dos linfócitos T CD8 + totais (Figura 5.3A). Inversamente, nos PDT, as células efetoras (30,79%±14,68%) representaram a maioria dos linfócitos T CD8 + totais (15,2%±6,6%). O percentual médio de células de memória central (31,1%±12,4%) foi semelhante àquele observado das células efetoras e a minoria destes linfócitos foi representada pelas células de memória efetora (15,1%±6,1%). Os linfócitos T CD8 + naïve apresentaram um percentual médio (22,4%±9,5%) com valor intermediário às outras três subpopulações (Figura 5.3B). Já nos PPT, a distribuição dos linfócitos T CD8 + totais (19,9%±8,2%) apresentou uma maioria de células de memória central (38,55%±10,94%) e uma minoria composta por células efetoras (17,49%±16,63%) e células de memória efetora (19,6%±8,1%). Assim como nos PDT, os linfócitos T CD8 + naïve dos PPT apresentaram um percentual médio (29,42%±17,5%) com valor intermediário quando comparado às outras três subpopulações (Figura 5.3C). Ao realizar uma avaliação intragrupo, através da comparação dos percentuais médios das subpopulações de linfócitos T CD8 +, foram observadas algumas diferenças estatisticamente significantes que refletem uma distribuição heterogênea destas células. Paralelamente, através de uma avaliação intergrupo, pôde-se observar que as subpopulaçõesmajoritárias dos três grupos eram diferentes (naïve, nos CTRL; efetora nos PDT; e de memória central nos PPT) e, portanto, a distribuição das subpopulações também mostrou ser heterogênea entre os grupos estudados (Figura 5.3). 66
67 Figura 5.3: Perfil de distribuição de células efetoras (CD8 + CD45RA + CD27 - ), naïve (CD8 + CD45RA + CD27 + ), de memória efetora (T ME ) (CD8 + CD45RA - CD27 - ) e de memória central (T MC ) (CD8 + CD45RA - CD27 + ). Foram avaliados CTRL (controles - indivíduos sadios) (A) (n=18), PDT (pacientes durante o tratamento, com doença ativa) (B) (n=14), e PPT (pacientes póstratamento) (C) (n=11). *** (p<0,05), ** (p<0,01) e * (p<0,001). Valor de p obtido pelo teste ANOVA não-paramétrico de Kruskal-Wallis e pósteste de Dunns. Os resultados foram mostrados como média±desvio padrão. 67
68 5.4 ANÁLISE COMPARATIVA DAS SUBPOPULAÇÕES DE LINFÓCITOS T CD8 + ENTRE OS GRUPOS ESTUDADOS. Ao analisar a diferenciação dos linfócitos T CD8 + em diferentes subpopulações, em relação às células CD8 + CD45RA + CD27 - (efetoras), foi observado que os PDT apresentaram um maior percentual médio (30,8%±14,7%; mediana =31,7%) quando comparado tanto aos CTRL (16,5±14,4%; mediana=13,1%; p<0,01) como aos PPT (17,5%±16,7%; mediana=14,6%; p<0,05) (Figura 5.4). Foi importante notar a semelhança entre o percentual médio destas células efetoras nos CTRL e nos PPT. Além disso, o maior percentual médio observado nos PDT reforça a idéia de que há uma expansão clonal de células efetoras preferencialmente na fase ativa da doença. Figura 5.4: Avaliação, ex vivo, do percentual de linfócitos T (Linf.) CD8 + CD45RA + CD27 - (efetores). Foram avaliados CTRL (controles - indivíduos sadios) (n=18), PDT (pacientes durante o tratamento, com doença ativa) (n=14), e PPT (pacientes póstratamento) (n=11). ** (p<0,01) e * (p<0,05). Valor de p obtido pelo teste ANOVA não-paramétrico de Kruskal-Wallis e pósteste de Dunns. A mediana foi representada por barras horizontais. Cada ponto representa um indivíduo. Após o quinto dia do ensaio experimental in vitro, enquanto os linfócitos T CD8 + efetores dos CTRL (Figura 5.5A) parecem não ser ativados pelos Ag-Lb, (BG:11,5%±2,1%; Ag-Lb:11,9%±2%), em ambos os grupos de pacientes pôde-se observar um aumento da frequência destas células na presença dos Ag-Lb (PDT - BG: 33,1%±9,5%; mediana=37%; Ag-Lb: 41,1%±9,9%; mediana=40,2%; PPT - BG: 26,7%±5,8%; mediana=28,3% Ag- Lb: 37,2±6,1%; mediana=38,4%) (Figura 5.5B e C). 68
69 Figura 5.5: Avaliação do percentual de linfócitos (Linf.) T CD8 + CD45RA + CD27 - (efetores), cultivados in vitro sem estímulo antigênico (background - BG); e sob estímulo de antígenos de Leishmania (viannia) braziliensis (Ag-Lb). Foram avaliados CTRL (controles - indivíduos sadios) (A) (n=8), PDT (pacientes durante o tratamento, com doença ativa) (B) (n=12), e pacientes póstratados (PPT) (C) (n=6). * (p<0,05) e ***(p<0,001). Valor de p obtido pelo teste pareado, não-paramétrico de Wilcoxon. As linhas contínuas ligam os resultados referentes ao mesmo indivíduo. Inversamente, em relação aos linfócitos T CD8 + CD45RA + CD27 + (naïve), os PDT apresentaram um menor percentual médio (22,4%±9,6%; mediana=22,2%) quando comparados aos CTRL (35,6%±9,9%; mediana=33,2%) e aos PPT (29,4%±17,5%; mediana=26,7%). Entretanto somente a comparação entre os percentuais de linfócitos T CD8 + naïve dos CTRL e dos PDT foi estatisticamente significante (p<0,01) (Figura 5.6). Mais uma vez, vale ressaltar a heterogeneidade dos percentuais destas células nos PPT. 69
70 Figura 5.6: Avaliação, ex vivo, do percentual de linfócitos T (Linf.) CD8 + CD45RA + CD27 + (naïve). Foram avaliados CTRL (controles - indivíduos sadios) (n=18), PDT (pacientes durante o tratamento, com doença ativa) (n=14), e PPT (pacientes póstratamento) (n=11). * (p<0,05). Valor de p obtido pelo teste ANOVA nãoparamétrico de Kruskal-Wallis e pósteste de Dunns. A mediana foi representada por barras horizontais. Cada ponto representa um indivíduo. Apesar da diminuição desta subpopulação de linfócitos T CD8 + nos PDT, avaliada ex vivo, após o quinto dia de cultura sob o estímulo de Ag-Lb não foi observada alteração do percentual de células naïve nestes pacientes (BG: 35,7%±8,9%; mediana=37,5% Ag-Lb: 34,8%±7,8%; mediana= 37,8%) (Figura 5.7B), assim como nos PPT (BG: 44,9%±9,5%; mediana=41,2%; Ag-Lb: 43,2%±13,3%; mediana=42,8%) (Figura 5.7C) e nos CTRL (BG: 59,5%±3%; mediana=57,8% Ag-Lb: 58,2%±3,3%; mediana=56,6%) (Figura 5.7A). Figura 5.7: Avaliação do percentual de linfócitos (Linf.) T CD8 + CD45RA + CD27 + (naïve), cultivados in vitro sem estímulo antigênico (background- BG); e sob estímulo de antígenos de Leishmania (viannia) braziliensis (Ag-Lb). Foram avaliados CTRL (controles - indivíduos sadios) (A) (n=8), PDT (pacientes durante o tratamento, com doença ativa) (B) (n=12); e pacientes póstratados (PPT) (C) (n=6). Teste pareado, não-paramétrico de Wilcoxon. As linhas contínuas ligam os resultados referentes ao mesmo indivíduo. 70
71 Em relação aos percentuais de células de memória, os linfócitos T CD8 + CD45RA - CD27 - (T ME ) apresentaram um percentual médio semelhante entre os CTRL (14,9%±7,5%; mediana=12,1%) e os PDT (15,2%±6,1%; mediana=13,2%). Já nos PPT, apesar do percentual mínimo e máximo de frequência de linfócitos T CD8 + ME ter sido semelhante aos outros dois grupos e da ausência de significância estatística, pôde-se observar um percentual médio ligeiramente mais elevado nestes pacientes (19,6%±8,1%; mediana=19,7%) (Figura 5.8). Figura 5.8: Avaliação, ex vivo, do percentual de linfócitos T (Linf.) CD8 + CD45RA - CD27 - (de memória efetora - T ME ). Foram avaliados CTRL (controles - indivíduos sadios) (n=18), PDT (pacientes durante o tratamento, com doença ativa) (n=14), e PPT (pacientes póstratamento) (n=11). Teste ANOVA não-paramétrico de Kruskal-Wallis. A mediana foi representada por barras horizontais. Cada ponto representa um indivíduo. A diferença da frequência média de linfócitos T CD8 + CD45RA - CD27 + (T MC ), entre os três grupos estudados também não foi estatisticamente significante (CTRL: 32,5%±10,93%; mediana=35,9%; PDT: 31,4%±12,4%; mediana=30,4%; PPT: 38,6%±10,9%; mediana=35,9%). No entanto, é importante ressaltar a heterogeneidade dos percentuais, a qual pode ser consequência da diversidade de especificidade destas células de memória, em cada indivíduo (Figura 5.9). Figura 5.9: Avaliação, ex vivo, do percentual de linfócitos T (Linf.) CD8 + CD45RA - CD27 + (de memória central T MC ). Foram avaliados CTRL (controles - indivíduos sadios) (n=18); pacientes durante o tratamento (PDT) (n=14); e pacientes póstratamento (PPT) (n=11). Teste ANOVA não-paramétrico de Kruskal-Wallis. A mediana foi representada por barras horizontais. Cada ponto representa um indivíduo. 71
PROPRIEDADES E VISÃO GERAL DAS RESPOSTAS IMUNES. FARMÁCIA PROFa SIMONE PETRI AULA - 1
 PROPRIEDADES E VISÃO GERAL DAS RESPOSTAS IMUNES FARMÁCIA PROFa SIMONE PETRI AULA - 1 INTRODUÇÃO A função fisiológica do sistema imune é a defesa contra micro-organismos infecciosos. Entretanto, mesmo
PROPRIEDADES E VISÃO GERAL DAS RESPOSTAS IMUNES FARMÁCIA PROFa SIMONE PETRI AULA - 1 INTRODUÇÃO A função fisiológica do sistema imune é a defesa contra micro-organismos infecciosos. Entretanto, mesmo
Introdução ao sistema imune
 Introdução ao sistema imune Simone Aparecida Rezende Dep. de Análises Clínicas - Escola de Farmácia Fone: 3559-1032. Aulas, exercícios, exemplos de questões de prova e comunicação com alunos em: www.aulasecia.com/imunobasica
Introdução ao sistema imune Simone Aparecida Rezende Dep. de Análises Clínicas - Escola de Farmácia Fone: 3559-1032. Aulas, exercícios, exemplos de questões de prova e comunicação com alunos em: www.aulasecia.com/imunobasica
Profa. MsC Priscila P. S. dos Santos
 Células e órgãos especializados em defesa CÉLULAS DO SISTEMA IMUNITÁRIO Resposta imune Inata Resposta imune específica Profa. MsC Priscila P. S. dos Santos Quem são os invasores? Quem são os invasores?
Células e órgãos especializados em defesa CÉLULAS DO SISTEMA IMUNITÁRIO Resposta imune Inata Resposta imune específica Profa. MsC Priscila P. S. dos Santos Quem são os invasores? Quem são os invasores?
Profa. MsC Priscila P. S. dos Santos
 Células e órgãos especializados em defesa CÉLULAS DO SISTEMA IMUNITÁRIO Resposta imune Inata Resposta imune específica Profa. MsC Priscila P. S. dos Santos Quem são os invasores? Quem são os invasores?
Células e órgãos especializados em defesa CÉLULAS DO SISTEMA IMUNITÁRIO Resposta imune Inata Resposta imune específica Profa. MsC Priscila P. S. dos Santos Quem são os invasores? Quem são os invasores?
Auto-imunidade Doenças auto-imunes. Sandra Bertelli Ribeiro sandrabertelliribeiro@hotmail.com Doutoranda Lab. de Imunologia
 Auto-imunidade Doenças auto-imunes Sandra Bertelli Ribeiro sandrabertelliribeiro@hotmail.com Doutoranda Lab. de Imunologia Célula tronco-hematopoiética Pluripotente. - Progenitor linfóide comum - Progenitor
Auto-imunidade Doenças auto-imunes Sandra Bertelli Ribeiro sandrabertelliribeiro@hotmail.com Doutoranda Lab. de Imunologia Célula tronco-hematopoiética Pluripotente. - Progenitor linfóide comum - Progenitor
Diagnóstico Microbiológico
 Diagnóstico Microbiológico Identificação e Tipagem Bacteriana Prof. Vânia Lúcia Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação
Diagnóstico Microbiológico Identificação e Tipagem Bacteriana Prof. Vânia Lúcia Diagnóstico clínico Sinais (mensuráveis) e sintomas (subjetivos) Origem Etiologia Natureza Diagnóstico laboratorial Identificação
LEISHMANIOSES. Afonso Heusser Jr.*
 LEISHMANIOSES Afonso Heusser Jr.* As leishmanioses compreendem um grupo de doenças zoonóticas causadas por protozoários flagelados heteroxenos, pertencentes ao gênero Leishmania (Protozoa, Kinetoplastida,
LEISHMANIOSES Afonso Heusser Jr.* As leishmanioses compreendem um grupo de doenças zoonóticas causadas por protozoários flagelados heteroxenos, pertencentes ao gênero Leishmania (Protozoa, Kinetoplastida,
EXPANSÃO DA LEISHMANIOSE E PERDA DE BIODIVERSIDADE
 PROBIO II EXPANSÃO DA LEISHMANIOSE E PERDA DE BIODIVERSIDADE Drª CELESTE SOUZA LAB. DE IMUNOMODULAÇÃO E PROTOZOOLOGIA INSTITUTO OSWALDO CRUZ - RJ Leishmanioses Representam um complexo de doenças que afetam
PROBIO II EXPANSÃO DA LEISHMANIOSE E PERDA DE BIODIVERSIDADE Drª CELESTE SOUZA LAB. DE IMUNOMODULAÇÃO E PROTOZOOLOGIA INSTITUTO OSWALDO CRUZ - RJ Leishmanioses Representam um complexo de doenças que afetam
ANÁLISE DOS RESULTADOS DOS PROGRAMAS DE APOIO ÀS PMEs NO BRASIL Resumo Executivo PARA BAIXAR A AVALIAÇÃO COMPLETA: WWW.IADB.
 ANÁLISE DOS RESULTADOS DOS PROGRAMAS DE APOIO ÀS PMEs NO BRASIL Resumo Executivo PARA BAIXAR A AVALIAÇÃO COMPLETA: WWW.IADB.ORG/EVALUATION ANÁLISE DOS RESULTADOS DOS PROGRAMAS DE APOIO ÀS PMEs NO BRASIL
ANÁLISE DOS RESULTADOS DOS PROGRAMAS DE APOIO ÀS PMEs NO BRASIL Resumo Executivo PARA BAIXAR A AVALIAÇÃO COMPLETA: WWW.IADB.ORG/EVALUATION ANÁLISE DOS RESULTADOS DOS PROGRAMAS DE APOIO ÀS PMEs NO BRASIL
PUBVET, Publicações em Medicina Veterinária e Zootecnia.
 Mossoró/RN no período de a 8. PUBVET, Londrina, V., N., Ed. 8, Art.,. PUBVET, Publicações em Medicina Veterinária e Zootecnia. Análise dos casos de leishmaniose visceral humana residentes em Mossoró/RN
Mossoró/RN no período de a 8. PUBVET, Londrina, V., N., Ed. 8, Art.,. PUBVET, Publicações em Medicina Veterinária e Zootecnia. Análise dos casos de leishmaniose visceral humana residentes em Mossoró/RN
A Meta-Analytic Review of Psychosocial Interventions for Substance Use Disorders
 A Meta-Analytic Review of Psychosocial Interventions for Substance Use Disorders REVISÃO META-ANALÍTICA DO USO DE INTERVENÇÕES PSICOSSOCIAIS NO TRATAMENTO DE DEPENDÊNCIA QUÍMICA Publicado: Am J Psychiattry
A Meta-Analytic Review of Psychosocial Interventions for Substance Use Disorders REVISÃO META-ANALÍTICA DO USO DE INTERVENÇÕES PSICOSSOCIAIS NO TRATAMENTO DE DEPENDÊNCIA QUÍMICA Publicado: Am J Psychiattry
Inovação aberta na indústria de software: Avaliação do perfil de inovação de empresas
 : Avaliação do perfil de inovação de empresas Prof. Paulo Henrique S. Bermejo, Dr. Prof. André Luiz Zambalde, Dr. Adriano Olímpio Tonelli, MSc. Pamela A. Santos Priscila Rosa LabGTI Laboratório de Governança
: Avaliação do perfil de inovação de empresas Prof. Paulo Henrique S. Bermejo, Dr. Prof. André Luiz Zambalde, Dr. Adriano Olímpio Tonelli, MSc. Pamela A. Santos Priscila Rosa LabGTI Laboratório de Governança
COORDENAÇÃO ACADÊMICA NÚCLEO DE GESTÃO DE ATIVIDADES DE PESQUISA COORDENAÇÃO ACADÊMICA. Projeto de Pesquisa Registrado Informações Gerais
 COORDENAÇÃO ACADÊMICA Projeto de Pesquisa Registrado Informações Gerais 1. Coordenador (a): ANA KARINA DA SILVA CAVALCANTE (KARINA@UFRB.EDU.BR) Vice- Coordenador (a): 2. Título do projeto: Ocorrência de
COORDENAÇÃO ACADÊMICA Projeto de Pesquisa Registrado Informações Gerais 1. Coordenador (a): ANA KARINA DA SILVA CAVALCANTE (KARINA@UFRB.EDU.BR) Vice- Coordenador (a): 2. Título do projeto: Ocorrência de
A IMPORTÂNCIA DO PIBID NO CONTEXTO ENSINO APRENDIZAGEM REPORTADA POR ALUNOS DO 1º ANO DO ENSINO MÉDIO
 A IMPORTÂNCIA DO PIBID NO CONTEXTO ENSINO APRENDIZAGEM REPORTADA POR ALUNOS DO 1º ANO DO ENSINO MÉDIO Rothchild Sousa de Morais Carvalho Filho 1 Naiana Machado Pontes 2 Laiane Viana de Andrade 2 Antonio
A IMPORTÂNCIA DO PIBID NO CONTEXTO ENSINO APRENDIZAGEM REPORTADA POR ALUNOS DO 1º ANO DO ENSINO MÉDIO Rothchild Sousa de Morais Carvalho Filho 1 Naiana Machado Pontes 2 Laiane Viana de Andrade 2 Antonio
MINISTÉRIO DA SAÚDE MANUAL DE VIGILÂNCIA DA LEISHMANIOSE TEGUMENTAR AMERICANA. 2.ª edição
 MINISTÉRIO DA SAÚDE MANUAL DE VIGILÂNCIA DA LEISHMANIOSE TEGUMENTAR AMERICANA 2.ª edição Brasília DF 2007 Ministério da Saúde Secretaria de Vigilância em Saúde MANUAL DE VIGILÂNCIA DA LEISHMANIOSE TEGUMENTAR
MINISTÉRIO DA SAÚDE MANUAL DE VIGILÂNCIA DA LEISHMANIOSE TEGUMENTAR AMERICANA 2.ª edição Brasília DF 2007 Ministério da Saúde Secretaria de Vigilância em Saúde MANUAL DE VIGILÂNCIA DA LEISHMANIOSE TEGUMENTAR
DIFUSÃO E DIVULGAÇÃO DA BIOTECNOLOGIA PARA ALUNOS DO ENSINO FUNDAMENTAL NO MUNICÍPIO DE CAMPOS DOS GOYTACAZES RJ
 DIFUSÃO E DIVULGAÇÃO DA BIOTECNOLOGIA PARA ALUNOS DO ENSINO FUNDAMENTAL NO MUNICÍPIO DE CAMPOS DOS GOYTACAZES RJ Vanessa de Souza Rodrigues 1 ; Luís André Poiares Fulgêncio 1 ; Aline Martins de Vita 1
DIFUSÃO E DIVULGAÇÃO DA BIOTECNOLOGIA PARA ALUNOS DO ENSINO FUNDAMENTAL NO MUNICÍPIO DE CAMPOS DOS GOYTACAZES RJ Vanessa de Souza Rodrigues 1 ; Luís André Poiares Fulgêncio 1 ; Aline Martins de Vita 1
Teste seus conhecimentos: Caça-Palavras
 Teste seus conhecimentos: Caça-Palavras Batizada pelos médicos de diabetes mellitus, a doença ocorre quando há um aumento do açúcar no sangue. Dependendo dos motivos desse disparo, pode ser de dois tipos.
Teste seus conhecimentos: Caça-Palavras Batizada pelos médicos de diabetes mellitus, a doença ocorre quando há um aumento do açúcar no sangue. Dependendo dos motivos desse disparo, pode ser de dois tipos.
Aula IV Protozoários Zoopatogênicos
 ZOOLOGIA E PARASITOLOGIA Aula IV Protozoários Zoopatogênicos Professora: Luciana Alves de Sousa Doenças causadas por Protozoários Doença de Chagas Leishmaniose Malária Giardíase Amebíase Toxoplasmose Doença
ZOOLOGIA E PARASITOLOGIA Aula IV Protozoários Zoopatogênicos Professora: Luciana Alves de Sousa Doenças causadas por Protozoários Doença de Chagas Leishmaniose Malária Giardíase Amebíase Toxoplasmose Doença
PLANO DE CURSO 1ª SÉRIE ANO: 2008
 PLANO DE CURSO 1ª SÉRIE ANO: 2008 CURSO: MEDICINA DEPARTAMENTO: SAÚDE COLETIVA DISCIPLINA: IMUNOLOGIA BÁSICA CARGA HORÁRIA: 72h/a PROFESSORES: Prof. Dr. Valmir Laurentino Silva Prof a. Dr a. Maria das
PLANO DE CURSO 1ª SÉRIE ANO: 2008 CURSO: MEDICINA DEPARTAMENTO: SAÚDE COLETIVA DISCIPLINA: IMUNOLOGIA BÁSICA CARGA HORÁRIA: 72h/a PROFESSORES: Prof. Dr. Valmir Laurentino Silva Prof a. Dr a. Maria das
Indicamos inicialmente os números de cada item do questionário e, em seguida, apresentamos os dados com os comentários dos alunos.
 Os dados e resultados abaixo se referem ao preenchimento do questionário Das Práticas de Ensino na percepção de estudantes de Licenciaturas da UFSJ por dez estudantes do curso de Licenciatura Plena em
Os dados e resultados abaixo se referem ao preenchimento do questionário Das Práticas de Ensino na percepção de estudantes de Licenciaturas da UFSJ por dez estudantes do curso de Licenciatura Plena em
1 Introdução. Lei Nº. 9.394, de 20 de dezembro de 1996. Estabelece as diretrizes e bases da educação nacional.
 11 1 Introdução No contexto da reforma da administração do Estado, ocorrida com o fim da ditadura militar, a educação sofreu ajustamentos que se refletiram nas mudanças ocorridas na legislação durante
11 1 Introdução No contexto da reforma da administração do Estado, ocorrida com o fim da ditadura militar, a educação sofreu ajustamentos que se refletiram nas mudanças ocorridas na legislação durante
AVALIAÇÃO DAS SUBPOPULAÇÕES DE MONÓCITOS EXPRESSANDO CD14 E CD16 EM PACIENTES COM LEISHMANIOSE TEGUMENTAR AMERICANA
 AVALIAÇÃO DAS SUBPOPULAÇÕES DE MONÓCITOS EXPRESSANDO CD14 E CD16 EM PACIENTES COM LEISHMANIOSE TEGUMENTAR AMERICANA Ledice I A PEREIRA, Hélio GALDINO Jr, Ildefonso Alves DA SILVA Jr, Valéria Bernadete
AVALIAÇÃO DAS SUBPOPULAÇÕES DE MONÓCITOS EXPRESSANDO CD14 E CD16 EM PACIENTES COM LEISHMANIOSE TEGUMENTAR AMERICANA Ledice I A PEREIRA, Hélio GALDINO Jr, Ildefonso Alves DA SILVA Jr, Valéria Bernadete
BIOFÍSICA DAS RADIAÇÕES IONIZANTES
 BIOFÍSICA DAS RADIAÇÕES IONIZANTES DANOS RADIOINDUZIDOS NA MOLÉCULA DE DNA Por ser responsável pela codificação da estrutura molecular de todas as enzimas da células, o DNA passa a ser a molécula chave
BIOFÍSICA DAS RADIAÇÕES IONIZANTES DANOS RADIOINDUZIDOS NA MOLÉCULA DE DNA Por ser responsável pela codificação da estrutura molecular de todas as enzimas da células, o DNA passa a ser a molécula chave
www.printo.it/pediatric-rheumatology/br/intro
 www.printo.it/pediatric-rheumatology/br/intro Artrite de lyme Versão de 2016 1. O QUE É ARTRITE DE LYME 1.1 O que é? A artrite de Lyme é uma das doenças causadas pela bactéria Borrelia burgdorferi (borreliose
www.printo.it/pediatric-rheumatology/br/intro Artrite de lyme Versão de 2016 1. O QUE É ARTRITE DE LYME 1.1 O que é? A artrite de Lyme é uma das doenças causadas pela bactéria Borrelia burgdorferi (borreliose
O desafio das correlações espúrias. Série Matemática na Escola
 O desafio das correlações espúrias Série Matemática na Escola Objetivos 1. Apresentar o conceito de correlação; 2. Discutir correlação entre variáveis. O desafio das correlações espúrias Série Matemática
O desafio das correlações espúrias Série Matemática na Escola Objetivos 1. Apresentar o conceito de correlação; 2. Discutir correlação entre variáveis. O desafio das correlações espúrias Série Matemática
Mestrado Profissional em Ensino de Biologia em Rede Nacional - PROFBIO PROPOSTA
 Mestrado Profissional em Ensino de Biologia em Rede Nacional - PROFBIO PROPOSTA Considerando que o Ensino Médio é para a maioria dos cidadãos a última oportunidade de uma educação formal em Biologia, a
Mestrado Profissional em Ensino de Biologia em Rede Nacional - PROFBIO PROPOSTA Considerando que o Ensino Médio é para a maioria dos cidadãos a última oportunidade de uma educação formal em Biologia, a
Q-Acadêmico. Módulo CIEE - Estágio. Revisão 01
 Q-Acadêmico Módulo CIEE - Estágio Revisão 01 SUMÁRIO 1. VISÃO GERAL DO MÓDULO... 2 1.1 PRÉ-REQUISITOS... 2 2. ORDEM DE CADASTROS PARA UTILIZAÇÃO DO MÓDULO CIEE... 3 2.1 CADASTRANDO EMPRESAS... 3 2.1.1
Q-Acadêmico Módulo CIEE - Estágio Revisão 01 SUMÁRIO 1. VISÃO GERAL DO MÓDULO... 2 1.1 PRÉ-REQUISITOS... 2 2. ORDEM DE CADASTROS PARA UTILIZAÇÃO DO MÓDULO CIEE... 3 2.1 CADASTRANDO EMPRESAS... 3 2.1.1
INFORME TÉCNICO SEMANAL: DENGUE, CHIKUNGUNYA, ZIKA E MICROCEFALIA RELACIONADA À INFECÇÃO PELO VÍRUS ZIKA
 1. DENGUE Em 2015, até a 52ª semana epidemiológica (SE) foram notificados 79.095 casos, com incidência de 5.600,2/100.000 habitantes. Quando comparado ao mesmo período do ano anterior observa-se um aumento
1. DENGUE Em 2015, até a 52ª semana epidemiológica (SE) foram notificados 79.095 casos, com incidência de 5.600,2/100.000 habitantes. Quando comparado ao mesmo período do ano anterior observa-se um aumento
Módulo 9 A Avaliação de Desempenho faz parte do subsistema de aplicação de recursos humanos.
 Módulo 9 A Avaliação de Desempenho faz parte do subsistema de aplicação de recursos humanos. 9.1 Explicações iniciais A avaliação é algo que faz parte de nossas vidas, mesmo antes de nascermos, se não
Módulo 9 A Avaliação de Desempenho faz parte do subsistema de aplicação de recursos humanos. 9.1 Explicações iniciais A avaliação é algo que faz parte de nossas vidas, mesmo antes de nascermos, se não
A Sustentabilidade e a Inovação na formação dos Engenheiros Brasileiros. Prof.Dr. Marco Antônio Dias CEETEPS
 A Sustentabilidade e a Inovação na formação dos Engenheiros Brasileiros Prof.Dr. Marco Antônio Dias CEETEPS O PAPEL DA FORMAÇÃO ACADÊMICA Segundo diversos autores que dominam e escrevem a respeito do tema,
A Sustentabilidade e a Inovação na formação dos Engenheiros Brasileiros Prof.Dr. Marco Antônio Dias CEETEPS O PAPEL DA FORMAÇÃO ACADÊMICA Segundo diversos autores que dominam e escrevem a respeito do tema,
Boletim Epidemiológico UHE Santo Antônio do Jari
 Editorial Índice - Editorial - Doença Leishmaniose - Gráfico de Notificações - Doença Malária Este é o segundo número do ano de, com veiculação semestral, referente aos meses de janeiro a junho, contendo
Editorial Índice - Editorial - Doença Leishmaniose - Gráfico de Notificações - Doença Malária Este é o segundo número do ano de, com veiculação semestral, referente aos meses de janeiro a junho, contendo
OUTUBRO ROSA REFORÇA A IMPORTÂNCIA DO DIAGNÓSTICO PRECOCE NA CURA DO CÂNCER DE MAMA
 OUTUBRO ROSA REFORÇA A IMPORTÂNCIA DO DIAGNÓSTICO PRECOCE NA CURA DO CÂNCER DE MAMA Enviado por LINK COMUNICAÇÃO EMPRESARIAL 01-Out-2015 PQN - O Portal da Comunicação LINK COMUNICAÇÃO EMPRESARIAL - 01/10/2015
OUTUBRO ROSA REFORÇA A IMPORTÂNCIA DO DIAGNÓSTICO PRECOCE NA CURA DO CÂNCER DE MAMA Enviado por LINK COMUNICAÇÃO EMPRESARIAL 01-Out-2015 PQN - O Portal da Comunicação LINK COMUNICAÇÃO EMPRESARIAL - 01/10/2015
Educador: Mariana Borges Batista Componente Curricular: Biologia Data: / /2012 Estudante: 1ª Série
 Educador: Mariana Borges Batista Componente Curricular: Biologia Data: / /2012 Estudante: 1ª Série Questão 1 (UFMA) Das estruturas abaixo relacionadas, qual a alternativa que não está presente na célula
Educador: Mariana Borges Batista Componente Curricular: Biologia Data: / /2012 Estudante: 1ª Série Questão 1 (UFMA) Das estruturas abaixo relacionadas, qual a alternativa que não está presente na célula
O que é câncer de mama?
 Câncer de Mama O que é câncer de mama? O câncer de mama é a doença em que as células normais da mama começam a se modificar, multiplicando-se sem controle e deixando de morrer, formando uma massa de células
Câncer de Mama O que é câncer de mama? O câncer de mama é a doença em que as células normais da mama começam a se modificar, multiplicando-se sem controle e deixando de morrer, formando uma massa de células
Introdução 50.000 novos casos por ano DNA microarray imuno-histoquímica (IHQ) tissue microarray (TMA) técnicas alternativas de construção de TMA
 Introdução No Brasil o câncer de mama é a neoplasia maligna mais freqüente, com cerca de 50.000 novos casos por ano. Na última década, avanços na área da patologia molecular permitiram o reconhecimento
Introdução No Brasil o câncer de mama é a neoplasia maligna mais freqüente, com cerca de 50.000 novos casos por ano. Na última década, avanços na área da patologia molecular permitiram o reconhecimento
Texto de apoio ao curso de Especialização Atividade física Adaptada e saúde Prof. Dr. Luzimar Teixeira
 Componentes do sistema imunitário Texto de apoio ao curso de Especialização Atividade física Adaptada e saúde Prof. Dr. Luzimar Teixeira Manual Merck Capítulo 167 O sistema imunitário é composto por células
Componentes do sistema imunitário Texto de apoio ao curso de Especialização Atividade física Adaptada e saúde Prof. Dr. Luzimar Teixeira Manual Merck Capítulo 167 O sistema imunitário é composto por células
Informe Técnico Sarampo nº 9 - ALERTA SARAMPO. Novos casos confirmados de sarampo (Genótipo D4), residentes no Estado de São Paulo.
 INFORME TÉCNICO Nº 9 (Outubro) ALERTA SARAMPO 2011 GOVERNO DO ESTADO DE SÃO PAULO SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE CONTROLE DE DOENÇAS CENTRO DE VIGILÂNCIA EPIDEMIOLÓGICA PROF. ALEXANDRE
INFORME TÉCNICO Nº 9 (Outubro) ALERTA SARAMPO 2011 GOVERNO DO ESTADO DE SÃO PAULO SECRETARIA DE ESTADO DA SAÚDE COORDENADORIA DE CONTROLE DE DOENÇAS CENTRO DE VIGILÂNCIA EPIDEMIOLÓGICA PROF. ALEXANDRE
A REGULAMENTAÇÃO DA EAD E O REFLEXO NA OFERTA DE CURSOS PARA FORMAÇÃO DE PROFESSORES
 A REGULAMENTAÇÃO DA EAD E O REFLEXO NA OFERTA DE CURSOS PARA FORMAÇÃO DE PROFESSORES Autor(a): Alessandra Barbara Santos de Almeida Coautor(es): Alessandra Barbara Santos de Almeida, Gliner Dias Alencar,
A REGULAMENTAÇÃO DA EAD E O REFLEXO NA OFERTA DE CURSOS PARA FORMAÇÃO DE PROFESSORES Autor(a): Alessandra Barbara Santos de Almeida Coautor(es): Alessandra Barbara Santos de Almeida, Gliner Dias Alencar,
UNIVERSIDADE DO ESTADO DA BAHIA UNEB DEPARTAMENTO DE EDUCAÇÃO CAMPUS XII / GUANAMBI BA REGIMENTO INTERNO
 UNIVERSIDADE DO ESTADO DA BAHIA UNEB DEPARTAMENTO DE EDUCAÇÃO CAMPUS XII / GUANAMBI BA REGIMENTO INTERNO GUANAMBI 2005 CAPÍTULO I Da Finalidade Art. 1º - O Núcleo de Pesquisa e Extensão () do Departamento
UNIVERSIDADE DO ESTADO DA BAHIA UNEB DEPARTAMENTO DE EDUCAÇÃO CAMPUS XII / GUANAMBI BA REGIMENTO INTERNO GUANAMBI 2005 CAPÍTULO I Da Finalidade Art. 1º - O Núcleo de Pesquisa e Extensão () do Departamento
PIBID: DESCOBRINDO METODOLOGIAS DE ENSINO E RECURSOS DIDÁTICOS QUE PODEM FACILITAR O ENSINO DA MATEMÁTICA
 PIBID: DESCOBRINDO METODOLOGIAS DE ENSINO E RECURSOS DIDÁTICOS QUE PODEM FACILITAR O ENSINO DA MATEMÁTICA Naiane Novaes Nogueira 1 Universidade Estadual do Sudoeste da Bahia UESB n_n_nai@hotmail.com José
PIBID: DESCOBRINDO METODOLOGIAS DE ENSINO E RECURSOS DIDÁTICOS QUE PODEM FACILITAR O ENSINO DA MATEMÁTICA Naiane Novaes Nogueira 1 Universidade Estadual do Sudoeste da Bahia UESB n_n_nai@hotmail.com José
BIOLOGIA - 3 o ANO MÓDULO 28 REINO PROTISTA
 BIOLOGIA - 3 o ANO MÓDULO 28 REINO PROTISTA Corpúsculo basal Membrana ondulante Citoplasma núcleo flagelo Reprodução assexuada em flagelados Parasita Leishmania brasiliensis Transmissor homem Phlebotomus
BIOLOGIA - 3 o ANO MÓDULO 28 REINO PROTISTA Corpúsculo basal Membrana ondulante Citoplasma núcleo flagelo Reprodução assexuada em flagelados Parasita Leishmania brasiliensis Transmissor homem Phlebotomus
Disfagia: Diagnóstico Diferencial
 Disfagia: Diagnóstico Diferencial M.Sc. Prof.ª Viviane Marques Fonoaudióloga, Neurofisiologista e Mestre em Fonoaudiologia Coordenadora da Pós-graduação em Fonoaudiologia Hospitalar Chefe da Equipe de
Disfagia: Diagnóstico Diferencial M.Sc. Prof.ª Viviane Marques Fonoaudióloga, Neurofisiologista e Mestre em Fonoaudiologia Coordenadora da Pós-graduação em Fonoaudiologia Hospitalar Chefe da Equipe de
Sistema Imunitário. Estado especifico de protecção do organismo permitindo-lhe reconhecer agentes infecciosos ou estranhos neutralizando-os
 O que é a Imunidade? Estado especifico de protecção do organismo permitindo-lhe reconhecer agentes infecciosos ou estranhos neutralizando-os e eliminando-os Funções: Eliminação de agentes estranhos no
O que é a Imunidade? Estado especifico de protecção do organismo permitindo-lhe reconhecer agentes infecciosos ou estranhos neutralizando-os e eliminando-os Funções: Eliminação de agentes estranhos no
2. Nesse sistema, ocorre uma relação de protocooperação entre algas e bactérias.
 PROVA DE BIOLOGIA QUESTÃO 01 Entre os vários sistemas de tratamento de esgoto, o mais econômico são as lagoas de oxidação. Essas lagoas são reservatórios especiais de esgoto, que propiciam às bactérias
PROVA DE BIOLOGIA QUESTÃO 01 Entre os vários sistemas de tratamento de esgoto, o mais econômico são as lagoas de oxidação. Essas lagoas são reservatórios especiais de esgoto, que propiciam às bactérias
CENTRO UNIVERSITÁRIO CATÓLICA DE SANTA CATARINA EM JOINVILLE PRÓ-REITORIA ACADÊMICA CURSO DE BIOMEDICINA. Matriz Curricular vigente a partir de 2012/1
 CENTRO UNIVERSITÁRIO CATÓLICA DE SANTA CATARINA EM JOINVILLE PRÓ-REITORIA ACADÊMICA CURSO DE BIOMEDICINA Matriz Curricular vigente a partir de 2012/1 Fase Cod. Disciplina P.R Carga Horária Teórica Prática
CENTRO UNIVERSITÁRIO CATÓLICA DE SANTA CATARINA EM JOINVILLE PRÓ-REITORIA ACADÊMICA CURSO DE BIOMEDICINA Matriz Curricular vigente a partir de 2012/1 Fase Cod. Disciplina P.R Carga Horária Teórica Prática
COLÉGIO JOÃO PAULO I LABORATÓRIO DE BIOLOGIA - 2º ANO PROF. ANDRÉ FRANCO FRANCESCHINI MALÁRIA
 COLÉGIO JOÃO PAULO I LABORATÓRIO DE BIOLOGIA - 2º ANO PROF. ANDRÉ FRANCO FRANCESCHINI MALÁRIA AGENTE CAUSADOR: Plasmodium falciparum, P. vivax e P. malariae. protozoário esporozoário parasita da hemáceas.
COLÉGIO JOÃO PAULO I LABORATÓRIO DE BIOLOGIA - 2º ANO PROF. ANDRÉ FRANCO FRANCESCHINI MALÁRIA AGENTE CAUSADOR: Plasmodium falciparum, P. vivax e P. malariae. protozoário esporozoário parasita da hemáceas.
MELHORES PRÁTICAS DA OCDE
 MELHORES PRÁTICAS DA OCDE PARA A TRANSPARÊNCIA ORÇAMENTÁRIA INTRODUÇÃO A relação entre a boa governança e melhores resultados econômicos e sociais é cada vez mais reconhecida. A transparência abertura
MELHORES PRÁTICAS DA OCDE PARA A TRANSPARÊNCIA ORÇAMENTÁRIA INTRODUÇÃO A relação entre a boa governança e melhores resultados econômicos e sociais é cada vez mais reconhecida. A transparência abertura
Tema: Boceprevir para tratamento da hepatite viral crônica C associada a cirrose hepática
 Data: 15/10/2012 Nota Técnica 02/2012 Solicitante: Dr. José Augusto Lourenço dos Santos Juiz de Direito da 2.ª Vara Cível de Timóteo/MG Medicamento x Material Procedimento Cobertura Tema: Boceprevir para
Data: 15/10/2012 Nota Técnica 02/2012 Solicitante: Dr. José Augusto Lourenço dos Santos Juiz de Direito da 2.ª Vara Cível de Timóteo/MG Medicamento x Material Procedimento Cobertura Tema: Boceprevir para
SAÍDA DO MERCADO DE TRABALHO: QUAL É A IDADE?
 SAÍDA DO MERCADO DE TRABALHO: QUAL É A IDADE? Ana Amélia Camarano* Solange Kanso** Daniele Fernandes** 1 INTRODUÇÃO Assume-se que idade avançada e invalidez resultam em perda da capacidade laboral, o que
SAÍDA DO MERCADO DE TRABALHO: QUAL É A IDADE? Ana Amélia Camarano* Solange Kanso** Daniele Fernandes** 1 INTRODUÇÃO Assume-se que idade avançada e invalidez resultam em perda da capacidade laboral, o que
PROJETO PILOTO. Setembro 2015
 PROJETO PILOTO Setembro 2015 Manual completo de funcionamento do projeto: Instruções Iniciais, Perguntas Frequentes e Tutorial de Utilização 1 Projeto Piloto - Aplicativo Di@rio de Classe 1) Instruções
PROJETO PILOTO Setembro 2015 Manual completo de funcionamento do projeto: Instruções Iniciais, Perguntas Frequentes e Tutorial de Utilização 1 Projeto Piloto - Aplicativo Di@rio de Classe 1) Instruções
SUELI MARIA SARMENTO AVELAR A LEISHMANIOSE TEGUMENTAR AMERICANA COMO PROBLEMA DE SAÚDE DO TRABALHADOR NO AMAPÁ: UM PERFIL EPIDEMIOLÓGICO
 Centro de Referência em Saúde do Trabalhador do Estado do Amapá- CEREST/AP SUELI MARIA SARMENTO AVELAR A LEISHMANIOSE TEGUMENTAR AMERICANA COMO PROBLEMA DE SAÚDE DO TRABALHADOR NO AMAPÁ: UM PERFIL EPIDEMIOLÓGICO
Centro de Referência em Saúde do Trabalhador do Estado do Amapá- CEREST/AP SUELI MARIA SARMENTO AVELAR A LEISHMANIOSE TEGUMENTAR AMERICANA COMO PROBLEMA DE SAÚDE DO TRABALHADOR NO AMAPÁ: UM PERFIL EPIDEMIOLÓGICO
Metadados. 1. Introdução. 2. O que são Metadados? 3. O Valor dos Metadados
 1. Introdução O governo é um dos maiores detentores de recursos da informação. Consequentemente, tem sido o responsável por assegurar que tais recursos estejam agregando valor para os cidadãos, as empresas,
1. Introdução O governo é um dos maiores detentores de recursos da informação. Consequentemente, tem sido o responsável por assegurar que tais recursos estejam agregando valor para os cidadãos, as empresas,
Leishmaniose visceral: vacina europeia traz fórmula inovadora
 Leishmaniose visceral: vacina europeia traz fórmula inovadora Em entrevista à Sociedade Brasileira de Medicina Tropical (SBMT), Dr. Javier Moreno fala sobre a vacina contra leishmanioses (http://www.ideal.es/jaen/20140212/mas-actualidad/ciencia/europaimpulsa-vacuna-contra-201402121152.html)
Leishmaniose visceral: vacina europeia traz fórmula inovadora Em entrevista à Sociedade Brasileira de Medicina Tropical (SBMT), Dr. Javier Moreno fala sobre a vacina contra leishmanioses (http://www.ideal.es/jaen/20140212/mas-actualidad/ciencia/europaimpulsa-vacuna-contra-201402121152.html)
7 etapas para construir um Projeto Integrado de Negócios Sustentáveis de sucesso
 7 etapas para construir um Projeto Integrado de Negócios Sustentáveis de sucesso Saiba como colocar o PINS em prática no agronegócio e explore suas melhores opções de atuação em rede. Quando uma empresa
7 etapas para construir um Projeto Integrado de Negócios Sustentáveis de sucesso Saiba como colocar o PINS em prática no agronegócio e explore suas melhores opções de atuação em rede. Quando uma empresa
função de produção côncava. 1 É importante lembrar que este resultado é condicional ao fato das empresas apresentarem uma
 90 6. CONCLUSÃO Segundo a teoria microecônomica tradicional, se as pequenas empresas brasileiras são tomadores de preços, atuam nos mesmos mercados e possuem a mesma função de produção, elas deveriam obter
90 6. CONCLUSÃO Segundo a teoria microecônomica tradicional, se as pequenas empresas brasileiras são tomadores de preços, atuam nos mesmos mercados e possuem a mesma função de produção, elas deveriam obter
Gerenciamento de Projetos Modulo VIII Riscos
 Gerenciamento de Projetos Modulo VIII Riscos Prof. Walter Cunha falecomigo@waltercunha.com http://waltercunha.com Bibliografia* Project Management Institute. Conjunto de Conhecimentos em Gerenciamento
Gerenciamento de Projetos Modulo VIII Riscos Prof. Walter Cunha falecomigo@waltercunha.com http://waltercunha.com Bibliografia* Project Management Institute. Conjunto de Conhecimentos em Gerenciamento
UNIVERSIDADE ESTADUAL DE MATO GROSSO DO SUL. RESOLUÇÃO CEPE-UEMS Nº 1.152, de 24 de novembro de 2011.
 RESOLUÇÃO CEPE-UEMS Nº 1.152, de 24 de novembro de 2011. Aprova o Regulamento da Comissão de Ética no Uso de Animais, da Universidade Estadual de Mato Grosso do Sul. O CONSELHO DE ENSINO, PESQUISA E EXTENSÃO
RESOLUÇÃO CEPE-UEMS Nº 1.152, de 24 de novembro de 2011. Aprova o Regulamento da Comissão de Ética no Uso de Animais, da Universidade Estadual de Mato Grosso do Sul. O CONSELHO DE ENSINO, PESQUISA E EXTENSÃO
EDITAL FACEPE 14/2008 PROGRAMA DE BOLSAS DE INCENTIVO ACADÊMICO - BIA
 EDITAL FACEPE 14/2008 PROGRAMA DE BOLSAS DE INCENTIVO ACADÊMICO - BIA A Fundação de Amparo à Pesquisa do Estado de Pernambuco FACEPE convida as universidades públicas de Pernambuco, federais ou estaduais,
EDITAL FACEPE 14/2008 PROGRAMA DE BOLSAS DE INCENTIVO ACADÊMICO - BIA A Fundação de Amparo à Pesquisa do Estado de Pernambuco FACEPE convida as universidades públicas de Pernambuco, federais ou estaduais,
A POLUIÇÃO DO AR NA REGIÃO METROPOLITANA DO RIO DE JANEIRO: IMPACTOS À SAÚDE HUMANA
 A POLUIÇÃO DO AR NA REGIÃO METROPOLITANA DO RIO DE JANEIRO: IMPACTOS À SAÚDE HUMANA Ana Carolina Rodrigues Teixeira 1, Luiz Felipe Silva 1, Vanessa S. Barreto Carvalho 1 ¹Instituto de Recursos Naturais
A POLUIÇÃO DO AR NA REGIÃO METROPOLITANA DO RIO DE JANEIRO: IMPACTOS À SAÚDE HUMANA Ana Carolina Rodrigues Teixeira 1, Luiz Felipe Silva 1, Vanessa S. Barreto Carvalho 1 ¹Instituto de Recursos Naturais
Etapa complementar para o diagnóstico da infecção pelo HIV princípios metodológicos
 Aula 11 Etapa complementar para o diagnóstico da infecção pelo HIV princípios metodológicos As amostras com resultados reagentes, na etapa de triagem, devem ser submetidas à etapa complementar. Nessa etapa,
Aula 11 Etapa complementar para o diagnóstico da infecção pelo HIV princípios metodológicos As amostras com resultados reagentes, na etapa de triagem, devem ser submetidas à etapa complementar. Nessa etapa,
TRANSPLANTE DE CÉLULAS TRONCO HEMATOPOIÉTICAS NO TRATAMENTO DA LEUCEMIA.
 UNIVERSIDADE CASTELO BRANCO ATUALIZA ASSOCIAÇÃO CULTURAL ESPECIALIZAÇÃO EM BIOLOGIA MOLECULAR E CITOGÉNETICA HUMANA MÔNICA DE SOUSA PITA TRANSPLANTE DE CÉLULAS TRONCO HEMATOPOIÉTICAS NO TRATAMENTO DA LEUCEMIA.
UNIVERSIDADE CASTELO BRANCO ATUALIZA ASSOCIAÇÃO CULTURAL ESPECIALIZAÇÃO EM BIOLOGIA MOLECULAR E CITOGÉNETICA HUMANA MÔNICA DE SOUSA PITA TRANSPLANTE DE CÉLULAS TRONCO HEMATOPOIÉTICAS NO TRATAMENTO DA LEUCEMIA.
Trimeb. (maleato de trimebutina)
 Trimeb (maleato de trimebutina) Bula para paciente Cápsula mole 200 mg Página 1 Trimeb (maleato de trimebutina) Cápsula mole FORMA FARMACÊUTICA E APRESENTAÇÕES Embalagens com 20, 30 ou 60 cápsulas contendo
Trimeb (maleato de trimebutina) Bula para paciente Cápsula mole 200 mg Página 1 Trimeb (maleato de trimebutina) Cápsula mole FORMA FARMACÊUTICA E APRESENTAÇÕES Embalagens com 20, 30 ou 60 cápsulas contendo
JOGO GALÁPAGOS: A EXTINÇÃO E A IRRADIAÇÃO DE ESPÉCIES NA CONSTRUÇÃO DA DIVERSIDADE BIOLÓGICA
 ISSN 1980-3540 03.01, 49-57 (2008) www.sbg.org.br JOGO GALÁPAGOS: A EXTINÇÃO E A IRRADIAÇÃO DE ESPÉCIES NA CONSTRUÇÃO DA DIVERSIDADE BIOLÓGICA Marcus Vinícius de Melo Oliveira, Walter Santos de Araújo,
ISSN 1980-3540 03.01, 49-57 (2008) www.sbg.org.br JOGO GALÁPAGOS: A EXTINÇÃO E A IRRADIAÇÃO DE ESPÉCIES NA CONSTRUÇÃO DA DIVERSIDADE BIOLÓGICA Marcus Vinícius de Melo Oliveira, Walter Santos de Araújo,
PRÁTICAS DE AVALIAÇÃO COMO UM MEIO DE MOTIVAÇÃO. Celina Pinto Leão Universidade do Minho cpl@dps.uminho.pt
 PRÁTICAS DE AVALIAÇÃO COMO UM MEIO DE MOTIVAÇÃO Celina Pinto Leão Universidade do Minho cpl@dps.uminho.pt O evidente decréscimo de conhecimento básico de matemática por parte dos alunos nos cursos de engenharia,
PRÁTICAS DE AVALIAÇÃO COMO UM MEIO DE MOTIVAÇÃO Celina Pinto Leão Universidade do Minho cpl@dps.uminho.pt O evidente decréscimo de conhecimento básico de matemática por parte dos alunos nos cursos de engenharia,
Imunologia dos Tr T ansplantes
 Imunologia dos Transplantes Base genética da rejeição Camundongos isogênicos - todos os animais possuem genes idênticos Transplante de pele entre animais de linhagens diferentes rejeição ou aceitação depende
Imunologia dos Transplantes Base genética da rejeição Camundongos isogênicos - todos os animais possuem genes idênticos Transplante de pele entre animais de linhagens diferentes rejeição ou aceitação depende
DESCRIÇÃO DAS PRÁTICAS DE GESTÃO DA INICIATIVA
 DESCRIÇÃO DAS PRÁTICAS DE GESTÃO DA INICIATIVA Como é sabido existe um consenso de que é necessário imprimir qualidade nas ações realizadas pela administração pública. Para alcançar esse objetivo, pressupõe-se
DESCRIÇÃO DAS PRÁTICAS DE GESTÃO DA INICIATIVA Como é sabido existe um consenso de que é necessário imprimir qualidade nas ações realizadas pela administração pública. Para alcançar esse objetivo, pressupõe-se
FLUXO PARA ACOMPANHAMENTO, ENCERRAMENTO E DIGITAÇÃO DOS CASOS DE DENGUE
 Prefeitura da Cidade do Rio de Janeiro Secretaria Municipal de Saúde e Defesa Civil Subsecretaria de Promoção, Atenção Primária e Vigilância em Saúde Superintendência de Vigilância em Saúde Coordenação
Prefeitura da Cidade do Rio de Janeiro Secretaria Municipal de Saúde e Defesa Civil Subsecretaria de Promoção, Atenção Primária e Vigilância em Saúde Superintendência de Vigilância em Saúde Coordenação
TESTES RÁPIDOS: CONSIDERAÇÕES GERAIS PARA SEU USO COM ÊNFASE NA INDICAÇÃO DE TERAPIA ANTI-RETROVIRAL EM SITUAÇÕES DE EMERGÊNCIA
 TESTES RÁPIDOS: CONSIDERAÇÕES GERAIS PARA SEU USO COM ÊNFASE NA INDICAÇÃO DE TERAPIA ANTI-RETROVIRAL EM SITUAÇÕES DE EMERGÊNCIA Unidade de Assistência, Unidade de Laboratório e Rede de Direitos Humanos
TESTES RÁPIDOS: CONSIDERAÇÕES GERAIS PARA SEU USO COM ÊNFASE NA INDICAÇÃO DE TERAPIA ANTI-RETROVIRAL EM SITUAÇÕES DE EMERGÊNCIA Unidade de Assistência, Unidade de Laboratório e Rede de Direitos Humanos
Estratégias adotadas pelas empresas para motivar seus funcionários e suas conseqüências no ambiente produtivo
 Estratégias adotadas pelas empresas para motivar seus funcionários e suas conseqüências no ambiente produtivo Camila Lopes Ferreir a (UTFPR) camila@pg.cefetpr.br Dr. Luiz Alberto Pilatti (UTFPR) lapilatti@pg.cefetpr.br
Estratégias adotadas pelas empresas para motivar seus funcionários e suas conseqüências no ambiente produtivo Camila Lopes Ferreir a (UTFPR) camila@pg.cefetpr.br Dr. Luiz Alberto Pilatti (UTFPR) lapilatti@pg.cefetpr.br
Iniciação Científica. Regime de. Centro de Pesquisa
 Regime de Iniciação Científica Centro de Pesquisa Regime de Iniciação Científica - RIC Rua Taquari, 546 Mooca - São Paulo/SP - CEP 03166-000 Tel.: (011) 2799-1946 - Fax: 2794-2513 www.usjt.br C P MANTENEDORA
Regime de Iniciação Científica Centro de Pesquisa Regime de Iniciação Científica - RIC Rua Taquari, 546 Mooca - São Paulo/SP - CEP 03166-000 Tel.: (011) 2799-1946 - Fax: 2794-2513 www.usjt.br C P MANTENEDORA
Recomendada. A coleção apresenta eficiência e adequação. Ciências adequados a cada faixa etária, além de
 Recomendada Por quê? A coleção apresenta eficiência e adequação metodológica, com os principais temas relacionados a Ciências adequados a cada faixa etária, além de conceitos em geral corretos. Constitui
Recomendada Por quê? A coleção apresenta eficiência e adequação metodológica, com os principais temas relacionados a Ciências adequados a cada faixa etária, além de conceitos em geral corretos. Constitui
SISTEMA DE AVALIAÇÃO E APOIO À QUALIDADE DO ENSINO A DISTÂNCIA
 1 SISTEMA DE AVALIAÇÃO E APOIO À QUALIDADE DO ENSINO A DISTÂNCIA Renato Cislaghi, UFSC, cislaghi@inf.ufsc.br Silvia Modesto Nassar, UFSC, silvia@inf.ufsc.br Beatriz Wilges, UFSC, beaw@inf.ufsc.br Introdução
1 SISTEMA DE AVALIAÇÃO E APOIO À QUALIDADE DO ENSINO A DISTÂNCIA Renato Cislaghi, UFSC, cislaghi@inf.ufsc.br Silvia Modesto Nassar, UFSC, silvia@inf.ufsc.br Beatriz Wilges, UFSC, beaw@inf.ufsc.br Introdução
SIGNIFICADOS ATRIBUÍDOS ÀS AÇÕES DE FORMAÇÃO CONTINUADA DA REDE MUNICIPAL DE ENSINO DO RECIFE/PE
 SIGNIFICADOS ATRIBUÍDOS ÀS AÇÕES DE FORMAÇÃO CONTINUADA DA REDE MUNICIPAL DE ENSINO DO RECIFE/PE Adriele Albertina da Silva Universidade Federal de Pernambuco, adrielealbertina18@gmail.com Nathali Gomes
SIGNIFICADOS ATRIBUÍDOS ÀS AÇÕES DE FORMAÇÃO CONTINUADA DA REDE MUNICIPAL DE ENSINO DO RECIFE/PE Adriele Albertina da Silva Universidade Federal de Pernambuco, adrielealbertina18@gmail.com Nathali Gomes
Numeração Única: 0145120798114 ou 0798114-29.2012.8.13.0145
 NT 25/2012 Solicitante: João Martiniano Vieira Neto Juiz da 2ª Vara de Registros Públicos e Fazenda Pública Municipal de Juiz de Fora/MG Data: 26/11/2012 Medicamento X Material Procedimento Cobertura Numeração
NT 25/2012 Solicitante: João Martiniano Vieira Neto Juiz da 2ª Vara de Registros Públicos e Fazenda Pública Municipal de Juiz de Fora/MG Data: 26/11/2012 Medicamento X Material Procedimento Cobertura Numeração
NCE/15/00099 Relatório preliminar da CAE - Novo ciclo de estudos
 NCE/15/00099 Relatório preliminar da CAE - Novo ciclo de estudos Caracterização do pedido Perguntas A.1 a A.10 A.1. Instituição de Ensino Superior / Entidade Instituidora: Instituto Politécnico De Setúbal
NCE/15/00099 Relatório preliminar da CAE - Novo ciclo de estudos Caracterização do pedido Perguntas A.1 a A.10 A.1. Instituição de Ensino Superior / Entidade Instituidora: Instituto Politécnico De Setúbal
LESÕES DOS ISQUIOTIBIAIS
 LESÕES DOS ISQUIOTIBIAIS INTRODUÇÃO Um grande grupo muscular, que se situa na parte posterior da coxa é chamado de isquiotibiais (IQT), o grupo dos IQT é formado pelos músculos bíceps femoral, semitendíneo
LESÕES DOS ISQUIOTIBIAIS INTRODUÇÃO Um grande grupo muscular, que se situa na parte posterior da coxa é chamado de isquiotibiais (IQT), o grupo dos IQT é formado pelos músculos bíceps femoral, semitendíneo
ENTENDENDO A PRÁTICA DE PESQUISA REALIZADA POR PROFESSORES DE CIÊNCIAS DA NATUREZA, NO SEMINÁRIO INTEGRADO DO ENSINO MÉDIO POLITÉCNICO EM IJUÍ 1
 ENTENDENDO A PRÁTICA DE PESQUISA REALIZADA POR PROFESSORES DE CIÊNCIAS DA NATUREZA, NO SEMINÁRIO INTEGRADO DO ENSINO MÉDIO POLITÉCNICO EM IJUÍ 1 Elisangela Wisch Baiotto 2. 1 Trabalho resultante de pesquisa
ENTENDENDO A PRÁTICA DE PESQUISA REALIZADA POR PROFESSORES DE CIÊNCIAS DA NATUREZA, NO SEMINÁRIO INTEGRADO DO ENSINO MÉDIO POLITÉCNICO EM IJUÍ 1 Elisangela Wisch Baiotto 2. 1 Trabalho resultante de pesquisa
Biologia. Sistema circulatório
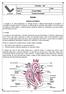 Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
TERMO DE CONSENTIMENTO INFORMADO
 TERMO DE CONSENTIMENTO INFORMADO PREZADO PACIENTE: O Termo de Consentimento Informado é um documento no qual sua AUTONOMIA (vontade) em CONSENTIR (autorizar) é manifestada. A intervenção cirúrgica indicada
TERMO DE CONSENTIMENTO INFORMADO PREZADO PACIENTE: O Termo de Consentimento Informado é um documento no qual sua AUTONOMIA (vontade) em CONSENTIR (autorizar) é manifestada. A intervenção cirúrgica indicada
Gráfico 1 Jovens matriculados no ProJovem Urbano - Edição 2012. Fatia 3;
 COMO ESTUDAR SE NÃO TENHO COM QUEM DEIXAR MEUS FILHOS? UM ESTUDO SOBRE AS SALAS DE ACOLHIMENTO DO PROJOVEM URBANO Rosilaine Gonçalves da Fonseca Ferreira UNIRIO Direcionado ao atendimento de parcela significativa
COMO ESTUDAR SE NÃO TENHO COM QUEM DEIXAR MEUS FILHOS? UM ESTUDO SOBRE AS SALAS DE ACOLHIMENTO DO PROJOVEM URBANO Rosilaine Gonçalves da Fonseca Ferreira UNIRIO Direcionado ao atendimento de parcela significativa
Transcrição da Teleconferência Resultados do 3T09 - Inpar 18 de novembro de 2009
 Transcrição da Teleconferência Resultados do 3T09 - Inpar 18 de novembro de 2009 Bom dia, e obrigada por aguardarem. Sejam bem-vindos à teleconferência da Inpar para discussão dos resultados referentes
Transcrição da Teleconferência Resultados do 3T09 - Inpar 18 de novembro de 2009 Bom dia, e obrigada por aguardarem. Sejam bem-vindos à teleconferência da Inpar para discussão dos resultados referentes
ANÁLISE HISTOPATOLÓGICA E PARASITOLÓGICA DE GLÂNDULA ADRENAL DE CÃES NATURALMENTE INFECTADOS POR LEISHMANIA SPP.
 ANÁLISE HISTOPATOLÓGICA E PARASITOLÓGICA DE GLÂNDULA ADRENAL DE CÃES NATURALMENTE INFECTADOS POR LEISHMANIA SPP. Guerra JM 1, Fernandes NCCA 2, Kimura LM 1, Shirata NK 1, Magno JA 3, Barbosa JER 4, Taniguchi
ANÁLISE HISTOPATOLÓGICA E PARASITOLÓGICA DE GLÂNDULA ADRENAL DE CÃES NATURALMENTE INFECTADOS POR LEISHMANIA SPP. Guerra JM 1, Fernandes NCCA 2, Kimura LM 1, Shirata NK 1, Magno JA 3, Barbosa JER 4, Taniguchi
Data: 07/04/2014 NTRR 67/2014. Medicamento x Material Procedimento Cobertura
 NTRR 67/2014 Solicitante: Juiz Alex Matoso Silva Município de Itaúna - MG Número do processo: 0338.14.003128-1 Data: 07/04/2014 Medicamento x Material Procedimento Cobertura TEMA: Pegvisomanto para acromegalia
NTRR 67/2014 Solicitante: Juiz Alex Matoso Silva Município de Itaúna - MG Número do processo: 0338.14.003128-1 Data: 07/04/2014 Medicamento x Material Procedimento Cobertura TEMA: Pegvisomanto para acromegalia
Marcelo c. m. pessoa
 Marcelo c. m. pessoa CRM 52670502 CIRURGIA PLASTICA INFORMAÇÕES SOBRE TRATAMENTO MÉDICO-ESPECIALIZADO SOLICITAÇÃO E AUTORIZAÇÃO PARA TRATAMENTO Eu, identidade número expedida por, solicito e autorizo ao
Marcelo c. m. pessoa CRM 52670502 CIRURGIA PLASTICA INFORMAÇÕES SOBRE TRATAMENTO MÉDICO-ESPECIALIZADO SOLICITAÇÃO E AUTORIZAÇÃO PARA TRATAMENTO Eu, identidade número expedida por, solicito e autorizo ao
ESTADO DE MATO GROSSO PREFEITURA MUNICIPAL DE PORTO ALEGRE DO NORTE MT CNPJ.: 03.238.672/0001-28
 DECRETO Nº. 810/2015, DE 03 DE FEVEREIRO DE 2015 Regulamenta o estágio de estudantes em órgãos municipais, com base na Lei Federal nº 11.788, de 25 de setembro de 2008, e dá outras providências. O PREFEITO
DECRETO Nº. 810/2015, DE 03 DE FEVEREIRO DE 2015 Regulamenta o estágio de estudantes em órgãos municipais, com base na Lei Federal nº 11.788, de 25 de setembro de 2008, e dá outras providências. O PREFEITO
ESTATUTO DA BIBLIOTECA VIRTUAL EM SAÚDE BRASIL CAPITULO I. Da Apresentação
 ESTATUTO DA BIBLIOTECA VIRTUAL EM SAÚDE BRASIL CAPITULO I Da Apresentação Art. 1º O presente Estatuto orienta a organização, as competências e o funcionamento do da Biblioteca Virtual em Saúde Brasil (BVS
ESTATUTO DA BIBLIOTECA VIRTUAL EM SAÚDE BRASIL CAPITULO I Da Apresentação Art. 1º O presente Estatuto orienta a organização, as competências e o funcionamento do da Biblioteca Virtual em Saúde Brasil (BVS
ANPAD; Um representante da comunidade científica indicado pela Diretoria Artigo 5º ANDIFES. - São atribuições do Comitê Gestor: da
 Regulamento do Curso de Mestrado Profissional Nacional em Administração Pública em Rede (PROFIAP) Artigo Capítulo 1º I - Objetivos administrativa produtividade tem O Mestrado avançada como objetivo Profissional
Regulamento do Curso de Mestrado Profissional Nacional em Administração Pública em Rede (PROFIAP) Artigo Capítulo 1º I - Objetivos administrativa produtividade tem O Mestrado avançada como objetivo Profissional
Manual de Formatura. Manual de Formatura NOVA Faculdade
 Manual de Formatura Direção Diretora Executiva Renata Carla Castro Diretor Geral Pablo Bittencourt Diretor Acadêmico Ricardo Medeiros Ferreira Este manual tem a finalidade de orientar os procedimentos
Manual de Formatura Direção Diretora Executiva Renata Carla Castro Diretor Geral Pablo Bittencourt Diretor Acadêmico Ricardo Medeiros Ferreira Este manual tem a finalidade de orientar os procedimentos
Aula 1. Introdução à Avaliação Econômica de Projetos Sociais
 Aula 1 Introdução à Avaliação Econômica de Projetos Sociais Avaliar é... Emitir juízo de valor sobre algo. Avaliação Econômica é... Quantificar o impacto e o retorno econômico de um projeto, com base em
Aula 1 Introdução à Avaliação Econômica de Projetos Sociais Avaliar é... Emitir juízo de valor sobre algo. Avaliação Econômica é... Quantificar o impacto e o retorno econômico de um projeto, com base em
Terapia medicamentosa
 www.printo.it/pediatric-rheumatology/pt/intro Terapia medicamentosa Versão de 2016 13. Medicamentos biológicos Nos últimos anos foram introduzidas novas perspetivas terapêuticas com substâncias conhecidas
www.printo.it/pediatric-rheumatology/pt/intro Terapia medicamentosa Versão de 2016 13. Medicamentos biológicos Nos últimos anos foram introduzidas novas perspetivas terapêuticas com substâncias conhecidas
Imunologia dos tumores. Imunologia dos tumores. Imunologia dos tumores. Imunologia dos tumores. Imunologia dos tumores. Imunologia dos tumores
 Introdução Objetivos Ags expressados pelas células cancerosas Natureza da resposta Imune Como o câncer escapa do sistema Imune Imunoterapia Introdução ao Câncer Crescimento descontrolado produz um tumor
Introdução Objetivos Ags expressados pelas células cancerosas Natureza da resposta Imune Como o câncer escapa do sistema Imune Imunoterapia Introdução ao Câncer Crescimento descontrolado produz um tumor
BOLSA FAMÍLIA Relatório-SÍNTESE. 53
 CAPÍTULO6 BOLSA FAMÍLIA Relatório-SÍNTESE. 53 Aspectos de gênero O Programa Bolsa Família privilegia como titulares as mulheres-mães (ou provedoras de cuidados), público que aflui às políticas de assistência
CAPÍTULO6 BOLSA FAMÍLIA Relatório-SÍNTESE. 53 Aspectos de gênero O Programa Bolsa Família privilegia como titulares as mulheres-mães (ou provedoras de cuidados), público que aflui às políticas de assistência
Cotagem de dimensões básicas
 Cotagem de dimensões básicas Introdução Observe as vistas ortográficas a seguir. Com toda certeza, você já sabe interpretar as formas da peça representada neste desenho. E, você já deve ser capaz de imaginar
Cotagem de dimensões básicas Introdução Observe as vistas ortográficas a seguir. Com toda certeza, você já sabe interpretar as formas da peça representada neste desenho. E, você já deve ser capaz de imaginar
GUIA DE PROJECTO INTEGRADO PARA O CLIENTE VERSÃO FINAL
 GUIA DE PROJECTO INTEGRADO PARA O CLIENTE VERSÃO FINAL AUTORES Andy Sutton BRE, Reino Unido TRADUÇÃO E ADAPTAÇÃO PARA A VERSÃO PORTUGUESA Carlos Laia CONTACTO Carlos Laia CEEETA ECO, Consultores em Energia,
GUIA DE PROJECTO INTEGRADO PARA O CLIENTE VERSÃO FINAL AUTORES Andy Sutton BRE, Reino Unido TRADUÇÃO E ADAPTAÇÃO PARA A VERSÃO PORTUGUESA Carlos Laia CONTACTO Carlos Laia CEEETA ECO, Consultores em Energia,
CENTRO UNIVERSITÁRIO UNIVATES
 CENTRO UNIVERSITÁRIO UNIVATES REGULAMENTO DE ESTÁGIO CURRICULAR NÃO OBRIGATÓRIO CURSO SUPERIOR DE TECNOLOGIA EM GASTRONOMIA REGULAMENTO DO ESTÁGIO SUPERVISIONADO NÃO OBRIGATÓRIO Das Disposições Gerais
CENTRO UNIVERSITÁRIO UNIVATES REGULAMENTO DE ESTÁGIO CURRICULAR NÃO OBRIGATÓRIO CURSO SUPERIOR DE TECNOLOGIA EM GASTRONOMIA REGULAMENTO DO ESTÁGIO SUPERVISIONADO NÃO OBRIGATÓRIO Das Disposições Gerais
ANÁLISE DE DIFERENTES MODELOS DE ATRIBUIÇÃO DE NOTAS DA AVALIAÇÃO INTEGRADORA (AVIN) DO CURSO DE ENGENHARIA CIVIL DO UNICENP
 ANÁLISE DE DIFERENTES MODELOS DE ATRIBUIÇÃO DE NOTAS DA AVALIAÇÃO INTEGRADORA (AVIN) DO CURSO DE ENGENHARIA CIVIL DO UNICENP Flavia Viviani Tormena ftormena@unicenp.edu.br Júlio Gomes jgomes@unicenp.edu.br
ANÁLISE DE DIFERENTES MODELOS DE ATRIBUIÇÃO DE NOTAS DA AVALIAÇÃO INTEGRADORA (AVIN) DO CURSO DE ENGENHARIA CIVIL DO UNICENP Flavia Viviani Tormena ftormena@unicenp.edu.br Júlio Gomes jgomes@unicenp.edu.br
REGULAMENTO PARA INSCRIÇÃO E SELEÇÃO DE APLICADORES DE PROVAS EM PROCESSOS SELETIVOS DA UFOP
 REGULAMENTO PARA INSCRIÇÃO E SELEÇÃO DE APLICADORES DE PROVAS EM PROCESSOS SELETIVOS DA UFOP 1. DO OBJETIVO A Seleção de Aplicadores de Provas em Processos Seletivos - Vestibulares e Processos Isolados
REGULAMENTO PARA INSCRIÇÃO E SELEÇÃO DE APLICADORES DE PROVAS EM PROCESSOS SELETIVOS DA UFOP 1. DO OBJETIVO A Seleção de Aplicadores de Provas em Processos Seletivos - Vestibulares e Processos Isolados
A SEGUIR ALGUMAS DICAS PARA O DESENVOLVIMENTO DE UM PROJETO CIENTÍFICO
 A SEGUIR ALGUMAS DICAS PARA O DESENVOLVIMENTO DE UM PROJETO CIENTÍFICO DESENVOLVENDO UM PROJETO 1. Pense em um tema de seu interesse ou um problema que você gostaria de resolver. 2. Obtenha um caderno
A SEGUIR ALGUMAS DICAS PARA O DESENVOLVIMENTO DE UM PROJETO CIENTÍFICO DESENVOLVENDO UM PROJETO 1. Pense em um tema de seu interesse ou um problema que você gostaria de resolver. 2. Obtenha um caderno
Visão Geral. Tecido conjuntivo líquido. Circula pelo sistema cardiovascular. Produzido na medula óssea, volume total de 5,5 a 6 litros (homem adulto)
 Tecido Sanguíneo Visão Geral Tecido conjuntivo líquido Circula pelo sistema cardiovascular Produzido na medula óssea, volume total de 5,5 a 6 litros (homem adulto) Defesa imunológica (Leucócitos) Trocas
Tecido Sanguíneo Visão Geral Tecido conjuntivo líquido Circula pelo sistema cardiovascular Produzido na medula óssea, volume total de 5,5 a 6 litros (homem adulto) Defesa imunológica (Leucócitos) Trocas
