Estudo e modelagem do processo de transferência de massa durante a dessalinização de água por eletrodiálise
|
|
|
- Luiz Felipe Nunes Bennert
- 6 Há anos
- Visualizações:
Transcrição
1 Escola Politécnica da Universidade de São Paulo Departamento de Engenharia Química PQI 2000 Trabalho de Conclusão de Curso II CAROLINA PIMENTA BRITO MARCO TÚLIO TERRELL DE CAMARGO Estudo e modelagem do processo de transferência de massa durante a dessalinização de água por eletrodiálise Orientador: Prof. Dr. Roberto Guardani São Paulo 2010
2 CAROLINA PIMENTA BRITO MARCO TÚLIO TERRELL DE CAMARGO Estudo e modelagem do processo de transferência de massa durante a dessalinização de água por eletrodiálise Tese apresentada à Escola Politécnica da Universidade de São Paulo para obtenção do diploma de graduação. Área de concentração: Engenharia Química Orientador: Prof. Dr. Roberto Guardani São Paulo 2010
3 Dedicatória Aos alunos de mestrado Adriana Katerine Niño Vargas e Thales Pires Dias Galuchi, pela atenção e incansável apoio ao longo do período de elaboração deste trabalho.
4 Agradecimentos Aos alunos de mestrado Adriana Katerine Niño Vargas e Thales Pires Dias Galuchi, que sempre tiveram paciência e disposição para nos orientar. Aos alunos e funcionários do laboratório Semi-Industrial pela colaboração e auxílio. Aos nossos parentes por terem acompanhado nossa trajetória e nos apoiado nos momentos difíceis. Ao nosso orientador, professor doutor Roberto Guardani, pela sua confiança, amizade e, principalmente, pelo seu suporte na realização desse trabalho.
5 Índice de Figuras Figura 1 - Representação esquemática de uma membrana trocadora de cátions Figura 2 - Representação esquemática de uma célula de eletrodiálise com os respectivos perfis de concentração dos cátions e ânions Figura 3 - Polarização de concentração para uma membrana trocadora de cátions Figura 4 - Curva de intensidade de corrente em função do potencial elétrico Figura 5 - Determinação da corrente limite experimentalmente Figura 6 - Volume diferencial no compartimento de diluído Figura 7 Planta piloto de eletrodiálise e empilhamento de membranas PCCell Figura 8 - Esquema representativo da planta piloto de eletrodiálise Figura 9 - Dados experimentais para cloreto de sódio 0,01M Figura 10 - Dados experimentais para cloreto de sódio 0,03M Figura 11 - Dados experimentais para cloreto de sódio 0,05M Figura 12 - Dados experimentais para cloreto de potássio 0,01M Figura 13 - Dados experimentais para cloreto de potássio 0,03M Figura 14 - Dados experimentais para cloreto de potássio 0,05M Figura 15 - Dados experimentais para sulfato de sódio 0,01M Figura 16 - Dados experimentais para sulfato de sódio 0,03M Figura 17 - Dados experimentais para sulfato de sódio 0,05M Figura 18 - Dados experimentais para cloreto de magnésio 0,01M Figura 19 - Dados experimentais para cloreto de magnésio 0,03M Figura 20 - Dados experimentais para cloreto de magnésio 0,05M Figura 21 - Determinação da corrente limite a partir dos dados experimentais Figura 22 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio antes do tratamento estatístico Figura 23 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio após o tratamento estatístico Figura 24 - Densidade de corrente limite em função da vazão teórica de escoamento para cloreto de sódio Figura 25 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio antes do tratamento estatístico... 35
6 Figura 26 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio após o tratamento estatístico Figura 27 - Densidade de corrente limite em função da vazão teórica de escoamento para cloreto de potássio Figura 28 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de potássio antes do tratamento estatístico Figura 29 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de potássio após o tratamento estatístico Figura 30 - Densidade de corrente limite em função da vazão teórica de escoamento para sulfato de sódio Figura 31 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para sulfato de sódio antes do tratamento estatístico Figura 32 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para sulfato de sódio após o tratamento estatístico Figura 33 - Densidade de corrente limite em função da vazão teórica de escoamento para cloreto de magnésio Figura 34 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de magnésio antes do tratamento estatístico Figura 35 - Membrana catiônica com precipitado de Mg(OH) Figura 36 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de magnésio após o tratamento estatístico Figura 37. Resultados da validação do modelo para separação de NaCl 0,026 e 0,1 Keq/m³ Figura 38. Resultados da validação do modelo para separação de Na 2 SO 4 0,03 e 0,1 Keq/m³ Figura 39 Planejamento das atividades... 49
7 Índice de Tabelas Tabela 1 - Informações técnicas das membranas Tabela 2 - Informações da rede hidráulica Tabela 3 Níveis das variáveis independentes para o cálculo da densidade de corrente limite Tabela 5 - Parâmetros a, b e n antes do tratamento estatístico para cloreto de sódio 35 Tabela 6 - Parâmetros a, b e n após o tratamento estatístico para cloreto de sódio Tabela 7 - Parâmetros a, b e n antes do tratamento estatístico para cloreto de potássio Tabela 8 - Parâmetros a, b e n após o tratamento estatístico para cloreto de potássio 38 Tabela 9 - Parâmetros a, b e n antes do tratamento estatístico para sulfato de sódio. 40 Tabela 10 - Parâmetros a, b e n após o tratamento estatístico para cloreto de sódio.. 41 Tabela 11 - Parâmetros a, b e n antes do tratamento estatístico para cloreto de magnésio Tabela 12 - Parâmetros a, b e n após o tratamento estatístico para cloreto de sódio.. 45 Tabela 13 - Condições de operação do sistema de ED para validação do modelo proposto Tabela 14 - Comparação do modelo com os dados experimentais... 47
8 Sumário 1. Resumo Abstract Introdução Revisão Bibliográfica Processos de Separação por Membranas Membranas Trocadoras de Íons Eletrodiálise Mecanismos de transporte Exclusão de Donnan Polarização de concentração e corrente limite Rendimento de Faraday Transporte sem migração Transporte com migração Modelo Matemático do Sistema de Eletrodiálise Dados Experimentais Equipamentos Procedimento Experimental Planejamento Experimental Resultados Experimentais Cloreto de Sódio Cloreto de Potássio Sulfato de Sódio Cloreto de Magnésio Tratamento dos Dados Resultados e Discussões Cloreto de Sódio Cloreto de Potássio Sulfato de Sódio Cloreto de Magnésio Validação do modelo para um sistema de eletrodiálise Planejamento de Atividades... 49
9 8. Conclusões Referências... 52
10 1. Resumo O processo de separação por eletrodiálise é baseado nas propriedades das membranas trocadoras de íons, as quais permitem o transporte seletivo de espécies carregadas. A aplicação de corrente elétrica na célula de eletrodiálise resulta no fluxo de solvente e soluto através das membranas, permitindo a formação de dois tipos de compartimentos distintos: diluído (solução que perde íons) e concentrado (solução receptora de íons). O transporte de sal e água pelas membranas é dependente principalmente da concentração de sal inicial do diluído e da densidade de corrente elétrica aplicada, sendo que os ensaios realizados em laboratório permitiram quantificar como esses parâmetros irão influenciar a transferência do soluto. O presente trabalho visa validar a modelagem matemática proposta para a transferência de massa no sistema de eletrodiálise através da obtenção de parâmetros que permitam o cálculo da densidade de corrente limite. 7
11 2. Abstract The electrodialysis separation process is based on the properties of ion exchange membranes, which allow the selective transport of charged species. The application of electric current in the electrodialysis cell results in the flow of solvent and solute through membranes, allowing the formation of two distinct compartments: diluate (which loses ions) and concentrate (which receive ions). The transport of salt and water through membranes is mainly dependent on the initial concentration of salt in the diluate and on the current density. The tests performed in laboratory allowed the quantification of how these parameters will influence the transfer of the solute. The present work aims to validate the mathematical model proposed for the mass transfer in electrodialysis system by obtaining parameters related to the limiting current density. 8
12 3. Introdução A água é o recurso natural mais importante para o desenvolvimento da vida. Enquanto os animais utilizam os recursos hídricos para funções puramente vitais, os humanos utilizam estes recursos como insumos para o funcionamento e crescimento da sociedade. Dentre as formas de emprego da água pelos seres humanos, pode-se destacar a utilização pessoal (higiene pessoal, preparo de alimentos, lavagens em geral), na agricultura (irrigação) e na industrial (matéria-prima ou como produtos auxiliares), sendo a qualidade da água definida de acordo com a aplicação. O acelerado crescimento da população mundial, principalmente no século XX, gerou uma demanda excessiva pelos recursos hídricos, sobretudo nas áreas urbanas. Conseqüentemente, este fato trouxe grandes problemas de abastecimento e poluição das águas, tais como a necessidade de buscar mananciais cada vez mais distantes, o comprometimento dos recursos disponíveis pelos esgotos domésticos e efluentes industriais e os riscos potenciais à população em decorrência do uso da água de mananciais degradados. O problema da degradação ambiental e da escassez da água é um ciclo vicioso, que ocorre em dois momentos distintos: na busca por recursos naturais e na disposição de resíduos na natureza. É importante destacar que a água está presente nas duas situações, sendo que o homem capta a água no mesmo local em que outro lançou seus resíduos. Para evitar a degradação das fontes de água limpa é necessária uma série de esforços coletivos, dentre eles, o uso racional da água, o reuso da água e o tratamento dos efluentes industriais e domésticos. Como o uso racional e o reuso da água fogem do escopo deste trabalho, será abordado, a seguir, o processo de tratamento dos efluentes. Em geral, os efluentes gerados nas grandes cidades são captados através de uma rede coletora, que os leva até uma estação de tratamento de esgoto (ETE). O tratamento de esgoto inclui processos físicos, químicos e biológicos para a remoção dos contaminantes, permitindo sua volta para o meio ambiente. Por outro lado, pelo fato de terem diferentes compostos químicos em sua composição, os efluentes industriais requerem um pré-tratamento interno antes de 9
13 serem lançados ao meio ambiente. Uma vez que efluentes com menores concentrações iônicas podem ser mais facilmente tratados, como é o caso do fenol, um dos possíveis pré-tratamentos de efluentes industriais é a eletrodiálise (ED). A eletrodiálise é utilizada para remover compostos iônicos presentes em um fluido através da aplicação de um campo elétrico em um conjunto de membranas trocadoras de íons (ânions e cátions). Verifica-se, portanto, que a eletrodiálise pode adequar-se como pré-tratamento no processo de tratamento de efluentes, e por este motivo, será estudada em detalhes no presente trabalho. 10
14 4. Revisão Bibliográfica 4.1. Processos de Separação por Membranas Membrana é uma camada de um material específico que possui a função de criar uma barreira seletiva entre duas fases, permanecendo impermeável à passagem de partículas específicas quando o sistema é exposto a uma perturbação. Devido á essa propriedade, as membranas são utilizadas em processos de separação, purificação e fracionamento de misturas. As principais características de uma membrana estão relacionadas com sua seletividade, permeabilidade, estabilidade química e mecânica, espessura e tamanho dos poros. Essas características, aliadas ás propriedades químicas da membrana, determinam a gama de processos que podem empregar a membrana em questão. Em geral, os processos industriais baseados em separação por membranas mais comuns são a microfiltração (MF), ultrafiltração (UF), nanofiltração (UF), osmose reversa (OR), pervaporação (PV) e eletrodiálise (ED). As membranas utilizadas nos processos de MF, UF, OR e PV têm como principal característica o tamanho dos poros, sendo a força motriz desses processos a diferença de pressão hidrostática aplicada. A PV é um sistema mais complexo uma vez que a separação é efetuada devido à diferença de pressão de vapor dos compostos envolvidos. Já o processo de separação por eletrodiálise requer um tipo especial de membranas, denominadas membranas trocadoras de íons. Estas membranas permitem a passagem seletiva de espécies carregadas eletricamente, sendo, portanto, fundamentais ao processo de dessalinização de água por eletrodiálise. O próximo tópico irá abordar mais detalhadamente o princípio de funcionamento deste tipo de membranas Membranas Trocadoras de Íons Como já mencionado, as membranas trocadoras de íons permitem o transporte seletivo de espécies carregadas. Esta transferência é dependente do sinal da carga da 11
15 espécie, sendo as membranas trocadoras de cátion (MTC) responsáveis pela passagem de cátions, e as membranas trocadoras de ânions (MTA) responsáveis pela passagem de ânions. A transferência seletiva de íons é regida por um mecanismo eletrostático, ou seja, uma membrana trocadora de cátions permite a passagem de cátions (conta-íons) e repele os ânions (co-íons) por possuir grupos funcionais com carga negativa em sua matriz polimérica (íons fixos). A Figura 1 apresenta um esquema de uma membrana trocadora de cátions: Figura 1 - Representação esquemática de uma membrana trocadora de cátions As membranas trocadoras de íons podem ser homogêneas ou heterogêneas. As membranas homogêneas são obtidas por polimerização direta de monômeros funcionais por via química ou radioquímica, enquanto as membranas heterogêneas são elaboradas a partir de partículas coloidais trocadoras de íons incorporadas em uma resina fenólica ou um polímero. As propriedades das membranas trocadoras de íons são determinadas por diferentes parâmetros, tais como a densidade da rede polimérica, o comportamento hidrofílico ou hidrofóbico da matriz, o tipo e concentração das cargas no polímero e a morfologia da membrana. As propriedades de uma MTI que irão definir suas aplicações são a taxa de hidratação, resistência elétrica, estabilidade mecânica, capacidade de troca e a seletividade. 12
16 4.3. Eletrodiálise Uma célula típica de eletrodiálise consiste em uma série de membranas trocadoras de cátions e ânions dispostas alternadamente em paralelo entre o ânodo e o cátodo. Quando aplicado um potencial elétrico nas duas extremidades do arranjo, as células individuais entre duas membranas consecutivas alimentadas por soluções iônicas irão permitir a migração dos cátions em direção ao cátodo, e dos ânions em direção ao ânodo. A figura a seguir representa esquematicamente uma célula de eletrodiálise com os respectivos perfis de concentração dos cátions e ânions: Figura 2 - Representação esquemática de uma célula de eletrodiálise com os respectivos perfis de concentração dos cátions e ânions Observa-se no esquema apresentado acima a formação de dois tipos de compartimentos distintos, o do diluído e o do concentrado. O diluído corresponde à solução iônica que irá perder seus íons, enquanto o concentrado corresponde à solução que irá receber estes íons. É importante destacar que esta transferência é possível devido ao arranjo alternado das membranas, uma vez que o cátion que sai do diluído atravessa facilmente a membrana trocadora de cátions e é barrado pela membrana trocadora de ânions disposta na sequência, enquanto o inverso é verificado para os ânions. Atualmente, a eletrodiálise é utilizada principalmente no processo de dessalinização de soluções salinas, tanto para produzir soluções salinas específicas, quanto para produzir água potável a partir da água do mar. Além disso, estimulada pelo desenvolvimento de novas membranas trocadoras de íons, outros usos da 13
17 eletrodiálise têm ganhado maior interesse, principalmente nas indústrias alimentícias, farmacêuticas, de biotecnologia, de tratamentos de resíduos, entre outras Mecanismos de transporte Exclusão de Donnan A transferência de massa nos processos de eletrodiálise pode ser descrita a partir de modelos termodinâmicos baseados na descrição de equilíbrio de fases e modelos cinéticos. Uma membrana trocadora de íons irá impedir a passagem das espécies carregadas com carga de mesmo sinal que os íons fixos à sua matriz, sendo este efeito denominado exclusão de Donnan. A exclusão de Donnan pode ser descrita por um equilíbrio termodinâmico que permite o cálculo do potencial químico de um componente iônico nas duas fases presentes quando uma solução iônica está em equilíbrio com uma membrana trocadora de íons. Para uma membrana trocadora de ânions de carga R + imersa em uma solução eletrolítica contendo os íons A + e B -, o sistema de equações obtido a partir da igualdade dos potenciais químicos e da eletroneutralidade em cada uma das fases resulta na seguinte expressão da concentração da espécie A (C A ) dentro da membrana: 2 z R C R 2C A C A (1) z R C R onde: C A = concentração da espécie A dentro da membrana [mol.m -3 ]; z R = valência do íon R; C R = capacidade de troca do material [mol.m -3 ]; Polarização de concentração e corrente limite O fenômeno de polarização de concentração, descrito pela teoria da camada limite, é comum aos sistemas operando uma transferência de matéria seletiva através 14
18 de uma interface. Na eletrodiálise, este fenômeno ocorre devido à diferença de mobilidade dos íons existentes na solução eletrolítica e na membrana trocadora de íons. A Figura 3 representa o fenômeno de polarização de concentração para uma membrana trocadora de cátions: Figura 3 - Polarização de concentração para uma membrana trocadora de cátions onde: j + = fluxo de cátions na solução [mol.m -2.s -1 ]; j + m = densidade de fluxo de cátions através da membrana [mol.m -2.s -1 ]; C + d,m = concentração de cátions no diluído na superfície da membrana [mol.m -3 ]; C + d.0 = concentração de cátions no diluído fora da camada limite [mol.m -3 ]; j + diff,m = fluxo difusivo através da membrana [mol.m -2.s -1 ]; δ = espessura da camada limite. A densidade de corrente limite é definida como sendo o valor em que a concentração de um determinado íon na membrana tende a zero. Este parâmetro depende da concentração e das características da espécie iônica em solução, tais como o coeficiente de difusão e o número de transporte, das propriedades de seletividade da membrana e das condições hidrodinâmica dentro dos compartimentos. A densidade de corrente em função do potencial aplicado entre os eletrodos é apresentada na Figura 4: 15
19 Figura 4 - Curva de intensidade de corrente em função do potencial elétrico Verifica-se a existência de três zonas distintas de acordo com o aumento do potencial elétrico. Em um primeiro momento, a intensidade de corrente varia linearmente com o potencial elétrico, ou seja, o sistema segue a lei de Ohm e, portanto, a resistência elétrica é igual ao inverso da inclinação da reta. Na segunda zona, a intensidade de corrente permanece constante apesar do aumento do potencial, sendo o valor da corrente igual ao valor da corrente limite. Finalmente, na terceira zona a intensidade de corrente volta a crescer com o potencial, fenômeno este associado ao transporte de corrente pelos íons H + e OH - produzidos pela dissociação da água. Dessa forma, tratando-se de concentração e/ou desmineralização de soluções, é indispensável trabalhar com uma intensidade de corrente inferior à intensidade limite. No entanto, quando se espera atingir a dissociação da água para produzir os íons H + e OH -, a intensidade deve ser superior à intensidade de corrente limite, o que ocorre, por exemplo, no caso da eletrodiálise com membranas bipolares. Experimentalmente, pode-se determinar a densidade de corrente limite traçando-se a curva de polarização e determinando-se o valor da intensidade correspondente ao patamar. Por outro lado, o método usualmente empregado, que fornece uma melhor precisão, consiste em plotar a resistência (U/I) em função do inverso da corrente (1/I). O ponto de inflexão dessa curva será a corrente limite (Figura 5). 16
20 Figura 5 - Determinação da corrente limite experimentalmente A equação empírica para determinar a densidade de corrente limite proposta por [5] é apresentada abaixo: d n b lim a( C s u (2) i ) onde: i lim = densidade de corrente limite [A/m 2 ]; a,b = constantes dependentes da geometria n = constante; C d S = concentração da solução no compartimento do diluído [Keq/m 3 ]; u = velocidade linear de escoamento no compartimento [m/s] Rendimento de Faraday A eficácia de uma eletrodiálise pode ser determinada pelo rendimento de Faraday, que é definido como a fração de corrente efetivamente transportada pelos íons migrando do diluído em direção ao concentrado. Este rendimento é obtido pela razão entre o número de íons realmente transportado pelo número de equivalentes teóricos, que numericamente é dado por: J s i / F (3) onde: Js = fluxo molar do íon [eq.s -1.cm -2 ]; 17
21 i = densidade de corrente aplicada [C.s -1.cm -2 ]; F = constante de Faraday [96480 C.eq -1 ] Transporte sem migração Na ausência de um potencial elétrico, o fluxo volumétrico do solvente (m 3.m -2.s - 1 ) e o fluxo molar dos solutos (mol.m -3.s -1 ) devidos à osmose através de uma membrana semipermeável podem ser descritos pelas seguintes equações: i J i (4) v L p i i i J P C ( 1 ) J (5) v onde: J v = fluxo volumétrico do solvente; L p = permeabilidade da membrana ao solvente; σ = coeficiente de reflexão; Δ i = gradiente de pressão osmótica através da membrana; J i = fluxo molar dos solutos; P i = coeficiente de permeabilidade; C i = concentração média dos solutos nos dois lados da membrana Transporte com migração Quando se aplica corrente elétrica na célula de eletrodiálise, o fluxo de solvente (J w ) será resultado da contribuição osmótica e eletro-osmótica, enquanto o fluxo de soluto (J s ) será expresso pela soma das contribuições da difusão, migração e convecção: t wi J w L p i (6) F t si J s Ps C s Cs ( 1 ) J w (7) F onde: L p = permeabilidade da membrana ao solvente; σ = coeficiente de reflexão; Δ i = gradiente de pressão osmótica através da membrana; 18
22 t w = número de transporte da água; i = corrente elétrica aplicada; F = constante de Faraday; P s = coeficiente de permeabilidade do soluto; ΔC s = diferença de concentração do soluto através das membranas; ts = número de transferência do sal; C s = concentração média do sal nos dois lados da membrana. Normalmente, a contribuição osmótica é desprezível para o fluxo de solvente, enquanto para o soluto, a contribuição da migração é preponderante à difusão e à convecção. Com estas simplificações, as equações (8) e (9) podem ser reescritas da seguinte forma: t wi J w (8) F t si J s (9) F 4.5. Modelo Matemático do Sistema de Eletrodiálise O modelo matemático proposto por [11] é baseado no equacionamento de um sistema de eletrodiálise em série, co-corrente e sem reciclo. Neste modelo, considerase o balanço de cátions nos compartimentos do diluído, sendo as principais variáveis de análise relativas à área efetiva de troca das membranas (A ef ) e à densidade de corrente (i). Os balanços para encontrar as concentrações de saída em função destas duas variáveis foram feitos considerando as seguintes hipóteses: compartimentos do concentrado e do diluído de mesma geometria; regime permanente (dcs/dt=0); fluxo dos cátions igual ao fluxo dos ânions nas membranas; potencial de concentração devido a diferenças de concentração entre o concentrado e o diluído desprezível quando comparado à queda de voltagem devido à resistência ôhmica das soluções (Lee, Sarfert et al., 2002); 19
23 diferenças de concentração no concentrado e no diluído devido à difusão de íons e ao transporte osmótico e eletro-osmótico da água expressos na corrente de utilização (Strathmann et al., 2004); espessura das membranas desconsideradas nos balanços de massa; densidade e viscosidade do concentrado e diluído constantes. O esquema ampliado do volume de controle diferencial no compartimento do diluído é apresentado na Figura 6. Figura 6 - Volume diferencial no compartimento de diluído Pode-se observar que a transferência de massa no compartimento é resultado dos fluxos devido à migração na direção z e à convecção na direção x. A difusão dos íons no sentido x é muito inferior ao fluxo convectivo e, portanto, é desprezível. Desenvolvendo o balanço de massa e realizando as manipulações necessárias, a diferença de concentração tanto do diluído como no concentrado ao longo do compartimento na direção x é dada por: d C Z c c M h E w fc fd C C C C S s M s h S R am R cm F (10) onde: dc = diferencial da concentração do sal entre o ponto de entrada e qualquer ponto ao longo do compartimento [Keq/m³]; Δ C s = diferença de concentração do sal entre o ponto de entrada e qualquer ponto ao longo do compartimento [Keq/m³]; C fc s = concentração de sal no fundo do compartimento concentrado [Keq/m³]; C fd s = concentração de sal no fundo do compartimento diluído [Keq/m³]; 20
24 h = espessura do compartimento [m]; w = comprimento da membrana [m]; dx = diferencial da altura do compartimento [m]; Q = vazão da solução salina no compartimento [m³/s]; ξ = utilização de corrente; E = diferença de potencial aplicada ao empilhamento [V]; Z c = valência eletroquímica; ѵ c = número de cátions por molécula de sal; Λ M = condutância molar da solução salina [Sm²/ K eq ]; R am = resistência das membranas aniônicas [Ω]; R cm = resistência das membranas catiônicas [Ω]; F = constante de Faraday [96480 C/eq]; É importante destacar que a diferença de potencial aplicada ao empilhamento (E) pode ser calculada através da densidade de corrente limite, sendo, portanto, de interesse, uma correlação que permita a obtenção deste parâmetro para uma gama de sais variados. 21
25 5. Dados Experimentais 5.1. Equipamentos A planta piloto de eletrodiálise em processo batelada (Figura 7) é constituída por um conjunto de membranas do tipo PCCell , cuja ddp é regulada através de uma fonte galvanicamente isolada com corrente contínua ICEL PS-6100, sendo as amperagens e voltagens máximas permitidas de 5A e 30V, respectivamente. As informações técnicas a respeito das membranas estão listadas na tabela a seguir: Tabela 1 - Informações técnicas das membranas Dimensões Largura e comprimento da membrana 110 x 110 mm Área ativa da membrana 64 cm²/membrana Comprimento de processo 80 mm Espessura da célula 0,5 mm Número de pares de célula 5 Materiais Ânodo Pt/Ir revestido de Titânio Cátodo Aço V4A Compartimento dos eletrodos Polipropileno Figura 7 Planta piloto de eletrodiálise e empilhamento de membranas PCCell As soluções utilizadas no experimento são mantidas em três tanques distintos (diluído, concentrado e eletrólito), onde as vazões são reguladas por bombas magnéticas do tipo BOMAX NH-50PX-T e medidas por rotâmetros de plástico Applitech localizados na linha de alimentação. 22
26 Para as análises de condutividade, utiliza-se o condutivímetro Tecnal para a realização de medidas on-line. As informações relativas ao sistema hidráulico são apresentadas abaixo: Tabela 2 - Informações da rede hidráulica Diâmetro interno do tubo de conexão à membrana 8 mm Vazão através dos eletrodos 150 l/h Vazão através das células de diluído e concentrado 4 a 10 l/h (por par de célula) Máxima queda de pressão permitida na membrana 0,5 bar O fluxograma abaixo representa esquematicamente o arranjo experimental do empilhamento de membranas, do sistema hidráulico e elétrico de alimentação, além do sistema de aquisição de dados de condutividade: Figura 8 - Esquema representativo da planta piloto de eletrodiálise 5.2. Procedimento Experimental As soluções do concentrado e diluído atravessam os compartimentos do empilhamento de membranas ao mesmo tempo em que é aplicado um potencial elétrico no sistema de eletrodiálise. Para a determinação da densidade de corrente 23
27 limite, a saída do tanque do concentrado é conectada ao tanque do diluído e a saída do tanque do diluído é conectada ao tanque concentrado para que a concentração se mantenha constante. A velocidade das correntes também é mantida constante durante o experimento. Aumenta-se o potencial elétrico gradativamente, em intervalos de um minuto, e realizam-se leituras da corrente. Finalmente, plotam-se os dados da resistência em função do inverso da corrente para se determinar a densidade de corrente limite. Para a validação do modelo, o experimento foi conduzido da mesma forma que o descrito anteriormente, porém com a saída dos compartimentos concentrado e diluído conectadas aos seus próprios tanques. Analisou-se os seguinte solutos: cloreto de sódio (NaCl), sulfato de sódio (Na 2 SO4), cloreto de potássio (KCl) e cloreto de magnésio (MgCl 2 ) Planejamento Experimental Para o planejamento experimental em questão, usou-se o procedimento fatorial em três níveis: 3 n, onde n é o números de variáveis independentes. Para esse experimento, a densidade de corrente limite é a variável dependente e a concentração do diluído e a velocidade linear são as variáveis independentes. Os níveis para cada variável são apresentados abaixo: Tabela 3 Níveis das variáveis independentes para o cálculo da densidade de corrente limite Limite C d s (K eq /m 3 ) u (m/s) Superior 0,05 0,069 Médio 0,03 0,042 Inferior 0,01 0, Resultados Experimentais Cloreto de Sódio Os resultados experimentais da resistência da célula (V/I) em função do inverso da corrente elétrica aplicada (1/I) para o cloreto de sódio são apresentados nas figuras a seguir: 24
28 V/I (V/A) V/I (V/A) 50 Cloreto de Sódio 0,01M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=20L/h (rep) Figura 9 - Dados experimentais para cloreto de sódio 0,01M 20 Cloreto de Sódio 0,03M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 10 - Dados experimentais para cloreto de sódio 0,03M 25
29 V/I (V/A) V/I (V/A) 20 Cloreto de Sódio 0,05M Q=20L/h Q=40L/h Q=50L/h /I (1/A) Figura 11 - Dados experimentais para cloreto de sódio 0,05M Cloreto de Potássio Os resultados experimentais da resistência da célula (V/I) em função do inverso da corrente elétrica aplicada (1/I) para o cloreto de potássio são apresentados nas figuras a seguir: 40 Cloreto de Potássio 0,01M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=20L/h (rep) Figura 12 - Dados experimentais para cloreto de potássio 0,01M 26
30 V/I (V/A) V/I (V/A) 20 Cloreto de Potássio 0,03M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 13 - Dados experimentais para cloreto de potássio 0,03M 20 Cloreto de Potássio 0,05M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 14 - Dados experimentais para cloreto de potássio 0,05M Sulfato de Sódio Os resultados experimentais da resistência da célula (V/I) em função do inverso da corrente elétrica aplicada (1/I) para o sulfato de sódio são apresentados nas figuras a seguir: 27
31 V/I (V/A) V/I (V/A) 50 Sulfato de Sódio 0,01M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 15 - Dados experimentais para sulfato de sódio 0,01M 20 Sulfato de Sódio 0,03M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=50L/h (rep) Figura 16 - Dados experimentais para sulfato de sódio 0,03M 28
32 V/I (V/A) V/I (V/A) 20 Sulfato de Sódio 0,05M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 17 - Dados experimentais para sulfato de sódio 0,05M Cloreto de Magnésio Os resultados experimentais da resistência da célula (V/I) em função do inverso da corrente elétrica aplicada (1/I) para o cloreto de magnésio são apresentados nas figuras a seguir: 50 Cloreto de Magnésio 0,01M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 18 - Dados experimentais para cloreto de magnésio 0,01M 29
33 V/I (V/A) V/I (V/A) 20 Cloreto de Magnésio 0,03M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 19 - Dados experimentais para cloreto de magnésio 0,03M 20 Cloreto de Magnésio 0,05M /I (1/A) Q=20L/h Q=40L/h Q=50L/h Q=40L/h (rep) Figura 20 - Dados experimentais para cloreto de magnésio 0,05M 5.5. Tratamento dos Dados Através dos experimentos descritos na seção 5.2, determinou-se a densidade de corrente limite em diferentes condições experimentais para os sais analisados. Para obter este parâmetro, utilizam-se as curvas de resistência (U/I) em função do inverso da corrente (1/I), nos quais o ponto de inflexão corresponde ao valor da corrente limite (Figura 21). O valor obtido graficamente é então dividido pela área de troca das membranas para se obter a densidade de corrente limite. 30
34 V/I (V/A) 50 Cloreto de Sódio 0,01M Q=50L/h 0 0 i lim /I (1/A) Figura 21 - Determinação da corrente limite a partir dos dados experimentais Uma vez que a densidade de corrente limite pode ser relacionada à concentração de sal no compartimento e à velocidade da solução escoando por ele através da expressão (2), é possível obter os parâmetros a, b e n da equação através da forma linearizada desta equação e dos resultados experimentais de cada sal. A equação da densidade de corrente linearizada é apresentada a seguir: d log( i lim ) log( a) nlog( Cs ) blog( u) (11) Os parâmetros a, b e n são então obtidos resolvendo-se o sistema linear indicado na equação (12), já que para a mesma concentração C d s, realizaram-se três experimentos variando-se a velocidade de escoamento (u), resultando em um sistema de três equações e três incógnitas. [ A] [ X ] [ b] (12) onde: 1 [ A] log( C log( u) d s ) T ; 31
35 log( a) [ X ] n b ; [ b] log( ilim ). Finalmente, realizou-se a média desses parâmetros para cada sal e calculou-se a densidade de corrente limite teórica (equação (2)) para comparação com o valor experimental. Essa comparação foi feita através das curvas de densidade de corrente limite teórica em função dos valores obtidos experimentalmente. Para efetuar o refinamento dos dados, realizou-se um tratamento estatístico para excluir os dados não compreendidos entre os limites inferior e superior da curva média obtida. Optouse por utilizar a medida de um desvio padrão como limite superior e inferior, o qual foi obtido a partir da equação: ( ilim i n 2 * lim ) 2 (13) onde: σ = desvio padrão; i lim = densidade de corrente limite experimental [A/m²]; i * lim = densidade de corrente limite calculada [A/m²]; n = número de dados experimentais; Dessa forma, os parâmetros a, b e n foram recalculados após o descarte dos pontos, sendo estes os valores utilizados para o cálculo da densidade de corrente limite no modelo teórico. As figuras 22 e 23 ilustram o descarte dos dados localizados fora dos limites calculados para o caso do cloreto de sódio: 32
36 Densidade de Corrente Limite Teórica Densidade de Corrente Limite Teórica Cloreto de Sódio (sem descarte) y = 0,8489x + 20,12 R² = 0, Densidade de Corrente Limite Experimental Figura 22 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio antes do tratamento estatístico Cloreto de Sódio (com descarte) y = 0,8452x + 10,945 R² = 0, Densidade de Corrente Limite Experimental Figura 23 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio após o tratamento estatístico 33
37 Densidade de Corrente Limite (A/m²) 6. Resultados e Discussões 6.1. Cloreto de Sódio Os valores da densidade de corrente limite obtidos experimentalmente em função das vazões teóricas de escoamento são apresentados na Figura 24: Cloreto de Sódio C=0,01 keq/m³ C=0,03 keq/m³ C=0,05 keq/m³ Vazão Teórica (L/h) Figura 24 - Densidade de corrente limite em função da vazão teórica de escoamento para cloreto de sódio Observa-se que o aumento da concentração do sal resulta em considerável aumento da densidade de corrente limite. Esse fato pode ser verificado pela comparação entre a densidade de corrente limite obtida para a concentração de 0,05 Keq /m³ em relação ao valor obtido para a concentração de 0,01 Keq/m³, na qual conclui-se que houve um aumento de aproximadamente 32% para a vazão de 20 L/h, 21% para a vazão de 40L/h e 25% para 50L/h. Também se verifica, a partir da curva acima, que a tendência das curvas para as concentrações mais altas (0,03 e 0,05 Keq /m³) são próximas, sendo observado um aumento da densidade de corrente limite entre as vazões de 20 L/h e 40 L/h, e um decréscimo entre as vazões de 40 L/h e 50 L/h. Para a concentração de 0,01 Keq /m³, a tendência observada se diferenciou das demais, uma vez que o menor valor foi registrado para a vazão de 40 L/h e os desvios entre os três dados são menores. 34
38 Densidade de Corrente Limite Teórica (A/m²) A resolução do sistema linear indicado na equação (12) resultou nos seguintes valores dos parâmetros a, b e n: Tabela 4 - Parâmetros a, b e n antes do tratamento estatístico para cloreto de sódio a b n ,847 0,0524 Verifica-se que as ordens de grandeza desses parâmetros são bem distintas, o que é reflexo da contribuição de cada termo no resultado da corrente limite teórica. A partir destes dados é possível obter o gráfico da densidade de corrente limite teórica em função da densidade de corrente limite experimental. A Figura 25 apresenta este gráfico com os limites superior e inferior descritos na seção 5.5: Cloreto de Sódio (sem descarte) y = 0,8489x + 20,12 R² = 0, Densidade de Corrente Limite Experimental (A/m²) Figura 25 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio antes do tratamento estatístico Observa-se que dois pontos encontram-se fora dos limites definidos, sendo necessário, portanto, descartá-los. Destaca-se que esses pontos correspondem às condições da concentração mais elevada (0,05 Keq/m³) e às vazões de 40 e 50 L/h. Uma vez excluídos, os dados remanescentes são utilizados para o refinamento dos parâmetros a, b e n, os quais são apresentados na tabela abaixo: Tabela 5 - Parâmetros a, b e n após o tratamento estatístico para cloreto de sódio a b n ,920 0,
39 Densidade de Corrente Limite Teórica (A/m²) Os parâmetros obtidos após a exclusão dos pontos apresentam desvios consideráveis em relação aos valores obtidos inicialmente, o que justifica a utilização dos limites de confiança de apenas um desvio padrão. A figura abaixo apresenta a correlação entre os valores da densidade de corrente limite teórica em função da densidade de corrente limite experimental após o tratamento estatístico: Cloreto de Sódio (com descarte) y = 0,8452x + 10,945 R² = 0, Densidade de Corrente Limite Experimental (A/m²) Figura 26 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de sódio após o tratamento estatístico Conclui-se que os dados teóricos e experimentais apresentam boa correlação para o intervalo de concentrações e velocidades estudado, o que pode ser avaliado pelo parâmetro R2 obtido. Dessa forma, pode-se dizer que a correlação teórica da densidade de corrente limite é adequada para a implementação do modelo matemático do sistema de eletrodiálise para o cloreto de sódio Cloreto de Potássio A Figura 27 apresenta os valores da densidade de corrente limite obtidos experimentalmente para o cloreto de potássio em função das vazões teóricas de escoamento: 36
40 Densidade de Corrente Limite (A/m²) 250 Cloreto de Potássio C=0,01 keq/m³ C=0,03 keq/m³ C=0,05 keq/m³ Vazão Teórica (L/h) Figura 27 - Densidade de corrente limite em função da vazão teórica de escoamento para cloreto de potássio Para concentrações baixas (0,01 Keq/m³) a curva pode ser aproximada por uma reta decrescente no intervalo de vazões avaliado. Já para as concentrações mais altas (0,03 e 0,05 Keq/m³), as curvas podem ser aproximadas por um polinômio de segundo grau com concavidade para cima, apresentando, portanto, um ponto mínimo de densidade de corrente limite. É importante destacar que as concentrações mais altas também apresentam maiores valores de densidade de corrente limite. O sistema linear indicado na equação (12) foi utilizado para calcular os valores dos parâmetros a, b e n: Tabela 6 - Parâmetros a, b e n antes do tratamento estatístico para cloreto de potássio a b n ,786-0,0758 Mais uma vez, as ordens de grandeza dos parâmetros mostraram-se distintas, indicando que a contribuição de cada termo no cálculo da densidade de corrente limite teórica é diferente. A partir destes dados, plota-se o gráfico da densidade de corrente limite teórica em função da densidade de corrente limite experimental: 37
41 Densidade de Corrente Limite Teórica (A/m²) 250 Cloreto de Potássio (sem descarte) y = 0,8783x + 16,239 R² = 0, Densidade de Corrente Limite Experimental (A/m²) Figura 28 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de potássio antes do tratamento estatístico Observa-se que para este sal, a quantidade de pontos fora dos limites estabelecidos é maior quando comparado ao cloreto de sódio, sendo necessário descartar quatro pontos. Os pontos descartados correspondem às condições de concentrações mais elevadas (0,03 e 0,05 Keq/m³), sugerindo que a correlação é menos satisfatória para concentrações em torno de 0,05 Keq/m³. Os parâmetros a, b e n recalculados são apresentados na tabela abaixo: Tabela 7 - Parâmetros a, b e n após o tratamento estatístico para cloreto de potássio a b n ,781-0,148 A Figura 29 apresenta a correlação entre os valores da densidade de corrente limite teórica em função da densidade de corrente limite experimental após o tratamento estatístico: 38
42 Densidade de Corrente Limite Teórica (A/m²) 250 Cloreto de Potássio (com descarte) y = 1,0588x - 2,7788 R² = 0, Densidade de Corrente Limite Experimental (A/m²) Figura 29 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de potássio após o tratamento estatístico. Conclui-se que os dados teóricos e experimentais para o cloreto de potássio apresentam boa correlação para o intervalo entre 0,01 e 0,03 Keq/m³, e correlação menos satisfatória para valores superiores a 0,03 Keq/m³. Espera-se, portanto, que o modelo seja capaz de calcular a concentração das soluções no sistema de eletrodiálise a partir desses parâmetros com algumas limitações em concentrações mais elevadas Sulfato de Sódio Na figura abaixo são apresentados os valores da densidade de corrente limite obtidos experimentalmente em função das vazões teóricas de escoamento: 39
43 Densidade de Corrente Limite (A/m²) 250 Sulfato de Sódio C=0,01 keq/m³ C=0,03 keq/m³ C=0,05 keq/m³ Vazão Teórica (L/h) Figura 30 - Densidade de corrente limite em função da vazão teórica de escoamento para sulfato de sódio Observa-se que o aumento da concentração do sulfato de sódio resulta no aumento do valor da densidade de corrente limite, assim como nos outros dois sais analisados. As curvas para as concentrações de 0,01 e 0,03 Keq/m³ apresentaram comportamentos semelhantes, uma vez que ambas possuem uma região praticamente constante até 40 L/h, e para vazões acima deste valor, um aumento da densidade de corrente limite. Já para a concentração de 0,05 Keq/m³, verifica-se um decréscimo acentuado da densidade de corrente limite para toda a faixa de vazões estudada. Destaca-se que o sulfato de sódio apresentou valores de densidade de corrente limite inferiores ao cloreto de sódio, o que pode estar relacionado com o fato do sulfato de sódio ser um sal bivalente, ao passo que o cloreto de sódio é monovalente. A resolução do sistema linear indicado na equação (12) resultou nos seguintes valores dos parâmetros a, b e n: Tabela 8 - Parâmetros a, b e n antes do tratamento estatístico para sulfato de sódio a b n ,922-0,0591 As ordens de grandeza distintas indicam que a contribuição de cada termo no resultado da corrente limite teórica é diferente. 40
44 Densidade de Corrente Limite Teórica (A/m²) O gráfico da densidade de corrente limite teórica em função da densidade de corrente limite experimental para o sulfato de sódio é apresentado na figura abaixo: 250 Sulfato de Sódio (sem descarte) y = 0,9533x + 3,8627 R² = 0, Densidade de Corrente Limite Experimental (A/m²) Figura 31 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para sulfato de sódio antes do tratamento estatístico Assim como o cloreto de sódio, observa-se que dois pontos encontram-se fora dos limites definidos. Os pontos a serem descartados correspondem aos resultados obtidos para as concentrações de 0,05 e 0,03 Keq/m³ para a vazão de 50 L/h. Os dados remanescentes são utilizados para o refinamento dos parâmetros a, b e n, os quais são apresentados na tabela abaixo: Tabela 9 - Parâmetros a, b e n após o tratamento estatístico para cloreto de sódio a b n ,991-0,0403 A figura abaixo apresenta a correlação entre os valores da densidade de corrente limite teórica em função da densidade de corrente limite experimental após o tratamento estatístico: 41
45 Densidade de Corrente Limite Teórica (A/m²) 250 Sulfato de Sódio (com descarte) y = 0,9054x + 5,2372 R² = 0, Densidade de Corrente Limite Experimental (A/m²) Figura 32 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para sulfato de sódio após o tratamento estatístico Conclui-se que os dados teóricos e experimentais apresentam boa correlação para o intervalo de concentrações estudado, embora velocidades mais altas possam apresentar resultados menos satisfatórios, conforme se verificou durante a realização do tratamento estatístico. Destaca-se também, que os resultados obtidos para este sal são inferiores aos valores do cloreto de sódio, indicando a influência do caráter bivalente dos sais. De qualquer forma, a correlação teórica da densidade de corrente limite é adequada para a implementação do modelo matemático do sistema de eletrodiálise para o sulfato de sódio Cloreto de Magnésio Os valores da densidade de corrente limite obtidos experimentalmente em função das vazões teóricas de escoamento para o cloreto de magnésio são apresentados na Figura 33: 42
46 Densidade de Corrente Limite (A/m²) 250 Cloreto de Magnésio C=0,01 keq/m³ C=0,03 keq/m³ C=0,05 keq/m³ Vazão Teórica (L/h) Figura 33 - Densidade de corrente limite em função da vazão teórica de escoamento para cloreto de magnésio A partir das curvas acima, verifica-se que o cloreto de magnésio apresenta os maiores valores da densidade de corrente limite para a concentração intermediária de 0,03 Keq/m³. Observa-se também que o formato das curvas para as concentrações mais altas se assemelha a uma parábola com concavidade para cima, sendo o ponto mínimo observado para a vazão de 40 L/h. A curva obtida para a concentração de 0,01 Keq/m³ apresenta um decrescimento acentuado da densidade de corrente limite entre o intervalo de 20 e 40 L/h, e um decréscimo suave entre 40 e 50 L/h. A resolução do sistema linear indicado na equação (12) resultou nos valores dos parâmetros a, b e n indicados abaixo: Tabela 10 - Parâmetros a, b e n antes do tratamento estatístico para cloreto de magnésio a b n 779 0,669-0,234 As ordens de grandeza distintas indicam que a contribuição de cada termo no resultado da corrente limite teórica é diferente. O gráfico da densidade de corrente limite teórica em função da densidade de corrente limite experimental para o cloreto de magnésio é apresentado na figura abaixo: 43
47 Densidade de Corrente Limite Teórica (A/m²) Cloreto de Magnésio (sem descarte) y = 0,5546x + 69,287 R² = 0, Densidade de Corrente Limite Experimental (A/m²) Figura 34 - Gráfico da correlação entre as densidades de corrente limite teóricas e experimentais para cloreto de magnésio antes do tratamento estatístico Os dados obtidos para o cloreto de magnésio apresentaram a maior dispersão dentre os sais analisados, o que indica que a correlação aproxima a densidade de corrente limite de forma insatisfatória. Esta dispersão dos dados pode ser resultado do fato de que o cloreto de magnésio precipita nas membranas catiônicas devido à mudança de ph que ocorre durante a realização do experimento. A Figura 35 evidencia a formação de hidróxido de magnésio nas membranas catiônicas após o experimento. Dessa forma, é necessário o descarte de três pontos do conjunto de dados experimentais, os quais estão relacionados à concentração de 0,05 Keq/m³. 44
48 Figura 35 - Membrana catiônica com precipitado de Mg(OH) 2 Os dados remanescentes são utilizados para o refinamento dos parâmetros a, b e n, os quais são apresentados na tabela abaixo: Tabela 11 - Parâmetros a, b e n após o tratamento estatístico para cloreto de sódio a b n ,986-0,587 A figura a seguir apresenta a correlação entre os valores da densidade de corrente limite teórica em função da densidade de corrente limite experimental após o tratamento estatístico. Destaca-se, que apesar do tratamento estatístico, os dados apresentam baixa linearidade, conforme indicado na Figura
AVALIAÇÃO DE UM REATOR ELETRODIALÍTICO PARA O APROVEITAMENTO DO SUBPRODUTO DA DESSALINIZAÇÃO DE SOLUÇÕES SALINAS VIA ELETRODIÁLISE
 AVALIAÇÃO DE UM REATOR ELETRODIALÍTICO PARA O APROVEITAMENTO DO SUBPRODUTO DA DESSALINIZAÇÃO DE SOLUÇÕES SALINAS VIA ELETRODIÁLISE M. L. Freire, E. D. Melo e K. B. França 1 Resumo - Um reator eletrodialítico
AVALIAÇÃO DE UM REATOR ELETRODIALÍTICO PARA O APROVEITAMENTO DO SUBPRODUTO DA DESSALINIZAÇÃO DE SOLUÇÕES SALINAS VIA ELETRODIÁLISE M. L. Freire, E. D. Melo e K. B. França 1 Resumo - Um reator eletrodialítico
PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes
 PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes AULA 2 CLASSIFICAÇÃO DOS PROCESSOS DE SEPARAÇÃO POR MEMBRANAS Prof.: José Carlos Mierzwa Processos de Separação por Membranas
PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes AULA 2 CLASSIFICAÇÃO DOS PROCESSOS DE SEPARAÇÃO POR MEMBRANAS Prof.: José Carlos Mierzwa Processos de Separação por Membranas
PHA 5053 Processos de Separação por Membranas para Tratamento de Água e Efluentes
 PHA 5053 Processos de Separação por Membranas para Tratamento de Água e Efluentes AULA 2 CLASSIFICAÇÃO DOS PROCESSOS DE SEPARAÇÃO POR MEMBRANAS Prof.: José Carlos Mierzwa mierzwa@usp.br Classificação dos
PHA 5053 Processos de Separação por Membranas para Tratamento de Água e Efluentes AULA 2 CLASSIFICAÇÃO DOS PROCESSOS DE SEPARAÇÃO POR MEMBRANAS Prof.: José Carlos Mierzwa mierzwa@usp.br Classificação dos
Escola Politécnica da Universidade de São Paulo. Departamento de Engenharia Química. PQI 2000 Trabalho de Conclusão de curso II MARCELO DUTRA DA SILVA
 Escola Politécnica da Universidade de São Paulo Departamento de Engenharia Química PQI 2000 Trabalho de Conclusão de curso II MARCELO DUTRA DA SILVA Estudo do efeito de soluções supersaturadas na separação
Escola Politécnica da Universidade de São Paulo Departamento de Engenharia Química PQI 2000 Trabalho de Conclusão de curso II MARCELO DUTRA DA SILVA Estudo do efeito de soluções supersaturadas na separação
Condutividade Elétrica
 FQE1 Exp. 1 Condutividade Elétrica 1. Introdução A condução elétrica é um fenômeno de transporte em que a carga elétrica (elétrons ou íons) se move através do sistema. A condutividade elétrica, também
FQE1 Exp. 1 Condutividade Elétrica 1. Introdução A condução elétrica é um fenômeno de transporte em que a carga elétrica (elétrons ou íons) se move através do sistema. A condutividade elétrica, também
C.S.L. SANTOS¹ * *, M.V. FIRMINO¹, M.M. RESENDE¹, V.L. CARDOSO¹ RESUMO
 DETERMINAÇÃO DA DENSIDADE DE CORRENTE LIMITE E AVALIAÇÃO DA REMOÇÃO DE CROMO (VI) DE EFLUENTES SINTÉTICOS CONTAMINADOS ATRAVÉS DE UMA CÉLULA DE ELETRODIÁLISE COM E SEM A APLICAÇÃO DE CORRENTE C.S.L. SANTOS¹
DETERMINAÇÃO DA DENSIDADE DE CORRENTE LIMITE E AVALIAÇÃO DA REMOÇÃO DE CROMO (VI) DE EFLUENTES SINTÉTICOS CONTAMINADOS ATRAVÉS DE UMA CÉLULA DE ELETRODIÁLISE COM E SEM A APLICAÇÃO DE CORRENTE C.S.L. SANTOS¹
HIDROMETALURGIA E ELETROMETALURGIA
 A melhoria das propriedades das resinas orgânicas incentivou a aplicação para o processo de troca iônica devido a sua estabilidade e elevada capacidade. As primeiras tentativas para aplicação da troca
A melhoria das propriedades das resinas orgânicas incentivou a aplicação para o processo de troca iônica devido a sua estabilidade e elevada capacidade. As primeiras tentativas para aplicação da troca
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CONCEITOS BÁSICOS Eletroquímica Fenômenos químicos associados à transferência de cargas elétricas Duas semi-reações de transferência de carga em direções opostas
TÉCNICAS AVANÇADAS DE MODELAÇÃO E SIMULAÇÃO
 Universidade de Coimbra Faculdade de Ciência e Tecnologia Departamento de Engenharia Química TÉCNICAS AVANÇADAS DE MODELAÇÃO E SIMULAÇÃO PROFESSOR NUNO DE OLIVEIRA MODELAGEM DE UM SEPARADOR POR MEMBRANA
Universidade de Coimbra Faculdade de Ciência e Tecnologia Departamento de Engenharia Química TÉCNICAS AVANÇADAS DE MODELAÇÃO E SIMULAÇÃO PROFESSOR NUNO DE OLIVEIRA MODELAGEM DE UM SEPARADOR POR MEMBRANA
DETERMINAÇÃO DA CORRENTE LIMITE NA ELETRODIÁLISE USANDO UMA SOLUÇÃO DILUÍDA COM MANGANÊS
 DETERMINAÇÃO DA CORRENTE LIMITE NA ELETRODIÁLISE USANDO UMA SOLUÇÃO DILUÍDA COM MANGANÊS DETERMINATION OF THE LIMIT CURRENT IN ELECTRODIALYSIS USING A DILUTED SOLUTION WITH MANGANESE Camila Silveira Lamanes
DETERMINAÇÃO DA CORRENTE LIMITE NA ELETRODIÁLISE USANDO UMA SOLUÇÃO DILUÍDA COM MANGANÊS DETERMINATION OF THE LIMIT CURRENT IN ELECTRODIALYSIS USING A DILUTED SOLUTION WITH MANGANESE Camila Silveira Lamanes
MONTAGEM E CARACTERIZAÇÃO DE UNIDADE DE ELETRODIÁLISE EM ESCALA DE LABORATÓRIO PARA TRATAMENTO DE SOLUÇÕES SALINAS
 THALES PIRES DIAS GALUCHI MONTAGEM E CARACTERIZAÇÃO DE UNIDADE DE ELETRODIÁLISE EM ESCALA DE LABORATÓRIO PARA TRATAMENTO DE SOLUÇÕES SALINAS Dissertação apresentada à Escola Politécnica da Universidade
THALES PIRES DIAS GALUCHI MONTAGEM E CARACTERIZAÇÃO DE UNIDADE DE ELETRODIÁLISE EM ESCALA DE LABORATÓRIO PARA TRATAMENTO DE SOLUÇÕES SALINAS Dissertação apresentada à Escola Politécnica da Universidade
FÚLVIA JUNG BORGES INTEGRAÇÃO DOS PROCESSOS DE ELETRODIÁLISE E DE DEGRADAÇÃO FOTOQUÍMICA PARA O TRATAMENTO DE EFLUENTES SALINOS CONTENDO FENOL
 FÚLVIA JUNG BORGES INTEGRAÇÃO DOS PROCESSOS DE ELETRODIÁLISE E DE DEGRADAÇÃO FOTOQUÍMICA PARA O TRATAMENTO DE EFLUENTES SALINOS CONTENDO FENOL São Paulo 29 FÚLVIA JUNG BORGES INTEGRAÇÃO DOS PROCESSOS DE
FÚLVIA JUNG BORGES INTEGRAÇÃO DOS PROCESSOS DE ELETRODIÁLISE E DE DEGRADAÇÃO FOTOQUÍMICA PARA O TRATAMENTO DE EFLUENTES SALINOS CONTENDO FENOL São Paulo 29 FÚLVIA JUNG BORGES INTEGRAÇÃO DOS PROCESSOS DE
TRATAMENTO DE EFLUENTES LÍQUIDOS POR MEMBRANAS. Eng. Walter Plácido
 TRATAMENTO DE EFLUENTES LÍQUIDOS POR MEMBRANAS 1 Eng. Walter Plácido Bacteriológicas Considerações Custos Químicas e volumétricas Eficácia (disponibilidade e rendimento) Nível da tecnologia SISTEMAS MEMBRANARES
TRATAMENTO DE EFLUENTES LÍQUIDOS POR MEMBRANAS 1 Eng. Walter Plácido Bacteriológicas Considerações Custos Químicas e volumétricas Eficácia (disponibilidade e rendimento) Nível da tecnologia SISTEMAS MEMBRANARES
Métodos Eletroanalíticos. Condutometria
 Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
Métodos Eletroanalíticos Condutometria Tipos de métodos eletroanalíticos Métodos Eletroanalíticos Métodos Interfaciais Métodos Não-Interfaciais Estáticos Dinâmicos Condutimetria Titulações Condutimétricas
9 RESULTADOS E DISCUSSÃO
 9 RESULTADOS E DISCUSSÃO Uma etapa importante na seqüência do trabalho foi a obtenção de dados sobre a membrana NF-9-4, fatores como permeabilidade hidráulica, características de rejeição, hidrofilicidade
9 RESULTADOS E DISCUSSÃO Uma etapa importante na seqüência do trabalho foi a obtenção de dados sobre a membrana NF-9-4, fatores como permeabilidade hidráulica, características de rejeição, hidrofilicidade
Operações Unitárias: nanofiltração, ultrafiltração, microfiltração e osmose reversa. Profª. Camila Ortiz Martinez UTFPR Campo Mourão
 Operações Unitárias: nanofiltração, ultrafiltração, microfiltração e osmose reversa Profª. Camila Ortiz Martinez UTFPR Campo Mourão Introdução Definição Eliminar componentes indesejáveis Meio filtrante:
Operações Unitárias: nanofiltração, ultrafiltração, microfiltração e osmose reversa Profª. Camila Ortiz Martinez UTFPR Campo Mourão Introdução Definição Eliminar componentes indesejáveis Meio filtrante:
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Físico-Química, cap. 5: Transformações Físicas de Substâncias Puras Misturas Simples Misturas de substâncias que não reagem Modelo simples para
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Solução Eletrolítica Dupla Camada Elétrica Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Titração Potenciométrica Potenciometria Potencial
Eletroanalítica: Condutometria (ou Condutimetria)
 Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
Universidade Federal do ABC Disciplina: Eletroanalítica e Técnicas de Separação (NH 3101) Eletroanalítica: Condutometria (ou Condutimetria) Bruno Lemos Batista Santo André - SP 2018 Site da disciplina
2 Teoria Geral sobre Eletroforese Capilar
 2 Teoria Geral sobre Eletroforese Capilar 2.1. Breve resumo sobre a técnica de eletroforese capilar A eletroforese é definida como o transporte, em solução eletrolítica, de compostos carregados eletricamente
2 Teoria Geral sobre Eletroforese Capilar 2.1. Breve resumo sobre a técnica de eletroforese capilar A eletroforese é definida como o transporte, em solução eletrolítica, de compostos carregados eletricamente
AVALIAÇÃO DE UM SISTEMA DE MEMBRANA-RESINA PARA A PRODUÇÃO DE ÁGUA DE BAIXA CONDUTIVIDADE ELÉTRICA
 ISSN 1983-4209 Volume 09 Número 04 2013 AVALIAÇÃO DE UM SISTEMA DE MEMBRANA-RESINA PARA A PRODUÇÃO DE ÁGUA DE BAIXA CONDUTIVIDADE ELÉTRICA José Theódulo Fernandes Neto 1, Bruna da Silveira Guimarães 2,
ISSN 1983-4209 Volume 09 Número 04 2013 AVALIAÇÃO DE UM SISTEMA DE MEMBRANA-RESINA PARA A PRODUÇÃO DE ÁGUA DE BAIXA CONDUTIVIDADE ELÉTRICA José Theódulo Fernandes Neto 1, Bruna da Silveira Guimarães 2,
CLARIFICAÇÃO DE SUCO 1. Introdução
 21 CLARIFICAÇÃO DE SUCO 1 Mariana Tito Teixeira 2, Kamila Lacerda de Almeida 3, Gabryela Nardy de Oliveira 4, Adriana M. Patarroyo Vargas 5 Resumo: Os sucos de frutas têm evoluído bastante na preferência
21 CLARIFICAÇÃO DE SUCO 1 Mariana Tito Teixeira 2, Kamila Lacerda de Almeida 3, Gabryela Nardy de Oliveira 4, Adriana M. Patarroyo Vargas 5 Resumo: Os sucos de frutas têm evoluído bastante na preferência
Processos de Membranas. João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, Piso 4 Ext. 1964
 Processos de Membranas João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, Piso 4 Ext. 1964 Introdução aos Processos com Membranas Definição de Membrana Tipos de Membranas Processos
Processos de Membranas João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, Piso 4 Ext. 1964 Introdução aos Processos com Membranas Definição de Membrana Tipos de Membranas Processos
Eletroquímica. Métodos/Técnicas - Eletroquímicas. Físico-química III/DAQBI/UTFPR - João Batista Floriano. Técnicas Eletroquímicas
 Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Métodos/Técnicas - s Técnicas s Interface Eletrodo/ solução Métodos Estacionários (I = 0) Métodos Dinâmicos (I 0) Solução Eletrolítica Titração Potenciométrica Potenciometria Potencial Controlado Potencial
Membranas de Eletrodiálise: Síntese e Caracterização. Prof. Dr. Marco Antônio Siqueira Rodrigues
 Membranas de Eletrodiálise: Síntese e Caracterização Prof. Dr. Marco Antônio Siqueira Rodrigues ELETRODIÁLISE Fluxograma do funcionamento de uma planta de Eletrodiálise na recuperação de Metais MEMBRANAS
Membranas de Eletrodiálise: Síntese e Caracterização Prof. Dr. Marco Antônio Siqueira Rodrigues ELETRODIÁLISE Fluxograma do funcionamento de uma planta de Eletrodiálise na recuperação de Metais MEMBRANAS
Unidade Curricular: Física Aplicada
 FFUP Física Aplicada 206/207 Mestrado Integrado em Ciências Farmacêuticas Unidade Curricular: Física Aplicada Aulas Laboratoriais Trabalho laboratorial n.º 7 Estudo da condução elétrica: aplicação à determinação
FFUP Física Aplicada 206/207 Mestrado Integrado em Ciências Farmacêuticas Unidade Curricular: Física Aplicada Aulas Laboratoriais Trabalho laboratorial n.º 7 Estudo da condução elétrica: aplicação à determinação
ABORDAGENS TECNOLÓGICAS PARA SEPARAÇÃO DOS SAIS DA ÁGUA MÃE
 ABORDAGENS TECNOLÓGICAS PARA SEPARAÇÃO DOS SAIS DA ÁGUA MÃE Clodomiro Alves Junior Professor visitante UFERSA/Labplasma clodomiro.jr@ufersa.edu.br WORKSHOP - Industria Salineira em Foco: Perspectiva de
ABORDAGENS TECNOLÓGICAS PARA SEPARAÇÃO DOS SAIS DA ÁGUA MÃE Clodomiro Alves Junior Professor visitante UFERSA/Labplasma clodomiro.jr@ufersa.edu.br WORKSHOP - Industria Salineira em Foco: Perspectiva de
Processos de Membranas. Docente: João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, 2º Andar Ext. 1964
 Processos de Membranas Docente: João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, 2º Andar Ext. 1964 Introdução aos Processos com Membranas! Definição de Membrana! Tipos de Membranas!
Processos de Membranas Docente: João Salvador Fernandes Lab. de Tecnologia Electroquímica Pavilhão de Minas, 2º Andar Ext. 1964 Introdução aos Processos com Membranas! Definição de Membrana! Tipos de Membranas!
Físico-Química I. Profa. Dra. Carla Dalmolin. Misturas Simples. Termodinâmica das Misturas Propriedades das Soluções Atividade
 Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
Físico-Química I Profa. Dra. Carla Dalmolin Misturas Simples Termodinâmica das Misturas Propriedades das Soluções Atividade Misturas Simples Misturas de substâncias que não reagem Modelo simples para posteriormente
u A prática de reúso é mias uma opção para a redução da pressão sobre os recursos hídricos;
 Introdução u A prática de reúso é mias uma opção para a redução da pressão sobre os recursos hídricos; u Contudo, ela apresenta limitações; u É necessário um planejamento adequado para a implantação do
Introdução u A prática de reúso é mias uma opção para a redução da pressão sobre os recursos hídricos; u Contudo, ela apresenta limitações; u É necessário um planejamento adequado para a implantação do
AVALIAÇÃO DO TRANSPORTE IÔNICO NOS DIFERENTES LADOS DAS MEMBRANAS ANIÔNICAS HETEROGÊNEAS APLICADAS EM ELETRODIÁLISE
 AVALIAÇÃO DO TRANSPORTE IÔNICO NOS DIFERENTES LADOS DAS MEMBRANAS ANIÔNICAS HETEROGÊNEAS APLICADAS EM ELETRODIÁLISE G. M. da Silveira*, N. E. Lauffer, F. T. Nascimento, J. F. Corte, N. C. Martins, M. Flach,
AVALIAÇÃO DO TRANSPORTE IÔNICO NOS DIFERENTES LADOS DAS MEMBRANAS ANIÔNICAS HETEROGÊNEAS APLICADAS EM ELETRODIÁLISE G. M. da Silveira*, N. E. Lauffer, F. T. Nascimento, J. F. Corte, N. C. Martins, M. Flach,
TIPOS DE MÉTODOS ELETROANALÍTICOS
 CONDUTOMETRIA TIPOS DE MÉTODOS ELETROANALÍTICOS CONDUTOMETRIA Baseia-se em medições de condutância das soluções iônicas(seio da solução). A condução de eletricidade através das soluções iônicas é devida
CONDUTOMETRIA TIPOS DE MÉTODOS ELETROANALÍTICOS CONDUTOMETRIA Baseia-se em medições de condutância das soluções iônicas(seio da solução). A condução de eletricidade através das soluções iônicas é devida
Potencial de Membrana.
 1 de 5 06/06/2007 08:28 Potencial de Membrana. O potencial de Nernst: Como é possível separar cargas através da membrana para se ter uma diferença potencial? Vamos ver um exemplo. Vamos assumir que temos
1 de 5 06/06/2007 08:28 Potencial de Membrana. O potencial de Nernst: Como é possível separar cargas através da membrana para se ter uma diferença potencial? Vamos ver um exemplo. Vamos assumir que temos
E cel = E catodo - E anodo E cel = 0,337 ( 0,763) E cel = 1,100 V. ZnSO 4(aq) 1,0 mol L -1 CuSO 4(aq) 1,0 mol L -1
 QMC5351 Química Analítica Instrumental POTENCIOMETRIA Análise Potenciométrica Conceitos Iniciais CÉLULA ELETROQUÍMICA sistema onde dois eletrodos, cada um deles imerso em uma solução eletrolítica (interligadas
QMC5351 Química Analítica Instrumental POTENCIOMETRIA Análise Potenciométrica Conceitos Iniciais CÉLULA ELETROQUÍMICA sistema onde dois eletrodos, cada um deles imerso em uma solução eletrolítica (interligadas
ESCOAMENTOS UNIFORMES EM CANAIS
 ESCOAMENTOS UNIFORMES EM CANAIS Nome: nº turma INTRODUÇÃO Um escoamento em canal aberto é caracterizado pela existência de uma superfície livre. Esta superfície é na realidade uma interface entre dois
ESCOAMENTOS UNIFORMES EM CANAIS Nome: nº turma INTRODUÇÃO Um escoamento em canal aberto é caracterizado pela existência de uma superfície livre. Esta superfície é na realidade uma interface entre dois
ELETROQUÍMICA. Prof a. Dr a. Carla Dalmolin
 ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
ELETROQUÍMICA Prof a. Dr a. Carla Dalmolin CINÉTICA E MECANISMOS DAS REAÇÕES ELETROQUÍMICAS Eletrodo Transferência de Elétrons O + e R 5. Transferência de elétrons k c O 1. Difusão k d,o k a O Para uma
Eletrodo redox. Eletrodos construídos com metais inertes: platina, ouro, paládio. do sistema de óxido-redução presente na solução.
 Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
Eletrodo redox Para sistemas de óxido-redução. Eletrodos construídos com metais inertes: platina, ouro, paládio Atuam como fontes ou depósito de elétrons transferidos a partir do sistema de óxido-redução
ESTE Aula 2- Introdução à convecção. As equações de camada limite
 Universidade Federal do ABC ESTE013-13 Aula - Introdução à convecção. As equações de camada limite EN 41: Aula As equações de camada limite Análise das equações que descrevem o escoamento em camada limite:
Universidade Federal do ABC ESTE013-13 Aula - Introdução à convecção. As equações de camada limite EN 41: Aula As equações de camada limite Análise das equações que descrevem o escoamento em camada limite:
TRANSPORTE ATRAVÉS DA MEMBRANA
 TRANSPORTE ATRAVÉS DA MEMBRANA LÍQUIDOS INTRA E EXTRA CELULARES MEMBRANA CELULAR: manutenção das # / seletividade das proteínas transportadoras para íons ou moléculas; SELETIVIDADE E ABERTURAS DAS COMPORTAS
TRANSPORTE ATRAVÉS DA MEMBRANA LÍQUIDOS INTRA E EXTRA CELULARES MEMBRANA CELULAR: manutenção das # / seletividade das proteínas transportadoras para íons ou moléculas; SELETIVIDADE E ABERTURAS DAS COMPORTAS
PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes
 PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes AULAS 4 E 5 APLICAÇÕES E LIMITAÇÕES Prof.: José Carlos Mierzwa mierzwa@usp.br Aplicação dos processos de separação por
PHA 3418 Tecnologia de Separação por Membranas para Tratamento de Água e Efluentes AULAS 4 E 5 APLICAÇÕES E LIMITAÇÕES Prof.: José Carlos Mierzwa mierzwa@usp.br Aplicação dos processos de separação por
PQI 2321 Tópicos de Química para Engenharia Ambiental I
 PQI 2321 Tópicos de Química para Engenharia Ambiental I Aulas 14 e 15 Balanços de massa em processos com reações químicas. Cinética química. Ordem de reação Prof. Antonio Carlos S. C. Teixeira Centro de
PQI 2321 Tópicos de Química para Engenharia Ambiental I Aulas 14 e 15 Balanços de massa em processos com reações químicas. Cinética química. Ordem de reação Prof. Antonio Carlos S. C. Teixeira Centro de
Prof. Dr. Marco Antônio Siqueira Rodrigues. Instituto de Ciências Exatas e Tecnológicas. Departamento de Engenharia Química
 Prof. Dr. Marco Antônio Siqueira Rodrigues Instituto de Ciências Exatas e Tecnológicas Departamento de Engenharia Química Eletrodiálise Aplicada ao Tratamento de Efluentes Eletrodiálise O princípio básico
Prof. Dr. Marco Antônio Siqueira Rodrigues Instituto de Ciências Exatas e Tecnológicas Departamento de Engenharia Química Eletrodiálise Aplicada ao Tratamento de Efluentes Eletrodiálise O princípio básico
MODELAGEM E SIMULAÇÃO DA SEPARAÇÃO DO FLUIDO DE PERFURAÇÃO EM PENEIRAS VIBRATÓRIAS
 MODELAGEM E SIMULAÇÃO DA SEPARAÇÃO DO FLUIDO DE PERFURAÇÃO EM PENEIRAS VIBRATÓRIAS M. D. MARQUES 1 e V. V. MURATA 1 1 Universidade Federal de Uberlândia, Faculdade de Engenharia Química e-mail para contato:
MODELAGEM E SIMULAÇÃO DA SEPARAÇÃO DO FLUIDO DE PERFURAÇÃO EM PENEIRAS VIBRATÓRIAS M. D. MARQUES 1 e V. V. MURATA 1 1 Universidade Federal de Uberlândia, Faculdade de Engenharia Química e-mail para contato:
UNIVERSIDADE DE SÃO PAULO ENGENHARIA QUÍMICA LOQ4085 OPERAÇÕES UNITÁRIAS I
 UNIVERSIDADE DE SÃO PAULO ENGENHARIA QUÍMICA LOQ4085 OPERAÇÕES UNITÁRIAS I Profa. Lívia Chaguri E-mail: lchaguri@usp.br Conteúdo Filtração Parte 1 - Mecanismos de filtração - Perda de carga relativa à
UNIVERSIDADE DE SÃO PAULO ENGENHARIA QUÍMICA LOQ4085 OPERAÇÕES UNITÁRIAS I Profa. Lívia Chaguri E-mail: lchaguri@usp.br Conteúdo Filtração Parte 1 - Mecanismos de filtração - Perda de carga relativa à
Fonte: Netz e Ortega, 2002.
 1 Atividade A atividade é uma espécie de concentração efetiva. Para entender o que é uma concentração efetiva, podemos raciocinar do seguinte modo: As interações entre as moléculas em uma mistura fazem
1 Atividade A atividade é uma espécie de concentração efetiva. Para entender o que é uma concentração efetiva, podemos raciocinar do seguinte modo: As interações entre as moléculas em uma mistura fazem
) (8.20) Equipamentos de Troca Térmica - 221
 onde: v = &m = Cp = h lv = U = A = T = t = volume específico vazão em massa (Kg/h) calor específico calor latente de vaporização coeficiente global de troca térmica área de transmissão de calor temperatura
onde: v = &m = Cp = h lv = U = A = T = t = volume específico vazão em massa (Kg/h) calor específico calor latente de vaporização coeficiente global de troca térmica área de transmissão de calor temperatura
Aula 11: Técnicas de Purificação
 Aula 11: Técnicas de Purificação Felipe Curtolo, Fernanda Ribeiro Sumário Processos de separação por membrana Classificação e transporte por membranas Avaliação dos processos de separação por membrana
Aula 11: Técnicas de Purificação Felipe Curtolo, Fernanda Ribeiro Sumário Processos de separação por membrana Classificação e transporte por membranas Avaliação dos processos de separação por membrana
XXXIII ENCONTRO NACIONAL DE ENGENHARIA DE PRODUCAO
 ANÁLISE COMPARATIVA DO PROCESSO DE ELETRODIÁLISE COMO FERRAMENTA ANALÍTICA PARA REDUÇÃO DE CONSUMO ENERGÉTICO DO PROCESSO DE DESSALINIZAÇÃO DA ÁGUA SALOBRA Caio Cezar Neves Kunrath (UESC ) caiokunratth@hotmail.com
ANÁLISE COMPARATIVA DO PROCESSO DE ELETRODIÁLISE COMO FERRAMENTA ANALÍTICA PARA REDUÇÃO DE CONSUMO ENERGÉTICO DO PROCESSO DE DESSALINIZAÇÃO DA ÁGUA SALOBRA Caio Cezar Neves Kunrath (UESC ) caiokunratth@hotmail.com
Ronaldo Guimarães Corrêa. Aula #3: Configurações de Controle
 Ronaldo Guimarães Corrêa Aula #3: Configurações de Controle São Carlos 2012 Trocadores de Calor Em geral, trocadores de calor são fáceis de controlar. O modelo dinâmico de um trocador de calor casco-tubo
Ronaldo Guimarães Corrêa Aula #3: Configurações de Controle São Carlos 2012 Trocadores de Calor Em geral, trocadores de calor são fáceis de controlar. O modelo dinâmico de um trocador de calor casco-tubo
Transporte Iônico e o Potencial de Membrana
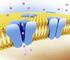 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
BIOMEMBRANAS. M Filomena Botelho
 BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
DETERMINAÇÃO DO COEFICIENTE DE DIFUSÃO DO ETANOL 1 DETERMINATION OF THE ETHANOL DIFFUSION COEFFCIENT
 DETERMINAÇÃO DO COEFICIENTE DE DIFUSÃO DO ETANOL 1 DETERMINATION OF THE ETHANOL DIFFUSION COEFFCIENT Anderson Luís Gay 2, Gabriela Zorzetto Do Nascimento 3, Mônica Lima Gonçalves 4, Fernanda Da Cunha Pereira
DETERMINAÇÃO DO COEFICIENTE DE DIFUSÃO DO ETANOL 1 DETERMINATION OF THE ETHANOL DIFFUSION COEFFCIENT Anderson Luís Gay 2, Gabriela Zorzetto Do Nascimento 3, Mônica Lima Gonçalves 4, Fernanda Da Cunha Pereira
ARTIGO CIENTÍFICO. Sistemas de Obtenção de Água para Aplicações Farmacêuticas. Skid com OR e EDI
 ARTIGO CIENTÍFICO Tema: As Vantagens da Eletrodeionização Responsável: Eduardo Horn Gerente de Produção Depto: Purificadores de água E-mail: eduardo.horn@gehaka.com.br Data: 05/02/2007 Sistemas de Obtenção
ARTIGO CIENTÍFICO Tema: As Vantagens da Eletrodeionização Responsável: Eduardo Horn Gerente de Produção Depto: Purificadores de água E-mail: eduardo.horn@gehaka.com.br Data: 05/02/2007 Sistemas de Obtenção
UFPR - Setor de Tecnologia Departamento de Engenharia Mecânica TM Laboratório de Engenharia Térmica Data : / / Aluno :
 UFPR - Setor de Tecnologia Departamento de Engenharia Mecânica TM-58 - Laboratório de Engenharia Térmica Data : / / Aluno : Tabela de controle de presença e entrega de relatórios Data Assinatura Entrega
UFPR - Setor de Tecnologia Departamento de Engenharia Mecânica TM-58 - Laboratório de Engenharia Térmica Data : / / Aluno : Tabela de controle de presença e entrega de relatórios Data Assinatura Entrega
BIOELETROGÊNESE. Laboratório de Biofísica de Membranas Prof. Dr. Wamberto A. Varanda Luiz Artur P. Chaves Vander Baptista
 BIOELETROGÊNESE Laboratório de Biofísica de Membranas Prof. Dr. Wamberto A. Varanda Luiz Artur P. Chaves Vander Baptista Todas as células são envolvidas por uma membrana de 7 a 10 nm de espessura que separa
BIOELETROGÊNESE Laboratório de Biofísica de Membranas Prof. Dr. Wamberto A. Varanda Luiz Artur P. Chaves Vander Baptista Todas as células são envolvidas por uma membrana de 7 a 10 nm de espessura que separa
Objectivo: Separar uma proteína das restantes no extracto celular. Estratégia: Existem inúmeras técnicas de purificação disponíveis.
 Objectivo: Separar uma proteína das restantes no extracto celular Estratégia: Existem inúmeras técnicas de purificação disponíveis. O procedimento exacto e a ordem dos métodos a aplicar dependem do tipo
Objectivo: Separar uma proteína das restantes no extracto celular Estratégia: Existem inúmeras técnicas de purificação disponíveis. O procedimento exacto e a ordem dos métodos a aplicar dependem do tipo
QUÍMICA ELETROANALÍTICA
 QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
QUÍMICA ELETROANALÍTICA A química Eletroanalítica compreende um conjunto de métodos analíticos qualitativos e quantitativos baseados nas propriedades elétricas de uma solução contendo o analito quando
Neste caso, diz-se que a reação é de primeira ordem, e a equação pode ser resolvida conforme segue abaixo:
 1. Introdução Cinética Química A termodinâmica indica a direção e a extensão de uma transformação química, porém não indica como, nem a que velocidade, uma reação acontece. A velocidade de uma reação deve
1. Introdução Cinética Química A termodinâmica indica a direção e a extensão de uma transformação química, porém não indica como, nem a que velocidade, uma reação acontece. A velocidade de uma reação deve
CÉLULAS ELETROLÍTICAS
 QUÍMICAELETROANALÍTICA CÉLULAS ELETROLÍTICAS REPRESENTAÇÃOESQUEMÁTICA dois limites, um em cada extremidade da ponte salina Cu Cu 2+ (0,0200 mol L -1 ) Ag + (0,0200 mol L -1 ) Ag limite entres fases, ou
QUÍMICAELETROANALÍTICA CÉLULAS ELETROLÍTICAS REPRESENTAÇÃOESQUEMÁTICA dois limites, um em cada extremidade da ponte salina Cu Cu 2+ (0,0200 mol L -1 ) Ag + (0,0200 mol L -1 ) Ag limite entres fases, ou
Uso Racional e Reúso da Água NECESSIDADES E DESAFIOS
 Escola Politécnica da USP PHD - 2548 Uso Racional e Reúso da Água NECESSIDADES E DESAFIOS Apresentação: José Carlos Mierzwa mierzwa@usp.br http://www.usp.br/cirra cirra@usp.br Programa do Curso 1 - A necessidade
Escola Politécnica da USP PHD - 2548 Uso Racional e Reúso da Água NECESSIDADES E DESAFIOS Apresentação: José Carlos Mierzwa mierzwa@usp.br http://www.usp.br/cirra cirra@usp.br Programa do Curso 1 - A necessidade
ESTUDO COMPORTAMENTAL DAS CÉLULAS COMBUSTÍVEIS DE MEMBRANA POLIMÉRICA JOSÉ R.CAMACHO
 ESTUDO COMPORTAMENTAL DAS CÉLULAS COMBUSTÍVEIS DE MEMBRANA POLIMÉRICA JOSÉ R.CAMACHO Lab. de Eletricidade Rural e Fontes Alt. de Energia, Faculdade de Engenharia Elétrica, Universidade Federal de Uberlândia
ESTUDO COMPORTAMENTAL DAS CÉLULAS COMBUSTÍVEIS DE MEMBRANA POLIMÉRICA JOSÉ R.CAMACHO Lab. de Eletricidade Rural e Fontes Alt. de Energia, Faculdade de Engenharia Elétrica, Universidade Federal de Uberlândia
Origens do potencial de membrana Excitabilidade celular
 Origens do potencial de membrana Excitabilidade celular Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana. Alterações na permeabilidade
Origens do potencial de membrana Excitabilidade celular Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana. Alterações na permeabilidade
SOLUÇÃO NUMÉRICA PARA O PROBLEMA DE FILTRAÇÃO TANGENCIAL COM MALHAS NÃO- UNIFORMES
 SOLUÇÃO NUMÉRICA PARA O PROBLEMA DE FILTRAÇÃO TANGENCIAL COM MALHAS NÃO- UNIFORMES D. E. N. LIMA e J. M. SILVA Universidade Federal de Alfenas, Instituto de Ciência e Tecnologia E-mail para contato: douglasales33@gmail.com
SOLUÇÃO NUMÉRICA PARA O PROBLEMA DE FILTRAÇÃO TANGENCIAL COM MALHAS NÃO- UNIFORMES D. E. N. LIMA e J. M. SILVA Universidade Federal de Alfenas, Instituto de Ciência e Tecnologia E-mail para contato: douglasales33@gmail.com
Primeira Lista de Exercícios de Biofísica II. c n
 Primeira Lista de Exercícios de Biofísica II 1. Considere uma célula composta por um corpo celular ao qual está preso um longo e fino processo tubular (por exemplo, o axônio de um neurônio ou o flagelo
Primeira Lista de Exercícios de Biofísica II 1. Considere uma célula composta por um corpo celular ao qual está preso um longo e fino processo tubular (por exemplo, o axônio de um neurônio ou o flagelo
5 MATERIAIS E MÉTODOS
 - 93-5 MATERIAIS E MÉTODOS 5.1. Preparação da emulsão sintética Para preparar um litro de emulsão sintética misturaram-se 3g de óleo lubrificante Shell Talpa 30 e água destilada, através de um misturador
- 93-5 MATERIAIS E MÉTODOS 5.1. Preparação da emulsão sintética Para preparar um litro de emulsão sintética misturaram-se 3g de óleo lubrificante Shell Talpa 30 e água destilada, através de um misturador
Experiência 1: Identificação de Amostras Sólidas por densidade 59
 Sumário Prefácio da 2 a Edição 17 Prefácio da 1 a edição 21 Capítulo 1: EQUIPAMENTOS BÁSICOS DE LABORATÓRIO 25 Capítulo 2: SEGURANÇA EM LABORATÓRIO 39 COMO MANTER UM AMBIENTE DE LABORATÓRIO SAUDÁVEL? 39
Sumário Prefácio da 2 a Edição 17 Prefácio da 1 a edição 21 Capítulo 1: EQUIPAMENTOS BÁSICOS DE LABORATÓRIO 25 Capítulo 2: SEGURANÇA EM LABORATÓRIO 39 COMO MANTER UM AMBIENTE DE LABORATÓRIO SAUDÁVEL? 39
EMENTÁRIO. Princípios de Conservação de Alimentos 6(4-2) I e II. MBI130 e TAL472*.
 EMENTÁRIO As disciplinas ministradas pela Universidade Federal de Viçosa são identificadas por um código composto por três letras maiúsculas, referentes a cada Departamento, seguidas de um número de três
EMENTÁRIO As disciplinas ministradas pela Universidade Federal de Viçosa são identificadas por um código composto por três letras maiúsculas, referentes a cada Departamento, seguidas de um número de três
CORRENTE DE ARRASTAMENTO
 Objectivos Compreender as correntes de arrastamento Apreender a noção de concentração média de uma membrana homogénea e de uma membrana porosa Apreender a noção de densidade de corrente total Compreender
Objectivos Compreender as correntes de arrastamento Apreender a noção de concentração média de uma membrana homogénea e de uma membrana porosa Apreender a noção de densidade de corrente total Compreender
3. Origem das cargas elétricas no solo
 3. Origem das cargas elétricas no solo 3.1. Origem das cargas elétricas Há no solo, em geral, predominância de cargas negativas sobre positivas. Essa predominância, bastante significativa em solos de regiões
3. Origem das cargas elétricas no solo 3.1. Origem das cargas elétricas Há no solo, em geral, predominância de cargas negativas sobre positivas. Essa predominância, bastante significativa em solos de regiões
Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O
 Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O 2 0 1 0 Difusão Movimento de componentes de uma mistura qualquer,
Difusão: Osmose Tônus Aplicação: Diálise T É C N I C A S B Á S I C A S D E L A B O R A T Ó R I O B I O M E D I C I N A U F R J M A I O 2 0 1 0 Difusão Movimento de componentes de uma mistura qualquer,
6ª OLIMPÍADA BAIANA DE QUÍMICA EXAME 2011
 Data da prova: 30.07.2011 Data da publicação do gabarito: 01.09.2011 GABARITO QUESTÕES DISCURSIVAS QUESTÃO 1. (Peso 2) Uma vela de massa 34,5g é acesa e encoberta por um bequer. Após algum tempo a chama
Data da prova: 30.07.2011 Data da publicação do gabarito: 01.09.2011 GABARITO QUESTÕES DISCURSIVAS QUESTÃO 1. (Peso 2) Uma vela de massa 34,5g é acesa e encoberta por um bequer. Após algum tempo a chama
DESTILAÇÃO COM MEMBRANAS APLICADA PARA CONCENTRAÇÃO DE SOLUÇÕES AQUOSAS DE CLORETO DE SÓDIO: MODELAGEM MATEMÁTICA
 DESTILAÇÃO COM MEMBRANAS APLICADA PARA CONCENTRAÇÃO DE SOLUÇÕES AQUOSAS DE CLORETO DE SÓDIO: MODELAGEM MATEMÁTICA Y. N. NARIYOSHI 1, C. E. PANTOJA 1, M. M. SECKLER 1 1 Universidade de São Paulo, Departamento
DESTILAÇÃO COM MEMBRANAS APLICADA PARA CONCENTRAÇÃO DE SOLUÇÕES AQUOSAS DE CLORETO DE SÓDIO: MODELAGEM MATEMÁTICA Y. N. NARIYOSHI 1, C. E. PANTOJA 1, M. M. SECKLER 1 1 Universidade de São Paulo, Departamento
Bioeletrogênese-Origens do potencial de membrana. Prof. Ricardo M. Leão. FMRP-USP
 Bioeletrogênese-Origens do potencial de membrana Prof. Ricardo M. Leão. FMRP-USP Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana.
Bioeletrogênese-Origens do potencial de membrana Prof. Ricardo M. Leão. FMRP-USP Origens do potencial de repouso Todas as células apresentam uma diferença de potencial elétrico (voltagem) através da membrana.
5 Resultados de Campo
 5 Resultados de Campo O modelo desenvolvido e testado no capítulo anterior foi utilizado para realizar a previsão de depósito de parafina em um poço produtor da Petrobras. Utilizando informações de geometria,
5 Resultados de Campo O modelo desenvolvido e testado no capítulo anterior foi utilizado para realizar a previsão de depósito de parafina em um poço produtor da Petrobras. Utilizando informações de geometria,
AULA 3. Tratamento Sistemático do Equilíbrio Químico
 AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
AULA Tratamento Sistemático do Equilíbrio Químico Objetivos Escrever as equações químicas que descrevem as reações químicas. Escrever as expressões de constante de equilíbrio para as reações químicas.
Corrente elétrica e leis de Ohm Módulo FE.05 (página 46 à 49) Apostila 2
 Aula 05 Corrente elétrica e leis de Ohm Módulo FE.05 (página 46 à 49) Apostila 2 Eletrodinâmica Sentido convencional da corrente elétrica Intensidade da corrente elétrica Leis de Ohm Resistor Condutividade
Aula 05 Corrente elétrica e leis de Ohm Módulo FE.05 (página 46 à 49) Apostila 2 Eletrodinâmica Sentido convencional da corrente elétrica Intensidade da corrente elétrica Leis de Ohm Resistor Condutividade
FLOCULAÇÃO E DISPERSÃO DAS ARGILAS
 1 FLOCULAÇÃO E DISPERSÃO DAS ARGILAS PROF. GILSON MOURA FILHO/SER/UFAL CURSO DE PÓSGRADUAÇÃO EM AGRONOMIA DISCIPLINA: FÍSICA DO SOLO 1. FORÇAS E ENERGIA NO SISTEMA SOLOÁGUA Forças de coesão e adesão Forças
1 FLOCULAÇÃO E DISPERSÃO DAS ARGILAS PROF. GILSON MOURA FILHO/SER/UFAL CURSO DE PÓSGRADUAÇÃO EM AGRONOMIA DISCIPLINA: FÍSICA DO SOLO 1. FORÇAS E ENERGIA NO SISTEMA SOLOÁGUA Forças de coesão e adesão Forças
EXERCÍCIOS DE ELETROQUÍMICA
 Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
Aula EXERCÍCIOS DE ELETROQUÍMICA META Apresentar os conceitos relacionados a misturas de substâncias simples através da resolução de exercícios comentados. OBJETIVOS Ao nal desta aula, o aluno deverá:
Universidade Federal de Sergipe, Departamento de Engenharia Química 2
 ELABORAÇÃO DE FERRAMENTA DE CÁLCULO PARA A DETERMINAÇÃO DO COEFICIENTE CONVECTIVO EM EXPERIMENTOS DE CONVECÇÃO FORÇADA AO REDOR DE UM CORPO SUBMERSO E ALETAS TORRES, F. C. O. 1, BARBOSA NETO, A. M. 2 1
ELABORAÇÃO DE FERRAMENTA DE CÁLCULO PARA A DETERMINAÇÃO DO COEFICIENTE CONVECTIVO EM EXPERIMENTOS DE CONVECÇÃO FORÇADA AO REDOR DE UM CORPO SUBMERSO E ALETAS TORRES, F. C. O. 1, BARBOSA NETO, A. M. 2 1
Tratamento de Água de Poços, Tecnologias e Custos. Geol. José Paulo G. M. Netto Eng. Bruno Brunelli Químico Thiago Schneider
 Tratamento de Água de Poços, Tecnologias e Custos Geol. José Paulo G. M. Netto Eng. Bruno Brunelli Químico Thiago Schneider A ÁGUA DO POÇO PODE TER PROBLEMAS DE QUALIDADE? 2 Lembrando: Poços são Obras
Tratamento de Água de Poços, Tecnologias e Custos Geol. José Paulo G. M. Netto Eng. Bruno Brunelli Químico Thiago Schneider A ÁGUA DO POÇO PODE TER PROBLEMAS DE QUALIDADE? 2 Lembrando: Poços são Obras
QUI 070 Química Analítica V Análise Instrumental. Aula 11 Cromatografia Líquida de Alta Eficiência (CLAE)
 Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 11 Cromatografia Líquida de Alta Eficiência (CLAE) Julio
Universidade Federal de Juiz de Fora (UFJF) Instituto de Ciências Exatas Depto. de Química QUI 070 Química Analítica V Análise Instrumental Aula 11 Cromatografia Líquida de Alta Eficiência (CLAE) Julio
Exercícios de Propriedades Coligativas e Coloides
 Exercícios de Propriedades Coligativas e Coloides Material de apoio do Extensivo 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse
Exercícios de Propriedades Coligativas e Coloides Material de apoio do Extensivo 1. Considere o gráfico da pressão máxima de vapor em função da temperatura para um solvente puro e para uma solução desse
USO DA CINETICA DE ORDEM ZERO E PRIMEIRA ORDEM DO CLORETO FERRICO PARA PURIFICAÇÃO DE ÁGUA
 25 a 28 de Outubro de 2011 ISBN 978-85-8084-055-1 USO DA CINETICA DE ORDEM ZERO E PRIMEIRA ORDEM DO CLORETO FERRICO PARA PURIFICAÇÃO DE ÁGUA Joseane D. P.Theodoro 1, Grasiele S. Madrona 1, Paulo S. Theodoro
25 a 28 de Outubro de 2011 ISBN 978-85-8084-055-1 USO DA CINETICA DE ORDEM ZERO E PRIMEIRA ORDEM DO CLORETO FERRICO PARA PURIFICAÇÃO DE ÁGUA Joseane D. P.Theodoro 1, Grasiele S. Madrona 1, Paulo S. Theodoro
ELETROQUÍMICA SAINDO DO EQUILÍBRIO. Curvas de Polarização Pilhas e Corrosão Exercício
 ELETROQUÍMICA SAINDO DO EQUILÍBRIO Curvas de Polarização Pilhas e Corrosão Exercício Escola Politécnica da USP Departamento de Engenharia Metalúrgica e de Materiais A. C. Neiva 1 CURVAS DE POLARIZAÇÃO
ELETROQUÍMICA SAINDO DO EQUILÍBRIO Curvas de Polarização Pilhas e Corrosão Exercício Escola Politécnica da USP Departamento de Engenharia Metalúrgica e de Materiais A. C. Neiva 1 CURVAS DE POLARIZAÇÃO
META Medir a condutividade de diferentes eletrólitos determinar a condutividade molar limite dessas soluções.
 CONDUTIMETRIA META Medir a condutividade de diferentes eletrólitos determinar a condutividade molar limite dessas soluções. OBJETIVOS Ao final desta aula, o aluno deverá: estudar a condutividade de eletrólitos
CONDUTIMETRIA META Medir a condutividade de diferentes eletrólitos determinar a condutividade molar limite dessas soluções. OBJETIVOS Ao final desta aula, o aluno deverá: estudar a condutividade de eletrólitos
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas:
 Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
AVALIAÇÃO DO TRASPORTE IÔNICO DE MEMBRANAS ÍON SELETIVAS HETEROGÊNEAS APLICADAS EM ELETRODIÁLISE
 AVALIAÇÃ D TRASPRTE IÔNIC DE MEMBRANAS ÍN SELETIVAS HETERGÊNEAS APLICADAS EM ELETRDIÁLISE G. M. da Silveira*, N. E. Lauffer, F. T. Nascimento, J. F. Corte, N. C. Martins, M. Flach, R. M. de Martins, M.
AVALIAÇÃ D TRASPRTE IÔNIC DE MEMBRANAS ÍN SELETIVAS HETERGÊNEAS APLICADAS EM ELETRDIÁLISE G. M. da Silveira*, N. E. Lauffer, F. T. Nascimento, J. F. Corte, N. C. Martins, M. Flach, R. M. de Martins, M.
Permeabilidade da Membrana: Difusão e Osmose
 Aula 01 Permeabilidade da Membrana: Difusão e Osmose Introdução A biofísica busca enxergar o ser vivo com um corpo que ocupa um lugar no espaço, transforma energia e interage com o meio ambiente. Aspectos
Aula 01 Permeabilidade da Membrana: Difusão e Osmose Introdução A biofísica busca enxergar o ser vivo com um corpo que ocupa um lugar no espaço, transforma energia e interage com o meio ambiente. Aspectos
Cromatografia Iônica. Alexandre Martins Fernandes Orientador: Prof. Jefferson Mortatti. Novembro 2006.
 Cromatografia Iônica Alexandre Martins Fernandes Orientador: Prof. Jefferson Mortatti Novembro 2006. Roteiro 1. O que é troca iônica. 2. Cromatografia iônica. 3. Dionex ICS-90. 4. Vantagens. 5. Desvantagens.
Cromatografia Iônica Alexandre Martins Fernandes Orientador: Prof. Jefferson Mortatti Novembro 2006. Roteiro 1. O que é troca iônica. 2. Cromatografia iônica. 3. Dionex ICS-90. 4. Vantagens. 5. Desvantagens.
Uso Racional e Reúso da Água
 Escola Politécnica da USP PHD - 2548 Uso Racional e Reúso da Água NECESSIDADES E DESAFIOS Apresentação: José Carlos Mierzwa mierzwa@usp.br http://www.usp.br/cirra cirra@usp.br Programa do Curso 1 - A necessidade
Escola Politécnica da USP PHD - 2548 Uso Racional e Reúso da Água NECESSIDADES E DESAFIOS Apresentação: José Carlos Mierzwa mierzwa@usp.br http://www.usp.br/cirra cirra@usp.br Programa do Curso 1 - A necessidade
Aula II Lei de Ohm, ddp, corrente elétrica e força eletromotriz. Prof. Paulo Vitor de Morais
 Aula II Lei de Ohm, ddp, corrente elétrica e força eletromotriz Prof. Paulo Vitor de Morais E-mail: paulovitordmorais91@gmail.com 1 Potencial elétrico Energia potencial elétrica Quando temos uma força
Aula II Lei de Ohm, ddp, corrente elétrica e força eletromotriz Prof. Paulo Vitor de Morais E-mail: paulovitordmorais91@gmail.com 1 Potencial elétrico Energia potencial elétrica Quando temos uma força
3. MODELOS MATEMÁTICOS
 13 3. MODELOS MATEMÁTICOS 3.1 ENSAIOS EXPERIMENTAIS COM O TROCADOR DE CALOR Todos os ensaios realizados com o trocador de calor para a obtenção de seu modelo consistiram em se aplicar um degrau de vazão
13 3. MODELOS MATEMÁTICOS 3.1 ENSAIOS EXPERIMENTAIS COM O TROCADOR DE CALOR Todos os ensaios realizados com o trocador de calor para a obtenção de seu modelo consistiram em se aplicar um degrau de vazão
RECUPERAÇÃO DE ÁGUA INDUSTRIAL UTILIZANDO TECNOLOGIA DE MEMBRANAS
 RECUPERAÇÃO DE ÁGUA INDUSTRIAL UTILIZANDO TECNOLOGIA DE MEMBRANAS Margarida Ribau-Teixeira e Maria João Rosa Universidade do Algarve, Campus de Gambelas, 8000 Faro, PORTUGAL, e-mail: SUMÁRIO São descritos
RECUPERAÇÃO DE ÁGUA INDUSTRIAL UTILIZANDO TECNOLOGIA DE MEMBRANAS Margarida Ribau-Teixeira e Maria João Rosa Universidade do Algarve, Campus de Gambelas, 8000 Faro, PORTUGAL, e-mail: SUMÁRIO São descritos
ELEMENTOS DE TERMODINÂMICA
 ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
ELEMENTOS DE TERMODINÂMICA TERMODINÂMICA ESCALAS DE TEMPERATURA Estuda as relações entre grandezas como a temperatura, a pressão, o volume, o calor e a energia interna Reparar na necessidade de definir
Origens do potencial de membrana Excitabilidade celular
 Origens do potencial de membrana Excitabilidade celular Algumas medidas elétricas Potencial (E,V) V (volt) Carga C (coulomb) Corrente (I) A (ampere = C/s) Resistência (R) W (ohm = V/A) Condutância (G)
Origens do potencial de membrana Excitabilidade celular Algumas medidas elétricas Potencial (E,V) V (volt) Carga C (coulomb) Corrente (I) A (ampere = C/s) Resistência (R) W (ohm = V/A) Condutância (G)
INTRODUÇÃO A MÉTODOS CROMATOGRÁFICOS
 INTRODUÇÃO A MÉTODOS CROMATOGRÁFICOS 1 Histórico da cromatografia moderna Mikhail Tsweett (1872-1919) Botânico russo: usou uma coluna empacotada contendo carbonato de cálcio como fase estacionária para
INTRODUÇÃO A MÉTODOS CROMATOGRÁFICOS 1 Histórico da cromatografia moderna Mikhail Tsweett (1872-1919) Botânico russo: usou uma coluna empacotada contendo carbonato de cálcio como fase estacionária para
7 Extração de Dados Quantitativos
 Capítulo 7 - Extração de Dados Quantitativos 119 7 Extração de Dados Quantitativos A técnica de medição desenvolvida e descrita nos capítulos anteriores produz como resultado a variação temporal da espessura
Capítulo 7 - Extração de Dados Quantitativos 119 7 Extração de Dados Quantitativos A técnica de medição desenvolvida e descrita nos capítulos anteriores produz como resultado a variação temporal da espessura
QFL Instruções para elaboração dos relatórios 2013
 GERAL QFL 2453 - Instruções para elaboração dos relatórios 2013 Todos os relatórios devem apresentar: 1) Capa contendo os nomes dos alunos, número USP, a turma da qual fazem parte, título e número da experiência,
GERAL QFL 2453 - Instruções para elaboração dos relatórios 2013 Todos os relatórios devem apresentar: 1) Capa contendo os nomes dos alunos, número USP, a turma da qual fazem parte, título e número da experiência,
Vazão. Conceito de Vazão
 Vazão Conceito de Vazão Quando se toma um ponto de referência, a vazão é a quantidade do produto ou da utilidade, expressa em massa ou em volume, que passa por ele, na unidade de tempo. A unidade de vazão
Vazão Conceito de Vazão Quando se toma um ponto de referência, a vazão é a quantidade do produto ou da utilidade, expressa em massa ou em volume, que passa por ele, na unidade de tempo. A unidade de vazão
