CORRENTE DE ARRASTAMENTO
|
|
|
- Nicholas Victor Gabriel Botelho Belém
- 6 Há anos
- Visualizações:
Transcrição
1 Objectivos Compreender as correntes de arrastamento Apreender a noção de concentração média de uma membrana homogénea e de uma membrana porosa Apreender a noção de densidade de corrente total Compreender e explicar como ocorrem as correntes de água Compreender as forças que originam as correntes de água Definir pressão osmótica Compreender o noção de coeficiente de reflexão CORRENTE DE ARRASTAMENTO M Filomena Botelho 1
2 Corrente de soluto arrastado na corrente de água Moléculas de soluto arrastadas por convecção pelo solvente J w - mol cm -2 s -1 Considerando: - V w volume parcial molar da água (volume em cm 3 por mol de água) Podemos considerar a corrente de água expressa em volume. Assim: - J v = V w J w cm 3 mol mol cm 2 s = cm3 cm -2 s -1 cm s -1 Corrente de soluto arrastado por J v, é - J s = C s J v É uma densidade de corrente de convecção mol cm 3 cm 3 cm 2 s = mol cm 2 s - C s - concentração média do soluto no interior da membrana 2
3 - C s - concentração média do soluto no interior da membrana O cálculo desta concentração média é diferente conforme o tipo da membrana Membrana porosa - C si + C II = s 2 C s Membrana homogénea - K (C si + C II s ) = 2 C s - Há moléculas de soluto arrastadas por convecção, que não penetram a membrana, sendo reflectidas - Pode também suceder que as moléculas de soluto sejam muito grandes de modo que todas sejam reflectidas, como é o caso das membranas semi-permeáveis As moléculas reflectidas representam uma fracção σ do total, constituindo esta fracção o - Coeficiente de reflexão de Staverman Coeficiente de reflexão de Staverman σ - fracção do número total de moléculas arrastadas até à membrana, e que são reflectidos Deste modo, a fracção que atravessa é: (1 σ) Densidade de corrente de soluto de arrastamento - J s(arrastamento) = C s J v (1 σ) 3
4 Densidade de corrente de soluto de arrastamento - J s(arrastamento) = C s J v (1 σ) Decompondo esta equação, vem: - J s(arrastamento) = C s J v - -C s J v σ Moléculas que passam Moléculas arrastadas por convecção Moléculas reflectidas Equações gerais para as densidades de corrente de solutos não iónicos através de membranas Homogéneas J s = P s C s - + C s J v (1 σ) Termo de difusão Termo de arrastamento Porosas - J s = w C s + C s J v (1 σ) 4
5 Expressões gerais Nas densidades de corrente de difusão, há por vezes conveniência em usar pressões em vez de concentrações Pela Lei de Van T Hoff, a temperatura constante: π V = n RT π = n V RT = C RT mol cm -3 π = RT C s π diferença de pressão osmótica Expressões gerais π = RT C s π diferença de pressão osmótica Para Membranas homogéneas J s = P s C s π como C s = RT P J s = s RT π = ω π onde ω = P s RT J s = ω π 5
6 P ω = s RT = D m K x RT Permeabilidade ω = mol dine -1 s -1 ω difere de P s pelo factor 1 RT Expressões gerais π = RT C s π diferença de pressão osmótica Nas Membranas porosas a permeabilidade pode também ser reescrita, aparecendo com a seguinte forma w ω = RT = φ w D x RT ω = mol dine -1 s -1 J s = ω π 6
7 Expressões gerais Deste modo, a densidade de corrente total de um soluto não electrolítico através de qualquer membrana, tem como expressão geral ω ω = RT = φ w D x RT ω = mol dine -1 s -1 - J s = ω π + C s J v (1 σ) Componente devida à difusão Componente devida ao arrastamento Objectivos Compreender as correntes de arrastamento Apreender a noção de concentração média de uma membrana homogénea e de uma membrana porosa Apreender a noção de densidade de corrente total 7
8 CORRENTES DE ÁGUA M Filomena Botelho Correntes de água e pressão osmótica Correntes de água como consequência de diferenças das pressões Osmótica Hidrostática 8
9 Pressão osmótica solução tubo graduado Solvente passa pela membrana e entra no compartimento da solução Modificação da altura no tubo graduado recipiente com solvente puro (água) membrana semi-permeável (tipo papel celofane) Altura constante Atingir o equilíbrio Pressão osmótica solução tubo graduado Solvente passa pela membrana e entra no compartimento da solução Modificação da altura no tubo graduado recipiente com solvente puro (água) membrana semi-permeável (tipo papel celofane) Altura constante Atingir o equilíbrio A pressão hidrostática que se está a exercer sobre a solução equilibra a pressão osmótica 9
10 Pressão osmótica Vamos supor um recipiente que contém solvente puro (água). Dentro deste, existe um compartimento, que num dos lados tem ligada uma membrana semi-permeável (tipo papel celofane) e que do outro termina por um tubo graduado. Neste compartimento existe uma solução, que atinge uma determinada altura no tubo graduado. Com o decorrer do tempo, o solvente puro passará através da membrana para o compartimento que contém a solução, de tal modo que a altura atingida no tubo graduado se altera Esta ascensão da solução dentro do tubo graduado, passado algum tempo, permanece constante, o que significa que foi atingido o equilíbrio solução tubo graduado recipiente com solvente puro (água) membrana semi-permeável (tipo papel celofane) Quando esse ponto é atingido, significa que a pressão hidrostática que se está a exercer sobre a solução (altura da coluna líquida) equilibra a pressão osmótica pressão osmótica de uma solução é a pressão que é necessário exercer sobre uma solução, para impedir a entrada de solvente 10
11 Membrana semi-permeável - São membranas permeáveis somente às moléculas do solvente Devemos contudo distinguir entre as membranas semi-permeáveis - ideais - reais Absolutamente impermeáveis às moléculas do soluto Algumas moléculas do soluto (as mais pequenas) conseguem atravessá-la Primeiro consideraremos a situação da corrente de água, com uma membrana semi-permeável ideal Só depois passaremos à situação da membrana semi-permeável real Membrana semi-permeável ideal 11
12 Corrente de água P I I E M II P II 2 recipientes separados por uma - membrana semi-permeável ideal C s I C s II Concentração do soluto é maior no recipiente II do que no I - C s II > C s I Corrente de água I M II 2 recipientes separados por uma - membrana semi-permeável ideal C s I C s II Concentração do soluto é maior no recipiente II do que no I - C s II > C s I Condições a impor Membrana semi-permeável ideal Pressão hidrostáticas iguais nos dois recipientes 12
13 Corrente de água I C s I M II C s II Condições a impor Membrana semi-permeável ideal Pressão hidrostáticas iguais nos dois recipientes Como a concentração do soluto é maior no recipiente II do que no I, e a membrana é semi-permeável ideal (só permite a passagem de moléculas de água) a passagem da água é do recipiente I para o recipiente II Podemos dizer que existe uma - corrente osmótica proporcional à diferença de concentrações (C si -C II s ) Assim, podemos escrever: J wosm = K (C s II -C si ) = - K C s J wosm = - K C s Já que: C s = C si -C s II Neste caso considera-se como positiva, igualmente quando a corrente de água é do recipiente I para o recipiente II (verifica-se porque C s II > C si ) 13
14 P I I E M II P II Se as pressões nos recipientes forem diferentes, é possível haver transporte de água por - diferenças de pressão hidrostática C s I C s II O êmbolo está no recipiente I, pelo que: - P I > P II A corrente de água por diferença de pressão hidrostática (corrente hidráulica) vai-se deslocar do recipiente I para o recipiente II J whidrau = L p (P I -P II ) P = P I -P II com : J whidrau = L p P L p = coeficiente de filtração Positiva nas condições impostas Densidade de corrente de água J wt = J wo + J wh J wt = L p P K C s Como: π = RT C s C s = π RT J wo = - K C s = - K RT Lp π J wo = - L p π J wt = L p ( P π ) Densidade de corrente total de água (caso de membranas semi-permeáveis ideais) 14
15 Membrana semi-permeável real Corrente de água I E P I C I s M II C s II P II 2 recipientes separados por uma - membrana semi-permeável real - C s II > C s I - P I > P II Nas situações reais, as membranas semi-permeáveis, deixam sempre passar algumas moléculas de soluto P: Quando esta situação ocorre, como será a corrente de solvente? R: A corrente de água neste caso é menor 15
16 Nas membranas semi-permeáveis reais, há uma - fracção de moléculas de soluto que atravessam a membrana, fazendo com que a diferença de potenciais químicos do solvente nos dois recipientes fique menor, pelo que a corrente de água através da membrana é menor Assim, para considerar este facto, a expressão anterior aparece com um factor de correcção, chamado: - coeficiente de reflexão - σ J wt = L p ( P σ π ) Densidade de corrente total de água (caso de membranas semi-permeáveis reais) Equação de Kedem-Katchalski J wt = L p ( P σ π ) Densidade de corrente total de água (caso de membranas semi-permeáveis reais) Equação de Kedem-Katchalski Esta equação de Kedem-Katchalski pode adaptar-se às membranas semi-permeáveis ideais. Neste caso, todas as moléculas de soluto são reflectidas coeficiente de reflexão σ, é igual a 1. 16
17 Na situação de se tratar de uma membrana semi-permeável ideal, quando ocorre equilíbrio entre as diferenças de pressão e de concentração existentes, a densidade de corrente de água é nula J w = 0 Nestas condições: P = π o que significa que: Na situação de equilíbrio, a diferença de pressão osmótica entre os dois compartimentos, é igual à diferença de pressão osmótica entre os dois compartimentos Dimensões Densidade de corrente de água J w - mol cm -2 s -1 Pressões hidrostáticas - P - dine cm -2 osmóticas - π - dine cm -2 Coeficiente de filtração - L p -moldine -1 s -1 17
18 Objectivos Compreender as correntes de arrastamento Apreender a noção de concentração média de uma membrana homogénea de uma membrana porosa Apreender a noção de densidade de corrente total Compreender e explicar como ocorrem as correntes de água Compreender as forças que originam as correntes de água Definir pressão osmótica Compreender o noção de coeficiente de reflexão FORÇAS DE DIFUSÃO M Filomena Botelho 18
19 Objectivos Compreender as forças que controlam a difusão Ser capaz de compreender e explicar a equação da 1ª lei de Fick tendo por base as forças de difusão Força de difusão A variação do potencial químico é a força motora dos processos de difusão Quando temos um soluto não electrolítico, a força de difusão por mol de soluto é: F D = - dµ Ou seja: A força por mole presente na difusão é igual ao gradiente do potencial químico (µ) segundo a direcção dos xx, vezes -1 19
20 Para soluções muito diluídas de concentração C s, o potencial químico µ de um soluto é: µ = µ 0 + RT ln C s Constante que depende da pressão e temperatura µ 0 = constante µ 0 = µ 0 (P, T) A dependência da pressão é pouco importante para os solutos, sendo contudo muito importante para o potencial químico da água É possível obter-se a 1ª lei de Fick, a partir da força de difusão, F D v - C s 1 cm O tubo, com 1 cm 2 de secção, contém uma solução com concentração molar de soluto de C s, que se desloca com uma velocidade média v. - Se continuar a não haver deslocamento de solvente - O número de moles de soluto que num segundo passa através da secção 1, é igual ao número de moles contido num cilindro de volume: 1 x v - cm 3 Onde 1 cm 2 a área da base -v a distância média percorrida pelas partículas durante 1 segundo Sendo assim: A densidade de corrente de soluto é: J s = v- C s 20
21 Mobilidade molecular É importante o conceito de mobilidade molecular, u : f u = -v-v u = -v f Que representam a velocidade média das moléculas do soluto por unidade de força motora A mobilidade molecular u, é uma constante que depende do: -soluto -solvente - temperatura Podemos então dizer que a densidade de corrente de soluto, é: Como: J s = C s v - F D = - dµ = C s u f = C s u F D A u = - -v f v = u f f = F D A J s = - C s u A dµ 21
22 J s = - C s u A dµ dµ = d (µ 0 + RT ln C s ) = RT C s dc s J s = - C s u A RT C s dc s = - u RT A dc s se: D = u RT A Então: J s = - D dc s 1ª Lei de Fick da Difusão Objectivos Compreender as forças que controlam a difusão Ser capaz de compreender e explicar a equação da 1ª lei de Fick tendo por base as forças de difusão 22
23 TRANSPORTE DE IÕES M Filomena Botelho Objectivos Compreender o transporte de iões Compreender e explicar a equação de Nerst-Plank na sua forma simplificada Distinguir entre mobilidade molecular e eléctrica Ser capaz de corrigir a equação de Nerst-Plank, com as mobilidades eléctricas Explicar a equação de Nerst do equilíbrio, para cada espécie iónica 23
24 As equações da difusão podem ser generalizadas e aplicadas a solutos iónicos Comecemos por generalizar a soluções iónicas, a equação do potencial químico que aplicámos a soluções neutras No caso de soluções iónicas, existem Potencial químico Potencial eléctrico No caso de soluções iónicas, existem Potencial químico Potencial eléctrico ψ energia potencial eléctrica / Coulomb de iões positivos (o número de Coulomb transportado por 1 mole de iões, depende da valência e do sinal dos iões) Z i valência e sinal dos iões da espécie i exemplos: Cl - -1 Na + +1 Ca F = A. e carga do electrão x nº Avogadro = C = Faraday 1, x X 6,023 x F. Z i carga em Coulombs de 1 mole de iões i A energia potencial eléctrica de 1 mole de iões = F. Z i. ψ J/mol 24
25 O transporte de iões pode ser tratado da mesma maneira que o transporte de moléculas neutras. Assim: J i = - C i u A ~ dµ J s = - C s u A dµ dµ ~ = d (µ 0 + RT ln C i + F Z i ψ) 1 dc = RT i + F Z i C i d ψ C J i = - i u RT dc i C - i u F Z A A i C i dψ RTu dc J i = - i C - i u F Z A A i dψ Equação de Nernst-Plank (forma simplificada e pouco rigorosa) Densidade de corrente eléctrica - Difusão Carga eléctrica, que por segundo (unidade de tempo) atravessa a unidade de área, colocada normalmente à direcção da propagação - J i O efeito produzido por cargas eléctricas positivas quando se deslocam num sentido, é igual ao produzido por cargas negativas que se deslocam em sentido contrário O sentido positivo da densidade de corrente eléctrica, é convencionalmente, o sentido do deslocamento das cargas positivas (as cargas negativas deslocam-se em sentido contrário) 25
26 A densidade de corrente eléctrica, para uma espécie iónica i, é J i = ρ v - ρ = densidade espacial de carga (carga por unidade de volume) v - = velocidade média dos iões Se considerarmos C a - concentração molar dos iões A densidade espacial de carga ρ é: -C F Z ρ = C F Z F = A. e = C Z = carga e sinal dos iões - J i = ρ v ρ = C F Z A densidade de corrente eléctrica, toma então outra forma: J i = C F Z v- J s J i = J s F Z e pode ser considerada como: - densidade de corrente de difusão de soluto iónico Unidades J i Coulomb cm -2 s -1 26
27 Voltemos à equação anterior J i = J s F Z Substituindo na equação, o valor de J s, vem J s = - C s u A dµ C = - s u 1 dc RT s = - A C s u RT A dc s D J i = - u RT A dc s F Z O sentido da densidade de corrente eléctrica, depende do sinal do ião MOBILIDADES M Filomena Botelho 27
28 Mobilidades Molecular u Eléctrica u Molecular u Moléculas neutras Já falámos de mobilidade molecular Relação entre a velocidade média de uma molécula, e a força que actua sobre ela Quando falamos de iões, a mobilidade molecular é aplicável, mas é mais frequente o uso da - mobilidade eléctrica dos iões Mobilidade eléctrica u Pode ser definida como: a velocidade média dos iões por unidade de campo eléctrico - u = v E campo eléctrico - força que actua na unidade de carga positiva Consideremos um ião, com carga Z i.e a força que actua sobre o ião, quando sujeito à acção do campo eléctrico E, é em módulo f = Z i e E 28
29 Deste modo, como a mobilidade molecular é: - - u = v = v f Z i ee u = u E Zi e E = u Zi e mas u = - v E u = u Zi e Voltemos agora atrás, à expressão da densidade de corrente eléctrica J i = - u RT A dc s F Z i Podemos agora substituir a mobilidade molecular pela mobilidade eléctrica u u = Zi e J i = - u RT Z i e A dc s F Z i J i = - u RT Z i dc s Z i Densidade de corrente eléctrica correspondente à difusão de iões de carga Z i.e 29
30 Densidade de corrente iónica em campos eléctricos Podemos considerar, como já vimos, que a densidade de corrente eléctrica para iões, que se deslocam com uma velocidade média v- e que têm uma densidade espacial de carga ρ, como: J i = ρ v - Como: a concentração dos iões é C i a valência dos iões é Z i vem: J i = C i Z i F v - Se os iões de deslocarem por acção de um campo eléctrico - v = u E Z i -em módulo porque quando o campo eléctrico actua, provoca uma corrente que é sempre no sentido do campo J i = C i Z i F u E Cargas positivas a deslocarem-se no sentido do campo Cargas negativas em sentido contrário Como o campo eléctrico está relacionado com o potencial eléctrico: E = - dψ O gradiente de potencial eléctrico segundo a direcção x, corresponde à intensidade do campo segundo a mesma direcção Podemos então dizer que: A densidade de corrente iónica produzida pelo campo eléctrico (ou pelo gradiente de potencial eléctrico) é: J i = - C i Z i F u dψ Densidade de corrente eléctrica iónica Coulombs cm - 2 s -1 Adoptando um raciocínio semelhante ao que aplicámos para a difusão 30
31 EQUAÇÃO DE NERSNT-PLANCK M Filomena Botelho Equação de Nernst-Planck Equação que traduz a densidade de corrente eléctrica, quando sobre uma dada espécie iónica i, actuam simultaneamente Forças de difusão Forças eléctricas Densidade de corrente eléctrica, por acção de forças de difusão u RT dc J i = - i F Z Z i A e i J i = - u C A dµ F Z i Densidade de corrente eléctrica produzida por um gradiente de potencial químico 31
32 Densidade de corrente eléctrica, por acção de forças eléctricas - J i = ρ v = ρ u E - v = u E ρ = C i F Z i J i = C i F Z i u E Em módulo, porque o campo eléctrico actua produzindo corrente sempre no sentido do campo: cargas positivas deslocam-se no sentido do campo cargas negativas deslocam-se no sentido oposto J i = C i F Z i u E Como a intensidade do campo segundo a direcção dos xx é igual a: - menos o gradiente de potencial eléctrico Então E = - dψ J i = - C i F Z i u dψ Densidade de corrente eléctrica produzida por um gradiente de potencial eléctrico 32
33 Densidade de corrente eléctrica, quando actuam gradientes de potencial químico e eléctrico (forças de difusão e eléctricas) J i = - u C i A dµ dψ F Z i + (- C i F Z i u ) u dµ = - C i A F Z dψ ( i + F Z i u ) = - C ( u RT dc i dψ i F Z A i + F Z i u ) C i J i = - ( ) u Z i Z i RT dc i + u C i F Z i dψ Equação de Nernst-Planck J i = - ( ) u Z i Z i RT dc i + u C i F Z i dψ Se para uma dada espécie iónica, existe equilíbrio através duma membrana, a: J i = 0 e os coeficientes de partição forem iguais para ambos os lados da membrana, então: dψ = - RT F Z i 1 C i dc i 33
34 dψ = - RT F Z i 1 C i dc i Integrando no interior da membrana, entre 0 e x (espessura da membrana) vem: ψ ( x) ψ (0) = RT F Z i ln C i(0) C i( x) ou: ψ ( x) = ψ (2) ψ (2) ψ (1) = RT C 1 ln F Z i C 2 ψ (0) = ψ (1) Equação de Nernst EQUAÇÃO DE NERNST M Filomena Botelho 34
35 Potencial electroquímico Quando temos iões em solução, constituindo uma solução iónica, actuam dois tipos de forças: Forças originadas pelo gradiente de potencial químico Forças resultantes do gradiente de potencial eléctrico (os campos eléctricos actuantes, podem ser os campos das próprias cargas eléctricas) Neste caso (soluções iónicas) o potencial total ou electroquímico é a soma do: potencial químico energia potencial eléctrica por mole ~ µ i = µ 0 + RT lnc i + F Z i ψ C i = concentração da espécie iónica i Quando consideramos uma espécie iónica qualquer i, através de uma membrana celular, existe equilíbrio, ou seja, a densidade de corrente eléctrica dessa espécie iónica é nula J i = 0 O potencial electroquímico da espécie iónica i nos dois lados da membrana é igual ~ µ i i = µ ~ e i Esta igualdade tem a ver com o equilíbrio e não com o repouso µ i 0i + RT lnc i i + F Z i ψ i i = µ e 0i + RT lnc i e + F Z i ψ i e 35
36 µ i 0i + RT lnc i i + F Z i ψ i i = µ e 0i + RT lnc i e + F Z i ψ i e F Z i (ψ i i - ψ i e ) = - RT ln C i i C i e ψ = ψ i i - ψ e RT i = - ln C i i F Z i C i e Equação de Nernst µ i 0i = µe 0i Para uma dada membrana, as condições de pressão e temperatura são supostamente as mesmas nos dois lados da membrana Z i ψ Carga e sinal do ião Diferença de potencial eléctrico que deverá existir através da membrana para que a relação C i i / C i e se mantenha O potencial eléctrico compensará a diferença de potencial químico, produzido pela diferença de concentração Objectivos Compreender o transporte de iões Compreender e explicar a equação de Nerst-Plank na sua forma simplificada Distinguir entre mobilidade molecular e eléctrica Ser capaz de corrigir a equação de Nerst-Plank, com as mobilidades eléctricas Explicar a equação de Nerst do equilíbrio, para cada espécie iónica 36
37 Leitura adicional Biofísica Médica. JJ Pedroso de Lima Capítulo I - pag. 29 a 44 37
BIOMEMBRANAS. M Filomena Botelho
 BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
EQUILÍBRIO IÓNICO E POTENCIAIS DE REPOUSO DAS MEMBRANAS. M Filomena Botelho
 EQUILÍBRIO IÓNICO E POTENCIAIS DE REPOUSO DAS MEMBRANAS M ilomena Botelho Potenciais de repouso das membranas O equilíbrio de Donnan não explica o potencial de repouso das células nervosas e musculares,
EQUILÍBRIO IÓNICO E POTENCIAIS DE REPOUSO DAS MEMBRANAS M ilomena Botelho Potenciais de repouso das membranas O equilíbrio de Donnan não explica o potencial de repouso das células nervosas e musculares,
Transporte Iônico e o Potencial de Membrana
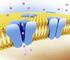 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Exercícios Práticos de Biofísica
 Exercícios Práticos de Biofísica Faculdade de Medicina da Universidade de Coimbra Membranas 2 Convenções Nos exercícios desta secção, e salvo indicação em contrário, utilizaremos as seguintes convenções:
Exercícios Práticos de Biofísica Faculdade de Medicina da Universidade de Coimbra Membranas 2 Convenções Nos exercícios desta secção, e salvo indicação em contrário, utilizaremos as seguintes convenções:
Aula Teórico-Prática Nº1
 Aula Teórico-Prática Nº1 Sumário Introdução aos sistemas de unidades: SI e cgs. (1) Exloração de videos e exeriências simles sobre o fenómeno de difusão. (2) Discussão orientada sobre a 1ª lei de Fick
Aula Teórico-Prática Nº1 Sumário Introdução aos sistemas de unidades: SI e cgs. (1) Exloração de videos e exeriências simles sobre o fenómeno de difusão. (2) Discussão orientada sobre a 1ª lei de Fick
SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
Física e Química A 715 (versão 1)
 Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
Módulo inicial Materiais: Diversidade e Constituição. Química 10.º ano Ano lectivo 2007/2008
 Química 10.º ano Ano lectivo 2007/2008 Escola Secundária José Saramago Marta Paulino e Ângela Patrício O que é um Material? É algo que tem massa e ocupa espaço. Classificação Materiais: Componentes Origem
Química 10.º ano Ano lectivo 2007/2008 Escola Secundária José Saramago Marta Paulino e Ângela Patrício O que é um Material? É algo que tem massa e ocupa espaço. Classificação Materiais: Componentes Origem
Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio.
 EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
Universidade Federal do Pampa UNIPAMPA. Fluidos Hidrostática e Hidrodinâmica
 Universidade Federal do Pampa UNIPAMPA Fluidos Hidrostática e Hidrodinâmica SUMÁRIO Fluido Força do fluido Pressão Lei de Stevin Sistemas de vasos comunicantes Princípio de Pascal Medições de pressão Princípio
Universidade Federal do Pampa UNIPAMPA Fluidos Hidrostática e Hidrodinâmica SUMÁRIO Fluido Força do fluido Pressão Lei de Stevin Sistemas de vasos comunicantes Princípio de Pascal Medições de pressão Princípio
Hidrostática Prof: Edson Rizzo. Pressões: Mecânica, Hidrostática, Atmosférica e Absoluta. Empuxo
 Hidrostática Prof: Edson Rizzo Pressões: Mecânica, Hidrostática, Atmosférica e Absoluta. Empuxo DENSIDADE Consideremos um corpo de massa m e volume V. A densidade (d) do corpo é definida por: d = m V No
Hidrostática Prof: Edson Rizzo Pressões: Mecânica, Hidrostática, Atmosférica e Absoluta. Empuxo DENSIDADE Consideremos um corpo de massa m e volume V. A densidade (d) do corpo é definida por: d = m V No
Electromagnetismo. Campo Magnético:
 Campo Magnético: http://www.cartoonstock.com/lowres/hkh0154l.jpg Campo Magnético: Existência de ímans Corrente eléctrica A bússola é desviada http://bugman123.com/physics/oppositepoles large.jpg Observação
Campo Magnético: http://www.cartoonstock.com/lowres/hkh0154l.jpg Campo Magnético: Existência de ímans Corrente eléctrica A bússola é desviada http://bugman123.com/physics/oppositepoles large.jpg Observação
Prática 08 Determinação da Massa Molar da Ureia via Ebuliometria
 UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
UNIVERSIDADE DO ESTADO DE SANTA CATARINA CENTRO DE CIÊNCIAS TECNOLÓGICAS CCT DEPARTAMENTO DE QUÍMICA DQMC Disciplina: Química Geral Experimental QEX0002 Prática 08 Determinação da Massa Molar da Ureia
CAPÍTULO VII ONDAS MECÂNICAS
 CAPÍTULO VII ONDAS MECÂNICAS 7.1. INTRODUÇÃO As ondas mecânicas são fenómenos ondulatórios que necessitam de um meio material para se propagarem. Como exemplos destas ondas, vamos estudar neste capítulo
CAPÍTULO VII ONDAS MECÂNICAS 7.1. INTRODUÇÃO As ondas mecânicas são fenómenos ondulatórios que necessitam de um meio material para se propagarem. Como exemplos destas ondas, vamos estudar neste capítulo
FÍSICA (ELETROMAGNETISMO) CORRENTE ELÉTRICA E RESISTÊNCIA
 FÍSICA (ELETROMAGNETISMO) CORRENTE ELÉTRICA E RESISTÊNCIA FÍSICA (Eletromagnetismo) Nos capítulos anteriores estudamos as propriedades de cargas em repouso, assunto da eletrostática. A partir deste capítulo
FÍSICA (ELETROMAGNETISMO) CORRENTE ELÉTRICA E RESISTÊNCIA FÍSICA (Eletromagnetismo) Nos capítulos anteriores estudamos as propriedades de cargas em repouso, assunto da eletrostática. A partir deste capítulo
Elementos de Circuitos Elétricos
 Elementos de Circuitos Elétricos Corrente e Lei de Ohm Consideremos um condutor cilíndrico de seção reta de área S. Quando uma corrente flui pelo condutor, cargas se movem e existe um campo elétrico. A
Elementos de Circuitos Elétricos Corrente e Lei de Ohm Consideremos um condutor cilíndrico de seção reta de área S. Quando uma corrente flui pelo condutor, cargas se movem e existe um campo elétrico. A
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
MÓDULO 1 Noções Básicas de Eletricidade
 Técnico de Gestão de Equipamentos Informáticos ESCOLA SECUNDÁRIA DE TOMAZ PELAYO SANTO TIRSO 402916 MÓDULO 1 Noções Básicas de Eletricidade Eletrónica Fundamental Prof.: Erika Costa Estrutura da Matéria
Técnico de Gestão de Equipamentos Informáticos ESCOLA SECUNDÁRIA DE TOMAZ PELAYO SANTO TIRSO 402916 MÓDULO 1 Noções Básicas de Eletricidade Eletrónica Fundamental Prof.: Erika Costa Estrutura da Matéria
Reacções de oxidação-redução em solução aquosa. Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p.
 Reacções de oxidação-redução em solução aquosa Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p. 116 até ao final REACÇÕES de OXIDAÇÃO-REDUÇÃO reacções que envolvem troca de
Reacções de oxidação-redução em solução aquosa Livro Química Inorgânica Básica na página da cadeira no Moodle Capítulo 4, p. 116 até ao final REACÇÕES de OXIDAÇÃO-REDUÇÃO reacções que envolvem troca de
Objectivo: Separar uma proteína das restantes no extracto celular. Estratégia: Existem inúmeras técnicas de purificação disponíveis.
 Objectivo: Separar uma proteína das restantes no extracto celular Estratégia: Existem inúmeras técnicas de purificação disponíveis. O procedimento exacto e a ordem dos métodos a aplicar dependem do tipo
Objectivo: Separar uma proteína das restantes no extracto celular Estratégia: Existem inúmeras técnicas de purificação disponíveis. O procedimento exacto e a ordem dos métodos a aplicar dependem do tipo
Mecânica dos Fluidos. Aula 4 Teorema de Stevin e Princípio de Pascal. Prof. MSc. Luiz Eduardo Miranda J. Rodrigues
 ula 4 Teorema de Stevin e Princípio de Pascal Tópicos bordados Nesta ula Teorema de Stevin. Princípio de Pascal. Teorema de Stevin O teorema de Stevin também é conhecido por teorema fundamental da hidrostática
ula 4 Teorema de Stevin e Princípio de Pascal Tópicos bordados Nesta ula Teorema de Stevin. Princípio de Pascal. Teorema de Stevin O teorema de Stevin também é conhecido por teorema fundamental da hidrostática
Reacções de Oxidação-Redução
 Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Reacções de Oxidação-Redução Há transferência de electrões entre espécies reagentes, com variação do número de oxidação de elementos dessas espécies. Regras simples para determinar o número de oxidação
Agrupamento de Escolas da Senhora da Hora
 Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Gestão de Equipamentos Informáticos Informação Prova da Disciplina de Física e Química - Módulo: 4 Circuitos elétricos. Modalidade
Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Gestão de Equipamentos Informáticos Informação Prova da Disciplina de Física e Química - Módulo: 4 Circuitos elétricos. Modalidade
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
A força magnética tem origem no movimento das cargas eléctricas.
 Grandezas Magnéticas Força e Campo Magnético A força magnética tem origem no movimento das cargas eléctricas. Considere os dois fios condutores paralelos e imersos no espaço vazio representados na Figura
Grandezas Magnéticas Força e Campo Magnético A força magnética tem origem no movimento das cargas eléctricas. Considere os dois fios condutores paralelos e imersos no espaço vazio representados na Figura
PROPRIEDADES COLIGATIVAS DAS SOLUÇõES
 PROPRIEDADES COLIGATIVAS DAS SOLUÇõES Propriedades coligativas são propriedades de uma solução que dependem exclusivamente do número de partículas do soluto dissolvido e não da sua natureza. Cada uma dessas
PROPRIEDADES COLIGATIVAS DAS SOLUÇõES Propriedades coligativas são propriedades de uma solução que dependem exclusivamente do número de partículas do soluto dissolvido e não da sua natureza. Cada uma dessas
Gás Ideal (1) PMT2305 Físico-Química para Metalurgia e Materiais I César Yuji Narita e Neusa Alonso-Falleiros 2012
 Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL?
 CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL? CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS Organismos constituídos por células procarióticas: Bactérias e cianobácterias. Organismos constituídos por células
CÉLULAS QUAL CÉLULA É ANIMAL E QUAL É A VEGETAL? CÉLULAS EUCARIÓTICAS E PROCARIÓTICAS Organismos constituídos por células procarióticas: Bactérias e cianobácterias. Organismos constituídos por células
Problemas de Física Estatística e Termodinâmica
 1 Problemas de Física Estatística e Termodinâmica Todas as grandezas físicas se supõem expressas no Sistema Internacional de Unidades. 1. Uma variável aleatória y pode tomar valores no conjunto {1,2,3,4,5}
1 Problemas de Física Estatística e Termodinâmica Todas as grandezas físicas se supõem expressas no Sistema Internacional de Unidades. 1. Uma variável aleatória y pode tomar valores no conjunto {1,2,3,4,5}
!"#$%&'()*+,-'#&*'!-./0+-+*'11! '728'9/:/*.0/;!
 !"#$%&'()*+,-'#&*'!-./0+-+*'11! 234252346'728'9/:/*.0/;! A'CD9'!AEBF1A19'11! Programa! "#!$%&'()*+,-.!&()!/012&()!!3.10.)!4567!!!!!!! 8'9)):(!! ;9&%
!"#$%&'()*+,-'#&*'!-./0+-+*'11! 234252346'728'9/:/*.0/;! A'CD9'!AEBF1A19'11! Programa! "#!$%&'()*+,-.!&()!/012&()!!3.10.)!4567!!!!!!! 8'9)):(!! ;9&%
10ª Série de Problemas Mecânica e Ondas (Relatividade) MEBM, MEFT, LEGM, LMAC
 10ª Série de Problemas Mecânica e Ondas (Relatividade) MEBM, MEFT, LEGM, LMAC 1. A vida média de uma partícula é 100 ns no seu referencial próprio. 1.a) Qual a duração da partícula no laboratório, sabendo
10ª Série de Problemas Mecânica e Ondas (Relatividade) MEBM, MEFT, LEGM, LMAC 1. A vida média de uma partícula é 100 ns no seu referencial próprio. 1.a) Qual a duração da partícula no laboratório, sabendo
Lista de Exercícios - Unidade 10 Buscando o equilíbrio
 Lista de xercícios - Unidade 10 uscando o equilíbrio Hidrostática Primeira lista de exercícios: 1. Um recipiente contém 6,0 litros de água. Sabendo que a densidade da água é 1,0 g / cm 3, qual a massa
Lista de xercícios - Unidade 10 uscando o equilíbrio Hidrostática Primeira lista de exercícios: 1. Um recipiente contém 6,0 litros de água. Sabendo que a densidade da água é 1,0 g / cm 3, qual a massa
Lei fundamental da hidrostática
 Sumário Unidade I MECÂNICA 3- de fluidos - Lei fundamental da hidrostática ou Lei de Stevin. - Vasos comunicantes Equilíbrio de dois líquidos não miscíveis. - Relação entre as pressões de dois pontos,
Sumário Unidade I MECÂNICA 3- de fluidos - Lei fundamental da hidrostática ou Lei de Stevin. - Vasos comunicantes Equilíbrio de dois líquidos não miscíveis. - Relação entre as pressões de dois pontos,
Física Módulo 2 Ondas
 Física Módulo 2 Ondas Ondas, o que são? Onda... Onda é uma perturbação que se propaga no espaço ou em qualquer outro meio, como, por exemplo, na água. Uma onda transfere energia de um ponto para outro,
Física Módulo 2 Ondas Ondas, o que são? Onda... Onda é uma perturbação que se propaga no espaço ou em qualquer outro meio, como, por exemplo, na água. Uma onda transfere energia de um ponto para outro,
Difusão, Osmose e Tônus
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Difusão, Osmose e Tônus 1. Difusão 1.1. Definição 1.2. Fatores que afetam o coeficiente
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Difusão, Osmose e Tônus 1. Difusão 1.1. Definição 1.2. Fatores que afetam o coeficiente
FACULDADE DE MEDICINA
 Tenha em consideração o exercício que se segue. Sobre ele responda às questões seguintes: onsidere o sistema horizontal representado na figura, onde circula um fluido líquido, sem atrito B interno, de
Tenha em consideração o exercício que se segue. Sobre ele responda às questões seguintes: onsidere o sistema horizontal representado na figura, onde circula um fluido líquido, sem atrito B interno, de
Propriedades Coligativas
 Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
onde v m é a velocidade média do escoamento. O 2
 Exercício 24: São dadas duas placas planas paralelas à distância de 1 mm. A placa superior move-se com velocidade de 2 m/s, enquanto a inferior é fixa. Se o espaço entre a placas é preenchido com óleo
Exercício 24: São dadas duas placas planas paralelas à distância de 1 mm. A placa superior move-se com velocidade de 2 m/s, enquanto a inferior é fixa. Se o espaço entre a placas é preenchido com óleo
Densidade relativa é a razão entre a densidade do fluido e a densidade da água:
 MECÂNICA DOS FLUIDOS 1.0 Hidrostática 1.1 Definições O tempo que determinada substância leva para mudar sua forma em resposta a uma força externa determina como tratamos a substância, se como um sólido,
MECÂNICA DOS FLUIDOS 1.0 Hidrostática 1.1 Definições O tempo que determinada substância leva para mudar sua forma em resposta a uma força externa determina como tratamos a substância, se como um sólido,
Equação de Schrödinger
 Maria Inês Barbosa de Carvalho Equação de Schrödinger Apontamentos para a disciplina Física dos Estados da Matéria 00/0 Licenciatura em Engenharia Electrotécnica e de Computadores Faculdade de Engenharia
Maria Inês Barbosa de Carvalho Equação de Schrödinger Apontamentos para a disciplina Física dos Estados da Matéria 00/0 Licenciatura em Engenharia Electrotécnica e de Computadores Faculdade de Engenharia
Combustão. Problemas para as aulas práticas
 Combustão Problemas para as aulas práticas ª aula - sexta-feira 5 e terça-feira 9 de Março Problema Escreva a fórmula química e represente esquematicamente a molécula dos seguintes combustíveis: metano,
Combustão Problemas para as aulas práticas ª aula - sexta-feira 5 e terça-feira 9 de Março Problema Escreva a fórmula química e represente esquematicamente a molécula dos seguintes combustíveis: metano,
Fundamentos de Química
 FCiências Fundamentos de Química Apontamentos Equilíbrio químico, Ácido e Bases, Cinética Química Produzido por Filipa França Divulgado e Partilhado por FCiências Equilíbrio Químico FCiências Reações em
FCiências Fundamentos de Química Apontamentos Equilíbrio químico, Ácido e Bases, Cinética Química Produzido por Filipa França Divulgado e Partilhado por FCiências Equilíbrio Químico FCiências Reações em
UDESC 2015/2 FÍSICA. Comentário
 FÍSICA I. Incorreta. Com o aumento da distância a força aplicada é menor para produzir o mesmo torque. II. Incorreta. Joule é a unidade específica para energia. III. Correta. IV. Incorreta. Se a força
FÍSICA I. Incorreta. Com o aumento da distância a força aplicada é menor para produzir o mesmo torque. II. Incorreta. Joule é a unidade específica para energia. III. Correta. IV. Incorreta. Se a força
3. Exemplo prático: escreva a equação de Kc para a formação da amônia.
 1. Defina. 2. Qual o significado de Kc? E Kp? 3. Exemplo prático: escreva a equação de Kc para a formação da amônia. 4. Qual a relação entre Kp e Kc? O que significa uma variação de número de mols nula?
1. Defina. 2. Qual o significado de Kc? E Kp? 3. Exemplo prático: escreva a equação de Kc para a formação da amônia. 4. Qual a relação entre Kp e Kc? O que significa uma variação de número de mols nula?
DEFORMAÇÕES ELÁSTICAS
 Objectivos Compreender o conceito de material elástico Compreender a Lei de Hooke Compreender o conceito dos módulos: Elasticidade por tracção ou de Young Elasticidade por compressão Elastância Módulo
Objectivos Compreender o conceito de material elástico Compreender a Lei de Hooke Compreender o conceito dos módulos: Elasticidade por tracção ou de Young Elasticidade por compressão Elastância Módulo
ESCOLA BÁSICA 2º e 3º CICLOS INFANTE D. PEDRO BUARCOS. Currículo da disciplina de Ciências Físico Químicas. 8ºAno de escolaridade
 ESCOLA BÁSICA 2º e 3º CICLOS INFANTE D. PEDRO BUARCOS Currículo da disciplina de Ciências Físico Químicas 8ºAno de escolaridade BLOCO 1 A ENERGIA (Tema: Terra em Transformação) Unidade Conteúdo Nº de FONTES
ESCOLA BÁSICA 2º e 3º CICLOS INFANTE D. PEDRO BUARCOS Currículo da disciplina de Ciências Físico Químicas 8ºAno de escolaridade BLOCO 1 A ENERGIA (Tema: Terra em Transformação) Unidade Conteúdo Nº de FONTES
QUESTÃO 16 QUESTÃO 17 PROVA DE FÍSICA II
 7 PROVA DE FÍSICA II QUESTÃO 16 Uma barra homogênea de massa 4,0 kg e comprimento 1,0 m está apoiada em suas extremidades sobre dois suportes A e B conforme desenho abaixo. Coloca-se a seguir, apoiada
7 PROVA DE FÍSICA II QUESTÃO 16 Uma barra homogênea de massa 4,0 kg e comprimento 1,0 m está apoiada em suas extremidades sobre dois suportes A e B conforme desenho abaixo. Coloca-se a seguir, apoiada
Eletromagnetismo I. Prof. Daniel Orquiza. Eletromagnetismo I. Prof. Daniel Orquiza de Carvalho
 de Carvalho - Eletrostática Densidade de Fluxo Elétrico e Lei de Gauss (Páginas 48 a 55 no livro texto) Experimento com esferas concêntricas Densidade de Fluxo elétrico (D) Relação entre D e E no vácuo
de Carvalho - Eletrostática Densidade de Fluxo Elétrico e Lei de Gauss (Páginas 48 a 55 no livro texto) Experimento com esferas concêntricas Densidade de Fluxo elétrico (D) Relação entre D e E no vácuo
MEMBRANA PLASMÁTICA: TIPOS DE TRANSPORTE
 MEMBRANA PLASMÁTICA: TIPOS DE TRANSPORTE Transporte passivo O transporte passivo é o transporte de substância entre a membrana plasmática sem gasto de energia (ATP Adenosina trifosfato ou trifosfato de
MEMBRANA PLASMÁTICA: TIPOS DE TRANSPORTE Transporte passivo O transporte passivo é o transporte de substância entre a membrana plasmática sem gasto de energia (ATP Adenosina trifosfato ou trifosfato de
Física. B) Determine a distância x entre o ponto em que o bloco foi posicionado e a extremidade em que a reação é maior.
 Física 01. Uma haste de comprimento L e massa m uniformemente distribuída repousa sobre dois apoios localizados em suas extremidades. Um bloco de massa m uniformemente distribuída encontra-se sobre a barra
Física 01. Uma haste de comprimento L e massa m uniformemente distribuída repousa sobre dois apoios localizados em suas extremidades. Um bloco de massa m uniformemente distribuída encontra-se sobre a barra
QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA 2010/ º Período
 QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA Henrique Fernandes, número 9 Ricardo Cunha, número 20 Jéssica Lopes, número 26 Professor Ângelo Fernandes Turma B
QUÍMICA 12º ANO ACTIVIDADE DE PROJECTO CONSTRUÇÃO DE UMA PILHA PROPOSTA DA METODOLOGIA Henrique Fernandes, número 9 Ricardo Cunha, número 20 Jéssica Lopes, número 26 Professor Ângelo Fernandes Turma B
Halliday Fundamentos de Física Volume 2
 Halliday Fundamentos de Física Volume 2 www.grupogen.com.br http://gen-io.grupogen.com.br O GEN Grupo Editorial Nacional reúne as editoras Guanabara Koogan, Santos, Roca, AC Farmacêutica, LTC, Forense,
Halliday Fundamentos de Física Volume 2 www.grupogen.com.br http://gen-io.grupogen.com.br O GEN Grupo Editorial Nacional reúne as editoras Guanabara Koogan, Santos, Roca, AC Farmacêutica, LTC, Forense,
Transmissão hidráulica de força e energia
 Líquidos Transmissão de força Intensificador de pressão Pressão em uma coluna de fluido Velocidade e vazão Tipos de fluxo Geração de calor Diferencial de pressão Transmissão Hidráulica de Força e Energia
Líquidos Transmissão de força Intensificador de pressão Pressão em uma coluna de fluido Velocidade e vazão Tipos de fluxo Geração de calor Diferencial de pressão Transmissão Hidráulica de Força e Energia
Fundamentos do Eletromagnetismo - Aula IX
 Fundamentos do Eletromagnetismo - Aula IX Prof. Dr. Vicente Barros Conteúdo 11 - Energia eletrostática e capacitância. Conteúdo 12- Capacitores. Antes uma revisão Existe o famoso triângulo das equações
Fundamentos do Eletromagnetismo - Aula IX Prof. Dr. Vicente Barros Conteúdo 11 - Energia eletrostática e capacitância. Conteúdo 12- Capacitores. Antes uma revisão Existe o famoso triângulo das equações
Capítulo 6 Processos Envolvendo Vapores
 Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
Corrente elétricas. i= Δ Q Δ t [ A ]
![Corrente elétricas. i= Δ Q Δ t [ A ] Corrente elétricas. i= Δ Q Δ t [ A ]](/thumbs/51/27743177.jpg) Corrente elétricas A partir do modelo atômico de Bohr, que o define pela junção de prótons, nêutrons e elétrons, é possível explicar a alta condutividade dos metais, devida à presença dos elétrons livres.
Corrente elétricas A partir do modelo atômico de Bohr, que o define pela junção de prótons, nêutrons e elétrons, é possível explicar a alta condutividade dos metais, devida à presença dos elétrons livres.
defi departamento de física
 defi departamento de física Laboratórios de Física www.defi.isep.ipp.pt Interferómetro de Michelson Instituto Superior de Engenharia do Porto Departamento de Física Rua Dr. António Bernardino de Almeida,
defi departamento de física Laboratórios de Física www.defi.isep.ipp.pt Interferómetro de Michelson Instituto Superior de Engenharia do Porto Departamento de Física Rua Dr. António Bernardino de Almeida,
aceleração da gravidade g = 10 m/s 2 índice de refração do ar n = 1 π = 3,14
 FÍSICA (Cada questão desta prova vale até cinco pontos) Use, quando necessário, os seguintes valores numéricos: aceleração da gravidade g = 10 m/s 2 índice de refração do ar n = 1 π = 3,14 Questão 01 Um
FÍSICA (Cada questão desta prova vale até cinco pontos) Use, quando necessário, os seguintes valores numéricos: aceleração da gravidade g = 10 m/s 2 índice de refração do ar n = 1 π = 3,14 Questão 01 Um
Hidrostática REVISÃO ENEM O QUE É UM FLUIDO? O QUE É MASSA ESPECÍFICA? OBSERVAÇÕES
 REVISÃO ENEM Hidrostática O QUE É UM FLUIDO? Fluido é denominação genérica dada a qualquer substância que flui isto é, escoa e não apresenta forma própria, pois adquire a forma do recipiente que o contém.
REVISÃO ENEM Hidrostática O QUE É UM FLUIDO? Fluido é denominação genérica dada a qualquer substância que flui isto é, escoa e não apresenta forma própria, pois adquire a forma do recipiente que o contém.
FÍSICA - 2 o ANO MÓDULO 05 HIDROSTÁTICA REVISÃO GERAL
 FÍSICA - 2 o ANO MÓDULO 05 HIDROSTÁTICA REVISÃO GERAL Fixação 1) A figura ao lado representa um cilindro constituído por três partes de volumes iguais a V. A parte de baixo é de ferro maciço e homogêneo,
FÍSICA - 2 o ANO MÓDULO 05 HIDROSTÁTICA REVISÃO GERAL Fixação 1) A figura ao lado representa um cilindro constituído por três partes de volumes iguais a V. A parte de baixo é de ferro maciço e homogêneo,
Escoamento completamente desenvolvido
 Escoamento completamente desenvolvido A figura mostra um escoamento laminar na região de entrada de um tubo circular. Uma camada limite desenvolve-se ao longo das paredes do duto. A superfície do tubo
Escoamento completamente desenvolvido A figura mostra um escoamento laminar na região de entrada de um tubo circular. Uma camada limite desenvolve-se ao longo das paredes do duto. A superfície do tubo
Uma onda se caracteriza como sendo qualquer perturbação que se propaga no espaço.
 16 ONDAS 1 16.3 Uma onda se caracteriza como sendo qualquer perturbação que se propaga no espaço. Onda transversal: a deformação é transversal à direção de propagação. Deformação Propagação 2 Onda longitudinal:
16 ONDAS 1 16.3 Uma onda se caracteriza como sendo qualquer perturbação que se propaga no espaço. Onda transversal: a deformação é transversal à direção de propagação. Deformação Propagação 2 Onda longitudinal:
RESOLUÇÃO Exame nacional ª Fase Versão 1
 RESOLUÇÃO Exame nacional 2013 2ª Fase Versão 1 Grupo I 1. Um sinal eletromagnético apresenta, no vácuo, uma velocidade que se representa por c: c = 3,00 10 8 m s 1 como se trata de uma velocidade constante,
RESOLUÇÃO Exame nacional 2013 2ª Fase Versão 1 Grupo I 1. Um sinal eletromagnético apresenta, no vácuo, uma velocidade que se representa por c: c = 3,00 10 8 m s 1 como se trata de uma velocidade constante,
UC: STC 6 Núcleo Gerador: URBANISMO E MOBILIDADES Tema: Construção e Arquitectura Domínio de Ref.ª:RA1 Área: Ciência
 UC: STC 6 Núcleo Gerador: URBANISMO E MOBILIDADES Tema: Construção e Arquitectura Domínio de Ref.ª:RA1 Área: Ciência Sumário: Betão armado armadura aplicações Equilíbrio estático de um ponto material Momento
UC: STC 6 Núcleo Gerador: URBANISMO E MOBILIDADES Tema: Construção e Arquitectura Domínio de Ref.ª:RA1 Área: Ciência Sumário: Betão armado armadura aplicações Equilíbrio estático de um ponto material Momento
Conteúdo Eletromagnetismo: Campo Magnético gerado por um fio e por um solenoide.
 AULA 16.1 Conteúdo Eletromagnetismo: Campo Magnético gerado por um fio e por um solenoide. Habilidades: Compreender os princípios físicos envolvidos no magnetismo e eletromagnetismo para relacionar fenômenos
AULA 16.1 Conteúdo Eletromagnetismo: Campo Magnético gerado por um fio e por um solenoide. Habilidades: Compreender os princípios físicos envolvidos no magnetismo e eletromagnetismo para relacionar fenômenos
Pontifícia Universidade Católica de Goiás Departamento de Biologia. Membrana Plasmática. Prof. Msc. Macks Wendhell Gonçalves.
 Pontifícia Universidade Católica de Goiás Departamento de Biologia Membrana Plasmática Prof. Msc. Macks Wendhell Gonçalves mackswendhell@gmail.com Membrana Plasmática (MP) A MP mantem constante o meio
Pontifícia Universidade Católica de Goiás Departamento de Biologia Membrana Plasmática Prof. Msc. Macks Wendhell Gonçalves mackswendhell@gmail.com Membrana Plasmática (MP) A MP mantem constante o meio
PROPRIEDADES DAS SOLUÇÕES
 PROPRIEDADES DAS SOLUÇÕES M Filomena Botelho Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica
PROPRIEDADES DAS SOLUÇÕES M Filomena Botelho Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica
BIOELETROGÊNESE. Capacidade de gerar e alterar a diferença de potencial elétrico através da membrana. - Neurônios. esqueléticas lisas cardíacas
 BIOELETROGÊNESE Capacidade de gerar e alterar a diferença de potencial elétrico através da membrana - Neurônios - células musculares esqueléticas lisas cardíacas Membrana citoplasmática Os neurônios geram
BIOELETROGÊNESE Capacidade de gerar e alterar a diferença de potencial elétrico através da membrana - Neurônios - células musculares esqueléticas lisas cardíacas Membrana citoplasmática Os neurônios geram
FISIOLOGIA DAS MEMBRANAS. Composição da membrana plasmática. Transporte através da membrana.
 FISIOLOGIA DAS MEMBRANAS Composição da membrana plasmática. Transporte através da membrana. FUNÇÕES DA MEMBRANA PLASMÁTICA Isolamento físico Regulação de trocas Comunicação celular Suporte estrutural Modelo
FISIOLOGIA DAS MEMBRANAS Composição da membrana plasmática. Transporte através da membrana. FUNÇÕES DA MEMBRANA PLASMÁTICA Isolamento físico Regulação de trocas Comunicação celular Suporte estrutural Modelo
Hidrostática e Hidrodinâmica
 Capítulo 1 Hidrostática e Hidrodinâmica Exercício 1.1: Calcule o valor de 1 atmosfera (76 cmhg) em unidades do Sistema Internacional. ρ Hg = 13.6 g/cm 3. Exercício 1.2: Calcule a massa de uma esfera de
Capítulo 1 Hidrostática e Hidrodinâmica Exercício 1.1: Calcule o valor de 1 atmosfera (76 cmhg) em unidades do Sistema Internacional. ρ Hg = 13.6 g/cm 3. Exercício 1.2: Calcule a massa de uma esfera de
Soluções das Questões de Física da Universidade do Estado do Rio de Janeiro UERJ
 Soluções das Questões de Física da Universidade do Estado do Rio de Janeiro UERJ 1º Exame de Qualificação 011 Vestibular 011 Utilize as informações a seguir para responder às questões de números e 3. Um
Soluções das Questões de Física da Universidade do Estado do Rio de Janeiro UERJ 1º Exame de Qualificação 011 Vestibular 011 Utilize as informações a seguir para responder às questões de números e 3. Um
Introdução à Magneto-hidrodinâmica
 Introdução à Magneto-hidrodinâmica Gilson Ronchi November, 013 1 Introdução A magneto-hidrodinâmica é o estudo das equações hidrodinâmicas em uidos condutores, em particular, em plasmas. Entre os principais
Introdução à Magneto-hidrodinâmica Gilson Ronchi November, 013 1 Introdução A magneto-hidrodinâmica é o estudo das equações hidrodinâmicas em uidos condutores, em particular, em plasmas. Entre os principais
Figura 1: Potencial químico de um solvente na presença de um soluto.
 Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
Propriedades Coligativas 1. Introdução Algumas propriedades do solvente mudam quando um soluto é dissolvido nele para formar uma solução. O ponto de congelamento da água salgada, por exemplo, é menor que
AULA 05: Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa do carbono-12.
 SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
SETOR 2306 Turma de Maio/Manhã Aulas 05 e 06 Resolução dos eercícios de sala AULA 05: EXERCÍCIO 1) (discutido em sala) Hidrogênio (MA = 1,0 u). Isso significa que 1 átomo de hidrogênio pesa 1/12 da massa
AULA DO CAP. 15-2ª Parte Fluidos Ideais em Movimento DANIEL BERNOULLI ( )
 AULA DO CAP. 15-2ª Parte Fluidos Ideais em Movimento DANIEL BERNOULLI (1700-1782) Radicada em Basiléia, Suíça, a família Bernoulli (ou Bernouilli) tem um papel de destaque nos meios científicos dos séculos
AULA DO CAP. 15-2ª Parte Fluidos Ideais em Movimento DANIEL BERNOULLI (1700-1782) Radicada em Basiléia, Suíça, a família Bernoulli (ou Bernouilli) tem um papel de destaque nos meios científicos dos séculos
O símbolo usado em diagramas de circuito para fontes de tensão é:
 Circuitos Elétricos Para fazer passar cargas elétricas por um resistor, precisamos estabelecer uma diferença de potencial entre as extremidades do dispositivo. Para produzir uma corrente estável é preciso
Circuitos Elétricos Para fazer passar cargas elétricas por um resistor, precisamos estabelecer uma diferença de potencial entre as extremidades do dispositivo. Para produzir uma corrente estável é preciso
Biofísica renal. Estrutura e função dos rins
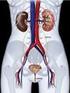 Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Biofísica renal Estrutura e função dos rins Múltiplas funções do sistema renal Regulação do balanço hídrico e eletrolítico (volume e osmolaridade) Regulação do equilíbrio ácidobásico (ph) Excreção de produtos
Física. Setor B. Índice-controle de Estudo. Prof.: Aula 17 (pág. 88) AD TM TC. Aula 18 (pág. 88) AD TM TC. Aula 19 (pág.
 Física Setor B Prof.: Índice-controle de Estudo ula 17 (pág. 88) D TM TC ula 18 (pág. 88) D TM TC ula 19 (pág. 90) D TM TC ula 20 (pág. 90) D TM TC ula 21 (pág. 92) D TM TC ula 22 (pág. 94) D TM TC Revisanglo
Física Setor B Prof.: Índice-controle de Estudo ula 17 (pág. 88) D TM TC ula 18 (pág. 88) D TM TC ula 19 (pág. 90) D TM TC ula 20 (pág. 90) D TM TC ula 21 (pág. 92) D TM TC ula 22 (pág. 94) D TM TC Revisanglo
Conceitos Básicos de Teoria dos Circuitos
 Teoria dos Circuitos e Fundamentos de Electrónica Conceitos Básicos de Teoria dos Circuitos T.M.lmeida ST-DEEC- CElectrónica Teresa Mendes de lmeida TeresaMlmeida@ist.utl.pt DEEC Área Científica de Electrónica
Teoria dos Circuitos e Fundamentos de Electrónica Conceitos Básicos de Teoria dos Circuitos T.M.lmeida ST-DEEC- CElectrónica Teresa Mendes de lmeida TeresaMlmeida@ist.utl.pt DEEC Área Científica de Electrónica
CURSO PROFISSIONAL FÍSICA. F = m a MÓDULO 1 FORÇAS E MOVIMENTOS. Prof: Marília Pacheco Ano lectivo
 CURSO PROFISSIONAL FÍSICA F = m a MÓDULO 1 FORÇAS E MOVIMENTOS Prof: Marília Pacheco Ano lectivo 2013-14 ÍNDICE 1. A FÍSICA ESTUDA A INTERACÇÃO ENTRE CORPOS... 2 1.1 INTERACÇÕES FUNDAMENTAIS... 2 FORÇAS...
CURSO PROFISSIONAL FÍSICA F = m a MÓDULO 1 FORÇAS E MOVIMENTOS Prof: Marília Pacheco Ano lectivo 2013-14 ÍNDICE 1. A FÍSICA ESTUDA A INTERACÇÃO ENTRE CORPOS... 2 1.1 INTERACÇÕES FUNDAMENTAIS... 2 FORÇAS...
3º Ensino Médio Trabalho de Física Data /08/09 Professor Marcelo
 Nome 3º Ensino Médio Trabalho de Física Data /08/09 Professor Marcelo Em física, corrente elétrica é o movimento ordenado de partículas portadoras de cargas elétricas. Microscopicamente as cargas livres
Nome 3º Ensino Médio Trabalho de Física Data /08/09 Professor Marcelo Em física, corrente elétrica é o movimento ordenado de partículas portadoras de cargas elétricas. Microscopicamente as cargas livres
Resolução do Exame Nacional de Física e Química A 11.º, 2010, 2.ª fase, versão 1
 Resolução do Exame Nacional de Física e uímica A 11.º, 010,.ª fase, versão 1 Sociedade Portuguesa de Física, Divisão de Educação, 15 de Julho de 010, http://de.spf.pt 1. 1.1. O aumento da acidez da água
Resolução do Exame Nacional de Física e uímica A 11.º, 010,.ª fase, versão 1 Sociedade Portuguesa de Física, Divisão de Educação, 15 de Julho de 010, http://de.spf.pt 1. 1.1. O aumento da acidez da água
Física II Ondas, Fluidos e Termodinâmica USP Prof. Antônio Roque Aula
 Aula 3 010 Movimento Harmônico Simples: Exemplos O protótipo físico do movimento harmônico simples (MHS) visto nas aulas passadas um corpo de massa m preso a uma mola executando vibrações de pequenas amplitudes
Aula 3 010 Movimento Harmônico Simples: Exemplos O protótipo físico do movimento harmônico simples (MHS) visto nas aulas passadas um corpo de massa m preso a uma mola executando vibrações de pequenas amplitudes
P4 - PROVA DE QUÍMICA GERAL - 03/12/05
 P4 - PROVA DE QUÍMICA GERAL - 03//05 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: R = 0,08 atm L mol - K - = 8,34 J
P4 - PROVA DE QUÍMICA GERAL - 03//05 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão a,5 a,5 3 a,5 4 a,5 Total 0,0 Constantes e equações: R = 0,08 atm L mol - K - = 8,34 J
Princípios de Eletricidade Magnetismo
 Princípios de Eletricidade Magnetismo Corrente Elétrica e Circuitos de Corrente Contínua Professor: Cristiano Faria Corrente e Movimento de Cargas Elétricas Embora uma corrente seja um movimento de partícula
Princípios de Eletricidade Magnetismo Corrente Elétrica e Circuitos de Corrente Contínua Professor: Cristiano Faria Corrente e Movimento de Cargas Elétricas Embora uma corrente seja um movimento de partícula
0.1 Introdução Conceitos básicos
 Laboratório de Eletricidade S.J.Troise Exp. 0 - Laboratório de eletricidade 0.1 Introdução Conceitos básicos O modelo aceito modernamente para o átomo apresenta o aspecto de uma esfera central chamada
Laboratório de Eletricidade S.J.Troise Exp. 0 - Laboratório de eletricidade 0.1 Introdução Conceitos básicos O modelo aceito modernamente para o átomo apresenta o aspecto de uma esfera central chamada
Professora MSc Monyke Lucena
 Professora MSc Monyke Lucena Está presente em todas as células. Em algumas células, há envoltórios adicionais externos à membrana são as membranas esqueléticas (paredes celulares) Na célula vegetal: membrana
Professora MSc Monyke Lucena Está presente em todas as células. Em algumas células, há envoltórios adicionais externos à membrana são as membranas esqueléticas (paredes celulares) Na célula vegetal: membrana
FÍSICA II. Justifique todas as suas respostas convenientemente Apresente uma Prova limpa e ordenada
 FÍSICA II Duração: 2 H 30 (exactas) 1ª Chamada 22 de Janeiro de 2002 Justifique todas as suas respostas convenientemente Apresente uma Prova limpa e ordenada g = 9,8 m/s 2 1 atm = 1 x 10 5 Pa ρ água =
FÍSICA II Duração: 2 H 30 (exactas) 1ª Chamada 22 de Janeiro de 2002 Justifique todas as suas respostas convenientemente Apresente uma Prova limpa e ordenada g = 9,8 m/s 2 1 atm = 1 x 10 5 Pa ρ água =
Física Unidade VI Série 2
 01 A força magnética F é perpendicular, simultaneamente, ao campo indução B e a velocidade v. No entanto v e B não são, necessariamente, perpendiculares entre si. Resposta: B 1 02 Como a velocidade é paralelo
01 A força magnética F é perpendicular, simultaneamente, ao campo indução B e a velocidade v. No entanto v e B não são, necessariamente, perpendiculares entre si. Resposta: B 1 02 Como a velocidade é paralelo
T.D. de Química 28/03/2015. Prof. Victor Henrique
 T.D. de Química 28/03/2015 Prof. Victor Henrique 01) Qual é a molalidade de uma solução que contém 34,2 g de sacarose, C 12 H 22 O 11, dissolvidos em 200 g de água? Dados: C = 12; H = 1; O = 16 a) 0,1
T.D. de Química 28/03/2015 Prof. Victor Henrique 01) Qual é a molalidade de uma solução que contém 34,2 g de sacarose, C 12 H 22 O 11, dissolvidos em 200 g de água? Dados: C = 12; H = 1; O = 16 a) 0,1
5 Forças em Dinâmica. 1 Princípio da inércia (primeira lei de Newton) 2 Princípio fundamental da Dinâmica (segunda lei de Newton)
 F=m.a 5 Forças em Dinâmica A Dinâmica é a parte da Mecânica que estuda os movimentos e as causas que os produzem ou os modificam. Significa que a força resultante F produz uma aceleração a com mesma direção
F=m.a 5 Forças em Dinâmica A Dinâmica é a parte da Mecânica que estuda os movimentos e as causas que os produzem ou os modificam. Significa que a força resultante F produz uma aceleração a com mesma direção
Agrupamento de Escolas da Senhora da Hora
 Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Multimédia Informação Prova da Disciplina de Física - Módulo: 1 Forças e Movimentos; Estática Modalidade da Prova: Escrita Ano
Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Multimédia Informação Prova da Disciplina de Física - Módulo: 1 Forças e Movimentos; Estática Modalidade da Prova: Escrita Ano
A) Se a massa molar do composto C é 76 g.mol 1, determine as fórmulas químicas para os compostos A, B, C, D e E.
 VTB 2008 2ª ETAPA Solução Comentada da Prova de Química 01. Na análise de 5 (cinco) diferentes compostos (A, B, C, D e E) formados apenas por nitrogênio e oxigênio, observou-se que as relações de massas
VTB 2008 2ª ETAPA Solução Comentada da Prova de Química 01. Na análise de 5 (cinco) diferentes compostos (A, B, C, D e E) formados apenas por nitrogênio e oxigênio, observou-se que as relações de massas
2.1 Breve história da termodinâmica
 2.1 Breve história da termodinâmica TERMODINÂMICA calor força, movimento No início, estudava os processos que permitiam converter calor em trabalho (força e movimento). 2.1 Breve história da termodinâmica
2.1 Breve história da termodinâmica TERMODINÂMICA calor força, movimento No início, estudava os processos que permitiam converter calor em trabalho (força e movimento). 2.1 Breve história da termodinâmica
Carga axial. Princípio de Saint-Venant
 Carga axial Princípio de Saint-Venant O princípio Saint-Venant afirma que a tensão e deformação localizadas nas regiões de aplicação de carga ou nos apoios tendem a nivelar-se a uma distância suficientemente
Carga axial Princípio de Saint-Venant O princípio Saint-Venant afirma que a tensão e deformação localizadas nas regiões de aplicação de carga ou nos apoios tendem a nivelar-se a uma distância suficientemente
UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES
 Acção de Formação UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES (Guião da Actividade) Formanda: Maria Teresa Novo Formador: Professor Vítor Duarte Teodoro Braga 2010 Transportes Transmembranares: O Processo
Acção de Formação UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES (Guião da Actividade) Formanda: Maria Teresa Novo Formador: Professor Vítor Duarte Teodoro Braga 2010 Transportes Transmembranares: O Processo
CQ110 : Princípios de FQ
 CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
MATRÍCULA: PROF. : NOTA:
 Física Geral e Experimental III & XIX 2ª prova 30/05/2015 A NOME: TURMA: MATRÍCULA: PROF. : NOTA: Importante: Assine a primeira página do cartão de questões e a folha do cartão de respostas. Leia os enunciados
Física Geral e Experimental III & XIX 2ª prova 30/05/2015 A NOME: TURMA: MATRÍCULA: PROF. : NOTA: Importante: Assine a primeira página do cartão de questões e a folha do cartão de respostas. Leia os enunciados
Aula de Bioquímica I. Tema: Água. Prof. Dr. Júlio César Borges
 Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Aula de Bioquímica I Tema: Água Prof. Dr. Júlio César Borges Depto. de Química e Física Molecular DQFM Instituto de Química de São Carlos IQSC Universidade de São Paulo USP E-mail: borgesjc@iqsc.usp.br
Propriedades Coligativas. Tecnologia de Alimentos Prof a. Msc. Fernanda Caspers Zimmer
 Propriedades Coligativas Tecnologia de Alimentos Prof a. Msc. Fernanda Caspers Zimmer Propriedades Coligativas: São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química,
Propriedades Coligativas Tecnologia de Alimentos Prof a. Msc. Fernanda Caspers Zimmer Propriedades Coligativas: São mudanças que ocorrem no comportamento de um líquido. Quando comparamos, em análise química,
