P2 de 1S 2009 até 2S 2017
|
|
|
- Brenda Mangueira Aragão
- 5 Há anos
- Visualizações:
Transcrição
1 P2 de 1S 2009 até 2S 2017 P2 QUIM ORG 2S ) Com relação a condutividade elétrica dos materiais: a) explique o que são semi-condutores do tipo p e n. b) explique a Teoria de Bandas e os tipos de materiais e relacione com a teoria dos Orbitais Moleculares. 2) Explique: (a) por que a energia de ionização do potássio é menor do que a do sódio, ainda que a carga nuclear efetiva do sódio seja menor. (b) por que os metais do bloco s são mais reativos do que os metais do bloco p. 3) Observe a estrutura abaixo, enumere os carbonos em ordem crescente da direita para a esquerda e responda: 1,39 pm O 1.24pm C1,54 pm C 1,51pm C 1,33pm N 1,46pm C C C C C 1,34 pm 1,20 pm 1,39 pm a) Esboce num único diagrama de energia dos orbitais moleculares de todas as ligações carbono hidrogênio. b) Esboce num único diagrama de energia dos orbitais moleculares das seguintes ligações covalentes: carbono 2-3, carbono 4-5 e carbono 7-8. c) Esboce num único diagrama de energia dos orbitais moleculares de todas as ligações covalentes do carbono 7. d) Esboce os diagramas de energia dos orbitais atômicos e moleculares que descrevem a origem das ligações covalentes e sua natureza energética dos carbonos 1-2, carbonos 3-4 e carbonos ) Explique a diferença dos comprimentos de ligações entre carbono 5-nitrogêno e carbonos 7-8 da estrutura molecular da questão 3. 5) Analise e explique os comprimentos de ligações do anel aromático da estrutura molecular da questão 3, utilizando as comparações entre as ligações carbonos 10-11, carbonos 13-14, carbonos 3-4, carbonos 7-8, nos seus argumentos. 1) Observe a estrutura abaixo e responda: P2 QUIM ORG 1S ,39 pm O 1.24pm C1,54 pm C 1,51pm C 1,33pm N 1,46pm C C C C C 1,34 pm 1,20 pm 1,39 pm a) Enumere os carbonos e descreva todas as ligações químicas (tipos, quantidade e a natureza). b) Explique as diferença dos comprimentos das ligações do carbono 7. 2) Com relação a estrutura da questão 2, esboce comparativamente os diagramas de energia das ligações entre:
2 a) carbonos 1-2, carbonos 3-4 e carbonos 7-8 (em um único diagrama). b) todas as ligações do carbono 6. 3) Leia atentamente o texto abaixo e explique o significado de cada propriedade e sua relação com a estrutura das moléculas. Todas as ligações químicas do etino aparecem como picos em frequências mais altas que as ligações do eteno, que por sua vez apresenta espectro com picos em maiores frequências que o do etano. Os valores de pka s do etino é menor que a do eteno, que por sua vez, é menor que a do etano. Observa-se que o etino e o eteno reagem com ácidos enquanto o etano é inerte. 4) Com relação a condutividade elétrica dos materiais: a) explique o que são semi-condutores do tipo p e n. b) explique a Teoria de Bandas e os tipos de materiais e relacione com a teoria dos Orbitais Moleculares. 5) A partir dos dados abaixo, responda os itens Etanol, estiramento O- em 3590 cm -1, pka = 16. Ácido acético, estiramento O- em 2500 cm -1, pka = 4,75. Etilamina, estiramento N- em 3300 cm -1, pkb= 3,19. a) Escreva as estruturas químicas, identifique a ligação relacionada aos estiramentos e explique a diferença nos valores de estiramento entre as três moléculas. b) Escreva as equações de equilíbrio de desprotonação e protonação necessárias para explicar a diferença entre os pka s e entre pka e pkb. Explique as diferenças nos valores da constante de equilíbrio entre as moléculas. QO P2 2S SEM/2016 Questão 1. Demonstre os cálculos e preencha os dados da Tabela abaixo. Substância Fórmula Molaridade p Constantes de Equilíbrio Protona ou desprotona: fórmula Morfina C O 3 N 0,010 10,10 K = pk = istidina C 6 8 O 2 N 3 0,010 2,15 K = pk = Questão 2. Preencha os dados da Tabela abaixo e explique a diferença da força dos ácidos, relacionando com a estrutura química das substâncias e a capacidade de desprotonar em água: substância Fórmula Molaridade p Força do ácido * Ka ** pka ** Ácido cloroso ClO 2 0,010 2,19 Ácido hipocloroso ClO 0,010 4,71 Ácido clorídrico Cl 0,010 2,00 * preencher se é mais forte, intermediário ou mais fraco. ** preencher se é maior, intermediário ou menor. Questão 3. Preencha os dados da Tabela abaixo e explique a diferença da força das bases, relacionando com a estrutura química das substâncias e a capacidade em protonar em água: substância Fórmula Molaridade p Força da base * Kb ** pkb ** Metilamina C 3 N 0,010 M 11,24 Amônia N 3 0,010 M 10,62 idroxilamina N 2 0,010 M 9,02 * preencher se é mais forte, intermediário ou mais fraco. ** preencher se é maior, intermediário ou menor.
3 Questão 4. Calcule a porcentagem de desprotonação dos ácidos, preencha a Tabela abaixo e responda os itens b, c e d: Ácido Molaridade p Ácido Molaridade p Ácido Molaridade p Clorídrico 0,010 M 2,00 Sulfúrico 0,010 M 1,78 Fosfórico 0,010 M 2,24 Clorídrico 0,030 M 1,52 Sulfúrico 0,030 M 1,36 Fosfórico 0,030 M 1,93 a) Clorídrico % D = Sulfúrico % D = Fosfórico % D = b) Para o mesmo volume de cada ácido, qual é a concentração de hidróxido de sódio necessária para neutralizar completamente o ácido clorídrico 0,010 M, o ácido sulfúrico 0,010 M e o ácido fosfórico 0,010 M, separadamente? Por quê? c) De acordo com a fórmula química do ácido fosfórico, o p da solução de ácido fosfórico 0,010 M deveria ser igual ao p da solução de ácido clorídrico 0,030 M, mas os dados da Tabela mostram que isto não ocorre. Explique porque deveria ser e porque não é. d) Entre os ácidos da Tabela, qual é o ácido mais forte, o intermediário e o mais fraco. Explique o seu raciocínio. Questão 5. De acordo com os dados apresentados na Tabela abaixo, responda: a) Identifique os hidrogênios da istidina relacionados com cada pka e explique o seu raciocínio para estas atribuições. b) caso a histidina se comporte como uma base identifique aonde ela protonaria mais facilmente e explique o seu raciocínio. c) Qual é a molécula mais reativa em água: a histidina ou o ácido fosfórico? Explique a sua escolha. N O N C N 2 C O istidina O P pka s = 1.78 / 5.97 / 8.97 Ácido fosfórico, 3 PO 4 pka s = 2.12 / 7.21 / QO P2 1S SEM/2016 Questão 1. De acordo com os dados da Tabela abaixo, calcule as constantes de equilíbrio do ácido mandélico e da metilamina. ácido mandélico (2-hidróxi-2-feniletanóico) C 8 8 O 3 0,010 M p = 2,95 metilamina C 5 N 0,20 M p = 11,93 Questão 2. Compare as constantes de equilíbrio entre a nicotina (C N 2 e pkb igual a 5,98) e a hidroxilamina (N 3 O e pkb igual a 8,75) e induza a conclusão de qual é a molécula mais estável em água. Questão 3. Com relação a condutividade elétrica dos materiais: a) explique o que são semi-condutores do tipo p e n. b) relacione a Teoria dos Orbitais Moleculares com a Teoria de Bandas e explique a diferença de condutividade elétrica entre compostos iônicos e metálicos. Questão 4. De acordo com os dados apresentados na Tabela abaixo, responda: a) Identifique os hidrogênios da istidina relacionados com cada pka. b) caso a histidina se comporte como uma base, identifique aonde ela protonaria mais facilmente. c) a istidina é um ácido, uma base ou uma molécula neutra? Explique sua escolha. d) Qual é a molécula mais reativa em água: a histidina ou o ácido fosfórico? Explique a sua escolha.
4 N C C N N 2 O istidina pka s = 1.78 / 5.97 / 8.97 O O P Ácido fosfórico, 3 PO 4 pka s = 2.12 / 7.21 / Questão 5. Leia atentamente o texto abaixo e explique a origem de cada comparação e as aparentes contradições experimentais ressaltadas no texto. Nos espectros no IV a localização exata do pico depende da força (e da rigidez) das ligações, isto é, quanto mais forte e rígida a ligação mais alta é a frequência. Todas as ligações químicas do etino aparecem como picos em frequências mais altas que as ligações do eteno, que por sua vez apresenta espectro com picos em maiores frequências que o do etano. Entretanto, os valores de pka s mostram que o etino e o eteno apresentam maior facilidade em desprotonar que o etano e, além disso, estranhamente observa-se que o etino e o eteno reagem com ácidos enquanto o etano é inerte. QO P2 2S SEM/2015 1) O p de 50 ml de solução preparada com 1 g de ácido hipocloroso, ClO, é de 3,97 e o p de 50 ml de solução preparada com 1 g de ácido iódico, IO, é de 4,77. a) Determine o pka para cada ácido b) Qual ácido é o mais forte? Dê a explicação completa de como você sabe que a sua escolha está correta. 2) Responda: a) Escreva os equilíbrios e as constantes de equilíbrio que mostram que a amônia pode apresentar um caráter anfiprótico. b) Foram preparadas três soluções aquosas salinas: uma de cloreto de potássio, a outra de fluoreto de sódio e a terceira de cloreto de amônio. As soluções apresentam p ácido, básico ou neutro? Explique como você definiu a sua escolha para cada solução. 3) O 1.24pm a) Explique a diferença no comprimento de ligação entre C-C (1,51pm) e N-C (1,46 pm). C 1,51pm C 1,33pm N 1,46pm C b) Explique a diferença no comprimento de ligação entre C-N (1,33pm) e N-C (1,46pm). 4) A estrutura dos orbitais do íon diatômico heteronuclear CN - é semelhante à do N 2. Desenhe os diagramas de níveis de energia do CN - de N 2 e nomeie os níveis de energia conforme o tipo de orbital do qual eles provêem, isto é, se eles são orbitais,, e se são ligantes (OM onde estão os elétrons compartilhados), antiligantes e não ligantes (elétrons não compartilhados).
5 5) Com relação a condutividade elétrica dos materiais: a) explique o que são semi-condutores do tipo p e n. b) relacione a Teoria dos Orbitais Moleculares com a Teoria de Bandas e explique a diferença de condutividade elétrica entre compostos iônicos e metálicos. Questão 1. termodinâmica. Questão 2. (pka = -7). De acordo com os dados da Tabela abaixo: QO P2 1S SEM/2015 a) Escreva a equação de equilíbrio e determine os valores das constantes de acidez de cada substância b) Defina qual ácido é o mais forte e explique como a constante mostra a força do ácido e a estabilidade Ácido nitroso NO 2 0,015 M p = 2,63 Ácido cloroso ClO 2 0,10 M p = 1,2 a) Explique a natureza da diferença de acidez entre o ácido nitroso e o ácido cloroso. b) Explique porque o pka do F (pka = 3,4) é menor que a da água (pka = 16), porém é maior que o do ácido clorídrico Questão 3. A partir dos dados da Tabela abaixo, responda: a) A água pode reagir tanto com a amônia quanto com o iodeto de hidrogênio? Por quê? b) A amônia pode reagir com o iodeto de hidrogênio? Por quê? c) O metano pode agir como uma base de Lewis quando misturado com I? Por quê? C 4 pka = 48 N 3 pka = 38 2 O pka = 16 I pka = -10 Questão 4. De acordo com os dados apresentados na Tabela abaixo, responda: a) Identifique os hidrogênios da istidina relacionados com cada pka. b) caso a histidina se comporte como uma base, identifique aonde ela protonaria mais facilmente. c) a istidina é um ácido, uma base ou uma molécula neutra? Explique. d) Qual é a molécula mais reativa: a histidina ou o ácido fosfórico? Explique. N N C C N 2 O istidina pka s = 1.78 / 5.97 / 8.97 O O P Ácido fosfórico, 3 PO 4 pka s = 2.12 / 7.21 / Questão 5. Leia atentamente o texto e discuta e explique o significado da palavra entretanto :
6 Nos espectros no IV a localização exata do pico depende da força (e da rigidez) das ligações, isto é, quanto mais forte e rígida a ligação mais alta é a frequência. Todas as ligações químicas do etino aparecem como picos em frequências mais altas que as ligações do etano. Entretanto, a constante de acidez do etino etino (pka=25) é menor que a do etano (pka=50). QO P2 2S SEM/2014 1) Explique porque o AlCl 3 reage com amônia, mas o NaCl não reage. 2) Explique porque o pka do F (pka = 3,4) é menor que a da água (pka = 16), porém é maior que o do ácido clorídrico (pka = -7). De acordo com os dados apresentados na Tabela abaixo, responda: N N C C N 2 O istidina pka s = 1.78 / 5.97 / 8.97 N Amônia pkb = 4,75 pka = 38 O O P Ácido fosfórico, 3 PO 4 pka s = 2.12 / 7.21 / O P Ácido fosforoso, 3 PO 3 pka s = 2.00 / ) Com relação a istidina; a) ela apresenta propriedades ácida, básica ou neutra? Explique. b) Identifique os hidrogênios da istidina relacionados com os pka s. Explique a sua identificação. c) caso a histidina se comporte como uma base, aonde ela irá se protonar? Explique. d) Qual é a molécula mais reativa: a histidina ou o ácido fosfórico? Explique. 4) Com relação ao ácido fosforoso: a) Explique porque ele apresenta apenas dois pka s. b) Qual ácido é o mais reativo: ácido fosforoso ou o ácido fosfórico? Explique. 5) Leia atentamente o texto abaixo e explique a origem de cada observação descrita no texto. Apesar de todas as ligações química do etino serem mais curtas que as do etano, o etino é mais reativo e o etano é mais inerte. Além disso, o etino reage tanto com ácido clorídrico como com amideto de sódio, mas não reage com a água. QO P2 1 SEM/2014 1) Explique as diferenças entre as reação I e II, mostradas abaixo: I) C 3 O - + C 3 CBr C 3 C=C + C 3 )C= 70 o C C 3 2-Metil-2-buteno (69%-Metil-1-buteno (31%)
7 70 o C II) ) 3 CO - + C 3 CBr C 3 C=C + C 3 )C= ) 3 C 2-Metil-2-buteno (28%-Metil-1-buteno (72%) 2) Explique as diferenças entre as reação III, IV e V, mostradas abaixo: III) IV) V) 3) Explique a afirmação: Apesar da hidrogenação de um alceno liberar aproximadamente 120 kj.mol -1, a reação não-catalisada não ocorre a temperatura ambiente. Por isto, adiciona-se um metal de transição. 4) Explique as diferenças entre as reação VI e VII, mostradas abaixo: VI) VII) QO PROVA 2 2 SEM/2013 Tabela I. Dados da reação radicalar da halogenação de metano. Iniciador F 2 Cl 2 Br 2 I 2 D o (kj/mol) Reatividade Altíssima (explosiva) Alta (controlável e não-seletiva) Moderada (seletivo) Não-reativo Tabela II. Energias de Dissociação homolítica das ligações C- de alcanos com carbonos terciário e primário. Substrato ) 3 C- C 3 - D o (kj/mol) ) Com base nos dados da Tabela I, explique a seguinte afirmação: Ao analisarmos os dados de reatividade e as energias de dissociação homolítica de ligação, D o, do cloro, bromo e iodo, observa-se que os valores de D o, nos fornecem uma maneira conveniente de prever as estabilidades relativas, as reatividades e as seletividades dos radicais. Entretanto, os dados do flúor mostram que os valores de D o não são o suficiente para analisar a reatividade e a seletividade real do radical numa reação radicalar. 2) Com base nos dados da Tabela I e II, compare e explique todas as diferenças entre as duas reações abaixo: ) 3 C + Br 2 luz, 127 C ) 3 CBr + C Br (>99%) (traços)
8 ) 3 C + Cl 2 luz, 25 C ) 3 CCl + C Cl (37%) (63%) 3) Explique por quê os alcanos constituídos somente de carbonos e hidrogênios são bastante inertes (isto é, não reagem por mecanismos de reação iônica), mas podem reagir por um mecanismo radicalar, se houver um iniciador apropriado. 4) Escreva todos os 7 produtos possíveis das reações iônicas para (1R,2S)-dimetil-1-bromo-butano com metóxido de sódio, C 3 ONa. Para cada produto proposto classifique-o com relação a atividade óptica e defenda a existência de cada produto proposto. 5) Explique o fato da mistura de C 3 Cl com NaCN 0,01 mol.l -1 em etanol produzir principalmente C 3 CN, enquanto que mistura de ) 3 CCl com NaCN 0,01 mol.l -1 em etanol produzir principalmente ) 3 CO C 3. QO PROVA 2 1 SEM/2013 1) A reação de haletos de alquila primários (RX) com sais de nitrito (NaNO 2, por exemplo) produz tanto o RNO 2 quanto RONO. Forneça o mecanismo da reação e explique qual é o principal produto da reação e por que os dois produtos podem ser formados. 2) Explique porque a estabilidade termodinâmica é maior para: a) trans-dimetil-eteno em comparação ao cis-dimetil-eteno; b) trimetil-eteno em comparação ao trans-dimetil-eteno; c) 1,1-dimetil-eteno em comparação ao trans-dimetil-eteno. 3) Com relação ao efeito da estrutura dos compostos abaixo Composto C 3 X C 3 X CX ) 3 C X ) 3 CX Veloc. para SN ,03 0,00001 ~0 Primeiramente ordene por: - reatividade para SN2; - reatividade para SN1; - reatividade para Eliminação. Em seguida explique cada uma das três ordens propostas por você. 4) O Br pode atuar como em agente de desidratação e/ou como catalisador quando misturado com C 3 C )C()C. a) Escreva todos os produtos da desidratação da reação e identifique o produto principal e justifique. b) Escreva todos os produtos em que o Br age como um catalisador e identifique o produto principal e justifique.
9 c) Represente a projeção de Fischer do reagente e dos produtos que apresentem atividade óptica e estipule o sentido R e S na projeção de modo a indicar o mecanismo de reação responsável pela estereoquímica do produto. QO 2 SEM/2012 Tabela 1. Valores de pka para alguns compostos. Composto C 3 2O C 3 ) 3C F Cl Br N 4 + N 3 pk a 15,5 15,7 15, Questões obrigatórias: 1) Explique as afirmações abaixo: a) Os álcoois reagem com haletos de hidrogênio, X, fortemente ácidos (Br por exemplo), mas não reagem com NaCl, NaBr ou NaI. b) A ordem de reatividade dos haletos de hidrogênio é I > Br > Cl (o F é geralmente não reativo). c) A ordem de reatividade dos álcoois é terciário > secundário > primário < metanol. d) A desidratação de álcoois primários, R, com haletos de hidrogênio, X, pode formar tanto haletos de alquilas, RX, como também a formação de éteres, ROR, e de alcenos. 2) Escreva todos os produtos da desidratação do álcool secundário C 3 C )C()C por Br, colocando os produtos em ordem crescente de preferência de formação e justifique essa ordem. 3) Algum dos produtos da questão 2 pode apresentar atividade óptica? Em caso positivo, represente a projeção de Fischer do reagente e dos produtos que apresente atividade óptica e estipule o sentido R e S na projeção de modo a indicar o mecanismo de reação responsável pela estereoquímica do produto. Questões não obrigatórias: 4) O seu objetivo é preparar o éter metil isopropílico, C 3 OC. Existem duas reações possível: (I) C 3 ONa + CI C 3 OC (II) CONa + C 3 I C 3 OC Então, responda qual dessas reações forneceria o melhor rendimento com relação a formação de C 3 OC? Justifique 5) Explique o fato da mistura de C 3Cl com NaCN 0,01 mol.l -1 em etanol produzir principalmente C 3CN, enquanto que mistura de ) 3CCl com NaCN 0,01 mol.l -1 em etanol produzir principalmente ) 3COC 3. 6) Escreva o mecanismo de reação dos principais produtos numa mistura entre água, tert-butanol e amônia, destacando o motivo da escolha do substrato e do nucleófilo mais reativo? QO PROVA 2 1 SEM/2012 Tabela 1. Composto Cl + N 4 C O ) 3 C N 3 C 3 C 3 pk a
10 Tabela 2. Composto C 3 X C 3 X CX ) 3 C X ) 3 CX Veloc. para SN ,03 0,00001 ~0 1) Pode ocorrer uma reação de substituição nucleofílica ou de eliminação entre o etano com I? Por quê? 2) Se ocorrer uma reação entre o fenol, C 6 5, e o tert-butanol, ) 3 C, quais seriam os produtos formados? Mostre através do mecanismo de reação. 3) Numa mistura entre água, tert-butanol e amônia, qual dos compostos seria o substrato, qual seria o nucleófilo mais forte e qual seria o principal mecanismo de reação? Explique. Explique a origem (isto é, o porquê) das seguintes afirmações abaixo: 4) Com relação a uma competição entre produto de substituição e eliminação:...se o produto de eliminação é desejado, é mais conveniente adicionar uma base forte e forçar que ocorra uma eliminação por um mecanismo de reação E2. 5) A comparação entre nucleófilos com mesmo átomo nucleofílico, a nucleofilia se assemelha a basicidade, por exemplo, RO - >O - >>RCO 2 ->R> 2 O. Entretanto, apesar da água apresentar um pka = 16 e o CN apresentar um pka = 10, o CN - e mais nucleofilo que o -. Com relação a reação do (R)-2,3-dimetil-3-bromo-pentano com uma mistura de 90/10 de tertbutanol/água, à temperatura ambiente e considerando os dados de pka da tabela 1, responda: 6) Existe diferença de reatividade, como nucleófilos, entre o tert-butanol e a água? Explique. 7) O (R)-2,3-dimetil-3-bromo-pentano poderia ser o nucleófilo e o tert-butanol o substrato? Explique? 8) Escreva o mecanismo de reação do produto termodinamicamente mais estável. 9) Escreva o mecanismo de reação do produto cineticamente mais favorecido. 10) Com relação a estereoquímica (enantiômeros), faça uma análise dos produtos formados. QO PROVA 2 2 SEM/2011 OBS: Considere os dados de pka s da tabela para responder a questão 2. substâncias Br Cl 3 O + N O N 3 pk a ,7 9, Questão 1 (1 ponto). Quando o brometo de etila reage com cianeto de potássio em metanol, o produto principal é C 3 CN. Entretanto, algum C 3 NC também é formado. Explique. Questão 2 (5 pontos).
11 Com relação às três substâncias: C 3, C 3 Br, e C 3 N 2. a) Coloque as substâncias em ordem de reatividade em função do grupo abandonador e explique essa ordem. b) Tanto o C 3 quanto C 3 N 2 podem reagir com o C 3 Br. Explique esta afirmação. c) Tanto o C 3 Br, quanto o C 3 e o C 3 N 2 podem reagir com o Cl. Explique esta afirmação. d) A velocidade de reação entre C 3 N 2 e C 3 Br é maior em comparação com a reação entre C 3 e C 3 Br. Explique esta afirmação. e) A velocidade de reação entre C 3 N 2 e Cl é menor em comparação com a reação entre C 3 e Cl. Explique esta afirmação. Questão 3 (4 pontos). A reação do (R)-2,3-dimetil-3-bromo-pentano com uma mistura de 90/10 de propanol/água, à temperatura ambiente, produz 5 compostos orgânicos com propriedades físicas diferentes. Os compostos formados por substituição são os produtos majoritários (aproximadamente 80% de rendimento) e não apresentam atividade óptica. O propanol apresenta um pka ligeiramente menor que a água. a) Existe diferença de reatividade, como nucleófilos, entre o propanol e a água? Explique. b) Explique por que 80% dos produtos são de substituição. c) Escreva o mecanismo de reação de todos os produtos de substituição e explique por que eles não apresentam atividade óptica. d) Indique qual é o produto principal de eliminação e explique a sua formação preferencial entre os produtos de eliminação. Tabela A. Valores de pka para algumas substâncias QO PROVA 2 1 SEM/2011 C 4 pka = 48 N 3 pka = 38 2 O pka = 16 F pka = 3 2 S pka = 7 Cl pka = -7 2 Se pka = 4 Br pka = -9 I pka = -10 1) Interprete e explique o que significa os dados da Tabela 1. 2) O metano pode agir como uma base de Lewis quando misturado com I? Por quê?
12 3) A reação de haletos de alquila primários (RX) com sais de nitrito (NaNO 2, por exemplo) produz tanto o RNO 2 quanto RONO. Forneça o mecanismo da reação e explique por que os dois produtos podem ser formados. 4) O seu objetivo é preparar o éter metil isopropílico, C 3 OC. Existem duas reações possível: (I) C 3 ONa + CI C 3 OC (II) CONa + C 3 I C 3 OC Então, responda qual dessas reações forneceria o melhor rendimento com relação a formação de C 3 OC? Justifique 5) Preveja os todos os produtos formados e qual o produto majoritário, a 55 O C, para a reação abaixo. Justifique a sua resposta para cada produto formado e suas quantidades relativas: C 3 ONa + C 3 C )Br QO PROVA 2 2 SEM/2010 1) Interprete e explique o que significa os dados da tabela abaixo. Tabela 1. Valores de pka para algumas substâncias C 4 pka = 48 N 3 pka = 38 2 O pka = 16 F pka = 3 2 S pka = 7 Cl pka = -7 2 Se pka = 4 Br pka = -9 I pka = -10 2) A reação de etanol com ácido clorídrico produz cloreto de etila e água. Entretanto, quando o etanol é tratado com hidreto de sódio ocorre a liberação de um gás e a formação de um sal. Quais são esses produtos e explique por quê ocorre a reação de etanol com o ácido clorídrico e com o hidreto de sódio. Dado. Etanol Cl idreto Gás pka 16-7 Muito alto 35 3) Explique a seguinte reação: (+)-2-Clorobutano + Na(aq) (-)-2-Butanol + NaCl(aq) [α] 25 D = +36, puro [α] 25 D = 13,52, puro 4) Com relação ao efeito da estrutura do substrato, explique as seguintes ordens de reatividades em função dos dois tipos de mecanismo de substituição nucleofílica. Ordem de reatividade parem reações SN1:
13 Metila (inerte), Primário (inerte), Secundário << Terciário Ordem de reatividade para reações SN2: Metila > Primário > Secundário >> Terciário (inerte) 5) Explique o por quê das diferenças entre as quantidades dos produtos formados entre as reação I e II, mostradas abaixo: (2 pontos) I) C 3 O C 3 CBr o C C 3 C=C + C 3 )C=C 3 2-Metil-2-buteno (69%-Metil-1-buteno (31%) 70 o C II) ) 3 CO - + C 3 CBr C 3 C=C + C 3 )C= ) 3 C 2-Metil-2-buteno (28%-Metil-1-buteno (72%) QO PROVA 2 1 SEM/2010 1) Desenhe as projeções de Fischer para todos os isômeros possíveis do 2,4-dibromopentano, atribua a designação R,S para todos os centros estereogênicos e classifique os tipos de isômeros, se houver. 2) Explique o fato da mistura de C 3Cl com NaCN 0,01 mol.l -1 em etanol produzir principalmente C 3CN, enquanto que mistura de ) 3CCl com NaCN 0,01 mol.l -1 em etanol produzir principalmente ) 3COC 3. 3) Quais são as semelhanças entre as reações de substituição nucleofílica e eliminação e quais são os fatores que favorecem um tipo de reação mais que a outra e por quê? 4) Dê o produto (ou os produtos) que você esperaria ser formado em cada uma das seguintes reações. Em cada caso, forneça o mecanismo (S N1, S N2, E1 ou E2) através do qual o produto é formado e preveja a quantidade relativa de cada um (isto é, seria apenas um produto, um produto principal ou um produto minoritário?) a) C 3Br + C 3O - 5) Descreva as principais características das reações de eliminação e os fatores que podem influenciar nesse tipo de reação e como isso ocorre. QO PROVA 2 2 SEM/2009 1) Com relação ao trans-1,3-dietilcicloexano: a) Escreva a estrutura conformacional para a conformação mais estável e para a sua imagem especular. b) Este composto apresenta isômeros? Quais e Por quê? 2) O ácido tartárico [O 2CC()C()CO 2] foi um composto importante na história da estereoquímica. Duas formas naturais do ácido tartárico são oticamente inativas. Uma forma tem ponto de fusão de 206 o C, a outra tem um ponto de fusão de 140 o C. O ácido tartárico inativo com um ponto de fusão de 206 o C pode ser separado em duas formas oticamente ativas do ácido tartárico com o mesmo ponto de fusão de 170 o C. Um ácido tartárico oticamente ativo tem [ 25 o ] D 12 e o outro, [ 25 o ] D 12.
14 Todas as tentativas em separar a outra forma inativa do ácido tartárico (ponto de fusão de 140 o C) em compostos oticamente ativos fracassaram. (a) Escreva a projeção de Fischer do ácido tartárico com o ponto de fusão de 140 o C. (b) Quais são as possíveis estruturas para o ácido tartárico com pontos de fusão 170 o C? (c) Você pode dizer qual ácido tartárico do item (b) tem uma rotação positiva e qual tem uma rotação negativa? (d) Qual é a natureza da forma do ácido tartárico com um ponto de fusão de 206 o C? 3) Em contraste com as reações S N2, as reações S N1 mostram relativamente pouca seletividade nucleofílica. Isto é, quando mais de um nucleófilo está presente nomeio onde ocorre a reação, as reações S N1 mostram apenas uma ligeira tendência em discriminar entre nucleófilos fracos e fortes, enquanto as reações S N2 mostram uma tendência marcante em discriminar. a) Forneça uma explicação para esse comportamento. b) Mostre como a sua resposta explica o fato de o C 3Cl reagir com o NaCN 0,01 mol.l -1 em etanol para produzir principalmente C 3CN, enquanto que sob as mesmas condições o ) 3CCl reage para produzir principalmente ) 3COC 3. (Mostre o mecanismo de reação). 4) Descreva as principais semelhanças e diferenças entre uma reação S N1 e S N2 e os principais fatores que podem influenciar no tipo de reação de substituição. 5) Descreva as principais características das reações de eliminação e os fatores que podem influenciar nesse tipo de reação e como isso ocorre. QO PROVA 2 1 SEM/2009 1) Quando um álcool metílico é tratado com Na, o produto é C 3O - Na + (e 2) e não o Na +- (e 2). Explique esse fenômeno. 2) O ácido malônico, O 2CCO 2, é um ácido diprótico. O pka para a perda do primeiro próton é 2,93; e o pka para a perda do segundo próton é 5,69. (a) Explique por que o ácido malônico é um ácido mais forte do que o ácido acético (pka = 4,75). (b) Explique pro que o anion O 2CCO 2 é muito menos ácido do que o próprio ácido malônico. 3) O D-galactol é um dos compostos tóxicos produzidos pela doença galactosemia. O acúmulo de altos níveis de D-galactitol provoca a formação de catarata. A lactose é um dissacarídeo presente no leite de humanos, de vacas e de quase todos os mamíferos. A lactose é um açúcar redutor que se hidrolisa para produzir a D-glicose e a D-galactose. Uma projeção de Fischer para o D-galactitol e a D-galactose estão mostradas abaixo: O O D-galactitol O O CO (a) Desenhe uma estrutura tridimensional para o D-galactitol e uma para a D-galactose. (b) Determine quantos centros estereogênicos existem no D-galactitol e na D-galactose? (c) Desenhe a imagem especular do D-galactitol e da D-galactose usando a projeção de Fischer
15 D-galactose (d) Atribua a designação (R) ou (S) apropriada para cada estrutura. (e) Qual é a relação estereoquímica entre o D-galactitol e sua imagem? (f) Qual é a relação estereoquímica entre a D-galactose e sua imagem? 4a) Escreva uma estrutura conformacional para a conformação mais estável do trans-1,4-dietilcicloexano e para a sua imagem especular. 4b) Este composto apresenta isômeros? Quais e Por quê? 5) O ácido tartárico [O 2CC()C()CO 2] foi um composto importante na história da estereoquímica. Duas formas naturais do ácido tartárico são oticamente inativas. Uma forma tem ponto de fusão de 206 o C, a outra tem um ponto de fusão de 140 o C. O ácido tartárico inativo com um ponto de fusão de 206 o C pode ser separado em duas formas oticamente ativas do ácido tartárico com o mesmo ponto de fusão de 170 o C. Um ácido tartárico oticamente ativo tem [ 25 o ] D 12 e o outro, [ 25 o ] D 12. Todas as tentativas em separar a outra forma inativa do ácido tartárico (ponto de fusão de 140 o C) em compostos oticamente ativos fracassaram. (a) Escreva a estrutura tridimensional do ácido tartárico com o ponto de fusão de 140 o C. (b) Quais são as possíveis estruturas para o ácido tartárico com pontos de fusão 170 o C? (c) Você pode dizer qual ácido tartárico do item (b) tem uma rotação positiva e qual tem uma rotação negativa? (d) Qual é a natureza da forma do ácido tartárico com um ponto de fusão de 206 o C?
Química Orgânica Fundamental. Exercícios Cap 6
 Química Orgânica Fundamental Exercícios Cap 6 6.5 Use as estruturas conformacionais em cadeira e mostre a reação de substituição nucleofílica entre o trans-1-bromo-4-terc-butilcicloexano e o íon iodeto.
Química Orgânica Fundamental Exercícios Cap 6 6.5 Use as estruturas conformacionais em cadeira e mostre a reação de substituição nucleofílica entre o trans-1-bromo-4-terc-butilcicloexano e o íon iodeto.
Lista de Exercícios (1)
 Química rgânica Departamento de iências Naturais EBS/UNIRI 1 Lista de Exercícios (1) 1 Escrever a configuração eletrônica, mostrando o arranjo do orbital, forma e distribuição dos elétrons nos orbitais
Química rgânica Departamento de iências Naturais EBS/UNIRI 1 Lista de Exercícios (1) 1 Escrever a configuração eletrônica, mostrando o arranjo do orbital, forma e distribuição dos elétrons nos orbitais
Reações de Eliminação
 Reações de Eliminação N307 - Química Orgânica II Prof. Dr. José Nunes da Silva Jr. Objetivos da Unidade Descrever os tipos e mecanismos de reações de eliminação; Analisar o efeito da estrutura dos substratos
Reações de Eliminação N307 - Química Orgânica II Prof. Dr. José Nunes da Silva Jr. Objetivos da Unidade Descrever os tipos e mecanismos de reações de eliminação; Analisar o efeito da estrutura dos substratos
QFL 2340 Estrutura e Propriedade de Compostos Orgânicos Lista 09: Reações Orgânicas. Parte I: Noções Gerais e Adição Nucleofílica
 QFL 2340 Estrutura e Propriedade de Compostos Orgânicos - 2014 Lista 09: Reações Orgânicas Parte I: Noções Gerais e Adição Nucleofílica 1. Cada uma das moléculas abaixo são eletrofílicas, identifique o
QFL 2340 Estrutura e Propriedade de Compostos Orgânicos - 2014 Lista 09: Reações Orgânicas Parte I: Noções Gerais e Adição Nucleofílica 1. Cada uma das moléculas abaixo são eletrofílicas, identifique o
AS REAÇÕES DE ELIMINAÇÃO E1 e E2
 AS REAÇÕES DE ELIMINAÇÃO E1 e E2 As reações de substituição nucleofílica e de eliminação estão freqüentemente, competindo entre si. Exemplo: Um haleto de alquila pode reagir com um íon hidróxido (nucleófilo)
AS REAÇÕES DE ELIMINAÇÃO E1 e E2 As reações de substituição nucleofílica e de eliminação estão freqüentemente, competindo entre si. Exemplo: Um haleto de alquila pode reagir com um íon hidróxido (nucleófilo)
QFL 2340 Estrutura e Propriedade de Compostos Orgânicos Lista 08: Reações Orgânicas. Parte I: Noções Gerais e Adição Nucleofílica
 QFL 2340 Estrutura e Propriedade de Compostos Orgânicos - 2013 Lista 08: Reações Orgânicas Parte I: Noções Gerais e Adição Nucleofílica 1. Cada uma das moléculas abaixo são eletrofílicas, identifique o
QFL 2340 Estrutura e Propriedade de Compostos Orgânicos - 2013 Lista 08: Reações Orgânicas Parte I: Noções Gerais e Adição Nucleofílica 1. Cada uma das moléculas abaixo são eletrofílicas, identifique o
Revisão III Unidade Isomeria
 1 Revisão III Unidade Isomeria 1) Em relação ao ácido lático, cujas fórmulas espaciais estão representadas abaixo, estão corretas as opções, exceto: a) Possui átomo de carbono assimétrico. b) Possui atividade
1 Revisão III Unidade Isomeria 1) Em relação ao ácido lático, cujas fórmulas espaciais estão representadas abaixo, estão corretas as opções, exceto: a) Possui átomo de carbono assimétrico. b) Possui atividade
QFL 2349 Reatividade de Compostos Orgânicos II 2016 Prof. J. Wilhelm Baader Exercícios 00 Revisão 08/08/2016
 Exercícios 00 Revisão 08/08/2016 01. Uma reação química leva aos dois produtos A e B, a relação dos quais depende das condições de reação. A -60 o C os rendimentos são de 80% em A e 20% em B são formados.
Exercícios 00 Revisão 08/08/2016 01. Uma reação química leva aos dois produtos A e B, a relação dos quais depende das condições de reação. A -60 o C os rendimentos são de 80% em A e 20% em B são formados.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 3
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa correta.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 4
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Assinale a alternativa incorreta.
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 1
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 A quantidade de Na 2 CO 3.10H 2
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 A quantidade de Na 2 CO 3.10H 2
Prova 3 Química QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. QUESTÕES OBJETIVAS GABARITO 2
 Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considere que, a 25 o C, temos
Prova 3 QUESTÕES OBJETIVAS QUESTÕES APLICADAS A TODOS OS CANDIDATOS QUE REALIZARAM A PROVA ESPECÍFICA DE QUÍMICA. UEM Comissão Central do Vestibular Unificado QUÍMICA 01 Considere que, a 25 o C, temos
Química Orgânica Ambiental
 Química Orgânica Ambiental Aula 9 Estudo dos Haletos de alquila Prof. Dr. Leandro Vinícius Alves Gurgel 1. Introdução Os haletos de alquila são compostos que possuem um halogênio ligado a um grupo alquila;
Química Orgânica Ambiental Aula 9 Estudo dos Haletos de alquila Prof. Dr. Leandro Vinícius Alves Gurgel 1. Introdução Os haletos de alquila são compostos que possuem um halogênio ligado a um grupo alquila;
Responda apenas duas (02) questões referentes a área de Química Analítica
 Responda apenas duas (02) questões referentes a área de Química Analítica QUESTÃ 1 Escreva as equações químicas para estabelecimento do equilíbrio químico e calcule o ph das seguintes soluções: a- Solução
Responda apenas duas (02) questões referentes a área de Química Analítica QUESTÃ 1 Escreva as equações químicas para estabelecimento do equilíbrio químico e calcule o ph das seguintes soluções: a- Solução
Lista de Exercícios Disciplina: Mecanismos de Reações Orgânicas I
 Ministério da Educação Universidade Tecnológica Federal do Paraná ampus de uritiba Gerência de Ensino e Pesquisa Departamento de Química e Biologia Lista de Exercícios Disciplina: Mecanismos de Reações
Ministério da Educação Universidade Tecnológica Federal do Paraná ampus de uritiba Gerência de Ensino e Pesquisa Departamento de Química e Biologia Lista de Exercícios Disciplina: Mecanismos de Reações
Alcenos: estrutura, síntese e reatividade. Fundamentos de Química Orgânica Fábio Herbst Florenzano
 Alcenos: estrutura, síntese e reatividade Fundamentos de Química Orgânica Fábio Herbst Florenzano Estrutura Alcenos (e alcinos) Importância Substâncias naturais Reagentes de partida para materiais como
Alcenos: estrutura, síntese e reatividade Fundamentos de Química Orgânica Fábio Herbst Florenzano Estrutura Alcenos (e alcinos) Importância Substâncias naturais Reagentes de partida para materiais como
1ª Lista de Exercícios Química Orgânica II Prof. Marco Antonio Barbosa Ferreira
 1ª Lista de Exercícios Química Orgânica II Prof. Marco Antonio Barbosa Ferreira 1) Para os pares de reações S N 2 a seguir, indique que reação ocorre mais rápido. Explique. 2) Dois produtos de substituição
1ª Lista de Exercícios Química Orgânica II Prof. Marco Antonio Barbosa Ferreira 1) Para os pares de reações S N 2 a seguir, indique que reação ocorre mais rápido. Explique. 2) Dois produtos de substituição
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo. Álcoois, Éteres e Haletos de Alquila
 Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Álcoois, Éteres e Haletos de Alquila 1- Álcoois Álcoois são compostos que possuem um ou mais grupos hidroxila
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Álcoois, Éteres e Haletos de Alquila 1- Álcoois Álcoois são compostos que possuem um ou mais grupos hidroxila
INSTRUÇÕES PARA O DESENVOLVIMENTO DA PROVA
 Boa Vista, 30 de julho 2014. INSTRUÇÕES PARA O DESENVOLVIMENTO DA PROVA 1. Esta prova tem a duração de 4 (quatro) horas. 2. Preencha o quadro de identificação com atenção, não esquecendo de marcar a área
Boa Vista, 30 de julho 2014. INSTRUÇÕES PARA O DESENVOLVIMENTO DA PROVA 1. Esta prova tem a duração de 4 (quatro) horas. 2. Preencha o quadro de identificação com atenção, não esquecendo de marcar a área
Roteiro de Estudos Prova de Recuperação 1 Trimestre. Setor A
 Roteiro de Estudos Prova de Recuperação 1 Trimestre Nome: Ano: 3º E.M. Professor: Cassio Pacheco Setor A 1- A solubilidade do fluoreto de cálcio, a 18 C, é 2.10-5 mol/litro. Qual o produto de solubilidade
Roteiro de Estudos Prova de Recuperação 1 Trimestre Nome: Ano: 3º E.M. Professor: Cassio Pacheco Setor A 1- A solubilidade do fluoreto de cálcio, a 18 C, é 2.10-5 mol/litro. Qual o produto de solubilidade
Desenhe a estrutura espacial do gás carbônico, da amônia, do metano, do etileno, do acetileno e do benzeno.
 Exemplos de Questões de Conteúdo Geral Questão 1 Responda os seguintes itens: a) Na classificação periódica, o elemento químico de configuração [Ar] 4s 2 3d 10 4p 5 está localizado em que período? Qual
Exemplos de Questões de Conteúdo Geral Questão 1 Responda os seguintes itens: a) Na classificação periódica, o elemento químico de configuração [Ar] 4s 2 3d 10 4p 5 está localizado em que período? Qual
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 02-08/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
Revisão Específicas 1. As conchas marinhas não se dissolvem apreciavelmente na água do mar, por serem compostas, na sua maioria, de carbonato de cálcio, um sal insolúvel cujo produto de solubilidade é
6.1 CLASSIFICAÇÃO DAS REAÇÕES ORGÂNICAS
 131 6.1 CLASSIFICAÇÃO DAS REAÇÕES ORGÂNICAS Quando a ligação pi estiver entre dois carbonos, formando alcenos, a reação será de adição eletrofílica. Substratos que apresentam a ligação pi formada entre
131 6.1 CLASSIFICAÇÃO DAS REAÇÕES ORGÂNICAS Quando a ligação pi estiver entre dois carbonos, formando alcenos, a reação será de adição eletrofílica. Substratos que apresentam a ligação pi formada entre
Reações de Substituição Nucleofílica em Carbono Saturado. Aula 11
 Universidade Federal de Ouro Preto Reações de Substituição Nucleofílica em Carbono Saturado Aula 11 Flaviane Francisco Hilário 1 1 - Reação de Substituição Nucleofílica e Reação de Eliminação SUBSTITUIÇÃO
Universidade Federal de Ouro Preto Reações de Substituição Nucleofílica em Carbono Saturado Aula 11 Flaviane Francisco Hilário 1 1 - Reação de Substituição Nucleofílica e Reação de Eliminação SUBSTITUIÇÃO
Reações Orgânicas - Adição e Eliminação
 Reações Orgânicas - Adição e Eliminação Reações Orgânicas - Adição e Eliminação 1. São apresentados, abaixo, quatro compostos pertencentes a várias funções orgânicas: CH 3OH CH 3NH 2 CH 2 = CH 2 A alternativa
Reações Orgânicas - Adição e Eliminação Reações Orgânicas - Adição e Eliminação 1. São apresentados, abaixo, quatro compostos pertencentes a várias funções orgânicas: CH 3OH CH 3NH 2 CH 2 = CH 2 A alternativa
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia Sacramento Melo. REAÇÕES DE ELIMINAÇÃO Aula 13
 Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia Sacramento Melo REAÇÕES DE ELIMINAÇÃO Aula 13 Em uma reação de eliminação uma molécula (HX) é removida (eliminada) de um reagente.
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia Sacramento Melo REAÇÕES DE ELIMINAÇÃO Aula 13 Em uma reação de eliminação uma molécula (HX) é removida (eliminada) de um reagente.
Reações de Radicais Substituição Radicalar
 Reações de Radicais Substituição Radicalar 1 Formação de Radicais Halogenação e Combustão: i) Ocorrem por um mecanismo radicalar. ii) Envolvem a quebra homolítica de uma ligação. Clivagem Homolítica: Em
Reações de Radicais Substituição Radicalar 1 Formação de Radicais Halogenação e Combustão: i) Ocorrem por um mecanismo radicalar. ii) Envolvem a quebra homolítica de uma ligação. Clivagem Homolítica: Em
Lista de Exercícios 7 Reações de Substituição Nucleofílica (SN) ao carbono saturado
 Prof a. Dr a. Patrícia Bulegon ondani Lista de Exercícios 7 Reações de Substituição Nucleofílica (SN) ao carbono saturado 1. Qual o produto da reação do íon cianeto, relação molar com substrato 1:1, frente
Prof a. Dr a. Patrícia Bulegon ondani Lista de Exercícios 7 Reações de Substituição Nucleofílica (SN) ao carbono saturado 1. Qual o produto da reação do íon cianeto, relação molar com substrato 1:1, frente
Definição: São compostos derivados dos hidrocarbonetos pela substituição de um ou mais hidrogênios por igual número de halogênios (F, Cl, Br e I)
 QUÍMICA ORGÂNICA Definição: São compostos derivados dos hidrocarbonetos pela substituição de um ou mais hidrogênios por igual número de halogênios (F, Cl, Br e I) Exemplos: Algumas Propriedades Físicas
QUÍMICA ORGÂNICA Definição: São compostos derivados dos hidrocarbonetos pela substituição de um ou mais hidrogênios por igual número de halogênios (F, Cl, Br e I) Exemplos: Algumas Propriedades Físicas
Aula 7. Organic Chemistry 4 th Edition Paula Yurkanis Bruice. Reações de Eliminação de Haletos de Alquila. Reações de Álcoois e Éteres
 Organic Chemistry 4 th Edition Paula Yurkanis Bruice Aula 7 Reações de Eliminação de Haletos de Alquila Reações de Álcoois e Éteres Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice
Organic Chemistry 4 th Edition Paula Yurkanis Bruice Aula 7 Reações de Eliminação de Haletos de Alquila Reações de Álcoois e Éteres Irene Lee Case Western Reserve University Cleveland, OH 2004, Prentice
 Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Entrada no Curso de Mestrado do PPGQ-UFRN 2011.2 Instruções 1. Não identifique sua prova.
Universidade Federal do Rio Grande do Norte Instituto de Química Programa de Pós-Graduação em Química Concurso para Entrada no Curso de Mestrado do PPGQ-UFRN 2011.2 Instruções 1. Não identifique sua prova.
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
7.1 CISÃO E FORMAÇÃO DE LIGAÇÃO NO MECANISMO POLAR
 163 7.1 CISÃO E FORMAÇÃO DE LIGAÇÃO NO MECANISMO POLAR Para que uma reação orgânica ocorra, é necessário que haja rompimento nas ligações químicas envolvidas na estrutura das moléculas do substrato e do
163 7.1 CISÃO E FORMAÇÃO DE LIGAÇÃO NO MECANISMO POLAR Para que uma reação orgânica ocorra, é necessário que haja rompimento nas ligações químicas envolvidas na estrutura das moléculas do substrato e do
Programa Analítico de Disciplina QUI131 Química Orgânica I
 0 Programa Analítico de Disciplina Departamento de Química - Centro de Ciências Exatas e Tecnológicas Número de créditos: 4 Teóricas Práticas Total Duração em semanas: 15 Carga horária semanal 4 0 4 Períodos
0 Programa Analítico de Disciplina Departamento de Química - Centro de Ciências Exatas e Tecnológicas Número de créditos: 4 Teóricas Práticas Total Duração em semanas: 15 Carga horária semanal 4 0 4 Períodos
Formação de Radicais. Halogenação e Combustão: i) Ocorrem por um mecanismo radicalar. Envolvem a quebra homolítica de uma ligação.
 Reações de Radicais Substituição Radicalar 1 Formação de Radicais Halogenação e Combustão: i) Ocorrem por um mecanismo radicalar. ii) Envolvem a quebra homolítica de uma ligação. Clivagem Homolítica: Em
Reações de Radicais Substituição Radicalar 1 Formação de Radicais Halogenação e Combustão: i) Ocorrem por um mecanismo radicalar. ii) Envolvem a quebra homolítica de uma ligação. Clivagem Homolítica: Em
PPGQTA. Prof. MGM D Oca
 PPGQTA Prof. MGM D Oca Adição e Eliminação A Reação de Eliminação envolve a remoção de dois grupos adjacentes (vicinais) para formar uma nova ligação dupla. A Reação de Adição envolve a inclusão o de grupos
PPGQTA Prof. MGM D Oca Adição e Eliminação A Reação de Eliminação envolve a remoção de dois grupos adjacentes (vicinais) para formar uma nova ligação dupla. A Reação de Adição envolve a inclusão o de grupos
Reações de Radicais Substituição Radicalar
 Reações de Radicais Substituição Radicalar 1 Formação de Radicais Halogenação e Combustão: i) Ocorrem por um mecanismo radicalar ii) Envolvem a quebra homolítica de uma ligação Clivagem Homolítica: Em
Reações de Radicais Substituição Radicalar 1 Formação de Radicais Halogenação e Combustão: i) Ocorrem por um mecanismo radicalar ii) Envolvem a quebra homolítica de uma ligação Clivagem Homolítica: Em
LISTA DE EXERCÍCIO PARA A PROVA MENSAL. 3 Ano
 Setor A LISTA DE EXERCÍCIO PARA A PROVA MENSAL 3 Ano 1- O ph do suco gástrico, uma solução aquosa de ácido clorídrico (HCl), é, aproximadamente, 2. Portanto, a massa, em gramas, de HCl existente em cada
Setor A LISTA DE EXERCÍCIO PARA A PROVA MENSAL 3 Ano 1- O ph do suco gástrico, uma solução aquosa de ácido clorídrico (HCl), é, aproximadamente, 2. Portanto, a massa, em gramas, de HCl existente em cada
ESCOLA SECUNDÁRIA PINHAL DO REI FICHA FORMATIVA 2ºTESTE
 Ano Letivo 2016/2017 ESCOLA SECUNDÁRIA PINHAL DO REI FICHA FORMATIVA 2ºTESTE Física e Química A 10ºAno 1. A energia dos eletrões nos átomos inclui: (A) apenas o efeito das atrações entre os eletrões e
Ano Letivo 2016/2017 ESCOLA SECUNDÁRIA PINHAL DO REI FICHA FORMATIVA 2ºTESTE Física e Química A 10ºAno 1. A energia dos eletrões nos átomos inclui: (A) apenas o efeito das atrações entre os eletrões e
1) Escrever as estruturas de Lewis para cada um dos seguintes compostos: (h) H 2 CO 3
 1ªLista de Exercícios QUI147 e 153 2014 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Disciplina: Química Orgânica Ambiental (QUI153) Professor Leandro
1ªLista de Exercícios QUI147 e 153 2014 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Disciplina: Química Orgânica Ambiental (QUI153) Professor Leandro
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA
 PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
PROVA ESCRITA DE CONHECIMENTOS EM QUÍMICA INFORMAÇÕES IMPORTANTES: - IDENTIFIQUE TODAS AS FOLHAS DESTA PROVA COM SEU NÚMERO DE INSCRIÇÃO. Obs.: EM HIPÓTESE NENHUMA USE SEU NOME NAS FOLHAS COMO IDENTIFICAÇÃO.
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo
 Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Reações de Substituição Nucleofílica Alifática Aula 14 Substratos: Haletos de alquila, Álcoois, Haletos de
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Reações de Substituição Nucleofílica Alifática Aula 14 Substratos: Haletos de alquila, Álcoois, Haletos de
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA. Exame de Seleção para o Mestrado em Química-2011.
 UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
UNIVERSIDADE FEDERAL DA BAHIA INSTITUTO DE QUÍMICA PROGRAMA DE PÓS GRADUAÇÃO EM QUÍMICA Exame de Seleção para o Mestrado em Química-2011.2 PROVA DE QUÍMICA CÓDIGO do CANDIDATO: INSTRUÇÕES: Confira o caderno
Reações de Eliminação. Aula 10
 Universidade Federal de Ouro Preto Reações de Eliminação Aula 10 Flaviane Francisco Hilário 1 1 - Reações de Eliminação O produto é um alqueno. um alqueno 2-metilpropeno 2 Também chamada de eliminação
Universidade Federal de Ouro Preto Reações de Eliminação Aula 10 Flaviane Francisco Hilário 1 1 - Reações de Eliminação O produto é um alqueno. um alqueno 2-metilpropeno 2 Também chamada de eliminação
6.1 REATIVIDADE DOS ALCENOS
 146 6.1 REATIVIDADE DOS ALCENOS Os alcenos são compostos orgânicos, que apresentam em suas estruturas carbonos sp 2 responsáveis pela formação da ligação pi. Uma das características da ligação π é o fenômeno
146 6.1 REATIVIDADE DOS ALCENOS Os alcenos são compostos orgânicos, que apresentam em suas estruturas carbonos sp 2 responsáveis pela formação da ligação pi. Uma das características da ligação π é o fenômeno
Quí. Monitor: Gabriel Pereira
 Quí. Professor: Xandão Monitor: Gabriel Pereira Reação orgânica: Reação de eliminação (exercícios) 09 out EXERCÍCIOS DE AULA 1. Quando o -bromopentano sofre reação de eliminação, os produtos A e B, abaixo,
Quí. Professor: Xandão Monitor: Gabriel Pereira Reação orgânica: Reação de eliminação (exercícios) 09 out EXERCÍCIOS DE AULA 1. Quando o -bromopentano sofre reação de eliminação, os produtos A e B, abaixo,
UNIPAC Universidade Presidente Antônio Carlos Juiz de Fora
 PLANO DE ENSINO FACULDADE: Ciências da Saúde de Juiz de Fora CURSO: Farmácia Período: 2º DISCIPLINA: Química Orgânica Ano: CARGA HORÁRIA: 120h PRÉ-REQUISITO: - EMENTA Estrutura e ligações químicas em moléculas
PLANO DE ENSINO FACULDADE: Ciências da Saúde de Juiz de Fora CURSO: Farmácia Período: 2º DISCIPLINA: Química Orgânica Ano: CARGA HORÁRIA: 120h PRÉ-REQUISITO: - EMENTA Estrutura e ligações químicas em moléculas
UFSC. Resposta: = 40. Comentário
 Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
Resposta: 08 + 32 = 40 01. Incorreta. O butano não possui isomeria óptica, pois não possui carbono assimétrico. 02. Incorreta. Ao serem liberados para a atmosfera os gases sofrem expansão de volume. 04.
X δ. X=F,Cl,Br,I. Substituição RCH 2 CH 2 Y + X - Eliminação RHC CH 2 + HY + X -
 Reações de aletos de Alquila O átomo de halogênio de um haleto de alquila é ligado a um carbono hibridizado em sp 3. Por isso, a disposição dos grupos em torno do átomo de carbono é normalmente tetraédrica.
Reações de aletos de Alquila O átomo de halogênio de um haleto de alquila é ligado a um carbono hibridizado em sp 3. Por isso, a disposição dos grupos em torno do átomo de carbono é normalmente tetraédrica.
Química Orgânica. 1- Substituição substituição nucleofílica alifática
 Química Orgânica 1- Substituição substituição nucleofílica alifática 1 Índice reações de S N 2 reações de S N 1 comparação entre S N 2 e S N 1 concorrência entre S N e eliminação Literatura recomendada
Química Orgânica 1- Substituição substituição nucleofílica alifática 1 Índice reações de S N 2 reações de S N 1 comparação entre S N 2 e S N 1 concorrência entre S N e eliminação Literatura recomendada
Atividades de Recuperação Paralela de Química A
 Atividades de Recuperação Paralela de Química A 3ª série Ensino Médio. Conteúdos para estudos: Setor A: calcular ph e poh de soluções; equacionar hidrólises de sais ácidos e básicos; calcular a solubilidade
Atividades de Recuperação Paralela de Química A 3ª série Ensino Médio. Conteúdos para estudos: Setor A: calcular ph e poh de soluções; equacionar hidrólises de sais ácidos e básicos; calcular a solubilidade
Simulação da Prova para o ingresso na Pós-graduação
 Simulação da Prova para o ingresso na Pós-graduação A prova consiste de 20 questões dissertativas e têm duração de 3 horas. Atenção - Deverão ser respondidas: as quatro questões GERAIS DE CONHECIMENTOS
Simulação da Prova para o ingresso na Pós-graduação A prova consiste de 20 questões dissertativas e têm duração de 3 horas. Atenção - Deverão ser respondidas: as quatro questões GERAIS DE CONHECIMENTOS
ESCOLA SECUNDÁRIA DE SANTA MARIA MAIOR E QUÍMICA A 10ºANO (2015/2016)
 ESCOLA SECUNDÁRIA DE SANTA MARIA MAIOR FÍSICA E QUÍMICA A 10ºANO (2015/2016) Ficha de Trabalho nº 2.1 Domínio 2: Propriedades e Transformações da Matéria Subdomínioo 4: Ligações químicas 1. Na figura está
ESCOLA SECUNDÁRIA DE SANTA MARIA MAIOR FÍSICA E QUÍMICA A 10ºANO (2015/2016) Ficha de Trabalho nº 2.1 Domínio 2: Propriedades e Transformações da Matéria Subdomínioo 4: Ligações químicas 1. Na figura está
SERVIÇO PÚBLICO FEDERAL MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE RORAIMA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 SERVIÇO PÚBLICO FEDERAL MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE RORAIMA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA Boa Vista, 17 de julho de 2015. INSTRUÇÕES PARA O DESENVOLVIMENTO DA PROVA 1. Esta prova
SERVIÇO PÚBLICO FEDERAL MINISTÉRIO DA EDUCAÇÃO UNIVERSIDADE FEDERAL DE RORAIMA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA Boa Vista, 17 de julho de 2015. INSTRUÇÕES PARA O DESENVOLVIMENTO DA PROVA 1. Esta prova
REAÇÕES ORGÂNICAS. Prof: WELLINGTON DIAS
 REAÇÕES ORGÂNICAS Prof: WELLINGTON DIAS REAÇÕES ORGÂNICAS 1. REAÇÕES DE SUBSTITUIÇÃO. 1.1. ALCANOS: Por serem apolares sofrem cisão homolítica e a reação ocorre por meio de radicais livres. EXEMPLO: Halogenação
REAÇÕES ORGÂNICAS Prof: WELLINGTON DIAS REAÇÕES ORGÂNICAS 1. REAÇÕES DE SUBSTITUIÇÃO. 1.1. ALCANOS: Por serem apolares sofrem cisão homolítica e a reação ocorre por meio de radicais livres. EXEMPLO: Halogenação
Alcoóis. -Nomenclatura IUPAC: Quantidade de C + tipo de ligação entre C + ol. Ex: Butan-2-ol. Fenóis
 Ácidos e Base -Numa reação entre um ácido e uma base, o ácido atua como o doador de prótons e a base como o aceptor de prótons. O íon H + é considerado um próton, então na reação o ácido perde um H + e
Ácidos e Base -Numa reação entre um ácido e uma base, o ácido atua como o doador de prótons e a base como o aceptor de prótons. O íon H + é considerado um próton, então na reação o ácido perde um H + e
Reações de Substituição Nucleofílica Acílica
 Reações de Substituição Nucleofílica Acílica Estas reações ocorrem em compostos carbonilados possuidores de um grupo que pode servir como grupo abandonador. Estes compostos são os chamados derivados de
Reações de Substituição Nucleofílica Acílica Estas reações ocorrem em compostos carbonilados possuidores de um grupo que pode servir como grupo abandonador. Estes compostos são os chamados derivados de
Prof a. Dr a. Patrícia Bulegon Brondani. Lista de Exercícios 3- Acidez e basicidade
 1. Completar a tabela abaixo: Lista de Exercícios 3- Acidez e basicidade Ácido Fórmula pka Base conjugada Etano C 3 C 3 50 Eteno 2 C=C 2 45 Amônia 3 30 Acetileno 27 C C Etanol C 3 C 2 16 Água 2 15,7 Fenol
1. Completar a tabela abaixo: Lista de Exercícios 3- Acidez e basicidade Ácido Fórmula pka Base conjugada Etano C 3 C 3 50 Eteno 2 C=C 2 45 Amônia 3 30 Acetileno 27 C C Etanol C 3 C 2 16 Água 2 15,7 Fenol
QB70C:// Química (Turmas S71/S72) Ácidos e Bases. Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 11 Atkins (5ed.
 QB70C:// Química (Turmas S71/S72) Ácidos e Bases Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 11 Atkins (5ed.) Pai, o que é chuva ácida? NaO idróxido de magnésio Mg(O)
QB70C:// Química (Turmas S71/S72) Ácidos e Bases Prof. Dr. Eduard Westphal (http://paginapessoal.utfpr.edu.br/eduardw) Capítulo 11 Atkins (5ed.) Pai, o que é chuva ácida? NaO idróxido de magnésio Mg(O)
PROVA DE INGRESSO NO CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: segundo semestre de 2007
 UIVERSIDADE FEDERAL DO PARAÁ DEPARTAMETO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE IGRESSO O CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: segundo semestre de 2007 09 de Julho
UIVERSIDADE FEDERAL DO PARAÁ DEPARTAMETO DE QUÍMICA PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PROVA DE IGRESSO O CURSO DE MESTRADO ACADÊMICO EM QUÍMICA PROCESSO DE SELEÇÃO: segundo semestre de 2007 09 de Julho
Exercíciosde Funções Orgânicas 1) Identifique as funções químicas presentes em cada uma das estruturas seguintes. Faça um círculo e dê o nome da
 Exercíciosde Funções Orgânicas 1) Identifique as funções químicas presentes em cada uma das estruturas seguintes. Faça um círculo e dê o nome da função. REVISÃO DE ISOMERIA PLANA E GEOMETRICA 1) Indique
Exercíciosde Funções Orgânicas 1) Identifique as funções químicas presentes em cada uma das estruturas seguintes. Faça um círculo e dê o nome da função. REVISÃO DE ISOMERIA PLANA E GEOMETRICA 1) Indique
Os sais são neutros, ácidos ou básicos? Íons como Ácidos e Bases
 Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
Os sais são neutros, ácidos ou básicos? Sais são compostos iônicos formados pela reação entre um ácido e uma base. 1. NaCl Na + é derivado de NaOH, uma base forte Cl é derivado do HCl, um ácido forte NaCl
QUÍMICA ORGÂNICA Reações Orgânicas - Substituição Prof. Jackson Alves
 QUÍMICA ORGÂNICA Reações Orgânicas - Substituição Prof. Jackson Alves Reações de Substituição Reações características de compostos saturados (alcanos, haletos de alquila) e compostos aromáticos. um grupo
QUÍMICA ORGÂNICA Reações Orgânicas - Substituição Prof. Jackson Alves Reações de Substituição Reações características de compostos saturados (alcanos, haletos de alquila) e compostos aromáticos. um grupo
QUÍMICA. Qual será o efeito na velocidade desta reação no caso de triplicarmos a concentração molar de ácido clorídrico?
 NÚMER DE INSRIÇÃ! - QUÍMIA QUESTÃ 11 Ao expressarmos uma equação de velocidade para a reação, Al(H) 3 + 3 Hl All 3 + 3H 2 Qual será o efeito na velocidade desta reação no caso de triplicarmos a concentração
NÚMER DE INSRIÇÃ! - QUÍMIA QUESTÃ 11 Ao expressarmos uma equação de velocidade para a reação, Al(H) 3 + 3 Hl All 3 + 3H 2 Qual será o efeito na velocidade desta reação no caso de triplicarmos a concentração
Gabaritos Resolvidos Energia Química Semiextensivo V4 Frente E
 01) D A preferência de substituição obedece a ordem: C terciário C secundário C primário. A halogenação de um alcano se dá por substituição de um átomo de hidrogênio por um halogênio, resultando em um
01) D A preferência de substituição obedece a ordem: C terciário C secundário C primário. A halogenação de um alcano se dá por substituição de um átomo de hidrogênio por um halogênio, resultando em um
Resumo das aulas de Química Orgânica II
 Resumo das aulas de Química rgânica II aloalcanos aloalcanos sp 3 C X p alometano C 3 F C 3 C 3 C 3 I Comprimento da ligação (A o ) 1,385 1,784 1,929 2,139 Energia da ligação (Kcal/mol) 110 85 71 57 SN
Resumo das aulas de Química rgânica II aloalcanos aloalcanos sp 3 C X p alometano C 3 F C 3 C 3 C 3 I Comprimento da ligação (A o ) 1,385 1,784 1,929 2,139 Energia da ligação (Kcal/mol) 110 85 71 57 SN
Reações em Aromáticos
 Reações em Aromáticos 01 (Unicamp-SP) Um dos átomos de hidrogênio do anel benzênico pode ser substituído por CH3, OH, Cℓ ou COOH. a) Escreva as fórmulas e os nomes dos derivados benzênicos obtidos por
Reações em Aromáticos 01 (Unicamp-SP) Um dos átomos de hidrogênio do anel benzênico pode ser substituído por CH3, OH, Cℓ ou COOH. a) Escreva as fórmulas e os nomes dos derivados benzênicos obtidos por
PROVA DE INGRESSO ANO LETIVO 2018/2019 PROVA DE QUÍMICA OBJETIVOS
 UNIVERSIDADE DE CABO VERDE PROVA DE INGRESSO ANO LETIVO 2018/2019 PROVA DE QUÍMICA OBJETIVOS OBJETIVOS Reconhecer o átomo de hidrogénio como átomo mais simples. Conhecer o espetro de emissão de hidrogénio.
UNIVERSIDADE DE CABO VERDE PROVA DE INGRESSO ANO LETIVO 2018/2019 PROVA DE QUÍMICA OBJETIVOS OBJETIVOS Reconhecer o átomo de hidrogénio como átomo mais simples. Conhecer o espetro de emissão de hidrogénio.
Reações de Oxidação e Substituição. Karla Gomes Diamantina-MG
 Reações de Oxidação e Substituição Karla Gomes Diamantina-MG Reações de oxidação Envolvem aumento no estado de oxidação (Nox) dos átomos presentes em uma molécula. De forma geral: Substância orgânica (redutora)
Reações de Oxidação e Substituição Karla Gomes Diamantina-MG Reações de oxidação Envolvem aumento no estado de oxidação (Nox) dos átomos presentes em uma molécula. De forma geral: Substância orgânica (redutora)
PSVS/UFES 2014 MATEMÁTICA 1ª QUESTÃO. O valor do limite 2ª QUESTÃO. O domínio da função real definida por 3ª QUESTÃO
 MATEMÁTICA 1ª QUESTÃO O valor do limite 3 x 8 lim é x 2 x 2 2ª QUESTÃO O domínio da função real definida por é 3ª QUESTÃO A imagem da função real definida por, para todo, é GRUPO 2 PROVA DE MATEMÁTICA
MATEMÁTICA 1ª QUESTÃO O valor do limite 3 x 8 lim é x 2 x 2 2ª QUESTÃO O domínio da função real definida por é 3ª QUESTÃO A imagem da função real definida por, para todo, é GRUPO 2 PROVA DE MATEMÁTICA
QUIMICA ORGÂNICA A. Analisando Reações Orgânicas e seus Intermediários
 QUIMICA ORGÂNICA A Analisando Reações Orgânicas e seus Intermediários Prof. Antonio Luiz Braga braga.antonio@ufsc.br 1 Intermedíarios de Reações Mecanismos de Reações 2 1 Intermedíarios de Reações Nucleófilos
QUIMICA ORGÂNICA A Analisando Reações Orgânicas e seus Intermediários Prof. Antonio Luiz Braga braga.antonio@ufsc.br 1 Intermedíarios de Reações Mecanismos de Reações 2 1 Intermedíarios de Reações Nucleófilos
Relatório sobre as atividades desenvolvidas
 QFL-5925 Prática de Ensino de Química e Bioquímica Aluno: Anderson Melo Gaia n USP 5195946 Docente: Profª Denise Freitas S. Petri Disciplina de monitoria: QFL-0342 Química Orgânica II Professora responsável:
QFL-5925 Prática de Ensino de Química e Bioquímica Aluno: Anderson Melo Gaia n USP 5195946 Docente: Profª Denise Freitas S. Petri Disciplina de monitoria: QFL-0342 Química Orgânica II Professora responsável:
Q.02 Considere uma solução aquosa diluída de dicromato de potássio, a 25 ºC. Dentre os equilíbrios que estão presentes nessa solução, destacam-se:
 Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
Q.01 Íons indesejáveis podem ser removidos da água, tratando-a com resinas de troca iônica, que são constituídas por uma matriz polimérica, à qual estão ligados grupos que podem reter cátions ou ânions.
H 2 C OCH 3 H 2 C OH EXERCÍCIOS DE CLASSE
 EXERCÍCIOS DE CLASSE 1- De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: COMPOSTO PESO MOLECULAR
EXERCÍCIOS DE CLASSE 1- De um modo geral, o ponto de ebulição dos compostos orgânicos cresce com o aumento do peso molecular, o que não acontece com os compostos do quadro abaixo: COMPOSTO PESO MOLECULAR
X X. Calor ou Luz. Calor R O O R. Exemplo 1: Peróxidos. Exemplo 2: Halogênios. Universidade Federal Rural do Semi Árido UFERSA. 1. Reações de Alcanos
 1. Reações de Alcanos Os alcanos são caracterizados por apresentar pouca reatividade a muitos reagentes químicos. As ligações carbono carbono e hidrogênio hidrogênio são bastante fortes; elas não quebram,
1. Reações de Alcanos Os alcanos são caracterizados por apresentar pouca reatividade a muitos reagentes químicos. As ligações carbono carbono e hidrogênio hidrogênio são bastante fortes; elas não quebram,
4. Ácidos e Bases em Química Orgânica
 4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
4. Ácidos e Bases em Química Orgânica Leitura Recomendada: Organic Chemistry, J. Clayden, N. Greeves, S. Warren, P. Wothers, Oxford, Oxford, 2001, cap. 8. Compreender aspectos de acidez e basicidade é
Índice. reações de S N 2. reações de S N 1. comparação entre S N 2 e S N 1. concorrência entre S N e eliminação
 Química Orgânica Substituição substituição nucleofílica alifática 1 Índice reações de S N 2 reações de S N 1 comparação entre S N 2 e S N 1 concorrência entre S N e eliminação Literatura recomendada Clayden,
Química Orgânica Substituição substituição nucleofílica alifática 1 Índice reações de S N 2 reações de S N 1 comparação entre S N 2 e S N 1 concorrência entre S N e eliminação Literatura recomendada Clayden,
1.1. REAÇÃO DE SUBSTITUIÇÃO CARACTERÍSTICA DE COMPOSTOS SATURADOS ( ALCANOS E HALETOS ORGÂNICOS) C A + B X C B + A X
 1.1. REAÇÃO DE SUBSTITUIÇÃO CARACTERÍSTICA DE COMPOSTOS SATURADOS ( ALCANOS E HALETOS ORGÂNICOS) C A + B X C B + A X 1.1.1. SUBSTITUIÇÃO EM ALCANOS ( APOLARES SOFREM CISÃO HOMOLÍTICA) SUBSTITUIÇÃO POR
1.1. REAÇÃO DE SUBSTITUIÇÃO CARACTERÍSTICA DE COMPOSTOS SATURADOS ( ALCANOS E HALETOS ORGÂNICOS) C A + B X C B + A X 1.1.1. SUBSTITUIÇÃO EM ALCANOS ( APOLARES SOFREM CISÃO HOMOLÍTICA) SUBSTITUIÇÃO POR
PPGQTA. Prof. MGM D Oca
 PPGQTA Prof. Compostos Carbonílicos O grupo carbonila é um dos mais importantes grupos funcionais e está envolvido em muitas reações. Reações envolvendo grupos carbonila também são particularmente importantes
PPGQTA Prof. Compostos Carbonílicos O grupo carbonila é um dos mais importantes grupos funcionais e está envolvido em muitas reações. Reações envolvendo grupos carbonila também são particularmente importantes
Compostos Carbonílicos I (Ácidos carboxílicos e seus derivados) Aula 2
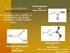 Universidade Federal de Ouro Preto Compostos Carbonílicos I (Ácidos carboxílicos e seus derivados) Aula 2 Flaviane Francisco Hilário 1 1 Haletos de acila 1.1 - Preparação 2 O objetivo é converter o grupo
Universidade Federal de Ouro Preto Compostos Carbonílicos I (Ácidos carboxílicos e seus derivados) Aula 2 Flaviane Francisco Hilário 1 1 Haletos de acila 1.1 - Preparação 2 O objetivo é converter o grupo
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo. Álcoois, Éteres e Haletos de Alquila Aula 8
 Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Álcoois, Éteres e Haletos de Alquila Aula 8 1- Álcoois: Álcoois são compostos que possuem um ou mais grupos
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Álcoois, Éteres e Haletos de Alquila Aula 8 1- Álcoois: Álcoois são compostos que possuem um ou mais grupos
HIDROCARBONETOS FUNÇÕES ORGÂNICAS
 HIDROCARBONETOS FUNÇÕES ORGÂNICAS FUNÇÕES ORGÂNICAS O átomo de carbono: Apresenta capacidade singular de compartilhar elétrons com outros átomos de carbono formando ligações carbono-carbono estáveis. Permite
HIDROCARBONETOS FUNÇÕES ORGÂNICAS FUNÇÕES ORGÂNICAS O átomo de carbono: Apresenta capacidade singular de compartilhar elétrons com outros átomos de carbono formando ligações carbono-carbono estáveis. Permite
EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
 EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2015 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. É expressamente proibido assinar ou fazer qualquer
EXAME DE CAPACIDADE PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA PRIMEIRO SEMESTRE, 2015 NOME COMPLETO INSTRUÇÕES Escreva seu nome de forma legível no espaço acima. É expressamente proibido assinar ou fazer qualquer
MGM D Oca Adição e Eliminação. Adição: (GRADUAÇÃO)
 MGM D Oca Adição e Eliminação Adição: MATERIAL SUPLEMENTAR (GRADUAÇÃO) UNIVERSIDADE FEDERAL DO RIO GRANDE - FURG ESCOLA DE QUÍMICA E ALIMENTOS Reações dos Alcenos (R 2 C=CR 2 ) Disciplina Química Orgânica
MGM D Oca Adição e Eliminação Adição: MATERIAL SUPLEMENTAR (GRADUAÇÃO) UNIVERSIDADE FEDERAL DO RIO GRANDE - FURG ESCOLA DE QUÍMICA E ALIMENTOS Reações dos Alcenos (R 2 C=CR 2 ) Disciplina Química Orgânica
Reações Orgânicas - 1
 Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Reações Orgânicas - 1 1. (Fuvest 1995) O composto A, B e C são alcenos em que os átomos ou grupos de átomos estão
Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Reações Orgânicas - 1 1. (Fuvest 1995) O composto A, B e C são alcenos em que os átomos ou grupos de átomos estão
ALQUENOS - REVISÃO. Bruice, P Vol. 1 cap.3 e 6 Carey Vol. 1 cap. 6 e 9
 ALQUENOS - REVISÃO Bruice, P Vol. 1 cap.3 e 6 arey Vol. 1 cap. 6 e 9 São compostos insaturados que possuem como grupo funcional o =. Estes compostos são ricos em elétrons, portanto reagem com reagentes
ALQUENOS - REVISÃO Bruice, P Vol. 1 cap.3 e 6 arey Vol. 1 cap. 6 e 9 São compostos insaturados que possuem como grupo funcional o =. Estes compostos são ricos em elétrons, portanto reagem com reagentes
b) Atribua as designações R ou S para todos os carbonos estereogênicos dessa molécula. (3,5 pontos)
 1 a Questão (10 pontos) obrigatória a) Circule todos os grupos funcionais heteroatômicos (grupos funcionais que não são hidrocarbonetos) dessa molécula e indique os respectivos nomes. (3,5 pontos) b) Atribua
1 a Questão (10 pontos) obrigatória a) Circule todos os grupos funcionais heteroatômicos (grupos funcionais que não são hidrocarbonetos) dessa molécula e indique os respectivos nomes. (3,5 pontos) b) Atribua
Prof. Hugo Braibante Química - UFSM
 Prof. Hugo Braibante Química - UFSM estereoquímica Conceitos Forma tridimensional das moléculas Moléculas como objeto-imagens Moléculas com simetria Separação de Enantiômeros Diastereoisômeros Atividade
Prof. Hugo Braibante Química - UFSM estereoquímica Conceitos Forma tridimensional das moléculas Moléculas como objeto-imagens Moléculas com simetria Separação de Enantiômeros Diastereoisômeros Atividade
O que você deve saber sobre REAÇÕES ORGÂNICAS
 O que você deve saber sobre São reações químicas que ocorrem com compostos orgânicos, e normalmente são lentas. Para que haja uma reação, é necessária a quebra das ligações moleculares dos reagentes. Tais
O que você deve saber sobre São reações químicas que ocorrem com compostos orgânicos, e normalmente são lentas. Para que haja uma reação, é necessária a quebra das ligações moleculares dos reagentes. Tais
Química Orgânica 3 Lista de exercícios Substituição eletrofílica Aromática e Nucleofilica aromática
 Ministério da Educação Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Química Orgânica 3 Lista de exercícios Substituição eletrofílica Aromática e Nucleofilica
Ministério da Educação Universidade Tecnológica Federal do Paraná Departamento Acadêmico de Química e Biologia Química Orgânica 3 Lista de exercícios Substituição eletrofílica Aromática e Nucleofilica
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
Prof. Luiz F. Silva Jr - IQ-USP
 8.1. Considerações Gerais 8.2. Reações de Adição Nucleofílica 8.3. Reações de Adição/Eliminação 8.4. Reações de Substituição Nucleofílica Alifática e de Eliminação 8.5. Reações de Adição Eletrofílica 8.6.
8.1. Considerações Gerais 8.2. Reações de Adição Nucleofílica 8.3. Reações de Adição/Eliminação 8.4. Reações de Substituição Nucleofílica Alifática e de Eliminação 8.5. Reações de Adição Eletrofílica 8.6.
PROVA PARA INGRESSO NO MESTRADO. Programa de Pós Graduação em Química 14/06/2017 NOME
 PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 14/06/2017 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
PROVA PARA INGRESSO NO MESTRADO Programa de Pós Graduação em Química 14/06/2017 NOME Instruções para a prova: Coloque seu nome nesta folha antes de continuar; Marcar com um X, no quadro abaixo, as questões
Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA. Seleção 2019/1
 Seleção 2019/2 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO.
Seleção 2019/2 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO.
OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela
![OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela OQ-SP 2012 Exame da Fase Final Nota parcial. Série: 2ª ou 3ª; Ingresso: Redação Fuvest ORRP TVQ; Senha [ ] Parte I Experimentos de combustão da vela](/thumbs/70/62007377.jpg) 1 Parte I Experimentos de combustão da vela I.1 Seria o consumo de oxigênio o fator determinante da subida do nível da água no Erlenmeyer no experimento I.1, ou há nos experimentos 1 e 2 evidências que
1 Parte I Experimentos de combustão da vela I.1 Seria o consumo de oxigênio o fator determinante da subida do nível da água no Erlenmeyer no experimento I.1, ou há nos experimentos 1 e 2 evidências que
com o oxigênio, formando o trióxido de enxofre (SO 3 ), e deste com a água, resultando no H 2
 11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
11 Em 2004 iniciou-se, no Brasil, a exploração de uma importante jazida de minério de cobre. Nestes minérios, o metal é normalmente encontrado na forma de sulfetos, como o CuS, e para sua obtenção o minério
~ 1 ~ PARTE 1 QUESTÕES DE ESCOLHA SIMPLES
 Questão 03: Os alimentos são constituídos de diversos nutrientes e minerais. Considerando substâncias bioquímicas, algumas predominam mais que outras nos alimentos. Baseado nessa ideia faça uma associação
Questão 03: Os alimentos são constituídos de diversos nutrientes e minerais. Considerando substâncias bioquímicas, algumas predominam mais que outras nos alimentos. Baseado nessa ideia faça uma associação
REAÇÕES ORGÂNICAS. Ruptura ou cisão de ligações: Cisão homolítica: Cisão heterolítica:
 REAÇÕES ORGÂNICAS Ruptura ou cisão de ligações: Cisão homolítica: Cisão heterolítica: Classificação dos reagentes: Eletrófilos: Recebem um par de elétrons. Deficientes em elétrons. Ácidos de Lewis, agentes
REAÇÕES ORGÂNICAS Ruptura ou cisão de ligações: Cisão homolítica: Cisão heterolítica: Classificação dos reagentes: Eletrófilos: Recebem um par de elétrons. Deficientes em elétrons. Ácidos de Lewis, agentes
