A equação de Schrödinger é uma equação que descreve como um estado quântico, ψ(r,t), de um sistema físico muda com o tempo.
|
|
|
- Benedicto Klettenberg Marreiro
- 7 Há anos
- Visualizações:
Transcrição
1 2 Mecânica Quântica A Mecânica Quântica é a descrição matemática do comportamento dos elétrons, e com isso, dos sistemas químicos. Enquanto que a mecânica clássica é aplicável à partículas macroscópicas, a mecânica quântica é necessária quando tratamos de partículas microscópicas. Na mecânica clássica é possível determinar a posição e velocidade de cada partícula do sistema num dado instante, entretanto, o princípio de Heisenberg mostra que não é possível determinar, simultaneamente, a posição exata e a velocidade de uma partícula microscópica. Para descrever o estado de um sistema na mecânica quântica, postula-se a existência de uma função de coordenadas chamada de função de onda Ψ, que é uma função do tempo (Ψ = Ψ(x,t)). A função de onda contém todas as informações possíveis sobre o sistema. A partir dela pode-se descrever um estado quântico e estudar sistemas moleculares poliatômicos resolvendo-se a equação de Shrödinger para tais sistemas. 39 Um grande número de métodos tem sido desenvolvido para uma solução aproximada da equação de Shrödinger para sistemas com muitos elétrons. A maioria destes métodos baseia-se no método de Hartree-Fock (HF), porém, nesse método só se leva em consideração parte da correlação eletrônica, o que impõe a necessidade de se utilizar métodos pós-hf. A energia calculada pelo método HF possui erros por volta de 1%, o que é relativamente alto quando comparado à energia de uma ligação, que é por volta de 100 kcal mol 1. Esse erro é corrigido quando consideramos as interações instantâneas entre os elétrons, que é chamada de correlação eletrônica. 39 Existem vários métodos que foram desenvolvidos a partir do HF, onde o termo de correlação eletrônica foi introduzida no sistema, sendo que a escolha de algum deles deve ser feita levando-se em consideração o sistema de interesse e as propriedades que se pretendem estudar.
2 Equação de Schrödinger A equação de Schrödinger é uma equação que descreve como um estado quântico, ψ(r,t), de um sistema físico muda com o tempo. H Ψ(r,t) = E Ψ(r,t) (1) onde ψ é a função de onda, E é a energia associada a esta função e o termo H é o operador Hamiltoniano de ψ com respeito às coordenadas de cada elétron em função do tempo. O estado Ψ(r,t) é a descrição mais completa que pode ser dada a um sistema físico, segundo o 1º postulado da mecânica quântica. Em 1926, Max Born postulou que a densidade de probabilidade de se encontrar uma partícula numa dada posição e instante t poderia ser obtida a partir da função de onda pela relação: p(x,t) = Ψ(r,t) 2 (2) espaço, é Sendo que a probabilidade de encontrar a partícula, em algum lugar no ( ) 2 3 r t dr ψ, = 1 (3) As funções de onda precisam possuir certas propriedades para ter significado físico: 1) ψ(r,t) deve pertencer a uma região finita do espaço de Hilbert, L 2, 2) ψ(r,t) é um conjunto de funções de onda composta de funções suficientemente regulares (ψ(r,t) é um sub-espaço de L 2 ), 3) precisa ser contínua e diferenciável, e 4) ψ(r,t) 2 deve ser integrável. A equação de Schrödinger independente do tempo também pode ser escrita como uma equação de autovalores e autovetores. A equação de Schrödinger independente do tempo para uma molécula poliatômica composta por N elétrons e M núcleos pode ser escrita como:
3 23 Hψ(r,R) = Eψ (r,r) (4) onde r e R representam as coordenadas dos elétrons e núcleos, respectivamente. O operador Hamiltoniano é descrito neste caso, como: 1 1 Z Z Z 1 H = + + N M N M M M N N 2 2 A A B i A i= 1 2 A= 1 2M A i= 1 A= 1 ria A= 1 B> A RAB i= 1 j> i rij (5) onde R AB é a distância entre os núcleos A e B, R AB = R A R B r ia é a distância entre o núcleo A e o elétron i, r ia = r i R A r ij é a distância entre os elétrons i e j, r ij = ri rj Z A é o número atômico do átomo A M A é a razão da massa do núcleo A em relação ao elétron i Pode-se reescrever esta equação como: H = T e + T N + V Ne + V N + V e (6) onde T N é o operador de energia cinética nuclear, T e o operador de energia cinética eletrônica, V Ne o operador referente à atração núcleo-elétron, V e o operador da energia potencial repulsiva elétron-elétron e V N o operador de energia potencial repulsiva núcleo-núcleo. Tendo em vista que os núcleos são muito mais pesados que os elétrons, suas transições são mais lentas que as transições eletrônicas. Então, para uma boa aproximação, pode-se considerar os elétrons numa molécula se movendo num campo de núcleo fixo, essa aproximação chama-se aproximação de Born- Oppenheimer. Com essa aproximação, o segundo termo da equação 6, a energia cinética do núcleo, pode ser desprezada e o quarto termo, a repulsão entre os núcleos, pode ser considerada constante. Qualquer connstante adicionada a um operador somente adiciona ao operador autovalor e naõ possui nenhum efeito no operador autofunção. Então, essa aproximação consiste em separar a equação de Schrödinger independente do tempo em duas partes: uma relacionada à parte
4 24 eletrônica e outra à parte nuclear. A equação nuclear diz respeito aos fenômenos da dinâmica molecular, da interação entre os núcleos que traz informação de um estado eletrônico particular do sistema molecular e da energia de repulsão núcleonúcleo. A equação eletrônica descreve os movimentos dos elétrons para uma dada configuração nuclear. Cada uma dessas configurações nuclear gera uma solução da energia no estado eletrônico de interesse. Usando essa aproximação, tem-se que: H = T N + T e + V Ne + V e + V N H T = T e + V Ne + V e + V N (7) ou seja, o Hamiltoniano total H T é H = H ele + V N (8) onde H ele = T e + V Ne + V e (9) é denominado o Hamiltoniano eletrônico. No átomo de hidrogênio, os únicos termos que compõem o operador Hamiltoniano são a energia cinética do elétron (assumindo o núcleo fixo) e a energia potencial de interação elétron-núcleo. Para este sistema, é possível empregar esse procedimento de separação de variáveis, no qual a Equação de Schrödinger independente do tempo é dividida em três equações que podem ser resolvidas de forma exata. Porém, percebeu-se que a equação de Schrödinger não tem solução analítica para sistemas moleculares, pois são sistemas onde há vários elétrons. Neste caso, faz-se uso de métodos aproximados que são baseados em aproximações matemáticas. Esses métodos são chamados de ab initio, e permitem obter soluções acuradas da equação de Schrödinger.
5 Método Hartree-Fock-Roothaan 39,41-43 O método Hartree-Fock (HF) é um método aproximado para a determinação de funções de onda e energia no estado fundamental de sistemas quânticos de muitos corpos. Esse método é a base da teoria do orbital molecular, que diz que cada movimento do elétron pode ser descrito por uma simples função (orbital) que não depende explicitamente do movimento instantâneo dos outros elétrons. Ele é também o ponto de partida para todos os outros métodos quânticos ab initio. A origem do Método HF vem do final da década de 1920, logo depois da derivação da equação de Schrödinger, em Em 1927 J. R. Hartree introduziu o método do campo autoconsistente para o cálculo aproximado de funções de onda e de energias para átomos e íons. Seu método proposto tornou-se conhecido como o método de Hartree. Hartree fez algumas considerações que foram fundamentais num primeiro estágio de pesquisa para tentar resolver o problema da equação de Schrödinger de sistemas multieletrônicos. Ele aproximou o termo de interação intereletrônica para um termo de campo médio, e com isso, ele pôde separar as funções de onda de cada elétron para um sistema de N elétrons. N ψ(r) = ψ 1 (r 1 )ψ 2 (r 2 )ψ 3 (r 3 )ψ 4 (r 4 )...= Πψ i (r i ) i (10) Este produto é chamado de produto de Hartree, e com ele a equação de Schrödinger pode ser separada em N equações independentes para cada elétron. A aproximação introduzida por Hartree trata os elétrons com funções de onda independentes e isso possui conseqüências drásticas, pois trata parte da correlação eletrônica. Em 1930, Slater e Fock independentemente mostraram que o método de Hartree não respeita o princípio da antissimetria da função de onda. O método utilizado por Hartree usa o princípio da exclusão de Pauli em sua antiga formulação, proibindo a presença de dois elétrons num mesmo estado quântico. Em seguida demonstrado que um determinante de Slater satisfaz esse princípio e é uma solução adequada para a aplicação do princípio variacional. Então, em 1935 Hartree reformulou seu método tornando-o mais adequado. Hartree aproximou o
6 26 termo de interação intereletrônica para um termo de campo médio, (υ HF ) resultante da presença dos demais elétrons. A função de onda eletrônica antissimétrica é dada por um determinante de Slater, que é a função de onda antissimétrica mais simples que pode ser usada para descrever o estado fundamental de sistemas de N elétrons. Considerando um sistema de dois elétrons em que os orbitais spin χ i e χ j estão ocupados. Se o elétron 1 estiver em χ i e o elétron 2 estiver em χ j, e viceversa, tem-se que: H H Ψ ( x, x ) = χ ( x ) χ ( x ) ( x x ) = χ ( x ) χ ( ) i 1 j 2 Ψ (11) 21 1, 2 i 2 j x1 Cada um desses orbitais claramente distingue os elétrons, entretanto pode-se obter uma função de onda que não distingüe e satisfaça o princípio de exclusão de Pauli através da combinação linear destes dois produtos: ( x1 ) χ j ( x1 ) ( x ) χ ( x ) Ψ 1 1 i ( x1, x ) = χ 2 ( χi ( x1 ) χ j ( x2 ) χ j ( x1 ) χi ( x2 )) 2 = 2 χ (12) i 2 j 2 onde o fator 2 -½ é um fator de normalização e o sinal assegura a antisimetria de Ψ H com relação a troca de coordenadas dos elétrons 1 e 2. Então, para um sistema de N elétrons tem-se que: ( x, x, K, x ) Ψ = 1 2 N ( x1 ) ( x1 ) K ( x1 ) ( x ) ( x ) K ( x ) χ χ χ i j k 1 χ χ χ N! M M O M χ χ χ i 2 j 2 k 2 ( x ) ( x ) K ( x ) i N j N k N (13) ( x x x ) ( x ) ( x ) ( x ) Ψ 1, 2, K, N = χi 1 χ j 2 Kχk N = χi χ jk χk (14) A troca de coordenadas de dois elétrons corresponde a troca de duas linhas do determinante de Slater, o que muda o sinal do determinante. Ter dois elétrons ocupando o mesmo orbital spin corresponde a ter duas colunas idênticas do determinante, que o faz ser zero. Portanto, não mais do que um elétron pode ocupar um orbital spin (Princípio de Exclusão de Pauli)
7 27 A função de onda antissimétrica mais simples, que pode ser usada para descrever o estado fundamental de um sistema com N elétrons, é um simples determinante de Slater: χ χ Ψ 0 = 1 2LχN (15) Pelo princípio variacional, a melhor função de onda dessa forma funcionalé aquela que dá a energia mais baixa possível: E 0 = Ψ 0 H Ψ 0 (16) O método variacional é baseado no seguinte teorema: Dado um sistema com operador Hamiltoniano H, então, se Ψ é uma função qualquer, que seja normalizada, bem comportada e que satisfaz as condições de contorno do problema, pode-se mostrar que esta função admite que o valor esperado do operador Hamiltoniano para uma função de onda aproximada é sempre maior que a energia exata E 0 correspondente a esse Hamiltoniano. Ψ * HΨd E0 τ (17) onde E 0 é o valor verdadeiro da mais baixa energia do autovalor H. Em outras palavras, a função de onda aproximada conduz à menor energia. Assim sendo, os coeficientes dos orbitais moleculares Ψ são determinados de modo a conduzirem ao valor mínimo de energia E associada a esse orbital molecular. Em relação à obtenção de soluções aproximadas, o que se faz na prática é partir de uma função aceitável, com vários parâmetros ajustáveis, e variar esses parâmetros de modo minimizar E pois, segundo o princípio variacional, conseguirá obter-se uma melhor aproximação para a energia do estado fundamental E 0. A flexibilidade variacional na função de onda (15) é na escolha dos spinorbitais. Através da minimização da energia E 0 com relação a escolha dos spinorbitais, pode-se derivar uma equação, chamada quação de Hartree-Fock, que determina os spin-orbitais ótimos. A equação de Hartree-Fock (HF) é uma equação de autovalor da forma:
8 28 ( ) χ ( ) εχ ( ) f i x = x (18) i i M 1 2 Z A HF f ( i) = i + v ( i) (19) 2 r A= 1 ia onde f (i) é o operador de Fock de um elétron efetivo e ν HF (i) é o potencial médio experimentado pelo elétron i devido a presença dos outros elétrons. A utilização do método Hartree-Fock implicou no uso do método do campo autoconsistente (SCF), que é capaz de obter soluções para as funções de onda do sistema a partir de uma função tentativa. Essa função tentativa é obtida a partir de uma estimativa inicial da função de onda, a qual é aperfeiçoada até convergir. A idéia básica do método SCF é simples, através de um chute inicial dos orbitais de spin, pode-se calcular o campo médio experimentado por cada elétron, e em seguida, resolve-se a equação de Fock para um novo conjunto de orbitais de spin. Usando estes novos orbitais de spin, tem-se um novo campo. Repete-se este procedimento até a autoconsistência ser alcançada. Em resumo, no método de Hartree-Fock, cada elétron é representado por uma função de onda que possui dependência apenas nas coordenadas daquele elétron. A probabilidade de se encontrar um elétron em um dado ponto nas vizinhanças de um núcleo é determinada apenas pela posição em relação ao núcleo, mas não em relação aos outros elétrons. Um certo elétron interage apenas com o campo médio dos outros elétrons, mas não há dependência mútua nas equações SCF e não se considera as interações instantâneas entre esses elétrons, ou seja, os movimentos não estão correlacionados. Então, método de Hartree-Fock faz cinco simplificações para tratar sistemas multieletrônicos: 1) Considera a aproximação de Born-Oppenheimer. 2) Despreza efeitos relativísticos. 3) Usa uma combinação linear de um número finito de funções ortonormais, que supõe-se formar uma base completa. 4) Cada autofunção do operador Hamiltoniano retorna a energia e é descrita por um determinante de Slater.
9 29 5) A aproximação SCF está implícita e somente parte da correlação eletrônica é considerada. Para átomos, o problema de resolver a equação de Hartree-Fock é simplificado devido à simetria esférica, diferentemente do caso de moléculas, onde perde-se essa simetria. Uma solução que tornou-se amplamente aplicada para cálculos de propriedades eletrônicas de qualquer sistema foi o método proposto por Roothaan. Ele sugeriu que as funções que fossem utilizadas para representar orbitais moleculares poderiam ser obtidas em termos de funções que representassem orbitais atômicos. Se considerarmos que orbitais atômicos de sistemas multieletrônicos são funções aproximadas, a mesma idéia poderia ser utilizada para construi-los através de funções matemáticas que permitissem computacionalmente cálculos precisos de propriedades atômicas e moleculares. Este método ficou conhecido como o método de combinação linear de orbitais atômicos (linear combination of atomic orbitals - LCAO). Roothaan e Hall reformularam as equações de Hartree e Fock com o intuito de obter soluções numéricas. O método consiste em introduzir um conjunto de funções de base normalizadas na equação Hartree-Fock. Para expandir a parte espacial dos spin-orbitais. O problema então fica resumido a uma mera diagonalização matricial. A forma espacial dos orbitais pode ser representada por uma combinação linear de K funções de base monoeletrônicas, como segue: κ φp (r) = Cνpgν(r) (20) ν = 1 onde, k é o número de funções do conjunto e os C vp são coeficientes a serem determinados. Como a função de onda pode ser representada por uma combinação linearmente independente de k funções de base que constituem a função de onda total, a equação de Fock pode ser escrita como: 1 f ( r ) Cνpgν( r1) = εp Cνpgν( r1) (21) ν ν
10 30 Multiplicando-se por g * µ (r 1 ) e integrando, temos: ν Cνp g µ (1) f (1) gν(1) = ε p Cνp gµ (1) gν(1) (22) ν onde g υ (1) g υ (r 1 ) (F) como: Definindo os elementos da matriz de superposição (S) e a matyriz de Fock S µν = gµ( 1) gν(1) (23) F µν = gµ( 1) f (1) gν(1) (24) podemos escrever ν FµνCνp = εp Sµ νcνp. (25) ν Em forma matricial, F C = S C Є (26) onde Є é uma matriz diagonal dos autovalores da matriz de Fock F que contém as energias orbitais Conjunto de base 44 Então, Roothaan propôs representar os orbitais Hartree-Fock como combinações lineares de um conjunto completo de funções conhecidas, que são chamadas de conjunto de base. Deve-se relacionar qual conjunto de base será
11 31 usada a fim de representar os orbitais ψ 1 em termos de funções analíticas simples f υ com suas propriedades conhecidas. Um conjunto de bases é o conjunto de funções usadas para criar os orbitais moleculares, que são expandidos como uma combinação linear de tais funções com coeficientes a serem determinados. A escolha da base é fundamental em cálculos teóricos, uma vez que a precisão dos cálculos de propriedades físicas e químicas de sistemas atômicos e moleculares depende do conjunto de funções de base. Funções de onda dos elétrons em uma molécula são orbitais espaciais. O orbital espacial ψ i (r) é uma função ortonormal do vetor posição r, que descreve a distribuição eletrônica no espaço. Se os orbitais espaciais forem bases completas, o orbital espacial pode ser expandido: N F(r) = a i ψ i = a 1 ψ 1 + a 2 ψ 2 + a 3 ψ a ψ (27) i = 1 A forma dessas funções é muito importante para uma boa convergência. Para escolher um conjunto de bases é necessário fixar um número mínimo de bases para cada átomo. Para isto deve-se considerar a distribuição eletrônica de cada átomo, e a partir dela pode-se saber o número mínimo de funções que uma base para aquele átomo deve ter. O orbital 1s é da forma Ne ζr que é relativamente simples. As funções com momentos angulares superior, como 2p e 3d, podem ser facilmente construídas a partir das funções s, multiplicando por fatores x, y e z. Funções deste tipo chamam-se orbitais do tipo Slater e são da forma: Φ STO = N x a y b z c e ζ r (28) onde ζ é o chamado expoente orbital zeta, N é a constante de normalização e os fatores x, y e z são dos orbitais 2p x, 2p y, 2p z, d xy, etc. Para minimizar problemas inerentes ao cálculo de integrais com funções exponenciais, usa-se frequentemente uma forma gaussiana, exp( αr 2 ), para a parte radial da função:
12 32 Φ GTO = N exp( a r 2 ) (29) O melhor é combiná-las a fim de obter o melhor resultado nos cálculos. Os conjuntos de base do tipo STO-nG são conjuntos de base mínima ou single-zeta, onde n representa o número de funções gaussianas primitivas compreendendo a um conjunto de bases simples. Para um conjunto de base mínima, os orbitais de caroço e valência são representados pelo mesmo número de funções Gaussianas primitivas. Na base dupla ou double-zeta, cada orbital de valência é representado por duas funções de base, mas cada orbital interno continua a ser representado por apenas uma função de base. Na base triple-zeta-valence, cada orbital de valência é representado por 3 funções e os orbitais internos são obtidos pela combinação de funções GTO. Em alguns sistemas também são necessários outros tipos de funções para uma melhor descrição. Podemos acrescentar as funções de polarização e também as funções difusas. A adição de funções de polarização a um conjunto de bases permite uma melhor descrição dos elétrons, pois através destas funções conseguese uma descrição das deformações sofridas pelos orbitais que participam em uma ligação química. Dentre os conjuntos de base com funções de polarização mais utilizados em cálculos moleculares destacam-se a 6-31G* e 6-31**G. Um asterisco (*) no final da base quer dizer que essa polarização tomou em consideração os orbitais p. Dois asteriscos (**) significa que a polarização tomou em consideração os orbitais s, além dos orbiatais p. Já as funções difusas, elas permitem descrever uma região maior do espaço dos orbitais ocupados. Utilizam-se estas funções para melhorar a representação de sistemas que tenham densidades eletrônicas afastadas do núcleo. Dentre essa funções, podemos citar a 6-31+G e G. Um + significa que estamos olhando para os orbitais p, enquanto que ++ significa que estamos olhando para ambos os orbitais p e s.
13 Métodos para tratamento da correlação eletrônica 39 Uma função de onda HF leva em consideração as interações entre elétrons somente de forma média, porém é necessário considerar as interações instantâneas entre os elétrons. Os movimentos dos elétrons são correlacionados um com os outros, o que é chamado de correlação eletrônica. É preciso encontrar um modo de introduzir a correlação instantânea dos elétrons na função de onda. Dentro do método HF, a função de onda antissimétrica que descreve um conjunto de elétrons é aproximada por um simples determinante de Slater. As funções de onda exatas, entretanto, em geral não podem ser representadas como determinantes únicos. A aproximação feita por somente um determinate não leva em conta a correlação entre elétrons de spin oposto, levando a uma energia eletrônica total diferente da solução exata da equação de Schrödinger nãorelativística dentro da aproximação de Born-Oppenheimer. Assim, o limite HF está sempre acima desta energia. Essa diferença é chamada de energia de correlação. Na realidade, uma parte da correlação eletrônica é considerada dentro da aproximação HF, encontrada no termo de troca eletrônica que descreve a correlação entre elétrons com spins paralelos. Isto que evita que dois elétrons com spins paralelos se encontrem na mesma reagião do espaço. Uma das maneiras para fornecer a correlação eletrônica instantânea é introduzir a distância intereletrônica rij até a função de onda. Esse método é somente praticável para sistemas com poucos elétrons. E uma outra maneira é através de métodos pós-hf. Como exemplos desses métodos temos o de Interação de configuração (CI), a Teoria de perturbação Moller-Plesset (MP2, MP3, MP4, etc.), Coupled-cluster (CC) e o Campo multiconfiguracional auto-consistente (MCSCF).
14 Interação de Configuração (CI) Um dos métodos mais importantes para encontrar correlação eletrônica é a enteração de configuração (CI). Ele se baseia nas funções de onda HF e leva uma combinação linear de determinantes excitados Φ I como uma função de onda e otimiza os fatores C I. CI é um método variacional pós-hf para resolver a equação de Schrödinger não-relativística dentro da aproximação de Born-Oppenheimer para sistemas quânticos de muitos elétrons. Porém, este método é limitado à sistemas relatiamente pequenos. A idéia básica deste método é diagonalizar os Hamiltonianos de N-elétrons numa base de N-funções eletrônicas (determinantes de Slater). Ou seja, representar a função de onda exata como uma combinação linear de funções de N- elétrons e usar o método variacional linear. A aproximação HF consiste em utilizar como função de estado em único determinante onde os spin-orbitais ψ (i) i são determinados pelo método variacional e são soluções das equações de HF: (1) (2) ( N ) 1, ψ 2,..., ψ Φ = ψ N,... (30) A Como os ψ (i) i formam um conjunto completo de funções de uma partícula é possível construir através deles um conjunto completo de funções de N partículas utilizando-se sistematicamente esses orbitais e usando os determinantes como base do espaço de Hilbert anti-simetrizado. Se N for o número de elétons no sistema e 2K > N o número de spin-orbitais usados na equação (30) o número de elementos distintos desta base é dado por: 2K = N (2K)! N!(2K N)! (31) Os determinantes desta base são formados considerando como referência o estado fundamental HF Φ 0 e as excitações possíveis. Um determinante é dito
15 35 mono-excitado, Φ r a, quando um elétrons, então ocupando o spin-orbital ψ a no estado fundamental é promovido para um spin-orbital ψ r, então desocupado. De maneira similar diz-se que um determinante é duplamente excitado, Φ rs ab quando dois elétrons antes ocupando os spin-orbitais ψ a e ψ b são promovidos aos orbitais ψ r e ψ s, respectivamente. A base de determinantes, com o número de elementos dado pela equação (30) forma um conjunto completo. O método CI baseia-se em construir o autoestado ψ de H como uma combinação linear desses determinantes de Slater, ou seja, propõe-se que r r rs rs rst rst ψ = C Φ + C Φ + C Φ + C Φ +... (32) 0 0 a, r a a a< b r< s ab ab a< b< c r< s< t abc abc onde os CI s são os parâmetros a serem determinados usando o princípio variacional e Φ 0 é o estado HF tomado como referência para construir os determinantes com excitações. A expansão (32) é a função de estado para o CI completo (FCI); no caso da expansão conter um número limitado de excitações, o CI é dito truncado Complete Active Space SCF (CASSCF) 45 O CASSCF é uma importante aproximação do método do Campo autoconsistente multi-configuracional (MCSCF). O MCSCF é um método na Química quântica usado para gerar qualitativamente estados de referência de moléculas nos casos onde o Hartree-Fock e a Teoria do funcional de densidade não são adequados (por exemplo, moléculas com estrutura de ressonância). Ele usa uma combinação linear de funções de estado de ajuste (SCF) ou determinantes de ajuste para aproximar a função de onda eletrônica exata de um átomo ou molécula.
16 36 No CASSCF, as configurações são geradas a partir da separação dos orbitais moleculares em orbitais ativos e inativos. O espaço ativo é constituído pelos orbitais ocupados mais energéticos (orbitais de valência) e os orbitais vazios menos energéticos (orbitais virtuais), figura 1. Os outros orbitais são os orbitais inativos. A seleção do conjunto de orbitais deve ser feita levando em consideração o sistema em estudo e o custo computacional. Figura 1. Representação do espaço ativo. No método CASSCF, o conjunto de orbitais (ocupados e virtuais) é dividido em quatro subconjuntos: 1) orbitais de caroço (core): são os orbitais moleculares mais internos, com características atômicas. Por isso, permanecem praticamente inalterados durante o processo de excitação e ionização de elétrons de valência, quebra e formação de ligações químicas;
17 37 2) orbitais inativos: são orbitais que, apesar de não participarem diretamente dos processos mencionados acima, precisam ser otimizados para melhorar a descrição do sistema; 3) orbitais ativos: são os orbitais diretamente envolvidos nos processos mencionados no item 1; serão otimizados novamente; 4) orbitais virtuais: são os orbitais que não serão ocupados. Utilizando esses quatro conjuntos de orbitais moleculares, o método CASSCF permite gerar automaticamente as configurações que serão empregadas para construir a expansão CASSCF. Os orbitais de caroço e do espaço inativo serão sempre duplamente ocupados, sendo que os orbitais do espaço inativo serão otimizados novamente e os do caroço serão mantidos na forma original. Os orbitais do espaço virtual serão mantidos sempre vazios, fora do espaço ativo. E os orbitias do espaço ativo também serão otimizados, tendo ocupação inicial igual a zero, um ou dois. Após a escolha dos orbitais, distribuem-se os elétrons do espaço ativo de todas as maneiras possíveis, gerando todas as configurações possíveis. Essas configurações são usadas para definir a função de onda CASSCF. Somente os elétrons contidos no espaço ativo serão correlacionados, então, a escolha dos orbitais é de grande importância para o sucesso do cálculo. Uma função de onda CASSCF é geralmente usada para obter uma primeira aproximação da chamada correlação estática, que representa a contribuição necessária para descrever corretamente os processos de dissociação de ligação. Isso requer uma função de onda que inclui um conjunto de configurações eletrônicas de importância. A correlação dinâmica, representando a contribuição da energia de quebra por interações instantâneas entre os elétrons, é normalmente pequena e pode ser calculada com grande acurácia por outros métodos como CI, CC, MRCI e CASPT2.
18 Multireference configuration Interaction (MRCI) O método MRCI é uma boa ferramenta para calcular funções de energia potencial (PEF) e propriedades moleculares. Em comparação a muitos outros métodos usados em Química Quântica, que são baseados em estados de referência de configurações simples, as funções de onda MRCI dão um maior balanço da descrição global do PEF. Em cálculos do Full CI (FCI) foi demonstrado para um número de moléculas pequenas que funções de onda MRCI, com excitações simples e duplas de funções relativas ao campo autoconsistente do espaço ativo completo (CASSCF), fornece PEFs que chega perto dos resultados do FCI. Outra vantagem desse método é que as funções de onda para estados eletrônicos excitados podem ser calculadas. Há também casos onde funções de onda de estados eletrônicos fundamentais não podem ser bem representadas por simples configurações, e no qual uma descrição dos efeitos de correlação eletrônica requer funções de onda MRCI. O principal obstáculo do método MRCI convencional é o tipo de expansão de configuração e o esforço computacional que aumenta com o número de configurações de referência. Então, faz-se necessário aplicar um esquema de seleção de configurações usando a teoria de perturbação, ou selecionando aos poucos um pequeno número dominante de configurações de referência. Entretanto, é freqüentemente difícil fazer seleções de um pequeno número de configurações e predizer o efeito da seleção da configuração nas propriedades não-energéticas, como dipolo ou momento de transição. A aplicabilidade do método MRCI tem sido limitada, pois o comprimento da expansão da configuração e o arquivo de armazenamento rapidamente aumentam com o número de configurações de referência. Em geral, uma função de onda MRCI pode ser escrita da seguinte forma c i c S a P ab i a ΨS c abψp i S a P ab Ψ = Ψ + + (33)
19 39 onde a, b representam orbitais externos (não ocupados na configuração de referência) e S e P representam os estados internos N 1 e N 2. Ψ 1, Ψ S a, e Ψ P ab são configurações internas, isoladas e duplamente externas, respectivamente Coupled-cluster (CC) 41,50-53 Coupled-cluster é uma técnica numérica usada para descrever sistemas de muitos corpos. Ele é uma das várias metodologias ab initio pós-hf. Como todos os métodos pós-hf, ele começa a partir do método de orbital molecular Hartree- Fock e adiciona um termo de correção para levar em consideração a correlação eletrônica. Este método é um dos mais aprimorados, confiáveis e computacionalmente acessíveis para moléculas de tamanho pequeno a médio. O método Coupled Cluster (CC) foi originalmente formulado por Coster 50 e Kümmel, 51 e reformulado por Cizek e Josef Paldus, 54 Pople, et. al. 55 e Bartlett et. al. 56 A teoria CC fornece uma solução para a equação de Schrödinger independente do tempo, H ψ = E ψ. (34) A idéia básica deste método consiste em dividir um sistema de muitos elétrons em vários aglomerados com poucos elétrons, os clusters. Então, calculam-se as interações dos elétrons de um mesmo cluster e, em seguida, a interação entre os diversos clusters. A função de onda na teoria CC é escrita como um ponto de partida, que nada mais é do que um chute inteligente : ψ = e T ϕ 0 (35) T = T 1 + T T n (36)
20 40 onde φ 0 é o determinante de Slater usualmente construído no método HF, T é o operador de excitação ou de grupos que, quando age em ϕ 0 produz uma combinação linear de determinantes de Slater excitados. A escolha desse chute é oportuna porque ela garante a propriedade de extensividade do tamanho. Uma desvantagem desse método é que ele é não variacional. Levando em consideração a forma de T, o operador exponencial e T pode ser tratado como uma séria de Taylor: e T 1 + T + T 2 /2! + T 3 /3! +... (37) Considerando apenas T 1 e T 2, tem-se que: e T = 1 + T 1 + T 2 + T 1 2 /2 + T 2 2 /2 + T 1 T 2 (38) Essa série é finita, pois o número de orbitais ocupados é finito, assim como o número de excitações. O termo T permite incluir todas as excitações i possíveis de uma só vez. A forma do operador de excitação envolve dois tipos de operadores: o operador de criação e o operador de aniquilação. T t 1 i a i a a i a a = (39) 1 ab T 2 t 4 ij ai a jaaab i, j a, b = (40) e assim por diante, até T n. A aplicação de T 1, T 2, T 3, T 4... gera configurações de excitações simples, duplas, triplas, quádruplas, etc. Nesta notação, i e j representam os orbitais ocupados e a e b, os orbitais desocupados ou virtuais. Os operadores a e a atuam como operadores de criação e aniquilação, respectivamente. Um operador de aniquilação é um operador que diminui o número de partículas num dado estado, e um operador de criação é um operador que aumenta o número de partículas num dado sistema e é um adjunto do
21 41 operador de aniquilação. Os operadores de criação e aniquilação no coupled cluster são escritos na forma canônica, onde cada termo está em sua ordem normal. O cálculo mais simples dentro desse método inclui somente o termo T 2 no operador do cluster e chama-se aproximação CCD (coupled cluster com excitações duplas). Embora seja claro que as excitações duplas desempenham um papel dominante em cálculos de correlação, existem problemas em que a inclusão das excitações simples é de fundamental importância. Um modelo de coupled cluster levando em consideração as excitações simples e duplas (CCSD) foi formulado e implementado por Purvis e Bartlett 52. O método CCSD é um método aproximado do método CC, onde a função de onda é escrita como ψ CCSD = e T1+T2 ϕ 0 (41) Já em uma segunda variante, o método CCSD(T), o termo das excitações triplas é incluído através da Teoria de Perturbação Teoria do Funcional de densidade 41,43 Em 1927, Thomas e Fermi propuseram uma nova abordagem para a obtenção da energia eletrônica. Ao invés de utilizar funções de onda que possuem 3N coordenadas eles utilizaram a densidade eletrônica (ρ), que é definida em 3 dimensões. Então, foi possível reduzir o número de integrais para a descrição de um sistema, reduzindo o custo computacional. No Modelo Thomas-Fermi (TF) parte-se do pressuposto que os elétrons estão distribuídos uniformemente no espaço, e usando argumentos estatísticos para aproximar a distribuição dos elétrons, Thomas e Fermi desenvolveram o funcional de energia Thomas-Fermi (TF). A energia total do sistema, nessa abordagem de Thomas e Fermi, é descrita como um funcional da densidade eletrônica (ρ):
22 42 ( r) ( r) h ρ TTF ( ρ ) = C ρ ( r) d r + dr 8 m ρ 2 (42) A energia de um átomo é: E TF [ρ] = T TF [ρ] + V núcleo-elétron [ρ] + V elétron-elétron [ρ] (43) onde T TF [ρ] é a energia cinética, V núcleo-elétron [ρ] é a energia potencial elétronnúcleo e V elétron-elétron [ρ] é a energia potencial de repulsão elétron-elétron. O modelo TF é limitado, pois E TF é uma energia aproximada e não representa a interação de troca, por isso, essa aproximação não despertou muito interesse na comunidade científica. Porém, na década de 60, Hohenberg e Kohn publicaram trabalhos mostrando que existe um funcional da densidade eletrônica para uma molécula no estado fundamental. A energia de troca (E troca ) e de correlação (E corr ) foram representadas nesse modelo. A E troca foi incluída, pois elétrons com mesmo spin ficam separados, e a energia tende a cair, e a E corr foi incluída para representar a energia de interação entre os elétrons. Desta forma, o efeito de troca que está ligado ao spin e a correlação eletrônica são adicionados na equação de energia para se obter a energia total, levando a um funcional da forma: E TF [ρ] = T TF [ρ] + V núcleo-elétron [ρ] + V elétron-elétron [ρ] + E troca [ρ] + E corr [ρ] (44) Os conceitos modernos da Teoria do Funcional de Densidade (DFT), formulados por Kohn e Sham, incluem efeitos de troca e correlação eletrônica para os cálculos quânticos. A grande vantagem desta metodologia, em relação aos métodos pós-hartree-fock (por exemplo, CC), para o cálculo da correlação eletrônica, está no ganho em velocidade computacional e em espaço em memória. A idéia básica do DFT é que a energia de um sistema eletrônico pode ser escrita em termos da densidade eletrônica, ρ. Segundo o Teorema de Hohemberg-Kohn (HK), o Hamiltoniano de um sistema eletrônico molecular, com M núcleos e N elétrons, na aproximação de Bohr-Oppenheimer e desprezando os efeitos relativísticos, é dado por:
23 43 H 1 Z 1 = + + Z Z N M N N N M B 2 A A B i i= 1 2 A= 1 i= 1 RA ri i< j j= 1 ri rj A< B B= 1 RA RB (45) H = T + U + V + V (46) e a A densidade eletrônica é definida por: ( ) = (,,, ) (,,, ) ρ r K ψ r r K r ψ r r K r drk dr (47) 1 2 N 1 2 N 1 N A energia total do sistema é dada por: 0 ( ) ( ) ( r ) ρ ( r ) ( ) ( ) E = ψ H ψ = ψ ( T + V ) ψ + ψ ρ r υ r ψ = 1 ρ = e ( ) ( ) 1 2 Ts ρ EXC ρ dr1 dr2 ρ r υ r dr 2 r1 r2 (48) onde T s (ρ) é o funcional de energia cinética de um sistema de elétrons que não interagem e tem a mesma densidade eletrônica do sistema de elétrons que interagem, E XC (ρ) é a energia de troca-correlação, que inclui o termo de interação elétron-elétron não clássica, mas também a parte residual da energia cinética, T(ρ) Ts(ρ) e T(ρ) é a energia cinética exata para o sistema de elétrons que interagem. Porém, esse é um problema intratável para muitos elétrons interagindo em um potencial externo. Para resolver esse problema, segundo o Teorema de Kohn-Sham, é possível utilizar-se um sistema de referência de elétrons que não interagem com um Hamiltoniano que tenha um potencial local efetivo, υ ef (r): H KS 1 2 ( r) 2 = + υef (49) A função de onda ψ KS do estado fundamental é aproximada pelo produto anti-simetrizado de N funções de onda de um elétron ψ i KS (r i ), representado pelo determinante de Slater:
24 44 ( r, r, K, r ) Ψ = 1 2 N ( r1 ) ( r1 ) K ( r1 ) ( r ) ( r ) K ( r ) ψ ψ ψ i j k 1 ψ ψ ψ N! M M O M ψ ψ ψ i 2 j 2 k 2 ( r ) ( r ) K ( r ) i N j N k N (50) Os orbitais são obtidos a partir da Equação de Schrödinger independente do tempo de um elétron: 1 2 υ ψ ε ψ 2 KS KS + ef i = i i (51) A conexão entre esse sistema hipotético e o sistema real pode ser estabelecida escolhendo-se o potencial efetivo, de forma que a densidade eletrônica resultante seja igual à densidade eletrônica fundamental: N KS 2 s ( r) = ni i ( r) = 0 ( r) (52) i= 1 ρ ψ ρ Pelo princípio variacional, o potencial efetivo é obtido minimizando-se a expressão da energia total E 0 : ( ) ( ) ( r ) ρ ( r ) ( ) ( ) Eυ = ψ H ψ = ψ ( T + V ) ψ + ψ ρ r υ r ψ = 1 ρ = e ( ) ( ) 1 2 Ts ρ EXC ρ dr1 dr2 ρ r υ r dr 2 r1 r2 (53) ef ( ) ( ) ( r ) ρ υ = υ + + υ = ( r1 ) EXC ( ) dr1 δρ ( ) ( ) 1 r r dr1 XC r r r1 ρ δ ρ = υ ( r) + + r r r 1 (54) Existem vários funcionais de troca e correlação, e também os funcionais híbridos, que incluem tanto a energia de troca quanto de correlação.
25 Estados de Transição Um estado de transição (TS) numa reação química é uma configuração particular ao longo da coordenada da reação que se define como o estado que corresponde ao máximo de energia ao longo dessa coordenada, ou seja, é uma espécie molecular que é representada por um ponto de cela. A energia dessa espécie é necessária para determinar a energia de ativação e depois, calcular a constante de velocidade. A geometria de um estado de transição é uma importante informação para descrever um mecanismo de reação. Uma estrutura de TS é matematicamente definida como a geometria no ponto de sela da superfície que possui derivada de energia igual a zero, com respeito ao movimento das coordenadas nucleares, e possui também uma segunda derivada positiva de energia, que possui uma curvatura negativa. No resultado do cálculo para encontrar um estado de transição deve haver apenas uma frequência imaginária. Na realidade, a freqüência é exibida com o sinal negativo pelo algoritmo, e é obtida em função da raiz quadrada da constante de força do modo normal característico do estado de transição. Esta constante de força, uma grandeza negativa, muda a natureza das forças harmônicas atuantes, que passam a ser denominadas auxiliadoras ao invés de restauradores. A otimização do TS que será usada nesse trabalho usa o algoritmo de Berny com coordenadas internas redundantes, que é o algoritmo mais popular para essa otimização. A escolha do sistema de coordenadas para iniciar a estrutura molecular é irrelevante, e não possui nenhum efeito no modo do procedimento de otimização. A otimização por coordenadas internas redundantes usa informações da geometria e especificações de diferenciação numérica. A menos que se especifique de outra maneira, uma otimização de geometria pelo algoritmo de Berny começa com uma suposição para a matriz Hessiana, que é determinada usando conectividades determinadas por raios atômicos e um campo de força simples. A matriz inicial é melhorada em cada ponto usando as primeiras derivadas computadas. Esse esquema geralmente funciona muito bem, mas em alguns casos, tais como z-matrizes com arranjos incomuns de átomos, o chute inicial pode ser tão ruim que a otimização não inicia corretamente ou gasta muitas etapas para
26 46 melhorar a matriz Hessiana sem se aproximar da estrutura otimizada. Além disso, para as otimizações dos estados de transição, algum conhecimento da curvatura em torno do ponto de sela é necessário e o erro aproximado da matriz Hessian deve ser melhorado. Nesses casos, pode-se usar um nível mais baixo de cálculo para melhorar as constantes de força analiticamente ou numericamente. Quando se procura por um mínimo local, o algoritmo de Berny usa uma combinação de etapas da otimização da função racional e a busca linear para conseguir a velocidade e a confiabilidade (como descrito abaixo). Esta etapa da busca linear não pode ser aplicada ao procurar por um estado de transição. Consequentemente, as otimizações de estado da transição são muito mais sensíveis à curvatura da superfície. Uma otimização de estado da transição deve sempre iniciar usando uma das opções descritas acima para especificar a informação da curvatura. Sem uma segunda matriz derivada total, o passo inicial é dependente da escolha do sistema de coordenadas, assim é melhor tentar fazer a coordenada da reação (sentido da curvatura negativa) correspondendo a uma ou duas coordenadas internas redundantes ou a variáveis da Z-matriz. O algoritmo de otimização de Berny checa a curvatura através do número de autovalores negativos de sua matriz da derivada aproximada em cada etapa de uma otimização de estado da transição. O algoritmo de otimização de Berny no Gaussian é baseado em algoritmos anteriores escrito por H.B. Schlegel. 58 A matriz Hessiana é atualizada, a menos que uma Hessiana analítica esteja computada. A atualização é feita normalmente usando o método Broyden-Fletcher-Goldfarb- Shanno (BFGS) 59 iterativo para estados de transição em coordenadas internas redundantes, e usando uma modificação do procedimento original da atualização de Schlegel para otimizações em coordenadas internas.
Operadores e Função de Onda para Muitos Elétrons. Introdução à Física Atômica e Molecular UEG Prof. Renato Medeiros
 Operadores e Função de Onda para Muitos Elétrons Introdução à Física Atômica e Molecular UEG Prof. Renato Medeiros Livro texto: Modern Quantum Chemistry Introduction to Advanced Elecronic Structure Theory
Operadores e Função de Onda para Muitos Elétrons Introdução à Física Atômica e Molecular UEG Prof. Renato Medeiros Livro texto: Modern Quantum Chemistry Introduction to Advanced Elecronic Structure Theory
Correlação Eletrônica - CI e MP2
 Correlação Eletrônica - CI e MP2 CF740 Tópicos Especiais de Física Atômica e Molecular Cálculos de Estrutura Eletrônica Utilizando Funcionais de Densidade Departamento de Física Universidade Federal do
Correlação Eletrônica - CI e MP2 CF740 Tópicos Especiais de Física Atômica e Molecular Cálculos de Estrutura Eletrônica Utilizando Funcionais de Densidade Departamento de Física Universidade Federal do
Operadores e Função de Onda para Muitos Elétrons. Introdução à Física Atômica e Molecular UEG Prof. Renato Medeiros
 Operadores e Função de Onda para Muitos Elétrons Introdução à Física Atômica e Molecular UEG Prof. Renato Medeiros Aproximação de Hartree-Fock A maior preocupação da química quântica é encontrar e descrever
Operadores e Função de Onda para Muitos Elétrons Introdução à Física Atômica e Molecular UEG Prof. Renato Medeiros Aproximação de Hartree-Fock A maior preocupação da química quântica é encontrar e descrever
Introdução ao Método de Hartree-Fock
 Introdução ao Método de Hartree-Fock CF352 - Fundamentos de Física Atômica e Molecular Departamento de Física Universidade Federal do Paraná M. H. F. Bettega (UFPR) CF352 1 / 24 Preliminares Aproximação
Introdução ao Método de Hartree-Fock CF352 - Fundamentos de Física Atômica e Molecular Departamento de Física Universidade Federal do Paraná M. H. F. Bettega (UFPR) CF352 1 / 24 Preliminares Aproximação
O Método de Hartree-Fock
 O Método de Hartree-Fock CF740 Tópicos Especiais de Física Atômica e Molecular Cálculos de Estrutura Eletrônica Utilizando Funcionais de Densidade Departamento de Física Universidade Federal do Paraná
O Método de Hartree-Fock CF740 Tópicos Especiais de Física Atômica e Molecular Cálculos de Estrutura Eletrônica Utilizando Funcionais de Densidade Departamento de Física Universidade Federal do Paraná
FF-296: Teoria do Funcional da Densidade I. Ronaldo Rodrigues Pela
 FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos O problema de 1 elétron O princípio variacional Função de onda tentativa Átomo de H unidimensional Íon H2 + unidimensional Equação
FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos O problema de 1 elétron O princípio variacional Função de onda tentativa Átomo de H unidimensional Íon H2 + unidimensional Equação
Data de entrega dos resumos
 Data de entrega dos resumos Primeiro resumo Até 25 de abril de 2018 quarta-feira Segundo resumo Até 20 de junho de 2018 quarta-feira Cap. 3 Terceira parte Teorema de Koopmans Teorema de Brillouin Hamiltoniano
Data de entrega dos resumos Primeiro resumo Até 25 de abril de 2018 quarta-feira Segundo resumo Até 20 de junho de 2018 quarta-feira Cap. 3 Terceira parte Teorema de Koopmans Teorema de Brillouin Hamiltoniano
restrito tornar-se irrestrito, deixando orbitais tornarem-se complexos, e reduzindo a simetria desses orbitais. Se alguma instabilidade fosse
 5 Metodologia A maioria dos cálculos foi feita utilizando o software GAUSSIAN03 69, apenas um dos cálculos de acoplamento spin-órbita foi feito utilizando o programa MOLPRO 70 através de cooperação com
5 Metodologia A maioria dos cálculos foi feita utilizando o software GAUSSIAN03 69, apenas um dos cálculos de acoplamento spin-órbita foi feito utilizando o programa MOLPRO 70 através de cooperação com
NOTAS DE AULAS DE ESTRUTURA DA MATÉRIA
 NOTAS DE AULAS DE ESTRUTURA DA MATÉRIA Prof. Carlos R. A. Lima CAPÍTULO 10 ÁTOMOS COMPLEXOS Primeira Edição junho de 2005 CAPÍTULO 10 ÁTOMOS COMPLEXOS ÍNDICE 10-1- Introdução 10.2- Átomos com mais de um
NOTAS DE AULAS DE ESTRUTURA DA MATÉRIA Prof. Carlos R. A. Lima CAPÍTULO 10 ÁTOMOS COMPLEXOS Primeira Edição junho de 2005 CAPÍTULO 10 ÁTOMOS COMPLEXOS ÍNDICE 10-1- Introdução 10.2- Átomos com mais de um
FF-296: Teoria do Funcional da Densidade I. Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Problema de 2 elétrons Férmions Hartree-Fock Troca
FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Problema de 2 elétrons Férmions Hartree-Fock Troca
Fundamentos de Química Quântica
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Fundamentos de Química Quântica Aula 3 Professora: Melissa Soares Caetano Átomo de Hidrogênio Um núcleo
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Fundamentos de Química Quântica Aula 3 Professora: Melissa Soares Caetano Átomo de Hidrogênio Um núcleo
FF-296: Teoria do Funcional da Densidade I. Ronaldo Rodrigues Pela
 FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos HF Dois elétrons N elétrons Thomas Fermi Átomo de Hélio 1D Energia exata: 3,154 H Vamos resolver este problema usando o método
FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos HF Dois elétrons N elétrons Thomas Fermi Átomo de Hélio 1D Energia exata: 3,154 H Vamos resolver este problema usando o método
UMA SIMPLIFICAÇÃO DO MÉTODO HARTREE-FOCK
 UMA SIMPLIFICAÇÃO DO MÉTODO HARTREE-FOCK Lucas Modesto da Costa Instituto de Física - DFGE - USP 8 de outubro de 2008 1 / 39 Slater, J. C. Época Aproximação de Thomas-Fermi 2 / 39 Slater, J. C. Slater,
UMA SIMPLIFICAÇÃO DO MÉTODO HARTREE-FOCK Lucas Modesto da Costa Instituto de Física - DFGE - USP 8 de outubro de 2008 1 / 39 Slater, J. C. Época Aproximação de Thomas-Fermi 2 / 39 Slater, J. C. Slater,
2 Fundamentos de Mecânica Quântica e Química Computacional
 2 Fundamentos de Mecânica Quântica e Química Computacional 2.1. Introdução Assim como em outras áreas do conhecimento humano, o uso do termo Química Computacional se popularizou devido a uma confluência
2 Fundamentos de Mecânica Quântica e Química Computacional 2.1. Introdução Assim como em outras áreas do conhecimento humano, o uso do termo Química Computacional se popularizou devido a uma confluência
Geralmente, fazemos simplificações e desenvolvemos modelos. A matéria é composta por átomos e moléculas
 Disciplina: SiComLíMol 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite tratar quantidades macroscópicas da matéria.
Disciplina: SiComLíMol 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite tratar quantidades macroscópicas da matéria.
Física Moderna II - FNC376
 Universidade de São Paulo Instituto de Física Física Moderna II - FNC376 Profa. Márcia de Almeida Rizzutto 1o. Semestre de 2008 1 MQ átomos > < Moléculas moléculas e sólidos núcleos e partículas Moléculas
Universidade de São Paulo Instituto de Física Física Moderna II - FNC376 Profa. Márcia de Almeida Rizzutto 1o. Semestre de 2008 1 MQ átomos > < Moléculas moléculas e sólidos núcleos e partículas Moléculas
2 Teoria do Funcional da Densidade
 2 Teoria do Funcional da Densidade A Mecânica Quântica teve seu início com a equação de Schrödinger (1926). Esta equação determina a função de onda quântica de um sistema, seja ele um átomo, uma molécula
2 Teoria do Funcional da Densidade A Mecânica Quântica teve seu início com a equação de Schrödinger (1926). Esta equação determina a função de onda quântica de um sistema, seja ele um átomo, uma molécula
Átomo de Hélio. Tiago Santiago. 2 de novembro de Resumo
 Átomo de Hélio Tiago Santiago de novembro d015 Resumo Nesse trabalho o átomo de Hélio é abordado definindo-se o hamiltoniano e utilizando métodos de aproximação para estimar a energia do ground state.
Átomo de Hélio Tiago Santiago de novembro d015 Resumo Nesse trabalho o átomo de Hélio é abordado definindo-se o hamiltoniano e utilizando métodos de aproximação para estimar a energia do ground state.
Seminário. Teoria de Ligação de Valência - TLV UMA ABORDAGEM MECÂNICO QUÂNTICA DAS LIGAÇÕES COVALENTES
 Seminário Teoria de Ligação de Valência - TLV UMA ABORDAGEM MECÂNICO QUÂNTICA DAS LIGAÇÕES COVALENTES Autor: Marcelo Alves de Souza Mestrando UFABC 2015 Disciplina Química Integrada 1 O modelo de repulsão
Seminário Teoria de Ligação de Valência - TLV UMA ABORDAGEM MECÂNICO QUÂNTICA DAS LIGAÇÕES COVALENTES Autor: Marcelo Alves de Souza Mestrando UFABC 2015 Disciplina Química Integrada 1 O modelo de repulsão
Introdução à Física Atômica e Molecular
 4005 Introdução à Física Atômica e Molecular Átomos Multieletrônicos Referências: D. Vianna, A. Fazzio e S. Canuto, Teoria Quântica de Moléculas e Sólidos. P. Atkins e R. Friedman, Molecular Quantum Mechanics,
4005 Introdução à Física Atômica e Molecular Átomos Multieletrônicos Referências: D. Vianna, A. Fazzio e S. Canuto, Teoria Quântica de Moléculas e Sólidos. P. Atkins e R. Friedman, Molecular Quantum Mechanics,
Física Moderna II - FNC376
 Universidade de São Paulo Instituto de Física Física Moderna II - FNC376 Profa. Márcia de Almeida Rizzutto o. Semestre de 008 Conteúdo (P) Cap. 7, 8 e 9 Eisberg (/ do 9.7), Cap. 7 do Tipler, Cap. 7 e parte
Universidade de São Paulo Instituto de Física Física Moderna II - FNC376 Profa. Márcia de Almeida Rizzutto o. Semestre de 008 Conteúdo (P) Cap. 7, 8 e 9 Eisberg (/ do 9.7), Cap. 7 do Tipler, Cap. 7 e parte
Física Moderna II Aula 07
 Universidade de São Paulo Instituto de Física 1 º Semestre de 015 Profa. Márcia de Almeida Rizzutto Oscar Sala sala 0 rizzutto@if.usp.br Física Moderna II Aula 07 Monitor: Gabriel M. de Souza Santos Sala
Universidade de São Paulo Instituto de Física 1 º Semestre de 015 Profa. Márcia de Almeida Rizzutto Oscar Sala sala 0 rizzutto@if.usp.br Física Moderna II Aula 07 Monitor: Gabriel M. de Souza Santos Sala
A teoria de Hartree. r r. r r
 A teoria de Hartree Vimos, na aula 4, a proposta de Hartree: tratamento autoconsistente Ou seja, V(r) obtido a posteriori, a partir das distribuições de carga dos e -, deve concordar com o V(r) usado para
A teoria de Hartree Vimos, na aula 4, a proposta de Hartree: tratamento autoconsistente Ou seja, V(r) obtido a posteriori, a partir das distribuições de carga dos e -, deve concordar com o V(r) usado para
NOTAS DE AULAS DE FÍSICA MODERNA
 NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de janeiro de 2010 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução 6.2- Equação
NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de janeiro de 2010 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução 6.2- Equação
FF-296: Teoria do Funcional da Densidade I. Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Hartree-Fock e Thomas-Fermi Hartree-Fock Caso de N
FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Hartree-Fock e Thomas-Fermi Hartree-Fock Caso de N
Átomos multi-eletrônicos. Indistinguibilidade
 Átomos multi-eletrônicos Indistinguibilidade Princípio de exclusão, de Pauli 1. Em um átomo multi-eletrônico nunca pode haver mais de 1 e- ocupando o mesmo estado quântico.. Um sistema constituído de vários
Átomos multi-eletrônicos Indistinguibilidade Princípio de exclusão, de Pauli 1. Em um átomo multi-eletrônico nunca pode haver mais de 1 e- ocupando o mesmo estado quântico.. Um sistema constituído de vários
Universidade de São Paulo Instituto de Física. Física Moderna II. Profa. Márcia de Almeida Rizzutto 2 o Semestre de Física Moderna 2 Aula 8
 Universidade de São Paulo Instituto de Física Física Moderna II Profa. Márcia de Almeida Rizzutto o Semestre de 04 Átomos multi-eletrônicos Indistinguibilidade Princípio de exclusão, de Pauli. Em um átomo
Universidade de São Paulo Instituto de Física Física Moderna II Profa. Márcia de Almeida Rizzutto o Semestre de 04 Átomos multi-eletrônicos Indistinguibilidade Princípio de exclusão, de Pauli. Em um átomo
A Estrutura Eletrônica dos Átomos. Prof. Fernando R. Xavier
 A Estrutura Eletrônica dos Átomos Prof. Fernando R. Xavier UDESC 2015 Estrutura Atômica, Antencedentes... Modelos de Demócrito, Dalton, Thomson, etc 400 a.c. até 1897 d.c. Nascimento da Mecânica Quântica
A Estrutura Eletrônica dos Átomos Prof. Fernando R. Xavier UDESC 2015 Estrutura Atômica, Antencedentes... Modelos de Demócrito, Dalton, Thomson, etc 400 a.c. até 1897 d.c. Nascimento da Mecânica Quântica
FF-296: Teoria do Funcional da Densidade I. Ronaldo Rodrigues Pela
 FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos Teorema de Hohenberg-Kohn Equações de Kohn-Sham Problema de N elétrons Aproximação de Born-Oppenheimer: os núcleos estão totalmente
FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos Teorema de Hohenberg-Kohn Equações de Kohn-Sham Problema de N elétrons Aproximação de Born-Oppenheimer: os núcleos estão totalmente
Estrutura Atômica. Química Quântica Prof a. Dr a. Carla Dalmolin. Átomos Polieletrônicos
 Estrutura Atômica Química Quântica Prof a. Dr a. Carla Dalmolin Átomos Polieletrônicos Átomos Polieletrônicos Átomos que possuem mais de 1 elétron A Eq. de Schrödinger pode ser resolvida exatamente apenas
Estrutura Atômica Química Quântica Prof a. Dr a. Carla Dalmolin Átomos Polieletrônicos Átomos Polieletrônicos Átomos que possuem mais de 1 elétron A Eq. de Schrödinger pode ser resolvida exatamente apenas
NOTAS DE AULAS DE FÍSICA MODERNA
 NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de agosto de 2011 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução 6.2- Equação
NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de agosto de 2011 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução 6.2- Equação
A eq. de Schrödinger em coordenadas esféricas
 A eq. de Schrödinger em coordenadas esféricas A autofunção espacial, ψ, e a energia, E, são determinadas pela solução da equação independente do tempo: Separação de variáveis Solução do tipo: Que leva
A eq. de Schrödinger em coordenadas esféricas A autofunção espacial, ψ, e a energia, E, são determinadas pela solução da equação independente do tempo: Separação de variáveis Solução do tipo: Que leva
NOTAS DE AULAS DE FÍSICA MODERNA
 NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 5 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de junho de 2014 CAPÍTULO 5 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 5.1- Introdução 5.2- Equação
NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 5 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de junho de 2014 CAPÍTULO 5 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 5.1- Introdução 5.2- Equação
Métodos de Química Computacional
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Métodos de Química Computacional Professora: Melissa Soares Caetano Métodos Semi-empíricos Expressão
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Métodos de Química Computacional Professora: Melissa Soares Caetano Métodos Semi-empíricos Expressão
Física Molecular Estrutura das Ligações Químicas
 Física Molecular Estrutura das Ligações Químicas 100 É razoável focalizar o estudo de moléculas nas interações entre elétrons e núcleos já reagrupados em caroço atômico (núcleo + camadas fechadas internas),
Física Molecular Estrutura das Ligações Químicas 100 É razoável focalizar o estudo de moléculas nas interações entre elétrons e núcleos já reagrupados em caroço atômico (núcleo + camadas fechadas internas),
CF100 - Física Moderna II. 2º Semestre de 2018 Prof. Ismael André Heisler Aula 10/08/2018
 CF100 - Física Moderna II 2º Semestre de 2018 Prof. Ismael André Heisler Aula 10/08/2018 1 Átomos Multieletrônicos 2 Partículas Idênticas 3 Na física quântica, o princípio da incerteza impede a observação
CF100 - Física Moderna II 2º Semestre de 2018 Prof. Ismael André Heisler Aula 10/08/2018 1 Átomos Multieletrônicos 2 Partículas Idênticas 3 Na física quântica, o princípio da incerteza impede a observação
Átomos polieletrónicos
 Átomos polieletrónicos Química Teórica e Estrutural P.J.S.B. Caridade & U. Miranda 2/12/2013 5/11/2013, Aula 8 Química Teórica & Estrutural (2013) Caridade & Ulises 1 Átomo de hidrogénio O Hamiltoniano
Átomos polieletrónicos Química Teórica e Estrutural P.J.S.B. Caridade & U. Miranda 2/12/2013 5/11/2013, Aula 8 Química Teórica & Estrutural (2013) Caridade & Ulises 1 Átomo de hidrogénio O Hamiltoniano
Fundamentos de Química Quântica
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Fundamentos de Química Quântica Professora: Melissa Soares Caetano Partícula na caixa Sistema ideal
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Fundamentos de Química Quântica Professora: Melissa Soares Caetano Partícula na caixa Sistema ideal
UNIVERSIDADE DE SÃO PAULO
 UNIVERSIDADE DE SÃO PAULO - Instituto de Química - Estrutura Atômica As propriedades ondulatórias do elétron Hermi F. Brito hefbrito@iq.usp.br QFL 1101 Química Geral I, -03-2017 Dualidade onda-partícula
UNIVERSIDADE DE SÃO PAULO - Instituto de Química - Estrutura Atômica As propriedades ondulatórias do elétron Hermi F. Brito hefbrito@iq.usp.br QFL 1101 Química Geral I, -03-2017 Dualidade onda-partícula
Interações Atômicas e Moleculares
 Interações Atômicas e Moleculares 6. O Princípio Variacional Prof. Pieter Westera pieter.westera@ufabc.edu.br http://professor.ufabc.edu.br/~pieter.westera/iam.html Na aula anterior, tratando de moléculas
Interações Atômicas e Moleculares 6. O Princípio Variacional Prof. Pieter Westera pieter.westera@ufabc.edu.br http://professor.ufabc.edu.br/~pieter.westera/iam.html Na aula anterior, tratando de moléculas
NOTAS DE AULAS DE FÍSICA MODERNA
 NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 8 ÁTOMOS MONOELETRÔNICOS Edição de agosto de 2008 CAPÍTULO 8 ÁTOMOS MONOELETRÔNICOS ÍNDICE 8.1- Introdução 8.2- Problema da Força Central
NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 8 ÁTOMOS MONOELETRÔNICOS Edição de agosto de 2008 CAPÍTULO 8 ÁTOMOS MONOELETRÔNICOS ÍNDICE 8.1- Introdução 8.2- Problema da Força Central
Introdução à Modelagem Molecular
 Introdução à Modelagem Molecular Prof. Alex Fabiano C. Campos, Dr Introdução Métodos teóricos e técnicas computacionais para modelar ou imitar o comportamento de moléculas e sistemas atômicos. Empregados
Introdução à Modelagem Molecular Prof. Alex Fabiano C. Campos, Dr Introdução Métodos teóricos e técnicas computacionais para modelar ou imitar o comportamento de moléculas e sistemas atômicos. Empregados
FF-296: Teoria do Funcional da Densidade I. Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Hartree-Fock e Thomas-Fermi Teorema de Hohenberg-Kohn
FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Hartree-Fock e Thomas-Fermi Teorema de Hohenberg-Kohn
Fundamentos da Mecânica Quântica
 Fundamentos da Mecânica Quântica Vitor Oguri Departamento de Física Nuclear e Altas Energias (DFNAE) Instituto de Física Armando Dias Tavares (IFADT) Universidade do Estado do Rio de Janeiro (UERJ) Rio
Fundamentos da Mecânica Quântica Vitor Oguri Departamento de Física Nuclear e Altas Energias (DFNAE) Instituto de Física Armando Dias Tavares (IFADT) Universidade do Estado do Rio de Janeiro (UERJ) Rio
NOTAS DE AULAS DE FÍSICA MODERNA
 NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de janeiro de 2009 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução 6.2- Equação
NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER Edição de janeiro de 2009 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução 6.2- Equação
FF-296: Teoria do Funcional da Densidade I. Ronaldo Rodrigues Pela
 FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos Teorema de Hellman-Feynman Conexão adiabática Buraco de XC Sucesso do LDA Estados excitados Teorema de Koopmans Teor. de Hellmann-Feynmann
FF-296: Teoria do Funcional da Densidade I Ronaldo Rodrigues Pela Tópicos Teorema de Hellman-Feynman Conexão adiabática Buraco de XC Sucesso do LDA Estados excitados Teorema de Koopmans Teor. de Hellmann-Feynmann
PPGQTA. Prof. MGM D Oca
 PPGQTA Prof. Polarizabilidade: Dureza e Moleza A polarizabilidade está relacionada ao tamanho do átomo e da capacidade deste estabilizar elétrons na nuvem eletrônica, esta matematicamente correlacionada
PPGQTA Prof. Polarizabilidade: Dureza e Moleza A polarizabilidade está relacionada ao tamanho do átomo e da capacidade deste estabilizar elétrons na nuvem eletrônica, esta matematicamente correlacionada
POSTULADOS DA MECÂNICA QUÂNTICA
 UNIVERSIDADE FEDERAL DO ABC POSTULADOS DA MECÂNICA QUÂNTICA FERNANDA MARIA RODRIGUEZ ABRIL/2015 Resumo da Apresentação O que é Mecânica Quântica? Cenário no fim do século XIX; Radiação do corpo negro;
UNIVERSIDADE FEDERAL DO ABC POSTULADOS DA MECÂNICA QUÂNTICA FERNANDA MARIA RODRIGUEZ ABRIL/2015 Resumo da Apresentação O que é Mecânica Quântica? Cenário no fim do século XIX; Radiação do corpo negro;
NOTAS DE AULAS DE FÍSICA MODERNA
 NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE DE SCHRÖDINGER Primeira Edição junho de 2005 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução
NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 6 MECÂNICA QUÂNTICA DE DE SCHRÖDINGER Primeira Edição junho de 2005 CAPÍTULO 6 MECÂNICA QUÂNTICA DE SCHRÖDINGER ÍNDICE 6.1- Introdução
Estudo Teórico das Propriedades Cinéticas da Reação NF+F = N+F 2
 SIMPOETS, CEFET-GO, 121-130, 2008 Estudo Teórico das Propriedades Cinéticas da Reação NF+F = N+F 2 Danielle Maria Fernandes Do Prado 1 Graduanda de Licenciatura em Química daniellemarfe@hotmail.com Simone
SIMPOETS, CEFET-GO, 121-130, 2008 Estudo Teórico das Propriedades Cinéticas da Reação NF+F = N+F 2 Danielle Maria Fernandes Do Prado 1 Graduanda de Licenciatura em Química daniellemarfe@hotmail.com Simone
Moléculas. Usamos a aproximação de Born- Oppenheimer, que considera os núcleos fixos, apenas o e - se movimenta.
 Moléculas Moléculas é uma coleção de 2 ou mais núcleos e seus elétrons associados, com todas as ligações complexas unidas pelas forças Os tipos mais importantes de ligação molecular são: covalente, iônica
Moléculas Moléculas é uma coleção de 2 ou mais núcleos e seus elétrons associados, com todas as ligações complexas unidas pelas forças Os tipos mais importantes de ligação molecular são: covalente, iônica
ESTRUTURA MOLECULAR. Prof. Harley P. Martins filho
 ESTRUTURA MOLECULAR Prof. Harley P. Martins filho o A aproximação de Born-Oppenheimer Núcleos são muito mais pesados que elétrons dinâmica dos elétrons pode ser estudada com os núcleos parados (aproximação
ESTRUTURA MOLECULAR Prof. Harley P. Martins filho o A aproximação de Born-Oppenheimer Núcleos são muito mais pesados que elétrons dinâmica dos elétrons pode ser estudada com os núcleos parados (aproximação
1.1. Motivação Objetivos
 1 Introdução As Unidades de Processamento Gráfico (GPUs), ou Placas Gráficas, foram originalmente desenvolvidas com o propósito de renderização gráfica. Contudo, nos últimos anos, o desempenho na realização
1 Introdução As Unidades de Processamento Gráfico (GPUs), ou Placas Gráficas, foram originalmente desenvolvidas com o propósito de renderização gráfica. Contudo, nos últimos anos, o desempenho na realização
NOTAS DE AULAS DE FÍSICA MODERNA
 NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 8 ÁTOMOS DE UM ELÉTRON Primeira Edição junho de 2005 CAPÍTULO 08 ÁTOMOS DE UM ELÉTRON ÍNDICE 8.1- Introdução 8.2- Força Central 8.3- Equação
NOTAS DE AULAS DE FÍSICA MODERNA Prof. Carlos R. A. Lima CAPÍTULO 8 ÁTOMOS DE UM ELÉTRON Primeira Edição junho de 2005 CAPÍTULO 08 ÁTOMOS DE UM ELÉTRON ÍNDICE 8.1- Introdução 8.2- Força Central 8.3- Equação
O spin do elétron. Vimos, na aula 2, que Goudsmit e Uhlenbeck propõem uma variável, quantizada, com 2 valores, com propriedades de momento angular.
 O spin do elétron Vimos, na aula, que Goudsmit e Uhlenbeck propõem uma variável, quantizada, com valores, com propriedades de momento angular. Analogia com o momento angular orbital e e com e foram observadas
O spin do elétron Vimos, na aula, que Goudsmit e Uhlenbeck propõem uma variável, quantizada, com valores, com propriedades de momento angular. Analogia com o momento angular orbital e e com e foram observadas
Não serão aceitas respostas sem justificativa:
 Primeira Prova de Conceitos de Mecânica Quântica -(,5) Uma partícula de massa m encontra-se no estado ψ(x,t)= A exp[ω(mx /ħ+it)], onde A e a são constantes reais e positivas. a- Normalize ψ(x,t); b- Calcule
Primeira Prova de Conceitos de Mecânica Quântica -(,5) Uma partícula de massa m encontra-se no estado ψ(x,t)= A exp[ω(mx /ħ+it)], onde A e a são constantes reais e positivas. a- Normalize ψ(x,t); b- Calcule
Átomos e Moléculas. Ligações moleculares. Energia do ion. A molécula de hidrogênio H 2
 Ligações moleculares Átomos e Moléculas Energia do ion H 2 + A molécula de hidrogênio Ligações moleculares Uma molécula é formada por um conjunto de átomos que interagem formando um sistema com energia
Ligações moleculares Átomos e Moléculas Energia do ion H 2 + A molécula de hidrogênio Ligações moleculares Uma molécula é formada por um conjunto de átomos que interagem formando um sistema com energia
Apresentações com base no material disponível no livro: Atkins, P.; de Paula, J.; Friedman, R. Physical Chemistry Quanta, Matter, and Change
 Físico-Química 01 Apresentações com base no material disponível no livro: Atkins, P.; de Paula, J.; Friedman, R. Physical Chemistry Quanta, Matter, and Change, 2nd Ed., Oxford, 2014 Prof. Dr. Anselmo E
Físico-Química 01 Apresentações com base no material disponível no livro: Atkins, P.; de Paula, J.; Friedman, R. Physical Chemistry Quanta, Matter, and Change, 2nd Ed., Oxford, 2014 Prof. Dr. Anselmo E
Física Moderna II - FNC376
 Universidade de São Paulo Instituto de Física Física Moderna II - FNC376 Profa. Márcia de Almeida Rizzutto 1o. Semestre de 2008 1 Resultados da Teoria de Hartree As autofunções obtidas pela teoria de Hartree
Universidade de São Paulo Instituto de Física Física Moderna II - FNC376 Profa. Márcia de Almeida Rizzutto 1o. Semestre de 2008 1 Resultados da Teoria de Hartree As autofunções obtidas pela teoria de Hartree
Física Moderna 2. Aula 9. Moléculas. Tipos de ligações. Íon H2 + Iônica Covalente Outras: ponte de hidrogênio van der Waals
 Física Moderna 2 Aula 9 Moléculas Tipos de ligações Iônica Covalente Outras: Íon H2 + ponte de hidrogênio van der Waals 1 Moléculas Uma molécula é um arranjo estável de dois ou mais átomos. Por estável
Física Moderna 2 Aula 9 Moléculas Tipos de ligações Iônica Covalente Outras: Íon H2 + ponte de hidrogênio van der Waals 1 Moléculas Uma molécula é um arranjo estável de dois ou mais átomos. Por estável
Cleber Fabiano do Nascimento Marchiori
 Cleber Fabiano do Nascimento Marchiori Programa de Pós -Graduação em Física - Departamento de Física- UFPR Estrutura Eletrônica de Moléculas Orgânicas Curitiba Janeiro, 2014 Sumário LISTA DE FIGURAS 1
Cleber Fabiano do Nascimento Marchiori Programa de Pós -Graduação em Física - Departamento de Física- UFPR Estrutura Eletrônica de Moléculas Orgânicas Curitiba Janeiro, 2014 Sumário LISTA DE FIGURAS 1
Raios atômicos Física Moderna 2 Aula 6
 Raios atômicos 1 2 8 8 18 18 32 2 Energias de ionização 3 Espectros de R-X A organização da tabela periódica reflete a distribuição dos e - nas camadas mais externas dos átomos. No entanto, é importante
Raios atômicos 1 2 8 8 18 18 32 2 Energias de ionização 3 Espectros de R-X A organização da tabela periódica reflete a distribuição dos e - nas camadas mais externas dos átomos. No entanto, é importante
Disciplina: SiComLíMol 1
 Disciplina: SiComLíMol 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite tratar quantidades macroscópicas da matéria.
Disciplina: SiComLíMol 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite tratar quantidades macroscópicas da matéria.
Equação de Onda de Schrödinger
 Equação de Onda de Schrödinger Em 1926, Schrödinger escreveu uma equação que descrevia simulteamente a natureza ondulatória e corpuscular do electrão. A função de onda Ψ (psi) descreve: 1. Energia de e
Equação de Onda de Schrödinger Em 1926, Schrödinger escreveu uma equação que descrevia simulteamente a natureza ondulatória e corpuscular do electrão. A função de onda Ψ (psi) descreve: 1. Energia de e
O estado fundamental do átomo de Hélio Prof. Ricardo L. Viana
 Universidade Federal do Paraná Setor de Ciências Exatas Departamento de Física O estado fundamental do átomo de Hélio Prof. Ricardo L. Viana Introdução O Hélio é, depois do Hidrogênio, o átomo mais simples
Universidade Federal do Paraná Setor de Ciências Exatas Departamento de Física O estado fundamental do átomo de Hélio Prof. Ricardo L. Viana Introdução O Hélio é, depois do Hidrogênio, o átomo mais simples
Equação de Schrödinger em 3D
 Equação de Schrödinger em 3D Conteúdo básico: extensão do que foi feito em 1D: p 2 /2m + V(x,y,z) = E; Equação independente do tempo: 2m 2 ψ +V(x, y, z)ψ = Eψ A interpretação probabilística envolve a integração
Equação de Schrödinger em 3D Conteúdo básico: extensão do que foi feito em 1D: p 2 /2m + V(x,y,z) = E; Equação independente do tempo: 2m 2 ψ +V(x, y, z)ψ = Eψ A interpretação probabilística envolve a integração
Ligação Covalente. O íon molecular H 2
 O íon molecular H 2 + Dois núcleos de hidrogênio estão ligados por um único elétron O que acontece à medida que os núcleos se aproximam? 4 O íon molecular H 2 + Dois núcleos de hidrogênio estão ligados
O íon molecular H 2 + Dois núcleos de hidrogênio estão ligados por um único elétron O que acontece à medida que os núcleos se aproximam? 4 O íon molecular H 2 + Dois núcleos de hidrogênio estão ligados
Schrödinger propôs uma equação que contém os termos onda e partícula. A resolução da equação leva às funções de onda. Af função de onda fornece o
 Aula 3 Estrutura Atômica cont Tabela Periódica Mecânica quântica e orbitais atômicos Schrödinger propôs uma equação que contém os termos onda e partícula. A resolução da equação leva às funções de onda.
Aula 3 Estrutura Atômica cont Tabela Periódica Mecânica quântica e orbitais atômicos Schrödinger propôs uma equação que contém os termos onda e partícula. A resolução da equação leva às funções de onda.
A Teoria de Orbitais Moleculares
 2 A Teoria de Orbitais Moleculares 2.1 A Equação de Schroedinger De acordo com a mecânica clássica de Hamilton, um sistema de partículas interagentes tem energia total : T + V = E A mecânica quântica de
2 A Teoria de Orbitais Moleculares 2.1 A Equação de Schroedinger De acordo com a mecânica clássica de Hamilton, um sistema de partículas interagentes tem energia total : T + V = E A mecânica quântica de
h mc 2 =hν mc 2 =hc/ λ
 Louis de Broglie investigou as propriedades ondulatórias da matéria na década de 30. Ele supôs que o e-, em seu movimento ao redor do núcleo, tinha associado a ele um λ. Ele igualou as duas expressões
Louis de Broglie investigou as propriedades ondulatórias da matéria na década de 30. Ele supôs que o e-, em seu movimento ao redor do núcleo, tinha associado a ele um λ. Ele igualou as duas expressões
Universidade de São Paulo em São Carlos Mecânica Quântica Aplicada Prova 1
 Universidade de São Paulo em São Carlos 9514 Mecânica Quântica Aplicada Prova 1 Nome: Questão 1: Sistema de dois níveis (3 pontos) Considere um sistema de dois estados 1 e ortonormais H do sistema seja
Universidade de São Paulo em São Carlos 9514 Mecânica Quântica Aplicada Prova 1 Nome: Questão 1: Sistema de dois níveis (3 pontos) Considere um sistema de dois estados 1 e ortonormais H do sistema seja
DICAS SOBRE A CONSTRUÇÃO DO ESPAÇO ATIVO EM CÁLCULOS MULTICONFIGURACIONAIS: UM ESTUDO DE CASOS
 http://dx.doi.org/10.5935/0100-4042.20150054 Quim. Nova, Vol. 38, No. 5, 738-748, 2015 Educação DICAS SOBRE A CONSTRUÇÃO DO ESPAÇO ATIVO EM CÁLCULOS MULTICONFIGURACIONAIS: UM ESTUDO DE CASOS Antonio Carlos
http://dx.doi.org/10.5935/0100-4042.20150054 Quim. Nova, Vol. 38, No. 5, 738-748, 2015 Educação DICAS SOBRE A CONSTRUÇÃO DO ESPAÇO ATIVO EM CÁLCULOS MULTICONFIGURACIONAIS: UM ESTUDO DE CASOS Antonio Carlos
Aplicação do Método Variacional na Mecânica Quântica:
 Aplicação do Método Variacional na Mecânica Quântica: Átomo de Hélio Milena Menezes Carvalho 1 1 Instituto de Física de São Carlos, Universidade de São Paulo E-mail: glowingsea@gmail.com 1. Introdução
Aplicação do Método Variacional na Mecânica Quântica: Átomo de Hélio Milena Menezes Carvalho 1 1 Instituto de Física de São Carlos, Universidade de São Paulo E-mail: glowingsea@gmail.com 1. Introdução
A Equação de Onda de Schröedinger. O Princípio da Incerteza de Heisenberg. λ =
 O Modelo Mecânico-Quântico Louis de Broglie apresentou a idéia de que, se as ondas luminosas exibiam características de partícula, então talvez as partículas de matéria pudessem mostrar propriedades ondulatórias.
O Modelo Mecânico-Quântico Louis de Broglie apresentou a idéia de que, se as ondas luminosas exibiam características de partícula, então talvez as partículas de matéria pudessem mostrar propriedades ondulatórias.
Estrutura Hiperfina e Efeito Zeeman para Muônio e Positrônio
 Estrutura Hiperfina e Efeito Zeeman para Muônio e Positrônio Armando Valter Felicio Zuffi 05 de dezembro de 014 Resumo Neste trabalho, serão exploradas algumas correções da hamiltoniana do átomo de hidrogênio.
Estrutura Hiperfina e Efeito Zeeman para Muônio e Positrônio Armando Valter Felicio Zuffi 05 de dezembro de 014 Resumo Neste trabalho, serão exploradas algumas correções da hamiltoniana do átomo de hidrogênio.
Gases quânticos sem interação
 UFABC - Mecânica Estatística Curso 2018.1 Prof. Germán Lugones CAPÍTULO 6 Gases quânticos sem interação!1 Regime clássico e regime quântico Para um gás ideal clássico em equilíbrio térmico a uma temperatura
UFABC - Mecânica Estatística Curso 2018.1 Prof. Germán Lugones CAPÍTULO 6 Gases quânticos sem interação!1 Regime clássico e regime quântico Para um gás ideal clássico em equilíbrio térmico a uma temperatura
Introdução à Física Atômica e Molecular
 4300315 Introdução à Física Atômica e Molecular Átomo de Hélio * : Estado Fundamental II *Referência Principal: D. Vianna, A. Fazzio e S. Canuto, Teoria Quântica de Moléculas e Sólidos Átomo de Hélio Aproximação
4300315 Introdução à Física Atômica e Molecular Átomo de Hélio * : Estado Fundamental II *Referência Principal: D. Vianna, A. Fazzio e S. Canuto, Teoria Quântica de Moléculas e Sólidos Átomo de Hélio Aproximação
Os orbitais 2p (3 orb p = px + py + pz ) estão na segunda camada energética, portanto mais afastados que o orbital esférico 2s, logo mais energético.
 1 - Introdução Os elementos mais importantes para a química orgânica são C, H, N e O. Estes elementos estão nos dois primeiros períodos da tabela periódica e os seus elétrons estão distribuídos próximos
1 - Introdução Os elementos mais importantes para a química orgânica são C, H, N e O. Estes elementos estão nos dois primeiros períodos da tabela periódica e os seus elétrons estão distribuídos próximos
NOTAS DE AULAS DE ESTRUTURA DA MATÉRIA
 NOTAS DE AULAS DE ESTRUTURA DA MATÉRIA Prof. Carlos R. A. Lima CAPÍTULO 11 MOLÉCULAS Primeira Edição junho de 2005 CAPÍTULO 11 MOLÉCULAS ÍNDICE 11-1- Introdução 11.2- Ligação por Tunelamento e a Molécula
NOTAS DE AULAS DE ESTRUTURA DA MATÉRIA Prof. Carlos R. A. Lima CAPÍTULO 11 MOLÉCULAS Primeira Edição junho de 2005 CAPÍTULO 11 MOLÉCULAS ÍNDICE 11-1- Introdução 11.2- Ligação por Tunelamento e a Molécula
Estrutura da Matéria Profª Fanny Nascimento Costa
 Estrutura da Matéria Profª Fanny Nascimento Costa (fanny.costa@ufabc.edu.br) Aula 08 Átomos multieletrônicos; Spin; Princípio da exclusão de Pauli; Periodicidade Onde está o elétron? https://www.youtube.com/watch?v=8rohpz0a70i
Estrutura da Matéria Profª Fanny Nascimento Costa (fanny.costa@ufabc.edu.br) Aula 08 Átomos multieletrônicos; Spin; Princípio da exclusão de Pauli; Periodicidade Onde está o elétron? https://www.youtube.com/watch?v=8rohpz0a70i
B) [N] é uma constante de normalização indicando que a probabilidade de encontrar o elétron em qualquer lugar do espaço deve ser unitária. R n,l (r) é
![B) [N] é uma constante de normalização indicando que a probabilidade de encontrar o elétron em qualquer lugar do espaço deve ser unitária. R n,l (r) é B) [N] é uma constante de normalização indicando que a probabilidade de encontrar o elétron em qualquer lugar do espaço deve ser unitária. R n,l (r) é](/thumbs/71/66033065.jpg) QUÍMICA I AULA 04: ESTRUTURA ELETRÔNICA DOS ÁTOMOS TÓPICO 05: ORBITAL ATÔMICO 5.1 A EQUAÇÃO DE SCHRODINGER E O ÁTOMO DE HIDROGÊNIO: Como o elétron tem propriedades ondulatórias, ele pode ser descrito como
QUÍMICA I AULA 04: ESTRUTURA ELETRÔNICA DOS ÁTOMOS TÓPICO 05: ORBITAL ATÔMICO 5.1 A EQUAÇÃO DE SCHRODINGER E O ÁTOMO DE HIDROGÊNIO: Como o elétron tem propriedades ondulatórias, ele pode ser descrito como
3 SPH. 3.1 Introdução
 3 SPH 3.1 Introdução Smoothed Particle Hydrodynamics (SPH) é um método puramente Lagrangiano desenvolvido por Lucy (1977) e Gingold (1977) em um estudo do campo da astrofísica voltado para colisão entre
3 SPH 3.1 Introdução Smoothed Particle Hydrodynamics (SPH) é um método puramente Lagrangiano desenvolvido por Lucy (1977) e Gingold (1977) em um estudo do campo da astrofísica voltado para colisão entre
FF-296: Teoria do Funcional da Densidade I. Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Problema de 1 elétron O princípio variacional Função
FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Tema de hoje: Problema de 1 elétron O princípio variacional Função
Fundamentos de Química Quântica
 Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Fundamentos de Química Quântica Aula 1 Professora: Melissa Soares Caetano Origem da teoria quântica
Universidade Federal de Ouro Preto Instituto de Ciências Exatas e Biológicas Departamento de Química Fundamentos de Química Quântica Aula 1 Professora: Melissa Soares Caetano Origem da teoria quântica
Como Entender a Física Quântica em 8 Passos! Passos
 Como Entender a Física Quântica em 8 Passos! A física quântica (também chamada de teoria quântica ou mecânica quântica) é um ramo da física que permite uma descrição do comportamento e interação da matéria
Como Entender a Física Quântica em 8 Passos! A física quântica (também chamada de teoria quântica ou mecânica quântica) é um ramo da física que permite uma descrição do comportamento e interação da matéria
Disciplina: FGE5748 Simulação Computacional de Líquidos Moleculares 1
 Disciplina: FGE5748 Simulação Computacional de Líquidos Moleculares 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite
Disciplina: FGE5748 Simulação Computacional de Líquidos Moleculares 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite
Rotor quântico. Quanticamente o rotor é descrito por uma função de onda, tal que: l A função de onda do estado estacionário é dada por:
 Rotor quântico Vamos tratar o caso da rotação de um corpo rígido, que corresponde a 2 massas pontuais, ligadas por uma barra rígida e sem massa. Consideremos rotação livre em torno de um eixo perpendicular
Rotor quântico Vamos tratar o caso da rotação de um corpo rígido, que corresponde a 2 massas pontuais, ligadas por uma barra rígida e sem massa. Consideremos rotação livre em torno de um eixo perpendicular
Estrutura Atômica I. Química Quântica Prof a. Dr a. Carla Dalmolin. Átomo de Hidrogênio Átomos Hidrogenóides
 Estrutura Atômica I Química Quântica Prof a. Dr a. Carla Dalmolin Átomo de Hidrogênio Átomos Hidrogenóides Aplicações da Mecânica Quântica Soluções da Equação de Schrödinger independente do tempo Partícula
Estrutura Atômica I Química Quântica Prof a. Dr a. Carla Dalmolin Átomo de Hidrogênio Átomos Hidrogenóides Aplicações da Mecânica Quântica Soluções da Equação de Schrödinger independente do tempo Partícula
FF-296: Teoria do Funcional da Densidade I. Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal
 FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Conexão Adiabática Sucesso do LDA Conexão Adiabática Sucesso do
FF-296: Teoria do Funcional da Densidade I Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Conexão Adiabática Sucesso do LDA Conexão Adiabática Sucesso do
4 e 6/Maio/2016 Aulas 17 e 18
 9/Abril/016 Aula 16 Princípio de Incerteza de Heisenberg. Probabilidade de encontrar uma partícula numa certa região. Posição média de uma partícula. Partícula numa caixa de potencial: funções de onda
9/Abril/016 Aula 16 Princípio de Incerteza de Heisenberg. Probabilidade de encontrar uma partícula numa certa região. Posição média de uma partícula. Partícula numa caixa de potencial: funções de onda
Física Moderna II Aula 08
 Universidade de São Paulo Instituto de Física 1 º Semestre de 2015 Profa. Márcia de Almeida Rizzutto Oscar Sala sala 220 rizzutto@if.usp.br Física Moderna II Aula 08 Monitor: Gabriel M. de Souza Santos
Universidade de São Paulo Instituto de Física 1 º Semestre de 2015 Profa. Márcia de Almeida Rizzutto Oscar Sala sala 220 rizzutto@if.usp.br Física Moderna II Aula 08 Monitor: Gabriel M. de Souza Santos
ESTRUTURA ELETRÔNICA DOS ÁTOMOS
 ESTRUTURA ELETRÔNICA DOS ÁTOMOS 2 Natureza ondulatória da luz 3 Natureza ondulatória da luz 4 Natureza ondulatória da luz 5 Natureza ondulatória da luz 6 Energia quantizada e fótons Planck quantum h é
ESTRUTURA ELETRÔNICA DOS ÁTOMOS 2 Natureza ondulatória da luz 3 Natureza ondulatória da luz 4 Natureza ondulatória da luz 5 Natureza ondulatória da luz 6 Energia quantizada e fótons Planck quantum h é
PGF Mecânica Clássica Prof. Iberê L. Caldas
 PGF 5005 - Mecânica Clássica Prof Iberê L Caldas Quarto Estudo Dirigido o semestre de 08 Os estudos dirigidos podem ser realizados em duplas Apenas os exercícios marcados com asteriscos precisam ser entregues
PGF 5005 - Mecânica Clássica Prof Iberê L Caldas Quarto Estudo Dirigido o semestre de 08 Os estudos dirigidos podem ser realizados em duplas Apenas os exercícios marcados com asteriscos precisam ser entregues
Mecânica Quântica. Química Quântica Prof a. Dr a. Carla Dalmolin. A Equação de Schrödinger Postulados da Mecânica Quântica
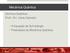 Mecânica Quântica Química Quântica Prof a. Dr a. Carla Dalmolin A Equação de Schrödinger Postulados da Mecânica Quântica Mecânica Clássica O movimento de uma partícula é governado pela Segunda Lei de Newton:
Mecânica Quântica Química Quântica Prof a. Dr a. Carla Dalmolin A Equação de Schrödinger Postulados da Mecânica Quântica Mecânica Clássica O movimento de uma partícula é governado pela Segunda Lei de Newton:
Teoria da Ligação de Valência. Prof. Fernando R. Xavier
 Teoria da Ligação de Valência Prof. Fernando R. Xavier UDESC 2013 Princípios básicos... É a primeira teoria de ligação baseada no princípios da mecânica quântica. ĤΨ(x) = EΨ(x) Considera os orbitais atômicos
Teoria da Ligação de Valência Prof. Fernando R. Xavier UDESC 2013 Princípios básicos... É a primeira teoria de ligação baseada no princípios da mecânica quântica. ĤΨ(x) = EΨ(x) Considera os orbitais atômicos
Eq. de Dirac com campo magnético
 Eq. de Dirac com campo magnético Rafael Cavagnoli GAME: Grupo de Médias e Altas Energias Eletromagnetismo clássico Eq. de Schrödinger Partícula carregada em campo mag. Eq. de Dirac Partícula carregada
Eq. de Dirac com campo magnético Rafael Cavagnoli GAME: Grupo de Médias e Altas Energias Eletromagnetismo clássico Eq. de Schrödinger Partícula carregada em campo mag. Eq. de Dirac Partícula carregada
LCE0143 Química Geral. Estrutura Atômica. Wanessa Melchert Mattos.
 LCE0143 Química Geral Estrutura Atômica Wanessa Melchert Mattos wanemelc@usp.br Princípio da Incerteza Elétron dualidade onda-partícula W. Heisenberg: impossível fixar a posição de um elétron em um átomo
LCE0143 Química Geral Estrutura Atômica Wanessa Melchert Mattos wanemelc@usp.br Princípio da Incerteza Elétron dualidade onda-partícula W. Heisenberg: impossível fixar a posição de um elétron em um átomo
Campo Elétrico [N/C] Campo produzido por uma carga pontual
![Campo Elétrico [N/C] Campo produzido por uma carga pontual Campo Elétrico [N/C] Campo produzido por uma carga pontual](/thumbs/57/40344984.jpg) Campo Elétrico Ao tentar explicar, ou entender, a interação elétrica entre duas cargas elétricas, que se manifesta através da força elétrica de atração ou repulsão, foi criado o conceito de campo elétrico,
Campo Elétrico Ao tentar explicar, ou entender, a interação elétrica entre duas cargas elétricas, que se manifesta através da força elétrica de atração ou repulsão, foi criado o conceito de campo elétrico,
PROPRIEDADES ONDULATÓRIAS DO ELÉTRON
 MODELO QUÂNTICO PROPRIEDADES ONDULATÓRIAS DO ELÉTRON EINSTEIN: usou o efeito fotoelétrico para demonstrar que a luz, geralmente imaginada como tendo propriedades de onda, pode também ter propriedades de
MODELO QUÂNTICO PROPRIEDADES ONDULATÓRIAS DO ELÉTRON EINSTEIN: usou o efeito fotoelétrico para demonstrar que a luz, geralmente imaginada como tendo propriedades de onda, pode também ter propriedades de
