Versão integral disponível em digitalis.uc.pt
|
|
|
- Lucca Sintra Sales
- 6 Há anos
- Visualizações:
Transcrição
1
2 Termodinâmica e propriedades termofísicas VOLUME 2 LÉLIO QUARESMA LOBO ABEL GOMES MARTINS FERREIRA Coimbra Imprensa da Universidade
3 I S BNDi gi t a l DOI ht t p: / / dx. doi. or g/ /
4 Somos anões que treparam aos ombros de gigantes. Desse modo, vemos mais e mais longe do que eles, não porque a nossa vista seja mais aguda ou maior a nossa estatura, mas porque eles nos erguem no ar e nos elevam com toda a sua altura gigantesca. (Bernardo de Chartres, sec. XII)
5 (Página deixada propositadamente em branco)
6 ÍNDICE Lista de símbolos Nota introdutória PARTE I. TEORIA CINÉTICA DOS GASES Introdução O modelo fisico. Pressão de um gás Distribuição das velocidades moleculares Considerações sobre as velocidades moleculares Princípio da equipartição da energia Lei de distribuição de Maxwell em termos das energias Lei de distribuição de Boltzmann Colisões entre as moléculas de um gás Livre percurso médio Efusão PARTE II. PROPRIEDADES DE TRANSPORTE DOS FLUIDOS Propriedades de transporte Viscosidade dos gases a baixa pressão Viscosidade dos fluidos densos Condutibilidade térmica Coeficiente de difusão ApÊNDICE 1. FORÇAS INTERMOLECULARES Forças intermoleculares Forças intermoleculares repulsivas Forças intermoleculares atractivas Forças electrostáticas Forças de indução Forças de dispersão Forças intermoleculares atractivas: sumário
7 19. Modelos da função potencial intermolecular Ligações de hidrogénio ApÊNDICE 2. M ÉTODOS DE ESTIMATIVA DE PROPRIEDADES DE TRANSPORTE ApÊNDICE 3. TABELAS DE PROPRIEDADES DE SUBSTÂNCIAS SIMPLES Bibliografia complementar Índice alfabético
8 LISTA DE SÍMBOLOS A parâmetro em diversas equações F força a parâmetro em diversas equações f força a aceleração; f(ã} função de distribuição da a polarizabilidade propriedade X <I> fluxo B segundo coeficiente de viria I; <I>(Q) potencial electrostático B parâmetro em diversas equações <p ângulo b parâmetro em diversas equações ~ ângulo; constante (eq. 13) h constante de Planck 1] viscosidade C propriedade de transporte genérica (eq. 42) I potencial de ionização Cp capacidade calorífica molar a pressão constante Jij parâmetro empírico na regra Cv capacidade calorífica molar a de Lorentz volume constante c velocidade molecular K parâmetro em diversas equações tridimensional k condutibilidade térmica cy capacidade calorífica específica k B constante de Boltzmann a volume constante kij parâmetro empírico na regra de y razão das capacidades caloríficas Berthelot Cp/C v t dimensão linear D coeficiente de difusão A, livre percurso médio; d diâmetro molecular parâmetro de largura da função 11 diferença entre dois valores potencial; parâmetro multiplicador de E energia Lagrange e carga do electrão E energia molecular; M massa molar relativa; mínimo da função potencial massa total do sistema (eq. 30); Co permitividade do vácuo propriedade genérica (eq. 42) 7
9 m massa molecular Tr temperatura reduzida (T/Tc) J1 momento dipolar; e momento quadrupolar massa reduzida U energia interna; N número de partículas velocidade global do fluido NA constante de Avogadro u componente da velocidade n quantidade de substância (moi) molecular na direcção Ox Vi número de ondas u(r) energia potencial intermolecular V volume P pressão Vc volume de colisão; P(X) probabilidade referente à volume crítico variável X V componente da velocidade Pc pressão crítica molecular na direcção Oy Pr pressão reduzida p quantidade de movimento w componente da velocidade molecular na direcção Oz Q carga eléctrica; Q função de partição X propriedade genérica qi coordenada de posição <X> valor médio (expectável) ç parâmetro na eq. (51); da variável X função definida na eq. (78) Z frequência das colisões R constante dos gases moleculares r distância intermolecular ri raio molecular do soluto Q1] integral de colisão rmin distância no mínimo do Qo integral de colisão (difusão) potencial új frequência; p densidade molecular numérica ângulo genérico p' densidade mássica (=p m) S área (J área de colisão (=n: ál); 8 diâmetro de colisão T temperatura T* temperatura adimensional (=kb/c) T b temperatura de ebulição normal Tc temperatura crítica Tr temperatura de fusão
10 NOTA INTRODUTÓRIA As matérias que aqui se apresentam têm feito parte do programa da disciplina de Propriedades Termofisicas, leccionada aos alunos do 3 ano da licenciatura em Engenharia Química da Universidade de Coimbra, desde a reforma curricular concretizada em 1984/85. Parte significativa fora já apresentada aos estudantes quando, em 1981/82, o autor senior organizou o programa do curso, ainda integrado em Química-Física. Quer a forma, quer o conteúdo foram sofrendo aperfeiçoamentos ao longo dos anos. Esta disciplina vem na sequência e em complemento da cadeira de Termodinâmica Química, do 1 semestre, em que se revêm os Princípios da Termodinâmica e as suas aplicações imediatas, onde se estudam as condições de equilíbrio termodinâmico dos sistemas e se estabelecem as relações físico-matemáticas que descrevem as fases que os constituem, o equilíbrio entre elas e as formas concretas de o calcular, com incidência nos sistemas constituídos por substâncias puras. Em Propriedades Termofísicas, leccionada no 2 semestre, complementando e alargando o discurso iniciado em Termodinâmica Química, optámos por organizar as matérias em dois grandes grupos. O primeiro ocupa-se do cálculo das propriedades de equilíbrio dos sistemas que consideramos de maior relevância no contexto da Engenharia Química, nomeadamente os que são constituídos por mais que um componente. São estudados o Príncipio dos estados correspondentes e as suas aplicações, o cálculo dos equilíbrios de fases e o problema da solubilidade (ef volume 1). Tudo isto em sequência natural do estudo empreendido no semestre anterior, em que a atenção foi concentrada nos conceitos fundamentais e nas propriedades tennodinâmicas das substâncias puras. O segundo grupo de matérias incluído na disciplina de Propriedades Termofísicas, objecto da presente publicação, é constituído pelo conjunto das propriedades de transporte - propriedades de não-equilíbrio, cuja definição envolve o conceito de fluxo: viscosidade, condutibilidade térmica e coeficiente de difusão. Uma melhor compreensão destes assuntos fundamenta-se na teoria cinética dos gases e requer alguma referência, ainda que breve, à teoria das forças intermoleculares, principais responsáveis pelas diferenças no compor- 9
11 tamento particular dos fluidos densos, relativamente às previsões da teoria cinética, que apenas permite explicar de forma aproximada as propriedades dos gases a baixa pressão, também chamados gases diluídos. Uma vez que nem a teoria cinética por si só, nem a sua combinação com os resultados da teoria das forças intermoleculares conseguem, ainda, chegar a resultados úteis na previsão rigorosa e expedita das propriedades de transporte da maior parte dos sistemas fluidos, puros ou em mistura, optámos por uma aproximação pragmática ao assunto. Assim, depois de estabelecermos em traços gerais os fundamentos, a metodologia e os resultados essenciais da teoria cinética, por forma a permitir uma interpretação quantitativa aproximada das propriedades de transporte, fazemos referência aos métodos de estimativa, quase todos de raiz empírica, das propriedades que constituem o corpo de informação mais utilizado na prática projectual de Engenharia Química. Para isto os estudantes são orientados para a consulta de artigos científicos e para a utilização sistemática de monografias conceituadas, nomeadamente as sucessivas edições da referência fundamental neste domínio: The Properties of Gases and Liquids, sucessivamente editada pela McGraw-Hill(a) desde Tentámos conferir ligação às diferentes matérias versadas, objectivo que se justifica com a intenção pedagógica indispensável a qualquer curso universitário, mesmo àqueles que, como este, visam as aplicações a problemas concretos de Engenharia. Os Elementos de Teoria Cinética e Propriedades de Transporte dos Gases, que aqui se apresentam têm, precisamente, a intenção de sustentar a ligação entre o que a teoria permite explicar de forma sem i-quantitativa - a partir da Teoria Cinética (Parte I) - e aquilo que as estimativas empíricas das Propriedades de Transporte (Parte II) deixam obter no domínio das quantidades úteis em Projecto. Os conceitos de teoria das forças intermoleculares e algumas tabelas de valores, relevantes para os cálculos, mas não essenciais para o desenvolvimento das matérias aqui versadas, são apresentados em apêndice. O mesmo sucede com uma súmula dos métodos de estimativa de propriedades de transporte 10 dos fluidos, que incluímos no Apêndice 2. Coimbra, Setembro de 2003 Lélio Quaresma Lobo Abel Gomes Martins Ferreira (a) Desde a versão inicial, da autoria de R. C. Reid e T. K. Sherwood, até à mais recente, a 5 a edição, publicada em 2001, tendo como co-autores B. E. Poling, J. M. Prausnitz e J. P. O'Connell; Prausnitz é também co-autor das edições de 1977 (3 a ) e de 1987, na 4 a versão, que quanto a nós é a mais conseguida (cl, pg. 180).
12 Se se tratar de moléculas de uma só espécie (do tipo 1, por exemplo), o número de pares 1-1 será dado pelo número de combinações das N) moléculas tomadas duas a duas: N) (N) - 1) 2 Para valores N) muito elevados é 2 2 e a frequência de colisões 1-1 por unidade de volume é (29) em que <CJI> é a velocidade relativa média entre moléculas do tipo 1, sendo esta média calculada para todos os pares de moléculas 1-1. A área ajl = ndjl2 é a área de colisão das moléculas da espécie 1. Note-se o factor 1/2 na expressão anterior, uma vez que em cada choque estão envolvidas duas moléculas do mesmo tipo. Para prosseguir é preciso calcular agora as velocidades relativas médias, <C12> e <C1I>. Como é sabido da Mecânica, um dos teoremas de Kõenig (adaptando-o ao caso que aqui nos interessa) afirma que a energia cinética, E, de um conjunto de dois corpos de massas m) e m2 se pode decompor numa soma de duas parcelas: 46 em que (30) : massa do sistema e mi m 2 - = => J.1 = + : massa reduzida do sistema J.1 mi m 2 mi m 2 c : velocidade do centro de massa do sistema Cl2 : velocidade relativa das duas partículas.
13 As componentes de Cl2 são Ul2 = UI-U2, Vl2 = VI-V2 e Wl2 = WI-W2. A primeira parcela do segundo membro da equação (30) representa a energia cinética de translação de um corpo de massa M (=ml+m2), movendo-se com velocidade c num referencial fixo. A segunda parcela representa a energia cinética de uma só partícula de massa /1 (massa reduzida do sistema) movendo-se com velocidade C12 em relação ao centro de massa do sistema. No que respeita às colisões moleculares só importa a parcela que envolve a velocidade relativa. Recordando que a velocidade média de partículas de massa m é dada por <c>= J8k B T ltm a velocidade relativa média de um par de partículas de massa reduzida /1 será, analogamente, (31) e a frequência de colisões 1-2 por unidade de volume vem: (32) Para um gás puro (i.e, constituído por uma só substância, 1), (33) 47 visto que quando só existem moléculas da espécie 1 Da eq. (33) pode então escrever-se, para a frequência das colisões por unidade de volume de um gás puro:
14 fi 2 (34) Como, porém, usando notação geral podemos escrever a relação entre <Cii > e <Ci> < c > = fi < c > li 1 (35) em que <cii> é a velocidade relativa média entre partículas da mesma espécie, i, e < q > é a velocidade média das partículas da espécie i. Quer dizer, (36) tendo em conta a eq. (35). Em suma, num conjunto de partículas iguais a velocidade relativa média das partículas (em relação a cada uma das restantes) é.j2 vezes maior que a velocidade molecular média no conjunto de partículas. 48 EXERCÍCIO 6 Calcular a frequência das colisões entre moléculas de O 2 na camada limite inferior da estratosfera onde a pressão média é de 5.6 kpa, e na zona superior onde a pressão é cerca de O.3kPa. As temperaturas nestas zonas limites são as indicadas no Exercício 4. Resolução: A frequência de colisões por unidade de volume é dada pela equação (34). Para o oxigénio é M= g mol- I, donde m=31.999xl0-3 kg mol-ii x l0 23 mol- I = 5.314x- 26 kg. À temperatura de 217 K a velocidade média, dada pela equação (21), é <c>= m-s- I. A densidade molecular
15 numérica retira-se da equação (8), vindo p=5.6xi0 3 Pa / [( xIO- 23 J-K-I) (217K)] = 1.869xl0 24 m- 3. Do Apêndice 3 tira-se d=3.382 A. Então, a área de colisão será <Jll=(1t)(3.382xIO- IO mf = 3.593xIO- 19 m 2. Portanto, da equação (36), resulta Zll=3.357xI0 32 m- 3 s- l. Analogamente, a 27lK (zona superior da estratosfera) <c>= m's- I, p=8.018xi0 22 m- 3 e Zll=6.916xI0 29 m- 3 s- l. Na camada superior da estratosfera a frequência de colisões é muito inferior devido à grande diminuição da densidade numérica, que não é compensada pelo aumento da velocidade média das partículas. 9. LIVRE PERCURSO MÉDIO Tem interesse definir uma quantidade que se designa por livre percurso médio, À, igual à distância média percorrida por cada molécula entre dois choques consecutivos. Por definição (devida a Maxwell) é À = velocidade média de cada molécula (número médio de colisões sofridas por cada molécula na unidade de tempo) ou, o que é o mesmo, À = (velocidade média de cada molécula)x(tempo médio entre colisões). Para um gás puro, o numerador da fracção é obviamente <Cj>. Atendendo ao que se disse, o denominador é a frequência das colisões entre cada molécula e as restantes (N-1), e será portanto dada por (37) visto que, sendo Nj»l, vem Nj-l == N j. Nestas condições, conclui-se que À= < c 1> PI (J 11 < c 11> 49 ou, usando a eq. (35), (38) o livre percurso médio é inversamente proporcional à densidade numérica do gás.
16 EXERCÍCIO 7 Considerar um reservatório contendo azoto gasoso a 25 C e à pressão de 1 atm. Calcular: a) a frequência das colisões sofridas por cada molécula individual; b) a frequência das colisões entre pares de moléculas no reservatório. Resolução: Nas condições do problema a densidade numérica molecular é P I =P/k B T= /[(1.380x l 0-23)x 298.l5]x(N m-2/j)=2.463x l 025m-3. O diâmetro de colisão do azoto é (Tabela 7) d ll =0.3632x lo- 9 m; consequentemente a área de colisão vem <r1l=1t dil 2 =4.l44x lo- 19 m 2. A velocidade relativa <Cll > pode calcular-se a partir da eq. (35), que exige a determinação prévia da velocidade média molecular <Cl >: <cl>=(8 kbt/ 1t m) l/2 =[(8x l.380x 1O-23x 398.l5)/(1tx 4.652x 10-26)] 12X [J-K- lxk) /(kg)]l/2 =475m-s- l. Teremos então que: a) a frequência das colisões sofridas por cada molécula individual será dada pela eq. (37): ZI=PI <rll < CIl > =(2.463x 1 025)X( 4.l44x )X(67l )x (m-3 m2 m-s- l) =6.85x l0 9 sol (colisões); b) a frequência das colisões entre moléculas por unidade de volume é dada pela eq. (34) ou eq. (36): Zll= (1 /2) Pl 2 <rll < CIl> =(1I2)x (2.463x 1 025)2X( 4.l44x )X(67l ) x (m-6 m2 m-s-l) =2.08x m- 3 s- 1 (colisões); 50 EXERCÍCIO 8 A densidade molecular numérica no espaço interestelar é da ordem de P ""lcm- 3. Se esse espaço for essencialmente preenchido por hidrogénio e se a temperatura for de 7 K, qual será a frequência dos choques sofridos por cada molécula de H2?
17 Resolução: Da literatura retira-se que o diâmetro da molécula de hidrogénio é d::o: 2Á = 2xl0- IO m. Teremos, então: Como virá PI ::0:10-6 m- 3 À = (J2 PI ail)-1 = ( J2 X 10-6 x 12.6 X 10-2 )-1 x (m-3xm 2 )-1 = 5.6xl0 24 m Esta distância, entre dois choques consecutivos, é enorme. Para calcular a frequência dos choques de cada molécula vamos ter de conhecer a velocidade molecular média, Ora, m=mina=2.0xi0-3/(6.022xi023)x(kg mol-i)/mol-1 = 3.3xl0-27 kg, e, portanto, e <ci>=[8x 1.38x 1O-23x7/(1tx3.3x 1O-27)]I/2x [J-K-IxKl(kg)]112 = =273 m-s- I. <CII>= J2 x 273 (m-s- I ) = 383 m-s- I Consequentemente 51 ZI=PI ali <CII> =[1O- 6 x(12.6xl0-20 )x(383)]x[m- 3 x m 2 (m-s- I )]= 4.8xl0-23 s-1. Por conseguinte, o tempo que mediará entre dois choques consecutivos da mesma molécula no espaço interestelar será o inverso de ZI: t.t =ZI-1 =_I_x s"" 2 X s=6.6x séculos.
18 EXERCícIO 9 Calcular o livre percurso médio das moléculas de O 2 nas condições do Exercício 6. Resolução: Tratando-se de um gás puro, o livre percurso médio pode ser calculado pela eq. (38). Teremos: a) para a camada inferior da estratosfera, onde T=217 K e P=5.6x 10 3 Pa, a densidade molecular numérica retira-se da equação (8), vindo p=[5.6x /(1.3 8 x 1O-23x 217)]x [(Pa/(J K-I.K)]= x ([(Pa/ (Pa'm 3 )] =1.869xl0 24 m- 3. Como o diâmetro de colisão do oxigénio é 3.382x l 0-10 m, substituindo valores na eq. (38), teremos: À= 1.fi X 1t x (3.382 X 10-10)2 x (1.869 X ) X (m 2.m- 3 ) = 1.053x 10-6 m '" 1 I-lm; b) para a camada superior, onde T= 271 K e P = 0.3x 10 3 Pa a densidade numérica é p=8.018x l0 22 m- 3 e o livre percurso médio virá, calculado como na alínea anterior, À = 2.454x 10-5 m '" 24.5 I-lm. Quer dizer, na camada superior o livre percurso médio é cerca de 25 vezes maior do que aquele que se observa na camada inferior. Este efeito deriva da diminuição de pressão e do aumento da temperatura. Isto compreendese se recordarmos que P=p kbt e 52 Para uma mistura binária gasosa de componentes 1 e 2 haverá dois livres percursos médios, À! e À 2, um por cada espécie: Âl=~~ <_C21_>.fi PI 0'11 <q> + P2 0'12 <cl2 > 1 = ======= r;;,,2 PI 0'11 + P2 0'12 Jml+m2 m2 (39)
19 visto que J8k BT <C12>= -- 1t1l e analogamente para (com as necessárias adaptações na notação dos Índices). É possível a generalização para mais que duas espécies moleculares. EXERCÍCIO 10 Calcular os livres percursos médios das moléculas de oxigénio e das de azoto no ar, nas condições de pressão e temperatura normais. Resolução: A composição aproximada do ar (em percentagem molar) é 79 por cento de azoto e 21 por cento de oxigénio. Consequentemente, consideraremos que o ar é uma mistura gasosa binária 02(1)+N2(2). Do Apêndice 3 podemos tirar para o O2 que M= g mol- 1 e d= Â, enquanto que os valores correspondentes para o N2 são g mol- 1 e 3.632Â. Nas condições de pressão e de temperatura normais (F = K e P = Pa) os valores da densidade numérica molecular para o O 2 e para o N 2 são, respectivamente, 53 e p 1=(0.21)(101325Pa)/(1.380x 1O-23}K-l)(273.15K)=5.642x 1024m-3 P2=(0. 79)(101325Pa)/(1.380x }K-l)(273.15K)=2.123x m-3 o livre percurso médio de cada uma das espécies calcula-se pela equação (39). Para o oxigénio, ml=5.314xl0-26 kg e para o azoto m2=4.652xi0-26 kg; o diâmetro de colisão é d 12 =( )12=3.507 Â e assim:
20 ÀI =1I[ h(5.642 X m- 3 )(n)(3.382 X 1O- 1 0m)2 + +(2.123 X m 3 )(n)(3.507 X m)2 X..)( ) / ] =6.723x 10-8 m. Procedendo analogamente para o N2, virá Â 2 = 6.482x 10-8 m. O livre percurso médio das moléculas de 0 2 e N 2 no ar é de valor próximo (6x 10-8 m) o que pode ser justificado por ambas as espécies possuirem tamanho e massa molecular semelhantes. Antes de deixar este assunto convém fazer uma observação. Nas duas secções precedentes ignorámos o facto de, em cada choque, haver em geral mudança de direcção da velocidade molecular. Bastaria que se definisse o volume de colisão como a soma dos volumes parcelares varridos entre cada duas colisões, como se esquematiza na Figura 9, e a conclusão não seria alterada. Por outro lado, se se considerarem as forças intermoleculares atractivas o modelo fisico terá de ser convenientemente modificado. Passará a considerar-se choque molecular qualquer interacção mútua entre moléculas que perturbe as respectivas trajectórias. A área de colisão terá de ser convenientemente alterada: definem-se uma «secção eficaz de colisão» e um «parâmetro de colisão». Mas, para as aplicações que vamos 54 Figura 9 - Volumes de colisão parcelares
21 Da Tabela 8 retira-se a seguinte informação: N2 TefK Pc!bar 34.0 V e l(em3 mol- 1) ze (J) dia Aplicando as regras de mistura: LYiZei Pem = R Tem ' resultando Pcm = 36.6 bar LYiVCi Como o ar é uma mistura de gases não polares e não quânticos, Fpmo=l e Fqmo=l. Procedendo como no exercício anterior obtém-se 1]m =181IlP, ou seja um desvio de -2 % relativamente ao valor tabelado. O método de Chung et ai. é também recomendado para este caso. A expressão a usar é F (M T)1I2 1] = cm m m d 2n m TJ onde as quantidades envolvidas têm o significado visto anteriormente. À semelhança do método de Lucas têm que ser definidas regras de mistura: (i) dm 3 = LLYi Yj di/ ' onde dii = di = O.809Vci 1 / 3 j e dij = (dii djj)1i2 91 (ii) T*=T/(e/kB)m, que vai permitir o cálculo do integral de colisão, d 3 m
22 e (iii) (iv) CO m ~ ~y. y ' CO. d ).L...L... 1 J 1J 1J j --=------"-- d----:: ' sendo CO ii= coi e COij=(COi+COj)/2 m Substituindo valores, obtêm-se sucessivamente: (i) d 12 = A, d m 3 = A3, donde d m = A; (ii) (c l /kb)=100.2 K, (c2/kb)=122.8 K, e (ElkB)m =104.4 K; (iii) M I 2 = g'mol- 1 e Mm = g mol- I ; (iv) 0)1 2 = e mm = 0.034; Como T*=300/l04.4, o integral de colisão vem Q1] = Por outro lado, Fcm = 1- (0.2756)(0.034) = Finalmente: 0.991~28.85x 300 1] m= = 1831lP (3.575) x donde decorre um desvio de %. c) Uma vez que é dada a viscosidade do líquido a uma temperatura, a estimativa de T/ a outra temperatura pode ser efectuada pela expressão devida a Lewis e Squires, eq. (48). Substituindo valores T/ - O.2661 = (0.210) ( )/233 = 1.129, donde resulta T/ = cp, valor que coincide com o que é observado experimentalmente.
23 d) Um dos métodos indicados para esta situação é o método de Teja erice, baseado no princípio dos estados correspondentes. Utiliza dois fluidos de referência. Os fluidos seleccionados para o efeito são os próprios componentes da mistura, neste caso o azoto e o oxigénio. Para a mistura N2(1)+02(2) teremos, então, onde a viscosidade T/I é calculada a uma temperatura T(Te)RI IT cm e T/2 à temperatura T(Te)R2 ITem. Tem é a temperatura de um fluido, calculada com regras de mistura apropriadas: Vem = L2>i Xj Veij j onde (V..1/3 + V..1 /3 )3 V... - el C] CI] - 8 LLXi Xj TCij VCij T cm = I j onde Tcij Vcij = ('I'ij) (Tci Tcj Vci V c j)1/2 Vcm sendo, para efeitos práticos, 'Vij= 1; ú) = ~ X ú). m L..,; I I Obtém-se V cl2 = cm 3 mol- 1 e daqui V cm =86042 cm 3 mol- l ; T Cl2 X V cl2 = cm 3 mol- I.K; T cm = K e M m = g.mol- I. V. 2/3 O parâmetro ç é dado por ~ = C 1/2 ' (TcM) vindo Çl = , Ç2 = e çm= Efectuando o cálculo da viscosidade do azoto à temperatura T=75 x (126.2/131.4) = 72 K, obtém-se T/=0.192 cp. Para o oxigénio à temperatura de T=75 x (154.6/131.4) = 88 K, obtemos T/=0.202 cp. Depois de todas as substituições teremos ln (T/m xo.3175) = 0.79xln (0.I92xO.3378) x ln (0.202xO.2492) = , e, portanto, T/m = cp. Esta estimativa tem um desvio de -14% relativamente ao valor experimental. 93
24 14. CONDUTIBILIDADE l'érmica o que se vai dizer aplica-se ao modelo que serve de fundamento à teoria cinética dos gases. Portanto, as moléculas são consideradas pontuais (e, aqui, em particular, supõem-se monoatómicas), não havendo forças intermoleculares. Por outras palavras, os resultados que procuramos aplicamse ao gás perfeito ou, quando muito, aos gases a pressões muito baixas. Consideremos, de novo, três camadas lamelares no seio do gás (A, A' e A"), separadas de uma distância  igual ao livre percurso médio molecular. Admitamos que existe um gradiente de temperatura segundo a direcção Oy e seja E a energia (cinética) de uma molécula (à temperatura 7). A 94 Figura 18 - Esquema para ilustração da condutibilidade térmica de um gás Se a velocidade média das moléculas segundo a direcção Oy for <v>, então o produto «v> M) será o espaço percorrido, em média, por cada molécula no intervalo de tempo!1t. O volume definido pelas áreas S" e S, com altura igual a «v>m) contém um certo número de moléculas, cuja velocidade, recorde-se, tem, em média, componente igual a <v> segundo a direcção Oy. Se todas as moléculas que se encontram dentro desse
25 volume se deslocassem no mesmo sentido (por exemplo, de cima para baixo, ou seja de S " para S), todas elas atravessariam a superfície S (vindas de cima) no intervalo de tempo /).t. Essas moléculas iriam transferir energia da camada A" para a camada A, por choque. Ora, por razões de simetria, metade das moléculas com componente da velocidade (segundo Oy) igual a <v> deslocar-se-á de cima para baixo (de A " para A) enquanto a outra metade se desloca em sentido contrário (de A para A" ou, o que é o mesmo, de A' para A). Como o volume do paralelipípedo (c! Figura 12) é (S <v>/).t) e a densidade numérica é p = N / V, o número de moléculas que, em média, atravessa a área S no tempo M é: e 1 - (S < v > /).t) P moléculas vindas de cima (de A" ) (S < v > /).t) P moléculas vindas de baixo (de A' ) 2 Assim, a energia transportada da camada A" para a camada A pelas moléculas (vindas de cima) é -(S<v 1 > M)p x (de) E+A- 2 dy e, portanto, o fluxo de energia correspondente, que se obtém dividindo esta quantidade por S x M, é =_.!. <v> p (E+ A de) <I> y+ 2 dy, em que o sinal (- ) se deve ao facto de o fluxo se observar no sentido dos 95 valores de y decrescentes. Analogamente, o fluxo de energia que atravessa S devido às moléculas que vêm da camada inferior (A') é: 1 ( de) <I>y_ = - < v > P E - A - 2 dy Por conseguinte, o fluxo total de energia através de S, segundo a direcção Oy, devido ao movimento molecular, é
26 ou seja: 1 <P =- de que resulta <v> p E+À,- de) 1 ( de) y <v> p E-À,- ( dy 2 dy 1 de <Py = - < v > p /\, - dy Recordando que de dy de - x dt dt dy vem m. 1 de dt ""' y = - < v > p /\, dt x dy Como sabemos da Termodinâmica, para sistemas constituídos por moléculas (monoatómicas) pontuais a energia cinética translacional, E, identifica-se com a própria energia interna do sistema, U. Deste modo, de du - == - = m c dt dt v onde Cv é a capacidade calorífica específica a volume constante e m é a massa de uma molécula. Substituindo na equação do fluxo, obtém-se: dt <Py =-<v>pà,mc - v dy 96 Comparando esta equação com a equação geral, de definição de condutibilidadetérmica (c! secção 11), conclui-se que = -k dt dy k = < v > p À, m C v
27 Mas, como se viu antes, <v> = 1.!. ~8kBT <c> 3 3 rrm e A,= 1 J2rrd 2 p Consequentemente, por substituição, obtemos para a condutibilidade térmica de um gás a baixa pressão 1 j8k;j 1 k =3".Jrrm P J2 rrd 2 P m C v ou seja k = /2 2 ~m kbt Cv rr d (53) Ora, vimos que para a viscosidade, 'T}, se obteve a equação (43): (43) o que permite concluir que k = 'T} C v ou seja ou ainda k km 'T} CV,m 1 1 (54) 97 onde M é a massa molecular relativa e CV,m é a capacidade calorífica molar a volume constante. Este quociente, adimensional, é conhecido pela designação de factor de Eucken.
28 Em conclusão: a condutibilidade térmica, k, dos gases monoatómicos não depende da pressão e deve crescer com.fi. Na realidade observa-se que: (i) k é praticamente independente da pressão, para pressões da ordem de 10 2 ou 10 3 mm Hg (ou seja, da ordem de 10 ou 10 2 kpa); (ii) fora deste intervalo, a condutibilidade térmica dos gases monoatómicos varia com a pressão; a pressões muito baixas (da ordem de 10-4 a 1mm Hg ou, o que é o mesmo, de 10-2 a 10 2 Pa) k varia linearmente com a pressão; (iii) a variação de k com a temperatura, para gases a baixa pressão, monoatómicos, é mais rápida do que a prevista pela teoria cinética (To.S): k é proporcional a potências da temperatura entre rg 6 e rg 8 para os gases monoatómicos. Para gases poliatómicos a dependência de k em ordem a T acentua-se, em virtude de Cv poder variar, também, com a temperatura. Na realidade observa-se que o valor do quociente k/( 11 c y ) é muito diferente do valor unitário previsto pela teoria cinética dos gases. Para os gases monoatómicos este quociente toma valores próximos de 2.5. A teoria de Chapman e Enskog (que admite a existência de forças intermoleculares isotrópicas) prevê um factor de Eucken modificado dado por: 98 _ k_ 11 Cv = 2.50, para gases monoatómi cos = 1.90, para gases diatórni cos = 1.72, para gases triatómi cos Constitui, portanto, uma melhoria em relação às previsões da teoria cinética na sua forma mais simples. Para gases poliatómicos, Eucken explicou a variação de k/(11 c y ) através de um mecanismo de transformação da energia cinética translacional em energia interna (rotacional, vibracional, etc.) das moléculas, em consequência dos choques. Admitindo que k resulta
29 de uma contribuição translacional e de uma contribuição interna (intrínseca das próprias moléculas), seria: k = ktransl + k int. Se, adicionalmente, se admitir que ktransl = Cy,transl e k int = 17 Cy,int onde Cv,transl e Cv,int são, respectivamente, as contribuições translacional e intrínseca para o valor de c v, segue-se que k 5 - = - C tr I + c v, int 17 2 v, ans Tendo em conta que Cv,int = Cv - Cv,transl 3 Cv,transl = "2 k B, obtém~se: Consequentemente: k 9 k B 9 R =1+-- = C v 4 C V m Como para o gás perfeito é Cp,m - CV,m= R, teremos 99 k = C -C P,m V,m 4 CV,m e finalmente, a designada correlação de Eucken, k 9 Y (55)
30 Bibliografia complementar
31 (Página deixada propositadamente em branco)
32 o primeiro objectivo desta publicação é, como se disse, o de fornecer um elemento de apoio ao curso de Termodinâmica e Propriedades Termofisicas que vimos leccionando aos alunos da licenciatura em Engenharia Química há cerca de vinte anos. Tratando-se de uma obra que tem raiz em lições organizadas para um curso específico, a apresentação dos assuntos não pode deixar de estar ligada à envolvente dessas disciplinas na orgânica da licenciatura dependendo, naturalmente, dos critérios de selecção de matérias e da própria formação dos autores. Resulta, portanto, da experiência pessoal e de pontos de vista que se foram consolidando ao longo de anos. Por estas razões, o conteúdo e o discurso que aqui se registam incorporam em si conhecimento destilado da leitura, da intervenção científica e das preocupações pedagógicas dos autores. Não é, pois, de estranhar que na apresentação destas lições se tenha dispensado a enumeração exaustiva de bibliografia especializada, cujo resultado global se considera, assim o esperamos, traduzido neste nosso trabalho. Em todo o caso, indica-se um conjunto de referências bibliográficas adicionais de eventual utilidade para o leitor mais interessado, como ponto de partida para o universo da abundante literatura da especialidade. (i) Livros de Química - Física e/ou de Termodinâmica (com bons capítulos sobre as Partes I e II) P. Atkins, L. Jones, Chemical principies, 2 nd ed., Freeman, New York, 2002 R. Chang, Physical chemistry, University Science Books, Sausalito, 2000 D. A. McQuarrie, 1. D. Simon, Physical chemistry, University Science Books, Sausalito, 1997 M. W. Zemansky, R. H. Dittman, Heat and thermodynamics, 7 th ed., McGraw-Hill, New York, 1997 G. Castellan, Physical chemistry, Addison-Wesley, New York, 1983 V. Fried, U. Blukis, H. Hameka, Physical chemistry, Collier-Mac Millan, New York, 1977 (ii) Monografias sobre teoria cinética dos gases W. Kauzmann, Kinetic theory of gases, Benjamin, New York, 1966 N. G. Parsonage, The gaseous state, Pergamon, London, 1966 J. S. Rowlinson, The perfect gas, Pergamon, London, (iii) Monografias sobre forças intermoleculares M. Rigby, E. B. Smith, W. A. Wakeham, G. C. Maitland, The forces between molecules, Clarendon, Oxford, 1986 G. C. Maitland, M. Rigby, E. B. Smith, W. A. Wakeham, Intermolecular forces, Clarendon, Oxford, 1981
33 (iv) Métodos de estimativa B. E. Poling, J. M. Prausnitz, J. P. O' Connell, The properties of gases and liquids, 5 th ed., McGraw-Hill, New York, 2001 R. C. Reid, J. M. Prausnitz, B. E. Poling, The properties of gases and liquids, 4 th ed., McGraw-Hill, New York, 1987 R. C. Reid, J. M. Prausnitz, T. K. Sherwood, The properties of gases and liquids, yd ed., McGraw-Hill, New York, 1977 R. C. Reid, T. K. Sherwood, The properties of gases and liquids, 2 nd ed., McGraw-Hill, New York, 1966 R. C. Reid, T. K. Sherwood, The properties of gases and liquids, McGraw-Hill, New York, 1958 A. Bondi, Physical properties of molecular crystals, liquids and glasses, J. Wiley, New York, 1968 S. Bretsznajder, Prediction oftransport and other physical properties offluids, Pergamon, New York, 1971 (v) Livros avançados J. O. Hirschfelder, C. F. Curtiss, R. B. Bird, Molecular theory of gases and liquids, J. Wiley, New York, 1954 C. G. Gray, K. E. Gubbins, Theory of molecular fluids, Vol 1, Clarendon Press, Oxford, 1984 S. Chapman, T. G. Cowling, The mathematical theory of nonuniform gases, Cambridge University Press, New York, 1961 C. S. Wang Chang, J. E. Uhlenbeck, Transport phenomena in polyatomic gases, Michigan Eng. Res. Report, Ann Arbour, 1951 J. Millat, J. H. Dymond, C. A. Nieto de Castro, Transport properties offluids, Cambridge University Press, Cambridge, 1996 E. I. Cussler, DifJusion: mass transfer in fluid systems, Cambridge University Press, Cambridge, (vi) Métodos experimentais Measurement of the transport properties of flu ids, W. A. Wakeham, A. Nagashima, J. V. Sengers (Editors), Blackwell, Oxford, 1991 (vii) Tabelas de propriedades N.B. Vargaftik, Tables of the thermophysical properties of liquids and gases, 2 nd ed., Hemisphere, Washington, 1975 CRC Handbook of Chemistry and Physics, D. R. Lide (Editor), 76 th ed., CRC Press, Boca Raton, 1995 R. H. Perry, D. W. Green, Perry s chemical engineers' handbook, 7 th ed., McGraw-Hill, New York, 1998 G. W. C. Kaye, T. H. Laby, Tables ofphysical and chemical constants, 15 th ed., Longman, London, 1986
34 Índice alfabético
35 (Página deixada propositadamente em branco)
36 A Aproximação de Bom e Oppenheimer área de colisão - 45 B Bernoulli, D. - 12, 14, 15 Boltzmann, L. - 14, 26, 42 Boyle, lei de - 17 Boyle, R C Célula de Knudsen - 58 Chapman, S. - 14, 73, 75, choque molecular - 54 C1ausius, R. - 14, 19, 26, 40 coeficiente de autodifusão (eq. 60) coeficiente de difusão - 66, 113 gases (Tabela) gás a baixa pressão (eq. 59) líquidos líquidos (Tabela) coeficiente de difusão mútua (eq. 63) colisões entre moléculas - 44 condutibilidade térmica - 66, 94 gases (Tabela) gás a baixa pressão (eq. 53) - 97 líquidos (Tabela) variação com a temperatura constante de Avogadro - 19 constante de Boltzmann - 20 constante de Planck convenção de sinal correcção de Axilrod e Teller (eq. 94) correlação de Eucken (eq. 55) - 99 D Debye, P , 135 densidade molecular numérica - 20 diâmetro de colisão dipolo distribuição da energia cinética molecular - 40 distribuição das velocidades moleculares - 25 E Efusão - 55, 58 energia cinética translacional média - 23 energia de indução dipolo-molécula (eq. 86) energia de indução dipolo-dipolo (eq. 87) energia dipolo-dipolo (eq. 79) energia dipolo-quadrupolo (eq. 80) energia de dispersão (eq. 89) energia de interacção dipolo-dipolo dipolo-quadrupolo quadrupolo-quadrupolo energia da ligação de hidrogénio (eq. 114) energia potencial intermolecular energia quadrupolo-quadrupolo (eq. 81) Enskog, D. - 14, 73, 75, equação de estado do gás perfeito - 20 equação geral das propriedades de transporte (eq. 42) - 65 equação de Stokes-Einstein (eq. 65) espaço das fases - 43 estados correspondentes - 81 Eucken, A. - 98, 100 F Factor de Boltzmann factor de Eucken - 97, 100 factor de Eucken modificado - 98 Fick, A fluidos densos - 14 fluxo - 66 forças atractivas - 135, 149 forças de dispersão - 135, 147 forças electrostáticas - 135, 138 forças de indução - 135, 144 forças intermoleculares forças de overlap forças repulsivas forças de sobreposição forças de van der Waals fórmula de Andrade (eq. 47) - 78, 79 fosso de potencial
37 184 Fourier, J-J - 64 frequência de colisões - 45, 46, 47 função de distribuição - 25 função de partição - 43 G Gases diluídos - 14 Graham, T H Hipótese do gás unidimensional - 15 I Integral de colisão - 74, 119 interacção entre dipolos (fig. 25) L Lei da distribuição das velocidades [Maxwell (eq. 13 e 18)]- 31,33 lei da distribuição de Boltzmann (eq. 26) - 42 lei de Boyle - 17 lei de distribuição de Maxwell-Boltzmann - 43 lei de Fick - 66 lei de Fourier - 66 lei de Graham - 58 lei de Newton - 66 ligações de hidrogénio livre percurso médio - 49 London, F , 147 M Massa reduzida - 46 Maxwell, J. C. - 14, 26, 27, 40 métodos de estimativa de coeficientes de difusão da condutibilidade térmica da viscosidade modelo de Drude modelo do gás perfeito - 15 modelos da função potencial momento dipolar - 136, 150 momento dipolar induzido (eq. 82) momento quadrupolar multiplicadores de Lagrange - 30 N Newton, I o Octopolo p Parâmetro de colisão - 54 parâmetros da função potencial (Tabela 7) Pauling, L permitividade do vácuo polarizabilidade potencial de esferas rígidas (eq. 106) potencial de ionização potencial intermolecular atractivo (eq. 93) potencial de Lennard-Jones (eq. 102 e Fig. 30) - 154, 155 potencial de Mie (eq. 97) potencial rectangular (eq. 107) potencial de Stockmayer pressão de sublimação - 58 princípio da equipartição da energia - 38, 40 probabilidade - 25 propriedades macroscópicas de substâncias simples (Tabela 8) propriedades moleculares de substâncias simples (Tabela 6) propriedades termodinâmicas - 13 propriedades termofisicas - 13 propriedades de transporte - 13, 65 Q Quadrupolo R Relação entre velocidades moleculares (eq. 22) - 36 relação entre <Cjj> e < Cj) (eq. 35) - 48 relação entre k, 1) e Cv (eq. 54) - 97 regras de combinação regra de Berthelot (eq. 109) regra de Lorentz (eq. 108) - 158
38 S Secção eficaz de colisão - 54 segundo coeficiente de virial Stokes, G T Teorema de Kõenig - 46 termo do triplo dipolo (eq. 94) U Unidades SI - 66 Uyehara e Watson - 82, 83 V Valor médio da propriedade X - 27 van der Waals, J. - 14, 128 velocidade do som - 23 velocidade mais provável - 34 velocidade molecular média - 36 velocidade quadrática média - 18, 23 velocidade relativa média - 48 viscosidade - 66 crítica - 81 de fluidos densos - 13 de gases (Tabela) - 85 de gases a baixa pressão (eq. 44) - 69, 74 de líquidos (Tabela) - 86 variação com a composição - 88 variação com a pressão - 80 variação com a temperatura - 78 volume de colisão - 45,
Lista de símbolos...7. Nota introdutória...9
 ÍNDICE Lista de símbolos...7 Nota introdutória...9 PARTE I. TEORIA CINÉTICA DOS GASES... 11 1. Introdução...13 2. O modelo físico. Pressão de um gás...15 3. Distribuição das velocidades moleculares...25
ÍNDICE Lista de símbolos...7 Nota introdutória...9 PARTE I. TEORIA CINÉTICA DOS GASES... 11 1. Introdução...13 2. O modelo físico. Pressão de um gás...15 3. Distribuição das velocidades moleculares...25
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Fases de Agregação da Matéria Sublimação (sólido em gás ou gás em sólido) Gás Evaporação (líquido em gás) Condensação (gás em líquido) Sólido
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2. Propriedades Moleculares dos Gases
 CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
CURSO: ENGENHARIA CIVIL FÍSICA GERAL E EXPERIMENTAL II 2º Período Prof.a: Érica Muniz UNIDADE 2 Propriedades Moleculares dos Gases Estado Gasoso Dentre os três estados de agregação, apenas o estado gasosos
Estudo Físico-Químico dos Gases
 Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Estudo Físico-Químico dos Gases Prof. Alex Fabiano C. Campos Gás e Vapor Diagrama de Fase Gás Vapor Gás: fluido elástico que não pode ser condensado apenas por aumento de pressão, pois requer ainda um
Programa da cadeira Termodinâmica e Teoria Cinética
 Programa da cadeira Termodinâmica e Teoria Cinética Cursos: Engenharia Civil, Engenharia de Instrumentação e Electrónica Ano lectivo 2004-05, 2º semestre Docentes: Prof. Dr. Mikhail Benilov (aulas teóricas,
Programa da cadeira Termodinâmica e Teoria Cinética Cursos: Engenharia Civil, Engenharia de Instrumentação e Electrónica Ano lectivo 2004-05, 2º semestre Docentes: Prof. Dr. Mikhail Benilov (aulas teóricas,
Física e Química A 715 (versão 1)
 Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
Exame (Resolução proposta por colaboradores da Divisão de Educação da Sociedade Portuguesa de Física) Física e Química A 715 (versão 1) 0 de Junho de 008 1. 1.1. Átomos de ferro A espécie redutora é o
Gás Ideal (1) PMT2305 Físico-Química para Metalurgia e Materiais I César Yuji Narita e Neusa Alonso-Falleiros 2012
 Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Gás Ideal (1) Para um gás, uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n). O primeiro passo para a determinação de uma equação de
Termodinâmica Aplicada. (PF: comunicar eventuais erros para Exercícios 6
 Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 6 1. Um mole de um gás de van der Waals sofre uma expansão isotérmica (à temperatura ) entre um volume inicial
Termodinâmica Aplicada (PF: comunicar eventuais erros para pmmiranda@fc.ul.pt) Exercícios 6 1. Um mole de um gás de van der Waals sofre uma expansão isotérmica (à temperatura ) entre um volume inicial
Geralmente, fazemos simplificações e desenvolvemos modelos. A matéria é composta por átomos e moléculas
 Disciplina: SiComLíMol 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite tratar quantidades macroscópicas da matéria.
Disciplina: SiComLíMol 1 A matéria é composta por átomos e moléculas Geralmente, fazemos simplificações e desenvolvemos modelos O estudo teórico não permite tratar quantidades macroscópicas da matéria.
Interpretação Molecular da Temperatura de um Gás Ideal
 Interpretação Molecular da Temperatura de um Gás Ideal Já vimos que a pressão está relacionada com a energia cinética média das moléculas. Agora relacionaremos a temperatura à uma descrição microscópica
Interpretação Molecular da Temperatura de um Gás Ideal Já vimos que a pressão está relacionada com a energia cinética média das moléculas. Agora relacionaremos a temperatura à uma descrição microscópica
TERMODINÂMICA APLICADA CAPÍTULO 2
 TERMODINÂMICA APLICADA CAPÍTULO 2 PROPRIEDADES DAS SUBSTÂNCIAS PURAS SUMÁRIO Neste capítulo o conceito de substância pura é introduzido e as várias fases, bem como as propriedades físicas dos processos
TERMODINÂMICA APLICADA CAPÍTULO 2 PROPRIEDADES DAS SUBSTÂNCIAS PURAS SUMÁRIO Neste capítulo o conceito de substância pura é introduzido e as várias fases, bem como as propriedades físicas dos processos
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785
 Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Mecânica Mecânica: estuda o estado de movimento (ou repouso) de corpos sujeitos à ação
Mecânica I (FIS-14) Prof. Dr. Ronaldo Rodrigues Pelá Sala 2602A-1 Ramal 5785 rrpela@ita.br www.ief.ita.br/~rrpela Mecânica Mecânica: estuda o estado de movimento (ou repouso) de corpos sujeitos à ação
Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio.
 EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
EQUILÍBRIO QUÍMICO Metas Aprsentar os principais conceitos envolvidos no equilíbrio químico e suas relações termodinâmicas com a constante e composições de equilíbrio. Objetivos Ao final desta aula, o
CQ110 : Princípios de FQ. Imagens de Rorschach
 Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
Imagens de Rorschach 1 Leis de velocidade Velocidade de uma reação química: Variação de reagentes / produtos em função do tempo: a A+ b B produtos v = k [A] x [B] y Lei de velocidade k: constante de velocidade
BIOMEMBRANAS. M Filomena Botelho
 BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
BIOMEMBRANAS M Filomena Botelho Transporte de massa Transporte de moléculas neutras Transporte de iões Noções de bioelectricidade Biomembranas Transporte de massa Transporte de massa ou transferência de
Apresentar os conceitos fundamentais da termodinâmica estatística e como aplicá-los as propriedades termodinâmicas vista até então.
 Introdução À Termodinâmica Estatística Aula 15 Meta Apresentar os conceitos fundamentais da termodinâmica estatística e como aplicá-los as propriedades termodinâmicas vista até então. Objetivos Ao final
Introdução À Termodinâmica Estatística Aula 15 Meta Apresentar os conceitos fundamentais da termodinâmica estatística e como aplicá-los as propriedades termodinâmicas vista até então. Objetivos Ao final
Ciência e Tecnologia de Filmes Finos. Aula Cinética dos Gases (Cap.2/Smith) (detalhes)
 Ciência e Tecnologia de Filmes Finos Aula 02-2009 Cinética dos Gases (Cap.2/Smith) (detalhes) Cinética de Gases - como os gases participam dos processos de crescimento de filmes? - quais as propriedades
Ciência e Tecnologia de Filmes Finos Aula 02-2009 Cinética dos Gases (Cap.2/Smith) (detalhes) Cinética de Gases - como os gases participam dos processos de crescimento de filmes? - quais as propriedades
Forças Intermoleculares
 Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
Forças Intermoleculares Você já se perguntou por que a água forma gotas ou como os insetos conseguem caminhar sobre a água? Gota d'água caindo sobre a superfície da água. Inseto pousado sobre a superfície
CAPÍTULO 1 Quantidades e Unidades 1. CAPÍTULO 2 Massa Atômica e Molecular; Massa Molar 16. CAPÍTULO 3 O Cálculo de Fórmulas e de Composições 26
 Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
Sumário CAPÍTULO 1 Quantidades e Unidades 1 Introdução 1 Os sistemas de medida 1 O Sistema Internacional de Unidades (SI) 1 A temperatura 2 Outras escalas de temperatura 3 O uso e o mau uso das unidades
Combustíveis Energia e Ambiente. Combustíveis gasosos, líquidos e sólidos: compreender as diferenças
 Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
Combustíveis gasosos, líquidos e sólidos: compreender as diferenças 1 Estados físicos de hidrocarbonetos em função do número de carbonos da cadeia Os gases combustíveis podem ser agrupados em famílias,
PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA
 PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA 2012 Componente de Física 1. Mecânica da Partícula 1.1 Cinemática e dinâmica da partícula em movimento
PROVAS DE ACESSO AO ENSINO SUPERIOR PARA MAIORES DE 23 ANOS PROGRAMA DA PROVA ESPECÍFICA FÍSICA/QUÍMICA 2012 Componente de Física 1. Mecânica da Partícula 1.1 Cinemática e dinâmica da partícula em movimento
NOTAS DE AULA INTRODUÇÃO À ENGENHARIA BIOMÉDICA 70
 NOTAS DE AULA INTRODUÇÃO À ENGENHARIA BIOMÉDICA 70 4.2 CINETICA DO CORPO HUMANO a. Sistemas de massa A seção anterior considerou cinemática de corpo humano e definiu as equações pertinentes. Recorde que
NOTAS DE AULA INTRODUÇÃO À ENGENHARIA BIOMÉDICA 70 4.2 CINETICA DO CORPO HUMANO a. Sistemas de massa A seção anterior considerou cinemática de corpo humano e definiu as equações pertinentes. Recorde que
UNIVERSIDADE PRESBITERIANA MACKENZIE CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE
 UNIVERSIDADE PRESBITERIANA MACKENZIE CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PLANO DE ENSINO Código Unidade 040 CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE Curso Etapa Sem. / Ano 4045-1 Farmácia 2ª 2º /
UNIVERSIDADE PRESBITERIANA MACKENZIE CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PLANO DE ENSINO Código Unidade 040 CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE Curso Etapa Sem. / Ano 4045-1 Farmácia 2ª 2º /
Gases. 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação?
 Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
Capítulo 2 Gases 1. Qual a equação de Van der Waals para o gás real e qual o significado de cada termo dessa equação? Van der Waals verificou que o fato do gás real não se comportar como o gás ideal é
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS
 PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto Lei n.º 64/2006, de 21 de Março) 2010 PROVA DE QUÍMICA Data da prova:
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS (Decreto Lei n.º 64/2006, de 21 de Março) 2010 PROVA DE QUÍMICA Data da prova:
Problemas de Física Estatística e Termodinâmica
 1 Problemas de Física Estatística e Termodinâmica Todas as grandezas físicas se supõem expressas no Sistema Internacional de Unidades. 1. Uma variável aleatória y pode tomar valores no conjunto {1,2,3,4,5}
1 Problemas de Física Estatística e Termodinâmica Todas as grandezas físicas se supõem expressas no Sistema Internacional de Unidades. 1. Uma variável aleatória y pode tomar valores no conjunto {1,2,3,4,5}
UNIVERSIDADE EDUARDO MONDLANE Faculdade de Engenharia. Transmissão de calor. 3º ano
 UNIVERSIDADE EDUARDO MONDLANE Faculdade de Engenharia Transmissão de calor 3º ano Aula 3 Equação diferencial de condução de calor Condições iniciais e condições de fronteira; Geração de Calor num Sólido;
UNIVERSIDADE EDUARDO MONDLANE Faculdade de Engenharia Transmissão de calor 3º ano Aula 3 Equação diferencial de condução de calor Condições iniciais e condições de fronteira; Geração de Calor num Sólido;
TRANSFERÊNCIA DE CALOR POR CONVECÇÃO NATURAL E FORÇADA À VOLTA DE CILINDROS METÁLICOS TP4
 TRANSFERÊNCIA DE CALOR POR CONVECÇÃO NATURAL E FORÇADA À VOLTA DE CILINDROS METÁLICOS TP4 LABORATÓRIOS DE ENGENHARIA QUÍMICA I 2009/2010 1. Objectivo Determinação do coeficiente de convecção natural e
TRANSFERÊNCIA DE CALOR POR CONVECÇÃO NATURAL E FORÇADA À VOLTA DE CILINDROS METÁLICOS TP4 LABORATÓRIOS DE ENGENHARIA QUÍMICA I 2009/2010 1. Objectivo Determinação do coeficiente de convecção natural e
LIGAÇÕES QUÍMICAS INTERMOLECULARES
 LIGAÇÕES QUÍMICAS INTERMOLECULARES Ligações Químicas INTRAmoleculares INTERmoleculares Tipo de Ligação Química INTERMOLECULAR INTRAMOLECULAR Magnitude Comparativamente FRACA FORTE Polaridade em Ligações
LIGAÇÕES QUÍMICAS INTERMOLECULARES Ligações Químicas INTRAmoleculares INTERmoleculares Tipo de Ligação Química INTERMOLECULAR INTRAMOLECULAR Magnitude Comparativamente FRACA FORTE Polaridade em Ligações
Universidade Federal do Pampa UNIPAMPA. Teoria Cinética do Gases
 Universidade Federal do ampa UNIAMA Teoria inética do Gases 7.alores específicos molares de um gás ideal A quantidade de gás ideal é medida pelo número de moles n, em vez da massa m O gás é submetido
Universidade Federal do ampa UNIAMA Teoria inética do Gases 7.alores específicos molares de um gás ideal A quantidade de gás ideal é medida pelo número de moles n, em vez da massa m O gás é submetido
Cinética. Módulo I - Físico Química Avançada. Profa. Kisla P. F. Siqueira
 Cinética Módulo I - Físico Química vançada Profa. Introdução Estudo das velocidades das reações químicas; Velocidade em função das concentrações das espécies presentes; Leis de velocidade: equações diferenciais;
Cinética Módulo I - Físico Química vançada Profa. Introdução Estudo das velocidades das reações químicas; Velocidade em função das concentrações das espécies presentes; Leis de velocidade: equações diferenciais;
Neste caso, diz-se que a reação é de primeira ordem, e a equação pode ser resolvida conforme segue abaixo:
 1. Introdução Cinética Química A termodinâmica indica a direção e a extensão de uma transformação química, porém não indica como, nem a que velocidade, uma reação acontece. A velocidade de uma reação deve
1. Introdução Cinética Química A termodinâmica indica a direção e a extensão de uma transformação química, porém não indica como, nem a que velocidade, uma reação acontece. A velocidade de uma reação deve
Trabalho prático 2. Laboratório de Química Física Biológica 2012/2013. Influência da força iónica na actividade do catião hidrogénio
 Influência da força iónica na actividade do catião hidrogénio Trabalho prático 2 Henrique Silva Fernandes João Manuel Rodrigues Ricardo Jorge Almeida 16 de março de 2013 Índice DADOS E CÁLCULOS PRÉVIOS...
Influência da força iónica na actividade do catião hidrogénio Trabalho prático 2 Henrique Silva Fernandes João Manuel Rodrigues Ricardo Jorge Almeida 16 de março de 2013 Índice DADOS E CÁLCULOS PRÉVIOS...
Agrupamento de Escolas da Senhora da Hora
 Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Multimédia Informação Prova da Disciplina de Física - Módulo: 1 Forças e Movimentos; Estática Modalidade da Prova: Escrita Ano
Agrupamento de Escolas da Senhora da Hora Curso Profissional de Técnico de Multimédia Informação Prova da Disciplina de Física - Módulo: 1 Forças e Movimentos; Estática Modalidade da Prova: Escrita Ano
Equação de Schrödinger
 Maria Inês Barbosa de Carvalho Equação de Schrödinger Apontamentos para a disciplina Física dos Estados da Matéria 00/0 Licenciatura em Engenharia Electrotécnica e de Computadores Faculdade de Engenharia
Maria Inês Barbosa de Carvalho Equação de Schrödinger Apontamentos para a disciplina Física dos Estados da Matéria 00/0 Licenciatura em Engenharia Electrotécnica e de Computadores Faculdade de Engenharia
ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA
 ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA Camilo Andrea Angelucci META Compreender os conceitos relacionados as leis de velocidade e seus modelos matematicos. compreender as aplicações conjuntas dessas
ATIVIDADES SOBRE LEIS DE VELOCIDADE CINÉTICA Camilo Andrea Angelucci META Compreender os conceitos relacionados as leis de velocidade e seus modelos matematicos. compreender as aplicações conjuntas dessas
TEORIA DO ESTADO ESTACIONÁRIO E SIMULAÇÃO COMPUTACIONAL.
 EXERCÍCIOS SOBRE: TEORIA DA COLISÃO, TEORIA DO ESTADO ESTACIONÁRIO E SIMULAÇÃO COMPUTACIONAL. Glauber Silva Godoi META Desenvolver no aluno a capacidade de extrair os parâmetros cinéticos de uma reação
EXERCÍCIOS SOBRE: TEORIA DA COLISÃO, TEORIA DO ESTADO ESTACIONÁRIO E SIMULAÇÃO COMPUTACIONAL. Glauber Silva Godoi META Desenvolver no aluno a capacidade de extrair os parâmetros cinéticos de uma reação
As variáveis de rotação
 Capítulo 10 Rotação Neste capítulo vamos estudar o movimento de rotação de corpos rígidos sobre um eixo fixo. Para descrever esse tipo de movimento, vamos introduzir os seguintes conceitos novos: -Deslocamento
Capítulo 10 Rotação Neste capítulo vamos estudar o movimento de rotação de corpos rígidos sobre um eixo fixo. Para descrever esse tipo de movimento, vamos introduzir os seguintes conceitos novos: -Deslocamento
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E tecnologia PARAÍBA. Ministério da Educação
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E tecnologia PARAÍBA Ministério da Educação Instituto Federal de Educação, Ciência e Tecnologia da Paraíba - Campus Cajazeiras Diretoria de Ensino / Coord. do Curso
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E tecnologia PARAÍBA Ministério da Educação Instituto Federal de Educação, Ciência e Tecnologia da Paraíba - Campus Cajazeiras Diretoria de Ensino / Coord. do Curso
Fundamentos de Química
 FCiências Fundamentos de Química Apontamentos Equilíbrio químico, Ácido e Bases, Cinética Química Produzido por Filipa França Divulgado e Partilhado por FCiências Equilíbrio Químico FCiências Reações em
FCiências Fundamentos de Química Apontamentos Equilíbrio químico, Ácido e Bases, Cinética Química Produzido por Filipa França Divulgado e Partilhado por FCiências Equilíbrio Químico FCiências Reações em
CQ110 : Princípios de FQ
 CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
CQ 110 Princípios de Físico Química Curso: Farmácia 1º semestre de 2011 Quartas / Quintas: 9:30 11:30 Prof. Dr. Marcio Vidotti www.quimica.ufpr.br/mvidotti mvidotti@ufpr.br criação de modelos CQ110 : Princípios
Série IV - Momento Angular (Resoluções Sucintas)
 Mecânica e Ondas, 0 Semestre 006-007, LEIC Série IV - Momento Angular (Resoluções Sucintas) 1. O momento angular duma partícula em relação à origem é dado por: L = r p a) Uma vez que no movimento uniforme
Mecânica e Ondas, 0 Semestre 006-007, LEIC Série IV - Momento Angular (Resoluções Sucintas) 1. O momento angular duma partícula em relação à origem é dado por: L = r p a) Uma vez que no movimento uniforme
Transporte Iônico e o Potencial de Membrana
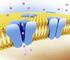 Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Transporte Iônico e o Potencial de Membrana Até o momento, consideramos apenas o transporte de solutos neutros (sem carga elétrica) através da membrana celular. A partir de agora, vamos passar a estudar
Cinemática de Mecanismos
 Cinemática de Mecanismos C. Glossário de Termos Paulo Flores J.C. Pimenta Claro Universidade do Minho Escola de Engenharia Guimarães 2007 In language, clarity is everything. Confucius C. GLOSSÁRIO DE
Cinemática de Mecanismos C. Glossário de Termos Paulo Flores J.C. Pimenta Claro Universidade do Minho Escola de Engenharia Guimarães 2007 In language, clarity is everything. Confucius C. GLOSSÁRIO DE
PROPRIEDADE DOS GASES
 RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
RORIEDADE DOS GASES 0. Gás Ideal x Gás Real eoria Cinética dos Gases A eoria Cinética dos Gases procura dar uma idéia da estrutura interna dos gases através de hipóteses, criando-se um modelo que sirva
1. Camada limite atmosférica
 Meteorologia 1. Camada limite atmosférica Equações da dinâmica Num referencial em rotação, a atmosfera satisfaz as equações de Navier-Stokes para um fluido newtoniano: (1-1) (1-2) (1-3) onde é o operador
Meteorologia 1. Camada limite atmosférica Equações da dinâmica Num referencial em rotação, a atmosfera satisfaz as equações de Navier-Stokes para um fluido newtoniano: (1-1) (1-2) (1-3) onde é o operador
Escoamento completamente desenvolvido
 Escoamento completamente desenvolvido A figura mostra um escoamento laminar na região de entrada de um tubo circular. Uma camada limite desenvolve-se ao longo das paredes do duto. A superfície do tubo
Escoamento completamente desenvolvido A figura mostra um escoamento laminar na região de entrada de um tubo circular. Uma camada limite desenvolve-se ao longo das paredes do duto. A superfície do tubo
Hidrocinemática 1.1 Conceitos básicos: A hidrocinemática
 Hidrocinemática 1.1 Conceitos básicos: A hidrocinemática estuda o movimento dos fluidos desde o ponto de vista meramente descritivo, isto e, sem considerar as causas que o originam. Consideram-se unicamente
Hidrocinemática 1.1 Conceitos básicos: A hidrocinemática estuda o movimento dos fluidos desde o ponto de vista meramente descritivo, isto e, sem considerar as causas que o originam. Consideram-se unicamente
Capítulo 6 Processos Envolvendo Vapores
 Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
Capítulo 6 Processos Envolvendo Vapores Pressão de vapor Define-se vapor como um componente no estado gasoso que se encontra a pressão e temperatura inferiores às do ponto crítico. Assim, um vapor pode
1. Reconhecer o átomo de hidrogénio como o Átomo mais simples.
 PROVA DE INGRESSO ANO LECTIVO 2016/2017 QUÍMICA 1. Reconhecer o átomo de hidrogénio como o Átomo mais simples. 2. Conhecer o espectro de emissão de hidrogénio. 3. Compreender como os resultados do estudo
PROVA DE INGRESSO ANO LECTIVO 2016/2017 QUÍMICA 1. Reconhecer o átomo de hidrogénio como o Átomo mais simples. 2. Conhecer o espectro de emissão de hidrogénio. 3. Compreender como os resultados do estudo
TERMODINÂMICA E ESTRUTURA DA MATÉRIA COLECÇÃO DE PROBLEMAS PARTE - II INTRODUÇÃO À TEORIA CINÉTICA CALORIMETRIA MUDANÇAS DE ESTADO
 TERMODINÂMICA E ESTRUTURA DA MATÉRIA COLECÇÃO DE PROBLEMAS PARTE - II INTRODUÇÃO À TEORIA CINÉTICA CALORIMETRIA MUDANÇAS DE ESTADO GASES IDEAIS EQUAÇÃO DE ESTADO GASES REAIS EQUAÇÃO DE VAN DER WAALS TRANSFORMAÇÕES
TERMODINÂMICA E ESTRUTURA DA MATÉRIA COLECÇÃO DE PROBLEMAS PARTE - II INTRODUÇÃO À TEORIA CINÉTICA CALORIMETRIA MUDANÇAS DE ESTADO GASES IDEAIS EQUAÇÃO DE ESTADO GASES REAIS EQUAÇÃO DE VAN DER WAALS TRANSFORMAÇÕES
CAPÍTULO 3 DINÂMICA DA PARTÍCULA: TRABALHO E ENERGIA
 CAPÍLO 3 DINÂMICA DA PARÍCLA: RABALHO E ENERGIA Neste capítulo será analisada a lei de Newton numa de suas formas integrais, aplicada ao movimento de partículas. Define-se o conceito de trabalho e energia
CAPÍLO 3 DINÂMICA DA PARÍCLA: RABALHO E ENERGIA Neste capítulo será analisada a lei de Newton numa de suas formas integrais, aplicada ao movimento de partículas. Define-se o conceito de trabalho e energia
Capítulo 3: Propriedades de uma Substância Pura
 Capítulo 3: Propriedades de uma Substância Pura Substância pura Princípio de estado Equilíbrio de fases Diagramas de fases Equação de estado do gás ideal Outras equações de estado Outras propriedades termodinâmicas
Capítulo 3: Propriedades de uma Substância Pura Substância pura Princípio de estado Equilíbrio de fases Diagramas de fases Equação de estado do gás ideal Outras equações de estado Outras propriedades termodinâmicas
Física do Estado Sólido: Sólidos Condutores
 Física do Estado Sólido: Sólidos Condutores Trabalho de Física Moderna II Professor Marcelo Gameiro Munhoz 7 de maio de 2012 André E. Zaidan Cristiane Calil Kores Rebeca Bayeh Física do Estado Sólido -
Física do Estado Sólido: Sólidos Condutores Trabalho de Física Moderna II Professor Marcelo Gameiro Munhoz 7 de maio de 2012 André E. Zaidan Cristiane Calil Kores Rebeca Bayeh Física do Estado Sólido -
3.º Teste de Física e Química A 10.º A Jan minutos /
 3.º Teste de Física e Química A 10.º A Jan. 2013 90 minutos / Nome: n.º Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas
3.º Teste de Física e Química A 10.º A Jan. 2013 90 minutos / Nome: n.º Classificação Professor E.E. GRUPO I As seis questões deste grupo são todas de escolha múltipla. Para cada uma delas são indicadas
PNV-2321 TERMODINÂMICA E TRANSFERÊNCIA DE CALOR
 PNV-31 TERMODINÂMICA E TRANSFERÊNCIA DE CALOR TRANSMISSÃO DE CALOR 1) INTRODUÇÃO Sempre que há um gradiente de temperatura no interior de um sistema ou quando há contato de dois sistemas com temperaturas
PNV-31 TERMODINÂMICA E TRANSFERÊNCIA DE CALOR TRANSMISSÃO DE CALOR 1) INTRODUÇÃO Sempre que há um gradiente de temperatura no interior de um sistema ou quando há contato de dois sistemas com temperaturas
Termodinâmica II - FMT 259
 Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2010 Lista 4 GABARITO (revisado em 22/04/10 1. (a Calcule o expoente adiabático γ = C p /C v para um gás a uma temperatura elevada, sabendo-se
Termodinâmica II - FMT 259 Diurno e Noturno, primeiro semestre de 2010 Lista 4 GABARITO (revisado em 22/04/10 1. (a Calcule o expoente adiabático γ = C p /C v para um gás a uma temperatura elevada, sabendo-se
MATRIZ DE CONTEÚDOS E DE PROCEDIMENTOS
 Elementos químicos e sua organização Agrupamento de Escolas General Humberto Delgado Sede na Escola Secundária/3 José Cardoso Pires Santo António dos Cavaleiros 10º Ano Planificação Anual 201-2016 Física
Elementos químicos e sua organização Agrupamento de Escolas General Humberto Delgado Sede na Escola Secundária/3 José Cardoso Pires Santo António dos Cavaleiros 10º Ano Planificação Anual 201-2016 Física
Aula 15 Diagramas de Fase
 Aula 15 Diagramas de Fase 1. Introdução O diagrama de fases de uma substância é um mapeamento que mostra as condições de temperatura e pressão em que as diferentes fases são termodinamicamente mais estáveis.
Aula 15 Diagramas de Fase 1. Introdução O diagrama de fases de uma substância é um mapeamento que mostra as condições de temperatura e pressão em que as diferentes fases são termodinamicamente mais estáveis.
Electromagnetismo Aula Teórica nº 24
 Electromagnetismo Aula Teórica nº 24 Departamento de Engenharia Física Faculdade de Engenharia Universidade do Porto PJVG, LMM 1 Breve revisão da última aula Energia magnética Corrente de deslocamento
Electromagnetismo Aula Teórica nº 24 Departamento de Engenharia Física Faculdade de Engenharia Universidade do Porto PJVG, LMM 1 Breve revisão da última aula Energia magnética Corrente de deslocamento
Termodinâmica das Reações de Transesterificação e de Esterificação
 UNIVERSIDADE FEDERAL DE SÃO CARLOS Laboratório de Catálise Termodinâmica das Reações de Transesterificação e de Esterificação Mini-curso: Biodiesel Demian Patrick Fabiano Outubro - 2007 1 Sumário A) Catálise
UNIVERSIDADE FEDERAL DE SÃO CARLOS Laboratório de Catálise Termodinâmica das Reações de Transesterificação e de Esterificação Mini-curso: Biodiesel Demian Patrick Fabiano Outubro - 2007 1 Sumário A) Catálise
Módulo II: A visão clássica da ligação covalente
 Módulo II: A visão clássica da ligação covalente Aula 3: Eletronegatividade de Pauling e o caráter iônico das ligações químicas 4. Eletronegatividade de Pauling e o caráter iônico das ligações covalentes
Módulo II: A visão clássica da ligação covalente Aula 3: Eletronegatividade de Pauling e o caráter iônico das ligações químicas 4. Eletronegatividade de Pauling e o caráter iônico das ligações covalentes
CINÉTICA QUÍMICA. Obs.: a variação da quantidade deverá ser sempre um valor positivo, então ela deverá ser em módulo. 1.
 CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
CINÉTICA QUÍMICA 1. Introdução O Conhecimento e o estudo da velocidade das reações, além de ser muito importante em termos industriais, também está relacionado ao nosso dia-adia, verificamos que há algumas
17/08/ /08/2011 Prof. Dr. Ricardo A. Mazza 3
 Propriedades de Uma Substância Pura Prof. Dr. Ricardo A. Mazza DE/FEM/UNICAMP 17/08/2011 Prof. Dr. Ricardo A. Mazza 1 Substância Pura Substância pura é a aquela que tem composição química invariável e
Propriedades de Uma Substância Pura Prof. Dr. Ricardo A. Mazza DE/FEM/UNICAMP 17/08/2011 Prof. Dr. Ricardo A. Mazza 1 Substância Pura Substância pura é a aquela que tem composição química invariável e
TERMODINÂMICA. Propriedades Independentes de uma Substância Pura
 UNIVERSIDADE FEDERAL RURAL DO SEMI - ÁRIDO DEPARTAMENTO DE CIÊNCIAS AMBIENTAIS TERMODINÂMICA Um motivo importante para a introdução do conceito de substância pura é que o estado de uma substância pura
UNIVERSIDADE FEDERAL RURAL DO SEMI - ÁRIDO DEPARTAMENTO DE CIÊNCIAS AMBIENTAIS TERMODINÂMICA Um motivo importante para a introdução do conceito de substância pura é que o estado de uma substância pura
GRADUAÇÃO EM ENGENHARIA ELETRÔNICA. FÍSICA IV Óptica e Física Moderna. Prof. Dr. Cesar Vanderlei Deimling
 GRADUAÇÃO EM ENGENHARIA ELETRÔNICA FÍSICA IV Óptica e Física Moderna Prof. Dr. Cesar Vanderlei Deimling O plano de ensino Bibliografia: Geração de ondas eletromagnéticas Propriedades das ondas eletromagnéticas
GRADUAÇÃO EM ENGENHARIA ELETRÔNICA FÍSICA IV Óptica e Física Moderna Prof. Dr. Cesar Vanderlei Deimling O plano de ensino Bibliografia: Geração de ondas eletromagnéticas Propriedades das ondas eletromagnéticas
VERSÃO DE TRABALHO. Prova Escrita de Física e Química A. 11.º Ano de Escolaridade. Prova 715/2.ª Fase. Critérios de Classificação
 EXAME FINAL NACIONAL DO ENSINO SECUNDÁRIO Prova Escrita de Física e Química A 11.º Ano de Escolaridade Decreto-Lei n.º 139/2012, de 5 de julho Prova 715/2.ª Fase Critérios de Classificação 12 Páginas 2015
EXAME FINAL NACIONAL DO ENSINO SECUNDÁRIO Prova Escrita de Física e Química A 11.º Ano de Escolaridade Decreto-Lei n.º 139/2012, de 5 de julho Prova 715/2.ª Fase Critérios de Classificação 12 Páginas 2015
ESTUDO DO MOVIMENTO UNIFORMEMENTE ACELERADO DETERMINAÇÃO DA ACELERAÇÃO DA GRAVIDADE
 TRABALHO PRÁTICO ESTUDO DO MOVIMENTO UNIFORMEMENTE ACELERADO DETERMINAÇÃO DA ACELERAÇÃO DA GRAVIDADE Objectivo Pretende-se estudar o movimento rectilíneo e uniformemente acelerado medindo o tempo gasto
TRABALHO PRÁTICO ESTUDO DO MOVIMENTO UNIFORMEMENTE ACELERADO DETERMINAÇÃO DA ACELERAÇÃO DA GRAVIDADE Objectivo Pretende-se estudar o movimento rectilíneo e uniformemente acelerado medindo o tempo gasto
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2
 QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
QUÍMICA - 1 o ANO MÓDULO 22 RELAÇÕES NUMÉRICAS FUNDAMENTAIS - PARTE 2 Fixação 1) (UNESP) O volume de uma massa fixa de gás ideal, a pressão constante, é diretamente proporcional à: a) concentração do gás.
Universidade de São Paulo Instituto de Física
 Universidade de São Paulo Instituto de Física FEP - FÍSICA II para o Instituto Oceanográfico º Semestre de 009 Sexta Lista de Exercícios a. Lei da Termodinâmica e Teoria Cinética dos Gases ) Uma máquina
Universidade de São Paulo Instituto de Física FEP - FÍSICA II para o Instituto Oceanográfico º Semestre de 009 Sexta Lista de Exercícios a. Lei da Termodinâmica e Teoria Cinética dos Gases ) Uma máquina
Resolução do Exame Nacional de Física e Química A 11.º, 2010, 2.ª fase, versão 1
 Resolução do Exame Nacional de Física e uímica A 11.º, 010,.ª fase, versão 1 Sociedade Portuguesa de Física, Divisão de Educação, 15 de Julho de 010, http://de.spf.pt 1. 1.1. O aumento da acidez da água
Resolução do Exame Nacional de Física e uímica A 11.º, 010,.ª fase, versão 1 Sociedade Portuguesa de Física, Divisão de Educação, 15 de Julho de 010, http://de.spf.pt 1. 1.1. O aumento da acidez da água
onde v m é a velocidade média do escoamento. O 2
 Exercício 24: São dadas duas placas planas paralelas à distância de 1 mm. A placa superior move-se com velocidade de 2 m/s, enquanto a inferior é fixa. Se o espaço entre a placas é preenchido com óleo
Exercício 24: São dadas duas placas planas paralelas à distância de 1 mm. A placa superior move-se com velocidade de 2 m/s, enquanto a inferior é fixa. Se o espaço entre a placas é preenchido com óleo
defi departamento de física
 defi departamento de física Laboratórios de Física www.defi.isep.ipp.pt Interferómetro de Michelson Instituto Superior de Engenharia do Porto Departamento de Física Rua Dr. António Bernardino de Almeida,
defi departamento de física Laboratórios de Física www.defi.isep.ipp.pt Interferómetro de Michelson Instituto Superior de Engenharia do Porto Departamento de Física Rua Dr. António Bernardino de Almeida,
Aula 14 Equilíbrio de Fases: Substâncias Puras
 Aula 14 Equilíbrio de Fases: Substâncias Puras 1. A condição de estabilidade Inicialmente precisamos estabelecer a importância da energia de Gibbs molar na discussão das transições de fase. A energia de
Aula 14 Equilíbrio de Fases: Substâncias Puras 1. A condição de estabilidade Inicialmente precisamos estabelecer a importância da energia de Gibbs molar na discussão das transições de fase. A energia de
PLANO DE ENSINO IMPLANTAÇÃO: VERSÃO: PRÉ-REQUISITOS: FGE1001
 - CCT EMENTA: Oscilações mecânicas. Estática e dinâmica de fluidos. Ondas mecânicas e acústicas. Temperatura. Calor. Teoria cinética dos gases. Leis da termodinâmica. Máquinas térmicas. Refrigeradores.
- CCT EMENTA: Oscilações mecânicas. Estática e dinâmica de fluidos. Ondas mecânicas e acústicas. Temperatura. Calor. Teoria cinética dos gases. Leis da termodinâmica. Máquinas térmicas. Refrigeradores.
Espectro Roto-vibracional do Monóxido de Carbono
 Espectro Roto-vibracional do Monóxido de Carbono Grupo 7 : David Tavares 62818, Luís Costa 62824, Marta Farracho 62845 1. Resumo Este trabalho teve como objectivo a obtenção do espectro roto-vibracional
Espectro Roto-vibracional do Monóxido de Carbono Grupo 7 : David Tavares 62818, Luís Costa 62824, Marta Farracho 62845 1. Resumo Este trabalho teve como objectivo a obtenção do espectro roto-vibracional
Teorema de Fubini. Cálculo de volumes
 Instituto Superior Técnico Departamento de Matemática Secção de Álgebra e Análise Prof. Gabriel Pires Teorema de Fubini. Cálculo de volumes Teorema de Fubini O teorema de Fubini (cf. [,, 3] permite relacionar
Instituto Superior Técnico Departamento de Matemática Secção de Álgebra e Análise Prof. Gabriel Pires Teorema de Fubini. Cálculo de volumes Teorema de Fubini O teorema de Fubini (cf. [,, 3] permite relacionar
Aula 8 Gases Ideais e Teoria Cinética
 Aula 8 Gases Ideais e Teoria Cinética Física II 2012 UNICAMP Quadro de Joseph Wrigth of Derby (1768) representando experimento de Robert Boyle Equação de estado dos gases ideais Qualquer objeto macroscópico
Aula 8 Gases Ideais e Teoria Cinética Física II 2012 UNICAMP Quadro de Joseph Wrigth of Derby (1768) representando experimento de Robert Boyle Equação de estado dos gases ideais Qualquer objeto macroscópico
FÍSICA NUCLEAR E PARTÍCULAS
 FÍSICA NUCLEAR E PARTÍCULAS DETERMINAÇÃO DA ABUNDÂNCIA NATURAL DO 40 K O potássio natural é fracamente radioactivo, contendo uma parte em 10 4 de 40 K, um isótopo de potássio emissor de electrões. Conhecendo
FÍSICA NUCLEAR E PARTÍCULAS DETERMINAÇÃO DA ABUNDÂNCIA NATURAL DO 40 K O potássio natural é fracamente radioactivo, contendo uma parte em 10 4 de 40 K, um isótopo de potássio emissor de electrões. Conhecendo
MISTURA DE GASES E TERMODINÂMICA DO EQUILÍBRIO QUÍMICO
 INSTITUTO SUPERIOR TÉCNICO LICENCIATURA EM CIÊNCIAS DE ENGENHARIA ENGENHARIA DO AMBIENTE ENERGIA E AMBIENTE 3º Ano 2º Semestre MISTURA DE GASES E TERMODINÂMICA DO EQUILÍBRIO QUÍMICO Tiago Domingos André
INSTITUTO SUPERIOR TÉCNICO LICENCIATURA EM CIÊNCIAS DE ENGENHARIA ENGENHARIA DO AMBIENTE ENERGIA E AMBIENTE 3º Ano 2º Semestre MISTURA DE GASES E TERMODINÂMICA DO EQUILÍBRIO QUÍMICO Tiago Domingos André
DO SOL AO AQUECIMENTO A ENERGIA NO AQUECIMENTO/ ARREFECIMENTO DE SISTEMAS
 DO SOL AO AQUECIMENTO A ENERGIA NO AQUECIMENTO/ ARREFECIMENTO DE SISTEMAS 01-03-2013 Dulce Campos 2 O que é de facto ENERGIA? ENERGIA Ainda não sabemos o que é energia " Ainda não sabemos o que é energia.
DO SOL AO AQUECIMENTO A ENERGIA NO AQUECIMENTO/ ARREFECIMENTO DE SISTEMAS 01-03-2013 Dulce Campos 2 O que é de facto ENERGIA? ENERGIA Ainda não sabemos o que é energia " Ainda não sabemos o que é energia.
Química Geral e Experimental II: Cinética Química. Prof. Fabrício Ronil Sensato
 Química Geral e Experimental II: Cinética Química Prof. Fabrício Ronil Sensato Resolução comentada de exercícios selecionados. Versão v2_2005 2 1) Para a reação em fase gasosa N 2 + 3H 2 2NH 3, 2) A decomposição,
Química Geral e Experimental II: Cinética Química Prof. Fabrício Ronil Sensato Resolução comentada de exercícios selecionados. Versão v2_2005 2 1) Para a reação em fase gasosa N 2 + 3H 2 2NH 3, 2) A decomposição,
EXERCÍCIOS FÍSICA 10. e problemas Exames Testes intermédios Professor Luís Gonçalves
 FÍSICA 10 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 Unidade 1 Do Sol ao
FÍSICA 10 EXERCÍCIOS e problemas Exames 2006 2007 2008 2009 2010 2011 Testes intermédios 2008 2009 2010 2011 Escola Técnica Liceal Salesiana do Estoril Professor Luís Gonçalves 2 3 Unidade 1 Do Sol ao
Grandezas Físicas Fundamentais
 ANÁLISE DIMENSIONAL Grandezas Físicas Fundamentais Grandeza Física Unidade no SI Comprimento L metro m Massa M quilograma kg Tempo T segundo s Temperatura termodinâmica Corrente elétrica Intensidade luminosa
ANÁLISE DIMENSIONAL Grandezas Físicas Fundamentais Grandeza Física Unidade no SI Comprimento L metro m Massa M quilograma kg Tempo T segundo s Temperatura termodinâmica Corrente elétrica Intensidade luminosa
Como a PA é decrescente, a razão é negativa. Então a PA é dada por
 Detalhamento das Soluções dos Exercícios de Revisão do mestre 1) A PA será dada por Temos Então a PA será dada por:, e como o produto é 440: Como a PA é decrescente, a razão é negativa. Então a PA é dada
Detalhamento das Soluções dos Exercícios de Revisão do mestre 1) A PA será dada por Temos Então a PA será dada por:, e como o produto é 440: Como a PA é decrescente, a razão é negativa. Então a PA é dada
Apostila de Química 01 Estudo dos Gases
 Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
Apostila de Química 01 Estudo dos Gases 1.0 Conceitos Pressão: Número de choques de suas moléculas contra as paredes do recipiente. 1atm = 760mHg = 760torr 105Pa (pascal) = 1bar. Volume 1m³ = 1000L. Temperatura:
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES
 MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
MUDANÇA DE ESTADO ROMPIMENTO DE FORÇAS INTERMOLECULARES DEFORMAÇÃO DA NUVEM ELETRÔNICA EFEITO COLISÃO = CHOQUE ///// EFEITO INDUÇÃO = VARIAÇÃO ELÉTRICA DIPOLO INDUZIDO FORÇAS DE LONDON ///// DIPOLO INSTANTÂNEO
- identificar operadores ortogonais e unitários e conhecer as suas propriedades;
 DISCIPLINA: ELEMENTOS DE MATEMÁTICA AVANÇADA UNIDADE 3: ÁLGEBRA LINEAR. OPERADORES OBJETIVOS: Ao final desta unidade você deverá: - identificar operadores ortogonais e unitários e conhecer as suas propriedades;
DISCIPLINA: ELEMENTOS DE MATEMÁTICA AVANÇADA UNIDADE 3: ÁLGEBRA LINEAR. OPERADORES OBJETIVOS: Ao final desta unidade você deverá: - identificar operadores ortogonais e unitários e conhecer as suas propriedades;
O QUE É TERMOMETRIA E TEMPERATURA??
 TERMOMETRIA O QUE É TERMOMETRIA E TEMPERATURA?? Termometria: Área específica da Termodinâmica que estuda a temperatura e suas diferentes escalas usadas pelo mundo Temperatura: Parâmetro termométrico que
TERMOMETRIA O QUE É TERMOMETRIA E TEMPERATURA?? Termometria: Área específica da Termodinâmica que estuda a temperatura e suas diferentes escalas usadas pelo mundo Temperatura: Parâmetro termométrico que
Química 2º Ano. Professora Cristina Lorenski Ferreira
 Química 2º Ano Professora Cristina Lorenski Ferreira 2016 1 GEOMETRIA MOLECULAR POLARIDADE DAS MOLÉCULAS INTERAÇÕES INTERMOLECULARES PROFESSORA CRISTINA LORENSKI FERREIRA 2 ALGUNS QUESTIONAMENTOS Como
Química 2º Ano Professora Cristina Lorenski Ferreira 2016 1 GEOMETRIA MOLECULAR POLARIDADE DAS MOLÉCULAS INTERAÇÕES INTERMOLECULARES PROFESSORA CRISTINA LORENSKI FERREIRA 2 ALGUNS QUESTIONAMENTOS Como
Soluções das Questões de Física da Universidade do Estado do Rio de Janeiro UERJ
 Soluções das Questões de Física da Universidade do Estado do Rio de Janeiro UERJ 1º Exame de Qualificação 011 Vestibular 011 Utilize as informações a seguir para responder às questões de números e 3. Um
Soluções das Questões de Física da Universidade do Estado do Rio de Janeiro UERJ 1º Exame de Qualificação 011 Vestibular 011 Utilize as informações a seguir para responder às questões de números e 3. Um
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo
 Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Formas de representação e interações intermoleculares Aula 3 1- Fórmula química Maneira que os químicos possuem
Química Orgânica I Profa. Dra. Alceni Augusta Werle Profa. Dra. Tania Márcia do Sacramento Melo Formas de representação e interações intermoleculares Aula 3 1- Fórmula química Maneira que os químicos possuem
Regime: Semestre: GRANDEZAS FÍSICAS, UNIDADES E DIMENSÕES Conceito de Grandeza: Grandezas fundamentais e derivadas
 FUNDAMENTOS DE FÍSICA [10400] GERAL Regime: Semestre: OBJETIVOS O objectivo da disciplina de Física é o de adquirir conhecimentos técnicos baseados nos princípios físicos fundamentais à análise de problemas
FUNDAMENTOS DE FÍSICA [10400] GERAL Regime: Semestre: OBJETIVOS O objectivo da disciplina de Física é o de adquirir conhecimentos técnicos baseados nos princípios físicos fundamentais à análise de problemas
EDITAL DE TURMA ESPECIAL
 Edital N 0132 2016. Cacoal, 31 de Outubro de 2016. EDITAL DE TURMA ESPECIAL A Faculdade de Ciências Biomédicas de Cacoal FACIMED, no uso de suas atribuições legais, e tendo presente o disposto no Art.
Edital N 0132 2016. Cacoal, 31 de Outubro de 2016. EDITAL DE TURMA ESPECIAL A Faculdade de Ciências Biomédicas de Cacoal FACIMED, no uso de suas atribuições legais, e tendo presente o disposto no Art.
EP34D Fenômenos de Transporte
 EP34D Fenômenos de Transporte Prof. Dr. André Damiani Rocha arocha@utfpr.edu.br Introdução à Transferência de Calor 2 Introdução à Transferência de Calor O que é Transferência de Calor? Transferência de
EP34D Fenômenos de Transporte Prof. Dr. André Damiani Rocha arocha@utfpr.edu.br Introdução à Transferência de Calor 2 Introdução à Transferência de Calor O que é Transferência de Calor? Transferência de
Cinética Química. Prof. Alex Fabiano C. Campos
 Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
Cinética Química Prof. Alex Fabiano C. Campos Rapidez Média das Reações A cinética é o estudo da rapidez com a qual as reações químicas ocorrem. A rapidez de uma reação pode ser determinada pela variação
ESTUDO DO COMPORTAMENTO DE UM GÁS POR DINÂMICA MOLECULAR.
 ESTUDO DO COMPORTAMENTO DE UM GÁS POR DINÂMICA MOLECULAR. João Paulo Smykaluk (ICV-UNICENTRO), Eduardo Vicentini (Orientador), e-mail: evicentini@unicentro.br. Universidade Estadual do Centro-Oeste, Setor
ESTUDO DO COMPORTAMENTO DE UM GÁS POR DINÂMICA MOLECULAR. João Paulo Smykaluk (ICV-UNICENTRO), Eduardo Vicentini (Orientador), e-mail: evicentini@unicentro.br. Universidade Estadual do Centro-Oeste, Setor
SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS
 ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
ESCOLA DE ENGENHARIA DE LORENA EEL/USP TERMODINÂMICA QUÍMICA PROF. ANTONIO CARLOS DA SILVA SOLUÇÕES - SOLUÇÃO IDEAL E AS PROPRIEDADES COLIGATIVAS 1. TIPOS DE SOLUÇÕES Solução é uma mistura homogênea de
PG0054 Transferência de Calor B
 PG0054 Transferência de Calor B Prof. Dr. Thiago Antonini Alves thiagoaalves@utfpr.edu.br http://pessoal.utfpr.edu.br/thiagoaalves/ Aula 0 09/08/2016 Apresentação do Plano de Ensino 2016/2 Sumário Objetivos
PG0054 Transferência de Calor B Prof. Dr. Thiago Antonini Alves thiagoaalves@utfpr.edu.br http://pessoal.utfpr.edu.br/thiagoaalves/ Aula 0 09/08/2016 Apresentação do Plano de Ensino 2016/2 Sumário Objetivos
FÍSICA E QUÍMICA A 10º ANO
 Departamento de Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 10º ANO PLANIFICAÇÃO 011 / 01 PLANIFICAÇÃO A LONGO PRAZO Período 1º 1/09 a 1/1 º 03/01 a 3/03 3º 10/0 a 08/0 Nº Semanas Nº aulas totais
Departamento de Matemática e Ciências Experimentais FÍSICA E QUÍMICA A 10º ANO PLANIFICAÇÃO 011 / 01 PLANIFICAÇÃO A LONGO PRAZO Período 1º 1/09 a 1/1 º 03/01 a 3/03 3º 10/0 a 08/0 Nº Semanas Nº aulas totais
