DISCENTES: - Antônio Ricardo Vizentim -Ricardo B. de Oliveira. DOCENTE: Prof. Dr. José Eduardo de Oliveira Prof. Dr.
|
|
|
- Thiago Frade
- 4 Há anos
- Visualizações:
Transcrição
1 DISCENTES: - Antônio Ricardo Vizentim -Ricardo B. de Oliveira DOCENTE: Prof. Dr. José Eduardo de Oliveira Prof. Dr. Leonardo Pezza
2 Propriedades dos Solventes Imiscível vel; Formar duas Fases; Não reagir Quimicamente; com o Soluto; A Substância Orgânica a ser extraída deve ser mais solúvel no segundo solvente; Volátil til; Não ser inflamável ou tóxico.
3 Solventes mais Utilizados Tabela 1:Constantes físicas de alguns solventes
4 LEI DA DISTRIBUIÇÃO
5 O processo de extração: A) O solvente 1 contém m uma mistura de moléculas (brancas e pretas). Deseja-se separar as moléculas brancas por extração. Um segundo solvente (sombreado), que é imiscível com o primeiro e menos denso, é adicionado e ambos são agitados. B) Após s a separação das fases, a maioria das moléculas brancas, mas nem todas, foram extraídas para o novo solvente. C) Com a separação das duas camadas, as moléculas brancas e pretas, foram parcialmente separadas.
6 COEFICIENTE DE DISTRIBUIÇÃO Quando uma solução (soluto A em solvente 1) é agitada com um segundo solvente (solvente 2) com o qual é imiscível, o soluto A se distribui entre as duas fases líquidas. Quando as duas fases se separarem novamente em duas camadas de solvente distintas, um equilíbrio será alcançado ado de tal forma que a razão das concentrações do soluto em cada solvente C1 e C2 define uma constante. A constante chamada de coeficiente de distribuição (ou coeficiente de partição): K = C2 / C1
7 Exemplo: A extração do composto orgânico A, 6 g, dissolvido em 100mL de água, com volume total de 100mL de benzeno. Se a 20 C o coeficiente de partição entre a água e o benzeno é 3 então: Para uma extração única 100mL de benzeno: K m /100ml b = = 3, onde mágua é 6 mágua /100mL g m b mb /100mL 3 = mb = 4, 5g (6 m ) /100mL b após s uma extração com 100mL de benzeno, obtém-se 4,5g de A (75% do total) como rendimento da extração, restando ainda 1,5g de A na fase aquosa.
8 Para uma extração com duas porções iguais 50mL de benzeno Primeira extração: mb / 50mL 3 = mb = (6 m ) /100mL b 3,6g Remove 3,6g de A, restando 2,4g de A em solução aquosa. Segunda extração: mb '/50mL 3 = mb ' = 1, 44g (2,4 m ')/100mL b Consegue-se mais 1,44g de A, ou seja, um total de 5,04g do composto A. Restam ainda 0,96g de A na fase aquosa.
9 Comparando a extração simples com a múltipla Massa extração única: 4,5g Massa extração múltipla (2 porções): 5,04g Conclusão: Extração múltipla é mais eficiente do que a extração simples Observação: Quanto maior for o coeficiente de distribuição menor será o número de extrações sucessivas necessárias para separar o soluto com eficiência. Se K for muito pequeno, a extração simples não é recomendada devido ao gasto excessivo de solvente.
10 APARELHOS USADOS frasco cônico para volumes menores que 4 ml; tubos centrífugos para volumes até 10 ml: funis de separação para volumes maiores. Frasco cônico Tubo centrífugo Funil de separação
11 TIPOS DE EXTRAÇÃO Descontínua - Maior solubilidade em solvente orgânico do que em água. Contínua - Maior solubilidade do composto orgânico na água. Sólido-líquido Líquido-líquido - Extração com solventes quimicamente ativos -Efeito Salting-Out - Extração Múltipla -Extração simples Supercrítica
12 EXTRAÇÃO DESCONTÍNUA NUA quando é extração líquido-liquido usa-se funil de separação; ambos os solventes são colocados: indicado quando existe uma grande diferença de solubilidade do soluto nos dois solventes (grande KD). fase mais densa é recolhida. (funil de separação)
13 EXTRAÇÃO CONTÍNUA NUA o solvente orgânico passa continuamente sobre a solução contendo o soluto, levando parte deste consigo, até o balão de aquecimento; útil quando a diferença de solubilidade do soluto em ambos os solventes não é muito grande; o solvente vai sendo destilado e o soluto vai se concentrando no balão de aquecimento;
14 EXTRAÇÃO SÓLIDOS LIDO-LÍQUIDO Preparação de chá,, café,, chimarrão; componentes que estavam na fase sólida s ( póp de café) ) passam para a fase líquida l (água);( A extração é descontínua nua nos 3 casos, pois a solubilidade dos componentes extraídos em água é grande.
15 EXTRAÇÃO SÓLIDOS LIDO-LÍQUIDO Extrator de Soxhlet Usado nos casos onde a solubilidade do soluto é pequena, ou quando se quer maximizar a extração do soluto; Técnica da extração contínua; Usado para solventes de baixo ponto de ebulição; Extrator de Soxhlet
16 PROCEDIMENTO: Coloca-se o sólido s na câmara do extrator e o solvente; O balão é aquecido e os vapores condensam-se se na câmara do extrator, caindo sobre o material a extrair; Quando o nível n do destilado na câmara de extração atingir o nível n do sifão, a solução retornará ao balão. (Extrator de Soxhlet)
17 EXTRAÇÃO QUIMICAMENTE ATIVA Um composto é alterado quimicamente a fim de mudarmos o coeficiente de distribuição nos dois solventes. Exemplo: Mistura de dois compostos A e B,, sendo solúveis em éter etílico e insolúveis em água. Mudando as características de B (de modo que B seja solúvel em água, mas insolúvel em éter etílico), então poderemos separar B (fase aquosa) e A (fase orgânica éter etílico).
18 EXTRAÇÃO SIMPLES Fundamenta-se no fato de que as substâncias orgânicas são, em geral, solúveis em solventes orgânicos e muito pouco solúveis em água, de modo que, ao se formar duas fases pela adição do solvente, após s agitação, a substância passa em maior parte da fase aquosa para o solvente.
19 EXTRAÇÃO MÚLTIPLAM A solução aquosa original que jáj foi extraída uma vez é colocada novamente dentro do funil de separação com uma nova porção do solvente orgânico para uma segunda extração. - Comparação entre Extração Simples e múltipla.
20 EXTRAÇÃO SUPERCRÍTICA A extração com fluido supercrítico (SFE - "Supercritical Fluid Extraction") é uma técnica de extração utilizada principalmente quando se deseja retirar substâncias de interesse (analitos) de matrizes sólidas. Ela emprega um fluido em condições supercríticas, que apresenta propriedades intermediárias entre um gás e um líquido. O crescimento desta técnica está relacionado com a preocupação da comunidade científica com a saúde e o bem estar do ser humano, gerando a necessidade de analisar matrizes cada vez mais complexas (como águas naturais, solos, sedimentos e ar, além de amostras de alimentos, plantas, frutas, plásticos, etc.), com baixos níveis de concentração
21 Um fluido supercrítico (SF-"Supercritical Fluid") é definido como sendo formado acima do ponto crítico, da temperatura crítica (Tc) e pressão crítica (Pc), o que pode ser visualizado em um diagrama de fases, apresentado na Figura 1. É um processo que possui várias vantagens do ponto de vista do meio-ambiente e da saúde humana porque não deixa resíduos de substâncias tóxicas nos produtos ou na matriz vegetal original
22
23 NA = não se aplica O biodiesel tem a grande vantagem de ser produzido a partir de fontes renováveis de energia como as diversas oleaginosas, tais como soja, girassol, semente de algodão, canola e palmas como o dendê.este combustível pode ser usado sem nenhuma modificação no motor e produz níveis bem mais baixos de produtos poluentes e cancerígenos (SHAH, SHARMA, GUPTA, 2003). O tempo ideal para extração de óleo de mamona em aparelho Soxhlet é de 6 horas. A maior eficiência de extração de óleo de mamona em aparelho Soxhlet foi obtida com o metanol. Observou-se variação no teor de óleo de semente de mamona coletada no Estado de Pernambuco. A adição de 25 % de metanol ao etanol aumenta a eficiência de extração de óleo de mamona. Tabela Percentual de óleo extraído como função do solvente utilizado Solvente Teor de Óleo experimental (%) Teor de Óleo calculado (%) Metanol 51,1 NA Etanol 46,9 NA Hexano 41,4 NA Etanol : Metanol (1 : 1) 49,8 49,0 Etanol : Hexano (1 : 1) 49,4 44,2 Metanol : Hexano (1 : 1) 50,9 46,3 Etanol : Metanol (3 : 1) 50,3 48,0 Etanol : Hexano (3 : 1) 47,0 45,5 Metanol : Hexano (3 : 1) 48,5 48,7
24 Métodos de Extração Para volumes menores que 4ml (micro) Fase Inferior Fase Superior - Método 1 - Método 2
25 Fase inferior Extração de uma solução aquosa utilizando o CH 2 Cl 2 (d = 1,33g/ml) A solução aquosa contém a substância desejada. B - Diclorometano é usado para extrair a fase aquosa. C A pipeta é colocada no frasco cônico. D A fase orgânica é removida e transferida para um recipiente seco. A fase aquosa permanece no frasco original.
26 Fase superior: 1º 1 método Extração de uma solução aquosa utilizando o éter dietílico (d = 0,7174g/ml) A - a solução aquosa contém a substancia desejada. B Éter é usado para extrair a fase aquosa. C A fase aquosa é removida e transferida para um recipiente. A fase que contém éter permanece no frasco original. D - A camada etérea é transferida para um novo frasco. A camada aquosa é transferida de volta ao frasco original
27 Fase superior: 2º 2 método Extração de uma solução aquosa utilizando o éter dietílico (d = 0,7174 g/ml) A - Pressione o bulbo e coloque a pipeta no frasco B - Colete ambas camadas C - Coloque a camada aquosa inferior de volta ao frasco D - Coloque a camada etérea em um recipiente seco
28 Métodos de extração Para volumes maiores que 10 ml (macro); Fase superior Fase inferior Funil de separação
29 A - A solução aquosa contém a substancia desejada. B Éter (d = 0,7471 g/ml) é usado para extrair a fase aquosa. C A fase aquosa é removida pela torneira do funil para um recipiente. A fase que contém éter permanece no funil de separação. D - A camada etérea é transferida para um novo frasco através da abertura superior do funil, a fim de se evitar qualquer tipo de contaminação com traços da fase inferior que podem estar ainda aderidas a superfície do vidro. Fase Superior (Macro)
30 Fase Inferior (Macro) A solução aquosa contém a substância desejada. B - Diclorometano (d = 1,33 g/ml) é usado para extrair a fase aquosa. C A fase orgânica é removida pela torneira. D A fase aquosa pode ser removida pela abertura superior do funil ou pode-se adicionar mais diclorometano para uma segunda extração.
31 Etapas na extração 1) Preparando o funil de separação: Apóia ia-se o funil em um anel metálico ou fixa-o o a uma garra do suporte. Cuidados: Observa-se a ausência de vazamentos na tampa e na torneira do funil Funil de separação
32 MANUSEIO DO FUNIL 2-) ) Adição da solução e do solvente: Apoiá-lo num anel metálico preso em um suporte metálico; A capacidade do funil deve ser tal que o volume ocupado não exceda ¾ do volume total do funil. Adicionando Líquidos
33 3) Agitação e alívio da pressão Agitação do funil cuidadosamente, segurando firmemente a tampa. A pressão interna deve ser constantemente aliviada durante a agitação, sob perigo de explosão. Para tanto, inverte-se o funil, firmando a rolha com a palma da mão, e abre-se a torneira cuidadosamente. A mesma precaução deve ser tomada na extração de ácidos com soluções de carbonato ou bicarbonato, devido ao aumento da pressão interna ocasionada pela evolução do dióxido de carbono.
34 figura (alívio da pressão) Misturando os Líquidos
35 3) Separação das camadas Após deixar o funil descansar até a separação das duas camadas de solvente, a torneira então é aberta e a camada infeiror é liberada por drenagem. A camada superior remanescente é removida vertendo-a a através s da abertura superior do funil de separação. Separando as Camadas
36
37 Colóides são misturas heterogêneas de pelo menos duas fases diferentes, com a matéria de uma das fases na forma finamente dividida (sólido, líquido ou gás), denominada fase dispersa, misturada com a fase contínua (sólido, líquido ou gás), denominada meio de dispersão.a ciência dos colóides está relacionada com o estudo dos sistemas nos quais pelo menos um dos componentes da mistura apresenta uma dimensão no intervalo de 1 a 1000 nanometros (1 nm = 10-9 m). Soluções de macromoléculas são misturas homogêneas e também são consideradas colóides porque a dimensão das macromoléculas está no intervalo de tamanho coloidal e, como tal, apresentam as propriedades características dos colóides. FERROFLUÍDO
38 Fase contínua Gás Líquido Sólido Fase dispersa Gás Líquido Sólido Aerosol líquido, Aerosol sólido, Não existe. Todos os gases são solúveis entre si. Espuma líquida, Exemplo: espuma de sabão Espuma sólida, Exemplo: pedrapomes Exemplos: nuvem, neblina Emulsão, Exemplos: leite, maionese, cremes, sangue Gel, Exemplos: gelatina, queijo, geléia Exemplos: fumaça, pó em suspensão Sol, Exemplo: tintas, vidros coloridos Sol sólido, Exemplo: cristal de rubi, cristal de safira, ligas metálicas
39 EMULSÃO É a suspensão coloidal de um líquido em outro intimamente disperso sob a forma de gotículas cujo diâmetro, em geral, excede 0,1µm. Emulsão
40 Emulsão e microemulsão são dispersões coloidais de um líquido em outro, geralmente estabilizadas por um terceiro componente tensoativo (emulsificante) que se localiza na interface entre as fases líquidas. Entre os emulsificantes mais usados pode-se citar proteínas (ovoalbumina, caseína), gomas (gelatina), sabões e detergentes, argilas e óxidos hidratados. Há dois tipos de emulsão, conforme a proporção das fases: água em óleo, com gotículas de água dispersas na fase contínua óleo, e óleo em água, gotículas de óleo dispersas em água. O termo óleo refere-se à fase orgânica e água à fase aquosa. Esse sistema coloidal é vastamente utilizado na apresentação de produtos farmacêuticos (cremes), alimentícios (maionese, margarina, leite), indústriais (petróleo, lubrificantes, asfalto). Além da proporção das fases aquosa e orgânica, a natureza hidrofóbica/hidrofílica do emulsificante determina a formação de emulsão água/óleo ou óleo/água. Diferentes fenômenos ocorrem em emulsão, tais como: i) cremeação (creaming), que resulta da flutuação das gotas dispersas para a superfície da emulsão; ii) coagulação das gotas, que causa a formação de agregados constituídos de gotas individuais, processo este que também aumenta o creme, iii) coalescência das gotas individuais, que formam gotas maiores até estender a fase finamente dispersa a ponto de quebrar a emulsão. Exemplo de coalescência é a coagulação das gotas de gordura pela ação de ácido acético (vinagre) seguida da precipitação de caseína (proteína do leite).
41 A sua formação está relacionada com diferenças muito pequenas de densidades entre as duas fases. COMO EVITAR: Deixar o funil de separação em descanso por algum tempo. Adicionar cloreto de sódio, pois diminui a solubilidade da água no solvente orgânico e vice-e-versa. Adicionar água ao sistema (desestabiliza a emulsão). Filtrar a mistura à vácuo(remove as partículas sólidas que estabilizam a emulsão); Submeter o sistema a uma força centrífuga ou a temperaturas muito baixas. Alterar a proporção entre o volume das fases. Como Evitar
42 EFEITO SALTING-OUT Também m conhecido como efeito de dessolubilização ão. Se o coeficiente de distribuição for muito menor do que 1 a extração simples não será eficiente. Pode-se, em alguns casos, aumentar o coeficiente de distribuição por adição de sais, como cloreto de sódio, sulfato de sódio, na solução aquosa. Isso diminui a solubilidade dos compostos orgânicos em água. de sais. A adição de sais diminui consideravelmente a solubilidade da maior parte dos compostos orgânicos em água.
43 Efeito da Força Iônica sobre a Solubilidade das Proteínas A capacidade dos sais neutros de influenciar a solubilidade das proteínas, é uma função de sua força iônica, que tanto depende de sua concentração como na valência de cátions e ânions que formam o sal. A força iônica (I) é dada pela expressão: I = 1/2Σ mi Zi2 sendo mi a molaridade do ion e Zi a valência do ion. Em concentração reduzida, os sais aumentam a solubilidade de muitas proteínas, um fenômeno denominado salting-in, provavelmente devido à interação da proteína com os sais causando diminuição da interação proteína-proteína e portanto, aumentando a solubilidade.
44 Em altas forças iônicas, conseguidas pela adição de grandes quantidades de um sal muito solúvel (por exemplo o sulfato de amônio) a uma solução de água de hidratação das moléculas, o que leva à predominância da interação proteína-proteína, resultando em precipitação. Este efeito é denominado de salting-out. A precipitação de proteínas pela alta concentração de sais é um processo muito importante para a separação de misturas complexas de proteínas, uma vez que a concentração de sal necessária para precipitar diferentes proteínas é variável. No laboratório, rio, o sal que se usa muito é o Cloreto de Sódio-Lab.. De Orgânica.
45 PRÁTICA (Extração por solventes) 1º Parte Faremos primeiro uma extração que gerará duas porções. Estas denominadas porção A e porção B. A porção A será submetida à uma extração Simples. A porção B será submetida à uma extração Múltipla.
46 PRÁTICA (Extração por solventes) 2º Parte Faremos neste momento uma extração quimicamente atíva, à partir de uma mistura de 2 g de Ácido Benzóico com 2g de p- diclorobenzeno ambos em 100 ml de éter. BOA PRÁTICA
47 PRÁTICA (Extração por solventes)
48 Extração Simples 1. Dissolver pequena quantidade de cristal violeta em 2 a 3 gotas de etanol e adicionar 30 ml de água. Dividir a solução em duas porções iguais (15 ml) A e B. 2. Transferir a porção A para um funil de separação de 100 ml (testar previamente vazamento) e adicionar 15 ml de clorofórmio. 3. Efetuar a extração obedecendo a técnica correta para o uso do funil de separação. 4. Colocar o funil na posição vertical, aguardar a separação das fases e recolher a fase orgânica e aquosa em tubos de ensaio (Etiquetar os tubos anotando as fases em cada um).
49 Extração Simples
50 Prática Extração MúltiplaM 1. Transferir a porção B para um funil de separação de 100 ml e efetuar a extração com 5 ml de clorofórmio. 2. Recolher a fase orgânica em um tubo de ensaio e reextrair a fase aquosa com 5 ml de clorofórmio. Recolher a fase orgânica no mesmo tubo de ensaio. 3. Repetir a extração da fase aquosa com 5 ml de clorofórmio e proceder como descrito no item anterior. 4. Transferir a fase aquosa para um tubo de ensaio (fase aquosa 2) através da boca do funil de separação. 5. Comparar a intensidade das cores das soluções A e B nos dois tipos de extração e discutir os resultados.
51 Extração Múltipla
52 Extração Quimicamente Ativa 1. Dissolver em 100 ml de éter: 2 g de ácido benzóico e 2 g de p-diclorobenzeno. 2. Calcular o volume de solução de hidróxido de sódio 5%, necessário para reagir com ácido. (15ml) 3. Extrair a solução éterea superior duas vezes com a solução básica, usando em cada extração o volume calculado. 4. Recolher as fases aquosas em um béquer de 250 ml. 5. Lavar a fase éterea com 10 ml de água e transferir o extrato aquoso para o béquer. 6. Transferir a fase etérea para um erlenmeyer de 250 ml e adicionar cerca de 1g de cloreto de cálcio com agitação ocasional. 7. Eliminar o agente secante por filtração em papel pregueado (ou por decantação), recolhendo a fase orgânica em um béquer previamente pesado. 8. Eliminar o éter, pesar o resíduo e determinar o ponto de fusão. 9. Elaborar um procedimento para recuperação do ácido benzóico.
53 Extração com solventes quimicamente ativos
54 Reações envolvidas Extrações Simples e Múltipla : não há reações Extrações com Solventes Quimicamente Ativos: OH O + NaOH + H 2 O O- O Na + + Ácido benzóico Hidróxido de sódio Benzoato de sódio Água OH O + NaOH + H 2 O O- O Na + + Ácido benzóico Hidróxido de sódio Benzoato de sódio Água
55
56 Propriedades Físico-Químicas Solvente Massa Molar Densidade (g/ ml) p.f./ºc p.e./ºc Solubilidade Água * 18 0, Etanol 46,07 0, ,3 78,5 Água, acetona, benzeno, éter Clorofórmio rmio 119,39 1,484-63,5 62 Álcool, éter, benzeno Éter 79,12 0, ,3 34,61 Benzeno, acetona, clorofórmio, rmio, álcool Ác. Benzóico* 122,12 1, ,4 249,2 Álcool, éter, acetona, benzeno, clorofórmio rmio O- diclorobenzeno Hidróxido de Sódio * 147 1,311 53,5 174,12 Clorofórmio, rmio, benzeno, éter, álcool 40,11 2, Glicerina, álcool, água Cloreto de CálcioC 110,99 2, >1600 Ácido acético, acetona, álcool, água Benzoato de Sódio 144,11 1,248 53,1 174,5 Benzeno, acetona, álcool * Utilizados na Prática de Extração de Solventes
57 Fórmulas Estruturais Eter (eter dietilico) Cristal Violeta (Cloreto de Hexametilpararosanilina) Cloroformio (triclorometano)
58 Constantes Físicas dos solventes mais usados Solvente Massa Molar Densidade Polaridade p.f./ºc p.e./ºc Metanol 32,04 0,791 6, ,7 Acetato de Etila 88,11 0,902 4, ,5-77,5 Diclorometano 84,93 1,325 3, Hexano 86 0, Tetra Cloreto de Carbono 154 1,5 1,7 77 Tolueno 92,14 0,865 2, ,6 Benzeno 78,11 0, ,5 80 N-butanol 74,12 0,081 3, ,7 Acetona 58,08 0,791 5, Etanol 46,07 0,794 5,2-117,3 78,5 Água * 18 0, * Utilizados na Prática de Extração de Solventes
59 Solvente Etanol Toxicidade dos solventes mais usados na química orgânica Toxicidade Causa náuseas, n vômitos, depressão, sonolência, falta de coordenação, coma e pode causar morte. Clorofórmio rmio Éter etílico p-diclorobenzeno Hidróxido de sódio * Ácido benzóico * Diclorometano Benzeno A inalação em grandes doses pode causar hipotensão, depressão respiratória, ria, morte e pode atuar como sonífero. É cancerígeno. Suavemente irritante para a pele, olhos e membranas mucosas. Potente anestésico, sico, podendo provocar paradas cardíacas. acas. Vapores causam irritação à pele, garganta e olhos. Corrosivo para todos os tecidos. A inalação do póp ou da mistura concentrada pode causar lesões no trato respiratório. rio. Causa irritação na pele, nos olhos e nas membranas mucosas Potencial de sintoma ao expor demasiado ao cansaço, fraqueza, sonolência, náusea, n irritação nos olhos e na pele. Irritação aguda das membranas mucosas,(por ingestão ou inalação), inquietação, convulsões, depressão. Dificuldade respiratória. ria. Hexano * Utilizados na Prática de Extração de Solventes Potencial de sintoma ao expor demasiadamente à luz, nervosismo, náusea, n dor de cabeça, a, fraqueza nos músculos, m irritação nos olhos e nariz, pneumonia química.
60 Agentes Secantes A solução orgânica pode ser lavada para se retirar pequenas quantidades restantes, de água. Para isso utiliza-se agentes secantes como o cloreto de cálcio.
61 * Utilizado na prática Agentes Secantes Tabela 2 : Características de alguns agentes secantes Agente secante CaCl 2 CaSO 4 MgSO 4 K 2 CO 3 Na 2 SO 4 Capacidade * Alta Baixo Alto Médio Alto Velocidade Médio Rápido Rápido Médio Devagar Aplicação Hidrocarbonetos Geralmente utilizado Não utilizado em meios ácidos Não utilizados para compostos ácidos Geralmente utilizado
62 LAVAGEM (PURIFICAÇÃO) Três modos de lavagem: com água - para remover materiais altamente polares como sais orgânicos, ácidos ou bases fortes; com ácido diluído - para remover impurezas básicas, em particular, aminas orgânicas; com bases para remover impurezas ácidas.
63 FILTRAÇÃO A VÁCUOV A sucção acelera a filtração, especialmente para precipitados gelatinosos.
64 Descarte Extrato aquoso com resíduos de benzoato de sódio e de hidróxido de sódio, podem ser descartado na pia, pois o benzoato de sódio é um sal solúvel em água. Agente secante (no caso o CaCl 2 ), não deve ser jogado na pia, pois o mesmo é insolúvel em água, podendo ser descartado no lixo. Os solventes orgânicos clorados, como por exemplo, o clorofórmio, devem ser descartados num recipiente adequado para os mesmos, para posteriormente, ser incinerado.
65 BIBLIOGRAFIA 1. OLIVEIRA,J.E. Instituto de Química da UNESP de Araraquara,Departamento de Química Orgânica. 2. D.L. PAVIA, G.M. LAMPMAN and G.S. KRIZ JR. Saunders, 1995 lndroduction to Laboratory Techniques,2nd ed., 3.Gonçalves,D.; alves,d.;wal,e.;almeida,,e.;almeida,r.r. R.R.- Química Orgânica Experimental, São Paulo, McGraw Hill, Gonçalves,D.; alves,d.;wal,e.;almeida,,e.;almeida,r.r. R.R.- Química Orgânica Experimental, São Paulo, McGraw Hill, Merck Index-Software Eletrônico 6. Artigo: QUÍMICA NOVA NA ESCOLA O Mundo dos Colóides N N 9, MAIO BRUDNA,Luís. fazer/,site Glúon on/blog 8. Seminários Anteriores-Material Fornecido pelo Professor José Eduardo de Oliveira
INSTITUTO DE QUÍMICA UNESP / ARARAQUARA
 INSTITUTO DE QUÍMICA UNESP / ARARAQUARA Agosto / 2007 Química Orgânica Experimental Prof. José Eduardo de Oliveira Kamila Ericka dos Santos Karina Almeida Rancan Rafael Miguel Sábio Técnica de extração
INSTITUTO DE QUÍMICA UNESP / ARARAQUARA Agosto / 2007 Química Orgânica Experimental Prof. José Eduardo de Oliveira Kamila Ericka dos Santos Karina Almeida Rancan Rafael Miguel Sábio Técnica de extração
Extração com Solventes
 Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
EXTRAÇÃO COM SOLVENTES
 EXTRAÇÃO COM SOLVENTES Discentes: Alessandra Maciel do Nascimento Mariana Alessandra Corrêa Docente: Prof.Dr. José Eduardo de Oliveira INTRODUÇÃO MISTURAS HOMOGÊNEAS HETEROGÊNEAS SOLUÇÃO EXTRAÇÃO! Exemplos:
EXTRAÇÃO COM SOLVENTES Discentes: Alessandra Maciel do Nascimento Mariana Alessandra Corrêa Docente: Prof.Dr. José Eduardo de Oliveira INTRODUÇÃO MISTURAS HOMOGÊNEAS HETEROGÊNEAS SOLUÇÃO EXTRAÇÃO! Exemplos:
Química Orgânica Experimental I. Extração com Solventes
 Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
EXTRAÇÃO COM SOLVENTES
 EXTRAÇÃO COM SOLVENTES Alunas Integrantes: Andréa Cristina Pesce Daniele Tonon Juliana Orru Maria Gabriela R. Oliveira Renata Fogaça Samanta A. Vulcano A técnica de extração A extração é uma técnica para
EXTRAÇÃO COM SOLVENTES Alunas Integrantes: Andréa Cristina Pesce Daniele Tonon Juliana Orru Maria Gabriela R. Oliveira Renata Fogaça Samanta A. Vulcano A técnica de extração A extração é uma técnica para
EXTRAÇÃO POR SOLVENTES (QUIMICAMENTE ATIVA)
 INSTITUTO DE QUÍMICA ARARAQUARA QUÍMICA ORGÂNICA EXPERIMENTAL EXTRAÇÃO POR SOLVENTES (QUIMICAMENTE ATIVA) Prof. Dr. José Eduardo de Oliveira Prof. Dr. Leonardo Pezza Profª Juliana Rodrigues Grupo 6 Michelle
INSTITUTO DE QUÍMICA ARARAQUARA QUÍMICA ORGÂNICA EXPERIMENTAL EXTRAÇÃO POR SOLVENTES (QUIMICAMENTE ATIVA) Prof. Dr. José Eduardo de Oliveira Prof. Dr. Leonardo Pezza Profª Juliana Rodrigues Grupo 6 Michelle
Extração com Solventes
 Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
2 EXTRAÇÃO POR SOLVENTES II (Quimicamente Ativa)
 UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 2 EXTRAÇÃO POR SOLVENTES II (Quimicamente Ativa) Discentes: Grupo VIII Mariana de Castro Anna Caroline Franchetti Profº. Dr. Leonardo
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 2 EXTRAÇÃO POR SOLVENTES II (Quimicamente Ativa) Discentes: Grupo VIII Mariana de Castro Anna Caroline Franchetti Profº. Dr. Leonardo
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
EXTRAÇÃO POR SOLVENTE
 EXTRAÇÃO POR SOLVENTE Extração consiste na separação de um componente de uma mistura por meio de um solvente. Os solventes devem ser imiscíveis e formar duas fases ou camadas separadas. A substância de
EXTRAÇÃO POR SOLVENTE Extração consiste na separação de um componente de uma mistura por meio de um solvente. Os solventes devem ser imiscíveis e formar duas fases ou camadas separadas. A substância de
1 EXTRAÇÃO COM SOLVENTES simples e múltipla
 UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 1 EXTRAÇÃO COM SOLVENTES simples e múltipla Discente: Juliana Rodrigues Profº. Dr. José Eduardo de Oliveira Prof o. Dr. Leonardo Pezza
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 1 EXTRAÇÃO COM SOLVENTES simples e múltipla Discente: Juliana Rodrigues Profº. Dr. José Eduardo de Oliveira Prof o. Dr. Leonardo Pezza
EXTRAÇÃO COM SOLVENTES (transp. 1)
 EXTRAÇÃO COM SOLVENTES (transp. 1) Usado para separar e isolar determinadas substâncias encontradas em misturas complexas. As substâncias em geral são solúveis em água. Ao se adicionar um solvente não
EXTRAÇÃO COM SOLVENTES (transp. 1) Usado para separar e isolar determinadas substâncias encontradas em misturas complexas. As substâncias em geral são solúveis em água. Ao se adicionar um solvente não
EXTRAÇÃO COM SOLVENTES II
 EXTRAÇÃO COM SOLVENTES II (Quimicamente Ativa) Discentes: Ana Carolina G. V. Carvalho Laisa dos Santos Lípari Docentes: Profª. Amanda Coelho Danuello Prof.Dr. José Eduardo de Oliveira Prof.Dr. Leonardo
EXTRAÇÃO COM SOLVENTES II (Quimicamente Ativa) Discentes: Ana Carolina G. V. Carvalho Laisa dos Santos Lípari Docentes: Profª. Amanda Coelho Danuello Prof.Dr. José Eduardo de Oliveira Prof.Dr. Leonardo
Preparação do cloreto de t-butila. Carina de Freitas Vellosa Daiane Cristina Romanini
 Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Química Orgânica Experimental I. Extração com Solventes
 Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE
 Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE densidade Nomenclatur a 2,152 cloreto de cálcio 0,789 álcool etílico fórmula Mol (g/ml) P.F.( 0 C) P.E.( 0 C) toxidade solubilidade
Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE densidade Nomenclatur a 2,152 cloreto de cálcio 0,789 álcool etílico fórmula Mol (g/ml) P.F.( 0 C) P.E.( 0 C) toxidade solubilidade
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS
 EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
Extração do Limoneno. Integrantes do grupo: Diego Souza, Jefferson Honorio, Marcelo Tangerina
 Extração do Limoneno Integrantes do grupo: Diego Souza, Jefferson Honorio, Marcelo Tangerina Quem é o Limoneno? O Limoneno ( IUPAC: : 1-metil1 metil-4-isopropenilciclohex- 1-eno ) é uma substância química:
Extração do Limoneno Integrantes do grupo: Diego Souza, Jefferson Honorio, Marcelo Tangerina Quem é o Limoneno? O Limoneno ( IUPAC: : 1-metil1 metil-4-isopropenilciclohex- 1-eno ) é uma substância química:
Recristalização da Acetanilida
 Recristalização da Acetanilida Reação de formação da acetanilida O NH 2 + CH 3 CH 3 C C O O O NaAc/HAc H N C CH 3 + CH 3 C O O H Anilina Anidrido Acético Acetanilida Acido acético H + CH 3 COO - CH 3 COOH
Recristalização da Acetanilida Reação de formação da acetanilida O NH 2 + CH 3 CH 3 C C O O O NaAc/HAc H N C CH 3 + CH 3 C O O H Anilina Anidrido Acético Acetanilida Acido acético H + CH 3 COO - CH 3 COOH
EXTRAÇÃO COM SOLVENTES
 UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE QUÍMICA EXTRAÇÃO COM SOLVENTES Extração simples, múltipla e quimicamente ativa Química Orgânica Experimental Prof. José Eduardo de Oliveira Profa. Dra. Angela
UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE QUÍMICA EXTRAÇÃO COM SOLVENTES Extração simples, múltipla e quimicamente ativa Química Orgânica Experimental Prof. José Eduardo de Oliveira Profa. Dra. Angela
Extração com Solventes
 Licenciatura 2009 Prof. Dr. José Eduardo de Oliveira Profª. Amanda Coelho Danuello Extração com Solventes Alana Evangelista Honório Sara Cardoso de Souza Lucy Elaine Sugauara Extração com Solvente O que
Licenciatura 2009 Prof. Dr. José Eduardo de Oliveira Profª. Amanda Coelho Danuello Extração com Solventes Alana Evangelista Honório Sara Cardoso de Souza Lucy Elaine Sugauara Extração com Solvente O que
Recristalização da Acetanilida
 Profª. Amanda Coelho Danuello Prof. Dr. Leonardo Pezza Prof. Dr. José Eduardo de Oliveira Msc. Rodrigo Sequinel Recristalização da Acetanilida Discentes: Grupo 4 Felipe Berto Ometto Rodolfo Debone Piazza
Profª. Amanda Coelho Danuello Prof. Dr. Leonardo Pezza Prof. Dr. José Eduardo de Oliveira Msc. Rodrigo Sequinel Recristalização da Acetanilida Discentes: Grupo 4 Felipe Berto Ometto Rodolfo Debone Piazza
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL
 DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO DE UMA MISTURA HETEROGÊNEA P =
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO DE UMA MISTURA HETEROGÊNEA P =
Isolamento de compostos orgânicos voláteis de fontes naturais
 Isolamento de compostos orgânicos voláteis de fontes naturais Os componentes voláteis de plantas constituem uma enorme riqueza da Química Orgânica. Eles são utilizados na farmacologia, ingredientes de
Isolamento de compostos orgânicos voláteis de fontes naturais Os componentes voláteis de plantas constituem uma enorme riqueza da Química Orgânica. Eles são utilizados na farmacologia, ingredientes de
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS
 PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL
 DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO FRACIONADA DE UMA SOLUÇÃO evaporações
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO FRACIONADA DE UMA SOLUÇÃO evaporações
RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA
 RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA INTRODUÇÃO A RECRISTALIZAÇÃO consiste na dissolução de uma substância sólida num solvente, a quente, e depois, por resfriamento, obtém-se novamente o estado
RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA INTRODUÇÃO A RECRISTALIZAÇÃO consiste na dissolução de uma substância sólida num solvente, a quente, e depois, por resfriamento, obtém-se novamente o estado
EXPERIMENTOS DE QUIMICA ORGANICA I(QUI 127, QUI 186 E QUI 214) EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO
 EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA. Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe
 PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe Reação de Esterificação Os ácidos carboxílicos reagem com álcoois produzindo ésteres
PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe Reação de Esterificação Os ácidos carboxílicos reagem com álcoois produzindo ésteres
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
Preparação do acetato de isopentila
 Preparação do acetato de isopentila I - Introdução Neste experimento, será preparado um éster, acetato de isopentila. Este éster é frequentemente chamado de óleo de banana, uma vez que possui odor característico
Preparação do acetato de isopentila I - Introdução Neste experimento, será preparado um éster, acetato de isopentila. Este éster é frequentemente chamado de óleo de banana, uma vez que possui odor característico
Destilação Fracionada do Sistema Limoneno-Hexano
 UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO Instituto de Química do Campus de Araraquara Destilação Fracionada do Sistema Limoneno-Hexano Docentes: Prof. Dr. José Eduardo de Oliveira Profa.
UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO Instituto de Química do Campus de Araraquara Destilação Fracionada do Sistema Limoneno-Hexano Docentes: Prof. Dr. José Eduardo de Oliveira Profa.
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
Figura 1: Ilustração do processo de dissolução do NaCl em água.
 Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
Figura 1. Variação da solubilidade dos compostos em função da temperatura. fonte: 2010, 2008, 2005, 2002 por P. W. Atkins e L. L. Jones.
 Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 )
 Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Purificação de Solventes
 Purificação de Solventes Química Orgânica Experimental Ives A. Leonarczyk Matheus Gonçalves Alves Paulo Pessolato Jr. Tiago Varão Data: 21/08/2008 Principais casos onde a purificação é necessária. Solventes
Purificação de Solventes Química Orgânica Experimental Ives A. Leonarczyk Matheus Gonçalves Alves Paulo Pessolato Jr. Tiago Varão Data: 21/08/2008 Principais casos onde a purificação é necessária. Solventes
EXPERIÊNCIA 2 - SOLUBILIDADE
 CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 2 - SOLUBILIDADE 1. CONCEITOS FUNDAMENTAIS
CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 2 - SOLUBILIDADE 1. CONCEITOS FUNDAMENTAIS
Seminário de Química Orgânica Experimental I. Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002
 Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
QUÍMICA. Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. Parte 10. Prof a.
 QUÍMICA Parte 10 Prof a. Giselle Blois Exemplo: Foi colocado 25 ml de uma solução de HCl de concentração desconhecida no erlenmeyer (titulado), com gotas de fenolftaleína, e foi usado como titulante uma
QUÍMICA Parte 10 Prof a. Giselle Blois Exemplo: Foi colocado 25 ml de uma solução de HCl de concentração desconhecida no erlenmeyer (titulado), com gotas de fenolftaleína, e foi usado como titulante uma
Experiência 02 - SOLUBILIDADE SOLUBILIDADE
 1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
TABELA 1) Constantes físicas, características e periculosidade dos reagente e produtos.
 TABELA 1) Constantes físicas, características e periculosidade dos reagente e produtos. Substância e Fórmula molecular Etanol C 2 H 5 OH Massa molecular (g/mol) 46,07 P.F. (ºC) P.E. (ºC) 114,1 78,5 Clorofórmio
TABELA 1) Constantes físicas, características e periculosidade dos reagente e produtos. Substância e Fórmula molecular Etanol C 2 H 5 OH Massa molecular (g/mol) 46,07 P.F. (ºC) P.E. (ºC) 114,1 78,5 Clorofórmio
Preparação do Cloreto de t-butila. Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa
 Preparação do Cloreto de t-butila Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante: Solvente;
Preparação do Cloreto de t-butila Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante: Solvente;
Laboratório de Análise Instrumental
 Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis PRÁTICA 8: Verificação da influência do ph na extração de Fe(III) com éter etílico Objetivo:
Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis PRÁTICA 8: Verificação da influência do ph na extração de Fe(III) com éter etílico Objetivo:
4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico
 NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
Experiência 04 - Solubilidade
 Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
Isolamento de compostos orgânicos voláteis de fontes naturais
 Isolamento de compostos orgânicos voláteis de fontes naturais Os componentes voláteis de plantas constituem uma enorme riqueza da Química Orgânica. Eles são utilizados na farmacologia, ingredientes de
Isolamento de compostos orgânicos voláteis de fontes naturais Os componentes voláteis de plantas constituem uma enorme riqueza da Química Orgânica. Eles são utilizados na farmacologia, ingredientes de
6 Preparação e Purificação do Acetato de Isopentila (parte II)
 UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 6 Preparação e Purificação do Acetato de Isopentila (parte II) Discentes: Grupos IX e XXIV Camila Francisconi Lima Marcus Massahiro Sinzato
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 6 Preparação e Purificação do Acetato de Isopentila (parte II) Discentes: Grupos IX e XXIV Camila Francisconi Lima Marcus Massahiro Sinzato
SISTEMAS DISPERSOS SOLUÇÕES COLÓIDES SUSPENSÕES
 SISTEMAS DISPERSOS SOLUÇÕES COLÓIDES SUSPENSÕES SOLUÇÕES homogêneo COLÓIDES SUSPENSÕES heterogêneo Tamanho médio das partículas do disperso Homogeneidade do sistema Sedimentação das partículas Filtração
SISTEMAS DISPERSOS SOLUÇÕES COLÓIDES SUSPENSÕES SOLUÇÕES homogêneo COLÓIDES SUSPENSÕES heterogêneo Tamanho médio das partículas do disperso Homogeneidade do sistema Sedimentação das partículas Filtração
Parte II. Meneah Renata Talita
 Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
PREPARAÇÃO DO ACETATO DE ISOPENTILA
 Química Orgânica Experimental I PREPARAÇÃO DO ACETATO DE ISOPENTILA Armando Ferreira Gameiro Jr. Janaína Leme do Amaral Introdução: Os ácidos carboxílicos reagem com álcoois na presença de ácidos minerais
Química Orgânica Experimental I PREPARAÇÃO DO ACETATO DE ISOPENTILA Armando Ferreira Gameiro Jr. Janaína Leme do Amaral Introdução: Os ácidos carboxílicos reagem com álcoois na presença de ácidos minerais
Exercícios Métodos de Separação. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017
 Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP
 UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 7 -Isolamento e Purificação do Limoneno I André Marques de Andrade Guilherme Condutta Júlio Cesar de Bianchi Sobrinho Murilo de Souza
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 7 -Isolamento e Purificação do Limoneno I André Marques de Andrade Guilherme Condutta Júlio Cesar de Bianchi Sobrinho Murilo de Souza
Extração e Purificação do Limoneno Parte II
 Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
Acetato de Isopentila I
 Profª. Amanda Coelho Danuello Prof. Dr. Leonardo Pezza Prof. Dr. José Eduardo de Oliveira Msc. Rodrigo Sequinel Acetato de Isopentila I Discentes: Grupo 24 André Paulesini Iagalo Renan Moraes Pioli Índice
Profª. Amanda Coelho Danuello Prof. Dr. Leonardo Pezza Prof. Dr. José Eduardo de Oliveira Msc. Rodrigo Sequinel Acetato de Isopentila I Discentes: Grupo 24 André Paulesini Iagalo Renan Moraes Pioli Índice
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas:
 Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
Preparação do t-butila Reação SN1. Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa
 Preparação do t-butila Reação SN1 Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante; Solvente;
Preparação do t-butila Reação SN1 Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante; Solvente;
Recristalização da Acetanilida
 Recristalização da Carolina Cavasin Leandro Lílian Cristine I. Guevara Caroline Oliveira da Rocha Mariana Emídia Silva Cabral Docentes: José Eduardo de Oliveira Juliana Rodrigues Leonardo Pezza , o que
Recristalização da Carolina Cavasin Leandro Lílian Cristine I. Guevara Caroline Oliveira da Rocha Mariana Emídia Silva Cabral Docentes: José Eduardo de Oliveira Juliana Rodrigues Leonardo Pezza , o que
SUBSTÂNCIAS E MISTURAS
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli edsont@iqsc.usp.br Monitor: Dr. Wanderson Oliveira
Recristalização da Acetanilida
 Recristalização da Acetanilida Grupo 2 Maísa Sanchez Gomes Mariana Cutigi Recristalização Método para purificar sólidos ou para separar compostos que são solúveis à quente e insolúveis, ou pouco solúveis,
Recristalização da Acetanilida Grupo 2 Maísa Sanchez Gomes Mariana Cutigi Recristalização Método para purificar sólidos ou para separar compostos que são solúveis à quente e insolúveis, ou pouco solúveis,
30/03/2017 Química Licenciatura Prof. Udo Eckard Sinks SOLUÇÕES E SOLUBILIDADE
 SOLUÇÕES E SOLUBILIDADE 1. Objetivos Aprender a preparar soluções usando balão volumétrico Reconhecer soluções diluídas, saturadas e supersaturadas Observar a termodinâmica do processo de dissolução 2.
SOLUÇÕES E SOLUBILIDADE 1. Objetivos Aprender a preparar soluções usando balão volumétrico Reconhecer soluções diluídas, saturadas e supersaturadas Observar a termodinâmica do processo de dissolução 2.
A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano
 A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano Objetivo: Recuperar diclorometano e n-hexano de misturas de n-hexano/diclorometano.
A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano Objetivo: Recuperar diclorometano e n-hexano de misturas de n-hexano/diclorometano.
Purificação do Éter Etílico Parte 1
 Purificação do Éter Etílico Parte 1 Docentes: Humberto Marcio Santos Milagre Isabele Rodrigues Nascimento Jose Eduardo de Oliveira Mariano Gabriel S. Rai O. Bueno da Silva Solventes Dissolvem outras substâncias
Purificação do Éter Etílico Parte 1 Docentes: Humberto Marcio Santos Milagre Isabele Rodrigues Nascimento Jose Eduardo de Oliveira Mariano Gabriel S. Rai O. Bueno da Silva Solventes Dissolvem outras substâncias
Extração da Cafeína a partir de saquinhos de chá
 Universidade Estadual Paulista Júlio de Mesquita Filho UESP Instituto de Química Campus Araraquara Extração da Cafeína a partir de saquinhos de chá Andressa Somensi H 3 C C H 3 C H 3 1 bjetivos: Isolamento
Universidade Estadual Paulista Júlio de Mesquita Filho UESP Instituto de Química Campus Araraquara Extração da Cafeína a partir de saquinhos de chá Andressa Somensi H 3 C C H 3 C H 3 1 bjetivos: Isolamento
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini
 Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
Prof. Dr. José Eduardo de Oliveira Adriana Teixeira Machado Marcela Dias da Silva Matheus Gibbin Zanzini Filtração Fonte de aquecimento Destilação Correção do ponto de ebulição OBJETIVO: Remover impurezas
QUÍMICA. Soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. Parte 11. Prof a.
 QUÍMICA Parte 11 Prof a. Giselle Blois Dispersões: São sistemas nos quais uma substância está disseminada (disperso ou fase dispersa), sob forma de pequenas partículas, em uma segunda substância (dispersante,
QUÍMICA Parte 11 Prof a. Giselle Blois Dispersões: São sistemas nos quais uma substância está disseminada (disperso ou fase dispersa), sob forma de pequenas partículas, em uma segunda substância (dispersante,
Classificação Solução Colóide Suspensão Exemplo: açúcar na água, sal de cozinha na água, álcool hidratado.
 Química - Unidade 5 de 12: GOVERNO DO ESTADO DE MATO GROSSO DO SUL Conteúdo 10: Dispersões (definição,classificação, e características) Habilidade e competência: Identificar a diferença entre dispersões,
Química - Unidade 5 de 12: GOVERNO DO ESTADO DE MATO GROSSO DO SUL Conteúdo 10: Dispersões (definição,classificação, e características) Habilidade e competência: Identificar a diferença entre dispersões,
Química Orgânica Experimental I BAC CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS
 Química Orgânica Experimental I BAC - 2009 CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS Além do aqui solicitado para os Pré-Relatórios, devem ser apresentados os itens correspondentes a cada
Química Orgânica Experimental I BAC - 2009 CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS Além do aqui solicitado para os Pré-Relatórios, devem ser apresentados os itens correspondentes a cada
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
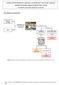 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
PURIFICAÇÃO DO ACETATO DE ISOPENTILA (PARTE 2)
 PURIFICAÇÃO DO ACETATO DE ISOPENTILA (PARTE 2) Docentes: Prof. Dr. José Eduardo de Oliveira Profª. Drª. Angela Regina Araújo Discentes: Pâmela Botassim Reinoso Paula Rodrigues Dias Introdução Os ésteres
PURIFICAÇÃO DO ACETATO DE ISOPENTILA (PARTE 2) Docentes: Prof. Dr. José Eduardo de Oliveira Profª. Drª. Angela Regina Araújo Discentes: Pâmela Botassim Reinoso Paula Rodrigues Dias Introdução Os ésteres
4006 Síntese do éster etílico do ácido 2-(3-oxobutil) ciclopentanona-2-carboxílico
 4006 Síntese do éster etílico do ácido 2-(3-oxobutil) ciclopentanona-2-carboxílico CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156,2) (70,2) (270,3) (226,3) Classificação Tipos de reações
4006 Síntese do éster etílico do ácido 2-(3-oxobutil) ciclopentanona-2-carboxílico CEt + FeCl 3 x 6 H 2 CEt C 8 H 12 3 C 4 H 6 C 12 H 18 4 (156,2) (70,2) (270,3) (226,3) Classificação Tipos de reações
Preparação do cloreto de terc-butila
 Preparação do cloreto de terc-butila Substituição Nucleofílica Alifática Tatiana Verissimo Métodos mais comuns de Preparação de Haletos de Alquila Halogenção direta de alcanos,para a formação direta de
Preparação do cloreto de terc-butila Substituição Nucleofílica Alifática Tatiana Verissimo Métodos mais comuns de Preparação de Haletos de Alquila Halogenção direta de alcanos,para a formação direta de
Separação de misturas
 Separação de misturas Filtração: A separação se faz através de uma superfície porosa chamada filtro; o componente sólido ficará retido sobre a sua superfície, separando-se assim do líquido que atravessa.
Separação de misturas Filtração: A separação se faz através de uma superfície porosa chamada filtro; o componente sólido ficará retido sobre a sua superfície, separando-se assim do líquido que atravessa.
Conteúdo: ESTUDO DAS DISPERSÕES E SOLUÇÕES
 Atividade/Exercício: FIXAÇÃO DE ESTUDO DAS SOLUÇÕES Disciplina: QUÍMICA Educador: ENDERSON BASTANI 1ª Etapa 23/ 04 /2019 Ano/Série: 2º Educando(a): Turma: Conteúdo: ESTUDO DAS DISPERSÕES E SOLUÇÕES QUESTÃO
Atividade/Exercício: FIXAÇÃO DE ESTUDO DAS SOLUÇÕES Disciplina: QUÍMICA Educador: ENDERSON BASTANI 1ª Etapa 23/ 04 /2019 Ano/Série: 2º Educando(a): Turma: Conteúdo: ESTUDO DAS DISPERSÕES E SOLUÇÕES QUESTÃO
9 o EF. Jeosafá de P. Lima. Exercícios sobre separação de misturas
 9 o EF QUÍMICA Exercícios Jeosafá de P. Lima Exercícios sobre separação de misturas 1) (VUNESP-2006) A preparação de um chá utilizando os já tradicionais saquinhos envolve, em ordem de acontecimento, os
9 o EF QUÍMICA Exercícios Jeosafá de P. Lima Exercícios sobre separação de misturas 1) (VUNESP-2006) A preparação de um chá utilizando os já tradicionais saquinhos envolve, em ordem de acontecimento, os
Seminário de Química Orgânica Experimental n 7. Destilação Fracionada do Sistema Limoneno - Hexano
 Seminário de Química Orgânica Experimental n 7 Destilação Fracionada do Sistema Limoneno - Hexano Responsáveis: Prof. Dr. José Eduardo de Oliveira (docente) Profª. Amanda Coelho Danuello (docente) Rafael
Seminário de Química Orgânica Experimental n 7 Destilação Fracionada do Sistema Limoneno - Hexano Responsáveis: Prof. Dr. José Eduardo de Oliveira (docente) Profª. Amanda Coelho Danuello (docente) Rafael
Ana Elisa Comanini Ana Karla Agner Felipe Gollino
 Ana Elisa Comanini Ana Karla Agner Felipe Gollino 2º ano Bacharelado 2008 Filtração Remover impurezas sólidas de um líquido ou de uma solução Coletar um produto sólido de uma solução na qual ele tenha
Ana Elisa Comanini Ana Karla Agner Felipe Gollino 2º ano Bacharelado 2008 Filtração Remover impurezas sólidas de um líquido ou de uma solução Coletar um produto sólido de uma solução na qual ele tenha
3033 Síntese do ácido acetilenodicarboxílico a partir de ácido meso dibromosuccínico
 3033 Síntese do ácido acetilenodicarboxílico a partir de ácido meso dibromosuccínico HOOC H Br Br H COOH KOH HOOC COOH C 4 H 4 Br 2 O 4 C 4 H 2 O 4 (275.9) (56.1) (114.1) Classificação Tipos de reação
3033 Síntese do ácido acetilenodicarboxílico a partir de ácido meso dibromosuccínico HOOC H Br Br H COOH KOH HOOC COOH C 4 H 4 Br 2 O 4 C 4 H 2 O 4 (275.9) (56.1) (114.1) Classificação Tipos de reação
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno
 3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
Dispersão: disperso dispersante ou dispergente
 Dispersão: disperso dispersante ou dispergente Dispersão: Suspensão, Solução Coloidal e Solução Verdadeira (solução) Mistura Heterogênea: Suspensão e Solução Coloidal Mistura Homogênea: Solução Verdadeira
Dispersão: disperso dispersante ou dispergente Dispersão: Suspensão, Solução Coloidal e Solução Verdadeira (solução) Mistura Heterogênea: Suspensão e Solução Coloidal Mistura Homogênea: Solução Verdadeira
Deborah Vilhagra Faria Guilherme Pires de Campos Rafael Carbone Cintra Rafael Rovatti Pupin
 Deborah Vilhagra Faria Guilherme Pires de Campos Rafael Carbone Cintra Rafael Rovatti Pupin São substâncias que dissolvem outras sem se alterarem quimicamente ou modificar as substâncias dissolvidas; São
Deborah Vilhagra Faria Guilherme Pires de Campos Rafael Carbone Cintra Rafael Rovatti Pupin São substâncias que dissolvem outras sem se alterarem quimicamente ou modificar as substâncias dissolvidas; São
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
Experiência 1: Identificação de Amostras Sólidas por densidade 59
 Sumário Prefácio da 2 a Edição 17 Prefácio da 1 a edição 21 Capítulo 1: EQUIPAMENTOS BÁSICOS DE LABORATÓRIO 25 Capítulo 2: SEGURANÇA EM LABORATÓRIO 39 COMO MANTER UM AMBIENTE DE LABORATÓRIO SAUDÁVEL? 39
Sumário Prefácio da 2 a Edição 17 Prefácio da 1 a edição 21 Capítulo 1: EQUIPAMENTOS BÁSICOS DE LABORATÓRIO 25 Capítulo 2: SEGURANÇA EM LABORATÓRIO 39 COMO MANTER UM AMBIENTE DE LABORATÓRIO SAUDÁVEL? 39
Ministério da Educação Universidade Federal do Paraná Setor Palotina. Soluções e cálculos de soluções
 Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Ficha de Informação de Segurança de Produtos Químicos NEUTROL
 1. Identificação do produto e da empresa Nome do produto: Nome da empresa: Otto Baumgart Ind. e Com. S/A Endereço: Rua Coronel Marcílio Franco, 1063 São Paulo S.P. Telefone da empresa: (11) 6901-5522 /
1. Identificação do produto e da empresa Nome do produto: Nome da empresa: Otto Baumgart Ind. e Com. S/A Endereço: Rua Coronel Marcílio Franco, 1063 São Paulo S.P. Telefone da empresa: (11) 6901-5522 /
PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK
 PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK Substância Pura: Um único tipo de substância Simples: formada por átomos de um único elemento. Composta: formada por átomos de mais de um elemento.
PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK Substância Pura: Um único tipo de substância Simples: formada por átomos de um único elemento. Composta: formada por átomos de mais de um elemento.
Éter etílico (parte II)
 Éter etílico (parte II) Solventes orgânicos de diferentes graus de pureza comercialmente disponíveis; Seleção do grau de pureza: condicionada à finalidade de seu emprego, à sua disponibilidade e à seu
Éter etílico (parte II) Solventes orgânicos de diferentes graus de pureza comercialmente disponíveis; Seleção do grau de pureza: condicionada à finalidade de seu emprego, à sua disponibilidade e à seu
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
Dureza da Água e Problemas de Lavagem
 Dureza da Água e Problemas de Lavagem O que se pretende Classificar uma água quanto à sua dureza, como dura ou macia, a partir do seu comportamento em testes de lavagem. Para além disso, e a partir das
Dureza da Água e Problemas de Lavagem O que se pretende Classificar uma água quanto à sua dureza, como dura ou macia, a partir do seu comportamento em testes de lavagem. Para além disso, e a partir das
13/04/2017. Instrumentação/Características. Extração por Soxhlet Soxhlet extraction. Automatizado ou Soxtec. Automatizado ou Soxtec
 Instrumentação/Características Extração por Soxhlet Soxhlet extraction Extração com solvente resfriado Ausência de pressão Extração demorada (6 a 48h) Baixo poder de extração Grande volume extraído (diluição
Instrumentação/Características Extração por Soxhlet Soxhlet extraction Extração com solvente resfriado Ausência de pressão Extração demorada (6 a 48h) Baixo poder de extração Grande volume extraído (diluição
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS. Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
PURIFICAÇÃO DE UM COMPOSTO ORGÂNICO SÓLIDO
 PURIFICAÇÃO DE UM COMPOSTO ORGÂNICO SÓLIDO INTRODUÇÃO Substâncias sólidas raramente são puras quando obtidas a partir de uma reação. Conseqüentemente, desde a época dos primeiros alquimistas, substâncias
PURIFICAÇÃO DE UM COMPOSTO ORGÂNICO SÓLIDO INTRODUÇÃO Substâncias sólidas raramente são puras quando obtidas a partir de uma reação. Conseqüentemente, desde a época dos primeiros alquimistas, substâncias
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Preparação do cloreto de terc-butila
 Preparação do cloreto de terc-butila Substituição Nucleofílica Alifática Júlia Ciaramello Fuzatto Juliana Gonçalves Gomes Simone Avelino Fonseca Reações de Substituição Nucleofílica É quando um nucleófilo,espécie
Preparação do cloreto de terc-butila Substituição Nucleofílica Alifática Júlia Ciaramello Fuzatto Juliana Gonçalves Gomes Simone Avelino Fonseca Reações de Substituição Nucleofílica É quando um nucleófilo,espécie
Estudo Estudo da Química
 Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: rayllander.silva.borges@gmail.com Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
PREPARAÇÃO DO ACETATO DE ISOPENTILA (PARTE II)
 Universidade Estadual Paulista Júlio de Mesquita Filho Instituto de Química-UNESP Química Orgânica Experimental PREPARAÇÃO DO ACETATO DE ISOPENTILA (PARTE II) Docentes:Profª. Drª. Marcia Nasser Lopes Prof.
Universidade Estadual Paulista Júlio de Mesquita Filho Instituto de Química-UNESP Química Orgânica Experimental PREPARAÇÃO DO ACETATO DE ISOPENTILA (PARTE II) Docentes:Profª. Drª. Marcia Nasser Lopes Prof.
