Extração com Solventes
|
|
|
- Washington Salvado Guimarães
- 8 Há anos
- Visualizações:
Transcrição
1 Licenciatura 2009 Prof. Dr. José Eduardo de Oliveira Profª. Amanda Coelho Danuello Extração com Solventes Alana Evangelista Honório Sara Cardoso de Souza Lucy Elaine Sugauara
2 Extração com Solvente O que é? O que podemos extrair? Amostra Sólidas: dissolução lenta: SOXHLET dissolução rápida: método para misturas líquidas Amostra Líquidas: micro escala Volume < 4mL : VIAL CÔNICO (A) 4mL < Volume 10mL : TUBO DE CENTRÍGUGA (B) macro escala Volume > 10 ml : FUNIL DE SEPARAÇÃO (C) A B C
3 Extração com Solvente Escolha do Solvente. Constante de Distribuição. A A A
4 Tipos de extração: EXTRAÇÃO CONTÍNUA sólido-líquido SOXHLET Quando o K não é muito favorável
5 EXTRAÇÃO CONTÍNUA líquido-líquido a) Para solventes menos densos que a água b) Para solventes mais densos que a água O aspecto mais importante deste tipo de extração é que pode ser processada com um volume limitado de solvente.
6 EFEITO SALTING OUT O efeito SALTING OUT se baseia no aumento do coeficiente de distribuição da solução que é possível quando um sal é dissolvido na solução coloidal. Como uma das fases é aquosa, as moléculas de água terão preferência em solvatar o sal, liberando assim, as moléculas orgânicas para a fase orgânica. Extração que modifica o valor de K;
7 Formação de Emulsão Emulsão é uma solução coloidal de um líquido no outro. São gotículas de solvente orgânicos mantidas em suspensão numa solução aquosa quando os dois são misturados ou agitados vigorosamente.
8 EXTRAÇÃO NÃO CONTÍNUA líquida-líquida Tampa Funil de Separação Anel de Ferro Fase menos densa Torneira Fase mais densa Frasco Extrator
9 Extração Simples 1X100mL K = 3 mtotal = 50g m m m m m m m
10 Extração Múltipla 2 X com 50mL cada mtotal= 50g matual total= 50g 30g = 20g mtotal extraído
11 EXTRAÇÃO SIMPLES X MÚLTIPLA Massa total extraída na EXTRAÇÃO SIMPLES m = 37,5 gramas Massa total extraída na EXTRAÇÃO MÚLTIPLA m = 42 gramas
12 EXTRAÇÃO MÚLTIPLA 88% 75%
13 PROCEDIMENTO Ao iniciar uma extração, o primeiro passo é verificar a ausência de vazamentos na tampa e torneira do funil.
14 Para encher o funil de separação, ele é apoiado num anel metálico preso em um suporte. Tanto a solução a ser extraída, quanto o solvente de extração são colocados no funil. NÃO ESQUEÇA DE FECHAR A TORNEIRA!!!!!!! Colocar um frasco limpo e seco na saída do funil.
15
16 CUIDADO: Escolha o funil certo para o volume que será utilizado, o volume total das soluções não pode ultrapassar ¾ do volume total do funil.
17 CUIDADO: O funil de separação é segurado principalmente pelo gargalo superior.
18 Para igualar a pressão interna do funil de separação com a externa, o funil é ventilado segurando-o de cabeça para baixo e abrindo vagarosamente a torneira. SEGURAR A TAMPA FIRMEMENTE!!!!! Vídeo da Pressão
19 CUIDADO: NÃO DIRECIONE O FUNIL DE SEPARAÇÃO PARA AS PESSOAS!!! APONTE PARA DENTRO DE UMA CAPELA.
20 Coloque o funil de separação no suporte metálico e aguarde até que decante as fases. Destampe o funil de separação antes de iniciar a separação das fases. O resultado ideal são duas fases bem definidas, fáceis de separar observando a interface das fases.
21 Pode ocorrer a formação de EMULSÃO.
22 Formação de Emulsão Emulsão é uma solução coloidal de um líquido no outro. São gotículas de solvente orgânicos mantidas em suspensão numa solução aquosa quando os dois são misturados ou agitados vigorosamente.
23 1) Descanso e leves batidas com uma mangueira de silicone na lateral do funil de separação. 2) Descanso e mexidas com uma bagueta.
24 3) Efeito Salting out.
25 Efeito Salting Out O efeito SALTING OUT se baseia no aumento do coeficiente de distribuição da solução que é possível quando um sal é dissolvido na solução coloidal. Como uma das fases é aquosa, as moléculas de água terão preferência em solvatar o sal, liberando assim, as moléculas orgânicas para a fase orgânica. Molécula orgânica solvatada
26 Como retirar CORRETAMENTE as duas fases do funil de separação.
27 A maneira correta de se escoar a fase inferior é igual a de se manusear a bureta numa titulação. MOTIVO: Mais segurança no manuseio da torneira
28 A fase inferior é retirada pela torneira em um frasco seco e limpo. A fase superior é removida vertendo através da abertura superior do funil de separação com o auxílio de uma baguete.
29 PRECAUÇÕES: Não passe as duas fases pela torneira do funil de separação. Não descarte nenhuma fase antes de ter certeza em qual das fases se encontra o soluto desejado na separação.
30 Secar a Fase Orgânica Como secar a FASE ORGÂNICA? Como deve ser o AGENTE SECANTE? não deve combinar quimicamente com o composto orgânico; não deve ter apreciável solubilidade no solvente; rápido e eficiente; mais econômico possível.
31 Etapas da Secagem FILTRAR ADICIONAR AGUARDAR
32 EXTRAÇÃO QUIMICAMENTE ATIVA A EXTRAÇÃO QUIMICAMENTE ATIVA difere da Simples e da Múltipla por envolver uma reação, no caso que estudaremos envolverá uma reação ácido-base, que será necessária para separarmos dois compostos solúveis no solvente orgânico. Ácido Benzóico
33
34 REAÇÕES NA EXTRAÇÃO QUIMICAMENTE ATIVA Adição de NaOH na solução de Ácido Benzóico. Formação do Benzoato de Sódio, um sal solúvel em água.
35 FASE SUPERIOR ORGÂNICA Benzoato de Sódio FASE INFERIOR AQUOSA
36 Fase Orgânica AGENTE SECANTE RECOLHER Solução etérea de p-diclorobenzeno SECAR FILTRAR
37 DESTILAÇÃO SIMPLES
38 Fase Aquosa Recuperação do Ácido Benzóico NaOH + HCl NaCl + H2O Para recuperar o Ácido Benzóico a partir do sal Benzoato de Sódio, adicionamos o Ácido Clorídrico e obtemos uma solução de Ácido Benzóico e Cloreto de Sódio.
39 Como Separar o Ácido Benzóico Filtração a Pressão Reduzida X Extração com Solvente
40 Determinação do Grau de Pureza Um composto sólido com alto grau de pureza funde-se a uma temperatura bem definida, isto é, a faixa do ponto de fusão não excede 1,0 ºC. O ponto de fusão do p-diclorobenzeno é 53,5 ºC O ponto de fusão do ácido benzóico é 122,4 ºC INTERVALO DE FUSÃO: é a diferença entre a temperatura em que se observa o início da degradação (temperatura de degelo) dos cristais e a temperatura em que a amostra se torna completamente líquida (temperatura de fusão).
41 Aparelho Digital de Ponto de Fusão
42 Propriedades Coligativas: Abaixamento do Ponto de Fusão
43
44 BOA PRÁTICA!!!!
45 BOM RELATÓRIO!!!
46 BIBLIOGRAFIA Fundamentos de Química Experimental; CONSTANTINO, M.G. (pag.179~199) VOGEL Análise Química Quantitativa; J. Mendham,R.C Denney, J.D. Barnes, M.J.K. Thomas. Laboratory Experimental in Organic Chemistry; MOHRIG; NECKERS (pag. 33~45) Experimental Organic Chemistry A Small-Scale Aproach; CHARLES F. WILCOX Jr. (cap.6; 80~98) A Tex Book of Practical Organic Chemistry; 3 th Ed; LONGMAN (pag.152,153) Experimental Organic Chemistry A Samall Scale Approach; 2 nd Ed; CHARLE WILCOX Jr, MARY F. WILCOX (pag. 116, 117) Vogel s Texbook of Practical Organic Chemistry; 4 th Ed; LONGMAN (pag.129~140) Merck Index; BUDAVARI, S. (pag.187,369,538,670,677,1542) página da Universidade de Brasília. Figuras e Vídeos TQjukG01PApVtbY31an_HujvxY=&h=298&w=680&sz=94&hl=pt- BR&start=1&tbnid=TtKo6whdCinlTM:&tbnh=61&tbnw=139&prev=/images%3Fq%3Dsimbolos%2Bno%2Blaboratorio%26gbv%3D2%26hl%3Dpt-BR P[agina da Universidade de Brasília.
TABELA 1) Constantes físicas, características e periculosidade dos reagente e produtos.
 TABELA 1) Constantes físicas, características e periculosidade dos reagente e produtos. Substância e Fórmula molecular Etanol C 2 H 5 OH Massa molecular (g/mol) 46,07 P.F. (ºC) P.E. (ºC) 114,1 78,5 Clorofórmio
TABELA 1) Constantes físicas, características e periculosidade dos reagente e produtos. Substância e Fórmula molecular Etanol C 2 H 5 OH Massa molecular (g/mol) 46,07 P.F. (ºC) P.E. (ºC) 114,1 78,5 Clorofórmio
1 EXTRAÇÃO COM SOLVENTES simples e múltipla
 UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 1 EXTRAÇÃO COM SOLVENTES simples e múltipla Discente: Juliana Rodrigues Profº. Dr. José Eduardo de Oliveira Prof o. Dr. Leonardo Pezza
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 1 EXTRAÇÃO COM SOLVENTES simples e múltipla Discente: Juliana Rodrigues Profº. Dr. José Eduardo de Oliveira Prof o. Dr. Leonardo Pezza
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
EXTRAÇÃO POR SOLVENTES (QUIMICAMENTE ATIVA)
 INSTITUTO DE QUÍMICA ARARAQUARA QUÍMICA ORGÂNICA EXPERIMENTAL EXTRAÇÃO POR SOLVENTES (QUIMICAMENTE ATIVA) Prof. Dr. José Eduardo de Oliveira Prof. Dr. Leonardo Pezza Profª Juliana Rodrigues Grupo 6 Michelle
INSTITUTO DE QUÍMICA ARARAQUARA QUÍMICA ORGÂNICA EXPERIMENTAL EXTRAÇÃO POR SOLVENTES (QUIMICAMENTE ATIVA) Prof. Dr. José Eduardo de Oliveira Prof. Dr. Leonardo Pezza Profª Juliana Rodrigues Grupo 6 Michelle
Extração com Solventes
 Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
EXTRAÇÃO COM SOLVENTES
 EXTRAÇÃO COM SOLVENTES Discentes: Alessandra Maciel do Nascimento Mariana Alessandra Corrêa Docente: Prof.Dr. José Eduardo de Oliveira INTRODUÇÃO MISTURAS HOMOGÊNEAS HETEROGÊNEAS SOLUÇÃO EXTRAÇÃO! Exemplos:
EXTRAÇÃO COM SOLVENTES Discentes: Alessandra Maciel do Nascimento Mariana Alessandra Corrêa Docente: Prof.Dr. José Eduardo de Oliveira INTRODUÇÃO MISTURAS HOMOGÊNEAS HETEROGÊNEAS SOLUÇÃO EXTRAÇÃO! Exemplos:
2 EXTRAÇÃO POR SOLVENTES II (Quimicamente Ativa)
 UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 2 EXTRAÇÃO POR SOLVENTES II (Quimicamente Ativa) Discentes: Grupo VIII Mariana de Castro Anna Caroline Franchetti Profº. Dr. Leonardo
UNIVERSIDADE ESTADUAL PAULISTA Instituto de Química ARARAQUARA / SP 2 EXTRAÇÃO POR SOLVENTES II (Quimicamente Ativa) Discentes: Grupo VIII Mariana de Castro Anna Caroline Franchetti Profº. Dr. Leonardo
EXTRAÇÃO COM SOLVENTES
 EXTRAÇÃO COM SOLVENTES Alunas Integrantes: Andréa Cristina Pesce Daniele Tonon Juliana Orru Maria Gabriela R. Oliveira Renata Fogaça Samanta A. Vulcano A técnica de extração A extração é uma técnica para
EXTRAÇÃO COM SOLVENTES Alunas Integrantes: Andréa Cristina Pesce Daniele Tonon Juliana Orru Maria Gabriela R. Oliveira Renata Fogaça Samanta A. Vulcano A técnica de extração A extração é uma técnica para
EXTRAÇÃO COM SOLVENTES II
 EXTRAÇÃO COM SOLVENTES II (Quimicamente Ativa) Discentes: Ana Carolina G. V. Carvalho Laisa dos Santos Lípari Docentes: Profª. Amanda Coelho Danuello Prof.Dr. José Eduardo de Oliveira Prof.Dr. Leonardo
EXTRAÇÃO COM SOLVENTES II (Quimicamente Ativa) Discentes: Ana Carolina G. V. Carvalho Laisa dos Santos Lípari Docentes: Profª. Amanda Coelho Danuello Prof.Dr. José Eduardo de Oliveira Prof.Dr. Leonardo
Extração com Solventes
 Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
Extração com Solventes Discentes: Guilhermina Ferreira Teixeira Mayara Regina dos Santos Ruy Marili Filizatti Docente:Prof.Dr. José Eduardo de Oliveira O que é extração? Este processo é usado em química
Química Orgânica Experimental I. Extração com Solventes
 Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
EXTRAÇÃO COM SOLVENTES (transp. 1)
 EXTRAÇÃO COM SOLVENTES (transp. 1) Usado para separar e isolar determinadas substâncias encontradas em misturas complexas. As substâncias em geral são solúveis em água. Ao se adicionar um solvente não
EXTRAÇÃO COM SOLVENTES (transp. 1) Usado para separar e isolar determinadas substâncias encontradas em misturas complexas. As substâncias em geral são solúveis em água. Ao se adicionar um solvente não
Preparação do cloreto de t-butila. Carina de Freitas Vellosa Daiane Cristina Romanini
 Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL
 DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO DE UMA MISTURA HETEROGÊNEA P =
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO DE UMA MISTURA HETEROGÊNEA P =
EXTRAÇÃO COM SOLVENTES
 UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE QUÍMICA EXTRAÇÃO COM SOLVENTES Extração simples, múltipla e quimicamente ativa Química Orgânica Experimental Prof. José Eduardo de Oliveira Profa. Dra. Angela
UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE QUÍMICA EXTRAÇÃO COM SOLVENTES Extração simples, múltipla e quimicamente ativa Química Orgânica Experimental Prof. José Eduardo de Oliveira Profa. Dra. Angela
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS
 EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
Figura 1: Ilustração do processo de dissolução do NaCl em água.
 Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL
 DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO FRACIONADA DE UMA SOLUÇÃO evaporações
DESTILAÇÃO POR ARRASTE DE VAPOR DE ÁGUA DO ÓLEO DE CRAVO E EXTRAÇÃO QUIMICAMENTE ATIVA DO EUGENOL Principais componentes do óleo de cravo obtidos pelo arraste DESTILAÇÃO FRACIONADA DE UMA SOLUÇÃO evaporações
Figura 1. Variação da solubilidade dos compostos em função da temperatura. fonte: 2010, 2008, 2005, 2002 por P. W. Atkins e L. L. Jones.
 Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
Experiência 4. SOLUBILIDADE 1. Objetivos No final desta experiência, espera-se que o aluno seja capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de extração,
EXPERIÊNCIA 2 - SOLUBILIDADE
 CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 2 - SOLUBILIDADE 1. CONCEITOS FUNDAMENTAIS
CENTRO DE CIÊNCIAS TECNOLÓGICAS - CCT Departamento de Ciências Básicas e Sociais - DCBS Disciplina Química Experimental QEX Prof. Sivaldo Leite Correia EXPERIÊNCIA 2 - SOLUBILIDADE 1. CONCEITOS FUNDAMENTAIS
RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA
 RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA INTRODUÇÃO A RECRISTALIZAÇÃO consiste na dissolução de uma substância sólida num solvente, a quente, e depois, por resfriamento, obtém-se novamente o estado
RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA INTRODUÇÃO A RECRISTALIZAÇÃO consiste na dissolução de uma substância sólida num solvente, a quente, e depois, por resfriamento, obtém-se novamente o estado
5007 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína
 57 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Classificação Tipos de reações e classes das substâncias
57 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Classificação Tipos de reações e classes das substâncias
Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE
 Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE densidade Nomenclatur a 2,152 cloreto de cálcio 0,789 álcool etílico fórmula Mol (g/ml) P.F.( 0 C) P.E.( 0 C) toxidade solubilidade
Propriedades físicas dos reagentes e produtos da prática EXTRAÇÕES COM SOLVENTE densidade Nomenclatur a 2,152 cloreto de cálcio 0,789 álcool etílico fórmula Mol (g/ml) P.F.( 0 C) P.E.( 0 C) toxidade solubilidade
EXPERIMENTOS DE QUIMICA ORGANICA I(QUI 127, QUI 186 E QUI 214) EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO
 EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
EXPERIMENTO 7 TÉCNICAS DE EXTRAÇÃO 1.1. Fundamentação teórica A extração é um processo de separação de compostos que consiste em transferir uma substância da fase na qual essa se encontra (dissolvida ou
INSTITUTO DE QUÍMICA UNESP / ARARAQUARA
 INSTITUTO DE QUÍMICA UNESP / ARARAQUARA Agosto / 2007 Química Orgânica Experimental Prof. José Eduardo de Oliveira Kamila Ericka dos Santos Karina Almeida Rancan Rafael Miguel Sábio Técnica de extração
INSTITUTO DE QUÍMICA UNESP / ARARAQUARA Agosto / 2007 Química Orgânica Experimental Prof. José Eduardo de Oliveira Kamila Ericka dos Santos Karina Almeida Rancan Rafael Miguel Sábio Técnica de extração
A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano
 A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano Objetivo: Recuperar diclorometano e n-hexano de misturas de n-hexano/diclorometano.
A. Recuperação de n-hexano e de diclorometano a partir de resíduo constituído de mistura de n-hexano e diclorometano Objetivo: Recuperar diclorometano e n-hexano de misturas de n-hexano/diclorometano.
Extração do Limoneno. Integrantes do grupo: Diego Souza, Jefferson Honorio, Marcelo Tangerina
 Extração do Limoneno Integrantes do grupo: Diego Souza, Jefferson Honorio, Marcelo Tangerina Quem é o Limoneno? O Limoneno ( IUPAC: : 1-metil1 metil-4-isopropenilciclohex- 1-eno ) é uma substância química:
Extração do Limoneno Integrantes do grupo: Diego Souza, Jefferson Honorio, Marcelo Tangerina Quem é o Limoneno? O Limoneno ( IUPAC: : 1-metil1 metil-4-isopropenilciclohex- 1-eno ) é uma substância química:
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS. Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese II (Alaranjado II) Benzeno Nitrobenzeno Anilina Ácido Sulfanilico Alaranjado II 1- OBTENÇÃO DO NITROBENZENO Reagentes: -Ácido nítrico
Recristalização da Acetanilida
 Profª. Amanda Coelho Danuello Prof. Dr. Leonardo Pezza Prof. Dr. José Eduardo de Oliveira Msc. Rodrigo Sequinel Recristalização da Acetanilida Discentes: Grupo 4 Felipe Berto Ometto Rodolfo Debone Piazza
Profª. Amanda Coelho Danuello Prof. Dr. Leonardo Pezza Prof. Dr. José Eduardo de Oliveira Msc. Rodrigo Sequinel Recristalização da Acetanilida Discentes: Grupo 4 Felipe Berto Ometto Rodolfo Debone Piazza
Experiência 02 - SOLUBILIDADE SOLUBILIDADE
 1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
Química Orgânica. Separação e Purificação de Compostos Orgânicos. Relatório 2. Instituto Superior Técnico. Trabalho realizado por:
 Instituto Superior Técnico Mestrado Integrado em Engenharia Biomédica 2ªano, 2º semestre de 2008/09 Química Orgânica Relatório 2 Separação e Purificação de Compostos Orgânicos Trabalho realizado por: Joana
Instituto Superior Técnico Mestrado Integrado em Engenharia Biomédica 2ªano, 2º semestre de 2008/09 Química Orgânica Relatório 2 Separação e Purificação de Compostos Orgânicos Trabalho realizado por: Joana
SUBSTÂNCIAS E MISTURAS
 Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli [email protected] Monitor: Dr. Wanderson Oliveira
Universidade de São Paulo Instituto de Química de São Carlos Departamento de Físico-Química SUBSTÂNCIAS E MISTURAS Prof. Dr. Edson Antonio Ticianelli [email protected] Monitor: Dr. Wanderson Oliveira
Laboratório de Análise Instrumental
 Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis PRÁTICA 8: Verificação da influência do ph na extração de Fe(III) com éter etílico Objetivo:
Laboratório de Análise Instrumental Prof. Renato Camargo Matos Tutora: Aparecida Maria http://www.ufjf.br/nupis PRÁTICA 8: Verificação da influência do ph na extração de Fe(III) com éter etílico Objetivo:
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXTRAÇÃO POR SOLVENTE
 EXTRAÇÃO POR SOLVENTE Extração consiste na separação de um componente de uma mistura por meio de um solvente. Os solventes devem ser imiscíveis e formar duas fases ou camadas separadas. A substância de
EXTRAÇÃO POR SOLVENTE Extração consiste na separação de um componente de uma mistura por meio de um solvente. Os solventes devem ser imiscíveis e formar duas fases ou camadas separadas. A substância de
RECRISTALIZAÇÃO e. PURIFICAÇÃO da ACETANILIDA. Jaqueline Nicola Thaís Rosa
 RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA Jaqueline Nicola Thaís Rosa INTRODUÇÃO O produto obtido de uma reação química, na maioria das vezes, encontra-se no estado impuro, e é necessário purificá-lo.
RECRISTALIZAÇÃO e PURIFICAÇÃO da ACETANILIDA Jaqueline Nicola Thaís Rosa INTRODUÇÃO O produto obtido de uma reação química, na maioria das vezes, encontra-se no estado impuro, e é necessário purificá-lo.
Experiência 04 - Solubilidade
 Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
Experimentos de Química Orgânica
 Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA
 Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Exercícios Métodos de Separação. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017
 Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios de Solubilidade. Talita M.
 Exercícios de Solubilidade Talita M. Questão 1 (Fuvest) Quatro tubos contêm 20mL (mililitros) de água cada um. Coloca-se nesses tubos dicromato de potássio (K 2 Cr 2 O 7 ) nas seguintes quantidades: Tubo
Exercícios de Solubilidade Talita M. Questão 1 (Fuvest) Quatro tubos contêm 20mL (mililitros) de água cada um. Coloca-se nesses tubos dicromato de potássio (K 2 Cr 2 O 7 ) nas seguintes quantidades: Tubo
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
3033 Síntese do ácido acetilenodicarboxílico a partir de ácido meso dibromosuccínico
 3033 Síntese do ácido acetilenodicarboxílico a partir de ácido meso dibromosuccínico HOOC H Br Br H COOH KOH HOOC COOH C 4 H 4 Br 2 O 4 C 4 H 2 O 4 (275.9) (56.1) (114.1) Classificação Tipos de reação
3033 Síntese do ácido acetilenodicarboxílico a partir de ácido meso dibromosuccínico HOOC H Br Br H COOH KOH HOOC COOH C 4 H 4 Br 2 O 4 C 4 H 2 O 4 (275.9) (56.1) (114.1) Classificação Tipos de reação
1. Procedimento da experiência (Xerox) 2. reação principal e reações secundárias; 3. Tabela de constantes físicas dos reagentes e produtos (conforme
 PLANEJAMENTO DAS PREPARAÇÕES 1. Procedimento da experiência (Xerox) 2. reação principal e reações secundárias; 3. Tabela de constantes físicas dos reagentes e produtos (conforme modelo apresentado em aula)
PLANEJAMENTO DAS PREPARAÇÕES 1. Procedimento da experiência (Xerox) 2. reação principal e reações secundárias; 3. Tabela de constantes físicas dos reagentes e produtos (conforme modelo apresentado em aula)
PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA. Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe
 PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe Reação de Esterificação Os ácidos carboxílicos reagem com álcoois produzindo ésteres
PREPARAÇÃO E PURIFICAÇÃO DO ACETATO DE ISOPENTILA Daniela Gonçalves Dias Jeniffer Biin Huoy Lin Renato Oyadomari Abe Reação de Esterificação Os ácidos carboxílicos reagem com álcoois produzindo ésteres
SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS
 EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
EXPERIMENTO 4 SOLUBILIDADE DE SÓLIDOS EM LÍQUIDOS OBJETIVOS Observar soluções insaturadas, saturadas e supersaturadas; Construir a curva de solubilidade de um sal inorgânico. INTRODUÇÃO Os depósitos naturais
3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno
![3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno 3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno](/thumbs/61/45682965.jpg) 00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
Química Orgânica Experimental I BAC CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS
 Química Orgânica Experimental I BAC - 2009 CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS Além do aqui solicitado para os Pré-Relatórios, devem ser apresentados os itens correspondentes a cada
Química Orgânica Experimental I BAC - 2009 CRITÉRIOS PARA CORREÇÃO DOS PRÉ-RELATÓRIOS E RELATÓRIOS Além do aqui solicitado para os Pré-Relatórios, devem ser apresentados os itens correspondentes a cada
RECRISTALIZAÇÃO ACETANILIDA
 RECRISTALIZAÇÃO ACETANILIDA CONCEITOS A purificação de substâncias sólidas através de recristalização baseia-se nas diferenças em suas solubilidades em diferentes solventes e no fato de que a maioria das
RECRISTALIZAÇÃO ACETANILIDA CONCEITOS A purificação de substâncias sólidas através de recristalização baseia-se nas diferenças em suas solubilidades em diferentes solventes e no fato de que a maioria das
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno
 3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
3003 Síntese de 2-cloro-ciclohexanol a partir de ciclohexeno _ + SO 2 NCl Na OH H 2 SO 4 + x 3 H 2 O + Cl CH 3 SO 2 NH 2 CH 3 C 6 H 10 (82.2) C 7 H 13 ClNNaO 5 S (281.7) (98.1) C 6 H 11 ClO (134.6) C 7
Preparação do Cloreto de t-butila. Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa
 Preparação do Cloreto de t-butila Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante: Solvente;
Preparação do Cloreto de t-butila Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante: Solvente;
ANÁLISE DOS GASES DE COMBUSTÃO ATRAVÉS DO APARELHO ORSAT. Procedimento
 CETESB ANÁLISE DOS GASES DE COMBUSTÃO ATRAVÉS DO APARELHO ORSAT Procedimento L9.210 OUT/90 SUMÁRIO Pág. 1 Objetivo...1 2 Normas Complementar...1 3 Definições...1 4 Aparelhagem e reagentes...1 5 Execução
CETESB ANÁLISE DOS GASES DE COMBUSTÃO ATRAVÉS DO APARELHO ORSAT Procedimento L9.210 OUT/90 SUMÁRIO Pág. 1 Objetivo...1 2 Normas Complementar...1 3 Definições...1 4 Aparelhagem e reagentes...1 5 Execução
3001 Hidroboração/oxidação de 1-octeno a 1-octanol
 3001 Hidroboração/oxidação de 1-octeno a 1-octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Referência Bibliográfica A.S. Bhanu
3001 Hidroboração/oxidação de 1-octeno a 1-octanol 1. NaBH, I CH H 3 C C. H O /NaOH H 3 OH C 8 H 16 NaBH H O I NaOH C 8 H 18 O (11.) (37.8) (3.0) (53.8) (0.0) (130.) Referência Bibliográfica A.S. Bhanu
Recristalização e Purificação da Acetanilida
 Recristalização e Purificação da Acetanilida Química Orgânica Experimental Docentes : Prof. Dr. José Eduardo de Oliveira Prof. Amanda Coelho Danuello Docente: PARÁ vulgo Rafael Rodrigues Hatanaka Discentes:
Recristalização e Purificação da Acetanilida Química Orgânica Experimental Docentes : Prof. Dr. José Eduardo de Oliveira Prof. Amanda Coelho Danuello Docente: PARÁ vulgo Rafael Rodrigues Hatanaka Discentes:
QFL1423 Química Orgânica Experimental
 QFL1423 Química Orgânica Experimental Aula 2 Técnicas Básicas em Química Orgânica Prof. Dr. Leandro H. Andrade (Sala 11 Bloco zero) [email protected] Prof. Dr. Reinaldo C. Bazito (Sala 811 B8I) [email protected]
QFL1423 Química Orgânica Experimental Aula 2 Técnicas Básicas em Química Orgânica Prof. Dr. Leandro H. Andrade (Sala 11 Bloco zero) [email protected] Prof. Dr. Reinaldo C. Bazito (Sala 811 B8I) [email protected]
Recristalização da Acetanilida
 Recristalização da Acetanilida Grupo 2 Maísa Sanchez Gomes Mariana Cutigi Recristalização Método para purificar sólidos ou para separar compostos que são solúveis à quente e insolúveis, ou pouco solúveis,
Recristalização da Acetanilida Grupo 2 Maísa Sanchez Gomes Mariana Cutigi Recristalização Método para purificar sólidos ou para separar compostos que são solúveis à quente e insolúveis, ou pouco solúveis,
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
Recristalização da Acetanilida
 Recristalização da Acetanilida Reação de formação da acetanilida O NH 2 + CH 3 CH 3 C C O O O NaAc/HAc H N C CH 3 + CH 3 C O O H Anilina Anidrido Acético Acetanilida Acido acético H + CH 3 COO - CH 3 COOH
Recristalização da Acetanilida Reação de formação da acetanilida O NH 2 + CH 3 CH 3 C C O O O NaAc/HAc H N C CH 3 + CH 3 C O O H Anilina Anidrido Acético Acetanilida Acido acético H + CH 3 COO - CH 3 COOH
Seminário de Química Orgânica Experimental I. Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002
 Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Métodos Clássicos de Separação
 Analítica V: Aula 9: 22-07-13 Métodos Clássicos de Separação Prof. Rafael Sousa Departamento de Química - ICE [email protected] Notas de aula: www.ufjf.br/baccan Plano de aula Importância da extração
Analítica V: Aula 9: 22-07-13 Métodos Clássicos de Separação Prof. Rafael Sousa Departamento de Química - ICE [email protected] Notas de aula: www.ufjf.br/baccan Plano de aula Importância da extração
1. PREPARO DE SOLUÇÕES E TITULAÇÃO
 1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
1. PREPARO DE SOLUÇÕES E TITULAÇÃO I. INTRODUÇÃO Solução é uma mistura homogênea de uma ou mais substâncias. A substância presente em maior quantidade é denominada solvente, e as outras substâncias na
Exercícios Complementares - Recuperação Paralela. Soluções parte Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é
 Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Soluções parte 1 01 Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é a) ar atmosférico.
Ensino Médio QUÍMICA Exercícios Complementares - Recuperação Paralela Classe: 2 2 a série Soluções parte 1 01 Dentre as misturas abaixo relacionadas, a que não corresponde a uma solução é a) ar atmosférico.
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
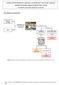 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a macroescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
Processos físicos de separação de misturas
 Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
Preparação do t-butila Reação SN1. Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa
 Preparação do t-butila Reação SN1 Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante; Solvente;
Preparação do t-butila Reação SN1 Ana Carolina Boni Glaucio de Oliveira Testoni Susilaine Maira Savassa Qual a utilidade do cloreto de t-butila? Usado na síntese orgânica como agente alquilante; Solvente;
4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico
 NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
GOIÂNIA, / / PROFESSORA: Núbia de Andrade. DISCIPLINA:Química SÉRIE: 3º. ALUNO(a): Lista de Exercícios P1 I Bimestre
 GOIÂNIA, / / 2016 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 3º ALUNO(a): Lista de Exercícios P1 I Bimestre No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
GOIÂNIA, / / 2016 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 3º ALUNO(a): Lista de Exercícios P1 I Bimestre No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
Neste caso o sistema recebe o nome de DISPERSÃO
 1 2 Em uma mistura de duas espécies químicas diferentes, pode ocorrer a disseminação, sob forma de pequenas partículas, de uma espécie na outra. Neste caso o sistema recebe o nome de DISPERSÃO 3 A espécie
1 2 Em uma mistura de duas espécies químicas diferentes, pode ocorrer a disseminação, sob forma de pequenas partículas, de uma espécie na outra. Neste caso o sistema recebe o nome de DISPERSÃO 3 A espécie
AULA PRÁTICA Nº / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS
 LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
Purificação de Solventes
 Purificação de Solventes Química Orgânica Experimental Ives A. Leonarczyk Matheus Gonçalves Alves Paulo Pessolato Jr. Tiago Varão Data: 21/08/2008 Principais casos onde a purificação é necessária. Solventes
Purificação de Solventes Química Orgânica Experimental Ives A. Leonarczyk Matheus Gonçalves Alves Paulo Pessolato Jr. Tiago Varão Data: 21/08/2008 Principais casos onde a purificação é necessária. Solventes
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p )
 REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
REALIZAÇÃO EXPERIMENTAL - MICROESCALA (adaptada de Pike et al, Microscale Inorganic Chemistry, exp.16, p204-207) PARTE B: PREPARAÇÃO QUANTITATIVA DO TETRATIONATO DE SÓDIO A MICROESCALA Reagentes Tiossulfato
SOLUÇÕES PARTE 1. Giseli Menegat e Maira Gazzi Manfro
 SOLUÇÕES PARTE 1 Giseli Menegat e Maira Gazzi Manfro [email protected] [email protected] * dispersão É o sistema um sistema em que uma substância, sob a forma de pequenas
SOLUÇÕES PARTE 1 Giseli Menegat e Maira Gazzi Manfro [email protected] [email protected] * dispersão É o sistema um sistema em que uma substância, sob a forma de pequenas
Química Geral Experimental - Aula 4
 Química Geral Experimental - Aula 4 Título da Prática: Determinação do teor de álcool etílico na gasolina. Objetivos: Determinar o teor de álcool etílico na gasolina Comercial. Determinar o teor de água
Química Geral Experimental - Aula 4 Título da Prática: Determinação do teor de álcool etílico na gasolina. Objetivos: Determinar o teor de álcool etílico na gasolina Comercial. Determinar o teor de água
Tarefa 22 Professor Gustavo
 6º ano Química Tarefa 22 Professor Gustavo 01. Uma amostra de água do mar contaminada com óleo foi coletada em alto mar. Sobre os procedimentos aplicados para a separação eficiente dos componentes dessa
6º ano Química Tarefa 22 Professor Gustavo 01. Uma amostra de água do mar contaminada com óleo foi coletada em alto mar. Sobre os procedimentos aplicados para a separação eficiente dos componentes dessa
QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES. Prof a. Giselle Blois. Estudo da matéria: substâncias, misturas, processos de separação Parte 2
 QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES Estudo da matéria: substâncias, misturas, Parte 2 Prof a. Giselle Blois Métodos de separação de misturas: O método empregado vai depender da mistura, já que esta
QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES Estudo da matéria: substâncias, misturas, Parte 2 Prof a. Giselle Blois Métodos de separação de misturas: O método empregado vai depender da mistura, já que esta
Estudo Estudo da Química
 Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: [email protected] Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
Estudo Estudo da Química Prof. Railander Borges Fale com o Professor: Email: [email protected] Instagram: @rayllanderborges Facebook: Raylander Borges Aula 16 CONCENTRAÇÃO DE SOLUÇÕES 1.
Recristalização da Acetanilida
 Recristalização da Acetanilida Química Orgânica Experimental Docentes José Eduardo de Oliveira Amanda Coelho Danuello 9º Seminário Daniela Corsino Sandron Fernando Monteiro Borges Willian Richard Rodrigues
Recristalização da Acetanilida Química Orgânica Experimental Docentes José Eduardo de Oliveira Amanda Coelho Danuello 9º Seminário Daniela Corsino Sandron Fernando Monteiro Borges Willian Richard Rodrigues
CQ136 Química Experimental I. Técnicas de purificação e critérios de pureza
 CQ136 Química Experimental I Técnicas de purificação e critérios de pureza Introdução Fundamentalmente em todos os métodos de purificação utiliza-se uma propriedade onde os componentes da mistura se comportam
CQ136 Química Experimental I Técnicas de purificação e critérios de pureza Introdução Fundamentalmente em todos os métodos de purificação utiliza-se uma propriedade onde os componentes da mistura se comportam
Química Orgânica Experimental
 Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
Métodos Clássicos de Separação
 Analítica V: Aula 15-05-12 Plano de aula Importância da extração química nos procedimentos de análise Etapasdeumprocesso deextração Métodos Clássicos de Separação O processo de destilação e exemplos para
Analítica V: Aula 15-05-12 Plano de aula Importância da extração química nos procedimentos de análise Etapasdeumprocesso deextração Métodos Clássicos de Separação O processo de destilação e exemplos para
PURIFICAÇÃO DO ÉTER ETÍLICO PARTE 2. Instituição, alunos que irão proferir, curso, ano, professores e estagiários docentes
 PURIFICAÇÃO DO ÉTER ETÍLICO PARTE 2 Instituição, alunos que irão proferir, curso, ano, professores e estagiários docentes ASSUNTOS ABORDADOS: Filtração Fontes de aquecimento Ponto de Ebulição Destilação
PURIFICAÇÃO DO ÉTER ETÍLICO PARTE 2 Instituição, alunos que irão proferir, curso, ano, professores e estagiários docentes ASSUNTOS ABORDADOS: Filtração Fontes de aquecimento Ponto de Ebulição Destilação
4014 Separação enantiomérica de (R)- e (S)-2,2'-dihidroxi-1,1'- binaftil ((R)- e (S)-1,1-bi-2-naftol)
 4014 Separação enantiomérica de (R)- e (S)-2,2'-dihidroxi-1,1'- binaftil ((R)- e (S)-1,1-bi-2-naftol) NBCC CH 3 CN + C 20 H 14 O 2 C 26 H 29 ClN 2 O (286,3) (421,0) R-enantiômero S-enantiômero Classificação
4014 Separação enantiomérica de (R)- e (S)-2,2'-dihidroxi-1,1'- binaftil ((R)- e (S)-1,1-bi-2-naftol) NBCC CH 3 CN + C 20 H 14 O 2 C 26 H 29 ClN 2 O (286,3) (421,0) R-enantiômero S-enantiômero Classificação
Prof.: HÚDSON SILVA. Soluções. Frente 2 Módulo 5. Coeficiente de Solubilidade.
 Prof.: HÚDSON SILVA Frente 2 Módulo 5 Soluções. Coeficiente de Solubilidade. # SOLUÇÕES É uma mistura homogênea de duas ou mais substâncias. Exemplos: Água + Açúcar, Gasolina + Álcool, CLASSIFICAÇÃO DOS
Prof.: HÚDSON SILVA Frente 2 Módulo 5 Soluções. Coeficiente de Solubilidade. # SOLUÇÕES É uma mistura homogênea de duas ou mais substâncias. Exemplos: Água + Açúcar, Gasolina + Álcool, CLASSIFICAÇÃO DOS
2º ano do Ensino Médio Profª Luiza Martins
 2º ano do Ensino Médio Profª Luiza Martins Dispersão coloidal Ganache: é uma emulsão estável de gordura em água. A gordura vêm do creme de leite e do chocolate e a água do creme de leite. Bolo: A massa
2º ano do Ensino Médio Profª Luiza Martins Dispersão coloidal Ganache: é uma emulsão estável de gordura em água. A gordura vêm do creme de leite e do chocolate e a água do creme de leite. Bolo: A massa
Química Orgânica Experimental I. Extração com Solventes
 Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
Química Orgânica Experimental I Extração com Solventes Discentes: Guilherme A.D. Trevisan Thomas Habeck Ian Maluf Farhat Docente: Prof. Dr. José Eduardo de Oliveira Princípios básicos O que é extração?
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA. Tópicos de Química Experimental. Débora Alvim/ Willian Miguel
 MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
MATERIAIS BÁSICOS DO LABORATÓRIO DE QUÍMICA Tópicos de Química Experimental Débora Alvim/ Willian Miguel BÉQUER OU BECHER É de uso geral em laboratório: Serve para fazer reações entre soluções Dissolver
Experiência 2 : TEMPERATURA DE FUSÃO DE UMA SUBSTÂNCIA
 Experiência 2 : TEMPERATURA DE FUSÃO DE UMA SUBSTÂNCIA 1. Objetivos Ao final desta atividade experimental espera-se que os alunos sejam capazes de: - Identificar compostos e determinar suas purezas usando
Experiência 2 : TEMPERATURA DE FUSÃO DE UMA SUBSTÂNCIA 1. Objetivos Ao final desta atividade experimental espera-se que os alunos sejam capazes de: - Identificar compostos e determinar suas purezas usando
Química Geral Experimental - Aula 4
 Química Geral Experimental - Aula 4 Título da Prática: Determinação do teor de álcool etílico na gasolina. Objetivos: Determinar o teor de álcool etílico na gasolina Comercial. Determinar o teor de água
Química Geral Experimental - Aula 4 Título da Prática: Determinação do teor de álcool etílico na gasolina. Objetivos: Determinar o teor de álcool etílico na gasolina Comercial. Determinar o teor de água
Separação de misturas
 Separação de misturas Filtração: A separação se faz através de uma superfície porosa chamada filtro; o componente sólido ficará retido sobre a sua superfície, separando-se assim do líquido que atravessa.
Separação de misturas Filtração: A separação se faz através de uma superfície porosa chamada filtro; o componente sólido ficará retido sobre a sua superfície, separando-se assim do líquido que atravessa.
PROCESSOS DE SEPARAÇÃO. Jeosafá Lima
 PROCESSOS DE SEPARAÇÃO Jeosafá Lima Misturas homogêneas e heterogêneas Uma mistura é constituída por duas ou mais substâncias, sejam elas simples ou compostas. https://www.youtube.com/watch?v=6jcxdhovkcm
PROCESSOS DE SEPARAÇÃO Jeosafá Lima Misturas homogêneas e heterogêneas Uma mistura é constituída por duas ou mais substâncias, sejam elas simples ou compostas. https://www.youtube.com/watch?v=6jcxdhovkcm
1 de 7 01/11/12 10:49
 1 de 7 01/11/12 10:49 Olimpíada Brasileira de Química Seletiva para a 31 th International Chemistry Olympiad (Tailândia, 4 a 11 julho/1999) DATA: 27.03.99 HORA: 14 horas Nome: Estado: Identifique-se somente
1 de 7 01/11/12 10:49 Olimpíada Brasileira de Química Seletiva para a 31 th International Chemistry Olympiad (Tailândia, 4 a 11 julho/1999) DATA: 27.03.99 HORA: 14 horas Nome: Estado: Identifique-se somente
