UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA E EVOLUÇÃO
|
|
|
- Danilo Coimbra Wagner
- 6 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA E EVOLUÇÃO ESTUDOS CITOGENÉTICOS EM ALGUMAS ESPÉCIES DE LORICARIIDAE (TELEOSTEI, SILURIFORMES) DA REGIÃO DE TRANSPOSIÇÃO DO RIO PIUMHI PARA O RIO SÃO FRANCISCO Ernani de Oliveira Mendes Neto SÃO CARLOS 2008
2 Livros Grátis Milhares de livros grátis para download.
3 UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA E EVOLUÇÃO ESTUDOS CITOGENÉTICOS EM ALGUMAS ESPÉCIES DE LORICARIIDAE (TELEOSTEI, SILURIFORMES) DA REGIÃO DE TRANSPOSIÇÃO DO RIO PIUMHI PARA O RIO SÃO FRANCISCO Ernani de Oliveira Mendes Neto Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Genética e Evolução do Centro de Ciências Biológicas e da Saúde da Universidade Federal de São Carlos, como parte dos requisitos para a obtenção do título de Mestre em Genética e Evolução, área de concentração: Genética e Evolução. SÃO CARLOS 2008
4 Ficha catalográfica elaborada pelo DePT da Biblioteca Comunitária da UFSCar M538ec Mendes Neto, Ernani de Oliveira. Estudos citogenéticos em algumas espécies de Loricariidae (Teleostei, Siluriformes) da região de transposição do rio Piumhi para o rio São Francisco / Ernani de Oliveira Mendes Neto. -- São Carlos : UFSCar, f. Dissertação (Mestrado) -- Universidade Federal de São Carlos, Citogenética de peixes. 2. Loricariidae. 3. Transposição de águas. 4. Fish - DNAr 18S. 5. Fish - DNAr 5S. I. Título. CDD: (20 a )
5 Orientador Prof. Dr. Orlando Moreira Filho
6 Dedico este trabalho aos meus pais Denise e Ernani
7 AGRADECIMENTOS Os meus agradecimentos vão para toda a estrutura institucional e humana que possibilitaram a realização deste trabalho. À Fundação de Amparo e à Pesquisa do Estado de São Paulo (FAPESP), pela bolsa concedida (Proc.: 06/ ), a qual foi muito útil durante o desenvolvimento deste trabalho. Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) pelo auxílio concedido durante toda a minha formação científica e durante a elaboração deste trabalho. Ao Programa de Pós-graduação em Genética e Evolução, ao Laboratário de Citogenética de Peixes do Departamento de Genética e Evolução da Universidade Federal de São Carlos e ao Laboratório de Citogenética e Evolução da Universidade Estadual de Ponta Grossa pelo suporte e auxílio no desenvolvimento deste trabalho. Ao meu orientador, Prof. Dr. Orlando Moreira Filho, por ter acreditado em mim e me ter proporcionado a realização deste mestrado. Ao meu co-orientador, Prof. Dr. Marcelo Ricardo Vicari, por toda ajuda e ensinamento a mim concedida durante toda a minha formação científica. Ao amigo Marcelo pelo apoio e pelos momentos de descontração. Aos Profs. Drs. Mara Cristina de Almeida Matiello e Roberto Ferreira Artoni do Laboratório de Citogenética e Evolução da UEPG, por terem acreditado em mim e me dado a oportunidade de ingressar no meio científico. Aos meus pais Denise e Ernani que mesmo com alguma dificuldade me possibilitaram realizar meus estudos. Aos meus irmãos Erenise, Edelize, Rodrigo e Giovanna.
8 Aos meus melhores amigos Camila Gadens, Camila Sanches e Fabiano pelos momentos de descontração e principalmente por me agüentarem nos momentos mais estressantes. Aos amigos Camila e Cleverson por toda ajuda e hospitalidade, sempre que eu precisava de um abrigo em Ponta Grossa. Aos amigos e colegas do Laboratório de Citogenética de Peixes da UFSCar: Daniel Blanco, Elisângela, Rosângela, Wellington, Daniel Magrão, Viviane, Karina, Marcelo, Celeste, Débora, Marceléia e Maressa. Aos amigos que fiz em São Carlos: Vagner, Tathianna, Simone, Tatiana, Andréa, Thaís e Eder. Aos amigos e colegas do Departamento de Genética e Evolução. Aos amigos do Laboratório de Citogenética e Evolução da UEPG. A todos aqueles que direta ou indiretamente me ajudaram neste trabalho, mas que me esqueci de nomear, meu muito obrigado.
9 Nós vamos morrer, e isso nos torna afortunados. A maioria das pessoas nunca vai morrer, porque nunca vai nascer. As pessoas potenciais que poderiam estar no meu lugar, mas que jamais verão a luz do dia, são mais numerosas que os grãos de areia da Arábia. Certamente esses fantasmas não nascidos incluem poetas maiores que Keats, cientistas maiores que Newton. Sabemos disso porque o conjunto das pessoas possíveis permitidas pelo nosso DNA excede em muito o conjunto das pessoas reais. Apesar dessas probabilidades assombrosas, somos você e eu, com toda nossa banalidade, que aqui estamos. Richard Dawkins
10 RESUMO A família Loricariidae é a segunda mais numerosa entre os peixes, com 716 espécies distribuídas entre 96 gêneros e seis subfamílias. Neste trabalho foram caracterizadas citogeneticamente, por meio de ferramentas convencionais e moleculares, cinco espécies desta família que ocorrem na região de cabeceira da bacia do rio São Francisco, município de Piumhi: quatro espécies do gênero Hypostomus (Hypostomus sp.1a, Hypostomus sp.1b, Hypostomus sp.2 e Hypostomus regani) e uma espécie do gênero Rineloricaria (Rineloricaria cf. latirostris). Hypostomus sp.1a e Hypostomus sp.1b foram consideradas pelo especialista como uma única espécie. Entretanto, os marcadores cromossômicos utilizados no presente trabalho mostraram-se concisos, podendo demonstrar que se trata de duas espécies distintas. A ocorrência de Hypostomus regani e Rineloricaria cf. latirostris para o rio São Francisco é relatada pela primeira vez. Os dados citogenéticos para estas duas espécies sugerem que elas são formas invasoras para o rio São Francisco, originadas da bacia do Alto Paraná. A citogenética molecular mostrou-se útil na identificação e diferenciação de espécies da família Loricariidae. Principalmente o cístron 5S demonstrou ser um conciso marcador espécie/específico. Este estudo demonstra claramente que as ferramentas citogenéticas foram muito eficientes na distinção de algumas espécies crípticas e/ou problemáticas sobre o ponto de vista taxonômico, bem como no rastreamento e no mapeamento de algumas espécies da família Loricariidae do rio Piumhi, consideradas invasoras para a bacia do rio São Francisco.
11 ABSTRACT The Loricariidae is the second largest family among fishes, with 716 species, distributed in 96 genera and 6 subfamilies. Five species of this family, four species of the Hypostomus genus (Hypostomus sp.1a, Hypostomus sp.1b, Hypostomus sp.2 e Hypostomus regani) and one specie of the Rineloricaria genus (Rineloricaria cf. latirostris), which are found in the headwaters of the São Francisco River, in Piumhi town, were cytogenetically characterized using conventional and molecular tools. One specialist considered Hypostomus sp.1a and Hypostomus sp.1b to be only one specie. However, the chromosomal markers used in this present work have been shown concise, so they could demonstrate that those two species are, in fact, distinct. The occurrence of Hypostomus regani and Rineloricaria cf. latirotris in the São Francisco River is reported for the first time. The cytogenetic data for these two species suggest that they are invasive forms for the São Francisco River, originated from the upper Paraná River basin. The molecular cytogenetic has been shown useful for the identification and differentiation of species of the Loricariidae family. Mainly, the cistron 5S ended up as a very concise specie/specific marker. This study clearly shows that the cytogenetic tolls were very efficient at distinguishing some cryptic and/or problematic species in the taxonomic point of view, so as at finding and mapping of some species of the Loricariidae family of the Piumhi River, considered invasive for the headwaters of the São Francisco River.
12 LISTA DE FIGURAS Figura 01 Bacia do rio São Francisco Figura 02 Em a): Rio Piumhi antes da construção da Represa da Usina Hidroelétrica de Furnas. O ribeirão da Água Limpa está indicado pelo número 1. Em b): Transposição das águas do rio Piumhi: (1) canal de transposição, (2), (3) lago artificial formado pela drenagem do baixo Piumhi após a construção do dique de Capitólio, (4) dique de Capitólio, (5) lago de furnas, (6) Represa de Furnas no rio Grande. (Fonte: MOREIRA-FILHO & BUCKUP, 2005) Figura 03 Local de coleta dos espécimes analisados. Quadrado Azul = Hypostomus regani, Estrela Laranja = Rineloricaria cf. latirostris, Círculo Amarelo = Hypostomus sp.1a, Círculo Verde = Hypostomus sp.1b e Triângulo Vermelho = Hypostomus sp.2. (Fonte: MOREIRA- FILHO & BUCKUP, 2005 modificado por Wellington Adriano Moreira Peres) Figura 04 Cariótipo de Hypostomus regani corado com Giemsa em (a). (b) apresenta o padrão de distribuição da heterocromatina constitutiva evidenciada pelo bandamento C. A caixa (c) apresenta os cromossomos impregnados pelo Nitrato de Prata Figura 05 Cromossomos mitóticos de Hypostomus regani submetidos à hibridação fluorescente in situ com sondas de DNAr 18S (a) e 5S (b). Setas= sítios evidenciados pela técnica. Barra= 10µm Figura 06 Cariótipo de Hypostomus sp.1a. (a) coloração convencional; (b) bandamento C; (c) cromossomos portadores de Ag-RONs Figura 07 Hibridação fluorescente in situ evidenciando a localização de sítios de DNAr 18S (a) e 5S (b) em Hypostomus sp.1a. Setas= sítios evidenciados pela técnica. Barra= 10µm Figura 08 Cariótipo de Hypostomus sp.1b corado com Giemsa em (a). (b) apresenta o padrão de distribuição da heterocromatina constitutiva evidenciada pelo bandamento C. A caixa (c) apresenta os cromossomos impregnados pelo Nitrato de Prata Figura 09 Cromossomos mitóticos de Hypostomus sp.1b submetidos à hibridação fluorescente in situ com sondas de DNAr 18S (a) e 5S (b). Setas= sítios evidenciados pela técnica. Barra= 10µm Figura 10 Cariótipo de Hypostomus sp.2. (a) coloração convencional; (b) bandamento C; (c) cromossomos portadores de Ag-RONs... 35
13 Figura 11 Hibridação fluorescente in situ evidenciando a localização de sítios de DNAr 18S (a) e 5S (b) em Hypostomus sp.2. Setas= sítios evidenciados pela técnica. Barra= 10µm Figura 12 Cariótipo de Rineloricaria cf. latirostris corado com Giemsa em (a). (b) apresenta o padrão de distribuição da heterocromatina constitutiva evidenciada pelo bandamento C. A caixa (c) apresenta os cromossomos impregnados pelo Nitrato de Prata Figura 13 Cromossomos mitóticos de Rineloricaria cf. latirostris submetidos à hibridação fluorescente in situ com sondas de DNAr 18S (a) e 5S (b). Setas= sítios evidenciados pela técnica. Barra= 10µm... 39
14 SUMÁRIO 1) INTRODUÇÃO: ) Família Loricariidae: ) Estudos citogenéticos na família Loricariidae ) Endemismo em riachos: ) Bacia do rio São Francisco: ) Rio Piumhi ) Transposição do rio Piumhi ) OBJETIVOS ) MATERIAL E MÉTODOS ) Material e Locais de Coleta ) Metodologia ) Indução de Metáfases ) Obtenção dos Cromossomos Mitóticos ) Análise Cromossômica ) Detecção das Regiões Heterocromáticas ) Detecção das Regiões Organizadoras de Nucléolo (Ag-RONs) ) Hibridação Fluorescente in situ ) Análises Cariotípicas ) RESULTADOS ) Hypostomus regani ) Hypostomus sp.1a ) Hypostomus sp.1b ) Hypostomus sp ) Rineloricaria cf. latirostri...37
15 5) DISCUSSÃO ) Diversidade Cromossômica na família Loricariidae ) A Transposição do rio Piumhi e Espécies Invasoras ) CONCLUSÃO ) REFERÊNCIAS...66
16 1 1) INTRODUÇÃO: 1.1) Família Loricariidae: Os loricariídeos são comumente reconhecidos por possuírem o corpo recoberto por placas dérmicas (o que lhes confere o nome popular de cascudos ) e a boca em forma de ventosa localizada na região ventral. A família Loricariidae é a segunda mais numerosa entre os peixes, com 716 espécies, distribuídas entre 96 gêneros (FERRARIS, 2007). Estes peixes estão distribuídos por toda a região Neotropical, estendendo-se da Costa Rica à Argentina (REIS et al., 2003). Desde o reconhecimento de Loricariidae como uma família, sob o nome de Gonyodontes, por Spix e Agassiz em 1829 (GOSLINE, 1947), muitas formas de agrupamento das espécies foram propostas por ictiólogos. Em 2003 REIS et al. propuseram que a família Loricariidae seria composta por seis subfamílias: Ancistrinae, Hypoptopomatinae, Hypostominae, Lithogeneinae, Loricariinae e Neoplecostominae. ARMBRUSTER (2004), através da análise cladística de um número maior de características reordenou esta distribuição, propondo a criação de uma nova subfamília composta pelos gêneros Delturus e Upsilodus e a extinção das subfamílias Ancistrinae e Lithogeneinae. Nesta proposta os integrantes da subfamília Ancistrinae passariam para a subfamília Hypostominae na forma de tribo. Desta forma a sub-família Hypostominae passaria a ter cinco tribos: Ancistrini, Corymbophanini, Hypostomini, Pterygoplichthini e Rhinelipini. O único gênero representante de Lithogeneinae, Lithogenes, passaria à família Astroblepidae, juntamente com o gênero Astroblepus. Assim sendo, a família Loricariidae passaria a ser dividida em cinco subfamílias: Delturinae, Hypoptopomatinae, Hypostominae, Loricariinae e Neoplecostominae.
17 2 Entretanto, REIS et al. (2006) propuseram uma nova filogenia, similar à apresentada por ARMBRUSTER (2004), onde eles descrevem a subfamília Delturinae e alocam Ancistrinae como tribo de Hypostominae. No entanto, eles mantêm Lithogeneinae como subfamília de Loricariidae. Seguindo este último estudo cladístico realizado na família, têm-se seis subfamílias para Loricariidae: Loricariinae, Hypoptopomatinae, Hypostominae, Neoplecostominae, Lithogeneinae e Delturinae. 1.2) Estudos citogenéticos na família Loricariidae Embora Loricariidae seja uma família muito ampla, apenas 111 das 716 espécies pertencentes a ela foram estudadas citogeneticamente. A família Loricariidae possui grande variabilidade tanto no que se refere ao número diplóide, que pode variar de 2n=34 em Ancistrus sp. 1 e Ancistrus sp. 2 (OLIVEIRA, 2006) a 2n=96 em Upsilodus sp. (KAVALCO, et al., 2004), quanto à macroestrutura cariotípica, que podem apresentar fórmula cariotípica variando de cariótipos formados apenas de cromossomos meta e submetacêntricos, como no caso de Otocinclus affinis que possui 2n=54 e NF=108 (ANDREATA, et al., 1994) a cariótipos formados predominantemente por cromossomos subtelo e acrocêntricos, como no caso de Hypostomus strigaticeps que possui 2n=74 e NF=86 (MICHELE et al., 1977), entre outros. Os estudos citogenéticos já realizados na família Loricariidae não abrangem espécies de todas as seis subfamílias. Entre as subfamílias analisadas, a representatividade não é a mesma. Na subfamília Lithogeneinae, que possui apenas uma espécie descrita taxonomicamente ainda não foram realizados estudos nesta
18 3 área. A sub-família Hypostominae é sem dúvida a que apresenta o maior número de espécies estudadas pela citogenética, com 61 representantes. Nesta subfamília observa-se que o número modal varia de 2n=34 em Ancistrus sp. 1 e Ancistrus sp. 2 (OLIVEIRA, 2006) a 2n=80 em Hypostomus sp. E (ARTONI & BERTOLLO, 1996). A subfamília Loricariinae apresenta 21 espécies com estudos cromossômicos e apresenta uma variação no número cromossômico de 2n=36 em Rineloricaria latirostris (GIULIANO-CAETANO, 1998) a 2n=74 em Sturisoma cf. nigrirostrum (ARTONI & BERTOLLO, 2001). Análises cromossômicas em 15 espécies de Hypoptopomatinae demonstraram em 13 espécies (ANDREATA et al., 1992, 1993, 1994, 2006; CAMILO & MOREIRA-FILHO, 2005) o número cromossômico conservado de 2n=54, e apenas duas espécies com números diplóides divergentes. Em Hisonotus gibbosos evidenciou-se 2n=58 (ANDREATA et al., 2000) enquanto em Otocinclus aff. vestitus foi relatado 2n=72 (ANDREATA et al., 1994). Entre as seis subfamílias de Loricariidae, doze espécies foram estudadas de Neoplecostominae, (ALVES, 2000; ALVES et al., 2003, 2005; KAVALCO et al., 2004), mantendo o número cromossômico (2n= 54) conservado. Delturinae apresenta apenas uma espécie (Upsilodus sp.) estudada, a qual apresenta 2n=96 (KAVALCO et al., 2004). Sistemas de cromossomos sexuais têm sido relatados na família Loricariidae. Os sistemas de cromossomos sexuais encontrados vão desde os sistemas simples, como o XX/XO em Ancistrus n. sp. 1 (ALVES et al., 2003), o XX/XY em Hypostomus ancistroides e H. macrops (Michele et al., 1977), Pseudotocinclus tietensis (ANDREATA et al., 1992), Ancistrus cf. dubius (MARIOTTO & MIYAZAWA, 2006), Ancistrus sp.1, Ancistrus sp.2 e Ancistrus n.sp.5, (Oliveira, 2006) e o ZZ/ZW em
19 4 Microlepdogaster leucofrenatus (ANDREATA et al., 1993), Loricariichthys platymetopon (SCAVONE & JULIO JR., 1995), Hypostomus sp. G (ARTONI et al., 1998) e Ancistrus cf. dubius (MARIOTTO et al., 2004), Ancistrus ranunculus, Ancistrus sp. 6 e Hemiancistrus spilomma (Oliveira, 2006; Oliveira et al., 2007), até sistemas de cromossomos sexuais múltiplos, como o XX/XY 1 Y 2 em Harttia carvalhoi (CENTOFANTE et al., 2006) e Ancistrus sp. 8 (Oliveira, 2006) e Z 1 Z 1 Z 2 Z 2 /Z 1 Z 2 W 1 W 2.em Ancistrus sp. 3 (OLIVEIRA, 2006). Polimorfismos cromossômicos interpopulacionais também foram relatados em algumas espécies da família Loricariidae, como no caso de Ancistrus cf. dubius (MARIOTTO et al., 2004; MARIOTTO & MIYAZAWA, 2006) que apresenta entre as populações tanto em número cromossômico como aestrutura cariotípica divergente. Hypostomus ancistroides, apesar de manter o número cromossômico de 2n=68, demonstra fórmulas cromossômicas diferentes para cada uma das sete populações estudadas, sendo que uma delas evidencia sistema de cromossomos sexuais do tipo XX/XY (MICHELE, 1977; ARTONI & BERTOLLO, 1996; ALVES et al., 2006; RUBERT, 2007). Em duas populações de Hypostomus paulinus e as seis populações de Hypostomus strigaticeps (MICHELE, 1977; RUBERT, 2007) foram evidenciados números cromossômicos distintos. Já em duas populações de Neoplecostomus microps (ALVES et al., 2005; KAVALCO et al., 2005) evidenciaramse fórmulas cariotípicas divergentes. A mesma situação foi evidenciada em três populações de Hypostomus regani que apresentaram 2n=72 (ARTONI & BERTOLLO, 1996; ALVES et al., 2006; RUBERT, 2007). Em Liposarcus anisitsi o número diplóide de 2n=52 também se manteve conservado nas três populações estudadas (ALVES et al., 2006; ARTONI & BERTOLLO, 1999), mas a fórmula cariotípica variou.
20 5 Polimorfismos cromossômicos intrapopulacionais também foram relatados, como no caso descrito por GIULIANO-CAETANO (1998) para Rineloricaria latirostris, que apresentou variação no número cromossômico dentro de cada uma das quatro populações estudadas, além de ter evidenciado que alguns espécimens de uma das populações não apresentaram um número modal característicos. Outro tipo de polimorfismo cromossômico encontrado nesta família refere-se à presença de cromossomos supranumerários. Estes foram relatados apenas em Microlepdogaster leucofrenatus (ANDREATA et al., 1993), Loricaria prolixa, Loricaria sp. (SCAVONE & JULIO JR., 1994) e Rineloricaria pentamaculata (ERRERO- PORTO, 2007). Muitas espécies deste grupo de peixes têm sido estudadas citogeneticamente, entretanto, somente em poucas foram realizados estudos de citogenética molecular, através de hibridização fluorescente in situ, sendo que estes se referem à localização dos sítios de DNAr 18S e 5S. Um estudo realizado por KAVALCO et al. (2004, 2005), localizou os sítios de DNAr 5S e 18S em quatro espécies de Loricariidae, sendo elas: Neoplecostomus microps, pertencente à subfamília Neoplecostominae; Harttia loricariformis, pertencente à subfamília Loricariinae, Upsilodus sp., pertencente à subfamília Delturinae e Hypostomus affinis, pertencente à subfamília Hypostominae. As espécies analisadas apresentaram apenas um par cromossômico marcado com a sonda de DNAr 18S, o qual correspondeu com os sítios de Ag-RON, exceto H. affinis que apresentou cinco cromossomos marcados com a sonda de DNAr 18S e de dois a cinco sítios de Ag-RON. Os sítios de DNAr 5S variaram de dois a oito. Sua localização foi mais freqüente na região intersticial dos braços cromossômicos, sendo que apenas
21 6 Hypostomus affinis apresentou sítios localizados na região terminal. Harttia loricariformis apresentou sítios de DNAr 5S em sintenia com o sítio de DNAr 18S. CENTOFANTE et al. (2006), analisando uma população de Harttia carvalhoi, pertencente a subfamília Loricariinae, verificou que nesta espécie o sítio de DNAr 18S encontra-se em um único par cromossômico, coincidindo com a posição das RONs e que a espécie possui dois pequenos loci de DNAr 5S, sendo que um dos loci encontra-se em sintenia com o sítio de DNAr 18S. 1.3) Endemismo em riachos: Espécies endêmicas são aquelas restritas a uma região ou localidade específica. Uma vez que uma espécie recém formada ocupa uma área restrita, sua distribuição fica limitada por barreiras que circundam sua área de origem. O tamanho absoluto dos sistemas de rios tropicais de grande porte é um importante fator no processo evolutivo dos peixes, pois permite que muitas espécies de peixes se isolem geograficamente nas cabeceiras de seus tributários através de barreiras físicas, químicas ou bióticas (LOWE-MCCONNEL, 1969). As espécies de peixes descritas em riachos são, geralmente, de pequeno porte e apresentam caracteres redutivos (CASTRO, 1999). Estes peixes, de modo geral possuem uma capacidade de deslocamento relativamente baixa, não realizando migrações extensas durante suas vidas (CASTRO, op. cit.). Este fato deve facilitar em muito a ocorrência de eventos de vicariância, levando à multiplicação, por especiação alopátrica, de espécies de peixes de riacho caracterizadas por distribuição geográfica restrita (CASTRO, 1999). BUCKUP (1999) afirma que a identificação de áreas de endemismo
22 7 associadas à ocorrência de eventos de vicariância é um campo bastante promissor para estudos de diversidade e conservação, corroborando as recomendações de BÖHLKE et al. (1978) que enfatizaram a necessidade de se coletar e estudar peixes de áreas com endemismo acentuado, como cabeceiras de rios. De modo geral, a fauna de peixes de riachos é formada por um conjunto de espécies pouco conhecidas e ameaçadas pela ação antrópica, especialmente no sudeste do Brasil (MENEZES et al., 1990 apud BUCKUP, 1999). Nos últimos anos o número de publicações sobre a citogenética de peixes tem aumentado consideravelmente, mas referem-se, principalmente, a espécies que habitam calhas de rios ou ambientes lênticos. Trabalhos relativos a ambientes de cabeceiras de rios são raros, restringindo-se, geralmente, a levantamentos faunísticos, abordagens taxonômicas ou distribuição longitudinal de espécies (CARAMASCHI, 1986; LANGEANI-NETO, 1989; GARUTTI, 1998). 1.4) Bacia do rio São Francisco: A bacia hidrográfica do rio São Francisco (Figura 01), em seu sentido amplo, de recepção, transporte e deposição de toda a drenagem superficial e subterrânea, abrange uma área de ,2 km², o que equivale a cerca de 7,4% do território nacional, contida aproximadamente entre as coordenadas de Lat. S e Log. W Gr. Trata-se da terceira bacia hidrográfica do Brasil, e a primeira contida inteiramente em território brasileiro, segundo o mesmo critério. Considerando-se o trecho tradicional ou histórico, o rio São Francisco nasce no Chapadão dos Zagaias, nos altos orientais da Serra da Canastra e percorre km até a foz. Para o trecho geográfico, considerando-se suas nascentes verdadeiras nas nascentes do rio
23 8 Samburá, sua extensão passa a ser de km. O rio São Francisco abrange as regiões Nordeste, Sudeste e Centro-Oeste, cortando os estados de Pernambuco, Alagoas, Sergipe, Bahia, Minas Gerais, Goiânia e o Distrito Federal (PAIVA, 1982, 1983, CETEC apud KOHLER, 2003; SILVA et al., 2003). Ao longo do seu curso, o São Francisco estende-se por superfícies de altitude variável (entre 400 e 1000m) sendo caracterizado como um típico rio de planalto, com algumas corredeiras, quedas e cascatas. A bacia é tradicionalmente dividida em três segmentos: superior, médio e inferior. O vale superior compreende da nascente até a corredeira de Pirapora, numa extensão de 630 km; o médio, com km, estende-se da corredeira de Pirapora até a cachoeira de Paulo Afonso (onde se encontra o complexo hidrelétrico de Paulo Afonso) e, finalmente, o trecho mais curto com 274 Km o baixo, que se estende de Paulo Afonso até a foz (PAIVA, 1982). O alto curso é caracterizado por águas rápidas, frias e oxigenadas; o médio por ser rio de planalto, com menor velocidade e sujeito a grandes cheias; o submédio está praticamente barrado e o baixo, por ser trecho de planície, é mais lento e encontra-se sob influência marinha (SATO & GODINHO, 1999). Excluídas as espécies diádromas (aquelas que migram entre o mar e a água doce), são registradas cerca de 158 espécies de peixes de diversas famílias, sendo muitas delas caracterizadas pelo endemismo (BRITSKI et al. 1988; SATO & GODINHO, 1999), mas novas espécies tem sido descritas com freqüência. PAIVA (1983) sugere que, com relação à distribuição de peixes pelo rio São Francisco, devem ser levadas em consideração algumas características: 1) o São Francisco é um rio perene e que cruza o Brasil de oeste para leste; 2) na região do vale superior, as águas são torrenciais, frias e com pouco material em suspensão; 3) no vale
24 9 médio, as águas possuem pequena velocidade, com temperaturas mais elevadas e com um pouco mais de material orgânico em suspensão; 4) no vale inferior, nas proximidades do estuário, as lagoas marginais são verdadeiros criadouros de peixes, com água sedimentada, rica em nutrientes. Grande parte da fauna de peixes do São Francisco concentra-se em seus afluentes permanentes e de água com pouco material em suspensão, sendo que são nas lagoas marginais que muitas espécies desovam, principalmente durante a piracema. A época predominante de reprodução tem início em outubro, antecedendo os meses mais chuvosos, com a chegada dos quais tem início a piracema (PAIVA, 1983).
25 Figura 01 Bacia do rio São Francisco. 10
26 11 1.5) Rio Piumhi A cabeceira do rio Piumhi está localizada entre os municípios de Vargem Bonita e Piumhi, no centro oeste do estado de Minas Gerais, Brasil a aproximadamente 930 metros de altitude (MOREIRA-FILHO & BUCKUP, 2005). Segundo as folhas cartográficas de Vargem Bonita, rio Piumhi, Piumhi e Capitólio (escala 1:50.000), os principais afluentes do rio Piumhi, à margem direita, são córregos da Jorça, da Confusão e da Estiva, ribeirão dos Pavões, córregos dos Bois, da Onça, do Servo, Campão Grande, do Fumo, Mutuca, Penedo, ribeirão da Cachoeira e córregos Àgua Limpa, dos Soares e Araujo. Os afluentes da margem esquerda são córregos do Destêrro, das Almas, ribeirão dos Almeidas, córrego Capão da Olaria, ribeirão das Minhocas e os córregos Pari Velho e Engenho da Serra. Ressalta-se que até o inicio dos anos 60 os córregos da Onça, Mutuca, do Servo, Campão Grande, do Fumo e Capão da Olaria não desaguavam diretamente nas margens do rio Piumhi, mas sim no grande pantanal por onde percorria o rio Piumhi (Figura 02a) 1.6) Transposição do rio Piumhi Em julho de 1958 iniciou-se a construção da Usina Hidrelétrica de FURNAS, a qual está localizada no curso médio do rio Grande, no trecho denominado "Corredeiras das FURNAS", entre os municípios de São José da Barra e São João Batista da Glória, no estado de Minas Gerais. O reservatório, um dos maiores do Brasil, com altura máxima de 127m, km 2 e km de perímetro, banha 34 municípios de Minas Gerais e é alimentado pelos rios Grande e Sapucaí. Após o fechamento das comportas dessa hidrelétrica as águas da bacia do rio Grande escoariam até a bacia do rio São Francisco alagando o município de
27 12 Capitólio. Esse problema foi contornado pela construção de um dique (dique de Capitólio) nessa cidade. Entretanto, o dique represou também o rio Piumhi. Aproveitando a topografia da região do pantanal (por onde corria o leito do rio Piumhi, suas lagoas marginais e seus 22 afluentes) foi efetuado um sistema de drenagem, com a construção de aproximadamente 18 km de canais, alterando o curso do rio Piumhi, o qual foi desviado para o leito do córrego Água Limpa, que deságua no ribeirão Sujo, um dos afluentes da margem direita do rio São Francisco. Para efetuar o desvio, foi necessário alterar o leito do córrego Água Limpa, que foi totalmente dragado e alargado para receber todo o volume de águas vindas do rio Piumhi, de seus afluentes e da drenagem do pântano. O mesmo procedimento teve de ser feito em parte do leito do ribeirão Sujo (Figura 02b). Assim, a transposição do rio Piumhi, da bacia do rio Grande para a bacia do rio São Francisco, acarretou diversas alterações ambientais, tais como (a) a formação de um conjunto de lagos no antigo leito do rio Piumhi, na região do município de Capitólio, (b) a construção de canais, por onde corre atualmente o rio Piumhi, (c) a drenagem do pântano e, finalmente, (d) a alteração dos leitos dos córregos e ribeirões. Além dos impactos comumente associados à implantação das grandes represas, a construção de FURNAS trouxe outro problema ainda pouco conhecido, a transposição de fauna (MOREIRA-FILHO & BUCKUP, 2005). Inevitavelmente, a transposição de águas colocou em contato peixes de distintas bacias hidrográficas, que estavam separados há milhões de anos. Assim, toda a ictiofauna do rio Piumhi (bacia rio Grande), que representava uma parcela da ictiofauna do sistema hídrico do Alto Paraná, foi transposta para a bacia do rio São Francisco.
28 13 Dentre todos os impactos ambientais ocasionados pela transposição do rio Piumhi para a bacia do rio São Francisco, a mistura das duas ictiofaunas, sem dúvida alguma, é o que mais chama a atenção dos ictiologistas. Entretanto, o contato dessas duas importantes bacias passou despercebido por mais de 40 anos pela comunidade científica (MOREIRA-FILHO & BUCKUP, 2005).
29 Figura 02 Em a): Rio Piumhi antes da construção da Represa da Usina Hidroelétrica de Furnas. O ribeirão da Água Limpa está indicado pelo número 1. Em b): Transposição das águas do rio Piumhi: (1) canal de transposição, (2), (3) lago artificial formado pela drenagem do baixo Piumhi após a construção do dique de Capitólio, (4) dique de Capitólio, (5) lago de furnas, (6) Represa de Furnas no rio Grande. (Fonte: MOREIRA-FILHO & BUCKUP, 2005) 14
30 15 2) OBJETIVOS a) Com o intuito de contribuir para a compreensão da evolução cariotípica da família Loricariidae, propôs-se neste trabalho caracterizar citogeneticamente, através das ferramentas convencionais e moleculares, algumas espécies desta família que ocorrem na região de cabeceira da bacia do rio São Francisco. b) Testar a citogenética como uma ferramenta na identificação de espécies invasoras na bacia do São Francisco devido à transposição do rio Piumhi para o rio São Francisco.
31 16 3) MATERIAL E MÉTODOS 3.1) Material e Locais de Coleta Foram analisados exemplares de quatro espécies de Loricariidae pertencentes a cinco populações distribuídas por riachos da cabeceira do rio São Francisco na região dos municípios de Piumhi e Pimenta MG (Figura 03). Foram analisados oito exemplares machos e oito exemplares fêmeas de Hypostomus regani coletados na foz do rio Piumhi no rio São Francisco (Figura 03), quatro exemplares machos, seis exemplares fêmeas e um exemplar de sexo não definido de Rineloricaria cf. latirostris coletados na foz do rio Piumhi no rio São Francisco (Figura 03), onze exemplares machos, quinze exemplares fêmeas e um exemplar cujo sexo não foi identificado de Hypostomus sp.1a coletados no ribeirão dos Patos (Figura 03), trinta e quatro exemplares machos e vinte e seis exemplares fêmeas de Hypostomus sp.1b coletados no ribeirão das Araras (Figura 03) e dezessete exemplares machos e dez exemplares fêmeas de Hypostomus sp.2 coletados no ribeirão das Araras (Figura 03). A Autorização de Coleta número foi concedida pelo IBAMA e a Licença de Pesca número 091/07 foi concedida pelo Instituto Estadual de Floresta de Minas Gerais.
32 Figura 03 Local de coleta dos espécimes analisados. Quadrado Azul = Hypostomus regani, Estrela Laranja = Rineloricaria cf. latirostris, Círculo Amarelo = Hypostomus sp.1a, Círculo Verde = Hypostomus sp.1b e Triângulo Vermelho = Hypostomus sp.2. (Fonte: MOREIRA-FILHO & BUCKUP, 2005 modificado por Wellington Adriano Moreira Peres) 17
33 18 3.2) Metodologia Os espécimens analisados foram coletados com tarrafas e transportados vivos para o Laboratório de Citogenética de Universidade Federal de São Carlos, onde foram mantidos em aquários até o processamento para obtenção das suspensões celulares e análise dos materiais ) Indução de Metáfases Para uma boa análise cromossômica, faz-se necessária a obtenção mais consistente de cromossomos metafásicos, tanto em qualidade como em quantidade. Uma vez que para a obtenção de cromossomos necessita-se de células em divisão, o primeiro passo em um estudo citogenético é observar locais (tecidos, órgãos) no organismo onde atividades de divisão celular estejam ocorrendo, quer seja de forma natural quer sobre determinados estímulos. Em peixes, o órgão utilizado para obtenção destas células é o rim que também possui função hematopoiética, ou seja, produzir células de defesa do organismo. Visando aumentar o índice mitótico nos animais a serem preparados foi utilizada a técnica descrita por LEE & ELDER (1980: 1. Injetar intraperitonialmente suspensão de levedura (0,5g de fermento biológico + 1,5g de dextrose + 6mL H 2 O) na proporção de 1mL/100g de peso animal. Transcorridas 48 horas processa-se o material para a preparação de cromossomos mitóticos.
34 ) Obtenção dos Cromossomos Mitóticos Os cromossomos mitóticos foram obtidos de células do rim dos animais, por meio da técnica de preparação cromossômica segundo FORESTI et al. (1993) com algumas adaptações. 1. Anestesiar o exemplar em solução de benzocaína 0,01% e sacrificar o animal em seguida; 2. Retirar uma porção do rim anterior, colocar em solução de Hanks, dissociar e incubar durante 25 minutos com 1-2 gotas de colchicina 0,025%; 3. Centrifugar a 900 rpm por 10 minutos. Descartar o sobrenadante com o auxílio de uma pipeta pasteur e acrescentar 10mL de solução hipotônica de KCl 0,075mol/L; 4. Incubar a solução celular por 25 minutos em estufa a 37 C; 5. Adicionar seis gotas de fixador Carnoy I (3 partes de metanol para 1 parte de ácido acético glacial), homogeneizar o material e centrifugar por 10 minutos a 900 rpm; 6. Descartar o sobrenadante. Adicionar cerca de 10mL de fixador, re-suspender o material. Centrifugar por 10 minutos a 900 rpm; 7. Repetir o passo 6 por mais duas vezes; 8. Adicionar de 0,5 a 1mL de fixador, homogeneizar e acondicionar o material em frascos do tipo Ependorff. Nesta etapa o material pode ser armazenado em freezer a -20 C. Alternativamente, utilizou-se a técnica descrita por BERTOLLO et al. (1978): 1. Injetar intraperitonialmente colchicina 0,025% na proporção de 1mL para cada
35 20 100g do animal; 2. Após 30 minutos sacrificar o animal, retirar o rim e dissociar em solução hipotônica de KCl 0,075mol/L; 3. Incubar a solução celular por 25 minutos em estufa a 37 C; 4. Proceder a fixação conforme o protocolo anterior, a partir do passo ) Análise Cromossômica Foram colocadas de duas a três gotas da suspensão celular sobre uma lâmina de vidro coberta por uma lâmina d água a 50ºC. A lâmina foi corada com Giemsa 5% em tampão fosfato (ph= 6,8) por 10 minutos ) Detecção das Regiões Heterocromáticas A identificação das regiões de heterocromatina constitutiva foi feita através da técnica de obtenção de bandas C, descrita por SUMNER (1972), com algumas adaptações. 1. Tratar uma lâmina contendo a suspensão celular com HCl 0,2 N à temperatura ambiente durante 9 minutos; 2. Lavar a lâmina em água corrente e deixar secar ao ar. 3. Colocar a lâmina em solução aquosa de hidróxido de bário (Ba(OH) 2 8H 2 O) 5%, recém-preparada e filtrada, a 28 o C, durante 1 a 2 minutos; 4. Para interromper a ação da solução de hidróxido de bário, submergir rapidamente a lâmina em solução de HCl 0,2 N, lavar em água corrente e deixar secar ao ar.
36 21 5. Colocar a lâmina em solução salina 2xSSC a 60 o C durante 20 minutos; 6. Lavar a lâmina em água corrente e secar ao ar. 7. Corar com solução de Giemsa diluída a 2% em tampão fosfato (ph=6,8), durante 8 minutos ) Detecção das Regiões Organizadoras de Nucléolo (Ag-RONs) A identificação das Regiões Organizadoras de Nucléolo seguiu a técnica de impregnação pelo nitrato de prata descrita por HOWELL & BLACK (1980), com algumas adaptações. 1. Colocar sobre uma lâmina contendo as preparações cromossômicas 3 gotas de solução aquosa de gelatina a 2% (acrescida de ácido fórmico na proporção de 1 ml para cada 100 ml de solução); 2. Adicionar 6 gotas de solução aquosa de nitrato de prata a 50%. Misturar bem e cobrir com lamínula; 3. Incubar em estufa a 60 C o tempo necessário para que os cromossomos e núcleos assumam uma coloração amarelada e os nucléolos e as RONs uma coloração marrom escura ou preta. Este tempo varia de 2 a 3 minutos; 4. Retirar a lamínula com um jato de água destilada, lavar bem e deixar secar ao ar ) Hibridação Fluorescente in situ A localização dos sítios de rdna 18S e 5S nos cromossomos foram mapeadas usando hibridação fluorescente in situ (FISH) de acordo com PINKEL et al. (1986), com sondas obtidas de Prochilodus lineatus (Teleostei, Prochilodontidae)
37 22 obtidas por HATANAKA & GALETTI JR. (2004) e de Leporinus elongatus (Teleostei, Anostomidae) obtidas por MARTINS & GALETTI JR. (2001), respectivamente. Marcação da Sonda As sondas foram marcadas com biotina através da reação de Nick Translation com o kit Bionick TM Labeling System da Invitrogem, seguindo-se as instruções do fabricante. A solução de hibridação consistiu de 200µL de formamida (50% de formamida), 80µL de Sulfato de Dextrano a 50% (concentração final de 10%), 40µL de 20xSSC (concentração final 2xSSC) e 80µL de H 2 O q.s.p., à qual foram adicionados 1,5µg de sonda (DNA marcado com biotina). A solução de hibridação foi submetida a um banho fervente, por 10 minutos, e imediatamente transferida par um recipiente com gelo, impedindo a renaturação por choque térmico. Preparação das Lâminas As lâminas contendo as preparações cromossômicas foram lavadas em PBS por 5 minutos em temperatura ambiente. Desidratadas em série alcoólica de etanol a 70%, 85% e 100%, 5 minutos cada banho. As lâminas foram tratadas em solução de RNAse (100µg/mL) por 1 hora em câmara úmida, a 37 C. Foram lavadas duas vezes em solução salina de 2XSSC por 10minutos cada e em solução PBS por 5 minutos. Seguiu-se fixação em formaldeído 1% / PBS 1x / MgCl 2 50mM por 10 minutos em temperatura ambiente. Lavagem em PBS 1x por 5 minutos e desidratação em
38 23 serie de etanol 70%, 85% e 100%, 5 minutos cada. As lâminas foram então tratadas em formamida 70%, diluída em 2xSSC a 70 C por 5 minutos e desidratas novamente em série alcoólica de etanol 70%, 85% e 100% por 5 minutos cada banho. Hibridação e Detecção dos Sinais Foram aplicados sobre as lâminas cerca de 50µL de solução de hibridação contendo solução de formamida 60% em 2xSSC ph 7,0. As lâminas foram incubadas em câmara úmida a 37 C, overnight. As lâminas foram lavadas em solução de formamida 50% em 2xSSC ph 7,0 por 20 minutos a 42 C e, em seguida, lavadas em 0,1xSSC a 60 C por 15 minutos. Logo a seguir foram lavadas em Tween 20, por e minutos, seguido de incubação em tampão NFDM a 5% por 15 minutos. Para a detecção das ondas marcadas com biotina foram colocadas sobre as lâminas 90µL de avidina-fitc (Fluoresceina Isotil Cianato-avidina conjugada) a 0,25µg/µL, permanecendo por 30 minutos a 37 C, em câmara úmida. As Lâminas foram lavadas 3 vezes em Tween 20, cinco minutos cada. O sinal de hibridação foi intensificado colocando-se cerca de 90µL de anti-avidina biotina-conjugada sobre as lâminas, por 30 minutos, seguindo-se 3 lavagens com solução de Tween 20, 5 minutos cada. Este ciclo foi repetido por mais uma vez e complementado novamente pelo tratamento com avidina-fitc e posterior lavagem com Tween 20. Seguiu-se desidratação em série de etanol a 70%, 85% e 100% à temperatura ambiente, 5 minutos em cada banho. Os cromossomos foram então corados com DAPI + antifade (0,2 µg/ml).
39 ) Análises Cariotípicas As preparações cromossômicas convencionais foram analisadas em microscópio de campo claro, estabelecendo-se o número diplóide modal presente em cada espécie/população amostrada no presente trabalho. As melhores metáfases foram capturadas em um foto microscópio Olympus BX50, com a utilização do software CoolSNAP-pro, Image Pro Plus, 4,1 (Media Cybernetics). Os cromossomos foram classificados em metacêntricos (m), submetacêntricos (sm), subtelocêntricos (st) e acrocêntricos (a), de acordo com o tamanho e razão de braços, segundo proposta de LEVAN et al. (1964). A montagem dos cariótipos foi feita de acordo com o tamanho e morfologia dos cromossomos, os quais foram dispostos em ordem decrescente e em pares, em cada grupo cromossômico. Os pares foram numerados e os cromossomos homólogos tentativamente emparelhados, para facilidade de apresentação e comparação. O Número Fundamental (NF) foi calculado levando-se em consideração que os cromossomos metacêntricos, submetacêntricos e subtelocêntricos apresentam dois braços e os cromossomos acrocêntricos apenas um.
40 25 4) RESULTADOS 4.1) Hypostomus regani Todos os exemplares de Hypostomus regani analisados apresentaram 2n=72 cromossomos, com fórmula cariotípica composta de 4 pares de cromossomos metacêntricos, 8 submetacêntricos, 10 subtelocêntricos e 14 acrocêntricos (8m+16sm+20st+28a) e Número Fundamental (NF) = 116 (Figura 04a). A heterocromatina constitutiva encontra-se distribuída em pequenos blocos (Figura 04b). A região intersticial dos braços longos dos pares cromossômicos 15, 18 e 20 (subtelocêntricos) e 23, 25, 26, 27 e 33 (acrocêntricos) apresentaram blocos bem evidentes. O par cromossômico metacêntrico 1 mostra uma marcação mais pálida na região intersticial do braço curto. Os pares cromossômicos 13, 15 e 36 apresentam blocos heterocromáticos na região centromérica e o par cromossômico 31 apresenta a região telomérica do braço longo heterocromática. As regiões organizadoras de nucléolo marcadas pelo Nitrato de Prata foram evidentes apenas no braço curto do par cromossômico submetacêntrico 8 (Figura 04c). Todas as células analisadas apresentaram heteromorfismo em relação ao tamanho das Ag- RONs. A hibridação fluorescente in situ confirmou a presença de DNAr 18S coincidente com as Ag-RONs, bem como o heteromorfismo de tamanho dos sítios (Figura 05a). Os sítios de DNAr 5s foram localizados em cinco pares cromossômicos, sendo localizados na região terminal do braço curto de três pares acrocêntricos e na região centromérica de dois pares submetacêntricos (Figura 05b).
41 Figura 04 Cariótipo de Hypostomus regani corado com Giemsa em (a). (b) apresenta o padrão de distribuição da heterocromatina constitutiva evidenciada pelo bandamento C. A caixa (c) apresenta os cromossomos impregnados pelo Nitrato de Prata. 26
42 Figura 05 Cromossomos mitóticos de Hypostomus regani submetidos à hibridação fluorescente in situ com sondas de DNAr 18S (a) e 5S (b). Setas= sítios evidenciados pela técnica. Barra= 10µm. 27
43 28 4.2) Hypostomus sp.1a Dos exemplares de Hypostomus sp.1a coletados no Ribeirão dos Patos apenas três machos e uma fêmea não deram resultados. Os demais espécimens apresentaram 2n= 76 cromossomos distribuídos em seis cromossomos metacêntricos, oito submetacêntricos, dezesseis subtelocêntricos e quarenta e seis acrocêntricos (6m+8sm+16st+46a) e NF= 106 (Figura 06a). A heterocromatina constitutiva localizou-se na região centromérica do par cromossômico 13 e do par acrocêntrico 16, no telômero dos pares cromossômicos acrocêntricos 24, 25 e 27 e na região intersticial do braço longo do par cromossômico acrocêntrico 31 (Figura 06b). A RON foi observada no telômero do braço longo do par cromossômico subtelocêntrico 13 (Figura 06c). As marcações encontradas com as sondas de DNAr 18S utilizadas na hibridação fluorescente in situ coincidiram com as marcações encontradas com Nitrato de Prata (Figura 07a). A hibridação fluorescente in situ com sondas de DNAr 5S evidenciou dois pares cromossômicos marcados (Figura 07b). Um par de cromossomos acrocêntricos que apresentou a marcação na região centromérica e um par de cromossomos subtelocêntricos que também apresentou marcação na região centromérica.
44 Figura 06 Cariótipo de Hypostomus sp.1a. (a) coloração convencional; (b) bandamento C; (c) cromossomos portadores de Ag-RONs. 29
45 Figura 07 Hibridação fluorescente in situ evidenciando a localização de sítios de DNAr 18S (a) e 5S (b) em Hypostomus sp.1a. Setas= sítios evidenciados pela técnica. Barra= 10µm. 30
46 31 4.3) Hypostomus sp.1b Dos 60 exemplares de Hypostomus sp.1b coletados no Ribeirão das Araras, 51 deram resultados. O cariótipo desta população é constituído por 76 cromossomos, com fórmula cariotípica 6m+8sm+16st+46a e NF=106 (Figura 08a). O padrão de distribuição da heterocromatina constitutiva foi de poucos blocos heterocromáticos pálidos. Estes localizados na região telocêntrica de alguns cromossomos acrocêntricos, na região intersticial do braço longo do par cromossomômico subtelocêntrico número 9. O braço curto dos cromossomos submetacêntricos 4 apresentou-se totalmente heterocromático (Figura 08b). Foi observada uma constrição secundária na região terminal do braço longo do par cromossômico metacêntrico número 2, coincidindo com as marcações com Nitrato de Prata (Figura 08). A hibridação fluorescente in situ com sondas de DNAr 18S confirmou a localização do cístron ribossômico 18S na região telomérica do par cromossômico 2 (Figura 09a). A sonda de DNAr 5S apresentou 6 cromossomos marcados (Figura 09b). Estas marcações aparecem no centrômero de dois pares cromossômicos acrocêntricos e de um par cromossômico submetacêntrico.
47 Figura 08 Cariótipo de Hypostomus sp.1b corado com Giemsa em (a). (b) apresenta o padrão de distribuição da heterocromatina constitutiva evidenciada pelo bandamento C. A caixa (c) apresenta os cromossomos impregnados pelo Nitrato de Prata. 32
48 Figura 09 Cromossomos mitóticos de Hypostomus sp.1b submetidos à hibridação fluorescente in situ com sondas de DNAr 18S (a) e 5S (b). Setas= sítios evidenciados pela técnica. Barra= 10µm. 33
49 34 4.4) Hypostomus sp.2 Todos os espécimens da população de Hypostomus sp.2 do Ribeirão das Araras apresentaram 2n= 74 cromossomos, organizados em 10m+6sm+16st+42a e NF= 106 (Figura 10a). Não se observou diferença na constituição cromossômica entre machos e fêmeas. A heterocromatina constitutiva foi localizada na região centromérica dos cromossomos meta e submetacêntricos, e na região intersticial do braço longo de quase todos os cromossomos acrocêntricos. Os pares 23 e 30 apresentam blocos bem evidentes de heterocromatina (Figura 10b). Esta população apresentou a RON localizada na região telomérica do braço longo de um par de cromossomo submetacêntrico, sendo provavelmente o par 6 (Figura 10). O hibridação fluorescente in situ com sondas de DNAr 18S mostrou 4 cromossomos com marcações na região telomérica (Figura 11a). A sonda de DNAr 5S revelou 6 marcações, sendo duas na região telomérica dos cromossomos e uma na região centromérica (Figura 11b).
50 Figura 10 Cariótipo de Hypostomus sp.2. (a) coloração convencional; (b) bandamento C; (c) cromossomos portadores de Ag-RONs. 35
51 Figura 11 Hibridação fluorescente in situ evidenciando a localização de sítios de DNAr 18S (a) e 5S (b) em Hypostomus sp.2. Setas= sítios evidenciados pela técnica. Barra= 10µm. 36
52 37 4.5) Rineloricaria cf. latirostri Os espécimens de Rineloricaria cf. latirostris analisados apresentaram 2n=48 com fórmula cromossômica 14m/sm+34st/a e NF=62 (Figura 12a). O par cromossômico 6 apresentou uma constrição secundária em toda a extensão do braço curto. Dos onze espécimens examinados uma fêmea não apresentou resultados, nas análises comparativas entre os exemplares não foi observado polimorfismo cromossômico. A heterocromatina constitutiva encontra-se distribuída pela região centromérica de quase todos os cromossomos (Figura 12b). As RONs foram evidentes em apenas um par cromossômico, o número dez, coincidindo com a constrição secundária (Figura 12). A hibridação fluorescente in situ com sondas de DNAr 18S mostrou duas grandes marcações no braço curto de um cromossomo acrocêntrico, coincidente com as marcações com Nitrato de Prata e com a constrição secundária (Figura 13a). As sondas de DNAr 5r mostrou dois pares cromossômicos acrocêntricos marcados na região centromérica (Figura 13b).
53 Figura 12 Cariótipo de Rineloricaria cf. latirostris corado com Giemsa em (a). (b) apresenta o padrão de distribuição da heterocromatina constitutiva evidenciada pelo bandamento C. A caixa (c) apresenta os cromossomos impregnados pelo Nitrato de Prata. 38
54 Figura 13 Cromossomos mitóticos de Rineloricaria cf. latirostris submetidos à hibridação fluorescente in situ com sondas de DNAr 18S (a) e 5S (b). Setas= sítios evidenciados pela técnica. Barra= 10µm. 39
55 40 5) DISCUSSÃO 5.1) Diversidade Cromossômica na família Loricariidae Com 716 espécies e 96 gêneros a família Loricariidae é a segunda maior família entre os peixes, e provavelmente também uma das mais taxonomicamente complexa (ISBRÜCKER apud DE PINNA, 1998; FERRARIS, 2007). Sua morfologia altamente especializada faz dos loricariídeos um dos grupos de Siluriformes melhor caracterizados, reconhecidos como um táxon desde as primeiras classificações. As evidências para a monofilia dos Loricariidae são muito fortes, uma vez que este grupo possui muitas sinapomorfias morfológicas (DE PINNA, 1998). Entretanto, devido à complexidade da família, os taxonomistas encontram algumas dificuldades em agrupar as espécies em subfamílias. Os trabalhos mais recentes reconhecem seis subfamílias para este grupo (REIS et al., 2006), mas estudos posteriores podem reorganizar estas famílias, bem como excluir algumas ou descrever novas, como vem ocorrendo nos últimos anos (REIS et al., 2003; ARMBRUSTER, 2004). A família Loricariidae apresenta uma grande diversidade morfológica e muita divergência entre os taxonomistas, em relação a alguns grupos. Entretanto, algumas subfamílias são relativamente bem definidas. Uma revisão dos dados de citogenética disponíveis para as espécies da família Loricariidae foi realizada e resumida na Tabela 01. Através desta, é possível verificar que a alta diversidade encontrada em relação às características morfológicas também é encontrada em nível cromossômico, tanto no número diplóide como na estrutura cariotípica.
Hibridação in situ por fluorescência FISH
 Universidade Estadual de Londrina Departamento de Biologia Geral Laboratório de Citogenética Animal - LACA Hibridação in situ por fluorescência FISH O protocolo descrito a seguir foi baseado nos procedimentos
Universidade Estadual de Londrina Departamento de Biologia Geral Laboratório de Citogenética Animal - LACA Hibridação in situ por fluorescência FISH O protocolo descrito a seguir foi baseado nos procedimentos
Universidade Estadual de Maringá
 1 Universidade Estadual de Maringá Mini-Curso Citogenética de Peixes: do Clássico ao Molecular Prof: Ana Luiza de Brito Portela Castro Prof: Ana Camila Prizon Prof: Andréa Cius Prof: Isabelle Pereira Mari
1 Universidade Estadual de Maringá Mini-Curso Citogenética de Peixes: do Clássico ao Molecular Prof: Ana Luiza de Brito Portela Castro Prof: Ana Camila Prizon Prof: Andréa Cius Prof: Isabelle Pereira Mari
UEM Universidade Estadual de Maringá
 1 UEM Universidade Estadual de Maringá MINI-CURSO INTRODUÇÃO A CITOGENÉTICA DE PEIXES Prof. Dra Ana Luiza de Brito Portela Castro Mestranda Ana Camila Prizon Mestranda Andréa Cius Doutorando Lucas Baumgärtner
1 UEM Universidade Estadual de Maringá MINI-CURSO INTRODUÇÃO A CITOGENÉTICA DE PEIXES Prof. Dra Ana Luiza de Brito Portela Castro Mestranda Ana Camila Prizon Mestranda Andréa Cius Doutorando Lucas Baumgärtner
ANÁLISE CROMOSSÔMICA EM HOPLIAS MALABARICUS (CHARACIFORMES, ERYTHRINIDAE) NO RIO SARANDI, EM REALEZA PARANÁ. BOROWSKI PIETRICOSKI 2
 ANÁLISE CROMOSSÔMICA EM HOPLIAS MALABARICUS (CHARACIFORMES, ERYTHRINIDAE) NO RIO SARANDI, EM REALEZA PARANÁ. DIANA PAULA PERIN 1*, ALIFER PALHANO¹, SANDIELI BIANCHIN¹, LUCIANA BOROWSKI PIETRICOSKI 2 1
ANÁLISE CROMOSSÔMICA EM HOPLIAS MALABARICUS (CHARACIFORMES, ERYTHRINIDAE) NO RIO SARANDI, EM REALEZA PARANÁ. DIANA PAULA PERIN 1*, ALIFER PALHANO¹, SANDIELI BIANCHIN¹, LUCIANA BOROWSKI PIETRICOSKI 2 1
ESTUDO CITOGENÉTICO E DE POLIMORFISMO CROMOSSÔMICO EM POPULAÇÕES DO GÊNERO Rineloricaria (LORICARIIDAE, SILURIFORMES) DA BACIA DO RIO PARANÁ.
 FERNANDA ERRERO PORTO ESTUDO CITOGENÉTICO E DE POLIMORFISMO CROMOSSÔMICO EM POPULAÇÕES DO GÊNERO Rineloricaria (LORICARIIDAE, SILURIFORMES) DA BACIA DO RIO PARANÁ. Dissertação apresentada ao Curso de Pós-graduação
FERNANDA ERRERO PORTO ESTUDO CITOGENÉTICO E DE POLIMORFISMO CROMOSSÔMICO EM POPULAÇÕES DO GÊNERO Rineloricaria (LORICARIIDAE, SILURIFORMES) DA BACIA DO RIO PARANÁ. Dissertação apresentada ao Curso de Pós-graduação
ESTUDOS CITOGENÉTICOS EM ALGUMAS ESPÉCIES DE PEIXES DA FAMÍLIA LORICARIIDAE PERTENCENTES À BACIA DO RIO PIRACICABA
 UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA E EVOLUÇÃO ESTUDOS CITOGENÉTICOS EM ALGUMAS ESPÉCIES DE PEIXES DA FAMÍLIA LORICARIIDAE
UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA E EVOLUÇÃO ESTUDOS CITOGENÉTICOS EM ALGUMAS ESPÉCIES DE PEIXES DA FAMÍLIA LORICARIIDAE
CARACTERIZAÇÃO CITOGENÉTICA DE Otocinclus vittatus (LORICARIIDAE, HYPOPTOPOMATINAE) DO CÓRREGO DO ONÇA, AFLUENTE DO TAQUARI, MUNICÍPIO DE COXIM, MS
 CARACTERIZAÇÃO CITOGENÉTICA DE Otocinclus vittatus (LORICARIIDAE, HYPOPTOPOMATINAE) DO CÓRREGO DO ONÇA, AFLUENTE DO TAQUARI, MUNICÍPIO DE COXIM, MS Josimar Lara da Silva 1 ; Drª. Margarida Maria de Rossi
CARACTERIZAÇÃO CITOGENÉTICA DE Otocinclus vittatus (LORICARIIDAE, HYPOPTOPOMATINAE) DO CÓRREGO DO ONÇA, AFLUENTE DO TAQUARI, MUNICÍPIO DE COXIM, MS Josimar Lara da Silva 1 ; Drª. Margarida Maria de Rossi
DINAÍZA ABADIA ROCHA REIS. ESTUDOS CITOGENÉTICO-MOLECULARES EM ESPÉCIES DO GÊNERO Hypostomus (TELEOSTEI, LORICARIIDAE)
 DINAÍZA ABADIA ROCHA REIS ESTUDOS CITOGENÉTICO-MOLECULARES EM ESPÉCIES DO GÊNERO Hypostomus (TELEOSTEI, LORICARIIDAE) Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências
DINAÍZA ABADIA ROCHA REIS ESTUDOS CITOGENÉTICO-MOLECULARES EM ESPÉCIES DO GÊNERO Hypostomus (TELEOSTEI, LORICARIIDAE) Dissertação apresentada à Universidade Federal de Viçosa, como parte das exigências
UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO INSTITUTO DE BIOCIÊNCIAS RIO CLARO
 unesp UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO INSTITUTO DE BIOCIÊNCIAS RIO CLARO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS (BIOLOGIA CELULAR E MOLECULAR) Estudo da evolução cariotípica
unesp UNIVERSIDADE ESTADUAL PAULISTA JÚLIO DE MESQUITA FILHO INSTITUTO DE BIOCIÊNCIAS RIO CLARO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS (BIOLOGIA CELULAR E MOLECULAR) Estudo da evolução cariotípica
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata)
 Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ
 INSTITUTO DE TECNOLOGIA PARA O DESENVOLVIMENTO Centro de Hidráulica e Hidrologia Prof. Parigot de Souza RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ RELATÓRIO TÉCNICO Nº 39 2012 COORDENAÇÃO
INSTITUTO DE TECNOLOGIA PARA O DESENVOLVIMENTO Centro de Hidráulica e Hidrologia Prof. Parigot de Souza RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ RELATÓRIO TÉCNICO Nº 39 2012 COORDENAÇÃO
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata)
 Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇAO EM GENÉTICA EVOLUTIVA E BIOLOGIA MOLECULAR
 i e l r b l a n c o l UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇAO EM GENÉTICA EVOLUTIVA E BIOLOGIA MOLECULAR Estudos citogenéticos clássicos e
i e l r b l a n c o l UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇAO EM GENÉTICA EVOLUTIVA E BIOLOGIA MOLECULAR Estudos citogenéticos clássicos e
UM TERCEIRO CITÓTIPO DE Astyanax aff. fasciatus (TELEOSTEI, CHARACIDAE) DA BACIA DO RIO SÃO FRANCISCO
 ISSN 2236-3866 DOI: 10.7902/ecb.v4i1.42 Acesso livre em www.simposiodabiodiversidade.com.br/ecb 1 UM TERCEIRO CITÓTIPO DE Astyanax aff. fasciatus (TELEOSTEI, CHARACIDAE) DA BACIA DO RIO SÃO FRANCISCO A
ISSN 2236-3866 DOI: 10.7902/ecb.v4i1.42 Acesso livre em www.simposiodabiodiversidade.com.br/ecb 1 UM TERCEIRO CITÓTIPO DE Astyanax aff. fasciatus (TELEOSTEI, CHARACIDAE) DA BACIA DO RIO SÃO FRANCISCO A
OCORRÊNCIA DE CROMOSSOMO B HETEROCROMÁTICO EM LAMBARIS DA BACIA DO SÃO FRANCISCO MINAS GERAIS
 OCORRÊNCIA DE CROMOSSOMO B HETEROCROMÁTICO EM LAMBARIS DA BACIA DO SÃO FRANCISCO MINAS GERAIS OCURRENCE OF HETEROCROMATIC B CROMOSOME IN TETRA FISH FROM SÃO FRANCISCO BASIN MINAS GERAIS Resumo Matheus
OCORRÊNCIA DE CROMOSSOMO B HETEROCROMÁTICO EM LAMBARIS DA BACIA DO SÃO FRANCISCO MINAS GERAIS OCURRENCE OF HETEROCROMATIC B CROMOSOME IN TETRA FISH FROM SÃO FRANCISCO BASIN MINAS GERAIS Resumo Matheus
RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ
 INSTITUTO DE TECNOLOGIA PARA O DESENVOLVIMENTO Centro de Hidráulica e Hidrologia Prof. Parigot de Souza RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ RELATÓRIO TÉCNICO Nº 39 2012 COORDENAÇÃO
INSTITUTO DE TECNOLOGIA PARA O DESENVOLVIMENTO Centro de Hidráulica e Hidrologia Prof. Parigot de Souza RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ RELATÓRIO TÉCNICO Nº 39 2012 COORDENAÇÃO
ISSN Evolução e Conservação da Biodiversidade e autores Acesso livre em
 ISSN 2236-3866 2012 Evolução e Conservação da Biodiversidade e autores Acesso livre em www.simposiodabiodiversidade.com.br/ecb 39 LOCALIZAÇÃO FÍSICA DOS GENES RIBOSSOMAIS 5S E 18S EM Ancistrus sp. (LORICARIIDAE:
ISSN 2236-3866 2012 Evolução e Conservação da Biodiversidade e autores Acesso livre em www.simposiodabiodiversidade.com.br/ecb 39 LOCALIZAÇÃO FÍSICA DOS GENES RIBOSSOMAIS 5S E 18S EM Ancistrus sp. (LORICARIIDAE:
AULA PRÁTICA SOBRE CARIÓTIPO - Pg 1
 AULA PRÁTICA SOBRE CARIÓTIPO - Pg 1 Cada célula humana possui 46 cromossomos, que são iguais dois a dois, existindo na verdade 23 pares de cromossomos. Destes 23 pares, 22 são chamados de cromossomos autossômicos
AULA PRÁTICA SOBRE CARIÓTIPO - Pg 1 Cada célula humana possui 46 cromossomos, que são iguais dois a dois, existindo na verdade 23 pares de cromossomos. Destes 23 pares, 22 são chamados de cromossomos autossômicos
CARACTERIZAÇÃO CITOGENÉTICA EM Poptella paraguayensis (CHARACIDAE, STETHAPRIONINAE) DO CÓRREGO DO ONÇA, AFLUENTE DO TAQUARI, MUNICÍPIO DE COXIM, MS
 CARACTERIZAÇÃO CITOGENÉTICA EM Poptella paraguayensis (CHARACIDAE, STETHAPRIONINAE) DO CÓRREGO DO ONÇA, AFLUENTE DO TAQUARI, MUNICÍPIO DE COXIM, MS Greicy Ellen de Brito Ferreira 1 ; Elis Aparecida Morita
CARACTERIZAÇÃO CITOGENÉTICA EM Poptella paraguayensis (CHARACIDAE, STETHAPRIONINAE) DO CÓRREGO DO ONÇA, AFLUENTE DO TAQUARI, MUNICÍPIO DE COXIM, MS Greicy Ellen de Brito Ferreira 1 ; Elis Aparecida Morita
Citótipos diferentes de Tetragonopterus argenteus... MIYAZAWA, C. S.
 17 (1) Docente da Universidade Federal do ABC (UFABC), CCNH; e-mail: carlosmiya@uol.com.br, carlos.miyazawa@ufabc.edu.br Resumo. No presente trabalho, foram estudados os cromossomos metafásicos de caracídeos
17 (1) Docente da Universidade Federal do ABC (UFABC), CCNH; e-mail: carlosmiya@uol.com.br, carlos.miyazawa@ufabc.edu.br Resumo. No presente trabalho, foram estudados os cromossomos metafásicos de caracídeos
Características da hidrografia brasileira
 Características da hidrografia brasileira Todos rios direta ou indiretamente são tributários do Oceano Atlântico. Predomínio de foz em estuário. Domínio de rios de planalto. Regime pluvial tropical austral
Características da hidrografia brasileira Todos rios direta ou indiretamente são tributários do Oceano Atlântico. Predomínio de foz em estuário. Domínio de rios de planalto. Regime pluvial tropical austral
Washington Candeia Araújo 1 e Wagner Franco Molina 2
 BIOTA AMAZÔNIA ARTIGO Citótipo exclusivo para Parauchenipterus galeatus (Siluriformes, Auchenipteridae) na Bacia do Atlântico NE Oriental do Brasil: Indicações de um complexo de espécies. Washington Candeia
BIOTA AMAZÔNIA ARTIGO Citótipo exclusivo para Parauchenipterus galeatus (Siluriformes, Auchenipteridae) na Bacia do Atlântico NE Oriental do Brasil: Indicações de um complexo de espécies. Washington Candeia
CARACTERIZAÇÃO CITOGENÉTICA DE PEIXES DO PARQUE ESTADUAL
 1 CARACTERIZAÇÃO CITOGENÉTICA DE PEIXES DO PARQUE ESTADUAL Introdução MATA SÃO FRANCISCO Lenice Souza-Shibatta 1 Tamyres R. Chaves Fernanda C. Simeão Jaqueline L. A. Souza Aderson S. Lima-Filho João L.
1 CARACTERIZAÇÃO CITOGENÉTICA DE PEIXES DO PARQUE ESTADUAL Introdução MATA SÃO FRANCISCO Lenice Souza-Shibatta 1 Tamyres R. Chaves Fernanda C. Simeão Jaqueline L. A. Souza Aderson S. Lima-Filho João L.
Citogenética Clássica e Molecularem Passifloras:
 Citogenética Clássica e Molecularem Passifloras: M arta Dias Soares-Scott Laura Maria Molina Meletti Luís Carlos Bernacci Ilene Ribeiro da Silva Passos 1 Citogenética -É a ciência que estuda os constituintes
Citogenética Clássica e Molecularem Passifloras: M arta Dias Soares-Scott Laura Maria Molina Meletti Luís Carlos Bernacci Ilene Ribeiro da Silva Passos 1 Citogenética -É a ciência que estuda os constituintes
Título do Projeto de Pesquisa: Estudos citogenéticos em amostras da espécie Apteronotus bonapartii coletadas em rios da região amazônica
 UNIVERSIDADE FEDERAL DO PARÁ PRÓ-REITORIA DE PESQUISA E PÓS-GRADUAÇÃO DIRETORIA DE PESQUISA PROGRAMA INSTITUCIONAL DE BOLSAS DE INICIAÇÃO CIENTÍFICA Relatório Técnico - Científico Período: 08/2014 07/2015
UNIVERSIDADE FEDERAL DO PARÁ PRÓ-REITORIA DE PESQUISA E PÓS-GRADUAÇÃO DIRETORIA DE PESQUISA PROGRAMA INSTITUCIONAL DE BOLSAS DE INICIAÇÃO CIENTÍFICA Relatório Técnico - Científico Período: 08/2014 07/2015
Luiz Ricardo de Souza Paiva
 UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE BIOCIÊNCIAS Luiz Ricardo de Souza Paiva CITOGENÉTICA DE POPULAÇÕES DE Serrapinnus notomelas (CHARACIDAE: CHEIRODONTINAE) DA BACIA DO RIO TIETÊ MESTRADO Botucatu-SP
UNIVERSIDADE ESTADUAL PAULISTA INSTITUTO DE BIOCIÊNCIAS Luiz Ricardo de Souza Paiva CITOGENÉTICA DE POPULAÇÕES DE Serrapinnus notomelas (CHARACIDAE: CHEIRODONTINAE) DA BACIA DO RIO TIETÊ MESTRADO Botucatu-SP
CARACTERIZAÇÃO CARIOTÍPICA DA POPULAÇÃO DE Astyanax altiparanae DO CÓRREGO DOS CAETANOS, UBERLÂNDIA-MG.
 PIBIC-UFU, CNPq & FAPEMIG Universidade Federal de Uberlândia Pró-Reitoria de Pesquisa e Pós-Graduação DIRETORIA DE PESQUISA CARACTERIZAÇÃO CARIOTÍPICA DA POPULAÇÃO DE Astyanax altiparanae DO CÓRREGO DOS
PIBIC-UFU, CNPq & FAPEMIG Universidade Federal de Uberlândia Pró-Reitoria de Pesquisa e Pós-Graduação DIRETORIA DE PESQUISA CARACTERIZAÇÃO CARIOTÍPICA DA POPULAÇÃO DE Astyanax altiparanae DO CÓRREGO DOS
Núcleo celular: O centro de comando. Unidade 4 Pág 34
 Núcleo celular: O centro de comando. Unidade 4 Pág 34 NÚCLEO O núcleo é o centro de coordenação das atividades da célula. Em geral há um núcleo por célula; células sem núcleo são apenas uma fase da vida;
Núcleo celular: O centro de comando. Unidade 4 Pág 34 NÚCLEO O núcleo é o centro de coordenação das atividades da célula. Em geral há um núcleo por célula; células sem núcleo são apenas uma fase da vida;
BIO Genética e Evolução Ciencias Biomedicas. Atividade 6 Montagem de cariótipos
 Instituto de biociências BIO0230 - Genética e Evolução Ciencias Biomedicas Atividade 6 Montagem de cariótipos Introdução O número total de células em um humano adulto médio é algo em torno de 100 trilhões,
Instituto de biociências BIO0230 - Genética e Evolução Ciencias Biomedicas Atividade 6 Montagem de cariótipos Introdução O número total de células em um humano adulto médio é algo em torno de 100 trilhões,
BIOLOGIA - 3 o ANO MÓDULO 35 NÚCLEO E DIVISÃO CELULAR: MITOSE
 BIOLOGIA - 3 o ANO MÓDULO 35 NÚCLEO E DIVISÃO CELULAR: MITOSE eucromatina heterocromatina 1 cromossomo duplicado 1 cromossomo simples 2 cromátides 2 cromossomos simples Metacêntrico Centrômero localizado
BIOLOGIA - 3 o ANO MÓDULO 35 NÚCLEO E DIVISÃO CELULAR: MITOSE eucromatina heterocromatina 1 cromossomo duplicado 1 cromossomo simples 2 cromátides 2 cromossomos simples Metacêntrico Centrômero localizado
Relatório Parcial sobre os primeiros trabalhos de campo realizado no Parque Nacional do Caparaó
 Relatório Parcial sobre os primeiros trabalhos de campo realizado no Parque Nacional do Caparaó Organização: Luisa Maria Sarmento Soares e Ronaldo Fernando Martins Pinheiro Museu de Biologia Prof. Mello
Relatório Parcial sobre os primeiros trabalhos de campo realizado no Parque Nacional do Caparaó Organização: Luisa Maria Sarmento Soares e Ronaldo Fernando Martins Pinheiro Museu de Biologia Prof. Mello
First cytogenetic record for a species of Otothyropsis Ribeiro, Carvalho & Melo, 2005 (Loricariidae, Hypoptopomatinae)
 Journal homepage: www.scielo.br/ni DOI: 10.1590/1982-0224-20150123 Published online: 14 April 2016 (ISSN 1982-0224) First cytogenetic record for a species of Otothyropsis Ribeiro, Carvalho & Melo, 2005
Journal homepage: www.scielo.br/ni DOI: 10.1590/1982-0224-20150123 Published online: 14 April 2016 (ISSN 1982-0224) First cytogenetic record for a species of Otothyropsis Ribeiro, Carvalho & Melo, 2005
Nucléolo, cromatina e cromossomos
 Nucléolo, cromatina e cromossomos NUCLÉOLO Tem aspecto de grânulo, mas não é limitado por membrana. É o centro de produção de ribossomos. O DNA origina os RNAr que são conjugados com proteínas vindas
Nucléolo, cromatina e cromossomos NUCLÉOLO Tem aspecto de grânulo, mas não é limitado por membrana. É o centro de produção de ribossomos. O DNA origina os RNAr que são conjugados com proteínas vindas
As partes de um rio e seu curso
 Hidrografia As partes de um rio e seu curso Nascentes - conjunto de córregos que formam o início do rio. Curso caminho do rio. Montante - sentido oposto ao curso de rio. Jusante sentido do curso do rio.
Hidrografia As partes de um rio e seu curso Nascentes - conjunto de córregos que formam o início do rio. Curso caminho do rio. Montante - sentido oposto ao curso de rio. Jusante sentido do curso do rio.
Detecção de IL-1 por ELISA sanduíche. Andréa Calado
 Detecção de IL-1 por ELISA sanduíche Andréa Calado andreabelfort@hotmail.com ELISA O teste identifica e quantifica Ag ou Ac, utilizando um dos dois conjugados com enzimas; PRINCIPAIS TIPOS: INDIRETO:
Detecção de IL-1 por ELISA sanduíche Andréa Calado andreabelfort@hotmail.com ELISA O teste identifica e quantifica Ag ou Ac, utilizando um dos dois conjugados com enzimas; PRINCIPAIS TIPOS: INDIRETO:
NÚCLEO E MITOSE. 9º ANO BIOLOGIA LUCIANA ARAUJO 1º Bimestre
 NÚCLEO E MITOSE 9º ANO BIOLOGIA LUCIANA ARAUJO 1º Bimestre I. Diferença entre célula procarionte e eucarionte. PROCARIONTE EUCARIONTE CARIOTECA Não Sim NÚCLEO Não Sim MATERIAL GENÉTICO Sim Sim ORGANELAS
NÚCLEO E MITOSE 9º ANO BIOLOGIA LUCIANA ARAUJO 1º Bimestre I. Diferença entre célula procarionte e eucarionte. PROCARIONTE EUCARIONTE CARIOTECA Não Sim NÚCLEO Não Sim MATERIAL GENÉTICO Sim Sim ORGANELAS
Revelando os Processos de Diversificação Cariotípica em Primatas Neotropicais por FISH
 Revelando os Processos de Diversificação Cariotípica em Primatas Neotropicais por FISH Edivaldo Herculano C. de Oliveira Instituto Evandro Chagas Universidade Federal do Pará REVELANDO OS PROCESSOS DE
Revelando os Processos de Diversificação Cariotípica em Primatas Neotropicais por FISH Edivaldo Herculano C. de Oliveira Instituto Evandro Chagas Universidade Federal do Pará REVELANDO OS PROCESSOS DE
Análise do cariótipo de duas espécies da família Formicariidae (Aves, Passeriformes)
 15 Ararajuba 10 (1): 15-19 junho de 2002 Análise do cariótipo de duas espécies da família Formicariidae (Aves, Passeriformes) Mario Angel Ledesma, Analía del Valle Garnero e Ricardo José Gunski Proyecto
15 Ararajuba 10 (1): 15-19 junho de 2002 Análise do cariótipo de duas espécies da família Formicariidae (Aves, Passeriformes) Mario Angel Ledesma, Analía del Valle Garnero e Ricardo José Gunski Proyecto
AULA PRÁTICA 3-02/06/2015. Roteiro de aula prática. Infecção de macrófagos por Leishmania (Leishmania) amazonensis
 AULA PRÁTICA 3-02/06/2015 Roteiro de aula prática Infecção de macrófagos por Leishmania (Leishmania) amazonensis Macrófagos previamente plaqueados e infectados com formas promastigotas de Leishmania (Leishmania)
AULA PRÁTICA 3-02/06/2015 Roteiro de aula prática Infecção de macrófagos por Leishmania (Leishmania) amazonensis Macrófagos previamente plaqueados e infectados com formas promastigotas de Leishmania (Leishmania)
ESPACIALIZAÇÃO DE PARÂMETROS DE SOLO EM UMA MICROBACIA DE OCUPAÇÃO URBANA - SOROCABA/SP
 ESPACIALIZAÇÃO DE PARÂMETROS DE SOLO EM UMA MICROBACIA DE OCUPAÇÃO URBANA - SOROCABA/SP Rodrigo Custódio Urban 1 ; Alexandre Marco da Silva 1 ; Luiz Augusto Manfré 1 1 UNESP Campus Sorocaba. Av. Três de
ESPACIALIZAÇÃO DE PARÂMETROS DE SOLO EM UMA MICROBACIA DE OCUPAÇÃO URBANA - SOROCABA/SP Rodrigo Custódio Urban 1 ; Alexandre Marco da Silva 1 ; Luiz Augusto Manfré 1 1 UNESP Campus Sorocaba. Av. Três de
PROTOCOLO DE UTILIZAÇAO
 PROTOCOLO DE UTILIZAÇAO Hibridação para cortes de tecidos preservados em parafina Materiais fornecidos: DNA marcado com moléculas fluorescentes (sonda). Buffer(tampão) de Hibridação Reativos para preparar
PROTOCOLO DE UTILIZAÇAO Hibridação para cortes de tecidos preservados em parafina Materiais fornecidos: DNA marcado com moléculas fluorescentes (sonda). Buffer(tampão) de Hibridação Reativos para preparar
OCORRÊNCIA DE CROMOSSOMOS B EM PEIXES. NEOTROPICAIS E ANÁLISE CITOGENÉTICA EM Iheringichthys. labrosus E Megalonema platanum (TELEOSTEI, PIMELODIDAE)
 OCORRÊNCIA DE CROMOSSOMOS B EM PEIXES NEOTROPICAIS E ANÁLISE CITOGENÉTICA EM Iheringichthys labrosus E Megalonema platanum (TELEOSTEI, PIMELODIDAE) Rafael Augusto de Carvalho Maringá PR 2008 RAFAEL AUGUSTO
OCORRÊNCIA DE CROMOSSOMOS B EM PEIXES NEOTROPICAIS E ANÁLISE CITOGENÉTICA EM Iheringichthys labrosus E Megalonema platanum (TELEOSTEI, PIMELODIDAE) Rafael Augusto de Carvalho Maringá PR 2008 RAFAEL AUGUSTO
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
Hibridação de ácidos nucleicos. de cromossomo a chip de DNA
 Hibridação de ácidos nucleicos de cromossomo a chip de DNA Hibridação de ácidos nucleicos Pareamento complementar de bases entre duas fitas simples de ácido nucleico DNA DNA RNA RNA DNA - RNA Hibridação
Hibridação de ácidos nucleicos de cromossomo a chip de DNA Hibridação de ácidos nucleicos Pareamento complementar de bases entre duas fitas simples de ácido nucleico DNA DNA RNA RNA DNA - RNA Hibridação
CROMOSSOMOS. Profa. Dra. Viviane Nogaroto
 CROMOSSOMOS Cromossomos EUCARIOTOS Cada cromossomo carrega um subconjunto de genes que são arranjados linearmente ao longo do DNA Tamanho: -DNA de cromossomo de E. coli: 1.200 µm -DNA de cromossomo humano:
CROMOSSOMOS Cromossomos EUCARIOTOS Cada cromossomo carrega um subconjunto de genes que são arranjados linearmente ao longo do DNA Tamanho: -DNA de cromossomo de E. coli: 1.200 µm -DNA de cromossomo humano:
Materiais necessários que não estão incluídos
 DNA especifico com marca fluorescente Produto: 1. DNA marcado com moléculas fluorescentes (sonda). 2. Buffer(tampão) de Hibridação 3. Reagentes para solução de montagem (DAPI + antifade) Estas sondas estão
DNA especifico com marca fluorescente Produto: 1. DNA marcado com moléculas fluorescentes (sonda). 2. Buffer(tampão) de Hibridação 3. Reagentes para solução de montagem (DAPI + antifade) Estas sondas estão
A CÉLULA 1. Introdução: Uma Visão Geral da Célula
 A CÉLULA 1. Introdução: Uma Visão Geral da Célula O que são? Tipos? Estrutura? São unidades estruturais e funcionais dos organismos vivos Há muitos tipos diferentes de células, que variam enormemente em
A CÉLULA 1. Introdução: Uma Visão Geral da Célula O que são? Tipos? Estrutura? São unidades estruturais e funcionais dos organismos vivos Há muitos tipos diferentes de células, que variam enormemente em
Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011
 1 Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011 1. Introdução As parasitoses intestinais representam sério problema de saúde pública, em
1 Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011 1. Introdução As parasitoses intestinais representam sério problema de saúde pública, em
TÍTULO: INFLUÊNCIA DA PCH LUIZ DIAS SOBRE A COMPOSIÇÃO DA ICTIOFAUNA NO RIO LOURENÇO VELHO, MG
 TÍTULO: INFLUÊNCIA DA PCH LUIZ DIAS SOBRE A COMPOSIÇÃO DA ICTIOFAUNA NO RIO LOURENÇO VELHO, MG CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: CIÊNCIAS BIOLÓGICAS INSTITUIÇÃO: CENTRO
TÍTULO: INFLUÊNCIA DA PCH LUIZ DIAS SOBRE A COMPOSIÇÃO DA ICTIOFAUNA NO RIO LOURENÇO VELHO, MG CATEGORIA: EM ANDAMENTO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: CIÊNCIAS BIOLÓGICAS INSTITUIÇÃO: CENTRO
TÉCNICAS DE CITOLOGIA. Silene Gomes Correa
 TÉCNICAS DE CITOLOGIA Silene Gomes Correa Preparo de Amostras Citológicas 1 2 3 4 5 Descrever coloração, viscosidade e volume Centrifugar em 2100 RPM por 10 Decantar Cito-centrifugar o sedimento Amostras
TÉCNICAS DE CITOLOGIA Silene Gomes Correa Preparo de Amostras Citológicas 1 2 3 4 5 Descrever coloração, viscosidade e volume Centrifugar em 2100 RPM por 10 Decantar Cito-centrifugar o sedimento Amostras
Ajustar o ph para 7,4. Filtrar o meio em 0,22 µm no fluxo e depois acrescentar o antibiótico/antimicótico. Armazenar de 2ºC a 8ºC.
 ANEXO I - SOLUÇÕES A Para expansão dos hibridomas Meio de cultura (solução-estoque) Meio RPMI - Roswell Park Memorial 10,4 g Institute (Gibco, Invitrogen) NaHCO 3 2 g HEPES 4,68 g Antibiótico/antimicótico
ANEXO I - SOLUÇÕES A Para expansão dos hibridomas Meio de cultura (solução-estoque) Meio RPMI - Roswell Park Memorial 10,4 g Institute (Gibco, Invitrogen) NaHCO 3 2 g HEPES 4,68 g Antibiótico/antimicótico
RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ
 INSTITUTO DE TECNOLOGIA PARA O DESENVOLVIMENTO Centro de Hidráulica e Hidrologia Prof. Parigot de Souza RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ RELATÓRIO TÉCNICO Nº 34 2012 COORDENAÇÃO
INSTITUTO DE TECNOLOGIA PARA O DESENVOLVIMENTO Centro de Hidráulica e Hidrologia Prof. Parigot de Souza RELATÓRIO DE MONITORAMENTO DA ICTIOFAUNA NA ÁREA DA UHE MAUÁ RELATÓRIO TÉCNICO Nº 34 2012 COORDENAÇÃO
Biologia. ( ) centríolo (A) 2, 1, 3, 5, 6, 4. ( ) retículo endoplasmático (B) 2, 1, 3, 5, 4, 6. ( ) complexo de Golgi (C) 1, 6, 5, 3, 2, 4
 Biologia 21. Associe os números das estruturas celulares assinaladas no desenho com os respectivos nomes da coluna abaixo do desenho. A seguir, assinale a opção em que a seqüência coincida com o que foi
Biologia 21. Associe os números das estruturas celulares assinaladas no desenho com os respectivos nomes da coluna abaixo do desenho. A seguir, assinale a opção em que a seqüência coincida com o que foi
OBSERVAÇÃO DE MITOSE EM RAIZ DE CEBOLA
 OBSERVAÇÃO DE MITOSE EM RAIZ DE CEBOLA 1 Colocar uma lâmina limpa sobre a bancada 2 e pingar, sobre ela, 3 gotas de orceína lático/acética a 2% Colocar uma ponta de raiz de cebola na orceína lático/acética,
OBSERVAÇÃO DE MITOSE EM RAIZ DE CEBOLA 1 Colocar uma lâmina limpa sobre a bancada 2 e pingar, sobre ela, 3 gotas de orceína lático/acética a 2% Colocar uma ponta de raiz de cebola na orceína lático/acética,
TD de Revisão de Biologia- 9º ano- 4ª etapa Profa: Ana Gardênia Assunto: Mitose e Meiose
 TD de Revisão de Biologia- 9º ano- 4ª etapa Profa: Ana Gardênia Assunto: Mitose e Meiose 1. A interfase é definida como o período que antecede as divisões celulares. Sobre este processo, responda: a) Qual
TD de Revisão de Biologia- 9º ano- 4ª etapa Profa: Ana Gardênia Assunto: Mitose e Meiose 1. A interfase é definida como o período que antecede as divisões celulares. Sobre este processo, responda: a) Qual
Evolução Cromossômica em Erythrinus erythrinus (Characiformes, Erythrinidae). Citogenética Comparativa entre Cariomorfos.
 UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA EVOLUTIVA E BIOLOGIA MOLECULAR Evolução Cromossômica em Erythrinus erythrinus (Characiformes,
UNIVERSIDADE FEDERAL DE SÃO CARLOS CENTRO DE CIÊNCIAS BIOLÓGICAS E DA SAÚDE PROGRAMA DE PÓS-GRADUAÇÃO EM GENÉTICA EVOLUTIVA E BIOLOGIA MOLECULAR Evolução Cromossômica em Erythrinus erythrinus (Characiformes,
BIOMAS. Professora Débora Lia Ciências/Biologia
 BIOMAS Professora Débora Lia Ciências/Biologia BIOMAS - Aquáticos Mares e oceanos Talássicos São as regiões com a maior variedade de vida do planeta, nem as florestas tropicais igualam-se às regiões litorâneas;
BIOMAS Professora Débora Lia Ciências/Biologia BIOMAS - Aquáticos Mares e oceanos Talássicos São as regiões com a maior variedade de vida do planeta, nem as florestas tropicais igualam-se às regiões litorâneas;
Introdução à Histologia e Técnicas Histológicas. Prof. Cristiane Oliveira
 Introdução à Histologia e Técnicas Histológicas Prof. Cristiane Oliveira Visão Geral Corpo humano organizado em 4 tecidos básicos: Epitelial Conjuntivo Muscular Nervoso Visão Geral - Tecidos consistem
Introdução à Histologia e Técnicas Histológicas Prof. Cristiane Oliveira Visão Geral Corpo humano organizado em 4 tecidos básicos: Epitelial Conjuntivo Muscular Nervoso Visão Geral - Tecidos consistem
EXTRAÇÃO DE DNA DE SANGUE (LEUCÓCITOS)
 EXTRAÇÃO DE DNA DE SANGUE (LEUCÓCITOS) A) Obtenção de Leucócitos 1. Coletar 5mL de sangue em tubos contendo EDTA potássio (50uL de EDTA (k 3) a 15%). O EDTA é uma substância anticoagulante. Existem outras
EXTRAÇÃO DE DNA DE SANGUE (LEUCÓCITOS) A) Obtenção de Leucócitos 1. Coletar 5mL de sangue em tubos contendo EDTA potássio (50uL de EDTA (k 3) a 15%). O EDTA é uma substância anticoagulante. Existem outras
Núcleo celular. Robert Brown ( ) Componente fundamental para a célula Nux. Compreensão da importância Séc. XX
 Núcleo celular Robert Brown (1773-1858) Componente fundamental para a célula Nux Compreensão da importância Séc. XX Componentes do núcleo celular Núcleo celular Eucariontes (+ 1 núcleo) Presença de cromossomos
Núcleo celular Robert Brown (1773-1858) Componente fundamental para a célula Nux Compreensão da importância Séc. XX Componentes do núcleo celular Núcleo celular Eucariontes (+ 1 núcleo) Presença de cromossomos
HIDROSFERA E AS ÁGUAS CONTINETAIS E BACIAS HIDROGRÁFICAS MÓDULOS 14 E 15
 HIDROSFERA E AS ÁGUAS CONTINETAIS E BACIAS HIDROGRÁFICAS MÓDULOS 14 E 15 IMPORTÂNCIA DA ÁGUA A água é um recurso natural fundamental ao ser humano, uma das principais fontes de vida. Necessárias são posturas
HIDROSFERA E AS ÁGUAS CONTINETAIS E BACIAS HIDROGRÁFICAS MÓDULOS 14 E 15 IMPORTÂNCIA DA ÁGUA A água é um recurso natural fundamental ao ser humano, uma das principais fontes de vida. Necessárias são posturas
1 - Objetivos. 2 Materiais e Métodos. Confecção dos Coletores
 PROTOCOLO PARA MONITORAMENTO DA ASSEMBLÉIA DE MACROINVERTEBRADOS BENTÔNICOS EM SISTEMA DE TANQUES-REDE PARA AQÜICULTURA UTILIZANDO COLETORES COM SUBSTRATO ARTIFICIAL 1 - Objetivos Este protocolo tem por
PROTOCOLO PARA MONITORAMENTO DA ASSEMBLÉIA DE MACROINVERTEBRADOS BENTÔNICOS EM SISTEMA DE TANQUES-REDE PARA AQÜICULTURA UTILIZANDO COLETORES COM SUBSTRATO ARTIFICIAL 1 - Objetivos Este protocolo tem por
TÍTULO: PADRONIZAÇÃO DA MACROTÉCNICA PARA CULTIVO DE LINFÓCITOS CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: FARMÁCIA
 16 TÍTULO: PADRONIZAÇÃO DA MACROTÉCNICA PARA CULTIVO DE LINFÓCITOS CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: FARMÁCIA INSTITUIÇÃO: UNIVERSIDADE ANHEMBI MORUMBI AUTOR(ES): CARLA REGINA
16 TÍTULO: PADRONIZAÇÃO DA MACROTÉCNICA PARA CULTIVO DE LINFÓCITOS CATEGORIA: CONCLUÍDO ÁREA: CIÊNCIAS BIOLÓGICAS E SAÚDE SUBÁREA: FARMÁCIA INSTITUIÇÃO: UNIVERSIDADE ANHEMBI MORUMBI AUTOR(ES): CARLA REGINA
Cursos de Enfermagem e Obstetrícia, Medicina e Nutrição. Disciplina Mecanismos Básicos de Saúde e Doença MCW 240. Aula Prática 3 Módulo Microbiologia
 Cursos de Enfermagem e Obstetrícia, Medicina e Nutrição Disciplina Mecanismos Básicos de Saúde e Doença MCW 240 Aula Prática 3 Módulo Microbiologia Teste da eficácia de agentes físicos e químicos sobre
Cursos de Enfermagem e Obstetrícia, Medicina e Nutrição Disciplina Mecanismos Básicos de Saúde e Doença MCW 240 Aula Prática 3 Módulo Microbiologia Teste da eficácia de agentes físicos e químicos sobre
GEOGRAFIA DE SANTA CATARINA E BACIAS HIDROGRÁFICAS DO BRASIL Profº Gustavo Silva de Souza
 GEOGRAFIA DE SANTA CATARINA E BACIAS HIDROGRÁFICAS DO BRASIL Profº Gustavo Silva de Souza Aspectos físicos: - Posição Geográfica Situada na região sul do Brasil, limita-se ao norte com o estado do PR
GEOGRAFIA DE SANTA CATARINA E BACIAS HIDROGRÁFICAS DO BRASIL Profº Gustavo Silva de Souza Aspectos físicos: - Posição Geográfica Situada na região sul do Brasil, limita-se ao norte com o estado do PR
Técnicas histológicas
 Técnicas histológicas Profa Simone Marcuzzo Histologia Estudo da estrutura e inter-relação dos constituintes teciduais de um organismo Células e material extracelular Tecidos Macroscopia e microscopia
Técnicas histológicas Profa Simone Marcuzzo Histologia Estudo da estrutura e inter-relação dos constituintes teciduais de um organismo Células e material extracelular Tecidos Macroscopia e microscopia
1. Considere os climogramas e o mapa a seguir.
 1. Considere os climogramas e o mapa a seguir. Os climogramas I e II apresentam respectivamente os climas nas seguintes áreas: a) equatorial (A); tropical de altitude (D). b) tropical (A); semi-árido (E).
1. Considere os climogramas e o mapa a seguir. Os climogramas I e II apresentam respectivamente os climas nas seguintes áreas: a) equatorial (A); tropical de altitude (D). b) tropical (A); semi-árido (E).
Apostila de Geografia 16 Hidrografia Matheus Borges
 Apostila de Geografia 16 Hidrografia Matheus Borges 1.0 Distribuição das Águas 97% Águas salgadas: Oceano Pacífico (o maior). Oceano Atlântico (muito navegável). Oceano Índico. 3% Água doce: 2% Geleiras.
Apostila de Geografia 16 Hidrografia Matheus Borges 1.0 Distribuição das Águas 97% Águas salgadas: Oceano Pacífico (o maior). Oceano Atlântico (muito navegável). Oceano Índico. 3% Água doce: 2% Geleiras.
MORFOLOGIA CROMOSSÔMICA E ALTERAÇÕES ESTRUTURAIS: UM MODELO DIDÁTICO MATERIAIS DIDÁTICOS
 MATERIAIS DIDÁTICOS MORFOLOGIA CROMOSSÔMICA E ALTERAÇÕES ESTRUTURAIS: UM MODELO DIDÁTICO Bruno Lassmar Bueno Valadares1, Andreza de Oliveira Pereira2, Camilla Silen de Almeida2 1 2 Departamento de Biologia,
MATERIAIS DIDÁTICOS MORFOLOGIA CROMOSSÔMICA E ALTERAÇÕES ESTRUTURAIS: UM MODELO DIDÁTICO Bruno Lassmar Bueno Valadares1, Andreza de Oliveira Pereira2, Camilla Silen de Almeida2 1 2 Departamento de Biologia,
Com base nos pontos foram determinadas direções intermediárias, conhecidas como. pontos : nordeste (NE), (NO), sudeste (SE) e (SO).
 PROFESSOR: EQUIPE DE GEOGRAFIA BANCO DE QUESTÕES - GEOGRAFIA - 6º ANO - ENSINO FUNDAMENTAL ============================================================================================= 01- Complete as
PROFESSOR: EQUIPE DE GEOGRAFIA BANCO DE QUESTÕES - GEOGRAFIA - 6º ANO - ENSINO FUNDAMENTAL ============================================================================================= 01- Complete as
Laboratório de Citogenética Molecular de Plantas Departamento de Genética Escola Superior de Agricultura Luiz de Queiroz UNIVERSIDADE DE SÃO PAULO
 Metodologia: COLORAÇÃO PELO MÉTODO DE FEULGEN Adaptado por: Mondin, M e Aguiar-Perecin MLR 1.) Retirar o material (raízes conservadas em álcool 70%) da geladeira com antecedência, deixando atingir a temperatura
Metodologia: COLORAÇÃO PELO MÉTODO DE FEULGEN Adaptado por: Mondin, M e Aguiar-Perecin MLR 1.) Retirar o material (raízes conservadas em álcool 70%) da geladeira com antecedência, deixando atingir a temperatura
AVALIAÇÃO AMBIENTAL A PARTIR DO USO DO SOLO NOS BAIRROS ROQUE E MATO GROSSO EM PORTO VELHO RO
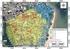 AVALIAÇÃO AMBIENTAL A PARTIR DO USO DO SOLO NOS BAIRROS ROQUE E MATO GROSSO EM PORTO VELHO RO 1 Tito José de Barba Avaroma Universidade Federal de Rondônia - UNIR tito.geo.ro@gmail.com Introdução Porto
AVALIAÇÃO AMBIENTAL A PARTIR DO USO DO SOLO NOS BAIRROS ROQUE E MATO GROSSO EM PORTO VELHO RO 1 Tito José de Barba Avaroma Universidade Federal de Rondônia - UNIR tito.geo.ro@gmail.com Introdução Porto
Capítulo 5 cariótipos
 Capítulo 5 cariótipos Compilação por Paulo de Oliveira, Universidade de Évora. Apresentação e PDF para uso exclusivo dos alunos de Genética da Universidade de Évora Cariótipos de jumento da raça marchadora
Capítulo 5 cariótipos Compilação por Paulo de Oliveira, Universidade de Évora. Apresentação e PDF para uso exclusivo dos alunos de Genética da Universidade de Évora Cariótipos de jumento da raça marchadora
Aconselhamento Genético e Diagnóstico Pré-natal
 Aconselhamento Genético e Diagnóstico Pré-natal O aconselhamento genético constitui-se de um processo de comunicação que trata dos problemas humanos associados com a ocorrência, ou risco de ocorrência
Aconselhamento Genético e Diagnóstico Pré-natal O aconselhamento genético constitui-se de um processo de comunicação que trata dos problemas humanos associados com a ocorrência, ou risco de ocorrência
ANÁLISE CITOGENÉTICA DE Coffea canephora
 ANÁLISE CITOGENÉTICA DE Coffea canephora II Simpósio de Pesquisa dos Cafés do Brasil FONTES, B.P.D. 1 e CARVALHO, C.R. 1 1 Dep. de Biologia Geral - UFV, Viçosa-MG,
ANÁLISE CITOGENÉTICA DE Coffea canephora II Simpósio de Pesquisa dos Cafés do Brasil FONTES, B.P.D. 1 e CARVALHO, C.R. 1 1 Dep. de Biologia Geral - UFV, Viçosa-MG,
UTILIZAÇÃO DOS MARCADORES MOLECULARES rdna 5S NA DIFERENCIAÇÃO GENÉTICA DE POPULAÇÕES DE Hypostomus sp. DA BACIA DO RIO IVAÍ
 V Mostra Interna de Trabalhos de Iniciação Científica 26 a 29 de outubro de 2010 ISBN 978-85-61091-69-9 UTILIZAÇÃO DOS MARCADORES MOLECULARES rdna 5S NA DIFERENCIAÇÃO GENÉTICA DE POPULAÇÕES DE Hypostomus
V Mostra Interna de Trabalhos de Iniciação Científica 26 a 29 de outubro de 2010 ISBN 978-85-61091-69-9 UTILIZAÇÃO DOS MARCADORES MOLECULARES rdna 5S NA DIFERENCIAÇÃO GENÉTICA DE POPULAÇÕES DE Hypostomus
ESTUDO DA OCORRÊNCIA DA ICTIOFAUNA EM SANTA CATARINA
 ESTUDO DA OCORRÊNCIA DA ICTIOFAUNA EM SANTA CATARINA Modalidade: ( ) Ensino ( x ) Pesquisa ( ) Extensão Nível: ( x ) Médio ( ) Superior ( ) Pós-graduação Área: ( ) Química ( ) Informática ( ) Ciências
ESTUDO DA OCORRÊNCIA DA ICTIOFAUNA EM SANTA CATARINA Modalidade: ( ) Ensino ( x ) Pesquisa ( ) Extensão Nível: ( x ) Médio ( ) Superior ( ) Pós-graduação Área: ( ) Química ( ) Informática ( ) Ciências
Técnicas utilizadas para estudo citogenético clínico. Prof. Dr. Bruno Lazzari de Lima
 Técnicas utilizadas para estudo citogenético clínico Prof. Dr. Bruno Lazzari de Lima Citogenética Clínica Estudo do cromossomo aplicado à prática da genética médica. 40 anos atrás Distúrbios cromossômicos
Técnicas utilizadas para estudo citogenético clínico Prof. Dr. Bruno Lazzari de Lima Citogenética Clínica Estudo do cromossomo aplicado à prática da genética médica. 40 anos atrás Distúrbios cromossômicos
DZ-104-R.3 - METODOLOGIA DE CODIFICAÇÃO DE BACIAS HIDROGRÁFICAS
 DZ-104-R.3 - METODOLOGIA DE CODIFICAÇÃO DE BACIAS HIDROGRÁFICAS Notas: Aprovada pela Deliberação CECA nº 804, de 20 de fevereiro de 1986 Publicada no DOERJ de 24 de março de 1986 1. OBJETIVO A metodologia
DZ-104-R.3 - METODOLOGIA DE CODIFICAÇÃO DE BACIAS HIDROGRÁFICAS Notas: Aprovada pela Deliberação CECA nº 804, de 20 de fevereiro de 1986 Publicada no DOERJ de 24 de março de 1986 1. OBJETIVO A metodologia
TERCEIRÃO GEOGRAFIA FRENTE 4A AULA 11. Profº André Tomasini
 TERCEIRÃO GEOGRAFIA FRENTE 4A AULA 11 Profº André Tomasini ÁGUAS CONTINENTAIS Os oceanos e mares cobrem 2/3 da superfície do planeta. Águas Oceânicas : Abrange oceanos e mares. Águas Continentais: Rios,
TERCEIRÃO GEOGRAFIA FRENTE 4A AULA 11 Profº André Tomasini ÁGUAS CONTINENTAIS Os oceanos e mares cobrem 2/3 da superfície do planeta. Águas Oceânicas : Abrange oceanos e mares. Águas Continentais: Rios,
O USO DE MARCADORES CITOGENÉTICOS BÁSICOS E MOLECULARES PARA A CARACTERIZAÇÃO DE UMA POPULAÇÃO DE Hoplias malabaricus
 CARLA DE ANDRADE VITORINO O USO DE MARCADORES CITOGENÉTICOS BÁSICOS E MOLECULARES PARA A CARACTERIZAÇÃO DE UMA POPULAÇÃO DE Hoplias malabaricus NOVA XAVANTINA 2010 UNIVERSIDADE DO ESTADO DE MATO GROSSO
CARLA DE ANDRADE VITORINO O USO DE MARCADORES CITOGENÉTICOS BÁSICOS E MOLECULARES PARA A CARACTERIZAÇÃO DE UMA POPULAÇÃO DE Hoplias malabaricus NOVA XAVANTINA 2010 UNIVERSIDADE DO ESTADO DE MATO GROSSO
GENÉTICA DE PEIXES NEOTROPICAIS. I. ASPECTOS DA CONSERVAÇÃO GENÉTICA DOS PEIXES NO PARQUE ESTADUAL DE VILA VELHA, PARANÁ, BRASIL
 CDD: 597 GENÉTICA DE PEIXES NEOTROPICAIS. I. ASPECTOS DA CONSERVAÇÃO GENÉTICA DOS PEIXES NO PARQUE ESTADUAL DE VILA VELHA, PARANÁ, BRASIL NEOTROPICAL FISH GENETICS. I. ASPECTS OF GENETIC CONSERVATION OF
CDD: 597 GENÉTICA DE PEIXES NEOTROPICAIS. I. ASPECTOS DA CONSERVAÇÃO GENÉTICA DOS PEIXES NO PARQUE ESTADUAL DE VILA VELHA, PARANÁ, BRASIL NEOTROPICAL FISH GENETICS. I. ASPECTS OF GENETIC CONSERVATION OF
Técnica Básicas para Análises de Células e Tecidos
 Técnica Básicas para Análises de Células e Tecidos Visão panorâmica da célula Algumas grandezas... 1km 1.000m 1m 100 cm 1cm 10 mm 1mm 1000 µm 1 µm 1000 nm 1Å (Angstron Angstron) 10 10-10 m Visão panorâmica
Técnica Básicas para Análises de Células e Tecidos Visão panorâmica da célula Algumas grandezas... 1km 1.000m 1m 100 cm 1cm 10 mm 1mm 1000 µm 1 µm 1000 nm 1Å (Angstron Angstron) 10 10-10 m Visão panorâmica
MINUTA DELIBERAÇÃO CBHSF Nº xx de xx de novembro de 2012
 MINUTA DELIBERAÇÃO CBHSF Nº xx de xx de novembro de 2012 Dispõe sobre os limites geográficos da Região fisiográfica do Baixo São Francisco. O Comitê da Bacia Hidrográfica do Rio São Francisco - CBHSF,
MINUTA DELIBERAÇÃO CBHSF Nº xx de xx de novembro de 2012 Dispõe sobre os limites geográficos da Região fisiográfica do Baixo São Francisco. O Comitê da Bacia Hidrográfica do Rio São Francisco - CBHSF,
Evolução cromossômica em peixes da família Erythrinidae (Characiformes). Citogenética comparativa entre espécies do gênero Hoplias.
 UNIVERSIDADE FEDERAL DE SÃO CARLOS PÓS-GRADUAÇÃO EM GENÉTICA EVOLUTIVA E BIOLOGIA MOLECULAR Evolução cromossômica em peixes da família Erythrinidae (Characiformes). Citogenética comparativa entre espécies
UNIVERSIDADE FEDERAL DE SÃO CARLOS PÓS-GRADUAÇÃO EM GENÉTICA EVOLUTIVA E BIOLOGIA MOLECULAR Evolução cromossômica em peixes da família Erythrinidae (Characiformes). Citogenética comparativa entre espécies
ARTIGO ORIGINAL. Abstract. Diones Krinski [a], Carlos Suetoshi Miyazawa [b] Recebido: 03/04/2013 Received: 04/03/2013
![ARTIGO ORIGINAL. Abstract. Diones Krinski [a], Carlos Suetoshi Miyazawa [b] Recebido: 03/04/2013 Received: 04/03/2013 ARTIGO ORIGINAL. Abstract. Diones Krinski [a], Carlos Suetoshi Miyazawa [b] Recebido: 03/04/2013 Received: 04/03/2013](/thumbs/55/37407184.jpg) 10.7213/estud.biol.35.085.AO02 Licenciado sob uma Licença Creative Commons ARTIGO ORIGINAL [I] Análises cariotípicas em Leporellus vittatus e Leporinus striatus (Teleostei, Characiformes, Anostomidae)
10.7213/estud.biol.35.085.AO02 Licenciado sob uma Licença Creative Commons ARTIGO ORIGINAL [I] Análises cariotípicas em Leporellus vittatus e Leporinus striatus (Teleostei, Characiformes, Anostomidae)
Estudos Citogenéticos e Moleculares em Representantes da Família Erythrinidae (Teleostei, Characiformes)
 Universidade Estadual de Maringá Departamento de Biologia Celular e Genética Programa de Pós-graduação em Ciências Biológicas Área de Concentração: Biologia Celular e Molecular RENATA DA ROSA Estudos Citogenéticos
Universidade Estadual de Maringá Departamento de Biologia Celular e Genética Programa de Pós-graduação em Ciências Biológicas Área de Concentração: Biologia Celular e Molecular RENATA DA ROSA Estudos Citogenéticos
BIOQUÍMICA EXPERIMENTAL
 Departamento de Bioquímica Instituto de Química USP Apostila de protocolos Parte A BIOQUÍMICA EXPERIMENTAL QBQ 036N 05 Professores Carlos T. Hotta Ronaldo B. Quaggio Esta apostila foi desenvolvida originalmente
Departamento de Bioquímica Instituto de Química USP Apostila de protocolos Parte A BIOQUÍMICA EXPERIMENTAL QBQ 036N 05 Professores Carlos T. Hotta Ronaldo B. Quaggio Esta apostila foi desenvolvida originalmente
Aanálise de cromossomos humanos é hoje
 PROPOSTAS PARA DESENVOLVER EM SALA DE AULA NÚMERO 4 JANEIRO DE 1997 EDITORA MODERNA ORGANIZANDO OS CROMOSSOMOS HUMANOS: IDIOGRAMA J. M. Amabis e G. R. Martho A identificação dos cromossomos humanos é de
PROPOSTAS PARA DESENVOLVER EM SALA DE AULA NÚMERO 4 JANEIRO DE 1997 EDITORA MODERNA ORGANIZANDO OS CROMOSSOMOS HUMANOS: IDIOGRAMA J. M. Amabis e G. R. Martho A identificação dos cromossomos humanos é de
Extracção de ADN de mancha de sangue por Chelex 100. Protocolo experimental:
 Extracção de ADN de mancha de sangue por Chelex 100 1. Num tubo eppendorf misturar 1ml de água desionizada estéril com uma mancha de sangue com aproximadamente 3mm²; 2. Incubar à temperatura ambiente no
Extracção de ADN de mancha de sangue por Chelex 100 1. Num tubo eppendorf misturar 1ml de água desionizada estéril com uma mancha de sangue com aproximadamente 3mm²; 2. Incubar à temperatura ambiente no
ECO GEOGRAFIA. Prof. Felipe Tahan BIOMAS
 ECO GEOGRAFIA Prof. Felipe Tahan BIOMAS DOMÍNIOS MORFOCLIMÁTICOS Os domínios morfoclimáticos representam a combinação de um conjunto de elementos da natureza relevo, clima, vegetação que se inter-relacionam
ECO GEOGRAFIA Prof. Felipe Tahan BIOMAS DOMÍNIOS MORFOCLIMÁTICOS Os domínios morfoclimáticos representam a combinação de um conjunto de elementos da natureza relevo, clima, vegetação que se inter-relacionam
RELATÓRIO FINAL Programa de Bolsa de Produtividade em Pesquisa
 RELATÓRIO FINAL Programa de Bolsa de Produtividade em Pesquisa Chamada de Projetos 02/2008 Nome do bolsista Marcelo Ricardo Vicari Protocolo 12938 (conv. 137/08) Período do Relatório 08/08/2008 a 07/08/2009
RELATÓRIO FINAL Programa de Bolsa de Produtividade em Pesquisa Chamada de Projetos 02/2008 Nome do bolsista Marcelo Ricardo Vicari Protocolo 12938 (conv. 137/08) Período do Relatório 08/08/2008 a 07/08/2009
CARTILHA DE INSTRUÇÃO PARA ACESSO AO PATRIMÔNIO GENÉTICO OU CONHECIMENTO TRADICIONAL ASSOCIADO
 RENATA PINHEIRO GONZALES TRABALHO DE CONCLUSÃO DE CURSO 2011 CARTILHA DE INSTRUÇÃO PARA ACESSO AO PATRIMÔNIO GENÉTICO OU CONHECIMENTO TRADICIONAL ASSOCIADO RENATA PINHEIRO GONZALES PANORAMA DO CONHECIMENTO
RENATA PINHEIRO GONZALES TRABALHO DE CONCLUSÃO DE CURSO 2011 CARTILHA DE INSTRUÇÃO PARA ACESSO AO PATRIMÔNIO GENÉTICO OU CONHECIMENTO TRADICIONAL ASSOCIADO RENATA PINHEIRO GONZALES PANORAMA DO CONHECIMENTO
Prova de Química Analítica
 CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número
CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número
BIOLOGIA - 3 o ANO MÓDULO 36 MEIOSE
 BIOLOGIA - 3 o ANO MÓDULO 36 MEIOSE Ploidia 2n n 4 3 2 interfase meiose I meiose II 4x 3x 2x x M M 1 Como pode cair no enem A meiose e a fecundação na reprodução sexuada são processos complementares,
BIOLOGIA - 3 o ANO MÓDULO 36 MEIOSE Ploidia 2n n 4 3 2 interfase meiose I meiose II 4x 3x 2x x M M 1 Como pode cair no enem A meiose e a fecundação na reprodução sexuada são processos complementares,
TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED
 TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED I. COMENTÁRIOS A técnica parasitológica de TF-Test Conventional, utilizando o kit comercial TF- Test, foi avaliada para o
TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED I. COMENTÁRIOS A técnica parasitológica de TF-Test Conventional, utilizando o kit comercial TF- Test, foi avaliada para o
Protocolo experimental
 Protocolo experimental E se a salinidade se alterar? Enquadramento Teórico Todos os animais necessitam de condições ambientais favoráveis à sua sobrevivência e manutenção. Parâmetros como por exemplo a
Protocolo experimental E se a salinidade se alterar? Enquadramento Teórico Todos os animais necessitam de condições ambientais favoráveis à sua sobrevivência e manutenção. Parâmetros como por exemplo a
INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA - INPA DIVISÃO DO CURSO DE PÓS-GRADUAÇÃO EM GENÉTICA, CONSERVAÇÃO E BIOLOGIA EVOLUTIVA DIGEN
 INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA - INPA DIVISÃO DO CURSO DE PÓS-GRADUAÇÃO EM GENÉTICA, CONSERVAÇÃO E BIOLOGIA EVOLUTIVA DIGEN ANÁLISES CROMOSSÔMICAS, CLÁSSICA E MOLECULAR, DE ESPÉCIES DE Farlowella
INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA - INPA DIVISÃO DO CURSO DE PÓS-GRADUAÇÃO EM GENÉTICA, CONSERVAÇÃO E BIOLOGIA EVOLUTIVA DIGEN ANÁLISES CROMOSSÔMICAS, CLÁSSICA E MOLECULAR, DE ESPÉCIES DE Farlowella
Alagoas. Tabela 1: Indicadores selecionados: mediana, 1º e 3º quartis nos municípios do estado de Alagoas (1991, 2000 e 2010)
 Alagoas Em, no estado de Alagoas (AL), moravam 3,1 milhões de pessoas, onde uma parcela considerável (6,%, 187,5 mil) tinha 65 ou mais anos de idade. O estado era composto de 12 municípios, dos quais 28
Alagoas Em, no estado de Alagoas (AL), moravam 3,1 milhões de pessoas, onde uma parcela considerável (6,%, 187,5 mil) tinha 65 ou mais anos de idade. O estado era composto de 12 municípios, dos quais 28
CARACTERIZAÇÃO DE DISTÚRBIOS ONDULATÓRIOS DE LESTE EM ALCÂNTARA: ESTUDO DE CASO
 CARACTERIZAÇÃO DE DISTÚRBIOS ONDLATÓRIOS DE LESTE EM ALCÂNTARA: ESTDO DE CASO Gunter de Azevedo Reschke (1); Gilberto Fisch (1) Núcleo Estadual de Meteorologia e Recursos Hídricos (NEMRH-MA) niversidade
CARACTERIZAÇÃO DE DISTÚRBIOS ONDLATÓRIOS DE LESTE EM ALCÂNTARA: ESTDO DE CASO Gunter de Azevedo Reschke (1); Gilberto Fisch (1) Núcleo Estadual de Meteorologia e Recursos Hídricos (NEMRH-MA) niversidade
