Estado Físico Características Macroscópicas Características Microscópicas
|
|
|
- Pedro Canto Lemos
- 6 Há anos
- Visualizações:
Transcrição
1 Sistemas materiais
2 Estados de agregação Estado Físico Características Macroscópicas Características Microscópicas Sólido forma e volume constantes. partículas com arranjo característico; formam estruturas geométricas; estão fixas. Líquido forma variável e volume constante. partículas sem ordenação e com algum movimento. Gasoso Forma e volume variáveis. grandes espaços entre as partículas que possuem movimento permanente e desordenado.
3 Curvas de aquecimento T ( O C) SUBSTÂNCIA PURA T ( O C) MISTURA HOMOGÊNEA t (min) t (min) T ( O C) MISTURA EUTÉTICA T ( O C) MISTURA AZEOTRÓPICA t (min) t (min)
4 Exemplo (UFSM) Observe o gráfico e assinale verdadeira (V) ou falsa (F) em cada afirmativa a seguir. ( ) O gráfico representa a curva de aquecimento de uma mistura eutética. ( ) A temperatura de fusão do sistema é variável. ( ) O sistema tem mais de uma fase no instante t 3. ( ) A temperatura de ebulição do sistema é constante. A seqüência correta é a) F -V -V-V. b) F -V-F-F. c) V -F -F-V. d) V -F-V-V. xe) V- F - V - F.
5 SUBSTÂNCIAS QUÍMICAS Reações químicas puras Simples átomos iguais Composta 2 ou +elementos homogênea misturas heterogênea Síntese: 2 ou + R um só P Análise: um só R 2 ou + R Simples Troca: A + XY X + AY Dupla Troca: AB + XY XB + AY Propriedades físicas constantes S + S fusão fracionada S + L evaporação = cristalização destilação simples L + L destilação fracionada G + G liquefação seguida de destilação fracionada S + S densidade: ventilação e levigação tamanho: peneiração ou tamisação atração por imã: imantização solubilidade: dissolução fracionada S + L e S + G densidade: decantação solubilidade: filtração L + L Funil ou pêra de decantação
6 Alotropia OXIGÊNIO CARBONO Gás oxigênio ozônio ENXOFRE FÓSFORO rômbico monoclínico branco vermelho
7 Fenômenos FÍSICO: muda a forma, não altera a fórmula. QUÍMICO: há formação de novas substâncias. 4 Fe + 3 O 2 2 Fe 2 O 3 combustão Comp.Orgânico + O 2 CO 2 + H 2 O
8 VENTILAÇÃO e LEVIGAÇÃO VENTILAÇÃO: corrente de ar desloca o sólido menos denso. LEVIGAÇÃO: corrente de água desloca o sólido menos denso. arroz + casca baseado na diferença de densidade
9 TAMISAÇÃO ou PENEIRAÇÃO tamises baseado na diferença de tamanho dos grãos
10 IMANTIZAÇÃO ou SEPARAÇÃO MAGNÉTICA Um dos sólidos deve ser atraído por um ímã: -Ferro -Cobalto -Níquel
11 DISSOLUÇÃO FRACIONADA 1) Adição de solvente deve solubilizar apenas um dos sólidoss 2) Filtração do sólido s insolúvel; 3) Evaporação do solvente; areia + H 2 O filtrar evaporar areia + NaCl areia + solução aquosa de NaCl solução aquosa de NaCl NaCl
12 DECANTAÇÃO baseado na diferença de densidade
13 FILTRAÇÃO baseado na diferença de solubilidade
14 baseado na diferença de densidade entre os líquidos DECANTAÇÃO
15 MISTURAS HOMOGÊNEAS SÓLIDO + SÓLIDO fusão fracionada ligas metálicas ouro 18 K 75% Au 25% Cu + Ag
16 Cristalização fracionada Processo utilizado na separação de sólidos s dissolvidos em um líquido. l Baseia-se na diferença a dos pontos de cristalização dos componentes da mistura. Através s do aquecimento do líquido l os sólidos s cristalizam separadamente. MgSO 4 + NaCl + H 2 O 1) Evaporação; 2) Precipitação;
17 DESTILAÇÃO SIMPLES baseado na diferença de ponto de ebulição entre o sólido e o líquido usado quando se deseja o líquido
18 LÍQUIDO + LÍQUIDO destilação fracionada
19 Destilação do petróleo
20 Liquefação fracionada Processo utilizado na separação de gases. Baseia-se na diferença a dos pontos de ebulição dos componentes da mistura. Através s do abaixamento da temperatura os gases são liquefeitos e separados. Ar atmosférico 1) Liquefação; 2) Destilação Fracionada;
21 Propriedades Coligativas
22 Conceitos Fundamentais 1) PRESSÃO DE VAPOR (PV) é a pressão que as moléculas de um líquido exercem sobre a sua superfície a fim de escapar. Quanto maior PV mais volátil é o líquido (mais fácil evapora).
23 DIAGRAMA DE FASES 2) DIAGRAMA DE FASES DE UMA SUBSTÂNCIA PURA- indica o estado físico da substância em cada valor de temperatura e pressão. PONTO TRÍPLICE: S + L + G
24 H 2 O
25 EBULIÇÃO 3) QUANDO UMA SUBSTÂNCIA PURA ENTRA EM EBULIÇÃO na temperatura na qual sua pressão de vapor fica igual à pressão atmosférica. Exemplo: ebulição da água em Porto Alegre:100ºC e em Gramado: 98ºC.
26 Propriedades Coligativas 1- TONOSCOPIA: Pv 20ºC Água pura Pv = 36 mmhg Água do mar Pv < 36 mmhg 2- EBULIOSCOPIA: TE 760 mmhg Água pura TE = 100ºC Água do mar TE > 100ºC
27 3- CRIOSCOPIA: TC Água pura TC = 0ºC Água do mar TC < 0ºC A água pura congela a 0ºC. A adição de sal baixa a temperatura de congelamento: uma solução com 10% de sal congela a -6ºC, e uma solução com 20% de sal congela a -16ºC.
28 OSMOSE 4- OSMOSCOPIA: π OSMOSE - É a diluição de uma solução concentrada, através de uma membrana semipermeável, em relação a outra solução diluída ou à água pura.
29 OSMOSE Exemplos de osmose: charque, adaptação de peixes, sucos de frutas e verduras temperadas, etc.
30 EFEITO COLIGATIVO M concentração em i nº de íons mol L
31 EFEITO COLIGATIVO DIAGRAMA DE FASES x PROPRIEDADES COLIGATIVAS
32 Termoquímica
33 ΔH REAÇÃO ENDOTÉRMICA REAÇÃO EXOTÉRMICA - absorve calor - libera calor -HP > HR - HP < HR - ΔH > 0 -ΔH < 0
34 EXOTÉRMICA H 2(g) + Cl 2(g) 2 HCl (g) + 184,9 kj (25ºC, 1 atm) H 2(g) + Cl 2(g) 2 HCl (g), ΔH = -184,9 kj (25ºC, 1 atm)
35 ENDOTÉRMICA H 2(g) + I 2(g) + 51,8 kj 2 HI (g) (25ºC, 1 atm) H 2(g) + I 2(g) 2 HI (g) ΔH = + 51,8 kj (25ºC, 1 atm)
36 ESTADO FÍSICO X ΔH
37 ENTALPIAS DE REAÇÃO CALOR FORMAÇÃO COMBUSTÃO DISSOLUÇÃO NEUTRALIZAÇÃO ΔH ENDO OU EXO EXO ENDO OU EXO EXO água como identificar substâncias simples 1 mol de produto 1 mol Composto Orgânico + O 2 CO 2 + H 2 O CA C + + A - solvatação de íons Ácido + Base Sal + 1 mol de água LIGAÇÃO QUEBRA = ENDO X 2 + calor 2 X FORMAÇÃO = EXO 2 Y Y 2 + calor ENERGIA DE IONIZAÇÃO ENDO X + calor X e AFINIDADE ELETRÔNICA EXO X + 1 e X + calor
38 CÁLCULO DO ΔH a partir dos calores de formação (ΔHf) usar: ΔH = HP HR 168) A quantidade de calor em kcal formado pela combustão de 221,0g de etino, a 25 C, conhecendo-se as entalpias (ΔH) de formação do CO 2 (g), H 2 O(l) e etino (g), é aproximadamente igual: Dados: ΔH (f) CO 2 (g) = 94,10 kcal/mol H 2 O(l) = 68,30 kcal/mol C 2 H 2 (g) = +54,20 kcal/mol a) 2640,95 kcal b) 1320,47 kcal c) 880,31 kcal d) 660,23 kcal e) 528,19 kcal x C 2 H 2 + 3/2 O 2 2 CO 2 + H 2 O +54, ( 94,1) + ( 68,3) H R = +54,2 H P = 256,5 ΔH = 310,7 kcal/mol 26 g 310,7 kcal 221 g x x = 2640 kcal
39 a partir dos calores de ligação NÃO usar: ΔH = HP HR REAGENTE = QUEBRA LIGAÇÕES = + (endo) PRODUTO = FORMA LIGAÇÕES = (exo) 169) A variação de entalpia para a reação, dada pela equação: 4 HCl (g) + O 2 (g) 2H 2 O(g) + 2 Cl 2 (g) é: Dados: (Energia de ligação em kcal/mol) H Cl 103,1 H O 110,6 O = O 119,1 Cl Cl 57,9 A) ,2 kcal B) 467,4 kcal xc) 26,7 kcal D) +911,8 kcal E) 114,8 kcal 4(103,1) + 119,1 4( 110,6) + 2( 57,9) + 531,5 558,2 26,7 kcal
40 a partir da soma de reações : Lei de Hess 172) Em um conversor catalítico, usado em veículos automotores em seu cano de escape, para reduzir a poluição atmosférica, ocorrem várias reações químicas, sendo que uma das mais importantes é: CO(g) + 1/2 O 2 (g) CO 2 (g) Sabendo-se que as entalpias das reações citadas a seguir são: C(grafite) + 1/2 O 2 (g) CO(g) C(grafite) + O 2 (g) CO 2 (g) pode-se afirmar que a reação inicial é: A) exotérmica e absorve 67,7 kcal/mol. B) exotérmica e libera 120,5 kcal/mol. C) x exotérmica e libera 67,7 kcal/mol. D) endotérmica e absorve 120,5 kcal/mol. E) endotérmica e absorve 67,7 kcal/mol. ΔH = 26,4 kcal ΔH = 94,1 kcal inverter manter +26,4 94,1 67,7
41 LEI DE HESS A variação de entalpia, ou seja, quantidade de calor liberada ou absorvida por um processo só depende do estado inicial e final do processo não dependendo das etapas intermediárias. C (grafite) + O 2 (g) ΔH 1 CO 2 (g) ΔH 2 ΔH 3 CO (g) + ½ O 2 (g) ΔH 1 = ΔH 2 + ΔH 3
SIMPLES SUBSTÂNCIA PURA COMPOSTA HOMOGÊNEO MISTURA HOMOGÊNEA SISTEMA SUBSTÂNCIA PURA HETEROGÊNEO MISTURA HETEROGÊNEA
 Sistemas materiais HOMOGÊNEO SUBSTÂNCIA PURA? SIMPLES MISTURA HOMOGÊNEA? COMPOSTA SISTEMA? HETEROGÊNEO SUBSTÂNCIA PURA MISTURA HETEROGÊNEA Sistema É parte do universo físico que contenha ou não matéria,
Sistemas materiais HOMOGÊNEO SUBSTÂNCIA PURA? SIMPLES MISTURA HOMOGÊNEA? COMPOSTA SISTEMA? HETEROGÊNEO SUBSTÂNCIA PURA MISTURA HETEROGÊNEA Sistema É parte do universo físico que contenha ou não matéria,
- SOLUÇÃO = SOLUTO + SOLVENTE. COEFICIENTE DE SOLUBILIDADE ( Cs) Grandeza que depende da natureza do soluto e da temperatura.
 Soluções - MISTURA HOMOGÊNEA - SOLUÇÃO = SOLUTO + SOLVENTE menor quantidade maior quantidade COEFICIENTE DE SOLUBILIDADE ( Cs) Grandeza que depende da natureza do soluto e da temperatura. Cs = g de soluto
Soluções - MISTURA HOMOGÊNEA - SOLUÇÃO = SOLUTO + SOLVENTE menor quantidade maior quantidade COEFICIENTE DE SOLUBILIDADE ( Cs) Grandeza que depende da natureza do soluto e da temperatura. Cs = g de soluto
Processos de Separação Misturas Para misturas Heterogêneas
 Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Processos de Separação Misturas Para misturas Heterogêneas
 Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK
 PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK Substância Pura: Um único tipo de substância Simples: formada por átomos de um único elemento. Composta: formada por átomos de mais de um elemento.
PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK Substância Pura: Um único tipo de substância Simples: formada por átomos de um único elemento. Composta: formada por átomos de mais de um elemento.
Professor Armando J. De Azevedo
 Professor Armando J. De Azevedo Química Professor Armando J. De Azevedo WWW.quimicarmando.com REAÇÃO DE ADIÇÃO As reações de adição são aquelas onde um átomo proveniente de uma substância orgânica ou inorgânica
Professor Armando J. De Azevedo Química Professor Armando J. De Azevedo WWW.quimicarmando.com REAÇÃO DE ADIÇÃO As reações de adição são aquelas onde um átomo proveniente de uma substância orgânica ou inorgânica
Química Monitores: Luciana Lima e Rafael França 06, 07, 08 e 11/07/2015. Material de Apoio para Monitoria
 Termoquímica II 1.. (BRASÍLIA) A energia de ligação média para a ligação C H no metano CH4(g) é aproximadamente: Dados: ΔHf 0 (entalpia de formação-padrão) CH4(g) = -17,9 kcal/mol H(g) = +52,1 kcal/mol
Termoquímica II 1.. (BRASÍLIA) A energia de ligação média para a ligação C H no metano CH4(g) é aproximadamente: Dados: ΔHf 0 (entalpia de formação-padrão) CH4(g) = -17,9 kcal/mol H(g) = +52,1 kcal/mol
PROFESSOR: EQUIPE DE QUÍMICA
 PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 2 ============================================================================================= Termoquímica
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 2 ============================================================================================= Termoquímica
Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria.
 O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES PROBLEMA HIPÓTESE(S) EXPERIMENTOS CONCLUSÕES CIÊNCIA:
O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES PROBLEMA HIPÓTESE(S) EXPERIMENTOS CONCLUSÕES CIÊNCIA:
Apostila de Química 02 Termoquímica
 Apostila de Química 02 Termoquímica 1.0 Introdução A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas; Não há reação química que ocorra sem variação de
Apostila de Química 02 Termoquímica 1.0 Introdução A Termoquímica tem como objetivo o estudo das variações de energia que acompanham as reações químicas; Não há reação química que ocorra sem variação de
Apostila de Química 12 A Matéria
 Apostila de Química 12 A Matéria 1.0 Átomo x Elemento Átomo é uma partícula fundamental que compõe toda a matéria. Elemento químico é um conjunto de átomos quimicamente iguais (com o mesmo número atômico).
Apostila de Química 12 A Matéria 1.0 Átomo x Elemento Átomo é uma partícula fundamental que compõe toda a matéria. Elemento químico é um conjunto de átomos quimicamente iguais (com o mesmo número atômico).
26/08/15 SUBSTÂNCIAS E MISTURAS. Prof. Ms. Mayanderson (Xuxu)
 SUBSTÂNCIAS E MISTURAS FENÔMENO FÍSICO: Não altera estrutura íntima da matéria. Exemplos: rasgar papel; derreter gelo (qualquer mudança de estado Físico); passagem de corrente elétrica por um Fio de cobre;
SUBSTÂNCIAS E MISTURAS FENÔMENO FÍSICO: Não altera estrutura íntima da matéria. Exemplos: rasgar papel; derreter gelo (qualquer mudança de estado Físico); passagem de corrente elétrica por um Fio de cobre;
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas:
 Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos.
 Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos. 1. Dados os potenciais de oxi-redução a seguir, Ag + 1e Ï Ag Fe + 2e Ï Fe Ag + 3e Ï Al Cu + 2e Ï Cu E = +0,80V E = -0,44V
Na(s) questão(ões) a seguir, escreva no espaço apropriado a soma dos itens corretos. 1. Dados os potenciais de oxi-redução a seguir, Ag + 1e Ï Ag Fe + 2e Ï Fe Ag + 3e Ï Al Cu + 2e Ï Cu E = +0,80V E = -0,44V
TERMOQUÍMICA EXERCÍCIOS PARA TREINO
 TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
TERMOQUÍMICA EXERCÍCIOS PARA TREINO 1 - Considere a seguinte reação termoquímica: 2NO(g) + O 2 (g) 2NO 2 (g) H = -13,5 kcal / mol de NO e assinale a alternativa falsa. a) A reação é exotérmica. b) São
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica
 Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
Lista de Exercícios Lei de Hess, Cinética Química e Equilíbrio Químico Prof. Benfica 1) A entalpia da reação (I) não pode ser medida diretamente em um calorímetro porque a reação de carbono com excesso
O Que é Química? Pra que serve a Química?²
 O Que é Química? Ciência que estuda as propriedades das substâncias e as leis que regem as suas combinações e decomposições ¹ Pra que serve a Química?² 1 Dicionário Michaelis 2 Figuras retiradas da Web
O Que é Química? Ciência que estuda as propriedades das substâncias e as leis que regem as suas combinações e decomposições ¹ Pra que serve a Química?² 1 Dicionário Michaelis 2 Figuras retiradas da Web
Sistemas, Substâncias puras e Misturas Separação de Misturas
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
Prof. Msc. João Neto 2
 Prof. Msc João Neto Prof. Msc. João Neto 2 Temperatura de Ebulição Concentração Temperatura de Fusão Osmos e Pressão Máxima M de Vapor (PMV) Prof. Msc. João Neto 3 Menor Concentração Maior Volatilidade
Prof. Msc João Neto Prof. Msc. João Neto 2 Temperatura de Ebulição Concentração Temperatura de Fusão Osmos e Pressão Máxima M de Vapor (PMV) Prof. Msc. João Neto 3 Menor Concentração Maior Volatilidade
QUÍMICA. Transformações Químicas e Energia. Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 5
 QUÍMICA Transformações Químicas e Energia Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 5 Prof ª. Giselle Blois Casos particulares das entalpias das reações
QUÍMICA Transformações Químicas e Energia Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 5 Prof ª. Giselle Blois Casos particulares das entalpias das reações
T.D. de Química 28/03/2015. Prof. Victor Henrique
 T.D. de Química 28/03/2015 Prof. Victor Henrique 01) Qual é a molalidade de uma solução que contém 34,2 g de sacarose, C 12 H 22 O 11, dissolvidos em 200 g de água? Dados: C = 12; H = 1; O = 16 a) 0,1
T.D. de Química 28/03/2015 Prof. Victor Henrique 01) Qual é a molalidade de uma solução que contém 34,2 g de sacarose, C 12 H 22 O 11, dissolvidos em 200 g de água? Dados: C = 12; H = 1; O = 16 a) 0,1
SEPARAÇÃO DE MISTURAS
 SEPARAÇÃO DE MISTURAS Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias. Água do mar Não apresenta muita utilidade H 2 O NaCl Apresentam inúmeras aplicações
SEPARAÇÃO DE MISTURAS Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias. Água do mar Não apresenta muita utilidade H 2 O NaCl Apresentam inúmeras aplicações
SUBSTÂNCIAS PURAS, MISTURAS E SEPARAÇÃO DE MISTURAS.
 SUBSTÂNCIAS PURAS, MISTURAS E SEPARAÇÃO DE MISTURAS. CAPÍTULOS 6 E 7 Prof.ª Tatiana Lima Substâncias Puras * Conceito Toda matéria cuja fusão e ebulição ocorrem a uma temperatura constante. SIMPLES * Tipos
SUBSTÂNCIAS PURAS, MISTURAS E SEPARAÇÃO DE MISTURAS. CAPÍTULOS 6 E 7 Prof.ª Tatiana Lima Substâncias Puras * Conceito Toda matéria cuja fusão e ebulição ocorrem a uma temperatura constante. SIMPLES * Tipos
Termoquímica: calor e os processos químicos. Profa. Claudia
 Termoquímica: calor e os processos químicos Profa. Claudia Termoquímica: 1)calor e unidades para expressá-lo 2)Entalpia e variação de entalpia 3)A lei de Hess 4)Estado-padrão 5)Entalpia padrão de combustão
Termoquímica: calor e os processos químicos Profa. Claudia Termoquímica: 1)calor e unidades para expressá-lo 2)Entalpia e variação de entalpia 3)A lei de Hess 4)Estado-padrão 5)Entalpia padrão de combustão
Um dos grandes problemas mundiais é constante necessidade de geração de energia.
 Termoquímica 1 2 Introdução Um dos grandes problemas mundiais é constante necessidade de geração de energia. A Termoquímica possibilita uma solução viável (econômica e ecológica) para esta crescente demanda.
Termoquímica 1 2 Introdução Um dos grandes problemas mundiais é constante necessidade de geração de energia. A Termoquímica possibilita uma solução viável (econômica e ecológica) para esta crescente demanda.
PROCESSOS DE SEPARAÇÃO. Prof. Ms. George Verçoza
 PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
Universidade Federal do Acre Engenharia Agronômica PET- Programa de Ensino Tutorial. Termoquímica
 Universidade Federal do Acre Engenharia Agronômica PET- Programa de Ensino Tutorial Termoquímica Bolsista: Joyce de Q. Barbosa Tutor: Dr. José Ribamar Silva Termodinâmica Conceitos Básicos Termoquímica
Universidade Federal do Acre Engenharia Agronômica PET- Programa de Ensino Tutorial Termoquímica Bolsista: Joyce de Q. Barbosa Tutor: Dr. José Ribamar Silva Termodinâmica Conceitos Básicos Termoquímica
Sistemas, Substâncias puras e Misturas Separação de Misturas
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
Colégio Estadual Professor Ernesto Faria. Subprojeto Pibid - Química UERJ. Termoquímica
 Colégio Estadual Professor Ernesto Faria Subprojeto Pibid - Química UERJ Termoquímica REAÇÕES ENDOTÉRMICAS E EXOTÉRMICAS Processo Exotérmico Libera calor para ambiente (vizinhança) Transmite sensação de
Colégio Estadual Professor Ernesto Faria Subprojeto Pibid - Química UERJ Termoquímica REAÇÕES ENDOTÉRMICAS E EXOTÉRMICAS Processo Exotérmico Libera calor para ambiente (vizinhança) Transmite sensação de
Propriedades Coligativas
 Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Química B Extensivo V. 2
 Extensivo V. 2 Resolva Aula 5 5.01) A 5.02) C 5.03) Colocar água para separar o salitre e decantar ou filtrar. Depois pôr sulfeto de carbono no sólido restante para retirar o enxofre. que sobra é o carvão.
Extensivo V. 2 Resolva Aula 5 5.01) A 5.02) C 5.03) Colocar água para separar o salitre e decantar ou filtrar. Depois pôr sulfeto de carbono no sólido restante para retirar o enxofre. que sobra é o carvão.
QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES. Prof a. Giselle Blois. Estudo da matéria: substâncias, misturas, processos de separação Parte 2
 QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES Estudo da matéria: substâncias, misturas, Parte 2 Prof a. Giselle Blois Métodos de separação de misturas: O método empregado vai depender da mistura, já que esta
QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES Estudo da matéria: substâncias, misturas, Parte 2 Prof a. Giselle Blois Métodos de separação de misturas: O método empregado vai depender da mistura, já que esta
Exercícios Métodos de Separação. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017
 Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
PROCESSOS DE SEPARAÇÃO. Jeosafá Lima
 PROCESSOS DE SEPARAÇÃO Jeosafá Lima Misturas homogêneas e heterogêneas Uma mistura é constituída por duas ou mais substâncias, sejam elas simples ou compostas. https://www.youtube.com/watch?v=6jcxdhovkcm
PROCESSOS DE SEPARAÇÃO Jeosafá Lima Misturas homogêneas e heterogêneas Uma mistura é constituída por duas ou mais substâncias, sejam elas simples ou compostas. https://www.youtube.com/watch?v=6jcxdhovkcm
TERMOQUÍMICA. 1 Fenômenos endotérmicos e exotérmicos
 TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
TERMOQUÍMICA 1 Fenômenos endotérmicos e exotérmicos a) Processos exotérmicos: Ocorrem com liberação de calor. Possuem variação de entalpia ( H) negativa. Ex: Combustão do metano (CH4) CH4 (g) + 2 O2 (g)
SOLUÇÃO PRATIQUE EM CASA
 SOLUÇÃO PC1. Incorreta. Seria pura se apresentasse apenas moléculas de água em sua composição, porém, a água potável apresenta diversos tipos de sais dissolvidos. Correta. A água do mar pode se tornar
SOLUÇÃO PC1. Incorreta. Seria pura se apresentasse apenas moléculas de água em sua composição, porém, a água potável apresenta diversos tipos de sais dissolvidos. Correta. A água do mar pode se tornar
QUÍMICA. Transformações Químicas e Energia. Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 3
 QUÍMICA Transformações Químicas e Energia Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 3 Prof ª. Giselle Blois Fatores que influenciam nas entalpias das reações:
QUÍMICA Transformações Químicas e Energia Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 3 Prof ª. Giselle Blois Fatores que influenciam nas entalpias das reações:
Química C Extensivo V. 1
 Extensivo V. 1 Resolva Aula 1 1.01) C Reação exotérmica liberação de calor H p < H r ΔH = 1.0) E Reação exotérmica liberação de calor diminuição de energia H r > H p ΔH = 1.0) C éter (L) T éter (V) absorve
Extensivo V. 1 Resolva Aula 1 1.01) C Reação exotérmica liberação de calor H p < H r ΔH = 1.0) E Reação exotérmica liberação de calor diminuição de energia H r > H p ΔH = 1.0) C éter (L) T éter (V) absorve
Aluno(a): nº: Turma: Data: / /2016. Matéria: Química Valor: 15,0
 Aluno(a): nº: Turma: Nota Ano: 2º Ano EM Data: / /2016 Trabalho Recuperação Professor(a): Willian Novato Matéria: Química Valor: 15,0 PARA TODAS AS QUESTÕES, AS RESPOSTAS DEVERÃO CONSTAR DE RACIOCÍNIO
Aluno(a): nº: Turma: Nota Ano: 2º Ano EM Data: / /2016 Trabalho Recuperação Professor(a): Willian Novato Matéria: Química Valor: 15,0 PARA TODAS AS QUESTÕES, AS RESPOSTAS DEVERÃO CONSTAR DE RACIOCÍNIO
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017
 ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 1º ano Nome Nº Turma Data 15/12 Nota 08 Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 01) Na química temos
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 1º ano Nome Nº Turma Data 15/12 Nota 08 Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 01) Na química temos
TERMOQUÍMICA. Maira Gazzi Manfro e Giseli Menegat
 TERMOQUÍMICA Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br O QUE É? TERMOQUÍMICA: é a parte da físico-química que estuda o calor envolvido nas reações
TERMOQUÍMICA Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br O QUE É? TERMOQUÍMICA: é a parte da físico-química que estuda o calor envolvido nas reações
QUÍMICA PROF. AMANDA THOMÉ
 QUÍMICA PROF. AMANDA THOMÉ // QUESTÃO 01 A natureza apresenta grande diversidade de materiais. É preciso analisar a composição e as propriedades desses materiais para que eles possam ser utilizados ou
QUÍMICA PROF. AMANDA THOMÉ // QUESTÃO 01 A natureza apresenta grande diversidade de materiais. É preciso analisar a composição e as propriedades desses materiais para que eles possam ser utilizados ou
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROFESSOR: JOÃO MEDEIROS
 COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: JOÃO MEDEIROS 2012 Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias.
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: JOÃO MEDEIROS 2012 Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias.
TERMOQUÍMICA- 3C13. As transformações físicas também são acompanhadas de calor, como ocorre na mudanda de estados físicos da matéria.
 TERMOQUÍMICA- 3C13 As transformações físicas e as reações químicas quase sempre estão envolvidas em perda ou ganho de calor. O calor é uma das formas de energia mais comum que se conhece. A Termoquimica
TERMOQUÍMICA- 3C13 As transformações físicas e as reações químicas quase sempre estão envolvidas em perda ou ganho de calor. O calor é uma das formas de energia mais comum que se conhece. A Termoquimica
Prof. José Valter SEPARAÇÃO DE MISTURAS
 1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
QUÍMICA. Transformações Químicas e Energia. Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 6
 QUÍMICA Transformações Químicas e Energia Entalpia, Equações e Lei de Hess - Parte 6 Prof ª. Giselle Blois Como ocorrem as reações químicas? - Afinidade química entre os reagentes; - Contato efetivo entre
QUÍMICA Transformações Químicas e Energia Entalpia, Equações e Lei de Hess - Parte 6 Prof ª. Giselle Blois Como ocorrem as reações químicas? - Afinidade química entre os reagentes; - Contato efetivo entre
Química C Semiextensivo V. 2
 Semiextensivo V. 2 Exercícios 01) B 04) E 02) D A diluição representa a diminuição da concentração da solução, por acréscimo de solvente no caso da solução em questão, a água. M = 1 mol/l V =? M = 0,2
Semiextensivo V. 2 Exercícios 01) B 04) E 02) D A diluição representa a diminuição da concentração da solução, por acréscimo de solvente no caso da solução em questão, a água. M = 1 mol/l V =? M = 0,2
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROFESSOR: JOÃO MEDEIROS
 COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) ESTADOS FÍSICOS E CLASSIFICAÇÃO DA MATÉRIA PROFESSOR: JOÃO MEDEIROS 2012 Matéria Formada por s tipos de átomos Elementos químicos que se diferenciam pelo Z Elemento
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) ESTADOS FÍSICOS E CLASSIFICAÇÃO DA MATÉRIA PROFESSOR: JOÃO MEDEIROS 2012 Matéria Formada por s tipos de átomos Elementos químicos que se diferenciam pelo Z Elemento
a) C 3 H 8 (g) 3C graf. + 4 H 2(g) C 3 H 8(g) b) C 2 H 6 O(l) 2C graf. + 3 H 2(g) + 1/2 O 2(g) C 2 H 6 O (l) c) Na 2 SO 4 (s)
 setor 30 300408 Aula 3 TERMOQUÍMICA. ENTALPIA DE FORMAÇÃO Estado Padrão = Estado físico e alotrópico mais estáveis em condição ambiente (5 C, atm). Substâncias Simples no Estado Padrão H FORM H FORM =
setor 30 300408 Aula 3 TERMOQUÍMICA. ENTALPIA DE FORMAÇÃO Estado Padrão = Estado físico e alotrópico mais estáveis em condição ambiente (5 C, atm). Substâncias Simples no Estado Padrão H FORM H FORM =
IX OSEQUIM - Olimpíada Sergipana de Química 2ª Etapa - Modalidade B
 Bom dia aluno! Está é a prova da segunda etapa da IX OSEQUIM, Olimpíada Sergipana de Química, modalidade B, para alunos que se encontram cursando o 2º. Ano do ensino médio em 2015. Confira se a sua prova
Bom dia aluno! Está é a prova da segunda etapa da IX OSEQUIM, Olimpíada Sergipana de Química, modalidade B, para alunos que se encontram cursando o 2º. Ano do ensino médio em 2015. Confira se a sua prova
02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a
![02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a 02)Numa reação endotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a](/thumbs/48/23999624.jpg) 01)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a variação de entalpia é [3] que zero. Completa-se corretamente essa frase substituindo-se
01)Numa reação exotérmica, há [1] de calor, a entalpia final (produtos) é [2] que a entalpia inicial (reagentes) e a variação de entalpia é [3] que zero. Completa-se corretamente essa frase substituindo-se
PROPRIEDADES COLIGATIVAS
 PROPRIEDADES COLIGATIVAS Prof. Gabriel P. Machado DEFINIÇÃO: Propriedades coligativas (ou efeitos coligativos) são alterações nas propriedades físicas de um solvente devido à adição de um soluto. As propriedades
PROPRIEDADES COLIGATIVAS Prof. Gabriel P. Machado DEFINIÇÃO: Propriedades coligativas (ou efeitos coligativos) são alterações nas propriedades físicas de um solvente devido à adição de um soluto. As propriedades
CIAS LIO TÂNC CIAN. Prof. Msc João Neto 2
 Prof. Msc João Neto 2 DIFERENC CIAN DO SUBS TÂNC CIAS DE MISTURA AS COM AUXÍL LIO DAS CURVAS DE AQ QUEC CIME ENTO Prof. Msc João Neto 3 1 L 0,4 mol 0,1L x x 0, 04mol 0,0404 mol 100mL solução / L 900mL
Prof. Msc João Neto 2 DIFERENC CIAN DO SUBS TÂNC CIAS DE MISTURA AS COM AUXÍL LIO DAS CURVAS DE AQ QUEC CIME ENTO Prof. Msc João Neto 3 1 L 0,4 mol 0,1L x x 0, 04mol 0,0404 mol 100mL solução / L 900mL
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM)
 NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
NOME: ANO: 2º ENSINO: MÉDIO TURMA: DATA: / / PROF(ª).: Luciano Raposo Freitas EXERCÍCIOS TERMOQUÍMICA QUÍMICA II (2º BIM) 1. Nos motores de explosão existentes hoje em dia utiliza-se uma mistura de gasolina
QUÍMICA. Soluções e Substâncias Inorgânicas. Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica - Parte 6
 QUÍMICA Soluções e Substâncias Inorgânicas Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica - Parte 6 Prof ª. Giselle Blois Como já vimos, a osmoscopia é a propriedade
QUÍMICA Soluções e Substâncias Inorgânicas Propriedades Coligativas: Tonoscopia, Ebulioscopia, Crioscopia e Pressão Osmótica - Parte 6 Prof ª. Giselle Blois Como já vimos, a osmoscopia é a propriedade
RECUPERAÇÃO SEMESTRAL (RS) PROJETO DE RECUPERAÇÃO
 6 anos ETAPA Rec Final 2017 RECUPERAÇÃO SEMESTRAL (RS) PROJETO DE RECUPERAÇÃO DISCIPLINA PROFESSOR CONTEÚDOS QUÍMICA Claudia Figueiredo Apostila 5 Substâncias puras e misturas. Apostila 6,7 e 8 Separação
6 anos ETAPA Rec Final 2017 RECUPERAÇÃO SEMESTRAL (RS) PROJETO DE RECUPERAÇÃO DISCIPLINA PROFESSOR CONTEÚDOS QUÍMICA Claudia Figueiredo Apostila 5 Substâncias puras e misturas. Apostila 6,7 e 8 Separação
PROCESSOS DE SEPARAÇÃO. Professor Cassio Pacheco
 PROCESSOS DE SEPARAÇÃO Professor Cassio Pacheco SEPARAÇÃO DE MISTURAS HETEROGÊNEAS (Processos mecânicos de separação) Sistema sólido - sólido Separação magnética: Separa misturas do tipo sólido-sólido
PROCESSOS DE SEPARAÇÃO Professor Cassio Pacheco SEPARAÇÃO DE MISTURAS HETEROGÊNEAS (Processos mecânicos de separação) Sistema sólido - sólido Separação magnética: Separa misturas do tipo sólido-sólido
Substâncias e Misturas
 ESTADO DE SANTA CATARINA EEB DR JORGE LACERDA Substâncias e Misturas Profª Luiza P. R. Martins Química 1º ano Estados físicos (de agregação) da matéria Vapor Características microscópicas 2 Ebulição, Vaporização
ESTADO DE SANTA CATARINA EEB DR JORGE LACERDA Substâncias e Misturas Profª Luiza P. R. Martins Química 1º ano Estados físicos (de agregação) da matéria Vapor Características microscópicas 2 Ebulição, Vaporização
LOUCOS POR QUÍMICA. PROF. Neif Nagib
 LOUCOS POR QUÍMICA PROF. Neif Nagib SEPARAÇÃO DE MISTURAS Prof. Neif Nagib CATAÇÃO É um método rudimentar baseado na diferença de tamanho e aspecto das partículas de uma mistura de sólidos granulados.
LOUCOS POR QUÍMICA PROF. Neif Nagib SEPARAÇÃO DE MISTURAS Prof. Neif Nagib CATAÇÃO É um método rudimentar baseado na diferença de tamanho e aspecto das partículas de uma mistura de sólidos granulados.
PROFESSOR: EQUIPE DE QUÍMICA
 PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 4 ============================================================================================= Termoquímica
PROFESSOR: EQUIPE DE QUÍMICA BANCO DE QUESTÕES - QUÍMICA ORGÂNICA 2ª SÉRIE - ENSINO MÉDIO - PARTE 4 ============================================================================================= Termoquímica
LOGO. Classificação da matéria. Profa. Samara Garcia
 LOGO Classificação da matéria Profa. Samara Garcia Classificação da matéria Substância pura: matéria formada por unidades químicas iguais, sejam átomos ou moléculas, e assim apresentam propriedades químicas
LOGO Classificação da matéria Profa. Samara Garcia Classificação da matéria Substância pura: matéria formada por unidades químicas iguais, sejam átomos ou moléculas, e assim apresentam propriedades químicas
TERMOQUÍMICA. Prof. Neif Nagib.
 TERMOQUÍMICA Prof. Neif Nagib neifnagib@yahoo.com.br Os princípios fundamentais do calor e do trabalho se aplicam no estudo de uma reação química e nas mudanças do estado físico de uma substância. Nesses
TERMOQUÍMICA Prof. Neif Nagib neifnagib@yahoo.com.br Os princípios fundamentais do calor e do trabalho se aplicam no estudo de uma reação química e nas mudanças do estado físico de uma substância. Nesses
Propriedades Coligativas
 Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Propriedades Coligativas Propriedades Coligativas São propriedades que se somam pela presença de um ou mais solutos e dependem única e exclusivamente do número de partículas (moléculas ou íons) que estão
Química C Intensivo V. 1
 Química C Intensivo V 1 Exercícios 01) Ma = 10,8 u Massa calculada pela média ponderada: Ma = ( 10 0 ) + ( 11 80 ) 00 + 880 Ma = Ma = 10,8 u 0) 4,3 u 4 5 6 Mg Mg Mg 80 10 10 Ma = ( 4 80) + ( 5 10) + (
Química C Intensivo V 1 Exercícios 01) Ma = 10,8 u Massa calculada pela média ponderada: Ma = ( 10 0 ) + ( 11 80 ) 00 + 880 Ma = Ma = 10,8 u 0) 4,3 u 4 5 6 Mg Mg Mg 80 10 10 Ma = ( 4 80) + ( 5 10) + (
PROFª. KAÍZA CAVALCANTI
 Processos Químicos Quando ocorre uma alteração qualitativa do sistema, dos tipos de substâncias presentes ou de suas proporções. Processos Físicos Quando ocorre uma alteração qualitativa do sistema, dos
Processos Químicos Quando ocorre uma alteração qualitativa do sistema, dos tipos de substâncias presentes ou de suas proporções. Processos Físicos Quando ocorre uma alteração qualitativa do sistema, dos
Estados de agregação da matéria. Mudanças de estado. Fenômenos
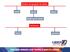 Estados de agregação da matéria sólido líquido gasoso Mudanças de estado Fenômenos físicos químicos Sistemas Interação Aspecto Composição aberto isolado substância mistura fechado homogêneo heterogêneo
Estados de agregação da matéria sólido líquido gasoso Mudanças de estado Fenômenos físicos químicos Sistemas Interação Aspecto Composição aberto isolado substância mistura fechado homogêneo heterogêneo
1. Estados físicos da matéria Mudanças de estado Substâncias puras Misturas 4 Exercícios Densidade 6 1.
 1. Estados físicos da matéria 3 1.1 Mudanças de estado 3 1.2 Substâncias puras 4 1.3 Misturas 4 Exercícios 5 1.4 Densidade 6 1.5 Transformação da matéria 6 1.6 Alotropia 6 1.7 Diagramas de fases 6 1.8
1. Estados físicos da matéria 3 1.1 Mudanças de estado 3 1.2 Substâncias puras 4 1.3 Misturas 4 Exercícios 5 1.4 Densidade 6 1.5 Transformação da matéria 6 1.6 Alotropia 6 1.7 Diagramas de fases 6 1.8
A Matéria. Profº André Montillo
 A Matéria Profº André Montillo www.montillo.com.br Substância: É a combinação de átomos de elementos diferentes em uma proporção de um número inteiro. O átomo não é criado e não é destruído, as diferentes
A Matéria Profº André Montillo www.montillo.com.br Substância: É a combinação de átomos de elementos diferentes em uma proporção de um número inteiro. O átomo não é criado e não é destruído, as diferentes
Disciplina: Química Data: 05 / 05 / Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo:
 Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
PROMILITARES 09/08/2018 QUÍMICA. Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS
 QUÍMICA Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS Conteúdos abordados na aula de hoje: 1. Matéria, corpo e objeto; 2. Energias; 3. Fenômenos; 4. Classificação da matéria. Matéria e suas transformações
QUÍMICA Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS Conteúdos abordados na aula de hoje: 1. Matéria, corpo e objeto; 2. Energias; 3. Fenômenos; 4. Classificação da matéria. Matéria e suas transformações
Observação Calor x Temperatura
 Prof. Jackson Alves Definição Parte da química que estuda a energia na forma de calor envolvido, seja nos processos químicos ou físicos. Observação Calor x Temperatura Instrumento de medição: Calorímetro
Prof. Jackson Alves Definição Parte da química que estuda a energia na forma de calor envolvido, seja nos processos químicos ou físicos. Observação Calor x Temperatura Instrumento de medição: Calorímetro
MÉTODOS DE SEPARAÇÃO DE MISTURAS. 9º ano
 MÉTODOS DE SEPARAÇÃO DE MISTURAS 9º ano Separações de Misturas são utilizadas para decompor misturas de substâncias em um sistema qualquer nos dois ou mais componentes originais. Podem ser para separar
MÉTODOS DE SEPARAÇÃO DE MISTURAS 9º ano Separações de Misturas são utilizadas para decompor misturas de substâncias em um sistema qualquer nos dois ou mais componentes originais. Podem ser para separar
H 2 (g) + ½ O 2 (g) H 2 O(l) H 2 (g) + ½ O 2 (g) H 2 O(g) 6 NH 3 (g) + 9 O 2 (g) 2 HNO 3 (g) + 4 NO(g) + 8 H 2 O(g).
 Química Frente IV Físico-Química Prof. Thiago Costa (Tchê) Lista de Exercícios Lei de Hess 1. (FGV) Em um conversor catalítico, usado em veículos automotores em seu cano de escape, para reduzir a poluição
Química Frente IV Físico-Química Prof. Thiago Costa (Tchê) Lista de Exercícios Lei de Hess 1. (FGV) Em um conversor catalítico, usado em veículos automotores em seu cano de escape, para reduzir a poluição
Termoquímica Entalpia e Lei de Hess
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Termoquímica Entalpia e Lei de Hess Sistemas a Pressão Constante Quando o volume do sistema não é constante,
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Termoquímica Entalpia e Lei de Hess Sistemas a Pressão Constante Quando o volume do sistema não é constante,
, é um líquido inflamável e, quando exposto ao oxigênio, pode explodir. A reação de combustão do pentaborano-9 segue representada pela equação:
 (Unimontes MG/2014) O pentaborano-9, B 5 H 9, é um líquido inflamável e, quando exposto ao oxigênio, pode explodir. A reação de combustão do pentaborano-9 segue representada pela equação: Utilizando os
(Unimontes MG/2014) O pentaborano-9, B 5 H 9, é um líquido inflamável e, quando exposto ao oxigênio, pode explodir. A reação de combustão do pentaborano-9 segue representada pela equação: Utilizando os
Secretaria de Estado da Educação e da Ciência e Tecnologia da Paraíba SEE-PB. Professor de Educação Básica 3 - Química AB118-19
 Secretaria de Estado da Educação e da Ciência e Tecnologia da Paraíba SEE-PB Professor de Educação Básica 3 - Química AB118-19 Todos os direitos autorais desta obra são protegidos pela Lei nº 9.610, de
Secretaria de Estado da Educação e da Ciência e Tecnologia da Paraíba SEE-PB Professor de Educação Básica 3 - Química AB118-19 Todos os direitos autorais desta obra são protegidos pela Lei nº 9.610, de
Conceitos importantes: a) Matéria : Tudo o que possui massa e ocupa lugar no espaço.
 SISTEMAS QUÍMICOS E SUAS TRANSFORMAÇÕES Prof. Ms. Mayanderson (Xuxu) QUÍMICA: A química estuda a natureza, as propriedades, a composição e as transformações da matéria. Ela está em nosso cotidiano e, ao
SISTEMAS QUÍMICOS E SUAS TRANSFORMAÇÕES Prof. Ms. Mayanderson (Xuxu) QUÍMICA: A química estuda a natureza, as propriedades, a composição e as transformações da matéria. Ela está em nosso cotidiano e, ao
Substâncias e Transformações
 Substâncias e Transformações PAESPE 2018 Aula: Mariany Fernandes O QUE É UM SISTEMA? É uma porção limitada do universo, considerada como um todo para efeito de estudo. Homogêneo Heterogêneo Homogêneo:
Substâncias e Transformações PAESPE 2018 Aula: Mariany Fernandes O QUE É UM SISTEMA? É uma porção limitada do universo, considerada como um todo para efeito de estudo. Homogêneo Heterogêneo Homogêneo:
Mistura de Soluções, Solubilidade e Propriedades Coligativas. Química 2/set
 Mistura de Soluções, Solubilidade e Propriedades Coligativas Química 2/set Mistura de Soluções 1 L 20 g/l 1 L 50 g/l 2L 70 g ou 35 g/l m a.v a + m b.v b = m f.v f m f = m a + m b Curvas de Solubilidade
Mistura de Soluções, Solubilidade e Propriedades Coligativas Química 2/set Mistura de Soluções 1 L 20 g/l 1 L 50 g/l 2L 70 g ou 35 g/l m a.v a + m b.v b = m f.v f m f = m a + m b Curvas de Solubilidade
QUÍMICA. Transformações Químicas e Energia. Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess - Parte 4
 QUÍMICA Transformações Químicas e Energia Entalpia, Equações e Lei de Hess - Parte 4 Prof ª. Giselle Blois Exercícios * Reação Irreversível: ocorre em apenas um único sentido. * Reação Reversível: ocorre,
QUÍMICA Transformações Químicas e Energia Entalpia, Equações e Lei de Hess - Parte 4 Prof ª. Giselle Blois Exercícios * Reação Irreversível: ocorre em apenas um único sentido. * Reação Reversível: ocorre,
Os sistemas podem armazenar energia e está pode ser transferida.
 AULA 13 Termoquímica A termoquímica é uma parte da físico-química que estuda as trocas de calor (entre os sistemas e o meio ambiente) que acompanha os fenômenos. Calor é uma energia em trânsito. Existem
AULA 13 Termoquímica A termoquímica é uma parte da físico-química que estuda as trocas de calor (entre os sistemas e o meio ambiente) que acompanha os fenômenos. Calor é uma energia em trânsito. Existem
Quase toda reação química é acompanhada de liberação ou absorção de calor (queima da gasolina, queima do etanol,
 TERMOQUÍMICA TERMOQUÍMICA Quase toda reação química é acompanhada de liberação ou absorção de calor (queima da gasolina, queima do etanol, queima do GLP). A termoquímica estuda as quantidades de calor
TERMOQUÍMICA TERMOQUÍMICA Quase toda reação química é acompanhada de liberação ou absorção de calor (queima da gasolina, queima do etanol, queima do GLP). A termoquímica estuda as quantidades de calor
01) (FESP-PE) Considere a equação:
 01) (FESP-PE) Considere a equação: 2 N 2O 5(g) 4 NO 2(g) + O 2(g) Admita que a formação de O2 tem uma velocidade média constante e igual a 0,05 mol/s. A massa de NO 2 formada em 1 min é: (Massas atômicas:
01) (FESP-PE) Considere a equação: 2 N 2O 5(g) 4 NO 2(g) + O 2(g) Admita que a formação de O2 tem uma velocidade média constante e igual a 0,05 mol/s. A massa de NO 2 formada em 1 min é: (Massas atômicas:
A Matéria. Profº André Montillo
 A Matéria Profº André Montillo www.montillo.com.br Substância: É a combinação de átomos de elementos diferentes em uma proporção de um número inteiro. O átomo não é criado e não é destruído, as diferentes
A Matéria Profº André Montillo www.montillo.com.br Substância: É a combinação de átomos de elementos diferentes em uma proporção de um número inteiro. O átomo não é criado e não é destruído, as diferentes
Obs.: foram analisadas 90 questões dos últimos cinco anos
 Conteúdo Nº de questões % Química ambiental 16 17,78 INORGÂNICA (Química Solucionada) Estequiometria 06 6,67% Cálculos químicos 01 1,11% Reações inorgânicas 05 5,55% Química elementar 07 7,78% Funções
Conteúdo Nº de questões % Química ambiental 16 17,78 INORGÂNICA (Química Solucionada) Estequiometria 06 6,67% Cálculos químicos 01 1,11% Reações inorgânicas 05 5,55% Química elementar 07 7,78% Funções
FÍSICA PROFº JAISON MATTEI
 FÍSICA PROFº JAISON MATTEI A MATÉRIA E SUAS TRANSFORMAÇÕES As mudanças de estado físico da água. Diagrama de mudanças de estado físico. 01. Um cientista recebeu uma substância desconhecida, no estado sólido,
FÍSICA PROFº JAISON MATTEI A MATÉRIA E SUAS TRANSFORMAÇÕES As mudanças de estado físico da água. Diagrama de mudanças de estado físico. 01. Um cientista recebeu uma substância desconhecida, no estado sólido,
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017
 ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 2º ano Nome Nº Turma Data 15/12 Nota Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 1. Um recipiente fechado
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 2º ano Nome Nº Turma Data 15/12 Nota Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 1. Um recipiente fechado
Com base nesses dados, calcule: a) Concentração em g/l. b) Título em massa.
 ALUNO(a): Nº: SÉRIE: ª TURMA: UNIDADE: VV JC JP PC DATA: / /06 Obs.: Esta lista deve ser entregue apenas ao professor no dia da aula de Recuperação Valor: 5,0. Uma solução contendo 4 g de cloreto de sódio
ALUNO(a): Nº: SÉRIE: ª TURMA: UNIDADE: VV JC JP PC DATA: / /06 Obs.: Esta lista deve ser entregue apenas ao professor no dia da aula de Recuperação Valor: 5,0. Uma solução contendo 4 g de cloreto de sódio
Termoquímica. Exercícios Complementares - Recuperação Paralela. Classe: 2 3 a série
 Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 3 a série QUÍMICA Termoquímica 1) (UFLA) Com base no conceito de entalpia de formação (H) e dado o diagrama de entalpia de formação
Ensino Médio Exercícios Complementares - Recuperação Paralela Classe: 2 3 a série QUÍMICA Termoquímica 1) (UFLA) Com base no conceito de entalpia de formação (H) e dado o diagrama de entalpia de formação
9 o EF. Jeosafá de P. Lima
 9 o EF QUÍMICA Estudo dirigido Jeosafá de P. Lima Todas 1- A combustão do gás de cozinha (gás butano) é representada pela equação química abaixo: C4H10 + 13 / 2 O2 4 CO2 + 5 H2O O número de substâncias
9 o EF QUÍMICA Estudo dirigido Jeosafá de P. Lima Todas 1- A combustão do gás de cozinha (gás butano) é representada pela equação química abaixo: C4H10 + 13 / 2 O2 4 CO2 + 5 H2O O número de substâncias
Métodos de Separação de Misturas
 Métodos de Separação de Misturas O que é uma mistura? Mistura: associação de duas ou mais substâncias em porções arbitrárias, separáveis por meios mecânicos ou físicos e em que cada um dos componentes
Métodos de Separação de Misturas O que é uma mistura? Mistura: associação de duas ou mais substâncias em porções arbitrárias, separáveis por meios mecânicos ou físicos e em que cada um dos componentes
COLÉGIO DA POLÍCIA MILITAR
 COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
COLÉGIO DA POLÍCIA MILITAR ASSESSORIA TÉCNICA Processo Avaliativo Recuperação - 3º Bimestre/2015 Disciplina: QUÍMICA 3ª série EM A/B Nome do aluno Nº Turma A Recuperação deve ser entregue no dia 08/09/2015.
Físico-Química I. Profa. Dra. Carla Dalmolin. Termoquímica. Transformações físicas. Transformações químicas
 Físico-Química I Profa. Dra. Carla Dalmolin Termoquímica Transformações físicas Transformações químicas Termoquímica Estudo do calor trocado quando ocorrem reações químicas Sistema Sistema Vizinhança Se
Físico-Química I Profa. Dra. Carla Dalmolin Termoquímica Transformações físicas Transformações químicas Termoquímica Estudo do calor trocado quando ocorrem reações químicas Sistema Sistema Vizinhança Se
COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS ATIVIDADE COMPLEMENTAR. Escola de Civismo e Cidadania
 COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS ANO LETIVO 2019 2º BIMESTRE ATIVIDADE COMPLEMENTAR Série Turma (s) Turno 2º do Ensino Médio K L M N O P NOTURNO Professor: HUMBERTO/EMERSON
COLÉGIO ESTADUAL DA POLÍCIA MILITAR DE GOIÁS HUGO DE CARVALHO RAMOS ANO LETIVO 2019 2º BIMESTRE ATIVIDADE COMPLEMENTAR Série Turma (s) Turno 2º do Ensino Médio K L M N O P NOTURNO Professor: HUMBERTO/EMERSON
Relações de energia em Química
 Relações de energia em Química 1- Termoquímica mica Termodinâmica - o estudo da energia e suas transformações. Alterações termoquímicos - alterações de energia associados com reações químicas. Sistema
Relações de energia em Química 1- Termoquímica mica Termodinâmica - o estudo da energia e suas transformações. Alterações termoquímicos - alterações de energia associados com reações químicas. Sistema
