Química: Concentrações das soluções Vestibulares UNICAMP
|
|
|
- Izabel Espírito Santo Jardim
- 7 Há anos
- Visualizações:
Transcrição
1 Química: Concentrações das soluções estibulares UNICAMP 1. (Unicamp 2015) O processo de condenação por falsificação ou adulteração de produtos envolve a identificação do produto apreendido. Essa identificação consiste em descobrir se o produto é aquele informado e se os componentes ali contidos estão na quantidade e na concentração indicadas na embalagem. a) Considere que uma análise da ANISA tenha descoberto que o comprimido de um produto 5 apresentava 5,2 10 mol do princípio ativo citrato de sildenafila. Esse produto estaria ou não fora da especificação, dado que a sua embalagem indicava haver 50mg dessa substância em cada comprimido? Justifique sua resposta. b) Duas substâncias com efeitos terapêuticos semelhantes estariam sendo adicionadas individualmente em pequenas quantidades em energéticos. Essas substâncias são o citrato de sildenafila e a tadalafila. Se uma amostra da substância adicionada ao energético fosse encontrada, seria possível diferenciar entre o citrato de sildenafila e a tadalafila, a partir do teor de nitrogênio presente na amostra? Justifique sua resposta. Dados: Citrato de sildenafila (C22H 30N6 O4S C6H6 O ; (C22H 19N3 O 4; 1 389,4 g mol ) , g mol ) e tadalafila 2. (Unicamp 2015) Entre os produtos comerciais engarrafados, aquele cujo consumo mais tem aumentado é a água mineral. Simplificadamente, pode-se dizer que há dois tipos de água mineral: a gaseificada e a não gaseificada. A tabela abaixo traz informações simplificadas sobre a composição de uma água mineral engarrafada. a) Na coluna relativa à quantidade não está especificada a respectiva unidade. Sabe-se, no entanto, que o total de cargas positivas na água é igual ao total de cargas negativas. Levando em conta essa informação e considerando que apenas os íons da tabela estejam presentes no produto, você escolheria, como unidade de quantidade, miligramas ou milimol? Justifique sua resposta. íon hidrogenocarbonato 1,200 cálcio 0,310 magnésio 0,100 sódio 0,380 Quantidade b) Levando em conta os dados da tabela e sua resposta ao item a, identifique o sal em maior concentração nessa amostra de água mineral, dando seu nome e fórmula. Justifique sua resposta. 3. (Unicamp 2014) Quando uma pessoa ingere bebida alcoólica, cerca de 90% do álcool ingerido é absorvido no trato digestivo, na primeira hora. Esse álcool passa para a corrente sanguínea e é metabolizado no fígado. Sua eliminação, no entanto, leva muito mais tempo e é isso que torna ilegal uma pessoa dirigir nessa condição. O gráfico abaixo mostra a concentração média de álcool no sangue em função do tempo, após um consumo rápido de 1, 2, 3 e 4 doses de destilado. a) De acordo com o gráfico, se uma pessoa ingere 4 doses de destilado, após quanto tempo a velocidade de metabolização do álcool será maior que a velocidade da absorção para a corrente sanguínea? Explique. 1
2 b) Um teste do bafômetro realizado duas horas após a ingestão de destilado acusou a presença de 0,019 miligramas de álcool por litro de ar expirado por um condutor. Considerando essas informações, e as contidas no gráfico, determine quantas doses de destilado o condutor havia ingerido. Justifique. Dado: A proporção entre as concentrações de álcool (sangue: ar expirado) é de 2300:1. 4. (Unicamp 2012) Após uma competição, a análise da urina de alguns nadadores mostrou a presença de furosemida (um diurético), sendo que a sua presença na urina pode indicar um possível caso de doping. Para justificar a branda punição que os nadadores receberam, um médico emitiu uma declaração à imprensa sobre os resultados das análises das urinas. Os itens a e b abaixo mostram trechos adaptados dessa declaração. a) Inicialmente o médico declarou: Quando o atleta tenta esconder alguma coisa, ele usa diuréticos... A urina encontrada estava muito concentrada. Levando-se em conta o contexto da questão e o conhecimento químico, estaria o médico referindo-se à concentração de furosemida na urina? Justifique. b) O médico continuava sua declaração: O ph estava bastante ácido nas quatro amostras de urina. Quando você usa substâncias dopantes.... Levando-se em conta as outras informações do texto e considerando que esse trecho seja válido do ponto de vista químico, o que se pode inferir sobre o caráter ácido-base das substâncias dopantes? Justifique sua resposta utilizando as informações fornecidas pelo texto. 2
3 Gabarito: Resposta da questão 1: a) Teremos: C H N O S C H O 666, g / mol mol 666, g 5 5,2 10 mol mc22h 30N6O4SC6H 6O 5 mc22h 30N6O4SC6H 6O 3.466,84 10 g 3 mc22h 30N6O4SC6H 6O 34,6 10 g mc22h 30N6O4SC6H 6O 34,6 mg 34,6 mg 50 mg (especificação) Conclusão: o produto está fora da especificação. b) Cálculo do teor de nitrogênio das amostras: N 14 g / mol C22H30N6O4S C6H6O (citrato de sildenafila ) 666, g / mol 666, g 100 % 6 14 g pn 12,60 % pn C22H19N3 O 4 (tadalafila ) 389,4 g / mol 389,4 g 100 % 3 14 g p' N 10,9 % p' N Conclusão: seria possível diferenciar entre o citrato de sildenafila e a tadalafila, a partir do teor de nitrogênio presente em cada amostra, já que as porcentagens de nitrogênio são diferentes nas amostras analisadas. Resposta da questão 2: a) A partir das cargas dos íons presentes na água mineral, vem: íon Carga Quantidade de íons Carga total HCO3 1 1,200 1,200 ( 1) 1,200 Ca 2 0,310 0,310 ( 2) 0,620 Mg 2 0,100 0,100 ( 2) 0,200 + Na 1 0,380 0,380 ( 1) 0,380 Total de cargas negativas = -1,200. Total de cargas positivas = 0, , ,380 = +1,200. O total de cargas negativas é igual ao total de cargas positivas. Conclusão: milimol é a melhor escolha como unidade de quantidade. 3
4 íon HCO3 Quantidade de íons 1,200mmol Ca 0,310mmol Mg 0,100mmol + Na 0,380mmol b) Possíveis sais presentes (a partir das combinações das fórmulas fornecidas): NaHCO 3, Mg(HCO 3) 2, Ca(HCO 3) 2. Cálculo das concentrações molares dos sais: Na HCO3 NaHCO3 0,380 mmol 0,380 mmol 0,380 mmol nnahco3 0,380 mmol [NaHCO 3] 2 Mg 2HCO3 Mg(HCO 3 ) 2 0,100 mmol 2 0,100 mmol 0,100 mmol nmg(hco 3) 2 0,100 mmol [Mg(HCO 3) 2] 2 Ca 2HCO3 Ca(HCO 3 ) 2 0,310 mmol 2 0,310 mmol 0,310 mmol nca(hco 3) 2 0,310 mmol [Ca(HCO 3) 2] 0,380 mmol 0,310 mmol 0,100 mmol O sal em maior concentração nessa amostra de água mineral é o hidrogeno carbonato de sódio ou bicarbonato de sódio, cuja fórmula é NaHCO 3. Resposta da questão 3: a) Teremos: Curva ascendente: velocidade de absorção do álcool maior do que a velocidade de metabolização. 4
5 De acordo com o gráfico, para quatro doses, após uma hora do consumo da bebida alcoólica a velocidade de metabolização do álcool será maior que a velocidade da absorção para a corrente sanguínea. b) Um teste do bafômetro realizado duas horas após a ingestão de destilado acusou a presença de 0,019 miligramas de álcool por litro de ar expirado por um condutor. A proporção entre as concentrações de álcool (sangue: ar expirado) é de 2300:1. Teremos, por litro de ar expirado: 2300 mg / L 1 mg c c 43, mg / L 0,019 mg De acordo com o gráfico após duas horas a concentração corresponde a três doses de destilado. Resposta da questão 4: a) Não. O médico se referiu ao fato da concentração de outras substâncias presentes na urina estarem elevadas. Se os atletas tivessem usado a furosamida, teriam urinado muito mais do que o normal e a urina estaria diluída em relação aos demais componentes. b) O médico alegou que o ph estava bastante ácido nas quatro amostras de urina. Se fossem utilizadas substâncias dopantes (não a furosamida, que é um diurético), o caráter da urina seria básico, ou seja, o ph seria maior do que o comum. 5
Revisão Específicas UNICAMP
 Revisão Específicas UNICAMP Material de Apoio para Monitoria 1. A figura abaixo mostra a porcentagem da hemoglobina por oxigênio, em função da pressão de O2, para alguns valores do ph do sangue. a) Devido
Revisão Específicas UNICAMP Material de Apoio para Monitoria 1. A figura abaixo mostra a porcentagem da hemoglobina por oxigênio, em função da pressão de O2, para alguns valores do ph do sangue. a) Devido
INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO
 2º EM Química A Priscila Av. Dissertativa 30/03/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
2º EM Química A Priscila Av. Dissertativa 30/03/16 INSTRUÇÕES PARA A REALIZAÇÃO DA PROVA LEIA COM MUITA ATENÇÃO 1. Verifique, no cabeçalho desta prova, se seu nome, número e turma estão corretos. 2. Esta
M (Na B O 10 H O) 381 g mol
 1. (Fuvest 2015) Nas águas das represas de regiões agrícolas, o aumento da concentração de íons nitrato, provenientes de sais contidos em fertilizantes, pode levar ao fenômeno da eutrofização. Tal fenômeno
1. (Fuvest 2015) Nas águas das represas de regiões agrícolas, o aumento da concentração de íons nitrato, provenientes de sais contidos em fertilizantes, pode levar ao fenômeno da eutrofização. Tal fenômeno
unicamp 17/Janeiro/2012
 CPV seu pé direito em Biomédicas e Exatas unicamp 17/Janeiro/2012 química 17. Um acidente comum ocorre com bastante frequência na cozinha. Uma panela com óleo quente para fritura é esquecida sobre a chama
CPV seu pé direito em Biomédicas e Exatas unicamp 17/Janeiro/2012 química 17. Um acidente comum ocorre com bastante frequência na cozinha. Uma panela com óleo quente para fritura é esquecida sobre a chama
Resolução UNIFESP 2015
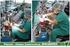 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
2ª SÉRIE roteiro 1 SOLUÇÕES
 2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
2ª SÉRIE roteiro 1 SOLUÇÕES 1.1) Os íons Íons são elementos químicos que possuem carga elétrica resultante, positiva ou negativa. O íon positivo é denominado cátion (Na +1, Ca +2...). O íon negativo é
Questão 1. manter a dose recomendada diária é cerca de a) 30 comprimidos. b) 45 comprimidos. c) 60 comprimidos. d)15 comprimidos.
 Teoria atômico molecular 1º SÉRIE Química PROF. Cirilo Questão 1 (Ufu 18) A vitamina E tem sido relacionada à prevenção ao câncer de próstata, além de atuar como antioxidante para prevenir o envelhecimento
Teoria atômico molecular 1º SÉRIE Química PROF. Cirilo Questão 1 (Ufu 18) A vitamina E tem sido relacionada à prevenção ao câncer de próstata, além de atuar como antioxidante para prevenir o envelhecimento
Exercícios de Equilíbrio Iônico II
 Exercícios de Equilíbrio Iônico II 1. Com relação às funções inorgânicas, assinale a alternativa incorreta. a) O acetato de sódio é um sal de características básicas, pois é resultante da reação entre
Exercícios de Equilíbrio Iônico II 1. Com relação às funções inorgânicas, assinale a alternativa incorreta. a) O acetato de sódio é um sal de características básicas, pois é resultante da reação entre
UNIFEV MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA
 UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
UNIFEV 2015 - MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO DE VOTUPORANGA 07. Para combater o subdiagnóstico da osteoporose no sexo masculino, os homens foram o foco da campanha internacional Ame seus
Equipe de Química QUÍMICA
 Aluno (a): Série: 3ª Turma: TUTORIAL 12R Ensino Médio Equipe de Química Data: QUÍMICA Mistura de soluções que não reagem entre si: Misturas de soluções de mesmo soluto quando misturamos soluções de mesmo
Aluno (a): Série: 3ª Turma: TUTORIAL 12R Ensino Médio Equipe de Química Data: QUÍMICA Mistura de soluções que não reagem entre si: Misturas de soluções de mesmo soluto quando misturamos soluções de mesmo
PADRÃO DE RESPOSTA - QUÍMICA - Grupo J
 PADRÃO DE RESPOSTA - QUÍMICA - Grupo J 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
PADRÃO DE RESPOSTA - QUÍMICA - Grupo J 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
LISTA DE EXERCÍCIOS 1
 UNIVERSIDADE DE SÃO PAULO ESCOLA SUPERIOR DE AGRICULTURA LUIZ DE QUEIROZ DEPARTAMENTO DE CIÊNCIAS EXATAS LCE 151 FUNDAMENTOS DE QUÍMICA INORGÂNICA E ANALÍTICA LISTA DE EXERCÍCIOS 1 1. Qual é e como é definida
UNIVERSIDADE DE SÃO PAULO ESCOLA SUPERIOR DE AGRICULTURA LUIZ DE QUEIROZ DEPARTAMENTO DE CIÊNCIAS EXATAS LCE 151 FUNDAMENTOS DE QUÍMICA INORGÂNICA E ANALÍTICA LISTA DE EXERCÍCIOS 1 1. Qual é e como é definida
AULA DE VÉSPERA 2ª FASE UECE / GABARITO Professor: Michel Henri
 AULA DE VÉSPERA ª FASE UECE / GABARITO Professor: Michel Henri Resposta da questão 1: [E] A equação de Henderson-Hasselbach é válida com melhor aproximação entre ph 4 e ph 10, devido às simplificações
AULA DE VÉSPERA ª FASE UECE / GABARITO Professor: Michel Henri Resposta da questão 1: [E] A equação de Henderson-Hasselbach é válida com melhor aproximação entre ph 4 e ph 10, devido às simplificações
Química. Xandão (Renan Micha) Soluções
 Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Soluções Soluções 1. (FUVEST) Sabe-se que os metais ferro (Fe 0 ), magnésio (Mg 0 ) e estanho (Sn 0 ) reagem com soluções de ácidos minerais, liberando gás hidrogênio e formando íons divalentes em solução.
Compostos iônicos e moleculares
 LCE0143 Química Geral Compostos iônicos e moleculares Wanessa Melchert Mattos wanemelc@usp.br Moléculas - Menores unidades identificáveis - Moléculas são reuniões de dois ou mais átomos ligados entre si
LCE0143 Química Geral Compostos iônicos e moleculares Wanessa Melchert Mattos wanemelc@usp.br Moléculas - Menores unidades identificáveis - Moléculas são reuniões de dois ou mais átomos ligados entre si
3º Trimestre Sala de Estudo - Química Data: 29/09/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº
 3º Trimestre Sala de Estudo - Química Data: 29/09/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Mol Questão 01 - (PUC Camp SP/2016) O consumo excessivo de sal pode acarretar o aumento
3º Trimestre Sala de Estudo - Química Data: 29/09/17 Ensino Médio 1º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Mol Questão 01 - (PUC Camp SP/2016) O consumo excessivo de sal pode acarretar o aumento
RESPOSTAS ESPERADAS QUÍMICA
 Questão 1 C 4 N 3 OH 7 - massa molar = 113 g mol -1 A concentração de creatinina no exame foi de 1,20 x 10-4 mol L -1, ou 1,20 x 10-5 mol dl -1. Assim, a concentração = 113.000 x 1,20 x 10-5 = 1,36 mg
Questão 1 C 4 N 3 OH 7 - massa molar = 113 g mol -1 A concentração de creatinina no exame foi de 1,20 x 10-4 mol L -1, ou 1,20 x 10-5 mol dl -1. Assim, a concentração = 113.000 x 1,20 x 10-5 = 1,36 mg
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell
 LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
LISTA DE EXERCÍCIOS # 05 QUÍMICA ANALÍTICA PROF. Wendell 1. Considere uma solução aquosa de NH 3, preparada na concentração de 0,100 mol L -1. Calcule o ph desta solução. Use K b = 1,8 10-5. 2. Uma alíquota
Revisão da aula anterior
 Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Revisão da aula anterior Cinética química Velocidade de reação Estabelecimento do equilíbrio químico Equilíbrio químico Cálculos de equilíbrio Fatores que afetam o equilíbrio químico Constante de equilíbrio
Disciplina: Química Data: 05 / 05 / Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo:
 Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
Disciplina: Química Data: 05 / 05 / 2018 Ensino Médio Série: 2º ano Turma: Valor: Média: Assunto: ROTEIRO DE RECUPERAÇÃO Etapa: I Tipo: Aluno(a): Nº: Nota: Professor(a): Thito Ass. do(a) Responsável: PROGRAMA
Plantão de dúvidas - Lista 12 2 os anos Danilo mai/12. Nome: Nº: Turma: Titulação, ppm, densidade e volumes
 Química Plantão de dúvidas - Lista 12 2 os anos Danilo mai/12 Nome: Nº: Turma: Titulação, ppm, densidade e volumes 1. (Unesp) Um analista químico de uma indústria de condimentos analisa o vinagre produzido
Química Plantão de dúvidas - Lista 12 2 os anos Danilo mai/12 Nome: Nº: Turma: Titulação, ppm, densidade e volumes 1. (Unesp) Um analista químico de uma indústria de condimentos analisa o vinagre produzido
Quí. Quí. Allan Rodrigues Monitor: João Castro
 Quí. Professor: Abner Camargo Allan Rodrigues Monitor: João Castro Unidades de concentração 05 jun RESUMO Concentração comum (C) A definição mais simples é: Concentração é a quantidade, em gramas, de soluto
Quí. Professor: Abner Camargo Allan Rodrigues Monitor: João Castro Unidades de concentração 05 jun RESUMO Concentração comum (C) A definição mais simples é: Concentração é a quantidade, em gramas, de soluto
PROJETO DE LEI Nº, DE 2003 (Do Sr. Ricardo Izar)
 PROJETO DE LEI Nº, DE 2003 (Do Sr. Ricardo Izar) Dispõe sobre a identificação e os padrões de qualidade da água preparada adicionada de sais e envasada para comercialização. O Congresso Nacional decreta:
PROJETO DE LEI Nº, DE 2003 (Do Sr. Ricardo Izar) Dispõe sobre a identificação e os padrões de qualidade da água preparada adicionada de sais e envasada para comercialização. O Congresso Nacional decreta:
Química Relações de massa. Olhar Químico. Prof. Romeu A. Nelo. (massa molecular, massa molar e mol)
 Olhar Químico Química Relações de massa Prof. Romeu A. Nelo. 1- Esta questão pretende exercitar a consulta à tabela periódica. Consulte-a e indique a massa atômica para o: a) Hidrogênio. b) Carbono. c)
Olhar Químico Química Relações de massa Prof. Romeu A. Nelo. 1- Esta questão pretende exercitar a consulta à tabela periódica. Consulte-a e indique a massa atômica para o: a) Hidrogênio. b) Carbono. c)
Colégio Equipe de Juiz de Fora Prof. Dr. Willian T. G. Novato Lista de Apoio para Reflexão no Feriado Data para correção: 17/04/2017
 TEXTO: 1 - Comum à questão: 1 A hidroxiapatita é um mineral constituído pelos íons cálcio, fosfato e hidróxido e tem fórmula unitária Ca10(PO4)6(OH)2. Ela é o principal constituinte dos osso e dentes.
TEXTO: 1 - Comum à questão: 1 A hidroxiapatita é um mineral constituído pelos íons cálcio, fosfato e hidróxido e tem fórmula unitária Ca10(PO4)6(OH)2. Ela é o principal constituinte dos osso e dentes.
01- (ITA 2001) Um litro de uma solução aquosa contém 0,30mol de íons Na, 0,28mol de íons
 01- (ITA 2001) Um litro de uma solução aquosa contém 0,30mol de íons Na, 0,28mol de íons CØ, 0,10mol de íons SO e x mols de íons Fe. A concentração de íons Fe (em mol/l) presentes nesta solução é a) 0,03
01- (ITA 2001) Um litro de uma solução aquosa contém 0,30mol de íons Na, 0,28mol de íons CØ, 0,10mol de íons SO e x mols de íons Fe. A concentração de íons Fe (em mol/l) presentes nesta solução é a) 0,03
(aq) + H 3 O + (aq) K 1 = 1,0 x (aq) + H 3 O + (aq) K 2 = 1,0 x 10-11
 Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
Questão 1 O ácido carbônico é formado quando se borbulha o dióxido de carbono em água. Ele está presente em águas gaseificadas e refrigerantes. Em solução aquosa, ele pode sofrer duas dissociações conforme
2. O processo de recristalização, usado na purificação de sólidos, consiste no seguinte:
 1. O efeito estufa é um fenômeno de graves conseqüências climáticas que se deve a altas concentrações de CO no ar. Considere que, num dado período, uma indústria "contribuiu" para o efeito estufa, lançando
1. O efeito estufa é um fenômeno de graves conseqüências climáticas que se deve a altas concentrações de CO no ar. Considere que, num dado período, uma indústria "contribuiu" para o efeito estufa, lançando
a) I amônia; II Ureia
 1. No tratamento de hipertensos, os pacientes devem retirar o sal (cloreto de sódio) de sua alimentação, assim como tomar um medicamento diurético. Explique qual a relação entre esses dois procedimentos
1. No tratamento de hipertensos, os pacientes devem retirar o sal (cloreto de sódio) de sua alimentação, assim como tomar um medicamento diurético. Explique qual a relação entre esses dois procedimentos
P4 - PROVA DE QUÍMICA GERAL - 05/12/07
 P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
P4 - PROVA DE QUÍMICA GERAL - 05/12/07 Nome: GABARITO Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes e equações: R = 0,082 atm L mol
a) 2. b) 3. c) 4. d) 5.
 (FUVEST) O ph normal do estômago varia entre 0,3 a 1,2. Entretanto, em algumas alterações de saúde é preciso neutralizar o excesso de acidez estomacal ministrando antiácidos (hidróxido de magnésio, hidróxido
(FUVEST) O ph normal do estômago varia entre 0,3 a 1,2. Entretanto, em algumas alterações de saúde é preciso neutralizar o excesso de acidez estomacal ministrando antiácidos (hidróxido de magnésio, hidróxido
 Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
Lista de exercícios - Bloco 2 - Aula 25 a 28 - Equilíbrio Químico - Conceitos gerais e cálculo (Kc e Kp) 1. (Unicid - Medicina 2017) Considere os equilíbrios: 1. 2 SO 2 (g) + O 2 (g) 2 SO 3 (g) 25 Kc =
Química Geral I Aula 3
 Química Geral I Aula 3 Curso de Química Licenciatura 2016-1 Prof. Udo Eckard Sinks Moléculas, Compostos e Fórmulas: Modelos Moleculares, Compostos Iônicos, Compostos moleculares, Fórmulas, Compostos e
Química Geral I Aula 3 Curso de Química Licenciatura 2016-1 Prof. Udo Eckard Sinks Moléculas, Compostos e Fórmulas: Modelos Moleculares, Compostos Iônicos, Compostos moleculares, Fórmulas, Compostos e
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
Professor: Fábio Silva SOLUÇÕES
 Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
Professor: Fábio Silva SOLUÇÕES Solvente: Substância que apresenta o mesmo estado de agregação da solução; Substância encontrada em maior quantidade. SOLUÇÃO É uma mistura homogênea de dois ou mais componentes.
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
QUÍMICA - 3 o ANO MÓDULO 24 DILUIÇÃO DE SOLUÇÕES
 QUÍMICA - 3 o ANO MÓDULO 24 DILUIÇÃO DE SOLUÇÕES solvente m c v m c v Como pode cair no enem (UERJ) Uma suspensão de células animais em um meio isotônico adequado apresenta volume igual a 1 L e concentração
QUÍMICA - 3 o ANO MÓDULO 24 DILUIÇÃO DE SOLUÇÕES solvente m c v m c v Como pode cair no enem (UERJ) Uma suspensão de células animais em um meio isotônico adequado apresenta volume igual a 1 L e concentração
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº
 3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
3º Trimestre Sala de estudos Química Data: 03/12/18 Ensino Médio 3º ano classe: A_B Profª Danusa Nome: nº Conteúdo: FAMERP/UNIFESP (REVISÃO) Questão 01 - (FAMERP SP/2018) A tabela indica a abundância aproximada
CPV seu pé direito também na medicina
 CPV seu pé direito também na medicina unifesp 18/dezembro/2009 QUÍMICA 06. Na queima do cigarro, há a liberação dos gases C, C 2 e de outras substâncias tóxicas como alcatrão, nicotina, fenóis e amônia
CPV seu pé direito também na medicina unifesp 18/dezembro/2009 QUÍMICA 06. Na queima do cigarro, há a liberação dos gases C, C 2 e de outras substâncias tóxicas como alcatrão, nicotina, fenóis e amônia
Na industria de alimentos a formação de filmes e depósitos minerais na superfície de equipamentos, prejudica o processo de higienização.
 Determinação da Dureza Total em água de abastecimento A dureza é provocada pela presença de sais de cálcio e magnésio. Não apresenta importância sanitária, mas o uso de uma água com excesso deste íons
Determinação da Dureza Total em água de abastecimento A dureza é provocada pela presença de sais de cálcio e magnésio. Não apresenta importância sanitária, mas o uso de uma água com excesso deste íons
QUI 01 PROF. Claudio Equilíbrio químico e ph
 facebook.com/proj.medicina QUI 01 PROF. Claudio Equilíbrio químico e ph RESOLUÇÃO DAS QUESTÕES DE AULA 1. (Unifesp 017) Certo produto utilizado como tira-ferrugem contém solução aquosa de ácido oxálico,
facebook.com/proj.medicina QUI 01 PROF. Claudio Equilíbrio químico e ph RESOLUÇÃO DAS QUESTÕES DE AULA 1. (Unifesp 017) Certo produto utilizado como tira-ferrugem contém solução aquosa de ácido oxálico,
-0,1-0,2-0,3-0,4-0,5. 0, mol contidos na alíquota de 10 ml. 0,00525 mol contidos no balão de 100 ml. M = 72,0 g/mol
 1) Um ácido monoprótico puro desconhecido foi analisado por titulação potenciométrica. Para isso,,378g do ácido foi dissolvido em água e o volume foi completado até 1,mL. Uma alíquota de 1, ml do ácido
1) Um ácido monoprótico puro desconhecido foi analisado por titulação potenciométrica. Para isso,,378g do ácido foi dissolvido em água e o volume foi completado até 1,mL. Uma alíquota de 1, ml do ácido
LISTA DE EXERCÍCIO PROVA MENSAL
 LISTA DE EXERCÍCIO PROVA MENSAL Nome: nº: Ano: 3º E.M. Professor: CASSIO PACHECO 1- O DDT, um inseticida largamente utilizado durante décadas e altamente tóxico, possui fórmula molecular C14H9Clx e massa
LISTA DE EXERCÍCIO PROVA MENSAL Nome: nº: Ano: 3º E.M. Professor: CASSIO PACHECO 1- O DDT, um inseticida largamente utilizado durante décadas e altamente tóxico, possui fórmula molecular C14H9Clx e massa
QUÍMICA TITULAÇÃO ,0 ml de uma solução de NaOH neutralizam totalmente 10,0 ml de uma solução de HNO
 QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
QUÍMICA Prof. Daniel Pires TITULAÇÃO 1. Um suco de laranja industrializado tem seu valor de ph determinado pelo controle de qualidade. Na análise, 20 ml desse suco foram neutralizados com 2 ml de NaOH
Polimerização e Reações Orgânicas
 Polimerização e Reações Orgânicas Material de Apoio para Monitoria 1. (FATEC-SP) A polimerização por adição consiste na reação entre moléculas de uma mesma substância, na qual em sua estrutura, ocorre
Polimerização e Reações Orgânicas Material de Apoio para Monitoria 1. (FATEC-SP) A polimerização por adição consiste na reação entre moléculas de uma mesma substância, na qual em sua estrutura, ocorre
1º trimestre Sala de Estudo Data: 16/03/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 1º trimestre Sala de Estudo Data: 16/03/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Fundamentos da química e Compostos Inorgânicos Questão 01 - (UEM PR/2016) Tendo em vista a tabela
1º trimestre Sala de Estudo Data: 16/03/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Fundamentos da química e Compostos Inorgânicos Questão 01 - (UEM PR/2016) Tendo em vista a tabela
Disponível em: Acesso em: 27 jun (Adaptado)
 1. Na atual estrutura social, o abastecimento de água tratada desempenha papel fundamental para a prevenção de doenças. Entretanto, a população mais carente é a que mais sofre com a falta de água tratada,
1. Na atual estrutura social, o abastecimento de água tratada desempenha papel fundamental para a prevenção de doenças. Entretanto, a população mais carente é a que mais sofre com a falta de água tratada,
d) o produto, representado por (5), é único e equivale ao composto CD. e) a presença do catalisador A torna a reação exotérmica.
 Professor: Alfênio 01 - (Univag MT/2014) O esquema representa dois experimentos, 1 e 2, que demonstram fatores que podem influenciar na rapidez das reações, como temperatura, superfície de contato e concentração
Professor: Alfênio 01 - (Univag MT/2014) O esquema representa dois experimentos, 1 e 2, que demonstram fatores que podem influenciar na rapidez das reações, como temperatura, superfície de contato e concentração
REVISÃO: CONDUTIVIDADE ELÉTRICA DE SOLUÇÕES AQUOSAS AULA 1 EXPRESSÕES DE CONCENTRAÇÃO PROF. ANA
 REVISÃO: CONDUTIVIDADE ELÉTRICA DE SOLUÇÕES AQUOSAS AULA 1 EXPRESSÕES DE CONCENTRAÇÃO DATA: 21/08/2015 PROF. ANA 1) SOLUÇÕES Soluções são misturas homogêneas de duas ou mais substâncias. - numa solução,
REVISÃO: CONDUTIVIDADE ELÉTRICA DE SOLUÇÕES AQUOSAS AULA 1 EXPRESSÕES DE CONCENTRAÇÃO DATA: 21/08/2015 PROF. ANA 1) SOLUÇÕES Soluções são misturas homogêneas de duas ou mais substâncias. - numa solução,
SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA.
 SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA. QUESTÕES SOLUÇÕES. 01) Dê o significado das seguintes sentenças: a) Uma solução apresenta título igual a 0,2. b) Uma solução a 10%, em massa, de NaCI. c)
SOS QUÍMICA - O SITE DO PROFESSOR SAUL SANTANA. QUESTÕES SOLUÇÕES. 01) Dê o significado das seguintes sentenças: a) Uma solução apresenta título igual a 0,2. b) Uma solução a 10%, em massa, de NaCI. c)
NUTRIÇÃO DESPORTIVA - ACSM
 NUTRIÇÃO DESPORTIVA - ACSM RECOMENDAÇÕES DO ACSM PARA NUTRIÇÃO RECOMENDAÇÃO ACSM 6-10g/kg por dia HCO PELAS RAZÕES ABAIXO REFERIDAS, DEVEM SER PRIVILEGIADOS OS ALIMENTOS RICOS EM AMIDO E CELULOSE (POLISSACARIDEOS)
NUTRIÇÃO DESPORTIVA - ACSM RECOMENDAÇÕES DO ACSM PARA NUTRIÇÃO RECOMENDAÇÃO ACSM 6-10g/kg por dia HCO PELAS RAZÕES ABAIXO REFERIDAS, DEVEM SER PRIVILEGIADOS OS ALIMENTOS RICOS EM AMIDO E CELULOSE (POLISSACARIDEOS)
Concentração de Soluções Aquosas
 Disciplina: Química Prof.: Ivo Turma: TR 16/09/2016 Tema da aula: Concentração das Soluções 1. Conceito Concentração de Soluções Aquosas Imagine um copo de limonada. Podemos definir essa limonada como
Disciplina: Química Prof.: Ivo Turma: TR 16/09/2016 Tema da aula: Concentração das Soluções 1. Conceito Concentração de Soluções Aquosas Imagine um copo de limonada. Podemos definir essa limonada como
O que você deve saber sobre
 O que você deve saber sobre Podemos conhecer as grandezas que regem a quantificação dos fenômenos químicos identificando o comportamento da massa, do número de partículas e do volume de diferentes substâncias.
O que você deve saber sobre Podemos conhecer as grandezas que regem a quantificação dos fenômenos químicos identificando o comportamento da massa, do número de partículas e do volume de diferentes substâncias.
, para vários sais, assinale a opção correta. CrO 4. (aq) em concentrações iguais, haverá precipitação, em primeiro lugar, do sal PbSO 4
 Resolução das atividades complementares 3 Química Q47 Coeficiente de solubilidade p. 72 1 (UFV-MG) Com base na tabela, na qual são apresentados os valores das constantes de produto de solubilidade,, para
Resolução das atividades complementares 3 Química Q47 Coeficiente de solubilidade p. 72 1 (UFV-MG) Com base na tabela, na qual são apresentados os valores das constantes de produto de solubilidade,, para
Potencial hidrogeniônico (ph) Potencial hidroxiliônico (poh)
 Potencial hidrogeniônico (ph) e Potencial hidroxiliônico (poh) PRODUTO IÔNICO DA ÁGUA CARÁTER DAS SOLUÇÕES AQUOSAS ph e poh ph e poh das soluções aquosas solução ácida: ph7 solução básica: ph>7
Potencial hidrogeniônico (ph) e Potencial hidroxiliônico (poh) PRODUTO IÔNICO DA ÁGUA CARÁTER DAS SOLUÇÕES AQUOSAS ph e poh ph e poh das soluções aquosas solução ácida: ph7 solução básica: ph>7
Simulado Química UNICAMP
 1. (Unicamp 2014) Recentemente encontrou-se um verdadeiro fatberg, um iceberg de gordura com cerca de 15 toneladas, nas tubulações de esgoto de uma região de Londres. Esse fatberg, resultado do descarte
1. (Unicamp 2014) Recentemente encontrou-se um verdadeiro fatberg, um iceberg de gordura com cerca de 15 toneladas, nas tubulações de esgoto de uma região de Londres. Esse fatberg, resultado do descarte
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula /
 QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
QUI109 QUÍMICA GERAL (Ciências Biológicas) 4ª aula / 2016-2 Prof. Mauricio X. Coutrim (disponível em: http://professor.ufop.br/mcoutrim) REAÇÃO EM SOLUÇÃO AQUOSA São reações envolvendo compostos iônicos
Prova de Conhecimentos de Química Código: Data: 09/07/2012 CADERNO DE QUESTÕES
 UNIVERSIDADE FEDERAL D ESPÍRIT SANT Centro de Ciências Exatas Programa de Pós-Graduação em Química Prova de Conhecimentos de Química Código: Data: 09/07/2012 Valor 10,0 CADERN DE QUESTÕES Instruções: VCÊ
UNIVERSIDADE FEDERAL D ESPÍRIT SANT Centro de Ciências Exatas Programa de Pós-Graduação em Química Prova de Conhecimentos de Química Código: Data: 09/07/2012 Valor 10,0 CADERN DE QUESTÕES Instruções: VCÊ
CINÉTICA QUÍMICA Folha 15 Prof.: João Roberto Mazzei
 01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
01. (UNIRIO-RJ) Uma solução-tampão é preparada a partir de 6,4g de NH 4 NO 3 e 0,10L de solução aquosa 0,080mol/L de NH 4 OH. Sendo assim, A) determine o ph desta solução. B) o ph após adição de 700 ml
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº
 1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
1º trimestre Sala de Estudos Data: 12/04/17 Ensino Médio 3º ano classe: A_B_C Profª Danusa Nome: nº Conteúdo: Soluções (concentração comum e molaridade) e Gases Caso seja necessário, utilize a tabela periódica.
1º trimestre Trabalho de Recuperação Data: 03/05/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº
 1º trimestre Trabalho de Recuperação Data: 03/05/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Mol e Soluções (Concentração Comum e Molar) *Entregar todos os exercícios resolvidos
1º trimestre Trabalho de Recuperação Data: 03/05/18 Ensino Médio 2º ano classe: A_B Profª Danusa Nome: nº Conteúdo: Mol e Soluções (Concentração Comum e Molar) *Entregar todos os exercícios resolvidos
Ano: 2ºEM. Recursos para Estudo / Atividades. Conteúdo. 2ª Etapa Unidades de Estudo conceitos e habilidades
 Rede de Educação Missionárias Servas do Espírito Santo Colégio Nossa Senhora da Piedade Av. Amaro Cavalcanti, 2591 Encantado Rio de Janeiro / RJ CEP: 20735042 Tel: 2594-5043 Fax: 2269-3409 E-mail: cnsp@terra.com.br
Rede de Educação Missionárias Servas do Espírito Santo Colégio Nossa Senhora da Piedade Av. Amaro Cavalcanti, 2591 Encantado Rio de Janeiro / RJ CEP: 20735042 Tel: 2594-5043 Fax: 2269-3409 E-mail: cnsp@terra.com.br
Revisão Específicas. Química Monitores: Luciana Lima e Rafael França 16-21/11/2015. Material de Apoio para Monitoria
 Revisão Específicas 1. (Ufpr) Considere as soluções I, II e III, descritas a seguir. I - Solução obtida pela adição de 9,80 g de H2SO4 (massa molar = 98,0 g) em água suficiente para completar o volume
Revisão Específicas 1. (Ufpr) Considere as soluções I, II e III, descritas a seguir. I - Solução obtida pela adição de 9,80 g de H2SO4 (massa molar = 98,0 g) em água suficiente para completar o volume
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS DE RECUPERAÇÃO PARCIAL 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica
 PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do aluno:
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do aluno:
Prova de Química Analítica
 CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número
CPF/PASSAPORTE: 1 PROCESSO DE SELEÇÃO E ADMISSÃO AO CURSO DE PARA O SEMESTRE 2017/01 EDITAL PPGQ Nº 002/2016 Prova de Química Analítica Instruções: 1) O candidato deverá identificar-se apenas com o número
Qui. Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa
 Semana 19 Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa EXERCÍCIOS DE AULA 1. Para determinar a pureza de uma amostra de ácido sulfúrico (H2SO 4), uma analista dissolveu 14,0 g do ácido
Semana 19 Professores: Allan Rodrigues Xandão Monitor: Thamiris Gouvêa EXERCÍCIOS DE AULA 1. Para determinar a pureza de uma amostra de ácido sulfúrico (H2SO 4), uma analista dissolveu 14,0 g do ácido
Meu Deus, ajude me a passar na prova de Química. Amém. a) 0,9. b) 1,3. c) 2,8. d) 5,7. e) 15.
 Meu Deus, ajude me a passar na prova de Química. Amém LISTA DE EXERCÍCIOS DE QUÍMICA - 2 ANO 01. A concentração de íons fluoreto em uma água de uso doméstico é de 5,0 10 5 mol/litro. Se uma pessoa tomar
Meu Deus, ajude me a passar na prova de Química. Amém LISTA DE EXERCÍCIOS DE QUÍMICA - 2 ANO 01. A concentração de íons fluoreto em uma água de uso doméstico é de 5,0 10 5 mol/litro. Se uma pessoa tomar
6ª OLIMPÍADA BAIANA DE QUÍMICA EXAME 2011
 Data da prova: 30.07.2011 Data da publicação do gabarito: 01.09.2011 GABARITO QUESTÕES DISCURSIVAS QUESTÃO 1. (Peso 2) Uma vela de massa 34,5g é acesa e encoberta por um bequer. Após algum tempo a chama
Data da prova: 30.07.2011 Data da publicação do gabarito: 01.09.2011 GABARITO QUESTÕES DISCURSIVAS QUESTÃO 1. (Peso 2) Uma vela de massa 34,5g é acesa e encoberta por um bequer. Após algum tempo a chama
, e o óxido de ferro III, iniciada por centelha elétrica. A equação para a reação é: 6NaN 3. (s) 3Na 2
 20 QUÍMICA s automóveis modernos estão equipados com air bags (bolsas de ar) para proteger os ocupantes em caso de colisão. Muitos deles são inflados com nitrogênio, N 2, gás liberado na reação muito rápida
20 QUÍMICA s automóveis modernos estão equipados com air bags (bolsas de ar) para proteger os ocupantes em caso de colisão. Muitos deles são inflados com nitrogênio, N 2, gás liberado na reação muito rápida
Reações Químicas Folha 01 Prof.: João Roberto Mazzei
 www.professormazzei.com Reações Químicas Folha 01 Prof.: João Roberto Mazzei 01. (PUC RIO 2006) Os coeficientes estequiométricos da reação química balanceada dada a seguir são: a KMnO 4 (aq) + b FeCl 2(aq)
www.professormazzei.com Reações Químicas Folha 01 Prof.: João Roberto Mazzei 01. (PUC RIO 2006) Os coeficientes estequiométricos da reação química balanceada dada a seguir são: a KMnO 4 (aq) + b FeCl 2(aq)
Química. Unicamp ETAPA. Resposta QUESTÃO 13 QUESTÃO 14
 Química Unicamp QUESTÃO 13 Notícia 1 Vazamento de gás oxigênio nas dependências do Hospital e Maternidade São Mateus, Cuiabá, em 03/12/13. Uma empresária que atua no setor de venda de oxigênio disse ao
Química Unicamp QUESTÃO 13 Notícia 1 Vazamento de gás oxigênio nas dependências do Hospital e Maternidade São Mateus, Cuiabá, em 03/12/13. Uma empresária que atua no setor de venda de oxigênio disse ao
Turma Fisioterapia - 2º Termo. Profa. Dra. Milena Araújo Tonon Corrêa
 Turma Fisioterapia - 2º Termo Profa. Dra. Milena Araújo Tonon Corrêa Administração Absorção Fármaco na circulação sistêmica Distribuído Biotransformado Excretado Farmacocinética : O que o organismo faz
Turma Fisioterapia - 2º Termo Profa. Dra. Milena Araújo Tonon Corrêa Administração Absorção Fármaco na circulação sistêmica Distribuído Biotransformado Excretado Farmacocinética : O que o organismo faz
Roteiro de estudos para recuperação final
 Roteiro de estudos para recuperação final Disciplina: Professor (a): Química Daiane Lima Conteúdo: Ligações Químicas: Iônica, Covalente, Metálica, estrutura de Lewis e propriedades gerais das ligações.
Roteiro de estudos para recuperação final Disciplina: Professor (a): Química Daiane Lima Conteúdo: Ligações Químicas: Iônica, Covalente, Metálica, estrutura de Lewis e propriedades gerais das ligações.
Gabarito: Resposta da questão 1: [A] [Resposta do ponto de vista da disciplina de Biologia]
![Gabarito: Resposta da questão 1: [A] [Resposta do ponto de vista da disciplina de Biologia] Gabarito: Resposta da questão 1: [A] [Resposta do ponto de vista da disciplina de Biologia]](/thumbs/65/53126075.jpg) Gabarito: Resposta da questão 1: [Resposta do ponto de vista da disciplina de Biologia] A dissolução do cloreto de sódio à água pura eleva o seu ponto de ebulição. O aquecimento do meio de cultura provocava
Gabarito: Resposta da questão 1: [Resposta do ponto de vista da disciplina de Biologia] A dissolução do cloreto de sódio à água pura eleva o seu ponto de ebulição. O aquecimento do meio de cultura provocava
FUVEST ª Fase (Questões 1 a 7)
 1ª Fase (Questões 1 a 7) Provas de Vestibular 1. O ácido gama-hidroxibutírico é utilizado no tratamento do alcoolismo. Esse ácido pode ser obtido a partir da gamabutirolactona, conforme a representação
1ª Fase (Questões 1 a 7) Provas de Vestibular 1. O ácido gama-hidroxibutírico é utilizado no tratamento do alcoolismo. Esse ácido pode ser obtido a partir da gamabutirolactona, conforme a representação
TB DE RECUPERAÇÃO DE QUÍMICA 2ºTRIMESTRE DE 2016 PROF: LUCIA SÉRIE: 2º EM TURMA: A-B-C LEVE ESTA FOLHA PARA A AULA DE RECUPERAÇÃO- 29/08/2016
 TB DE RECUPERAÇÃO DE QUÍMICA 2ºTRIMESTRE DE 2016 PROF: LUCIA SÉRIE: 2º EM TURMA: A-B-C LEVE ESTA FOLHA PARA A AULA DE RECUPERAÇÃO- 29/08/2016 OBS: a) O trabalho deverá ser entregue no dia da prova de recuperação(8/09/2016)
TB DE RECUPERAÇÃO DE QUÍMICA 2ºTRIMESTRE DE 2016 PROF: LUCIA SÉRIE: 2º EM TURMA: A-B-C LEVE ESTA FOLHA PARA A AULA DE RECUPERAÇÃO- 29/08/2016 OBS: a) O trabalho deverá ser entregue no dia da prova de recuperação(8/09/2016)
8ª LISTA - EXERCÍCIOS DE PROVAS Equilíbrio de Solubilidade
 Pg. 1/6 1 a Questão De acordo com as equações abaixo, a 25 ºC, faça o que se pede. BaF 2 (s) Ba 2+ (aq) + 2F - (aq) K ps (BaF 2 ) = 1,7 x 10-6 BaSO 4 (s) Ba 2+ (aq) + SO 2-4 (aq) K ps (BaSO 4 ) = 1,0 x
Pg. 1/6 1 a Questão De acordo com as equações abaixo, a 25 ºC, faça o que se pede. BaF 2 (s) Ba 2+ (aq) + 2F - (aq) K ps (BaF 2 ) = 1,7 x 10-6 BaSO 4 (s) Ba 2+ (aq) + SO 2-4 (aq) K ps (BaSO 4 ) = 1,0 x
Professora Talita Marcília Lista de Exercícios
 assa Atômica 1. (Unimontes 2014) O cloro presente no PVC tem dois isótopos estáveis. O cloro-35, com massa 34,97u, constitui 75,77% do cloro encontrado na natureza. O outro isótopo é o cloro-37, de massa
assa Atômica 1. (Unimontes 2014) O cloro presente no PVC tem dois isótopos estáveis. O cloro-35, com massa 34,97u, constitui 75,77% do cloro encontrado na natureza. O outro isótopo é o cloro-37, de massa
Qui. Allan Rodrigues Xandão (Victor Pontes)
 Semana 18 Allan Rodrigues Xandão (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. Diluição
Semana 18 Allan Rodrigues Xandão (Victor Pontes) Este conteúdo pertence ao Descomplica. Está vedada a cópia ou a reprodução não autorizada previamente e por escrito. Todos os direitos reservados. Diluição
Química. Resolução das atividades complementares. Q13 Massa molar e mol
 Resolução das atividades complementares 1 Química Q13 Massa molar e mol p. 75 1 (Univali-SC) A urina apresenta 5% de água e 5% de substâncias orgânicas e inorgânicas dissolvidas. Em um litro de urina,
Resolução das atividades complementares 1 Química Q13 Massa molar e mol p. 75 1 (Univali-SC) A urina apresenta 5% de água e 5% de substâncias orgânicas e inorgânicas dissolvidas. Em um litro de urina,
SOLUÇÕES E CONCENTRAÇÃO
 1. (Uerj 2016) Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo
1. (Uerj 2016) Para diferenciar os hidrocarbonetos etano e eteno em uma mistura gasosa, utiliza-se uma reação com bromo molecular: o etano não reage com esse composto, enquanto o eteno reage de acordo
UDESC 2016/2 QUÍMICA. Comentário. I. Verdadeira. 0,07 mg 1 kg x mg 14 kg. Na 2 PO 3. F 144 g 19 g 7,58 mg x mg. x = 0,98 (limite de ingestão diária)
 QUÍMICA I. Verdadeira. 0,07 mg 1 kg x mg 14 kg x = 0,98 (limite de ingestão diária) Na PO 3 F 144 g 19 g 7,58 mg x mg x = 1 mg (que já é maior que o limite de ingestão diária) 1 II. Verdadeira. 0,07 mg
QUÍMICA I. Verdadeira. 0,07 mg 1 kg x mg 14 kg x = 0,98 (limite de ingestão diária) Na PO 3 F 144 g 19 g 7,58 mg x mg x = 1 mg (que já é maior que o limite de ingestão diária) 1 II. Verdadeira. 0,07 mg
QUÍMICA RECUPERAÇÃO PARALELA. Prof. ALEXANDRE D. MARQUIORETO
 QUÍMICA RECUPERAÇÃO PARALELA Prof. ALEXANDRE D. MARQUIORETO SOLUÇÕES são misturas homogêneas de duas ou mais substâncias. SOLUÇÃO = SOLUTO + SOLVENTE Que se dissolve Que dissolverá Como se forma uma solução?
QUÍMICA RECUPERAÇÃO PARALELA Prof. ALEXANDRE D. MARQUIORETO SOLUÇÕES são misturas homogêneas de duas ou mais substâncias. SOLUÇÃO = SOLUTO + SOLVENTE Que se dissolve Que dissolverá Como se forma uma solução?
gás ou sólido (soluto)
 AULA 12 Soluções SOLUÇÃO Qualquer mistura homogênea é uma solução. A solução é formada pela união do soluto e do solvente. Soluto: é a substância que está sendo dissolvida. Solvente: é a substância que
AULA 12 Soluções SOLUÇÃO Qualquer mistura homogênea é uma solução. A solução é formada pela união do soluto e do solvente. Soluto: é a substância que está sendo dissolvida. Solvente: é a substância que
BIOLOGIA - 2 o ANO MÓDULO 10 EXCREÇÃO HUMANA
 BIOLOGIA - 2 o ANO MÓDULO 10 EXCREÇÃO HUMANA Fixação 1) A ingestão de álcool inibe a liberação de ADH (hormônio antidiurético) pela hipófise. Assim sendo, espera-se que um homem alcoolizado: a)
BIOLOGIA - 2 o ANO MÓDULO 10 EXCREÇÃO HUMANA Fixação 1) A ingestão de álcool inibe a liberação de ADH (hormônio antidiurético) pela hipófise. Assim sendo, espera-se que um homem alcoolizado: a)
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a
 01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
Docente: Prof a. Dr a. Luciana M. Saran
 FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Sais e Hidrólise Salina Docente: Prof a. Dr a. Luciana M. Saran 1. OBJETIVOS Discutir as propriedades ácido-base dos sais em soluções aquosas;
FCAV/ UNESP Jaboticabal Disciplina: Química Geral Assunto: Sais e Hidrólise Salina Docente: Prof a. Dr a. Luciana M. Saran 1. OBJETIVOS Discutir as propriedades ácido-base dos sais em soluções aquosas;
Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA. Seleção 2019/1
 Seleção 2019/2 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO.
Seleção 2019/2 Programa de Pós-Graduação em Química UNIFAL-MG PROVA ESCRITA DE CONHECIMENTOS GERAIS EM QUÍMICA Orientações Importantes: 1) IDENTIFIQUE TODAS AS FOLHAS DA PROVA COM SEU NÚMERO DE INSCRIÇÃO.
C O L É G I O I M P E R AT R I Z L E O P O L D I N A
 C O L É G I O I M P E R AT R I Z L E O P O L D I N A Ensino Médio Trimestre: 1º Revisão para P1 1º Trimestre Disciplina: Química (2) Série: 2º ano Professor: Ricardo Honda Aluno(a): N : Conteúdos: - Capítulo
C O L É G I O I M P E R AT R I Z L E O P O L D I N A Ensino Médio Trimestre: 1º Revisão para P1 1º Trimestre Disciplina: Química (2) Série: 2º ano Professor: Ricardo Honda Aluno(a): N : Conteúdos: - Capítulo
Qui. Professores: Allan Rodrigues Xandão Monitor: Renan Micha
 Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
Semana 19 Professores: Allan Rodrigues Xandão Monitor: Renan Micha Ao adicionarmos solutos não voláteis a um solv EXERCÍCIOS DE AULA 1. 2NaHCO 3(s) Na 2CO 3(s) + CO 2(g) + H 2O (g) Relativamente à equação
B) Defina a que forma de apresentação do alumínio corresponde cada uma das curvas. Justifique sua resposta.
 Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
Questão 01 PROVA DISCURSIVA QUÍMICA O gráfico abaixo representa a variação, em função do tempo, da concentração, em quantidade de matéria, do hidrogênio gasoso formado em duas reações químicas de alumínio
Centro Universitário Padre Anchieta Faculdade de Engenharia Química Química Analítica Quantitativa Prof. Vanderlei Lista 2
 Lista 1. Um dos parâmetros que determina a qualidade do azeite de oliva é sua acidez, normalmente expressa na embalagem na forma de porcentagem, e que pode ser associada diretamente ao teor de ácido oleico
Lista 1. Um dos parâmetros que determina a qualidade do azeite de oliva é sua acidez, normalmente expressa na embalagem na forma de porcentagem, e que pode ser associada diretamente ao teor de ácido oleico
29/03/ TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A
 29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
29/03/2016 - TRANSFORMAÇÕES QUÍMICAS PROVA 1 GABARITO - prova tipo A Texto para as questões 1 a 10: O permanganato de potássio (KMnO 4 ) é um forte agente oxidante. Em laboratório, pode ser empregado para
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica
 PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do
PROVA FINAL DE QUÍMICA ANALÍTICA 1 /2015 Departamento de Química - Setor de Química Analítica *Obs: Esta prova vale 23 pontos, pois tem um bônus de 3 pontos em uma questão extra.* Boa Prova!!! Nome do
Escolha uma vitamina OU um mineral e descreva:
 Escolha uma vitamina OU um mineral e descreva: D) risco de excesso e deficiência. VITAMINA E: a) Atletismo b) É antioxidante e actua protegendo a membrana celular; reduz e retarda lesões nos tecidos musculares;
Escolha uma vitamina OU um mineral e descreva: D) risco de excesso e deficiência. VITAMINA E: a) Atletismo b) É antioxidante e actua protegendo a membrana celular; reduz e retarda lesões nos tecidos musculares;
NOMENCLATURA DOS COMPOSTOS
 NOMENCLATURA DOS COMPOSTOS Prof. Dr. Cristiano Torres Miranda Disciplina: Química Geral QM81A Turmas Q13 e Q14 Moléculas e compostos moleculares Moléculas e fórmulas químicas Moléculas são reuniões de
NOMENCLATURA DOS COMPOSTOS Prof. Dr. Cristiano Torres Miranda Disciplina: Química Geral QM81A Turmas Q13 e Q14 Moléculas e compostos moleculares Moléculas e fórmulas químicas Moléculas são reuniões de
BC Transformações Químicas
 Transformações Químicas BC0307 Prof. Anderson O. Ribeiro http://www.andersonorzari.com BC 0307 Transformações Químicas ANDERSON ORZARI RIBEIRO Bloco B, 10º andar - Sala 1043 www.andersonorzari.com Transformações
Transformações Químicas BC0307 Prof. Anderson O. Ribeiro http://www.andersonorzari.com BC 0307 Transformações Químicas ANDERSON ORZARI RIBEIRO Bloco B, 10º andar - Sala 1043 www.andersonorzari.com Transformações
PROVA DE QUÍMICA. FONTE: Tabela Periódica da IUPAC/versão 2005 (adaptada). Acesso:
 PROVA DE QUÍMICA FONTE: Tabela Periódica da IUPAC/versão 2005 (adaptada) Acesso: http://wwwiupacorg/reports/periodic_table/ 16 QUESTÃO 25 Analise este gráfico, em que estão representadas as curvas de solubilidade
PROVA DE QUÍMICA FONTE: Tabela Periódica da IUPAC/versão 2005 (adaptada) Acesso: http://wwwiupacorg/reports/periodic_table/ 16 QUESTÃO 25 Analise este gráfico, em que estão representadas as curvas de solubilidade
