GGE RESPONDE - VESTIBULAR ITA 2010 (QUÍMICA) ALT ERNATIVA E. Dados: E. a) 0,75 b) 1,50 c) 1,75 d) 2,50 e) 3,25. Resolução:
|
|
|
- Ian Desconhecida Viveiros
- 6 Há anos
- Visualizações:
Transcrição
1 GG RSPOND - VSTIBULAR ITA 00 (QUÍMIA) QUÍMIA - 8// A figura ao lado a apreseta a curva de aquecimeto de 00 g de uma substâcia pura geérica o estado sólido. Sabe-se que o calor é forecido a uma velocidade costate de 500 cal mim -. Admite-se que ão há perda de calor para o meio ambiete, que a pressão é de atm durate toda a trasformação e que a substâcia sólida apreseta apeas um fase cristalia. osidere que sejam feitas as seguites afirmações em relação aos estágios de aquecimeto descritos a figura: I. No segmeto PQ ocorre aumeto de eergia ciética das éculas. II. No segmeto QR ocorre aumeto da eergia potecial. III. O segmeto RS tem icliação meor que o segmeto PQ porque o calor específico do sólido é maior que o calor específico do líquido. Das afirmações acima, está(ao) RRADA(S): a) apeas I b) apeas I, II e III c) apeas II e IV. d) apeas III e) apeas IV I. Verdadeiro. O aumeto de temperatura reflete aumeto de eergia ciética das partículas. II. verdadeiro. Na mudaça de fases, ocorre uma modificação das iterações itereculares. III. Verdadeiro. omo a taxa de calor forecido é costate e o calor de vaporização é maior que o de fusão, levará mais tempo a vaporização (ST) IV. Falso Uma icliação meor idica maior calor específico. ALT RNATIVA 0. istoricamete, a teoria atômica recebeu várias cotribuições de cietistas. Assiale a opção que apreseta, a ordem croológica ORRTA, os omes de cietistas que são apotados como autores de modelos atômicos. a) Dalto, Thomso, Rutherford e Bohr b) Thomso, Millika, Dalto e Rutherford c) Avogadro, Thomso, Bohr e Rutherford d) Lavoisier, Proust, Gay-Lussac e Thomso. e) Rutherford, Dalto, Bohr e Avogadro. roologicamete, Dalto propôs um modelo o qual cosiderava o átomo como esferas maciças e que apeas se recombiavam após uma reação química; Thomso icluiu a descoberta do elétro à estrutura atômica; Rutherford verificou a existêcia do úcleo atômico; Bohr descreveu o átomo de hidrogêio utilizado um modelo clássico-quâtico. ALT RNATIVA A 0. (g) é borbulhado e dissolvido em um solvete X. A solução resultate é ão-codutora em relação à correte elétrica. O solvete X deve ser ecessariamete a) polar. b) ão-polar. c) hidrofílico d) mais ácidos que e) meos ácido que omo a solução resultate é ão-codutora, o (g) ão se ecotra dissociado. Logo, o solvete X deve ser ecessariamete ão-polar. ALT RNATIVA B 0. Uma solução aquosa de 0, L - foi titulada como uma solução aquosa de NaO 0, L -. A figura ao lado apreseta a curva de titulação obtida em relação à codutâcia da solução de em fução do volume de NaO adicioado. om base as iformações apresetadas esta figura, assiale a opção RRADA. a) Os íos resposáveis pela codutâcia da solução o poto R são: +, - e Na +. b) Os íos resposáveis pela codutâcia da solução o poto S são: Na + e -. c) A codutâcia da solução o poto R é maior o poto S porque a mobilidade iôica dos íos presetes em R é maior que a dos íos presetes em S. d) A codutâcia da solução em T é maior que em S porque os íos O - têm maior mobilidade iôica que os íos -. e) No poto S, a solução apreseta eutralidade de cargas, o R, predomiâcia de cargas positivas e, o T, de cargas egativas. A eutralidade elétrica deve sempre existir. ALT RNATIVA 05. Uma barra de ferro e um fio de platia, coectados eletricamete a um voltímetro de alta impedâcia, são parcialmete imersos em uma mistura de soluções aquosas de FeSO (,0 L - ) e iseta de oxigêio. Um fluxo de gás hidrogêio é matido costate sobre a parte imersa da superfície da platia, com pressão omial P de,0 atm, e a força eletromotriz medida a 5 é igual a 0,9 V. osiderado-se que ambos os metais são quimicamete puros e que a platia é o pólo positivo do elemeto galvâico formado, assiale a opção ORRTA que apreseta o valor calculado do p desse meio aquoso. Dados: 0,000V; 0 a) 0,75 b),50 c),75 d),50 e),5 Re ações : Global : / Fe / Fe Fes Fe e aq aq g 0,0 V Fes aq Fe aq g Usado a equação de Nerst: Log Q ode : Fe P 0,V Q APÓS ADA PROVA, AOMPAN A RSOLUÇÃO DAS QUSTÕS NO SIT:
2 GG RSPOND - VSTIBULAR ITA 00 (QUÍMIA) 0,9 0, log 0,8 log 5,07 log p,5 ALT RNATIVA D x 06. A seguite reação ão-balaceada e icompleta ocorre em meio ácido: ro 7 O r O A soma dos coeficietes estequiométricos da reação completa e balaceada é igual a a). b). c) d) e) 55 r O O r 6O 7 O 7 Soma dos coeficietes: = ALT RNATIVA 07. osidere os seguites líquidos, todos a 5 : I. u (NO ) (aq) II. S () III. O (aq) IV. ( ) 6 O() V. (aq) VI. 6 6 () Assiale a opção que idica o(s) líquidos(s) solúvel(eis) em tetracloreto de carboo. a) Apeas I, III e V b) Apeas II, IV e VI c) Apeas III d) Apeas IV e) Apeas V omo o tetracloreto de carboo é apolar, serão solúveis apeas os líquidos apolares. ALT RNATIVA B 08. osidere o seguite mecaismo de reação geérica: A B A B etapa leta A B A B etapa rápida B B etapa rápida om relação a este mecaismo, assiale a opção RRADA. a) A reação global é represetada pela equação A A. b) B + é catalisador c) B + e B + são itermediários da reação. d) A lei de velocidade é descrita pela equação k A e) A reação é de seguda ordem. A etapa leta determia a ciética da reação. v k A B ALT RNATIVA D v. 09. A 5 e atm, uma solução de água pura cotedo algumas gotas de solução alcoólica de idicador ácido-base azul de bromoti apreseta coloração azulada. Nestas codições, certa quatidade de uma substãcia o estado sólido é adicioada e a solução tora-se amarelada. Assiale a opção que apreseta a substâcia sólida adicioada. a) Iodo b) Sacarose. c) Gelo seco. d) Nitrato de prata e) loreto de sódio. O azul de bromoti altera-se para amarelo em meio ácido. Assim, o gelo seco, por ser costituído por O, um óxido ácido, produz a alteração descrita. ALT RNATIVA 0. m cico béqueres foram adicioados 50mL de uma solução de referêcia, que cosiste de uma solução aquosa saturada em cloreto de prata, cotedo corpo de fudo, a 5 atm. A cada béquer, foram adicioados 50mL de uma solução aquosa diluída diferete, detre as seguites: I. Solução de cloreto de sódio a 5. II. Solução de Glicose a 5 III. Solução Iodeto de sódio a 5 IV. Solução de Nitrato de prata a 5 V. Solução de Sacarose 50 osidere que o corpo de fudo permaece em cotato com as soluções após rápida homogeeização das misturas aquosas e que ão ocorre formação de óxido de prata sólido. Nestas codições assiale a opção que idica a(s) solução(ões), detre as acima relacioadas, que altera(m) a costate de equilíbrio da solução de referêcia. a) Apeas I, III e IV b) Apeas I e IV c) Apeas II e V d) Apeas III e) Apeas V A costate de equilíbrio é defiida em termos das atividades das espécies iôicas evolvidas. A atividade de íos em solução depede da força iôica do meio. A força iôica, por sua vez, é afetada pela preseça de sais dissolvidos o meio. Além disso, a temperatura está diretamete relacioada com a costate de equilíbrio por meio da expressão G =- RTk. Assim, alterar a costate de equilíbrio as soluções I, II, III, IV. tretato, ão há alterativa que apresete este cojuto de opções. Dessa forma, acredita-se que apeas o efeito da temperatura seja cosiderado. Portato, resta a opção V. ALT RNATIVA. A 5 a atm, uma amostra de,0 L de água pura foi saturada com oxigêio gasoso (O ) e o sistema foi matido em equilíbrio essas codições. Admitido-se comportameto ideal para o O e sabedo-se que a costate da Lei de ery para esse gás dissolvido em água é igual a, x 0 - L - atm -, as codições do experimeto, assiale a opção ORRTA que exprime o valor calculado do volume, em L, de O solubilizado essa amostra. a), x 0 - b),6 x 0 - c),9 x 0 - d),6 x 0 - e), x 0 - Lei de ery O P O APÓS ADA PROVA, AOMPAN A RSOLUÇÃO DAS QUSTÕS NO SIT:
3 GG RSPOND - VSTIBULAR ITA 00 (QUÍMIA), 0 L atm PO atm O, 0 L O, 0 (oxigêio dissolvido em L) Aplicado lapeyro P V = RT V =, 0-0,08 98 V =,7 0 - L ALT RNATIVA. Um vaso de pressão com volume itero de 50 cm cotém gás itrogêio (N ) quimicamete puro, submetido à temperatura costate de 50 e pressão total de,0 atm. Assumido que o N se comporta como gás ideal, assiale a opção ORRTA que apreseta os respectivos valores uméricos de ecular e da massa especificam em kg m -, desse gás quado exposto às codições de pressão e temperatura apresetadas a),7 x 0 e, b), x 0 e, c) 5,9 x 0 e, d) 7, x 0 e, e) 8,7 x 0 e, V = 50 cm = 0,5L P = atm T = 50º 5k Aplicado lapeyro: PV = RT 0,5 = 0,08 5 = 0,06 0,06 6,0 0 éculas,0 0 éculas PM 8 d d d,g/ L,kg / m RT 0,08 5 ALTRNATIVA D. Um recipiete cotedo gás hidrogêio ( ) é matido à temperatura costate de 0. Assumido que, essa codição, o é um gás ideal e sabedo-se que a velocidade média das éculas desse gás, essa temperatura, é de,85 0 ms -, assiale a alterativa ORRTA que apreseta o valor calculado da eergia ciética média, em J, de uma úica écula de. a), 0 - b) 5,7 0 - c), 0 - d) 5,7 0 - e),8 0-8 mv,0 0 kg (,85 0 m s ) c 6,0 0 c = 5,7 0 - J ALTRNATIVA D. Assiale a opção que apreseta a afirmação ORRTA sobre uma reação geérica de ordem zero em relação ao reagete X. a) A velocidade iicial de X é maior que sua velocidade média. b) A velocidade iicial de X varia com a cocetração iicial de x c) A velocidade de cosumo de X permaece costate durate a reação. d) O gráfico do logaritimo atural de x versus o iverso do tempo é represetado por uma reta. e) O gráfico da cocetração de X versus tempo é represetado por uma curva expoecial decrescete. 5. Uma solução aquosa saturada em fosfato de estrôcio Sr PO está em equilíbrio químico à temperatura de 5, e a cocetração de equilíbrio do ío estrôcio, esse sistema, é de 7,5 0-7 L -. osiderado-se que ambos os reagetes (água e sal iorgâico) são quimicamete puros, assiale a alterativa ORRTA com o Sr. valor do pk PS(5) do PO Dado: K PS = costate do produto de solubilidade. a) 7,0 b),0 c) 5,0 d),0 e) 5,0 Sr PO s Sr aq POaq 7 7 Sr 7,5 0 M, etão : PO 7,5 0 7 PO 5 0 M como Assim : Kps Sr PO 7 7 7, Logo pkps log pkps 7 7 7, log 7,5 0 log5 0 pkps 8,7,6 pkps 0,97 ALTRNATIVA D 6. Sabe-se que a 5 as etalpias de combustão (em kj - ) de grafita, gás hidrogêio e gás metao são, respectivamete: -95,5; -85,9 e -890,5. Assiale a alterativa que apreseta o valor ORRTO de etalpia da seguite reação: grafita g g a) -, kj - b) -7,8 kj - c) 7,8 kj - d) 6, kj - e), kj - Reações de combustão evolvidas grafita g g I : grafita Og Og II : III : 9,5 kj g g O O 85,9 57,8 kj g g O O O 890,5 kj A reação que costa a questão é obtida pela seguite soma: I II III R R 9,5 57,8 890,5 78 kj ALTRNATIVA B Ordem zero idica velocidade costate. ALTRNATIVA APÓS ADA PROVA, AOMPAN A RSOLUÇÃO DAS QUSTÕS NO SIT:
4 GG RSPOND - VSTIBULAR ITA 00 (QUÍMIA) 7. Uma lâmpada icadescete comum cosiste de um bulbo de vidro preechido com um gás e de um filameto metálico que se aquece e emite luz quado percorrido por correte elétrica. Assiale a opção com a afirmação RRADA a respeito de características que o filameto metálico deve apresetar para o fucioameto adequado da lâmpada. a) O filameto deve ser feito com um metal de elevado poto de fusão. b) O filameto deve ser feito com um metal de elevada pressão de vapor. c) O filameto deve apresetar resistêcia à passagem de correte elétrica. d) O filameto deve ser feito com um metal que ão reaja com o gás cotido o bulbo. e) O filameto deve ser feito com um metal dúctil para permitir a produção de fios fios. levada pressão de vapor idicaria uma alta volatilidade, ou seja, sob altas temperaturas, o filameto se degradaria. ALTRNATIVA B 8. m um processo de eletrodeposição de íquel, empregou-se um eletrodo ativo de íquel e um eletrodo de cobre, ambos parcialmete imersos em uma solução aquosa cotedo sais de íquel (cloreto e sulfato) dissolvidos, sedo este eletrólito tampoado com ácido bórico. No decorrer do processo, coduzido à temperatura de 55 e pressão de atm, íquel metálico depositou-se sobre a superfície do eletrodo de cobre. osidere que as seguites afirmações sejam feitas: I. Ocorre formação de gás cloro o eletrotodo cobre. II. A cocetração de íos cobre aumeta a solução eletrolítica. III. Ocorre formação de hidrogêio gasoso o eletrodo de íquel. IV. O ácido bórico promove a precipitação de íquel a forma de produto isolúvel o meio aquoso. om relação ao processo de eletroposição acima descrito, assiale a opção ORRTA. a) Todas as afirmações são verdadeiras. b) Apeas a afirmação IV é verdadeira. c) Apeas a afirmação III é falsa. d) Apeas as afirmações II e IV são falsas. e) Todas as afirmações são falsas. I. (falsa) A reação que ocorre o eletrodo de cobre correspode à formação de íquel metálico: Ni + (aq) + e - Ni (s) II. (falsa) o eletrodo de cobre é o cátodo, ou seja, ão pode ocorrer oxidação do cobre. III. (falsa) como o eletrodo de íquel é o âodo, ão pode ocorrer a redução do + e. IV. (falsa) segudo o próprio euciado da questão, o ácido bórico é usado como tampão. Assim,os íos borato ão poderiam precipitar, pois isso impediria a formação desse sistema tampoado. ALTRNATIVA 9. osidere duas reações químicas, matidas à temperatura e pressão ambietes, descritas pelas equações abaixo: I. (g) + / O (g) O(g) II. (g) + / O (g) 0(l) Na reação I: = -0,5 omo: = U + RT e U < 0, oclui-se que: U ALTRNATIVA B 0. osidere o composto aromático do tipo 6 5Y, em que Y represeta um grupo fucioal ligado ao ael. Assiale a opção RRADA com relação ao(s) produto(s) preferecialmete formado(s) durate a reação de itração deste tipo de composto as codições experimetais apropriadas. a) Se Y represetar o grupo, o produto formado será o m- itrotolueo. b) Se Y represetar o grupo OO, o produto formado será o ácido m-itro bezóico. c) Se Y represetar o grupo N, os produtos formados serão o-itroailia e p-itroailia. d) Se Y represetar o grupo NO, o produto formado será o,- diitrobezeo. e) Se Y represetar o grupo O, os produtos formados serão o- itrofeol e p-itrofeol. Dado que o grupameto é um orietador orto/para, os pricipais produtos serão o orto-itrotolueo e o meta-itrotolueo. ALTRNATIVA A. Determie o valor aproximado do p o poto de equivalêcia, quado se titula 5,0 ml de ácido acético 0,000 L - com hidróxido de sódio 0,000 L -. Sabe-se que log = 0, e Ka =, Reação quivalêcia : OO NaO OO Na 0 5mL 0,M,5 0 5mL 0,M,5 0 O sal formado sofre hidrólise alcalia: OO O 0,05 M Kh OO O Kw OO Ka x 0 0,05,8 0 5 X, x 5,7 0 M OO x O x,5 0 a) As reações e II são exotérmicas. b) Na reação, o valor, em módulo, da variação de etalpia é meor que o da variação de eergia itera. c) O valor, em módulo, da variação de eergia itera da reação é meor que o da reação II. d) O valor, em módulo, da variação de etalpia da reação i é meor que o da reação II. e) A capacidade calorífica do produto da reação i é meor que a do produto da reação II. 6 O 5,7 0 M po 5, 78 p 8, 7 APÓS ADA PROVA, AOMPAN A RSOLUÇÃO DAS QUSTÕS NO SIT:
5 GG RSPOND - VSTIBULAR ITA 00 (QUÍMIA). Propoha um método de obteção de sulfato de cobre aidro a partir de uma reação de eutralização. xpresse as etapas para a sua obteção por meio de equações químicas, idicado as codições ecessárias para que cada etapa seja realizada. tapa I: Oxidação do cobre u(s) + O ( g) uo (s ) tapa II: Neutralização do óxido por SO : uo( s) SO uso O( ) ( aq) (aq) tapa III: Destilação da solução de uso uso O (aq) (s) (v) uso (aq). A itrogliceria, 5(ONO ) (), é um óleo deso que detoa se aquecido a 8 ou quado é submetido a um choque mecâico. screva a equação que represeta a reação química do processo, sabedo que a reação de decomposição é completa, e explique porque a écula é explosiva. Reação química do processo: 5 (ONO ) ( ) 6N(g) O(g) 0 O(g) 7O(g) A écula de itrogliceria é extremamete istável, devido ao grade volume dos grupos (O-NO ) ligados aos carboos. A explosão é favorecida pela formação de éculas estáveis (N, O e O por exemplo). Além disso, ocorre uma trasferêcia da eergia de ligação para as éculas formadas, a forma de eergia ciética promovedo uma rápida expasão dos gases formados.. Foram realizadas duas experiêcias com dois ovos de galiha. Iicialmete, ambos foram imersos em viagre até a dissolução total da casca, que pode ser cosiderada costituída prioritariamete por carboato de cálcio. Os ovos evoltos apeas em suas membraas foram cuidadosamete retirados do viagre e deixados secar por um breve período. A seguir, um ovo foi imerso em água pura e, o outro, uma solução saturada de sacarose, sedo ambos assim matidos até se observar variação volumétrica de cada ovo. a) screva a equação química balaceada que descreve a reação de dissolução da casca de ovo. b) O volume dos ovos imersos os líquidos deve aumetar ou dimiuir? xplique sucitamete por que estas variações volumétricas ocorrem. a) ao OO (aq) a (aq) O OO(aq) () b) O ovo imerso em água deve aumetar de volume, pois a água passa através da membraa pelo processo de osmose. O ovo imerso em solução de sacarose deve dimiuir de volume, pois a água o iterior do ovo tede a tetar reduzir a cocetração da solução de sacarose. (aq) a) Propoha um mecaismo de reação para o processo descrito a figura, idicado a reação global. b) Idique a etapa leta do processo e escreva a lei de velocidade da reação. c) Baseado a sua resposta ao item b) e cohecedo as cocetrações de A, B e em fução do tempo, explique como determiar a costate de velocidade desta reação. a) Mecaismo: I : A B II : D Reação global: A B D b) A etapa é aquela que apreseta a maior eergia de ativação. De acordo com a curva de variação de eergia em fução de camiho de reação, a etapa mais leta será: D A lei de velocidade, portato, é: V K omo ão aparece a reação global, deve-se expressar a Lei de Velocidade em fução de A e B. osiderado a etapa I em equilíbrio, temos: A B V k K K AB V k No equílibrio, V V ka B K K K AB Assim, a lei de velocidade será: k v k [A] [B] v k'[a] [B] k k' c) Admita que [A] >>[B] v = k * [B], com k * = k [A] trasformado a equação origial em uma pseudo-ª ordem, traçamos um gráfico da cocetração de B em fução do tempo. B B 0 5. osidere a curva de variação da eergia potecial das espécies A, B,, D e, evolvidas em uma reação química geérica, em fução do camiho da reação, apresetada a figura ao lado. Supoha que a reação teha sido acompahada experimetalmete, medido-se as cocetrações de A, B e em fução do tempo. B 0 t 0 t/ t t t Mas l t/ * k Logo, * k l k' k' t A / A APÓS ADA PROVA, AOMPAN A RSOLUÇÃO DAS QUSTÕS NO SIT: 5
6 GG RSPOND - VSTIBULAR ITA 00 (QUÍMIA) 6. Dada a fórmula ecular, apresete as fórmulas estruturais dos compostos de cadeia aberta que apresetam isomeria geométrica e dê seus respectivos omes. l l cis-,-dicloro--propeo l l l cis-,-dicloro--propeo l l tras-,-dicloro--propeo l l tras-,-dicloro--propeo 7. osidere que certa solução aquosa preparada recetemete cotém itratos dos seguites cátios: Pb +, u +, Fe + e Ag +. Descreva um procedimeto experimetal para separar esses íos, supodo que você dispõe de placas polidas dos seguites metais puros: zico, cobre, ferro, prata, chumbo e outro e os istrumetos de vidro adequados. Descreva cada etapa experimetal e apresete todas as equações químicas balaceadas. Dados: 0 Z / Z 0,76V 0 Fe / Fe 0, V 0 Pb / Pb 0,V 0 Ag / Ag 0,80V 0 u / u 0,V 0, V 0 Au / Au 0,80V,0 V tapa I Mergulha-se a solução uma chapa de cobre. O cobre se oxida, provocado a redução da prata: Ag u (s) Ag (s) u (aq) (aq ) A solução resultate deverá estar praticamete iseta de íos Ag +. tapa II Mergulha-se a placa de chumbo a solução resultate: Pb ( s) u (aq) Pb (aq) u(s) A solução fica iseta de Ag + e u + tapa III Mergulha-se a placa de ferro a solução: Fe ( s) Pb (aq) Fe (aq) Pb(s) A solução agora apreseta apeas íos Fe (aq) tapa IV Mergulha-se a placa de zico: Z ( s) Fe (aq) Z (aq) Fe(s) Assim todos íos foram extraídos separadamete a forma metálica. 8. osidere que as reações químicas represetadas pelas equações ão balaceadas abaixo ocorram em codições experimetais apropriadas e que as espécies A, B,, D, e F represetam os produtos destas reações. 6 6O + I A + B I + Na + D I + Na + F Apresete as equações químicas balaceadas e os respectivos produtos. I I Na NaI I Na NaI Obs.: a ª reação, o correto deveria ser 6 5O e ão 6 6O coforme mostrado o euciado. 9. Uma chapa metálica de cobre recoberta com uma camada passiva de óxido de cobre (I) é imersa em um recipiete de vidro cotedo água destilada acidificada (p = ) e gás oxigêio (O ) dissolvido, sedo a temperatura e a pressão deste sistema iguais a 5 e atm, respectivamete. Admitido-se que a cocetração iicial de equilíbrio dos íos de cobre (II) a solução aquosa é de 0-6 L - e, cosiderado que, essas codições, a camada de óxido que evolve o metal pode ser dissolvida: a) screva a equação química balaceada da reação que represeta o processo de corrosão do u O(s) o referido meio líquido com o O (g) dissolvido. b) Determie o valor umérico da pressão de oxigêio, expresso em atm, a partir do qual o u O(s) apreseta tedêcia termodiâmica de sofrer corrosão espotâea o meio descrito acima. Dados: 0 u 0 /u O 0,0V; O / O,V ; a) u O (s) O (aq) (aq) u (aq) O ( ) b) cálculo do potecial padrão: 0 O O reação O / O u /u O =,V 0,0V = =,0V quação de NRNST: 0 log Q odições: 6 u 0 M 0 M Para que a corrosão seja espotâea, > 0: log Q 0 0 u,0 log P O 0 log Q 0-0,0 0,095 log 6 P O 0,0 0,095 log0 0 0 logp O / 0 APÓS ADA PROVA, AOMPAN A RSOLUÇÃO DAS QUSTÕS NO SIT: 6
7 GG RSPOND - VSTIBULAR ITA 00 (QUÍMIA),0 0,095 logp 0,8 0,075 logpo 0,075 logpo log PO 6,8 O 0,9 7 PO,0 0 atm 0,0 0,8 0 8 h h 6 0 cm 50 6 h 0,0006 m 0. obre metálico exposto à atmosfera ambiete úmida sofre corrosão, com formação de cuprita (u O) sobre a sua superfície. ste fato é comprovado em laboratório com a aplicação de correte elétrica, proveiete de um gerador d correte cotíua, em um eletrodo de cobre ( iseto de óxido) imerso uma solução aquosa eutra de cloreto de potássio (p = 7) cotedo oxigêio gasoso (O ) dissolvido. osidere que esse procedimeto é realizado as seguites codições: I. letrodos metálicos empregados: catodo de platia e aodo de cobre. II. Área imersa do aodo: 50,0 cm III. Desidade de correte aplicada: 0,0 A cm - IV. Tempo de eletrólise: 50s Baseado o procedimeto experimetal acima descrito: a) screva as equações químicas balaceadas que represetam as reações evolvidas a formação da cuprita sobre cobre metálico. b) alcule o valor umérico da massa de cuprita, expressa em g, formada sobre a superfície do aodo. c) Sabedo que a massa específica média da cuprita é igual a 6,0 g cm -, calcule o valor umérico da espessura média, expressa em m, desse óxido formado durate a eletrólise. i Aodo atodo u Pt O K p 7 a) u e Aodo u s aq O Oaq e O atodo us O Oaq uaq O aq b) 6 J 0 0 A / cm 6 i J Si uoaq uos O,5mA S 50cm Q i. tq, ,75 0, ,8 F uo x,g / F,8 F 6 x 0,9 muo 0,9, 0 0,8 mg c) m m d ; V S h h v S d APÓS ADA PROVA, AOMPAN A RSOLUÇÃO DAS QUSTÕS NO SIT: 7
ELETROQUÍMICA TÓPICOS EXTRAS
 ELETROQUÍMCA TÓPCOS EXTRAS trodução Este artigo tem por fialidade tratar de assutos relacioados com a Eletroquímica que têm sido largamete cobrados os vestibulares do ME e do TA. remos tratar e mostrar
ELETROQUÍMCA TÓPCOS EXTRAS trodução Este artigo tem por fialidade tratar de assutos relacioados com a Eletroquímica que têm sido largamete cobrados os vestibulares do ME e do TA. remos tratar e mostrar
CINÉTICA QUÍMICA FATORES DE INFLUÊNCIA - TEORIA
 Itrodução CINÉTICA QUÍMICA FATORES DE INFLUÊNCIA - TEORIA A Ciética Química estuda a velocidade com a qual as reações acotecem e os fatores que são capazes de realizar ifluêcia sobre ela. A medida mais
Itrodução CINÉTICA QUÍMICA FATORES DE INFLUÊNCIA - TEORIA A Ciética Química estuda a velocidade com a qual as reações acotecem e os fatores que são capazes de realizar ifluêcia sobre ela. A medida mais
Questões Resolvidas de EquaÇão de Nernst
 Questões Resolvidas de EquaÇão de Nerst. (ITA 3) É ERRADO afirmar que, à temperatura de 5 C, o potecial de um eletrodo de cobre costruído pela imersão de uma placa de cobre em solução aquosa mol L de cloreto
Questões Resolvidas de EquaÇão de Nerst. (ITA 3) É ERRADO afirmar que, à temperatura de 5 C, o potecial de um eletrodo de cobre costruído pela imersão de uma placa de cobre em solução aquosa mol L de cloreto
P2 - PROVA DE QUÍMICA GERAL - 21/10/06
 P2 - PROVA DE QUÍMICA GERAL - 21/10/06 Nome: Nº de Matrícula: Gabarito Turma: Assiatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 a 2,5 Total 10,0 Costates: R = 8,31 J mol -1 K -1 = 0,0821 atm
P2 - PROVA DE QUÍMICA GERAL - 21/10/06 Nome: Nº de Matrícula: Gabarito Turma: Assiatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 a 2,5 Total 10,0 Costates: R = 8,31 J mol -1 K -1 = 0,0821 atm
Professora Sonia. CUSC MEDICINA - Segundo Semestre CENTRO UNIVERSITÁRIO SÃO CAMILO
 CUSC 2017 - MEDICINA - Segudo Semestre CENTR UNIVERSITÁRI SÃ CAMIL 01. maracujá, por ser rico em potássio, cotribui para o cotrole da pressão arterial. A tabela apreseta os pricipais mierais ecotrados
CUSC 2017 - MEDICINA - Segudo Semestre CENTR UNIVERSITÁRI SÃ CAMIL 01. maracujá, por ser rico em potássio, cotribui para o cotrole da pressão arterial. A tabela apreseta os pricipais mierais ecotrados
R I. (V) Segmento PQ ocorre um aumento da temperatura, então aumenta a energia cinética das moléculas.
 A figura abaixo apresenta a curva de aquecimento de 100 g de uma substância pura genérica no estado sólido. Sabe-se que calor é fornecido a uma velocidade constante de 500 cal min -1. Admite-se que não
A figura abaixo apresenta a curva de aquecimento de 100 g de uma substância pura genérica no estado sólido. Sabe-se que calor é fornecido a uma velocidade constante de 500 cal min -1. Admite-se que não
CUSC MEDICINA - Primeiro Semestre CENTRO UNIVERSITÁRIO SÃO CAMILO
 US 016 - MEDIINA - Primeiro Semestre ENTR UNIVERSITÁRI SÃ AMIL 01. A quatidade média de sódio (massa molar g/mol) ecotrada por pacote de 100 g de amostras de biscoito de polvilho aalisadas pela ANVISA
US 016 - MEDIINA - Primeiro Semestre ENTR UNIVERSITÁRI SÃ AMIL 01. A quatidade média de sódio (massa molar g/mol) ecotrada por pacote de 100 g de amostras de biscoito de polvilho aalisadas pela ANVISA
CUSC MEDICINA Primeiro Semestre CENTRO UNIVERSITÁRIO SÃO CAMILO
 US 019 - MEDIINA Primeiro Semestre ENTR UNIVERSITÁRI SÃ AMIL 01. Muitas ferrametas de seguraça são produzidas com uma liga de cobre-berílio (cohecida como u). Essa liga ão gera faíscas por atrito ou impacto,
US 019 - MEDIINA Primeiro Semestre ENTR UNIVERSITÁRI SÃ AMIL 01. Muitas ferrametas de seguraça são produzidas com uma liga de cobre-berílio (cohecida como u). Essa liga ão gera faíscas por atrito ou impacto,
CUSC MEDICINA - Primeiro Semestre CENTRO UNIVERSITÁRIO SÃO CAMILO
 US 017 - MEDIIA - Primeiro Semestre ETRO UIVERSITÁRIO SÃO AMILO 01. Em uma proveta, foram adicioados cuidadosamete volumes iguais dos diferetes líquidos idicados a tabela. osiderado que os líquidos ão
US 017 - MEDIIA - Primeiro Semestre ETRO UIVERSITÁRIO SÃO AMILO 01. Em uma proveta, foram adicioados cuidadosamete volumes iguais dos diferetes líquidos idicados a tabela. osiderado que os líquidos ão
TITULAÇÃO REDOX. Disciplina QUIO94 - Introdução à Análise Química 1 semestre Profa. Maria Auxiliadora Costa Matos
 Uiversidade Federal de Juiz de Fora Istituto de Ciêcias xatas Departameto de Química Disciplia QUIO94 - Itrodução à Aálise Química semestre 4 TITULAÇÃO RDOX Profa. Maria Auxiliadora Costa Matos Dowload
Uiversidade Federal de Juiz de Fora Istituto de Ciêcias xatas Departameto de Química Disciplia QUIO94 - Itrodução à Aálise Química semestre 4 TITULAÇÃO RDOX Profa. Maria Auxiliadora Costa Matos Dowload
TITULAÇÃO REDOX. Disciplina QUIO94 - Introdução à Análise Química II semestre Profa. Maria Auxiliadora Costa Matos
 Uiversidade Federal de Juiz de Fora Istituto de Ciêcias xatas Departameto de Química Disciplia QUIO94 - Itrodução à Aálise Química II semestre 8 TITULAÇÃO RDOX Profa. Maria Auxiliadora Costa Matos Dowload
Uiversidade Federal de Juiz de Fora Istituto de Ciêcias xatas Departameto de Química Disciplia QUIO94 - Itrodução à Aálise Química II semestre 8 TITULAÇÃO RDOX Profa. Maria Auxiliadora Costa Matos Dowload
Gases Introdução Lei de Boyle
 Itrodução Nos gases, as forças de atração itermoleculares são fracas, que permitem um movimeto rápido e idepedete das moléculas. Por outro lado, seu comportameto é cotrolado pelo seu volume, pressão, temperatura
Itrodução Nos gases, as forças de atração itermoleculares são fracas, que permitem um movimeto rápido e idepedete das moléculas. Por outro lado, seu comportameto é cotrolado pelo seu volume, pressão, temperatura
Química Analítica IV TITULOMETRIA DE OXI-REDUÇÃO
 Química Aalítica IV - I sem/ Profa Ma Auxiliadora - Química Aalítica IV semestre Profa. Maria Auxiliadora Costa Matos TITULOMTRIA D OXI-RDUÇÃO TITULOMTRIA RDOX Química Aalítica IV - I sem/ Profa Ma Auxiliadora
Química Aalítica IV - I sem/ Profa Ma Auxiliadora - Química Aalítica IV semestre Profa. Maria Auxiliadora Costa Matos TITULOMTRIA D OXI-RDUÇÃO TITULOMTRIA RDOX Química Aalítica IV - I sem/ Profa Ma Auxiliadora
TITULAÇÕES POR OXIREDUÇÃO. Qui-094 Introdução a Análise Química Profa Maria Auxiliadora Costa Matos
 TITULAÇÕS POR OXIRDUÇÃO Qui-94 Itrodução a Aálise Química Profa Maria Auxiliadora Costa Matos - TITULAÇÕS POR OXIRDUÇÃO As Titulações por oxiredução (Volumetria de oxiredução) baseiam-se em reações de
TITULAÇÕS POR OXIRDUÇÃO Qui-94 Itrodução a Aálise Química Profa Maria Auxiliadora Costa Matos - TITULAÇÕS POR OXIRDUÇÃO As Titulações por oxiredução (Volumetria de oxiredução) baseiam-se em reações de
TITULAÇÃO REDOX. Disciplina QUIO94 - Introdução à Análise Química 1 semestre Profa. Maria Auxiliadora Costa Matos
 Uiversidade Federal de Juiz de Fora Istituto de Ciêcias xatas Departameto de Química Disciplia QUIO94 - Itrodução à Aálise Química semestre 4 TITULAÇÃO RDOX Profa. Maria Auxiliadora Costa Matos Dowload
Uiversidade Federal de Juiz de Fora Istituto de Ciêcias xatas Departameto de Química Disciplia QUIO94 - Itrodução à Aálise Química semestre 4 TITULAÇÃO RDOX Profa. Maria Auxiliadora Costa Matos Dowload
P1 - PROVA DE QUÍMICA GERAL 18/09/06
 P1 - PROVA DE QUÍMICA GERAL 18/09/06 Nome: Nº de Matrícula: GABARITO Turma: Assiatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L -1 K -1 T (K ) T ( C) + 73,15 1 atm
P1 - PROVA DE QUÍMICA GERAL 18/09/06 Nome: Nº de Matrícula: GABARITO Turma: Assiatura: Questão Valor Grau Revisão 1 a,5 a,5 3 a,5 4 a,5 Total 10,0 Dados R 0,081 atm L -1 K -1 T (K ) T ( C) + 73,15 1 atm
FASM MEDICINA - Primeiro Semestre FACULDADE SANTA MARCELINA
 FASM 018 - MEDIINA - Primeiro Semestre FAULDADE SANTA MARELINA 01. Laboratórios químicos geram resíduos que causam impactos ambietais egativos. Esses resíduos devem ser adequadamete separados ates de seguirem
FASM 018 - MEDIINA - Primeiro Semestre FAULDADE SANTA MARELINA 01. Laboratórios químicos geram resíduos que causam impactos ambietais egativos. Esses resíduos devem ser adequadamete separados ates de seguirem
Introdução à Análise Química QUI semestre 2011 Profa. Maria Auxiliadora Costa Matos TITULOMETRIA DE OXI-REDUÇÃO
 Itrodução à Aálise Química QUI 94 semestre Profa. Maria Auxiliadora Costa Matos TITULOMTRIA D OXI-RDUÇÃO TITULOMTRIA RDOX As titulações por oxi-redução baseiam-se em reações de oxidação e redução, ou seja,
Itrodução à Aálise Química QUI 94 semestre Profa. Maria Auxiliadora Costa Matos TITULOMTRIA D OXI-RDUÇÃO TITULOMTRIA RDOX As titulações por oxi-redução baseiam-se em reações de oxidação e redução, ou seja,
Termodinâmica e Estrutura da Matéria. 19/Fev/2016 Aula 1
 Termodiâmica e Estrutura da Matéria 19/Fev/016 Aula 1 Temperatura e a Lei Zero da Termodiâmica Sistema Termodiâmico Termómetros e Escalas de Temperatura Descrição macroscópica dos gases ideais Equação
Termodiâmica e Estrutura da Matéria 19/Fev/016 Aula 1 Temperatura e a Lei Zero da Termodiâmica Sistema Termodiâmico Termómetros e Escalas de Temperatura Descrição macroscópica dos gases ideais Equação
QUÍMICA QUÍMICA. Questão 01
 QUÍMIA QUÍMIA Um composto de fórmula molecular AB 5 é costituído por elemetos que pertecem ao mesmo período de um determiado gás obre. Tal gás obre apreseta a mesma distribuição eletrôica que um ío de
QUÍMIA QUÍMIA Um composto de fórmula molecular AB 5 é costituído por elemetos que pertecem ao mesmo período de um determiado gás obre. Tal gás obre apreseta a mesma distribuição eletrôica que um ío de
Eletroquímica. Capítulo 10. 1. Dadas as reações de meia célula: Cu 2+ + e Cu + I 2 E 0 = 0,336 V. + 2e 2I E 0 = 0,536 V
 Capítulo 0 Eletroquímica. Dadas as reações de meia célula: Cu + + e Cu + E 0 = 0,53 V I + e I E 0 = 0,536 V pede-se: a) escrever a equação que represeta a reação global da célula; b) calcular o potecial
Capítulo 0 Eletroquímica. Dadas as reações de meia célula: Cu + + e Cu + E 0 = 0,53 V I + e I E 0 = 0,536 V pede-se: a) escrever a equação que represeta a reação global da célula; b) calcular o potecial
Química 5 aula 1. aula 2 COMENTÁRIOS ATIVIDADES PARA SALA COMENTÁRIOS ATIVIDADES PROPOSTAS. 7. ( F ) Raios x são prejudiciais aos pacientes.
 Química 5 aula 1 1. A alterativa icorreta ecotra-se em a, pois para a ideia de átomo idivisível, o que é por todo errado.. Atualmete, sabe-se que átomos do mesmo elemeto químico podem apresetar diferetes
Química 5 aula 1 1. A alterativa icorreta ecotra-se em a, pois para a ideia de átomo idivisível, o que é por todo errado.. Atualmete, sabe-se que átomos do mesmo elemeto químico podem apresetar diferetes
-0,4-0,6 -0,9 -1,5 -3,4 -13,6 EXERCÍCIOS
 EXERCÍCIOS FÍSICA MODERNA ÁTOMO DE BOHR PROF. MARENGÃO. (UFRN) Um átomo de hidrogêio, ao passar de um estado quâtico para outro, emite ou absorve radiação eletromagética de eergias bem defiidas. No diagrama
EXERCÍCIOS FÍSICA MODERNA ÁTOMO DE BOHR PROF. MARENGÃO. (UFRN) Um átomo de hidrogêio, ao passar de um estado quâtico para outro, emite ou absorve radiação eletromagética de eergias bem defiidas. No diagrama
Química Concentração das soluções Vestibular - FUVEST
 Química Cocetração das soluções Vestibular - FUVEST 1. (Fuvest 2014) Nos aos de 1970, o uso do iseticida DDT, também chamado de 1,1,1- tricloro-2,2-bis (para-clorofeil)etao, foi proibido em vários países.
Química Cocetração das soluções Vestibular - FUVEST 1. (Fuvest 2014) Nos aos de 1970, o uso do iseticida DDT, também chamado de 1,1,1- tricloro-2,2-bis (para-clorofeil)etao, foi proibido em vários países.
FASM MEDICINA - Segundo Semestre FACULDADE SANTA MARCELINA
 FASM 2016 - MEDIINA - Segudo Semestre FAULDADE SANTA MARELINA 01. No tratameto de esgotos, o método utilizado para a remoção de poluetes depede das características físicas, químicas e biológicas de seus
FASM 2016 - MEDIINA - Segudo Semestre FAULDADE SANTA MARELINA 01. No tratameto de esgotos, o método utilizado para a remoção de poluetes depede das características físicas, químicas e biológicas de seus
P1 - PROVA DE QUÍMICA GERAL 02/04/05
 P1 - PRVA DE QUÍMICA GERAL 0/04/05 Nome: Nº Matrícula: (Gabarito) Turma: Assiatura: Questão Valor Grau Revisão 1 a,0 a,0 3 a,0 4 a,0 5 a,0 Total 10,0 Dados R 0,081 atm L -1 K -1 K C + 73,15 1 atm 760,0
P1 - PRVA DE QUÍMICA GERAL 0/04/05 Nome: Nº Matrícula: (Gabarito) Turma: Assiatura: Questão Valor Grau Revisão 1 a,0 a,0 3 a,0 4 a,0 5 a,0 Total 10,0 Dados R 0,081 atm L -1 K -1 K C + 73,15 1 atm 760,0
CONSTANTES. 9,65x10 Cmol = 9,65x10 Asmol = 9,65x10 J V mol
 CONSTANTES Costate de Avogadro = Costate de Faraday (F) = 6,0 x0 mol Volume molar de gás ideal =,4 L (CNTP) Carga elemetar = Costate dos gases (R) = Costate gravitacioal (g) = 9,65x0 Cmol = 9,65x0 Asmol
CONSTANTES Costate de Avogadro = Costate de Faraday (F) = 6,0 x0 mol Volume molar de gás ideal =,4 L (CNTP) Carga elemetar = Costate dos gases (R) = Costate gravitacioal (g) = 9,65x0 Cmol = 9,65x0 Asmol
FENÔMENOS DE TRANSPORTE TERMODINÂMICA
 UNIERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO DEPARTAMENTO DE CIÊNCIAS AMBIENTAIS FENÔMENOS DE TRANSPORTE TERMODINÂMICA CICLO DE POTÊNCIA E DE REFRIGERAÇÃO CALOR E TRABALHO Prof. Roberto ieira Pordeus Mossoró-RN
UNIERSIDADE FEDERAL RURAL DO SEMI-ÁRIDO DEPARTAMENTO DE CIÊNCIAS AMBIENTAIS FENÔMENOS DE TRANSPORTE TERMODINÂMICA CICLO DE POTÊNCIA E DE REFRIGERAÇÃO CALOR E TRABALHO Prof. Roberto ieira Pordeus Mossoró-RN
Concentração de Soluções
 Esio Médio QUÍMICA Data: / /2012 Atividade: Exercícios de Recuperação Paralela e Aual aula 2 Nome : o Classe: 2 2MA Cocetração de Soluções 1 1. (Uisc 2012) Qual a cocetração em gl de uma solução de 500
Esio Médio QUÍMICA Data: / /2012 Atividade: Exercícios de Recuperação Paralela e Aual aula 2 Nome : o Classe: 2 2MA Cocetração de Soluções 1 1. (Uisc 2012) Qual a cocetração em gl de uma solução de 500
5. ANÁLISE DE SISTEMAS DA CONFIABILIADE DE SISTEMAS SÉRIE-PARALELO
 5. ANÁLISE DE SISTEMAS DA CONFIABILIADE DE SISTEMAS SÉRIE-PARALELO 5.1 INTRODUÇÃO Um sistema é defiido como todo o cojuto de compoetes itercoectados, previamete determiados, de forma a realizar um cojuto
5. ANÁLISE DE SISTEMAS DA CONFIABILIADE DE SISTEMAS SÉRIE-PARALELO 5.1 INTRODUÇÃO Um sistema é defiido como todo o cojuto de compoetes itercoectados, previamete determiados, de forma a realizar um cojuto
UNISA MEDICINA 2017 UNIVERSIDADE DE SANTO AMARO
 UNISA EDIINA 017 UNIVERSIDADE DE SANT AAR 01. s etais alcalios reage violetaete co água por reações de deslocaeto, produzido u coposto iôico e u gás cobustível. A reatividade desses etais varia o grupo
UNISA EDIINA 017 UNIVERSIDADE DE SANT AAR 01. s etais alcalios reage violetaete co água por reações de deslocaeto, produzido u coposto iôico e u gás cobustível. A reatividade desses etais varia o grupo
vem do gás sendo queimado. Sabendo que se formou 1 mol de CO (44g equivale a 1 mol desse composto), concluímos que havia 1 mol de átomos C no gás CH
 1) A equação (balaceada) da combustão é CxH x O xco HO 4 1 Perceba que todo o carboo presete o CO vem do gás sedo queimado. Sabedo que se formou 1 mol de CO (44g equivale a 1 mol desse composto), cocluímos
1) A equação (balaceada) da combustão é CxH x O xco HO 4 1 Perceba que todo o carboo presete o CO vem do gás sedo queimado. Sabedo que se formou 1 mol de CO (44g equivale a 1 mol desse composto), cocluímos
A QUÍMICA E A INDÚSTRIA
 A QUÍMICA E A INDÚSTRIA A idústria química, a partir de um pequeo úmero de substâcias aturais (matérias-primas), como a água do mar, o ar, o calcário, o salgema, o carvão, o petróleo e o gás atural, produz
A QUÍMICA E A INDÚSTRIA A idústria química, a partir de um pequeo úmero de substâcias aturais (matérias-primas), como a água do mar, o ar, o calcário, o salgema, o carvão, o petróleo e o gás atural, produz
(19) O ELITE RESOLVE ITA QUÍMICA QUÍMICA
 (9) 5- ELITE RESLVE ITA 5 - QUÍMICA DADS QUÍMICA CNSTANTES Costate de Avogadro = 6, mol - Costate de Faraday (F) = 9,65 C mol - = 9,65 A s mol - = 9,65 J V - mol - Volume molar de gás ideal =, L (CNTP)
(9) 5- ELITE RESLVE ITA 5 - QUÍMICA DADS QUÍMICA CNSTANTES Costate de Avogadro = 6, mol - Costate de Faraday (F) = 9,65 C mol - = 9,65 A s mol - = 9,65 J V - mol - Volume molar de gás ideal =, L (CNTP)
FMJ MEDICINA FACULDADE DE MEDICINA DE JUNDIAÍ
 Professora Soia FMJ 015 - MEDIINA FAULDADE DE MEDIINA DE JUNDIAÍ 09. A queia icopleta de cobustíveis gera oóxido de carboo, u gás iodoro, icolor e uito veeoso para o ser huao. Quado ialado, esse gás iterage
Professora Soia FMJ 015 - MEDIINA FAULDADE DE MEDIINA DE JUNDIAÍ 09. A queia icopleta de cobustíveis gera oóxido de carboo, u gás iodoro, icolor e uito veeoso para o ser huao. Quado ialado, esse gás iterage
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB
 AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
AULA DE RECUPERAÇÃO PROF. NEIF NAGIB ELETROQUÍMICA Estuda os fenômenos envolvidos na produção de corrente elétrica a partir da transferência de elétrons em reações de óxido-redução, e a utilização de corrente
1.1. Ordem e Precedência dos Cálculos 1) = Capítulo 1
 Capítulo. Aritmética e Expressões Algébricas O estudo de cálculo exige muito mais que o cohecimeto de limite, derivada e itegral. Para que o apredizado seja satisfatório o domíio de tópicos de aritmética
Capítulo. Aritmética e Expressões Algébricas O estudo de cálculo exige muito mais que o cohecimeto de limite, derivada e itegral. Para que o apredizado seja satisfatório o domíio de tópicos de aritmética
RADIOATIVIDADE- TEORIA PARTE I
 RDIOTIVIDDE- TEORI PRTE I Itrodução Radioatividade estuda a emissão atural ou provocada (artificial) de partículas e odas eletromagéticas pelos úcleos atômicos (uclídeos) de certos elemetos. Ela evolve
RDIOTIVIDDE- TEORI PRTE I Itrodução Radioatividade estuda a emissão atural ou provocada (artificial) de partículas e odas eletromagéticas pelos úcleos atômicos (uclídeos) de certos elemetos. Ela evolve
Respostas Saiba Mais Reações de Eliminação
 Respostas Saiba Mais Reações de Elimiação. F F V V F. De acordo com a regra de Saytzeff, o alqueo A seria o reagete adequado. A é um composto do tipo tras. B por apresetar dois ligates ) iguais o mesmo
Respostas Saiba Mais Reações de Elimiação. F F V V F. De acordo com a regra de Saytzeff, o alqueo A seria o reagete adequado. A é um composto do tipo tras. B por apresetar dois ligates ) iguais o mesmo
Olimpíada Brasileira de Química
 SO 2(g) + 2Cl 2(g) --> SOCl 2(g) + Cl 2 O (g) Olimpíada Brasileira de Química Olimpíada Brasileira de Química - 1999 Exame aplicado em 22.05.99 Questão 1 O dióxido de exôfre, SO 2, é um poluete do ar,
SO 2(g) + 2Cl 2(g) --> SOCl 2(g) + Cl 2 O (g) Olimpíada Brasileira de Química Olimpíada Brasileira de Química - 1999 Exame aplicado em 22.05.99 Questão 1 O dióxido de exôfre, SO 2, é um poluete do ar,
Instituto de Física USP. Física V - Aula 22. Professora: Mazé Bechara
 Istituto de Física USP Física V - Aula Professora: Mazé Bechara AVISO 1. Já se ecotra a págia da disciplia o TEC 3 para ser etregue até 9/5. Aula O Modelo Atômico de Bohr 1. As hipóteses do modelo de Bohr
Istituto de Física USP Física V - Aula Professora: Mazé Bechara AVISO 1. Já se ecotra a págia da disciplia o TEC 3 para ser etregue até 9/5. Aula O Modelo Atômico de Bohr 1. As hipóteses do modelo de Bohr
Exercícios sobre titulação ou titulometria
 Professora Soia Exercícios sobre titulação ou titulometria 01. (ITA) Assiale a opção que apreseta os istrumetos de medição de volume mais idicados para a realização de uma titulação. a) Bureta e erlemeyer
Professora Soia Exercícios sobre titulação ou titulometria 01. (ITA) Assiale a opção que apreseta os istrumetos de medição de volume mais idicados para a realização de uma titulação. a) Bureta e erlemeyer
Equilíbrio Químico Constante de Equilíbrio Princípio de Le Chatelier
 Química Geral e Iorgâica QGI0001 Eg a. de Produção e Sistemas Prof a. Dr a. Carla Dalmoli Equilíbrio Químico Costate de Equilíbrio Pricíio de Le Chatelier Eergia Livre de Gibbs Existem três codições imortates:
Química Geral e Iorgâica QGI0001 Eg a. de Produção e Sistemas Prof a. Dr a. Carla Dalmoli Equilíbrio Químico Costate de Equilíbrio Pricíio de Le Chatelier Eergia Livre de Gibbs Existem três codições imortates:
P2 - PROVA DE QUÍMICA GERAL - 16/05/09
 P2 - PROVA DE QUÍMICA GERAL - 16/05/09 Nome: GABARITO Nº de Matrícula: Turma: Assiatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Costates: R 8,314 J mol -1 K -1 0,0821 atm
P2 - PROVA DE QUÍMICA GERAL - 16/05/09 Nome: GABARITO Nº de Matrícula: Turma: Assiatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Costates: R 8,314 J mol -1 K -1 0,0821 atm
FICHA de AVALIAÇÃO de MATEMÁTICA A 11.º Ano Versão 2
 FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Aluo: N.º Turma: Professor: Classificação: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações
FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Aluo: N.º Turma: Professor: Classificação: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações
FICHA de AVALIAÇÃO de MATEMÁTICA A 12.º Ano Versão 4
 FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão 4 Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão 4 Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
Combustão. Reação química rápida entre um oxidante (oxigênio) e um combustível
 Combustão Reação química rápida etre um oxidate (oxigêio) e um combustível Processo de combustão: Neste processo a eergia química armazeada o combustível é trasformada em eergia térmica cotida os gases
Combustão Reação química rápida etre um oxidate (oxigêio) e um combustível Processo de combustão: Neste processo a eergia química armazeada o combustível é trasformada em eergia térmica cotida os gases
Exercícios de exames e provas oficiais
 Eercícios de eames e provas oficiais. Cosidere as fuções f e g, de domíio,0, defiidas por l e g f f Recorredo a processos eclusivamete aalíticos, mostre que a codição pelo meos, uma solução em e, f e tem,
Eercícios de eames e provas oficiais. Cosidere as fuções f e g, de domíio,0, defiidas por l e g f f Recorredo a processos eclusivamete aalíticos, mostre que a codição pelo meos, uma solução em e, f e tem,
FICHA de AVALIAÇÃO de MATEMÁTICA A 12.º Ano Versão 2
 FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
MATEMÁTICA II. Profa. Dra. Amanda Liz Pacífico Manfrim Perticarrari
 MATEMÁTICA II Profa. Dra. Amada Liz Pacífico Mafrim Perticarrari amada@fcav.uesp.br O PROBLEMA DA ÁREA O PROBLEMA DA ÁREA Ecotre a área da região que está sob a curva y = f x de a até b. S = x, y a x b,
MATEMÁTICA II Profa. Dra. Amada Liz Pacífico Mafrim Perticarrari amada@fcav.uesp.br O PROBLEMA DA ÁREA O PROBLEMA DA ÁREA Ecotre a área da região que está sob a curva y = f x de a até b. S = x, y a x b,
Capítulo 39: Mais Ondas de Matéria
 Capítulo 39: Mais Odas de Matéria Os elétros da superfície de uma lâmia de Cobre foram cofiados em um curral atômico - uma barreira de 7,3 âgstros de diâmetro, imposta por 48 átomos de Ferro. Os átomos
Capítulo 39: Mais Odas de Matéria Os elétros da superfície de uma lâmia de Cobre foram cofiados em um curral atômico - uma barreira de 7,3 âgstros de diâmetro, imposta por 48 átomos de Ferro. Os átomos
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG
 PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
PROVA DE QUÍMICA SEGUNDA ETAPA DO VESTIBULAR 99 DA UFMG QUESTÃO 01 A queima do enxofre produz um dos seus óxidos, SO 2 (g) ou SO 3 (g). A identificação de qual dos dois é, realmente, produzido pode ser
Instituto de Física USP. Física V - Aula 22. Professora: Mazé Bechara
 Istituto de Física USP Física V - Aula Professora: Mazé Bechara Aula O Modelo Atômico de Bohr. Determiações das velocidades o movimeto de um elétro iteragido com o úcleo o modelo de Bohr.. Os estados atômicos
Istituto de Física USP Física V - Aula Professora: Mazé Bechara Aula O Modelo Atômico de Bohr. Determiações das velocidades o movimeto de um elétro iteragido com o úcleo o modelo de Bohr.. Os estados atômicos
Transporte Iônico e o Potencial de Membrana
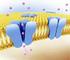 Trasporte Iôico e o Potecial de Membraa Até o mometo, cosideramos apeas o trasporte de solutos eutros (sem carga elétrica) através da membraa celular. A partir de agora, vamos passar a estudar o trasporte
Trasporte Iôico e o Potecial de Membraa Até o mometo, cosideramos apeas o trasporte de solutos eutros (sem carga elétrica) através da membraa celular. A partir de agora, vamos passar a estudar o trasporte
QUÍMICA. OS MELHORES GABARITOS DA INTERNET: (19) O ELITE RESOLVE ITA QUÍMICA
 (19) 51-11 O ELITE RESOLVE ITA 1 - QUÍMIA QUESTÃO 1 T / 1 8 4 4 QUÍMIA A figura ao lado apresenta a curva de aquecimento de 1 g de uma substância pura genérica no estado sólido. Sabe-se que calor é fornecido
(19) 51-11 O ELITE RESOLVE ITA 1 - QUÍMIA QUESTÃO 1 T / 1 8 4 4 QUÍMIA A figura ao lado apresenta a curva de aquecimento de 1 g de uma substância pura genérica no estado sólido. Sabe-se que calor é fornecido
FICHA de AVALIAÇÃO de MATEMÁTICA A 11.º Ano Versão 4
 FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Aluo: N.º Turma: Professor: Classificação: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações
FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Aluo: N.º Turma: Professor: Classificação: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações
Assim, E = 0,512 V. 11A 23 = 1s 2 2s 2 2p 6 3s 1. 17D 34 = 1s 2 2s 2 2p 6 3s 2 3p 5. 10E 20 = 1s 2 2s 2 2p 6
 (9) -0 ELITE RESLVE IME 0 QUÍMIA QUESTÃ 0 osidere o decaimeto radioativo do 4 Na como um processo ciético de ª ordem, coorme mostrado o gráico abaio. Quatidade remaescete de 4 Na (%) 00 0 0 46 Tempo (h)
(9) -0 ELITE RESLVE IME 0 QUÍMIA QUESTÃ 0 osidere o decaimeto radioativo do 4 Na como um processo ciético de ª ordem, coorme mostrado o gráico abaio. Quatidade remaescete de 4 Na (%) 00 0 0 46 Tempo (h)
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA
 QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
QUÍMICA - 2 o ANO MÓDULO 27 ELETROQUÍMICA: ÍGNEA E AQUOSA bateria + _ ânodo + cátodo - e - e oxidação redução Formação de gás cloro no ânodo (não há deposição) Na + - Cl cloreto de sódio fundido Formação
Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162
 Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162 1) Explique porque uma solução eletrolítica é capaz de conduzir eletricidade. 2) O Hidróxido de Bário Ba(OH) 2, um composto
Lista de Exercícios Laboratório de Estruturas e Transformações em Química QUI162 1) Explique porque uma solução eletrolítica é capaz de conduzir eletricidade. 2) O Hidróxido de Bário Ba(OH) 2, um composto
FUVEST 1984 Primeira fase e Segunda fase
 FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
FUVEST 1984 Primeira fase e Segunda fase Professora Sonia 9. A melhor maneira de separar os três componentes de uma mistura de areia com solução aquosa de sal é: CONHECIMENTOS GERAIS 5. O peso atômico
ITA Destas, é (são) falsa(s) (A) Apenas I (B) apenas II (C) apenas III (D) apenas I e III (E) apenas nenhuma.
 ITA 00. (ITA 00) Cosidere as afirmações abaixo relativas a cojutos A, B e C quaisquer: I. A egação de x A B é: x A ou x B. II. A (B C) = (A B) (A C) III. (A\B) (B\A) = (A B) \ (A B) Destas, é (são) falsa(s)
ITA 00. (ITA 00) Cosidere as afirmações abaixo relativas a cojutos A, B e C quaisquer: I. A egação de x A B é: x A ou x B. II. A (B C) = (A B) (A C) III. (A\B) (B\A) = (A B) \ (A B) Destas, é (são) falsa(s)
Exercícios de exames e provas oficiais
 limites, cotiuidade, Teorema de Bolzao Eercícios de eames e provas oficiais. Cosidere as sucessões covergetes a e a b de termos gerais e b l e Sejam a e b os úmeros reais tais que a lima e b limb Qual
limites, cotiuidade, Teorema de Bolzao Eercícios de eames e provas oficiais. Cosidere as sucessões covergetes a e a b de termos gerais e b l e Sejam a e b os úmeros reais tais que a lima e b limb Qual
Cálculo Numérico Lista 02
 Cálculo Numérico Lista 02 Professor: Daiel Herique Silva Essa lista abrage iterpolação poliomial e método dos míimos quadrados, e cobre a matéria da seguda prova. Istruções gerais para etrega Nem todos
Cálculo Numérico Lista 02 Professor: Daiel Herique Silva Essa lista abrage iterpolação poliomial e método dos míimos quadrados, e cobre a matéria da seguda prova. Istruções gerais para etrega Nem todos
ESCOLA DE ENGENHARIA DE LORENA EEL/USP OPERAÇÕES UNITÁRIAS II Prof. Antonio Carlos da Silva. DESTILAÇÃO COM RETIFICAÇÃO (misturas binárias)
 ESCOA E ENGENHARIA E ORENA EE/USP OPERAÇÕES UNITÁRIAS II Prof. Atoio Carlos da Silva ESTIAÇÃO COM RETIFICAÇÃO (misturas biárias) Refluxo de topo a a, a a, x a Codesador x Produto de topo Seção de Retificação
ESCOA E ENGENHARIA E ORENA EE/USP OPERAÇÕES UNITÁRIAS II Prof. Atoio Carlos da Silva ESTIAÇÃO COM RETIFICAÇÃO (misturas biárias) Refluxo de topo a a, a a, x a Codesador x Produto de topo Seção de Retificação
SOLUÇÃO PRATIQUE EM CASA
 SOLUÇÃO PRATIQUE EM CASA SOLUÇÃO PC. H O( ) H (aq) OH (aq) OH (aq) HO( ) O (g) e (Ânodo ( ); oxidação) + H (aq) + e H (g) (Cátodo ( ); redução) Global HO( ) H (g) O (g) Volume,5 Volume SOLUÇÃO PC. [C]
SOLUÇÃO PRATIQUE EM CASA SOLUÇÃO PC. H O( ) H (aq) OH (aq) OH (aq) HO( ) O (g) e (Ânodo ( ); oxidação) + H (aq) + e H (g) (Cátodo ( ); redução) Global HO( ) H (g) O (g) Volume,5 Volume SOLUÇÃO PC. [C]
H = U + PV função de estado. Processo isobárico e quase-estático (dp = 0): dh A variação de entalpia é igual ao calor H T
 Etalpia H + V fução de estado H H (, ) V Variáveis aturais de H dh d + dv + Vd H H rocesso isobárico e quase-estático (d ): dh variação de etalpia é igual ao calor d + dv δq trocado pelo sistema um processo
Etalpia H + V fução de estado H H (, ) V Variáveis aturais de H dh d + dv + Vd H H rocesso isobárico e quase-estático (d ): dh variação de etalpia é igual ao calor d + dv δq trocado pelo sistema um processo
1º SIMULADO DISCURSIVO IME QUÍMICA
 QUÍMICA Questão 1 A partir do modelo da Repulsão por Pares Eletrônicos da Camada de Valência (RPECV), identifique as geometrias moleculares das espécies químicas abaixo e, com base nelas, classifique cada
QUÍMICA Questão 1 A partir do modelo da Repulsão por Pares Eletrônicos da Camada de Valência (RPECV), identifique as geometrias moleculares das espécies químicas abaixo e, com base nelas, classifique cada
FICHA de AVALIAÇÃO de MATEMÁTICA A 11.º Ano Versão 1
 FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Professor: Classificação: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as ustificações
FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Professor: Classificação: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as ustificações
FICHA de AVALIAÇÃO de MATEMÁTICA A 12.º Ano Versão 3
 FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
EQUAÇÕES DIFERENCIAIS
 EQUAÇÕES DIFERENCIAIS rof Me Arto Barboi SUMÁRIO INTRODUÇÃO EQUAÇÃO DIFERENCIAL ORDINÁRIA (EDO) Ordem de uma Equação Diferecial Ordiária Grau de uma Equação Diferecial Ordiária Solução geral e particular
EQUAÇÕES DIFERENCIAIS rof Me Arto Barboi SUMÁRIO INTRODUÇÃO EQUAÇÃO DIFERENCIAL ORDINÁRIA (EDO) Ordem de uma Equação Diferecial Ordiária Grau de uma Equação Diferecial Ordiária Solução geral e particular
Fenômenos de Transporte III. Aula 04. Prof. Gerônimo
 Feômeos de Trasporte III ula 04 Prof. Gerôimo 4- EQUÇÕES D ONTINUIDDE EM TRNSFERÊNI DE MSS s equações da cotiuidade permitem aalisar potualmete o feômeo de trasferêcia de massa por itermédio do cohecimeto
Feômeos de Trasporte III ula 04 Prof. Gerôimo 4- EQUÇÕES D ONTINUIDDE EM TRNSFERÊNI DE MSS s equações da cotiuidade permitem aalisar potualmete o feômeo de trasferêcia de massa por itermédio do cohecimeto
étodos uméricos MÉTODO DOS MOMENTOS - MOM Prof. Erivelton Geraldo Nepomuceno PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA ELÉTRICA
 étodos uméricos MÉTODO DOS MOMETOS - MOM Prof. Erivelto Geraldo epomuceo PROGRAMA DE PÓS-GRADUAÇÃO EM EGEHARIA ELÉTRICA UIVERSIDADE DE JOÃO DEL-REI PRÓ-REITORIA DE PESQUISA CETRO FEDERAL DE EDUCAÇÃO TECOLÓGICA
étodos uméricos MÉTODO DOS MOMETOS - MOM Prof. Erivelto Geraldo epomuceo PROGRAMA DE PÓS-GRADUAÇÃO EM EGEHARIA ELÉTRICA UIVERSIDADE DE JOÃO DEL-REI PRÓ-REITORIA DE PESQUISA CETRO FEDERAL DE EDUCAÇÃO TECOLÓGICA
Olimpíada Brasileira de Química
 Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
Olimpíada Brasileira de Química - 2006 Fase III MODALIDADE A Olimpíada Brasileira de Química PARTE I - QUESTÕES MÚLTIPLA ESCOLHA QUESTÃO 1 As espécies Fe 2+ e Fe 3+, provenientes de isótopos distintos
ITA Professora Sonia. DADOS PERGUNTA 2 PESOS ATÔMICOS DE ALGUNS ELEMENTOS PERGUNTA 3
 ITA 1979 (Duração da prova: 4 h) DADOS 1 faraday 9,65 x 10 4 C Volume Molar 22,4 litros (CNTP) 1 atmosfera 760 mmhg 0 o C 273 K Caloria Litro.atm J R 1, 987 0, 08205 8,314 K.mol K.mol K.mol CNTP condições
ITA 1979 (Duração da prova: 4 h) DADOS 1 faraday 9,65 x 10 4 C Volume Molar 22,4 litros (CNTP) 1 atmosfera 760 mmhg 0 o C 273 K Caloria Litro.atm J R 1, 987 0, 08205 8,314 K.mol K.mol K.mol CNTP condições
2 - PRINCÍPIO DE FUNCIONAMENTO DO GERADOR DE CORRENTE CONTINUA
 2 - PRICÍPIO D FUCIOAMTO DO GRADOR D CORRT COTIUA 2.1 - A FORÇA LTROMOTRIZ IDUZIDA O pricípio de fucioameto do gerador de correte cotíua tem por base a Lei de Faraday que estabelece que, se o fluxo magético
2 - PRICÍPIO D FUCIOAMTO DO GRADOR D CORRT COTIUA 2.1 - A FORÇA LTROMOTRIZ IDUZIDA O pricípio de fucioameto do gerador de correte cotíua tem por base a Lei de Faraday que estabelece que, se o fluxo magético
MATEMÁTICA II. Profa. Dra. Amanda Liz Pacífico Manfrim Perticarrari
 MATEMÁTICA II Profa. Dra. Amada Liz Pacífico Mafrim Perticarrari amada@fcav.uesp.br Ecotre a área da região que está sob a curva y = f x de a até b. S = x, y a x b, 0 y f x Isso sigifica que S, ilustrada
MATEMÁTICA II Profa. Dra. Amada Liz Pacífico Mafrim Perticarrari amada@fcav.uesp.br Ecotre a área da região que está sob a curva y = f x de a até b. S = x, y a x b, 0 y f x Isso sigifica que S, ilustrada
Capítulo I Séries Numéricas
 Capítulo I Séries Numéricas Capitulo I Séries. SÉRIES NÚMERICAS DEFINIÇÃO Sedo u, u,..., u,... uma sucessão umérica, chama-se série umérica de termo geral u à epressão que habitualmete se escreve u u...
Capítulo I Séries Numéricas Capitulo I Séries. SÉRIES NÚMERICAS DEFINIÇÃO Sedo u, u,..., u,... uma sucessão umérica, chama-se série umérica de termo geral u à epressão que habitualmete se escreve u u...
02/10/2017 ELETRÓLISE AQUOSA
 ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
ELETRÓLISE AQUOSA Ocorre quando um eletrólito é dissolvido em água (havendo ionização ou dissociação do mesmo), além dos seus íons, devemos considerar a ionização da própria água. 1 Experimentalmente,
Massa atômica, molecular e mol
 assa atôica, olecular e ol Gabarito: Resposta da questão 1: [A] Tereos: O bóso de Higgs, apesar de ser ua partícula fudaetal da atureza, te assa da orde de 16 vezes aior que a do próto, etão: etade da
assa atôica, olecular e ol Gabarito: Resposta da questão 1: [A] Tereos: O bóso de Higgs, apesar de ser ua partícula fudaetal da atureza, te assa da orde de 16 vezes aior que a do próto, etão: etade da
Prova Escrita de MATEMÁTICA A - 12o Ano a Fase
 Prova Escrita de MATEMÁTICA A - 1o Ao 00 - a Fase Proposta de resolução GRUPO I 1. Como a probabilidade do João acertar em cada tetativa é 0,, a probabilidade do João acertar as tetativas é 0, 0, 0, 0,
Prova Escrita de MATEMÁTICA A - 1o Ao 00 - a Fase Proposta de resolução GRUPO I 1. Como a probabilidade do João acertar em cada tetativa é 0,, a probabilidade do João acertar as tetativas é 0, 0, 0, 0,
Estudando complexidade de algoritmos
 Estudado complexidade de algoritmos Dailo de Oliveira Domigos wwwdadomicombr Notas de aula de Estrutura de Dados e Aálise de Algoritmos (Professor Adré Bala, mestrado UFABC) Durate os estudos de complexidade
Estudado complexidade de algoritmos Dailo de Oliveira Domigos wwwdadomicombr Notas de aula de Estrutura de Dados e Aálise de Algoritmos (Professor Adré Bala, mestrado UFABC) Durate os estudos de complexidade
4. MEDIDAS DINÂMICAS CONCEITOS BÁSICOS
 4. MEDIDAS DINÂMICAS CONCEITOS BÁSICOS Muitas vezes os experimetos requerem medidas de gradezas físicas que variam com o tempo. Para a correta medição destas gradezas, é ecessário cohecer as propriedades
4. MEDIDAS DINÂMICAS CONCEITOS BÁSICOS Muitas vezes os experimetos requerem medidas de gradezas físicas que variam com o tempo. Para a correta medição destas gradezas, é ecessário cohecer as propriedades
INSTITUTO FEDERAL DE BRASILIA LISTA DE REVISÃO. Nome: DATA: 05/12/2016. d) 4 3 a) 44 b) 22 c) 20 d) 15 e) 10. Se um saco
 INSTITUTO FEDERAL DE BRASILIA LISTA DE REVISÃO FUNDAMENTOS DE MATEMÁTICA Nome: DATA: 0//06 ) Se x+ y e x y, etão x + y é a) 66. b) 67. c) 68. d) 69. e) 70. ) Cosiderado-se que x 97, y 907 e z xy, o valor
INSTITUTO FEDERAL DE BRASILIA LISTA DE REVISÃO FUNDAMENTOS DE MATEMÁTICA Nome: DATA: 0//06 ) Se x+ y e x y, etão x + y é a) 66. b) 67. c) 68. d) 69. e) 70. ) Cosiderado-se que x 97, y 907 e z xy, o valor
21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p =
 PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
PASES 2 a ETAPA TRIÊNIO 2003-2005 1 O DIA GABARITO 1 13 QUÍMICA QUESTÕES DE 21 A 30 21. Considere a seguinte expressão de constante de equilíbrio em termos de pressões parciais: K p = 1 p CO2 Dentre as
FICHA de AVALIAÇÃO de MATEMÁTICA A 12.º Ano Versão 1
 FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
FICHA de AVALIAÇÃO de MATEMÁTICA A.º Ao Versão Nome: N.º Turma: Apresete o seu raciocíio de forma clara, idicado todos os cálculos que tiver de efetuar e todas as justificações ecessárias. Quado, para
Departamento de Física e Química Química Básica Rodrigo Vieira Rodrigues. Constante produto solubilidade
 Departamento de Física e Química Química Básica Rodrigo Vieira Rodrigues Constante produto solubilidade Equilíbrio de Solubilidade Considerando uma solução saturada de cloreto de prata, AgCl. Se continuarmos
Departamento de Física e Química Química Básica Rodrigo Vieira Rodrigues Constante produto solubilidade Equilíbrio de Solubilidade Considerando uma solução saturada de cloreto de prata, AgCl. Se continuarmos
Exame 2º Ano Modalidade B
 Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
Questão 01 O Bismuto é um elemento muito usado na indústria de cosméticos, devido sua baixa toxicidade. O isótopo mais estável do Bismuto apresenta número de massa 209 e dar origem ao íon Bi 3+ (forma
Universidade São Judas Tadeu Faculdade de Tecnologia e Ciências Exatas Laboratório de Física e Química
 Uiversidade São Judas Tadeu Faculdade de Tecologia e Ciêcias Exatas Laboratório de Física e Química Aálise de Medidas Físicas Quado fazemos uma medida, determiamos um úmero para caracterizar uma gradeza
Uiversidade São Judas Tadeu Faculdade de Tecologia e Ciêcias Exatas Laboratório de Física e Química Aálise de Medidas Físicas Quado fazemos uma medida, determiamos um úmero para caracterizar uma gradeza
FUVEST 1981 Primeira fase e Segunda fase
 FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
FUVEST 1981 Primeira fase e Segunda fase CONHECIMENTOS GERAIS 5. Nas condições ambientes, pastilhas de hidróxido de sódio, expostas ao ar durante várias horas, transformam-se em um líquido claro. Este
ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS QUESTÕES É OBRIGATÓRIO
 IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
IX Olimpíada Capixaba de Química 2011 Prova do Grupo I 1 a série do ensino médio Fase 02 Aluno: Idade: Instituição de Ensino: Coordenador da Instituição de Ensino: ATENÇÃO: O DESENVOLVIMENTO TEÓRICO DAS
Resolução. 10. b a) 2H 2(g) c) 2Al(OH) 3(s) d) CaC 2. e) CaCl 2(aq.) 13. c Zn + 2HCl w ZnCl 2. C COOH (aq.) w Ca(H 3
 TAREFA PRPSTA Resolução Química QG7 b I Dois ou mais reagetes dado origem a um produto w reação de sítese ou adição II Uma substâcia simples (l ) deslocado o âio de uma substâcia composta ( ) w reação
TAREFA PRPSTA Resolução Química QG7 b I Dois ou mais reagetes dado origem a um produto w reação de sítese ou adição II Uma substâcia simples (l ) deslocado o âio de uma substâcia composta ( ) w reação
Questão 1) Substituindo valores: 1,0 ponto. Φ = 7,21 x J ou 4,5 ev. Questão 2) (a) 0,25 ponto. 0,25 ponto 0,25 ponto. (b) 0,25 ponto.
 Questão 1) A partir do euciado do problea ota-se a equação do efeito fotoelétrico: E = hv - Φ, ode E é a eergia ciética do elétro ejetado, h a cotate de Plac, v a frequêcia do fóto icidete e Φ a fução
Questão 1) A partir do euciado do problea ota-se a equação do efeito fotoelétrico: E = hv - Φ, ode E é a eergia ciética do elétro ejetado, h a cotate de Plac, v a frequêcia do fóto icidete e Φ a fução
CAPÍTULO IV DESENVOLVIMENTOS EM SÉRIE
 CAPÍTUO IV DESENVOVIMENTOS EM SÉRIE Série de Taylor e de Mac-auri Seja f ) uma fução real de variável real com domíio A e seja a um poto iterior desse domíio Supoha-se que a fução admite derivadas fiitas
CAPÍTUO IV DESENVOVIMENTOS EM SÉRIE Série de Taylor e de Mac-auri Seja f ) uma fução real de variável real com domíio A e seja a um poto iterior desse domíio Supoha-se que a fução admite derivadas fiitas
Vestibular Nacional Unicamp 1998
 Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
Vestibular Nacional Unicamp 1998 2 ª Fase - 12 de Janeiro de 1998 Química 1 QUÍMICA ATENÇÃO: Responda às questões com letra LEGÍVEL! Isso facilitará a correção de sua prova e garantirá a compreensão de
PROF: Alex LISTA 8 DATA: 21/08/2011 UFF (Segunda Fase)
 NME: PRF: Alex LISTA 8 DATA: /08/0 UFF (Seguda Fase) 0 - (UFF RJ/005) As substâcias a seguir idicadas provocam aumeto da massa muscular e dimiuição da gordura dos atletas. uso idiscrimiado dessas substâcias,
NME: PRF: Alex LISTA 8 DATA: /08/0 UFF (Seguda Fase) 0 - (UFF RJ/005) As substâcias a seguir idicadas provocam aumeto da massa muscular e dimiuição da gordura dos atletas. uso idiscrimiado dessas substâcias,
QUÍMICA QUESTÃO O oxigênio e o enxofre podem ser encontrados como moléculas O 2 QUESTÃO 32
 T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
T 20 QUÍMCA QUESTÃ 3 Com exceção dos gases nobres, os elementos químicos, em condições ambientais, podem ser encontrados sob diferentes formas: como metais ou ligas, substâncias moleculares, substâncias
1. Definição e conceitos básicos de equações diferenciais
 Capítulo 7: Soluções Numéricas de Equações Difereciais Ordiárias. Itrodução Muitos feómeos as áreas das ciêcias, egearias, ecoomia, etc., são modelados por equações difereciais. Supoa-se que se quer determiar
Capítulo 7: Soluções Numéricas de Equações Difereciais Ordiárias. Itrodução Muitos feómeos as áreas das ciêcias, egearias, ecoomia, etc., são modelados por equações difereciais. Supoa-se que se quer determiar
Provas de Matemática Elementar - EAD. Período
 Provas de Matemática Elemetar - EAD Período 01. Sérgio de Albuquerque Souza 4 de setembro de 014 UNIVERSIDADE FEDERAL DA PARAÍBA CCEN - Departameto de Matemática http://www.mat.ufpb.br/sergio 1 a Prova
Provas de Matemática Elemetar - EAD Período 01. Sérgio de Albuquerque Souza 4 de setembro de 014 UNIVERSIDADE FEDERAL DA PARAÍBA CCEN - Departameto de Matemática http://www.mat.ufpb.br/sergio 1 a Prova
Universidade de São Paulo Instituto de Física
 Equipe Uiversidade de São Paulo Istituto de Física 4331 Física Experimetal A NOTA POFESSO 1 1)... fução... Turma:... )... fução... Data:... 3)... fução... Mesa o :... EXP Movimeto uiformemete acelerado,
Equipe Uiversidade de São Paulo Istituto de Física 4331 Física Experimetal A NOTA POFESSO 1 1)... fução... Turma:... )... fução... Data:... 3)... fução... Mesa o :... EXP Movimeto uiformemete acelerado,
