4025 Síntese de 2-iodopropano a partir do 2-propanol
|
|
|
- Cássio Marques Schmidt
- 6 Há anos
- Visualizações:
Transcrição
1 4025 Síntese de 2-iodopropano a partir do 2-propanol OH I + 1/2 I 2 + 1/3 P x + 1/3 P(OH) 3 C 3 H 8 O (60,1) (253,8) (31,0) C 3 H 7 I (170,0) (82,0) Classificação Tipos de reação e classes de substâncias Substituição nucleofílica iodoalcano, álcool Técnicass de trabalho Aquecimento sob refluxo, agitação com agitador magnético, extração líquido-líquido, extração, filtração, exaustão de gases, trabalho com pisseta, destilação com coluna de fracionamento, retificação, aquecimento em banho de óleo. Instruções (escala em batelada de 10 mmol) Materiais Balão de fundo redondo de 10 ml, condensador de refluxo, 3 pissetas, agitador magnético com aquecimento, barra para agitação magnética, funil de separação, ponte de destilação, coluna de Vigreux, de 10 cm, banho de óleo. Substâncias de Partida 2-Propanol (anidro) (pe 82 C) Fósforo, vermelho Iodo Solução aquosa de NaOH (0,5 M) Peneira molecular de 3Å Solução aquosa diluída de NaHCO 3 Sulfato de sódio para secagem 0,601 g (0,765 ml, 10,0 mmol) 0,124 g (4,00 mmol) 1,29 g (5,08 mmol) Reação O procedimento deve ser realizado em capela. A aparelhagem consiste de um balão de fundo redondo de 10 ml com uma barra de agitação magnética e um condensador de refluxo. O condensador de refluxo é conectado a três pissetas conectadas consecutivamente. A primeira, diretamente conectada ao condensador de refluxo, é preenchida com peneira molecular; a segunda é vazia; a terceira contém uma solução aquosa de hidróxido de sódio a 0,05 M. 1
2 1,29 g (5,08 mmol) de iodo, 0,124 g (4,00 mmol) de fósforo vermelho e 0,601 g (0,765 ml, 10,0 mmol) de 2-propanol anidro são adicionados ao balão reacional. A mistura reacional sob agitação é aquecida à ebulição com um banho óleo e submetida a refluxo por duas horas. Etapa final Após a reação, o condensador de refluxo é substituído por uma ponte de destilação e o produto bruto é destilado a partir da mistura reacional, à temperatura de ebulição de C. O produto destilado é transferido para um funil de separação e extraído com solução aquosa diluída de NaHCO 3. A fase orgânica é separada e seca sobre sulfato de sódio. Após filtração, o produto bruto é destilado através de uma coluna de Vigreux de 10 cm. Rendimento: 1,21 g (7,12 mmol, 71%); PE 88 C, líquido incolor; n D 20 = 1,495 Comentários: O uso de uma peneira molecular como agente de secagem é recomendado, caso contrário o rendimento será menor. Se existir pequena quantidade de 2-propanol não reativo no produto bruto, este não pode mais ser detectado após o procedimento de extração. Gerenciamento dos resíduos Reciclagem A peneira molecular pode ser regenerada. Disposição dos resíduos Resíduo Fase aquosa após extração Resíduo da primeira destilação Resíduo da segunda destilação Sulfato de sódio Conteúdo da terceira pisseta Disposição mistura de solvente e água contendo halogênios Dissolver em água, neutralizar com NaOH diluído e então eliminar como mistura aquosa de solventes contendo halogênios solventes orgânicos contendo halogênios resíduo sólido, livre de mercúrio resíduo de água doméstica Tempo 4 horas Possível Intervalo Antes da primeira destilação e entre a primeira e segunda destilação. Grau de dificuldade Fácil 2
3 Instruções (escala em batelada de 100 mmol) Materiais Balão de fundo redondo de dois bocais de 50 ml, aparelho de extração (Thielepape) condensador de refluxo, 3 pissetas, agitador magnético com aquecimento, barra para agitação magnética, funil de separação, ponte de destilação, coluna de Vigreux de 10 cm, banho Substâncias de Partida 2-Propanol (anidro) (pe 82 C) Fósforo, vermelho Iodo Solução aquosa de NaOH (0,5 M) Peneira molecular de 3Å Solução aquosa diluída de NaHCO 3 Sulfato de sódio para secagem 6,01 g (7,65 ml, 100 mmol) 1,24 g (40,0 mmol) 12,9 g (50,8 mmol) Reação O procedimento deve ser realizado em capela. A aparelhagem consiste de um balão de fundo redondo de dois bocais de 50 ml com um agitador magnético e um extrator de Thielepape, acoplado a um condensador de refluxo. O condensador de refluxo é conectado a três pissetas, conectadas consecutivamente. A primeira, diretamente conectada ao condensador de refluxo, é preenchida com peneira molecular; a segunda é vazia; a terceira contém uma solução aquosa de hidróxido de sódio a 0,05 M. O extrator Thielepape tem um fundo de vidro sinterizado com porosidade P-0 ou um cone extrator de vidro com fundo de porosidade P-0. Como uma alternativa, o aparelho Thielepape pode ter um dispositivo de refluxo, que é coberto com lã de vidro. 12,9 g (50,8 mmol) de iodo são transferidos para o extrator dethielepape. 1,24 g (40,0 mmol) de fósforo vermelho e 6,01 g (7,65 ml, 100 mmol) de 2-propanol anidro são adicionados ao balão reacional e a mistura, sob agitação, é aquecida à ebulição em banho de óleo. Por refluxo de solvente no condensador, o iodo é dissolvido e transferido continuamente para a mistura reacional. O banho pode ser removido após um curto período de tempo, porque a liberação de calor durante a reação exotérmica resulta em refluxo sem aquecimento adicional. Quando a reação chega ao término, a mistura é submetida a refluxo por 30 minutos adicionais. Etapa final No primeiro estágio desta etapa, o refluxo do extrator de Thielepape é fechado e o produto bruto é diretamente destilado, a partir da mistura reacional, no extrator de the Thielepape. O produto destilado é retirado do aparelho e transferido para um funil de separação e extraído com solução aquosa diluída de NaHCO 3. A fase orgânica é separada e seca sob sulfato de sódio. Após filtração o produto bruto é destilado através de uma coluna de Vigreux de 10 cm. Rendimento: 14,1 g (82,9 mmol, 83%,); PE 88 C, líquido incolor; n D 20 = 1,495 3
4 Comentários O uso de uma peneira molecular como agente de secagem é recomendado, caso contrário o rendimento será menor. A transferência de solvente através do extrator de Thielepape deve ser rápida. Se existir pequena quantidade de 2-propanol não reativo no produto bruto, este não poderá mais ser detectado após o procedimento de extração. Gerenciamento dos resíduos Reciclagem A peneira molecular pode ser regenerada. Disposição dos resíduos Resíduo Disposição Fase aquosa após extração mistura de solvente e água contendo halogênios Resíduo da primeira destilação dissolver em água, neutralizar com NaOH diluído e eliminar como: mistura aquosa de solventes contendo halogênios Resíduo da segunda destilação solventes orgânicos contendo halogênios Sulfato de sódio resíduo sólido, livre de mercúrio Conteúdo da terceira pisseta resíduo de água doméstica Tempo 4 horas Possível Intervalo Antes da primeira destilação e entre a primeira e segunda destilação. Grau de dificuldade Fácil Instruções (escala em batelada de 1 mol) Materiais Balão de fundo redondo de dois bocais de 500 ml, aparelho de extração (Thielepape), condensador de refluxo, 3 pissetas, agitador magnético com aquecimento, barra para agitação magnética, funil de separação, ponte de destilação, coluna de Vigreux de 10 cm, banho de óleo. Substâncias de partida 2-Propanol (anidro) (pe 82 C) Fósforo, vermelho Iodo Solução aquosa de NaOH (0,5 M) Peneira molecular de 3Å 60,1 g (76,5 ml, 1,00 mol) 12,4 g (0,400 mol) 129 g (0,508 mol) 4
5 Solução aquosa diluída de NaHCO 3 Sulfato de sódio para secagem Reação O procedimento deve ser realizado em capela. A aparelhagem consiste de um balão de fundo redondo de dois bocais de 500 ml, com barra de agitação magnética e um extrator de Thielepape acoplado a um condensador de refluxo. O condensador de refluxo é conectado a três pissetas, conectadas consecutivamente. A primeira, diretamente conectada ao condensador de refluxo, é preenchida com peneira molecular; a segunda é vazia; a terceira contém uma solução aquosa de hidróxido de sódio a 0,05 M. O extrator Thielepape tem um fundo de vidro sinterizado com porosidade P-0 ou um cone extrator de vidro com fundo de porosidade P-0. Como uma alternativa, o aparelho Thielepape pode ter um dispositivo de refluxo, que é coberto com lã de vidro. 29 g (0,508 mol) de iodo são transferidos para o extrator dethielepape. 12,4 g (0,400 mol) de fósforo vermelho e 60,1 g (76,5 ml, 1,00 mol) de 2-propanol anidro são adicionados no balão reacional. A mistura sob agitação é então aquecida à ebulição em banho de óleo. Por refluxo de solvente no condensador, o iodo é dissolvido e transferido continuamente para a mistura reacional. O banho pode ser removido após um curto período de tempo, porque a liberação de calor durante a reação exotérmica resulta em refluxo sem aquecimento adicional. Quando a reação chega ao término, a mistura é submetida a refluxo por 30 minutos adicionais Procedimento No primeiro estágio desta etapa, o refluxo do extrator de Thielepape é fechado e o produto bruto é diretamente destilado, a partir da mistura reacional, no extrator de Thielepape. O produto destilado é retirado do aparelho e transferido para um funil de separação e extraído com solução aquosa diluída de NaHCO 3. A fase orgânica é separada e seca sob sulfato de sódio. Após filtração, o produto bruto é destilado através de uma coluna de Vigreux de 10 cm. Rendimento: 144 g (853 mmol, 85%); PE 88 C, líquido incolor; n D 20 = 1,495 Comentários O uso de uma peneira molecular como agente de secagem é recomendado, caso contrário o rendimento será menor. É importante que a transferência de solvente através do extrator de Thielepape seja rápida. Se existir pequena quantidade de 2-propanol não reativo no produto bruto, este não será mais detectável após o procedimento de extração. Gerenciamento dos resíduos Reciclagem A peneira molecular pode ser regenerada. Disposição dos resíduos Resíduo Disposição Fase aquosa após extração misturas de solventes e água contendo halogênios Resíduo da primeira destilação dissolver em água, neutralizar com NaOH diluído e 5
6 Resíduo da segunda destilação Sulfato de sódio Conteúdo da terceira pisseta eliminar como mistura aquosa de solventes contendo halogênios solventes orgânicos contendo halogênios resíduo sólido, livre de mercúrio resíduo de água doméstica Tempo 5 horas Possível Intervalo Antes da primeira destilação e entre a primeira e segunda destilação. Grau de dificuldade Fácil Caracterização Monitoramento da reação Parar a reacção a tomar uma amostra diminui o rendimento final! Monitoramento da reação pode ser realizado por espectroscopia de infravermellho. Preparação da amostra: 1 ml da mistura reacional é tomada com uma pipeta e destilada com um aparelho de microdestilação. O produto destilado é usado para espectroscopia de infravermelho sem solvente. O desaparecimento da banda do OH à 3400 cm -1 é uma indicação do término da reação. Espectro de RMN 1 H do produto puro (500 MHz, CDCl 3 ) I δ (ppm) Multiplicidade Número de H Atribuição 1,82 d 6 CH 3 4,26 m 1 I-CH 6
7 Espectro de RMN 13 C do produto puro (75,5 MHz, CDCl 3 ) δ (ppm) Atribuição 31,13 CH 3 21,23 I-CH Espectro de Infravermelho do produto puro (filme) cm -1 (cm -1 ) Atribuição 2983, 2917 Estiramento C-H, alcano 1455 C-H-deformação 1370 C-H-deformação, -CH 3 simétrico 7
1024 Eliminação de água do 4-hidroxi-4-metil-2-pentanona
 1024 Eliminação de água do 4-hidroxi-4-metil-2-pentanona C H I 2 CH 3 CH 3 H 3 C CH 3 - H 2 H 3 + H 3 C CH 3 H 2 C CH 3 C 6 H 12 I 2 C 6 H 10 (116.2) (253.8) (98.2) Classificação Tipo de reação e classes
1024 Eliminação de água do 4-hidroxi-4-metil-2-pentanona C H I 2 CH 3 CH 3 H 3 C CH 3 - H 2 H 3 + H 3 C CH 3 H 2 C CH 3 C 6 H 12 I 2 C 6 H 10 (116.2) (253.8) (98.2) Classificação Tipo de reação e classes
4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico
 NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
NP 4023 Síntese do éster etílico do ácido 2-cicclopentanona carboxílico a partir do éster dietílico do ácido adípico NaEt C 10 H 18 4 Na C 2 H 6 C 8 H 12 3 (202,2) (23,0) (46,1) (156,2) Classificação Tipos
3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno
![3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno 3005 Síntese de 7,7-diclorobiciclo [4.1.0] heptano (7,7- dicloronorcarano) a partir de ciclohexeno](/thumbs/61/45682965.jpg) 00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
00 Síntese de,-diclorobiciclo [..0] heptano (,- dicloronorcarano) a partir de ciclohexeno + CHCl NaOH tri-n-propylamine CCl + HCl C H 0 (8.) (9.) NaOH C 9 H N C H 0 Cl (0.0) (.) (.) (.) Classificação Tipos
2008 Esterificação do ácido propiônico com 1-butanol via catálise ácida para a obtenção do éster propanoato de butila
 28 Esterificação do ácido propiônico com 1-butanol via catálise ácida para a obtenção do éster propanoato de butila Classificação Tipos de reações e classes de substâncias Reação de carbonila de ácidos
28 Esterificação do ácido propiônico com 1-butanol via catálise ácida para a obtenção do éster propanoato de butila Classificação Tipos de reações e classes de substâncias Reação de carbonila de ácidos
4009 Síntese de ácido adípico a partir do ciclohexeno
 4009 Síntese de ácido adípico a partir do ciclohexeno C 6 H 10 (82,2) + tungstato de sódio dihidratado 4 H 2 H + 2 H + 4 H 2 + Aliquat 336. Na 2 W 4 2 H 2 (329,9) C 6 H 10 4 (34,0) C 25 H 54 ClN (404,2)
4009 Síntese de ácido adípico a partir do ciclohexeno C 6 H 10 (82,2) + tungstato de sódio dihidratado 4 H 2 H + 2 H + 4 H 2 + Aliquat 336. Na 2 W 4 2 H 2 (329,9) C 6 H 10 4 (34,0) C 25 H 54 ClN (404,2)
1011 Síntese do 1,4-di-terc-butil benzeno a partir do terc-butil benzeno e cloreto de terc-butila.
 1011 Síntese do 1,4-di-terc-butil benzeno a partir do terc-butil benzeno e cloreto de terc-butila. + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Classificação Tipos de Reações e
1011 Síntese do 1,4-di-terc-butil benzeno a partir do terc-butil benzeno e cloreto de terc-butila. + Cl AlCl 3 C 10 H 14 (134.) C 4 H 9 Cl C 14 H (9.6) (133.3) (190.3) Classificação Tipos de Reações e
4024 Síntese enantioseletiva do éster etílico do ácido (1R,2S)-cishidroxiciclopentano-carboxílico
 4024 Síntese enantioseletiva do éster etílico do ácido (1R,2S)-cishidroxiciclopentano-carboxílico H levedura C 8 H 12 3 C 8 H 14 3 (156,2) (158,2) Classificação Tipos de reação e classes de substâncias
4024 Síntese enantioseletiva do éster etílico do ácido (1R,2S)-cishidroxiciclopentano-carboxílico H levedura C 8 H 12 3 C 8 H 14 3 (156,2) (158,2) Classificação Tipos de reação e classes de substâncias
4001 Transesterificação do óleo de mamona em ricinoleato de metila
 4001 Transesterificação do óleo de mamona em ricinoleato de metila Classificação Tipos de reações e classes de substâncias. Reação do grupo carbonila de derivados do ácido carboxílico, trans-esterificação,
4001 Transesterificação do óleo de mamona em ricinoleato de metila Classificação Tipos de reações e classes de substâncias. Reação do grupo carbonila de derivados do ácido carboxílico, trans-esterificação,
4026 Síntese de 2-cloro-2-metilpropano (cloreto de tert-butila) a partir de tert-butanol
 4026 Síntese de 2-cloro-2-metilpropano (cloreto de tert-butila) a partir de tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74,1) (36,5) (92,6) Classificação Tipos de reações e classes de substâncias
4026 Síntese de 2-cloro-2-metilpropano (cloreto de tert-butila) a partir de tert-butanol OH + HCl Cl + H 2 O C 4 H 10 O C 4 H 9 Cl (74,1) (36,5) (92,6) Classificação Tipos de reações e classes de substâncias
2017 Obtenção da amida do ácido cinâmico através da reação do cloreto do ácido cinâmico com amônia
 217 Obtenção da amida do ácido cinâmico através da reação do cloreto do ácido cinâmico com amônia O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Classificação Tipos de reação e classes de
217 Obtenção da amida do ácido cinâmico através da reação do cloreto do ácido cinâmico com amônia O O Cl NH 3 NH 2 C 9 H 7 ClO (166.6) (17.) C 9 H 9 NO (147.2) Classificação Tipos de reação e classes de
2004 Redução diastereosseletiva de benzoina com boro-hidreto de sódio a 1,2-difenil-1,2-etanodiol
 24 Redução diastereosseletiva de benzoina com boro-hidreto de sódio a 1,2-difenil-1,2-etanodiol OH O NaBH 4 H HO OH meso H + H OH H OH racemic C 14 H 12 O 2 (212.3) (37.8) C 14 H 14 O 2 (214.3) Referência
24 Redução diastereosseletiva de benzoina com boro-hidreto de sódio a 1,2-difenil-1,2-etanodiol OH O NaBH 4 H HO OH meso H + H OH H OH racemic C 14 H 12 O 2 (212.3) (37.8) C 14 H 14 O 2 (214.3) Referência
5007 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína
 57 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Classificação Tipos de reações e classes das substâncias
57 Reação do anidrido ftálico com resorcinol para obtenção de fluoresceína CH H H + 2 + 2 H 2 H C 8 H 4 3 C 6 H 6 2 C 2 H 12 5 (148.1) (11.1) (332.3) Classificação Tipos de reações e classes das substâncias
3002 Adição de bromo ao ácido fumárico para formação de ácido meso-dibromo-succínico
 32 Adição de bromo ao ácido fumárico para formação de ácido meso-dibromo-succínico H HOOC COOH H Br 2 HOOC H Br Br H COOH C 4 H 4 O 4 (116.1) (159.8) C 4 H 4 Br 2 O 4 (275.9) Referência Bibliográfica A.
32 Adição de bromo ao ácido fumárico para formação de ácido meso-dibromo-succínico H HOOC COOH H Br 2 HOOC H Br Br H COOH C 4 H 4 O 4 (116.1) (159.8) C 4 H 4 Br 2 O 4 (275.9) Referência Bibliográfica A.
2028 Reação de brometo de magnésio de ciclohexila com dióxido de carbono para ácido ciclo-hexano carboxílico
 28 Reação de brometo de magnésio de ciclohexila com dióxido de carbono para ácido ciclo-hexano carboxílico Br + Mg éter etílico MgBr 1. CO 2 2. H 3 O O OH C 6 H 11 Br CO 2 (163,1) (24,3) (44,) C 7 H 12
28 Reação de brometo de magnésio de ciclohexila com dióxido de carbono para ácido ciclo-hexano carboxílico Br + Mg éter etílico MgBr 1. CO 2 2. H 3 O O OH C 6 H 11 Br CO 2 (163,1) (24,3) (44,) C 7 H 12
5026 Oxidação do antraceno à antraquinona
 506 xidação do antraceno à antraquinona KMn /Al C H 0 KMn C H 8 (78.) (58.0) (08.) Referência Bibliográfica Nüchter, M., ndruschka, B., Trotzki, R., J. Prakt. Chem. 000,, No. 7 Classificação Tipos de Reações
506 xidação do antraceno à antraquinona KMn /Al C H 0 KMn C H 8 (78.) (58.0) (08.) Referência Bibliográfica Nüchter, M., ndruschka, B., Trotzki, R., J. Prakt. Chem. 000,, No. 7 Classificação Tipos de Reações
4027 Síntese de 11-cloroundec-1-eno a partir de 10-undecen-1-ol
 4027 Síntese de 11-cloroundec-1-eno a partir de 10-undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Classificação Tipos de reações e classes das substâncias
4027 Síntese de 11-cloroundec-1-eno a partir de 10-undecen-1-ol OH SOCl 2 Cl + HCl + SO 2 C 11 H 22 O C 11 H 21 Cl (170.3) (119.0) (188.7) (36.5) (64.1) Classificação Tipos de reações e classes das substâncias
http://www.oc-praktikum.de SO 4 O 2 (120.1) (138.1) (98.1) (180.2) (60.1)
 NP 5012 Síntese do ácido acetilsalicílico (aspirina) a partir do ácido salicílico e anidrido acético CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1)
NP 5012 Síntese do ácido acetilsalicílico (aspirina) a partir do ácido salicílico e anidrido acético CH CH + H H 2 S 4 + CH 3 CH C 4 H 6 3 C 7 H 6 3 C 9 H 8 4 C 2 H 4 2 (120.1) (138.1) (98.1) (180.2) (60.1)
MATERIAL SUPLEMENTAR. Benzamidoxima
 MATERIAL SUPLEMENTAR Benzamidoxima Em um erlenmeyer de 125 ml, adicionou-se 2,0 g de cloridrato de hidroxilamina (29,1 mmol), 2,4 g de carbonato de sódio (29,1 mmol) e 25 ml de água destilada a temperatura
MATERIAL SUPLEMENTAR Benzamidoxima Em um erlenmeyer de 125 ml, adicionou-se 2,0 g de cloridrato de hidroxilamina (29,1 mmol), 2,4 g de carbonato de sódio (29,1 mmol) e 25 ml de água destilada a temperatura
IQ-UFG. Curso Experimental de Química Geral e Inorgânica. Prof. Dr. Anselmo
 IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
IQ-UFG Curso Experimental de Química Geral e Inorgânica Aula 02 Reconhecimento de Vidrarias e Introdução às Técnicas de Laboratório Prof. Dr. Anselmo Vidrarias e equipamentos usuais em laboratórios de
2013 Síntese do cloreto de cinamila a partir de ácido cinâmico e cloreto de tionila
 2013 Síntese do cloreto de cinamila a partir de ácido cinâmico e cloreto de tionila O O OH Cl + SOCl 2 + HCl + SO 2 C 9 H 8 O 2 (148.2) (119.0) C 9 H 7 ClO (166.6) Classificação Tipos de reações e classes
2013 Síntese do cloreto de cinamila a partir de ácido cinâmico e cloreto de tionila O O OH Cl + SOCl 2 + HCl + SO 2 C 9 H 8 O 2 (148.2) (119.0) C 9 H 7 ClO (166.6) Classificação Tipos de reações e classes
EQUIPAMENTO BÁSICO DE LABORATÓRIO
 1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
1 EQUIPAMENTO BÁSICO DE LABORATÓRIO MATERIAL DE VIDRO: TUBO DE ENSAIO Utilizado principalmente para efetuar reações químicas em pequena escala. 2 BÉQUER ou BÉCKER Recipiente com ou sem graduação, utilizado
Parte II. Meneah Renata Talita
 Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
Extração e Purificação do Limoneno Parte II Meneah Renata Talita Objetivo da prática Isolar e Purificar o Limoneno a partir de uma fase orgânica contendo n-hexano, limoneno, traços de substâncias voláteis
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
QUÍMICA FARMACÊUTICA
 INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
INSTITUTO DE CIÊNCIAS DA SAÚDE CURSO DE FARMÁCIA ROTEIRO PARA S PRÁTICAS DISCIPLINA: QUÍMICA FARMACÊUTICA Título da Aula: Determinação do coeficiente de partição óleo-água (P) do ácido benzóico 1 Demonstrar
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS OLIMPÍADA BRASILEIRA DE QUÍMICA 2004 FASE VI
 UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS OLIMPÍADA BRASILEIRA DE QUÍMICA 2004 FASE VI Questão 1 Em uma análise química desejava-se determinar o teor percentual de zinco em 96,57g de uma amostra
UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS OLIMPÍADA BRASILEIRA DE QUÍMICA 2004 FASE VI Questão 1 Em uma análise química desejava-se determinar o teor percentual de zinco em 96,57g de uma amostra
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
AULA PRÁTICA Nº / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS
 LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
LABORATÓRIO DE ANÁLISE DE ALIMENTOS E NUTRIÇÃO AULA PRÁTICA Nº - 05 31 / Abril / 2016 Profª Solange Brazaca DETERMINAÇÃO DE LIPÍDEOS FUNDAMENTO: Os lipídios constituem uma classe grande de compostos que
Síntese do acetato de n-butilo ou etanoato de n-butilo
 Projeto Ciência Viva INTRODUÇÃO À QUÍMICA VERDE, COMO SUPORTE DA SUSTENTABILIDADE, NO ENSINO SECUNDÁRIO PL 3.4 Identificação e síntese de substâncias com aromas e sabores especiais Síntese do acetato de
Projeto Ciência Viva INTRODUÇÃO À QUÍMICA VERDE, COMO SUPORTE DA SUSTENTABILIDADE, NO ENSINO SECUNDÁRIO PL 3.4 Identificação e síntese de substâncias com aromas e sabores especiais Síntese do acetato de
PROCESSOS DE SEPARAÇÃO. Prof. Ms. George Verçoza
 PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
INSTITUTO GEREMARIO DANTAS COMPONENTE CURRICULAR: QUÍMICA EXERCÍCIOS DE RECUPERAÇÃO PARCIAL 2016
 INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
INSTITUTO GEREMARIO DANTAS Educação Infantil, Ensino Fundamental e Médio Fone: (21) 21087900 Rio de Janeiro RJ www.igd.com.br Aluno(a): 1º Ano: C11 Nº Professora: Lúcia Nascimento COMPONENTE CURRICULAR:
Química Orgânica Experimental
 Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
Química Orgânica Experimental Destilação Simples para Purificação do Cloreto de Terc-butila e do Acetato de Isopentila Discentes: Ana Carolina Boni Eliana Alves Arxer Fernanda Maciel Barbosa Gubbiotti
Seminário de química orgânica Experimental I Destilação fracionada do limoneno. Edvan Ferreira de Oliveira Letícia Naomi Higa
 Seminário de química orgânica Experimental I Destilação fracionada do limoneno Edvan Ferreira de Oliveira Letícia Naomi Higa *Introdução *Destilação *Explicação da destilação fracionada *Coluna de fracionamento
Seminário de química orgânica Experimental I Destilação fracionada do limoneno Edvan Ferreira de Oliveira Letícia Naomi Higa *Introdução *Destilação *Explicação da destilação fracionada *Coluna de fracionamento
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo:
 ASSISTENTE DE LABORATÓRIO 4 CONHECIMENTOS ESPECÍFICOS QUESTÕES DE 11 A 25 11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo: a) Acelerar a
ASSISTENTE DE LABORATÓRIO 4 CONHECIMENTOS ESPECÍFICOS QUESTÕES DE 11 A 25 11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo: a) Acelerar a
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS
 EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
EXPERIÊNCIA 04 EXTRAÇÃO COM SOLVENTES REATIVOS 1 - INTRODUÇÃO O processo de extração com solventes é um método simples, empregado na separação e isolamento de substâncias componentes de uma mistura, ou
Unidade V - Determinação de umidade e sólidos totais
 Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Unidade V - Determinação de umidade e sólidos totais O método empregado depende do objetivo. O que estou necessitando? Rapidez? Precisão? Exatidão? Medir em tempo real? Umidade: métodos Quantitativos Métodos
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 )
 Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Síntese do Biodiesel a partir de óleo vegetal Procedimento experimental (adaptado de 1 ) O biodiesel é atualmente um combustível em fase de desenvolvimento no nosso país, estando algumas fábricas já em
Processos de Separação Misturas Para misturas Heterogêneas
 Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
1) A principal caracterís0ca de uma solução é:
 1) A principal caracterís0ca de uma solução é: a) possuir sempre um líquido com outra substância dissolvida. b) ser um sistema com mais de uma fase. c) ser homogênea ou heterogênea, dependendo das condições
1) A principal caracterís0ca de uma solução é: a) possuir sempre um líquido com outra substância dissolvida. b) ser um sistema com mais de uma fase. c) ser homogênea ou heterogênea, dependendo das condições
Concentração de soluções e diluição
 Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
Concentração de soluções e diluição 1. Introdução Uma solução é uma dispersão homogênea de duas ou mais espécies de substâncias moleculares ou iônicas. É um tipo especial de mistura, em que as partículas
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA
 MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
MF-612.R-3 - MÉTODO DE DETERMINAÇÃO DE NITRATOS EM SUSPENSÃO NO AR POR COLORIMETRIA 1. OBJETIVO Definir o método de determinação de nitratos em suspensão no ar, por colorimetria, utilizando 2,4 dimetilfenol
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
FQE0001 Exp. 04. Físico-Química Experimental. Termoquímica. 1. Introdução
 1. Introdução Termoquímica Termoquímica é o ramo da termodinâmica que estuda o calor trocado entre o sistema e sua vizinhança devido à ocorrência de uma reação química ou transformação de fase. Desta maneira,
1. Introdução Termoquímica Termoquímica é o ramo da termodinâmica que estuda o calor trocado entre o sistema e sua vizinhança devido à ocorrência de uma reação química ou transformação de fase. Desta maneira,
FICHA DE PREPARAÇÃO PARA O TESTE Nº5 FQ -7ºANO
 FICHA DE PREPARAÇÃO PARA O TESTE Nº5 FQ -7ºANO -CLASSIFICAÇÃO DOS MATERIAIS - SUBSTÃNCIAS E MISTURAS - SOLUÇÕES -TRANSFORMAÇÕES QUÍMICAS E FÍSICAS 1. A Química é a ciência que estuda as propriedades e
FICHA DE PREPARAÇÃO PARA O TESTE Nº5 FQ -7ºANO -CLASSIFICAÇÃO DOS MATERIAIS - SUBSTÃNCIAS E MISTURAS - SOLUÇÕES -TRANSFORMAÇÕES QUÍMICAS E FÍSICAS 1. A Química é a ciência que estuda as propriedades e
Preparação do cloreto de terc-butila
 Preparação do cloreto de terc-butila Substituição Nucleofílica Alifática Júlia Ciaramello Fuzatto Juliana Gonçalves Gomes Simone Avelino Fonseca Reações de Substituição Nucleofílica É quando um nucleófilo,espécie
Preparação do cloreto de terc-butila Substituição Nucleofílica Alifática Júlia Ciaramello Fuzatto Juliana Gonçalves Gomes Simone Avelino Fonseca Reações de Substituição Nucleofílica É quando um nucleófilo,espécie
Exercícios Métodos de Separação. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017
 Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Química Analítica I Tratamento dos dados analíticos Soluções analíticas
 Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
Química Analítica I Tratamento dos dados analíticos Soluções analíticas Profª Simone Noremberg Kunz 2 Mol Medidas em química analítica É a quantidade de uma espécie química que contém 6,02x10 23 partículas
SISTEMAS MATERIAIS. Conceitos Fundamentais, Classificação, Purificação. Reis, Oswaldo Henrique Barolli.
 SISTEMAS MATERIAIS Conceitos Fundamentais, Classificação, Purificação Reis, Oswaldo Henrique Barolli. R375s Sistemas materiais : conceitos fundamentais, classificação, purificação / Oswaldo Henrique Barolli.
SISTEMAS MATERIAIS Conceitos Fundamentais, Classificação, Purificação Reis, Oswaldo Henrique Barolli. R375s Sistemas materiais : conceitos fundamentais, classificação, purificação / Oswaldo Henrique Barolli.
Extração Sólido-Líquido
 Extração Sólido-Líquido Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 1 de novembro de 2016 Extração Sólido-Líquido 1 / 34 Introdução Extração Sólido-Líquido 2 / 34
Extração Sólido-Líquido Prof. Universidade Federal do Pampa BA310 Curso de Engenharia Química Campus Bagé 1 de novembro de 2016 Extração Sólido-Líquido 1 / 34 Introdução Extração Sólido-Líquido 2 / 34
III PARTE EXPERIMENTAL. III.1 Sínteses. III.1.1 Síntese da porfirina de base livre (TMPP) 16
 III Parte experimental 30 III PARTE EXPERIMENTAL III.1 Sínteses III.1.1 Síntese da porfirina de base livre (TMPP) 16 Método 1: Inicialmente, a síntese da meso-tetrakis(4-metóxifenil)porfirina (TMPP) 16
III Parte experimental 30 III PARTE EXPERIMENTAL III.1 Sínteses III.1.1 Síntese da porfirina de base livre (TMPP) 16 Método 1: Inicialmente, a síntese da meso-tetrakis(4-metóxifenil)porfirina (TMPP) 16
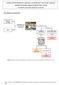
PROVA K. Questão 81. Resolução
 RES_17_10_ALICE 29/09/10 14:01 Página 32 - Questão 81 Considere o fluxograma abaixo, relativo à separação dos componentes de uma mistura constituída de biodiesel e de frutose totalmente dissolvida em água.
RES_17_10_ALICE 29/09/10 14:01 Página 32 - Questão 81 Considere o fluxograma abaixo, relativo à separação dos componentes de uma mistura constituída de biodiesel e de frutose totalmente dissolvida em água.
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a
 01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
01- (UFRRJ 2001) O hidróxido de lítio (LiOH), usado na produção de sabões de lítio para a fabricação de graxas lubrificantes a partir de óleos, é obtido pela reação do carbonato de lítio (Li COƒ) com o
LISTA DE EXERCÍCIOS 4. Equilíbrio de Misturas Líquidas Binárias com o Vapor
 DEPARTAMENTO DE FÍSICO-QUÍMICA DISCIPLINA QUI 03310 FÍSICO-QUÍMICA II-B INTRODUÇÃO LISTA DE EXERCÍCIOS 4 Equilíbrio de Misturas Líquidas Binárias com o Vapor Na presente unidade, será examinado o comportamento
DEPARTAMENTO DE FÍSICO-QUÍMICA DISCIPLINA QUI 03310 FÍSICO-QUÍMICA II-B INTRODUÇÃO LISTA DE EXERCÍCIOS 4 Equilíbrio de Misturas Líquidas Binárias com o Vapor Na presente unidade, será examinado o comportamento
3ªHumanas e Master - Química Prof os João Lins e Alexandre Estevão
 3ªHumanas e Master - Química Prof os João Lins e Alexandre Estevão 1) Um sistema heterogêneo, S, é constituído por uma solução colorida e um sólido branco. O sistema foi submetido ao seguinte esquema de
3ªHumanas e Master - Química Prof os João Lins e Alexandre Estevão 1) Um sistema heterogêneo, S, é constituído por uma solução colorida e um sólido branco. O sistema foi submetido ao seguinte esquema de
Sistemas, Substâncias puras e Misturas Separação de Misturas
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011
 ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011 Nome: 7.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. Classifique as transformações
ESCOLA SALESIANA DE MANIQUE TESTE DE AVALIAÇÃO DE CIÊNCIAS FÍSICO-QUÍMICAS ANO LECTIVO 2010/2011 Nome: 7.º Ano Turma Nº: Encarregado de Educação: Classificação: Professor: 1. Classifique as transformações
Resolução UNIFESP 2015
 Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
Resolução UNIFESP 2015 1-Utilizando o aparato indicado na figura, certo volume de solução aquosa de sulfato de cobre(ii) hidratado foi colocado dentro do béquer. Quando o plugue foi conectado à tomada
DESTILAÇÃO Lei de Raoult
 DESTILAÇÃO Operação que consiste na separação de líquidos de suas eventuais misturas, por passagem de vapor e posterior condensação com retorno ao estado líquido, com auxílio de calor e/ou por redução
DESTILAÇÃO Operação que consiste na separação de líquidos de suas eventuais misturas, por passagem de vapor e posterior condensação com retorno ao estado líquido, com auxílio de calor e/ou por redução
Aula prática 1: Materiais de laboratório, exatidão e precisão. 1. Material de laboratório
 Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
Aula prática 1: Materiais de laboratório, exatidão e precisão 1. Material de laboratório 1.1.Material de vidro o Tubo de ensaio utilizado para efetuar reações químicas em pequena escala. o Béquer recipiente
EXERCÍCIOS SUBSTÂNCIAS E MISTURAS
 EXERCÍCIOS SUBSTÂNCIAS E MISTURAS 1- Considere o sistema e responda as questões: A) Quantos átomos estão representados? B) Quantos elementos químicos há no sistema? C) Quantas moléculas estão representadas
EXERCÍCIOS SUBSTÂNCIAS E MISTURAS 1- Considere o sistema e responda as questões: A) Quantos átomos estão representados? B) Quantos elementos químicos há no sistema? C) Quantas moléculas estão representadas
ESTEQUIOMETRIA Folha 01 João Roberto Mazzei
 01. (UFC 2009) O principal componente da cal, importante produto industrial fabricado no Ceará, é o óxido de cálcio (CaO). A produção de CaO se processa de acordo com a seguinte reação química: CaCO 3(s)
01. (UFC 2009) O principal componente da cal, importante produto industrial fabricado no Ceará, é o óxido de cálcio (CaO). A produção de CaO se processa de acordo com a seguinte reação química: CaCO 3(s)
Experiência 04 - Solubilidade
 Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
Experiência 04 - Solubilidade 01. OBJETIVOS: No final desta experiência o aluno deverá ser capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração, recristalização
Profº André Montillo
 Profº André Montillo www.montillo.com.br Definição: É uma Mistura Homogênia de 2 ou mais substâncias. Na Solução não ocorre uma reação química, porque não há formação de novas substâncias e não há alterações
Profº André Montillo www.montillo.com.br Definição: É uma Mistura Homogênia de 2 ou mais substâncias. Na Solução não ocorre uma reação química, porque não há formação de novas substâncias e não há alterações
Métodos Clássicos de Separação
 Analítica V: Aula 15-05-12 Plano de aula Importância da extração química nos procedimentos de análise Etapasdeumprocesso deextração Métodos Clássicos de Separação O processo de destilação e exemplos para
Analítica V: Aula 15-05-12 Plano de aula Importância da extração química nos procedimentos de análise Etapasdeumprocesso deextração Métodos Clássicos de Separação O processo de destilação e exemplos para
Química Orgânica. Separação e Purificação de Compostos Orgânicos. Relatório 2. Instituto Superior Técnico. Trabalho realizado por:
 Instituto Superior Técnico Mestrado Integrado em Engenharia Biomédica 2ªano, 2º semestre de 2008/09 Química Orgânica Relatório 2 Separação e Purificação de Compostos Orgânicos Trabalho realizado por: Joana
Instituto Superior Técnico Mestrado Integrado em Engenharia Biomédica 2ªano, 2º semestre de 2008/09 Química Orgânica Relatório 2 Separação e Purificação de Compostos Orgânicos Trabalho realizado por: Joana
Alguns materiais utilizados no Laboratório de Química
 Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
Alguns materiais utilizados no Laboratório de Química 02 04 05 01 03 06 07 08 09 10 11 12 13 14 15 19 16 17 18 20 21 22 23 24 25 01. Suporte universal: utilizado para sustentar peças. 02. Tripé de ferro:
Experimentos de Química Orgânica
 Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
Experiência 02 - SOLUBILIDADE SOLUBILIDADE
 1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
Processos de Separação Misturas Para misturas Heterogêneas
 Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Seminário de Química Orgânica Experimental n 7. Destilação Fracionada do Sistema Limoneno - Hexano
 Seminário de Química Orgânica Experimental n 7 Destilação Fracionada do Sistema Limoneno - Hexano Responsáveis: Prof. Dr. José Eduardo de Oliveira (docente) Profª. Amanda Coelho Danuello (docente) Rafael
Seminário de Química Orgânica Experimental n 7 Destilação Fracionada do Sistema Limoneno - Hexano Responsáveis: Prof. Dr. José Eduardo de Oliveira (docente) Profª. Amanda Coelho Danuello (docente) Rafael
Processos físicos de separação de misturas
 Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico
 PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
PAGQuímica 2011/1 Exercícios de Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração
O que se pode fazer com amoníaco?
 Nome :.. 11º Ano Turma: Classificação: Professora:... Disciplina de Física e Química A Ano 2 (Susana Vieira) AL 1.2 Síntese do sulfato de tetraminocobre(ii) mono-hidratado Questão - problema O que se pode
Nome :.. 11º Ano Turma: Classificação: Professora:... Disciplina de Física e Química A Ano 2 (Susana Vieira) AL 1.2 Síntese do sulfato de tetraminocobre(ii) mono-hidratado Questão - problema O que se pode
Bolsistas do subprojeto de Química: Ana Claudia Liz Mariela Matheus Marques Nayara Mendes Gabriela Camila Zanetti
 Bolsistas do subprojeto de Química: Ana Claudia Liz Mariela Matheus Marques Nayara Mendes Gabriela Camila Zanetti Alguns equipamentos e vidrarias comumente utilizados em laboratórios de Química e necessários
Bolsistas do subprojeto de Química: Ana Claudia Liz Mariela Matheus Marques Nayara Mendes Gabriela Camila Zanetti Alguns equipamentos e vidrarias comumente utilizados em laboratórios de Química e necessários
Atividade extra. Questão 1 Cecierj Questão 2 Cecierj Ciências da Natureza e suas Tecnologias Química
 Atividade extra Questão 1 Cecierj - 2013 Desenhe uma esfera de ferro e outra de chumbo que tenham massas iguais. Para isso, considere as seguintes densidades: densidade do ferro = 7,9 g/cm3 densidade do
Atividade extra Questão 1 Cecierj - 2013 Desenhe uma esfera de ferro e outra de chumbo que tenham massas iguais. Para isso, considere as seguintes densidades: densidade do ferro = 7,9 g/cm3 densidade do
O b) SO 2. CaSO 3 + CO 2
 31 c QUÍMICA petróleo pode conter alto teor de enxofre, que deve ser removido nas refinarias de petróleo. Mesmo assim, na queima de combustíveis fósseis, forma-se dióxido de enxofre. Esse óxido liberado
31 c QUÍMICA petróleo pode conter alto teor de enxofre, que deve ser removido nas refinarias de petróleo. Mesmo assim, na queima de combustíveis fósseis, forma-se dióxido de enxofre. Esse óxido liberado
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
PAG Química Equilíbrio Químico 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é
 1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
1. Para o equilíbrio gasoso entre NO e O 2 formando NO 2 (2 NO (g) + O 2 (g) 2 NO 2 (g)), a constante de equilíbrio é Kc = 6,45 x 10 5. a) em que concentração de O 2 as concentrações de NO 2 e de NO são
01) (USF-SP) Considerando-se as aparelhagens esquematizadas: Dessas afirmações, apenas:
 01) (USF-SP) Considerando-se as aparelhagens esquematizadas: Dessas afirmações, apenas: a) I é correta. d) I e II são corretas. b) II é correta. e) II e III são corretas. c) III é correta. 05) (UFPE-PE)
01) (USF-SP) Considerando-se as aparelhagens esquematizadas: Dessas afirmações, apenas: a) I é correta. d) I e II são corretas. b) II é correta. e) II e III são corretas. c) III é correta. 05) (UFPE-PE)
GOIÂNIA, / / PROFESSORA: Núbia de Andrade. DISCIPLINA:Química SÉRIE: 3º. ALUNO(a): Lista de Exercícios P1 I Bimestre
 GOIÂNIA, / / 2016 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 3º ALUNO(a): Lista de Exercícios P1 I Bimestre No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
GOIÂNIA, / / 2016 PROFESSORA: Núbia de Andrade DISCIPLINA:Química SÉRIE: 3º ALUNO(a): Lista de Exercícios P1 I Bimestre No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente
Prática 4: Reações envolvendo trocas de calor
 Prática 4: Reações envolvendo trocas de calor Pretende-se com essa atividade dar ao aluno a oportunidade de fazer experiências que possibilitem calcular calores de reação e aplicação da Lei de Hess. Etapa
Prática 4: Reações envolvendo trocas de calor Pretende-se com essa atividade dar ao aluno a oportunidade de fazer experiências que possibilitem calcular calores de reação e aplicação da Lei de Hess. Etapa
5ª LISTA - EXERCÍCIOS DE PROVAS Lei de Raoult
 Pg. 1/6 1 a Questão Metanol, CH 4 O, e etanol, C 2 H 6 O, são dois álcoois voláteis a 25 C. Ambos podem ser usados como solvente ou combustível e muitas vezes a mistura dos dois é empregada em processos
Pg. 1/6 1 a Questão Metanol, CH 4 O, e etanol, C 2 H 6 O, são dois álcoois voláteis a 25 C. Ambos podem ser usados como solvente ou combustível e muitas vezes a mistura dos dois é empregada em processos
Prática de Laboratório 1
 Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
OPERAÇÕES UNITÁRIAS II
 COLÉGIO META OPERAÇÕES UNITÁRIAS II Prof. ABEL SCUPELITI ARTILHEIRO SÃO PAULO 2012 1 OPERAÇÕES UNITÁRIAS II BALANÇO MATERIAL O Balanço Material é utilizado para projetos e análises de equipamentos de novas
COLÉGIO META OPERAÇÕES UNITÁRIAS II Prof. ABEL SCUPELITI ARTILHEIRO SÃO PAULO 2012 1 OPERAÇÕES UNITÁRIAS II BALANÇO MATERIAL O Balanço Material é utilizado para projetos e análises de equipamentos de novas
TAREFA DA 2ª SEMANA - 02 A 06 DE MARÇO QUÍMICA 3ª SÉRIE EM
 TAREFA DA 2ª SEMANA - 02 A 06 DE MARÇO QUÍMICA 3ª SÉRIE EM 1. (Pucrj 2008) Considere: (i) a variação de entalpia ( H) na combustão de 1 mol de etanol é o calor de reação que ocorre em pressão constante
TAREFA DA 2ª SEMANA - 02 A 06 DE MARÇO QUÍMICA 3ª SÉRIE EM 1. (Pucrj 2008) Considere: (i) a variação de entalpia ( H) na combustão de 1 mol de etanol é o calor de reação que ocorre em pressão constante
Seminário de Química Orgânica Experimental I. Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002
 Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Seminário de Química Orgânica Experimental I Silene Alessandra Santos Melo Douglas Fernando Antonio Outubro 2002 Recristalização da Acetanilida Introdução Cristalização Precipitação Recristalização Cristalização
Prof. José Valter SEPARAÇÃO DE MISTURAS
 1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
Destilação etanólica
 Destilação etanólica Etanol - 5 a 10% (v) Líquida Água Outras substâncias (ácidos lático, succínico e acético, glicerol, furfural, alcoóis homólogos superiores (amílico, propílico, butílico), aldeído acético,
Destilação etanólica Etanol - 5 a 10% (v) Líquida Água Outras substâncias (ácidos lático, succínico e acético, glicerol, furfural, alcoóis homólogos superiores (amílico, propílico, butílico), aldeído acético,
ACTIVIDADE LABORATORIAL - QUÍMICA 12º ANO. Produção de BIODIESEL a partir de óleo alimentar usado
 ACTIVIDADE LABORATORIAL - QUÍMICA 12º ANO Produção de BIODIESEL a partir de óleo alimentar usado 1. Objectivo: Reutilizar os óleos vegetais rejeitados 2. O que se pretende: 2.1 Seleccionar material adequado
ACTIVIDADE LABORATORIAL - QUÍMICA 12º ANO Produção de BIODIESEL a partir de óleo alimentar usado 1. Objectivo: Reutilizar os óleos vegetais rejeitados 2. O que se pretende: 2.1 Seleccionar material adequado
Ministério da Educação Universidade Federal do Paraná Setor Palotina. Soluções e cálculos de soluções
 Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Ministério da Educação Universidade Federal do Paraná Setor Palotina Aula Soluções e cálculos de soluções Prof. Isac G. Rosset Isac G. Rosset -UFPR Mistura vs Composto Mistura Os componentes podem ser
Extração e Purificação do Limoneno Parte II
 Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
Extração e Purificação do Limoneno Parte II Alan Cesar Pilon Andrey Pinheiro Técnicas para extração e purificação do Limoneno Extração com Solvente Destilação por arraste de vapor Destilação Fracionada
3 - Reciclagem de poli(tereftalato de etileno), PET, e reutilização do ácido tereftálico (3 aulas)
 3 - Reciclagem de poli(tereftalato de etileno), PET, e reutilização do ácido tereftálico (3 aulas) Pretende-se reciclar PET, recuperar o ácido tereftálico correspondente, e usá-lo para sintetizar tereftalato
3 - Reciclagem de poli(tereftalato de etileno), PET, e reutilização do ácido tereftálico (3 aulas) Pretende-se reciclar PET, recuperar o ácido tereftálico correspondente, e usá-lo para sintetizar tereftalato
Sistemas, Substâncias puras e Misturas Separação de Misturas
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
MATERIAL SUPLEMENTAR ANÁLISES FISICO-QUÍMICAS DO ÓLEO DE COCO. = índice de acidez
 MATERIAL SUPLEMENTAR ANÁLISES FISICO-QUÍMICAS DO ÓLEO DE COCO Índice de acidez Pesaram-se 2 g do óleo em um erlenmeyer de 125 ml. Em seguida, adicionaram-se 25 ml de uma mistura de éter-álcool etílico
MATERIAL SUPLEMENTAR ANÁLISES FISICO-QUÍMICAS DO ÓLEO DE COCO Índice de acidez Pesaram-se 2 g do óleo em um erlenmeyer de 125 ml. Em seguida, adicionaram-se 25 ml de uma mistura de éter-álcool etílico
MONITORAMENTO E CONTROLE DE UM PROCESSO DE DESTILAÇÃO
 MONITORAMENTO E CONTROLE DE UM PROCESSO DE DESTILAÇÃO Ederson Luis Posselt, Eloy Maury Metz edersonlp@yahoo.com.br, eloy@softersul.com.br 1. Introdução Destilação é um processo de separação de líquidos
MONITORAMENTO E CONTROLE DE UM PROCESSO DE DESTILAÇÃO Ederson Luis Posselt, Eloy Maury Metz edersonlp@yahoo.com.br, eloy@softersul.com.br 1. Introdução Destilação é um processo de separação de líquidos
QUÍMICA Tipos de soluções Edson Mesquita
 QUÍMICA Tipos de soluções Edson Mesquita 1 Soluções Uma solução é uma mistura homogênea de substâncias puras (átomos, moléculas ou íons) na qual não há precipitação. Substância pura: substância com composição
QUÍMICA Tipos de soluções Edson Mesquita 1 Soluções Uma solução é uma mistura homogênea de substâncias puras (átomos, moléculas ou íons) na qual não há precipitação. Substância pura: substância com composição
8ª LISTA - EXERCÍCIOS DE PROVAS Equilíbrio de Solubilidade
 Pg. 1/6 1 a Questão De acordo com as equações abaixo, a 25 ºC, faça o que se pede. BaF 2 (s) Ba 2+ (aq) + 2F - (aq) K ps (BaF 2 ) = 1,7 x 10-6 BaSO 4 (s) Ba 2+ (aq) + SO 2-4 (aq) K ps (BaSO 4 ) = 1,0 x
Pg. 1/6 1 a Questão De acordo com as equações abaixo, a 25 ºC, faça o que se pede. BaF 2 (s) Ba 2+ (aq) + 2F - (aq) K ps (BaF 2 ) = 1,7 x 10-6 BaSO 4 (s) Ba 2+ (aq) + SO 2-4 (aq) K ps (BaSO 4 ) = 1,0 x
EXPERIÊNCIA 02 DESTILAÇÃO
 EXPERIÊNCIA 02 DESTILAÇÃO 1- INTRODUÇÃO Destilação é uma técnica utilizada, geralmente, para remover um solvente, purificar um líquido ou para separar os componentes de uma mistura de líquidos, ou ainda
EXPERIÊNCIA 02 DESTILAÇÃO 1- INTRODUÇÃO Destilação é uma técnica utilizada, geralmente, para remover um solvente, purificar um líquido ou para separar os componentes de uma mistura de líquidos, ou ainda
PADRÃO DE RESPOSTA - QUÍMICA - Grupo J
 PADRÃO DE RESPOSTA - QUÍMICA - Grupo J 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
PADRÃO DE RESPOSTA - QUÍMICA - Grupo J 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
Figura 1: Equilíbrio químico entre as espécies glicose, manose e frutose em meio alcalino
 Introducão Um açúcar redutor (AR) pode ser identificado pelo reagente de Benedict 1 porque o grupo aldeído, presente no açúcar, reduz o íon cúprico (Cu 2+ ) formando um precipitado de óxido de cobre (I),
Introducão Um açúcar redutor (AR) pode ser identificado pelo reagente de Benedict 1 porque o grupo aldeído, presente no açúcar, reduz o íon cúprico (Cu 2+ ) formando um precipitado de óxido de cobre (I),
