CONCEITOS DE ÁCIDO, BASE E ph
|
|
|
- Isaac Garrau Carmona
- 8 Há anos
- Visualizações:
Transcrição
1 ÁGUA, ph E TAMPÕES- DISTÚRBIOS ÁCIDO-BÁSICOS (Adaptado de A regulação dos líquidos do organismo inclui a regulação da concentração do íon hidrogênio, para assegurar o ambiente ótimo para as funções celulares. A energia para todos os processos celulares e orgânicos, provém da energia química produzida pelo metabolismo celular. A concentração dos íons hidrogênio nos líquidos do organismo é medida pela unidade denominada ph. A redução do ph é denominada acidose e o seu aumento constitui a alcalose. Ambos, acidose e alcalose, podem diminuir acentuadamente a eficiência das reações químicas celulares; o metabolismo celular exige um estreito limite para a concentração do íon hidrogênio. O metabolismo celular produz ácidos que devem ser neutralizados, a fim de preservar o ph ou, em outras palavras, manter estável a concentração do íon hidrogênio. A principal base do organismo é o íon bicarbonato, produzido à partir da combinação do dióxido de carbono com a água. O bicarbonato e as demais bases do organismo atuam em associação com ácidos da mesma natureza química, formando pares de substâncias chamadas sistema tampão. A regulação do equilíbrio entre os ácidos e as bases do organismo depende de um mecanismo imediato, representado pelos sistema tampão e de um mecanismo respiratório rápido, que elimina ou retém o dióxido de carbono e, portanto, reduz ou aumenta o ácido carbônico. Depende também do mecanismo renal, mais lento, que elimina íon hidrogênio e retém ou elimina o íon bicarbonato, moderando a quantidade de bases disponíveis no organismo. CONCEITOS DE ÁCIDO, BASE E ph OBJETIVOS: Descrever o conceito de ácidos e bases. Analisar a concentração dos íons hidrogênio nos líquidos do organismo e a determinação do ph. Descrever os mecanismos de regulação do ph. Definir acidose e alcalose. CONCEITOS GERAIS O metabolismo celular produz ácidos que são lançados, continuamente, nos líquidos intracelular e extracelular e tendem a modificar a concentração dos íons hidrogênio. A manutenção da concentração dos íons hidrogênio dentro da faixa ótima para o metabolismo celular, depende da eliminação do ácido carbônico nos pulmões, da eliminação de íons hidrogênio pelos rins e da ação dos sistemas tampão intra e extracelulares. O modo como o organismo regula a concentração dos íons hidrogênio (H+) é de fundamental importância para a compreensão e a avaliação das alterações do equilíbrio entre os ácidos e as bases no interior das células, no meio líquido que as cerca (líquido intersticial) e no sangue (líquido intravascular). CONCEITO DE ÁCIDO E BASE Os elementos importantes para a função celular estão dissolvidos nos líquidos intra e extracelular. Sob o ponto de vista químico, uma solução é um líquido formado pela mistura de duas ou mais substâncias, homogeneamente dispersas entre sí. A mistura homogênea apresenta as mesmas propriedades em qualquer ponto do seu interior e não existe uma superfície de separação entre os seus componentes. A solução, portanto, consiste de um solvente, o composto principal, e um ou mais solutos. Nos líquidos do organismo a água é o solvente universal; as demais substâncias em solução, constituem os solutos. Em uma solução, um soluto pode estar no estado ionizado ou no estado não ionizado. Nos líquidos do organismo, os solutos existem em ambas as formas, em um tipo especial de equilíbrio químico. Quando um soluto está ionizado, os elementos ou radiciais químicos que o compõem, estão dissociados uns dos outros; a porção da substância que existe no estado ionizado é chamada íon. O soro fisiológico, por exemplo, é uma solução de água (solvente) contendo o cloreto de sódio (soluto). Uma parte do cloreto de sódio está no estado dissociado ou ionizado, constituida pelos íons Cl- (cloro) e Na+ (sódio), enquanto uma outra parte está no estado não dissociado, como NaCl (cloreto de sódio); ambas as partes estão em equilíbrio químico. Existem substâncias, como os ácidos fortes, as bases fortes e os sais, que permanecem em solução, quase completamente no estado ionizado. Outras substâncias, como os ácidos e as bases fracas, ao contrário, permanecem em solução em graus diversos de ionização. A água tem sempre um pequeno número de moléculas no estado ionizado. Os íons combinam-se entre si conforme a sua carga elétrica. Os cátions são os íons com carga elétrica positiva, como o hidrogênio (H+) e o sódio (Na+). Os ânions são os íons com carga elétrica negativa, como o hidróxido ou hidroxila (OH-) e o cloreto (Cl-). Para ser um ácido, é necessário que a molécula da substância tenha, pelo menos, um hidrogênio ligado ionicamente. O hidrogênio ionizado, simplesmente representa um próton. Um ácido é uma substância que, em solução, é capaz de doar prótons (H+). Uma base é uma substância que, em solução, é capaz de receber prótons. Em outras palavras, os ácidos são substâncias que, quando em solução, tem capacidade de ceder íons hidrogênio; as bases são substâncias que, quando em solução, tem capacidade de captar íons hidrogênio. Um ácido forte pode doar muitos íons hidrogênio para a solução, porque uma grande parte das suas moléculas se encontra no estado dissociado (estado iônico). Do mesmo modo, uma base forte pode captar muitos íons hidrogênio de uma solução. CONCEITO DE ph A atividade dos íons hidrogênio em uma solução qualquer, depende da quantidade de hidrogênio livre na solução. Para a avaliação do hidrogênio livre nas soluções, usa-se a unidade chamada ph. O termo ph significa potência de hidrogênio e foi criado para simplificar a medida da concentração de íons hidrogênio (H+) na água e nas soluções. A água é a substância padrão usada como referência, para expressar o grau de acidez ou de alcalinidade das demais substâncias. A água se dissocia em pequena quantidade em íons hidrogênio (H+) e hidroxila (OH-). 1
2 A água é considerada um líquido neutro por ser o que menos se dissocia ou ioniza. A quantidade de moléculas dissociadas ou ionizadas na água é muito pequena, em relação ao total de moléculas, bem como são pequenas as quantidades de íons H+ e OH-, em solução. Para cada 1 molécula de água dissociada em H+ e OH-, há de moléculas não dissociadas. A concentração do H+ na água, portanto, é de 1/ ou seja 0, , conforme representado na figura acima. Para facilitar a comparação dessas pequenas quantidades de íons, foi adotada a fração exponencial, ao invés da fração decimal. Assim, pela fração exponencial o valor de 0, é expresso como 10-7, chamada "potência sete do hidrogênio", e significa a sua concentração na água. Para evitar a utilização de frações exponenciais negativas, foi criada a denominação ph, que representa o logarítmo negativo, ou seja, o inverso do logarítmo, da atividade do íon hidrogênio. O ph de uma solução, portanto, representa o inverso da sua concentração de íons hidrogênio. Esta forma de representação permite que os valores da atividade do hidrogênio nas soluções, sejam expressos com números positivos. Como as quantidades dos íons nas soluções se equivalem, a água tem partes iguais do cátion (H+) e do ânion (OH-), ou seja, a concentração de (H+) é de 10-7 e a concentração de (OH-) também é de A água, portanto, tem o ph=7. H2O Û H+ (10-7) + OH- (10-7) A água é considerada uma substância neutra. Isto equivale a dizer que a água não é ácido nem base e serve de comparação para as demais soluções. Um ácido forte, em solução, libera uma quantidade de íons hidrogênio (H+), muito maior que a água. O seu ph, portanto será inferior ao da água. Ao contrário, uma base forte, por aceitar muitos prótons ou íons hidrogênio da solução, permitirá que apenas uma pequena parte dos íons fique livre, em comparação à água. O ph da base forte, portanto, será superior ao ph da água. O ph é expresso por uma escala numérica simples que vai de 0 (zero) a 14. O ponto 7 da escala é o ponto de neutralidade e representa o ph da água. As soluções cujo ph está entre 0 e 7 são denominadas ácidas; as que tem o ph entre 7 e 14 são denominadas básicas ou alcalinas. Quanto maior a concentração de hidrogênio livre em uma solução, tanto mais baixo será o seu ph. REGULAÇÃO DO ph NO ORGANISMO Quando se adiciona ácido à água, mesmo em pequenas quantidades, o ph da solução se altera rapidamente. O mesmo fenômeno ocorre com a adição de bases. Pequenas quantidades de ácido ou de base podem produzir grandes alterações do ph da água. Se adicionarmos ácido ou base ao plasma sanguíneo, veremos que há necessidade de uma quantidade muito maior de um ou de outro, até que se produzam alterações do ph. Isto significa que o plasma dispõe de mecanismos de defesa contra variações bruscas ou significativas do ph. O balanço entre os ácidos e as bases no organismo se caracteriza pela busca permanente do equilíbrio; o plasma resiste às alterações do ph, por meio de pares de substâncias, capazes de reagir tanto com ácidos quanto com bases, chamadas sistemas "tampão". Os mesmos mecanismos de defesa existem nos líquidos intracelular e intersticial. Três mecanismos regulam o ph dos líquidos orgânicos, conforme demonstra a figura acima. O mecanismo químico é representado pelos sistemas tampão, capazes de neutralizar ácidos e bases em excesso, dificultando as oscilações do ph. O mecanismo respiratório, de ação rápida, elimina ou retém o dióxido de carbono do sangue, conforme as necessidades, moderando o teor de ácido carbônico. O mecanismo renal é de ação mais lenta e, fundamentalmente, promove a poupança ou a eliminação do íon bicarbonato, conforme as necessidades, para, à semelhança dos demais mecanismos, assegurar a manutenção do ph dentro dos limites normais. VALORES NORMAIS DO ph A água é o solvente universal dos líquidos orgânicos; a sua concentração de hidrogênio livre ou ionizado é utilizada como valor de comparação para as demais soluções. O ph normal da água, considerada um líquido neutro é 7. As soluções com ph inferior a 7 são consideradas ácidas e as soluções com ph superior a 7 são consideradas alcalinas. Os líquidos orgânicos são constituidos de água contendo uma grande quantidade de solutos de diversas características químicas e iônicas. A solução orgânica padrão para a avaliação do ph é o sangue. O ph normal do sangue varia dentro da pequena faixa de 7,35 a 7,45. Em comparação com a água, portanto, o sangue normal tem o ph levemente alcalino. Essa alcalinidade do sangue representa a atividade iônica de numerosas substâncias incluindo-se os sistemas tampão. O sangue arterial é o padrão habitual para avaliação do ph; seu valor se situa na 2
3 porção mais alcalina da faixa normal, entre 7,4 e 7,45. O sangue venoso tem maior concentração de hidrogênio livre, recebido do líquido intersticial pelos capilares venosos. Em consequência, o ph do sangue venoso se situa na faixa menos alcalina do ph normal, geralmente entre 7,35 e 7,40. As principais alterações do ph do sangue estão representadas na figura 4. Quando o ph do sangue está abaixo de 7,35 existe acidose; se o ph do sangue é superior a 7,45, existe alcalose. Quando a acidose é severa e o ph alcança valores abaixo de 6,85, em geral as funções celulares se alteram de tal forma que sobrevém a morte celular; o distúrbio é irreversível. Do mesmo modo, nas alcaloses severas e persistentes, os valores de ph superiores a 7,95 são incompatíveis com a normalidade da função celular. O distúrbio é irreversível e, em geral, ocorre a morte celular. ph INTRACELULAR O interior das células reflete uma realidade metabólica diferente do plasma sanguíneo. A atividade celular gera permanentemente subprodutos ácidos como resultado de numerosas reações químicas. Em consequência, o ph habitual do líquido intracelular é mais baixo que o ph do plasma. O ph intracelular é de aproximadamente 6,9 nas células musculares e pode cair a 6,4 após um exercício extenuante. Nas células dos túbulos renais, o ph é de cerca de 7,3, de acordo com a predominância de substâncias alcalinas, podendo se alterar com as necessidades do organismo. Em geral, as células dos tecidos com maior atividade metabólica tem um ph levemente ácido, em relação ao ph do sangue. RESUMO O metabolismo celular produz ácidos que tendem a modificar a concentração dos íons hidrogênio nos líquidos do organismo. A manutenção da concentração ideal de íons hidrogênio depende da ação de ácidos e bases existentes nos líquidos, da eliminação de ácido carbônico pelos pulmões e da eliminação de íons hidrogênio pelos rins. Os ácidos são as substâncias que podem ceder íons hidrogênio para uma solução; bases são as substâncias que podem receber íons hidrogênio em uma solução. A quantidade de íons hidrogênio livres nas soluções é quantificada pelo ph. Quanto maior a quantidade de íons hidrogênio nas soluções, tanto mais baixo será o seu ph; ao contrário, as soluções com baixa concentração de íons hidrogênio, tem o ph mais elevado. A água é a substância padrão para comparação com as demais substâncias. A dissociação da água é desprezível; apenas uma molécula, em cada 10 milhões, se dissocia. A água é, portanto, uma substância neutra, ou seja não é ácido nem é base. O ph da água é 7; a água ocupa o ponto neutro da escala do ph, que vai de 0 a 14. As soluções com ph inferior ao da água, são consideradas ácidas; as soluções cujo ph é superior a 7, são consideradas bases. O ph do sangue reflete a atividade iônica de numerosas substâncias e é ligeiramente maior que o ph da água. O sangue normal tem o ph que varia entre 7,35 e 7,45. O sangue normal, portanto, é levemente alcalino, em relação à água. Quando o ph do sangue está abaixo de 7,35 dizemos que existe acidose; quando o ph do sangue supera o valor de 7,45, dizemos que há alcalose. SISTEMA TAMPÃO CONCEITOS GERAIS O organismo dispões de três importantes mecanismos reguladores do ph, que atuam em sincronia, com a finalidade de preservar as condições ótimas para as funções celulares. O mecanismo respiratório, de ação rápida, o mecanismo renal, de ação lenta e o mecanismo químico, de ação imediata, representado por pares de substâncias chamados sistemas "tampão", que podem reagir com ácidos ou com bases em excesso nos líquidos do organismo. SISTEMAS TAMPÃO Os tampões, denominação traduzida do original inglês "buffer" (amortecedor), são as substâncias que limitam as variações do ph do sangue e demais líquidos orgânicos, ao se combinarem com os ácidos ou as bases que alcançam aqueles líquidos. As substâncias que constituem os tampões agem aos pares ou, menos comumente, em grupos, constituindo um sistema protetor. Um sistema tampão é constituído por um ácido fraco e o seu sal, formado com uma base forte. O ácido fraco e o sal do sistema tampão, em condições normais, existem em uma relação constante, que o organismo tende a preservar. Se gotejarmos continuamente ácido clorídrico em água durante um intervalo de 90 minutos, verificamos que o ph da água passa de 7 para 1,84. Se administrarmos proporcionalmente, a mesma quantidade de ácido clorídrico a um cão no mesmo período de tempo, verificamos que o ph do sangue do animal passa de 7,44 para 7,14. A diferença de comportamento diante da mistura com o ácido clorídrico reflete a atuação dos sistemas tampão do plasma do animal, que impedem a variação mais acentuada do ph. O sistema tampão do bicarbonato e ácido carbônico corresponde a cerca de 64% do total de tampões. Esse sistema é essencial à regulação do equilíbrio ácido-base, porque o metabolismo celular gera muito ácido como produto final, sob a forma de ácido carbônico. Composição do Sistema Percentual Bicarbonato/Ácido Carbônico 64% Hemoglobina/Oxihemoglobina 28% 3
4 Proteinas ácidas/proteinas básicas 7% Fosfato monoácido/fosfato diácido 1% A Tabela acima lista os sistemas tampão que existem no sangue (líquido intravascular), nos tecidos (líquido intersticial) e no interior das células (líquido intracelular). Quando um ácido se acumula em maior quantidade no organismo, é neutralizado no sangue, no líquido intersticial e no interior das células, em partes aproximadamente iguais, ou seja, 1/3 do ácido é neutralizado no sangue, 1/3 é neutralizado no líquido intersticial e 1/3 no líquido intracelular. O processo intracelular é mais lento e pode demorar cerca de duas horas, para compensar uma alteração. Quando um ácido é adicionado ao sangue, o bicarbonato do tampão prontamente reage com ele; a reação produz um sal, formado com o sódio do bicarbonato e ácido carbônico. Essa reação diminui a quantidade de bases e altera a relação entre o bicarbonato e o ácido carbônico. O ácido carbônico produzido pela reação do bicarbonato do tampão, se dissocia em CO2 e água; o CO2 é eliminado nos pulmões, recompondo a relação de 20:1 do sistema protetor. Quando uma base invade o organismo, o ácido carbônico prontamente reage com ela, produzindo bicarbonato e água. O ácido carbônico diminui. Os rins aumentam a eliminação de bicarbonato ao invés do íon hidrogênio, reduzindo a quantidade de bicarbonato no organismo, para preservar a relação do sistema tampão. Todos os sistemas tampão do organismo atuam da mesma forma que o sistema bicarbonato/ácido carbônico. O sistema neutraliza o excesso de ácidos ou de bases e em seguida o organismo tenta recompor a relação normal do tampão. O princípio fundamental da regulação do equilíbrio ácido-base é a manutenção da relação constante entre o numerador e o denominador do sistema tampão. O bicarbonato total disponível no organismo é de aproximadamente meq, dos quais cerca de 450 meq. estão imediatamente disponíveis, distribuidos em 15 litros de líquido extracelular, sendo 3 litros de plasma e 12 litros de líquido intersticial. Nas alcaloses o organismo tolera a redução dos íons hidrogênio em cerca da metade do seu valor normal, até alcançar o ph incompatível com a vida celular. Nas acidoses, o organismo tolera a elevação dos íons hidrogênio 3 vezes acima do normal, até alcançar o ph incompatível com a vida. INTEGRAÇÃO DA DEFESA CONTRA VARIAÇÕES DO ph Os sistemas de defesa que mantém o ph dos líquidos orgânicos dentro de uma faixa estreita, atuam perfeitamente integrados em suas funções. Todos os líquidos do organismo possuem sistemas tampão, para impedir alterações significativas da concentração dos íon hidrogênio ou, em outras palavras, do ph. Se a concentração do íon hidrogênio aumenta ou diminui significativamente, o centro respiratório é imediatamente estimulado, para alterar a frequência respiratória e modificar a eliminação do dióxido de carbono. As variações da eliminação do dióxido de carbono, tendem a retornar o ph aos seus valores normais. Quando o ph se afasta da faixa normal, os rins eliminam urina ácida ou alcalina, contribuindo para o retorno da concentração dos íons hidrogênio aos valores normais. O TAMPÃO BICARBONATO/ÁCIDO CARBÔNICO O sistema tampão constituido pelo bicarbonato e pelo ácido carbônico tem características especiais nos líquidos do organismo. O ácido carbônico é um ácido bastante fraco e a sua dissociação em íons hidrogênio e íons bicarbonato é mínima, em comparação com outros ácidos. Em cada moléculas de ácido carbônico, cerca de 999 estão em equilíbrio sob a forma de dióxido de carbono (CO2) e água (H2O), do que resulta uma alta concentração de dióxido de carbono dissolvido e uma baixa concentração de ácido. O sistema tampão do bicarbonato/ácido carbônico é muito poderoso porque os seus componentes podem ser facilmente regulados. A concentração do dióxido de carbono é regulada pela eliminação respiratória e a concentração do bicarbonato é regulada pela eliminação renal. OUTROS SISTEMAS TAMPÃO Além do principal sistema tampão, o bicarbonato/ácido carbônico, outros sistemas são importantes na manutenção do equilíbrio ácido-base. No líquido intracelular, cuja concentração de sódio é baixa, o tampão do ácido carbônico consiste principalmente de bicarbonato de potássio e de magnésio.o sistema tampão fosfato, formado pelo fosfato de sódio e ácido fosfórico é eficaz no plasma, no líquido intracelular e nos túbulos renais onde se concentra em grande quantidade. O sistema tampão das proteinas é muito eficaz no interior das células, onde é o sistema mais abundante. O tampão hemoglobina é exclusivo das hemácias; colabora com a função de transporte do CO2 e com o tampão bicarbonato. Os sistemas tampão não são independentes entre sí, mas cooperativos. Qualquer condição que modifique um dos sistemas também influirá no equilíbrio dos demais; na realidade, os sistemas tampão auxiliam-se uns aos outros. DISTÚRBIOS ÁCIDO-BÁSICOS CONCEITOS GERAIS Os desvios da concentração de íons hidrogênio são ocorrências relativamente comuns nos pacientes graves, nos pacientes sob regime de terapia intensiva, especialmente quando a ventilação depende de respiradores mecânicos e nos que apresentam doença 4
5 significativa pulmonar ou renal, devido à interferência com os mecanismos reguladores naturais. São ainda comuns em pacientes com doenças sistêmicas severas, de qualquer natureza, em que haja comprometimento das funções metabólicas ou respiratórias. DESVIOS DO ph O ph é o indicador do estado ácido-base do organismo. Os desvios do equilíbrio ácido-base refletem-se nas alterações do ph do sangue. O ph normal do sangue, situa-se entre 7,35 e 7,45. Quando o ph está abaixo do valor mínimo normal, existe acidose. Se o ph está acima da faixa normal, existe alcalose. A prática tem demonstrado que o organismo humano tolera um certo grau de alcalose, melhor que graus idênticos de acidose. A severidade dos distúrbios do equilíbrio ácido-base pode ser apreciada pelo grau de alteração do ph. Quanto mais baixo o ph, mais severa é a acidose; do mesmo modo um ph muito elevado, indica a presença de alcalose grave. Desvios extremos do equilíbrio ácido-base, em geral se acompanham de alterações profundas da função dos órgãos vitais e podem determinar a morte do indivíduo. Em geral, o valor mínimo do ph, compatível com a vida nas acidoses é de 6,85; nas alcaloses, o valor máximo de ph, tolerado pelo organismo é de aproximadamente 7,95. As variações da concentração dos íons hidrogênio no organismo podem ser de origem interna (endógena) ou externa (exógena). O acúmulo de ácidos no organismo pode ser consequência da retenção do CO2 no sangue por dificuldade de eliminação nos alvéolos pulmonares, pode ocorrer em consequência do aumento da produção de ácido lático e por incapacidade de eliminação de ácidos fixos pelos rins (causas endógenas). Pode também ocorrer, em consequência da ingestão acidental de grande quantidade de ácidos, como o ácido acetilsalicílico (aspirina) ou outros agentes de natureza ácida (causas exógenas). A redução dos ácidos no organismo pode ser consequência da eliminação excessiva do CO2 (causa endógena), da perda de ácidos fixos ou da administração excessiva de bases, como o bicarbonato de sódio, por exemplo (causa exógena). Sempre que há tendência a desvios do equilíbrio ácido-base, o organismo intensifica a atuação dos mecanismos de compensação, na tentativa de impedir grandes desvios do ph. Nestas circunstâncias os desvios podem ser parcialmente compensados. A compensação completa do desvio, entretanto, depende da remoção da sua causa primária. CLASSIFICAÇÃO DOS DESVIOS DO EQUILÍBRIO ÁCIDO-BASE Os distúrbios do equilíbrio ácido-base são classificados conforme os seus mecanismos de produção. Dessa forma, as alterações podem ter origem respiratória ou metabólica. Esses desvios correspondem, portanto, a quatro tipos de alterações. Os desvios do tipo respiratório devem-se à alterações da eliminação do dióxido de carbono. Os desvios do tipo metabólico não sofrem interferência respiratória na sua produção. Conforme a duração, os desvios do equilíbrio ácido-base podem ser agudos ou crônicos. Os distúrbios crônicos, em geral, acompanham doenças crônicas do sistema respiratório ou dos rins. Os distúrbios crônicos costumam ser de intensidade mais leve, parcialmente compensados e melhor tolerados. ACIDOSES Ocorre acidose quando a concentração de íons hidrogênio livres nos líquidos do organismo está elevada; em consequência, o ph, medido no sangue arterial, está abaixo de 7,35. As acidoses podem ser de dois tipos: acidose respiratória e acidose metabólica. A acidose respiratória ocorre em consequência da redução da eliminação do dióxido de carbono nos alvéolos pulmonares. A retenção do CO2 no sangue que atravessa os capilares pulmonares, produz aumento da quantidade de ácido carbônico no sangue, com consequente redução do ph, caracterizando a acidose de origem respiratória. A acidose metabólica ocorre em consequência do aumento da quantidade de ácidos fixos, não voláteis, no sangue, como o ácido lático, corpos cetônicos ou outros. O ph do sangue se reduz, devido ao acúmulo de íons hidrogênio livres; não há interferência respiratória na produção do distúrbio. As acidoses, como distúrbio primário do equilíbrio ácido-base, são encontradas na prática clínica, mais frequentemente que as alcaloses. ALCALOSES Ocorre alcalose quando a concentração de íons hidrogênio livres, nos líquidos do organismo está reduzida. Em consequência, o ph medido no sangue arterial está acima de 7,45. Conforme o mecanismo de produção, as alcaloses podem ser de dois tipos, alcalose respiratória e alcalose metabólica. A alcalose respiratória ocorre em consequência do aumento da eliminação de dióxido de carbono nos alvéolos pulmonares. A eliminação excessiva do CO2 do sangue que atravessa os capilares pulmonares, produz redução da quantidade de ácido carbônico no sangue, com consequente elevação do ph, caracterizando a alcalose de origem 5
6 respiratória. A alcalose metabólica ocorre em consequência do aumento da quantidade de bases no sangue, como o íon bicarbonato. O ph do sangue se eleva, devido à redução de íons hidrogênio livres; não há interferência respiratória na produção do distúrbio. As alcaloses como alterações primárias do equilíbrio ácido-base, são encontradas na prática clínica, com menos frequência que as acidoses. REGULAÇÃO RESPIRATÓRIA DO ph CONCEITOS GERAIS Os principais mecanismos reguladores do equilíbrio ácido-base do organismo são os sistemas tampão, a regulação respiratória e a regulação renal. Esses mecanismos atuam em conjunto e, em circunstâncias normais, mantém inalterada a concentração de íons hidrogênio dos líquidos orgânicos, assegurando as condições ideais para a função celular. A alimentação e a atividade física produzem desvios do ph que são prontamente compensados, quando as funções respiratória e renal são adequadas. Em determinados estados patológicos ou em certas alterações pulmonares ou renais, a produção de ácidos ou a retenção de bases no organismo, podem ser tão intensos que os mecanismos de compensação tornam-se incapazes de manter o equilíbrio adequado. Nessas condições, o sistema regulador colapsa e o ph dos líquidos orgânicos se altera; as funções celulares deterioram e quando a condição persiste, em geral, ocorre a morte do indivíduo. Os sistemas tampão e os mecanismos respiratórios são os principais reguladores do ph dos líquidos do organismo diante de alterações bruscas do equilíbrio entre os ácidos e as bases. VENTILAÇÃO PULMONAR O pulmão humano possui cerca de 300 milhões de alvéolos, que equivalem a uma superfície de aproximadamente 70 metros quadrados, destinada a trocar gases com o ar atmosférico. A função respiratória se processa mediante três atividades distintas, mas interrelacionadas e coordenadas: ventilação, que consiste no processo através do qual o ar atmosférico alcança os alvéolos, para as trocas gasosas; perfusão, que consiste no processo pelo qual o sangue venoso alcança os capilares dos alvéolos, para as trocas gasosas; difusão, o processo pelo qual o oxigênio da mistura gasosa alveolar passa para o sangue, ao mesmo tempo em que o dióxido de carbono (CO2) contido no sangue passa para o gas dos alvéolos. O sistema respiratório pode ser representado simplificadamente, por uma membrana com enorme superfície em que, de um lado existe o ar atmosférico e do outro lado o sangue venoso. Através desta membrana, ocorrem as trocas gasosas. A enorme superfície disponível para as trocas gasosas permite que em um minuto o organismo possa eliminar até 200 ml de dióxido de carbono (CO 2 ). Por esta grande capacidade de eliminar o CO 2 do sangue, o pulmão é o mais importante regulador do equilíbrio ácido-básico do organismo. O mecanismo regulador respiratório pode manter o ph na faixa normal, variando a quantidade de dióxido de carbono eliminada nos alvéolos. PRODUÇÃO DO DIÓXIDO DE CARBONO (CO 2 ) As etapas terminais do metabolismo celular consistem na combustão da glicose e de outros metabólitos, com liberação de energia química e produção de dióxido de carbono e água. O dióxido de carbono formado no organismo difunde-se para os líquidos intersticiais e destes para o sangue. O dióxido de carbono (CO 2 ) combina-se com a água (H2O), para formar o ácido carbônico (H 2 CO 3 ); uma pequena parte se dissocia nos íons bicarbonato (HCO 3- ) e hidrogênio (H + ), conforme esquematizado na figura 7. A maior parte do ácido carbônico existe no sangue como CO 2 dissolvido e água, em equilíbrio. O dióxido de carbono é transportado pelo sangue venoso para os capilares pulmonares, sob três formas: Gás dissolvido - Cerca de 5% do CO 2 é transportado simplesmente dissolvido na água do plasma. Íon bicarbonato - Cerca de 75% do total de CO 2 é transportado sob a forma de íon bicarbonato, produto da reação com a água das hemácias, catalisada pela enzima anidrase carbônica, que torna a reação vezes mais rápida. O íon hidrogênio resultante da reação é captado pela hemoglobina (sistema tampão das hemácias). Combinado à hemoglobina - Os restantes 25% do CO 2 ligam-se à hemoglobina em local diferente do que se liga o oxigênio, mediante uma ligação química facilmente reversível, para transporte pelo sangue (carbamino hemoglobina). ELIMINAÇÃO DO DIÓXIDO DE CARBONO A produção díária de dióxido de carbono é elevada e depende da atividade metabólica dos indivíduos. O índice metabólico é o fator determinante da produção do CO 2 e, portanto, da sua eliminação pelos pulmões. Os gases tem um comportamento especial quando estão em solução. A quantidade de gás existente em uma solução é medida pela sua pressão parcial, ou seja, a pressão ou a tensão exercida pelo gás na solução, independente da presença de outros gases. A pressão parcial é proporcional à quantidade 6
7 de gás existente na solução. Por essa razão, a quantidade de CO 2 existente no sangue é medida pela sua pressão parcial. A pressão parcial do dióxido de carbono é representada pelo símbolo PCO 2. Nos capilares alveolares, o dióxido de carbono do sangue venoso se difunde para o gas dos alvéolos. A difusão do CO 2 para os alvéolos é comandada pela diferença de pressão parcial (PCO 2 ) entre o sangue venoso e o gas alveolar; esta difusão rápidamente equilibra a pco 2 do sangue com a PCO2 do gas dos alvéolos pulmonares. A eliminação do CO 2, reduz a quantidade de ácido carbônico, conforme representado na figura 8. A redução do CO 2 do sangue, elimina ácido e eleva o ph. O aumento da quantidade de dióxido de carbono no sangue, altera o ph para o lado ácido; a redução da quantidade (ou da tensão parcial) do dióxido de carbono no sangue, altera o ph para o lado alcalino. É com base nessa relação que o sistema respiratório modifica o ph. MECANISMO DA AUTO-REGULAÇÃO DO ph A concentração de íons hidrogênio do sangue ou, em outras palavras, o ph do sangue, modifica a ventilação alveolar, através do centro respiratório. Esta estrutura do sistema nervoso central se comporta como um "sensor" do ph do sangue. Quando a concentração de íons hidrogênio do sangue está elevada (ph baixo) o centro respiratório aumenta a frequência dos estímulos respiratórios, produzindo taquipneia. Com o aumento da frequência respiratória, aumenta a eliminação do CO 2 do sangue; a redução dos níveis sanguíneos do CO 2 eleva o ph. A concentração de H+ no sangue é permanentemente acompanhada pelo centro respiratório, que regula seus estímulos de acordo com ela, conforme demonstra o diagrama da figura 9. Ao contrário, quando a concentração de íons hidrogênio (H+) está baixa (ph elevado), o centro respiratório diminui a frequência dos estímulos à respiração e ocorre bradipneia, que reduz a eliminação do CO 2 tentando corrigir o ph do sangue. Na realidade, a regulação respiratória do ph, por estímulos do centro respiratório, não normaliza o ph do sangue, porque, à medida que a concentração do íon hidrogênio se aproxima do normal, o estímulo que modifica a atividade respiratória vai desaparecendo. Apesar disso, a compensação respiratória é extremamente eficaz para impedir grandes oscilações do ph. AVALIAÇÂO DO EQUILÍBRIO ÁCIDO-BASE A normalidade do ph, da PCO2 e das bases do sangue e demais líquidos do organismo é representada por faixas, ao invés de um valor simples e absoluto, por duas razões principais: 1. As medidas de parâmetros biológicos em uma grande quantidade de indivíduos são semelhantes, mas não são exatamente iguais. Um mesmo exame, realizado em um grande número de indivíduos, mostrará uma curva de distribuição de resultados. O valor encontrado o maior número de vêzes representa o ponto médio da curva. Os valores encontrados em 95% dos indivíduos, formam um segmento simétrico da curva, acima e abaixo do ponto médio e constituem o desvio padrão. A faixa de normalidade nessa curva abrange o ponto médio e o desvios padrão inferior e superior. 2. Os valores do equilíbrio ácido-base refletem a atividade metabólica das células e a atividade química de um grande número de substâncias existentes no sangue e nos líquidos intracelular e intersticial, onde ocorrem intercâmbio e reações químicas muito rápidas. O conceito de normalidade e seus valores numéricos, portanto, devem ser abrangentes e devem considerar as variações individuais. AVALIAÇÃO DO EQUILÍBRIO ÁCIDO-BASE A avaliação do estado ácido-base do organismo, na prática clínica, é feita pela análise de quatro parâmetros principais, determinados em amostras de sangue arterial. Esses parâmetros são o ph, a PCO2, o bicarbonato e a diferença de bases (excesso ou déficit). Gasometria é o exame que fornece os valores que permitem analisar os gases sanguíneos e o equilíbrio ácido-base; os aparelhos utilizados para a determinação dos gases sanguíneos e do ph são os analisadores de gases, dos quais existem vários tipos e modelos, disponíveis no mercado. Os aparelhos mais sofisticados fazem correções automáticas para o valor da hemoglobina e da temperatura e emitem os resultados já impressos em formulários próprios. Por se tratar da análise de gases, inclusive o CO2, muito volátil, diversos cuidados são essenciais em relação à coleta das amostras de sangue, transporte ao laboratório e realização imediata do exame, para assegurar a fidelidade dos resultados. A velocidade com que as condições do equilíbrio ácido-base podem se modificar, principalmente na terapia intensiva, requer a imediata análise dos resultados do exame, que refletem as condições do paciente, no momento da coleta da amostra. ANALISADORES DE GASES Os analisadores de gases sanguíneos utilizam eletrodos especiais para a determinação do ph, da pressão parcial de dióxido de carbono (PCO2) e da pressão parcial de oxigênio (PO2). A pressão parcial de oxigênio é determinada ao mesmo tempo que os demais parâmetros; contudo, sua análise não tem implicações nos mecanismos do equilíbrio ácido-base. A PO2 do sangue arterial nos informa sobre a eficiência da oxigenação realizada nos alvéolos pulmonares. Os eletrodos de ph, pco2 e de po2 são contidos em um pequeno reservatório, cuja temperatura é controlada. O aparelho requer calibração prévia para uso, que é obtida por comparação com soluções padronizadas. Os aparelhos modernos calculam os parâmetros que não são diretamente medidos 7
8 pelos eletrodos e são de grande precisão. A taxa de hemoglobina do sangue do paciente deve ser informada, para a correção do valor das bases em excesso ou em déficit. Estes cálculos consideram a presença do sistema tampão da hemoglobina. INTERPRETAÇÃO DO EXAME A interpretação da gasometria arterial, para a identificação de distúrbios do equilíbrio ácido-base é feita em etapas sucessivas: * Verificação do ph; * Verificação da PCO 2 ; * Verificação das bases (bicarbonato); * Verificação da diferença de bases (excesso ou déficit). VERIFICAÇÃO DO ph O valor do ph da amostra indica o estado do equilíbrio ácido-base. Um ph normal demonstra a ausência de desvios ou sua completa compensação. Se o ph está abaixo de 7,35, dizemos que existe acidose; quando o ph está acima de 7,45, dizemos que existe alcalose, conforme representado na figura abaixo. A análise do ph demonstra, simplesmente, a existência de acidose ou alcalose. Podemos, com base na experiência clínica, estimar a gravidade dos distúrbios pelos níveis do ph. Um ph igual ou inferior a 7,25 é indicativo de acidose severa, enquanto que um ph, igual ou superior a 7,55 é indicativo de alcalose severa. A avaliação isolada do ph, obviamente, não oferece qualquer indicação sobre a origem do distúrbio, que pode ser respiratória ou metabólica. VERIFICAÇÃO DA PCO 2 Após determinar a presença de acidose ou alcalose, devemos investigar a origem do distúrbio. O passo seguinte é avaliar o componente respiratório do equilíbrio ácido-base. O componente respiratório é avaliado pela quantidade de ácido carbônico existente no sangue. O ácido carbônico existe quase completamente sob a forma de CO2 + H2O. A sua quantidade, portanto, pode ser determinada pela pressão parcial do dióxido de carbono (PCO 2 ). A pressão parcial do CO2 no sangue arterial normal oscila entre 35 e 45mmHg. Um valor anormal da PCO2, acima de 45mmHg ou abaixo de 35mmHg, indica a origem respiratória do distúrbio. Quando a PCO2 está acima de 45mmHg significa que há retenção de CO2 no sangue, o que, em consequência reduz o ph. Existe, portanto, acidose respiratória. Quando, ao contrário, a PCO2 está abaixo de 35mmHg significa que há excessiva eliminação de CO2 do sangue e, em consequência, o ph se eleva. Nessas circunstâncias, estamos diante de um quadro de alcalose respiratória. A figura 15 ilustra o comportamento da PCO2 que origina os dois distúrbios de natureza respiratória. NOTA: Embora na prática, o termo PCO2 seja de uso corrente, a expressão da pressão parcial de gases, deve respeitar a seguinte convenção: PACO 2 : refere-se à pressão parcial do CO2 no gas alveolar (com A maiúsculo). PaCO2: refere-se à pressão parcial do CO2 no sangue arterial (com a minúsculo). PvCO2: refere-se à pressão parcial do CO2 no sangue venoso (com v minúsculo). VERIFICAÇÃO DAS BASES A quantidade de bases disponíveis no sangue, indica o estado do componente metabólico do equilíbrio ácido-base. As bases disponíveis no organismo para a neutralização dos ácidos, não são medidas diretamente na amostra do sangue, como acontece com o ph e a pco2; na realidade, a medida das bases é derivada das medidas anteriores. Os analisadores de gases de uso corrente calculam aqueles valores. A relação entre o bicarbonato plasmático, controlado pelos rins, e o ácido carbônico, controlado pelos pulmões, determina o ph. Esse princípio permite o cálculo das bases, em função da sua relação com o ph e a PCO 2. 8
9 Existem diversos modos de expressar as bases existentes no sangue. Os dois parâmetros mais correntemente utilizados na prática, são o bicarbonato real e o base excess. No analisador de gases, a amostra de sangue é colocada em presença de uma solução padronizada, cuja PCO2 é de 40mmHg. Após o equilíbrio, a PCO2 da amostra será de 40mmHg, independente do seu valor inicial. O bicarbonato real existente no sangue é calculado à partir do ph e do CO2. Os valores das bases são expressos em miliequivalentes por litro ou, mais comumente em milimols/litro (mm/l). O valor normal do bicarbonato real (BR), oscila de 22 a 28mM/L. A figura 16 ilustra o comportamento do bicarbonato real nos distúrbios metabólicos do equilíbrio ácido-base. Quando o bicarbonato real (BR) está baixo, inferior a 22mM/L, significa que parte da reserva de bases foi consumida; em consequência o ph do sangue se reduz, configurando o quadro de acidose metabólica. Quando, ao contrário, o bicarbonato real (BR) está elevado, acima de 28mM/L, significa que há excesso de bases disponíveis no sangue. O excesso das bases eleva o ph, configurando o quadro da alcalose metabólica. VERIFICAÇÃO DA DIFERENÇA DE BASES O cálculo do bicarbonato ignora o poder tamponante do fosfato e das proteinas (principalmente a hemoglobina) do sangue e, portanto, não permite quantificar o distúrbio com precisão. A capacidade total de neutralização das bases é melhor refletida pelo cálculo da diferença de bases (excesso ou déficit de bases existentes). Este parâmetro é calculado à partir das medidas do ph, da PCO2 e da hemoglobina. O resultado expressa o excesso de bases existentes nas alcaloses metabólicas ou o déficit de bases existentes nas acidoses metabólicas. O valor aceito como normal para a diferença de bases é de 2mEq/L ou, em outras palavras: a diferença de bases oscila entre um déficit (BD) de -2,0mEq/l e um excesso (BE) de +2,0mEq/l. Usa-se o termo excesso de bases, do inglês "base excess" (BE) para exprimir o resultado positivo e o termo déficit ou deficiência de bases, "base deficit" (BD) para exprimir o resultado negativo. Um déficit de bases indica a existência de acidose metabólica, enquanto o excesso de bases indica alcalose metabólica. O comportamento da diferença de bases está representado na figura acima. A diferença de bases calculada, na realidade, representa o número de miliequivalentes de bases que faltam ou que excedem para que o ph do sangue seja normal (7,40). DISTÚRBIOS COMPENSADOS Os distúrbios do equilíbrio ácido-base ativam os mecanismos de compensação. Dessa forma, se o distúrbio se prolonga, os exames poderão mostrar também o resultado da ação dos mecanismos compensadores. O resultado dos exames laboratoriais representa o distúrbio primário e as tentativas de compensação do organismo. Por essa razão, quando a alteração primária tem duração suficiente, os exames podem expressar a resultante da compensação do distúrbio. Esses distúrbios são chamados compensados ou parcialmente compensados. Nas fases agudas, mais comum nas unidades de terapia intensiva, a compensação raramente ocorre, pelo menos ao ponto de mascarar o resultado dos exames. 9
Sistema tampão. Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H +
 Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
FISIOLOGIA RESPIRATÓRIA
 FISIOLOGIA RESPIRATÓRIA Respiração A função da respiração é essencial à vida e pode ser definida, de um modo simplificado, como a troca de gases (O 2 e CO 2 ) entre as células do organismo e a atmosfera.
FISIOLOGIA RESPIRATÓRIA Respiração A função da respiração é essencial à vida e pode ser definida, de um modo simplificado, como a troca de gases (O 2 e CO 2 ) entre as células do organismo e a atmosfera.
GASOMETRIA ARTERIAL GASOMETRIA. Indicações 11/09/2015. Gasometria Arterial
 GASOMETRIA ARTERIAL Processo pelo qual é feita a medição das pressões parciais dos gases sangüíneos, a partir do qual é possível o cálculo do PH sangüíneo, o que reflete o equilíbrio Ácido-Básico 2 GASOMETRIA
GASOMETRIA ARTERIAL Processo pelo qual é feita a medição das pressões parciais dos gases sangüíneos, a partir do qual é possível o cálculo do PH sangüíneo, o que reflete o equilíbrio Ácido-Básico 2 GASOMETRIA
Água e Solução Tampão
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
Anatomia e Fisiologia Humana
 Componentes Vias Respiratórias A) Cavidades ou Fossas Nasais; B) Boca; C) Faringe; D) Laringe; E) Traqueia; F) Brônquios; G) Bronquíolos; H) Pulmões Cavidades ou Fossas Nasais; São duas cavidades paralelas
Componentes Vias Respiratórias A) Cavidades ou Fossas Nasais; B) Boca; C) Faringe; D) Laringe; E) Traqueia; F) Brônquios; G) Bronquíolos; H) Pulmões Cavidades ou Fossas Nasais; São duas cavidades paralelas
QUÍMICA CELULAR NUTRIÇÃO TIPOS DE NUTRIENTES NUTRIENTES ENERGÉTICOS 4/3/2011 FUNDAMENTOS QUÍMICOS DA VIDA
 NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
Dra. Kátia R. P. de Araújo Sgrillo Sgrillo.ita@ftc.br
 Dra. Kátia R. P. de Araújo Sgrillo Sgrillo.ita@ftc.br A água é a substância mais abundante nos seres vivos, perfazendo 70% ou mais da massa da maioria dos organismos. A água permeia todas as porções de
Dra. Kátia R. P. de Araújo Sgrillo Sgrillo.ita@ftc.br A água é a substância mais abundante nos seres vivos, perfazendo 70% ou mais da massa da maioria dos organismos. A água permeia todas as porções de
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
TRANSPORTE DE GASES NO SANGUE. Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas
 TRANSPORTE DE GASES NO SANGUE Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas ANATOMIA DO SISTEMA RESPIRATÓRIO ESTRUTURA DAS VIAS AÉREAS ESQUERDO WEST 2002 VASOS ALVEOLARES
TRANSPORTE DE GASES NO SANGUE Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas ANATOMIA DO SISTEMA RESPIRATÓRIO ESTRUTURA DAS VIAS AÉREAS ESQUERDO WEST 2002 VASOS ALVEOLARES
OBJETIVOS: CARGA HORÁRIA MÍNIMA CRONOGRAMA:
 ESTUDO DIRIGIDO COMPONENTE CURRICULAR: Controle de Processos e Instrumentação PROFESSOR: Dorival Rosa Brito ESTUDO DIRIGIDO: Métodos de Determinação de Parâmetros de Processos APRESENTAÇÃO: O rápido desenvolvimento
ESTUDO DIRIGIDO COMPONENTE CURRICULAR: Controle de Processos e Instrumentação PROFESSOR: Dorival Rosa Brito ESTUDO DIRIGIDO: Métodos de Determinação de Parâmetros de Processos APRESENTAÇÃO: O rápido desenvolvimento
a) Qual a configuração eletrônica do cátion do alumínio isoeletrônico ao gás nobre neônio?
 Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B
 Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
PRINCÍPIO FÍSICO E TRANSPORTE DOS GASES
 PRINCÍPIO FÍSICO E TRANSPORTE DOS GASES Prof. Me Tatiane Quaresma O sangue tem várias funções, entre as quais o transporte de gases respiratórios essenciais ao funcionamento do nosso organismo. O2 das
PRINCÍPIO FÍSICO E TRANSPORTE DOS GASES Prof. Me Tatiane Quaresma O sangue tem várias funções, entre as quais o transporte de gases respiratórios essenciais ao funcionamento do nosso organismo. O2 das
Química Analítica Avançada: Volumetria de Neutralização. Prof a Lilian Silva 2011
 Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
Sistema Respiratório Introdução
 Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
Equilíbrio Ácido-Básico. Água : solvente das reações químicas
 Equilíbrio Ácido-Básico Água : solvente das reações químicas Introdução Polaridade molecular: moléculas que possuem uma maior concentração de cargas numa parte da molécula. Os elétrons são compartilhados
Equilíbrio Ácido-Básico Água : solvente das reações químicas Introdução Polaridade molecular: moléculas que possuem uma maior concentração de cargas numa parte da molécula. Os elétrons são compartilhados
EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA. Profa. Dra. Monica Akemi Sato
 EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA Profa. Dra. Monica Akemi Sato Introdução Homeostasia: constância do meio interno Claude Bernard Parâmetros fisiológicos constantes: temperatura, volume, pressão,
EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA Profa. Dra. Monica Akemi Sato Introdução Homeostasia: constância do meio interno Claude Bernard Parâmetros fisiológicos constantes: temperatura, volume, pressão,
Adaptações Cardiovasculares da Gestante ao Exercício
 Desde as décadas de 60 e 70 o exercício promove Aumento do volume sanguíneo Aumento do volume cardíaco e suas câmaras Aumento do volume sistólico Aumento do débito cardíaco que pode ser alcançado Aumento
Desde as décadas de 60 e 70 o exercício promove Aumento do volume sanguíneo Aumento do volume cardíaco e suas câmaras Aumento do volume sistólico Aumento do débito cardíaco que pode ser alcançado Aumento
As proteínas transportadoras
 As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
Insuficiência respiratória aguda. Prof. Claudia Witzel
 Insuficiência respiratória aguda O que é!!!!! IR aguda Incapacidade do sistema respiratório de desempenhar suas duas principais funções: - Captação de oxigênio para o sangue arterial - Remoção de gás carbônico
Insuficiência respiratória aguda O que é!!!!! IR aguda Incapacidade do sistema respiratório de desempenhar suas duas principais funções: - Captação de oxigênio para o sangue arterial - Remoção de gás carbônico
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S SÓ ABRA QUANDO AUTORIZADO.
 U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
Pigmentos respiratórios: capacidade de se ligar reversivelmente ao oxigênio, aumentando muito a capacidade carreadora do sangue
 PIGMENTOS RESPIRATÓRIOS RESPIRAÇÃO AULA 5 Pigmentos respiratórios: capacidade de se ligar reversivelmente ao oxigênio, aumentando muito a capacidade carreadora do sangue Ex: hemoglobina Mamíferos apresentam
PIGMENTOS RESPIRATÓRIOS RESPIRAÇÃO AULA 5 Pigmentos respiratórios: capacidade de se ligar reversivelmente ao oxigênio, aumentando muito a capacidade carreadora do sangue Ex: hemoglobina Mamíferos apresentam
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
Como interpretar a Gasometria de Sangue Arterial
 Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Alterações do Equilíbrio
 Alterações do Equilíbrio 17 Ácido-base A função normal das células do organismo depende de uma série de processos bioquímicos e enzimáticos do metabolismo celular. Diversos fatores devem ser mantidos dentro
Alterações do Equilíbrio 17 Ácido-base A função normal das células do organismo depende de uma série de processos bioquímicos e enzimáticos do metabolismo celular. Diversos fatores devem ser mantidos dentro
TROCA E TRANSPORTE DE GASES
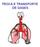 TROCA E TRANSPORTE DE GASES Difusão dos gases através da membrana respiratória Unidade Respiratória Cada alvéolo: 0,2 mm Parede Unidade respiratória: delgada Capilares Membrana Respiratória ou Membrana
TROCA E TRANSPORTE DE GASES Difusão dos gases através da membrana respiratória Unidade Respiratória Cada alvéolo: 0,2 mm Parede Unidade respiratória: delgada Capilares Membrana Respiratória ou Membrana
Alterações do Equilíbrio Ácido-Base.
 17 Alterações do Equilíbrio Ácido-Base. 308 - VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA A função normal das células do organismo depende de uma série de processos bioquímicos e enzimáticos do metabolismo
17 Alterações do Equilíbrio Ácido-Base. 308 - VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA A função normal das células do organismo depende de uma série de processos bioquímicos e enzimáticos do metabolismo
Química Geral 3º ANO
 Química Geral 3º ANO Teoria de Arrhenius Teoria Ácido-Base Teoria de Arrhenius Teoria Ácido-Base Ácido são substâncias que, dissolvidas em água, se ionizam liberando, na forma de cátions, exclusivamente
Química Geral 3º ANO Teoria de Arrhenius Teoria Ácido-Base Teoria de Arrhenius Teoria Ácido-Base Ácido são substâncias que, dissolvidas em água, se ionizam liberando, na forma de cátions, exclusivamente
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4. , K +, Mg 2+, etc...)
 Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza
 Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
P2 - PROVA DE QUÍMICA GERAL - 11/10/08
 P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
Apostila de Química Geral
 Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
Cursinho Vitoriano UNESP - Universidade Estadual Paulista "Júlio de Mesquita Filho" Câmpus de São José do Rio Preto Apostila de Química Geral Período noturno Ligações químicas interatômicas Vanessa R.
 Reações Químicas Reações Químicas DG O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças químicas, onde ocorre a conversão de uma substância, ou mais, em outras substâncias. A + B REAGENTES C +
Reações Químicas Reações Químicas DG O QUE É UMA REAÇÃO QUÍMICA? É processo de mudanças químicas, onde ocorre a conversão de uma substância, ou mais, em outras substâncias. A + B REAGENTES C +
ELETRODO OU SEMIPILHA:
 ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
ELETROQUÍMICA A eletroquímica estuda a corrente elétrica fornecida por reações espontâneas de oxirredução (pilhas) e as reações não espontâneas que ocorrem quando submetidas a uma corrente elétrica (eletrólise).
Professor Fernando Stuchi M ETABOLISMO DE C ONSTRUÇÃO
 M ETABOLISMO DE C ONSTRUÇÃO P ROTEÍNAS P ROPRIEDADE BÁSICA São grandes moléculas (macromoléculas) constituídas por aminoácidos, através de ligações peptídicas. É o composto orgânico mais abundante no corpo
M ETABOLISMO DE C ONSTRUÇÃO P ROTEÍNAS P ROPRIEDADE BÁSICA São grandes moléculas (macromoléculas) constituídas por aminoácidos, através de ligações peptídicas. É o composto orgânico mais abundante no corpo
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é:
 01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
01) (ACAFE) O grupo de átomos que é encontrado na forma monoatômica pelo fato de serem estáveis é: a) Halogênios b) Calcogênios c) Metais Alcalinos Terrosos d) Metais Alcalinos e) Gases Nobres 02) (UFF-RJ)
FISIOLOGIA RENAL EXERCÍCIOS DE APRENDIZAGEM
 EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
Introdução. Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo.
 Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0
 EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0 1- Que órgão do sistema nervoso central controla nosso ritmo respiratório? Bulbo 2- Os alvéolos são formados por uma única camada de células muito finas. Explique como
EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0 1- Que órgão do sistema nervoso central controla nosso ritmo respiratório? Bulbo 2- Os alvéolos são formados por uma única camada de células muito finas. Explique como
IESA-ESTUDO DIRIGIDO 1º SEMESTRE 8º ANO - MANHÃ E TARDE- DISCIPLINA: CIÊNCIAS PROFESSORAS: CELIDE E IGNÊS. Aluno(a): Turma:
 IESA-ESTUDO DIRIGIDO 1º SEMESTRE 8º ANO - MANHÃ E TARDE- DISCIPLINA: CIÊNCIAS PROFESSORAS: CELIDE E IGNÊS Aluno(a): Turma: Querido (a) aluno (a), Este estudo dirigido foi realizado para que você revise
IESA-ESTUDO DIRIGIDO 1º SEMESTRE 8º ANO - MANHÃ E TARDE- DISCIPLINA: CIÊNCIAS PROFESSORAS: CELIDE E IGNÊS Aluno(a): Turma: Querido (a) aluno (a), Este estudo dirigido foi realizado para que você revise
Química - Grupo J - Gabarito
 - Gabarito 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Informe a que volume deve ser diluído com água um litro de solução de um ácido fraco HA 0.10 M, de constante de ionização extremamente pequena (K
- Gabarito 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Informe a que volume deve ser diluído com água um litro de solução de um ácido fraco HA 0.10 M, de constante de ionização extremamente pequena (K
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com
 Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Reações a altas temperaturas. Diagrama de Equilíbrio
 Reações a altas temperaturas Diagrama de Equilíbrio Propriedades de um corpo cerâmico Determinadas pelas propriedades de cada fase presente e pelo modo com que essas fases (incluindo a porosidade) estão
Reações a altas temperaturas Diagrama de Equilíbrio Propriedades de um corpo cerâmico Determinadas pelas propriedades de cada fase presente e pelo modo com que essas fases (incluindo a porosidade) estão
EQUILÍBRIO QUÍMICO 1
 EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
Resolução: 0,86ºC. x = 0,5 mol etanol/kg acetona. 0,5 mol 1000 g de acetona. 200 g de acetona. y = 0,1 mol de etanol. 1 mol de etanol (C 2 H 6 O) 46 g
 (ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
(ACAFE) Foi dissolvida uma determinada massa de etanol puro em 200 g de acetona acarretando em um aumento de 0,86 C na temperatura de ebulição da acetona. Dados: H: 1 g/mol, C: 12 g/mol, O: 16 g/mol. Constante
A) Escreva a equação que representa a semi-reação de redução e seu respectivo potencial padrão.
 QUÍMICA QUESTÃ 01 Aparelhos eletrônicos sem fio, tais como máquinas fotográficas digitais e telefones celulares, utilizam, como fonte de energia, baterias recarregáveis. Um tipo comum de bateria recarregável
QUÍMICA QUESTÃ 01 Aparelhos eletrônicos sem fio, tais como máquinas fotográficas digitais e telefones celulares, utilizam, como fonte de energia, baterias recarregáveis. Um tipo comum de bateria recarregável
Sistema circulatório. Componentes: - Vasos sanguíneos. - Sangue (elementos figurados e plasma) - Coração
 Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
QUÍMICA QUESTÃO 41 QUESTÃO 42
 Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
Processo Seletivo/UNIFAL- janeiro 2008-1ª Prova Comum TIPO 1 QUÍMICA QUESTÃO 41 Diferentes modelos foram propostos ao longo da história para explicar o mundo invisível da matéria. A respeito desses modelos
TITULAÇÃO DE ÁCIDO-BASE
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Disciplina QUIO94 - Introdução à Análise Química
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Disciplina QUIO94 - Introdução à Análise Química
Características e os efeitos das propriedades coligativas
 Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
Unidade 1 Adaptação e Lesão Celular
 DISCIPLINA DE PATOLOGIA Prof. Renato Rossi Jr Unidade 1 Adaptação e Lesão Celular Objetivo da Unidade: Identificar e compreender os mecanismos envolvidos nas lesões celulares reversíveis e irreversíveis.
DISCIPLINA DE PATOLOGIA Prof. Renato Rossi Jr Unidade 1 Adaptação e Lesão Celular Objetivo da Unidade: Identificar e compreender os mecanismos envolvidos nas lesões celulares reversíveis e irreversíveis.
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA DE QUÍMICA
 PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA DE QUÍMICA TEMAS 1. Estrutura da matéria 1.1 Elementos, átomos e iões 1.2
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA DE QUÍMICA TEMAS 1. Estrutura da matéria 1.1 Elementos, átomos e iões 1.2
Prova de Recuperação Bimestral de Ciências Nome Completo: Data: / /2010
 COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
COLÉGIO MARIA IMACULADA QI 05 ch. 72 LAGO SUL BRASÍLIA DF E-MAIL: cmidf@cmidf.com.br FONE: 248 4768 SITE: www.cmidf.com.br VALOR:10 pontos. NOTA: 9ºano 2º PERÍODO Prova de Recuperação Bimestral de Ciências
EXERCÍCIO E DIABETES
 EXERCÍCIO E DIABETES Todos os dias ouvimos falar dos benefícios que os exercícios físicos proporcionam, de um modo geral, à nossa saúde. Pois bem, aproveitando a oportunidade, hoje falaremos sobre a Diabetes,
EXERCÍCIO E DIABETES Todos os dias ouvimos falar dos benefícios que os exercícios físicos proporcionam, de um modo geral, à nossa saúde. Pois bem, aproveitando a oportunidade, hoje falaremos sobre a Diabetes,
Existem diversos tipos de transporte que podem ocorrer através da membrana plasmática. Vejamos abaixo:
 MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
Biologia. Sistema circulatório
 Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
POTENCIAL ELÉTRICO. alvaro.unespbauru@hotmail.com
 POTENCIAL ELÉTRICO alvaro.unespbauru@hotmail.com Potenciais elétricos Potencial de membrana: é a diferença de potencial elétrico, em Volts (V), gerada a partir de um gradiente eletroquímico através de
POTENCIAL ELÉTRICO alvaro.unespbauru@hotmail.com Potenciais elétricos Potencial de membrana: é a diferença de potencial elétrico, em Volts (V), gerada a partir de um gradiente eletroquímico através de
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO
 Preparatório Concursos- 2012 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias;
Preparatório Concursos- 2012 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias;
Nesse sistema de aquecimento,
 Enem 2007 1- Ao beber uma solução de glicose (C 6 H 12 O 6 ), um corta-cana ingere uma substância: (A) que, ao ser degradada pelo organismo, produz energia que pode ser usada para movimentar o corpo. (B)
Enem 2007 1- Ao beber uma solução de glicose (C 6 H 12 O 6 ), um corta-cana ingere uma substância: (A) que, ao ser degradada pelo organismo, produz energia que pode ser usada para movimentar o corpo. (B)
SUSPENSÕES E SOLUÇÕES
 SUSPENSÕES E SOLUÇÕES Definições SUSPENSÃO Mistura heterogênea de substâncias Ex.: sangue (suspensão de plasma e células) água e óleo; água e areia, água e açúcar SOLUÇÃO Mistura homogênea de substâncias
SUSPENSÕES E SOLUÇÕES Definições SUSPENSÃO Mistura heterogênea de substâncias Ex.: sangue (suspensão de plasma e células) água e óleo; água e areia, água e açúcar SOLUÇÃO Mistura homogênea de substâncias
CONTEÚDOS OBJETIVOS PERÍODO
 ESCOLA BÁSICA2,3 EUGÉNIO DOS SANTOS 2013 2014 página 1 ESCOLA BÁSICA DO 2.º E 3.º CICLOS EUGÉNIO DOS SANTOS PLANIFICAÇÃO E METAS DE APRENDIZAGEM DA DISCIPLINA DE CIÊNCIAS FÍSICO-QUÍMICAS 8.º ANO DE ESCOLARIDADE
ESCOLA BÁSICA2,3 EUGÉNIO DOS SANTOS 2013 2014 página 1 ESCOLA BÁSICA DO 2.º E 3.º CICLOS EUGÉNIO DOS SANTOS PLANIFICAÇÃO E METAS DE APRENDIZAGEM DA DISCIPLINA DE CIÊNCIAS FÍSICO-QUÍMICAS 8.º ANO DE ESCOLARIDADE
Elementos do bloco p
 Elementos do bloco p Características gerais principais Estados de oxidação e tipos de ligações Inicialmente, para efeitos didáticos, serão utilizados os elementos do grupo 13 (B, Al, Ga, In Tl), que apresentam
Elementos do bloco p Características gerais principais Estados de oxidação e tipos de ligações Inicialmente, para efeitos didáticos, serão utilizados os elementos do grupo 13 (B, Al, Ga, In Tl), que apresentam
TRATAMENTO DA ÁGUA. Professora: Raquel Malta Química 3ª série - Ensino Médio
 TRATAMENTO DA ÁGUA Professora: Raquel Malta Química 3ª série - Ensino Médio Água poluída: água inadequada para beber ou para fazer nossa higiene. Diversas substâncias naturalmente presentes na água são
TRATAMENTO DA ÁGUA Professora: Raquel Malta Química 3ª série - Ensino Médio Água poluída: água inadequada para beber ou para fazer nossa higiene. Diversas substâncias naturalmente presentes na água são
Química Atomística Profª: Bruna Villas Bôas. Exercícios
 NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
NÚMERO ATÔMICO (Z) Os diferentes tipos de átomos (elementos químicos) são identificados pela quantidade de prótons (P) que possui. Esta quantidade de prótons recebe o nome de número atômico e é representado
O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico.
 1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
Informação Técnica 10.08.01 E 09.2003 Offset Serviços. Molhagem em impressão offset Fatos importantes para o uso nos aditivos de molhagem offset 1/5
 Informação Técnica 10.08.01 E 09.2003 Offset Serviços Molhagem em impressão offset Fatos importantes para o uso nos aditivos de molhagem offset 1/5 O processo de impressão offset Offset continua a ser
Informação Técnica 10.08.01 E 09.2003 Offset Serviços Molhagem em impressão offset Fatos importantes para o uso nos aditivos de molhagem offset 1/5 O processo de impressão offset Offset continua a ser
------------------------------------------------------------------------------ - Modelos de células de condutância. Procedimento Experimental
 QMC5351 Química Analítica Instrumental CONDUTIMETRIA A condutimetria é um método de análise que se fundamenta na medida da condutividade elétrica de uma solução eletrolítica. A condução da eletricidade
QMC5351 Química Analítica Instrumental CONDUTIMETRIA A condutimetria é um método de análise que se fundamenta na medida da condutividade elétrica de uma solução eletrolítica. A condução da eletricidade
Mecanismos renais de absorção e equilíbrio ácido-básico
 Mecanismos renais de absorção e equilíbrio ácido-básico A absorção no túbulo contornado proximal A característica base do túbulo contornado proximal é reabsorção ativa de sódio, com gasto energético, na
Mecanismos renais de absorção e equilíbrio ácido-básico A absorção no túbulo contornado proximal A característica base do túbulo contornado proximal é reabsorção ativa de sódio, com gasto energético, na
FISIOLOGIA COMPARATIVADA EXCREÇÃO AULA 1: EXCREÇÃO EM INVERTEBRADOS
 FISIOLOGIA COMPARATIVADA EXCREÇÃO AULA 1: EXCREÇÃO EM INVERTEBRADOS Tipos de órgão excretor Vacúolo contrátil(protozoários e Porífera) Nefrídios: Protonefrídio(Vermes chatos) Metanefrídio(Oligoqueta) Nefrídio(Moluscos)
FISIOLOGIA COMPARATIVADA EXCREÇÃO AULA 1: EXCREÇÃO EM INVERTEBRADOS Tipos de órgão excretor Vacúolo contrátil(protozoários e Porífera) Nefrídios: Protonefrídio(Vermes chatos) Metanefrídio(Oligoqueta) Nefrídio(Moluscos)
INTERATIVIDADE FINAL EDUCAÇÃO FÍSICA CONTEÚDO E HABILIDADES DINÂMICA LOCAL INTERATIVA AULA. Conteúdo: Sistema cardiovascular no exercício físico
 Conteúdo: Sistema cardiovascular no exercício físico Habilidades: Entender o sistema cardiovascular com a prática de atividades físicas. REVISÃO A Importância do sistema Muscular e a relação do mesmo com
Conteúdo: Sistema cardiovascular no exercício físico Habilidades: Entender o sistema cardiovascular com a prática de atividades físicas. REVISÃO A Importância do sistema Muscular e a relação do mesmo com
Introdução. Renata Loretti Ribeiro - Enfermeira
 Introdução A função do sistema respiratório é facilitar ao organismo uma troca de gases com o ar atmosférico, assegurando permanente concentração de oxigênio no sangue, necessária para as reações metabólicas,
Introdução A função do sistema respiratório é facilitar ao organismo uma troca de gases com o ar atmosférico, assegurando permanente concentração de oxigênio no sangue, necessária para as reações metabólicas,
Ligações Químicas Ligação Iônica Ligação Metálica
 Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Ligações Químicas Ligação Iônica Ligação Metálica Periodicidade O átomo é visto como uma esfera, onde só as
Química Geral e Inorgânica QGI0001 Eng a. de Produção e Sistemas Prof a. Dr a. Carla Dalmolin Ligações Químicas Ligação Iônica Ligação Metálica Periodicidade O átomo é visto como uma esfera, onde só as
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA
 SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
SÉRIE: 2º ano EM Exercícios de recuperação final DATA / / DISCIPLINA: QUÍMICA PROFESSOR: FLÁVIO QUESTÕES DE MÚLTIPLA ESCOLHA QUESTÃO 01 Em uma determinada transformação foi constatado que poderia ser representada
hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS
 hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS O NOSSO CORPO É CONSTITUÍDO NA MAIOR PARTE POR ÁGUA A ÁGUA É O PRINCIPAL CONSTITUINTE DO ORGANISMO, É ESSENCIAL PARA A VIDA E TEM
hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS O NOSSO CORPO É CONSTITUÍDO NA MAIOR PARTE POR ÁGUA A ÁGUA É O PRINCIPAL CONSTITUINTE DO ORGANISMO, É ESSENCIAL PARA A VIDA E TEM
VIVER BEM OS RINS DO SEU FABRÍCIO AGENOR DOENÇAS RENAIS
 VIVER BEM OS RINS DO SEU FABRÍCIO AGENOR DOENÇAS RENAIS Leia o código e assista a história de seu Fabrício Agenor. Este é o seu Fabrício Agenor. Ele sempre gostou de comidas pesadas e com muito tempero
VIVER BEM OS RINS DO SEU FABRÍCIO AGENOR DOENÇAS RENAIS Leia o código e assista a história de seu Fabrício Agenor. Este é o seu Fabrício Agenor. Ele sempre gostou de comidas pesadas e com muito tempero
Qualidade Ambiental Química
 Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
Teoria Ácido-Base e Reações Químicas
 Aula ao Vivo Teoria Ácido-Base e Reações Químicas Química Allan Rodrigues 27.04.2015 Existem várias teorias sobre ácidos e bases. Dentre elas, temos a teoria do químico sueco Svante August Arrhenius, que
Aula ao Vivo Teoria Ácido-Base e Reações Químicas Química Allan Rodrigues 27.04.2015 Existem várias teorias sobre ácidos e bases. Dentre elas, temos a teoria do químico sueco Svante August Arrhenius, que
Prova de Química Resolvida Segunda Etapa Vestibular UFMG 2011 Professor Rondinelle Gomes Pereira
 QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
QUESTÃO 01 Neste quadro, apresentam-se as concentrações aproximadas dos íons mais abundantes em uma amostra de água típica dos oceanos e em uma amostra de água do Mar Morto: 1. Assinalando com um X a quadrícula
Projeto Embuá Unidade de Aprendizagem: ENERGIA
 Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Projeto Embuá Unidade de Aprendizagem: ENERGIA Energia para realizar reações químicas: eletrólise do iodeto de potássio aquoso Existem reações químicas não espontâneas, mas que são realizadas com rapidez
Revisão: Química inorgânica Soluções aquosas
 QUÍMICA è Revisão: Química inorgânica Hidróxidos fortes família 1A e 2A (exceto Ca e Mg) Ácidos fortes nº de oxigênios nº de hidrogênios > 2, principalmente nítrico (HNO 3 ), clorídrico (HCl) e sulfúrico
QUÍMICA è Revisão: Química inorgânica Hidróxidos fortes família 1A e 2A (exceto Ca e Mg) Ácidos fortes nº de oxigênios nº de hidrogênios > 2, principalmente nítrico (HNO 3 ), clorídrico (HCl) e sulfúrico
DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA PERMEABILIDADE DAS MEMBRANAS CELULARES
 DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA FISIOLOGIA ANIMAL II AULA 4 PERMEABILIDADE DAS MEMBRANAS CELULARES CAETANA CARVALHO, PAULO SANTOS 2006 1 INTRODUÇÃO As
DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA FISIOLOGIA ANIMAL II AULA 4 PERMEABILIDADE DAS MEMBRANAS CELULARES CAETANA CARVALHO, PAULO SANTOS 2006 1 INTRODUÇÃO As
41 Por que não bebemos água do mar?
 A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
Degradação de Polímeros
 Degradação de Polímeros Degradação de Polímeros e Corrosão Prof. Hamilton Viana Prof. Renato Altobelli Antunes 1. Introdução Degradação é qualquer reação química destrutiva dos polímeros. Pode ser causada
Degradação de Polímeros Degradação de Polímeros e Corrosão Prof. Hamilton Viana Prof. Renato Altobelli Antunes 1. Introdução Degradação é qualquer reação química destrutiva dos polímeros. Pode ser causada
3.2 Equilíbrio de Fases Vapor - Líquida - Sólida numa Substância Pura Consideremos como sistema a água contida no conjunto êmbolo - cilindro abaixo:
 - Resumo do Capítulo 0 de Termodinâmica: Capítulo - PROPRIEDADES DE UMA SUBSTÂNCIA PURA Nós consideramos, no capítulo anterior, três propriedades familiares de uma substância: volume específico, pressão
- Resumo do Capítulo 0 de Termodinâmica: Capítulo - PROPRIEDADES DE UMA SUBSTÂNCIA PURA Nós consideramos, no capítulo anterior, três propriedades familiares de uma substância: volume específico, pressão
Sistema circulatório
 Sistema circulatório O que é: também conhecido como sistema cardiovascular é formado pelo coração e vasos sanguíneos. Tal sistema é responsável pelo transporte de nutrientes, gases, hormônios, excreções
Sistema circulatório O que é: também conhecido como sistema cardiovascular é formado pelo coração e vasos sanguíneos. Tal sistema é responsável pelo transporte de nutrientes, gases, hormônios, excreções
As Propriedades das Misturas (Aulas 18 a 21)
 As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
As Propriedades das Misturas (Aulas 18 a 21) I Introdução Em Química, solução é o nome dado a dispersões cujo tamanho das moléculas dispersas é menor que 1 nanometro (10 Angstrons). A solução ainda pode
Ácidos e bases. Aula 8 Ácidos e Bases / ph. Par ácido-base conjugado. Ácidos e bases
 Aula 8 Ácidos e Bases / ph Prof. Ricardo Aparicio - IQ/Unicamp - 1s/2009 QG107 (Biologia) - 1s/2009 Definição de Brønsted-Lowry (1923) definição mais abrangente que a de Arrhenius ácidos e bases = ácidos
Aula 8 Ácidos e Bases / ph Prof. Ricardo Aparicio - IQ/Unicamp - 1s/2009 QG107 (Biologia) - 1s/2009 Definição de Brønsted-Lowry (1923) definição mais abrangente que a de Arrhenius ácidos e bases = ácidos
REGULAÇÃO HIDROELETROLÍTICA FUNÇÃO RENAL
 REGULAÇÃO HIDROELETROLÍTICA FUNÇÃO RENAL Bioquímica Profa. Dra. Celene Fernandes Bernardes Referências Bioquímica Clínica M A T Garcia e S Kanaan Bioquímica Mèdica J W Baynes e M H Dominiczack Fundamentos
REGULAÇÃO HIDROELETROLÍTICA FUNÇÃO RENAL Bioquímica Profa. Dra. Celene Fernandes Bernardes Referências Bioquímica Clínica M A T Garcia e S Kanaan Bioquímica Mèdica J W Baynes e M H Dominiczack Fundamentos
Capítulo 3. Avaliação de Desempenho. 3.1 Definição de Desempenho
 20 Capítulo 3 Avaliação de Desempenho Este capítulo aborda como medir, informar e documentar aspectos relativos ao desempenho de um computador. Além disso, descreve os principais fatores que influenciam
20 Capítulo 3 Avaliação de Desempenho Este capítulo aborda como medir, informar e documentar aspectos relativos ao desempenho de um computador. Além disso, descreve os principais fatores que influenciam
UE Departamento de Química e Instituto de Ciências Agrárias Mediterrânicas Júlio Morais
 UE Departamento de Química e Instituto de Ciências Agrárias Mediterrânicas Júlio Morais O valor do ph FALAMOS DE QUÊ, QUANDO NOS REFERIMOS AO ph? Assim mesmo, com p minúsculo e H maiúsculo, ph designa
UE Departamento de Química e Instituto de Ciências Agrárias Mediterrânicas Júlio Morais O valor do ph FALAMOS DE QUÊ, QUANDO NOS REFERIMOS AO ph? Assim mesmo, com p minúsculo e H maiúsculo, ph designa
Kit para calibração de PCR pht
 Kit para calibração de PCR pht Itens fornecidos: Tampões ( concentrado) Composição ( concentrado) I0 500 mm KCl; 100 mm Tris-HCl ph 8,4; 1% Triton X-100 IB 500 mm KCl; 100 mm Tris-HCl ph 8,4; 1% Triton
Kit para calibração de PCR pht Itens fornecidos: Tampões ( concentrado) Composição ( concentrado) I0 500 mm KCl; 100 mm Tris-HCl ph 8,4; 1% Triton X-100 IB 500 mm KCl; 100 mm Tris-HCl ph 8,4; 1% Triton
SISTEMA EXCRETOR P R O F E S S O R A N A I A N E
 SISTEMA EXCRETOR P R O F E S S O R A N A I A N E O que não é assimilado pelo organismo O que o organismo não assimila, isto é, os materiais inúteis ou prejudiciais ao seu funcionamento, deve ser eliminado.
SISTEMA EXCRETOR P R O F E S S O R A N A I A N E O que não é assimilado pelo organismo O que o organismo não assimila, isto é, os materiais inúteis ou prejudiciais ao seu funcionamento, deve ser eliminado.
Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Disciplina: Físico-Química II Professora: Claudia
 Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Disciplina: Físico-Química II Professora: Claudia Aluno: Julys Pablo Atayde Fernandes Células a Combustível:
Universidade Federal da Paraíba Centro de Ciências Exatas e da Natureza Departamento de Química Disciplina: Físico-Química II Professora: Claudia Aluno: Julys Pablo Atayde Fernandes Células a Combustível:
Química em Solventes não Aquosos. Prof. Fernando R. Xavier
 Química em Solventes não Aquosos Prof. Fernando R. Xavier UDESC 2013 Reações químicas podem acontecer em cada uma das fases ordinárias da matéria (gasosa, líquida ou sólida). Exemplos: Grande parte das
Química em Solventes não Aquosos Prof. Fernando R. Xavier UDESC 2013 Reações químicas podem acontecer em cada uma das fases ordinárias da matéria (gasosa, líquida ou sólida). Exemplos: Grande parte das
Dimensionamento dos Estoques
 Administração Dimensionamento, Planejamento e Controle de Profª. Patricia Brecht Dimensionamento dos s Cada área possui interesse em aumentar os níveis de estoque para garantir a segurança e reduzir o
Administração Dimensionamento, Planejamento e Controle de Profª. Patricia Brecht Dimensionamento dos s Cada área possui interesse em aumentar os níveis de estoque para garantir a segurança e reduzir o
IBM1018 Física Básica II FFCLRP USP Prof. Antônio Roque Aula 6. O trabalho feito pela força para deslocar o corpo de a para b é dado por: = =
 Energia Potencial Elétrica Física I revisitada 1 Seja um corpo de massa m que se move em linha reta sob ação de uma força F que atua ao longo da linha. O trabalho feito pela força para deslocar o corpo
Energia Potencial Elétrica Física I revisitada 1 Seja um corpo de massa m que se move em linha reta sob ação de uma força F que atua ao longo da linha. O trabalho feito pela força para deslocar o corpo
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL
 RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
RESUMOS TEÓRICOS de QUÍMICA GERAL e EXPERIMENTAL 5 ESTUDO DA MATÉRIA 1 DEFINIÇÕES Matéria é tudo que ocupa lugar no espaço e tem massa. Nem tudo que existe no universo e matéria. Por exemplo, o calor e
PlanetaBio Resolução de Vestibulares UFRJ 2007 www.planetabio.com
 1-O gráfico a seguir mostra como variou o percentual de cepas produtoras de penicilinase da bactéria Neisseria gonorrhoeae obtidas de indivíduos com gonorréia no período de 1980 a 1990. A penicilinase
1-O gráfico a seguir mostra como variou o percentual de cepas produtoras de penicilinase da bactéria Neisseria gonorrhoeae obtidas de indivíduos com gonorréia no período de 1980 a 1990. A penicilinase
DS100: O SINAL ELÉTRICO
 DS100: O SINAL ELÉTRICO Emmanuel M. Pereira I. Objetivo O propósito deste artigo é esclarecer aos clientes da Sikuro, usuários do eletroestimulador modelo DS100 (C ou CB), no que se refere ao tipo de onda
DS100: O SINAL ELÉTRICO Emmanuel M. Pereira I. Objetivo O propósito deste artigo é esclarecer aos clientes da Sikuro, usuários do eletroestimulador modelo DS100 (C ou CB), no que se refere ao tipo de onda
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014
 RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
RESOLUÇÃO COMENTADA DA PROVA DA UNESP DE 2014 1-Alguns historiadores da Ciência atribuem ao filósofo pré-socrático Empédocles a Teoria dos Quatro Elementos. Segundo essa teoria, a constituição de tudo
