Alterações do Equilíbrio Ácido-Base.
|
|
|
- Thalita Canedo Caetano
- 8 Há anos
- Visualizações:
Transcrição
1 17 Alterações do Equilíbrio Ácido-Base.
2 308 - VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
3 A função normal das células do organismo depende de uma série de processos bioquímicos e enzimáticos do metabolismo celular. Diversos fatores devem ser mantidos dentro de estreitos limites, para preservar a função celular, como a temperatura, a osmolaridade, os eletrólitos e as quantidades de nutrientes, oxigênio, dióxido de carbono e íon hidrogênio. A circulação extracorpórea foi, durante alguns anos, sistematicamente acompanhada por distúrbios metabólicos, devidos, em grande parte, aos equipamentos pouco eficientes e ao conhecimento pobre da fisiopatologia da perfusão. Os baixos fluxos de perfusão à temperatura normal, com frequência, estavam relacionados às alterações do metabolismo celular. Logo foi reconhecido, que a acidose metabólica era causada pela vasoconstrição periférica e pobre perfusão tissular, determinadas pelos fluxos de perfusão utilizados; quanto mais baixo o fluxo da perfusão, maior era o déficit de bases no sangue e mais baixo o seu ph. As rotinas de trabalho, incluiam a administração empírica de bicarbonato de sódio, baseadas apenas, no tempo de duração da perfusão. O melhor conhecimento da hemodiluição, o adequado manuseio dos fluxos de perfusão, a inibição da vasoconstrição e o desenvolvimento de equipamentos mais sofisticados, permitiram o controle da circulação extracorpórea, com mínimos desvios da fisiologia e do equilíbrio dos ácidos e das bases no organismo. Um dos fatores mais importantes na preservação do metabolismo celular é a quantidade de hidrogênio livre, existente dentro e fora das células. Pequenas variações da concentração do hidrogênio, podem produzir grandes alterações na velocidade das reações químicas das células, acelerando algumas e retardando outras. Estas alterações são capazes de modificar profundamente o metabolismo celular, a ponto de inibir inteiramente certas funções; alterações extremas podem determinar a morte celular. A concentração do hidrogênio livre no organismo depende da ação de substâncias que disputam o hidrogênio entre sí. As que cedem hidrogênio e as que captam o hidrogênio. As substâncias que tendem a ceder hidrogênio em uma solução, são chamadas de ácidos, enquanto as substâncias que tendem a captar o hidrogênio nas soluções, são as bases. A concentração final do hidrogênio resulta do equilíbrio entre aqueles dois grupos de substâncias, ácidos e bases. O metabolismo celular produz ácidos, que são liberados continuamente na corrente sanguínea. O organismo neutraliza esses ácidos para prevenir mudanças agudas na concentração de hidrogênio e preservar a função celular. Quando ácidos ou bases são administrados aos pacientes, estas substâncias modificam o estado do equilíbrio entre ácidos e bases do organismo, com consequente alteração da quantidade de hidrogênio livre. Durante a circulação extracorpórea, podem ocorrer alterações importantes ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 309
4 desse delicado equilíbrio entre ácidos e bases, capazes de produzir transtornos importantes da função celular e determinar complicações, algumas vezes, severas. Muitos dos desvios do equilíbrio ácido-base durante a perfusão, podem ser prevenidos ou corrigidos através de medidas simples, desde que sejam conhecidos os princípios fisiológicos que o governam. FISIOLOGIA DO EQUILÍBRIO ÁCIDO-BASE A forma como o organismo regula a concentração dos íons hidrogênio (H + ), é de fundamental importância, para a avaliação das alterações do equilíbrio entre os ácidos e as bases no interior das células (líquido intracelular), no meio líquido que as cerca (líquido intersticial) e no sangue (líquido intravascular). CONCEITO DE ÁCIDO E BASE Os elementos importantes para a função celular, sob o ponto de vista químico, estão em solução. Uma solução é um líquido formado pela mistura de duas ou mais substâncias, inteiramente dispersas entre sí, de um modo homogêneo. Uma solução consiste de um solvente, o componente principal, e um ou mais solutos. O organismo humano contém 60 a 80% de água, conforme a idade do indivíduo e, nas soluções biológicas, a água constitui o solvente universal. As demais substâncias em solução, constituem os solutos. Em uma solução biológica um soluto pode estar em estado ionizado, ou seja, os elementos ou radicais químicos que a compõem, estão dissociados uns dos outros; a porção da substância que existe no estado dissociado ou ionizado é chamada íon. Uma outra parte do soluto existe no estado não ionizado; ambas coexistem, em um tipo especial de equilíbrio químico. Existem substâncias, como os ácidos fortes, as bases fortes e os sais, que permanecem em solução, quase completamente no estado ionizado, enquanto outras substâncias, como os ácidos e bases fracas permanecem em solução, em gráus diversos de ionização. A água tem sempre um pequeno número de moléculas, no estado ionizado. Um ácido é uma substância capaz de doar prótons (H + ). Uma base é uma substância capaz de receber prótons. Em outras palavras, os ácidos são substâncias que, quando em solução, tem capacidade de ceder íons hidrogênio; as bases são substâncias que, quando em solução, tem capacidade de captar íons hidrogênio. Um ácido forte pode doar muitos íons hidrogênio para a solução e uma base forte pode captar muitos íons hidrogênio da solução. Soluções ácidas VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
5 e básicas nas mesmas concentrações, neutralizam-se volume a volume, qualquer que sejam o ácido ou a base. DETERMINAÇÃO DA ATIVIDADE DO ÍON HIDROGÊNIO A presença e a atividade dos íons hidrogênio em uma solução e nos sistemas biológicos, deve ser avaliada pela determinação da quantidade de hidrogênio livre. Para a avaliação do hidrogênio livre nas soluções de ácidos ou de bases, usa-se a unidade ph. O termo ph significa potência de hidrogênio; foi criado para simplificar a quantificação da concentração de H + na água e nas soluções. A substância padrão, utilizada como referência é a água. A água se dissocia, em pequena quantidade, em íons hidrogênio (H + ) e hidroxila (OH - ). A constante de ionização da água é muito pequena, bem como são pequenas as quantidades de H + e OH -, em solução. A quantidade de hidrogênio livre na água é 0, Para facilitar a comparação destas pequenas quantidades de íons, Sorensen adotou a fração exponencial, ao invés da fração decimal. Assim, Sorensen referiu-se à concentração de 10-7, como a potência sete do hidrogênio, para definir a sua quantidade na água. Hasselbalch criou o termo ph, para expressar o logarítimo negativo da atividade do íon hidrogênio. O ph de uma solução, portanto, é o inverso da sua concentração de íons hidrogênio. A convenção de Hasselbalch permite que os valores da atividade do hidrogênio nas soluções, sejam expressos em números positivos. A escala do ph, varia de 0 a 14, representando a acidez ou a alcalinidade de uma solução, em comparação com a água. Pelas quantidade relativas de íons hidrogênio (H + ) e hidroxila (OH - ), a água tem uma concentração total de íons de 10-14, que corresponde a partes iguais, ou seja 10-7, de cada um dos íons. Dessa forma, a água tem o ph=7 e, pelas suas características, é considerada uma substância neutra, ou seja nem ácida nem base e, serve de padrão de comparação para todas as soluções. As soluções cujo ph está entre 0 e 7 são ditas ácidas; as que tem o ph entre 7 e 14 são ditas básicas ou alcalinas. Se acrescentarmos base forte a um ácido fraco, o ácido será neutralizado à medida que a base é gotejada na solução, formando-se sal. Se representarmos a escala logarítima de ph, em relação às quantidades adicionadas de base, traçaremos uma curva de titulação do ácido, que forma um S suave. O ph varia rapidamente, até um certo ponto e, desse ponto em diante, há necessidade da adição de maior quantidade de bases para que o ph volte a subir. REGULAÇÃO DO PH NO ORGANISMO Quando se adiciona ácido à água, mesmo em pequenas quantidades, o ph se altera ràpidamente. O mesmo ocorre com a adição de bases. Pequenas quan- ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 311
6 tidades de ácido ou de base podem produzir grandes alterações do ph da água. Se adicionarmos ácido ou base ao plasma sanguíneo, veremos que há necessidade de uma quantidade apreciável de um ou de outro, até que se produzam alterações do ph. O balanço entre ácidos e bases no organismo é uma busca constante do equilíbrio; o plasma resiste às variações bruscas do ph. O plasma, portanto, dispõe de mecanismos de defesa contra as alterações do ph. Os mecanismos de defesa do organismo contra as variações bruscas do ph, são químicos e fisiológicos, e agem em íntima relação. Os mecanismos químicos são representados por conjuntos de substâncias capazes de reagir tanto com ácidos quanto com bases, neutralizando-as, e dificultando as oscilações do ph. Os mecanismos fisiológicos são representados pelos pulmões e pelos rins, que eliminam substâncias indesejáveis ou em excesso, ácidos ou bases, e poupam outras, de acordo com as necessidades do momento. O mecanismo de defesa de natureza respiratória é o mais imediato, para corrigir alterações agudas, como as que ocorrem durante a circulação extracorpórea. O principal produto do metabolismo é o dióxido de carbono (CO2), que é a fonte de ácido carbônico (H2CO3), por reação química com a água (H2O). Os pulmões eliminam o dióxido de carbono, reduzindo o teor de ácidos no sangue e demais compartimentos líquidos do organismo. Os mecanismos renais são mais lentos e tardios; seus efeitos não são apreciáveis naquelas alterações. A principal função dos rins no balanço ácido-base é promover a poupança ou a eliminação de bicarbonato, conforme as necessidades do organismo. SISTEMAS TAMPÃO Um par de substâncias, capaz de reagir tanto com um ácido quanto com uma base, é chamado sistema tampão. Um sistema tampão é constituido por um ácido fraco e o seu sal de uma base forte, em relação constante, para combinar com ácidos e bases em excesso e evitar variações do ph. Os tampões são substâncias que dificultam as alterações do ph pela adição de ácidos ou bases. São fundamentais ao organismo, porque o metabolismo gera muito ácido. A regulação do equilíbrio ácido-base no organismo, depende da atuação dos sistemas tampão existentes no sangue (líquido intravascular), nos tecidos (líquido intersticial) e no interior das células (líquido intracelular). Os sistemas tampão são também conhecidos, pela sua denominação inglesa: sistemas buffer. A tabela 17.1 lista os principais sistemas tampão do organismo e as suas quantidades relativas. Quando um ácido se acumula em maior quantidade no organismo, é neutralizado no sangue, no líquido intersticial e no interior das células, em partes aproximadamente iguais, ou seja, VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
7 1/3 do ácido é neutralizado no sangue, 1/3 é neutralizado no líquido intersticial e 1/3 no líquido intracelular. Este último é o que mais demora a ser solicitado e ativado. Tabela Principais sistemas tampão do organismo. O sistema do bicarbonato é o mais abundante e extremamente importante na neutralização dos ácidos formados pelo metabolismo celular. Composição do sistema Percentual do total Bicarbonato/Ácico carbônico 64% Hemoglobina/Oxihemoglobina 28% Proteinas ácidas/proteinas básicas 7% Fosfato monoácido/fosfato diácido 1% O sistema bicarbonato/ácido carbônico é o de maior importância na regulação do ph, durante a circulação extracorpórea. A base forte deste sistema é o bicarbonato e o ácido fraco é o ácido carbônico. Quando um ácido se acumula no sangue, o bicarbonato do sistema tampão se combina com o mesmo, alterando o equilíbrio próprio do sistema tampão. O ácido carbônico em excesso, se dissocia em CO2 e H2O e o dióxido de carbono é eliminado pelos pulmões ou pelo oxigenador. Os sistemas tampão agem em sincronismo, e todos participam da regulação do ph. O sistema tampão se altera, para restabelecer o ph; a seguir procura refazer o seu próprio equilíbrio químico. O ph do plasma sanguíneo traduz as reações de um infindável número de substâncias dissolvidas, inclusive os sistemas tampão; seu valor normal corresponde à uma estreita faixa que varia entre 7,35 e 7,45. REGULAÇÃO RESPIRATÓRIA DO PH O metabolismo normal produz ácidos, que são neutralizados, eliminados do organismo ou são incorporados à outras substâncias. Em condições normais de metabolismo, são produzidos por dia, por um indivíduo, cerca de miliequivalentes de H +, ou miliequivalentes de CO2. Menos de 1% desse ácido é excretado pelos rins. O dióxido de carbono é transportado no sangue, sob a forma de um ácido volátil (H2CO3 H + + HCO3 H2O + CO2), o ácido carbônico, e eliminado pelos pulmões. Em solução aquosa, como no plasma, o CO2 é hidratado, formando o H2CO3 (ácido carbônico), que se dissocia em H + e HCO3 -. O sangue venoso transporta, dessa forma, o dióxido de carbono produzido nos tecidos até os pulmões, onde se difunde pela membrana alveolo-capilar, para o ar dos alvéolos; durante a perfusão o sangue venoso transporta o CO2 ao oxigenador, onde se difunde para o ar ambiente. O oxigenador desempenha o mesmo papel dos pulmões, na regulação do equilíbrio ácido-base durante a perfusão. As oscilações e a transferência do CO2, dependem apenas da ventilação; a água é reaproveitada pelos tecidos ou eliminada pelos rins. Quando o CO2 não é eliminado adequadamente, acumula-se no sangue e reage com a água, aumentando o teor de ácido carbônico. O ácido é par- ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 313
8 cialmente neutralizado pelo bicarbonato do sistema tampão, mas deixa livre um excesso de H +, que tende a reduzir o ph. Ao contrário, quando o CO2 é eliminado em excesso, no oxigenador, o bicarbonato (NaHCO3) se dissocia. O sódio (Na + ) livre, forma sais diferentes do bicarbonato e o íon HCO3 - reage com a água (H2O), formando ácido carbônico e íons hidroxila (OH - ). Os íons hidroxila combinam-se aos íons hidrogênio (H + ) para formar água. A produção de H2CO3 reduz o teor de H+ no sangue, com consequente elevação do ph. A regulação respiratória do equilíbrio ácido-base é feita exclusivamente através da regulação do CO2. Alterações da ventilação no oxigenador, podem produzir quebra daquele balanço e interferir com o metabolismo celular. REGULAÇÃO RENAL DO PH Os mecanismos de defesa contra as alterações do ph sanguíneo, incluem um mecanismo de ação rápida, o respiratório e o mecanismo renal, de ação mais lenta e eficaz apenas para compensar alterações crônicas ou de longa duração. A compensação renal do ph, é eficaz após 24 a 48 horas e não ocorre significativamente, durante a circulação extracorpórea. Via de regra, os pulmões eliminam as substâncias voláteis (gases) e os rins eliminam as substâncias que os pulmões não tem capacidade de eliminar. A compensação renal, entretanto, é mais completa, porque retorna o poder de tamponamento do sangue a níveis normais, refazendo o seu principal sistema tampão. Os rins excretam, diariamente, 50 miliequivalentes de íons hidrogênio e reabsorvem miliequivalentes de íon bicarbonato. Além de influir na restauração do equilíbrio ácido-base, a compensação renal é a mais importante, na manutenção da constância do meio ambiente das células, o líquido extracelular. Os rins reagem aos distúrbios da osmolaridade, desidratação e hipotensão, eliminando ácidos não voláteis e não carbônicos. PARÂMETROS DO EQUILÍBRIO ÁCIDO-BASE Os valores que analisam os parâmetros do equilíbrio ácido-base do sangue, expressam a integração entre as diversas substâncias, os sistemas tampão e os mecanismos de regulação respiratória e renal. Os parâmetros importantes para a análise do estado do equilíbrio ácidobase são o ph, a tensão parcial de dióxido de carbono no sangue (pco2) e o teor de bicarbonato (HCO3). O ph define se há acidose ou alcalose, conforme seu valor esteja abaixo ou acima da faixa de normalidade do VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
9 sangue. Se o ph estiver abaixo de 7,35, dizemos que existe acidose. Se, ao contrário, o ph estiver acima de 7,45, dizemos que há alcalose. A tensão parcial de CO2 no sangue (pco2) define a existência e o gráu de distúrbio respiratório, relativo à eliminação do dióxido de carbono. A faixa normal para a pco2 é de 35 a 45mmHg. O bicarbonato standard ou bicarbonato padrão é o teor de bicarbonato equilibrado com uma mistura gasosa com tensão parcial de dióxido de 40mmHg (pco2=40mmhg). O bicarbonato real, é a quantidade de bicarbonato existente na amostra de sangue analisada. Pode coincidir com o bicarbonato padrão, quando será normal, ou pode refletir os distúrbios existentes. A base tampão ou base total, corresponde à soma do teor de bases do plasma ou seja, a soma das concentrações de todas as bases contidas no sangue, compreendendo todos os sistemas tampão. A diferença de bases, (BE ou BD) denominação para excesso de bases (BE) ou para o seu déficit (BD), reflete o excesso ou a diminuição das bases tampão, em relação ao seu valor normal. O valor normal para a diferença de bases varia entre 0 e 3. O bicarbonato real, o excesso ou déficit de bases, não são medidos diretamente na amostra do sangue; o bicarbonato é derivado à partir das dosagens do ph e do pco2 e o excesso de bases é determinado à partir dos valores do ph, do pco2 e da hemoglobina, para dimensionar os tampões existentes nos glóbulos vermelhos. O resultado daqueles valores é expresso em miliequivalentes por litro (meq/l) de bases, acima ou abaixo, dos valores normais de bases. O valor da tensão parcial de oxigênio (po2) medido na mesma amostra de sangue, informa o estado da oxigenação do sangue (amostra arterial) ou da utilização do oxigênio pelos tecidos (amostra venosa); não tem significado na apreciação dos distúrbios do equilíbrio ácido-base. CLASSIFICAÇÃO DOS DISTÚRBIOS DO EQ. ÁCIDO BASE As alterações do equilíbrio ácido-base correspondem, em essência, às variações da concentração de íon hidrogênio no sangue. O aumento da quantidade de íons hidrogênio, reduz o ph e, portanto, produz acidose. A redução da quantidade de íons hidrogênio, aumenta o PH e, ao contrário, produz alcalose. As alterações pronunciadas do ph, não são bem toleradas pelo organismo. A faixa de tolerância do organismo humano se situa entre 6,8 e 7,8; valores fora daquela faixa, abaixo de 6,8 ou acima de 7,8, são extremamente dificeis de reverter. Um ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 315
10 valor de ph inferior a 6,8, com grande frequência, indica acidose irreversível. Conforme a origem, os distúrbios do equilíbrio ácido-base, acidose ou alcalose, podem ser de natureza metabólica ou respiratória. Em condições normais existe um delicado balanço entre os componentes metabólico e respiratório, que determina a estabilidade do ph, dentro da faixa normal, representado pela seguinte equação: Componente Metabólico ph= Componente Respiratório Quando o organismo acumula ácidos oriundos do metabolismo, o ph do sangue se reduz; dizemos que a acidose é de origem metabólica. Quando o organismo acumula CO2, não eliminado adequadamente pela ventilação, o ph se reduz; dizemos que a acidose é de origem respiratória. Se o organismo acumula bases em excesso, por exemplo o bicarbonato, o ph se eleva; dizemos que a alcalose é de origem metabólica. Se o organismo elimina CO2 em excesso por hiperventilação, o ph se eleva; dizemos que há alcalose respiratória. Acidose ou alcalose respiratórias, compreendem alterações primárias da ventilação, como causa do distúrbio. Acidose ou alcalose metabólicas, compreendem alterações primárias do metabolismo, como causa do distúrbio. Os valores normais dos parâmetros que analisam o equilíbrio ácido-base do organismo são: ph= 7,35 a 7,45 pco2= 35 a 45mmHg HCO3= 24 BE= -3 a +3 A tabela 17.2 lista os principais distúrbios do equilíbrio ácido base e as alterações encontradas na análise do sangue. Tabela 17.2 Representa os resultados da análise de amostras de sangue (gasometria), para o diagnóstico das alterações do equilíbrio entre os ácidos e as bases. As setas significam elevação ou redução do valor dos diferentes parâmetros indicados nas colunas; N representa o valor normal. Distúrbio ph pco2 BE HCO3 Acidose respiratória N Alcalose respiratória N Acidose metabólica N Alcalose metabólica N Algumas vêzes, os mecanismos de compensação podem dificultar a interpretação dos resultados das amostras, para o diagnóstico da causa primária. Na circulação extracorpórea, entretanto, as alterações ocorrem muito rapidamente e, quase sempre, nas suas formas puras, não compensadas. Embora, os mecanismos da circulação extracorpórea possam produzir qualquer tipo de distúrbio do equilíbrio ácido-base, as alterações mais encontradas são a acidose metabólica e a alcalose respiratória. Esta última ocorre, principalmente, quando se usam os oxigenadores de bolhas, ótimos eliminadores de CO VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
11 ACIDOSE RESPIRATÓRIA Na acidose respiratória o quadro laboratorial encontrado é: ph inferior a 7,35, que caracteriza a acidose e o pco2 acima de 45mmHg, que caracteriza a retenção de CO2 no sangue, como a causa primária do distúrbio. Como as bases do sangue são mobilizadas para tamponar o ácido carbônico em excesso, produto da reação do CO2 com a água, existe um déficit das bases livres e o BE se torna mais negativo, inferior a -3mEq/l. O total de bicarbonato pode estar pouco acima do normal (24 meq/l), se houver tempo para atuação dos mecanismos de compensação. A retenção de dióxido de carbono e consequente acidose respiratória pode ocorrer durante a perfusão, quando há hipoventilação do oxigenador. O fluxo de oxigênio no oxigenador é insuficiente para eliminar todo o CO2 produzido pelo organismo. O dióxido de carbono acumula nas câmaras do oxigenador e equilibra a sua tensão com o sangue. A pco2 do sangue aumenta progressivamente, forma-se um excesso de ácido carbônico, cuja fração dissociada, libera H+. Nos oxigenadores de membranas a retenção de CO2 pode ocorrer pela administração de gás rico em oxigênio (FiO2 elevada) porém com fluxo baixo. Nesses casos a po2 é normal e a pco2 é elevada. A retenção de CO2, com produção de acidose respiratória, durante a perfusão, pode ocorrer ainda por alterações do mecanismo dispersor de oxigênio na câmara de oxigenação dos oxigenadores de bolhas, geralmente por defeitos de fabricação ou controle. O mais comum é que ocorra escape de oxigênio dentro da câmara de oxigenação, sem que o gás atravesse o dispersor, sendo inútil para a adequada oxigenação e efetiva remoção de CO2. Esse problema deve ser suspeitado quando o aumento do fluxo na linha de gás do oxigenador de bolhas, não corrige a acidose respiratória. A acidose respiratória pode deprimir o miocárdio e favorecer o aparecimento de arritmias; essa combinação de fatores pode dificultar a saída de perfusão. As necessidades de agentes anestésicos e relaxantes musculares aumentam, para manter o mesmo plano anestésico. Pode, ainda, ocorrer sudorese intensa, mesmo no paciente anestesiado e edema cerebral. A acidose respiratória durante a perfusão deve ser tratada pelo aumento da oferta de oxigênio ao oxigenador de bolhas ou pelo aumento da oferta de gás ao oxigenador de membranas, sob controle rigoroso da gasometria arterial. O valor do bicarbonato total é normal ou elevado e a administração de bicarbonato de sódio é desnecessária e ineficaz. ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 317
12 ALCALOSE RESPIRATÓRIA A alcalose respiratória é o distúrbio mais frequente no transcurso da circulação extracorpórea, principalmente quando se utilizam os oxigenadores de bolhas. O fluxo de oxigênio habitualmente instilado no oxigenador é suficiente para oxigenar adequadamente o sangue venoso, porém, excessivo para a eliminação do CO2, removendo-o em excesso, na câmara de oxigenação do aparelho, o que reduz substancialmente a pco2. O CO2 é eliminado para o exterior do aparelho, carreado pelo fluxo de oxigênio que atravessa o oxigenador. O ácido carbônico do sangue diminui e provoca a redução concomitante do bicarbonato. O quadro laboratorial é representado pelo ph superior a 7,45 e a pco2 abaixo de 35 mmhg. O BE se mantém inalterado ou pode elevar-se fracamente; o bicarbonato plasmático se reduz a menos de 24 meq/l. A compensação das alterações do equilíbrio ácido-base é demorada e, ao contrário do que se acreditava, o organismo não compensa a alcalose respiratória pela produção de acidose metabólica. Isto apenas ocorre quando a alcalose dura mais de 12 a 18 horas. Pacientes operados sob regime de alcalose respiratória, não desenvolveram acidose metabólica, como mecanismo de compensação do distúrbio primário. A alcalose respiratória é extremamente comum, na perfusão com oxigenadores de bolhas, principalmente quando os fluxômetros de gás usados não são precisos e apenas permitem ajustes de fluxo de 1 em 1 litro; nessas circunstâncias a hiperventilação é a regra. O ajuste correto dos fluxos de oxigênio nos oxigenadores de bolhas, para moderar a eliminação de CO2, apenas pode ser feito quando se utilizam fluxômetros adequados, calibrados em frações de litros, especialmente na perfusão infantil, em que os fluxos de gás são, ainda, menores. A alcalose severa, com a pco2 abaixo de 25mmHg, especialmente quando prolongada, pode produzir vasoconstrição, que se manifesta com maior intensidade nos vasos cerebrais. Podem resultar, quadros psiquiátricos ou neurológicos de gravidade variável, incluindo convulsões, que serão manifestos no pós-operatório imediato. Na alcalose respiratória, há desvio para a esquerda, da curva de dissociação da oxihemoglobina, que corresponde à uma maior afinidade da hemoglobina pelo oxigênio, tornando mais difícil a sua liberação nos tecidos. Nestas condições, embora o sangue arterial esteja completamente saturado e a po2 esteja elevada, a liberação de oxigênio nos tecidos pode não ser suficiente para o metabolismo aeróbico, o que causa acidose metabólica, que vai se manifestar, nessas circunstâncias pela redução das bases disponíveis (redução do BE). A alcalose respiratória, durante a perfusão, é corrigida pela redução do fluxo de oxigênio oferecido aos oxige VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
13 nadores de bolhas ou pela redução do fluxo de gás oferecido aos oxigenadores de membranas. Um pequeno gráu de alcalose respiratória (pco2 acima de 28 a 30 mmhg.) é bem tolerado pelo organismo e tem alguns efeitos favoráveis, gerais e cardiovasculares. Há menor necessidade de agentes anestésicos e relaxantes musculares e a função global do coração, é melhor. O rítmo sinusal é melhor sustentado e a contratilidade miocárdica é estimulada. ACIDOSE METABÓLICA A acidose metabólica se inicia, sem interferência respiratória, por aumento da concentração de H +, de origem endógena ou exógena. É um distúrbio bastante frequente, durante a circulação extracorpórea e pode ser produzido por diversas causas. A causa mais comum da acidose metabólica é uma deficiente oxigenação dos tecidos. Os tecidos hipóxicos, se socorrem do metabolismo anaeróbico, cujo produto final é, principalmente, o ácido lático. O ácido lático é um ácido fraco, não volátil, e que, portanto, não pode ser eliminado pelo pulmão ou pelo oxigenador. A dissociação do ácido lático libera íons hidrogênio, que vão contribuir para reduzir o ph do sangue. O outro produto da dissociação do ácido lático é o íon lactato. O ácido lático é metabolizado no fígado. Entretanto, na acidose lática, a sua produção supera a capacidade de metabolização daquele órgão, permitindo o acúmulo no sangue. O lactato desloca o sódio do bicarbonato; além disso, como mecanismo de compensação, o pulmão aumenta a eliminação de CO2, para manter o teor de ácidos do sangue. Este último mecanismo inexiste, durante a perfusão. A redução da oxigenação dos tecidos, que induz ao metabolismo anaeróbico, com produção excessiva de ácido lático e acidose metabólica, também pode ocorrer na circulação extracorpórea, quando o fluxo arterial está reduzido em relação às necessidades do paciente, quando há vasoconstrição de determinados leitos vasculares, quando o sangue arterial não está adequadamente oxigenado ou quando a oxihemoglobina não libera suficiente oxigênio aos tecidos, por desvios da sua curva de dissociação. O fluxo arterial pode estar reduzido por diversas razões, como a estimativa inadequada para as necessidades do paciente, o rolete arterial mal calibrado ou a redução intencional, para facilitar manobras cirúrgicas. A vasoconstrição é extremamente comum durante a perfusão e decorre da liberação de catecolaminas e outros produtos vasopressores, estimulados pelo stress da circulação extracorpórea, e pela interação do sangue com as superfícies não endoteliais do circuito extracorpóreo. O sangue arterial pode não estar adequadamente oxigenado, por insuficiente fluxo de oxigênio no oxigenador ou por defeitos do sistema de oxige- ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 319
14 nação do aparelho, nos oxigenadores de bolhas. Um aumento da afinidade da hemoglobina pelo oxigênio (desvio para a esquerda da curva de dissociação da oxihemoglobina), que dificulta a liberação do oxigênio nos tecidos, pode ser produzido pela excessiva eliminação do CO2 no oxigenador e pela redução da temperatura do sangue. O sangue estocado, bem como seus derivados, tem o ph baixo e acidose metabólica, em consequência da preservação em soluções ácidas, como o ACD, CPD e EDTA e, quando usados no perfusato, devem ser neutralizados adequadamente, para evitar o consumo de bases do sangue do paciente. As soluções cristaloides comumente usadas no perfusato, são igualmente ácidas, como as soluções de Ringer ou Ringer lactato, cujo ph varia entre 5,2 e 6,4. O perfusato com estas soluções, também deve ser tamponado, antes do início da perfusão. Em pacientes diabéticos, submetidos a jejum prolongado para a cirurgia, pode ocorrer acidose metabólica, por liberação de ácidos cetônicos, produto final do metabolismo da glicose, na ausência da insulina. Na acidose metabólica o ph está abaixo de 7,35, o pco2 está normal e o BE está negativo, com um déficit de bases que varia de acordo com a severidade da acidose. Geralmente o BE oscila, entre -5 e -10. O bicarbonato total também está abaixo de seu valor normal. A acidose metabólica deprime a contratilidade miocárdica; pode produzir depressão do tonus vascular, arritmias ventriculares e tende a aumentar o sangramento operatório. A acidose metabólica produz, ainda, aumento do potássio extracelular, que altera as suas relações com outros íons. A acidose metabólica reduz ou abole a resposta aos medicamentos inotrópicos e vasopressores. A acidose metabólica durante a perfusão é corrigida pela eliminação das possíveis causas de hipóxia tissular e, se necessário, pela administração adicional de bases, como o bicarbonato de sódio, de acordo com o gráu de acidose, expresso pelo valor do déficit de bases (BE ou BD). O cálculo da quantidade total de bicarbonato a ser administrada, é feito através de fórmulas, das quais a mais comum é: Peso x BE x 0,3= Bic. sódio (ml da solução a 8,4%). A solução de bicarbonato de sódio a 8,4% contém 1 meq do sal por cada mililitro. A fórmula usada para o cálculo da dose de bicarbonato, fornece a quatidade de miliequivalentes de base bicarbonato, que precisa ser administrada, para tamponar a acidose correspondente ao déficit de bases determinado. Como as fórmulas são apenas aproximações de cálculo e outras medidas, visando corrigir a oxigenação tissular são tomadas, usa-se administrar a metade da dose calculada e repetir a gasometria após 10 ou 15 minutos. Não é raro que a causa da acidose seja a hipóxia das massas musculares, causada pela vasoconstrição que acompanha a perfusão. Nestes casos a simples VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
15 administração de vasodilatadores pode corrigir a acidose. A experiência tem demonstrado que, quando se usam vasodilatadores desde o início da perfusão, é mais raro o desenvolvimento de acidose metabólica. ALCALOSE METABÓLICA A alcalose metabólica não é um desvio comum durante a circulação extracorpórea. Pode ocorrer, contudo, quando se administram bases em excesso, aos pacientes, como o bicarbonato de sódio. Quando se administram diuréticos, há grande eliminação de líquidos e de eletrólitos, principalmente o potássio. A eliminação do potássio acarreta eliminação concomitante de íon H+ pela urina e retenção alternativa do íon bicarbonato, que produz a alcalose metabólica. Este mecanismo, entretanto, é lento e observado apenas em pacientes em uso prolongado dos diuréticos. Na alcalose metabólica o ph está acima de 7,45, o pco2 está normal e há excesso de bases, com BE positivo, superior a +3. O bicarbonato também está elevado, acima de 24 meq./l. De um modo geral a alcalose metabólica é branda, bem tolerada, e não necessita de qualquer tratamento específico. GASOMETRIA VENOSA Os valores normais do ph e dos gases do sangue referidos no exame dos principais distúrbios do equilíbrio ácido-base, referem-se ao sangue arterial, já oxigenado e modificado nos pulmões ou nos oxigenadores. O sangue venoso, que conduz os restos metabólicos celulares, coletados no sistema capilar, tem valores diferentes, e não menos importantes. A análise do sangue venoso normal, deve mostrar os seguintes resultados: ph= 7,27 a 7,39 pco2= 40 a 50mmHg po2= 35 a 40mmHg HCO3= 22 a 26mEq/l BE= 2,5 SO2= 70 a 75 (Saturação de oxigênio) A monitorização dos parâmetros do equilíbrio ácido base, ph, pco2 e BE é fundamental, durante a perfusão. Medidas simples, como a escolha de fluxômetro de gás adequado, cálculo dos fluxos de perfusão e cuidadosa monitorização dos aparelhos em uso, contribuem para minimizar os efeitos da circulação extracorpórea sobre os mecanismos reguladores do equilíbrio ácido-base do organismo. A análise dos gases e do ph do sangue, indica a presença, a natureza e a severidade das alterações do balanço ácido-base e possibilita a correção das suas alterações. A maioria daqueles distúrbios pode ser prevenida ou, pelo menos, minimizada, pela criteriosa condução da perfusão. O gráu de dissociação da água, e de ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 321
16 diversas outras substâncias do plasma sanguíneo, se altera com a redução da temperatura do organismo; em consequência, todos os mecanismos da regulação ácido-base, igualmente se alteram. Não se conhecem valores normais, para o equilíbrio ácido-base durante a hipotermia. A principal razão reside no fato de que a hipotermia é um estado, absolutamente anormal, do ser homeotérmico. Enquanto a maioria dos mecanismos da circulação extracorpórea procura aproximá-la, ao máximo, do comportamento fisiológico do ser humano, a hipotermia induz alterações significativas, não observadas em outras circunstâncias, a não ser acidentalmente. EQUILÍBRIO ÁCIDO-BASE NA HIPOTERMIA A interpretação e o significado dos parâmetros do equilíbrio ácido-base, durante a hipotermia, ainda são objeto de estudo e discussões. Estamos habituados a considerar normais, o ph de 7,40 e a pco2 de 40mmHg. Entretanto, isto é correto apenas à temperatura de 37 o C. Se colhermos uma quantidade de sangue arterial normal, à 37 o C e resfriamos uma amostra, o CO2 se tornará mais solúvel. Em consequência, a pco2 será mais baixa, para manter constante o conteudo total de CO2. O ph será mais elevado, na proporção de 0,0157 para cada gráu de redução de temperatura. A variação do ponto de neutralidade da água com a temperatura é bastante semelhante; o ph da água se eleva de 0,017 para cada gráu de redução da temperatura. Sistemas tampão proteicos, mantém constante as variações do ponto de neutralidade do plasma em relação ao da água, durante a exposição do organismo às baixas temperaturas. Uma neutralidade relativa constante, do plasma em relação à neutralidade da água, é mantida para impedir variações do equilíbrio entre os ácidos e as bases dentro do sistema, embora os valores do ph e da pco2 se alterem com o resfriamento do sangue. A relação entre a quantidade de íons H + e a quantidade de íons OH -, é mantida. O comportamento dos animais poicilotérmicos, cuja temperatura acompanha a temperatura do meio ambiente, o ph do sangue também acompanha o ponto de neutralidade da água mas o ph do líquido extracelular se comporta de outro modo. A maneira de interpretar as alterações do ph e da pco2 do sangue depende do modelo utilizado para comparar as variações do ponto de neutralidade. Se considerarmos que o conteudo total de CO2 deve permanecer constante e o ph deve variar com a temperatura, estamos aplicando o conceito alfa-stat, ou de CO2 constante para interpretar o equilíbrio ácido-base. Se, considerarmos que o ph deve ser mantido constante em qualquer temperatura, o conteudo total de CO2 deve necessariamente ser variado. Nesses casos, o CO2 deve ser administrado ao paciente, durante a hipotermia e estamos usando o conceito ph stat ou ph constante, VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
17 para interpretar o equilíbrio ácido-base. A experiência sugere e a maioria das escolas admite que o conceito alfa-stat, do ph variável, é mais próximo dos mecanismos fisiológicos e indica a monitorização do balanço entre os ácidos e as bases, dentro daquele conceito. isto significa que para cada gráu centígrado de redução da temperatura o ph se eleva de 0,0147 e a pco2 se reduz em 4%, embora o conteudo total de CO2 permaneça constante. A manutenção de adequada irrigação cerebral e dos demais órgãos é essencial, durante a circulação extracorpórea. O gráu de auto-regulação do fluxo sanguíneo cerebral depende do estado ácidobase durante a hipotermia. Quando o ph é mantido constante, a qualquer temperatura, a regulação automática do fluxo sanguíneo cerebral é interrompida se a pressão arterial média for inferior a 55mmHg. Ao contrário, quando se permitem as variaçòes do ph de acordo com a temperatura, a regulação do fluxo sanguíneo cerebral é controlada pelas próprias necessidades metabólicas do cérebro, em qualquer temperatura, mesmo com pressão arterial média baixa. Embora o valor mais adequado da pco2 em hipotermia não seja conhecido, existe o risco de surgirem lesões cerebrais, quando os mecanismos de auto-regulação do fluxo cerebral são interrompidos, por adoção do regime de ph constante. O metabolismo celular, a função miocárdica, a incidência de arritmias e a perfusão cerebral, dentre outros parâmetros de avaliação, parecem melhores, com a estratégia do ph variável, de acordo com a temperatura. MONITORIZAÇÃO DO PH E DOS GASES SANGUÍNEOS As gasometrias arterial e venosa devem ser monitorizadas, durante a circulação extracorpórea. A gasometria arterial oferece informações sobre o estado ácido-base do sangue que vai perfundir os tecidos do paciente e a qualidade da sua oxigenação; a amostra arterial informa com precisão a qualidade da função do oxigenador. A gasometria venosa, ao contrário, informa sobre a qualidade da oxigenação dos tecidos, o nível de extração de oxigênio, a adequácia do fluxo da perfusão e também, o estado ácido-base. A temperatura do sangue deve ser informada ao laboratório, para que a análise do ph e da tensão parcial dos gases da amostra, seja feita contra os padrões adequados à temperatura. A coleta de amostras para gasometria deve ser feita a intervalos regulares, ditados pelo transcurso da operação e deve consistir de, pelo menos, amostras coletadas, antes do início da perfusão, após a sua estabilização e próximo ao seu término. O exame de novas amostras deve, também, ser providenciado após a correção de qualquer alteração encontrada. Modernamente estudam-se máquinas capazes de analisar continuamente a oxigenação e o estado ácido- ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 323
18 base do sangue, durante a circulação extracorpórea, com o objetivo de monitorizar as tendências, ao invés das amostras isoladas. Não se conseguiu, até o momento, demonstrar vantagem apreciável naquela nova tecnologia capaz de justificar os seus custos elevados. Além disso, os transdutores são de difícil calibração e podem apresentar erros de leitura, especialmente durante a hipotermia. Entretanto a monitorização das tendências é, sem dúvidas, mais atraente que a monitorização de amostras, que refletem apenas o estado do sangue, no momento da coleta da amostra. Se, por exemplo, em uma amostra colhida aos 45 minutos de perfusão, encontrarmos o ph de 7,20, esse valor poderá representar uma de duas situações opostas. O ponto 7,20 pertence à uma curva de ph em queda, ou seja, o PH era de 7,35, alguns minutos antes da coleta da amostra, e continua decrescendo. Ou, ao contrário, o ponto 7,20 pertence à uma curva de ph em ascenção, ou seja, o ph era de 7,15 alguns minutos antes da coleta da amostra, e continua em elevação. No primeiro caso, a correção da causa da acidose é imperativa, enquanto no segundo caso, a simples observação da tendência é suficiente. A monitorização das tendências permite alterações da perfusão, capazes de impedir o desenvolvimento dos distúrbios do equilíbrio ácido-base, enquanto a análise de amostras, permite a identificação e correção dos distúrbios existentes VOL I - FUNDAMENTOS DA CIRCULAÇÃO EXTRACORPÓREA
19 REFERÊNCIAS SELECIONADAS 1. Amaral, R.V.G. - Alterações do Equilíbrio Ácido- Base em Circulação Extracorpórea. In Circulação Extracorpórea. Temas Básicos. São Paulo, Davies, L.K. - Hypothermia: Physiology and Clinical Use. In Gravlee, G.P.; Davis, R.F.; Utley, J.R.: Cardiopulmonary Bypass. Principles and Practice. Williams & Wilkins, Baltimore, Davenport, H.W. - The ABC of Acid-Base Chemistry. 6th edition. University Chicago Press, Chicago, Dearing, J.P.; Carmelengo, L. - Acid Base Physiology - A self-study module, Vol. II. AmSECT, Reston, Fagundes, F.E.S. - Equilíbrio Ácido-Base: Estudo Sumário. In Introdução à Circulação Extracorpórea. Módulo Teórico N o 1. SBCEC, Rio de Janeiro, Hickey, P.R.; Hansen, D.D. - Temperature and Blood Gases: The Clinical Dilemma of Acid-Base Management for Hypothermic Cardiopulmonary Bypass. In Tinker, J.H.: Cardiopulmonary Bypass: Current Concepts and Controversies. A Society of Cardiovascular Anesthesiologits Monograph. The W.B. Saunders Co., Philadelphia, Mitchell, B.A. - Profound Hypothermia with Circulatory Arrest and Acid-Base Balance. A review. AmSECT, Reston, Pearson, D.T. - Blood gas control during cardiopulmonary bypass. Perfusion, 3, , Reed, C.C.; Kurusz, M.; Lawrence, A.E.,Jr. - Safety and Techniques in Perfusion. Quali-Med, Stafford, Sethia, B. - Adequacy of perfusion - General review. In, Taylor, K.M.: Cardiopulmonary Bypass. Principles and Management. Williams & Wilkins, Baltimore, Schabel, R.K.; Berryessa, R.G.; Justison, G.A.; Tyndal, C.M.; Schumann, J. - Ten common perfusion problems: prevention and treatment protocols. J. Extra-Corp. Technol. 19, , Shapiro, B.A.; Harrison, R.A.; Walton, J.R. - Clinical Applications of Blood Gases. Year Book Medical Publishers, Chicago, Swain, J.A.; White, F.N.; Peters, R.M. - The effect of ph on the hypothermic ventricular fibrillation threshold. J. Thorac. Cardiovasc. Surg. 87, , ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BASE - Vol I - 325
Alterações do Equilíbrio
 Alterações do Equilíbrio 17 Ácido-base A função normal das células do organismo depende de uma série de processos bioquímicos e enzimáticos do metabolismo celular. Diversos fatores devem ser mantidos dentro
Alterações do Equilíbrio 17 Ácido-base A função normal das células do organismo depende de uma série de processos bioquímicos e enzimáticos do metabolismo celular. Diversos fatores devem ser mantidos dentro
Sistema tampão. Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H +
 Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
CONCEITOS DE ÁCIDO, BASE E ph
 ÁGUA, ph E TAMPÕES- DISTÚRBIOS ÁCIDO-BÁSICOS (Adaptado de http://perfline.com/cursos/cursos/acbas) A regulação dos líquidos do organismo inclui a regulação da concentração do íon hidrogênio, para assegurar
ÁGUA, ph E TAMPÕES- DISTÚRBIOS ÁCIDO-BÁSICOS (Adaptado de http://perfline.com/cursos/cursos/acbas) A regulação dos líquidos do organismo inclui a regulação da concentração do íon hidrogênio, para assegurar
GASOMETRIA ARTERIAL GASOMETRIA. Indicações 11/09/2015. Gasometria Arterial
 GASOMETRIA ARTERIAL Processo pelo qual é feita a medição das pressões parciais dos gases sangüíneos, a partir do qual é possível o cálculo do PH sangüíneo, o que reflete o equilíbrio Ácido-Básico 2 GASOMETRIA
GASOMETRIA ARTERIAL Processo pelo qual é feita a medição das pressões parciais dos gases sangüíneos, a partir do qual é possível o cálculo do PH sangüíneo, o que reflete o equilíbrio Ácido-Básico 2 GASOMETRIA
FISIOLOGIA RESPIRATÓRIA
 FISIOLOGIA RESPIRATÓRIA Respiração A função da respiração é essencial à vida e pode ser definida, de um modo simplificado, como a troca de gases (O 2 e CO 2 ) entre as células do organismo e a atmosfera.
FISIOLOGIA RESPIRATÓRIA Respiração A função da respiração é essencial à vida e pode ser definida, de um modo simplificado, como a troca de gases (O 2 e CO 2 ) entre as células do organismo e a atmosfera.
Água e Solução Tampão
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
Adaptações Cardiovasculares da Gestante ao Exercício
 Desde as décadas de 60 e 70 o exercício promove Aumento do volume sanguíneo Aumento do volume cardíaco e suas câmaras Aumento do volume sistólico Aumento do débito cardíaco que pode ser alcançado Aumento
Desde as décadas de 60 e 70 o exercício promove Aumento do volume sanguíneo Aumento do volume cardíaco e suas câmaras Aumento do volume sistólico Aumento do débito cardíaco que pode ser alcançado Aumento
QUÍMICA CELULAR NUTRIÇÃO TIPOS DE NUTRIENTES NUTRIENTES ENERGÉTICOS 4/3/2011 FUNDAMENTOS QUÍMICOS DA VIDA
 NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
NUTRIÇÃO QUÍMICA CELULAR PROFESSOR CLERSON CLERSONC@HOTMAIL.COM CIESC MADRE CLÉLIA CONCEITO CONJUNTO DE PROCESSOS INGESTÃO, DIGESTÃO E ABSORÇÃO SUBSTÂNCIAS ÚTEIS AO ORGANISMO ESPÉCIE HUMANA: DIGESTÃO ONÍVORA
Biologia. Sistema circulatório
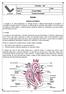 Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
Aluno (a): Série: 3ª Turma: TUTORIAL 10R Ensino Médio Equipe de Biologia Data: Biologia Sistema circulatório O coração e os vasos sanguíneos e o sangue formam o sistema cardiovascular ou circulatório.
TROCA E TRANSPORTE DE GASES
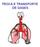 TROCA E TRANSPORTE DE GASES Difusão dos gases através da membrana respiratória Unidade Respiratória Cada alvéolo: 0,2 mm Parede Unidade respiratória: delgada Capilares Membrana Respiratória ou Membrana
TROCA E TRANSPORTE DE GASES Difusão dos gases através da membrana respiratória Unidade Respiratória Cada alvéolo: 0,2 mm Parede Unidade respiratória: delgada Capilares Membrana Respiratória ou Membrana
Como interpretar a Gasometria de Sangue Arterial
 Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Como interpretar a Gasometria de Sangue Arterial Sequência de interpretação e estratificação de risco 08/01/2013 Daniela Carvalho Objectivos da Tertúlia Sequência de interpretação da GSA - Método dos 3
Dra. Kátia R. P. de Araújo Sgrillo Sgrillo.ita@ftc.br
 Dra. Kátia R. P. de Araújo Sgrillo Sgrillo.ita@ftc.br A água é a substância mais abundante nos seres vivos, perfazendo 70% ou mais da massa da maioria dos organismos. A água permeia todas as porções de
Dra. Kátia R. P. de Araújo Sgrillo Sgrillo.ita@ftc.br A água é a substância mais abundante nos seres vivos, perfazendo 70% ou mais da massa da maioria dos organismos. A água permeia todas as porções de
INTERATIVIDADE FINAL EDUCAÇÃO FÍSICA CONTEÚDO E HABILIDADES DINÂMICA LOCAL INTERATIVA AULA. Conteúdo: Sistema cardiovascular no exercício físico
 Conteúdo: Sistema cardiovascular no exercício físico Habilidades: Entender o sistema cardiovascular com a prática de atividades físicas. REVISÃO A Importância do sistema Muscular e a relação do mesmo com
Conteúdo: Sistema cardiovascular no exercício físico Habilidades: Entender o sistema cardiovascular com a prática de atividades físicas. REVISÃO A Importância do sistema Muscular e a relação do mesmo com
EXERCÍCIO E DIABETES
 EXERCÍCIO E DIABETES Todos os dias ouvimos falar dos benefícios que os exercícios físicos proporcionam, de um modo geral, à nossa saúde. Pois bem, aproveitando a oportunidade, hoje falaremos sobre a Diabetes,
EXERCÍCIO E DIABETES Todos os dias ouvimos falar dos benefícios que os exercícios físicos proporcionam, de um modo geral, à nossa saúde. Pois bem, aproveitando a oportunidade, hoje falaremos sobre a Diabetes,
Equilíbrio Ácido-Básico. Água : solvente das reações químicas
 Equilíbrio Ácido-Básico Água : solvente das reações químicas Introdução Polaridade molecular: moléculas que possuem uma maior concentração de cargas numa parte da molécula. Os elétrons são compartilhados
Equilíbrio Ácido-Básico Água : solvente das reações químicas Introdução Polaridade molecular: moléculas que possuem uma maior concentração de cargas numa parte da molécula. Os elétrons são compartilhados
Sistema circulatório
 Sistema circulatório O que é: também conhecido como sistema cardiovascular é formado pelo coração e vasos sanguíneos. Tal sistema é responsável pelo transporte de nutrientes, gases, hormônios, excreções
Sistema circulatório O que é: também conhecido como sistema cardiovascular é formado pelo coração e vasos sanguíneos. Tal sistema é responsável pelo transporte de nutrientes, gases, hormônios, excreções
EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0
 EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0 1- Que órgão do sistema nervoso central controla nosso ritmo respiratório? Bulbo 2- Os alvéolos são formados por uma única camada de células muito finas. Explique como
EXERCÍCIOS ON LINE DE CIÊNCIAS 8 AN0 1- Que órgão do sistema nervoso central controla nosso ritmo respiratório? Bulbo 2- Os alvéolos são formados por uma única camada de células muito finas. Explique como
VALÊNCIAS FÍSICAS. 2. VELOCIDADE DE DESLOCAMENTO: Tempo que é requerido para ir de um ponto a outro o mais rapidamente possível.
 VALÊNCIAS FÍSICAS RESISTÊNCIA AERÓBICA: Qualidade física que permite ao organismo executar uma atividade de baixa para média intensidade por um longo período de tempo. Depende basicamente do estado geral
VALÊNCIAS FÍSICAS RESISTÊNCIA AERÓBICA: Qualidade física que permite ao organismo executar uma atividade de baixa para média intensidade por um longo período de tempo. Depende basicamente do estado geral
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B
 Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
Volumetria ácido-base (continuação) Prof a Alessandra Smaniotto QMC 5325 - Química Analítica - Farmácia Turmas 02102A e 02102B Curvas de titulação ² A curva de titulação é a representação gráfica de como
TRANSPORTE DE GASES NO SANGUE. Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas
 TRANSPORTE DE GASES NO SANGUE Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas ANATOMIA DO SISTEMA RESPIRATÓRIO ESTRUTURA DAS VIAS AÉREAS ESQUERDO WEST 2002 VASOS ALVEOLARES
TRANSPORTE DE GASES NO SANGUE Departamento de Bioquímica e Biologia Molecular Setor de Ciências Biológicas ANATOMIA DO SISTEMA RESPIRATÓRIO ESTRUTURA DAS VIAS AÉREAS ESQUERDO WEST 2002 VASOS ALVEOLARES
MÉTODO ADAPTATIVO. Nos métodos adaptativos, no entanto, juntamente com o exercício, associa-se um outro fator: a diminuição de oxigênio.
 MÉTODO ADAPTATIVO Em todos os métodos anteriores buscava-se a adaptação do organismo (supercompensação) através de uma estimulação por meio do stress físico. Nos métodos adaptativos, no entanto, juntamente
MÉTODO ADAPTATIVO Em todos os métodos anteriores buscava-se a adaptação do organismo (supercompensação) através de uma estimulação por meio do stress físico. Nos métodos adaptativos, no entanto, juntamente
Insuficiência respiratória aguda. Prof. Claudia Witzel
 Insuficiência respiratória aguda O que é!!!!! IR aguda Incapacidade do sistema respiratório de desempenhar suas duas principais funções: - Captação de oxigênio para o sangue arterial - Remoção de gás carbônico
Insuficiência respiratória aguda O que é!!!!! IR aguda Incapacidade do sistema respiratório de desempenhar suas duas principais funções: - Captação de oxigênio para o sangue arterial - Remoção de gás carbônico
EQUILÍBRIO QUÍMICO 1
 EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
EQUILÍBRIO QUÍMICO 1 1- Introdução Uma reação química é composta de duas partes separadas por uma flecha, a qual indica o sentido da reação. As espécies químicas denominadas como reagentes ficam à esquerda
05/10/2013 SISTEMA CIRCULATÓRIO. Evolução do sistema circulatório. Fisiologia do Sistema Circulatório ou Cardiovascular
 SISTEMA CIRCULATÓRIO Prof.Msc.MoisésMendes professormoises300@hotmail.com www.moisesmendes.com Fisiologia do Sistema Circulatório ou Cardiovascular Esse sistema é constituído por um fluido circulante (o
SISTEMA CIRCULATÓRIO Prof.Msc.MoisésMendes professormoises300@hotmail.com www.moisesmendes.com Fisiologia do Sistema Circulatório ou Cardiovascular Esse sistema é constituído por um fluido circulante (o
DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO
 Preparatório Concursos- 2012 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias;
Preparatório Concursos- 2012 DISTÚRBIO HIDRO- ELETROLÍTICO E ÁCIDO-BÁSICO Prof. Fernando Ramos Gonçalves -Msc Distúrbio hidro-eletrolítico e ácido-básico Distúrbios da regulação da água; Disnatremias;
Química Analítica Avançada: Volumetria de Neutralização. Prof a Lilian Silva 2011
 Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
OBJETIVOS: CARGA HORÁRIA MÍNIMA CRONOGRAMA:
 ESTUDO DIRIGIDO COMPONENTE CURRICULAR: Controle de Processos e Instrumentação PROFESSOR: Dorival Rosa Brito ESTUDO DIRIGIDO: Métodos de Determinação de Parâmetros de Processos APRESENTAÇÃO: O rápido desenvolvimento
ESTUDO DIRIGIDO COMPONENTE CURRICULAR: Controle de Processos e Instrumentação PROFESSOR: Dorival Rosa Brito ESTUDO DIRIGIDO: Métodos de Determinação de Parâmetros de Processos APRESENTAÇÃO: O rápido desenvolvimento
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza
 Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Monitorização/ Dispositivos de Oferta/Benefícios e Malefícios Oxigenoterapia. Mariana C. Buranello Fisioterapeuta Nayara C. Gomes - Enfermeira
 Monitorização/ Dispositivos de Oferta/Benefícios e Malefícios Oxigenoterapia Mariana C. Buranello Fisioterapeuta Nayara C. Gomes - Enfermeira Monitorização Oximetria de pulso É a medida da saturação da
Monitorização/ Dispositivos de Oferta/Benefícios e Malefícios Oxigenoterapia Mariana C. Buranello Fisioterapeuta Nayara C. Gomes - Enfermeira Monitorização Oximetria de pulso É a medida da saturação da
SISTEMA CARDIOVASCULAR
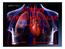 SISTEMA CARDIOVASCULAR Professora: Edilene biologolena@yahoo.com.br Sistema Cardiovascular Sistema Cardiovascular Composto pelo coração, pelos vasos sanguíneos e pelo sangue; Tem por função fazer o sangue
SISTEMA CARDIOVASCULAR Professora: Edilene biologolena@yahoo.com.br Sistema Cardiovascular Sistema Cardiovascular Composto pelo coração, pelos vasos sanguíneos e pelo sangue; Tem por função fazer o sangue
Sistema Respiratório Introdução
 Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
Introdução Nesse caso, o termo respiração é empregado incluindo as trocas gasosas através do corpo e as trocas gasosas nas células dos diferentes tecidos. As trocas gasosas são realizadas através da superfície
Sistema circulatório. Componentes: - Vasos sanguíneos. - Sangue (elementos figurados e plasma) - Coração
 Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
PlanetaBio Resolução de Vestibulares UFRJ 2007 www.planetabio.com
 1-O gráfico a seguir mostra como variou o percentual de cepas produtoras de penicilinase da bactéria Neisseria gonorrhoeae obtidas de indivíduos com gonorréia no período de 1980 a 1990. A penicilinase
1-O gráfico a seguir mostra como variou o percentual de cepas produtoras de penicilinase da bactéria Neisseria gonorrhoeae obtidas de indivíduos com gonorréia no período de 1980 a 1990. A penicilinase
FISIOLOGIA RENAL EXERCÍCIOS DE APRENDIZAGEM
 EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS
 hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS O NOSSO CORPO É CONSTITUÍDO NA MAIOR PARTE POR ÁGUA A ÁGUA É O PRINCIPAL CONSTITUINTE DO ORGANISMO, É ESSENCIAL PARA A VIDA E TEM
hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS O NOSSO CORPO É CONSTITUÍDO NA MAIOR PARTE POR ÁGUA A ÁGUA É O PRINCIPAL CONSTITUINTE DO ORGANISMO, É ESSENCIAL PARA A VIDA E TEM
PRINCÍPIO FÍSICO E TRANSPORTE DOS GASES
 PRINCÍPIO FÍSICO E TRANSPORTE DOS GASES Prof. Me Tatiane Quaresma O sangue tem várias funções, entre as quais o transporte de gases respiratórios essenciais ao funcionamento do nosso organismo. O2 das
PRINCÍPIO FÍSICO E TRANSPORTE DOS GASES Prof. Me Tatiane Quaresma O sangue tem várias funções, entre as quais o transporte de gases respiratórios essenciais ao funcionamento do nosso organismo. O2 das
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
POTENCIAL ELÉTRICO. alvaro.unespbauru@hotmail.com
 POTENCIAL ELÉTRICO alvaro.unespbauru@hotmail.com Potenciais elétricos Potencial de membrana: é a diferença de potencial elétrico, em Volts (V), gerada a partir de um gradiente eletroquímico através de
POTENCIAL ELÉTRICO alvaro.unespbauru@hotmail.com Potenciais elétricos Potencial de membrana: é a diferença de potencial elétrico, em Volts (V), gerada a partir de um gradiente eletroquímico através de
Introdução. Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo.
 Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Fisiologia Cardiovascular
 Fisiologia Cardiovascular Conceitos e funções do sistema circulatório O coração Eletrocardiograma A circulação Regulação da circulação Conceitos e funções do sistema circulatório Sistema Circulatório O
Fisiologia Cardiovascular Conceitos e funções do sistema circulatório O coração Eletrocardiograma A circulação Regulação da circulação Conceitos e funções do sistema circulatório Sistema Circulatório O
EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA. Profa. Dra. Monica Akemi Sato
 EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA Profa. Dra. Monica Akemi Sato Introdução Homeostasia: constância do meio interno Claude Bernard Parâmetros fisiológicos constantes: temperatura, volume, pressão,
EQÚILÍBRIO ÁCIDO-BÁSICO E ACIFICAÇÃO URINÁRIA Profa. Dra. Monica Akemi Sato Introdução Homeostasia: constância do meio interno Claude Bernard Parâmetros fisiológicos constantes: temperatura, volume, pressão,
SISTEMA URINÁRIO. Prof. Me. Leandro Parussolo
 SISTEMA URINÁRIO Prof. Me. Leandro Parussolo SISTEMA URINÁRIO Conjunto de órgãos e estruturas responsáveis pela filtração do sangue e consequente formação da urina; É o principal responsável pela eliminação
SISTEMA URINÁRIO Prof. Me. Leandro Parussolo SISTEMA URINÁRIO Conjunto de órgãos e estruturas responsáveis pela filtração do sangue e consequente formação da urina; É o principal responsável pela eliminação
Formas farmacêuticas líquidas - Soluções
 Formas farmacêuticas líquidas - Soluções Preparações líquidas: Podem conter uma ou mais substâncias químicas dissolvidas em solvente adequado ou em mistura de solventes mutuamente miscíveis ou dispersíveis.
Formas farmacêuticas líquidas - Soluções Preparações líquidas: Podem conter uma ou mais substâncias químicas dissolvidas em solvente adequado ou em mistura de solventes mutuamente miscíveis ou dispersíveis.
O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico.
 1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
Diminua seu tempo total de treino e queime mais gordura
 Diminua seu tempo total de treino e queime mais gordura Neste artigo vou mostrar o principal tipo de exercício para acelerar a queima de gordura sem se matar durante horas na academia. Vou mostrar e explicar
Diminua seu tempo total de treino e queime mais gordura Neste artigo vou mostrar o principal tipo de exercício para acelerar a queima de gordura sem se matar durante horas na academia. Vou mostrar e explicar
DOENÇAS CARDÍACAS NA INSUFICIÊNCIA RENAL
 DOENÇAS CARDÍACAS NA INSUFICIÊNCIA RENAL As doenças do coração são muito freqüentes em pacientes com insuficiência renal. Assim, um cuidado especial deve ser tomado, principalmente, na prevenção e no controle
DOENÇAS CARDÍACAS NA INSUFICIÊNCIA RENAL As doenças do coração são muito freqüentes em pacientes com insuficiência renal. Assim, um cuidado especial deve ser tomado, principalmente, na prevenção e no controle
Retinopatia Diabética
 Retinopatia Diabética A diabetes mellitus é uma desordem metabólica crónica caracterizada pelo excesso de níveis de glicose no sangue. A causa da hiper glicemia (concentração de glicose igual ou superior
Retinopatia Diabética A diabetes mellitus é uma desordem metabólica crónica caracterizada pelo excesso de níveis de glicose no sangue. A causa da hiper glicemia (concentração de glicose igual ou superior
Unidade 1 Adaptação e Lesão Celular
 DISCIPLINA DE PATOLOGIA Prof. Renato Rossi Jr Unidade 1 Adaptação e Lesão Celular Objetivo da Unidade: Identificar e compreender os mecanismos envolvidos nas lesões celulares reversíveis e irreversíveis.
DISCIPLINA DE PATOLOGIA Prof. Renato Rossi Jr Unidade 1 Adaptação e Lesão Celular Objetivo da Unidade: Identificar e compreender os mecanismos envolvidos nas lesões celulares reversíveis e irreversíveis.
Lisina, Farelo de Soja e Milho
 Lisina, Farelo de Soja e Milho Disponível em nosso site: www.lisina.com.br Veja como substituir uma parte do farelo de soja por Lisina Industrial e milho Grande parte dos suinocultores conhecem a Lisina
Lisina, Farelo de Soja e Milho Disponível em nosso site: www.lisina.com.br Veja como substituir uma parte do farelo de soja por Lisina Industrial e milho Grande parte dos suinocultores conhecem a Lisina
FORMAS DE TRANSFERÊNCIA DE CALOR ENTRE HOMEM E MEIO AMBIENTE
 AMBIENTE TÉRMICO O ambiente térmico pode ser definido como o conjunto das variáveis térmicas do posto de trabalho que influenciam o organismo do trabalhador, sendo assim um fator importante que intervém,
AMBIENTE TÉRMICO O ambiente térmico pode ser definido como o conjunto das variáveis térmicas do posto de trabalho que influenciam o organismo do trabalhador, sendo assim um fator importante que intervém,
P2 - PROVA DE QUÍMICA GERAL - 11/10/08
 P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
------------------------------------------------------------------------------ - Modelos de células de condutância. Procedimento Experimental
 QMC5351 Química Analítica Instrumental CONDUTIMETRIA A condutimetria é um método de análise que se fundamenta na medida da condutividade elétrica de uma solução eletrolítica. A condução da eletricidade
QMC5351 Química Analítica Instrumental CONDUTIMETRIA A condutimetria é um método de análise que se fundamenta na medida da condutividade elétrica de uma solução eletrolítica. A condução da eletricidade
As proteínas transportadoras
 As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
Pigmentos respiratórios: capacidade de se ligar reversivelmente ao oxigênio, aumentando muito a capacidade carreadora do sangue
 PIGMENTOS RESPIRATÓRIOS RESPIRAÇÃO AULA 5 Pigmentos respiratórios: capacidade de se ligar reversivelmente ao oxigênio, aumentando muito a capacidade carreadora do sangue Ex: hemoglobina Mamíferos apresentam
PIGMENTOS RESPIRATÓRIOS RESPIRAÇÃO AULA 5 Pigmentos respiratórios: capacidade de se ligar reversivelmente ao oxigênio, aumentando muito a capacidade carreadora do sangue Ex: hemoglobina Mamíferos apresentam
Qualidade Ambiental Química
 Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
Qualidade Ambiental Química Programa Revisão dos Conceitos Básicos de Química e Estatística Poluição o Ar e a Química da Troposfera Reações Químicas ligadas à Emissão de Poluentes da Atmosfera Bibliografia
VIVER BEM OS RINS DO SEU FABRÍCIO AGENOR DOENÇAS RENAIS
 VIVER BEM OS RINS DO SEU FABRÍCIO AGENOR DOENÇAS RENAIS Leia o código e assista a história de seu Fabrício Agenor. Este é o seu Fabrício Agenor. Ele sempre gostou de comidas pesadas e com muito tempero
VIVER BEM OS RINS DO SEU FABRÍCIO AGENOR DOENÇAS RENAIS Leia o código e assista a história de seu Fabrício Agenor. Este é o seu Fabrício Agenor. Ele sempre gostou de comidas pesadas e com muito tempero
Informação Técnica 10.08.01 E 09.2003 Offset Serviços. Molhagem em impressão offset Fatos importantes para o uso nos aditivos de molhagem offset 1/5
 Informação Técnica 10.08.01 E 09.2003 Offset Serviços Molhagem em impressão offset Fatos importantes para o uso nos aditivos de molhagem offset 1/5 O processo de impressão offset Offset continua a ser
Informação Técnica 10.08.01 E 09.2003 Offset Serviços Molhagem em impressão offset Fatos importantes para o uso nos aditivos de molhagem offset 1/5 O processo de impressão offset Offset continua a ser
Câncer de Próstata. Fernando Magioni Enfermeiro do Trabalho
 Câncer de Próstata Fernando Magioni Enfermeiro do Trabalho O que é próstata? A próstata é uma glândula que só o homem possui e que se localiza na parte baixa do abdômen. Ela é um órgão muito pequeno, tem
Câncer de Próstata Fernando Magioni Enfermeiro do Trabalho O que é próstata? A próstata é uma glândula que só o homem possui e que se localiza na parte baixa do abdômen. Ela é um órgão muito pequeno, tem
INTRODUÇÃO À FISIOLOGIA. Profª. Juliana Delatim Simonato Rocha Lab. de Ecofisiologia Animal LEFA - CIF/CCB
 INTRODUÇÃO À FISIOLOGIA Profª. Juliana Delatim Simonato Rocha Lab. de Ecofisiologia Animal LEFA - CIF/CCB 1 Fisiologia é... Literalmente... Conhecimento da natureza O estudo do funcionamento dos organismos
INTRODUÇÃO À FISIOLOGIA Profª. Juliana Delatim Simonato Rocha Lab. de Ecofisiologia Animal LEFA - CIF/CCB 1 Fisiologia é... Literalmente... Conhecimento da natureza O estudo do funcionamento dos organismos
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
- A velocidade da reação direta (V1) é igual à velocidade da reação inversa (V2) V 1 = V 2
 EQUILÍBRIO QUÍMICO Equilíbrio Químico - Equilíbrio químico é a parte da físico-química que estuda as reações reversíveis e as condições para o estabelecimento desta atividade equilibrada. A + B C + D -
EQUILÍBRIO QUÍMICO Equilíbrio Químico - Equilíbrio químico é a parte da físico-química que estuda as reações reversíveis e as condições para o estabelecimento desta atividade equilibrada. A + B C + D -
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com
 Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
TITULAÇÃO DE ÁCIDO-BASE
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Disciplina QUIO94 - Introdução à Análise Química
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Disciplina QUIO94 - Introdução à Análise Química
Prof. Me. Leandro Parussolo
 HISTOFISIOLOGIA ANIMAL AULA - SISTEMA CARDIOVASCULAR Prof. Me. Leandro Parussolo SISTEMA CARDIOVASCULAR INTRODUÇÃO A função da circulação é realizada pelo sistema cardiovascular sistema vascular sanguíneo
HISTOFISIOLOGIA ANIMAL AULA - SISTEMA CARDIOVASCULAR Prof. Me. Leandro Parussolo SISTEMA CARDIOVASCULAR INTRODUÇÃO A função da circulação é realizada pelo sistema cardiovascular sistema vascular sanguíneo
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S SÓ ABRA QUANDO AUTORIZADO.
 U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
U N I V E R S I D A D E F E D E R A L D E M I N A S G E R A I S QUÍMICA Prova de 2 a Etapa SÓ ABRA QUANDO AUTORIZADO. Leia atentamente as instruções que se seguem. 1 - Este Caderno de Prova contém cinco
EXERCÍCIOS RESISTIDOS. Parte I
 EXERCÍCIOS RESISTIDOS Parte I DESEMPENHO MUSCULAR Capacidade do músculo realizar trabalho. Elementos fundamentais: Força Potência muscular Resistência à fadiga FATORES QUE AFETAM O DESEMPENHO MUSCULAR
EXERCÍCIOS RESISTIDOS Parte I DESEMPENHO MUSCULAR Capacidade do músculo realizar trabalho. Elementos fundamentais: Força Potência muscular Resistência à fadiga FATORES QUE AFETAM O DESEMPENHO MUSCULAR
COMPOSIÇÃO QUÍMICA DA CARNE. Profª Sandra Carvalho
 COMPOSIÇÃO QUÍMICA DA CARNE Profª Sandra Carvalho A carne magra: 75% de água 21 a 22% de proteína 1 a 2% de gordura 1% de minerais menos de 1% de carboidratos A carne magra dos diferentes animais de abate
COMPOSIÇÃO QUÍMICA DA CARNE Profª Sandra Carvalho A carne magra: 75% de água 21 a 22% de proteína 1 a 2% de gordura 1% de minerais menos de 1% de carboidratos A carne magra dos diferentes animais de abate
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR
 UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
UFMG - 2005 3º DIA QUÍMICA BERNOULLI COLÉGIO E PRÉ-VESTIBULAR Química Questão 01 Carbono é um elemento cujos átomos podem se organizar sob a forma de diferentes alótropos. Alótropos H de combustão a 25
Características e os efeitos das propriedades coligativas
 Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
PROF.: FERNANDA BRITO Disciplina Farmacologia. fernandabrito@vm.uff.br
 PROF.: FERNANDA BRITO Disciplina Farmacologia fernandabrito@vm.uff.br EXEMPLOS DE ESQUEMAS COMPARTIMENTAIS DO CORPO TGI COMPARTIMENTO CENTRAL CÉREBRO FÍGADO ELIMINAÇÃO METABÓLICA EXCREÇÃO RENAL OUTROS
PROF.: FERNANDA BRITO Disciplina Farmacologia fernandabrito@vm.uff.br EXEMPLOS DE ESQUEMAS COMPARTIMENTAIS DO CORPO TGI COMPARTIMENTO CENTRAL CÉREBRO FÍGADO ELIMINAÇÃO METABÓLICA EXCREÇÃO RENAL OUTROS
Anatomia e Fisiologia Humana
 Componentes Vias Respiratórias A) Cavidades ou Fossas Nasais; B) Boca; C) Faringe; D) Laringe; E) Traqueia; F) Brônquios; G) Bronquíolos; H) Pulmões Cavidades ou Fossas Nasais; São duas cavidades paralelas
Componentes Vias Respiratórias A) Cavidades ou Fossas Nasais; B) Boca; C) Faringe; D) Laringe; E) Traqueia; F) Brônquios; G) Bronquíolos; H) Pulmões Cavidades ou Fossas Nasais; São duas cavidades paralelas
Aula 3 Arquitetura do Sistema de Medição de Desempenho
 Aula 3 Arquitetura do Sistema de Medição de Desempenho A primeira definição, a saber, é como o sistema de medição do desempenho é definido, sem especificar métodos de planejamento e sem esclarecer qual
Aula 3 Arquitetura do Sistema de Medição de Desempenho A primeira definição, a saber, é como o sistema de medição do desempenho é definido, sem especificar métodos de planejamento e sem esclarecer qual
Existem diversos tipos de transporte que podem ocorrer através da membrana plasmática. Vejamos abaixo:
 MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
Aplicações da FPA em Insourcing e Fábrica de Software
 Aplicações da FPA em Insourcing e Fábrica de Software Copyright 2002 por FATTO CONSULTORIA E SISTEMA LTDA. Esta publicação não poderá ser reproduzida ou transmitida por qualquer modo ou meio, no todo ou
Aplicações da FPA em Insourcing e Fábrica de Software Copyright 2002 por FATTO CONSULTORIA E SISTEMA LTDA. Esta publicação não poderá ser reproduzida ou transmitida por qualquer modo ou meio, no todo ou
Introdução a Química Analítica. Professora Mirian Maya Sakuno
 Introdução a Química Analítica Professora Mirian Maya Sakuno Química Analítica ou Química Quantitativa QUÍMICA ANALÍTICA: É a parte da química que estuda os princípios teóricos e práticos das análises
Introdução a Química Analítica Professora Mirian Maya Sakuno Química Analítica ou Química Quantitativa QUÍMICA ANALÍTICA: É a parte da química que estuda os princípios teóricos e práticos das análises
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4. , K +, Mg 2+, etc...)
 Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
O CALOR EXCESSIVO NO AMBIENTE DE TRABALHO A EXPOSIÇÃO AO CALOR PRODUZ REAÇÕES NO ORGANISMO
 O CALOR EXCESSIVO NO AMBIENTE DE TRABALHO Muitos trabalhadores passam parte de sua jornada diária diante de fontes de calor. As pessoas que trabalham em fundições, siderúrgicas, padarias, - para citar
O CALOR EXCESSIVO NO AMBIENTE DE TRABALHO Muitos trabalhadores passam parte de sua jornada diária diante de fontes de calor. As pessoas que trabalham em fundições, siderúrgicas, padarias, - para citar
QUESTÕES DE CARACTERIZAÇÃO E ANÁLISE AMBIENTAL. O 2(g) O 2(aq)
 QUESTÕES DE CARACTERIZAÇÃO E ANÁLISE AMBIENTAL Questão 01 O agente oxidante mais importante em águas naturais é, sem a menor dúvida, o oxigênio molecular dissolvido, O 2. O equilíbrio entre o oxigênio
QUESTÕES DE CARACTERIZAÇÃO E ANÁLISE AMBIENTAL Questão 01 O agente oxidante mais importante em águas naturais é, sem a menor dúvida, o oxigênio molecular dissolvido, O 2. O equilíbrio entre o oxigênio
5. Resultados e Análises
 66 5. Resultados e Análises Neste capítulo é importante ressaltar que as medições foram feitas com uma velocidade constante de 1800 RPM, para uma freqüência de 60 Hz e uma voltagem de 220 V, entre as linhas
66 5. Resultados e Análises Neste capítulo é importante ressaltar que as medições foram feitas com uma velocidade constante de 1800 RPM, para uma freqüência de 60 Hz e uma voltagem de 220 V, entre as linhas
Indicações e Cuidados Transfusionais com o Paciente Idoso
 Indicações e Cuidados Transfusionais com o Paciente Idoso Dra. Maria Odila Jacob de Assis Moura Centro de Hematologia de São Paulo Setembro/2006 Guidelines 1980 National Institutes of Health 1984 American
Indicações e Cuidados Transfusionais com o Paciente Idoso Dra. Maria Odila Jacob de Assis Moura Centro de Hematologia de São Paulo Setembro/2006 Guidelines 1980 National Institutes of Health 1984 American
Protocolo em Rampa Manual de Referência Rápida
 Protocolo em Rampa Manual de Referência Rápida 1 O que é o Protocolo em Rampa O protocolo em rampa é um protocolo para testes de esforço que não possui estágios. Nele o incremento da carga se dá de maneira
Protocolo em Rampa Manual de Referência Rápida 1 O que é o Protocolo em Rampa O protocolo em rampa é um protocolo para testes de esforço que não possui estágios. Nele o incremento da carga se dá de maneira
Gestão da Qualidade Políticas. Elementos chaves da Qualidade 19/04/2009
 Gestão da Qualidade Políticas Manutenção (corretiva, preventiva, preditiva). Elementos chaves da Qualidade Total satisfação do cliente Priorizar a qualidade Melhoria contínua Participação e comprometimento
Gestão da Qualidade Políticas Manutenção (corretiva, preventiva, preditiva). Elementos chaves da Qualidade Total satisfação do cliente Priorizar a qualidade Melhoria contínua Participação e comprometimento
Elementos do bloco p
 Elementos do bloco p Características gerais principais Estados de oxidação e tipos de ligações Inicialmente, para efeitos didáticos, serão utilizados os elementos do grupo 13 (B, Al, Ga, In Tl), que apresentam
Elementos do bloco p Características gerais principais Estados de oxidação e tipos de ligações Inicialmente, para efeitos didáticos, serão utilizados os elementos do grupo 13 (B, Al, Ga, In Tl), que apresentam
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA DE QUÍMICA
 PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA DE QUÍMICA TEMAS 1. Estrutura da matéria 1.1 Elementos, átomos e iões 1.2
PROVA ESPECIALMENTE ADEQUADA DESTINADA A AVALIAR A CAPACIDADE PARA A FREQUÊNCIA DO ENSINO SUPERIOR DOS MAIORES DE 23 ANOS PROVA DE QUÍMICA TEMAS 1. Estrutura da matéria 1.1 Elementos, átomos e iões 1.2
a) Qual a configuração eletrônica do cátion do alumínio isoeletrônico ao gás nobre neônio?
 Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
Questão 1: O Brasil é o campeão mundial da reciclagem de alumínio, colaborando com a preservação do meio ambiente. Por outro lado, a obtenção industrial do alumínio sempre foi um processo caro, consumindo
FISIOLOGIA DO EXERCÍCIO I BIOENERGÉTICA: CICLO DE KREBS
 FISIOLOGIA DO EXERCÍCIO I BIOENERGÉTICA: CICLO DE KREBS Ciclo de Krebs Considerações Gerais Esta denominação decorre da homenagem ao bioquímico Hans Krebs, a qual lhe valeu o Prémio Nobel de Fisiologia
FISIOLOGIA DO EXERCÍCIO I BIOENERGÉTICA: CICLO DE KREBS Ciclo de Krebs Considerações Gerais Esta denominação decorre da homenagem ao bioquímico Hans Krebs, a qual lhe valeu o Prémio Nobel de Fisiologia
MEIOS DE CULTURA DESENVOLVIMENTO OU PRODUÇÃO DE MEIOS DE CULTURA. Necessidade Bactérias Leveduras
 MEIOS DE CULTURA Associação equilibrada de agentes químicos (nutrientes, ph, etc.) e físicos (temperatura, viscosidade, atmosfera, etc) que permitem o cultivo de microorganismos fora de seu habitat natural.
MEIOS DE CULTURA Associação equilibrada de agentes químicos (nutrientes, ph, etc.) e físicos (temperatura, viscosidade, atmosfera, etc) que permitem o cultivo de microorganismos fora de seu habitat natural.
Planejamento de PIE- Guilherme de Almeida. 2º EM Biologia Frente B. Prof. Jairo José Matozinho Cubas
 Planejamento de PIE- Guilherme de Almeida 2º EM Biologia Frente B Prof. Jairo José Matozinho Cubas 3º Trimestre: Fisiologia animal e humana: a)fisiologia e relações entre sistemas respiratório e circulatório
Planejamento de PIE- Guilherme de Almeida 2º EM Biologia Frente B Prof. Jairo José Matozinho Cubas 3º Trimestre: Fisiologia animal e humana: a)fisiologia e relações entre sistemas respiratório e circulatório
TRATAMENTO DA ÁGUA. Professora: Raquel Malta Química 3ª série - Ensino Médio
 TRATAMENTO DA ÁGUA Professora: Raquel Malta Química 3ª série - Ensino Médio Água poluída: água inadequada para beber ou para fazer nossa higiene. Diversas substâncias naturalmente presentes na água são
TRATAMENTO DA ÁGUA Professora: Raquel Malta Química 3ª série - Ensino Médio Água poluída: água inadequada para beber ou para fazer nossa higiene. Diversas substâncias naturalmente presentes na água são
CURSO DE AQUITETURA E URBANISMO
 1- Generalidades PROPRIEDADES DO CONCRETO FRESCO Todas as misturas de concreto devem ser adequadamente dosadas para atender aos requisitos de: Economia; Trabalhabilidade; Resistência; Durabilidade. Esses
1- Generalidades PROPRIEDADES DO CONCRETO FRESCO Todas as misturas de concreto devem ser adequadamente dosadas para atender aos requisitos de: Economia; Trabalhabilidade; Resistência; Durabilidade. Esses
Mecanismos renais de absorção e equilíbrio ácido-básico
 Mecanismos renais de absorção e equilíbrio ácido-básico A absorção no túbulo contornado proximal A característica base do túbulo contornado proximal é reabsorção ativa de sódio, com gasto energético, na
Mecanismos renais de absorção e equilíbrio ácido-básico A absorção no túbulo contornado proximal A característica base do túbulo contornado proximal é reabsorção ativa de sódio, com gasto energético, na
Módulo 4. Construindo uma solução OLAP
 Módulo 4. Construindo uma solução OLAP Objetivos Diferenciar as diversas formas de armazenamento Compreender o que é e como definir a porcentagem de agregação Conhecer a possibilidade da utilização de
Módulo 4. Construindo uma solução OLAP Objetivos Diferenciar as diversas formas de armazenamento Compreender o que é e como definir a porcentagem de agregação Conhecer a possibilidade da utilização de
PADRÃO DE RESPOSTA - QUÍMICA - Grupo A
 PADRÃO DE RESPOSTA - QUÍMICA - Grupo A 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
PADRÃO DE RESPOSTA - QUÍMICA - Grupo A 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Num recipiente de 3,0 L de capacidade, as seguintes pressões parciais foram medidas: N 2 = 0,500 atm; H 2 = 0,400 atm;
Química - Grupo J - Gabarito
 - Gabarito 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Informe a que volume deve ser diluído com água um litro de solução de um ácido fraco HA 0.10 M, de constante de ionização extremamente pequena (K
- Gabarito 1 a QUESTÃO: (2,0 pontos) Avaliador Revisor Informe a que volume deve ser diluído com água um litro de solução de um ácido fraco HA 0.10 M, de constante de ionização extremamente pequena (K
TERAPÊUTICA DAS ALTERAÇÕES DO EQUILÍBRIO ÁCIDO-BÁSICO
 TERAPÊUTICA DAS ALTERAÇÕES DO EQUILÍBRIO ÁCIDOBÁSICO Introdução O ph do líquido extracelular é uma das variáveis mais rigorosamente reguladas do organismo. Os limites vitais da variação do ph para mamíferos
TERAPÊUTICA DAS ALTERAÇÕES DO EQUILÍBRIO ÁCIDOBÁSICO Introdução O ph do líquido extracelular é uma das variáveis mais rigorosamente reguladas do organismo. Os limites vitais da variação do ph para mamíferos
 Termos Técnicos Ácidos Classe de substâncias que têm ph igual ou maior que 1 e menor que 7. Exemplo: sumo do limão. Átomos Todos os materiais são formados por pequenas partículas. Estas partículas chamam-se
Termos Técnicos Ácidos Classe de substâncias que têm ph igual ou maior que 1 e menor que 7. Exemplo: sumo do limão. Átomos Todos os materiais são formados por pequenas partículas. Estas partículas chamam-se
Prescrição Dietética
 Prescrição Dietética Quantitativo Cálculo de Dietas Cálculo de dietas estimar as necessidades energéticas de um indivíduo (atividade física, estágio da vida e composição corporal) Necessidades energéticas
Prescrição Dietética Quantitativo Cálculo de Dietas Cálculo de dietas estimar as necessidades energéticas de um indivíduo (atividade física, estágio da vida e composição corporal) Necessidades energéticas
Prof. Paulo Fonseca Bioenergética do exercício
 Prof. Paulo Fonseca Bioenergética do exercício O exercício é uma atividade ativa, portanto, demanda muita energia. Durante o exercício, a demanda energética do muculo esquelético aumenta consumindo uma
Prof. Paulo Fonseca Bioenergética do exercício O exercício é uma atividade ativa, portanto, demanda muita energia. Durante o exercício, a demanda energética do muculo esquelético aumenta consumindo uma
DIABETES MELLITUS. Prof. Claudia Witzel
 DIABETES MELLITUS Diabetes mellitus Definição Aumento dos níveis de glicose no sangue, e diminuição da capacidade corpórea em responder à insulina e ou uma diminuição ou ausência de insulina produzida
DIABETES MELLITUS Diabetes mellitus Definição Aumento dos níveis de glicose no sangue, e diminuição da capacidade corpórea em responder à insulina e ou uma diminuição ou ausência de insulina produzida
Métodos de determinação da Massa Molecular
 Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
