Farmacologia Exercícios Teórico práticos
|
|
|
- Sabina Garrau Custódio
- 8 Há anos
- Visualizações:
Transcrição
1 UNIVERSIDADE DO MINHO DEPARTAMENTO DE BIOLOGIA Farmacologia Exercícios Teórico práticos Licenciatura em Optometria e Ciências da Visão Autores: Sandra Cristina Almeida Paiva e Sofia Alexandra Ferreira Duarte 2011
2 Aula TP1. Cálculos farmacêuticos. Formas de expressar a concentração. Na farmacologia, é essencial saber manipular, preparar ou administrar soluções. Para tal os alunos devem estar familiarizados com as diferentes formas nas quais as soluções podem estar expressas. As soluções são definidas como misturas homogéneas de duas ou mais substâncias, cujas propriedades dependem da composição e da natureza dos seus componentes e que podem existir no estado sólido, líquido ou gasoso. Numa solução o soluto é o componente da solução que se encontra presente em menor quantidade enquanto que o solvente é o componente da solução que se encontra presente em maior quantidade. A água é um solvente extraordinariamente adequado para solutos iónicos e polares e as soluções resultantes são chamadas soluções aquosas. Para caracterizar a composição de uma solução é essencial determinar a quantidade relativa dos seus componentes e à qual se dá o nome de concentração. Esta pode ser expressa de diferentes modos, conforme o fim em vista, sendo os mais comuns: Molaridade - número de moles de soluto por litro de solução. É a unidade mais comummente usada. Percentagem (% p/v) - gramas de soluto por 100 ml de solução Percentagem (% v/v) - volume de soluto por 100 ml de solução Percentagem (% p/p) gramas de soluto por 100 gramas de solução. Esta unidade é frequentemente usada em soluções concentradas, tipicamente ácidos ou bases. Nº de moles (n) = massa (g) / peso molecular (g/mol) Concentração inicial (Ci) x Volume inicial (Vi) = Concentração final (Cf) x Volume final (Vf) Conversões de unidades úteis na preparação de soluções: 1 cm 3 = 1 ml 1 dm 3 = 1 L 1L = 1000 ml 1 dm 3 = 1000 cm 3 1 g = 1000 mg 2
3 Exercícios TP1 1. Quantas gramas de sulfato de sódio (Na 2 SO 4 ) são precisas para preparar 250 ml de uma solução de concentração 0,68 M? M (Na 2 SO 4 ) = 142,05 g/mol. 2. Como preparar 500 ml de uma solução de ácido nítrico (HNO 3 ) com uma concentração de 1,75 M a partir de uma solução stock de 8,61 M?. 3. Como preparar 100 ml de uma solução de ácido clorídrico (HCl) 3 M a partir de uma solução stock de 37% (p/p) (ρ = 1,19 g/cm 3 )? Qual é a molaridade inicial da solução de HCl? M (HCl) = 36,5 g/mol. 4. Como preparar 500 ul de uma solução de ácido clorídrico (HCl) 0,5mM a partir de uma solução stock de 37% (p/p) (ρ = 1,19 g/cm 3 )? Qual é a molaridade inicial da solução de HCl? M (HCl) = 36,5 g/mol. 5. Calcular a molaridade da solução obtida por adição de 20 cm 3 de uma solução 0,40 M de NaOH a 80 cm 3 de uma solução 0,20 M de NaOH. 3
4 Aula TP2. Cálculos farmacêuticos. Formas de expressar a concentração - Percentagem A percentagem constituí uma parte essencial dos cálculos farmacêuticos. Todas as pessoas que lidam com fármacos usam muitas vezes este meio como um modo apropriado para expressar a concentração de um material activo ou inactivo numa preparação farmacêutica. Exercícios TP2 1. Uma solução aquosa de ácido metanóico (HCOOH) (ρ = 1,18 g/cm 3 ) tem 80% (p/p) em massa de ácido puro. Determinar o volume de solução mãe necessário para preparar 250 cm 3 de uma solução com concentração de 1 M. M (HCOOH) = 46,03 g/mol. 2. Um paciente recebeu 0,5 ml de solução de lidocaína a 2% (p/v). Quantos mg de lidocaína o paciente recebeu? 3. Num hospital, foi preciso administrar a um paciente 300 ml de soro fisiológico (solução 0,9% p/v) mas lá só tinha frascos de 100 ml contendo solução de cloreto de sódio a 2% (p/v). Como se pode contornar o problema? 4. Foi necessário anestesiar com Thionembutal um paciente. Cada ampola de Thionembutal contém 1 g que deve ser diluído com 20 ml de água destilada estéril. Calcular a concentração final em % (p/v) na ampola. 5. Um paciente adquiriu numa farmácia AMOXIL que veio armazenado num frasco contendo 6 g na forma de pó. Para fazer a suspensão, adicionou 60 ml de água filtrada como sugerido pelo fabricante. A posologia recomendada pelo médico foi de 5 ml de 8 em 8 horas. Quantas mg de AMOXIL o paciente tomou a cada 8 horas? E em 10 dias de tratamento quantas gramas tomou? 4
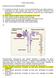
5 Aula TP3. Introdução à Farmacocinética Biodisponibilidade A farmacocinética estuda a absorção, distribuição, metabolismo e eliminação (ADME) dos fármacos. Antes de um fármaco poder ser absorvido por um determinado sistema biológico, tem que ser libertado da sua forma de dosagem (por exemplo um comprimido) e dissolvido nos fluidos biológicos. A disponibilidade biológica de um fármaco depende de vários factores incluindo as características físicas e químicas do fármaco, as características da forma de dosagem (por exemplo a natureza dos ingredientes adicionais que compõem a formulação farmacêutica), e o método de confecção do fármaco. A área de estudo que lida com as propriedades dos fármacos e as formas de dosagem que influenciam a libertação do fármaco para exercer actividade biológica é a biofarmacêutica. O termo biodisponibilidade referese à fracção da dose de fármaco administrada que entra na circulação sistémica numa forma não alterada. Quando os estudos de dissolução ou absorção de um determinado fármaco demonstram consistentemente que apenas uma fracção de fármaco numa determinada forma de dosagem (por exemplo um comprimido) se encontra disponível para absorção biológica, o factor de biodisponibilidade do fármaco F (percentagem decimal de fármaco disponível) pode ser usado para determinar a fracção de fármaco biodisponível. Por exemplo, se 100 mg de um fármaco forem administrados a um paciente e apenas 70 mg atingem a circulação sistémica então F é 0,7, ou a biodisponibilidade desse fármaco 70%. Após a administração de um medicamento, amostras sanguíneas podem ser recolhidas do paciente em intervalos de tempo específicos, e o seu conteúdo em fármaco analisado. Os dados resultantes podem ser apresentados graficamente de modo a obter um gráfico da concentração do fármaco no sangue (ou plasma) em função do tempo. Tipicamente, o eixo vertical apresenta a concentração de fármaco no sangue e o eixo horizontal os tempos para os quais foram obtidas as amostras após administração do fármaco. Quando o fármaco foi administrado (tempo zero), a concentração no sangue também deverá ser zero. Assim que um fármaco administrado oralmente passa pelo estômago e/ou intestino, é libertado da sua forma de dosagem, e dissolve-se totalmente ou parcialmente, e é absorvido. Com a continuação, as amostras de sangue revelam concentrações aumentadas de fármaco até atingirem um pico máximo de concentração (C máx ). Depois, os níveis sanguíneos de fármaco decrescem progressivamente e se não é administrado mais fármaco 5
6 poderá eventualmente baixar para zero. Para formas de dosagem convencionais como comprimidos e cápsulas, a C máx ocorre num único ponto de tempo referido como T máx. A quantidade de fármaco é normalmente expressa em termos da sua concentração em relação a um volume específico de sangue ou plasma. A quantidade de dose administrada e a sua biodisponibilidade, dissolução e absorção influenciam a sua concentração sanguínea. A taxa ou velocidade a que um fármaco é absorvido determina o T máx, o tempo de maior concentração no sangue após administração; quanto mais rápida a taxa de absorção, mais cedo será atingido o T máx. Neste exemplo, a C máx é 4 µg/ml e o T máx 2 horas. Num gráfico da concentração de fármaco versus tempo, a area under the curve (área sob ou debaixo da curva da concentração versus tempo) ou AUC é considerada representativa da quantidade total de fármaco absorvido na circulação sistémica. A biodisponibilidade (F) de um fármaco pode ser determinada pela razão entre a AUC para uma forma de dosagem particular e a AUC para a forma intravenosa, uma vez que por definição a extensão de absorção de um fármaco administrado intravenosamente é de 100%, uma vez que todo o fármaco administrado entra em circulação. F = AUC outra forma dosagem / AUC forma intravenosa F = (AUC outra forma dosagem / AUC forma intravenosa) x (dose intravenosa / dose outra forma de dosagem) 6
7 Dois fármacos dizem-se bioequivalentes se possuem biodisponibilidades comparáveis e tempos similares para atingirem concentrações máximas no sangue. A biodisponibilidade de um fármaco pode variar quando se encontra em formas de dosagem diferentes ou na mesma forma de dosagem mas elaboradas em diferentes laboratórios. Logo pode ser necessário calcular doses equivalentes de dois produtos não equivalentes (que possuam diferentes biodisponibilidades). Exercícios TP3 1. Os dados seguintes de dissolução foram obtidos para uma cápsula de ampicilina de 250 mg. Fazer o gráfico da concentração versus o tempo e determinar a percentagem aproximada de ampicilina aos 15, 30 e 45 minutos de estudo. Período (minutos) Ampicilina dissolvida (mg) Se o factor de biodisponibilidade (F) de um determinado fármaco na sua forma de dosagem é 0,60, quantas miligramas de fármaco estarão disponíveis para absorção de um comprimido de 100 mg? 3. Se a biodisponibilidade (F) da digoxina num comprimido de 0,25 mg é 0,60 comparado com a biodisponibilidade de um elixir de digoxina (0,05 mg/ml) que é 0,75, calcular a dose de elixir equivalente ao comprimido. 4. Se a AUC de uma dose de um fármaco administrada sob a forma de comprimido oralmente é 4,5 µg/ml x h e a dose administrada intravenosamente é 11,2 µg/ml x h, calcular a biodisponibilidade da dose oral do fármaco. 7
8 5. Um doente hospitalizado recebeu 50 mg de ranitidina (ZANTAC) por injecção intravenosa a cada 8 horas. Após receber alta do hospital, o médico quer que o paciente continue o tratamento com uma dose equivalente da forma liquida e que é administrada oralmente de ranitidina. Através de dados da literatura o médico verificou que a ranitidina no líquido se encontra 50% biodisponível. O produto encontra-se disponível numa concentração de 75 mg/5 ml a ser administrado duas vezes por dia. Quantos mililitros do liquido a administrar oralmente deverão ser prescritos por dia na receita médica? 6. Se o factor de biodisponibilidade F para um comprimido de 100 mg é 0,70 comparado com o factor de biodisponibilidade de 1,0 para uma injecção do mesmo fármaco, quantos mililitros de injecção contendo 40 mg/ml serão consideradas equivalentes ao comprimido? 7. Se um elixir de 5 ml contendo 2 mg/ml de um fármaco é equivalente a um comprimido de 15 mg com um factor de biodisponibilidade de 0,60, qual é o factor de biodisponibilidade (F) do elixir? 8. Se um fármaco de 500 mg é administrado oralmente e 300 mg são absorvidas, calcular o factor de biodisponibilidade. 9. Num ensaio de biodisponibilidade comparada foram administrados a 24 voluntários sãos 3 formulações de fluoxetina. De acordo com os dados apresentados na tabela, determine o a biodisponibilidade do fármaco quando administrado sob a forma de comprimido ou sob a forma de elixir. Dose (mg/kg) AUC 0-24 (mcg/l)/h Elixir 2,0 7,59 Comprimido 2,0 6,55 Solução Intravenosa 0,2 0, Doze mg de um fármaco foram administradas intravenosamente a um paciente. A AUC 0-12 foi calculada como sendo 10 µg.min/ml. Noutra ocasião, 50 mg de fármaco foram administrados oralmente sob a forma de comprimido ao mesmo paciente e a AUC 0-12 calculada foi de 8 µg.min/ml. Calcular a biodisponibilidade oral. 8
9 Aula TP4. Farmacocinética Absorção de fármacos A farmacocinética estuda a absorção, distribuição, metabolismo e excreção (ADME) dos fármacos. Na maior parte dos casos, os fármacos têm que atravessar as membranas celulares para acederem aos seus locais de acção. O primeiro dos processos a entrar em jogo é a absorção, considerada não como o desaparecimento do fármaco mas sim a sua entrada na circulação sistémica. A facilidade com que um fármaco atravessa as membranas celulares é a chave para aceder à velocidade e extensão da absorção e distribuição do fármaco através de compartimentos múltiplos do corpo. Existem vários factores que afectam a facilidade com que um fármaco atravessa as membranas e que influenciam a absorção: a carga, polaridade, peso molecular e lipossolubilidade. Dado que as membranas são compostas por uma bicamada lipídica e portanto são fortemente hidrofóbicas, são favorecidas as moléculas sem carga, apolares, de baixo peso molecular e solúveis em lípido, a atravessarem as membranas. Muitos fármacos são ácidos ou bases fracas. Em solução, os ácidos e as bases fracos ionizam-se parcialmente e existem em equilíbrio com o H + e A - ou H + e B produzidos pela dissociação: Logo, no inicio, a % de HA ou BH + em solução será 100, há medida que a ionização ocorre e que o equilíbrio é atingido, a % de HA ou BH + será igual a 100-x em que o x corresponderá à % de H + e A - formados, para o caso dos ácidos fracos ou de H + e B formados, para o caso das bases fracas. Tal como acima referido, o fármaco desloca-se mais facilmente através das membranas celulares se se encontrarem na forma sem carga, HA para ácidos fracos e B para bases fracas. Sendo assim as formas A - e BH + não permeiam as membranas. Deste modo, a concentração efectiva da forma permeável (HA ou B) de cada fármaco no seu local de absorção, é determinada pelas concentrações relativas das formas com carga e sem carga. A razão entre as duas formas [A - ] / [HA] ou [B] / [BH + ], por sua vez, é determinada pelo ph no local de absorção e pela força do ácido ou base fracos que é representada pelo pka. A relação entre o pka e a razão das concentrações ácido-base e ph do local de absorção pode ser obtida usando a 9
10 equação de Henderson - Hasselbach: ph = pka + log ([forma não protonada] / [forma protonada]), logo: ph = pka + log([a - ] / [HA]), para ácidos fracos ph = pka + log([b] / [BH + ]), para bases fracas Esta equação é muito útil para determinar a quantidade de fármaco que será encontrada entre dois compartimentos que diferem no ph. A gama de ph dos fluidos corporais varia entre 1 e 8. Por exemplo para um fármaco acídico com pka = 6, a equação de Henderson Hasselbach permite determinar o grau de ionização no estômago (ph = 1) e no sangue (ph = 7,4): No estômago: 1 = 6 + log ([A - ] / [HA]) <=> -5 = log ([A - ] / [HA]) <=> 10-5 = [A - ] / [HA] <=> [A - ] / [HA] = 0,00001; se [HA] = 1, então [A - ] é 0,00001, o que significa que no estômago o fármaco se encontra muito pouco ionizado. No sangue: 7,4 = 6 + log ([A - ] / [HA]) <=> 1,4 = log ([A - ] / [HA]) <=> 10 1,4 = [A - ] / [HA] <=> [A - ] / [HA] = 25; se [HA] = 1, então [A - ] é 25; o que significa que o composto se encontra significativamente ionizado. Logo este fármaco encontrase pouco ionizado no estômago mas apreciavelmente no sangue. Sendo assim, o fármaco deverá atravessar facilmente do estômago para o sangue mas dificilmente na direcção oposta. 10
11 Exercícios TP4 1. Colocar por ordem crescente de absorção de um determinado fármaco (cujo pka é 3,5 e sabendo que se comporta como um ácido fraco) nos seguintes fluidos do organismo: urina ph = 1,6; suco gástrico ph = 1,4 e leite materno ph = 6,8. 2. Determinar a razão das fracções ionizadas do ácido valpróico (pka = 5), em conteúdo gástrico normal (ph = 3) e em situação de acloridria (ph = 7). 3. A fracção não ionizada de um fármaco alcalino com pka = 8, entre o ph 9 de uma formulação líquida em ampola de vidro âmbar e o ph do plasma (ph = 7,4): a. Diminuirá para metade b. Aumentará cerca de 5 vezes c. Diminuirá cerca de 5 vezes d. Aumentará para metade 4. Considere um fármaco básico com um pka = 6,8. Sabendo que o ph do estômago é igual a 3 e que o ph do duodeno é igual a 6,9, a percentagem de fármaco dissolvido, após administração de um comprimido: a. Será superior no estômago b. Será superior no duodeno c. É idêntica no estômago e no duodeno d. Nestas condições, o fármaco não será dissolvido 5. Qual é a percentagem aproximada de um ácido fraco (pka = 5,4) na forma não ionizada no plasma (ph de 7,4)? 6. Um fármaco cuja ionização permite a difusão do intestino (ph = 8,4) para o sangue (ph = 7,4) comporta-se como um ácido fraco (pka = 6,4) ou como uma base fraca (pka = 8,4)? 7. Indique se as seguintes afirmações são verdadeiras ou falsas a. A aspirina (pka = 3,5) está 90% na sua forma lipossolúvel e protonada a ph = 2,5. b. O fármaco básico prometazina (pka = 9,1) encontra-se mais ionizado a ph 7,4 do que a ph 2. 11
12 8. Atendendo às características dos seguintes fármacos: fenobarbital (pka = 7, ácido fraco); ácido acetil salicílico (pka = 3, ácido fraco) e aftamina (pka = 9, base fraca), representar graficamente a percentagem não ionizada dos mesmos em função da variação do ph. 12
13 Aula TP5. Exercícios de revisão parte I 1. Uma solução oftálmica contém 25 µg/100 µl de substância activa TPA. a. Calcular a % (p/v) de TPA na solução. b. Que volume de uma solução contendo TPA a 50 mg/50 ml deverá ser usado em 100 µl da solução oftálmica? 2. Uma fórmula de gotas dos olhos contém 54 mg de antipirina e 14 mg de benzocaína por cada ml de solução. Calcular a % (p/v) de cada ingrediente na fórmula. 3. Observe a seguinte prescrição farmacêutica de uma solução oftálmica: Lactobionato de eritromicina 500 mg Fosfato de sódio dexametasona 100 mg Glicerina 2,5 ml Água esterilizada perfazer até 100 ml Qual a percentagem (p/v) de lactobionato de eritromicina na prescrição farmacêutica? mg de um fármaco foi dado oralmente sob a forma de um comprimido a um paciente de 6 em 6 horas. A fracção biodisponível do fármaco sob a forma de comprimido é de 50%. Qual a quantidade biodisponível em gramas tomada pelo paciente após 3 dias? 5. Considere um fármaco básico com um pka = 7,8. No momento em que a razão entre quantidade ionizada e não ionizada é a 0,666, qual é o ph do fluído em questão? 6. Qual será a razão das concentrações da forma não ionizada de um fármaco que se comporta como um ácido fraco (pka = 6,4) entre o intestino (ph = 8,4) e o plasma sanguíneo (ph = 7,4)? 13
14 Exercícios de revisão parte II 1. Uma cápsula de um determinado fármaco contém 300 mg de fosfato de clindamicina. Se um farmacêutico dissolver o conteúdo de 8 cápsulas em 60 ml de um líquido adstringente para preparar uma solução tópica, qual será a percentagem (p/v) de fosfato de clindamicina na solução tópica? 2. Um farmacêutico adicionou 10 ml de uma solução de um fármaco a 20% (p/v) a 500 ml de uma infusão. Qual é a percentagem do fármaco na infusão? 3. Observe a seguinte prescrição farmacêutica de uma solução oftálmica: Citrato de fentanil 20 µg/ml Hidrocloreto de bupivacaina 0,125% (p/v) Cloreto de sódio (0,9% - p/v) 100 ml Qual a percentagem (p/v) de citrato de fentanil na prescrição farmacêutica? 4. Para um determinado fármaco, a AUC 0-24 para uma dose de 200 mg administrada intravenosamente é de 20 µg.min/ml e para uma dose de 0,5 g administrada oralmente sob a forma de comprimido é 10 µg.min/ml. Calcule a biodisponibilidade do fármaco administrado sob a forma de comprimido. 5. O ph do estômago é 2,5. O pka do pentotal de sódio (anestésico) é 7,4 e comportase como um ácido fraco. Se uma dose oral for administrada a um paciente, o paciente adormecerá? (O paciente adormecerá se o fármaco for completamente absorvido no estômago e entrar 100% no sangue, ou seja, se no estômago se encontrar 100% na forma não ionizada) 6. Qual será a razão das concentrações da forma não ionizada de um fármaco que se comporta como um ácido fraco (pka = 5,0) entre o plasma sanguíneo (ph = 7,4) e o estômago (ph = 1,4)? 14
15 Aula TP6. Cálculo de parâmetros farmacocinéticos para doses únicas A farmacocinética desempenha um papel fulcral no estabelecimento de um regime de dosagem ou no ajustamento de um regime de dosagem já estabelecido, de modo a aumentar a eficiência de um fármaco ou reduzir os sintomas de toxicidade. Se um determinado fármaco é administrado intravenosamente e amostras de sangue são recolhidas periodicamente e a concentração em fármaco não modificado analisada, obtém-se um resultado similar ao da Fig. 1: Figura 1. Gráfico da concentração de um fármaco administrado por via intravenosa ao longo do tempo. A concentração será máxima poucos minutos após a injecção, após a distribuição do fármaco através do sistema circulatório se encontrar equilibrada. O fármaco deixa a circulação sanguínea através de vários processos: 1) distribuição através das membranas para tecidos ou outros fluidos corporais; 2) excreção do fármaco não alterado por vias renais ou biliares; 3) metabolismo em outros compostos activos ou inactivos; 4) evaporação através da via pulmonar se o fármaco for volátil. Alguma parte do fármaco pode ligar-se a proteínas plasmáticas ou outros constituintes; ou ainda a tecidos mas em qualquer um destes casos, o equilíbrio da ligação é rapidamente atingido. O gráfico da Fig. 1 também pode ser apresentado num formato linear se as concentrações estiverem numa escala logarítmica, com os pontos terminais numa linha recta (Fig. 2). A fase α representa a fase de distribuição na qual ocorre uma distribuição rápida do fármaco através de membranas e em regiões corporais. Na fase β a distribuição é ultrapassada pela eliminação que é a principal responsável pela diminuição da concentração plasmática do fármaco modelo de dois compartimentos. 15
16 Figura 2. Gráfico do logaritmo da concentração de um fármaco administrado por via intravenosa ao longo do tempo. No caso de um fármaco que é administrado oralmente o gráfico da concentração versus o tempo é diferente do gráfico para um fármaco administrado intravenosamente apenas durante a fase de absorção (Fig. 3). Os dois gráficos (dose oral e dose intravenosa) tornam-se similares para as fases pós-absorção ou fase de eliminação. Figura 3. Gráfico da concentração de um fármaco administrado por via oral ao longo do tempo. Para um fármaco que é administrado oralmente, inicialmente não existe fármaco no plasma uma vez que a preparação tem que ser ingerida, dissolvida e absorvida, no estômago ou intestino, para a circulação sistémica. Geralmente, os fármacos são eliminados através de uma cinética de primeira ordem, na qual uma fracção constante de fármaco é eliminada por unidade de tempo e para este tipo de cinéticas, o gráfico da concentração versus o tempo segue uma exponencial negativa e o gráfico resultante do logaritmo da concentração versus o tempo é uma linha recta. Numa cinética de primeira ordem a taxa de eliminação aumenta directamente com o aumento da concentração de fármaco no sangue. 16
17 Cálculo de parâmetros farmacocinéticos Experimentalmente, a informação derivada dos perfis da concentração de fármaco versus o tempo a partir da fase β permitem obter parâmetros farmacocinéticos importantes volume de distribuição, tempo de meia-vida e clearance ou depuração. Este parâmetros são usados para determinar regimes de dosagem. O volume aparente de distribuição (Vd) é um volume hipotético de fluido corporal (extra ou intracelular) no qual o fármaco está dissolvido e é distribuído, uma vez que o volume real no qual as moléculas de fármaco são distribuídas não pode ser determinado. É obtido através da razão entre a concentração de fármaco administrada intravenosamente (dose administrada - D) e a concentração de fármaco no sangue ou plasma (C P ): Vd = D / C P. O volume de distribuição pode ser expresso como um simples volume ou como percentagem do peso corporal. Dados experimentais para a maioria dos fármacos indicam que as taxas de eliminação, absorção e distribuição são geralmente directamente proporcionais à concentração seguindo uma cinética de primeira ordem já descrita na secção anterior. A constante de eliminação (kel) corresponde à fracção de fármaco eliminada por unidade de tempo e equivale ao declive da recta do gráfico do logaritmo da concentração do fármaco versus o tempo. Pode ser determinada através da seguinte equação: kel = 0,693 / t1/2, em que t1/2 é o tempo de meia vida do fármaco. O tempo de meia vida (t1/2) é o tempo que demora a que a concentração plasmática do fármaco seja reduzida para metade da concentração inicial (50%). A clearance (CL) é definida como o volume de plasma do qual o fármaco é completamente removido por unidade de tempo (unidades volume por tempo). A clearance total de um fármaco é igual à soma das clearances efectuadas por cada órgão envolvido na eliminação (fígado, rim, entre outros). Conhecendo o tempo de meia vida e o volume de distribuição a clearance pode ser determinada da seguinte forma: CL = 0,693 x Vd / t1/2. Resumindo, calculando o declive da recta do gráfico da concentração versus o tempo, que nos dá a constante de eliminação kel, é possível calcular o tempo de meia vida t1/2, a clearance CL e o volume de distribuição Vd. 17
18 Adaptado de Volume de distribuição: Vd = D / C P Constante de eliminação: kel = 0,693 / t1/2 Clearance ou depuração: CL = 0,693 x Vd / t1/2 18
19 Exercícios TP6 1. Um paciente recebeu uma dose intravenosa de 300 mg de um fármaco que produziu uma concentração imediata no sangue de 8,2 µg/ml. Calcule o volume de distribuição aparente. 2. Após 4 horas da administração intravenosa de um fármaco a um paciente pesando 70 Kg, a concentração sanguínea foi de 10 µg/ml. Assumindo que o volume de distribuição aparente é 10% do peso corporal, calcule a quantidade de fármaco total em miligramas administrada. 3. Um paciente recebeu uma dose intravenosa de um fármaco de 10 mg. Uma amostra sanguínea foi recolhida e continha 40 µg/100 ml. Calcular o volume aparente de distribuição do fármaco. 4. Um paciente recebeu 12 mg de um fármaco intravenosamente e amostras de sangue foram analisadas em intervalos de tempo específicos tal como indicado na tabela abaixo. Desenhe o gráfico em escala logarítmica e determine a constante de eliminação do fármaco e o seu tempo de meia vida. Concentração plasmática de Tempo (horas) fármaco (µg/ml) 1 26,5 2 17,5 3 11,5 4 7,6 5 5,0 6 3,3 5. Em adultos normais, o sangue constitui aproximadamente 7% do peso corporal. a. Calcule o volume aproximado de sangue em litros para um homem que pese 70 Kg. b. Se o fármaco ZANTAC atingiu um pico de 500 ng/ml no sangue, 2 a 3 horas após administração de uma dose oral, calcule a quantidade total de fármaco em miligramas no sangue no paciente descrito em a) quando o pico foi atingido. 19
20 6. Após administração intravenosa de uma dose de 12 mg de um determinado fármaco, a concentração plasmática pouco tempo após a administração foi de 300 ng/ml. Quatro horas depois, a concentração plasmática foi determinada como sendo 75 ng/ml. Assumindo uma cinética de primeira ordem, determine o tempo de meia vida do fármaco. 7. Apresente graficamente os seguintes dados em escala logarítmica e determine a constante de eliminação do fármaco e o seu tempo de meia vida. Concentração plasmática Tempo (horas) de fármaco (µg/ml) 0,5 8,5 1 6,8 1,5 5,4 2 4,0 2,5 3,2 3 2,5 8. Após administração de uma dose de 30 mg de um fármaco intravenosamente foram obtidos os seguintes resultados: Concentração plasmática Tempo (horas) de fármaco (mg/l) 1 0, ,0100 Assumindo uma cinética de primeira ordem, calcule a constante de eliminação do fármaco e o seu tempo de meia-vida. 20
21 Aula TP7. Cálculo de parâmetros farmacocinéticos para doses múltiplas Infusão intravenosa contínua A maioria dos fármacos são administrados durante um longo período de tempo para obter o efeito terapêutico desejável. Os dois modos principais de administração usados para obter um efeito prolongado são: 1) infusão intravenosa contínua e 2) doses múltiplas discretas segundo um determinado esquema de dosagem. O objectivo de cada um destes modos de administração de fármacos é aumentar a concentração plasmática de fármaco até uma concentração no equilíbrio (Ce) ser atingida, que irá produzir o efeito terapêutico desejado sem provocar toxicidade. Esta concentração no equilíbrio deverá ser mantida durante minutos, horas, dias ou mesmo durante mais tempo, consoante o requerido pela situação clínica. Infusão intravenosa contínua Numa infusão intravenosa contínua, o fármaco é administrado a uma taxa fixa (dose de manutenção). A concentração plasmática do fármaco aumenta gradualmente e depois atinge um plateau, a concentração no equilíbrio (Ce), para a qual a taxa de infusão iguala a taxa de eliminação (Fig. 1). Logo, no equilíbrio: Ce = R0 / (Ke x Vd), em que R0 é a taxa de infusão (ex. mg/min), Ke a constante de eliminação e Vd o volume de distribuição, ou Ce = R0 / CLtotal ou Ce = R0 / (0,693 x Vd / t1/2), em que CLtotal é a clearance total e t1/2 é o tempo de meia vida do fármaco. Figura 1. Perfil típico da variação da concentração plasmática (Cp) de um fármaco ao longo do tempo para uma injecção intravenosa contínua a uma taxa de infusão constante. A Cp(ss) é a concentração no plateau ou no equilíbrio (Ce), onde a taxa de infusão iguala à taxa de desaparecimento do fármaco. Adaptado de 21
22 Exercícios TP7 1. Qual a clearance total (CL) de um fármaco administrado por via endovenosa a uma taxa (R0) de 4 mg/min e que produz uma concentração no equilíbrio (Ce) de 6 mg/l no plasma? 2. A seguinte figura representa a variação da concentração de um fármaco ao longo de 70 minutos de administração de uma infusão contínua a uma taxa de 3 mg/min. a. Calcule a constante de eliminação (Ke), a clearance (CL) e o volume de distribuição do fármaco (Vd). b. Qual a taxa de infusão e a dose a administrar de modo a obter uma concentração no equilíbrio de fármaco de 7 mg/l? 3. Sabendo que a taxa de infusão para um determinado fármaco é 300 µg/min; o tempo de meia vida 15 horas e o volume de distribuição 40 L, qual é a concentração no equilíbrio? 4. Administrando um determinado fármaco a uma taxa de infusão de 150 µg/min e sabendo que a constante de eliminação é igual a 0,046/h e o volume de distribuição a 40 L, qual é o tempo de meia vida, a concentração no equilíbrio e a clearance do fármaco? 5. Sabendo que a taxa de infusão para um determinado fármaco é de 300 µg/min, o tempo de meia-vida 15 horas, a constante de eliminação 0,046/h e o volume de distribuição 40 L, quanto tempo demorará a atingir 50% da concentração no equilíbrio? 22
23 6. Qual será a taxa de infusão de um determinado fármaco necessária para atingir uma concentração no equilíbrio de 25 µg/ml? O tempo de meia-vida é 15 horas e o volume de distribuição 40 L. 7. Para um determinado fármaco sabe-se que a concentração no equilíbrio é 0,3 mg/l, o volume de distribuição 0,4 L/Kg e o tempo de meia vida 1,5 horas. a. Determine qual a dose inicial e a dose de manutenção (taxa de infusão) a administrar intravenosamente, para atingir a concentração no estado de equilíbrio num paciente com 71 Kg. b. Sabendo que a concentração no equilíbrio será alcançada após 5 meias vidas qual será o tempo necessário para a atingir? 8. Após administração de 6 mg/kg de teofilina por via intravenosa num paciente de 60 Kg, encontrou-se uma meia-vida plasmática de 8 h e uma concentração máxima inicial (Cp) equivalente a 20 mg/l. a. Calcule o volume de distribuição da teofilina neste paciente. b. Calcule a clearance total da teofilina. c. Após cessação do tratamento no quarto dia, qual será a dose de manutenção (taxa de infusão) pela via endovenosa necessária para obter, neste paciente, uma concentração plasmática de 15 mg/l? 23
24 Concentration (mg/l) Farmacologia Aula TP8. Cálculo de parâmetros farmacocinéticos para doses múltiplas regime de dosagem Regime de dosagem Na dosagem múltipla discreta, o tamanho da dose e o tempo entre doses (T) são fixos. Duas considerações são importantes na selecção de T. Intervalos menores resultam em flutuações mínimas da concentração de fármaco no plasma, no entanto o intervalo deverá ser um número de horas standardizado de modo a assegurar o acompanhamento adequado pelo paciente. Os intervalos de dosagem de 6, 8, 12 ou 24 horas são os mais usados. Adicionalmente, para a dosagem oral, as miligramas por dose devem ser compatíveis com as existentes sob a forma de comprimidos ou de outras preparações farmacêuticas. O T também é seleccionado de modo a que todo o fármaco da dose anterior desapareça antes da administração da dose seguinte. Sendo assim não há acumulação de fármaco e não será atingido nenhum plateau ou estado de equilíbrio (Fig. 1). Figura 1. Perfil típico da variação da concentração plasmática de um fármaco administrado num esquema de dosagem múltipla. O intervalo de tempo (T) entre a administração das doses, é longo o suficiente de tal modo que cada dose administrada desaparece completamente antes da administração da dose seguinte. Adaptado de Human Pharmacology: Molecular to Clinical, 3 rd edition. Se é desejável uma concentração de equilíbrio, o T deverá ser diminuído de modo a que o fármaco da dose anterior se encontre ainda presente quando a dose seguinte é administrada. Desta forma, a concentração plasmática aumenta 24
25 Concentration (mg/l) Farmacologia gradualmente até que o fármaco perdido por eliminação durante T seja igual à dose de fármaco adicionado no início de T. Quando esta equitabilidade é alcançada, a concentração média para T é Ce (Fig. 2). Ce Figura 2. Perfil típico da variação da concentração plasmática de um fármaco administrado num esquema de dosagem múltipla. O T é muito mais pequeno de tal modo que a dose da última administração ainda se encontra presente aquando da administração da dose seguinte. Isto resulta numa acumulação do fármaco com a Ce a representar a concentração média do fármaco no plateau, no qual a taxa média de entrada do fármaco iguala a taxa média de desaparecimento do fármaco para cada T. Adaptado de Human Pharmacology: Molecular to Clinical, 3 rd edition. A taxa média (sobre o intervalo da dose) de entrada de fármaco é constante para D/T. A taxa de desaparecimento do fármaco é muito pequena durante o primeiro T mas aumenta com a concentração de fármaco durante os intervalos seguintes até que a taxa média de desaparecimento seja igual à taxa média de entrada de fármaco. Para uma acumulação significativa de fármaco, o T deverá ser pelo menos tão pequeno como a meia vida e de preferência ainda menor. Deste modo: Ce = (D/T) / CL, sendo D/T a taxa de entrada de fármaco e CL a clearance. Através desta equação é evidente que o tamanho da dose e a duração de T pode ser alterada de modo a modificar a concentração no equilíbrio. Para uma dose oral: Ce = (F x D/T) / CL, em que F é a biodisponibilidade. 25
26 Exercícios TP8 1. Um paciente de 59 anos e com 70 Kg necessitou de fazer ampicilina durante 10 dias. Se se administrar uma dose oral de 1 g de 8 em 8 horas, e se t1/2 = 1,2 h; Vd = 0,28 L/Kg e F = 0,4, reflicta sobre a seguinte afirmação: Estará a ser administrada uma dose adequada se pretendermos uma concentração no equilíbrio (Ce) de 11 µg/ml. 2. Para um determinado fármaco sabe-se que a concentração no equilíbrio é igual a 0,3 mg/l, o Vd 0,4 L/Kg e o t1/2 1,5 horas. Sabendo que esse mesmo fármaco possui uma biodisponibilidade oral de 23%, calcule a dose a administrar e a dose de manutenção por via oral num regime de 6/6 h, 8/8h e 12/12 horas a um paciente de 71 Kg. 3. Um paciente com 60 Kg, com asma, começou um regime oral de aminofilina. Sabendo que: F (biodisponibilidade) = 1; Vd = 0,5 L/Kg; CL = 40 ml/hr/kg e que uma dose de 100 mg do fármaco está a ser administrado de 8 em 8 horas, calcule a sua concentração no equilíbrio. 4. Uma dose de 100 mg de um fármaco está a ser administrada oralmente a um paciente com 70 Kg, a cada 6 horas. A fracção biodisponível é de 50%. O fármaco é eliminado por uma cinética de primeira ordem, com uma meia vida de 6 horas. O volume de distribuição é 0,7 L/Kg. Qual a concentração no equilíbrio? 5. Se desejar atingir a concentração no equilíbrio do exercício anterior intravenosamente, que dose administraria? 6. A um paciente foi administrado o antibiótico gentamicina a cada 8 horas. Após o equilíbrio ter sido atingido foi determinada uma concentração plasmática de 6,8 mg/ml. A concentração, 7 horas após ter sido atingido o equilíbrio, foi de 1,7 mg/ml. Determine a constante de eliminação da gentamicina neste paciente. 7. A dose normal de administração de um determinado fármaco é de 5 g/dia. Sabendo que a clearance para este fármaco é de 12,5 ml/min., qual será a sua concentração no equilíbrio? 26
27 8. Um novo antibiótico (5 mg/kg) foi administrado por via intravenosa ao longo de 30 minutos a um voluntário com 70 Kg. A concentração plasmática do fármaco foi medida em vários tempos após a administração, como indicado na tabela abaixo. Tempo após administração (h) Concentração plasmática do fármaco (mg/ml) , ,8 2 4,6 3 3,7 4 3,0 5 2,4 6 1,9 8 1,3 a. Desenhe o gráfico da concentração de fármaco em função do tempo para este antibiótico. b. Determine a constante de eliminação, o tempo de meia vida e a clearance total do antibiótico neste paciente. 27
28 Aula TP9. Distribuição e eliminação de fármacos A distribuição de fármacos é o processo através do qual o fármaco deixa de uma forma reversível a corrente sanguínea e entra no fluído extracelular e/ou nas células dos tecidos. A passagem de um fármaco para o interstício depende do fluxo sanguíneo, da permeabilidade dos capilares, do grau de ligação a proteínas plasmáticas e da hidrofobicidade relativa do fármaco. Após entrada na circulação sistémica, uma porção da concentração total de fármaco absorvido (C T ) liga-se a proteínas plasmáticas, usualmente a albumina (C B ), enquanto que uma porção de fármaco absorvido mantém-se não ligada ou livre. É a forma livre ou não ligada (C U ) que se encontra disponível para transporte posterior ao seu local de acção no corpo. A razão entre a concentração de fármaco não ligada no plasma e a concentração de fármaco plasmática total (ligada + não ligada) é denominada por alfa (α): α = C U / (C U + C B ) = C U / C T. A eliminação é o processo através do qual ocorre a perda irreversível de fármaco do plasma. Os dois processos envolvidos na eliminação de fármaco são o metabolismo, através do qual o fármaco é convertido em outra espécie química e a excreção, na qual ocorre perda de fármaco na sua forma química não alterada. Os dois órgãos principais envolvidos na eliminação de fármacos são o fígado e o rim. O fígado encontra-se principalmente relacionado com o metabolismo de fármacos, desempenhando um papel minoritário na excreção. Já o rim, encontra-se maioritariamente envolvido na excreção. A forma mais vulgar usada para determinar a importância relativa das duas vias de eliminação de fármacos, é através da administração de uma dose intravenosa do fármaco e recolha de urina durante 5 meias-vidas, na qual se mede a quantidade de fármaco não alterado (o resto é assumido ter sido metabolizado) e esta quantidade é expressa como uma fracção da dose. Esta é denominada por fracção excretada não alterada e pode variar entre <5% (quase todo o fármaco foi metabolizado) a >90% (quase nenhuma quantidade de fármaco foi metabolizada). A fracção de dose metabolizada é a diferença entre 1 e a fracção excretada na forma não alterada. A clearance ou depuração corporal total de um fármaco corresponde à soma das clearances que ocorrem nos diferentes órgãos de eliminação de fármacos, usualmente, sendo os mais comuns o fígado e o rim. A clearance é o parâmetro farmacocinético mais importante uma vez que controla a concentração no equilíbrio. 28
29 As clearances individuais são aditivas logo: clearance total = clearance renal + clearance hepática + (outros). A clearance renal pode ser calculada multiplicando a fracção excretada pela via renal pela clearance total; logo a clearance não renal (usualmente a hepática), é a diferença entre a clearance total e a clearance renal: CLrenal = CLtotal x fracção de fármaco que é eliminado pela via renal CLhepática = CLtotal x fracção de fármaco que é eliminado pela via hepática ou CLhepática = CLtotal - CLrenal A clearance de um fármaco por um qualquer órgão de eliminação é função da taxa de fluxo sanguíneo através desse órgão (taxa de entrada - Q) e da razão de extracção (eficiência da remoção de fármaco - E): CL = Q x E. Por exemplo, para o fígado, a clearance hepática é igual ao produto entre a taxa de fluxo sanguíneo através do fígado (Qh) e a razão de extracção hepática (Eh). E pode variar entre 0 (sem extracção) e 1 (extracção completa). A clearance de qualquer fármaco não poderá exceder a taxa de fluxo sanguíneo através do órgão envolvido na sua eliminação. Para fármacos metabolizados através do fígado, o valor máximo de clearance hepática é 1,5 L/min enquanto para o rim é de 1,2 L/min (fluxo sanguíneo renal). C in Órgão de eliminação C out Eliminação C in e C out são as concentrações de fármaco que entram e deixam o órgão de eliminação, respectivamente. Taxa de entrada = Q x C in, em que Q é o fluxo sanguíneo no órgão de eliminação Taxa de saída = Q x C out Taxa de eliminação = Q x (C in C out ) 29
30 Exercícios TP9 1. Se o valor de α para o fármaco digoxina é 0,70 qual deverá ser a concentração de fármaco livre (C U ) se a concentração no plasma total é 0,7 mg/l? 2. O valor de α para um determinado fármaco no sangue é 0,90 e a concentração de fármaco livre é 0,55 ng/ml. Qual é a concentração de fármaco total (C T ) no corpo? 3. Se no equilíbrio, dois terços da quantidade de um fármaco no sangue estão ligados a proteínas, qual será o valor α do fármaco? 4. Um fármaco é eliminado quase exclusivamente através de metabolismo hepático, enquanto que a excreção renal e biliar de fármaco não alterado contribuem para menos do que 1% da eliminação de fármaco total. Uma via de metabolismo é a glucuronidação, com a excreção de todo o glucuronido através da bílis (o fluxo sanguíneo é 50 ml/h), a uma concentração 110 vezes superior à de fármaco no sangue. O Vd e o t1/2 são 100 L e 9 h, respectivamente. A glucuronidação é a principal via de eliminação? 5. Uma dose de 12 mg de um fármaco foi administrada intravenosamente a um paciente com 60 Kg. Sabendo que t1/2 = 4 h, Vd = 40 L, e que na urina recolhida após 24 h existiam 2% da dose inicial de fármaco, determine a clearance total, a clearance renal e a clearance hepática. 30
31 6. O acebutolol é um fármaco usado no tratamento da hipertensão. Sabendo que Qrenal = 72 L/h e Qhepático = 90 L/h, complete a seguinte tabela: Parâmetro Resultado Dose (mg) 200 F 0,4 fu 0,867 Vd (L) Ke (h -1 ) T1/2 (h) 5,5 %CLrenal 40 %CLnão renal 60 CLtotal (L/h) 20,2 CLhepática (L/h) CLrenal (L/h) Ehepática Erenal 7. A fracção de ácido valpróico excretada na urina sob a forma de metabolitos é de 90% num paciente com 70 Kg. Sabendo que a clearance total do fármaco é 10 ml/hr/kg, qual será a clearance hepática? 8. Um paciente é tratado com o fármaco A que possuí uma elevada afinidade pela albumina e é administrado em quantidades que não excedem a capacidade de ligação da albumina. Um segundo fármaco B é adicionado ao regime de tratamento. O fármaco B também possuí uma afinidade elevada para a albumina mas é administrado em quantidades que são 100 vezes superiores à capacidade de ligação da albumina. Qual das seguintes situações ocorre após administração do fármaco B? Justifique. a. Um aumento das concentrações nos tecidos do fármaco A. b. Uma diminuição das concentrações nos tecidos do fármaco A. c. A adição de mais fármaco A altera significativamente a concentração plasmática de fármaco B não ligado. 31
32 Aula TP10. Farmacodinâmica A farmacodinâmica estuda as acções farmacológicas e os seus mecanismos, resumindo, o que o fármaco faz ao organismo. As respostas farmacológicas são iniciadas pelas interacções moleculares dos fármacos com as células, tecidos ou outros constituintes do corpo. Receptores de fármacos Um receptor de um fármaco é uma macromolécula alvo especializada, presente na superfície celular ou intracelularmente, que se liga ao fármaco e medeia a sua acção farmacológica. Os fármacos podem interagir com enzimas, ácidos nucleicos ou receptores de membrana. Em qualquer um dos casos, a formação de um complexo fármaco-receptor conduz à resposta biológica e a magnitude da resposta é proporcional ao número de complexos fármaco-receptor: fármaco + receptor complexo fármaco-receptor efeito Curvas dose-resposta A magnitude do efeito de um fármaco depende da sua concentração no local do receptor, que por sua vez é determinada pela dose de fármaco administrada e por factores característicos do fármaco, como a taxa de absorção, a sua distribuição e o seu metabolismo. O efeito de um fármaco é mais facilmente analisado traçando o gráfico da resposta versus a dose de fármaco (Fig. 1). Figura 1. Curvas típicas do efeito de um fármaco (resposta) versus a sua concentração para fármacos com diferenças na potência e na eficácia. ED 50 = dose de fármaco que origina 32
33 50% de resposta máxima. Adaptado de Lippincott's Illustrated Reviews: Pharmacology, 2 nd edition. A eficácia corresponde à resposta máxima produzida por um fármaco. Depende do número de complexos fármaco-receptor formados e da eficiência com a qual o receptor activado produz uma acção celular. A afinidade traduz-se como a capacidade de ligação e expressa-se pelo coeficiente de dissociação Kd, que é a concentração de fármaco para a qual se obtém 50% da ligação máxima ao receptor. Afinidade e potência são, na prática, sinónimos pois, nos casos em que o agonista total necessite de ocupar todos os receptores para provocar a resposta máxima teremos Kd = ED 50. A potência também denominada por concentração de dose efectiva é uma medida da quantidade de fármaco requerida para desencadear uma determinada resposta. Quanto menor a dose requerida para desencadear uma determinada resposta, mais potente será esse fármaco. A potência é expressa frequentemente como a dose de fármaco que origina 50% na resposta máxima, ED 50. Um fármaco com um ED 50 baixo é mais potente que um fármaco com um ED 50 elevado. Na figura 1, ambos os fármacos A e B são capazes de induzir a resposta máxima, ou seja, possuem a mesma eficácia, mas o fármaco A é mais potente que o fármaco B, uma vez que para conseguir a resposta máxima necessita de uma concentração menor. Já o fármaco C, é menos potente e menos eficaz que os fármacos A e B. Os agonistas e os antagonistas permitem caracterizar melhor a ligação do fármaco ao seu receptor, permitindo conhecer melhor as características da ligação. Um agonista total é um fármaco que é capaz de produzir num órgão a resposta máxima que esse órgão pode dar como consequência da activação de um determinado sistema de receptores por um ligando endógeno. Ou seja, esse fármaco tem uma eficácia de 100%. Quando um fármaco produz apenas um efeito submáximo no órgão (ou seja, a sua eficácia é superior a zero mas inferior a 100%) esse fármaco é um agonista parcial (a resposta é inferior à da provocada pelo agonista por completo). Um antagonista é um fármaco que apenas ocupa os receptores (apenas possui afinidade), não produzindo qualquer efeito no órgão, isto é, não o activando. A sua eficácia é portanto zero. Estes fármacos, ao ocuparem os receptores, impedem que os agonistas actuem no órgão. Os antagonistas competitivos, são fármacos que interagem com os receptores no mesmo local do agonista, competindo pela mesma ligação que este. Um antagonista competitivo desloca a curva de dose-resposta do agonista para a direita, fazendo com que o fármaco se comporte como se fosse menos 33
34 potente. Os antagonistas não competitivos impedem a ligação do agonista ou impedem a activação do receptor por este. Um antagonista não competitivo diminui a resposta máxima. Exercícios TP10 1. Indique, justificando, se as seguintes afirmações são verdadeiras ou falsas: a. Se 10 mg do fármaco A produz a mesma resposta de 100 mg do fármaco B, então o fármaco A é mais eficaz que o fármaco B. b. Quanto maior a eficácia, maior a potência de um fármaco. c. Na selecção de um fármaco, a potência é mais importante que a eficácia. d. Um antagonista competitivo aumenta ED Observe a seguinte figura: Adaptado de Lippincott's Illustrated Reviews: Pharmacology, 2 nd edition. a. Coloque por ordem crescente de eficácia os fármacos A, B e C. b. Coloque por ordem crescente de potência os fármacos A, B e C. c. Se A e C representarem curvas do mesmo agonista da curva mais à esquerda na presença de um antagonista, de que tipo de antagonismo se trata? 3. As curvas abaixo representam as respostas para uma série de fármacos (A, B, C e D) que se ligam ao mesmo receptor. 34
35 Adaptado de Human Pharmacology: Molecular to Clinical, 3 rd edition. Com base na figura, indique justificando: a. O fármaco que tem maior afinidade. b. O fármaco menos eficaz. c. O fármaco mais potente. 4. Uma paciente com 73 anos, com insuficiência cardíaca congestiva e edemas vai iniciar um tratamento com um diurético (fármaco que promove a excreção renal de sódio e água). Os fármacos X e Y têm o mesmo mecanismo de acção diurética. O fármaco X na concentração de 1nM produz a mesma magnitude de efeito diurético que 10 nm do fármaco Y. Seleccione, justificando, as opções correctas: a. O fármaco X é mais eficaz que o fármaco Y. b. O fármaco X tem uma afinidade 10 vezes superior à do fármaco Y. c. O fármaco X é mais potente que o fármaco Y. 35
36 Aula TP11. Exercícios de revisão 1. Sabendo que a taxa de infusão para um determinado fármaco é 150 µg/min; o tempo de meia vida 15 horas e o volume de distribuição 40 L, determine: a. A concentração no equilíbrio. (Ce = 4,87 mg/l) b. A clearance total. (CLtotal = 1,85 L/h) c. A clearance hepática e renal, sabendo que 30% do fármaco é excretado na urina na forma de metabolitos. (CLhepática = 0,55 L/h; CLrenal = 1,30 L/h) 2. Para o fármaco fenitoína, que é usado no tratamento da epilepsia, a dose a administrar é de 200 mg uma vez por dia. Sabendo que o tempo de meia vida do fármaco é 15 horas, a biodisponibilidade 60% e o volume de distribuição 40 L, determine a sua concentração no equilíbrio. (Ce = 2,71 mg/l) 3. Considere um fármaco com uma clearance renal igual a 97 ml/min e um volume de distribuição de 115 L. Sabendo que a clearance renal é 60% da clearance total determine o tempo de meia vida e a constante de eliminação do fármaco. (T1/2 = 8,2 h; Kel = 0,084 h -1 ) 4. Observe a seguinte figura da variação da concentração plasmática ao longo do tempo para um fármaco administrado intravenosamente por infusão contínua: Adaptado de Determine o tempo de meia vida e a clearance total do fármaco. (T1/2 = 3,46 h; CLtotal = 4,0 L/h) 36
PROF.: FERNANDA BRITO Disciplina Farmacologia. fernandabrito@vm.uff.br
 PROF.: FERNANDA BRITO Disciplina Farmacologia fernandabrito@vm.uff.br EXEMPLOS DE ESQUEMAS COMPARTIMENTAIS DO CORPO TGI COMPARTIMENTO CENTRAL CÉREBRO FÍGADO ELIMINAÇÃO METABÓLICA EXCREÇÃO RENAL OUTROS
PROF.: FERNANDA BRITO Disciplina Farmacologia fernandabrito@vm.uff.br EXEMPLOS DE ESQUEMAS COMPARTIMENTAIS DO CORPO TGI COMPARTIMENTO CENTRAL CÉREBRO FÍGADO ELIMINAÇÃO METABÓLICA EXCREÇÃO RENAL OUTROS
ESTUDO DA FARMACOLOGIA Introdução - Parte II
 NESP UNIVERSIDADE ESTADUAL PAULISTA "JÚLIO DE MESQUITA FILHO UNESP ESTUDO DA FARMACOLOGIA Introdução - Parte II A Terapêutica é um torrencial de Drogas das quais não se sabe nada em um paciente de que
NESP UNIVERSIDADE ESTADUAL PAULISTA "JÚLIO DE MESQUITA FILHO UNESP ESTUDO DA FARMACOLOGIA Introdução - Parte II A Terapêutica é um torrencial de Drogas das quais não se sabe nada em um paciente de que
DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA PERMEABILIDADE DAS MEMBRANAS CELULARES
 DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA FISIOLOGIA ANIMAL II AULA 4 PERMEABILIDADE DAS MEMBRANAS CELULARES CAETANA CARVALHO, PAULO SANTOS 2006 1 INTRODUÇÃO As
DEPARTAMENTO DE ZOOLOGIA FACULDADE DE CIÊNCIAS E TECNOLOGIA UNIVERSIDADE DE COIMBRA FISIOLOGIA ANIMAL II AULA 4 PERMEABILIDADE DAS MEMBRANAS CELULARES CAETANA CARVALHO, PAULO SANTOS 2006 1 INTRODUÇÃO As
 Dose da droga administrada ABSORÇÃO Concentração da droga na circulação sistêmica DISTRIBUIÇÃO ELIMINAÇÃO Droga nos tecidos de distribuição FARMA- COCINÉ- TICA FARMACOCINÉTICA Concentração da droga no
Dose da droga administrada ABSORÇÃO Concentração da droga na circulação sistêmica DISTRIBUIÇÃO ELIMINAÇÃO Droga nos tecidos de distribuição FARMA- COCINÉ- TICA FARMACOCINÉTICA Concentração da droga no
Água e Solução Tampão
 União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
União de Ensino Superior de Campina Grande Faculdade de Campina Grande FAC-CG Curso de Fisioterapia Água e Solução Tampão Prof. Dra. Narlize Silva Lira Cavalcante Fevereiro /2015 Água A água é a substância
2 - Biodisponibilidade. Biodisponibilidade Velocidade e extensão de absorção de um fármaco a partir de uma forma de administração
 2 - Biodisponibilidade TOXICOCINÉTICA Biodisponibilidade Velocidade e extensão de absorção de um fármaco a partir de uma forma de administração Fator de Biodisponibilidade (F) Fração da dose administrada
2 - Biodisponibilidade TOXICOCINÉTICA Biodisponibilidade Velocidade e extensão de absorção de um fármaco a partir de uma forma de administração Fator de Biodisponibilidade (F) Fração da dose administrada
Concentração no local do receptor
 FARMACOCINÉTICA FARMACOCINÉTICA O que o organismo faz sobre a droga. FARMACODINÂMICA O que a droga faz no organismo. RELAÇÕES ENTRE FARMACOCINÉTICA E FARMACODINÂMICA DROGA ORGANISMO FARMACOCINÉTICA Vias
FARMACOCINÉTICA FARMACOCINÉTICA O que o organismo faz sobre a droga. FARMACODINÂMICA O que a droga faz no organismo. RELAÇÕES ENTRE FARMACOCINÉTICA E FARMACODINÂMICA DROGA ORGANISMO FARMACOCINÉTICA Vias
Informação para o paciente
 Informação para o paciente Viramune - nevirapina 18355 BI Viramune brochure POR_V2.indd 1 14-12-11 14:19 Introdução Viramune é um medicamento para o tratamento do HIV. Este prospecto contém informação
Informação para o paciente Viramune - nevirapina 18355 BI Viramune brochure POR_V2.indd 1 14-12-11 14:19 Introdução Viramune é um medicamento para o tratamento do HIV. Este prospecto contém informação
Métodos de determinação da Massa Molecular
 Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Métodos de determinação da Massa Molecular Métodos absolutos a) Massa molecular média em número - Análise de grupos terminais - Elevação ebulioscópica - Depressão crioscópica - Abaixamento da pressão de
Medicamento O que é? Para que serve?
 Medicamento O que é? Para que serve? Os Medicamentos são produtos farmacêuticos, tecnicamente obtidos ou elaborados, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico (Lei nº
Medicamento O que é? Para que serve? Os Medicamentos são produtos farmacêuticos, tecnicamente obtidos ou elaborados, com finalidade profilática, curativa, paliativa ou para fins de diagnóstico (Lei nº
Fisiologia vegetal. Aulas práticas. Departamento de Botânica Faculdade de Ciências e Tecnologia de Coimbra Universidade de Coimbra
 Fisiologia vegetal Aulas práticas Departamento de Botânica Faculdade de Ciências e Tecnologia de Coimbra Universidade de Coimbra 2 Aula 1 Osmose Gradiente osmótico (1 aluno de cada grupo) Osmómetro de
Fisiologia vegetal Aulas práticas Departamento de Botânica Faculdade de Ciências e Tecnologia de Coimbra Universidade de Coimbra 2 Aula 1 Osmose Gradiente osmótico (1 aluno de cada grupo) Osmómetro de
FISIOLOGIA RENAL EXERCÍCIOS DE APRENDIZAGEM
 EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
EXERCÍCIOS DE APRENDIZAGEM FISIOLOGIA RENAL 01. A sudorese (produção de suor) é um processo fisiológico que ajuda a baixar a temperatura do corpo quando está muito calor ou quando realizamos uma atividade
RECOMENDAÇÕES DA ANVISA PARA ALTERAÇÕES PÓS-REGISTRO DE MEDICAMENTOS:
 RECOMENDAÇÕES DA ANVISA PARA ALTERAÇÕES PÓS-REGISTRO DE MEDICAMENTOS: Estas recomendações têm por objetivo orientar o setor regulado e o agente regulador quanto às provas que poderão ser realizadas em
RECOMENDAÇÕES DA ANVISA PARA ALTERAÇÕES PÓS-REGISTRO DE MEDICAMENTOS: Estas recomendações têm por objetivo orientar o setor regulado e o agente regulador quanto às provas que poderão ser realizadas em
Genéricos - Guia Básico. Autor: Cesar Roberto CRF-RJ: 7461
 Autor: Cesar Roberto CRF-RJ: 7461 Versão 3.00 2001 Introdução: Este guia visa a orientar o profissional farmacêutico sobre os genéricos, e como este deve proceder na hora de aviar uma receita nesta nova
Autor: Cesar Roberto CRF-RJ: 7461 Versão 3.00 2001 Introdução: Este guia visa a orientar o profissional farmacêutico sobre os genéricos, e como este deve proceder na hora de aviar uma receita nesta nova
TURMA DE MEDICINA - QUÍMICA
 Prof. Borges / Lessa TURMA DE MEDICINA - QUÍMICA AULA 06 DILUIÇÃO DE SOLUÇÕES Diluir significa adicionar solvente a uma solução que já existe. Este método faz com que o volume de solução aumente e a concentração
Prof. Borges / Lessa TURMA DE MEDICINA - QUÍMICA AULA 06 DILUIÇÃO DE SOLUÇÕES Diluir significa adicionar solvente a uma solução que já existe. Este método faz com que o volume de solução aumente e a concentração
Aluno (a): Professor:
 3º BIM P1 LISTA DE EXERCÍCIOS CIÊNCIAS 6º ANO Aluno (a): Professor: Turma: Turno: Data: / / Unidade: ( ) Asa Norte ( ) Águas Lindas ( )Ceilândia ( ) Gama ( )Guará ( ) Pistão Norte ( ) Recanto das Emas
3º BIM P1 LISTA DE EXERCÍCIOS CIÊNCIAS 6º ANO Aluno (a): Professor: Turma: Turno: Data: / / Unidade: ( ) Asa Norte ( ) Águas Lindas ( )Ceilândia ( ) Gama ( )Guará ( ) Pistão Norte ( ) Recanto das Emas
CÁLCULOS COM MEDICAMENTOS. Professor: Edilberto Antônio Souza de Oliveira
 1 CÁLCULOS COM MEDICAMENTOS Professor: Edilberto Antônio Souza de Oliveira Embora muitos Hospitais trabalhem com as doses dos fármacos personalizadas e prontas para o uso de cada paciente, entretanto,
1 CÁLCULOS COM MEDICAMENTOS Professor: Edilberto Antônio Souza de Oliveira Embora muitos Hospitais trabalhem com as doses dos fármacos personalizadas e prontas para o uso de cada paciente, entretanto,
O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico.
 1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
1 O corpo humano está organizado desde o mais simples até o mais complexo, ou seja, do átomo microscópico ao complexo organismo humano macroscópico. Note essa organização na figura abaixo. - Átomos formam
Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2
 11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
11 Segundo a Portaria do Ministério da Saúde MS n.o 1.469, de 29 de dezembro de 2000, o valor máximo permitido (VMP) da concentração do íon sulfato (SO 2 4 ), para que a água esteja em conformidade com
COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015. Roteiro de estudos para recuperação trimestral
 COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015 Disciplina: Professor (a): QUÍMICA LUÍS FERNANDO Roteiro de estudos para recuperação trimestral Conteúdo: Referência para estudo: Sites recomendados:
COLÉGIO NOSSA SENHORA DE LOURDES 2ª SÉRIE Ensino Médio -2015 Disciplina: Professor (a): QUÍMICA LUÍS FERNANDO Roteiro de estudos para recuperação trimestral Conteúdo: Referência para estudo: Sites recomendados:
UNIVERSIDADE ABERTA DO BRASIL UNIVERSIDADE FEDERAL DA PARAIBA - UFPB VIRTUAL LICENCIATURA EM CIÊNCIAS BIOLÓGICAS A DISTÂNCIA
 UNIVERSIDADE ABERTA DO BRASIL UNIVERSIDADE FEDERAL DA PARAIBA - UFPB VIRTUAL LICENCIATURA EM CIÊNCIAS BIOLÓGICAS A DISTÂNCIA DISCIPLINA BIOQUÍMICA ESTRUTURAL Ministrante: Prof. Dr. Carlos Alberto de Almeida
UNIVERSIDADE ABERTA DO BRASIL UNIVERSIDADE FEDERAL DA PARAIBA - UFPB VIRTUAL LICENCIATURA EM CIÊNCIAS BIOLÓGICAS A DISTÂNCIA DISCIPLINA BIOQUÍMICA ESTRUTURAL Ministrante: Prof. Dr. Carlos Alberto de Almeida
Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos
 SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma MISTURA Quando na mistura tiver apenas
SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma MISTURA Quando na mistura tiver apenas
41 Por que não bebemos água do mar?
 A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
A U A UL LA Por que não bebemos água do mar? Férias no verão! Que maravilha! Ir à praia, tomar um solzinho, nadar e descansar um pouco do trabalho. Enquanto estamos na praia nos divertindo, não devemos
Introdução à Química Inorgânica
 Introdução à Química Inorgânica Orientadora: Drª Karla Vieira Professor Monitor: Gabriel Silveira Química A Química é uma ciência que está diretamente ligada à nossa vida cotidiana. A produção do pão,
Introdução à Química Inorgânica Orientadora: Drª Karla Vieira Professor Monitor: Gabriel Silveira Química A Química é uma ciência que está diretamente ligada à nossa vida cotidiana. A produção do pão,
Formas farmacêuticas líquidas - Soluções
 Formas farmacêuticas líquidas - Soluções Preparações líquidas: Podem conter uma ou mais substâncias químicas dissolvidas em solvente adequado ou em mistura de solventes mutuamente miscíveis ou dispersíveis.
Formas farmacêuticas líquidas - Soluções Preparações líquidas: Podem conter uma ou mais substâncias químicas dissolvidas em solvente adequado ou em mistura de solventes mutuamente miscíveis ou dispersíveis.
HALOCUR 0,5 mg/ml solução oral PT 4
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO PRODUTO HALOCUR 0,5 mg/ml solução oral PT 4 1. DENOMINAÇÃO DO MEDICAMENTO VETERINÁRIO HALOCUR 0.5 mg/ml solução oral 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 2.1 Princípio(s)
ANEXO I RESUMO DAS CARACTERÍSTICAS DO PRODUTO HALOCUR 0,5 mg/ml solução oral PT 4 1. DENOMINAÇÃO DO MEDICAMENTO VETERINÁRIO HALOCUR 0.5 mg/ml solução oral 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA 2.1 Princípio(s)
P2 - PROVA DE QUÍMICA GERAL - 11/10/08
 P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
P2 - PROVA DE QUÍMICA GERAL - 11/10/08 Nome: Gabarito Nº de Matrícula: Turma: Assinatura: Questão Valor Grau Revisão 1 a 2,5 2 a 2,5 3 a 2,5 4 a 2,5 Total 10,0 Constantes: R 8,314 J mol -1 K -1 0,0821
FICHA TÉCNICA - MASSA LEVE -
 FICHA TÉCNICA - MASSA LEVE - Massa Leve é um aditivo capaz de produzir concreto poroso de baixa massa especifica aparente, com ótima estabilidade, isto é, com reduzida queda de volume na aplicação. Características
FICHA TÉCNICA - MASSA LEVE - Massa Leve é um aditivo capaz de produzir concreto poroso de baixa massa especifica aparente, com ótima estabilidade, isto é, com reduzida queda de volume na aplicação. Características
Sistema circulatório. Componentes: - Vasos sanguíneos. - Sangue (elementos figurados e plasma) - Coração
 Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
Fisiologia Humana Sistema circulatório Componentes: - Sangue (elementos figurados e plasma) - Vasos sanguíneos - Coração Vasos sanguíneos Artérias Vasos com paredes espessas e elásticas por onde circula
Disciplina de Didáctica da Química I
 Disciplina de Didáctica da Química I Texto de Apoio Concepções Alternativas em Equilíbrio Químico Autores: Susana Fonseca, João Paiva 3.2.3 Concepções alternativas em Equilíbrio Químico Tal como já foi
Disciplina de Didáctica da Química I Texto de Apoio Concepções Alternativas em Equilíbrio Químico Autores: Susana Fonseca, João Paiva 3.2.3 Concepções alternativas em Equilíbrio Químico Tal como já foi
CALORIMETRIA, MUDANÇA DE FASE E TROCA DE CALOR Lista de Exercícios com Gabarito e Soluções Comentadas
 COLÉGIO PEDRO II PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA, EXTENSÃO E CULTURA PROGRAMA DE RESIDÊNCIA DOCENTE RESIDENTE DOCENTE: Marcia Cristina de Souza Meneguite Lopes MATRÍCULA: P4112515 INSCRIÇÃO: PRD.FIS.0006/15
COLÉGIO PEDRO II PRÓ-REITORIA DE PÓS-GRADUAÇÃO, PESQUISA, EXTENSÃO E CULTURA PROGRAMA DE RESIDÊNCIA DOCENTE RESIDENTE DOCENTE: Marcia Cristina de Souza Meneguite Lopes MATRÍCULA: P4112515 INSCRIÇÃO: PRD.FIS.0006/15
Lipossomas e as suas aplicações na actualidade
 Universidade de Évora Departamento de Química Célia Antunes Lipossomas e as suas aplicações na actualidade Os lipossomas foram descobertos em 1960 pelo cientista inglês Alec Bangham. No entanto, somente
Universidade de Évora Departamento de Química Célia Antunes Lipossomas e as suas aplicações na actualidade Os lipossomas foram descobertos em 1960 pelo cientista inglês Alec Bangham. No entanto, somente
ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl]
![ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl] ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl]](/thumbs/26/8060460.jpg) TRABALHO 3 ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl] 1. OBJECTIVO Estudo da cinética da reacção de hidrólise ácida do composto Trans-[Co(en) 2 Cl 2 ]Cl. Determinação
TRABALHO 3 ESTUDO DA CINÉTICA DE HIDRÓLISE ÁCIDA DO COMPOSTO Trans-[(Co(en) 2 Cl 2 )Cl] 1. OBJECTIVO Estudo da cinética da reacção de hidrólise ácida do composto Trans-[Co(en) 2 Cl 2 ]Cl. Determinação
9/9/2008 CONSIDERAÇÕES GERAIS. Toxicidade. Faixa terapêutica. Concentrações sub-terapêuticas. - Não sofre efeito de primeira passagem
 CONSIDERAÇÕES GERAIS Princípios de Farmacologia: Farmacocinética Farmacodinâmica Concentração plasmática Toxicidade Faixa terapêutica Concentrações sub-terapêuticas Tempo VIAS DE ADMINISTRAÇÃO DE MEDICAMENTOS
CONSIDERAÇÕES GERAIS Princípios de Farmacologia: Farmacocinética Farmacodinâmica Concentração plasmática Toxicidade Faixa terapêutica Concentrações sub-terapêuticas Tempo VIAS DE ADMINISTRAÇÃO DE MEDICAMENTOS
PROVA DE QUÍMICA - 1998 Segunda Etapa
 PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
PROVA DE QUÍMICA - 1998 Segunda Etapa QUESTÃO 01 Num laboratório químico, havia três frascos que continham, respectivamente, um alcano, um álcool e um alqueno. Foram realizados experimentos que envolviam
GUIA POSOLÓGICO E INFORMAÇÃO DE SEGURANÇA
 Peso do doente (kg) Indicações Infeções complicadas da pele e dos tecidos moles por bactérias Gram-positivas não associadas a bacteriemia* * ICTPM associadas a bacteriemia ver dosagem de 6 mg/kg Manuseamento
Peso do doente (kg) Indicações Infeções complicadas da pele e dos tecidos moles por bactérias Gram-positivas não associadas a bacteriemia* * ICTPM associadas a bacteriemia ver dosagem de 6 mg/kg Manuseamento
FATORES QUE AFETAM AS VELOCIDADES DAS REAÇÕES. 2. As concentrações dos reagentes. 3. A temperatura na qual a reação ocorre.
 CINÉTICA QUÍMICA FATORES QUE AFETAM AS VELOCIDADES DAS REAÇÕES 1. O estado físico dos reagentes. 2. As concentrações dos reagentes. 3. A temperatura na qual a reação ocorre. 4. A presença de um catalisador.
CINÉTICA QUÍMICA FATORES QUE AFETAM AS VELOCIDADES DAS REAÇÕES 1. O estado físico dos reagentes. 2. As concentrações dos reagentes. 3. A temperatura na qual a reação ocorre. 4. A presença de um catalisador.
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO. Dolorex 10 mg/ml, solução injetável para equinos, caninos e felinos.
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Dolorex 10 mg/ml, solução injetável para equinos, caninos e felinos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml contém:
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO 1. NOME DO MEDICAMENTO VETERINÁRIO Dolorex 10 mg/ml, solução injetável para equinos, caninos e felinos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml contém:
Escola de Engenharia de Lorena USP - Cinética Química Capítulo 05 Reações Irreversiveis a Volume Varíavel
 1 - Calcule a fração de conversão volumétrica (ε A) para as condições apresentadas: Item Reação Condição da Alimentação R: (ε A ) A A 3R 5% molar de inertes 1,5 B (CH 3 ) O CH 4 + H + CO 30% em peso de
1 - Calcule a fração de conversão volumétrica (ε A) para as condições apresentadas: Item Reação Condição da Alimentação R: (ε A ) A A 3R 5% molar de inertes 1,5 B (CH 3 ) O CH 4 + H + CO 30% em peso de
Química Analítica Avançada: Volumetria de Neutralização. Prof a Lilian Silva 2011
 Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
Química Analítica Avançada: Volumetria de Neutralização Prof a Lilian Silva 2011 INTRODUÇÃO À VOLUMETRIA TITULAÇÃO Processo no qual uma solução padrão ou solução de referência é adicionada a uma solução
Efeito Osmótico de Soluções de Concentração Diferente na Membrana de um Ovo de Codorniz
 Efeito Osmótico de Soluções de Concentração Diferente na Membrana de um Ovo de Codorniz Rui Pedro Lousa das Neves Bioquímica Grupo 3 Coimbra 05/05/99 Introdução Se entre dois meios com diferentes concentrações
Efeito Osmótico de Soluções de Concentração Diferente na Membrana de um Ovo de Codorniz Rui Pedro Lousa das Neves Bioquímica Grupo 3 Coimbra 05/05/99 Introdução Se entre dois meios com diferentes concentrações
hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS
 hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS O NOSSO CORPO É CONSTITUÍDO NA MAIOR PARTE POR ÁGUA A ÁGUA É O PRINCIPAL CONSTITUINTE DO ORGANISMO, É ESSENCIAL PARA A VIDA E TEM
hidratação ASSOCIAÇÃO PORTUGUESA DAS BEBIDAS REFRESCANTES NÃO ALCOÓLICAS O NOSSO CORPO É CONSTITUÍDO NA MAIOR PARTE POR ÁGUA A ÁGUA É O PRINCIPAL CONSTITUINTE DO ORGANISMO, É ESSENCIAL PARA A VIDA E TEM
Sistema tampão. Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H +
 Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A - + H + Quando se adiciona um ácido forte na solução de ácido fraco HX X - + H + HA A - H + X - H + H + HA A
LEI DE OHM. Professor João Luiz Cesarino Ferreira. Conceitos fundamentais
 LEI DE OHM Conceitos fundamentais Ao adquirir energia cinética suficiente, um elétron se transforma em um elétron livre e se desloca até colidir com um átomo. Com a colisão, ele perde parte ou toda energia
LEI DE OHM Conceitos fundamentais Ao adquirir energia cinética suficiente, um elétron se transforma em um elétron livre e se desloca até colidir com um átomo. Com a colisão, ele perde parte ou toda energia
Características e os efeitos das propriedades coligativas
 Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
Características e os efeitos das propriedades coligativas O estudo das propriedades coligativas é um dos conteúdos mais importantes a serem estudados, pois facilita a compreensão de fenômenos químicos
Escola Secundária Dr. Manuel Gomes de Almeida
 Escola Secundária Dr. Manuel Gomes de Almeida Ficha de trabalho de Biologia - 12º Ano Fermentação e actividade enzimática Nome: N º: Turma: Data: 1. A figura 1 representa um tipo de fermentação. Figura
Escola Secundária Dr. Manuel Gomes de Almeida Ficha de trabalho de Biologia - 12º Ano Fermentação e actividade enzimática Nome: N º: Turma: Data: 1. A figura 1 representa um tipo de fermentação. Figura
As proteínas transportadoras
 As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
As proteínas transportadoras 10 A U L A objetivos Ao final desta aula, você deverá compreender o que são: Proteínas transportadoras: carreadores e canais. Aquaporinas. Biologia Celular As proteínas transportadoras
TITULAÇÃO DE ÁCIDO-BASE
 Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Disciplina QUIO94 - Introdução à Análise Química
Universidade Federal de Juiz de Fora Instituto de Ciências Exatas Departamento de Química Introdução a Analise Química - II sem/2012 Profa Ma Auxiliadora - 1 Disciplina QUIO94 - Introdução à Análise Química
Departamento de Matemática - UEL - 2010. Ulysses Sodré. http://www.mat.uel.br/matessencial/ Arquivo: minimaxi.tex - Londrina-PR, 29 de Junho de 2010.
 Matemática Essencial Extremos de funções reais Departamento de Matemática - UEL - 2010 Conteúdo Ulysses Sodré http://www.mat.uel.br/matessencial/ Arquivo: minimaxi.tex - Londrina-PR, 29 de Junho de 2010.
Matemática Essencial Extremos de funções reais Departamento de Matemática - UEL - 2010 Conteúdo Ulysses Sodré http://www.mat.uel.br/matessencial/ Arquivo: minimaxi.tex - Londrina-PR, 29 de Junho de 2010.
1. Um corpo arremessado tem sua trajetória representada pelo gráfico de uma parábola, conforme a figura a seguir.
 1. Um corpo arremessado tem sua trajetória representada pelo gráfico de uma parábola, conforme a figura a seguir. Nessa trajetória, a altura máxima, em metros, atingida pelo corpo foi de a) 0,52m. b) 0,64m.
1. Um corpo arremessado tem sua trajetória representada pelo gráfico de uma parábola, conforme a figura a seguir. Nessa trajetória, a altura máxima, em metros, atingida pelo corpo foi de a) 0,52m. b) 0,64m.
Osmose Reversa Conheça este processo de purificação de água
 Osmose Reversa Conheça este processo de purificação de água Antes de falarmos sobre Osmose Reversa, precisamos entender o que é Osmose. Osmose é o nome dado ao movimento da água entre meios com concentrações
Osmose Reversa Conheça este processo de purificação de água Antes de falarmos sobre Osmose Reversa, precisamos entender o que é Osmose. Osmose é o nome dado ao movimento da água entre meios com concentrações
ANÁLISE QUÍMICA INSTRUMENTAL
 ANÁLISE QUÍMICA INSTRUMENTAL CROMATOGRAFIA 2 1 6 Ed. Cap. 10 268-294 6 Ed. Cap. 6 Pg.209-219 6 Ed. Cap. 28 Pg.756-829 6 Ed. Cap. 21 Pg.483-501 3 Separação Química Princípios de uma separação. Uma mistura
ANÁLISE QUÍMICA INSTRUMENTAL CROMATOGRAFIA 2 1 6 Ed. Cap. 10 268-294 6 Ed. Cap. 6 Pg.209-219 6 Ed. Cap. 28 Pg.756-829 6 Ed. Cap. 21 Pg.483-501 3 Separação Química Princípios de uma separação. Uma mistura
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO Fertagyl, 0,1 mg/ml solução injetável para bovinos e coelhos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml
RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 15 1. NOME DO MEDICAMENTO VETERINÁRIO Fertagyl, 0,1 mg/ml solução injetável para bovinos e coelhos. 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA Cada ml
Qual o efeito da radiação solar na evaporação da água?
 16 Qual o efeito da radiação solar na evaporação da água? E16-1 o que necessitas coador holofote com uma potência de 500 w filtros de café frasco com água salgada (do mar ou de qualquer compartimento da
16 Qual o efeito da radiação solar na evaporação da água? E16-1 o que necessitas coador holofote com uma potência de 500 w filtros de café frasco com água salgada (do mar ou de qualquer compartimento da
Álcool e energéticos. Uma mistura perigosa. José Guerchon Camila Welikson Arnaldo Welikson Barbara Macedo Durão
 Álcool e energéticos. Uma mistura perigosa. José Guerchon Camila Welikson Arnaldo Welikson Barbara Macedo Durão Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons.
Álcool e energéticos. Uma mistura perigosa. José Guerchon Camila Welikson Arnaldo Welikson Barbara Macedo Durão Este documento tem nível de compartilhamento de acordo com a licença 3.0 do Creative Commons.
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com
 Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Profa. Maria Fernanda - Química nandacampos.mendonc@gmail.com Estudo de caso Reúnam-se em grupos de máximo 5 alunos e proponha uma solução para o seguinte caso: A morte dos peixes ornamentais. Para isso
Preparação e padronização de uma solução 0,10 mol/l de ácido clorídrico
 Universidade Estadual de Goiás UnUCET - Anápolis Química Industrial Química Experimental II Preparação e padronização de uma solução 0,10 mol/l de ácido clorídrico Alunos: Bruno Ramos; Wendel Thiago; Thales
Universidade Estadual de Goiás UnUCET - Anápolis Química Industrial Química Experimental II Preparação e padronização de uma solução 0,10 mol/l de ácido clorídrico Alunos: Bruno Ramos; Wendel Thiago; Thales
Tópico 2. Conversão de Unidades e Notação Científica
 Tópico 2. Conversão de Unidades e Notação Científica Toda vez que você se refere a um valor ligado a uma unidade de medir, significa que, de algum modo, você realizou uma medição. O que você expressa é,
Tópico 2. Conversão de Unidades e Notação Científica Toda vez que você se refere a um valor ligado a uma unidade de medir, significa que, de algum modo, você realizou uma medição. O que você expressa é,
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza
 Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Lista de Exercícios 4 Indústrias Químicas Resolução pelo Monitor: Rodrigo Papai de Souza 1) a-) Calcular a solubilidade do BaSO 4 em uma solução 0,01 M de Na 2 SO 4 Dissolução do Na 2 SO 4 : Dado: BaSO
Propriedades do Concreto
 Universidade Federal de Itajubá Instituto de Recursos Naturais Propriedades do Concreto EHD 804 MÉTODOS DE CONSTRUÇÃO Profa. Nívea Pons PROPRIEDADES DO CONCRETO O concreto fresco é assim considerado até
Universidade Federal de Itajubá Instituto de Recursos Naturais Propriedades do Concreto EHD 804 MÉTODOS DE CONSTRUÇÃO Profa. Nívea Pons PROPRIEDADES DO CONCRETO O concreto fresco é assim considerado até
TESTES REFERENTES A PARTE 1 DA APOSTILA FUNDAMENTOS DA CORROSÃO INDIQUE SE AS AFIRMAÇÕES A SEGUIR ESTÃO CERTAS OU ERRADAS
 TESTES REFERENTES A PARTE 1 DA APOSTILA FUNDAMENTOS DA CORROSÃO INDIQUE SE AS AFIRMAÇÕES A SEGUIR ESTÃO CERTAS OU ERRADAS 1) Numa célula eletroquímica a solução tem que ser um eletrólito, mas os eletrodos
TESTES REFERENTES A PARTE 1 DA APOSTILA FUNDAMENTOS DA CORROSÃO INDIQUE SE AS AFIRMAÇÕES A SEGUIR ESTÃO CERTAS OU ERRADAS 1) Numa célula eletroquímica a solução tem que ser um eletrólito, mas os eletrodos
MEMBRANA PLASMÁTICA (Modelos da Ultra-Estrutura)
 MEMBRANA PLASMÁTICA (Modelos da Ultra-Estrutura) A membrana plasmática é uma estrutura altamente diferenciada, que delimita a célula e lhe permite manter a sua individualidade relativamente ao meio externo.
MEMBRANA PLASMÁTICA (Modelos da Ultra-Estrutura) A membrana plasmática é uma estrutura altamente diferenciada, que delimita a célula e lhe permite manter a sua individualidade relativamente ao meio externo.
Cálculo de potência; Limites de confiança; Análise estatística (ANOVA).
 CENTRO UNIVERSITÁRIO FRANCISCANO UNIFRA CURSO DE FARMÁCIA CONTROLE BIOLÓGICO DA QUALIDADE DE MEDICAMENTOS DELINEAMENTO: 3 x 3 3 doses do padrão Prof. Marcos R. dos Santos P2 A1 A3 A2 P1 A = amostra P=
CENTRO UNIVERSITÁRIO FRANCISCANO UNIFRA CURSO DE FARMÁCIA CONTROLE BIOLÓGICO DA QUALIDADE DE MEDICAMENTOS DELINEAMENTO: 3 x 3 3 doses do padrão Prof. Marcos R. dos Santos P2 A1 A3 A2 P1 A = amostra P=
Química C Extensivo V. 2
 Química C Extensivo V. 2 Exercícios 01) E 02) E Situação 1. Sistema heterogêneo solução saturada com corpo de fundo; 20 C = 46,5/100 g H 2 Na situação 1 há 80 g de soluto em 100 g de água a 20 C. excesso
Química C Extensivo V. 2 Exercícios 01) E 02) E Situação 1. Sistema heterogêneo solução saturada com corpo de fundo; 20 C = 46,5/100 g H 2 Na situação 1 há 80 g de soluto em 100 g de água a 20 C. excesso
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO
 ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 19 1. NOME DO MEDICAMENTO VETERINÁRIO DOX 100 mg/g pó oral para bovinos, suínos e aves (frangos e perus) 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
ANEXO I RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO Página 1 de 19 1. NOME DO MEDICAMENTO VETERINÁRIO DOX 100 mg/g pó oral para bovinos, suínos e aves (frangos e perus) 2. COMPOSIÇÃO QUALITATIVA E QUANTITATIVA
GABARITO. Resposta: Cálculo da superfície corporal para dose de gencitabina 1 m 2 --- 1000 mg 1,66 m 2 --- X mg X = 1660 mg
 GABARITO 1 - Sr José, 65 anos, apresenta dor abdominal intensa há dois meses. Após solicitação de ultrasonografia pelo médico assistente chegou-se ao diagnóstico de câncer de pâncreas. O tratamento proposto
GABARITO 1 - Sr José, 65 anos, apresenta dor abdominal intensa há dois meses. Após solicitação de ultrasonografia pelo médico assistente chegou-se ao diagnóstico de câncer de pâncreas. O tratamento proposto
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4. , K +, Mg 2+, etc...)
 Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
Regulação dos níveis iônicos do sangue (Na +, K +, Ca 2+, Cl -, HPO 4 2-, K +, Mg 2+, etc...) Regulação do equilíbrio hidrossalino e da pressão arterial; Regulação do ph sanguíneo (H +, HCO 3- ); Síntese
Nanotecnologia. Sua relevância e um exemplo de aplicação na Medicina
 Nanotecnologia Sua relevância e um exemplo de aplicação na Medicina O que é Nanotecnologia? É a criação, manipulação e exploração de materiais em escala nanométrica. Com esta tecnologia é possível manipular
Nanotecnologia Sua relevância e um exemplo de aplicação na Medicina O que é Nanotecnologia? É a criação, manipulação e exploração de materiais em escala nanométrica. Com esta tecnologia é possível manipular
REGULAÇÃO HIDROELETROLÍTICA FUNÇÃO RENAL
 REGULAÇÃO HIDROELETROLÍTICA FUNÇÃO RENAL Bioquímica Profa. Dra. Celene Fernandes Bernardes Referências Bioquímica Clínica M A T Garcia e S Kanaan Bioquímica Mèdica J W Baynes e M H Dominiczack Fundamentos
REGULAÇÃO HIDROELETROLÍTICA FUNÇÃO RENAL Bioquímica Profa. Dra. Celene Fernandes Bernardes Referências Bioquímica Clínica M A T Garcia e S Kanaan Bioquímica Mèdica J W Baynes e M H Dominiczack Fundamentos
Uso correcto dos antibióticos
 CAPÍTULO 7 Uso correcto dos antibióticos Quando usados correctamente, os antibióticos são medicamentos extremamente úteis e importantes. Eles combatem diversas infecções e doenças causadas por bactérias.
CAPÍTULO 7 Uso correcto dos antibióticos Quando usados correctamente, os antibióticos são medicamentos extremamente úteis e importantes. Eles combatem diversas infecções e doenças causadas por bactérias.
SISTEMA URINÁRIO. Prof. Me. Leandro Parussolo
 SISTEMA URINÁRIO Prof. Me. Leandro Parussolo SISTEMA URINÁRIO Conjunto de órgãos e estruturas responsáveis pela filtração do sangue e consequente formação da urina; É o principal responsável pela eliminação
SISTEMA URINÁRIO Prof. Me. Leandro Parussolo SISTEMA URINÁRIO Conjunto de órgãos e estruturas responsáveis pela filtração do sangue e consequente formação da urina; É o principal responsável pela eliminação
Introdução. Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo.
 Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Introdução Muitas reações ocorrem completamente e de forma irreversível como por exemplo a reação da queima de um papel ou palito de fósforo. Existem também sistemas, em que as reações direta e inversa
Propriedades Coligativas Aula 3
 Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
Propriedades Coligativas Aula 3 Um efeito coligativo é uma modificação em certas propriedades de um solvente quando nele adicionados um soluto não-volátil, o qual só depende do número de partículas (moléculas
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR. Cloreto de potássio Noridem 150 mg/ml Concentrado para solução para perfusão
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR APROVADO EM Cloreto de potássio Noridem 150 mg/ml Concentrado para solução para perfusão Cloreto de potássio Leia atentamente este folheto antes de utilizar
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR APROVADO EM Cloreto de potássio Noridem 150 mg/ml Concentrado para solução para perfusão Cloreto de potássio Leia atentamente este folheto antes de utilizar
MODELO DE BULA. USO ADULTO E PEDIÁTRICO (crianças acima de dois anos de idade)
 MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
MODELO DE BULA Logo Novartis Lacrigel TM A palmitato de retinol 10 mg/g Lágrima artificial estéril Forma farmacêutica e apresentação Gel oftálmico: cada tubo contém 10 g de gel. USO ADULTO E PEDIÁTRICO
Dispositivos Médicos: Requisitos para a esterilização por óxido de etileno
 Dispositivos Médicos: Requisitos para a esterilização por óxido de etileno A eficácia do processo de esterilização de um dispositivo médico é avaliada com base numa série de experiências e protocolos que
Dispositivos Médicos: Requisitos para a esterilização por óxido de etileno A eficácia do processo de esterilização de um dispositivo médico é avaliada com base numa série de experiências e protocolos que
RECOMENDAÇÕES PARA REALIZAÇÃO DE ENSAIOS DE DISSOLUÇÃO PARA FORMAS FARMACÊUTICAS SÓLIDAS ORAIS DE LIBERAÇÃO IMEDIATA (FFSOLI)
 RECOMENDAÇÕES PARA REALIZAÇÃO DE ENSAIOS DE DISSOLUÇÃO PARA FORMAS FARMACÊUTICAS SÓLIDAS ORAIS DE LIBERAÇÃO IMEDIATA (FFSOLI) 1. Introdução O objetivo desta recomendação é fornecer orientações gerais para
RECOMENDAÇÕES PARA REALIZAÇÃO DE ENSAIOS DE DISSOLUÇÃO PARA FORMAS FARMACÊUTICAS SÓLIDAS ORAIS DE LIBERAÇÃO IMEDIATA (FFSOLI) 1. Introdução O objetivo desta recomendação é fornecer orientações gerais para
Utilização do SOLVER do EXCEL
 Utilização do SOLVER do EXCEL 1 Utilização do SOLVER do EXCEL José Fernando Oliveira DEEC FACULDADE DE ENGENHARIA DA UNIVERSIDADE DO PORTO MAIO 1998 Para ilustrar a utilização do Solver na resolução de
Utilização do SOLVER do EXCEL 1 Utilização do SOLVER do EXCEL José Fernando Oliveira DEEC FACULDADE DE ENGENHARIA DA UNIVERSIDADE DO PORTO MAIO 1998 Para ilustrar a utilização do Solver na resolução de
PROPRIEDADES DAS SOLUÇÕES
 PROPRIEDADES DAS SOLUÇÕES M Filomena Botelho Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica
PROPRIEDADES DAS SOLUÇÕES M Filomena Botelho Objectivos Identificar e aplicar as propriedades das soluções Compreender a importância das propriedades coligativas Aplicar os conceito de pressão osmótica
As forças atrativas entre duas moléculas são significativas até uma distância de separação d, que chamamos de alcance molecular.
 Tensão Superficial Nos líquidos, as forças intermoleculares atrativas são responsáveis pelos fenômenos de capilaridade. Por exemplo, a subida de água em tubos capilares e a completa umidificação de uma
Tensão Superficial Nos líquidos, as forças intermoleculares atrativas são responsáveis pelos fenômenos de capilaridade. Por exemplo, a subida de água em tubos capilares e a completa umidificação de uma
SOLUÇÕES SOLUÇÕES MISTURAS
 MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
MISTURAS SOLUÇÕES Quando juntamos duas espécies químicas diferentes e, não houver reação química entre elas, isto é, não houver formação de nova(s) espécie(s), teremos uma mistura. Exemplos: Mistura de
Separação de Misturas
 1. Introdução Separação de Misturas As misturas são comuns em nosso dia a dia. Como exemplo temos: as bebidas, os combustíveis, e a própria terra em que pisamos. Poucos materiais são encontrados puros.
1. Introdução Separação de Misturas As misturas são comuns em nosso dia a dia. Como exemplo temos: as bebidas, os combustíveis, e a própria terra em que pisamos. Poucos materiais são encontrados puros.
Existem diversos tipos de transporte que podem ocorrer através da membrana plasmática. Vejamos abaixo:
 MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
MEMBRANA PLASMÁTICA E TRANSPORTES MEMBRANA PLASMÁTICA A membrana plasmática é constituída de uma camada dupla de lipídeos. Nesta camada, existem moléculas de proteínas encaixadas. Essas moléculas de proteínas
LOGO FQA. Da Terra à Lua. Leis de Newton. Prof.ª Marília Peres. Adaptado de Serway & Jewett
 LOGO Da Terra à Lua Leis de Newton Prof.ª Marília Peres Adaptado de Serway & Jewett Isaac Newton (1642-1727) Físico e Matemático inglês Isaac Newton foi um dos mais brilhantes cientistas da história. Antes
LOGO Da Terra à Lua Leis de Newton Prof.ª Marília Peres Adaptado de Serway & Jewett Isaac Newton (1642-1727) Físico e Matemático inglês Isaac Newton foi um dos mais brilhantes cientistas da história. Antes
Água e Soluções Biológicas
 Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Universidade Federal do Ceará Centro de Ciências Departamento de Bioquímica e Biologia Molecular Disciplina de Biofísica Água e Soluções Biológicas 1. Introdução 2. A estrutura da molécula de água 2.1.
Introdução a Química Analítica. Professora Mirian Maya Sakuno
 Introdução a Química Analítica Professora Mirian Maya Sakuno Química Analítica ou Química Quantitativa QUÍMICA ANALÍTICA: É a parte da química que estuda os princípios teóricos e práticos das análises
Introdução a Química Analítica Professora Mirian Maya Sakuno Química Analítica ou Química Quantitativa QUÍMICA ANALÍTICA: É a parte da química que estuda os princípios teóricos e práticos das análises
MATÉRIA Química II. Helder
 Valores eternos. TD Recuperação ALUNO(A) MATÉRIA Química II PROFESSOR(A) Helder ANO SEMESTRE DATA 1º 1º Jul/2013 TOTAL DE ESCORES ---- ESCORES OBTIDOS ---- 1. Numa solução saturada temos: a) uma soluçâo
Valores eternos. TD Recuperação ALUNO(A) MATÉRIA Química II PROFESSOR(A) Helder ANO SEMESTRE DATA 1º 1º Jul/2013 TOTAL DE ESCORES ---- ESCORES OBTIDOS ---- 1. Numa solução saturada temos: a) uma soluçâo
BLOCO 11. ASSUNTOS: Controlo Análise dos Registos Contabilísticos Análise de estrutura e de eficiência Análise de actividade PROBLEMAS:
 BLOCO 11 ASSUNTOS: Controlo Análise dos Registos Contabilísticos Análise de estrutura e de eficiência Análise de actividade PROBLEMAS: PROBLEMA 1 O empresário do Monte da Ribeira pretende realizar uma
BLOCO 11 ASSUNTOS: Controlo Análise dos Registos Contabilísticos Análise de estrutura e de eficiência Análise de actividade PROBLEMAS: PROBLEMA 1 O empresário do Monte da Ribeira pretende realizar uma
Anexo III. Alterações a incluir nas secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo
 Anexo III Alterações a incluir nas secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo
Anexo III Alterações a incluir nas secções relevantes do Resumo das Características do Medicamento e do Folheto Informativo Nota: Este Resumo das Características do Medicamento, rotulagem e folheto informativo
Curso de Farmácia. Operações Unitárias em Indústria Prof.a: Msd Érica Muniz 6 /7 Período DESTILAÇÃO
 Curso de Farmácia Operações Unitárias em Indústria Prof.a: Msd Érica Muniz 6 /7 Período DESTILAÇÃO 1 Introdução A destilação como opção de um processo unitário de separação, vem sendo utilizado pela humanidade
Curso de Farmácia Operações Unitárias em Indústria Prof.a: Msd Érica Muniz 6 /7 Período DESTILAÇÃO 1 Introdução A destilação como opção de um processo unitário de separação, vem sendo utilizado pela humanidade
Aplicações de Escritório Electrónico
 Universidade de Aveiro Escola Superior de Tecnologia e Gestão de Águeda Curso de Especialização Tecnológica em Práticas Administrativas e Tradução Aplicações de Escritório Electrónico Microsoft Word Folha
Universidade de Aveiro Escola Superior de Tecnologia e Gestão de Águeda Curso de Especialização Tecnológica em Práticas Administrativas e Tradução Aplicações de Escritório Electrónico Microsoft Word Folha
Como tomar os produtos?
 Como tomar os produtos? Importante: Como estamos a trabalhar sob as regras europeias não podemos dizer que os produtos curam doenças. A União Europeia tem direito de fechar o negócio da Synergy em qualquer
Como tomar os produtos? Importante: Como estamos a trabalhar sob as regras europeias não podemos dizer que os produtos curam doenças. A União Europeia tem direito de fechar o negócio da Synergy em qualquer
Reações a altas temperaturas. Diagrama de Equilíbrio
 Reações a altas temperaturas Diagrama de Equilíbrio Propriedades de um corpo cerâmico Determinadas pelas propriedades de cada fase presente e pelo modo com que essas fases (incluindo a porosidade) estão
Reações a altas temperaturas Diagrama de Equilíbrio Propriedades de um corpo cerâmico Determinadas pelas propriedades de cada fase presente e pelo modo com que essas fases (incluindo a porosidade) estão
Unidade de Pesquisa Clínica
 Unidade de Pesquisa Clínica A EQUIVALÊNCIA FARMACÊUTICA NO CONTEXTO DA INTERCAMBIALIDADE ENTRE MEDICAMENTOS GENÉRICOS E DE : BASES TÉCNICAS E CIENTÍFICAS abril/04 SÍLVIA STORPIRTIS1,2; RAQUEL MARCOLONGO1;
Unidade de Pesquisa Clínica A EQUIVALÊNCIA FARMACÊUTICA NO CONTEXTO DA INTERCAMBIALIDADE ENTRE MEDICAMENTOS GENÉRICOS E DE : BASES TÉCNICAS E CIENTÍFICAS abril/04 SÍLVIA STORPIRTIS1,2; RAQUEL MARCOLONGO1;
SOLUÇÕES. Curvas de Solubilidade
 QUÍMICA SOLUÇÕES 1. INTRODUÇÃO Soluções são misturas homogêneas, ou seja, misturas entre dois ou mais componentes apresentando uma única fase. Exemplos: Água + Álcool Água + Sal + Açucar Curvas de Solubilidade
QUÍMICA SOLUÇÕES 1. INTRODUÇÃO Soluções são misturas homogêneas, ou seja, misturas entre dois ou mais componentes apresentando uma única fase. Exemplos: Água + Álcool Água + Sal + Açucar Curvas de Solubilidade
APROVADO EM 01-10-2004 INFARMED
 FOLHETO INFORMATIVO Antibiophilus, 250 mg, Cápsulas Lactobacillus casei variedade rhamnosus Este folheto contém informações importantes para si. Leia-o atentamente. Este medicamento pode ser adquirido
FOLHETO INFORMATIVO Antibiophilus, 250 mg, Cápsulas Lactobacillus casei variedade rhamnosus Este folheto contém informações importantes para si. Leia-o atentamente. Este medicamento pode ser adquirido
VANTAGENS DAS CORREIAS TRAPEZOIDAIS DENTADAS SOBRE AS CLÁSSICAS LISAS
 VANTAGENS DAS CORREIAS TRAPEZOIDAIS DENTADAS SOBRE AS CLÁSSICAS LISAS 1. Introdução... 1 2. Estudo... 3 2.1 Condições do estudo... 3 2.2 Consumo de energia... 3 2.3 Estudo de degradação da tensão com o
VANTAGENS DAS CORREIAS TRAPEZOIDAIS DENTADAS SOBRE AS CLÁSSICAS LISAS 1. Introdução... 1 2. Estudo... 3 2.1 Condições do estudo... 3 2.2 Consumo de energia... 3 2.3 Estudo de degradação da tensão com o
Que tipos de Diabetes existem?
 Que tipos de Diabetes existem? -Diabetes Tipo 1 -também conhecida como Diabetes Insulinodependente -Diabetes Tipo 2 - Diabetes Gestacional -Outros tipos de Diabetes Organismo Saudável As células utilizam
Que tipos de Diabetes existem? -Diabetes Tipo 1 -também conhecida como Diabetes Insulinodependente -Diabetes Tipo 2 - Diabetes Gestacional -Outros tipos de Diabetes Organismo Saudável As células utilizam
Algarismos Significativos
 UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL INSTITUTO DE QUÍMICA DEPARTAMENTO DE QUÍMICA INORGÂNICA QUÍMICA FUNDAMENTAL A - QUI-01-009 Algarismos Significativos ALGARISMOS SIGNIFICATIVOS Os algarismos significativos
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL INSTITUTO DE QUÍMICA DEPARTAMENTO DE QUÍMICA INORGÂNICA QUÍMICA FUNDAMENTAL A - QUI-01-009 Algarismos Significativos ALGARISMOS SIGNIFICATIVOS Os algarismos significativos
SALSEP cloreto de sódio Solução nasal 9 mg/ml
 SALSEP cloreto de sódio Solução nasal 9 mg/ml USO INTRANASAL USO ADULTO E PEDIÁTRICO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
SALSEP cloreto de sódio Solução nasal 9 mg/ml USO INTRANASAL USO ADULTO E PEDIÁTRICO FORMAS FARMACÊUTICAS E APRESENTAÇÕES Solução nasal com 9 mg/ml de cloreto de sódio. Embalagem com 1 frasco spray nasal
