MATÉRIA CORPO OBJETO
|
|
|
- Emanuel Silveira Pacheco
- 7 Há anos
- Visualizações:
Transcrição
1
2 A ciência QUÍMICA está voltada para o estudo da matéria, qualquer que seja sua origem. Observando a composição da matéria, suas transformações e a energia envolvida nesses processos MATÉRIA CORPO OBJETO É tudo que tem massa e ocupa um lugar no espaço É uma porção limitada da matéria É um corpo que tem finalidade específica
3 As substâncias puras podem ser classificadas em: A matéria pode ser uma SUBSTÂNCIA PURA ou uma MISTURA SUBSTÂNCIA SIMPLES SUBSTÂNCIA COMPOSTA O2 H2O É constituída por um único tipo de elemento químico É constituída por mais de um tipo de elemento químico
4 01)(UNISA-SP) Em qual das seqüências a seguir estão representados um elemento, uma substância simples e uma substância composta, respectivamente: a) H2, Cl2, O2. b) N, HI, He. c) Cl, N2, HI. d) H2, Ne, H2O. e) H2O, O2, H2.
5 02) O número de substâncias simples com atomicidade par entre as substâncias de fórmula O3, H2O2, P4, I2, C2H4, CO2 e He é: a) 5. b) 4. c) 3. d) 2. e) 1. substância simples com atomicidade par
6 Podemos observar um fenômeno pelo qual um mesmo elemento químico é formador de substâncias simples diferentes, tal fenômeno chama-se ALOTROPIA OXIGÊNIO (O2) OZÔNIO (O3)
7 As substâncias que fazem parte do fenômeno são denominadas de VARIEADES ALOTRÓPICAS do elemento OXIGÊNIO (O2) OZÔNIO (O3) Oxigênio (O2) e Ozônio (O3) são VARIEDADES ALOTRÓPICAS Do elementos químico OXIGÊNIO
8 As variedades alotrópicas podem diferir quanto à ATOMICIDADE ou quanto à ESTRUTURA CRISTALINA Diferem pela atomicidade Diferem pela estrutura cristalina OXIGÊNIO (O2) OZÔNIO (O3)
9 VARIEDADES ALOTRÓPICAS DO OXIGÊNIO O elemento oxigênio possui duas variedades alotrópicas que diferem quanto à atomicidade, que são o oxigênio (O2) e o ozônio (O3). OXIGÊNIO (O2) OZÔNIO (O3)
10 VARIEDADES ALOTRÓPICAS DO CARBONO Na natureza o elemento químico carbono possui três formas alotrópicas: GRAFITE, DIAMANTE e FULERENO
11 VARIEDADES ALOTRÓPICAS DO ENXOFRE O elemento químico enxofre apresenta duas variedades alotrópicas: ENXOFRE RÔMBICO e ENXOFRE MONOCLÍNICO As formas cristalinas das duas formas alotrópicas são diferentes Porém, ambas são constituídas por moléculas com oito átomos de enxofre
12 VARIEDADES ALOTRÓPICAS DO FÓSFORO O elemento fósforo forma várias variedades alotrópicas, sendo o FÓSFORO BRANCO e o FÓSFORO VERMELHO as mais comuns.
13 01) (UNISA-SP) Três substâncias simples estão exemplificadas no item: a) enxofre rômbico, fósforo branco, grafite. b) diamante, metano, gás carbônico. c) ozônio, amônia, cloro. d) fósforo vermelho, diamante, fosfina (PH3). e) nitrogênio, cal (CaO), oxigênio.
14 02) Alotropia é um fenômeno relacionado com: a) substâncias simples b) substâncias iônicas c) compostos binários d) elementos químicos metálicos e) substâncias orgânicas oxigenadas
15 03) Observe o texto abaixo: "Diamante em pedra bruta renasce Reluzente brilhante e belo Com plenitude faz-se luz Aos olhos humanos enfeitiça Sobre o diamante, podemos afirmar que é uma forma alotrópica do elemento químico: a) enxofre. b) fósforo. c) oxigênio. d) hidrogênio. e) carbono.
16 04) Os recém descobertos fulerenos são formas alotrópicas do elemento químico carbono. Outras formas alotrópicas do carbono são: a) isótopos do carbono 13. b) calcário e mármore. c) silício e germânio. d) monóxido de carbono e dióxido de carbono. e) diamante e grafite.
17 Se a matéria for constituída por mais de um tipo de molécula teremos uma MISTURA Estas misturas podem ser HOMOGÊNEAS ou HETEROGÊNEAS
18 As misturas que possuem apenas um único aspecto, isto é, as mesmas propriedades químicas em toda a sua extensão são denominadas de HOMOGÊNEA Se a mistura apresentar mais de um aspecto, isto é, tem propriedades distintas em sua extensão, será HETEROGÊNEA
19 Cada aspecto homogêneo de uma mistura chama-se FASE da mistura A mistura de água e óleo possui duas fases
20 01) (UFPI) Adicionando-se excesso de água à mistura formada por sal de cozinha, areia e açúcar, obtém-se um sistema: a) homogêneo, monofásico. b) homogêneo, bifásico. c) heterogêneo, monofásico. d) heterogêneo, bifásico. e) heterogêneo, trifásico.
21 02) Os diferentes tipos de matéria podem ser classificados em dois grupos : Substâncias puras Misturas. As substâncias puras podem ser simples ou compostas. Considerando-se esse modo de classificação, analise as afirmações: O ar atmosférico é uma substância pura. A água é uma substância simples. O sangue é uma mistura. O oxigênio e o ozônio são substâncias distintas. A matéria que tem três tipos de molécula é uma substância composta.
22 03) Considere as ilustrações para responder às questões de 1 a 6 gelo I II III IV Pag. 37 Ex. 5 a 10 água água água e sal dissolvido água e óleo 01) Quais das ilustrações representam substância pura? I e II 02) Quais são misturas? III e IV 03) Quais são sistemas homogêneos? 04) Quais são sistemas heterogêneos? I e III II e IV 05) Em qual frasco temos uma mistura heterogênea? 06) Em qual frasco temos uma mistura homogênea? IV III
23 04) No esquema a seguir, estão representados quatro sistemas (de I a IV) formados por moléculas constituídas de três tipos de átomos (X, Y e Z), Representados por, e, respectivamente. I II III IV 01) Qual(is) é (são) substância(s) pura(s) simples? 02) Qual(is) é (são) substância(s) pura(s) composta(s)? II I Pag. 38 Ex. 1 a 5 03) Qual(is) é (são) mistura(s)? III e IV 04) Quantos componentes apresenta cada sistema? sistema I: 1 componente sistema III: 3 componentes sistema II: 1 componente sistema IV: 2 componentes 05) No caso dos sistemas com mais de um componente, quantos componentes são substâncias simples e quantos são substâncias compostas? sistema III: 1 substância simples e 2 substâncias compostas sistema IV: 2 substâncias simples e 0 substância composta
24 05) Analise os sistemas matérias abaixo, estando ambos em temperatura ambiente. Sistema (I): mistura de 10g de sal de cozinha, 30g de areia fina, 20 ml de óleo e 100 ml de água. Sistema (II): mistura de 2,0 L de gás carbônico, 3,0 L de gás nitrogênio e 1,5 L de gás oxigênio. Sobre esses sistemas, é correto afirmar que: a) Ambos são heterogêneos, pois apresentam mais de uma fase. Pag. 38 Ex. 09 b) Em I, o sistema é bifásico, após forte agitação, e, em II, o sistema é monofásico. c) Em I, o sistema é trifásico, após forte agitação, e, em II, o sistema é monofásico. d) Ambos apresentam uma única fase, formando sistemas homogêneos. e) Em I, o sistema é trifásico, independentemente da ordem de adição dos componentes, e, em II, o sistema é bifásico.
25 ESTADOS FÍSICOS DA MATÉRIA A matéria pode ser encontrada em três estados físicos SÓLIDO LÍQUIDO GASOSO Possui forma e volume fixos Possui forma variável e volume fixo Possui forma e volume variáveis
26 MUDANÇAS DE ESTADOS FÍSICOS DA MATÉRIA SUBLIMAÇÃO FUSÃO VAPORIZAÇÃO SÓLIDO LÍQUIDO GASOSO SOLIDIFICAÇÃO CONDENSAÇÃO RESSUBLIMAÇÃO
27 01) (UFRRJ) Podemos classificar, como processo endotérmico e exotérmico, respectivamente, as mudanças de estado: a) liquefação e solidificação. b) condensação e sublimação. c) solidificação e evaporação. d) fusão e liquefação. e) evaporação e fusão.
28 02) (Covest-2006) José dirige pelas ruas da cidade numa noite fria e chuvosa. Milton está a seu lado, suando frio e tremendo muito. As janelas do carro estão fechadas e o vidro começa a embaçar pelo lado de dentro. Tentando entender o que está ocorrendo, José enumera os seguintes conceitos que acredita ele, têm relação direta com este fenômeno Condensação. Evaporação. Umidade relativa do ar. Pressão de vapor. Ponto de ebulição.
29 03) (Covest-2001) Considere as afirmações abaixo: I. A areia molhada possui entropia maior que a areia seca. II. A condensação do vapor d'água é um processo exotérmico. III. A fusão do gelo é um processo endotérmico. IV. A evaporação da água é um processo endotérmico. Qual(is) da(s) afirmação(ões) acima melhor explica(m) o fato de que, numa praia do Recife, PE, a areia molhada é mais fria que a areia seca. a) I e III apenas b) II e III apenas c) IV apenas d) III apenas e) II apenas
30 100 C 0 C Temperatura ( C) a 1 atm sólido e líquido líquido líquido e gasoso gasoso 10 C sólido Tempo
31 t C t C Temperatura ( C) a 1 atm sólido e líquido líquido líquido e gasoso gasoso 15 C sólido Tempo
32 t C Temperatura ( C) a 1 atm líquido e gasoso gasoso t C sólido e líquido líquido 15 C sólido Tempo
33 t C Temperatura ( C) a 1 atm líquido e gasoso gasoso sólido e líquido líquido t C 15 C sólido Tempo
34 PLAY..\Aul MUDANÇA DE FASE DA ÁGUA
35 01) (UNICAP-96) A liquefação é um processo onde um cristal passa do estado sólido para o estado líquido. Uma mistura jamais terá um ponto de fusão ou ebulição constante. A naftalina gasosa e o iodo gasoso não podem ser mais ressublimados. 3 3 O iodo sólido, depois de totalmente sublimado, transforma-se em vapor de iodo. 4 4 O álcool forma uma mistura azeotrópica com a água, isto é, apresenta ponto de ebulição constante.
36 02) (Covest-2000) Uma panela X, com água, e outra Y, com água salgada, são levadas ao fogo e, após algum tempo, seus conteúdos encontram-se em ebulição. O gráfico que melhor descreve a variação de temperatura (eixo das coordenadas) dos líquidos em relação ao tempo (eixo das abscissas) durante a a ebulição é: a) b) c) d) e) Y X X Y X Y Y X X Y Y X
37 03) (UNITAU-SP) Misturas azeotrópicas são: a) misturas heterogêneas com ponto de fusão constante. b) misturas homogêneas ou ligas de ponto de fusão constante. c) líquidos ou ligas de ponto de fusão constante. d) soluções líquidas de ponto de ebulição constante. e) líquidos de ponto de ebulição variável.
38 PROPRIEDADES DA MATÉRIA Gerais Específicas Organolépticas Químicas Físicas Funcionais
39 EXTENSÃO A matéria ocupa um lugar no espaço que corresponde ao seu volume
40 MASSA É a quantidade de matéria que forma um corpo ELASTICIDADE É a propriedade que um corpo tem de voltar a sua forma inicial, cessada a força a que estava submetido.
41 INÉRCIA É a tendência natural que os corpos têm de manter seu estado de repouso ou de movimento numa trajetória reta
42 IMPENETRABILIDADE É a propriedade que os corpos têm de não poder ocupar um mesmo lugar no espaço ao mesmo tempo
43 COMPRESSIBILIDADE É a propriedade que os corpos possuem de terem seu volume reduzido quando submetido a determinada pressão.
44 PROPRIEDADES ESPECÍFICAS ORGANOLÉPTICAS São as propriedades pelas quais certas substâncias impressionam nossos sentidos
45 QUÍMICAS São aquelas que caracterizam quimicamente as substâncias
46 FÍSICAS São aquelas que caracterizam fisicamente as substâncias Fusão do gelo densidade
47 FUNCIONAIS São aquelas apresentadas por determinados grupos de substâncias
48 01) Uma pessoa se encontra cavalgando a cavalo e, de repente o o cavalo pára bruscamente e, o cavaleiro é lançado para frente. Isto ocorre devido a uma propriedade... da matéria INÉRCIA chamada... GERAL Completa-se corretamente o texto acima, respectivamente, com: a) Geral e divisibilidade. b) Geral e inércia. c) Específica e extensão. d) Específica e inércia. e) Geral e extensão.
49 02) Em um recipiente, com 60 ml de água no estado líquido, colocamos um sólido mais denso que a água, fazendo com que o nível do líquido passa para 75 ml. Sabe-se que a massa do sólido é de 30g, podemos afirmar que o sólido adicionado tem uma densidade de: a) 0,5 g/ml. b) 1,0 g/ml. c) 1,5 g/ml. V = V = 15 ml d) 2,0 g/ml. e) 2,5 g/ml. d = 30 m V ml 60 ml d = 2 g/ml
50
51 LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido Separação do ouro das areias auríferas
52 VENTILAÇÃO Consiste em separar os componentes da mistura por uma corrente de ar, que arrasta o componente mais leve Separação dos grãos do café de suas cascas
53 CATAÇÃO É método rudimentar baseado na diferença de tamanho e aspecto das partículas de uma mistura de sólidos granulados. Utilizamos as mãos ou pinças na separação dos componentes Separação das PEDRAS do FEIJÃO
54 PENEIRAÇÃO ou TAMISAÇÃO É usada para separar componentes de misturas de sólidos de tamanhos diferentes; passa-se a mistura por uma peneira Separação da areia dos pedregulhos
55 FLOTAÇÃO Consiste em colocar a mistura de dois sólidos em um líquido de densidade intermediária entre os mesmos Separação do isopor do ferro
56 DISSOLUÇÃO FRACIONADA Consiste em colocar a mistura em um líquido que dissolva apenas um dos componentes Separação do sal da areia
57 SEPARAÇÃO MAGNÉTICA Consiste em passar a mistura pela ação de um imã Separação de limalha de ferro do enxofre
58 DECANTAÇÃO Consiste em deixar a mistura em repouso até que o componente mais denso se deposite no fundo do recipiente A água e óleo Quando os componentes da mistura heterogênea são líquidos imiscíveis usamos o funil de decantação ou funil de bromo para separá-los
59 CENTRIFUGAÇÃO Consiste em colocar a mistura em um aparelho chamado centrífuga, que acelera a decantação, usando a força centrífuga
60 FILTRAÇÃO Consiste em passar a mistura por uma superfície porosa (filtro), que deixa passar o componente líquido ou gasoso, retendo a parte sólida da mistura
61 EVAPORAÇÃO Consiste em deixar a mistura em repouso sob a ação do sol e do vento até que o componente líquido passe para o estado de vapor, deixando apenas o componente sólido Obtenção do sal a partir da água do mar
62 DESTILAÇÃO A destilação é um processo que se utiliza para separar os componentes de uma mistura homogênea e pode ser dividida em SIMPLES e FRACIONADA Obtenção da água pura a partir da água do mar Purificação do álcool retirando água
63
64 01)(Covest-2004) No tratamento de efluentes industriais, é muito comum o emprego de métodos de separação de substâncias. No caso de um efluente constituído por água e óleo, qual dos métodos abaixo é indicado? a) filtração. b) decantação. c) flotação. d) precipitação. e) catação.
65 02)(Covest-2006) Uma mistura é constituída de areia, óleo, açúcar e sal de cozinha. A melhor seqüência experimental para separar essa mistura em seus constituintes puros é: a) destilação do óleo, filtração da areia, dissolução do sal e do açúcar em água. b) dissolução do açúcar e do sal em água, filtração da areia, decantação do óleo, recristalização fracionada da fase aquosa. c) filtração, dissolução do açúcar e do sal em água, decantação do óleo e destilação da fase aquosa. d) destilação do óleo, dissolução do sal e do açúcar em água e separação da areia por filtração. e) filtração do óleo e simples catação dos componentes da fase sólida.
66 03)(Covest-2006) No processo de extração de petróleo, geralmente, estão presentes, em uma mesma amostra, água do mar, petróleo e areia Esta amostra é uma solução, uma vez que os compostos mencionados encontram-se todos em uma única fase. A água sendo uma substância polar dissolve facilmente o petróleo que é constituído por um grande número de compostos orgânicos apolares, de elevada massa molar. 2 2 Para separar a água da areia, podemos empregar tanto um processo de filtração quanto de decantação. 3 3 O petróleo é uma substância simples. 4 4 Na água do mar, estão dissolvidos sais de compostos iônicos, que podem ser separados da água por destilação simples.
67 04) Uma mistura de dois sólidos de densidades diferentes pode ter seus componentes separados por: a) flotação. b) destilação. c) peneiração. d) filtração. e) decantação.
68 05) (Covest) Considere uma mistura de parafina (hidrocarboneto de cadeia longa) finamente dividida e açúcar ( sacarose C12H22O11) refinado. Selecione os processos de separação, na seqüência indicada, mais adequados para essa mistura. a) Dissolução em água, filtração, evaporação. b) Filtração, evaporação, combustão. c) Dissolução em água, floculação, decantação. d) Destilação fracionada a 50 C. e) Combustão, destilação.
69 06) Numa das etapas do tratamento da água que abastece uma cidade, a água é mantida durante um certo tempo em tanques para que os sólidos em suspensão se depositem no fundo. A essa operação denominamos: a) Filtração b) Sedimentação c) Sifonação d) Centrifugação e) Cristalização
70 07) Uma técnica usada para limpar aves cobertas por petróleo consiste em pulverizá-las com limalha de ferro. A limalha que fica impregnada de óleo é, então, retirada das penas das aves por um processo chamado: a) decantação. b) Peneiração. c) Sublimação. d) Centrifugação. e) Separação magnética.
71 08) São preparadas 3 misturas binárias em um l laboratório, descritas da seguinte maneira: 1ª mistura: heterogênea, formada por um sólido e um líquido. 2ª mistura: heterogênea, formada por dois líquidos. 3ª mistura: homogênea, formada por um sólido e um líquido. Os processos de separação que melhor permitem recuperar As substâncias originais são, respectivamente: a) Filtração, decantação, destilação simples. b) Decantação, filtração, destilação simples. c) Destilação simples, filtração, decantação. d) Decantação, destilação simples, filtração. e) Filtração, filtração, destilação simples.
72 É tudo aquilo que ocorre na natureza
73 CLASSIFICAÇÃO DOS FENÔMENOS QUÍMICOS FÍSICOS Alteram a natureza da matéria, isto é, produzem nova(s) substância(s) Não alteram a natureza da matéria, isto é, não produzem nova(s) substância(s)
74 01) (Covest-97) Considere as seguintes tarefas realizadas no dia-a-dia de uma cozinha e indique aquelas que envolvem transformações químicas. 1 Aquecer uma panela de alumínio. 2 Acender um fósforo. 3 Ferver água. 4 Queimar açúcar para fazer caramelo. 5 Fazer gelo. a) 1, 3 e 4. b) 2 e 4. c) 1, 3 e 5. d) 3 e 5. e) 2 e 3.
75 02)(Covest 98) Qual dos processos abaixo envolve transformação química? a) sublimação do gelo seco (CO 2 sólido) b) evaporação da água c) emissão de luz por uma lâmpada incandescente d) dissolução de açúcar em água e) respiração
76 03) (Covest 2000) Em qual dos eventos mencionados abaixo, não ocorre transformação química? a) emissão de luz por um vagalume. b) fabricação de vinho a partir da uva. c) crescimento da massa de pão. d) explosão de uma panela de pressão. e) produção de iogurte a partir do leite.
77 04) (Covest 2003) Em quais das passagens grifadas abaixo está ocorrendo transformação química? I. O reflexo da luz nas águas onduladas pelos ventos lembrava-lhe os cabelos de seu amado. II. A chama da vela confundia-se com o brilho nos seus olhos. III. Desolado, observava o gelo derretendo em seu copo e ironicamente comparava-o ao seu coração. IV. Com o passar dos tempos começou a sentir-se como a velha tesoura enferrujando no fundo da gaveta. Estão corretas apenas: a) I e II. b) II e III. c) III e IV. d) II e IV. e) I e III.
78 05) (CEESU 2003) Fenômeno químico é aquele que altera a natureza da matéria, isto é, é aquele no qual ocorre uma transformação química. Em qual alternativa não ocorre um fenômeno químico? a) A formação do gelo no congelador. b) Queima do carvão. c) Amadurecimento de uma fruta. d) Azedamento do leite. e) A combustão da parafina em uma vela.
79 06) Abaixo são fornecidos alguns fenômenos e a seguir alternativas que os classificam. Assinale a correta. I. Escurecimento de objetos de prata expostos ao ar. II. Evaporação da água dos rios. III. Sublimação da naftalina. IV. Formação da ferrugem. a) somente I é químico. b) todos são físicos. c) III é químico. d) existem dois químicos. e) somente IV é químico.
LOUCOS POR QUÍMICA. PROF. Neif Nagib
 LOUCOS POR QUÍMICA PROF. Neif Nagib SEPARAÇÃO DE MISTURAS Prof. Neif Nagib CATAÇÃO É um método rudimentar baseado na diferença de tamanho e aspecto das partículas de uma mistura de sólidos granulados.
LOUCOS POR QUÍMICA PROF. Neif Nagib SEPARAÇÃO DE MISTURAS Prof. Neif Nagib CATAÇÃO É um método rudimentar baseado na diferença de tamanho e aspecto das partículas de uma mistura de sólidos granulados.
MATÉRIA CORPO OBJETO
 A ciência QUÍMICA está voltada para o estudo da matéria, qualquer que seja sua origem. Observando a composição da matéria, suas transformações e a energia envolvida nesses processos MATÉRIA CORPO OBJETO
A ciência QUÍMICA está voltada para o estudo da matéria, qualquer que seja sua origem. Observando a composição da matéria, suas transformações e a energia envolvida nesses processos MATÉRIA CORPO OBJETO
QUÍMICA INORGÂNICA ESTRUTURA ATÔMICA PROF. NEIF NAGIB
 QUÍMICA INORGÂNICA ESTRUTURA ATÔMICA PROF. NEIF NAGIB JONH DALTON: Postulados de Dalton: 1- Toda matéria é formada por entidades extremamente pequenas, os átomos. 2- Os átomos são indivisíveis. 3- O número
QUÍMICA INORGÂNICA ESTRUTURA ATÔMICA PROF. NEIF NAGIB JONH DALTON: Postulados de Dalton: 1- Toda matéria é formada por entidades extremamente pequenas, os átomos. 2- Os átomos são indivisíveis. 3- O número
Prof. José Valter SEPARAÇÃO DE MISTURAS
 1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
1 Separação de misturas heterogêneas: LEVIGAÇÃO É usada para componentes de misturas de sólidos, quando um dos componentes é facilmente arrastado pelo líquido. Separação do ouro das areias auríferas Separação
LISTA B QUÍMICA TONI ATITUDE
 LISTA B QUÍMICA TONI ATITUDE Site: www.sosprofessor.xpg.com.br Lei da conservação (lei de Lavoisier)= em um sistema fechado a massa total não varia Lei da proporção constante (lei de Proust)= os elementos
LISTA B QUÍMICA TONI ATITUDE Site: www.sosprofessor.xpg.com.br Lei da conservação (lei de Lavoisier)= em um sistema fechado a massa total não varia Lei da proporção constante (lei de Proust)= os elementos
Sistemas, Substâncias puras e Misturas Separação de Misturas
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
SIMPLES SUBSTÂNCIA PURA COMPOSTA HOMOGÊNEO MISTURA HOMOGÊNEA SISTEMA SUBSTÂNCIA PURA HETEROGÊNEO MISTURA HETEROGÊNEA
 Sistemas materiais HOMOGÊNEO SUBSTÂNCIA PURA? SIMPLES MISTURA HOMOGÊNEA? COMPOSTA SISTEMA? HETEROGÊNEO SUBSTÂNCIA PURA MISTURA HETEROGÊNEA Sistema É parte do universo físico que contenha ou não matéria,
Sistemas materiais HOMOGÊNEO SUBSTÂNCIA PURA? SIMPLES MISTURA HOMOGÊNEA? COMPOSTA SISTEMA? HETEROGÊNEO SUBSTÂNCIA PURA MISTURA HETEROGÊNEA Sistema É parte do universo físico que contenha ou não matéria,
Sistemas, Substâncias puras e Misturas Separação de Misturas
 INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA BAIANO Campus Valença Sistemas, Substâncias puras e Misturas Separação de Misturas Professor: José Tiago Pereira Barbosa 1 Sistemas Para facilitar a
PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK
 PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK Substância Pura: Um único tipo de substância Simples: formada por átomos de um único elemento. Composta: formada por átomos de mais de um elemento.
PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: BISMARCK Substância Pura: Um único tipo de substância Simples: formada por átomos de um único elemento. Composta: formada por átomos de mais de um elemento.
26/08/15 SUBSTÂNCIAS E MISTURAS. Prof. Ms. Mayanderson (Xuxu)
 SUBSTÂNCIAS E MISTURAS FENÔMENO FÍSICO: Não altera estrutura íntima da matéria. Exemplos: rasgar papel; derreter gelo (qualquer mudança de estado Físico); passagem de corrente elétrica por um Fio de cobre;
SUBSTÂNCIAS E MISTURAS FENÔMENO FÍSICO: Não altera estrutura íntima da matéria. Exemplos: rasgar papel; derreter gelo (qualquer mudança de estado Físico); passagem de corrente elétrica por um Fio de cobre;
EXERCÍCIOS DE QUÍMICA
 INTRODUÇÃO AO ESTUDO DA QUÍMICA FENÔMENOS FÍSICOS E QUÍMICOS SUBSTÂNCIAS PURAS E MISTURAS ATOMICIDADE - ALOTROPIA 1. (UFPE) Em quais das passagens a seguir está ocorrendo transformação química? (1) O reflexo
INTRODUÇÃO AO ESTUDO DA QUÍMICA FENÔMENOS FÍSICOS E QUÍMICOS SUBSTÂNCIAS PURAS E MISTURAS ATOMICIDADE - ALOTROPIA 1. (UFPE) Em quais das passagens a seguir está ocorrendo transformação química? (1) O reflexo
Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria.
 O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES PROBLEMA HIPÓTESE(S) EXPERIMENTOS CONCLUSÕES CIÊNCIA:
O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES PROBLEMA HIPÓTESE(S) EXPERIMENTOS CONCLUSÕES CIÊNCIA:
PROCESSOS DE SEPARAÇÃO. Prof. Ms. George Verçoza
 PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
PROCESSOS DE SEPARAÇÃO Prof. Ms. George Verçoza Separação magnética: Separa misturas do tipo sólido-sólido nas quais um dos componentes tem propriedades magnéticas e é atraído por um ímã. Ex: Ferro e areia.
QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES. Prof a. Giselle Blois. Estudo da matéria: substâncias, misturas, processos de separação Parte 2
 QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES Estudo da matéria: substâncias, misturas, Parte 2 Prof a. Giselle Blois Métodos de separação de misturas: O método empregado vai depender da mistura, já que esta
QUÍMICA SUBSTÂNCIAS E SUAS PROPRIEDADES Estudo da matéria: substâncias, misturas, Parte 2 Prof a. Giselle Blois Métodos de separação de misturas: O método empregado vai depender da mistura, já que esta
Separação de misturas
 Separação de misturas Filtração: A separação se faz através de uma superfície porosa chamada filtro; o componente sólido ficará retido sobre a sua superfície, separando-se assim do líquido que atravessa.
Separação de misturas Filtração: A separação se faz através de uma superfície porosa chamada filtro; o componente sólido ficará retido sobre a sua superfície, separando-se assim do líquido que atravessa.
SEPARAÇÃO DE MISTURAS
 SEPARAÇÃO DE MISTURAS Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias. Água do mar Não apresenta muita utilidade H 2 O NaCl Apresentam inúmeras aplicações
SEPARAÇÃO DE MISTURAS Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias. Água do mar Não apresenta muita utilidade H 2 O NaCl Apresentam inúmeras aplicações
Processos de Separação Misturas Para misturas Heterogêneas
 Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
MÉTODOS DE SEPARAÇÃO DE MISTURAS. 9º ano
 MÉTODOS DE SEPARAÇÃO DE MISTURAS 9º ano Separações de Misturas são utilizadas para decompor misturas de substâncias em um sistema qualquer nos dois ou mais componentes originais. Podem ser para separar
MÉTODOS DE SEPARAÇÃO DE MISTURAS 9º ano Separações de Misturas são utilizadas para decompor misturas de substâncias em um sistema qualquer nos dois ou mais componentes originais. Podem ser para separar
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROFESSOR: JOÃO MEDEIROS
 COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: JOÃO MEDEIROS 2012 Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias.
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROCESSOS DE SEPARAÇÃO DE MISTURAS PROFESSOR: JOÃO MEDEIROS 2012 Natureza É raro encontrarmos substâncias puras, normalmente encontramos misturas de substâncias.
PROCESSOS DE SEPARAÇÃO. Jeosafá Lima
 PROCESSOS DE SEPARAÇÃO Jeosafá Lima Misturas homogêneas e heterogêneas Uma mistura é constituída por duas ou mais substâncias, sejam elas simples ou compostas. https://www.youtube.com/watch?v=6jcxdhovkcm
PROCESSOS DE SEPARAÇÃO Jeosafá Lima Misturas homogêneas e heterogêneas Uma mistura é constituída por duas ou mais substâncias, sejam elas simples ou compostas. https://www.youtube.com/watch?v=6jcxdhovkcm
Tarefa 22 Professor Gustavo
 6º ano Química Tarefa 22 Professor Gustavo 01. Uma amostra de água do mar contaminada com óleo foi coletada em alto mar. Sobre os procedimentos aplicados para a separação eficiente dos componentes dessa
6º ano Química Tarefa 22 Professor Gustavo 01. Uma amostra de água do mar contaminada com óleo foi coletada em alto mar. Sobre os procedimentos aplicados para a separação eficiente dos componentes dessa
PROMILITARES 09/08/2018 QUÍMICA. Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS
 QUÍMICA Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS Conteúdos abordados na aula de hoje: 1. Matéria, corpo e objeto; 2. Energias; 3. Fenômenos; 4. Classificação da matéria. Matéria e suas transformações
QUÍMICA Professora Caroline Azevedo ASPECTOS MACROSCÓPICOS Conteúdos abordados na aula de hoje: 1. Matéria, corpo e objeto; 2. Energias; 3. Fenômenos; 4. Classificação da matéria. Matéria e suas transformações
Processos de Separação Misturas Para misturas Heterogêneas
 Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
Ventilação: Sólido + Sólido O sólido menos denso é separado por uma corrente de ar. Catação: Sólido + Sólido Sólidos de aspectos diferentes são separados com as mãos ou uma pinça Levigação: Sólido + Sólido
O Que é Química? Pra que serve a Química?²
 O Que é Química? Ciência que estuda as propriedades das substâncias e as leis que regem as suas combinações e decomposições ¹ Pra que serve a Química?² 1 Dicionário Michaelis 2 Figuras retiradas da Web
O Que é Química? Ciência que estuda as propriedades das substâncias e as leis que regem as suas combinações e decomposições ¹ Pra que serve a Química?² 1 Dicionário Michaelis 2 Figuras retiradas da Web
Apostila de Química 12 A Matéria
 Apostila de Química 12 A Matéria 1.0 Átomo x Elemento Átomo é uma partícula fundamental que compõe toda a matéria. Elemento químico é um conjunto de átomos quimicamente iguais (com o mesmo número atômico).
Apostila de Química 12 A Matéria 1.0 Átomo x Elemento Átomo é uma partícula fundamental que compõe toda a matéria. Elemento químico é um conjunto de átomos quimicamente iguais (com o mesmo número atômico).
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017
 ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 1º ano Nome Nº Turma Data 15/12 Nota 08 Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 01) Na química temos
ESCOLA ESTADUAL DR. JOSÉ MARQUES DE OLIVEIRA - ANO 2017 1º ano Nome Nº Turma Data 15/12 Nota 08 Disciplina QUÍMICA TRABALHO Prof. ORLANDO Valor 30 ESTUDOS INDEPENDENTES DE RECUPERAÇÃO 01) Na química temos
PROCESSOS DE SEPARAÇÃO. Professor Cassio Pacheco
 PROCESSOS DE SEPARAÇÃO Professor Cassio Pacheco SEPARAÇÃO DE MISTURAS HETEROGÊNEAS (Processos mecânicos de separação) Sistema sólido - sólido Separação magnética: Separa misturas do tipo sólido-sólido
PROCESSOS DE SEPARAÇÃO Professor Cassio Pacheco SEPARAÇÃO DE MISTURAS HETEROGÊNEAS (Processos mecânicos de separação) Sistema sólido - sólido Separação magnética: Separa misturas do tipo sólido-sólido
SEPARAÇÃO DE MISTURAS
 SEPARAÇÃO DE MISTURAS Métodos de separação de misturas HETEROGÊNEAS SÓLIDO SÓLIDO: Catação Ventilação Levigação Separação magnética Dissolução fracionada Peneiração Flotação SÓLIDO LÍQUIDO: Decantação
SEPARAÇÃO DE MISTURAS Métodos de separação de misturas HETEROGÊNEAS SÓLIDO SÓLIDO: Catação Ventilação Levigação Separação magnética Dissolução fracionada Peneiração Flotação SÓLIDO LÍQUIDO: Decantação
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas:
 Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
Gabarito: Lista Classificação de Sistemas Químicos e Separação de Misturas: Resposta da questão 1: a) Cromo (Cr), manganês (Mn), alumínio ( (A l ) ) e Ferro (Fe). b) A distribuição: 2 2 6 2 6 2 5 1s 2s
Exercícios Métodos de Separação. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017
 Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
Exercícios Métodos de Separação Nome: nº: Ano: 1º E.M. Professor (a): Cassio Pacheco Disciplina: Química Data da entrega: 01/06/2017 Questões Objetivas 1- Para a separação das misturas: gasolina-água e
BIMESTRAL QUÍMICA - 1ºBIMESTRE
 BIMESTRAL QUÍMICA - 1ºBIMESTRE Série: 3ªEM Gabarito Questão 01) O vapor obtido pela ebulição das seguintes soluções: I. água e sal II. água e açúcar III. água e álcool é constituído de água pura apenas:
BIMESTRAL QUÍMICA - 1ºBIMESTRE Série: 3ªEM Gabarito Questão 01) O vapor obtido pela ebulição das seguintes soluções: I. água e sal II. água e açúcar III. água e álcool é constituído de água pura apenas:
Colégio XIX de Março Educação do jeito que deve ser
 Colégio XIX de Março Educação do jeito que deve ser 2018 1ª PROVA SUBSTITUTIVA DE QUÍMICA Aluno(a): Nº Ano: 1º Turma: Data: 07/05/2018 Nota: Professor(a): Taynara e Paulo Fernando Valor da Prova: 40 pontos
Colégio XIX de Março Educação do jeito que deve ser 2018 1ª PROVA SUBSTITUTIVA DE QUÍMICA Aluno(a): Nº Ano: 1º Turma: Data: 07/05/2018 Nota: Professor(a): Taynara e Paulo Fernando Valor da Prova: 40 pontos
Separação de Misturas
 Separação de Misturas Letícia Silva 1 Linguagem Científica Na ciência se faz necessário o uso de uma linguagem onde o significado das palavras não deixa margem de dúvidas ou interpretações diferentes.
Separação de Misturas Letícia Silva 1 Linguagem Científica Na ciência se faz necessário o uso de uma linguagem onde o significado das palavras não deixa margem de dúvidas ou interpretações diferentes.
CIÊNCIAS 9º Ano Ensino Fundamental
 CIÊNCIAS 9º Ano Ensino Fundamental QUÍMICA Densidade É uma propriedade específica da matéria que mede a relação entre a massa e o volume de um material, a uma dada pressão e temperatura. No SI (Sistema
CIÊNCIAS 9º Ano Ensino Fundamental QUÍMICA Densidade É uma propriedade específica da matéria que mede a relação entre a massa e o volume de um material, a uma dada pressão e temperatura. No SI (Sistema
PROMILITARES 16/08/2018 QUÍMICA. Professora Caroline Azevedo SEPARAÇÃO DE MISTURAS
 QUÍMICA Professora Caroline Azevedo SEPARAÇÃO DE MISTURAS Misturas Mistura Homogênea: duas ou mais substâncias com 1 fase. Mistura Heterogênea: duas ou mais substâncias com mais de 1 fase. Processos de
QUÍMICA Professora Caroline Azevedo SEPARAÇÃO DE MISTURAS Misturas Mistura Homogênea: duas ou mais substâncias com 1 fase. Mistura Heterogênea: duas ou mais substâncias com mais de 1 fase. Processos de
RECUPERAÇÃO SEMESTRAL (RS) PROJETO DE RECUPERAÇÃO
 6 anos ETAPA Rec Final 2017 RECUPERAÇÃO SEMESTRAL (RS) PROJETO DE RECUPERAÇÃO DISCIPLINA PROFESSOR CONTEÚDOS QUÍMICA Claudia Figueiredo Apostila 5 Substâncias puras e misturas. Apostila 6,7 e 8 Separação
6 anos ETAPA Rec Final 2017 RECUPERAÇÃO SEMESTRAL (RS) PROJETO DE RECUPERAÇÃO DISCIPLINA PROFESSOR CONTEÚDOS QUÍMICA Claudia Figueiredo Apostila 5 Substâncias puras e misturas. Apostila 6,7 e 8 Separação
GOIÂNIA, / / PROFESSORA: Núbia de Andrade. Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações:
 GOIÂNIA, / / 2017 PROFESSORA: Núbia de Andrade DISCIPLINA: SÉRIE:1º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
GOIÂNIA, / / 2017 PROFESSORA: Núbia de Andrade DISCIPLINA: SÉRIE:1º ALUNO(a): No Anhanguera você é + Enem Antes de iniciar a lista de exercícios leia atentamente as seguintes orientações: - É fundamental
1. Estados físicos da matéria Mudanças de estado Substâncias puras Misturas 4 Exercícios Densidade 6 1.
 1. Estados físicos da matéria 3 1.1 Mudanças de estado 3 1.2 Substâncias puras 4 1.3 Misturas 4 Exercícios 5 1.4 Densidade 6 1.5 Transformação da matéria 6 1.6 Alotropia 6 1.7 Diagramas de fases 6 1.8
1. Estados físicos da matéria 3 1.1 Mudanças de estado 3 1.2 Substâncias puras 4 1.3 Misturas 4 Exercícios 5 1.4 Densidade 6 1.5 Transformação da matéria 6 1.6 Alotropia 6 1.7 Diagramas de fases 6 1.8
Conceitos importantes: a) Matéria : Tudo o que possui massa e ocupa lugar no espaço.
 SISTEMAS QUÍMICOS E SUAS TRANSFORMAÇÕES Prof. Ms. Mayanderson (Xuxu) QUÍMICA: A química estuda a natureza, as propriedades, a composição e as transformações da matéria. Ela está em nosso cotidiano e, ao
SISTEMAS QUÍMICOS E SUAS TRANSFORMAÇÕES Prof. Ms. Mayanderson (Xuxu) QUÍMICA: A química estuda a natureza, as propriedades, a composição e as transformações da matéria. Ela está em nosso cotidiano e, ao
Processos físicos de separação de misturas
 Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
Processos físicos de separação de misturas Misturas heterogêneas sólido-sólido Catação Peneiração Flutuação Separação Magnética Dissolução Fracionada Sublimação CATAÇÃO Baseia-se na identificação visual
Substâncias e Transformações
 Substâncias e Transformações PAESPE 2018 Aula: Mariany Fernandes O QUE É UM SISTEMA? É uma porção limitada do universo, considerada como um todo para efeito de estudo. Homogêneo Heterogêneo Homogêneo:
Substâncias e Transformações PAESPE 2018 Aula: Mariany Fernandes O QUE É UM SISTEMA? É uma porção limitada do universo, considerada como um todo para efeito de estudo. Homogêneo Heterogêneo Homogêneo:
Estados de agregação da matéria. Mudanças de estado. Fenômenos
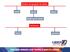 Estados de agregação da matéria sólido líquido gasoso Mudanças de estado Fenômenos físicos químicos Sistemas Interação Aspecto Composição aberto isolado substância mistura fechado homogêneo heterogêneo
Estados de agregação da matéria sólido líquido gasoso Mudanças de estado Fenômenos físicos químicos Sistemas Interação Aspecto Composição aberto isolado substância mistura fechado homogêneo heterogêneo
SOLUÇÃO PRATIQUE EM CASA
 SOLUÇÃO PC1. Incorreta. Seria pura se apresentasse apenas moléculas de água em sua composição, porém, a água potável apresenta diversos tipos de sais dissolvidos. Correta. A água do mar pode se tornar
SOLUÇÃO PC1. Incorreta. Seria pura se apresentasse apenas moléculas de água em sua composição, porém, a água potável apresenta diversos tipos de sais dissolvidos. Correta. A água do mar pode se tornar
SUBSTÂNCIAS PURAS, MISTURAS E SEPARAÇÃO DE MISTURAS.
 SUBSTÂNCIAS PURAS, MISTURAS E SEPARAÇÃO DE MISTURAS. CAPÍTULOS 6 E 7 Prof.ª Tatiana Lima Substâncias Puras * Conceito Toda matéria cuja fusão e ebulição ocorrem a uma temperatura constante. SIMPLES * Tipos
SUBSTÂNCIAS PURAS, MISTURAS E SEPARAÇÃO DE MISTURAS. CAPÍTULOS 6 E 7 Prof.ª Tatiana Lima Substâncias Puras * Conceito Toda matéria cuja fusão e ebulição ocorrem a uma temperatura constante. SIMPLES * Tipos
09) Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão:
 01) Indique a alternativa que completa corretamente as lacunas do seguinte período: Um elemento químico é representado pelo seu..., é identificado pelo número de... e pode apresentar diferentes números
01) Indique a alternativa que completa corretamente as lacunas do seguinte período: Um elemento químico é representado pelo seu..., é identificado pelo número de... e pode apresentar diferentes números
Química B Semiextensivo V. 1
 Química B Semiextensivo V. 1 Exercícios 01) A 02) C 03) A 04) E d = m v Densidade e massa são diretamente proporcionais, ou seja, quanto maior a massa da substância, maior será sua densidade. Já o volume
Química B Semiextensivo V. 1 Exercícios 01) A 02) C 03) A 04) E d = m v Densidade e massa são diretamente proporcionais, ou seja, quanto maior a massa da substância, maior será sua densidade. Já o volume
d) Separação Magnética: Esse processo é empregado quando um dos componentes da mistura é atraído por um imã.
 8. PROCESSOS DE SEPARAÇÃO DE MISTURAS A natureza comporta uma imensa mistura de substancias. A maioria dos materiais que utilizamos no cotidiano é composta de misturas. Na maioria das vezes o que interessa,
8. PROCESSOS DE SEPARAÇÃO DE MISTURAS A natureza comporta uma imensa mistura de substancias. A maioria dos materiais que utilizamos no cotidiano é composta de misturas. Na maioria das vezes o que interessa,
Tarefa 11 Professor Negri. 01. O equipamento esquematizado abaixo pode ser utilizado para separar os componentes de:
 Tarefa 11 Professor Negri 01. O equipamento esquematizado abaixo pode ser utilizado para separar os componentes de: a) um sistema homogêneo líquido/líquido. b) qualquer sistema heterogêneo. c) uma mistura
Tarefa 11 Professor Negri 01. O equipamento esquematizado abaixo pode ser utilizado para separar os componentes de: a) um sistema homogêneo líquido/líquido. b) qualquer sistema heterogêneo. c) uma mistura
Estado Físico Características Macroscópicas Características Microscópicas
 Sistemas materiais Estados de agregação Estado Físico Características Macroscópicas Características Microscópicas Sólido forma e volume constantes. partículas com arranjo característico; formam estruturas
Sistemas materiais Estados de agregação Estado Físico Características Macroscópicas Características Microscópicas Sólido forma e volume constantes. partículas com arranjo característico; formam estruturas
QUÍMICA PROF. AMANDA THOMÉ
 QUÍMICA PROF. AMANDA THOMÉ // QUESTÃO 01 A natureza apresenta grande diversidade de materiais. É preciso analisar a composição e as propriedades desses materiais para que eles possam ser utilizados ou
QUÍMICA PROF. AMANDA THOMÉ // QUESTÃO 01 A natureza apresenta grande diversidade de materiais. É preciso analisar a composição e as propriedades desses materiais para que eles possam ser utilizados ou
Ficha de Revisão - 8º ano
 Ficha de Revisão - 8º ano A matéria pode ser uma SUBSTÂNCIA PURA ou uma MISTURA. As substâncias puras podem ser classificadas em: Simples e Composta. SUBSTÂNCIA SIMPLES É constituída por um único tipo
Ficha de Revisão - 8º ano A matéria pode ser uma SUBSTÂNCIA PURA ou uma MISTURA. As substâncias puras podem ser classificadas em: Simples e Composta. SUBSTÂNCIA SIMPLES É constituída por um único tipo
Disciplina: Química Professor: Cassio Pacheco Turma: 1 Ano
 Disciplina: Química Professor: Cassio Pacheco Turma: 1 Ano Roteiro de Estudos 1- A queima da gasolina; a sublimação da naftalina; o enferrujamento do prego e o derretimento de um bloco de gelo são respectivamente,
Disciplina: Química Professor: Cassio Pacheco Turma: 1 Ano Roteiro de Estudos 1- A queima da gasolina; a sublimação da naftalina; o enferrujamento do prego e o derretimento de um bloco de gelo são respectivamente,
01) (USF-SP) Considerando-se as aparelhagens esquematizadas: Dessas afirmações, apenas:
 01) (USF-SP) Considerando-se as aparelhagens esquematizadas: Dessas afirmações, apenas: a) I é correta. d) I e II são corretas. b) II é correta. e) II e III são corretas. c) III é correta. 05) (UFPE-PE)
01) (USF-SP) Considerando-se as aparelhagens esquematizadas: Dessas afirmações, apenas: a) I é correta. d) I e II são corretas. b) II é correta. e) II e III são corretas. c) III é correta. 05) (UFPE-PE)
QUÍMICA Profº JAISON
 QUÍMICA Profº JAISON Determine o número atômico e o número de massa dos átomos A e B, que são isóbaros e apresentam a seguinte representação: 10+x 5x A 11+x 4x+8 B Afinal, o que é matéria? Chamamos de
QUÍMICA Profº JAISON Determine o número atômico e o número de massa dos átomos A e B, que são isóbaros e apresentam a seguinte representação: 10+x 5x A 11+x 4x+8 B Afinal, o que é matéria? Chamamos de
Recursos para Estudo / Atividades
 COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: QUÍMICA Ano: 1º Professora: Maria Luiza ENSINO MÉDIO Caro aluno, você está recebendo o conteúdo de recuperação.
COLÉGIO NOSSA SENHORA DA PIEDADE Programa de Recuperação Paralela 1ª Etapa 2014 Disciplina: QUÍMICA Ano: 1º Professora: Maria Luiza ENSINO MÉDIO Caro aluno, você está recebendo o conteúdo de recuperação.
La Salle Águas Claras 9º ano. Propriedades da Matéria
 La Salle Águas Claras 9º ano Propriedades da Matéria Matéria Matéria é tudo que tem massa e ocupa lugar no espaço. Não existe vida nem manutenção da vida sem matéria. Uma porção delimitada de matéria recebe
La Salle Águas Claras 9º ano Propriedades da Matéria Matéria Matéria é tudo que tem massa e ocupa lugar no espaço. Não existe vida nem manutenção da vida sem matéria. Uma porção delimitada de matéria recebe
AULA 1 FRENTE 1. Por causa do lançamento, na atmosfera, de grande quantidade de gás carbônico, causador do efeito estufa.
 Exercícios propostos AULA 1 FRENTE 1 1 Assinale na coluna da esquerda para causa e na coluna da direita para consequência do efeito estufa: I I Queimadas nas florestas II II Degelo das calotas polares
Exercícios propostos AULA 1 FRENTE 1 1 Assinale na coluna da esquerda para causa e na coluna da direita para consequência do efeito estufa: I I Queimadas nas florestas II II Degelo das calotas polares
TRANSFORMAÇÕES QUÍMICAS
 TRANSFORMAÇÕES QUÍMICAS MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS TRANSFORMAÇÕES QUÍMICAS Também conhecidas como REAÇÕES QUÍMICAS, as transformações químicas são mudanças onde ocorre a formação de novas substâncias
TRANSFORMAÇÕES QUÍMICAS MÓDULO 1 TRANSFORMAÇÕES QUÍMICAS TRANSFORMAÇÕES QUÍMICAS Também conhecidas como REAÇÕES QUÍMICAS, as transformações químicas são mudanças onde ocorre a formação de novas substâncias
9 o EF. Jeosafá de P. Lima
 9 o EF QUÍMICA Estudo dirigido Jeosafá de P. Lima Todas 1- A combustão do gás de cozinha (gás butano) é representada pela equação química abaixo: C4H10 + 13 / 2 O2 4 CO2 + 5 H2O O número de substâncias
9 o EF QUÍMICA Estudo dirigido Jeosafá de P. Lima Todas 1- A combustão do gás de cozinha (gás butano) é representada pela equação química abaixo: C4H10 + 13 / 2 O2 4 CO2 + 5 H2O O número de substâncias
LOGO. Classificação da matéria. Profa. Samara Garcia
 LOGO Classificação da matéria Profa. Samara Garcia Classificação da matéria Substância pura: matéria formada por unidades químicas iguais, sejam átomos ou moléculas, e assim apresentam propriedades químicas
LOGO Classificação da matéria Profa. Samara Garcia Classificação da matéria Substância pura: matéria formada por unidades químicas iguais, sejam átomos ou moléculas, e assim apresentam propriedades químicas
Lista de exercícios 1- Dos processos abaixo, qual pode ser caracterizado como fenômeno físico?
 Colégio FAAT Ensino Fundamental e Médio Lista de exercícios de Química - 1º Bimestre Nome: Ano: 9ºA/B/C Prof. Marcos Miranda N.: / /17 Pensamento cientifico Laboratório químico Estados físicos e as transformações
Colégio FAAT Ensino Fundamental e Médio Lista de exercícios de Química - 1º Bimestre Nome: Ano: 9ºA/B/C Prof. Marcos Miranda N.: / /17 Pensamento cientifico Laboratório químico Estados físicos e as transformações
TAREFA DA SEMANA DE 28 DE ABRIL A 02 DE MAIO
 TAREFA DA SEMANA DE 28 DE ABRIL A 02 DE MAIO QUÍMICA 1ª SÉRIE TEXTO PARA A PRÓXIMA QUESTÃO: DADOS: Constante universal dos gases perfeitos: 0,082 atm.l/mol.k Elemento Número Massa atômico atômica H 1 1,0
TAREFA DA SEMANA DE 28 DE ABRIL A 02 DE MAIO QUÍMICA 1ª SÉRIE TEXTO PARA A PRÓXIMA QUESTÃO: DADOS: Constante universal dos gases perfeitos: 0,082 atm.l/mol.k Elemento Número Massa atômico atômica H 1 1,0
AULA 1 FRENTE 1. Por causa do lançamento, na atmosfera, de grande quantidade de gás carbônico, causador do efeito estufa.
 Exercícios propostos AULA 1 FRENTE 1 1 Assinale na coluna da esquerda para causa e na coluna da direita para consequência do efeito estufa: I I Queimadas nas florestas II II Degelo das calotas polares
Exercícios propostos AULA 1 FRENTE 1 1 Assinale na coluna da esquerda para causa e na coluna da direita para consequência do efeito estufa: I I Queimadas nas florestas II II Degelo das calotas polares
Curso Pré-ENEM. Química. Profª M.ª Juliana Silva Leite
 Curso Pré-ENEM Química Profª M.ª Juliana Silva Leite O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES
Curso Pré-ENEM Química Profª M.ª Juliana Silva Leite O Que é Química? Química é uma Ciência Experimental que estuda a estrutura, composição e a transformação da matéria. O Método Científico OBSERVAÇÕES
Composição Densidade (g/mol) Carvão 0,3 0,6 Ossos 1,7 2,0 Areia 2,0 2,4 Solo 2,6 2,8 Pedras 2,6 5,0
 QUÍMICA Arqueologistas usam diferenças de densidade para separar as misturas que eles obtêm por escavação. Indique a opção correta para uma mostra que contém a seguinte composição: Composição Densidade
QUÍMICA Arqueologistas usam diferenças de densidade para separar as misturas que eles obtêm por escavação. Indique a opção correta para uma mostra que contém a seguinte composição: Composição Densidade
Exercícios. Exercícios QUÍMICA LISTA DE EXERCÍCIOS 1 ANO. Capítulo 1 Introdução ao Estudo da Química. Capítulo 2 Estados Físicos da Matéria
 Capítulo 1 Introdução ao Estudo da Química : 01 São substâncias puras: a) Um copo de água destilada, refrigerante aberto, granito. b) Barra de ouro, refrigerante sem agitar, ar atmosférico puro. c) Água
Capítulo 1 Introdução ao Estudo da Química : 01 São substâncias puras: a) Um copo de água destilada, refrigerante aberto, granito. b) Barra de ouro, refrigerante sem agitar, ar atmosférico puro. c) Água
Os estados físicos da matéria sólido, líquido e gasoso são chamados também de estados de agregação da matéria. No esquema abaixo,
 QUÍMICA (QUESTÕES 1 10) QUESTÃO 1 Os estados físicos da matéria sólido, líquido e gasoso são chamados também de estados de agregação da matéria. No esquema abaixo, marque a alternativa que representa CORRETAMENTE
QUÍMICA (QUESTÕES 1 10) QUESTÃO 1 Os estados físicos da matéria sólido, líquido e gasoso são chamados também de estados de agregação da matéria. No esquema abaixo, marque a alternativa que representa CORRETAMENTE
Métodos de Separação de Misturas
 Métodos de Separação de Misturas O que é uma mistura? Mistura: associação de duas ou mais substâncias em porções arbitrárias, separáveis por meios mecânicos ou físicos e em que cada um dos componentes
Métodos de Separação de Misturas O que é uma mistura? Mistura: associação de duas ou mais substâncias em porções arbitrárias, separáveis por meios mecânicos ou físicos e em que cada um dos componentes
Química B Intensivo V. 1
 1 Química B Intensivo V. 1 Exercícios 01) B 02) B a) Falsa. O leite in natura é uma mistura heterogênea e não apresenta as mesmas propriedades em toda a extensão da amostra. b) Verdadeira. A gelatina é
1 Química B Intensivo V. 1 Exercícios 01) B 02) B a) Falsa. O leite in natura é uma mistura heterogênea e não apresenta as mesmas propriedades em toda a extensão da amostra. b) Verdadeira. A gelatina é
1. Para a separação das misturas: gasolina-água e nitrogênio-oxigênio, os processos mais adequados são respectivamente:
 2 1. Para a separação das misturas: gasolina-água e nitrogênio-oxigênio, os processos mais adequados são respectivamente: a) decantação e liquefação. b) sedimentação e destilação. c) filtração e sublimação.
2 1. Para a separação das misturas: gasolina-água e nitrogênio-oxigênio, os processos mais adequados são respectivamente: a) decantação e liquefação. b) sedimentação e destilação. c) filtração e sublimação.
Processos de separação de misturas
 Disciplina: Química Prof.: Ivo Turma: IU 23/03/2017 Tema da aula: Métodos de separação de misturas Processos de separação de misturas 1) Separação de misturas heterogêneas Misturas sólido sólido Catação
Disciplina: Química Prof.: Ivo Turma: IU 23/03/2017 Tema da aula: Métodos de separação de misturas Processos de separação de misturas 1) Separação de misturas heterogêneas Misturas sólido sólido Catação
+ Resposta da questão 1: [C]
![+ Resposta da questão 1: [C] + Resposta da questão 1: [C]](/thumbs/84/89370407.jpg) + Resposta da questão 1: Ao absorver o calor do sol, a água recebe a energia necessária para passar do estado líquido para o estado gasoso, processo denominado evaporação. Resposta da questão 2: [Resposta
+ Resposta da questão 1: Ao absorver o calor do sol, a água recebe a energia necessária para passar do estado líquido para o estado gasoso, processo denominado evaporação. Resposta da questão 2: [Resposta
QUÍMICA. Lista de Exercícios / 1º ano. Professora: Geiziane Oliveira Data: / / Aluno(a):
 QUÍMICA Lista de Exercícios / 1º ano. Professora: Geiziane Oliveira Data: / / 2017. Um novo com a tradição de sempre! Aluno(a): 1. (UESC BA) Uma análise da curva de aquecimento dessa amostra de material
QUÍMICA Lista de Exercícios / 1º ano. Professora: Geiziane Oliveira Data: / / 2017. Um novo com a tradição de sempre! Aluno(a): 1. (UESC BA) Uma análise da curva de aquecimento dessa amostra de material
EXERCÍCIOS DE CIÊNCIAS PARA O 9 ano
 EXERCÍCIOS DE CIÊNCIAS PARA O 9 ano 1- Um sistema formado por três cubos de gelo, solução aquosa de sal de cozinha e areia apresenta quantas fases e quantos componentes? 3 componentes (água, areia e sal)
EXERCÍCIOS DE CIÊNCIAS PARA O 9 ano 1- Um sistema formado por três cubos de gelo, solução aquosa de sal de cozinha e areia apresenta quantas fases e quantos componentes? 3 componentes (água, areia e sal)
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) PROFESSOR: JOÃO MEDEIROS
 COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) ESTADOS FÍSICOS E CLASSIFICAÇÃO DA MATÉRIA PROFESSOR: JOÃO MEDEIROS 2012 Matéria Formada por s tipos de átomos Elementos químicos que se diferenciam pelo Z Elemento
COLÉGIO NOVO ANGLO DE JABOTICABAL (QUÍMICA) ESTADOS FÍSICOS E CLASSIFICAÇÃO DA MATÉRIA PROFESSOR: JOÃO MEDEIROS 2012 Matéria Formada por s tipos de átomos Elementos químicos que se diferenciam pelo Z Elemento
Segunda aula de química
 Segunda aula de química Nome: Laísa 17/04/2017 Relembrando... Questão 3: Relembrando... (UNESP 2015) Alguns historiadores da Ciência atribuem ao filósofo pré-socrático. Empédocles a Teoria dos Quatro elementos.
Segunda aula de química Nome: Laísa 17/04/2017 Relembrando... Questão 3: Relembrando... (UNESP 2015) Alguns historiadores da Ciência atribuem ao filósofo pré-socrático. Empédocles a Teoria dos Quatro elementos.
Ciências Físico-Químicas 7º ano Ficha de trabalho nº14 Separação dos componentes de uma mistura
 Para separar os constituintes de uma mistura pode-se recorrer a diferentes processos de separação. Os processos de separação permitem separar diferentes substâncias que inicialmente foram juntas, mantendo
Para separar os constituintes de uma mistura pode-se recorrer a diferentes processos de separação. Os processos de separação permitem separar diferentes substâncias que inicialmente foram juntas, mantendo
Início. Substância pura simples. É formado por apenas um tipo de elemento químico. Exemplo: gás oxigênio (O 2), gás nitrogênio (N 2), ferro (Fe)
 Professores: Alinne Borges Tiago Albuquerque Sandro Sobreira Exercícios Substâncias puras e misturas Material que apresenta TF e TE constantes a uma dada pressão e densidade característica em determinada
Professores: Alinne Borges Tiago Albuquerque Sandro Sobreira Exercícios Substâncias puras e misturas Material que apresenta TF e TE constantes a uma dada pressão e densidade característica em determinada
Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas ; Caderno 2 páginas Exercícios
 Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas 244-257; Caderno 2 páginas 258-280. Exercícios 1. As substâncias podem ser encontradas em três estados físicos, sólido, líquido
Recuperação Final Química 9º Ano Professor Diego Estudar: Caderno 1 páginas 244-257; Caderno 2 páginas 258-280. Exercícios 1. As substâncias podem ser encontradas em três estados físicos, sólido, líquido
QUÍMICA. Lista de Exercícios / 3º ano. Professora: Geiziane Oliveira Data: /02/2017. Aluno(a):
 QUÍMICA Lista de Exercícios / 3º ano. Professora: Geiziane Oliveira Data: /02/2017. Um novo com a tradição de sempre! Aluno(a): 1. (UESC BA) Uma análise da curva de aquecimento dessa amostra de material
QUÍMICA Lista de Exercícios / 3º ano. Professora: Geiziane Oliveira Data: /02/2017. Um novo com a tradição de sempre! Aluno(a): 1. (UESC BA) Uma análise da curva de aquecimento dessa amostra de material
4.1. Separação dos componentes de misturas heterogéneas
 4.1. Separação dos componentes de misturas heterogéneas Separação dos componentes de misturas heterogéneas Para separar os componentes de misturas utilizam-se processos físicos de separação. Durante o
4.1. Separação dos componentes de misturas heterogéneas Separação dos componentes de misturas heterogéneas Para separar os componentes de misturas utilizam-se processos físicos de separação. Durante o
Módulo inicial Materiais: Diversidade e Constituição. Química 10.º ano Ano lectivo 2007/2008
 Química 10.º ano Ano lectivo 2007/2008 Escola Secundária José Saramago Marta Paulino e Ângela Patrício O que é um Material? É algo que tem massa e ocupa espaço. Classificação Materiais: Componentes Origem
Química 10.º ano Ano lectivo 2007/2008 Escola Secundária José Saramago Marta Paulino e Ângela Patrício O que é um Material? É algo que tem massa e ocupa espaço. Classificação Materiais: Componentes Origem
A diferença entre misturas homogêneas e heterogêneas é o número de fases.
 Separação de misturas e saneamento RESUMO Vamos descrever os diversos processos de separação das misturas heterogêneas e homogêneas. Esses processos são de grande importância e largamente empregados nas
Separação de misturas e saneamento RESUMO Vamos descrever os diversos processos de separação das misturas heterogêneas e homogêneas. Esses processos são de grande importância e largamente empregados nas
Exercícios Aspectos Macroscópicos
 Exercícios Aspectos Macroscópicos 1. Observe atentamente os processos abaixo: I. Efervescência ocorrida ao se colocar água oxigenada sobre um ferimento. II. A imagem de uma célula é ampliada por um microscópio.
Exercícios Aspectos Macroscópicos 1. Observe atentamente os processos abaixo: I. Efervescência ocorrida ao se colocar água oxigenada sobre um ferimento. II. A imagem de uma célula é ampliada por um microscópio.
Equipamentos e Técnicas laboratoriais: Amostragem e separação de misturas
 MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA CÂMPUS LAGES Equipamentos e Técnicas laboratoriais: Amostragem e separação de
MINISTÉRIO DA EDUCAÇÃO SECRETARIA DE EDUCAÇÃO PROFISSIONAL E TECNOLÓGICA INSTITUTO FEDERAL DE EDUCAÇÃO, CIÊNCIA E TECNOLOGIA CÂMPUS LAGES Equipamentos e Técnicas laboratoriais: Amostragem e separação de
1. Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão:
 1. Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão: Substância PF ( C) PE ( C) Cloro -101,0-34,6 Flúor -219,6-188,1 Bromo -7,2 58,8 Mercúrio -38,8 356,6 Iodo
1. Considere a tabela de pontos de fusão e ebulição das substâncias a seguir, a 1 atm de pressão: Substância PF ( C) PE ( C) Cloro -101,0-34,6 Flúor -219,6-188,1 Bromo -7,2 58,8 Mercúrio -38,8 356,6 Iodo
Experimentos de Química Orgânica
 Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
Experimentos de Química Orgânica Conhecimento dos procedimentos experimentais Montagem dos equipamentos e execução da reação REAGENTES PRODUTO PRINCIPAL + PRODUTOS SECUNDÁRIOS SOLVENTES + CATALISADORES
DE ATIVIDADES TAREFÃO
 LISTA DE ATIVIDADES TAREFÃO ALUNO(a): TURMA: Valor: 0-2 pontos PROFESSOR(a): DATA: / / *A lista de exercícios deste tarefão estão relacionadas aos seguintes conteúdos: Capitulo 03 Composição da matéria:
LISTA DE ATIVIDADES TAREFÃO ALUNO(a): TURMA: Valor: 0-2 pontos PROFESSOR(a): DATA: / / *A lista de exercícios deste tarefão estão relacionadas aos seguintes conteúdos: Capitulo 03 Composição da matéria:
III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017
 III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017 ENSINO FUNDAMENTAL 9. o ano - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada),
III OLIMPÍADA DE QUÍMICA DO GRANDE ABC - 03/06/2017 ENSINO FUNDAMENTAL 9. o ano - FASE 2 INSTRUÇÕES: 1. A prova consta de 3 questões discursivas (5 pontos cada) e de 17 questões objetivas (1 ponto cada),
Colégio XIX de Março Educação do jeito que deve ser
 Colégio XIX de Março Educação do jeito que deve ser 2017 1ª PROVA PARCIAL DE QUÍMICA Aluno(a): Nº Ano: 1º Turma: Data: 25/03/2017 Nota: Professor(a): Paulo Fernando Valor da Prova: 40 pontos Orientações
Colégio XIX de Março Educação do jeito que deve ser 2017 1ª PROVA PARCIAL DE QUÍMICA Aluno(a): Nº Ano: 1º Turma: Data: 25/03/2017 Nota: Professor(a): Paulo Fernando Valor da Prova: 40 pontos Orientações
SUBSTÂNCIA PURA & MISTURAS
 SUBSTÂNCIA PURA & MISTURAS Química Professora: Danielle Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Sistemas Materiais Substância Pura Mistura Simples Composta Homogênea Heterogênea
SUBSTÂNCIA PURA & MISTURAS Química Professora: Danielle Átomos & Moléculas H + H H H H + H + O O H H Átomos Moléculas Sistemas Materiais Substância Pura Mistura Simples Composta Homogênea Heterogênea
Questão 2. (UFMG) Certas misturas podem ser separadas, usando-se uma destilação simples, realizável numa montagem, como a apresentada nesta figura:
 SE18 - Química LQUI1B2 - Separação de misturas Questão 1 (Cesgranrio 1992) Numa das etapas do tratamento da água que abastece uma cidade, a água é mantida durante um certo tempo em tanques para que os
SE18 - Química LQUI1B2 - Separação de misturas Questão 1 (Cesgranrio 1992) Numa das etapas do tratamento da água que abastece uma cidade, a água é mantida durante um certo tempo em tanques para que os
Colégio XIX de Março Educação do jeito que deve ser
 Colégio XIX de Março Educação do jeito que deve ser 2017 1ª PROVA SUBSTITUTIVA DE QUÍMICA Aluno(a): Nº Ano: 1º Turma: Data: 16/05/2017 Nota: Professor(a): Paulo Fernando Valor da Prova: 40 pontos Orientações
Colégio XIX de Março Educação do jeito que deve ser 2017 1ª PROVA SUBSTITUTIVA DE QUÍMICA Aluno(a): Nº Ano: 1º Turma: Data: 16/05/2017 Nota: Professor(a): Paulo Fernando Valor da Prova: 40 pontos Orientações
SEPARAÇÃO DE MISTURAS. Maira Gazzi Manfro e Giseli Menegat
 SEPARAÇÃO DE MISTURAS Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br CONCEITOS DE FASE E MISTURA Fase é a forma como a mistura se apresenta; é o que
SEPARAÇÃO DE MISTURAS Maira Gazzi Manfro e Giseli Menegat maira.manfro@caxias.ifrs.edu.br giseli.menegat@caxias.ifrs.edu.br CONCEITOS DE FASE E MISTURA Fase é a forma como a mistura se apresenta; é o que
Química B Extensivo V. 2
 Química B Extensivo V. 2 Exercícios Sistema Componentes Fases Classificação Água + gelo 1 2 Heterogêneo Água + 3 cubos de gelo 1 2 Heterogêneo Açúcar + sal 2 2 Heterogêneo Areia + enxofre + sal 3 3 Heterogêneo
Química B Extensivo V. 2 Exercícios Sistema Componentes Fases Classificação Água + gelo 1 2 Heterogêneo Água + 3 cubos de gelo 1 2 Heterogêneo Açúcar + sal 2 2 Heterogêneo Areia + enxofre + sal 3 3 Heterogêneo
QUÍMICA 1ª Série Ensino Médio
 LISTA 02 CENTRO EDUCACIONAL SIGMA QUÍMICA 1ª Série Ensino Médio Materiais Puros e Impuros Método de separação de Misturas Estados de agregação da matéria Números do átomo e distribuição eletrônica Leis
LISTA 02 CENTRO EDUCACIONAL SIGMA QUÍMICA 1ª Série Ensino Médio Materiais Puros e Impuros Método de separação de Misturas Estados de agregação da matéria Números do átomo e distribuição eletrônica Leis
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre
 PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 1ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
PROJETO DE RECUPERAÇÃO PARALELA 1º Trimestre - 2018 Disciplina: Química Série: 1ª série do Ensino Médio Professor(a): Paola Araújo Objetivo: Recuperar o conteúdo referente ao 1º trimestre, mesclando conteúdos
Sumário. Química. Frente 1. Frente 2. Capítulo 1: A matéria 112. Capítulo 1: Modelos atômicos 122. Capítulo 2: Estudando o átomo 130
 Sumário Química Frente 1 Capítulo 1: A matéria 112 Frente 2 Capítulo 1: Modelos atômicos 122 Capítulo 2: Estudando o átomo 130 Capítulo 3: Os elétrons 136 QUÍMICA frente 1 GINO CRESCOLI DREAMSTIME.COM,
Sumário Química Frente 1 Capítulo 1: A matéria 112 Frente 2 Capítulo 1: Modelos atômicos 122 Capítulo 2: Estudando o átomo 130 Capítulo 3: Os elétrons 136 QUÍMICA frente 1 GINO CRESCOLI DREAMSTIME.COM,
