Jornal Oficial das Comunidades Europeias COMISSÃO
|
|
|
- Ágatha Fialho
- 5 Há anos
- Visualizações:
Transcrição
1 PT Jornal Oficial das Comunidades Europeias L 131/17 COMISSÃO DECISÃO DA COMISSÃO de 7 de Maio de 2002 relativa a especificações técnicas comuns para dispositivos médicos de diagnóstico in vitro [notificada com o número C(2002) 1344] (Texto relevante para efeitos do EEE) (2002/364/CE) A COMISSÃO DAS COMUNIDADES EUROPEIAS, Tendo em conta o Tratado que institui a Comunidade Europeia, Tendo em conta a Directiva 98/79/CE do Parlamento Europeu e do Conselho, de 27 de Outubro de 1998, relativa aos dispositivos médicos de diagnóstico in vitro ( 1 ) e, nomeadamente, o n. o 3, segundo parágrafo, do seu artigo 5. o, Considerando o seguinte: (1) A Directiva 98/79/CE estabelece os requisitos essenciais que os dispositivos de diagnóstico in vitro devem respeitar quando são colocados no mercado, e a conformidade com as normas harmonizadas confere uma presunção de conformidade com os requisitos essenciais pertinentes. (2) Excepção aos princípios gerais, a criação de especificações técnicas comuns toma em consideração uma prática corrente em alguns Estados-Membros, pela qual, no que se refere a determinados dispositivos principalmente utilizados na avaliação da segurança do aprovisionamento de sangue e da doação de órgãos, tais especificações são adoptadas pelos poderes públicos. As referidas especificações técnicas comuns podem servir para efeitos de avaliação e de reavaliação do comportamento funcional. (3) À elaboração de especificações técnicas comuns foram associados peritos científicos de diversos interessados directos. (4) A Directiva 98/79/CE dispõe que os Estados-Membros devem estatuir a presunção de que os dispositivos concebidos e fabricados de acordo com as especificações técnicas comuns estabelecidas para determinados dispositivos na categoria de mais alto risco, se encontram em conformidade com os requisitos essenciais. As referidas especificações estabelecerão adequadamente os critérios de avaliação e de reavaliação do comportamento funcional, os critérios de aprovação dos lotes e os métodos e materiais de referência. (5) Regra geral, os fabricantes ficarão obrigados a respeitar as especificações técnicas comuns. Se, por razões devidamente justificadas, os fabricantes não derem cumprimento a tais especificações, devem adoptar soluções que, pelo menos, lhes equivalham. (6) As medidas previstas na presente decisão estão em conformidade com o parecer emitido pelo comité criado pelo n. o 2 do artigo 6. o da Directiva 90/385/CEE do Conselho ( 2 ), ADOPTOU A PRESENTE DECISÃO: Artigo 1. o As especificações técnicas fixadas no anexo da presente decisão são adoptadas como especificações técnicas comuns para os dispositivos médicos de diagnóstico in vitro constantes da lista A do anexo II da Directiva 98/79/CE. Artigo 2. o Os Estados-Membros são os destinatários da presente decisão. Feito em Bruxelas, em 7 de Maio de Pela Comissão Erkki LIIKANEN Membro da Comissão ( 1 ) JO L 331 de , p. 1. ( 2 ) JO L 189 de , p. 17.
2 L 131/18 PT Jornal Oficial das Comunidades Europeias ANEXO ETC ESPECIFICAÇÕES TÉCNICAS COMUNS PARA DISPOSITIVOS MÉDICOS DE DIAGNÓSTICO IN VITRO 1. ÂMBITO DE APLICAÇÃO As presentes especificações técnicas comuns aplicam-se aos dispositivos referidos na lista A do anexo II: reagentes e produtos reagentes, incluindo materiais associados de controlo e de calibração, para determinação dos seguintes grupos sanguíneos: sistema ABO, Rhesus (C, c, D, E, e), anti-kell, reagentes e produtos reagentes, incluindo materiais associados de controlo e de calibração, para detecção, confirmação e quantificação, em amostras humanas, de marcadores da infecção por HIV (HIV 1 e 2), HTLV I e II, hepatite B, CeD. 2. DEFINIÇÕES Sensibilidade (de diagnóstico) A probabilidade de o dispositivo dar um resultado positivo em presença do marcador-alvo. Verdadeiro positivo Uma amostra que se saiba ser positiva para o marcador-alvo e que seja classificada correctamente pelo dispositivo. Falso negativo Uma amostra que se saiba ser positiva para o marcador-alvo e que seja classificada incorrectamente pelo dispositivo. Especificidade (de diagnóstico) A probabilidade de o dispositivo dar um resultado negativo na ausência do marcador-alvo. Falso positivo Uma amostra que se saiba ser negativa para o marcador-alvo e seja classificada incorrectamente pelo dispositivo. Verdadeiro negativo Uma amostra que se saiba ser negativa para o marcador-alvo e que seja classificada correctamente pelo dispositivo. Sensibilidade analítica No contexto das ETC, pode ser expressa como o limite de detecção, ou seja, a quantidade mais pequena do marcador-alvo que pode ser detectada com precisão. Especificidade analítica A capacidade do método para determinar apenas o marcador-alvo. Técnicas de amplificação dos ácidos nucleicos (NAT) No contexto do presente documento, o termo «NAT» é utilizado para os testes de detecção e/ou quantificação dos ácidos nucleicos por amplificação de uma sequência-alvo, por amplificação de um sinal ou por hibridação. Teste rápido Neste contexto, «teste rápido» refere-se aos testes que só podem ser usados separadamente ou numa pequena série e que foram concebidos para dar um resultado rápido no caso de testes efectuados próximo dos pacientes. Robustez A robustez de um procedimento analítico é uma medida da sua capacidade de permanecer inalterado por variações pequenas mas deliberadas dos parâmetros do método, fornecendo uma indicação da sua fiabilidade em condições normais de utilização.
3 PT Jornal Oficial das Comunidades Europeias L 131/19 Taxa total de insucesso do sistema A taxa total de insucesso do sistema é a frequência de insucessos quando a totalidade do processo é realizado tal como indicado pelo fabricante. 3. ESPECIFICAÇÕES TÉCNICAS COMUNS (ETC) PARA OS PRODUTOS DEFINIDOS NA LISTA A DO ANEXO II DA DIRECTIVA 98/79/CE 3.1. ETC para a avaliação do comportamento funcional de reagentes e produtos reagentes para detecção, confirmação e quantificação, em amostras humanas, de marcadores da infecção por HIV (HIV 1 e 2), HTLV I e II, hepatite B, CeD: Princípios gerais Os dispositivos de detecção de infecções virais colocados no mercado para realizarem testes de rastreio ou de diagnóstico, cumprirão os mesmos requisitos quanto à sensibilidade e à especificidade (ver quadro 1) Os dispositivos destinados pelo fabricante a testar os fluídos corporais além do soro ou do plasma, por exemplo, urina, saliva, etc., cumprirão os mesmos requisitos das ETC para os testes de soro ou plasma, quanto à sensibilidade e especificidade. A avaliação do comportamento funcional testará amostras dos mesmos indivíduos em ambos os testes a serem aprovados e em testes correspondentes de soro ou plasma Os dispositivos destinados pelo fabricante ao autodiagnóstico, ou seja, a poderem ser utilizados no domicílio, cumprirão os mesmos requisitos das ETC quanto à sensibilidade e especificidade que os dispositivos correspondentes para uso profissional. Certas partes da avaliação do comportamento funcional serão realizadas (ou repetidas) por utilizadores leigos para validar o funcionamento do dispositivo e as instruções de utilização Todas as avaliações do comportamento funcional devem ser realizadas em comparação directa com um dispositivo reconhecido que tenha um comportamento funcional aceitável. O dispositivo utilizado para comparação comportará a marcação CE, se estiver no mercado na altura da avaliação do comportamento funcional Se se identificarem resultados discrepantes durante uma avaliação, a situação será resolvida na medida do possível, por exemplo: avaliando a amostra discrepante através de outros sistemas de teste, usando um método ou um marcador alternativo, analisando novamente a situação clínica e o diagnóstico do paciente, e testando novas amostras As avaliações do comportamento funcional serão realizadas numa população equivalente à população europeia Serão seleccionadas amostras positivas utilizadas na avaliação do comportamento funcional por forma a reflectir as diferentes fases da(s) doenças(s) correspondentes, diferentes padrões de anticorpos, diferentes genótipos, diferentes subtipos, etc No caso dos dispositivos para testes de rastreio do sangue (à excepção dos testes de HBsAg), todas as amostras verdadeiras positivas serão identificadas como positivas pelo dispositivo a comportar a marcação CE (quadro 1). No caso dos testes HBsAg, o novo dispositivo terá um comportamento funcional global pelo menos equivalente ao do dispositivo reconhecido (ver princípio 3.1.4). A sensibilidade dos testes de diagnóstico durante a fase inicial da infecção (seroconversão) tem de representar o progresso técnico. Quer os novos testes dos mesmos ou outros painéis de seroconversão sejam realizados pelo organismo notificado ou pelo fabricante, os resultados confirmarão os dados iniciais da avaliação do comportamento funcional (ver quadro 1) As amostra negativas utilizadas numa avaliação do comportamento funcional devem ser definidas por forma a reflectir a população-alvo à qual se destina o teste, por exemplo, dadores de sangue, pacientes hospitalizados, grávidas, etc No caso de avaliações do comportamento funcional para testes de rastreio (quadro 1), serão investigadas populações de dadores de sangue de, pelo menos, dois centros de doação de sangue e consistirão em doações de sangue consecutivas que não tenham sido seleccionadas para excluir dadores que deram sangue pela primeira vez Os dispositivos terão uma especificidade de, pelo menos, 99,5 % relativamente às doações de sangue, salvo indicação em contrário nos quadros anexos. A especificidade será calculada utilizando a frequência de resultados repetidamente reactivos (ou seja, falsos positivos) em dadores de sangue negativos para o marcador-alvo Os dispositivos serão avaliados para estabelecer o efeito de substâncias potencialmente no âmbito da avaliação do comportamento funcional. As substâncias potencialmente a avaliar dependerão, em certa medida, da composição do reagente e do tipo do teste. As substâncias potencialmente serão identificadas no âmbito da análise de risco exigida pelos requisitos essenciais para cada novo dispositivo, mas podem incluir, por exemplo: amostras que representem infecções «afins»,
4 L 131/20 PT Jornal Oficial das Comunidades Europeias amostras de multíparas, ou seja, mulheres que tenham tido mais de uma gravidez, ou de pacientes com factor reumatóide positivo, para os antigénios recombinantes, anticorpos humanos a componentes do sistema de expressão, por exemplo, anti-e. coli ou anti-levedura No caso de dispositivos destinados pelo fabricante a serem utilizados com soro ou plasma, a avaliação do comportamento funcional tem de demonstrar uma equivalência entre o soro e o plasma. Isto será demonstrado em, pelo menos, 50 doações No caso de dispositivos destinados a serem utilizados com plasma, a avaliação do comportamento funcional verificará o comportamento funcional do dispositivo utilizando todos os anticoagulantes que o fabricante indicou para serem usados com o dispositivo. Isto será demonstrado em, pelo menos, 50 doações No âmbito da análise de risco exigida, a taxa total de insucesso do sistema que origina resultados falsos negativos será determinada através da repetição de testes em amostras fracamente positivas Requisitos adicionais para as técnicas de amplificação dos ácidos nucleicos (NAT) Os critérios de avaliação do comportamento funcional para os testes NAT encontram-se no quadro Para os testes de amplificação de sequências-alvo, será aplicado um controlo de funcionalidade para cada amostra (controlo interno) representativo do progresso técnico. Este controlo será utilizado o mais possível em todo o processo, ou seja, extracção, amplificação/hibridação, detecção A sensibilidade analítica ou o limite de detecção para os testes NAT serão expressos pelo valor limiar positivo de 95 %. Esta é a concentração do analito em que 95 % dos testes dão resultados positivos no seguimento de uma série de diluições de um material de referência internacional, por exemplo, um material padronizado da OMS ou materiais de referência calibrados A detecção dos genótipos será demonstrada por validação da concepção de iniciadores e de sondas apropriados e será também validada através de testes a amostras com determinação do genótipo Os resultados de testes NAT quantitativos remeterão para os materiais padronizados internacionais ou para materiais de referência calibrados, se disponíveis, e serão expressos em unidades internacionais utilizadas no âmbito de aplicação específico Os testes NAT podem ser utilizados para detectar vírus em amostras negativas para anticorpos, ou seja, amostras de pré-seroconversão. Os vírus contidos em complexos imunes podem ter comportamentos diferentes dos vírus em liberdade, por exemplo, durante uma determinada fase de centrifugação. Assim, é importante que durante os estudos de robustez sejam incluídas amostras negativas para anticorpos (pré-seroconversão) Para a investigação de potenciais transferências, serão realizados durante os estudos de robustez pelo menos cinco testes, alternadamente, com amostras fortemente positivas e negativas. As amostras fortemente positivas consistirão em amostras com títulos elevados de vírus no estado natural A taxa total de insucesso do sistema que conduz a resultados falsos negativos será determinada através de testes a amostras fracamente positivas. As amostras fracamente positivas conterão uma concentração de vírus equivalente a3 95 % da concentração limiar positiva de vírus ETC para os testes de aprovação, por parte dos fabricantes, de reagentes e produtos reagentes para detecção, confirmação e quantificação, em amostras humanas, de marcadores da infecção por HIV (HIV 1 e 2), HTLV I e II e hepatite B, C e D(apenas testes imunológicos) Os critérios dos testes de aprovação por parte do fabricante assegurarão que cada lote identifique sistematicamente os antigénios, epitopos e anticorpos pertinentes Os testes de aprovação dos lotes por parte do fabricante incluirão, pelo menos, 100 amostras negativas relativamente ao analito pertinente ETC para a avaliação do comportamento funcional de reagentes e produtos reagentes para determinação dos antigénios dos grupos sanguíneos: ABO (A, B), Rhesus (C, c, D, E, e) e Kell (K) Os critérios para a avaliação do comportamento funcional de reagentes e produtos reagentes para a determinação dos grupos sanguíneos ABO (A, B), Rhesus (C, c, D, E, e) e Kell (K) encontram-se no quadro Todas as avaliações do comportamento funcional serão realizadas em comparação directa com um dispositivo reconhecido que tenha um comportamento funcional aceitável. O dispositivo utilizado para comparação comportará a marcação CE, se estiver no mercado na altura da avaliação do comportamento funcional Se se identificarem resultados discrepantes durante uma avaliação, a situação será resolvida na medida do possível, por exemplo: avaliando a amostra discrepante através de outros sistemas de teste, usando um método alternativo A avaliação do comportamento funcional será realizada numa população equivalente à população europeia.
5 PT Jornal Oficial das Comunidades Europeias L 131/ Serão seleccionadas amostras positivas utilizadas na avaliação do comportamento funcional para reflectir a expressão antigénica variante e fraca Os dispositivos serão avaliados para estabelecer o efeito de substâncias potencialmente, no âmbito da avaliação do comportamento funcional. As substâncias potencialmente a avaliar dependerão, em certa medida, da composição do reagente e do tipo do teste. As substâncias potencialmente serão identificadas no âmbito da análise de risco exigida pelos requisitos essenciais para cada novo dispositivo No caso de dispositivos destinados a serem utilizados com plasma, a avaliação do comportamento funcional verificará o comportamento funcional do dispositivo utilizando todos os anticoagulantes que o fabricante indicou para serem usados com o dispositivo. Isto será demonstrado em, pelo menos, 50 doações ETC para os testes de aprovação, por parte dos fabricantes, de reagentes e produtos reagentes para determinação dos antigénios dos grupos sanguíneos: ABO (A, B), Rhesus (C, c, D, E, e) e Kell (K) Os critérios dos testes de aprovação por parte do fabricante assegurarão que cada lote identifique sistematicamente os antigénios, epitopos e anticorpos pertinentes Os requisitos para os testes de aprovação dos lotes a efectuar pelos fabricantes são indicados no quadro 10.
6 Sensibilidade de diagnóstico Amostras positivas 400 HIV HIV 2 incluindo: 40 subtipos não-b, todos os subtipos de HIV/1 devem ser representados por, pelo menos, 3 amostras por subtipo Painéis de seroconversão Quadro 1: Testes de «rastreio»: anti-hiv 1 e 2, anti-htlv I e II, anti-hcv, HBsAg, anti-hbc Anti-HIV 1/2 Anti-HTL I/II Anti-VHC HBsAg Anti-HBc 20 painéis 10 painéis suplementares (no organismo notificado ou no fabricante) 300 HTLV I 100 HTLV II A definir quando disponíveis 400 incluindo genótipos 1a-4a: pelo menos 20 amostras/ /genótipos 4 não-a e 5: pelo menos 10 amostras/ /genótipo 20 painéis 10 painéis suplementares (no organismo notificado ou no fabricante) 400 incluindo consideração de subtipo 20 painéis 10 painéis suplementares (no organismo notificado ou no fabricante) Sensibilidade analítica Materiais padronizados 0,5 ng/ml (material padronizado francês ou britânico até que o da OMS esteja disponível) Especificidade Dadores não seleccionados (incluindo primeiros dadores) 400 incluindo avaliação de outros marcadores HBV A definir quando disponíveis Pacientes hospitalizados Amostras de sangue passíveis de reacção cruzada (FR+, vírus afins, grávidas, etc.) L 131/22 PT Jornal Oficial das Comunidades Europeias
7 Quadro 2: Testes NAT para HIV 1, HCV, HBV, HTLV I/II (qualitativos e quantitativos; não inclui tipagem molecular) HIV 1 HCV HBV HTLV I/II NAT Qualitativos Quantitativos Qualitativos Como para os testes quantitativos HIV Limite de detecção da sensibilidade. Detecção da sensibilidade analítica (UI/ml; definida por materiais padronizados da OMS ou por materiais de referência calibrados) Eficácia da detecção/ /quantificação do genótipo/subtipo várias séries de diluições na concentração limite; análises estatísticas (por exemplo, análises pelo método de Probit) com base em, pelo menos, 24 réplicas; cálculo do valor limiar de 95 % Limite de detecção: como para os testes qualitativos; Limite de quantificação: diluições (semi-logarítmicas de base 10 ou menos) de preparações de referência calibradas, definição de limite de quantificação inferior e superior, precisão, exactidão, intervalo de medida «linear», «intervalo dinâmico». A reprodutibilidade em diferentes níveis de concentração deve ser demonstrada. várias séries de diluições na concentração limite; análises estatísticas (por exemplo, análises pelo método de Probit) com base em, pelo menos, 24 réplicas; cálculo do valor limiar de 95 % Pelo menos 10 amostras Séries de diluição de Pelo menos 10 amos- por subtipo todos os genótipos/ tras por genótipo (segundo disponibilidade) /subtipos pertinentes, de (segundo disponibili- preferência de materiais dade) Sobrenadantes de de referência segundo culturas celulares disponibilidade (podem substituir os Podem ser utilizados subtipos raros de HIV 1) plasmidos ou transcritos quantificados pelos métodos apropriados. na medida em que os materiais de referência calibrados por subtipo estejam disponíveis, transcritos in vitro podem ser uma opção na medida em que os materiais de referência calibrados por subtipo estejam disponíveis, transcritos in vitro podem ser uma opção Quantitativos Quantitativos Quantitativos Qualitativos várias séries de diluições na concentração limite; análises estatísticas (por exemplo, análises pelo método de Probit) com base em, pelo menos, 24 réplicas; cálculo do valor limiar de 95 % Segundo a disponibilidade de materiais de referência genotípicos calibrados na medida em que os materiais de referência calibrados por subtipo estejam disponíveis, transcritos in vitro podem ser uma opção Como para os testes quantitativos HIV Qualitativos várias séries de diluições na concentração limite; análises estatísticas (por exemplo, análises pelo método de Probit) com base em, pelo menos, 24 réplicas; cálculo do valor limiar de 95 % Segundo a disponibilidade de materiais de referência genotípicos calibrados na medida em que os materiais de referência calibrados por subtipo estejam disponíveis, transcritos in vitro podem ser uma opção Como para os testes quantitativos HIV Critérios de aceitação PT Jornal Oficial das Comunidades Europeias L 131/23
8 HIV 1 HCV HBV HTLV I/II NAT Qualitativos Quantitativos Qualitativos Como para os testes quantitativos HIV Especificidade de diagnóstico amostras negativas Marcadores passíveis de reacção cruzada Quantitativos Quantitativos Quantitativos Qualitativos Como para os testes quantitativos HIV Qualitativos 500 dadores de sangue 100 dadores de sangue 500 dadores de sangue 500 dadores de sangue 500 doações de sangue individuais Provando que a concepção do teste é adequada (ex. por comparação de sequências) e/ou testando pelo menos 10 amostras positivas para um retrovirus humano (exemplo HTLV) Como para os testes qualitativos Robustez Como para os testes qualitativos Contaminação cruzada Pelo menos 5 testes utilizando, em alternância, amostras fortemente positivas (conhecidas por aparecerem naturalmente) e negativas Inibição Controlo interno seguindo de preferência todo o processo NAT Taxa total de insucesso do sistema que conduz a resultados falsos negativos Pelo menos 100 amostras infectadas pelo vírus com 3 95 % da concentração do limiar positivo Segundo a concepção do teste e/ou testando pelo menos 10 amostras positivas para os flavivirus humanos (exemplo HGV, YFV) Pelo menos 5 testes utilizando, em alternância, amostras fortemente positivas (conhecidas por aparecerem naturalmente) e negativas Controlo interno seguindo de preferência todo o processo NAT Pelo menos 100 amostras infectadas pelo vírus com 3 95 % da concentração do limiar positivo ( 1 ) Farmacopeia Europeia Nota: Critérios de aceitação para a «taxa total de insucesso do sistema que conduz a resultados falsos negativos»: 99 % de testes positivos Segundo a concepção do teste e/ou testando pelo menos 10 amostras positivas para outros vírus ADN Pelo menos 5 testes utilizando, em alternância, amostras fortemente positivas (conhecidas por aparecerem naturalmente) e negativas Controlo interno seguindo de preferência todo o processo NAT Pelo menos 100 amostras infectadas pelo vírus com 3 95 % da concentração do limiar positivo Segundo a concepção do teste ou testando pelo menos 10 amostras positivas para um retrovirus humano (exemplo HIV) Pelo menos 5 testes utilizando, em alternância, amostras fortemente positivas (conhecidas por aparecerem naturalmente) e negativas Controlo interno seguindo de preferência todo o processo NAT Pelo menos 100 amostras infectadas pelo vírus com 3 95 % da concentração do limiar positivo Como para os testes quantitativos HIV Critérios de aceitação 99 % de testes positivos L 131/24 PT Jornal Oficial das Comunidades Europeias
9 nega- Amostras tivas Amostras tivas Sensibilidade de diagnóstico posi- Especificadade de diagnóstico Quadro 3: Testes rápidos: anti HIV 1 e 2, anti-hcv, HBsAg, anti-hbc, anti-htlv I e II Anti-HIV 1/2 Anti-HCV HBsAg Anti-HBc Anti-HTLV I/II Critérios de aceitação Mesmos critérios que para os testes de rastreio doações de sangue Mesmos critérios que para os testes de rastreio doações de sangue Mesmos critérios que para os testes de rastreio doações de sangue Mesmos critérios que para os testes de rastreio doações de sangue Mesmos critérios que para os testes de rastreio doações de sangue 200 amostras clínicas 200 amostras clínicas 200 amostras clínicas 200 amostras clínicas 200 amostras clínicas 200 amostras de grávidas 100 amostras potencialmente 200 amostras de grávidas 100 amostras potencialmente 100 amostras potencialmente 200 amostras de grávidas 100 amostras potencialmente 200 amostras de grávidas 100 amostras potencialmente Mesmos critérios que para os testes de rastreio 99 % (anti-hbc: 96 %) PT Jornal Oficial das Comunidades Europeias L 131/25
10 Quadro 4: Testes de confirmação e suplementares para anti-hiv 1 e 2,anti-HTLV I e II, anti-hcv, HBsAg Teste de confirmação anti-hiv Teste de confirmação anti-htlv Teste suplementar HCV Teste de confirmação HBsAg Critérios de aceitação L 131/26 Sensibilidade de diagnóstico Amostras positivas 200 HIV 1 e 100 HIV HTLV Ie 100 HTLV II 300 HCV 300 HBsAG Identificação correcta como positiva (ou indeterminada), não como negativa Incluindo amostras de fases diferentes de infecção e reflectindo diferentes padrões de anticorpos Painéis de seroconversão 15 painéis de seroconversão/painéis de baixo título Incluindo amostras de diferentes fases de infecção e reflectindo diferentes padrões de anticorpos genótipos 1 4a: 15 amostras; genótipos 4 (não a), 5: 5 amostras; 6: se disponíveis 15 painéis de seroconversão/painéis de baixo título Incluindo amostras de diferentes fases de infecção 20 amostras «fortemente positivas» (> 50 ng HBsAg/ml); 20 amostras no intervalo do valor limiar 15 painéis de seroconversão/painéis de baixo título Sensibilidade de analítica Materiais padronizado Materiais padronizados HBsAG (AdM, NIBSC, OMS) Especificidade de diagnóstico Amostras negativas 200 doações de sangue 200 doações de sangue 200 doações de sangue 20 falsos positivos com o teste de rastreio correspondente ( 1 ) ( 1 ) Critérios de aceitação: sem neutralização para o teste de confirmação HBsAg. 200 amostras clínicas incluindo grávidas, incluindo amostras com resultados indeterminados noutros testes de confirmação 200 amostras clínicas incluindo grávidas, incluindo amostras com resultados indeterminados noutros testes de confirmação 200 amostras clínicas incluindo grávidas, incluindo amostras com resultados indeterminados noutros testes de confirmação Nenhum resultado falso positivo/ ( 1 ) sem neutralização PT Jornal Oficial das Comunidades Europeias
11 Quadro 5: Antigénio do HIV 1 Teste do antigénio do HIV 1 Sensibilidade de diagnóstico Amostras positivas 50 HIV 1 Ag positivo 50 sobrenadantes de culturas celulares incluindo diferentes subtipos de HIV 1eHIV2 Painéis de seroconversão 20 painéis de seroconversão/painéis de baixo título Sensibilidade analítica Materiais padronizados ADM ou 1. a referência internacional < 50 pg/ml Especificidade de diagnóstico Quadro 6: Teste de serotipagem do HCV 200 doações de sangue 200 amostras clínicas Teste de serotipagem do HCV 1 Sensibilidade de diagnóstico Amostras positivas 200 incl. genótipos 1 4a:> 20 amostras. 4 (não a); 5: > 10 amostras; 6: se disponíveis Especificidade de diagnóstico Amostras negativas 100 Critérios de aceitação Identificação correcta (após neutralização) 99,5 % após neutralização Critérios de aceitação 95 % de concordância entre a serotipagem e a genotipagem PT Jornal Oficial das Comunidades Europeias L 131/27
12 Sensibilidade de diagnóstico Amostras positivas 100 indivíduos vacinados 100 indivíduos infectados de forma natural Painéis de seroconversão Quadro 7: Marcadores HBV: anti-hbs, anti-igm HBc, anti-hbe, HbeAg Anti-HBs Anti-HBC IgM Anti-HBe HBeAg Critérios de aceitação 10 repetições ou seroconversões anti-hbs Sensibilidade analítica Material padronizado Material padronizado da OMS Especificidade de diagnóstico Amostras negativas 500 incluindo amostras clínicas 200 incluindo amostras de fases diferentes de infecção (aguda/crónica, etc.) Quando disponível Sensibilidade de diagnóstico Amostras positivas 100 especificando marcadores HBV Especificidade de diagnóstico Amostras negativas 200 incluindo amostras clínicas 200 incluindo amostras de fases diferentes de infecção (aguda/crónica, etc.) 200 incluindo amostras de fases diferentes de infecção (aguda/crónica, etc.) Material normalizado do PEI 98 % 200 doações de sangue 200 doações de sangue 200 doações de sangue 98 % 200 amostras clínicas 200 amostras clínicas 200 amostras clínicas Quadro 8: Marcadores HDV: anti-hdv, anti-igm HDV, antigénio Delta Anti-HBs: < 10 mui/ml Anti-HDV Anti-IgM HDV Antigénio Delta Critérios de aceitação 50 especificando marcadores HBV 200 incluindo amostras clínicas 10 especificando marcadores HBV 98 % % incluindo amostras clínicas L 131/28 PT Jornal Oficial das Comunidades Europeias
13 Quadro 9: Grupos sanguíneos ABO, Rhesus (C, c, D, E, e) e Kell Especifidade N. o de testes por método recomendado N. o total de amostras a analisar para um produto em lançamento N. o total de amostras a analisar para uma nova formulação ou utilização de reagentes bem caracterizados Anti-A, BeAB Anti-D Anti-C, c, E Anti-e Anti-K Critérios de aceitação: Todos os reagentes atrás indicados devem demonstrar resultados comparáveis com reagentes reconhecidos com um comportamento funcional aceitável no que respeita à alegada reactividade do dispositivo. Para um reagente reconhecido, quando a sua aplicação ou utilização tenha sido alterada ou alargada, devem ser realizados outros testes de acordo com as exigências definidas na coluna 1 (em cima). A avaliação do comportamento funcional dos reagentes anti-d deve incluir testes contra gama de amostras RhD fracas e Rh parciais, dependendo da utilização prevista do produto. Qualificação: Amostras clínicas: 10 % da população a testar Amostras de recém-nascidos: > 2 % da população a testar Amostras ABO: > 40 % A, B positivo «D fraco»: > 2 % de Rhesus positivos PT Jornal Oficial das Comunidades Europeias L 131/29
14 L 131/30 PT Jornal Oficial das Comunidades Europeias Quadro 10: Critérios de aprovação de lotes para os grupos sanguíneos ABO, Rhesus (C, c, D, E, e) e Kell 1. Reagentes de ensaio Requisitos relativos aos testes de especificidade em cada reagente Critérios de aceitação: Cada lote de reagente deve exibir resultados positivos ou negativos inequívocos através de todas as técnicas recomendadas em conformidade com os resultados obtidos dos dados da avaliação do comportamento funcional. 2. Materiais de controlo (glóbulos vermelhos) O fenótipo dos glóbulos vermelhos utilizado no controlo dos reagentes atrás enumerados deve ser confirmado utilizando um dispositivo reconhecido.
DECISÕES COMISSÃO. (Texto relevante para efeitos do EEE) (2009/886/CE)
 PT 4.12.2009 Jornal Oficial da União Europeia L 318/25 II (Actos aprovados ao abrigo dos Tratados CE/Euratom cuja publicação não é obrigatória) DECISÕES COMISSÃO DECISÃO DA COMISSÃO de 27 de Novembro de
PT 4.12.2009 Jornal Oficial da União Europeia L 318/25 II (Actos aprovados ao abrigo dos Tratados CE/Euratom cuja publicação não é obrigatória) DECISÕES COMISSÃO DECISÃO DA COMISSÃO de 27 de Novembro de
DIAGNÓSTICO LABORATORIAL DAS HEPATITES VIRAIS. Profa. Ms.: Themis Rocha
 DIAGNÓSTICO LABORATORIAL DAS HEPATITES VIRAIS Profa. Ms.: Themis Rocha MARCADORES INESPECÍFICOS Aminotransferases ALT ou TGP e AST ou TGO. Bilirrubinas. Fosfatase alcalina. Linfocitose. ISOTIPOS DE ANTICORPOS
DIAGNÓSTICO LABORATORIAL DAS HEPATITES VIRAIS Profa. Ms.: Themis Rocha MARCADORES INESPECÍFICOS Aminotransferases ALT ou TGP e AST ou TGO. Bilirrubinas. Fosfatase alcalina. Linfocitose. ISOTIPOS DE ANTICORPOS
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg)
 HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
HBsAg Quantitativo Sistema ARCHITECT / Abbott (Clareamento do HBsAg) USO PRETENDIDO O ensaio HBsAg é um imunoensaio de micropartículas por quimioluminescência (CMIA) para a determinação quantitativa do
HIV 1 E 2 - ANTICORPOS - CLIA - TESTE DE TRIAGEM
 HIV 1 E 2 - ANTICORPOS - CLIA - TESTE DE TRIAGEM Material...: Método...: Soro Quimioluminescência - Imunoensaio de 4ª geração Leitura...: 0,13 Não reagente: Inferior a 1,00 Reagente...: Superior ou igual
HIV 1 E 2 - ANTICORPOS - CLIA - TESTE DE TRIAGEM Material...: Método...: Soro Quimioluminescência - Imunoensaio de 4ª geração Leitura...: 0,13 Não reagente: Inferior a 1,00 Reagente...: Superior ou igual
Tópicos. Definição. Ensaios de diagnóstico 27/11/2013. Critérios de Validação de Ensaios de Diagnóstico Imunológico e Molecular
 Tópicos Critérios de Validação de Ensaios de Diagnóstico Imunológico e Molecular Prof. Alan McBride Rastreabilidade Molecular Biotecnologia, CDTec, UFPel 2013.2 Ensaios diagnósticos. Fatores a considerar
Tópicos Critérios de Validação de Ensaios de Diagnóstico Imunológico e Molecular Prof. Alan McBride Rastreabilidade Molecular Biotecnologia, CDTec, UFPel 2013.2 Ensaios diagnósticos. Fatores a considerar
VALIDAÇÃO DE MÉTODOS ANALÍTICOS
 VALIDAÇÃO DE MÉTODOS ANALÍTICOS RE nº 899, de 2003 da ANVISA - Guia para validação de métodos analíticos e bioanalíticos; Validation of analytical procedures - UNITED STATES PHARMACOPOEIA - última edição;
VALIDAÇÃO DE MÉTODOS ANALÍTICOS RE nº 899, de 2003 da ANVISA - Guia para validação de métodos analíticos e bioanalíticos; Validation of analytical procedures - UNITED STATES PHARMACOPOEIA - última edição;
Aplicação Diagnóstica. Método. Avaliação do Desempenho Não-Clínico. Inclusividade - Os isolados de HIV-1
 Nome COBAS AMPLICOR HIV1 MONITOR Test, version 1.5 Mandatário Fabricante Distribuidor Aplicação Diagnóstica Roche Diagnostics GmbH Roche Molecular Systems, Inc. Roche Sistemas de Diagnóstico, Sociedade
Nome COBAS AMPLICOR HIV1 MONITOR Test, version 1.5 Mandatário Fabricante Distribuidor Aplicação Diagnóstica Roche Diagnostics GmbH Roche Molecular Systems, Inc. Roche Sistemas de Diagnóstico, Sociedade
artus EBV QS-RGQ Kit Características de desempenho Maio 2012 Sample & Assay Technologies Sensibilidade analítica plasma
 artus EBV QS-RGQ Kit Características de desempenho artus EBV QS-RGQ Kit, Versão 1, 4501363 Verificar a disponibilidade de novas revisões de rotulagem electrónica em www.qiagen.com/products/artuscmvpcrkitce.aspx
artus EBV QS-RGQ Kit Características de desempenho artus EBV QS-RGQ Kit, Versão 1, 4501363 Verificar a disponibilidade de novas revisões de rotulagem electrónica em www.qiagen.com/products/artuscmvpcrkitce.aspx
GLICOSE - JEJUM Material: Soro Método..: Colorimétrico Enzimático - Auto Analisador RESULTADO:
 Pag.: 1 de 9 GLICOSE - JEJUM Método..: Colorimétrico Enzimático - Auto Analisador RESULTADO: 96 mg/dl 60 a 99 mg/dl Resultados Anteriores: 53[1/8/2013]; 71[9/12/2012]; 80[3/3/2012]; 74[17/5/2011]; 81[17/11/2006];
Pag.: 1 de 9 GLICOSE - JEJUM Método..: Colorimétrico Enzimático - Auto Analisador RESULTADO: 96 mg/dl 60 a 99 mg/dl Resultados Anteriores: 53[1/8/2013]; 71[9/12/2012]; 80[3/3/2012]; 74[17/5/2011]; 81[17/11/2006];
Jornal Oficial da União Europeia L 109/11
 19.4.2008 Jornal Oficial da União Europeia L 109/11 REGULAMENTO (CE) N. o 353/2008 DA COMISSÃO de 18 de Abril de 2008 que estabelece normas de execução relativas aos pedidos de autorização de alegações
19.4.2008 Jornal Oficial da União Europeia L 109/11 REGULAMENTO (CE) N. o 353/2008 DA COMISSÃO de 18 de Abril de 2008 que estabelece normas de execução relativas aos pedidos de autorização de alegações
A portaria 29, de 17 de dezembro de 2013 SVS/MS, regulamenta o diagnóstico da infecção pelo HIV, no Brasil.
 Aula 3 Base racional da portaria 29 de 17/12/2013 SVS/MS A portaria 29, de 17 de dezembro de 2013 SVS/MS, regulamenta o diagnóstico da infecção pelo HIV, no Brasil. Ao se elaborar uma portaria para normatizar
Aula 3 Base racional da portaria 29 de 17/12/2013 SVS/MS A portaria 29, de 17 de dezembro de 2013 SVS/MS, regulamenta o diagnóstico da infecção pelo HIV, no Brasil. Ao se elaborar uma portaria para normatizar
Programas de Controlo de Qualidade Externo UK NEQAS GRUPAGEM SANGUÍNEA
 Programas de Controlo de Qualidade Externo UK NEQAS GRUPAGEM SANGUÍNEA Programas Disponíveis Programa Analito/Aspectos avaliados Nº de distribuições por ano Nº de amostras por distribuição R Todos os aspectos
Programas de Controlo de Qualidade Externo UK NEQAS GRUPAGEM SANGUÍNEA Programas Disponíveis Programa Analito/Aspectos avaliados Nº de distribuições por ano Nº de amostras por distribuição R Todos os aspectos
Como detectar OGMs? Critérios para métodos para detectar OGMs. Como detectar OGMs? Bioensaios. Western blot 5/10/2011
 Como detectar OGMs? Critérios para métodos para detectar OGMs Prof. Alan McBride Biotecnologia, CDTec UFPel 2011.2 O que é um OGM? Organismos vivos, tais como plantas, animais e microorganismos, cujo material
Como detectar OGMs? Critérios para métodos para detectar OGMs Prof. Alan McBride Biotecnologia, CDTec UFPel 2011.2 O que é um OGM? Organismos vivos, tais como plantas, animais e microorganismos, cujo material
artus BK Virus QS-RGQ Kit
 artus BK Virus QS-RGQ Kit Características de desempenho artus BK Virus QS-RGQ Kit, versão 1, 4514363 Verificar a disponibilidade de novas revisões de rotulagem eletrónica em www.qiagen.com/products/artusbkvirusrgpcrkit.aspx
artus BK Virus QS-RGQ Kit Características de desempenho artus BK Virus QS-RGQ Kit, versão 1, 4514363 Verificar a disponibilidade de novas revisões de rotulagem eletrónica em www.qiagen.com/products/artusbkvirusrgpcrkit.aspx
Qualidade Assegurada e Avaliação Ferramentas existentes
 Qualidade Assegurada e Avaliação Ferramentas existentes Kits para diagnóstico in vitro - TESTES RÁPIDOS 1. HISTÓRIA LINHA DO TEMPO 1954 - LCCDM- Laboratório Central de Controle de Drogas e Medicamentos;
Qualidade Assegurada e Avaliação Ferramentas existentes Kits para diagnóstico in vitro - TESTES RÁPIDOS 1. HISTÓRIA LINHA DO TEMPO 1954 - LCCDM- Laboratório Central de Controle de Drogas e Medicamentos;
Proposta de. REGULAMENTO (CE) n.º / DA COMISSÃO
 Proposta de REGULAMENTO (CE) n.º / DA COMISSÃO de [ ] que altera o Regulamento (CE) n.º 2042/2003 da Comissão, relativo à aeronavegabilidade permanente das aeronaves e dos produtos, peças e equipamentos
Proposta de REGULAMENTO (CE) n.º / DA COMISSÃO de [ ] que altera o Regulamento (CE) n.º 2042/2003 da Comissão, relativo à aeronavegabilidade permanente das aeronaves e dos produtos, peças e equipamentos
COMISSÃO DAS COMUNIDADES EUROPEIAS. Proposta de DIRECTIVA DO PARLAMENTO EUROPEU E DO CONSELHO. que altera a
 COMISSÃO DAS COMUNIDADES EUROPEIAS Bruxelas, 22.12.2006 COM(2006) 923 final 2006/0288 (COD) Proposta de DIRECTIVA DO PARLAMENTO EUROPEU E DO CONSELHO que altera a Directiva 98/8/CE relativa à colocação
COMISSÃO DAS COMUNIDADES EUROPEIAS Bruxelas, 22.12.2006 COM(2006) 923 final 2006/0288 (COD) Proposta de DIRECTIVA DO PARLAMENTO EUROPEU E DO CONSELHO que altera a Directiva 98/8/CE relativa à colocação
Imunoensaios no laboratório clínico
 Imunoensaios no laboratório clínico Onde pesquisamos Ag e Ac?? Imunoensaios detecção e quantificação de antígeno e anticorpo: Doenças infecciosas: diagnóstico da doença diferenciação da fase da doença
Imunoensaios no laboratório clínico Onde pesquisamos Ag e Ac?? Imunoensaios detecção e quantificação de antígeno e anticorpo: Doenças infecciosas: diagnóstico da doença diferenciação da fase da doença
COMISSÃO. (Actos cuja publicação não é uma condição da sua aplicabilidade)
 L 133/26 II (Actos cuja publicação não é uma condição da sua aplicabilidade) COMISSÃO DECISÃO DA COMISSÃO de 3 de Maio de 2000 que aplica a Directiva 89/106/CEE do Conselho no que respeita à classificação
L 133/26 II (Actos cuja publicação não é uma condição da sua aplicabilidade) COMISSÃO DECISÃO DA COMISSÃO de 3 de Maio de 2000 que aplica a Directiva 89/106/CEE do Conselho no que respeita à classificação
Regulamento (CE) n.º 1991/2006 do Conselho. de 21 de Dezembro de 2006
 L 411/18 PT Jornal Oficial da União Europeia 30.12.2006 Regulamento (CE) n.º 1991/2006 do Conselho de 21 de Dezembro de 2006 que altera o Regulamento (CEE) n.º 2092/91 relativo ao modo de produção biológico
L 411/18 PT Jornal Oficial da União Europeia 30.12.2006 Regulamento (CE) n.º 1991/2006 do Conselho de 21 de Dezembro de 2006 que altera o Regulamento (CEE) n.º 2092/91 relativo ao modo de produção biológico
LABORATÓRIO ANÁLISE. PROCEDIMENTO OPERACIONAL PADRÃO. ANALITICO
 Edição Análise Crítica Aprovação Data / / Data: / / Data: / / ASS.: ASS.: ASS.: NOME: Rozileide Agostinho NOME:Rozileide Agostinho NOME: Marcelo Villar FUNÇÃO/CARGO: Controle de Documentos e Dados FUNÇÃO/CARGO:
Edição Análise Crítica Aprovação Data / / Data: / / Data: / / ASS.: ASS.: ASS.: NOME: Rozileide Agostinho NOME:Rozileide Agostinho NOME: Marcelo Villar FUNÇÃO/CARGO: Controle de Documentos e Dados FUNÇÃO/CARGO:
(Actos não legislativos) REGULAMENTOS. (Texto relevante para efeitos do EEE)
 1.7.2010 Jornal Oficial da União Europeia L 166/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 573/2010 DA COMISSÃO de 30 de Junho de 2010 que altera o Regulamento (UE) n. o 185/2010
1.7.2010 Jornal Oficial da União Europeia L 166/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 573/2010 DA COMISSÃO de 30 de Junho de 2010 que altera o Regulamento (UE) n. o 185/2010
Projecto de REGULAMENTO (CE) N.º.../2008 DA COMISSÃO
 Projecto de REGULAMENTO (CE) N.º.../2008 DA COMISSÃO de [ ] que estabelece as normas de execução do Regulamento (CE) n.º 2494/95 do Conselho no que respeita às normas mínimas para o tratamento dos produtos
Projecto de REGULAMENTO (CE) N.º.../2008 DA COMISSÃO de [ ] que estabelece as normas de execução do Regulamento (CE) n.º 2494/95 do Conselho no que respeita às normas mínimas para o tratamento dos produtos
Biofarmacotécnica. Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos
 Biofarmacotécnica Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos Introdução RES 60/14: Dispõe sobre os critérios para concessão e renovação de registro de medicamentos
Biofarmacotécnica Planejamento de Estudos de Biodisponibilidade Relativa e Bioequivalência de Medicamentos Introdução RES 60/14: Dispõe sobre os critérios para concessão e renovação de registro de medicamentos
COMISSÃO DAS COMUNIDADES EUROPEIAS. Projecto de REGULAMENTO (CE) N.º /2001 DA COMISSÃO
 COMISSÃO DAS COMUNIDADES EUROPEIAS Bruxelas, 21.5.2001 Projecto de REGULAMENTO (CE) N.º /2001 DA COMISSÃO de [ ] que estabelece regras pormenorizadas para a aplicação do Regulamento (CE) n.º 2494/95 do
COMISSÃO DAS COMUNIDADES EUROPEIAS Bruxelas, 21.5.2001 Projecto de REGULAMENTO (CE) N.º /2001 DA COMISSÃO de [ ] que estabelece regras pormenorizadas para a aplicação do Regulamento (CE) n.º 2494/95 do
Jornal Oficial da União Europeia L 8/29
 13.1.2007 Jornal Oficial da União Europeia L 8/29 DECISÃO DA COMISSÃO de 22 de Dezembro de 2006 relativa a determinadas medidas de protecção no que se refere à gripe aviária de alta patogenicidade e às
13.1.2007 Jornal Oficial da União Europeia L 8/29 DECISÃO DA COMISSÃO de 22 de Dezembro de 2006 relativa a determinadas medidas de protecção no que se refere à gripe aviária de alta patogenicidade e às
26/03/2015 VALIDAÇÃO CONTROLE FÍSICO-QUÍMICO DA QUALIDADE RDC 899/2003. Por que validar? OBJETIVO DA VALIDAÇÃO:
 VALIDAÇÃO CONTROLE FÍSICO-QUÍMICO DA QUALIDADE RDC 899/2003 VALIDAÇÃO: ato documentado que atesta que qualquer procedimento, processo, equipamento, material, operação ou sistema realmente conduza aos resultados
VALIDAÇÃO CONTROLE FÍSICO-QUÍMICO DA QUALIDADE RDC 899/2003 VALIDAÇÃO: ato documentado que atesta que qualquer procedimento, processo, equipamento, material, operação ou sistema realmente conduza aos resultados
Declaração de Conflitos de Interesse. Nada a declarar.
 Declaração de Conflitos de Interesse Nada a declarar. GARANTIA DA QUALIDADE EM IMUNOHEMATOLOGIA Dra. Carla D. Chaves Gestora de Processos Hematologia DASA Auditora Na abordagem do sistema de qualidade
Declaração de Conflitos de Interesse Nada a declarar. GARANTIA DA QUALIDADE EM IMUNOHEMATOLOGIA Dra. Carla D. Chaves Gestora de Processos Hematologia DASA Auditora Na abordagem do sistema de qualidade
Definição. RDC 17: 16 de abril de Validação de metodologia analítica
 Validação de metodologia analítica Definição RDC 17/2010: Ato documentado que atesta que qualquer procedimento, processo, equipamento, operação, material ou sistema realmente conduza ao resultado esperado.
Validação de metodologia analítica Definição RDC 17/2010: Ato documentado que atesta que qualquer procedimento, processo, equipamento, operação, material ou sistema realmente conduza ao resultado esperado.
Hepatites. Inflamação do fígado. Alteração em enzimas hepáticas (alaminotransferase aspartatoaminotransferase e gamaglutamiltransferase ALT AST e GGT
 Hepatites Virais Hepatites Inflamação do fígado Alteração em enzimas hepáticas (alaminotransferase aspartatoaminotransferase e gamaglutamiltransferase ALT AST e GGT Sinais clínicos: Náuseas, dor abdominal,
Hepatites Virais Hepatites Inflamação do fígado Alteração em enzimas hepáticas (alaminotransferase aspartatoaminotransferase e gamaglutamiltransferase ALT AST e GGT Sinais clínicos: Náuseas, dor abdominal,
L 296/22 Jornal Oficial da União Europeia
 L 296/22 Jornal Oficial da União Europeia 15.11.2007 REGULAMENTO (CE) N. o 1334/2007 DA COMISSÃO de 14 de Novembro de 2007 que altera o Regulamento (CE) n. o 1749/96 sobre medidas iniciais de aplicação
L 296/22 Jornal Oficial da União Europeia 15.11.2007 REGULAMENTO (CE) N. o 1334/2007 DA COMISSÃO de 14 de Novembro de 2007 que altera o Regulamento (CE) n. o 1749/96 sobre medidas iniciais de aplicação
L 336/36 Jornal Oficial da União Europeia
 L 336/36 Jornal Oficial da União Europeia 18.12.2009 DECISÃO DA COMISSÃO de 15 de Dezembro de 2009 que altera o anexo D da Directiva 64/432/CEE do Conselho no que se refere aos testes para diagnóstico
L 336/36 Jornal Oficial da União Europeia 18.12.2009 DECISÃO DA COMISSÃO de 15 de Dezembro de 2009 que altera o anexo D da Directiva 64/432/CEE do Conselho no que se refere aos testes para diagnóstico
Avaliação de não conformidades no Controle Externo. Dra. Andrea Piazza Assessora Científica do PNCQ em Sistema de Gestão da Qualidade
 Avaliação de não conformidades no Controle Externo Dra. Andrea Piazza Assessora Científica do PNCQ em Sistema de Gestão da Qualidade Andrea Piazza Bióloga PUC/PR Pós-graduada em Ciências do Laboratório
Avaliação de não conformidades no Controle Externo Dra. Andrea Piazza Assessora Científica do PNCQ em Sistema de Gestão da Qualidade Andrea Piazza Bióloga PUC/PR Pós-graduada em Ciências do Laboratório
Jornal Oficial da União Europeia L 227/33 DECISÕES COMISSÃO
 31.8.2007 Jornal Oficial da União Europeia L 227/33 II (Actos adoptados em aplicação dos Tratados CE/Euratom cuja publicação não é obrigatória) DECISÕES COMISSÃO DECISÃO DA COMISSÃO de 29 de Agosto de
31.8.2007 Jornal Oficial da União Europeia L 227/33 II (Actos adoptados em aplicação dos Tratados CE/Euratom cuja publicação não é obrigatória) DECISÕES COMISSÃO DECISÃO DA COMISSÃO de 29 de Agosto de
Aplicações de anticorpos em métodos diagnósticos
 Aula Prática Demonstrativa: Aplicações de anticorpos em métodos diagnósticos Introdução Profa. Cristina MED- 2017 Detecção de anticorpos (diagnóstico sorológico) Exemplo: detecção de anticorpos em jovem
Aula Prática Demonstrativa: Aplicações de anticorpos em métodos diagnósticos Introdução Profa. Cristina MED- 2017 Detecção de anticorpos (diagnóstico sorológico) Exemplo: detecção de anticorpos em jovem
REGULAMENTOS. Tendo em conta o Tratado sobre o Funcionamento da União Europeia,
 28.5.2014 L 159/41 REGULAMENTOS REGULAMENTO DELEGADO (UE) N. o 574/2014 DA COMISSÃO de 21 de fevereiro de 2014 que altera o anexo III do Regulamento (UE) n. o 305/2011 do Parlamento Europeu e do Conselho
28.5.2014 L 159/41 REGULAMENTOS REGULAMENTO DELEGADO (UE) N. o 574/2014 DA COMISSÃO de 21 de fevereiro de 2014 que altera o anexo III do Regulamento (UE) n. o 305/2011 do Parlamento Europeu e do Conselho
Métodos de Pesquisa e Diagnóstico dos Vírus
 Métodos de Pesquisa e Diagnóstico dos Vírus Estratégias Isolamento em sistemas vivos Pesquisa de antígeno viral Pesquisa de anticorpos Pesquisa do ácido nucléico viral (DNA ou RNA) Pré requisitos para
Métodos de Pesquisa e Diagnóstico dos Vírus Estratégias Isolamento em sistemas vivos Pesquisa de antígeno viral Pesquisa de anticorpos Pesquisa do ácido nucléico viral (DNA ou RNA) Pré requisitos para
PARLAMENTO EUROPEU ***II POSIÇÃO COMUM. Documento de sessão C5-0301/ /07/2001
 PARLAMENTO EUROPEU 1999 Documento de sessão 2004 C5-0301/2001 02/07/2001 ***II POSIÇÃO COMUM Assunto: Posição Comum adoptada pelo Conselho de 28 de Junho de 2001 tendo em vista a aprovação da Directiva
PARLAMENTO EUROPEU 1999 Documento de sessão 2004 C5-0301/2001 02/07/2001 ***II POSIÇÃO COMUM Assunto: Posição Comum adoptada pelo Conselho de 28 de Junho de 2001 tendo em vista a aprovação da Directiva
L 230/20 Jornal Oficial da União Europeia
 L 230/20 Jornal Oficial da União Europeia 1.9.2007 DECISÃO DA COMISSÃO de 28 de Agosto de 2007 relativa a medidas destinadas a impedir a propagação da gripe aviária de alta patogenicidade a outras aves
L 230/20 Jornal Oficial da União Europeia 1.9.2007 DECISÃO DA COMISSÃO de 28 de Agosto de 2007 relativa a medidas destinadas a impedir a propagação da gripe aviária de alta patogenicidade a outras aves
Jornal Oficial da União Europeia L 294/5
 13.11.2007 Jornal Oficial da União Europeia L 294/5 REGULAMENTO (CE) N. o 1322/2007 DA COMISSÃO de 12 de Novembro de 2007 que aplica o Regulamento (CE) n. o 458/2007 do Parlamento Europeu e do Conselho
13.11.2007 Jornal Oficial da União Europeia L 294/5 REGULAMENTO (CE) N. o 1322/2007 DA COMISSÃO de 12 de Novembro de 2007 que aplica o Regulamento (CE) n. o 458/2007 do Parlamento Europeu e do Conselho
PT Jornal Oficial da União Europeia. (Actos cuja publicação é uma condição da sua aplicabilidade) DECISÃO DA COMISSÃO
 L 312/1 I (Actos cuja publicação é uma condição da sua aplicabilidade) DECISÃO DA COMISSÃO de 26 de Novembro de 2003 que estabelece um modelo de passaporte para a circulação intracomunitária de cães, gatos
L 312/1 I (Actos cuja publicação é uma condição da sua aplicabilidade) DECISÃO DA COMISSÃO de 26 de Novembro de 2003 que estabelece um modelo de passaporte para a circulação intracomunitária de cães, gatos
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR
 FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Gammaglobulina Antihepatitis B P Behring 200 UI/ml Solução injectável Imunoglobulina Humana contra a Hepatite B Leia atentamente este folheto antes de
FOLHETO INFORMATIVO: INFORMAÇÃO PARA O UTILIZADOR Gammaglobulina Antihepatitis B P Behring 200 UI/ml Solução injectável Imunoglobulina Humana contra a Hepatite B Leia atentamente este folheto antes de
O CONTROLE DE PRODUTOS PRÉ E PÓS MERCADO E O INSTITUTO NACIONAL DE CONTROLE DE QUALIDADE EM SAÚDE- INCQS/FIOCRUZ
 O CONTROLE DE PRODUTOS PRÉ E PÓS MERCADO E O INSTITUTO NACIONAL DE CONTROLE DE QUALIDADE EM SAÚDE- INCQS/FIOCRUZ INCQS- LINHA DO TEMPO 1954 1978-81 Lei nº 2.187- cria o LCCDM- Laboratório Central de Controle
O CONTROLE DE PRODUTOS PRÉ E PÓS MERCADO E O INSTITUTO NACIONAL DE CONTROLE DE QUALIDADE EM SAÚDE- INCQS/FIOCRUZ INCQS- LINHA DO TEMPO 1954 1978-81 Lei nº 2.187- cria o LCCDM- Laboratório Central de Controle
(Texto relevante para efeitos do EEE)
 22.5.2008 Jornal Oficial da União Europeia L 132/7 REGULAMENTO (CE) N. o 437/2008 DA COMISSÃO de 21 de Maio de 2008 que altera os anexos VII, X e XI do Regulamento (CE) n. o 1774/2002 do Parlamento Europeu
22.5.2008 Jornal Oficial da União Europeia L 132/7 REGULAMENTO (CE) N. o 437/2008 DA COMISSÃO de 21 de Maio de 2008 que altera os anexos VII, X e XI do Regulamento (CE) n. o 1774/2002 do Parlamento Europeu
Jornal Oficial da União Europeia L 256/41
 1.10.2005 Jornal Oficial da União Europeia L 256/41 DIRECTIVA 2005/62/CE DA COMISSÃO de 30 de Setembro de 2005 que dá execução à Directiva 2002/98/CE do Parlamento Europeu e do Conselho no que respeita
1.10.2005 Jornal Oficial da União Europeia L 256/41 DIRECTIVA 2005/62/CE DA COMISSÃO de 30 de Setembro de 2005 que dá execução à Directiva 2002/98/CE do Parlamento Europeu e do Conselho no que respeita
COMISSÃO DAS COMUNIDADES EUROPEIAS. Projecto de REGULAMENTO DA COMISSÃO (UE) N.º.../2011
 PT PT PT COMISSÃO DAS COMUNIDADES EUROPEIAS Projecto de Bruxelas, XXX C REGULAMENTO DA COMISSÃO (UE) N.º.../2011 de [ ] que altera o Regulamento (CE) n.º 1702/2003 da Comissão, de 24 de Setembro de 2003,
PT PT PT COMISSÃO DAS COMUNIDADES EUROPEIAS Projecto de Bruxelas, XXX C REGULAMENTO DA COMISSÃO (UE) N.º.../2011 de [ ] que altera o Regulamento (CE) n.º 1702/2003 da Comissão, de 24 de Setembro de 2003,
LABORATÓRIO LAGOA NOVA
 Setor: HEMATOLOGIA HEMOGRAMA COMPLETO Total Método : Automação: ABX MICROS 60 SÉRIE VERMELHA HEMATÓCRITO... 46,8 % MASCULINO: 39 a 54 FEMININO : 37 a 46 HEMÁCIAS... 4,91 milhões/mm³ MASCULINO: 4,5 a 6
Setor: HEMATOLOGIA HEMOGRAMA COMPLETO Total Método : Automação: ABX MICROS 60 SÉRIE VERMELHA HEMATÓCRITO... 46,8 % MASCULINO: 39 a 54 FEMININO : 37 a 46 HEMÁCIAS... 4,91 milhões/mm³ MASCULINO: 4,5 a 6
APLICAÇÕES DA BIOLOGIA MOLECULAR NO DIAGNÓSTICO E TRATAMENTO DA HEPATITE B. Maio
 APLICAÇÕES DA BIOLOGIA MOLECULAR NO DIAGNÓSTICO E TRATAMENTO DA HEPATITE B Maio - 2009 BIOLOGIA MOLECULAR & HEPATITE B INFECÇÃO CRÔNICA PELO VÍRUS B Afeta mais de 300 milhões de indivíduos em todo o mundo.
APLICAÇÕES DA BIOLOGIA MOLECULAR NO DIAGNÓSTICO E TRATAMENTO DA HEPATITE B Maio - 2009 BIOLOGIA MOLECULAR & HEPATITE B INFECÇÃO CRÔNICA PELO VÍRUS B Afeta mais de 300 milhões de indivíduos em todo o mundo.
DECISÃO DELEGADA (UE) /... DA COMISSÃO. de
 COMISSÃO EUROPEIA Bruxelas, 25.1.2018 C(2018) 287 final DECISÃO DELEGADA (UE) /... DA COMISSÃO de 25.1.2018 relativa ao sistema aplicável para avaliar e verificar a regularidade do desempenho de dispositivos
COMISSÃO EUROPEIA Bruxelas, 25.1.2018 C(2018) 287 final DECISÃO DELEGADA (UE) /... DA COMISSÃO de 25.1.2018 relativa ao sistema aplicável para avaliar e verificar a regularidade do desempenho de dispositivos
DIRECTIVA 1999/4/CE DO PARLAMENTO EUROPEU E DO CONSELHO de 22 de Fevereiro de 1999 relativa aos extractos de café e aos extractos de chicória
 1999L0004 PT 18.11.2013 003.001 1 Este documento constitui um instrumento de documentação e não vincula as instituições B DIRECTIVA 1999/4/CE DO PARLAMENTO EUROPEU E DO CONSELHO de 22 de Fevereiro de 1999
1999L0004 PT 18.11.2013 003.001 1 Este documento constitui um instrumento de documentação e não vincula as instituições B DIRECTIVA 1999/4/CE DO PARLAMENTO EUROPEU E DO CONSELHO de 22 de Fevereiro de 1999
Jornal Oficial da União Europeia L 317/17
 30.11.2011 Jornal Oficial da União Europeia L 317/17 REGULAMENTO (UE) N. o 1235/2011 DA COMISSÃO de 29 de Novembro de 2011 que altera o Regulamento (CE) n. o 1222/2009 do Parlamento Europeu e do Conselho
30.11.2011 Jornal Oficial da União Europeia L 317/17 REGULAMENTO (UE) N. o 1235/2011 DA COMISSÃO de 29 de Novembro de 2011 que altera o Regulamento (CE) n. o 1222/2009 do Parlamento Europeu e do Conselho
Proposta de REGULAMENTO DO CONSELHO
 COMISSÃO EUROPEIA Bruxelas, 19.1.2017 COM(2017) 23 final 2017/0010 (NLE) Proposta de REGULAMENTO DO CONSELHO que altera o anexo III da Diretiva 2008/98/CE do Parlamento Europeu e do Conselho no que respeita
COMISSÃO EUROPEIA Bruxelas, 19.1.2017 COM(2017) 23 final 2017/0010 (NLE) Proposta de REGULAMENTO DO CONSELHO que altera o anexo III da Diretiva 2008/98/CE do Parlamento Europeu e do Conselho no que respeita
(Publicação dos títulos e das referências das normas harmonizadas ao abrigo da legislação de harmonização da União)
 C 173/136 PT Jornal Oficial da União Europeia 13.5.2016 Comunicação da Comissão no âmbito da execução da Directiva 98/79/CE do Parlamento Europeu e do Conselho relativa aos dispositivos médicos de diagnóstico
C 173/136 PT Jornal Oficial da União Europeia 13.5.2016 Comunicação da Comissão no âmbito da execução da Directiva 98/79/CE do Parlamento Europeu e do Conselho relativa aos dispositivos médicos de diagnóstico
REGULAMENTO (UE) /... DA COMISSÃO. de
 COMISSÃO EUROPEIA Bruxelas, 23.5.2017 C(2017) 279 final REGULAMENTO (UE) /... DA COMISSÃO de 23.5.2017 que estabelece regras sobre a utilização de um limite máximo de resíduos estabelecido para uma substância
COMISSÃO EUROPEIA Bruxelas, 23.5.2017 C(2017) 279 final REGULAMENTO (UE) /... DA COMISSÃO de 23.5.2017 que estabelece regras sobre a utilização de um limite máximo de resíduos estabelecido para uma substância
Implementação e Validação de Métodos Analíticos
 Alexandra Sofia Reynolds Mendes Laboratório Regional de Controlo da Qualidade da Água Estação da Alegria 9050-FUNCHAL E-mail: xana@iga.pt Resumo Este artigo tem como principal objectivo descrever as principais
Alexandra Sofia Reynolds Mendes Laboratório Regional de Controlo da Qualidade da Água Estação da Alegria 9050-FUNCHAL E-mail: xana@iga.pt Resumo Este artigo tem como principal objectivo descrever as principais
Jornal Oficial da União Europeia L 146/7
 8.6.2007 Jornal Oficial da União Europeia L 146/7 REGULAMENTO (CE) N. o 633/2007 DA COMISSÃO de 7 de Junho de 2007 que estabelece requisitos para a aplicação de um protocolo de transferência de mensagens
8.6.2007 Jornal Oficial da União Europeia L 146/7 REGULAMENTO (CE) N. o 633/2007 DA COMISSÃO de 7 de Junho de 2007 que estabelece requisitos para a aplicação de um protocolo de transferência de mensagens
Seleção de um Método Analítico. Validação e protocolos em análises químicas. Validação de Métodos Analíticos
 Seleção de um Método Analítico Capítulo 1 SKOOG, D.A.; HOLLER, F.J.; NIEMAN, T.A. Princípios de Análise Instrumental. 5 a edição, Ed. Bookman, Porto Alegre, 2002. Validação e protocolos em análises químicas
Seleção de um Método Analítico Capítulo 1 SKOOG, D.A.; HOLLER, F.J.; NIEMAN, T.A. Princípios de Análise Instrumental. 5 a edição, Ed. Bookman, Porto Alegre, 2002. Validação e protocolos em análises químicas
2. Aplicabilidade: Bioquímicos/biomédicos do setor de imunologia
 1. Sinonímia: Fator reumatoide, FR, Látex 2. Aplicabilidade: Bioquímicos/biomédicos do setor de imunologia 3. Aplicação clínica Diagnósticos para determinação quantitativa in vitro dos fatores reumatóides
1. Sinonímia: Fator reumatoide, FR, Látex 2. Aplicabilidade: Bioquímicos/biomédicos do setor de imunologia 3. Aplicação clínica Diagnósticos para determinação quantitativa in vitro dos fatores reumatóides
4ªs Jornadas Nacionais de Esterilização. Associação Nacional de Esterilização
 4ªs Jornadas Nacionais de Esterilização Associação Nacional de Esterilização Fundação Cupertino de Miranda 03 de Junho de 2006 Um Hospital Moderno A segurança dos pacientes é fundamental e assim deve ser
4ªs Jornadas Nacionais de Esterilização Associação Nacional de Esterilização Fundação Cupertino de Miranda 03 de Junho de 2006 Um Hospital Moderno A segurança dos pacientes é fundamental e assim deve ser
VI Simpósio Estadual de Hepatites Virais B e C
 BIOLOGIA MOLECULAR DOS VÍRUS DAS HEPATITES B E C Dra REGINA CÉLIA MOREIRA Pesquisadora Científica - Instituto Adolfo Lutz SP regina.moreira7@gmail.com VI Simpósio Estadual de Hepatites Virais B e C VÍRUS
BIOLOGIA MOLECULAR DOS VÍRUS DAS HEPATITES B E C Dra REGINA CÉLIA MOREIRA Pesquisadora Científica - Instituto Adolfo Lutz SP regina.moreira7@gmail.com VI Simpósio Estadual de Hepatites Virais B e C VÍRUS
Validação de processos em farmácia oncológica Marcos Coelho Soares
 Validação de processos em farmácia oncológica Marcos Coelho Soares De acordo com a Resolução RDC 96/2008 da Agência de Vigilância Sanitária declaro que desempenhei o papel de SPEAKER para as seguintes
Validação de processos em farmácia oncológica Marcos Coelho Soares De acordo com a Resolução RDC 96/2008 da Agência de Vigilância Sanitária declaro que desempenhei o papel de SPEAKER para as seguintes
Jornal Oficial da União Europeia L 280/5
 24.10.2007 Jornal Oficial da União Europeia L 280/5 REGULAMENTO (CE) N. o 1237/2007 DA COMISSÃO de 23 de Outubro de 2007 que altera o Regulamento (CE) n. o 2160/2003 do Parlamento Europeu e do Conselho
24.10.2007 Jornal Oficial da União Europeia L 280/5 REGULAMENTO (CE) N. o 1237/2007 DA COMISSÃO de 23 de Outubro de 2007 que altera o Regulamento (CE) n. o 2160/2003 do Parlamento Europeu e do Conselho
COMISSÃO Jornal Oficial da União Europeia L 79/27
 16.3.2006 Jornal Oficial da União Europeia L 79/27 COMISSÃO DECISÃO DA COMISSÃO de 6 de Março de 2006 que estabelece as classes de desempenho em matéria de reacção ao fogo no que respeita a certos produtos
16.3.2006 Jornal Oficial da União Europeia L 79/27 COMISSÃO DECISÃO DA COMISSÃO de 6 de Março de 2006 que estabelece as classes de desempenho em matéria de reacção ao fogo no que respeita a certos produtos
Título Código Rev. MÉTODOS DE ENSAIO E VALIDAÇÃO DE MÉTODOS MQ-CQMA
 5.4.1. Generalidades Os laboratórios do Centro de Química e Meio Ambiente (CQMA) estabelecem e mantêm procedimentos documentados para os métodos de ensaios que realizam. Nesses procedimentos estão incluídos
5.4.1. Generalidades Os laboratórios do Centro de Química e Meio Ambiente (CQMA) estabelecem e mantêm procedimentos documentados para os métodos de ensaios que realizam. Nesses procedimentos estão incluídos
Projecto de REGULAMENTO (UE) N.º.../.. DA COMISSÃO
 COMISSÃO EUROPEIA DRAFT Version 2.01 of 30 Nov 2010 D012380/01 Projecto de REGULAMENTO (UE) N.º.../.. DA COMISSÃO de que altera o anexo do regulamento (CE) n. 631/2009 que institui normas pormenorizadas
COMISSÃO EUROPEIA DRAFT Version 2.01 of 30 Nov 2010 D012380/01 Projecto de REGULAMENTO (UE) N.º.../.. DA COMISSÃO de que altera o anexo do regulamento (CE) n. 631/2009 que institui normas pormenorizadas
(Actos não legislativos) REGULAMENTOS
 22.5.2010 Jornal Oficial da União Europeia L 126/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 440/2010 DA COMISSÃO de 21 de Maio de 2010 relativo a taxas a pagar à Agência Europeia
22.5.2010 Jornal Oficial da União Europeia L 126/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 440/2010 DA COMISSÃO de 21 de Maio de 2010 relativo a taxas a pagar à Agência Europeia
Substâncias pesquisadas quantidade diversidade. Limitações em toxicologia forense tecnologia; NPS e padrões analíticos; limites
 Serviço de Química e Toxicologia Forense, delegação Sul do INMLCF, I.P. Substâncias pesquisadas quantidade diversidade Análise toxicológica orientada Análise toxicológica sistemática Limitações em toxicologia
Serviço de Química e Toxicologia Forense, delegação Sul do INMLCF, I.P. Substâncias pesquisadas quantidade diversidade Análise toxicológica orientada Análise toxicológica sistemática Limitações em toxicologia
Jornal Oficial da União Europeia L 125/7
 7.5.2013 Jornal Oficial da União Europeia L 125/7 REGULAMENTO (UE) N. o 415/2013 DA COMISSÃO de 6 de maio de 2013 que define responsabilidades e tarefas adicionais para os laboratórios de referência da
7.5.2013 Jornal Oficial da União Europeia L 125/7 REGULAMENTO (UE) N. o 415/2013 DA COMISSÃO de 6 de maio de 2013 que define responsabilidades e tarefas adicionais para os laboratórios de referência da
A COMISSÃO DAS COMUNIDADES EUROPEIAS,
 L 126/34 22.5.2003 DIRECTIVA 2003/40/CE DA COMISSÃO de 16 de Maio de 2003 que estabelece a lista, os limites de concentração e as menções constantes do rótulo para os constituintes das águas minerais naturais,
L 126/34 22.5.2003 DIRECTIVA 2003/40/CE DA COMISSÃO de 16 de Maio de 2003 que estabelece a lista, os limites de concentração e as menções constantes do rótulo para os constituintes das águas minerais naturais,
COMISSÃO EUROPEIA DIRECÇÃO-GERAL DAS EMPRESAS E INDÚSTRIA. Grupo de Trabalho sobre Controlo de Medicamentos e Inspecções
 1 COMISSÃO EUROPEIA DIRECÇÃO-GERAL DAS EMPRESAS E INDÚSTRIA Mercado único, ambiente regulamentar, indústrias reguladas por legislação vertical Produtos farmacêuticos e cosméticos Bruxelas, Julho de 2001
1 COMISSÃO EUROPEIA DIRECÇÃO-GERAL DAS EMPRESAS E INDÚSTRIA Mercado único, ambiente regulamentar, indústrias reguladas por legislação vertical Produtos farmacêuticos e cosméticos Bruxelas, Julho de 2001
Método. Aplicação Diagnóstica. Especificações Técnicas. Nome AMPLICOR HIV-1 MONITOR Test, version 1.5
 Nome AMPLICOR HIV-1 MONITOR Test, version 1.5 Mandatário Fabricante Distribuidor Aplicação Diagnóstica Roche Diagnostics GmbH Roche Molecular Systems, Inc. Roche Sistemas de Diagnóstico, Sociedade Unipessoal
Nome AMPLICOR HIV-1 MONITOR Test, version 1.5 Mandatário Fabricante Distribuidor Aplicação Diagnóstica Roche Diagnostics GmbH Roche Molecular Systems, Inc. Roche Sistemas de Diagnóstico, Sociedade Unipessoal
Este documento constitui um instrumento de documentação e não vincula as instituições
 2002D0994 PT 03.07.2015 007.001 1 Este documento constitui um instrumento de documentação e não vincula as instituições B DECISÃO DA COMISSÃO de 20 de Dezembro de 2002 relativa a certas medidas de protecção
2002D0994 PT 03.07.2015 007.001 1 Este documento constitui um instrumento de documentação e não vincula as instituições B DECISÃO DA COMISSÃO de 20 de Dezembro de 2002 relativa a certas medidas de protecção
(Actos não legislativos) REGULAMENTOS
 24.7.2010 Jornal Oficial da União Europeia L 193/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 662/2010 DA COMISSÃO de 23 de Julho de 2010 que altera o Regulamento (CE) n. o 1126/2008,
24.7.2010 Jornal Oficial da União Europeia L 193/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 662/2010 DA COMISSÃO de 23 de Julho de 2010 que altera o Regulamento (CE) n. o 1126/2008,
L 302/28 Jornal Oficial da União Europeia
 L 302/28 Jornal Oficial da União Europeia 19.11.2005 REGULAMENTO (CE) N. o 1895/2005 DA COMISSÃO de 18 de Novembro de 2005 relativo à restrição de utilização de determinados derivados epoxídicos em materiais
L 302/28 Jornal Oficial da União Europeia 19.11.2005 REGULAMENTO (CE) N. o 1895/2005 DA COMISSÃO de 18 de Novembro de 2005 relativo à restrição de utilização de determinados derivados epoxídicos em materiais
ScanGel Monoclonal ABO/RH1/RH Cards Cards
 ScanGel Monoclonal ABO/RH1/RH1 86494 48 Cards 86444 288 Cards GEL FORMULADO COM REAGENTES MONOCLONAIS DE ORIGEM MURINA OU HUMANA Prova directa ABO. Determinação dos Ag RH1 IVD Todos os produtos fabricados
ScanGel Monoclonal ABO/RH1/RH1 86494 48 Cards 86444 288 Cards GEL FORMULADO COM REAGENTES MONOCLONAIS DE ORIGEM MURINA OU HUMANA Prova directa ABO. Determinação dos Ag RH1 IVD Todos os produtos fabricados
Diagnóstico Laboratorial de Infecções Virais. Profa. Claudia Vitral
 Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
Diagnóstico Laboratorial de Infecções Virais Profa. Claudia Vitral Importância do diagnóstico laboratorial virológico Determinar a etiologia e acompanhar o curso de uma infecção viral Avaliar a eficácia
Imunidade Humoral. Células efectoras: Linfócitos B. (Imunoglobulinas)
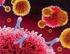 Imunidade Humoral Células efectoras: Linfócitos B (Imunoglobulinas) Determinantes antigénicos Também conhecidos como epítopos, são porções do antigénio que reúnem aspectos físicos e químicos que favorecem
Imunidade Humoral Células efectoras: Linfócitos B (Imunoglobulinas) Determinantes antigénicos Também conhecidos como epítopos, são porções do antigénio que reúnem aspectos físicos e químicos que favorecem
Parâmetros Imunológicos. Profª Heide Baida
 Parâmetros Imunológicos Profª Heide Baida Introdução Antes de estudarmos os testes imunológicos e seus parâmetros de avaliação, vale relembrar alguns tópicos importantes. Tipo de amostras que podem ser
Parâmetros Imunológicos Profª Heide Baida Introdução Antes de estudarmos os testes imunológicos e seus parâmetros de avaliação, vale relembrar alguns tópicos importantes. Tipo de amostras que podem ser
Portaria n.º 78/96, de 11 de Março
 Alterações às autorizações de introdução no mercado de medicamentos (Revogado pelo Decreto-Lei n.º 85/2004, de 15 de Abril) Na sequência do Regulamento (CEE) n.º 2309/93, do Conselho, de 22 de Julho de
Alterações às autorizações de introdução no mercado de medicamentos (Revogado pelo Decreto-Lei n.º 85/2004, de 15 de Abril) Na sequência do Regulamento (CEE) n.º 2309/93, do Conselho, de 22 de Julho de
MIF IgM para clamídia
 MIF IgM para clamídia Código do Produto:IF1250M Rev. I Características de desempenho Distribuição proibida nos Estados Unidos VALORES ESPERADOS População com pneumonia adquirida na comunidade Dois pesquisadores
MIF IgM para clamídia Código do Produto:IF1250M Rev. I Características de desempenho Distribuição proibida nos Estados Unidos VALORES ESPERADOS População com pneumonia adquirida na comunidade Dois pesquisadores
Jornal Oficial da União Europeia L 247/3
 9.9.2006 Jornal Oficial da União Europeia L 247/3 REGULAMENTO (CE) N. o 1329/2006 DA COMISSÃO de 8 de Setembro de 2006 que altera o Regulamento (CE) n. o 1725/2003, que adopta certas normas internacionais
9.9.2006 Jornal Oficial da União Europeia L 247/3 REGULAMENTO (CE) N. o 1329/2006 DA COMISSÃO de 8 de Setembro de 2006 que altera o Regulamento (CE) n. o 1725/2003, que adopta certas normas internacionais
Desvendando as Legislações
 Desvendando as Legislações (RDC 57/ 2010 e Portaria 1353/2011) Biomédica Ruth Hensel ruthzh@gmail.com RDC nº 57 (16-12-2010): Determina o Regulamento Sanitário para Serviços que desenvolvem atividades
Desvendando as Legislações (RDC 57/ 2010 e Portaria 1353/2011) Biomédica Ruth Hensel ruthzh@gmail.com RDC nº 57 (16-12-2010): Determina o Regulamento Sanitário para Serviços que desenvolvem atividades
HEMOCENTRO RP PROCEDIMENTO OPERACIONAL FENOTIPAGEM ERITROCITÁRIA
 P. 1/5 1. OBJETIVO Realizar fenotipagem eritrocitária de Doadores e Receptores. *1 1.1- Doadores: 1.1.1 - Banco de doadores fenotipados. 1.1.2 - Encontrar fenótipo compatível com o anticorpo identificado
P. 1/5 1. OBJETIVO Realizar fenotipagem eritrocitária de Doadores e Receptores. *1 1.1- Doadores: 1.1.1 - Banco de doadores fenotipados. 1.1.2 - Encontrar fenótipo compatível com o anticorpo identificado
Zika/Dengue TRIO ECO Teste
 Zika/Dengue TRIO ECO Teste Porque precisamos utilizar o TRIO Zika/Dengue Ab/Ag ECO Teste? A homologia da proteína do vírus Zika e Dengue está entre 53-58%, de modo que o teste sorológico Zika pode apresentar
Zika/Dengue TRIO ECO Teste Porque precisamos utilizar o TRIO Zika/Dengue Ab/Ag ECO Teste? A homologia da proteína do vírus Zika e Dengue está entre 53-58%, de modo que o teste sorológico Zika pode apresentar
Guia de Serviços Atualizado em 02/05/2019
 Guia de Serviços Atualizado em 02/05/2019 Solicitar diagnóstico de referência em hepatite B Atualizado em: 02/05/2019 Descrição O Laboratório de Hepatites Virais (LAHEP) atua como Laboratório de Referência
Guia de Serviços Atualizado em 02/05/2019 Solicitar diagnóstico de referência em hepatite B Atualizado em: 02/05/2019 Descrição O Laboratório de Hepatites Virais (LAHEP) atua como Laboratório de Referência
Catálogo de Produtos. Orange Life SEMPRE INOVANDO
 Catálogo de Produtos Orange Life SEMPRE INOVANDO FRETE Todos os custos de fretes são de responsabilidades do comprador. Pedimos que, caso haja preferência por alguma transportadora diferente da indicada
Catálogo de Produtos Orange Life SEMPRE INOVANDO FRETE Todos os custos de fretes são de responsabilidades do comprador. Pedimos que, caso haja preferência por alguma transportadora diferente da indicada
Jornal Oficial das Comunidades Europeias
 9.3.2002 PT Jornal Oficial das Comunidades Europeias L 67/31 DIRECTIVA 2002/6/CE DO PARLAMENTO EUROPEU E DO CONSELHO de 18 de Fevereiro de 2002 relativa às formalidades de declaração exigidas dos navios
9.3.2002 PT Jornal Oficial das Comunidades Europeias L 67/31 DIRECTIVA 2002/6/CE DO PARLAMENTO EUROPEU E DO CONSELHO de 18 de Fevereiro de 2002 relativa às formalidades de declaração exigidas dos navios
Detecção e Quantificação Viral
 Detecção e Quantificação Viral Análise e Tratamento de Dados Citomegalovirus i Carga Viral Vírus Epstein Barr Vírus a DNA Amplificação de fragmento de 74 pb Região BNRF1 (LMP2) Extracção do DNA Viral:
Detecção e Quantificação Viral Análise e Tratamento de Dados Citomegalovirus i Carga Viral Vírus Epstein Barr Vírus a DNA Amplificação de fragmento de 74 pb Região BNRF1 (LMP2) Extracção do DNA Viral:
Jornal Oficial da União Europeia L 294/7
 12.11.2011 Jornal Oficial da União Europeia L 294/7 REGULAMENTO DE EXECUÇÃO (UE) N. o 1147/2011 DA COMISSÃO de 11 de Novembro de 2011 que altera o Regulamento (UE) n. o 185/2010 que estabelece as medidas
12.11.2011 Jornal Oficial da União Europeia L 294/7 REGULAMENTO DE EXECUÇÃO (UE) N. o 1147/2011 DA COMISSÃO de 11 de Novembro de 2011 que altera o Regulamento (UE) n. o 185/2010 que estabelece as medidas
(Actos não legislativos) REGULAMENTOS
 8.9.2010 Jornal Oficial da União Europeia L 237/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 790/2010 DA COMISSÃO de 7 de Setembro de 2010 que altera os anexos VII, X e XI do Regulamento
8.9.2010 Jornal Oficial da União Europeia L 237/1 II (Actos não legislativos) REGULAMENTOS REGULAMENTO (UE) N. o 790/2010 DA COMISSÃO de 7 de Setembro de 2010 que altera os anexos VII, X e XI do Regulamento
Regulamento dos Produtos de Construção
 Regulamento dos Produtos de Construção As novas exigências para a Marcação CE Directiva versus Regulamento Seminário APFAC / CTCV 20 de Outubro de 2011 Melo Arruda - DGAE Tópicos O Regulamento (UE) nº
Regulamento dos Produtos de Construção As novas exigências para a Marcação CE Directiva versus Regulamento Seminário APFAC / CTCV 20 de Outubro de 2011 Melo Arruda - DGAE Tópicos O Regulamento (UE) nº
Jornal Oficial da União Europeia L 304/1. (Actos cuja publicação é uma condição da sua aplicabilidade)
 23.11.2005 Jornal Oficial da União Europeia L 304/1 I (Actos cuja publicação é uma condição da sua aplicabilidade) REGULAMENTO (CE) N. o 1905/2005 DO CONSELHO de 14 de Novembro de 2005 que altera o Regulamento
23.11.2005 Jornal Oficial da União Europeia L 304/1 I (Actos cuja publicação é uma condição da sua aplicabilidade) REGULAMENTO (CE) N. o 1905/2005 DO CONSELHO de 14 de Novembro de 2005 que altera o Regulamento
PROGRAMA DE PG EM BIOLOGIA EXPERIMENTAL - PGBIOEXP
 Questão 5 Considerando os estudos sobre genética de microrganismos, Lederberg e Tatum receberam o prêmio Nobel de Fisiologia e Medicina em 1958. O Esquema abaixo mostra a descoberta dos cientistas. Diante
Questão 5 Considerando os estudos sobre genética de microrganismos, Lederberg e Tatum receberam o prêmio Nobel de Fisiologia e Medicina em 1958. O Esquema abaixo mostra a descoberta dos cientistas. Diante
DECISÃO DE EXECUÇÃO DA COMISSÃO
 23.2.2012 Jornal Oficial da União Europeia L 50/51 DECISÃO DE EXECUÇÃO DA COMISSÃO de 17 de fevereiro de 2012 que altera o anexo E da Diretiva 92/65/CEE do Conselho no que diz respeito aos modelos de certificados
23.2.2012 Jornal Oficial da União Europeia L 50/51 DECISÃO DE EXECUÇÃO DA COMISSÃO de 17 de fevereiro de 2012 que altera o anexo E da Diretiva 92/65/CEE do Conselho no que diz respeito aos modelos de certificados
COMISSÃO DECISÕES Jornal Oficial da União Europeia L 102/7
 22.4.2009 Jornal Oficial da União Europeia L 102/7 II (Actos aprovados ao abrigo dos Tratados CE/Euratom cuja publicação não é obrigatória) DECISÕES COMISSÃO DECISÃO DA COMISSÃO de 20 de Abril de 2009
22.4.2009 Jornal Oficial da União Europeia L 102/7 II (Actos aprovados ao abrigo dos Tratados CE/Euratom cuja publicação não é obrigatória) DECISÕES COMISSÃO DECISÃO DA COMISSÃO de 20 de Abril de 2009
O presente regulamento é obrigatório em todos os seus elementos e directamente aplicável em todos os Estados-Membros.
 2.3.2005 Jornal Oficial da União Europeia L 56/3 REGULAMENTO (CE) N. o 355/2005 DA COMISSÃO de 28 de Fevereiro de 2005 que altera o Regulamento (CEE) n. o 2676/90 que determina os métodos de análise comunitários
2.3.2005 Jornal Oficial da União Europeia L 56/3 REGULAMENTO (CE) N. o 355/2005 DA COMISSÃO de 28 de Fevereiro de 2005 que altera o Regulamento (CEE) n. o 2676/90 que determina os métodos de análise comunitários
Jornal Oficial da União Europeia L 201/41
 3.8.2010 Jornal Oficial da União Europeia L 201/41 DECISÃO DA COMISSÃO de 28 de Julho de 2010 que autoriza a colocação no mercado de produtos que contenham, sejam constituídos por, ou produzidos a partir
3.8.2010 Jornal Oficial da União Europeia L 201/41 DECISÃO DA COMISSÃO de 28 de Julho de 2010 que autoriza a colocação no mercado de produtos que contenham, sejam constituídos por, ou produzidos a partir
Roteiro Testes sorológicos e moleculares no diagnóstico das doenças infecciosas: o que é necessário saber? Download da aula e links.
 Roteiro Testes sorológicos e moleculares no diagnóstico das doenças infecciosas: o que é necessário saber? Apresentação de conceitos e suas relações. Reação de Elisa e PCR como exemplos. Prof. Dr. Fábio
Roteiro Testes sorológicos e moleculares no diagnóstico das doenças infecciosas: o que é necessário saber? Apresentação de conceitos e suas relações. Reação de Elisa e PCR como exemplos. Prof. Dr. Fábio
DIRECTIVA DO CONSELHO
 13 / Fase. 04 Jornal Oficial das Comunidades Europeias 67 375L.0107 N? L 042/ 14 Jornal Oficial das Comunidades Europeias 15. 2. 75 DIRECTIVA DO CONSELHO de 19 de Janeiro de 1974 relativa à aproximação
13 / Fase. 04 Jornal Oficial das Comunidades Europeias 67 375L.0107 N? L 042/ 14 Jornal Oficial das Comunidades Europeias 15. 2. 75 DIRECTIVA DO CONSELHO de 19 de Janeiro de 1974 relativa à aproximação
Jornal Oficial da União Europeia L 106/55
 28.4.2009 Jornal Oficial da União Europeia L 106/55 DECISÃO DA COMISSÃO de 23 de Abril de 2009 que autoriza a colocação no mercado de licopeno como novo ingrediente alimentar, nos termos do Regulamento
28.4.2009 Jornal Oficial da União Europeia L 106/55 DECISÃO DA COMISSÃO de 23 de Abril de 2009 que autoriza a colocação no mercado de licopeno como novo ingrediente alimentar, nos termos do Regulamento
