TÉCNICAS CITOPATOLÓGICAS
|
|
|
- Lúcia Flores Cortês
- 6 Há anos
- Visualizações:
Transcrição
1 TÉCNICAS CITOPATOLÓGICAS INTRODUÇÃO Desde as últimas décadas a citologia vem se tornado amplamente aceita, sendo hoje um componente integral da Patologia. É rotineiramente praticada, mesmo nos pequenos laboratórios, onde o citotecnologista e, ou citopatologista podem contar com o auxílio do laboratório de histologia. Este capítulo pretende ser um guia introdutório de técnicas em citopatologia para histotecnologistas, e outros técnicos, que atuam como auxiliares num laboratório de citologia. Assim, apresentamos uma versão abreviada dos métodos em citologia, não voltada diretamente para os citotecnologistas. A citologia compreende o estudo da estrutura, função, multiplicação, história da vida, e alterações patológicas das células. A citopatologia estuda as alterações celulares na doença, sendo as amostras citológicas examinadas quanto aos detalhes nucleares e citoplasmáticos celulares. As alterações nos padrões celulares auxiliam na separação entre as células normais e anormais. Os preparados citológicos podem, contudo, ser diagnósticos finais ou auxiliar no diagnóstico das doenças. As amostras celulares podem ser coletadas de várias maneiras. A pessoa que manipula os espécimens citológicos deve estar ciente de que o espécimen citológico varia, dependendo do tipo do mesmo e do método de coleta. O material ginecológico (esfregaços de Papanicolaou) e as aspirações por agulha fina são distendidos em lâminas e fixados antes de chegarem no laboratório de citologia. São fixados com fixador de base alcoólica, em spray, ou com etanol a 95%. Os espécimens aquosos, ou com células esparsamente distribuidas, tais como a urina, o fluido cérebroespinhal, e os líquidos das cavidades corporais, devem ser colocados em filtros ou concentrados para se ter uma ótima amostragem celular. A citocentrifugação concentra as células em um sedimento (pellet) a partir do qual esfregaços ou blocos celulares podem ser feitos. A citocentrifugação também pode concentrar as células numa pequena área da lâmina de vidro na preparações cytospin. A rápida fixação e a ótima preservação das células são de grande importância para a interpretação diagnóstica do material. O fixador líquido mais comum, para os espécimens citológicos, é o etanol a 95%. Os materiais fixados em etanol a 95% são corados pela técnica de Papanicolaou modificada. Os espécimens podem também ser fixados a seco (ao ar) e corados pelos métodos Diff- Quik ou de Romanovsky. Se fluidos forem coletados após as horas de funcionamento do laboratório, eles devem ser colocados no refrigerador. Para auxiliar na preservação destes espécimens, etanol a 50% pode ser adicionado. Para evitar-se a formação de coágulo, a heparina deve ser acrescentada nos espécimens hemorrágicos. 1
2 FIXAÇÃO DOS ESFREGAÇOS Os principais propósitos de um fixador citológico são penetrar rapidamente nas células e a manutenção da integridade morfológica das mesmas. Hoje, o fixador usado mais comum é o etanol a 95%, o qual pode ser substituido por outros álcoois que dão resultados equivalentes, como o metanol a 100%, álcool desnaturado a 95%, isopropanol a 80%, e vários fixadores em spray disponíveis comercialmente. A fixação imediata, enquanto o espécimen ainda está úmido, é essencial para uma ótima preservação, pois mesmo uma mínima dessecação ao ar, de uma amostra, irá alterar os aspectos celulares. O tempo de fixação mínimo é de 15 minutos, porém uma fixação prolongada, de vários dias, não alterará a aparência do esfregaço. Os fixadores em spray consistem de uma base alcoólica e de uma substância cerácea que cobre a lâmina. Uma pequena quantidade de cêra, tal como Carbowax (polietilenoglicol) é acrescentada ao fixador alcoólico para prover uma cobertura protetora e evitar artefato por dessecação ao ar. Este deve ser removido antes da coloração. Dois banhos em etanol a 95%, de 10 a 15 minutos cada, são, usualmente, o suficiente para remover a substância cerácea. O carbowax é acrescentado ao fixador de Saccomanno, de modo que as preparações de Saccomanno também devem passar pelo etanol a 95%, por 10 a 20 minutos, antes do processamento através das colorações. Os espécimens não-fixados, para serem processados mais tarde, podem ter etanol a 50% adicionado à amostra, como preservativo, ou este pode ser usado como um fluido de coleta. Os espécimens deixados para o processamento no dia seguinte devem ser coletados em etanol a 50% e mantidos no refrigerador durante a noite. Concentrações maiores que 50% da solução préfixadora endurecem a amostra e dificultam a realização de esfregaços. A heparina deve ser adicionada às amostras sanguinolentas para prevenir a formação de coágulo. As amostras citológicas fixadas, como é de regra, são coradas pelo método de Papanicolaou. Os blocos celulares são fixados em formalina, e as secções coradas pelo método da hematoxilina e eosina, ou outras colorações especiais, que possam auxiliar no diagnóstico. Algumas preparações citológicas são, por escolha, deixadas secar ao ar e não fixadas. Tais preparações são, a seguir, coradas pelo método de Romanovsky, que contém metanol. A coloração, em si, age como um fixador. 2
3 PREPARO DE LÂMINAS COM AMOSTRAS CITOLÓGICAS As amostras ginecológicas (esfregaços de Papanicolaou), e as obtidas por aspiração com agulha fina, chegam ao laboratório já fixadas e prontas para serem coradas. Outras amostras, algumas das quais coletadas em fluido preservativo, usualmente o etanol a 50%, são preparadas no laboratório. O método de preparação depende do tipo e da quantidade da amostra. As amostras esparsamente celulares podem ser processadas em filtros ou colocadas na lâmina com uma citocentrífuga, a qual concentra as células numa área muito pequena (cytospins). O método de preparação celular preferido, entretanto, é o esfregaço direto da amostra sobre uma lâmina de vidro. As amostras escassas podem ser concentradas por centrifugação e, a seguir, serem feitos os esfregaços nas lâminas. O material de sobra pode fornecer blocos celulares. As secções dos blocos celulares podem ser coradas por técnicas especiais, importantes auxiliares no diagnóstico. BIOSSEGURANÇA: É importante ter ciência de que os espécimens frescos, não-fixados, podem ser infecciosos. Sempre use um jaleco e luvas, e manipule as amostras com cuidado, preferencialmente em uma capela com fluxo laminar. Esfregue, no lado de fora do frasco do espécimen, solução de isopropanol a 70% ou de Clorox a 10% [solução aquosa de hipoclorito de sódio a 10%]. Descontamine todos os equipamentos usados no preparo das amostras, tais como microscópio, centrífuga, misturadores Vortex, esfregando neles álcool ou solução de Clorox. 3
4 FILTROS DE MEMBRANA PRINCÍPIOS As preparações com filtro são usadas no processamento de espécimens esparsamente celulares, e servem como substitutos da citocentrifugação (cytospin). Os fluidos cérebroespinhais, a urina, os lavados brônquicos e os transudatos são espécimens que se encaixam bem neste tipo de processamento. Para se determinar a celularidade de uma amostra executa-se o teste com o azul de toluidina. Para os espécimens esparsamente celulares ou de pequeno volume, os filtros oferecem a potencialidade de se recuperar todas as células. O processamento com filtros é o mesmo para todos os espécimens, devendo as suas diretrizes serem seguidas fielmente, ou as preparações resultantes serão insatisfatórias. Três tipos de filtros (discutidos abaixo) podem ser usados nas preparações citológicas. MATERIAIS E SOLUÇÕES Filtro Suporte do filtro Grampos para filtro Pinças para filtro Seringas descartáveis de 10 mililitros Lâminas de vidro Etanol a 95% Método de coloração de Papanicolaou PROCEDIMENTO Figuras 1 e 2, no final do capítulo de técnicas citopatológicas. 1. Remova o filtro da caixa usando uma pinça e coloque-o no suporte. 2. Expanda o filtro injetando no suporte várias gotas de etanol a 95%. 3. Injete o espécimen dentro do suporte usando uma seringa de 10 mililitros. 4. Adicione 1 mililitro de etanol a 95% usando a seringa de 10 mililitros. 5. Remova o filtro do suporte, utilizando uma pinça, e corte-o para caber na lâmina. (Se utilizar um filtro grande corte-o em duas metades e use duas lâminas). 6. Prenda, com um grampo, cada metade do filtro em uma lâmina, e mergulhe as lâminas em uma jarra de coloração contendo etanol a 95%. 7. Core pelo método de Papanicolaou (veja adiante). 8. Monte em lâminas de vidro, com meio resinoso, mantendo as células voltadas para cima, e tomando o cuidado de não deixar bolhas entre a lâmina, o filtro e a lamínula. OBSERVAÇÕES: Há três tipos de filtro que podem ser usados na preparação de espécimens citológicos, a saber, Millipore, Gelman, e Nucleopore. A principal diferença entre eles é o tipo de material de que são feitos e o tamanho dos seus poros. Todos os três requerem um método de coloração de Papanicolaou modificado. Os filtros Millipore são filtros plásticos, contendo ésteres mistos de celulose, e poros grandes. Tais filtros devem ser expandidos com etanol a 95%, para que não se retraiam, quando expostos aos espécimens citológicos. Durante a coloração, os tempos suficientes nas soluções corantes, associados com os enxágues em etanol, permitem que os corantes sejam absorvidos pelas células e não pelo filtro em si. Precauções especiais devem ser tomadas durante a montagem da lâmina com os filtros Millipore. Eles se tornam transparentes somente quando montados em um meio com índice de refração semelhante ao dos filtros. Um meio de montagem usual é o Permount (Fisher Scientific). Uma quantidade apropriada de meio de montagem deve ser usada, pois o xileno não se mantém nos poros do filtro e, ao evaporar-se após alguns dias, levará à dessecação do filtro, apesar deste estar 4
5 coberto com a lamínula. Entretanto, muito meio de montagem pode dificultar o exame microscópico em grande aumento, a seco. Os filtros Gelman têm propriedades físicas e ópticas semelhantes às dos filtros Millipore, e são feitos de triacetato de celulose, um polímero mais resistente ao etanol. Em comparação com os filtros Millipore, expandem-se menos quando expostos ao etanol. A captura de corante por este filtro é marcantemente reduzida, o que permite as células coradas sobressaírem-se em relação com o fundo da lâmina. Os filtros Gelman têm um índice de refração de 1,47 a 1,48 e, para uma boa imagem microscópica, eles precisam ser montados em um meio com índice de refração igual ou semelhante ao deles. O meio Permount (Fisher Scientific) pode ser usado. Os filtros Nucleopore são feitos de policarbonato, o qual não é afetado pela maioria dos solventes. Por isso, não é necessário pré-expandi-los com etanol a 95%. Eles não se coram e, desse modo, dão um fundo claro à lâmina; entretanto, eles têm dois índices de refração e são birrefringentes, tornando impossível eliminar a imagem dos poros com o meio de montagem. Deve-se também chamar a atenção que se eles forem expostos ao xileno por mais de 15 minutos, eles ficarão ondulados. Isto tornará difícil a montagem com lamínula e o exame ao microscópio. Os filtros Nucleopore, entretanto, podem ser dissolvidos em clorofórmio ou em cloreto de etileno, o que elimina a ondulação e a imagem distorcida dos poros. Contudo, a eliminação do filtro quimicamente pode produzir vários artefatos, que podem causar problemas na avaliação do espécimen. 5
6 TESTE COM O AZUL DE TOLUIDINA PRINCÍPIOS Os espécimens celulares, não-ginecológicos, (i.é., fluidos de cavidades corporais) têm um alto potencial de contaminação cruzada e devem ser corados separadamente (regulação CLIA - 88). Para determinar a celularidade de uma amostra o teste do azul de toluidina deve ser feito. As amostras celulares coradas pelo azul de toluidina mostram claramente se o espécimen contém grande número de células e de grupamentos celulares. Os grupamentos celulares indicam que o fluido é anormal e que deve ser processado separadamente. MATERIAIS E SOLUÇÕES Azul de toluidina (C.I )...0,5 grama. Etanol a 95%...20 mililitros. Água destilada...80 mililitros. Dissolva o azul de toluidina no etanol. Acrescente água destilada até o volume final de 100 mililitros. Filtre antes de usar. PROCEDIMENTO 1. Coloque uma gota de azul de toluidina sobre uma lâmina limpa. 2. Coloque uma gota do fluido da amostra próximo ao corante, e deixe o contato se fazer. 3. Coloque uma pequena lamínula sobre o espécimen. 4. Avalie a celularidade da amostra sob o microscópio. 5. Processe, separadamente, as amostras com elevada celularidade e muitos grupamentos de células. 6
7 ESFREGAÇOS DIRETOS PRINCÍPIOS O esfregaço direto da amostra de células sobre a lâmina é o método preferido no processamento citológico. Os espécimens ricos em células são usados diretamente e os espécimens menos celulares são concentrados através de centrifugação. Os escarros, preparados de acordo com o método de Saccomanno, são pré-fixados, misturados por meio de um misturador, e concentrados por centrifugação, antes de serem feitos os esfregaços sobre as lâminas. Os esfregaços diretos são preparados usando-se o método da tração de duas lâminas. Duas gotas da amostra são colocados sobre uma lâmina e, sobre esta, é colocada uma segunda lâmina, sendo as duas gentilmente tracionadas em sentido opostos de modo que, ao final, haverá dois esfregaços. MATERIAIS E SOLUÇÕES Centrífuga Tubos de 50 mililitros para centrífuga Misturador Vortex Pipetas de vidro Etanol a 50% Lâminas de vidro cobertas com poli-l-lisina. PROCEDIMENTO Figuras 4 e 5, ao final do capítulo de técnicas citopatológicas. 1. Concentre o espécime através de centrifugação, se necessário. 2. Decante a maior parte do sobrenadante e redissolva o sedimento misturando-o com o Vortex, por poucos segundos. 3. Transfira, com uma pipeta de vidro, uma pequena quantidade do sedimento para o centro de uma lâmina de vidro, coberta previamente com poli-l-lisina. Coloque uma outra lâmina sobre o sedimento e, gentilmente, movimente as lâminas para frente e para trás, de modo a dispersar as células em uma fina camada. A seguir, separe as lâminas, uma da outra, rapidamente. 4. Imerja as lâminas em etanol a 95% para a coloração pelo método de Papanicolaou, ou deixe-as secar ao ar para serem coradas pelo método Diff-Quik. OBSERVAÇÕES: Os escarros, os fluidos cavitários corporais, e os aspirados por agulha fina são os tipos de espécimens, a partir dos quais, podem ser feitos esfregaços diretos. Faça uma solução de 50 microgramas/mililitro de poli-l-lisina em água desionizada, autoclavada (esta solução pode ser utilizada por até 1 mês, se mantida a 4 o C). Sobre cada lâmina coloque, aproximadamente, 1 mililitro de solução de poli-l-lisina, e distribua uniformemente em cada uma das superfícies. Deixe as lâminas em repouso, à temperatura ambiente, por 30 minutos. Escorra o excesso da solução de poli-l-lisina e enxágue as lâminas, 3 vezes, em água desionizada. Deixe as lâminas secarem (as lâminas secas podem ser armazenadas por 1 semana à temperatura ambiente). 7
8 MÉTODO DE SACCOMANNO PARA O PREPARO DE ESCARRO PRINCÍPIOS A técnica de Saccomanno é um método alternativo para o processamento de escarro. Esta técnica remove os restos celulares (debris) e o material mucóide, que podem esconder as células diagnósticas. MATERIAIS E SOLUÇÕES Misturador pequeno Centrífuga Tubos de 50 mililitros para centrífuga Misturador Vortex Pipetas Lâminas de vidro cobertas com poli-l-lisina (veja acima). Fixador de Saccomanno Etanol a 95% mililitros. Água destilada mililitros. Carbowax (1540) (DuPont)...92 gramas. [Nota: Carbowax = poli(glicol etilênico) ou polietilenoglicol] Misture a água destilada e o etanol em um recipiente de 4 litros. Derreta o Carbowax em banho-maria a 37 o C. Adicione o Carbowax derretido à solução no recipiente e agite por 30 segundos. PROCEDIMENTO 1. Adicione o fixador de Saccomanno ao escarro, e despeje num recipiente de 250 mililitros de um misturador semi-micro. O volume total do fixador com o espécimen deve ser em torno de 100 mililitros. (Se o espécimen for escasso acrescente fixador até o volume de 30 mililitros). 2. Misture tudo em baixa velocidade por 2 segundos e em alta velocidade por 5 a 30 segundos. Macroscopicamente os filamentos finos do material não devem ser visíveis. Se forem visíveis, misture novamente por mais 15 a 20 segundos ou até que os filamentos desapareçam. 3. Divida a suspensão entre dois tubos de centrífuga, de modo equilibrado. 4. Centrifugue o espécimen, por 5 minutos, a rotações por minuto (rpm). 5. Decante o sobrenadante até que 2 a 3 mililitros cubram o concentrado celular. 6. Redissolva o concentrado de células por agitação em um misturador Vortex. 7. Aspire com uma pipeta cerca de 1 mililitro da suspensão. Adicione duas gotas sobre uma lâmina previamente coberta com poli-l-lisina. Para os espécimens pouco celulares adicione 3 a 4 gotas ou mais, se necessário. 8. Faça os esfregaços segundo o método de esfregaços diretos. 9. Deixe as lâminas, com a superfície com o material voltada para cima, secar ao ar. 10. Imerja as lâminas, secas ao ar, em etanol a 95%, e deixe por 10 minutos para remover o Carbowax precipitado. NOTA: O esfregaço direto de escarro é feito com o espécimen fresco, enquanto o método de Saccomanno permite que a amostra fique no refrigerador para ser processada no dia seguinte. O fixador de Saccomanno contém Carbowax, o qual deve ser removido antes da coloração. 8
9 REFERÊNCIA GILL, G. & PLOWDEN, K.- Laboratory Cytopathology: Techniques for Specimen Preparation. Baltimore, Md, Johns Hopkins University Press,
10 PREPARO DE BLOCO CELULAR PRINCÍPIOS O bloco celular é um procedimento auxiliar na avaliação diagnóstica citológica. Pode ser preparado a partir de fluidos, lavados, escovados, ou aspirados por agulha. A vantagem do bloco celular é a captura de qualquer tecido que possa estar presente no espécimen, permitindo, assim, a observação de alguma arquitetura tecidual. O bloco celular permite também a realização de cortes adicionais, para estudo com colorações especiais, úteis no auxílio diagnóstico de um caso. MATERIAIS E SOLUÇÕES Centrífuga Tubos de 10 mililitros para centrífuga Solução aquosa de gelatina a 2% derretida, dentro de um tubo de ensaio de vidro, mantido em água fervendo. Pipeta de vidro aquecida para transferência da gelatina. Formalina a 10%, neutra, tamponada. Etanol Xileno Parafina PROCEDIMENTO 1. Centrifugue o espécimen até formar o sedimento. 2. Decante o sobrenadante. 3. Acrescente cerca de 0,25 mililitros de solução aquosa de gelatina a 2%, quente, cuidadosamente, e com o auxílio de um bastão ou espátula levante o sedimento de modo que a gelatina flua sob o mesmo. 4. Coloque o tubo de ensaio no gelo para solidificar rapidamente a gelatina. 5. Remova o botão de gelatina com o bastão ou a espátula e coloque-o na formalina. 6. Deixe fixar por pelo menos 1 hora. 7. Processe como um tecido, emblocando em parafina. OBSERVAÇÕES: Alguns espécimens celulares, e.g., fluidos de cavidades corporais, contêm sangue e poderão coagular na ausência de heparina. Assim, o material diagnóstico ficará entremeado na rede de fibrina e não disponível para a avaliação. Entretanto, tais coágulos podem ser envolvidos em papel de filtro, fixados em formalina, e processados como tecido. Nestes casos, não é necessário concentrar a amostra, por meio de centrifugação, e emblocá-la em gelatina. REFERÊNCIA GILL, G. & PLOWDEN, K.- Laboratory Cytopathology: Techniques for Specimen Preparation. Baltimore, Md, Johns Hopkins University Press,
11 PREPARAÇÃO DE CITOCENTRIFUGADO (CYTOSPIN) PRINCÍPIOS Para os espécimens paucicelulares ou em pequeno volume, tais como o líquido céfalorraquidiano ou os transudatos, a centrifugação das amostras para uma lâmina de vidro (cytospins), através de uma citocentrífuga, permite a captura de uma concentração maior de células para uma pequena área circular da lâmina. O cytospin elimina a maior parte dos restos proteináceos (debris), deixando um fundo limpo na lâmina. Os fabricantes deste tipo de equipamento fornecem as informações, quanto aos materiais e as soluções necessárias, e de como operar o equipamento. MATERIAIS E SOLUÇÕES Hemacitômetro Centrífuga Cytospin (Shandon Cytospin 2, Shandon Inc., Pittsburgh, PA) Câmaras Cytospin (citofunis para a colocação das amostras) Citoclipes Cytospin (prendedores de aço para lâminas) Filtros-almofadas Cytospin (cartões de filtro) Lâminas de vidro cobertas com poli-l-lisina (veja anteriormente), ou lâmina comuns se a poli- L-lisina não estiver disponível. Fixador Cytospin ou fixador de Saccomanno Etanol a 95% Pipetas PROCEDIMENTO 1. Conte as células do espécimen com o hemacitômetro, no microscópio, ou use uma quantidade aproximada (veja as observações abaixo). 2. Dilua as amostras, ricas em células, até 2 x 10 6 células/mililitro, e concentre as amostras paucicelulares, por meio de centrifugação, até o número de células citado, se possível. 3. Coloque um filtro-almofada (cartão de filtro) entre uma das lâminas (cobertas com poli- L-lisina) e cada uma das câmaras Cytospin (citofunis), mantendo o lado espesso do filtro não-justaposto à lâmina, e o conjunto preso com um citoclipe. O orifício no filtroalmofada (cartão de filtro) deve ficar na porção mais baixa da câmara (citofunil). 4. Coloque as câmaras (citofunis) dentro da centrífuga Cytospin. 5. Coloque algumas gotas de etanol a 95%, no poço da câmara (citofunil), para expandir o filtro. 6. Coloque 3 gotas da amostra (ou mais se a amostra for paucicelular) na porção horizontal do reservatório (citofunil) e, a seguir, várias gotas do fixador Cytospin. 7. Cubra o reservatório (citofunil) de modo que nenhum espécimen se perca. 8. Coloque a tampa sobre o cytospin (cabeçote com 12 posições) e feche a centrífuga. 9. Programe a velocidade (1.500 rpm) e o tempo (2 minutos). 10. Centrifugue. 11. Deixe a centrífuga parar antes de abri-la. OBSERVAÇÕES: Este procedimento é o recomendado para a Shandon Cytospin 2, Shandon Inc., Pittsburgh, PA, e pode ter que ser modificado no uso de outras citocentrífugas. O número de gotas de células, a ser usado, pode também ser determinado colocando-se uma gota da suspensão celular sobre uma lâmina de vidro e coberta com uma lamínula. A lâmina é, então, observada ao microscópio, de modo a se ter uma avaliação aproximada do número de células por campo, com a objetiva de 40x. O número aproximado de células contadas é, então, dividido por 60, cujo resultado inteiro será o número de gotas a ser usado em cada lâmina. Por exemplo, se a contagem celular for 20, o número de gotas será 3. Quando a observação com a objetiva de 10x revelar quase 11
12 nenhuma célula, use 20 gotas. Poucas gotas de saponina podem ser adicionadas, antes de se colocar o fixador Cytospin, se o espécimen for sanguinolento. A saponina lisa as hemácias, pois as mesmas são como um artefato que dificulta a observação das células diagnósticas. Deve-se lembrar que já existem equipamentos disponíveis para o preparo citológico, em monocamadas finas, sobre lâminas de vidro. Tais equipamentos variam desde simples e baratos até os mais complexos e caros. 12
13 PROCEDIMENTOS DE COLORAÇÃO O método de coloração mais comumente usado nos preparados citológicos é o de Papanicolaou. Modificações desta técnica variam de um laboratório para outro. É aconselhável a padronização deste método, de modo que sejam obtidos resultados satisfatórios. As preparações secas ao ar são coradas pelo método de Romanovsky e, usualmente, pelos métodos Diff-Quick ou de Giemsa. O uso de outros métodos de coloração, na rotina do diagnóstico citológico, tem sido limitado. As colorações especiais, rotineiramente utilizadas na maioria dos laboratórios histológicos, são algumas vezes aplicadas. Nós utilizamos como referência, para tais técnicas, o AFIP`s Laboratory Methods in Histotechnology. COLORAÇÃO DE PAPANICOLAOU PRINCÍPIOS O procedimento de coloração de Papanicolaou foi desenvolvido para uma ótima visualização das células cancerosas esfoliadas das superfícies epiteliais do corpo. É uma reação de coloração policromática, consistindo de um corante nuclear de base aquosa e de dois contracorantes citoplasmáticos de base alcoólica, cujo objetivo é mostrar as muitas variações na morfologia celular e os graus de maturidade e de atividade metabólica celular. Este método não é específico para qualquer substância encontrada no câncer. SOLUÇÕES Hematoxilina Água destilada mililitros. Etileno glicol mililitros. Hematoxilina de Gill II (Lerner, Pittsburgh, PA)...2 gramas. Iodato de sódio...0,2 grama. Sulfato de alumínio...17,6 gramas. Ácido acético glacial...20 mililitros. [Nota: A hematoxilina de Gill II pode ser substituida pela hematoxilina, cristais (C.I.: 75290)] Misture os ingredientes, na sequência, utilizando uma barra magnética, por 1 hora à temperatura ambiente. O corante pode ser usado imediatamente, porém filtre antes de cada uso. A hematoxilina empregada nesta fórmula é a anidra. Se for utilizada a forma da hematoxilina em cristais, use 2,36 gramas. Um grama de ácido cítrico pode ser substituido por 20 mililitros de ácido acético glacial. Banho de ácido clorídrico (usado somente para os filtros) Água destilada mililitros. Ácido clorídrico, concentrado...2 mililitros. (Prepare fresco em cada dia) 13
14 Hidróxido de amônio (banho azulador) Água destilada mililitros. NH4OH, concentrado...1 mililitro. (Prepare fresco em cada dia) Corante Orange G Solução-estoque: Orange G a 10% Orange G (Lerner) (C.I.16230)...10 gramas. Água destilada...até completar 100 mililitros. (Quando estiver preparando a solução-estoque leve em consideração a pureza do corante. Exemplo: Se a pureza for de 80%, use 12,5 gramas). Solução de trabalho: Corante Eosina-65 Solução estoque...20 mililitros. Ácido fosfotúngstico...0,15 grama. Etanol a 95% mililitros. Soluções-estoque: Eosina Y a 20% Eosina Y, aquosa (Lerner) (C.I )...20 gramas. Água destilada, 70 o a 80 o C...até completar 100 mililitros. Verde Claro (Light-Green SF) a 3% Light-Green SF (Lerner) (C.I )...3 gramas. Água destilada, 70 o a 80 o C...até completar 100 mililitros. As soluções podem ser usadas imediatamente, porém filtre-as antes de cada uso. Leve em consideração a concentração (pureza) do corante, quando for preparar as soluções-estoques. Solução de trabalho: EA-65 Solução-estoque de eosina Y...20 mililitros. Solução-estoque de Light-Green SF...10 mililitros. Ácido fosfotúngstico...2 gramas. Etanol a 95% mililitros. Metanol absoluto mililitros. Ácido acético glacial...20 mililitros. 14
15 Etanol: 95%, 100% Xileno (xilol) Meio de montagem PROCEDIMENTO 1. Etanol a 95%...10 gotas (veja as notas abaixo). 2. Etanol a 95%...10 gotas. 3. Água destilada/desionizada...10 gotas (veja as notas abaixo). 4. Água destilada/desionizada...10 gotas. 5. Hematoxilina...3 minutos. 6. Água destilada/desionizada...20 gotas. 7. Banho azulador...20 gotas. 8. Água destilada/desionizada...20 gotas. 9. Etanol a 95%...10 gotas. 10. Etanol a 95%...10 gotas. 11. Orange G, solução de trabalho...1 minuto. 12. Etanol a 95%...10 gotas. 13. Etanol a 95%...10 gotas. 14. Etanol a 95%...10 gotas. 15. Eosina-EA65, solução de trabalho...5 minutos. 16. Etanol a 95%...10 gotas. 17. Etanol a 95%...10 gotas. 18. Etanol a 95%...10 gotas. 19. Etanol a 100%...10 gotas. 20. Etanol a 100%...10 gotas. 21. Etanol a 100%...10 gotas. 22. Xileno...10 gotas. 23. Xileno...10 gotas. 24. Monte em meio resinoso. 15
16 MÉTODO DE COLORAÇÃO DE PAPANICOLAOU PARA FILTROS 1. Etanol a 95%...10 gotas. 2. Água destilada/desionizada...10 gotas. 3. Água destilada/desionizada...10 gotas. 4. Hematoxilina...2 minutos. 5. Água corrente de torneira...20 gotas. 6. Banho ácido, 1 gota/segundo por...1 minuto. (ou até que os filtros fiquem amarelo-pálidos) 7. Água destilada/desionizada...20 gotas. 8. Banho azulador...2 minutos. 9. Etanol a 95%...10 gotas. 10. Etanol a 95%...10 gotas. 11. Orange G, solução de trabalho...10 segundos. (não goteje nos filtros a partir deste ponto, deixe-os nas soluções) 12. Etanol a 95%...1 minuto. 13. Etanol a 95%...1 minuto. 14. Etanol a 95%...1 minuto. 15. Eosina-EA 65, solução de trabalho...8 minutos. 16. Etanol a 95%...4 minutos. 17. Etanol a 95%...2 minutos. 18. Etanol a 95%...1 minuto. 19. Etanol a 100%...1 minuto. 20. Etanol a 100%...1 minuto. 21. Etanol a 100%...1 minuto. 22. Xileno...1 minuto. 23. Xileno...1 minuto. 24. Monte em lâmina de vidro com meio resinoso. NOTAS: Quando estiver seguindo o procedimento de Papanicolaou, observe que todos os esfregaços que tenham sido fixados com spray e todas as preparações de Saccomanno devem permanecer no etanol a 95%, por pelo menos 10 minutos, antes de se proceder a coloração. Pode-se usar água destilada ou desionizada. Durante a coloração, um número substancial de células se solta das lâminas ou dos filtros. Não é incomum que tais células flutuantes se fixem em outro espécimen. Para evitar a ocorrência de 16
17 contaminação cruzada, certas regras devem ser seguidas: Todas as soluções devem ser filtradas diariamente. Os casos menos propensos a soltar células devem ser corados primeiro, e aqueles que mais facilmente soltam células devem ser corados por último. A ordem de coloração das amostras nãoginecológicas deve ser a seguinte: (1 o ) fluidos espinhais; (2 o ) esfregaços e citocentrifugados (cytospins); e (3 o ) todos os filtros. Deve-se ter em mente, entretanto, que o problema do desprendimento de células não pode ser totalmente eliminado. Algumas ocorrências que precedem a aplicação do meio de montagem na lâmina podem influenciar os resultados. Tais ocorrências incluem a espessura do esfregaço celular e a presença de água no etanol absoluto e no xileno. Para os esfregaços celulares espessos, ou para os filtros, uma quantidade maior de meio de montagem deve ser utilizada. Áreas densas, como borrões, das preparações, cobertas pelo meio de montagem, favorecem a produção de bolhas de ar e o aparecimento de focos secos pelo ar, causando o artefato conhecido com flocos de milho (Figura 11). Se isto ocorrer, retire a lamínula imergindo a lâmina no xileno, e, a seguir, recoloque a lamínula. Outro problema é a transferência de água para o etanol absoluto e deste para o xileno, tornando-os enevoados, esbranquiçados. O resultado será a má-desidratação e imagens pouco nítidas (Figura 12). Se água for notada no xileno, IMEDIATAMENTE, troque o xileno, assim como o etanol absoluto. Acima de tudo, um preparado citológico satisfatório depende não somente da coloração, mas também da coleta do espécimen, da sua preparação, e da sua fixação. Uma coloração perfeita não melhorará as amostras paucicelulares, ou as amostras mal-fixadas com células degeneradas, ou as amostras cujas células ficam obscurecidas por lagos de leucócitos polimorfonucleares (neutrófilos). Tais preparações podem ser consideradas insatisfatórias. REFERÊNCIAS GILL, G. & PLOWDEN, K.- Laboratory Cytopathology: Techniques for Specimen Preparation. Baltimore, Md, Johns Hopkins University Press, PROPHET, E. B.; MILLS, B.; ARRINGTON, J.B. & SOBIN, L.H., eds.-armed Forces Institute of Pathology. Laboratory Methods in Histotechnology. Washington, D.C., American Registry of Pathology,
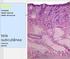
18 CONTROLE DE QUALIDADE DO MÉTODO DE COLORAÇÃO DE PAPANICOLAOU A apreciação técnica das lâminas coradas é feita para se determinar a ótima qualidade da coloração na avaliação citológica. Um registro diário da qualidade dos métodos de coloração celular deve ser mantido. Neste registro deve-se incluir a data e as observações quanto a qualidade da coloração ser ou não-aceitável. As ações corretivas devem ser documentadas quando as colorações estiverem não-aceitáveis. As ótimas colorações dependem da quantidade, da qualidade, e da tonalidade verdadeira dos corantes. A hematoxilina, um corante nuclear, deve ser avermelhada, azul, azul-escura, ou púrpuraescura. Uma cor castanha significa excessiva oxidação da hematoxilina o que, geralmente, dá resultados de coloração insatisfatórios. A hematoxilina não deve bloquear a captura ou adulterar a cor dos contracorantes aplicados subsequentemente. Para a avaliação da qualidade da coloração nuclear, o núcleo das células intermediárias deve ser observado. A cromatina dos mesmos deve ser granular, nítida, distinta, e de cor púrpura-clara. O núcleo dos neutrófilos deve também ser utilizado para a avaliação da qualidade tintorial nuclear. Eles devem corar-se intensamente em azul-escuro a púrpuraescuro e ter a cromatina com imagem bem nítida e distinta. Os contracorantes Orange G e a Eosina-EA65 podem dar cores vívidas, transparência citoplasmática e contracoloração diferenciada. Nas células preservadas de modo ideal, várias cores citoplasmáticas diferentes são identificadas. A eosina Y dá a cor rósea-avermelhada às células escamosas maduras e cora o nucléolo em vermelho; o Verde Claro (Light-Green SF) cora em verdeazulado as células metabolicamente ativas; e o Orange G cora em laranja ou amarelo o citoplasma queratinizado. Fragmentos espessos de tecido ou células acumuladas em múltiplas camadas, algumas vezes apresentam uma penetração irregular do corante, resultando em cores que não são normalmente esperadas. Sempre que for possível, camadas mais finas de células são o desejável. Deve-se ter cuidado na avaliação da morfologia das células, evitando-se a apreciação superficial da coloração que, eventualmente, pode levar a uma avaliação diagnóstica errônea. 18
19 DESCOLORAÇÃO DE LÂMINAS PRINCÍPIOS Ocasionalmente pode ser necessário descorar uma lâmina de citologia, seja para recolorir pelo método de Papanicolaou, seja para requerer uma coloração especial, que pode auxiliar no diagnóstico. MATERIAIS E SOLUÇÕES Jarras de coloração Xileno Etanol a 100% Álcool-ácido (HCl a 1% em etanol a 70%) Banho azulador Etanol a 95% PROCEDIMENTO 1. Coloque a lâmina na jarra de coloração contendo xileno e deixe a lamínula se destacar espontaneamente; não a puxe. As lâminas que estão montadas há muito tempo podem necessitar de vários dias para que a lamínula se solte. 2. Remova todos os traços do meio de montagem mergulhando a lâmina em xileno, fazendo 2 trocas de 1 minuto cada. 3. Coloque a lâmina em etanol a 100%, fazendo 2 trocas de 1 minuto cada. 4. Coloque a lâmina no álcool-ácido até que a descoloração se complete. O tempo variará nesta etapa. 5. Mergulhe a lâmina no banho azulador de deixe por 3 ou 4 minutos. 6. Enxágue em água de torneira, fazendo 2 trocas. 7. Coloque a lâmina na jarra de coloração contendo etanol a 95%. A lâmina está agora pronta para ser recolorida pelo método de Papanicolaou ou por uma coloração especial. 19
20 MÉTODO DO CORANTE DIFF-QUIK PRINCÍPIOS Este corante é comprado comercialmente e é um corante de Wright-Giemsa modificado. Foi originalmente idealizado para ser um método de coloração rápido para os esfregaços sanguíneos, porém também tem sido um corante de grande valor na avaliação de material citológico seco ao ar. SOLUÇÕES Fixador de Diff-Quik Solução I de Diff-Quik Solução II de Diff-Quik PROCEDIMENTO 1. Fixador de Diff-Quik...5 gotas. 2. Solução I de Diff-Quik...8 a 10 gotas. 3. Solução II de Diff-Quik...8 a 10 gotas. 4. Água corrente de torneira...8 a 10 gotas. 5. Seque ao ar a lâmina corada. 6. Xileno...5 gotas. 7. Montar em meio resinoso. Recolorir as lâminas coradas pelo método Diff-Quik pode ser feito com bons resultados, se necessário. PROCEDIMENTO DE RECOLORAÇÃO 1. Coloque a lâmina no xileno e gentilmente remova a lamínula, enquanto a mesma vai soltando. 2. Imerja a lâmina em xileno limpo para remover todo o meio de montagem. 3. Seque completamente a lâmina ao ar. 4. Coloque a lâmina no fixador de Diff-Quik e deixe por 45 minutos. 5. Recolore com as soluções I e II acima especificadas. OBSERVAÇÃO Filtre a solução II diariamente ou antes de cada uso. Complete ou troque os corantes frequentemente. As lâminas coradas no Diff-Quik NUNCA devem ser colocadas numa superfície quente para secar lâminas. As lâminas coradas pelo Diff-Quik podem ser recoradas se o espécimen ficar hipercorado ou pouco corado. REFERÊNCIA GILL, G. & PLOWDEN, K.- Laboratory Cytopathology: Techniques for Specimen Preparation. Baltimore, Md, Johns Hopkins University Press,
21 MÉTODO DE COLORAÇÃO DE GIEMSA PRINCÍPIO Este método é uma coloração do tipo-romanovsky em uma etapa, que requer fixação, com o metanol, de esfregaços citológicos secos ao ar. SOLUÇÃO Tampão fosfato 1/15M, ph 6,8 Solução A: Na 2HPO4.2H2O...5,93 gramas. Água destilada até o volume de mililitros. Solução B: KH2PO4...4,53 gramas. Água destilada até o volume de mililitros. Solução tampão de trabalho, ph 6,8 Solução A...50 mililitros. Solução B...50 mililitros. Água destilada mililitros. Ajuste o ph para 6,8 com a solução A ou B. Corante de Giemsa Giemsa (Merck)...10 mililitros. Solução tampão de trabalho...90 mililitros. Metanol Xileno Meio de montagem PROCEDIMENTO 1. Fixe as lâmina em metanol por 15 minutos. 2. Enxágue na solução de trabalho de tampão, ph 6,8. 3. Core no corante de Giemsa por 20 minutos. 4. Enxágue em água corrente de torneira até que a água fique clara. 5. Deixe secar ao ar. 6. Clarifique no xileno por 5 minutos. 7. Monte em meio resinoso. OBSERVAÇÕES Dependendo do tipo de espécimen, diferentes tempos de coloração são aplicados. A maioria dos tipos celulares é corada em 20 minutos, porém os fluidos cérebroespinhais levam apenas 5 minutos. Os esfregaços devem estar bem secos ao ar, antes de serem fixados em metanol, pois a fixação com o metanol de esfregações incompletamente secos gera artefatos azuis no núcleo, que podem mimetizar nucléolo aumentado. 21
22 REFERÊNCIA LOPES CARDOZO, P.- Atlas of Clinical Cytology. Netherlands, Publisher Targa, Hertogenbosch, REFERÊNCIAS ADICIONAIS SELECIONADAS BALES, C.E. & DURFEE, G.R.- Cytologic Techniques. In: KOSS, L.G.- Diagnostic Cytology and its Histopathologic Basis. 4 th ed., Philadelphia, Pa, JB Lippincott Company, pp KEEBLER, C.M.- Cytopreparatory Tecniques. In: BIBBO, M. ed.- Comprehensive Cytopathology. Philadelphia, Pa, W.B. Saunders, pp REFERÊNCIA PRINCIPAL Tracy L. Raber & Leigh Buckner III Cytopathology Techniques, In: Mikel, U.V., (ed.) AFIP Advanced Laboratory Methods in Histology and Pathology. Washington, D.C., American Registry of Pathology,
TÉCNICAS CITOPATOLÓGICAS
 TÉCNICAS CITOPATOLÓGICAS Tracy L. Raber & Leigh Buckner, III INTRODUÇÃO Desde as últimas décadas a citologia vem se tornado amplamente aceita, sendo hoje um componente integral da Patologia. É rotineiramente
TÉCNICAS CITOPATOLÓGICAS Tracy L. Raber & Leigh Buckner, III INTRODUÇÃO Desde as últimas décadas a citologia vem se tornado amplamente aceita, sendo hoje um componente integral da Patologia. É rotineiramente
TÉCNICAS DE CITOLOGIA. Silene Gomes Correa
 TÉCNICAS DE CITOLOGIA Silene Gomes Correa Preparo de Amostras Citológicas 1 2 3 4 5 Descrever coloração, viscosidade e volume Centrifugar em 2100 RPM por 10 Decantar Cito-centrifugar o sedimento Amostras
TÉCNICAS DE CITOLOGIA Silene Gomes Correa Preparo de Amostras Citológicas 1 2 3 4 5 Descrever coloração, viscosidade e volume Centrifugar em 2100 RPM por 10 Decantar Cito-centrifugar o sedimento Amostras
MÉTODO DE MANUEL PARA RETICULINA
 MÉTODO DE MANUEL PARA RETICULINA FIXADOR: Formalina a 10%, neutra, tamponada. SECÇÕES: Parafina, 6 micrômetros. SOLUÇÕES SOLUÇÃO DE NITRATO DE URÂNIO (URANILA) A 1% Nitrato de urânio (uranila) [UO 2 (NO
MÉTODO DE MANUEL PARA RETICULINA FIXADOR: Formalina a 10%, neutra, tamponada. SECÇÕES: Parafina, 6 micrômetros. SOLUÇÕES SOLUÇÃO DE NITRATO DE URÂNIO (URANILA) A 1% Nitrato de urânio (uranila) [UO 2 (NO
HEMATOXILINA & EOSINA Thomas C. Allen
 HEMATOXILINA & EOSINA Thomas C. Allen A hematoxilina, um corante natural, foi primeiro usada por volta de 1863. Em combinação com sais de alumínio, ferro, cromo, cobre, ou tungstênio é um excelente corante
HEMATOXILINA & EOSINA Thomas C. Allen A hematoxilina, um corante natural, foi primeiro usada por volta de 1863. Em combinação com sais de alumínio, ferro, cromo, cobre, ou tungstênio é um excelente corante
Introdução à Histologia e Técnicas Histológicas. Prof. Cristiane Oliveira
 Introdução à Histologia e Técnicas Histológicas Prof. Cristiane Oliveira Visão Geral Corpo humano organizado em 4 tecidos básicos: Epitelial Conjuntivo Muscular Nervoso Visão Geral - Tecidos consistem
Introdução à Histologia e Técnicas Histológicas Prof. Cristiane Oliveira Visão Geral Corpo humano organizado em 4 tecidos básicos: Epitelial Conjuntivo Muscular Nervoso Visão Geral - Tecidos consistem
PROTOCOLO PADRÃO DE TÉCNICAS PARA SECÇÕES EM CRIOSTATO
 UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS BIOLÓGICAS - CCB LABORATÓRIO MULTIUSUÁRIO DE ESTUDOS EM BIOLOGIA PROTOCOLO PADRÃO DE TÉCNICAS PARA SECÇÕES EM CRIOSTATO REVISADO EM 26/07/2017
UNIVERSIDADE FEDERAL DE SANTA CATARINA CENTRO DE CIÊNCIAS BIOLÓGICAS - CCB LABORATÓRIO MULTIUSUÁRIO DE ESTUDOS EM BIOLOGIA PROTOCOLO PADRÃO DE TÉCNICAS PARA SECÇÕES EM CRIOSTATO REVISADO EM 26/07/2017
Técnicas histológicas
 Técnicas histológicas Profa Simone Marcuzzo Histologia Estudo da estrutura e inter-relação dos constituintes teciduais de um organismo Células e material extracelular Tecidos Macroscopia e microscopia
Técnicas histológicas Profa Simone Marcuzzo Histologia Estudo da estrutura e inter-relação dos constituintes teciduais de um organismo Células e material extracelular Tecidos Macroscopia e microscopia
QUÍMICA FARMACÊUTICA II
 2016-2017 QUÍMICA FARMACÊUTICA II MÓDULO DE QUÍMICA FARMACÊUTICA INORGÂNICA SÉRIE LABORATORIAL Aulas 2 e 3 Monografia KBr (Farmacopeia Portuguesa 9) PLANO DAS AULAS LABORATORIAIS 2 e 3 (Q.F. Inorgânica):
2016-2017 QUÍMICA FARMACÊUTICA II MÓDULO DE QUÍMICA FARMACÊUTICA INORGÂNICA SÉRIE LABORATORIAL Aulas 2 e 3 Monografia KBr (Farmacopeia Portuguesa 9) PLANO DAS AULAS LABORATORIAIS 2 e 3 (Q.F. Inorgânica):
Protocolo de extração de DNA de tecido vegetal: (Doyle & Doyle, 1987)
 Protocolo de extração de DNA de tecido vegetal: (Doyle & Doyle, 1987) PROCEDIMENTOS 1. Preparo do Material» Primeiro verifique se todas as soluções estão preparadas;» Ligue o banho-maria a 65ºC;» Prepare
Protocolo de extração de DNA de tecido vegetal: (Doyle & Doyle, 1987) PROCEDIMENTOS 1. Preparo do Material» Primeiro verifique se todas as soluções estão preparadas;» Ligue o banho-maria a 65ºC;» Prepare
Thermo. Shandon Cytospin Collection Fluid ELECTRON CORPORATION. Rev. 3, 09/03 P/N
 Shandon Cytospin Collection Fluid Thermo ELECTRON CORPORATION Anatomical Pathology USA Clinical Diagnostics 171 Industry Drive Pittsburgh, PA 15275, USA Tel: 1-800-547-7429 +1 412 788 1133 Fax: +1 412
Shandon Cytospin Collection Fluid Thermo ELECTRON CORPORATION Anatomical Pathology USA Clinical Diagnostics 171 Industry Drive Pittsburgh, PA 15275, USA Tel: 1-800-547-7429 +1 412 788 1133 Fax: +1 412
Prática de Laboratório 1
 Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
Prática de Laboratório 1 12 pontos Preparação do ácido 2-iodobenzóico [Tempo aprox: 1 hr] Essa prática de laboratório envolve a preparação do acido 2-iodobenzóico a partir do acido 2-aminobenzóico. O procedimento
Catálogo Insumo
 Catálogo - 2016 Insumo w w w. o p a t o l o g i s t a. c o m. b r Índice: Álcool / Xilol / Formol Alcoômetro Bandeja para microscopia Berço Bomba de líquidos Caixa arquivo Caneta marcadora Cassete plástico
Catálogo - 2016 Insumo w w w. o p a t o l o g i s t a. c o m. b r Índice: Álcool / Xilol / Formol Alcoômetro Bandeja para microscopia Berço Bomba de líquidos Caixa arquivo Caneta marcadora Cassete plástico
Métodos Cito-Histoquímicos
 Ciências Biomédicas Laboratoriais Métodos Cito-Histoquímicos Aula 3 2016/17 João Furtado jffurtado@ualg.pt Gab. 2.06 na ESSUAlg Sumário Hematoxilina Introdução Tipos de hematoxilina (alumínica, férrica
Ciências Biomédicas Laboratoriais Métodos Cito-Histoquímicos Aula 3 2016/17 João Furtado jffurtado@ualg.pt Gab. 2.06 na ESSUAlg Sumário Hematoxilina Introdução Tipos de hematoxilina (alumínica, férrica
Experimento 6. Célula animal mucosa bucal. (40x) Descrições. Objetivos. Formato: Coloração dos componentes celulares: Número de células por campo:
 Experimento 6 Preparar corretamente, usando corantes adequados, as lâminas de esfregaço da mucosa bucal. Identificar ao microscópio óptico (M.O.) células da mucosa bucal previamente coradas e reconhecer
Experimento 6 Preparar corretamente, usando corantes adequados, as lâminas de esfregaço da mucosa bucal. Identificar ao microscópio óptico (M.O.) células da mucosa bucal previamente coradas e reconhecer
11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo:
 ASSISTENTE DE LABORATÓRIO 4 CONHECIMENTOS ESPECÍFICOS QUESTÕES DE 11 A 25 11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo: a) Acelerar a
ASSISTENTE DE LABORATÓRIO 4 CONHECIMENTOS ESPECÍFICOS QUESTÕES DE 11 A 25 11. O uso de pérolas ou pedaços de vidro ou ainda de cerâmica porosa no aquecimento de soluções tem por objetivo: a) Acelerar a
MANUAL DE ORIENTAÇÃO COLETA, ACONDICIONAMENTO E PRESERVAÇÃO DE AMOSTRAS BIOLÓGICAS
 MANUAL DE ORIENTAÇÃO COLETA, ACONDICIONAMENTO E PRESERVAÇÃO DE AMOSTRAS BIOLÓGICAS 2018 Versão 01 Código: REC.MAN.01 Data emissão: 10/05/2016 Data versão: 27/03/2018 Versão: 01 Pág.: 2/5 SUMÁRIO 1. OBJETIVO...
MANUAL DE ORIENTAÇÃO COLETA, ACONDICIONAMENTO E PRESERVAÇÃO DE AMOSTRAS BIOLÓGICAS 2018 Versão 01 Código: REC.MAN.01 Data emissão: 10/05/2016 Data versão: 27/03/2018 Versão: 01 Pág.: 2/5 SUMÁRIO 1. OBJETIVO...
ROTINA DO LABORATÓRIO DE PATOLOGIA DA FOA / UNESP
 ROTINA DO LABORATÓRIO DE PATOLOGIA DA FOA / UNESP MACROSCOPIA E INCLUSÃO EM PARAFINA MICROTOMIA E COLORAÇÃO MICROSCOPIA (HISTOPATOLOGIA) CITOLOGIA ESFOLIATIVA 01- ROTINA DO LABORATÓRIO DE PATOLOGIA DA
ROTINA DO LABORATÓRIO DE PATOLOGIA DA FOA / UNESP MACROSCOPIA E INCLUSÃO EM PARAFINA MICROTOMIA E COLORAÇÃO MICROSCOPIA (HISTOPATOLOGIA) CITOLOGIA ESFOLIATIVA 01- ROTINA DO LABORATÓRIO DE PATOLOGIA DA
DETECÇÃO QUALITATIVA DE ARGILAS PREJUDICIAIS DO GRUPO ESMECTITA EM AGREGADOS UTILIZANDO AZUL DE METILENO
 DETECÇÃO QUALITATIVA DE ARGILAS PREJUDICIAIS DO GRUPO ESMECTITA EM AGREGADOS UTILIZANDO AZUL DE METILENO C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2015 DESIGNAÇÃO - ARTERIS T- 330-07 (2011)¹
DETECÇÃO QUALITATIVA DE ARGILAS PREJUDICIAIS DO GRUPO ESMECTITA EM AGREGADOS UTILIZANDO AZUL DE METILENO C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2015 DESIGNAÇÃO - ARTERIS T- 330-07 (2011)¹
PS 31 PROFISSIONAL ASSISTENCIAL III (Profissional de Histologia) Pág. 1
 Pág. 1 HOSPITAL DE CLÍNICAS DE PORTO ALEGRE EDITAL N.º 02/2012 DE PROCESSOS SELETIVOS GABARITO APÓS RECURSOS PROCESSO SELETIVO 31 PROFISSIONAL ASSISTENCIAL III (Profissional de Histologia) 01. D 11. ANULADA
Pág. 1 HOSPITAL DE CLÍNICAS DE PORTO ALEGRE EDITAL N.º 02/2012 DE PROCESSOS SELETIVOS GABARITO APÓS RECURSOS PROCESSO SELETIVO 31 PROFISSIONAL ASSISTENCIAL III (Profissional de Histologia) 01. D 11. ANULADA
MICROSCOPIA E O ESTUDO DA CÉLULA
 Citologia e Histologia MICROSCOPIA E O ESTUDO DA CÉLULA PROFESSORA: Fernanda Guimarães E-MAIL: guimaraes.biologia@gmail.com NÍVEIS DE ORGANIZAÇÃO BIOLÓGICA Estruturas microscópicas Invisíveis a olho nu
Citologia e Histologia MICROSCOPIA E O ESTUDO DA CÉLULA PROFESSORA: Fernanda Guimarães E-MAIL: guimaraes.biologia@gmail.com NÍVEIS DE ORGANIZAÇÃO BIOLÓGICA Estruturas microscópicas Invisíveis a olho nu
Ficha de protocolo do QIAsymphony SP
 Fevereiro de 2017 Ficha de protocolo do QIAsymphony SP circdna_2000_dsp_v1 e circdna_4000_dsp_v1 Este documento é a ficha de protocolo do QIAsymphony circdna_2000_dsp_v1 e circdna_4000_dsp_v1, versão 1,
Fevereiro de 2017 Ficha de protocolo do QIAsymphony SP circdna_2000_dsp_v1 e circdna_4000_dsp_v1 Este documento é a ficha de protocolo do QIAsymphony circdna_2000_dsp_v1 e circdna_4000_dsp_v1, versão 1,
Plásticos para Cultivo Celular
 Plásticos para Cultivo Celular Linha Cultivo de Células e Tecidos Fabricada em poliestireno cristal virgem (GPPS), esta linha oferece produtos com alta transparência para ótima visualização e sem presença
Plásticos para Cultivo Celular Linha Cultivo de Células e Tecidos Fabricada em poliestireno cristal virgem (GPPS), esta linha oferece produtos com alta transparência para ótima visualização e sem presença
MICROBIOLOGIA. Observação de bactérias - colorações
 MICROBIOLOGIA Observação de bactérias - colorações Como o índice de refração do protoplasma bacteriano difere muito pouco do meio circundante, é difícil o exame direto de preparações não coradas, a não
MICROBIOLOGIA Observação de bactérias - colorações Como o índice de refração do protoplasma bacteriano difere muito pouco do meio circundante, é difícil o exame direto de preparações não coradas, a não
Associação Brasileira de Química XI Maratona Cearense de Química a Fase 1 o Ano 22/08/08. Experiência 1
 Associação Brasileira de Química XI Maratona Cearense de Química 2008 2 a Fase 1 o Ano Experiência 1 8 tubos de ensaio. Solução de Ba(OH) 2. Pipeta graduada. 4 conjuntos de mangueiras e rolhas. 1 estante
Associação Brasileira de Química XI Maratona Cearense de Química 2008 2 a Fase 1 o Ano Experiência 1 8 tubos de ensaio. Solução de Ba(OH) 2. Pipeta graduada. 4 conjuntos de mangueiras e rolhas. 1 estante
1 Extração Líquido-Líquido
 Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Ministério da Educação Universidade Tecnológica Federal do Paraná Campus de Curitiba Departamento de Química _ Extração Líquido-Líquido Disciplina: Práticas de Química Orgânica Materiais e Reagentes Mesa
Citofunil e Megafunil : estudo comparativo em líquidos de cavidades serosas
 Oinvestigação Citofunil e Megafunil : estudo comparativo em líquidos de cavidades serosas 1 1 1 1 1 Carla Pinheiro ; Rúben Roque ; Andreia Adriano ; Maria José Praça ; Saudade André 1 - Laboratório de
Oinvestigação Citofunil e Megafunil : estudo comparativo em líquidos de cavidades serosas 1 1 1 1 1 Carla Pinheiro ; Rúben Roque ; Andreia Adriano ; Maria José Praça ; Saudade André 1 - Laboratório de
Microbilogia de Alimentos I - Curso de Engenharia de Alimentos Profª Valéria Ribeiro Maitan
 15 PONTIFÍCIA UNIVERSIDADE CATÓLICA DE GOIÁS PUC Goiás ESCOLA DE ENGENHARIA CURSO DE ENGENHARIA DE ALIMENTOS Aula nº 3 e 4- Preparações Microscópicas Fixadas e Coradas (coloração simples e Diferencial)
15 PONTIFÍCIA UNIVERSIDADE CATÓLICA DE GOIÁS PUC Goiás ESCOLA DE ENGENHARIA CURSO DE ENGENHARIA DE ALIMENTOS Aula nº 3 e 4- Preparações Microscópicas Fixadas e Coradas (coloração simples e Diferencial)
TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED
 TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED I. COMENTÁRIOS A técnica parasitológica de TF-Test Conventional, utilizando o kit comercial TF- Test, foi avaliada para o
TÉCNICAS PARASITOLÓGICAS DE TF-TEST (THREE FECAL TEST) CONVENTIONAL E MODIFIED I. COMENTÁRIOS A técnica parasitológica de TF-Test Conventional, utilizando o kit comercial TF- Test, foi avaliada para o
Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio.
 ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
ATIVIDADE 2 - CÁLCULO DE CONCENTRAÇÃO Exercício 1. Calcule a concentração dos reagentes listados abaixo em mol L -1 Tabela 1. Propriedades de ácidos inorgânicos e hidróxido de amônio. Exercício 2. Calcule
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA
 PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
PORCENTAGEM DE CIMENTO POR TITULAÇÃO QUÍMICA C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 008 09/2014 T 008 pg 1 - Centro de Desenvolvimento Tecnológico ARTERIS
Procedimento Operacional Padrão - POP
 Página 1 de 10 IMT-POP-BB-0 Biobanco Procedimento Operacional Padrão para: Extração de DNA de sangue total POP: V. 1.0 Nome: Extração de DNA em sangue total Efetiva: dezembro, 22 autora: Erika Regina Manuli
Página 1 de 10 IMT-POP-BB-0 Biobanco Procedimento Operacional Padrão para: Extração de DNA de sangue total POP: V. 1.0 Nome: Extração de DNA em sangue total Efetiva: dezembro, 22 autora: Erika Regina Manuli
FACULDADE DE CIÊNCIAS DA SAÚDE DE BARRETOS DR. PAULO PRATA
 FACULDADE DE CIÊNCIAS DA SAÚDE DE BARRETOS DR. PAULO PRATA Avenida Loja Maçônica Renovadora 68, nº 100 - Aeroporto - Barretos - São Paulo Telefone: (17) 3321-3060 www.facisb.edu.br CURSO DE MEDICINA ATIVIDADE
FACULDADE DE CIÊNCIAS DA SAÚDE DE BARRETOS DR. PAULO PRATA Avenida Loja Maçônica Renovadora 68, nº 100 - Aeroporto - Barretos - São Paulo Telefone: (17) 3321-3060 www.facisb.edu.br CURSO DE MEDICINA ATIVIDADE
Introdução a Histologia. Profa. Dra. Constance Oliver Profa. Dra. Maria Célia Jamur
 Introdução a Histologia Profa. Dra. Constance Oliver Profa. Dra. Maria Célia Jamur O QUE É HISTOLOGIA? A histologia é o estudo da estrutura do material biológico e das maneiras como os componentes individuais
Introdução a Histologia Profa. Dra. Constance Oliver Profa. Dra. Maria Célia Jamur O QUE É HISTOLOGIA? A histologia é o estudo da estrutura do material biológico e das maneiras como os componentes individuais
Atividade prática - Estudando a água Parte 11
 Atividade prática - Estudando a água Parte 11 9º ano do Ensino Fundamental e 1º ano do Ensino Médio Objetivo Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são possíveis
Atividade prática - Estudando a água Parte 11 9º ano do Ensino Fundamental e 1º ano do Ensino Médio Objetivo Diversos experimentos, usando principalmente água e materiais de fácil obtenção, são possíveis
PROF. ROMMEL BARRETO Mestre em Morfologia (UFRJ)
 Microscopia PROF. ROMMEL BARRETO Mestre em Morfologia (UFRJ) Preparação das lâminas histológicas Remoção dos fragmentos de órgãos Fixação Desidratação (Álcool etílico) Concentração crescente (70%, 80%,
Microscopia PROF. ROMMEL BARRETO Mestre em Morfologia (UFRJ) Preparação das lâminas histológicas Remoção dos fragmentos de órgãos Fixação Desidratação (Álcool etílico) Concentração crescente (70%, 80%,
Colorações de Bactérias: Coloração Simples e Coloração Diferencial(Coloração de Gram)
 Escola Secundária com 3º Ciclo D.Manuel I Beja Acção de Formação ORGANIZAÇÃO E GESTÃO DOS LABORATÓRIOS ESCOLARES Guião de actividade laboratorial versão aluno Colorações de Bactérias: Coloração Simples
Escola Secundária com 3º Ciclo D.Manuel I Beja Acção de Formação ORGANIZAÇÃO E GESTÃO DOS LABORATÓRIOS ESCOLARES Guião de actividade laboratorial versão aluno Colorações de Bactérias: Coloração Simples
Produtos para Cultivo Celular
 Produtos para Cultivo Celular cultivo celular Através da técnica de cultivo celular, células animais ou vegetais são mantidas vivas em crescimento fora do seu tecido original, em condições controladas.
Produtos para Cultivo Celular cultivo celular Através da técnica de cultivo celular, células animais ou vegetais são mantidas vivas em crescimento fora do seu tecido original, em condições controladas.
EXPERIÊNCIA 5 SOLUBILIDADE
 EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
EXPERIÊNCIA 5 SOLUBILIDADE 1. OBJETIVOS No final desta experiência, espera-se que o aluno seja capaz de: Identificar algumas variáveis que afetam a solubilidade. Utilizar técnicas simples de extração,
Experimento 1: Efeito do íon comum equilíbrio de ionização da amônia
 Experimento Deslocamento de equilíbrios químicos (Princípio de Le Chatelier) Objetivo: Estudar e compreender alguns fatores que deslocam equilíbrios químicos. Experimento 1: Efeito do íon comum equilíbrio
Experimento Deslocamento de equilíbrios químicos (Princípio de Le Chatelier) Objetivo: Estudar e compreender alguns fatores que deslocam equilíbrios químicos. Experimento 1: Efeito do íon comum equilíbrio
DIAGNÓSTICO CITOPATOLÓGICO EM MEDICINA VETERINÁRIA Parte II
 DIAGNÓSTICO CITOPATOLÓGICO EM MEDICINA VETERINÁRIA Parte II PREPARAÇÃO DE LÂMINAS O objetivo da preparação da lâmina para a avaliação citológica é alcançar uma monocamada de células bem preservadas. Isto
DIAGNÓSTICO CITOPATOLÓGICO EM MEDICINA VETERINÁRIA Parte II PREPARAÇÃO DE LÂMINAS O objetivo da preparação da lâmina para a avaliação citológica é alcançar uma monocamada de células bem preservadas. Isto
ata Emissão:10/05/2016 Data Aprovação: 11/05/2017 Página 01 de 05
 ata Emissão:10/05/2016 Data Aprovação: 11/05/2017 Página 01 de 05 OBJETIVO Padronizar e estabelecer regras e recomendações quanto à coleta, acondicionamento, transporte e rejeição das amostras biológica
ata Emissão:10/05/2016 Data Aprovação: 11/05/2017 Página 01 de 05 OBJETIVO Padronizar e estabelecer regras e recomendações quanto à coleta, acondicionamento, transporte e rejeição das amostras biológica
ANÁLISE GRANULOMÉTRICA DE AGREGADOS PASSANTE NA PENEIRA DE 75 M (Nº200), POR LAVAGEM
 ANÁLISE GRANULOMÉTRICA DE AGREGADOS PASSANTE NA PENEIRA DE 75 M (Nº200), POR LAVAGEM C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 11-05 (2013)¹ 09/2014 T 11 pg1
ANÁLISE GRANULOMÉTRICA DE AGREGADOS PASSANTE NA PENEIRA DE 75 M (Nº200), POR LAVAGEM C D T - CENTRO DE DESENVOLVIMENTO TECNOLÓGICO Setembro de 2014 DESIGNAÇÃO - ARTERIS T- 11-05 (2013)¹ 09/2014 T 11 pg1
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata)
 Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações.
 EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
EXPERIMENTO 2 Preparação e Padronização de Soluções OBJETIVOS Rever os conceitos de concentração de soluções. Aprender a preparar soluções aquosas, realizar diluições e determinar suas concentrações. Exercitar
Cursos de Enfermagem e Obstetrícia, Medicina e Nutrição. Disciplina Mecanismos Básicos de Saúde e Doença MCW 240. Aula Prática 3 Módulo Microbiologia
 Cursos de Enfermagem e Obstetrícia, Medicina e Nutrição Disciplina Mecanismos Básicos de Saúde e Doença MCW 240 Aula Prática 3 Módulo Microbiologia Teste da eficácia de agentes físicos e químicos sobre
Cursos de Enfermagem e Obstetrícia, Medicina e Nutrição Disciplina Mecanismos Básicos de Saúde e Doença MCW 240 Aula Prática 3 Módulo Microbiologia Teste da eficácia de agentes físicos e químicos sobre
Departamento de Anatomia Patológica Laboratório de Multiusuário em Pesquisa UNIFESP
 VANTAGENS DO USO DA AGAROSE NAS TÉCNICAS DE PROCESSAMENTO DE CELL BLOCK NA CITOLOGIA ONCÓTICA DE LÍQUIDOS Joaquim Soares de Almeida. Departamento de Anatomia Patológica Laboratório de Multiusuário em Pesquisa
VANTAGENS DO USO DA AGAROSE NAS TÉCNICAS DE PROCESSAMENTO DE CELL BLOCK NA CITOLOGIA ONCÓTICA DE LÍQUIDOS Joaquim Soares de Almeida. Departamento de Anatomia Patológica Laboratório de Multiusuário em Pesquisa
Laboratório de Citogenética Molecular de Plantas Departamento de Genética Escola Superior de Agricultura Luiz de Queiroz UNIVERSIDADE DE SÃO PAULO
 Metodologia: COLORAÇÃO PELO MÉTODO DE FEULGEN Adaptado por: Mondin, M e Aguiar-Perecin MLR 1.) Retirar o material (raízes conservadas em álcool 70%) da geladeira com antecedência, deixando atingir a temperatura
Metodologia: COLORAÇÃO PELO MÉTODO DE FEULGEN Adaptado por: Mondin, M e Aguiar-Perecin MLR 1.) Retirar o material (raízes conservadas em álcool 70%) da geladeira com antecedência, deixando atingir a temperatura
Produtos para Cultivo Celular
 Produtos para Cultivo Celular CULTIVO CELULAR Através da técnica de cultivo celular, células animais ou vegetais são mantidas vivas em crescimento fora do seu tecido original, em condições controladas.
Produtos para Cultivo Celular CULTIVO CELULAR Através da técnica de cultivo celular, células animais ou vegetais são mantidas vivas em crescimento fora do seu tecido original, em condições controladas.
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata)
 Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
Hibridação in situ fluorescente em corte histológico (Câncer de Próstata) FISH em tecido incluído em parafina: Four Colour PTEN Deletion Probe O protocolo de FISH descrito abaixo é recomendado para cortes
Atividades Presenciais caderno do aluno aula 1
 1 Atividades Presenciais caderno do aluno aula 1 HISTÓRIA DA VIDA NA TERRA E DISTRIBUIÇÃO ATUAL DA VIDA NO PLANETA Origem, evolução e estrutura das células Avaliação: Nota de 0 a 10. Atividade 01 Objetivo:
1 Atividades Presenciais caderno do aluno aula 1 HISTÓRIA DA VIDA NA TERRA E DISTRIBUIÇÃO ATUAL DA VIDA NO PLANETA Origem, evolução e estrutura das células Avaliação: Nota de 0 a 10. Atividade 01 Objetivo:
EXTRAÇÃO DE DNA DE SANGUE (LEUCÓCITOS)
 EXTRAÇÃO DE DNA DE SANGUE (LEUCÓCITOS) A) Obtenção de Leucócitos 1. Coletar 5mL de sangue em tubos contendo EDTA potássio (50uL de EDTA (k 3) a 15%). O EDTA é uma substância anticoagulante. Existem outras
EXTRAÇÃO DE DNA DE SANGUE (LEUCÓCITOS) A) Obtenção de Leucócitos 1. Coletar 5mL de sangue em tubos contendo EDTA potássio (50uL de EDTA (k 3) a 15%). O EDTA é uma substância anticoagulante. Existem outras
MATERIAIS PARA FUNDIÇÃO - DETERMINAÇÃO DO FATOR DA SOLUÇÃO DE AZUL DE METILENO POR TITULAÇÃO COM SOLUÇÃO DE CLORETO TITANOSO (TiCl 3 )
 Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Padronização Folha : 1 de 6 SUMÁRIO 1_ Objetivo 2_ Princípio do método 3_ Aparelhagem 4_ Procedimento 1_ OBJETIVO 1.1_ Esta recomendação prescreve o método de fatoração da solução de azul de metileno utilizada
Cargo: D-43 - Tecnólogo Laboratório Meio ambiente
 da Prova Prática QUESTÃO 1: Cargo: D-43 - Tecnólogo Laboratório Meio ambiente A titulometria volumétrica envolve a medida de volume de uma solução de concentração conhecida, necessária para reagir essencial
da Prova Prática QUESTÃO 1: Cargo: D-43 - Tecnólogo Laboratório Meio ambiente A titulometria volumétrica envolve a medida de volume de uma solução de concentração conhecida, necessária para reagir essencial
Técnica Básicas para Análises de Células e Tecidos
 Técnica Básicas para Análises de Células e Tecidos Visão panorâmica da célula Algumas grandezas... 1km 1.000m 1m 100 cm 1cm 10 mm 1mm 1000 µm 1 µm 1000 nm 1Å (Angstron Angstron) 10 10-10 m Visão panorâmica
Técnica Básicas para Análises de Células e Tecidos Visão panorâmica da célula Algumas grandezas... 1km 1.000m 1m 100 cm 1cm 10 mm 1mm 1000 µm 1 µm 1000 nm 1Å (Angstron Angstron) 10 10-10 m Visão panorâmica
Procedimento Operacional Padrão - POP
 Página 1 de 10 Biobanco Procedimento Operacional Padrão para: Extração de RNA total de sangue POP: V. 1.0 Nome: Extração de RNA total de sangue Efetiva: dezembro, 22 autora: Erika Regina Manuli Aprovação
Página 1 de 10 Biobanco Procedimento Operacional Padrão para: Extração de RNA total de sangue POP: V. 1.0 Nome: Extração de RNA total de sangue Efetiva: dezembro, 22 autora: Erika Regina Manuli Aprovação
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 )
 SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
SÍNTESE DO 1-BROMOBUTANO Procedimento experimental a microescala (adaptado de Williamson, Minard & Masters 1 ) Introdução O 1-bromobutano é um halogeneto alquílico primário (alquilo primário) e, por isso,
Primeira aula. Apresentação da Disciplina. Características do sangue. Coleta de sangue. Extensão sanguínea e coloração. Hemograma
 Primeira aula Apresentação da Disciplina Características do sangue Coleta de sangue Extensão sanguínea e coloração Hemograma Profa Elvira Shinohara Tecido líquido e renovável Plasma Células sanguíneas
Primeira aula Apresentação da Disciplina Características do sangue Coleta de sangue Extensão sanguínea e coloração Hemograma Profa Elvira Shinohara Tecido líquido e renovável Plasma Células sanguíneas
Citologia de líquidos orgânicos, punções aspirativas, escarro, lavados cavitários, esfregaços cérvico-vaginais, etc. Exames de peças cirúrgicas de
 Citologia de líquidos orgânicos, punções aspirativas, escarro, lavados cavitários, esfregaços cérvico-vaginais, etc. Exames de peças cirúrgicas de variada complexidade e de material de biópsia Consultas
Citologia de líquidos orgânicos, punções aspirativas, escarro, lavados cavitários, esfregaços cérvico-vaginais, etc. Exames de peças cirúrgicas de variada complexidade e de material de biópsia Consultas
TÍTULO: ANÁLISE TITRIMÉTRICA (Volumétrica)
 Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
Componente Curricular: Química dos Alimentos Prof. Barbosa e Prof. Daniel 4º Módulo de Química Procedimento de Prática Experimental Competências: Identificar as propriedades dos alimentos. Identificar
MICROBIOLOGIA - AULAS PRÁTICAS
 MICROBIOLOGIA - AULAS PRÁTICAS Execução e observação microscópica de preparações coradas Objectivos: 1 - Familiarização com pincípios básicos de microscopia de campo claro. 2 Utilização de técnicas de
MICROBIOLOGIA - AULAS PRÁTICAS Execução e observação microscópica de preparações coradas Objectivos: 1 - Familiarização com pincípios básicos de microscopia de campo claro. 2 Utilização de técnicas de
Cultivo de Células Animais
 Técnico em Biotecnologia Módulo IV Cultivo de Células Animais Aula 3 Esterilização de materiais para a Cultura de Células Prof. Leandro Parussolo Trabalhar com cultura de células Ambiente Estéril Cells
Técnico em Biotecnologia Módulo IV Cultivo de Células Animais Aula 3 Esterilização de materiais para a Cultura de Células Prof. Leandro Parussolo Trabalhar com cultura de células Ambiente Estéril Cells
EXPERIÊNCIA 8 TITULAÇÃO ÁCIDO-BASE
 EXPERIÊNCIA 8 TITULAÇÃO ÁCIDO-BASE 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: - Determinar a concentração de uma base por titulação. - Determinar a molécula-grama (Mol) de um
EXPERIÊNCIA 8 TITULAÇÃO ÁCIDO-BASE 1. OBJETIVOS No final desta experiência o aluno deverá ser capaz de: - Determinar a concentração de uma base por titulação. - Determinar a molécula-grama (Mol) de um
Introdução à Histologia
 Introdução à Histologia Prof. a Dr a. Sara Tatiana Moreira UTFPR Campus Santa Helena 1 Histórico Bichat (1771-1802) Pioneiro da histologia e pai da histologia moderna Sem o uso de microscópio, examinou
Introdução à Histologia Prof. a Dr a. Sara Tatiana Moreira UTFPR Campus Santa Helena 1 Histórico Bichat (1771-1802) Pioneiro da histologia e pai da histologia moderna Sem o uso de microscópio, examinou
Ficha de trabalho. Microscópio
 Ficha de trabalho Microscópio 1. Observa com atenção a imagem 1. 1.1. Faz a legenda da figura 1-2- 3-4- 5-7- 8-9- 10-11- 12- Regras de utilização do microscópio 1º- Abre a caixa e retira, cuidadosamente,
Ficha de trabalho Microscópio 1. Observa com atenção a imagem 1. 1.1. Faz a legenda da figura 1-2- 3-4- 5-7- 8-9- 10-11- 12- Regras de utilização do microscópio 1º- Abre a caixa e retira, cuidadosamente,
Associação Brasileira de Química XIII Maratona Cearense de Química a Fase 1 o Ano 18/08/10. Experiência
 2 a Fase 1 o Ano 18/08/10 Material e Reagentes: Experiência Açúcar (sacarose) Bicarbonato de sódio Álcool etílico Recipiente com graduação (proveta ou seringa) Almofariz com pistilo Fósforo ou isqueiro
2 a Fase 1 o Ano 18/08/10 Material e Reagentes: Experiência Açúcar (sacarose) Bicarbonato de sódio Álcool etílico Recipiente com graduação (proveta ou seringa) Almofariz com pistilo Fósforo ou isqueiro
HISTOLOGIA E SEUS MÉTODOS DE ESTUDO
 HISTOLOGIA E SEUS MÉTODOS DE ESTUDO Histologia Estudo dos tecidos do corpo e como eles se organizam para constituir órgãos. Tecidos fundamentais tecido epitelial, tecido conjuntivo, tecido muscular e tecido
HISTOLOGIA E SEUS MÉTODOS DE ESTUDO Histologia Estudo dos tecidos do corpo e como eles se organizam para constituir órgãos. Tecidos fundamentais tecido epitelial, tecido conjuntivo, tecido muscular e tecido
20/8/2012. Raduan. Raduan
 MÉTODOS DE ESTUDO: CÉLULAS E TECIDOS 1 2 3 Etapas na preparação de amostras de tecidos para estudo histológico 4 Fixação Finalidades: Evitar a autólise; Impedir a atividade e proliferação de bactérias;
MÉTODOS DE ESTUDO: CÉLULAS E TECIDOS 1 2 3 Etapas na preparação de amostras de tecidos para estudo histológico 4 Fixação Finalidades: Evitar a autólise; Impedir a atividade e proliferação de bactérias;
Técnicas de Trabalho com Material Volumétrico
 Universidade Federal de Goiás Instituto de Química Curso Experimental de Transformações Químicas 2010 Prof. Dr. Anselmo (adaptado, Agustina) Técnicas de Trabalho com Material Volumétrico 1 Objetivo Nesta
Universidade Federal de Goiás Instituto de Química Curso Experimental de Transformações Químicas 2010 Prof. Dr. Anselmo (adaptado, Agustina) Técnicas de Trabalho com Material Volumétrico 1 Objetivo Nesta
Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011
 1 Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011 1. Introdução As parasitoses intestinais representam sério problema de saúde pública, em
1 Estudo da estabilidade do sistema Paratest usado para diagnóstico das parasitoses intestinais Rev.00 10/01/2011 1. Introdução As parasitoses intestinais representam sério problema de saúde pública, em
MF-431.R-1 - MÉTODO TURBIDIMÉTRICO PARA DETERMINAÇÃO DE SULFATO
 MF-431.R-1 - MÉTODO TURBIDIMÉTRICO PARA DETERMINAÇÃO DE SULFATO Notas: Revisão aprovada pela Deliberação CECA nº 0102, de 04 de setembro de 1980. Publicada no DOERJ de 18 de setembro de 1980. 1. OBJETIVO
MF-431.R-1 - MÉTODO TURBIDIMÉTRICO PARA DETERMINAÇÃO DE SULFATO Notas: Revisão aprovada pela Deliberação CECA nº 0102, de 04 de setembro de 1980. Publicada no DOERJ de 18 de setembro de 1980. 1. OBJETIVO
Métodos Cito-Histoquímicos
 Ciências Biomédicas Laboratoriais Métodos Cito-Histoquímicos Aula 6 2016/17 João Furtado jffurtado@ualg.pt Gab. 2.06 na ESSUAlg Sumário Métodos de Evidenciar Lípidos Introdução Os Métodos Corantes Lipossolúveis
Ciências Biomédicas Laboratoriais Métodos Cito-Histoquímicos Aula 6 2016/17 João Furtado jffurtado@ualg.pt Gab. 2.06 na ESSUAlg Sumário Métodos de Evidenciar Lípidos Introdução Os Métodos Corantes Lipossolúveis
EXAME PRÁTICO QUÍMICA ORGÂNICA QUÍMICA VERDE
 EXAME PRÁTICO QUÍMICA ORGÂNICA QUÍMICA VERDE O objetivo da Química verde é desenvolver procedimentos químicos que não provoquem a poluição do meio ambiente, utilizando as matérias primas de uma forma eficiente
EXAME PRÁTICO QUÍMICA ORGÂNICA QUÍMICA VERDE O objetivo da Química verde é desenvolver procedimentos químicos que não provoquem a poluição do meio ambiente, utilizando as matérias primas de uma forma eficiente
Processamento Histológico
 Universidade Estadual do Ceará UECE Faculdade de Veterinária FAVET Laboratório de Histologia de Efeitos Causados por Veneno de Serpentes - Histovesp Processamento Histológico Histologia e Embriologia Geral
Universidade Estadual do Ceará UECE Faculdade de Veterinária FAVET Laboratório de Histologia de Efeitos Causados por Veneno de Serpentes - Histovesp Processamento Histológico Histologia e Embriologia Geral
Capítulo COLORAÇÃO DAS GRANULAÇÕES DE SCHÜFFNER
 Capítulo 6 COLORAÇÃO DAS GRANULAÇÕES DE SCHÜFFNER Manual de Diagnóstico Laboratorial da Malária A natureza das granulações de Schüffner é ainda desconhecida. São grânulos de cor rósea surgidos nas hemácias
Capítulo 6 COLORAÇÃO DAS GRANULAÇÕES DE SCHÜFFNER Manual de Diagnóstico Laboratorial da Malária A natureza das granulações de Schüffner é ainda desconhecida. São grânulos de cor rósea surgidos nas hemácias
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS
 CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
CURSO PRÁTICO QUI 328 e 128 SÍNTESE DE COMPOSTOS ORGÂNICOS Síntese I ( p-red) Nitrobenzeno Anilina Acetanilida p-nitro Acetanilida p-nitro Anilina p-red 1- OBTENÇÃO DA ANILINA -Estanho -Àcido clorídrico
Departamento de Zoologia da Universidade de Coimbra
 Departamento de Zoologia da Universidade de Coimbra MICROBIOLOGIA António Verissimo Paula Morais Coloração de Gram Esta técnica permite subdividir as bactérias em dois grandes grupos: as designadas Gram
Departamento de Zoologia da Universidade de Coimbra MICROBIOLOGIA António Verissimo Paula Morais Coloração de Gram Esta técnica permite subdividir as bactérias em dois grandes grupos: as designadas Gram
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA
 Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Experiência 7. PREPARO DE SOLUÇÃO A PARTIR DE SUBSTÂNCIAS SÓLIDAS, LIQUIDAS E DE SOLUÇÃO CONCENTRADA 1. Objetivos Após a realização desta aula experimental, espera-se que o graduando do curso de Química
Experiência nº 8: Titulações Ácido-Base
 Experiência nº 8: Titulações Ácido-Base 1. Questões de estudo - Como determinar com precisão a concentração de uma solução (ácida ou básica)? Explique detalhadamente. - Como determinar experimentalmente
Experiência nº 8: Titulações Ácido-Base 1. Questões de estudo - Como determinar com precisão a concentração de uma solução (ácida ou básica)? Explique detalhadamente. - Como determinar experimentalmente
Preparação do cloreto de t-butila. Carina de Freitas Vellosa Daiane Cristina Romanini
 Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Preparação do cloreto de t-butila Carina de Freitas Vellosa Daiane Cristina Romanini Técnicas e Materiais Utilizados Funil de separação: serve para extrair duas soluções imiscíveis. A fase orgânica pode
Atividade Complementar
 FACULDADE DE CIÊNCIAS DA SAÚDE DE BARRETOS DR. PAULO PRATA Avenida Loja Maçônica Renovadora 68, nº 100 - Aeroporto - Barretos - São Paulo Telefone: (17) 3321-3060 www.facisb.edu.br CURSO DE MEDICINA Atividade
FACULDADE DE CIÊNCIAS DA SAÚDE DE BARRETOS DR. PAULO PRATA Avenida Loja Maçônica Renovadora 68, nº 100 - Aeroporto - Barretos - São Paulo Telefone: (17) 3321-3060 www.facisb.edu.br CURSO DE MEDICINA Atividade
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR
 EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
EXTRAÇÃO DO ÓLEO DE LARANJA A PARTIR DAS CASCAS DE LARANJA DESTILAÇÃO POR ARRASTAMENTO DE VAPOR Procedimento experimental adaptado de J. H. Beatty 1 Procedimento experimental Figura 1. Esquema resumo do
44º Congresso Brasileiro de Análise Clínicas. Centro de Convenções de João Pessoa, PB - 11 a 14 de junho de 2017 WORKSHOP PNCQ
 44º Congresso Brasileiro de Análise Clínicas Centro de Convenções de João Pessoa, PB - 11 a 14 de junho de 2017 WORKSHOP PNCQ CONTROLE EXTERNO EM ROBSON FERREIRA FERRAZ SANTOS FARMACÊUTICO BIOQUÍMICO GRADUADO
44º Congresso Brasileiro de Análise Clínicas Centro de Convenções de João Pessoa, PB - 11 a 14 de junho de 2017 WORKSHOP PNCQ CONTROLE EXTERNO EM ROBSON FERREIRA FERRAZ SANTOS FARMACÊUTICO BIOQUÍMICO GRADUADO
Figura 1: Ilustração do processo de dissolução do NaCl em água.
 Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
Solubilidade 1. Introdução Na maioria das reações químicas, os reagentes e produtos são usados e obtidos na forma de misturas homogêneas, chamadas de solução. Uma solução contém uma quantidade relativamente
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS
 PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
PRÁTICA N o. 01 SOLUBILIDADE DE COMPOSTOS ORGÂNICOS OBJETIVOS: Esta prática tem como objetivo a determinação da solubilidade de compostos orgânicos através de um estudo sequencial com solventes situando
72175 Material Área de crescimento (cm²) Volume (ml) Tipo de tampa Superfície de Cultura Estéril Embalagem
 CULTURA CELULAR frascos de cultura celular Frascos de cultura celular ergonomicamente desenvolvidos para fácil manuseio e mínima contaminação durante a cultura celular. O gargalo curto e largo permite
CULTURA CELULAR frascos de cultura celular Frascos de cultura celular ergonomicamente desenvolvidos para fácil manuseio e mínima contaminação durante a cultura celular. O gargalo curto e largo permite
Passo a passo para a coleta do Teste do Pezinho.
 Passo a passo para a coleta do Teste do Pezinho. A coleta de amostras para a triagem neonatal requer cuidados especiais para que se possa obter os resultados desejados. Todas as atividades envolvidas direta
Passo a passo para a coleta do Teste do Pezinho. A coleta de amostras para a triagem neonatal requer cuidados especiais para que se possa obter os resultados desejados. Todas as atividades envolvidas direta
AULA PRÁTICA 3-02/06/2015. Roteiro de aula prática. Infecção de macrófagos por Leishmania (Leishmania) amazonensis
 AULA PRÁTICA 3-02/06/2015 Roteiro de aula prática Infecção de macrófagos por Leishmania (Leishmania) amazonensis Macrófagos previamente plaqueados e infectados com formas promastigotas de Leishmania (Leishmania)
AULA PRÁTICA 3-02/06/2015 Roteiro de aula prática Infecção de macrófagos por Leishmania (Leishmania) amazonensis Macrófagos previamente plaqueados e infectados com formas promastigotas de Leishmania (Leishmania)
PRÁTICA 3 GRUPO 13. O objetivo desse procedimento é estudar a hidrólise do ácido bórico e do bórax.
 PRÁTICA 3 GRUPO 13 Departamento de Química Inorgânica, IQ-UFF Responsável: Prof. Fabio da Silva Miranda Revisado: 04/05/2017 1. Introdução O presente procedimento experimental pretende abordar alguns aspectos
PRÁTICA 3 GRUPO 13 Departamento de Química Inorgânica, IQ-UFF Responsável: Prof. Fabio da Silva Miranda Revisado: 04/05/2017 1. Introdução O presente procedimento experimental pretende abordar alguns aspectos
Experiência 02 - SOLUBILIDADE SOLUBILIDADE
 1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
1. Objetivos SOLUBILIDADE No final dessa experiência, o aluno deverá ser capaz de: - Identificar algumas variáveis que afetam a solubilidade. - Utilizar técnicas simples de separação de misturas. 2. Introdução
3016 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4
 6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
6 Oxidação do ácido ricinoléico a ácido azeláico (a partir de óleo de rícino) com KMnO 4 CH -(CH ) OH (CH ) -COOH KMnO 4 /KOH HOOC-(CH ) -COOH C H 4 O (.) KMnO 4 KOH (.) (6.) C H 6 O 4 (.) Classificação
Hoefer SG15, SG30, SG50 e SG100
 man ual usuário Português Hoefer SG15, SG30, SG50 e SG100 Fabricantes de gradiente mu SG100-IM/Portuguese/Rev.C0/08-12 Conteúdo 1. Introdução: Hoefer SG15, SG30, SG50, e SG100 fabricantes de gradiente...1
man ual usuário Português Hoefer SG15, SG30, SG50 e SG100 Fabricantes de gradiente mu SG100-IM/Portuguese/Rev.C0/08-12 Conteúdo 1. Introdução: Hoefer SG15, SG30, SG50, e SG100 fabricantes de gradiente...1
Procedimentos Técnicos. NOME FUNÇÃO ASSINATURA DATA Dr. Renato de Lacerda Barra Filho Dr. Ivo Fernandes. Gerente da Qualidade Biomédico
 Versão: 01 Pg: 1/5 ELABORADO POR DE ACORDO NOME FUNÇÃO ASSINATURA DATA Dr. Renato de Lacerda Barra Filho Dr. Ivo Fernandes Biomédico 01/10/2009 Gerente da Qualidade Biomédico 20/10/2009 Dr. Jose Carlos
Versão: 01 Pg: 1/5 ELABORADO POR DE ACORDO NOME FUNÇÃO ASSINATURA DATA Dr. Renato de Lacerda Barra Filho Dr. Ivo Fernandes Biomédico 01/10/2009 Gerente da Qualidade Biomédico 20/10/2009 Dr. Jose Carlos
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D
 RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
RESPOSTAS AOS RECURSOS AO CARGO DE TÉCNICO DE LABORATÓRIO Área: QUÍMICA D QUESTÃO 27 O técnico do laboratório pesou uma pequena barra de alumínio em uma balança cuja incerteza é ± 0,1 g e o valor obtido
BC-1302 QUÍMICA DOS ELEMENTOS
 PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
PRÁTICA 5: Oxigênio e Enxofre Objetivos Preparar o gás oxigênio, por método laboratorial e estudar algumas de suas propriedades. Estudar o enxofre nas suas variações alotrópicas e algumas de suas reações.
Microbilogia de Alimentos I - Curso de Engenharia de Alimentos Profª Valéria Ribeiro Maitan
 10 PONTIFÍCIA UNIVERSIDADE CATÓLICA DE GOIÁS PUC Goiás ESCOLA DE ENGENHARIA CURSO DE ENGENHARIA DE ALIMENTOS Aula nº 2- Preparações Microscópicas: Preparações a Fresco Introdução O olho humano é incapaz
10 PONTIFÍCIA UNIVERSIDADE CATÓLICA DE GOIÁS PUC Goiás ESCOLA DE ENGENHARIA CURSO DE ENGENHARIA DE ALIMENTOS Aula nº 2- Preparações Microscópicas: Preparações a Fresco Introdução O olho humano é incapaz
UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES
 Escola Secundária Carlos Amarante ACÇÃO DE FORMAÇÃO UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES Formando: Armindo Paulo Cunha Salvador Formador: Prof. Vítor Duarte Teodoro BRAGA / Julho 2010 Actividade
Escola Secundária Carlos Amarante ACÇÃO DE FORMAÇÃO UTILIZAÇÃO DOS NOVOS LABORATÓRIOS ESCOLARES Formando: Armindo Paulo Cunha Salvador Formador: Prof. Vítor Duarte Teodoro BRAGA / Julho 2010 Actividade
EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS
 1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015.1 EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS 1. Densidade Densidade (d) é uma grandeza expressa pela
1 UFSC Departamento de Química QMC 5119 Introdução ao Laboratório de Química 2015.1 EXPERIÊNCIA 04: DETERMINAÇÃO DA DENSIDADE DE LÍQUIDOS E SÓLIDOS 1. Densidade Densidade (d) é uma grandeza expressa pela
Equipe de Química QUÍMICA
 Aluno (a): Série: 3ª Turma: TUTORIAL 12R Ensino Médio Equipe de Química Data: QUÍMICA Mistura de soluções que não reagem entre si: Misturas de soluções de mesmo soluto quando misturamos soluções de mesmo
Aluno (a): Série: 3ª Turma: TUTORIAL 12R Ensino Médio Equipe de Química Data: QUÍMICA Mistura de soluções que não reagem entre si: Misturas de soluções de mesmo soluto quando misturamos soluções de mesmo
COMO ORGANIZAR A SUA MARMITA. Assessoria de Assuntos Estudantis - Pró-Reitoria de Ensino. Assistência Estudantil. Campus Serra
 COMO ORGANIZAR A SUA MARMITA Assessoria de Assuntos Estudantis - Pró-Reitoria de Ensino Assistência Estudantil Campus Serra COMO ORGANIZAR A SUA MARMITA Escolha Escolha uma uma marmita marmita que que
COMO ORGANIZAR A SUA MARMITA Assessoria de Assuntos Estudantis - Pró-Reitoria de Ensino Assistência Estudantil Campus Serra COMO ORGANIZAR A SUA MARMITA Escolha Escolha uma uma marmita marmita que que
